Máquinas térmicas y segunda ley de la termodinámica. Física II Comisión 2k1/2S1 Prof. López Avila
|
|
|
- Laura Alcaraz Gallego
- hace 7 años
- Vistas:
Transcripción
1 Máquinas térmicas y segunda ley de la termodinámica Física II Comisión 2k1/2S1 Prof. López Avila 1
2 Procesos Espontáneos 2
3 Procesos Espontáneos 3
4 Procesos Espontáneos Vacío Espontáneo No Espontáneo 4
5 Procesos Espontáneos Espontáneo (T > 0ºC) Espontáneo (T < 0ºC) 5
6 Máquinas térmicas y la segunda ley de la termodinámica La segunda ley de la termodinámica establece cuáles procesos pueden ocurrir y cuáles no en la naturaleza. Los siguientes son ejemplos de procesos que son consistentes con la primera ley de la termodinámica pero que proceden de un orden gobernado por la segunda ley: Cuando dos objetos a diferente temperatura se ponen en contacto térmico entre sí, la energía térmica siempre fluye del objeto más caliente al más frío, nunca del más frío al más caliente. Una pelota de goma que se deja caer al suelo rebota varias veces y finalmente queda en reposo, pero una pelota que se encuentra en el suelo nunca empieza a botar por sí sola. 6
7 Un Proceso Espontáneo ocurre sin ninguna intervención exterior. Procesos espontáneos en una dirección, son no-espontáneos en la dirección opuesta. Procesos espontáneos a una temperatura pueden no serlo a otra temperatura Todos los procesos espontáneos son irreversibles. Todos los procesos reales son irreversibles. En los procesos reversibles los gradientes de temperatura y diferencia de presión son infinitesimales, con una situación de cuasiequilibrio. 7
8 Máquinas de calor Representación esquemática de una máquina térmica. La máquina absorbe energía térmica Q c de un depósito caliente, libera la energía térmica Q f al depósito frío y efectúa un trabajo W (cíclico). Deposito caliente a T c Q c Motor Q f Depósito frío a T f W Una máquina térmica lleva trabajo a cierta sustancia a través de un proceso de un ciclo durante el cual 1) la energía térmica se absorbe de una fuente a alta temperatura, 2) la máquina realiza trabajo, y 3) la máquina expulsa energía térmica a una fuente de menor temperatura. 8
9 Máquinas de calor A partir de la primera ley de la termodinámica vemos que el trabajo neto W hecho por la máquina térmica es igual al calor neto que fluye hacia ella. Como podemos ver de la figura, Q neto = Q c - Q f ; por lo tanto Diagrama PV para un proceso cíclico arbitrario. El trabajo neto realizado es igual al área encerrada por la curva. W = Q c - Q f El trabajo neto hecho por un proceso cíclico es el área encerrada por la curva que representa el proceso en el diagrama PV. 9
10 Máquinas de calor La eficiencia térmica, e, de una máquina térmica se define como el cociente del trabajo neto realizado a la energía térmica absorbida a una temperatura más alta durante el ciclo: e W Qc Q f 1 Q Q c c Q Q f c Esta fórmula muestra que una máquina tiene un 100% de eficiencia sólo sí Q f = 0. Es decir, no se entrega energía térmica al reservorio frío. 10
11 Segunda ley de la termodinámica También llamada planteamiento de Kelvin-Planck, establece lo siguiente: Es imposible que un sistema efectúe un proceso en el que absorba calor de un depósito de temperatura uniforme y lo convierta totalmente en trabajo mecánico, terminando en el mismo estado en que lo inició. Deposito caliente a T c Q c Motor Depósito frío a T f W 11
12 Refrigeradores y bombas de calor Los refrigeradores y las bombas de calor son máquinas térmicas que operan a la inversa. La máquina absorbe energía térmica Q f del depósito frío y entrega energía térmica Q c al depósito caliente. Esto puede lograrse sólo si se hace trabajo sobre el refrigerador. El enunciado de Clausius afirma lo siguiente: Es imposible construir una máquina que opere en un ciclo y que no produzca ningún otro efecto más que transferir energía térmica continuamente de un objeto, a otro de mayor temperatura. En términos simples, la energía térmica no fluye espontáneamente de un objeto frío a uno caliente. 13
13 Diagrama esquemático de un refrigerador. Diagrama esquemático de un refrigerador imposible. Exterior Deposito caliente a T c Deposito caliente a T c Q c W Q c Motor Motor Q f Q f Depósito frío a T f Interior Depósito frío a T f Un refrigerador lleva calor de un cuerpo mas frio a uno caliente, 14 pero para funcionar requiere energía mecánico o trabajo.
14 Refrigeradores Desde un punto de vista económico, el mejor ciclo de refrigeración es el que saca el máximo calor Q F del refrigerador, con el menor gasto de trabajo mecánico. Cuanto mayor sea Q F /W mejor será el refrigerador. Llamamos K, al coeficiente de rendimiento (adimensional): K Q f W Q c Q f Q f 15
15 Refrigeradores 16
16 Exterior Refrigeradores capilar Interior motor
17 Funcionamiento Refrigeradores Todo liquido que se evapore fácilmente a bajas temperaturas es un potencial refrigerante. Es posible evaporarlo y licuarlo alternadamente, haciéndolo circular a través de tubos en los que varíe la presión. En la mayoría de los refrigeradores domésticos, el refrigerante es uno de los compuestos conocidos como clorofluorocarbonos o freones. Los tubos del interior del refrigerador son de grueso calibre, por lo que dentro de ellos la presión es baja y el líquido que allí circula se evapora. Con ello se mantiene frio el tubo y se absorbe el calor de los alimentos. Un motor eléctrico succiona el gas frío de los tubos, lo comprime para que se caliente y lo manda al tubo serpentín de la parte trasera del refrigerador. El aire que circunda al serpentín absorbe el calor y hace que el gas vuelva a condensarse, todavía a muy alta presión. Después, un tubo de calibre muy angosto, llamado capilar, devuelve el líquido de alta presión a los tubos ensanchados del interior, el líquido se evapora de nuevo y el ciclo se repite. 18
18 Bomba de calor Una bomba de calor es un dispositivo mecánico que transporta energía térmica de una región a baja temperatura a una región a temperatura mayor. La figura es una representación esquemática de una bomba de calor. La temperatura exterior es T f y la energía térmica absorbida por el fluido circulante es Q f. La bomba de calor realiza un trabajo W sobre el fluido, y la energía térmica transferida de la bomba de calor hacia el interior del edificio es Q c. Interior Deposito caliente a T c Q c Motor Q f Depósito frío a T f W Exterior 19
19 La eficacia de la bomba de calor, en el modo de calentamiento, se describe en función de un número conocido como el coeficiente de realización, CDR. Éste se define como la razón entre el calor transferido al depósito y el trabajo que se requiere para transferir el calor: CDR (bomba de calor) calor transferido trabajo hecho por la bomba Una máquina térmica en un ciclo de Carnot que opere a la inversa constituye una bomba de calor; de hecho, es la bomba de calor con el coeficiente de rendimiento más alto posible para las temperaturas entre las cuales opera. El máximo coeficiente de realización es Tc CDR f (bomba de calor) T T c f Q c W 20
20 El refrigerador trabaja de un modo muy similar a una bomba de calor; enfría su interior bombeando energía térmica desde los compartimientos de almacenamiento de los alimentos hacia el exterior más caliente. Durante su operación, un refrigerador elimina una cantidad de energía térmica Q f del interior del refrigerador, y en el proceso (igual que la bomba de calor) su motor realiza trabajo W. El coeficiente de realización de un refrigerador o de una bomba de calor se define en términos de Q f : CDR (refrigerador) Q f W En este caso, el coeficiente de realización más alto posible es también el de un refrigerador cuya sustancia de trabajo se lleva por un ciclo de máquina térmica de Carnot a la inversa. Tf CDR f (refrigerador) T T 21 c f
21 Carnot y Clausius Físico francés que nació el 1 de junio de 1796 en París y fallece en la misma ciudad el 24 de agosto de 1832; pertenecía a una familia distinguida de Francia; ya que su padre, Lazare Nicolas Marguerite Carnot fue el general francés que organizó a los ejércitos republicanos. Rudolf Julius Emanuel Clausius Físico Alemán que nació en Köslin, Pomerania (ahora Koszalin, Polonia) el 2 de enero de 1822 y murió en Bonn el 24 de agosto de
22 Equivalencia de la 2ª ley de Kelvin- Planck y Clausius Clausius Motor Kelvin - Planck Q 2 Q 1 W Q 1 W Motor Motor Motor Q 2 Q 2 Kelvin - Planck Refrigerador Clausius Q 1 W Q 1 + Q 2 Q 2 Motor Motor Motor Q 2 Q 2 23
23 El ciclo de Carnot Para describir el ciclo de Carnot supongamos que la sustancia que trabaja entre dos temperaturas T f y T c, es un gas ideal contenido en un cilindro con un émbolo móvil en el extremo. Las paredes del cilindro y el émbolo no son conductoras térmicas. En la figura inferior se muestran cuatro etapas del ciclo de Carnot, y en la superior, el diagrama PV. El ciclo de Carnot consta de dos procesos adiabáticos y dos procesos isotérmicos, todos reversibles. El flujo de calor a través de un ΔT finito es irreversible, por eso en el ciclo de Carnot no debe haber ΔT finito. 24 Tc Tf
24 El ciclo de Carnot El proceso A B es una expansión isotérmica a temperatura T c, en la cual el gas se pone en contacto térmico con un depósito de calor a temperatura T c. Durante la expansión, el gas absorbe energía térmica Q c desde el depósito a través de la base del cilindro y efectúa trabajo W AB al levantar el émbolo. En el proceso B C, la base del cilindro se sustituye por una pared que no es conductora térmica y el gas se expande adiabáticamente; es decir, ninguna energía térmica entra o sale del sistema. Durante la expansión, la temperatura cae de T c a T f y el gas realiza trabajo W BC al elevar el émbolo. En el proceso C D, el gas se coloca en contacto térmico con un depósito de calor a la temperatura T f y se comprime isotérmicamente a temperatura T f. Durante ese tiempo, el gas libera la energía térmica Q f hacia el depósito y el trabajo realizado sobre el gas por un agente externo es W CD. En la etapa final, D A, la base del cilindro se sustituye por una pared no conductora y el gas se comprime adiabáticamente. La temperatura del gas aumenta a T c y el trabajo efectuado sobre el gas por un agente externo es W DA. 25
25 Eficiencia de la máquina de Carnot Proceso A B (expansión isotérmica) Q c = W AB = nrt c lnv B /V A Proceso B C (expansión adiabática) T c V B g-1 = T f V C g-1 Proceso C D (compresión isotérmica) Q f = W CD = - nrt f lnv C /V D Tc Tf Q f /Q c = - T f ln(v C /V D ) / T c ln(v B /V A ) Etapa final, D A (compresión adiabática) T c V A g-1 = T f V D g-1 Se deduce que: V g-1 B /V g-1 A = V g-1 C / V g-1 D de aquí V B /V A = V C /V D e C = 1 Q f /Q c = 1 T f /T c K c =Q f /(Q c -Q f )=(Q f /Q c )/[1-Q f /Q c ]=T f /(T c -T f ) 26
26 Eficiencia de la máquina de Carnot Todas las máquinas de Carnot que operan de modo reversible entre las mismas dos temperaturas tienen la misma eficiencia. De acuerdo con el teorema de Carnot, la eficiencia de cualquier máquina reversible que opera en un ciclo entre dos temperaturas es más grande que la eficiencia de cualquier máquina irreversible (real) operando entre las dos mismas temperaturas. Todas las máquinas reales son menos eficientes que la máquina de Carnot porque están sujetas a dificultades prácticas como la fricción y las pérdidas térmicas por conducción. 27
27 La máquina de Carnot El teorema de Carnot puede enunciarse como sigue: Ninguna máquina térmica real que opera entre dos depósitos térmicos puede ser más eficiente que una máquina de Carnot operando entre los mismos dos depósitos. Describiremos brevemente algunos aspectos de este teorema. Primero supondremos que la segunda ley es válida. Luego, imaginamos dos máquinas térmicas que operan entre los mismos depósitos de calor, una de las cuales es una máquina de Carnot con una eficiencia e c, y la otra, cuya eficiencia, e, es más grande que e c. Si la máquina más eficiente se opera para accionar la máquina de Carnot como un refrigerador, el resultado neto es la transferencia de calor del depósito frío al caliente o la generación neta de ΔW sin expulsion al depósito frío. De acuerdo con la segunda ley, esto es imposible. En consecuencia, la suposición de que e > e c debe ser falsa. Q c Q c +ΔQc Refrigerador de Carnot e c Motor W ΔW Motor e Motor mas eficiente Q f Q f 28
28 El motor de gasolina El motor de gasolinas puede describirse mediante el ciclo Otto, el cual se ilustra en la figura 30
29 Cigüeñal en funcionamiento 31
30 Durante la carrera de admisión O A, se introduce aire y gasolina al cilindro a presión atmosférica y el volumen aumenta de V 2 a V 1. En el proceso A B (carrera de compresión), la mezcla de aire y combustible se comprime adiabáticamente del volumen V 1 a V 2, y la temperatura aumenta de T A a T B. El trabajo realizado sobre el gas es el área bajo la curva AB. En el proceso B C, la combustión ocurre y se añade la energía térmica Q c al gas. Esto no es una entrada de energía térmica, sino más bien una liberación de energía térmica del proceso de combustión. Durante este tiempo la presión y la temperatura aumentan rápidamente, aunque el volumen permanece constante. No se efectúa trabajo sobre el gas. P Q c C B O Procesos adiabáticos D A Q f V 2 V 1 V 32
31 En el proceso C D (carrera de potencia), el gas se expande adiabáticamente de lo que origina que la temperatura descienda de T C a T D. El trabajo realizado por el gas es el área bajo la curva CD. En el proceso D A se extrae la energía térmica Q f del gas a medida que su presión disminuye a volumen constante al abrir una válvula de escape. No se hace trabajo durante este proceso. P En el proceso final de la carrera de escape A O, los gases residuales se expulsan a presión atmosférica, y el volumen disminuye de V 2 a V 1. El mismo ciclo se repite después. Q c C B O Procesos adiabáticos D A Q f V 2 V 1 V 33
32 Eficiencia del ciclo Otto El trabajo realizado es: W = Q c Q f Los procesos B -> C y D -> A ocurren a volumen constante entonces Q c = nc V (T C T B ) y Q f = nc V (T D T A ) La eficiencia es: e Q f 1 1 Q c T T D C T T A B En A -> B se cumple: T A V g-1 A = T B V g-1 B En C -> D se cumple: T C V g-1 C = T D V g-1 D Sea V 1 = V A = V D y V 2 = V C = V B sustituyendo en la anteriores y simplificando se llega a 1 e 1 g V V 1 1 / 2 Donde r=v 1 /V 2 es la razón de compresión. Si r=8 y γ=1,4 para el aire, e=56% 34
33 Ejemplo Un motor de gasolina opera con un volumen de desplazamiento de 3L a 4000 rpm y una razón de compresión de 9.5. Suponga T A = 300, R = 287 kj/kg K, T C = 1623 K y se utilizan calores específicos no molares. V desplazamiento = 3L = m 3 rpm = 4000 rpm r = 9.5 P A = 1.00 x 10 5 Pa T A = 300 K T C = 1623 K c V = 718 J/kg K c P = 1005 J/kg K R = 287 kpa/m 3 /kg K g = 1.4 V B = Vdesp/(6(r 1)) = x 10 5 m 3 V A = r V B = m 3 m = P A V A /(RT A ) = 6.49 x 10 4 kg P B = P A (V A /V B ) g = 2.34 x 10 6 Pa T B = P B V B /(R m)= K P C = m R T C /V B = 5.14 x 10 6 Pa P D = P C (V B /V A ) g = 2.20 x 10 5 T D = P D V A /(m R )= K c P c V = 287 Q c = Q entra = m c V (T C T B ) = J Q f = Q sale = m c V (T D T A ) = J W neto = Q c Q f = J Potencia = (6/2) (rpm/60) Wneto = W = W/740 = hp 35
34 El motor Diesel En el motor Diesel se comprime aire con una razón de compresión mayor que en el motor Otto. El combustible es inyectado en el punto máximo de la compresión. Los procesos O -> A, A -> B, D -> A y A -> O son iguales que en el ciclo Otto. El proceso B -> C corresponde a una expansión isobárica cuando el combustible es inyectado y se enciende. En este proceso hay una entrada de calor Q C. El proceso C -> D es una expansión adiabática de los gases calientes. P Q c B C Procesos adiabáticos D O A Q f V 2 V 1 V 3 V 36
35 Eficiencia del ciclo diesel El trabajo realizado es: W = Q c Q f Los procesos B -> C (isobárico) y D -> A (isocórico) entonces La eficiencia es: Q c = nc P (T C T B ) y Q f = nc V (T D T A ) Q e 1 Q En A -> B se cumple: T A V A g-1 = T B V B g-1 En C -> D se cumple: T C V C g-1 = T D V D g-1 f c C 1 C V P T T D C Sea V 1 = V A = V D y V 2 = V B y V 3 = V C = sustituyendo en la anteriores y simplificando se llega a g 1 1 r c e 1 g 1 V 1 1 / V g r 2 c Donde r = V 1 /V 2 es la razón de compresión y r c = V 3 /V 2 es la relación de corte de admisión definida como la relación de los volúmenes del cilindro después y antes del proceso de combustión T T A B TD TA 1 g T T C B 37
36 Ejemplo Un motor de Diesel opera con un volumen de desplazamiento de 2L a 3000 rpm, una razón de compresión de 22 y una razón de compresión crítica r c = 2. Suponga T A = 300, R = 287 kj/kg K y se utilizan calores específicos no molares. V desplazamiento = 2L = m 3 rpm = 3000 rpm r = 22 P A = 1.00 x 10 5 Pa T A = 300 K T C = 1623 K c V = 718 J/kg K c P = 1005 J/kg K R = 287 kpa/m 3 /kg K g = 1.4 V A = 2L/4 = m 3 V B = V desp /(6(r 1)) = x 10 5 m 3 m = P A V A /(RT A ) = 5.81 x 10 4 kg P B = P A (V A /V B ) g = 7.57 x 10 6 Pa T B = P B V B /(R m)= 1,030 K T C = 2T B = 2,060 K P C = P B P D = P C (V C /V D ) g = P C (V C /V B ) g (V B /V D ) g = P C (r c ) g (r) g = 2.64 x 10 5 Pa T D = P D V A /(m R )= 792 K c P c V = 287 Q c = Q entra = m c P (T C T B ) = 601 J Q f = Q sale = m c V (T D T A ) = 205 J W neto = Q c Q f = 396 J Potencia = (4/2) (rpm/60) Wneto = W = W/740 = 53 hp 38
37 Entropía E k =1/2.M.V 2 cm V cm ds dq T r 39
38 Entropía Otra función de estado, relacionada con la segunda ley de la termodinámica, es la entropía. La entropía es una medida cuantitativa del desorden. Pensemos un proceso isotérmico: n. r. T dqr dw p. dv. dv V dv V dqr T. n. R 1 ds. n. R Considere un proceso infinitesimal en un sistema entre dos estados de equilibrio. Sea dq r es la cantidad de energía térmica que se transferiría si el sistema hubiera seguido una trayectoria reversible, entonces el cambio en la entropía ds, independientemente de la trayectoria real seguida, es igual a la cantidad de energía térmica transferida a lo largo de la trayectoria reversible dividida entre la temperatura absoluta del sistema: dqr ds T 40
39 Entropía Cuando la energía térmica es absorbida por el sistema, dq r, es positiva y por lo tanto la entropía crece. Cuando la energía térmica es liberada por el sistema, dq r, es negativa y la entropía disminuye. En la mecánica estadística, el comportamiento de una sustancia se describe en función del comportamiento estadístico de átomos y moléculas contenidos en la sustancia. Uno de los principales resultados de este tratamiento es que: Los sistemas aislados tienden al desorden, y la entropía es una medida de dicho desorden. Todos los procesos físicos tienden a estados más probables para el sistema y sus alrededores. El estado más probable siempre es el de mayor desorden. Debido a que la entropía es una medida del desorden, una manera alternativa de decir lo anterior es: La entropía del universo aumenta en todos los procesos. Estado ordenado Estado desordenado 41
40 Entropía Para calcular el cambio en la entropía en relación con un proceso finito, debemos recordar que T por lo general no es constante. Si dq r es la energía térmica transferida cuando el sistema está a una temperatura T, entonces el cambio de entropía en un proceso reversible arbitrario entre un estado inicial y un estado final es S f ds i i f dq T S Debido a que la entropía es una función de estado, el cambio en la entropía de un sistema al ir de un estado a otro tiene el mismo valor para todas las trayectorias que conectan los dos estados. Es decir, el cambio en la entropía de un sistema solo depende de las propiedades del estado de equilibrio inicial y final. J K 42
41 Proceso reversible y cuasiestático para un gas ideal Un gas ideal experimenta un proceso reversible y cuasiestático de un estado inicial T i, V i a otro final T f, V f. Calculemos el cambio de entropía en este proceso. De acuerdo con la primera ley, dq = du + dw, donde dw = PdV. Recuerde que para un gas ideal du = nc V dt, y por la ley del gas ideal, tenemos que P = nrt/v. En consecuencia, podemos expresar la energía térmica transferida como dq r du PdV nc V dt nrt dv V 43
42 Dividiendo en T e integrando ambos términos dq T r nc V dt T nr Suponiendo que C V sea constante sobre el intervalo en cuestión, e integrando a partir de T i, V i a T f, V f obtenemos dv V S i f dq T r nc V Tf ln T i V nr ln V f i Esta expresión muestra que S sólo depende de los estados inicial y final y es independiente de la trayectoria reversible. S puede ser positiva o negativa dependiendo de si el gas absorbe o expulsa energía térmica durante el proceso. Por último, en un proceso cíclico, vemos que S = 0. 44
43 Entropía en ciclo de Carnot Q i T i Considere los cambios en la entropía que ocurren en una máquina térmica de Carnot que opera entre las temperaturas T f y T i. En un ciclo, la máquina absorbe energía térmica Q i del depósito cliente y libera energía térmica Q f al depósito frío. De modo que, el cambio total de entropía para el ciclo es T f S Q T i i Q T f f Donde el signo negativo representa el hecho de que la energía térmica Q f es liberada por el sistema. Para el ciclo de Carnot se cumple que Al usar este resultado en la expresión para S, encontramos que el cambio total en la entropía para la máquina de Carnot que opera en un ciclo es cero. Q Q f c T T f c 45
44 El ciclo de Carnot adopta una representación especialmente sencilla si en lugar de un diagrama pv se representa en uno TS que tiene por eje de abscisas la entropía del sistema y por eje de ordenadas la temperatura de éste. En un diagrama TS, los procesos isotermos son simplemente rectas horizontales. Los procesos adiabáticos que, por ser reversibles, son a entropía constante, son rectas verticales. Esto quiere decir que a un ciclo de Carnot le corresponde simplemente un rectángulo, independientemente de que el ciclo sea producido actuando sobre un gas ideal o sobre cualquier otro sistema. En este diagrama el calor absorbido Q c es el área del rectángulo delimitado por el lado superior del ciclo y el eje de abscisas, mientras que el calor cedido Q f es el área del rectángulo definido por el lado inferior del ciclo y el eje de abscisas. El calor neto, Q c Q f, que entra en el sistema es el área del rectángulo delimitado por el ciclo. Por el Primer Principio, este área equivale al trabajo neto efectuado por el sistema, W. Si en vez de una máquina de Carnot tenemos un refrigerador de Carnot, la figura es exactamente la misma, solo que se recorren en sentido opuesto. 46
45 Entropía Considere ahora un sistema que sigue un ciclo arbitrario. Puesto que la función entropía es una función de estado y, por lo tanto, sólo depende de las propiedades de un estado de equilibrio determinado, concluimos que S = 0 para cualquier ciclo. En general, podemos escribir esta condición en la forma matemática dq r 0 T Donde la integral es sobre un ciclo cerrado. 47
46 Cambio de entropía en un proceso de fusión Un sólido tiene un calor latente de fusión L f se funde a una temperatura T m. Calcule el cambio en la entropía S dq T r 1 T m dq Q T m ml T m f Un cubo de hielo se funde, 3 cm de lado, 30 cm 3 de volumen, L = 3.33x10 5 J/kg. S = (0.030 kg)(3.33x10 5 J/kg)/(273 K) = 40 J/K 48
47 Ejemplo Una bandeja de hielo contiene 500 g de agua a 0 C. Calcule el cambio en la entropía del agua cuando se congela lenta y completamente a 0 C. L w = 3.33x10 5 J/kg. Q r = ml w = (0.5)(3.33x10 5 ) = 1.67x10 5. S = 610 J/K 49
48 Cambios de entropía en procesos irreversibles Se ha encontrado experimentalmente que el cambio de entropía es el mismo para todos los procesos que ocurren entre un conjunto de estados inicial y final. Calculemos ahora los cambios de entropía para procesos irreversibles entre dos estados de equilibrio ideando un proceso reversible (o serie de procesos reversibles) entre los mismos dos estados y calculando dq r / T para el proceso reversible. El cambio de entropía para el proceso irreversible es el mismo que el del proceso reversible entre los dos mismos estados de equilibrio. 50
49 Expansión libre de un gas Cuando se rompe la membrana, el gas se expande irreversiblemente de modo que ocupa un volumen más grande. dq f r 1 S dqr T T i Para calcular Q r sustituimos el proceso por un proceso isotérmico reversible. Como la expansión es isotérmica: V f W nrt ln Vi Entonces: S Q V f nr ln V i r Muro aislado Vacío Gas a T i Proceso reversible El gas se expande en un proceso cuasiestático Proceso irreversible Membrana Gas a T i 51
50 Transferencia irreversible de calor Una sustancia de masa m 1, calor específico c 1 y temperatura inicial T 1, se pone en contacto térmico con una segunda sustancia de masa m 2, calor específico c 2 y temperatura inicial T 2, donde T 2 > T 1. La temperatura final T f es: T f m1c 1T m c m2c2t m c El calor lo calculamos con: dq = mcdt El cambio en la entropía es: S dt dt Tf Tf f f m1c 1 m2c2 m1c 1 ln m2c2 ln T1 T T2 T T1 T 52 2 T T
51 Ejemplo Sea m 1 = m 2 = 1 kg, c 1 = c 2 = 4186 J/kg K, T 1 = 273 K y T 2 = 373 K y T f = 323 K, en el caso anterior. Entonces el cambio de entropía es: S = (1)(4186)ln((323)/(273)) + (1)(4186)ln((323)/(373)) = = 102 J/K 53
Electricidad y calor
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor. Webpage: Departamento de Física Universidad de Sonora
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
CAPITULO V TERMODINAMICA - 115 -
 CAPIULO V ERMODINAMICA - 5 - 5. EL GAS IDEAL Es el conjunto de un gran número de partículas diminutas o puntuales, de simetría esférica, del mismo tamaño y de igual volumen, todas del mismo material. Por
CAPIULO V ERMODINAMICA - 5 - 5. EL GAS IDEAL Es el conjunto de un gran número de partículas diminutas o puntuales, de simetría esférica, del mismo tamaño y de igual volumen, todas del mismo material. Por
III Tema Segunda ley de la termodinámica
 UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA PESQUERA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA III Tema Segunda ley de
UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA PESQUERA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA III Tema Segunda ley de
Capítulo 8. Termodinámica
 Capítulo 8 Termodinámica 1 Temperatura La temperatura es la propiedad que poseen los cuerpos, tal que su valor para ellos es el mismo siempre que estén en equilibrio térmico. Principio cero de la termodinámica:
Capítulo 8 Termodinámica 1 Temperatura La temperatura es la propiedad que poseen los cuerpos, tal que su valor para ellos es el mismo siempre que estén en equilibrio térmico. Principio cero de la termodinámica:
PROBLEMARIO No. 2. Veinte problemas con respuesta sobre los Temas 3 y 4 [Trabajo y Calor. Primera Ley de la Termodinámica]
![PROBLEMARIO No. 2. Veinte problemas con respuesta sobre los Temas 3 y 4 [Trabajo y Calor. Primera Ley de la Termodinámica] PROBLEMARIO No. 2. Veinte problemas con respuesta sobre los Temas 3 y 4 [Trabajo y Calor. Primera Ley de la Termodinámica]](/thumbs/50/26203302.jpg) Universidad Simón olívar Departamento de Termodinámica y Fenómenos de Transferencia -Junio-007 TF - Termodinámica I Prof. Carlos Castillo PROLEMARIO No. Veinte problemas con respuesta sobre los Temas y
Universidad Simón olívar Departamento de Termodinámica y Fenómenos de Transferencia -Junio-007 TF - Termodinámica I Prof. Carlos Castillo PROLEMARIO No. Veinte problemas con respuesta sobre los Temas y
F. Aclarando conceptos sobre termodinámica
 IES Antonio Glez Glez Principios de máquinas Página 1 F. Aclarando conceptos sobre termodinámica Termodinámica La termodinámica es la parte de la física que analiza los fenómenos en los que interviene
IES Antonio Glez Glez Principios de máquinas Página 1 F. Aclarando conceptos sobre termodinámica Termodinámica La termodinámica es la parte de la física que analiza los fenómenos en los que interviene
Electricidad y calor
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora 1 emas 5. Segunda ley de la ermodinámica. i. Máquinas térmicas y su eficiencia. ii. Segunda
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora 1 emas 5. Segunda ley de la ermodinámica. i. Máquinas térmicas y su eficiencia. ii. Segunda
MATERIAL DE APOYO DE USO ESCLUSIVO DEL CENTRO DE ESTUDIOS MATEMÁTICOS. C.E.M.
 1-. Una cubeta con hielo recibe constantemente calor de un B. mechero como se aprecia en la figura. C. D. De la gráfica de temperatura como función del tiempo, para la muestra, se concluye que entre A.
1-. Una cubeta con hielo recibe constantemente calor de un B. mechero como se aprecia en la figura. C. D. De la gráfica de temperatura como función del tiempo, para la muestra, se concluye que entre A.
Termodinámica y Máquinas Térmicas
 Termodinámica y Máquinas Térmicas Tema 04. Funciones de Estado Inmaculada Fernández Diego Severiano F. Pérez Remesal Carlos J. Renedo Estébanez DPTO. DE INGENIERÍA ELÉCTRICA Y ENERGÉTICA Este tema se publica
Termodinámica y Máquinas Térmicas Tema 04. Funciones de Estado Inmaculada Fernández Diego Severiano F. Pérez Remesal Carlos J. Renedo Estébanez DPTO. DE INGENIERÍA ELÉCTRICA Y ENERGÉTICA Este tema se publica
Sustancias puras, procesos de cambios de fase, diagramas de fase. Estado 3 Estado 4 Estado 5. P =1 atm T= 100 o C. Estado 3 Estado 4.
 TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
TEMA 13: Termodinámica
 QUÍMICA I TEMA 13: Termodinámica Tecnólogo Minero Temario ü Procesos espontáneos ü Entropía ü Segunda Ley de la Termodinámica ü Energía libre de Gibbs ü Energía libre y equilibrio químico Procesos espontáneos
QUÍMICA I TEMA 13: Termodinámica Tecnólogo Minero Temario ü Procesos espontáneos ü Entropía ü Segunda Ley de la Termodinámica ü Energía libre de Gibbs ü Energía libre y equilibrio químico Procesos espontáneos
Sistemas de refrigeración: compresión y absorción
 Sistemas de refrigeración: compresión y absorción La refrigeración es el proceso de producir frío, en realidad extraer calor. Para producir frío lo que se hace es transportar calor de un lugar a otro.
Sistemas de refrigeración: compresión y absorción La refrigeración es el proceso de producir frío, en realidad extraer calor. Para producir frío lo que se hace es transportar calor de un lugar a otro.
Unidad 16: Temperatura y gases ideales
 Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
Capítulo 17. Temperatura. t(h) = 100 h h 0
 Capítulo 17 Temperatura t(h) = 100 h h 0 h 1 00 h 0 rincipio cero de la termodinámica. Temperatura empírica. La temperatura empírica de un sistema en equilibrio termodinámico se puede asignar mediante
Capítulo 17 Temperatura t(h) = 100 h h 0 h 1 00 h 0 rincipio cero de la termodinámica. Temperatura empírica. La temperatura empírica de un sistema en equilibrio termodinámico se puede asignar mediante
Electricidad y calor. Dr. Roberto Pedro Duarte Zamorano. Departamento de Física
 Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea.
 Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea. Mezcla de aceite y agua Mezcla de hielo y agua Las sustancias existen
Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea. Mezcla de aceite y agua Mezcla de hielo y agua Las sustancias existen
Tema 3. Máquinas Térmicas II
 Asignatura: Tema 3. Máquinas Térmicas II 1. Motores Rotativos 2. Motores de Potencia (Turbina) de Gas: Ciclo Brayton 3. Motores de Potencia (Turbina) de Vapor: Ciclo Rankine Grado de Ingeniería de la Organización
Asignatura: Tema 3. Máquinas Térmicas II 1. Motores Rotativos 2. Motores de Potencia (Turbina) de Gas: Ciclo Brayton 3. Motores de Potencia (Turbina) de Vapor: Ciclo Rankine Grado de Ingeniería de la Organización
ESTO NO ES UN EXAMEN, ES UNA HOJA DEL CUADERNILLO DE EJERCICIOS. Heroica Escuela Naval
 CUADERNILLO DE FÍSICA. TERCER GRADO. I.- SUBRAYE LA RESPUESTA CORRECTA EN LOS SIGUIENTES ENUNCIADOS. 1.- CUANDO DOS CUERPOS CON DIFERENTE TEMPERATURA SE PONEN EN CONTACTO, HAY TRANSMISIÓN DE: A) FUERZA.
CUADERNILLO DE FÍSICA. TERCER GRADO. I.- SUBRAYE LA RESPUESTA CORRECTA EN LOS SIGUIENTES ENUNCIADOS. 1.- CUANDO DOS CUERPOS CON DIFERENTE TEMPERATURA SE PONEN EN CONTACTO, HAY TRANSMISIÓN DE: A) FUERZA.
TERMODINÁMICA AVANZADA
 ERMODINÁMICA AANZADA Unidad I: ropiedades y Leyes de la ermodinámica! Ciclos de potencia! Ciclo de refrigeración 8/7/0 Ctenido! Ciclos termodinámicos!! Ciclo Rankine! ariantes del Ciclo Rankine! Ciclos
ERMODINÁMICA AANZADA Unidad I: ropiedades y Leyes de la ermodinámica! Ciclos de potencia! Ciclo de refrigeración 8/7/0 Ctenido! Ciclos termodinámicos!! Ciclo Rankine! ariantes del Ciclo Rankine! Ciclos
TEMA 4: Circuito frigorífico y bomba de calor: elementos y aplicaciones.
 Esquema: TEMA 4: Circuito frigorífico y bomba de calor: elementos y aplicaciones. TEMA 4: Circuito frigorífico y bomba de calor: elementos y aplicaciones....1 1.- Introducción...1 2.- Máquina frigorífica...1
Esquema: TEMA 4: Circuito frigorífico y bomba de calor: elementos y aplicaciones. TEMA 4: Circuito frigorífico y bomba de calor: elementos y aplicaciones....1 1.- Introducción...1 2.- Máquina frigorífica...1
ENERGÍA INTERNA PARA GASES NO IDEALES.
 DEPARTAMENTO DE FISICA UNIERSIDAD DE SANTIAGO DE CHILE ENERGÍA INTERNA PARA GASES NO IDEALES. En el caso de los gases ideales o cualquier cuerpo en fase no gaseosa la energía interna es función de la temperatura
DEPARTAMENTO DE FISICA UNIERSIDAD DE SANTIAGO DE CHILE ENERGÍA INTERNA PARA GASES NO IDEALES. En el caso de los gases ideales o cualquier cuerpo en fase no gaseosa la energía interna es función de la temperatura
Introducción. Flujo Eléctrico.
 Introducción La descripción cualitativa del campo eléctrico mediante las líneas de fuerza, está relacionada con una ecuación matemática llamada Ley de Gauss, que relaciona el campo eléctrico sobre una
Introducción La descripción cualitativa del campo eléctrico mediante las líneas de fuerza, está relacionada con una ecuación matemática llamada Ley de Gauss, que relaciona el campo eléctrico sobre una
Tema 2. Segundo Principio de la Termodinámica
 ema Segundo Principio de la ermodinámica EMA SEGUNDO PRINCIPIO DE LA ERMODINÁMICA. ESPONANEIDAD. SEGUNDO PRINCIPIO DE LA ERMODINÁMICA 3. ENROPÍA 4. ECUACIÓN FUNDAMENAL DE LA ERMODINÁMICA 5. DEERMINACIÓN
ema Segundo Principio de la ermodinámica EMA SEGUNDO PRINCIPIO DE LA ERMODINÁMICA. ESPONANEIDAD. SEGUNDO PRINCIPIO DE LA ERMODINÁMICA 3. ENROPÍA 4. ECUACIÓN FUNDAMENAL DE LA ERMODINÁMICA 5. DEERMINACIÓN
Física para Ciencias: Principio de Arquímedes, Ecuaciones de Continuidad y Bernoulli.
 Física para Ciencias: Principio de Arquímedes, Ecuaciones de Continuidad y Bernoulli. Dictado por: Profesor Aldo Valcarce 1 er semestre 2014 Presión de un fluido Presión depende de la profundidad P = ρ
Física para Ciencias: Principio de Arquímedes, Ecuaciones de Continuidad y Bernoulli. Dictado por: Profesor Aldo Valcarce 1 er semestre 2014 Presión de un fluido Presión depende de la profundidad P = ρ
Universidad Nacional de Córdoba. Facultad de Ciencias Exactas Físicas y Naturales. Cátedra de Mecánica de los Fluidos. Carrea de Ingeniería Civil
 Universidad Nacional de Córdoba Facultad de Ciencias Exactas Físicas y Naturales Cátedra de Mecánica de los Fluidos Carrea de Ingeniería Civil FLUJO COMPRESIBLE DR. ING. CARLOS MARCELO GARCÍA 2011 A modo
Universidad Nacional de Córdoba Facultad de Ciencias Exactas Físicas y Naturales Cátedra de Mecánica de los Fluidos Carrea de Ingeniería Civil FLUJO COMPRESIBLE DR. ING. CARLOS MARCELO GARCÍA 2011 A modo
Tema 9: Calor, Trabajo, y Primer Principio
 1/34 Tema 9: Calor, Trabajo, y Primer Principio Fátima Masot Conde Ing. Industrial 2010/11 Tema 9: Calor, Trabajo, Primer Principio 2/34 Índice: 1. Introducción. 2. Capacidad calorífica. Calor específico.
1/34 Tema 9: Calor, Trabajo, y Primer Principio Fátima Masot Conde Ing. Industrial 2010/11 Tema 9: Calor, Trabajo, Primer Principio 2/34 Índice: 1. Introducción. 2. Capacidad calorífica. Calor específico.
El Equilibrio Termodinámico. Tipos de Equilibrios.
 TEMA 1.) CONCEPTOS BASICOS Sistema Termodinámico. Paredes. Tipos de Sistemas. Criterio de Signos. Estado Termodinámico. El Equilibrio Termodinámico. Tipos de Equilibrios. Variables Termodinámicas. Procesos
TEMA 1.) CONCEPTOS BASICOS Sistema Termodinámico. Paredes. Tipos de Sistemas. Criterio de Signos. Estado Termodinámico. El Equilibrio Termodinámico. Tipos de Equilibrios. Variables Termodinámicas. Procesos
Módulo 2: Termodinámica. mica Temperatura y calor
 Módulo 2: Termodinámica mica Temperatura y calor 1 Termodinámica y estado interno Para describir el estado externo de un objeto o sistema se utilizan en mecánica magnitudes físicas como la masa, la velocidad
Módulo 2: Termodinámica mica Temperatura y calor 1 Termodinámica y estado interno Para describir el estado externo de un objeto o sistema se utilizan en mecánica magnitudes físicas como la masa, la velocidad
CUADERNILLO PREPARADO POR LA CÁTEDRA DE TERMODINÁMICA 1.1.1. TEMPERATURA:
 CUADERNILLO PREPARADO POR LA CÁTEDRA DE TERMODINÁMICA 1.1.1. TEMPERATURA: 1.1.. Introducción: El concepto de temperatura está muy relacionado con el diario vivir. Tenemos un concepto intuitivo de algo
CUADERNILLO PREPARADO POR LA CÁTEDRA DE TERMODINÁMICA 1.1.1. TEMPERATURA: 1.1.. Introducción: El concepto de temperatura está muy relacionado con el diario vivir. Tenemos un concepto intuitivo de algo
Los principios de Carnot son:
 IV.- Principios de Carnot La segunda ley de termodinámica pone límites en la operación los ciclos. Una máquina térmica no puede operar intercambiando calor con un reservorio simple, y un refrigerador no
IV.- Principios de Carnot La segunda ley de termodinámica pone límites en la operación los ciclos. Una máquina térmica no puede operar intercambiando calor con un reservorio simple, y un refrigerador no
CAPITULO 15. SEGUNDA LEY DE LA TERMODINAMICA Y ENTROPIA.
 ap. 15. Segunda ley de la termodinámica APIULO 15. SEGUNDA LEY DE LA ERMODINAMIA Y ENROPIA. La primera ley de la termodinámica es la ley de conservación de la energía generalizada para incluir el calor
ap. 15. Segunda ley de la termodinámica APIULO 15. SEGUNDA LEY DE LA ERMODINAMIA Y ENROPIA. La primera ley de la termodinámica es la ley de conservación de la energía generalizada para incluir el calor
Estudiar el fenómeno de trasferencia de calor en los procesos de fundido y evaporación del agua. Calcular el calor latente de vaporización del agua.
 CAMBIOS DE FASE. OBJETIVO: Estudiar el fenómeno de trasferencia de calor en los procesos de fundido y evaporación del agua. Calcular el calor latente de vaporización del agua. INTRODUCCION. Los procesos
CAMBIOS DE FASE. OBJETIVO: Estudiar el fenómeno de trasferencia de calor en los procesos de fundido y evaporación del agua. Calcular el calor latente de vaporización del agua. INTRODUCCION. Los procesos
Concepto de trabajo, Primera Ley. energía, y calor.
 Concepto de trabajo, Primera Ley energía, y calor. Trabajo micro 1 2 En general: W= F. dr = m( v2 2 1 Si hay una parte de fuerzas conservativa: W= 1-2 F.dr=φ 2 -φ 1 De manera que: W total =W=W nc -φ 2
Concepto de trabajo, Primera Ley energía, y calor. Trabajo micro 1 2 En general: W= F. dr = m( v2 2 1 Si hay una parte de fuerzas conservativa: W= 1-2 F.dr=φ 2 -φ 1 De manera que: W total =W=W nc -φ 2
LEYES DE LA TERMODINAMICA LEY DE LA ENERGIA LEY DE LA ENTROPIA
 LEYES DE LA TERMODINAMICA LEY DE LA ENERGIA LEY DE LA ENTROPIA Joaquín Medín Molina Fisica general 2 2006 FORMULACION SIMPLIFICADA DE LEYES TERMODINAMICAS PARA SISTEMAS PURAMENTE TERMICOS energia de cuerpo
LEYES DE LA TERMODINAMICA LEY DE LA ENERGIA LEY DE LA ENTROPIA Joaquín Medín Molina Fisica general 2 2006 FORMULACION SIMPLIFICADA DE LEYES TERMODINAMICAS PARA SISTEMAS PURAMENTE TERMICOS energia de cuerpo
QUÉ ES LA TEMPERATURA?
 1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
EJERCICIOS DE TERMOQUÍMICA
 EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
La energía interna. Nombre Curso Fecha
 Ciencias de la Naturaleza 2.º ESO Unidad 10 Ficha 1 La energía interna La energía interna de una sustancia está directamente relacionada con la agitación o energía cinética de las partículas que la componen.
Ciencias de la Naturaleza 2.º ESO Unidad 10 Ficha 1 La energía interna La energía interna de una sustancia está directamente relacionada con la agitación o energía cinética de las partículas que la componen.
CICLOS DE POTENCIAS DE GAS AIRE CERRADOS
 UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA CICLOS DE POTENCIAS DE
UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA CICLOS DE POTENCIAS DE
Termotecnia y Mecánica de Fluidos (DMN) Mecánica de Fluidos y Termodinámica (ITN) TD. T6.- Ciclos de Refrigeración
 Termotecnia y Mecánica de Fluidos (DMN) Mecánica de Fluidos y Termodinámica (ITN) TD. T6.- Ciclos de Refrigeración Las trasparencias son el material de apoyo del profesor para impartir la clase. No son
Termotecnia y Mecánica de Fluidos (DMN) Mecánica de Fluidos y Termodinámica (ITN) TD. T6.- Ciclos de Refrigeración Las trasparencias son el material de apoyo del profesor para impartir la clase. No son
FÍSICA CICLO 5 CAPACITACIÓN La Termodinámica es el estudio de las propiedades de la energia térmica y de sus propiedades.
 UNIDAD 5 TERMODINÁMICA - HIDRAULICA TERMODINÁMICA La Termodinámica es el estudio de las propiedades de la energia térmica y de sus propiedades. ENERGIA TERMICA: Todos los cuerpos se componen de pequeñas
UNIDAD 5 TERMODINÁMICA - HIDRAULICA TERMODINÁMICA La Termodinámica es el estudio de las propiedades de la energia térmica y de sus propiedades. ENERGIA TERMICA: Todos los cuerpos se componen de pequeñas
Mediciones Confiables con Termómetros de Resistencia i de Platino. Edgar Méndez Lango
 Mediciones Confiables con Termómetros de Resistencia i de Platino Edgar Méndez Lango Termometría, Metrología Eléctrica, CENAM Noviembre 2009 Contenido 2 1. Concepto de temperatura 2. La Escala Internacional
Mediciones Confiables con Termómetros de Resistencia i de Platino Edgar Méndez Lango Termometría, Metrología Eléctrica, CENAM Noviembre 2009 Contenido 2 1. Concepto de temperatura 2. La Escala Internacional
V B. g (1) V B ) g, (2) +ρ B. =( m H. m H (3) ρ 1. ρ B. Aplicando al aire la ecuación de estado de los gases perfectos, en la forma.
 Un globo de aire caliente de volumen =, m 3 está abierto por su parte inferior. La masa de la envoltura es =,87 kg y el volumen de la misma se considera despreciable. La temperatura inicial del aire es
Un globo de aire caliente de volumen =, m 3 está abierto por su parte inferior. La masa de la envoltura es =,87 kg y el volumen de la misma se considera despreciable. La temperatura inicial del aire es
www.academianuevofuturo.com
 Tecnología Industrial. Septiembre 2013. Opción A. Cuestión 1. a) 1--> Región monofásica (α) 2--> Región bifásica (α+l) 3--> Región monofásica (Líquido) 6--> Región bifásica (α+β) b) Hasta llegar a los
Tecnología Industrial. Septiembre 2013. Opción A. Cuestión 1. a) 1--> Región monofásica (α) 2--> Región bifásica (α+l) 3--> Región monofásica (Líquido) 6--> Región bifásica (α+β) b) Hasta llegar a los
Tema 12 Termoquímica. Desprende o absorbe calor? Cuánto calor? Criterio de espontaneidad En qué dirección se produce? Reacciones Químicas
 Tema 1 Estequiometría Cuánto se produce? Cuánto reacciona? Tema 15 Equilibrio Cuándo se alcanza? Cómo modificarlo? Tema 12 Termoquímica Desprende o absorbe calor? Cuánto calor? Criterio de espontaneidad
Tema 1 Estequiometría Cuánto se produce? Cuánto reacciona? Tema 15 Equilibrio Cuándo se alcanza? Cómo modificarlo? Tema 12 Termoquímica Desprende o absorbe calor? Cuánto calor? Criterio de espontaneidad
TEMPERATURA DILATACIÓN. 9. En la escala Celsius una temperatura varía en 45 C. Cuánto variará en la escala Kelvin y
 TEMPERATURA 1. A cuántos grados kelvin equivalen 50 grados centígrados? a) 303 b) 353 c) 453 d) 253 2. Si un cuerpo presenta una temperatura de 20 C Cuál será la lectura de esta en la escala Fahrenheit?
TEMPERATURA 1. A cuántos grados kelvin equivalen 50 grados centígrados? a) 303 b) 353 c) 453 d) 253 2. Si un cuerpo presenta una temperatura de 20 C Cuál será la lectura de esta en la escala Fahrenheit?
Bol. 2: Convección Atmosférica y Nubes
 Bol. 2: Convección Atmosférica y Nubes Por equilibrio radiativo no podemos explicar el perfil observado de temperatura en troposfera La troposfera es calentada en gran parte por convección lo que realiza
Bol. 2: Convección Atmosférica y Nubes Por equilibrio radiativo no podemos explicar el perfil observado de temperatura en troposfera La troposfera es calentada en gran parte por convección lo que realiza
CALOR Y TEMPERATURA CALOR
 CALOR Y TEMPERATURA El calor y la temperatura no son sinónimos, podemos decir que están estrictamente relacionados ya que la temperatura puede determinarse por la cantidad de calor acumulado. El calor
CALOR Y TEMPERATURA El calor y la temperatura no son sinónimos, podemos decir que están estrictamente relacionados ya que la temperatura puede determinarse por la cantidad de calor acumulado. El calor
Capítulo 10. Efectos de superficie. Sistema respiratorio
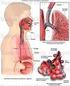 Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Clase 2. Estructura de la Atmósfera
 Clase 2 Estructura de la Atmósfera Preguntas claves 1. Qué es la presión y temperatura? 2. Cómo varían con la altura? 3. Cuál es la estructura de la atmósfera? La física y dinámica de la atmósfera puede
Clase 2 Estructura de la Atmósfera Preguntas claves 1. Qué es la presión y temperatura? 2. Cómo varían con la altura? 3. Cuál es la estructura de la atmósfera? La física y dinámica de la atmósfera puede
TERMODINÁMICA. La TERMODINÁMICA estudia la energía y sus transformaciones
 TERMODINÁMICA La TERMODINÁMICA estudia la energía y sus transformaciones SISTEMA Y AMBIENTE Denominamos SISTEMA a una porción del espacio que aislamos de su entorno para simplificar su estudio y denominamos
TERMODINÁMICA La TERMODINÁMICA estudia la energía y sus transformaciones SISTEMA Y AMBIENTE Denominamos SISTEMA a una porción del espacio que aislamos de su entorno para simplificar su estudio y denominamos
TEMA IV: ENERGÍA DE LAS REACCIONES QUÍMICAS
 TEMA IV: ENERGÍA DE LAS REACCIONES QUÍMICAS 1.- INTRODUCCIÓN A LA TERMODINÁMICA 2.- PRIMER PRINCIPIO DE LA TERMODINÁMICA 3.- ENTALPIAS DE REACCIÓN Y DE FORMACIÓN 4.- ECUACIONES TERMOQUÍMICAS.REACCIONES
TEMA IV: ENERGÍA DE LAS REACCIONES QUÍMICAS 1.- INTRODUCCIÓN A LA TERMODINÁMICA 2.- PRIMER PRINCIPIO DE LA TERMODINÁMICA 3.- ENTALPIAS DE REACCIÓN Y DE FORMACIÓN 4.- ECUACIONES TERMOQUÍMICAS.REACCIONES
y 2 Considere que el viento no sopla en la dirección AB sino que lo hace de forma que v r
 P1. Anemometría sónica. Hoy en día, los Centros Meteorológicos disponen de aparatos muy sofisticados para medir la velocidad del viento que, además y simultáneamente, miden la temperatura del aire. El
P1. Anemometría sónica. Hoy en día, los Centros Meteorológicos disponen de aparatos muy sofisticados para medir la velocidad del viento que, además y simultáneamente, miden la temperatura del aire. El
PRODUCCIÓN DE ENERGÍA ELÉCTRICA DE FUGA DE CALOR:
 PRODUCCIÓN DE ENERGÍA ELÉCTRICA DE FUGA DE CALOR: ciclo doble / simple etapa ORC con un innovador motor rotativo termovolumetrico patentada de alta eficiencia 0.Resumen Se presentan algunos resultados
PRODUCCIÓN DE ENERGÍA ELÉCTRICA DE FUGA DE CALOR: ciclo doble / simple etapa ORC con un innovador motor rotativo termovolumetrico patentada de alta eficiencia 0.Resumen Se presentan algunos resultados
3. MOTORES DE COMBUSTIÓN INTERNA
 3. MOTORES DE COMBUSTIÓN INTERNA 3.1 INTRODUCCIÓN. 3.2 ZONAS Y ELEMENTOS BÁSICOS. 3.3 FUNCIONAMIENTO. 3.4 CLASIFICACIÓN. Los motores de combustión interna son sistemas que convierten, internamente, la
3. MOTORES DE COMBUSTIÓN INTERNA 3.1 INTRODUCCIÓN. 3.2 ZONAS Y ELEMENTOS BÁSICOS. 3.3 FUNCIONAMIENTO. 3.4 CLASIFICACIÓN. Los motores de combustión interna son sistemas que convierten, internamente, la
TERMODINAMICA INTRODUCCION. CALOR Y TRABAJO
 TERMODINAMICA INTRODUCCION. La termodinámica puede definirse como el tema de la Física que estudia los procesos en los que se transfiere energía como calor y como trabajo. Al hablar de termodinámica, con
TERMODINAMICA INTRODUCCION. La termodinámica puede definirse como el tema de la Física que estudia los procesos en los que se transfiere energía como calor y como trabajo. Al hablar de termodinámica, con
Ecuación de estado del gas ideal
 Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
Bioquímica Termodinámica y bioenergética.
 Bioquímica Termodinámica y bioenergética. Facultad de Enfermería Universidad de la República ESFUNO 2014 Amalia Ávila Termodinámica y bioenergética Los organismos vivos no se encuentran en equilibrio con
Bioquímica Termodinámica y bioenergética. Facultad de Enfermería Universidad de la República ESFUNO 2014 Amalia Ávila Termodinámica y bioenergética Los organismos vivos no se encuentran en equilibrio con
Respuesta: a) La fracción molar de NaCl es 0,072 b) La concentración másica volumétrica de NaCl es 0,231 g/cc
 Ejercicio 1: La densidad a 4 ºC de una solución acuosa de NaCl al 20% en peso es 1,155 g/cc a) Calcule la fracción molar de NaCl b) Calcule la concentración másica volumétrica de NaCl La masa molecular
Ejercicio 1: La densidad a 4 ºC de una solución acuosa de NaCl al 20% en peso es 1,155 g/cc a) Calcule la fracción molar de NaCl b) Calcule la concentración másica volumétrica de NaCl La masa molecular
FUNDAMENTOS DE REFRIGERACION
 FUNDAMENTOS DE REFRIGERACION PRESENTACION EN ESPAÑOL Mayo 2010 Renato C. OLvera Index ESTADOS DE LA MATERIA LOS DIFERENTES ESTADOS DE LA MATERIA SON MANIFESTACIONES DE LA CANTIDAD DE ENERGIA QUE DICHA
FUNDAMENTOS DE REFRIGERACION PRESENTACION EN ESPAÑOL Mayo 2010 Renato C. OLvera Index ESTADOS DE LA MATERIA LOS DIFERENTES ESTADOS DE LA MATERIA SON MANIFESTACIONES DE LA CANTIDAD DE ENERGIA QUE DICHA
TERMODINÁMICA AVANZADA
 ERMODINÁMICA AANZADA Cantidades fundamentales Cantidades básicas y unidaded Unidad I: ropiedades y Leyes de la ermodinámica Cantidades fundamentales ropiedades de estado Función de estado y ecuación de
ERMODINÁMICA AANZADA Cantidades fundamentales Cantidades básicas y unidaded Unidad I: ropiedades y Leyes de la ermodinámica Cantidades fundamentales ropiedades de estado Función de estado y ecuación de
Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES. Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile
 Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile Guía 4: Mecánica de fluidos Martes 25 de Septiembre, 2007
Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile Guía 4: Mecánica de fluidos Martes 25 de Septiembre, 2007
Tema 8. Termodinámica
 Física I. Curso 2010/11 Departamento de Física Aplicada. ETSII de Béjar. Universidad de Salamanca Profs. Alejandro Medina Domínguez y Jesús Ovejero Sánchez Tema 8. Termodinámica Índice 1. Conceptos básicos
Física I. Curso 2010/11 Departamento de Física Aplicada. ETSII de Béjar. Universidad de Salamanca Profs. Alejandro Medina Domínguez y Jesús Ovejero Sánchez Tema 8. Termodinámica Índice 1. Conceptos básicos
MÁQUINAS TERMODINÁMICA
 MÁQUINAS r r Trabajo: W F * d (N m Julios) (producto escalar de los dos vectores) Trabajo en rotación: W M * θ (momento o par por ángulo de rotación) Trabajo en fluidos: W p * S * d p * Energía: capacidad
MÁQUINAS r r Trabajo: W F * d (N m Julios) (producto escalar de los dos vectores) Trabajo en rotación: W M * θ (momento o par por ángulo de rotación) Trabajo en fluidos: W p * S * d p * Energía: capacidad
ΔS > 0 aumento del desorden. ΔS < 0 disminución del desorden.
 PRIMER PRINCIPIO La Energía del universo (sistema + entorno) se conserva. A + B C La energía del universo se conservará asimismo para: C A + B Los cambios pueden ocurrir en ambos sentidos? Qué determina
PRIMER PRINCIPIO La Energía del universo (sistema + entorno) se conserva. A + B C La energía del universo se conservará asimismo para: C A + B Los cambios pueden ocurrir en ambos sentidos? Qué determina
CINEMÁTICA: ESTUDIO DEL MOVIMIENTO. Cinemática es la parte de la Física que estudia la descripción del movimiento de los cuerpos.
 CINEMÁTICA: ESTUDIO DEL MOVIMIENTO Cinemática es la parte de la Física que estudia la descripción del movimiento de los cuerpos. 1. Cuándo un cuerpo está en movimiento? Para hablar de reposo o movimiento
CINEMÁTICA: ESTUDIO DEL MOVIMIENTO Cinemática es la parte de la Física que estudia la descripción del movimiento de los cuerpos. 1. Cuándo un cuerpo está en movimiento? Para hablar de reposo o movimiento
PROBLEMAS. Segundo Principio. Problema 1
 PROBLEMAS Segundo Principio Problema 1 La figura muestra un sistema que capta radiación solar y la utiliza para producir electricidad mediante un ciclo de potencia. El colector solar recibe 0,315 kw de
PROBLEMAS Segundo Principio Problema 1 La figura muestra un sistema que capta radiación solar y la utiliza para producir electricidad mediante un ciclo de potencia. El colector solar recibe 0,315 kw de
Física y Tecnología Energética. 8 - Máquinas térmicas. Motores de Otto y Diesel.
 Física y Tecnología Energética 8 - Máquinas térmicas. Motores de Otto y Diesel. Máquinas térmicas y motores Convierten calor en trabajo. Eficiencia limitada por el 2º principio a
Física y Tecnología Energética 8 - Máquinas térmicas. Motores de Otto y Diesel. Máquinas térmicas y motores Convierten calor en trabajo. Eficiencia limitada por el 2º principio a
CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN ÍNDICE
 CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN 9.1 Introducción 9.2 Estabilidad y equilibrio ÍNDICE 9.3 Concepto de polimorfismo y de transformación
CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN 9.1 Introducción 9.2 Estabilidad y equilibrio ÍNDICE 9.3 Concepto de polimorfismo y de transformación
Carrera: MCT 0540. Participantes. Representantes de las academias de Ingeniería Mecánica de Institutos Tecnológicos. Academia de Ingeniería
 1.- DATOS DE LA ASIGNATURA Nombre de la asignatura: Carrera: Clave de la asignatura: Horas teoría-horas práctica-créditos Termodinámica Ingeniería Mecánica MCT 0540 2 3 7 2.- HISTORIA DEL PROGRAMA Lugar
1.- DATOS DE LA ASIGNATURA Nombre de la asignatura: Carrera: Clave de la asignatura: Horas teoría-horas práctica-créditos Termodinámica Ingeniería Mecánica MCT 0540 2 3 7 2.- HISTORIA DEL PROGRAMA Lugar
Apuntes de Electroquímica
 En la región donde interaccionan electrodo y disolución pueden ocurrir dos tipos de reacciones: de oxidación o de reducción. La velocidad de una reacción elemental depende de la concentración de las especies
En la región donde interaccionan electrodo y disolución pueden ocurrir dos tipos de reacciones: de oxidación o de reducción. La velocidad de una reacción elemental depende de la concentración de las especies
Unidad 6: ELECTROQUIMICA
 Unidad 6: ELECTROQUIMICA REACCIONES DE OXIDACION-REDUCCION Las reacciones redox son aquellas en las cuales hay intercambio de electrones entre las sustancias que intervienen en la reacción. Oxidación:
Unidad 6: ELECTROQUIMICA REACCIONES DE OXIDACION-REDUCCION Las reacciones redox son aquellas en las cuales hay intercambio de electrones entre las sustancias que intervienen en la reacción. Oxidación:
Guía Teórica Experiencia Motor Stirling
 Universidad de Chile Escuela de Verano 2009 Curso de Energía Renovable Guía Teórica Experiencia Motor Stirling Escrito por: Diego Huarapil Enero 2009 Introducción El Motor Stirling es un motor térmico,
Universidad de Chile Escuela de Verano 2009 Curso de Energía Renovable Guía Teórica Experiencia Motor Stirling Escrito por: Diego Huarapil Enero 2009 Introducción El Motor Stirling es un motor térmico,
1. Los calores de combustión del metano y butano son 890 kj/mol y 2876 kj/mol respectivamente
 . Los calores de combustión del metano y butano son 890 kj/mol y 876 kj/mol respectivamente Butano: C 4 H 0 Metano: CH 4 a) Cuando se utiliza como combustible Cual generaría más calor para la misma masa
. Los calores de combustión del metano y butano son 890 kj/mol y 876 kj/mol respectivamente Butano: C 4 H 0 Metano: CH 4 a) Cuando se utiliza como combustible Cual generaría más calor para la misma masa
MECANICA DE LOS FLUIDOS
 MECANICA DE LOS FLUIDOS 7 FUNDAMENTOS DEL FLUJO DE FLUIDOS Ing. Alejandro Mayori Flujo de Fluidos o Hidrodinámica es el estudio de los Fluidos en Movimiento Principios Fundamentales: 1. Conservación de
MECANICA DE LOS FLUIDOS 7 FUNDAMENTOS DEL FLUJO DE FLUIDOS Ing. Alejandro Mayori Flujo de Fluidos o Hidrodinámica es el estudio de los Fluidos en Movimiento Principios Fundamentales: 1. Conservación de
LEYES DE LOS GASES. Leyes de los gases. Leyes de los gases
 LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
W =F t. 0 Trabajo y energía. W = F r= F r cos. Donde F cos es la componente de la fuerza en la dirección del desplazamiento F t.
 El trabajo mecánico realizado por una fuerza constante, F, que actúa sobre un cuerpo que realiza un desplazamiento r es igual al producto escalar de la fuerza por el desplazamiento. Es decir: W = F r=
El trabajo mecánico realizado por una fuerza constante, F, que actúa sobre un cuerpo que realiza un desplazamiento r es igual al producto escalar de la fuerza por el desplazamiento. Es decir: W = F r=
ADAPTACIÓN CURRICULAR TEMA 11 CIENCIAS NATURALES 2º E.S.O
 ADAPTACIÓN CURRICULAR TEMA 11 CIENCIAS NATURALES 2º E.S.O Calor y temperatura 1ª) Qué es la energía térmica? La energía térmica es la energía que posee un cuerpo (o un sistema material) debido al movimiento
ADAPTACIÓN CURRICULAR TEMA 11 CIENCIAS NATURALES 2º E.S.O Calor y temperatura 1ª) Qué es la energía térmica? La energía térmica es la energía que posee un cuerpo (o un sistema material) debido al movimiento
GASES IDEALES. 1 atm = 760 mmhg = 760 Torr = 1013 hpa
 GASES IDEALES Para comprender los problemas de este capítulo es necesario leer previamente la Teoría Cinética de los Gases, el concepto de Variables de Estado y las Leyes de los Gases. Ecuación general
GASES IDEALES Para comprender los problemas de este capítulo es necesario leer previamente la Teoría Cinética de los Gases, el concepto de Variables de Estado y las Leyes de los Gases. Ecuación general
Volumen de Sólidos de Revolución
 60 CAPÍTULO 4 Volumen de Sólidos de Revolución 6 Volumen de sólidos de revolución Cuando una región del plano de coordenadas gira alrededor de una recta l, se genera un cuerpo geométrico denominado sólido
60 CAPÍTULO 4 Volumen de Sólidos de Revolución 6 Volumen de sólidos de revolución Cuando una región del plano de coordenadas gira alrededor de una recta l, se genera un cuerpo geométrico denominado sólido
4.3 Problemas de aplicación 349
 4. Problemas de aplicación 49 4. Problemas de aplicación Ejemplo 4.. Circuito Eléctrico. En la figura 4.., se muestra un circuito Eléctrico de mallas en el cual se manejan corrientes, una en cada malla.
4. Problemas de aplicación 49 4. Problemas de aplicación Ejemplo 4.. Circuito Eléctrico. En la figura 4.., se muestra un circuito Eléctrico de mallas en el cual se manejan corrientes, una en cada malla.
A. Sustancia pura, isotermal de una atmósfera a presión constante. 1. dg = V dp - S dt (1) 2. dg = V dp (2) 3. (3) 4. (4)
 POTENCIAL QUÍMICO Y CAMBIO DE FASES I. Potencial químico: gas ideal y su estado patrón. A. Sustancia pura, isotermal de una atmósfera a presión constante. 1. dg = V dp - S dt (1) 2. dg = V dp (2) 3. (3)
POTENCIAL QUÍMICO Y CAMBIO DE FASES I. Potencial químico: gas ideal y su estado patrón. A. Sustancia pura, isotermal de una atmósfera a presión constante. 1. dg = V dp - S dt (1) 2. dg = V dp (2) 3. (3)
Dispositivos Cilindro-Pistón
 Presión ejercida sobre superficies sólidas: sistema cilindro-pistón Un sistema importante desde el punto de vista termodinámico es el sistema cilindro-pistón, ya que se puede estudiar con él el comportamiento
Presión ejercida sobre superficies sólidas: sistema cilindro-pistón Un sistema importante desde el punto de vista termodinámico es el sistema cilindro-pistón, ya que se puede estudiar con él el comportamiento
Ejercicios relacionados con líquidos y sólidos
 Ejercicios relacionados con líquidos y sólidos. La presión de vapor del etanol es de 35,3 mmhg a 40 o C y 542,5 mmhg a 70 o C. Calcular el calor molar de vaporización y la presión del etanol a 50 o C.
Ejercicios relacionados con líquidos y sólidos. La presión de vapor del etanol es de 35,3 mmhg a 40 o C y 542,5 mmhg a 70 o C. Calcular el calor molar de vaporización y la presión del etanol a 50 o C.
Clase 2: Sustancias puras
 Teórico Física Térmica 2012 02 de Marzo de 2012 Agenda... 1 Referencias 2 Sustancias puras Intro Propiedades independientes 3 Fases Definiciones Cambios (o transiciones) de fase Mezcla Superficies P-v-T
Teórico Física Térmica 2012 02 de Marzo de 2012 Agenda... 1 Referencias 2 Sustancias puras Intro Propiedades independientes 3 Fases Definiciones Cambios (o transiciones) de fase Mezcla Superficies P-v-T
BARCO A VAPOR TERMODINÁMICO. INTEGRANTES: Bibiana Rodríguez Laura Liliana Triana Carlos Alberto Chinome
 BARCO A VAPOR TERMODINÁMICO INTEGRANTES: Bibiana Rodríguez Laura Liliana Triana Carlos Alberto Chinome PLANTEAMIENTO DEL PROBLEMA Continuando con la promoción y desarrollo de la cátedra de termodinámica
BARCO A VAPOR TERMODINÁMICO INTEGRANTES: Bibiana Rodríguez Laura Liliana Triana Carlos Alberto Chinome PLANTEAMIENTO DEL PROBLEMA Continuando con la promoción y desarrollo de la cátedra de termodinámica
Soluciones. DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I)
 Soluciones DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I) 1. Demuestre que 1 mol de cualquier gas a presión atmosférica de 101 kpa y temperatura de 0ºC ocupa un volumen de 22,4 L. n =
Soluciones DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I) 1. Demuestre que 1 mol de cualquier gas a presión atmosférica de 101 kpa y temperatura de 0ºC ocupa un volumen de 22,4 L. n =
A) FÍSICA II (CURSO DE LA FACULTAD DE CIENCIAS, CLAVE : T91F2) B) DATOS BÁSICOS DEL CURSO C) OBJETIVOS DEL CURSO
 UNIVERSIDAD AUTÓNOMA DE SAN LUIS POTOSI Facultad de Ciencias Programas Analíticos de los primeros dos semestres de la licenciatura en Biofísica. 1) NOMBRE DE CADA CURSO O ACTIVIDAD CURRICULAR A) FÍSICA
UNIVERSIDAD AUTÓNOMA DE SAN LUIS POTOSI Facultad de Ciencias Programas Analíticos de los primeros dos semestres de la licenciatura en Biofísica. 1) NOMBRE DE CADA CURSO O ACTIVIDAD CURRICULAR A) FÍSICA
λ fus + λ vap = λ sub
 Cambios De Fase Ecuacion De Clasius V : diferencia de volumen entre ambas fases. λ = T(s f s i ) se denomina calor latente o entalpia de transición. Se considera normalmente como constante. Además se cumple
Cambios De Fase Ecuacion De Clasius V : diferencia de volumen entre ambas fases. λ = T(s f s i ) se denomina calor latente o entalpia de transición. Se considera normalmente como constante. Además se cumple
EQUIVALENCIA CALOR-TRABAJO. Elaborado por M en C Omar Hernández Segura
 EQUIVALENCIA CALOR-TRABAJO TRABAJO 1 TRABAJO Y SUS VARIEDADES Tipo de trabajo: δw Donde: Unidades δw (J) Expansión-compresión P op dv P op es la presión de oposición dv es el cambio de volumen Superficial
EQUIVALENCIA CALOR-TRABAJO TRABAJO 1 TRABAJO Y SUS VARIEDADES Tipo de trabajo: δw Donde: Unidades δw (J) Expansión-compresión P op dv P op es la presión de oposición dv es el cambio de volumen Superficial
LÍNEAS DEL DIAGRAMA DE MOLLIER
 DIAGRAMA DE MOLLIER El refrigerante cambia de estado a lo largo del ciclo frigorífico como hemos visto en el capítulo anterior. Representaremos sobre el diagrama de p-h las distintas transformaciones que
DIAGRAMA DE MOLLIER El refrigerante cambia de estado a lo largo del ciclo frigorífico como hemos visto en el capítulo anterior. Representaremos sobre el diagrama de p-h las distintas transformaciones que
Determinación de entalpías de vaporización
 Prácticas de Química. Determinación de entalpías de vaporización I. Introducción teórica y objetivos........................................ 2 II. Desarrollo experimental...............................................
Prácticas de Química. Determinación de entalpías de vaporización I. Introducción teórica y objetivos........................................ 2 II. Desarrollo experimental...............................................
Objetivos: Principal: Investigar las propiedades de un gas a presión constante. Secundario: Determinar la tasa de enfriamiento de un cuerpo.
 ! " # $ %& ' () ) Objetivos: Principal: Investigar las propiedades de un gas a presión constante. Secundario: Determinar la tasa de enfriamiento de un cuerpo. Conceptos a afianzar: Descripción termodinámica
! " # $ %& ' () ) Objetivos: Principal: Investigar las propiedades de un gas a presión constante. Secundario: Determinar la tasa de enfriamiento de un cuerpo. Conceptos a afianzar: Descripción termodinámica
Capítulo 6: Entropía.
 Capítulo 6: Entropía. 6. La deigualdad de Clauiu La deigualdad de Clauiu no dice que la integral cíclica de δq/ e iempre menor o igual que cero. δq δq (ciclo reverible) Dipoitivo cíclico reverible Depóito
Capítulo 6: Entropía. 6. La deigualdad de Clauiu La deigualdad de Clauiu no dice que la integral cíclica de δq/ e iempre menor o igual que cero. δq δq (ciclo reverible) Dipoitivo cíclico reverible Depóito
TEMA 1. MECANISMOS BÁSICOS DE TRANSMISIÓN DE CALOR
 TEMA 1. MECANISMOS BÁSICOS DE TRANSMISIÓN DE CALOR El calor: Es una forma de energía en tránsito. La Termodinámica y La Transferencia de calor. Diferencias. TERMODINAMICA 1er. Principio.Permite determinar
TEMA 1. MECANISMOS BÁSICOS DE TRANSMISIÓN DE CALOR El calor: Es una forma de energía en tránsito. La Termodinámica y La Transferencia de calor. Diferencias. TERMODINAMICA 1er. Principio.Permite determinar
MECÁNICA DE FLUIDOS. Docente: Ing. Alba Díaz Corrales
 MECÁNICA DE FLUIDOS Docente: Ing. Alba Díaz Corrales Fecha: 1 de septiembre 2010 Mecánica de Fluidos Tipo de asignatura: Básica Específica Total de horas semanales: 6 Total de horas semestrales: 84 Asignatura
MECÁNICA DE FLUIDOS Docente: Ing. Alba Díaz Corrales Fecha: 1 de septiembre 2010 Mecánica de Fluidos Tipo de asignatura: Básica Específica Total de horas semanales: 6 Total de horas semestrales: 84 Asignatura
El tubo De Vénturi. Introducción
 El tubo De Vénturi Recopilado a partir de http://www.monografias.com/trabajos6/tube/tube.shtml por: Jose Carlos Suarez Barbuzano. Técnico Superior Química Ambiental. Técnico del Centro Canario del Agua
El tubo De Vénturi Recopilado a partir de http://www.monografias.com/trabajos6/tube/tube.shtml por: Jose Carlos Suarez Barbuzano. Técnico Superior Química Ambiental. Técnico del Centro Canario del Agua
TUTORIAL BÁSICO DE MECÁNICA FLUIDOS
 TUTORIAL BÁSICO DE MECÁNICA FLUIDOS El tutorial es básico pues como habréis visto en muchos de ellos es haceros entender no sólo la aplicación práctica de cada teoría sino su propia existencia y justificación.
TUTORIAL BÁSICO DE MECÁNICA FLUIDOS El tutorial es básico pues como habréis visto en muchos de ellos es haceros entender no sólo la aplicación práctica de cada teoría sino su propia existencia y justificación.
TEMA 1. DIAGRAMAS AEROLÓGICOS
 TEMA 1. DIAGRAMAS AEROLÓGICOS 1.1 Finalidad y elección de coordenadas 1.2 Orientación relativa de las líneas fundamentales 1.3 Diagrama de Clapeyron 1.4 Tefigrama 1.5 Emagrama o diagrama de Neuhoff 1.6
TEMA 1. DIAGRAMAS AEROLÓGICOS 1.1 Finalidad y elección de coordenadas 1.2 Orientación relativa de las líneas fundamentales 1.3 Diagrama de Clapeyron 1.4 Tefigrama 1.5 Emagrama o diagrama de Neuhoff 1.6
TERMODINÁMICA Tema 10: El Gas Ideal
 TERMODINÁMICA Tema 10: El Gas Ideal Fundamentos Físicos de la Ingeniería 1 er Curso Ingeniería Industrial Dpto. Física Aplicada III 1 Índice Introducción Ecuación de estado Experimento de Joule Capacidades
TERMODINÁMICA Tema 10: El Gas Ideal Fundamentos Físicos de la Ingeniería 1 er Curso Ingeniería Industrial Dpto. Física Aplicada III 1 Índice Introducción Ecuación de estado Experimento de Joule Capacidades
