DESCUBRE TODAS LAS OPCIONES QUE TIENES PARA LA EM RECURRENTE. En el interior: Un mundo de tratamientos y apoyo con Biogen.
|
|
|
- José Ignacio Mora Soler
- hace 7 años
- Vistas:
Transcripción
1 DESCUBRE TODAS LAS OPCIONES QUE TIENES PARA LA EM RECURRENTE En el interior: Un mundo de tratamientos y apoyo con Biogen.
2 ÍNDICE Introducción a Biogen Programa de apoyo de Biogen Nuestras marcas Conoce TECFIDERA Conoce TYSABRI Conoce PLEGRIDY Conoce AVONEX (dimetil fumarato) 2 Consulta la versión completa de la Información de prescripción para TYSABRI (natalizumab), incluidos el cuadro de advertencia y la guía de medicamentos en las páginas 49 a 83. 3
3 COMPROMETIDOS CON LA LUCHA CONTRA LA EM RECURRENTE Durante aproximadamente 20 años, Biogen ha luchado contra la esclerosis múltiple (EM) recurrente. Lo hemos hecho brindando terapias significativas a la vez que realizamos investigaciones y desarrollos valiosos. Trabajamos a la par con la comunidad de EM para ayudar a las personas que viven con esta enfermedad. Terapias para la EM recurrente Existen varias opciones a la hora de tratar la EM recurrente. Cada una funciona de manera diferente y en los ensayos clínicos se han observado distintos resultados. Según lo recete tu médico, puedes tomar de diferentes maneras los medicamentos para la EM recurrente. Es importante que comprendas tus opciones y te asesores con tu médico para encontrar el tratamiento que mejor satisfaga tus necesidades y objetivos de tratamiento. Se ha demostrado que las terapias de Biogen para la EM ayudan a las personas con EM recurrente mediante la reducción de las recidivas, el retraso en la progresión de la discapacidad física, y la disminución de la cantidad de lesiones detectadas mediante los imágenes de resonancia magnética (IRM). Investigación y desarrollo continuos En 2014, dedicamos más del 20% de nuestros ingresos a la investigación y el desarrollo de fármacos. Esta inversión nos ayuda a encontrar maneras de ayudar a satisfacer las necesidades futuras de las personas que viven con EM. Cápsulas Inyecciones Infusiones Para comenzar a obtener información sobre las terapias de Biogen, pasa a la página
4 ABOVE MS ESTÁ AQUÍ PARA TI Presentado por Biogen El programa Above MS de Biogen te ofrece consejos, herramientas e información para la EM y mucho más. El programa Above MS de Biogen asume el compromiso de ayudar a las personas que viven con EM y brinda apoyo adicional, como: 6 Unirse al programa Above MS te brinda muchos beneficios. Como miembro, recibirás ayuda adicional proporcionada por personas que comprenden la EM, incluido lo siguiente: Información especialmente adaptada brindada por personas como tú que viven con EM recurrente, pero que también son expertas en áreas como planificación financiera, cocina, ejercicio físico y muchas más Apoyo individualizado por vía telefónica sobre la EM Una comunidad de compañeros Acceso a enfermeros educadores Apoyo financiero y de seguros cuando lo necesites Información acerca de las opciones de tratamiento y los servicios de apoyo de Biogen Ten en cuenta que el médico siempre es tu principal recurso cuando se trata de tu EM y su tratamiento. Recibe aún más apoyo. Haz un seguimiento de tu evolución y prepárate para la próxima consulta con el médico. Descarga la aplicación gratuita MySidekick en MySidekickApp.com Coordinadores de apoyo que ofrecen información general acerca de la EM, apoyo individualizado por vía telefónica sobre la EM, capacitación adicional acerca de inyecciones y apoyo financiero y de seguros Comunidad afín que te ayuda a comunicar con otras personas que viven con EM, compartir experiencias personales y mantenerte optimista y motivado Apoyo financiero y de seguros para ayudarte a encontrar las mejores soluciones en términos de asesoramiento de seguros, investigación de beneficios, nuestro programa $0 Copago y ayuda para copagos, si eres elegible Enfermeros educadores que te brindan apoyo adicional a ti y a la persona a cargo de tu cuidado con técnicas para colocar inyecciones y que responden a preguntas relacionadas con la EM y el tratamiento. Están disponibles por vía telefónica las 24 horas del día, los 7 días de la semana Inscríbete hoy mismo: Llama al Visita AboveMS.com Completa la tarjeta que se encuentra al dorso de este folleto 7
5 OBTÉN INFORMACIÓN SOBRE LAS OPCIONES DISPONIBLES DE BIOGEN (dimetil fumarato) Consulta la página 10 para obtener más información. Biogen ofrece una amplia variedad de opciones de tratamiento para tu afección, y con 4 medicamentos diferentes, es posible que tengamos una opción para ti. Esperamos que la información de este folleto te ayude a aprovechar al máximo tu próxima visita al médico. Habla con tu médico sobre tus opciones de tratamiento. Consulta la página 18 para obtener más información. Consulta la página 30 para obtener más información. Consulta la página 42 para obtener más información. 8 Consulta la Información importante de seguridad acerca de TYSABRI en las páginas 13 a 15 y la versión completa de la Información de prescripción, incluidos el Cuadro de advertencia y la Guía de medicamentos para el paciente en las páginas 49 a 83. 9
6 (dimetil fumarato) Imagine otra PERSPECTIVA 10 Información importante de seguridad seleccionada No uses TECFIDERA si has tenido una reacción alérgica (como ronchas, urticaria, hinchazón del rostro, los labios, la boca o la lengua o dificultad para respirar) a TECFIDERA o a cualquiera de sus componentes. Consulta la Información importante de seguridad acerca de TECFIDERA en las páginas 8 a 9 y la versión completa de la Información de prescripción y la Información para el paciente en las páginas 30 a
7 CONSIDERA TOMAR TECFIDERA, UNA PILDORA PARA LA EM RECURRENTE Más de 150,000 personas en el mundo han tomado TECFIDERA cápsulas de liberación (dimetil fumarato) retardada de 240 mg TECFIDERA puede reducir la cantidad de recidivas a la mitad TECFIDERA es una cápsula que ha demostrado lo siguiente: Reduce las recidivas a la mitad Retrasa el desarrollo de lesiones cerebrales Retrasa la progresión de la discapacidad física Durante un estudio de 2 años de duración, TECFIDERA redujo las recidivas a la mitad mediante la disminución del riesgo de recidivas en un 49% en comparación con placebo. Un objetivo del tratamiento para la esclerosis múltiple (EM) recurrente debería ser reducir el riesgo de recidivas. Imagina lo que podrías hacer con menos recidivas. En un estudio de 2 años de duración, el 27% de las personas que tomaba TECFIDERA sufrió una recidiva, en comparación con el 46% que tomaba placebo. Eso significa lo siguiente: TECFIDERA REDUCE EL RIESGO DE RECIDIVAS A LA MITAD 49 % En otro estudio de 2 años de duración, el 29% de las personas que tomaba TECFIDERA sufrió una recidiva, en comparación con el 41% que tomaba placebo. CONSIDERA EL MEDICAMENTO #1 EN PRESCRIPCIONES 12 en los EE.UU. para la EM recurrente desde septiembre de 2013 *. Si consideras que TECFIDERA es adecuado para ti, habla con tu médico o visita TECFIDERA.com * Basado en la cantidad de recetas de los datos semanales de IMS NPA (desde el 27 de septiembre de 2013 hasta el 3 de junio de 2016). Información en archivo de Biogen. Consulta la Información importante de seguridad acerca de TECFIDERA en las páginas 8 a 9 y la versión completa de la Información de prescripción y la Información para el paciente en las páginas 30 a
8 INFORMACIÓN IMPORTANTE DE SEGURIDAD ACERCA DE TECFIDERA En un estudio de 2 años de duración, TECFIDERA redujo la cantidad de recidivas en un 44% en comparación con el placebo. TECFIDERA REDUCE LA CANTIDAD DE RECIDIVAS CASI A LA MITAD 44 % En otro estudio de 2 años de duración, TECFIDERA redujo la cantidad de recidivas en un 53% en comparación con el placebo. Para obtener Información importante de seguridad, consulta las páginas 8 a 9 y la versión completa de la Información de prescripción y la Información para el paciente en las páginas 30 a 48. INDICACIÓN Tecfidera (dimetil fumarato) es un medicamento de venta con receta que se utiliza para tratar a personas con formas recurrentes de esclerosis múltiple. INFORMACIÓN IMPORTANTE DE SEGURIDAD No uses TECFIDERA si has tenido una reacción alérgica (como ronchas, urticaria, hinchazón del rostro, los labios, la boca o la lengua o dificultad para respirar) a TECFIDERA o a cualquiera de sus componentes. Antes de tomar TECFIDERA y mientras lo haces, informa a tu médico sobre cualquier recuento leucocitario bajo o infección, o sobre cualquier otra afección. Cuáles son los posibles efectos secundarios de TECFIDERA? TECFIDERA puede causar efectos secundarios graves, entre los que se incluyen reacciones alérgicas, leucoencefalopatía multifocal progresiva (LMP), que es una infección cerebral rara que generalmente causa la muerte o una discapacidad grave, y disminuciones del recuento leucocitario. Es posible que el médico verifique tu recuento leucocitario antes de que tomes TECFIDERA y periódicamente durante el tratamiento
9 INFORMACIÓN IMPORTANTE DE SEGURIDAD ACERCA DE TECFIDERA cápsulas de liberación (dimetil fumarato) retardada de 240 mg 16 Los efectos secundarios más frecuentes de TECFIDERA incluyen sofocos y problemas estomacales. Estos pueden producirse especialmente al comienzo del tratamiento y pueden disminuir con el tiempo. Tomar TECFIDERA con alimentos puede ayudar a reducir los sofocos. Llama a tu médico si estos síntomas constituyen una molestia para ti o no desaparecen. Pregunta a tu médico si tomar aspirina antes de tomar TECFIDERA puede reducir los sofocos. Estos no son todos los posibles efectos secundarios de TECFIDERA. Si necesitas asesoramiento médico sobre los efectos secundarios, llama a tu médico. Puedes informar los efectos secundarios a la Administración de Medicamentos y Alimentos de los EE. UU. (US Food and Drug Administration, FDA) llamando al FDA Para obtener más información, visita dailymed.nlm.nih.gov. Informa a tu médico si estás embarazada o planeas quedar embarazada, o si estás amamantando o planeas amamantar. Se desconoce si TECFIDERA dañará al bebé en gestación o si pasa a la leche materna. También informa a tu médico si estás tomando medicamentos recetados o de venta libre, vitaminas o suplementos a base de hierbas. Para obtener Información importante de seguridad adicional, consulta la versión completa de la Información de prescripción y la Información para el paciente en las páginas 40 a 48. Esta información no tiene el fin de reemplazar la consulta con tu médico. 17
10 ES TU LUCHA INDICACIÓN TYSABRI (natalizumab) es un medicamento de venta con receta que se utiliza para tratar a personas adultas con formas recurrentes de esclerosis múltiple (EM), para retardar el empeoramiento de los síntomas frecuentes en personas con EM y para disminuir la cantidad de exacerbaciones (recidivas). TYSABRI aumenta el riesgo de leucoencefalopatía multifocal progresiva (LMP). Cuando se inicia y continua el tratamiento con TYSABRI, es importante hablar con el médico para saber si el beneficio esperado de TYSABRI es suficiente como para compensar este riesgo. 18 Consulta la Información importante de seguridad acerca de TYSABRI en las páginas 13 a 15 y la versión completa de la Información de prescripción, incluidos el Cuadro de advertencia y la Guía de medicamentos para el paciente en las páginas 49 a 83. Erica, paciente que toma TYSABRI. 19
11 TYSABRI ES PARA PERSONAS QUE NO SE RINDEN, NO SUCUMBEN NI ABANDONAN LA LUCHA Si consideras que TYSABRI podría ser adecuado para ti, habla con tu médico hoy o visita TYSABRI.com CADA 4 SEMANAS 300 mg i. v. (natalizumab) 20 Lucha por las cosas que realmente son importantes para ti TYSABRI puede proporcionar resultados comprobados con una infusión cada 28 días. Pregunta a tu médico si es momento de cambiar a la efectividad comprobada de TYSABRI para el tratamiento de tu EM recurrente. Retrase la progresión de la discapacidad física Más del 80% de las personas tratadas con TYSABRI no sufrió una progresión de la discapacidad física durante un período de 12 semanas *. 17% de las personas tratadas con TYSABRI experimentó un empeoramiento de la discapacidad física, en comparación con el 29% de las personas que tomaban placebo. Reduzca la formación de lesiones cerebrales nuevas El 97% de las personas tratadas con TYSABRI no sufrió lesiones nuevas que mostraron actividad de la enfermedad en una IRM *. En comparación con el 72% de las personas que tomó placebo. Reduzca la cantidad de recidivas Aproximadamente el 70% de las personas que tomó TYSABRI no tuvo recidivas *. El 67% de las personas que tomó TYSABRI no tuvo recidivas, en comparación con el 41% de las personas que tomó placebo. * En un estudio de 2 años de duración con 627 personas tratadas con TYSABRI y 315 que tomó placebo. INFORMACIÓN IMPORTANTE DE SEGURIDAD SELECCIONADA TYSABRI aumenta el riesgo de desarrollar una infección cerebral rara, llamada leucoencefalopatía multifocal progresiva (LMP), que generalmente provoca la muerte o una discapacidad grave. Consulta la Información importante de seguridad acerca de TYSABRI en las páginas 13 a 15 y la versión completa de la Información de prescripción, incluidos el Cuadro de advertencia y la Guía de medicamentos para el paciente en las páginas 49 a 83. Erica, paciente que toma TYSABRI. 21
12 CADA 4 SEMANAS 300 mg i. v. 2 HORAS CADA 28 DÍAS (natalizumab) Comprender la LMP y el virus de John Cunningham (VJC)? Actualmente, Biogen cuenta con datos de seguridad de 6 años para Con TYSABRI, recibes una infusión que la administra un profesional de atención médica, una vez cada 28 días. ayudarte a ti y a tu médico a comprender mejor el riesgo estimado de sufrir leucoencefalopatía multifocal progresiva (LMP), una infección cerebral rara que puede provocar la muerte o una discapacidad grave. En la actualidad, La infusión tarda aproximadamente una hora. Luego se te pide que permanezcas durante otra hora sólo para asegurarse de que no presentes Nadie puede predecir quién sufrirá LMP, pero podemos calcular ninguna reacción, como una reacción relacionada con la infusión. el riesgo con base en 3 factores conocidos: Debido a que TYSABRI puede aumentar el riesgo de desarrollar LMP (consulta la página 24), puedes que pueden debilitar tu sistema inmunitario de prescripción TOUCH, mediante el cual nos aseguramos de que mantengas una estrecha Lapso de tiempo durante el que tomaste TYSABRI, especialmente comunicación con tu médico para controlar el riesgo durante más de 2 años a lo largo del tiempo. Una infusión puede realizarse en el consultorio del médico o en un centro de infusiones autorizado por TOUCH, lo que sea más conveniente para ti. Resultado positivo de la prueba de anticuerpos contra el VJC Utilización previa de ciertos medicamentos (llamados inmunosupresores) recibir TYSABRI solamente a través del Programa En los EE. UU. se han administrado más de 2 millones de infusiones de TYSABRI*. *A partir de junio de no se conoce ningún tratamiento, prevención ni cura para la LMP. Para obtener más información sobre esto, habla con tu médico o visita TYSABRI.com. Consulta la Información importante de seguridad acerca de TYSABRI en las páginas 13 a 15 y la versión completa de la Información de prescripción, incluidos el Cuadro de advertencia y la Guía de medicamentos para el paciente en las páginas 49 a
13 INFORMACIÓN IMPORTANTE DE SEGURIDAD ACERCA DE TYSABRI CADA 4 SEMANAS 300 mg i. v. (natalizumab) El riesgo de presentar LMP es un virus frecuente que puede INDICACIÓN TYSABRI (natalizumab) es un medicamento de venta con receta que se utiliza para tratar a personas adultas con formas recurrentes de esclerosis múltiple (EM), para retardar el empeoramiento de los síntomas frecuentes en personas con EM y disminuir la cantidad de exacerbaciones (recidivas). TYSABRI aumenta el riesgo de leucoencefalopatía multifocal progresiva (LMP). Cuando se inicia y continua el tratamiento con TYSABRI, es importante hablar con el médico para saber si el beneficio esperado de TYSABRI es suficiente como para compensar este riesgo. INFORMACIÓN IMPORTANTE DE SEGURIDAD TYSABRI aumenta el riesgo de desarrollar una infección cerebral rara, llamada leucoencefalopatía multifocal progresiva (LMP), que generalmente provoca la muerte o una discapacidad grave. No se conoce ningún tratamiento, prevención ni cura para la LMP. No deberás usar determinados medicamentos que debilitan el sistema inmunitario mientras recibas TYSABRI. Incluso si tomas sólo recibes TYSABRI para tratar la EM, igualmente puedes presentar LMP. mayor en estos casos: Si has recibido TYSABRI durante un tiempo prolongado, especialmente durante más de 2 años. Si has recibido determinados medicamentos que pueden debilitar el sistema inmunitario antes de comenzar a recibir TYSABRI. Si has experimentado una infección por el virus John Cunningham (VJC). Antes de recibir TYSABRI, o mientras lo recibes, es posible que el médico te haga un análisis de sangre para verificar si tienes una infección por VJC. El VJC es provocar LMP en personas con sistemas inmunitarios debilitados, como las personas que reciben TYSABRI. El riesgo de contraer LMP es mayor si tienes los 3 factores mencionados anteriormente. Es posible que existan otros factores de riesgo que todavía no se han identificado. Los pacientes que tienen un resultado negativo de anticuerpos contra el VJC aún corren el riesgo de desarrollar LMP debido al potencial de una nueva infección por el VJC o un resultado falso negativo de la prueba. Por lo 24 25
14 INFORMACIÓN IMPORTANTE DE SEGURIDAD ACERCA DE TYSABRI (CONTINUACIÓN) CADA 4 SEMANAS 300 mg i. v. (natalizumab) trasplante de órganos, u otras TYSABRI puede ocasionar tanto, los pacientes con un resultado de análisis negativo deberán repetirse el análisis periódicamente. Debido al riesgo de presentar LMP mientras recibes TYSABRI, este fármaco sólo se encuentra disponible a través afecciones, o si empeora algún problema médico o aparece alguno nuevo que haya durado varios días. efectos secundarios graves. Llama de inmediato a tu médico si experimentas alguno de los siguientes síntomas: Mientras recibes TYSABRI y durante los 6 meses posteriores a dejar de recibir TYSABRI, de un programa de distribución restringida llamado Programa de prescripción TOUCH. Si estás embarazada o planeas quedar embarazada, o si estás amamantando o planeas Infección del cerebro o del revestimiento cerebral o la médula espinal (encefalitis es importante que llames a tu Si presentas LMP o si eres amamantar. Se desconoce si o meningitis) ocasionada por médico de inmediato si algún alérgico a TYSABRI o a alguno de TYSABRI puede dañar al bebé el virus del herpes que puede problema médico empeora o si sus componentes, no deberás en gestación o si la cantidad provocar la muerte. Los síntomas aparece alguno nuevo (como recibir TYSABRI. de TYSABRI que pase a la leche incluyen fiebre repentina, dolor 26 problemas en tu capacidad de razonamiento, visión, equilibrio o fuerza; debilidad en un lado del cuerpo y al mover brazos o piernas) que haya durado varios días. Informa a todos los médicos que estás recibiendo tratamiento con TYSABRI. Antes de recibir TYSABRI, es importante que le informes lo siguiente a tu médico: Si tienes una afección médica que pueda debilitar tu sistema inmunitario, como infección por VIH o SIDA, leucemia o linfoma, materna puede dañar a tu bebé. Acerca de todos los medicamentos y suplementos que tomas, en especial los medicamentos que pueden debilitar tu sistema inmunitario. Si no estás seguro, consulta a tu médico. de cabeza intenso o confusión. Daño hepático. Los síntomas de daño hepático incluyen coloración amarillenta de la piel y los ojos (ictericia), oscurecimiento anormal de la orina, náuseas, sensación de cansancio o debilidad, o vómitos. 27
15 INFORMACIÓN IMPORTANTE DE SEGURIDAD ACERCA DE TYSABRI (CONTINUACIÓN) CADA 4 SEMANAS 300 mg i. v. (natalizumab) Reacciones alérgicas (por ejemplo, urticaria, comezón, problemas para respirar, dolor de pecho, mareos, sibilancias, escalofríos, erupción cutánea, náuseas, enrojecimiento de la piel, presión arterial baja), incluidas reacciones alérgicas graves (por ejemplo, anafilaxia). Las reacciones alérgicas graves habitualmente ocurren dentro de las 2 horas del inicio de la infusión, pero pueden ocurrir en cualquier momento después de recibir TYSABRI. Sistema inmunitario debilitado. TYSABRI puede aumentar el riesgo de desarrollar una infección inusual o grave. Los efectos secundarios más frecuentes de TYSABRI son los siguientes: Dolor de cabeza, infección urinaria, infección pulmonar, dolor en brazos y piernas, vaginitis, dolor en la zona del estómago, sensación de cansancio, dolor articular, depresión, diarrea, erupción cutánea y náuseas. Si experimentas cualquier efecto secundario que te cause molestias o que no desaparezca, llama a tu médico. Estos son sólo algunos posibles efectos secundarios de TYSABRI. Para obtener más información, consulta a tu médico. Para informar un efecto secundario a la Administración de Medicamentos y Alimentos (Food and Drug Administration, FDA), llama al FDA Para obtener Información importante de seguridad adicional, consulta la versión completa de la Información de prescripción, incluidos el Cuadro de advertencia y la Guía de medicamentos para el paciente en las páginas 49 a
16 Es esta tu inyección? PLEGRIDY es el PRIMER y ÚNICO interferón beta para la esclerosis múltiple recurrente con 1 inyección cada 2 semanas INFORMACIÓN IMPORTANTE DE SEGURIDAD SELECCIONADA No utilices PLEGRIDY si eres alérgico al interferón beta o al peginterferón beta-1a o a cualquiera de los otros componentes de PLEGRIDY. 30 Consulta la información de dosis adicional sobre valoración, instrucciones de administración y premedicación para los síntomas similares a los de la gripe en la página 18. Consulta la Información importante de seguridad acerca de PLEGRIDY en las páginas 19 a 21, y la versión completa de la Información de prescripción y la Guía de medicamentos en las páginas 84 a 102. No es un paciente real. 31
17 PLEGRIDY: EL PRIMER Y ÚNICO INTERFERÓN BETA PARA LA EM RECURRENTE QUE SE TOMA UNA VEZ CADA 2 SEMANAS Si consideras que PLEGRIDY, el interferón beta que tomas una vez cada 2 semanas, es adecuado para ti, habla con tu médico o visita PLEGRIDY.com CADA 2 SEMANAS INYECCIÓN SUBCUTÁNEA DE 125 microgramos INFORMACIÓN IMPORTANTE DE SEGURIDAD SELECCIONADA Conoce la diferencia de PLEGRIDY PLEGRIDY (peginterferón beta-1a) es un interferón pegilado para la EM recurrente. La pegilación es un proceso que permite que la molécula permanezca más tiempo en el cuerpo. MENOS de recidivas PLEGRIDY puede provocar efectos secundarios graves, que incluyen problemas hepáticos o empeoramiento de problemas hepáticos, incluidas la insuficiencia para obtener asesoramiento médico antes de iniciar el tratamiento con PLEGRIDY y si experimentas cualquiera de estos efectos secundarios. 32 Se ha comprobado que PLEGRIDY * trata la EM recurrente de 3 maneras importantes: Reduce las recidivas Retrasa la progresión de la discapacidad física Reduce las lesiones cerebrales detectadas mediante una IRM * En un estudio de 1 año de duración con 512 personas que tomaron PLEGRIDY y 500 personas que tomaron placebo. Indicación PLEGRIDY (peginterferón beta-1a) es un medicamento de venta con receta que se utiliza para tratar a personas con formas recurrentes de esclerosis múltiple (EM). TASA DE RECIDIVAS MÁS BAJA 0.26 recidivas con PLEGRIDY, en comparación con 0.40 recidivas con placebo. REDUCCIÓN DEL EN EL RIESGO DE RECIDIVAS MENOR RIESGO DE RECIDIVAS 19% con PLEGRIDY, en comparación con 29% con placebo. hepática y la muerte; depresión o pensamientos suicidas; reacciones alérgicas graves; reacciones en el lugar de la inyección; problemas cardíacos, incluida insuficiencia cardíaca congestiva; enfermedades autoinmunitarias; problemas sanguíneos y alteraciones en los análisis de sangre y convulsiones. Es importante conocer todos los efectos secundarios posibles. Deberás llamar a tu médico Consulta la página 35 para obtener información de dosis adicional sobre valoración, instrucciones de administración y premedicación para síntomas similares a los de la gripe. Consulta la Información importante de seguridad acerca de PLEGRIDY en las páginas 19 a 21, y la versión completa de la Información de prescripción y la Guía de medicamentos en las páginas 84 a
18 CADA 2 SEMANAS PLEGRIDY PEN ESTÁ CUIDADOSAMENTE DISEÑADA Y NO TIENE COMPARACIÓN Qué debes saber sobre el tratamiento con PLEGRIDY: INYECCIÓN SUBCUTÁNEA DE 125 microgramos El PLEGRIDY Pen tiene un autoinyector listo para usar. El PLEGRIDY Pen viene completamente ensamblada, por ello no necesitas colocar una aguja, ver una aguja, hacer clic en botón alguno ni pulsar un émbolo. Solo tienes que posicionar y presionar el PLEGRIDY Pen para inyectar el medicamento debajo de la piel una vez cada 2 semanas. PLEGRIDY también viene en una jeringa precargada. Tu médico y tú pueden decidir cuál opción es la adecuada para ti. AVISOS SONOROS Los clics audibles dejarán de sonar cuando se completa la dosis. ÉMBOLO Cambia a color amarillo cuando se completa la dosis. CONSEJO PARA AUTOINYECCIÓN Inyecta PLEGRIDY sin pulsar un botón. Solicita a tu proveedor de atención médica que te capacite en el uso adecuado de PLEGRIDY. Comienza con el paquete de inicio de PLEGRIDY para aumentar gradualmente a una dosis completa de PLEGRIDY. Esto puede ayudar a acostumbrarte a los efectos de PLEGRIDY. Habla con tu médico para familiarizarte con las instrucciones de administración, como la premedicación para el manejo de posibles síntomas similares a los de la gripe. PLEGRIDY se administra con una inyección aplicada debajo de la piel (inyección subcutánea) del estómago, la parte posterior del brazo o en el muslo una vez cada 14 días. Lee la Guía de medicamentos Cambia el lugar de aplicación de PLEGRIDY y las Instrucciones de uso antes de cada dosis de PLEGRIDY. que elijes con cada inyección para ayudar a disminuir la probabilidad de presentar una reacción en el lugar de 34 AVISOS VISUALES Las rayas se convierten en marcas de comprobación cuando se completa la dosis. AGARRE CÓMODO Se adapta a manos de todos los tamaños. PROTECTOR DE LA AGUJA Esconde la aguja antes, durante y después de la inyección. la inyección. Consulta la Información importante de seguridad acerca de PLEGRIDY en las páginas 19 a 21, y la versión completa de la Información de prescripción y la Guía de medicamentos en las páginas 84 a
19 CADA 2 SEMANAS INFORMACIÓN IMPORTANTE DE SEGURIDAD ACERCA DE PLEGRIDY INYECCIÓN SUBCUTÁNEA DE 125 microgramos INDICACIÓN PLEGRIDY (peginterferón beta-1a) es un medicamento de venta con receta que se utiliza para tratar a personas con formas recurrentes de esclerosis múltiple (EM). INFORMACIÓN IMPORTANTE DE SEGURIDAD Antes de comenzar el tratamiento, deberás analizar con tu proveedor de atención médica los posibles beneficios y riesgos relacionados con PLEGRIDY. PLEGRIDY puede ocasionar efectos secundarios graves. Llama de inmediato a tu proveedor de atención médica si presentas alguno de los síntomas que se mencionan a continuación. Problemas hepáticos o empeoramiento de problemas hepáticos, incluidas insuficiencia hepática y muerte. Los síntomas pueden incluir coloración amarillenta de la piel o de la parte blanca de los ojos, náuseas, pérdida del apetito, cansancio, sangrado con más facilidad de lo normal, confusión, somnolencia, orina de color oscuro y heces pálidas. Durante el tratamiento con PLEGRIDY, tendrás que visitar a tu proveedor de atención médica con frecuencia. Se realizarán análisis de sangre con frecuencia para detectar estos posibles efectos secundarios. Depresión o pensamientos suicidas. Los síntomas pueden incluir depresión nueva o que empeora (sentirte desesperanzado o mal contigo mismo), pensamientos de hacerte daño a ti mismo o suicidarte, irritabilidad (enojarte con facilidad), nerviosismo, o ansiedad nueva o que empeora. No utilices PLEGRIDY si eres alérgico al interferón beta o al peginterferón beta-1a o a cualquiera de los otros componentes en PLEGRIDY. Antes de tomar PLEGRIDY, informa a tu proveedor de atención médica lo siguiente: Si estás siendo tratado por una enfermedad mental, o recibiste tratamiento anteriormente por alguna enfermedad mental, incluidas depresión y conducta suicida. Si tienes o tuviste problemas hepáticos, disminución en los recuentos de glóbulos sanguíneos, problemas de sangrado, problemas cardíacos, convulsiones (epilepsia), problemas de tiroides o cualquier tipo de enfermedad autoinmunitaria
20 CADA 2 SEMANAS INFORMACIÓN IMPORTANTE DE SEGURIDAD ACERCA DE PLEGRIDY (CONTINUACIÓN) INYECCIÓN SUBCUTÁNEA DE 125 microgramos 38 Si tomas medicamentos de venta con receta y de venta libre, vitaminas o suplementos a base de hierbas. Si estás embarazada o planeas quedar embarazada. Se desconoce si PLEGRIDY dañará a tu bebé en gestación. Infórmale a tu proveedor de atención médica si quedas embarazada durante tu tratamiento con PLEGRIDY. Si estás amamantando o planeas amamantar. Se desconoce si PLEGRIDY se secreta en la leche materna. Habla con tu proveedor de atención médica sobre la mejor manera de alimentar a tu bebé mientras recibes PLEGRIDY. PLEGRIDY puede ocasionar efectos secundarios graves adicionales que incluyen lo siguiente: Reacciones alérgicas graves. Las reacciones alérgicas graves pueden producirse rápidamente. Los síntomas pueden incluir comezón, hinchazón de la cara, los ojos, los labios, la lengua o la garganta, dificultad para respirar, sensación de desmayo, ansiedad, sarpullido en la piel, urticaria o protuberancias en la piel. Reacciones en el lugar de la inyección. PLEGRIDY con frecuencia puede ocasionar enrojecimiento, dolor o hinchazón en el lugar donde se aplicó la inyección. Si el lugar de la inyección se hincha o te duele, o si el área parece infectada y no se cura en pocos días, llama a tu proveedor de atención médica de inmediato. Es posible que tengas una infección de la piel o un área con daño grave a la piel (necrosis) que necesite tratamiento proporcionado por un proveedor de atención médica. Problemas cardíacos, incluida insuficiencia cardíaca congestiva. Si bien se desconoce si PLEGRIDY tiene efectos directos en el corazón, algunas personas que no tenían antecedentes de problemas cardíacos desarrollaron problemas en el músculo cardíaco o insuficiencia cardíaca congestiva luego de recibir interferón beta. Si ya tienes insuficiencia cardíaca, PLEGRIDY puede hacer que esta empeore. Llama a tu proveedor de atención médica de inmediato si presentas síntomas de empeoramiento de la insuficiencia cardíaca, como falta de aliento o hinchazón de la parte inferior de las piernas, mientras utilizas PLEGRIDY. 39
21 CADA 2 SEMANAS INFORMACIÓN IMPORTANTE DE SEGURIDAD ACERCA DE PLEGRIDY (CONTINUACIÓN) INYECCIÓN SUBCUTÁNEA DE 125 microgramos 40 Algunas personas que usan PLEGRIDY podrían sufrir otros problemas cardíacos que incluyen presión arterial baja, latidos cardíacos acelerados o anormales, dolor en el pecho, ataques cardíacos o un problema del músculo cardíaco (cardiomiopatía). Enfermedades autoinmunes. Algunas personas han tenido problemas de fácil sangrado o aparición de hematomas (trombocitopenia idiopática), problemas en la glándula tiroides (hipertiroidismo e hipotiroidismo) y hepatitis autoinmunitaria con el uso de interferón beta. Problemas con la sangre y cambios en los análisis de sangre. PLEGRIDY puede disminuir los glóbulos blancos o las plaquetas, lo que puede ocasionar un mayor riesgo de infección, sangrado o anemia, y puede ocasionar cambios en las pruebas de la función hepática. Tu proveedor de atención médica deberá realizarte análisis de sangre durante el tratamiento con PLEGRIDY para controlar los efectos secundarios. Convulsiones. Algunas personas han sufrido convulsiones mientras utilizaban PLEGRIDY, incluidas las personas que nunca antes las habían experimentado. Estos son algunos de los efectos secundarios más frecuentes de PLEGRIDY: Síntomas similares a los de la gripe. Muchas personas que utilizan PLEGRIDY tienen síntomas similares a los de la gripe al principio de la terapia. Estos síntomas no indican realmente una gripe. No puedes contagiarla a otra persona. Los síntomas pueden incluir dolor de cabeza, dolor muscular y de las articulaciones, fiebre, escalofríos o cansancio. Es posible que puedas controlar estos síntomas similares a los de la gripe si tomas antipiréticos y analgésicos de venta libre y bebes abundante agua. Para muchas personas, estos síntomas se reducen o desaparecen con el tiempo. Si necesitas asesoramiento médico sobre los efectos secundarios, llama a tu médico. Puedes informar los efectos secundarios a la Administración de Medicamentos y Alimentos de los EE. UU. (US Food and Drug Administration, FDA) llamando al FDA Para obtener Información importante de seguridad adicional, consulta la versión completa de la Información de prescripción y la Guía de medicamentos. Esta información no tiene el fin de reemplazar las consultas con tu proveedor de atención médica. 41
22 AVONEX Tratamiento para personas con EM recurrente durante aproximadamente 2 décadas INFORMACIÓN IMPORTANTE DE SEGURIDAD SELECCIONADA No utilices AVONEX si eres alérgico al interferón beta, la albúmina (humana) o a cualquiera de los componentes de AVONEX. Consulta la Información importante de seguridad acerca de AVONEX en las páginas 24 a 27, y la versión completa de la Información de prescripción y la Guía de medicamentos en las páginas 103 a
23 AVONEX (INTERFERÓN BETA-1A): UNA OPCIÓN DE TRATAMIENTO ESTABLECIDA PARA LA EM RECURRENTE UNA VEZ A LA SEMANA INYECCIÓN INTRAMUSCULAR de 30 MCG 44 AVONEX se ha recetado a más de 400,000 personas desde 1996 AVONEX es un tratamiento inyectable que se administra una vez por semana para la EM recurrente y que ha estado disponible desde su aprobación en También ha sido aprobado para funcionar incluso si has sufrido una exacerbación*. *AVONEX está aprobado para personas con EM recurrente, incluidas aquellas que han experimentado su primera exacerbación y que tienen lesiones que concuerdan con la EM en sus IRM, según un estudio de personas que habían experimentado un primer ataque y tenían lesiones que coincidían con la EM en sus IRM. AVONEX retrasa la progresión de la discapacidad física, disminuye la cantidad de recidivas y reduce las lesiones cerebrales detectadas mediante una IRM. INDICACIÓN AVONEX (interferón beta-1a) está aprobado por la FDA para tratar las formas recurrentes de la esclerosis múltiple (EM) con el objetivo de disminuir la cantidad de exacerbaciones y retardar la aparición de algunas de las discapacidades físicas que son frecuentes en las personas con EM. AVONEX está aprobado para el uso en personas que experimentaron un primer ataque y que tienen lesiones que concuerdan con la EM en sus IRM. Consulta la Información importante de seguridad completa de la Información de prescripción y la Guía de medicamentos en las páginas 103 a 128. INFORMACIÓN IMPORTANTE DE SEGURIDAD SELECCIONADA AVONEX puede ocasionar efectos secundarios graves, que incluyen problemas de salud conductual (incluídas depresión, pensamientos suicidas o alucinaciones), problemas hepáticos (incluidas insuficiencia hepática y muerte), reacciones alérgicas graves y reacciones cutáneas, problemas cardíacos (incluida insuficiencia cardíaca), problemas sanguíneos, convulsiones, infecciones y problemas de tiroides. 45
24 UNA VEZ A LA SEMANA INYECCIÓN INTRAMUSCULAR de 30 MCG INFORMACIÓN IMPORTANTE DE SEGURIDAD ACERCA DE AVONEX 46 AVONEX Un clic. Una vez por semana. El AVONEX PEN es un autoinyector precargado de dosis única que te permite tratar la EM recurrente con un solo clic. Gracias a su aguja cubierta con una longitud que es la mitad de la longitud de la aguja estándar de la jeringa precargada de AVONEX, brinda una forma más sencilla de administrar AVONEX una vez por semana. De una encuesta realizada a 74 personas para descubrir si las personas que habían usado la jeringa precargada de AVONEX durante un mínimo de 3 meses eran capaces de usar satisfactoriamente el AVONEX PEN. Las personas recibieron AVONEX utilizando la jeringa precargada la primera semana y luego cambiaron al AVONEX PEN durante las siguientes 3 semanas. Los resultados se basaron en cuestionarios realizados a pacientes y médicos. En el último día de la encuesta, las personas calificaron al AVONEX PEN como mejor que la jeringa precargada de AVONEX en cuanto a facilidad de inyección y practicidad en el agarre. Si consideras que AVONEX es adecuado para ti, habla con tu médico o visita AVONEX.com. INDICACIÓN AVONEX (interferón beta-1a) está aprobado por la FDA para tratar las formas recurrentes de la esclerosis múltiple (EM) con el objetivo de disminuir la cantidad de exacerbaciones y retardar la aparición de algunas de las discapacidades físicas que son frecuentes en las personas con EM. AVONEX está aprobado para el uso en personas que experimentaron un primer ataque y que tienen lesiones que concuerdan con la EM en sus IRM. INFORMACIÓN IMPORTANTE DE SEGURIDAD Antes de comenzar el tratamiento, de los síntomas que figuran deberás analizar con tu proveedor a continuación mientras de atención médica los posibles utlizas AVONEX. beneficios y riesgos relacionados Problemas de salud conductual con AVONEX. que incluyen depresión, AVONEX puede ocasionar efectos pensamientos suicidas secundarios graves. Informa de o alucinaciones. Algunas inmediato a tu proveedor de personas que toman AVONEX atención médica si presentas alguno podrían desarrollar problemas 47
25 INFORMACIÓN IMPORTANTE DE SEGURIDAD ACERCA DE AVONEX (CONTINUACIÓN) UNA VEZ A LA SEMANA INYECCIÓN INTRAMUSCULAR de 30 MCG respirar, ansiedad, sensación y efectivo en los niños. 48 de conducta o del estado de ánimo que incluyen irritabilidad (enojarte con facilidad), depresión (sentirte desesperanzado o mal contigo mismo), nerviosismo, ansiedad, conducta agresiva, pensamientos de hacerte daño a ti mismo o suicidarte, y escuchar o ver cosas que los demás no escuchan o ven (alucinaciones). Problemas hepáticos o empeoramiento de problemas hepáticos, incluidas insuficiencia hepática y muerte. Los síntomas pueden incluir náuseas, pérdida del apetito, cansancio, orina de color oscuro y heces pálidas, coloración amarillenta de la piel o de la parte blanca de los ojos, sangrado con más facilidad de lo normal, confusión y somnolencia. Durante el tratamiento con AVONEX, tendrás que visitar a tu proveedor de atención médica con regularidad y realizarte análisis de sangre habitualmente para detectar si hay efectos secundarios. Reacciones alérgicas graves y reacciones cutáneas. Los síntomas pueden incluir comezón, hinchazón de la cara, los ojos, los labios, la lengua o la garganta, dificultad para de desmayo, sarpullido en la piel, urticaria, llagas en la boca, o ampollas en la piel y descamación. AVONEX no curará la EM pero podría disminuir la cantidad de exacerbaciones de la enfermedad y retardar la aparición de algunas de las discapacidades físicas que son frecuentes en las personas con EM. La EM es una enfermedad de por vida que afecta el sistema nervioso al destruir el recubrimiento protector (mielina) que rodea las fibras nerviosas. Se desconoce la forma en que AVONEX actúa en la EM. Se desconoce si AVONEX es seguro No utilices AVONEX si eres alérgico al interferón beta, la albúmina (humana) o a cualquiera de los componentes de AVONEX. Antes de tomar AVONEX, informa a tu proveedor de atención médica lo siguiente: Si estás siendo tratado por una enfermedad mental, o recibiste tratamiento anteriormente por alguna enfermedad mental, incluidas depresión y conducta suicida. Si tienes o tuviste problemas de sangrado o coágulos de sangre, tienes o tuviste recuentos disminuidos de 49
26 INFORMACIÓN IMPORTANTE DE SEGURIDAD ACERCA DE AVONEX (CONTINUACIÓN) AVONEX puede ocasionar efectos UNA VEZ A LA SEMANA INYECCIÓN INTRAMUSCULAR de 30 MCG pies durante la administración secundarios graves, que incluyen de AVONEX. 50 glóbulos sanguíneos, tienes o tuviste problemas hepáticos, tienes o tuviste convulsiones (epilepsia), tienes o tuviste problemas cardíacos, tiene o tuvo problemas de tiroides, tienes o tuviste algún tipo de enfermedad autoinmunitaria (en la que el sistema inmunitario del cuerpo ataque las propias células del cuerpo), como psoriasis, lupus eritematoso sistémico o artritis reumatoide. Si bebes alcohol. Si estás embarazada o planeas quedar embarazada. Se desconoce si AVONEX dañará a un bebé en gestación. Infórmale a tu proveedor de atención médica si quedas embarazada durante el tratamiento con AVONEX. Si estás amamantando o planeas amamantar. Se desconoce si AVONEX pasa a la leche materna. Tú y tu proveedor de atención médica deberán decidir si recibirás AVONEX o amamantarás. No deberás hacer ambas cosas. Informa a tu proveedor de atención médica sobre todos los medicamentos que tomas, incluidos medicamentos de venta con receta y de venta libre, vitaminas y suplementos a base de hierbas. los siguientes: Problemas cardíacos, incluida insuficiencia cardíaca. Aunque se desconoce si AVONEX tiene algún efecto directo en el corazón, algunos pacientes que no tenían antecedentes de problemas cardíacos desarrollaron problemas en el músculo cardíaco o insuficiencia cardíaca congestiva después de recibir AVONEX. Si ya tienes insuficiencia cardíaca, AVONEX podría empeorarla. Llama de inmediato a tu proveedor de atención médica si los síntomas de insuficiencia cardíaca empeoran, como dificultad para respirar o hinchazón de la parte inferior de las piernas o de los Algunas personas que usan AVONEX podrían sufrir otros problemas cardíacos que incluyen presión arterial baja, latidos del corazón acelerados o anormales, dolor en el pecho y ataques cardíacos o un problema del músculo cardíaco (cardiomiopatía). Problemas sanguíneos. AVONEX puede afectar la médula ósea y ocasionar una disminución en el recuento de glóbulos blancos y rojos, y en el recuento plaquetario. En algunas personas, estos recuentos de glóbulos podrían disminuir a niveles peligrosamente bajos. Si tu recuento de glóbulos 51
27 INFORMACIÓN IMPORTANTE DE SEGURIDAD ACERCA DE AVONEX (CONTINUACIÓN) UNA VEZ A LA SEMANA INYECCIÓN INTRAMUSCULAR de 30 MCG disminuye mucho, puedes Problemas de tiroides. Algunas Los efectos secundarios más incluir dolor muscular, fiebre, contraer infecciones y problemas personas que utilizan AVONEX frecuentes de AVONEX incluyen cansancio y escalofríos. de sangrado y formación de hematomas. Convulsiones. Algunos pacientes han tenido convulsiones mientras utilizaban AVONEX, incluidos pacientes que nunca habían tenido convulsiones. desarrollan cambios en la función tiroidea. Los síntomas de cambios en la tiroides incluyen problemas para concentrarse, sensación de frío o calor todo el tiempo y cambios en el peso y en la piel. Infórmale de inmediato a tu proveedor los siguientes: Síntomas similares a los de la gripe. La mayoría de las personas que utilizan AVONEX presenta síntomas similares a los de la gripe al principio de la terapia. Por lo general, estos Si necesitas asesoramiento médico sobre los efectos secundarios, llama a tu médico. Puede informar los efectos secundarios a la Administración de Medicamentos y Alimentos de los EE. UU. (US Food and Drug Administration, FDA), Infecciones. Algunas personas que utilizan AVONEX pueden contraer una infección. Los síntomas de una infección pueden incluir fiebre, escalofríos, dolor o ardor al orinar, micción frecuente, diarrea con sangre y tos con flema. de atención médica si presentas alguno de los síntomas que se mencionan arriba. síntomas duran un día después de la inyección. Es posible que puedas controlar estos síntomas similares a los de la gripe si tomas antipiréticos y analgésicos de venta libre. Para muchas personas, estos síntomas se reducen o desaparecen con el tiempo. Los síntomas pueden llamando al FDA Para obtener Información importante de seguridad adicional, consulta la versión completa de la Información de prescripción y la Guía de medicamentos. Esta información no tiene el fin de reemplazar las consultas con tu proveedor de atención médica
28 Presentado por Biogen El programa Above MS TM de Biogen ofrece consejos, herramientas, información y mucho más. Inscríbete hoy: Llama al Completa la tarjeta que se encuentra al dorso de este folleto. 54 Para obtener información importante de seguridad sobre los productos de Biogen mencionados en este folleto, consulta las páginas 8 a 9, 13 a 15, 19 a 21, 24 a 27, y la versión completa de la Información de prescripción, incluidos el cuadro de advertencia y la guía de medicamentos para TYSABRI, las guías de medicamentos para PLEGRIDY y AVONEX, y la Información para el paciente acerca de TECFIDERA en las páginas 30 a 128. Habla con tu proveedor de atención médica si tienes alguna pregunta o necesitas apoyo adicional.
29 2016 Biogen. Todos los derechos reservados. 10/16 FCH-US Binney Street, Cambridge, MA
30 PUNTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN Estos puntos destacados no incluyen toda la información necesaria para utilizar TECFIDERA de forma segura y eficaz. Consulte la información de prescripción completa de TECFIDERA. TECFIDERA (dimetil fumarato), cápsulas de liberación retardada, para uso oral Aprobación inicial en Estados Unidos: 2013 PRINCIPALES CAMBIOS RECIENTES Advertencias y precauciones, LMP (5.2) 2/2016 INDICACIONES Y USO TECFIDERA está indicado para el tratamiento de pacientes con formas recurrentes de esclerosis múltiple (1) POSOLOGÍA Y ADMINISTRACIÓN Dosis inicial: 120 mg dos veces al día, por vía oral, durante 7 días (2.1) Dosis de mantenimiento después de 7 días: 240 mg dos veces al día, por vía oral (2.1) Trague las cápsulas de TECFIDERA enteras e intactas. No triture, mastique ni espolvoree el contenido de las cápsulas sobre los alimentos (2.1) Tome TECFIDERA con o sin alimentos (2.1) FORMAS FARMACÉUTICAS Y CONCENTRACIONES Cápsulas de liberación retardada: 120 mg y 240 mg (3) CONTRAINDICACIONES Hipersensibilidad conocida al dimetil fumarato o a cualquiera de los excipientes de TECFIDERA. (4) ADVERTENCIAS Y PRECAUCIONES Anafilaxia y angioedema: interrumpir permanentemente y no reiniciar la administración de TECFIDERA si estos se producen. (5.1) Leucoencefalopatía multifocal progresiva (LMP): suspender temporalmente TECFIDERA a la primera manifestación clínica indicativa de LMP. (5.2) Linfopenia: hacer un hemograma completo (HgC), incluido un recuento linfocitario, antes de iniciar la administración de TECFIDERA, después de 6 meses y cada 6 a 12 meses a partir de entonces. Considerar la interrupción temporal de TECFIDERA si los recuentos linfocitarios < /l persisten durante más de seis meses. (5.3) REACCIONES ADVERSAS Las reacciones adversas más frecuentes (incidencia 10% y 2% con el placebo) fueron crisis vasomotora (sofoco), dolor abdominal, diarrea y náuseas. (6.1) Para informar PRESUNTAS REACCIONES ADVERSAS, comuníquese con Biogen al o con la Administración de Medicamentos y Alimentos (Food and Drug Administration, FDA) al FDA-1088 o visite el sitio web USO EN POBLACIONES ESPECÍFICAS Embarazo: según información obtenida de estudios sobre animales, puede causar daño fetal. (8.1) Consulte la sección 17 para conocer la INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y la ficha técnica con información para el paciente aprobada por la FDA Revisado: 2/2016 INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: ÍNDICE* 1 INDICACIONES Y USO 2 POSOLOGÍA Y ADMINISTRACIÓN 2.1 Información sobre la administración de dosis 2.2 Análisis de sangre previo al inicio de la terapia 3 FORMAS FARMACÉUTICAS Y CONCENTRACIONES 4 CONTRAINDICACIONES 5 ADVERTENCIAS Y PRECAUCIONES 5.1 Anafilaxia y angioedema 5.2 Leucoencefalopatía multifocal progresiva 5.3 Linfopenia 5.4 Crisis vasomotora (sofocos) 6 REACCIONES ADVERSAS 6.1 Experiencia en ensayos clínicos 8 USO EN POBLACIONES ESPECÍFICAS 8.1 Embarazo 8.3 Madres lactantes 8.4 Uso pediátrico 8.5 Uso geriátrico 11 DESCRIPCIÓN 12 FARMACOLOGÍA CLÍNICA 12.1 Mecanismo de acción 12.2 Farmacodinámica 12.3 Farmacocinética 13 TOXICOLOGÍA NO CLÍNICA 13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad 13.2 Toxicología o farmacología en animales 14 ESTUDIOS CLÍNICOS 16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN 17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE *No se indican las secciones ni subsecciones omitidas de la información de prescripción completa. 1
31 INFORMACIÓN DE PRESCRIPCIÓN COMPLETA 1 INDICACIONES Y USO TECFIDERA está indicado para el tratamiento de pacientes con formas recurrentes de esclerosis múltiple. 2 POSOLOGÍA Y ADMINISTRACIÓN 2.1 Información sobre la administración de dosis La dosis inicial de TECFIDERA es de 120 mg dos veces al día por vía oral. Después de 7 días, la dosis debe incrementarse a la dosis de mantenimiento de 240 mg dos veces al día por vía oral. Pueden considerarse reducciones temporales de la dosis a 120 mg dos veces al día en el caso de las personas que no toleren la dosis de mantenimiento. En un plazo de 4 semanas, se debe reanudar la dosis recomendada de 240 mg dos veces al día. Se debe considerar la interrupción de la administración de TECFIDERA en el caso de los pacientes que no puedan tolerar regresar a la dosis de mantenimiento. Se puede reducir la incidencia de la crisis vasomotora al administrar TECFIDERA con alimentos. De forma alternativa, la administración de aspirina sin recubrimiento entérico (hasta una dosis de 325 mg) 30 minutos antes de la administración de TECFIDERA puede reducir la incidencia o la gravedad de la crisis vasomotora [consulte Farmacología clínica (12.3)]. TECFIDERA debe tragarse entero e intacto. TECFIDERA no debe triturarse ni masticarse, y el contenido de las cápsulas no debe espolvorearse sobre los alimentos. TECFIDERA puede tomarse con o sin alimentos. 2.2 Análisis de sangre previo al inicio de la terapia Se debe hacer un hemograma completo (HgC), incluido un recuento linfocitario, antes del inicio de la terapia [consulte Advertencias y precauciones (5.3)]. 3 FORMAS FARMACÉUTICAS Y CONCENTRACIONES TECFIDERA se encuentra disponible como cápsulas de gelatina dura de liberación retardada, que contienen 120 mg o 240 mg de dimetil fumarato. Las cápsulas de 120 mg tienen una tapa verde y un cuerpo blanco, y llevan impreso BG mg en tinta negra en el cuerpo. Las cápsulas de 240 mg tienen una tapa verde y un cuerpo verde, y llevan impreso BG mg en tinta negra en el cuerpo.
32 4 CONTRAINDICACIONES TECFIDERA está contraindicado en pacientes con hipersensibilidad conocida al dimetil fumarato o a cualquiera de los excipientes de TECFIDERA. Las reacciones han incluido anafilaxia y angioedema [consulte Advertencias y precauciones (5.1)]. 5 ADVERTENCIAS Y PRECAUCIONES 5.1 Anafilaxia y angioedema TECFIDERA puede causar anafilaxia y angioedema después de la primera dosis o en cualquier momento durante el tratamiento. Las manifestaciones clínicas han incluido dificultad para respirar, urticaria e hinchazón de la garganta y la lengua. Se debe indicar a los pacientes que interrumpan permanentemente la administración de TECFIDERA y procuren atención médica inmediata si presentan manifestaciones clínicas de anafilaxia o angioedema. 5.2 Leucoencefalopatía multifocal progresiva Se ha producido Leucoencefalopatía multifocal progresiva (LMP) en pacientes con esclerosis múltiple (EM) tratados con TECFIDERA. La LMP es una infección viral oportunista del cerebro provocada por el virus de John Cunningham (VJC) que, por lo general, se produce solo en pacientes inmunocomprometidos y que habitualmente provoca la muerte o discapacidad grave. Se produjo un caso mortal de LMP en un paciente que recibió TECFIDERA durante 4 años mientras se encontraba inscrito en un ensayo clínico. Durante el ensayo clínico, el paciente presentó linfopenia prolongada (recuentos linfocitarios en su mayoría < /l durante 3.5 años) mientras tomaba TECFIDERA [consulte Advertencias y precauciones (5.3)]. El paciente no tenía otras afecciones sistémicas identificadas que provocaran un compromiso de la función del sistema inmunitario y no se lo había tratado previamente con natalizumab, que tiene una asociación conocida con la LMP. El paciente tampoco estaba recibiendo ningún medicamento inmunosupresor o inmunomodulador de forma concomitante. La LMP también tuvo lugar en el contexto posterior a la comercialización en presencia de linfopenia (<0.8 x 10 9 /l) con una persistencia de más de 6 meses. Si bien el papel de la linfopenia en estos casos es incierto, la mayoría de los casos tuvo lugar en pacientes con recuentos linfocitarios de <0.5 x 10 9 /l. A la primera manifestación clínica indicativa de LMP, se debe suspender temporalmente la administración de TECFIDERA y hacer una adecuada evaluación diagnóstica. Los hallazgos de las imágenes por resonancia magnética (IRM) pueden ser evidentes antes de la manifestación de síntomas o signos clínicos. Los síntomas típicos asociados a la LMP son diversos, evolucionan en el transcurso de días a semanas e incluyen debilidad progresiva en un lado del cuerpo o torpeza de las extremidades, alteración de la vista y cambios en el pensamiento, la memoria y la orientación que provocan confusión y cambios de personalidad.
33 5.3 Linfopenia TECFIDERA puede disminuir los recuentos linfocitarios. En los ensayos sobre la EM controlados con placebo, la media de los recuentos linfocitarios descendió en aproximadamente un 30% durante el primer año de tratamiento con TECFIDERA y luego se mantuvo estable. Cuatro semanas después de interrumpir la administración de TECFIDERA, la media de los recuentos linfocitarios se incrementó, pero no regresó al nivel inicial. El seis por ciento (6%) de los pacientes que recibió TECFIDERA y <1% de los pacientes que recibió placebo presentaron recuentos linfocitarios < /l (límite inferior del intervalo normal /l). La incidencia de infecciones (60% vs. 58%) e infecciones graves (2% vs. 2%) fue similar en los pacientes tratados con TECFIDERA o el placebo, respectivamente. No se observó una mayor incidencia de infecciones graves en los pacientes con recuentos linfocitarios < /l o < /l en los ensayos controlados, aunque un paciente en un estudio de extensión presentó LMP en el contexto de linfopenia prolongada (recuentos linfocitarios en su mayoría < /l durante 3.5 años) [consulte Advertencias y precauciones (5.2)]. En ensayos clínicos controlados y no controlados, 2% de pacientes experimentaron recuentos linfocitarios de < /l durante al menos seis meses, y en este grupo la mayoría de los recuentos linfocitarios se mantuvo en < /l con la continuación de la terapia. TECFIDERA no se ha estudiado en pacientes con recuentos linfocitarios bajos preexistentes. Haga un HgC, incluido un recuento linfocitario, antes de iniciar el tratamiento con TECFIDERA, 6 meses después de comenzar el tratamiento y cada 6 a 12 meses a partir de entonces, según se indique clínicamente. Considere la interrupción de TECFIDERA en pacientes con recuentos linfocitarios menores de /l que persisten durante más de seis meses. Dado el potencial de una recuperación demorada de los recuentos linfocitarios, siga obteniendo recuentos linfocitarios hasta la recuperación si se interrumpe permanentemente o temporalmente TECFIDERA debido a linfopenia. Considere suspender temporalmente el tratamiento en pacientes con infecciones graves hasta la resolución. La decisión de reiniciar o no la administración de TECFIDERA debe ser individualizada en función de las circunstancias clínicas. 5.4 Crisis vasomotora (sofocos) TECFIDERA puede causar crisis vasomotora (sofocos) (por ej., sensación de calor, enrojecimiento, comezón o sensación de escozor). En los ensayos clínicos, el 40% de los pacientes que recibieron tratamiento con TECFIDERA presentó crisis vasomotora. Los síntomas de crisis vasomotora por lo general comenzaron al poco tiempo de iniciar la administración de TECFIDERA y habitualmente mejoraron o se resolvieron con el tiempo. En la mayoría de los pacientes que presentaron crisis vasomotora, esta fue leves o moderada en intensidad. El tres por ciento (3%) de los pacientes interrumpió permanentemente la administración de TECFIDERA debido a crisis vasomotora y <1% tuvo síntomas graves de crisis vasomotora, que no fueron potencialmente mortales, pero que culminaron en la hospitalización de los pacientes. La administración de TECFIDERA con alimentos puede reducir la incidencia de crisis vasomotora. De forma alternativa, la administración de aspirina sin recubrimiento entérico (hasta una dosis de 325 mg) 30 minutos antes de la administración de TECFIDERA puede reducir la incidencia o la gravedad de la crisis vasomotora [consulte Posología y administración (2.1) y Farmacología clínica (12.3)].
34 6 REACCIONES ADVERSAS Las siguientes reacciones adversas importantes se describen en otro lugar de la ficha técnica: Anafilaxia y angioedema [consulte Advertencias y precauciones (5.1)]. Leucoencefalopatía multifocal progresiva [consulte Advertencias y precauciones (5.2)] Linfopenia [consulte Advertencias y precauciones (5.3)]. Crisis vasomotora (sofocos) [consulte Advertencias y precauciones (5.4)]. 6.1 Experiencia en ensayos clínicos Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variadas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas en los ensayos clínicos de otro fármaco y puede que no reflejen las tasas observadas en la práctica clínica. Las reacciones adversas más frecuentes (incidencia 10% y 2% más que con placebo) para TECFIDERA fueron crisis vasomotora (sofocos), dolor abdominal, diarrea y náuseas. Reacciones adversas en ensayos controlados con placebo En los dos estudios bien controlados que demostraron la efectividad, 1529 pacientes recibieron TECFIDERA con una exposición global de 2244 años-persona [consulte Estudios clínicos (14)]. Las reacciones adversas presentadas en la tabla a continuación se basan en la información de seguridad de 769 pacientes tratados con TECFIDERA 240 mg dos veces al día y 771 pacientes tratados con placebo. Tabla 1: Reacciones adversas en el estudio 1 y 2 informadas con respecto a TECFIDERA 240 mg dos veces al día con una incidencia 2% más alta que la del placebo TECFIDERA N = 769 % Placebo N = 771 % Crisis vasomotora 40 6 Dolor abdominal Diarrea Náuseas 12 9 Vómitos 9 5 Prurito 8 4 Sarpullido 8 3 Presencia de albúmina en la orina 6 4 Eritema 5 1 Dispepsia 5 3 Aumento de la 4 2 aspartato-aminotransferasa Linfopenia 2 <1
35 Eventos gastrointestinales TECFIDERA causó eventos GI (por ej., náuseas, vómitos, diarrea, dolor abdominal y dispepsia). La incidencia de los eventos GI fue más alta a comienzos del ciclo de tratamiento (principalmente en el mes 1) y habitualmente disminuyó con el tiempo en los pacientes tratados con TECFIDERA en comparación con placebo. El cuatro por ciento (4%) de los pacientes tratados con TECFIDERA y menos del 1% de los pacientes que recibieron el placebo interrumpieron permanentemente la administración debido a eventos gastrointestinales. La incidencia de los eventos GI graves fue del 1% en los pacientes tratados con TECFIDERA. Transaminasas hepáticas Se observó un aumento de la incidencia de elevaciones de las transaminasas hepáticas en pacientes tratados con TECFIDERA principalmente durante los primeros seis meses del tratamiento, y la mayoría de los pacientes con elevaciones tuvieron niveles <3 veces el límite superior de lo normal (upper limit of normal, ULN). Se produjeron aumentos de la alaninaaminotransferasa y aspartato-aminotransferasa a 3 veces el ULN en una pequeña cantidad de pacientes tratados con TECFIDERA y con el placebo, y estos estuvieron bien equilibrados entre los grupos. No hubo aumentos de las transaminasas 3 veces el ULN con aumentos concomitantes en la bilirrubina total >2 veces el ULN. Las interrupciones permanentes debidas a los aumentos de las transaminasas hepáticas fueron <1% y fueron similares en los pacientes tratados con TECFIDERA o con el placebo. Eosinofilia Se observó un incremento pasajero en la media de los recuentos de eosinófilos durante los primeros 2 meses de terapia. Reacciones adversas en estudios controlados con placebo y no controlados En estudios clínicos controlados con placebo y no controlados, un total de 2513 pacientes han recibido TECFIDERA y se les ha dado seguimiento durante períodos de hasta 4 años con una exposición global de 4603 años-persona. Aproximadamente 1162 pacientes han recibido más de 2 años de tratamiento con TECFIDERA. El perfil de reacciones adversas de TECFIDERA en los estudios clínicos no controlados fue congruente con la experiencia en los ensayos clínicos controlados con placebo. 8 USO EN POBLACIONES ESPECÍFICAS 8.1 Embarazo Categoría C para el embarazo No hay estudios adecuados ni bien controlados en embarazadas. En animales, se observaron efectos adversos en la supervivencia, el crecimiento, la maduración sexual y la función neuroconductual de las crías, cuando el dimetil fumarato (DMF) se administró durante la preñez y la lactancia en dosis clínicamente relevantes. TECFIDERA debe utilizarse durante el embarazo únicamente si el posible beneficio justifica el posible riesgo para el feto.
36 En ratas a las que se administró DMF por vía oral (25, 100, 250 mg/kg/día) durante la organogénesis, se observó toxicidad embriofetal (peso fetal reducido y retraso en la osificación) con la dosis más alta evaluada. Esta dosis también produjo evidencia de toxicidad materna (peso reducido). La exposición plasmática (área bajo la curva [area under the curve, AUC]) para el monometil fumarato (MMF), el principal metabolito circulante, con la dosis sin efectos es de aproximadamente el triple de la de los seres humanos con la dosis recomendada para seres humanos (recommended human dose, RHD) de 480 mg/día. En conejas a las que se administró DMF por vía oral (25, 75 y 150 mg/kg/día) durante la organogénesis, se observaron mortalidad embrionaria y peso materno reducido con la dosis más alta evaluada. El AUC plasmática para el MMF con la dosis sin efectos es de aproximadamente 5 veces la de los seres humanos con la RHD. La administración oral de DMF (25, 100 y 250 mg/kg/día) a ratas durante la organogénesis y la lactancia provocó un aumento de la mortalidad, reducciones persistentes del peso, retraso en la maduración sexual (crías macho y hembra) y reducción del peso testicular con la dosis más alta evaluada. Se observó deterioro neuroconductual con todas las dosis. No se identificó ninguna dosis sin efectos en términos de toxicidad del desarrollo. La dosis más baja evaluada se asoció a una AUC plasmática del MMF más baja que la de los seres humanos con la RHD. Registro de embarazos Existe un registro de embarazos que vigila los desenlaces de los embarazos de mujeres expuestas a TECFIDERA durante el embarazo. Aliente a las pacientes a que se inscriban al llamar al o en Madres lactantes Se desconoce si este fármaco se excreta en la leche materna. Debido a que muchos fármacos se excretan en la leche materna, se debe tener cautela cuando TECFIDERA se administra a una mujer que está amamantando. 8.4 Uso pediátrico No se han establecido la seguridad ni la efectividad en pacientes pediátricos. 8.5 Uso geriátrico En los estudios clínicos de TECFIDERA no se incluyó una cantidad suficiente de pacientes de 65 años de edad para determinar si responden de forma diferente a los pacientes más jóvenes.
37 11 DESCRIPCIÓN TECFIDERA contiene dimetil fumarato, que también es conocido por su denominación química, dimetil (E) butenodioato, (C 6 H 8 O 4 ). Tiene la siguiente estructura: O H O O H O El dimetil fumarato es un polvo blanco a blancuzco que es sumamente soluble en agua y tiene una masa molecular de TECFIDERA se proporciona en cápsulas de gelatina dura de liberación retardada para administración oral, con un contenido de 120 mg o 240 mg de dimetil fumarato que consisten en los siguientes ingredientes inactivos: celulosa microcristalina, celulosa microcristalina silicificada, croscarmelosa sódica, talco, sílice, dióxido de silicio coloidal, estearato de magnesio, trietil citrato, copolímero de ácido metacrílico de tipo A, dispersión de copolímero de ácido metacrílico, simeticona (emulsión al 30%), lauril sulfato de sodio y polisorbato 80. La cubierta de la cápsula, impresa en tinta negra, contiene los siguientes ingredientes inactivos: gelatina, dióxido de titanio, azul FD&C 1; azul brillante FCF, óxido de hierro amarillo y óxido de hierro negro. 12 FARMACOLOGÍA CLÍNICA 12.1 Mecanismo de acción Se desconoce el mecanismo mediante el cual el dimetil fumarato (DMF) ejerce su efecto terapéutico en la esclerosis múltiple. Se ha demostrado que el DMF y el metabolito, monometil fumarato (MMF) activan la vía del factor nuclear (derivado de eritroide 2) similar al 2 (Nrf2) in vitro e in vivo en animales y seres humanos. La vía del Nrf2 participa en la respuesta celular al estrés oxidativo. Se ha identificado el MMF como un agonista de los receptores del ácido nicotínico in vitro.
38 12.2 Farmacodinámica Potencial de prolongación del intervalo QT En un minucioso estudio controlado con placebo sobre el intervalo QT que se hizo en sujetos sanos, no hubo evidencia de que el dimetil fumarato causara una prolongación del intervalo QT clínicamente significativa (es decir, el límite superior del intervalo de confianza de 90% para el mayor intervalo QT corregido [QTc] inicial ajustado por el placebo se situó por debajo de 10 ms) Farmacocinética Después de la administración oral de TECFIDERA, el dimetil fumarato experimenta una rápida hidrólisis presistémica por las esterasas y es convertido en su metabolito activo, monometil fumarato (MMF). El dimetil fumarato no es cuantificable en plasma después de la administración oral de TECFIDERA. Por consiguiente, todos los análisis farmacocinéticos relacionados con TECFIDERA se hicieron con concentraciones plasmáticas de MMF. Se obtuvieron datos de farmacocinética de sujetos con esclerosis múltiple y de voluntarios sanos. Absorción La mediana del T máx del MMF es de 2 a 2.5 horas. La concentración plasmática máxima (C máx ) y la exposición global (AUC) aumentaron de forma aproximadamente proporcional a la dosis en el intervalo de dosis estudiado (120 mg a 360 mg). Después de la administración de TECFIDERA 240 mg dos veces al día con alimentos, la media de la C máx del MMF fue de 1.87 mg/l y el AUC fue de 8.21 mg.h/l en los pacientes con EM. Una comida con alto contenido graso y calórico no afectó el AUC del MMF, pero disminuyó su C máx en el 40%. El T máx aumentó de 2.0 horas a 5.5 horas. En este estudio, la incidencia de crisis vasomotora se redujo en aproximadamente un 25% en el estado posprandial. Distribución El volumen de distribución aparente del MMF varía entre 53 y 73 l en sujetos sanos. La unión a proteínas plasmáticas del MMF en seres humanos es del 27 al 45% y es independiente de la concentración. Metabolismo En seres humanos, el dimetil fumarato es metabolizado en gran parte por las esterasas, que se encuentran en todo el tubo digestivo, la sangre y los tejidos, antes de alcanzar la circulación sistémica. El metabolismo adicional del MMF tiene lugar a través del ciclo del ácido tricarboxílico (tricarboxylic acid, TCA), sin participación del sistema del citocromo P450 (CYP). El MMF, el ácido fumárico, el ácido cítrico y la glucosa son los principales metabolitos en el plasma. Eliminación La exhalación de CO 2 es la principal vía de eliminación y representa aproximadamente el 60% de la dosis de TECFIDERA. La eliminación renal y fecal son vías menores de eliminación y representan el 16% y el 1% de la dosis, respectivamente. En la orina, hubo cantidades vestigiales de MMF inalterado.
39 La semivida terminal del MMF es de aproximadamente 1 hora y no hay presencia de MMF circulante a las 24 horas en la mayoría de las personas. No se produce acumulación de MMF con dosis múltiples de TECFIDERA. Poblaciones específicas No es necesario ajustar la dosis en función del peso, el sexo ni la edad. No se han hecho estudios en sujetos con deficiencia hepática o renal. Sin embargo, no sería de prever que ninguna de estas enfermedades afectara la exposición al MMF y, por consiguiente, no es necesario ajuste alguno de la dosis. Estudios sobre interacciones farmacológicas No se identificaron potenciales interacciones farmacológicas con dimetil fumarato ni MMF en estudios de inhibición e inducción de CYP in vitro ni en estudios sobre la glucoproteína P. Las dosis únicas de interferón beta-1a o acetato de glatirámero no modificaron la farmacocinética del MMF. La aspirina, cuando se administró aproximadamente 30 minutos antes de TECFIDERA, no modificó la farmacocinética del MMF. 13 TOXICOLOGÍA NO CLÍNICA 13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad Carcinogénesis Se hicieron estudios de carcinogenicidad del dimetil fumarato (DMF) en ratones y ratas. En los ratones, la administración oral de DMF (25, 75, 200 y 400 mg/kg/día) durante un máximo de dos años ocasionó un aumento de los tumores del estómago no glandular (estómago anterior) y del riñón: carcinomas de células escamosas y papilomas del estómago anterior en machos y hembras a 200 y 400 mg/kg/día; leiomiosarcomas del estómago anterior a 400 mg/kg/día en machos y hembras; adenomas y carcinomas tubulares renales a 200 y 400 mg/kg/día en machos; y adenomas tubulares renales a 400 mg/kg/día en hembras. La exposición plasmática al MMF (AUC) con la dosis más alta no asociada a tumores en ratones (75 mg/kg/día) fue similar a la de los seres humanos con la dosis recomendada para seres humanos (RHD) de 480 mg/día. En ratas, la administración oral de DMF (25, 50, 100 y 150 mg/kg/día) durante un máximo de dos años causó aumentos en los carcinomas de células escamosas y papilomas del estómago anterior en todas las dosis evaluadas en machos y hembras, y en los adenomas de las células intersticiales (Leydig) testiculares a 100 y 150 mg/kg/día. El AUC plasmática del MMF con la dosis más baja evaluada fue más baja que la de los seres humanos con la RHD. Mutagénesis Ni el dimetil fumarato (DMF) ni el monometil fumarato (MMF) fueron mutágenos en el ensayo de mutación bacteriana inversa (Ames) in vitro. El DMF y el MMF fueron clastógenos en el ensayo de aberraciones cromosómicas in vitro en linfocitos de sangre periférica humana en ausencia de activación metabólica. El DMF no fue clastógeno en el análisis de micronúcleos in vivo en ratas.
40 Deterioro de la fertilidad En ratas macho, la administración oral de DMF (75, 250 y 375 mg/kg/día) antes y durante el período de apareamiento no tuvo efecto alguno en la fertilidad; sin embargo, se observaron aumentos de los espermatozoides inmóviles en las dosis media y alta. La dosis sin efectos en términos de efectos adversos en los espermatozoides es similar a la dosis recomendada para seres humanos (RHD) de 480 mg/día en función del área de la superficie corporal (mg/m 2 ). En ratas hembra, la administración oral de DMF (20, 100 y 250 mg/kg/día) antes y durante el apareamiento y hasta el día 7 de la gestación causó alteración del ciclo estral y aumentos en la mortalidad embrionaria con la dosis más alta evaluada. La dosis más alta no asociada a efectos adversos (100 mg/kg/día) es del doble de la RHD sobre una base de mg/m 2. Se observó toxicidad testicular (degeneración del epitelio germinal, atrofia, hipospermia e hiperplasia) en dosis clínicamente relevantes en ratones, ratas y perros en estudios de toxicidad oral subcrónica y crónica del DMF, y en un estudio de toxicidad oral crónica en el que se evaluó una combinación de cuatro ésteres del ácido fumárico (incluido el DMF) en ratas Toxicología o farmacología en animales Se observó toxicidad renal después de la administración oral repetida de dimetil fumarato (DMF) a ratones, ratas, perros y monos. En todas las especies, se observó regeneración del epitelio tubular renal, lo cual indica lesión epitelial tubular. Se observó hiperplasia tubular renal en ratas con administración durante un máximo de dos años. Se observaron atrofia cortical y fibrosis intersticial en perros y monos con dosis superiores a 5 mg/kg/día. En monos, la dosis más alta evaluada (75 mg/kg/día) se asoció a necrosis unicelular y fibrosis intersticial multifocal y difusa, lo cual indica la pérdida irreversible de tejido y función renales. En perros y monos, la dosis de 5 mg/kg/día se asoció a exposiciones plasmáticas al MMF inferiores o similares a la de los seres humanos con la dosis recomendada para seres humanos (RHD). Se observó un aumento relacionado con la dosis en la incidencia y gravedad de la degeneración retiniana en los ratones después de la administración oral de DMF durante un máximo de dos años en dosis superiores a 75 mg/kg/día, una dosis asociada a la exposición plasmática al MMF (AUC) similar a la de los seres humanos con la RHD. 14 ESTUDIOS CLÍNICOS La eficacia y seguridad de TECFIDERA se demostraron en dos estudios (estudios 1 y 2) en los que se evaluó TECFIDERA administrado dos o tres veces al día en pacientes con esclerosis múltiple recurrente (EMRR). La dosis inicial de TECFIDERA fue de 120 mg dos o tres veces al día durante los primeros 7 días, seguida de un incremento a 240 mg dos o tres veces al día. En ambos estudios se incluyeron pacientes que habían sufrido al menos 1 recidiva durante el año previo al ensayo o que se habían sometido a imágenes por resonancia magnética (IRM) del cerebro que mostraban al menos una lesión con contraste con gadolinio (Gd+) en un plazo de 6 semanas de la aleatorización. También se evaluó la Escala ampliada del estado de discapacidad (Expanded Disability Status Scale, EDSS) y los pacientes podían tener puntajes del 0 al 5. Se hicieron evaluaciones neurológicas al inicio, cada 3 meses y en el momento de una presunta recidiva. Se hicieron IRM al inicio, en el mes 6 y en el año 1 y 2 en un subconjunto de pacientes (44% en el estudio 1 y 48% en el estudio 2).
41 Estudio 1: Ensayo controlado con placebo sobre la EMRR El estudio 1 fue un estudio a 2 años, aleatorizado, con doble enmascaramiento, controlado con placebo, que se llevó a cabo en 1234 pacientes con EMRR. El criterio de valoración principal fue la proporción de pacientes con recidivas a los 2 años. Otros criterios de valoración a 2 años fueron el número de lesiones hiperintensas T2 nuevas o con hipertrofia reciente, el número de lesiones hipointensas T1 nuevas, el número de lesiones Gd+, la tasa de recidivas anualizada (annualized relapse rate, ARR) y el tiempo hasta la progresión confirmada de la discapacidad. La progresión confirmada de la discapacidad se definió como un incremento de al menos 1 punto con respecto del inicio en la EDSS (incremento de 1.5 puntos para los pacientes con una EDSS inicial de 0) sostenido durante 12 semanas. Los pacientes se aleatorizaron para recibir TECFIDERA 240 mg dos veces al día (n = 410), TECFIDERA 240 mg tres veces al día (n = 416) o placebo (n = 408) durante un máximo de 2 años. La mediana de la edad fue de 39 años, la mediana del tiempo desde el diagnóstico fue de 4 años y la mediana del puntaje de la EDSS al inicio fue de 2. La mediana del tiempo en que se recibió el fármaco del estudio para todos los grupos de tratamiento fue de 96 semanas. Los porcentajes de pacientes que completaron 96 semanas con el fármaco del estudio por grupo de tratamiento fueron: 69% para los pacientes asignados a TECFIDERA 240 mg dos veces al día, 69% para los pacientes asignados a TECFIDERA 240 mg tres veces al día y 65% para los pacientes asignados a los grupos del placebo. TECFIDERA tuvo un efecto estadísticamente significativo en todos los criterios de valoración descritos anteriormente y la dosis de 240 mg tres veces al día no mostró ningún beneficio adicional con respecto a la dosis de TECFIDERA 240 mg dos veces al día. Los resultados de este estudio (240 mg dos veces al día vs. el placebo) se muestran en la Tabla 2 y en la Figura 1. Tabla 2: Resultados clínicos y de las IRM del estudio 1 TECFIDERA 240 mg dos veces al día Placebo Valor de p Criterios de valoración clínicos N = 410 N = 408 Proporción con recidivas (criterio de valoración principal) Reducción relativa del riesgo 27% 49% 46% < Tasa de recidivas anualizada < Reducción relativa 53% Proporción con progresión de la discapacidad 16% 27% Reducción relativa del riesgo 38% Criterios de valoración de IRM N = 152 N = 165 Media de la cantidad de lesiones T2 nuevas o con hipertrofia reciente durante 2 años < Porcentaje de sujetos sin lesiones nuevas ni con hipertrofia reciente 45% 27%
42 Cantidad de lesiones Gd+ a 2 años Media (mediana) TECFIDERA 240 mg dos veces al día 0.1 (0) Placebo 1.8 (0) Valor de p Porcentaje de sujetos con 0 lesiones 1 lesión 2 lesiones 3 a 4 lesiones 5 o más lesiones 93% 5% <1% 0 <1% 62% 10% 8% 9% 11% Reducción de la probabilidad relativa (porcentaje) 90% < Media de la cantidad de lesiones hipointensas T1 durante 2 años <0.0001
43 Figura 1: Tiempo hasta la progresión de la discapacidad confirmada a 12 semanas (estudio 1) Estudio 2: Ensayo controlado con placebo sobre la EMRR El estudio 2 fue un estudio a 2 años, multicéntrico, aleatorizado, doble enmascaramiento, controlado con placebo, en el cual también se incluyó un grupo comparador sin enmascaramiento en pacientes con EMRR. El criterio de valoración principal fue la tasa de recidivas anualizada a 2 años. Otros criterios de valoración a 2 años fueron el número de lesiones hiperintensas T2 nuevas o con hipertrofia reciente, el número de lesiones hipointensas T1, el número de lesiones Gd+, la proporción de pacientes con recidivas y el tiempo hasta la progresión confirmada de la discapacidad, como se define en el estudio 1. Los pacientes se aleatorizaron para recibir TECFIDERA 240 mg dos veces al día (n = 359), TECFIDERA 240 mg tres veces al día (n = 345), un comparador sin enmascaramiento (n = 350) o placebo (n = 363) durante un máximo de 2 años. La mediana de la edad fue de 37 años, la mediana del tiempo desde el diagnóstico fue de 3 años y la mediana del puntaje de la EDSS al inicio fue de 2.5. La mediana del tiempo en que se recibió el fármaco del estudio para todos los grupos de
44 tratamiento fue de 96 semanas. Los porcentajes de pacientes que completaron 96 semanas con el fármaco del estudio por grupo de tratamiento fueron: 70% para los pacientes asignados a TECFIDERA 240 mg dos veces al día, 72% para los pacientes asignados a TECFIDERA 240 mg tres veces al día y 64% para los pacientes asignados a los grupos del placebo. TECFIDERA tuvo un efecto estadísticamente significativo en los criterios de valoración de recidivas e IRM descritos anteriormente. No hubo ningún efecto estadísticamente significativo en la progresión de la discapacidad. La dosis de TECFIDERA 240 mg tres veces al día no tuvo ningún beneficio adicional con respecto a la dosis de TECFIDERA 240 mg dos veces al día. Los resultados de este estudio (240 mg dos veces al día vs. el placebo) se muestran en la Tabla 3. Tabla 3: Resultados clínicos y de las IRM del estudio 2 TECFIDERA 240 mg dos veces al día Placebo Valor de p Criterios de valoración clínicos N = 359 N = 363 Tasa de recidivas anualizada < Reducción relativa 44% Proporción con recidivas 29% 41% Reducción relativa del riesgo 34% Proporción con progresión de la discapacidad 13% 17% 0.25 Reducción relativa del riesgo 21% Criterios de valoración de IRM N = 147 N = 144 Media de la cantidad de lesiones T2 nuevas o con hipertrofia reciente durante 2 años < Porcentaje de sujetos sin lesiones nuevas ni con hipertrofia reciente 27% 12% Cantidad de lesiones Gd+ a 2 años Media (mediana) Porcentaje de sujetos con 0 lesiones 1 lesión 2 lesiones 3 a 4 lesiones 5 o más lesiones 0.5 (0.0) 80% 11% 3% 3% 3% 2.0 (0.0) 61% 17% 6% 2% 14% Reducción de la probabilidad relativa (porcentaje) 74% < Media de la cantidad de lesiones hipointensas T1 durante 2 años <0.0001
45 16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN TECFIDERA se encuentra disponible como cápsulas de gelatina dura de liberación retardada en dos concentraciones, que contienen 120 mg o 240 mg de dimetil fumarato. Las cápsulas verdes y blancas de 120 mg tienen impreso BG mg en tinta negra. Las cápsulas verdes de 240 mg tienen impreso BG mg en tinta negra. TECFIDERA se encuentra disponible de la siguiente forma: Paquete de inicio para 30 días (NDC ): frasco para 7 días con cápsulas de 120 mg, 14 unidades frasco para 23 días con cápsulas de 240 mg, 46 unidades Cápsulas de 120 mg: frasco para 7 días de 14 cápsulas (NDC ) Cápsulas de 240 mg: frasco para 30 días de 60 cápsulas (NDC ) Almacenar a una temperatura de entre 15 C y 30 C (59 F a 86 F). Proteger las cápsulas de la luz. Almacenar en el envase original. 17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE Aconseje al paciente que lea la ficha técnica para el paciente aprobada por la FDA (Información para el paciente). Posología Informe a los pacientes que se les entregarán dos concentraciones de TECFIDERA al iniciar el tratamiento: cápsulas de 120 mg para la dosis inicial durante 7 días y cápsulas de 240 mg para la dosis de mantenimiento; ambas deben tomarse dos veces al día. Informe a los pacientes que deben tragar las cápsulas de TECFIDERA enteras e intactas. Informe a los pacientes que no deben triturar, masticar ni espolvorear el contenido de las cápsulas sobre los alimentos. Informe a los pacientes que TECFIDERA puede tomarse con o sin alimentos [consulte Posología y administración (2.1)]. Anafilaxia y angioedema Indique a los pacientes que interrumpan permanentemente la administración de TECFIDERA y que procuren atención médica si presentan manifestaciones clínicas de anafilaxia o angioedema [consulte Advertencias y precauciones (5.1)].
46 Leucoencefalopatía multifocal progresiva Informe a los pacientes que se produjo leucoencefalopatía multifocal progresiva (LMP) en los pacientes que recibieron TECFIDERA. Informe al paciente que la LMP se caracteriza por una progresión de los déficits y generalmente provoca muerte o discapacidad grave en el transcurso de semanas o meses. Indique al paciente la importancia de comunicarse con su médico si presenta síntomas indicativos de LMP. Informe al paciente que los síntomas típicos asociados a la LMP son diversos, evolucionan en el transcurso de días a semanas e incluyen debilidad progresiva en un lado del cuerpo o torpeza de las extremidades, alteración de la vista y cambios en el pensamiento, la memoria y la orientación que provocan confusión y cambios de personalidad [consulte Advertencias y precauciones (5.2)]. Recuentos linfocitarios Informe a los pacientes que TECFIDERA puede disminuir los recuentos linfocitarios. Se debe hacer un análisis de sangre antes de iniciar la terapia. También se recomiendan los análisis de sangre después de 6 meses de tratamiento, cada 6 a 12 meses a partir de entonces y según indicación clínica [consulte Advertencias y precauciones (5.3), Reacciones adversas (6.1)]. Crisis vasomotora y reacciones gastrointestinales (GI) La crisis vasomotora y las reacciones GI (dolor abdominal, diarrea y náuseas) son las reacciones más frecuentes, especialmente al inicio de la terapia, y pueden disminuir con el tiempo. Asesore a los pacientes que se comuniquen con su proveedor de atención médica si presentan crisis vasomotora y/o reacciones GI persistentes o graves. Asesore a los pacientes que presentan crisis vasomotora que tomar TECFIDERA con alimentos o tomar una aspirina sin recubrimiento entérico antes de tomar TECFIDERA puede ayudar [consulte Reacciones adversas (6.1)]. Embarazo y registro de embarazos Indique a las pacientes que si están embarazadas o planean quedar embarazadas mientras toman TECFIDERA, deben informar a su médico. Aliente a las pacientes a inscribirse en el Registro de embarazos durante el uso de TECFIDERA si quedan embarazadas mientras toman TECFIDERA. Aconseje a las pacientes que llamen al o visiten para obtener más información [consulte Uso en poblaciones específicas (8.1)] Fabricado por: Biogen Inc. Cambridge, MA TECFIDERA es una marca comercial registrada de Biogen. Biogen
47 Datos del paciente TECFIDERA (dimetil fumarato) cápsulas de liberación retardada Qué es TECFIDERA? TECFIDERA es un medicamento recetado que se utiliza para tratar a personas con formas recurrentes de esclerosis múltiple (EM) Se desconoce si TECFIDERA es seguro y eficaz en niños y adolescentes de menos de 18 años de edad Quién no debe tomar TECFIDERA? No use TECFIDERA si ha tenido una reacción alérgica (como ronchas, urticaria, hinchazón del rostro, los labios, la boca o la lengua o dificultad para respirar) a TECFIDERA o a cualquiera de sus ingredientes. Consulte a continuación una lista completa de los ingredientes. Antes de tomar TECFIDERA y mientras lo hace, informe a su médico si tiene o ha tenido lo siguiente: recuento bajo de glóbulos blancos o una infección cualquier otra afección Informe a su médico si: está embarazada o planea quedar embarazada. Se desconoce si TECFIDERA dañará a un bebé en gestación. Si queda embarazada mientras toma TECFIDERA, hable con su médico acerca de inscribirse en el Registro de embarazos durante el uso de TECFIDERA. Puede inscribirse en este registro al llamar al o en El propósito de este registro es vigilar su salud y la de su bebé. está amamantando o planea amamantar. Se desconoce si TECFIDERA pasa a la leche materna. Usted y su médico deben decidir si usted tomará TECFIDERA o si amamantará. está tomando medicamentos recetados o de venta libre, vitaminas o suplementos a base de hierbas Cómo debo tomar TECFIDERA? Tome TECFIDERA exactamente como su médico le indique que lo haga La dosis inicial recomendada es una cápsula de 120 mg tomada por boca 2 veces al día durante 7 días La dosis recomendada después de 7 días es una cápsula de 240 mg tomada por boca 2 veces al día TECFIDERA puede tomarse con o sin alimentos Trague entera la cápsula de TECFIDERA. No triture, mastique ni espolvoree el contenido de las cápsulas sobre los alimentos. Proteja TECFIDERA de la luz. Puede hacer esto almacenando las cápsulas en su envase original. Cuáles son los posibles efectos secundarios de TECFIDERA? TECFIDERA puede causar efectos secundarios graves, que incluyen los siguientes: reacción alérgica (como ronchas, urticaria, hinchazón del rostro, los labios, la boca o la lengua o dificultad para respirar) LMP, una infección cerebral rara que generalmente provoca la muerte o discapacidad grave disminuciones en su recuento de glóbulos blancos. Su médico debe hacerle un análisis de sangre antes de que comience el tratamiento con TECFIDERA y durante este.
48 Los efectos secundarios más frecuentes de TECFIDERA incluyen los siguientes: crisis vasomotora (sofocos), enrojecimiento, comezón o erupción náuseas, vómitos, diarrea, dolor estomacal o indigestión La crisis vasomotora y los problemas estomacales son las reacciones más frecuentes, especialmente al inicio de la terapia, y pueden disminuir con el tiempo. Tomar TECFIDERA con alimentos puede ayudar a reducir la crisis vasomotora. Llame a su médico si tiene cualquiera de estos síntomas y constituyen una molestia para usted o no desaparecen. Pregunte a su médico si tomar aspirina antes de tomar TECFIDERA puede reducir la crisis vasomotora. Estos no son todos los efectos secundarios posibles de TECFIDERA. Llame a su médico para obtener asesoramiento médico con respecto a los efectos secundarios. Puede informar los efectos secundarios a la Administración de Medicamentos y Alimentos (Food and Drug Administration, FDA), llamando al FDA Para obtener más información, visite dailymed.nlm.nih.gov. Información general sobre el uso seguro y eficaz de TECFIDERA Los medicamentos a veces se recetan con fines que no son los indicados en esta Información para el paciente. No use TECFIDERA para una afección para la cual no se le recetó. No dé TECFIDERA a otras personas, ni siquiera si tienen los mismos síntomas que usted. Puede hacerles daño. Si desea más información, hable con su médico o farmacéutico. Puede pedirle a su médico o farmacéutico información sobre TECFIDERA escrita para profesionales de la atención médica. Cuáles son los ingredientes de TECFIDERA? Ingrediente activo: dimetil fumarato Ingredientes inactivos: celulosa microcristalina, celulosa microcristalina silicificada, croscarmelosa sódica, talco, sílice, dióxido de silicio coloidal, estearato de magnesio, trietil citrato, copolímero de ácido metacrílico de tipo A, dispersión de copolímero de ácido metacrílico, simeticona (emulsión al 30%), lauril sulfato de sodio y polisorbato 80. Cubierta de la cápsula: gelatina, dióxido de titanio, azul FD&C 1; azul brillante FCF, óxido de hierro amarillo y óxido de hierro negro. Fabricado por: Biogen Inc., Cambridge, MA 02142, o llame al Esta Información para el paciente ha sido aprobada por la Administración de Medicamentos y Alimentos de Estados Unidos (FDA) Revisado: 4/2015
49 PUNTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN Estos puntos destacados no incluyen toda la información necesaria para utilizar TYSABRI de forma segura y eficaz. Consulte la información completa de prescripción de TYSABRI. TYSABRI (natalizumab) inyección para uso intravenoso Aprobación inicial en los EE. UU.: 2004 ADVERTENCIA: LEUCOENCEFALOPATÍA MULTIFOCAL PROGRESIVA Consulte la información completa de prescripción para ver el cuadro completo de advertencia TYSABRI aumenta el riesgo de desarrollar leucoencefalopatía multifocal progresiva (LMP), una infección viral oportunista del cerebro que habitualmente provoca la muerte o una discapacidad grave (5.1) Los factores de riesgo para el desarrollo de la LMP incluyen la duración de la terapia, el uso anterior de inmunodepresores y la presencia de anticuerpos anti-vjc. Estos factores deben considerarse en el contexto del beneficio esperado cuando se inicia y continúa el tratamiento con TYSABRI (5.1) Controle a los pacientes y suspenda TYSABRI de inmediato tras el primer signo o síntoma indicativo de LMP (4, 5.1) Debido al riesgo de contraer LMP, TYSABRI solo se encuentra disponible a través de un programa de distribución restringido llamado Programa de prescripción TOUCH (5.1, 5.2) PRINCIPALES CAMBIOS RECIENTES Advertencias y precauciones (5.1, 5.5, 5.7) 05/ INDICACIONES Y USO TYSABRI es un antagonista del receptor de la integrina indicado para el tratamiento de lo siguiente: Esclerosis múltiple (EM) TYSABRI está indicado como monoterapia para el tratamiento de pacientes con formas recurrentes de esclerosis múltiple. TYSABRI aumenta el riesgo de LMP. Al iniciar y continuar el tratamiento con TYSABRI, los médicos deben considerar si el beneficio esperado de TYSABRI es suficiente para compensar este riesgo. Consulte información importante sobre el riesgo de desarrollar LMP con TYSABRI. (1.1, 5.1) Enfermedad de Crohn (EC) TYSABRI está indicado para inducir y mantener la respuesta y la remisión clínicas en pacientes adultos con enfermedad de Crohn moderada a gravemente activa con evidencia de inflamación que tuvieron una respuesta inadecuada a tratamientos convencionales para la EC e inhibidores del FNT-α o que no pueden tolerarlos. (1.2) Limitaciones importantes: En la EC, TYSABRI no debe usarse en combinación con inmunodepresores ni con inhibidores del FNT-α. (1.2) INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: ÍNDICE* ADVERTENCIA: LEUCOENCEFALOPATÍA MULTIFOCAL PROGRESIVA 1 INDICACIONES Y USO 1.1 Esclerosis múltiple (EM) 1.2 Enfermedad de Crohn (EC) 2 POSOLOGÍA Y ADMINISTRACIÓN 2.1 Esclerosis múltiple (EM) 2.2 Enfermedad de Crohn (EC) 2.3 Instrucciones de dilución 2.4 Instrucciones de administración 3 FORMULACIONES Y CONCENTRACIONES 4 CONTRAINDICACIONES 5 ADVERTENCIAS Y PRECAUCIONES 5.1 Leucoencefalopatía multifocal progresiva 5.2 Programa de prescripción TOUCH de TYSABRI 5.3 Meningitis y encefalitis por herpes 5.4 Hepatotoxicidad 5.5 Hipersensibilidad/formación de anticuerpos 5.6 Inmunodepresión/infecciones 5.7 Anomalías en los análisis de laboratorio 5.8 Vacunas 6 REACCIONES ADVERSAS 6.1 Experiencia en ensayos clínicos 6.2 Inmunogenicidad POSOLOGÍA Y ADMINISTRACIÓN Infusión intravenosa de 300 mg durante una hora, cada cuatro semanas. No debe administrarse como bolo o inyección intravenosa rápida (2.1, 2.2) La solución TYSABRI debe administrarse dentro de las 8 horas de su preparación (2.3) Observe a los pacientes durante la infusión y durante una hora después de completarla (2.4) En la EC, interrumpa el tratamiento en los pacientes que no hayan tenido un beneficio terapéutico al cabo de 12 semanas del tratamiento de inducción y en los pacientes que no pueden interrumpir el uso crónico de esteroides concomitantes dentro de los seis meses del inicio del tratamiento (2.2) FORMULACIONES Y CONCENTRACIONES Solución [300 mg por vial de 15 ml] para dilución antes de la infusión (3) CONTRAINDICACIONES Pacientes que tienen o tuvieron LMP (4) Pacientes que tuvieron una reacción de hipersensibilidad a TYSABRI (4, 5.3) ADVERTENCIAS Y PRECAUCIONES Meningitis y encefalitis por herpes: se han producido casos posiblemente mortales y mortales. Interrumpa TYSABRI si ocurre esto y trate de manera apropiada (5.3) Hepatotoxicidad: se han producido lesiones hepáticas significativas, que incluyen insuficiencia hepática que requirió trasplante. Interrumpa TYSABRI en pacientes con evidencia de lesión hepática (5.4) Reacciones de hipersensibilidad: se produjeron reacciones de hipersensibilidad grave (p. ej., anafilaxia). Interrumpa TYSABRI de forma permanente si se produce esta reacción (5.5) Inmunodepresión/infecciones: TYSABRI puede aumentar el riesgo de desarrollar ciertas infecciones. Controle a los pacientes para determinar si se desarrollan infecciones debido al mayor riesgo que implica el uso de TYSABRI (5.6) REACCIONES ADVERSAS Reacciones adversas más frecuentes (incidencia 10%): EM: dolor de cabeza, fatiga, artralgia, infección urinaria, infección de las vías respiratorias bajas, gastroenteritis, vaginitis, depresión, dolor en las extremidades, molestia abdominal, diarrea sin especificación y sarpullido (6.1) EC: dolor de cabeza, infecciones de las vías respiratorias altas, náuseas y fatiga (6.1) Para informar PRESUNTAS REACCIONES ADVERSAS, comuníquese con Biogen llamando al o con la FDA al FDA-1088 o visitando USO EN POBLACIONES ESPECÍFICAS Embarazo: según información obtenida de estudios sobre animales, puede causar daño fetal. (8.1) Consulte la sección 17 para conocer la INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y la Guía de medicamentos. Revisado: 05/ INTERACCIONES FARMACOLÓGICAS 8 USO EN POBLACIONES ESPECÍFICAS 8.1 Embarazo 8.3 Madres lactantes 8.4 Uso pediátrico 8.5 Uso geriátrico 10 SOBREDOSIS 11 DESCRIPCIÓN 12 FARMACOLOGÍA CLÍNICA 12.1 Mecanismo de acción 12.2 Farmacodinámica 12.3 Farmacocinética 13 TOXICOLOGÍA NO CLÍNICA 13.1 Carcinogénesis, mutagénesis, alteración de la fertilidad 13.2 Toxicología y/o farmacología en animales 14 ESTUDIOS CLÍNICOS 14.1 Esclerosis múltiple 14.2 Enfermedad de Crohn 15 REFERENCIAS 16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN 17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE *No se incluyen las secciones o subsecciones que se han omitido de la Información completa de prescripción.
50 INFORMACIÓN COMPLETA DE PRESCRIPCIÓN ADVERTENCIA: LEUCOENCEFALOPATÍA MULTIFOCAL PROGRESIVA TYSABRI aumenta el riesgo de desarrollar leucoencefalopatía multifocal progresiva (LMP), una infección viral oportunista del cerebro que habitualmente provoca la muerte o una discapacidad grave. Los factores de riesgo para el desarrollo de la LMP incluyen la duración de la terapia, el uso anterior de inmunodepresores y la presencia de anticuerpos anti-vjc. Estos factores deben considerarse en el contexto del beneficio esperado cuando se inicia y continúa el tratamiento con TYSABRI [consulte Advertencias y precauciones (5.1)]. Los profesionales de la salud deben controlar a los pacientes que usan TYSABRI para determinar si hay algún signo o síntoma nuevo indicativo de LMP. La administración de la dosis de TYSABRI debe suspenderse de inmediato ante el primer signo o síntoma indicativo de LMP. Para el diagnóstico, se recomienda hacer una evaluación que incluya una imagen por resonancia magnética (IRM) del cerebro con contraste con gadolinio y, cuando esté indicado, un análisis del líquido cefalorraquídeo del ADN del virus de JC [consulte Contraindicaciones (4) y Advertencias y precauciones (5.1)]. Debido al riesgo de contraer LMP, TYSABRI solo se encuentra disponible a través de un programa restringido conforme a una Estrategia de Evaluación y Mitigación de Riesgos (Risk Evaluation and Mitigation Strategy, REMS) llamada Programa de prescripción TOUCH [consulte Advertencias y precauciones (5.2)]. 1. INDICACIONES Y USO 1.1. Esclerosis múltiple (EM) TYSABRI está indicado como monoterapia para el tratamiento de pacientes con formas recurrentes de esclerosis múltiple. TYSABRI aumenta el riesgo de LMP. Al iniciar y continuar el tratamiento con TYSABRI, los médicos deben considerar si el beneficio esperado de TYSABRI es suficiente para compensar este riesgo. Consulte información importante sobre el riesgo de desarrollar LMP con TYSABRI [consulte Advertencias y precauciones (5.1)] Enfermedad de Crohn (EC) TYSABRI está indicado para inducir y mantener la respuesta y la remisión clínicas en pacientes adultos con enfermedad de Crohn moderada a gravemente activa con evidencia de inflamación que tuvieron una respuesta inadecuada a tratamientos convencionales para la EC e inhibidores del FNT-α o que no pueden tolerarlos. TYSABRI no debe usarse con inmunodepresores (p. ej.,
51 6-mercaptopurina, azatioprina, ciclosporina o metotrexato) ni con inhibidores del FNT-α [consulte Advertencias y precauciones (5.1)]. 2. POSOLOGÍA Y ADMINISTRACIÓN 2.1. Esclerosis múltiple (EM) Solo los prescriptores registrados en el Programa de prescripción TOUCH para EM pueden recetar TYSABRI para la esclerosis múltiple [consulte Advertencias y precauciones (5.2)]. La dosis recomendada de TYSABRI para la esclerosis múltiple es una infusión intravenosa de 300 mg durante una hora cada cuatro semanas Enfermedad de Crohn (EC) Solo los prescriptores registrados en el Programa de prescripción TOUCH para la EC pueden recetar TYSABRI para la enfermedad de Crohn [consulte Advertencias y precauciones (5.2)]. La dosis recomendada de TYSABRI para la enfermedad de Crohn es una infusión intravenosa de 300 mg durante una hora cada cuatro semanas. TYSABRI no debe usarse con inmunodepresores concomitantes (p. ej., 6-mercaptopurina, azatioprina, ciclosporina o metotrexato) ni con inhibidores del FNT-α concomitantes. Puede continuarse el tratamiento con aminosalicilatos durante el tratamiento con TYSABRI. Si el paciente con enfermedad de Crohn no tuvo un beneficio terapéutico al cabo de 12 semanas de tratamiento de inducción, interrumpa TYSABRI. En el caso de los pacientes con enfermedad de Crohn que comiencen TYSABRI mientras reciben corticoesteroides orales de manera crónica, comience con la reducción de los esteroides tan pronto como el beneficio terapéutico de TYSABRI se manifieste; si al paciente con enfermedad de Crohn no se le puede reducir el uso de corticoesteroides orales dentro de los seis meses del inicio de TYSABRI, interrumpa TYSABRI. Además de la reducción en el período de seis meses desde el inicio, los prescriptores deben considerar interrumpir TYSABRI en el caso de los pacientes que requieran un uso adicional de esteroides de más de tres meses en un año calendario para controlar la enfermedad de Crohn Instrucciones de dilución 1. Use una técnica aséptica al preparar la solución de TYSABRI para la infusión intravenosa. Cada vial está destinado para un solo uso. 2. TYSABRI es un concentrado incoloro, de transparente a ligeramente opalescente. Inspeccione el vial de TYSABRI para ver si tiene material sólido y cambio de color antes de su dilución y administración. Si hay material sólido visible o si el líquido del vial cambió de color, no debe usarse el vial. 3. Para preparar la solución, extraiga 15 ml del concentrado de TYSABRI del vial con una aguja y jeringa estériles. Inyecte el concentrado en 100 ml de inyección de cloruro de sodio al 0.9%, conforme a la Convención de la Farmacopea de Estados Unidos (U.S. Pharmacopeia, USP). No pueden usarse otros diluyentes IV para preparar la solución TYSABRI.
52 4. Invierta suavemente la solución de TYSABRI para mezclar por completo. No agitar. Inspeccione la solución visualmente para ver si hay material sólido antes de la administración. 5. La solución para la administración de la dosis final tiene una concentración de 2.6 mg/ml. 6. Tras la dilución, administre la infusión de la solución TYSABRI de inmediato o coloque la solución en el refrigerador a una temperatura de entre 2 C y 8 C, y use dentro de las 8 horas. Si se guarda a entre 2 C y 8 C, deje que la solución adquiera temperatura ambiente antes de administrar la infusión. NO LO CONGELE Instrucciones de administración Administre la infusión de 300 mg de TYSABRI en 100 ml de inyección de cloruro de sodio al 0.9%, conforme a la USP, durante una hora aproximadamente (tasa de infusión de cerca de 5 mg por minuto). No administre TYSABRI como bolo o inyección intravenosa rápida. Después de que la infusión esté completa, irrigue con inyección de cloruro de sodio al 0.9%, según la USP. Observe a los pacientes durante la infusión y durante una hora después de completarla. Interrumpa la infusión de inmediato ante el primer signo o síntoma que concuerde con una reacción de tipo hipersensibilidad [consulte Advertencias y precauciones (5.5)]. No se evaluó el uso de dispositivos de filtración durante la administración. No deben inyectarse otros medicamentos a través de puertos laterales del equipo de infusión ni deben mezclarse con TYSABRI. 3. FORMULACIONES Y CONCENTRACIONES TYSABRI es una solución concentrada que debe diluirse antes de administrarse como infusión intravenosa. La inyección TYSABRI se suministra como 300 mg de natalizumab en 15 ml (20 mg/ml) en un vial estéril de uso único sin conservantes. 4. CONTRAINDICACIONES TYSABRI está contraindicado en pacientes que tienen o tuvieron leucoencefalopatía multifocal progresiva (LMP) [consulte Advertencias y precauciones (5.1)]. TYSABRI está contraindicado en pacientes que tuvieron una reacción de hipersensibilidad a TYSABRI. Las reacciones observadas varían de urticaria a anafilaxia [consulte Advertencias y precauciones (5.5)].
53 5. ADVERTENCIAS Y PRECAUCIONES 5.1. Leucoencefalopatía multifocal progresiva Se ha manifestado leucoencefalopatía multifocal progresiva (LMP), una infección viral oportunista del cerebro provocada por el virus de John Cunningham (VJC) que, por lo general, se produce solo en pacientes inmunocomprometidos. Habitualmente provoca la muerte o discapacidad grave en pacientes que recibieron TYSABRI. Se identificaron tres factores que se ha demostrado que aumentan el riesgo de desarrollar LMP en pacientes tratados con TYSABRI: Mayor duración del tratamiento, especialmente más de 2 años. Hay experiencia limitada en pacientes que recibieron tratamiento con TYSABRI durante más de 6 años. Tratamiento anterior con un inmunodepresor (p. ej., mitoxantrona, azatioprina, metotrexato, ciclofosfamida, micofenolato mofetil). La presencia de anticuerpos anti-vjc. Los pacientes que tienen un resultado positivo al anticuerpo anti-vjc tienen un mayor riesgo de desarrollar LMP. Estos factores deben considerarse en el contexto del beneficio esperado cuando se inicia y continúa el tratamiento con TYSABRI. Tabla 1: Resultado negativo al anticuerpo anti-vjc <1/1,000 Incidencia estimada de LMP estratificada por factor de riesgo en Estados Unidos Exposición a Resultado positivo al anticuerpo anti-vjc TYSABRI Sin uso anterior de inmunodepresores Uso anterior de inmunodepresores 1-24 meses <1/1,000 1/1, meses 3/1,000 12/1, meses 6/1,000 13/1,000 Notas: Las estimaciones de riesgo se basan en los datos posteriores a la comercialización en los Estados Unidos de aproximadamente 69,000 pacientes expuestos a TYSABRI. Los datos después de los 6 años de tratamiento son limitados. El estado de los anticuerpos anti-vjc se determinó usando un análisis de anticuerpo anti-vjc (ELISA) que se validó analítica y clínicamente. Además, se configura con pasos de detección e inhibición para confirmar la presencia de anticuerpos específicos del VJC con una tasa analítica de resultados negativos falsos del 3%. Generalmente, los pacientes que reciben una terapia inmunodepresora o una terapia inmunomoduladora crónica o que tienen afecciones médicas sistémicas que afectan la función del sistema inmunológico de manera significativa no deben recibir tratamiento con TYSABRI. Es necesario que haya una infección por el virus de JC para el desarrollo de la LMP. No deben usarse análisis de anticuerpos anti-vjc para diagnosticar la LMP. El estado negativo de los anticuerpos anti-vjc indica que no se detectó la exposición al virus de JC. Los pacientes que tienen un resultado negativo al anticuerpo anti-vjc tienen un riesgo más bajo de LMP que aquellos con resultado positivo. Los pacientes que tienen un resultado negativo al anticuerpo anti-vjc aún tienen riesgo de desarrollar LMP debido a la posibilidad de una nueva infección por el VJC o de un resultado negativo falso. La tasa de seroconversión informada en pacientes con EM (que cambiaron de resultado negativo al anticuerpo anti-vjc a resultado positivo y permanecieron con un resultado positivo en análisis posteriores) es del 3 al 8% anualmente. Además, el estado serológico de algunos pacientes puede cambiar de manera intermitente. Por lo
54 tanto, los pacientes con un resultado de análisis negativo del anticuerpo anti-vjc deben repetirse el análisis periódicamente. Para fines de una evaluación de riesgo, un paciente con un resultado de análisis positivo del anticuerpo anti-vjc en cualquier momento se considera con resultado positivo al anticuerpo anti-vjc independientemente de los resultados de todo análisis anterior o posterior del anticuerpo anti-vjc. En esta evaluación, el estado respecto del anticuerpo anti-vjc debe determinarse usando un inmunoensayo validado analítica y clínicamente. El análisis del anticuerpo anti-vjc no debe realizarse por al menos dos semanas después de la plasmaféresis debido a la extracción de anticuerpos del suero. Los profesionales de la salud deben controlar a los pacientes que usan TYSABRI para determinar si hay algún signo o síntoma nuevo indicativo de LMP. Los síntomas asociados a la LMP son diversos, evolucionan en el transcurso de días a semanas e incluyen debilidad progresiva en un costado del cuerpo o torpeza de las extremidades, alteración de la vista y cambios en el pensamiento, la memoria y la orientación que provocan confusión y cambios de personalidad. La progresión de los déficits generalmente provoca muerte o discapacidad grave en el transcurso de semanas o meses. A la primera manifestación clínica indicativa de LMP, se debe suspender inmediatamente la administración de TYSABRI y hacer una adecuada evaluación diagnóstica. Los hallazgos de las imágenes por resonancia magnética (IRM) pueden ser evidentes antes de la manifestación de síntomas o signos clínicos. Se ha informado de casos de LMP, diagnosticado de acuerdo con los hallazgos de las IRM y la detección de ADN de VJC en el líquido cefalorraquídeo en ausencia de síntomas o signos clínicos específicos para LMP. Muchos de esos pacientes posteriormente son sintomáticos. Se debe considerar el control periódico de signos radiográficos consistentes con LMP para permitir un diagnóstico precoz de LMP. Se ha informado de menor mortalidad y morbilidad relacionada con LMP luego de la interrupción de TYSABRI en pacientes con LMP que inicialmente eran asintomáticos en comparación con pacientes con LMP que presentaron signos y síntomas clínicos característicos al momento del diagnóstico. Se desconoce si estas diferencias se deben a la detección temprana y la interrupción de TYSABRI o debido a las diferencias en las enfermedades en estos pacientes. No se conocen intervenciones que puedan prevenir la LMP de manera confiable ni que puedan tratarla de manera adecuada si esta se desarrolla. Se ha informado de LMP tras la interrupción de TYSABRI en pacientes que no tenían resultados indicativos de LMP al momento de la interrupción. Se debe continuar controlando a los pacientes para ver si hay algún signo o síntoma nuevo que pueda indicar LMP durante, al menos, seis meses tras la interrupción de TYSABRI. Debido al riesgo de contraer LMP, TYSABRI solo se encuentra disponible a través de un programa de distribución restringido, el Programa de prescripción TOUCH. En los pacientes con esclerosis múltiple, debe hacerse una IRM antes de iniciar el tratamiento con TYSABRI. Esta IRM puede ser de utilidad para diferenciar los síntomas posteriores de esclerosis múltiple de la LMP. En los pacientes con enfermedad de Crohn, una IRM de cerebro inicial también podría ser de utilidad para distinguir lesiones preexistentes de lesiones de aparición reciente; sin embargo, las lesiones cerebrales del inicio que podrían dificultar el diagnóstico durante la terapia con TYSABRI son poco frecuentes. Para el diagnóstico de la LMP, se recomienda hacer una evaluación que incluya una IRM del cerebro con contraste con gadolinio y, cuando esté indicado, un análisis del líquido
55 cefalorraquídeo del ADN del virus de JC. Si las evaluaciones iniciales de la LMP arrojan resultados negativos, pero persiste la sospecha clínica de LMP, continúe suspendiendo la administración de la dosis de TYSABRI y repita las evaluaciones. Se desconocen intervenciones que puedan tratar de manera adecuada la LMP si esta se desarrolla. En un estudio de 12 pacientes con EM que no tenían LMP se demostró que tres sesiones de plasmaféresis durante 5 a 8 días aceleran la depuración de TYSABRI, aunque en la mayoría de los pacientes la unión al receptor de la alfa-4-integrina permaneció elevada. Los eventos adversos que pueden producirse durante la plasmaféresis incluyen la depuración de otros medicamentos y cambios en el volumen, los cuales pueden generar hipotensión o edema pulmonar. Si bien no se estudió la plasmaféresis en pacientes tratados con TYSABRI que tenían LMP, se ha usado en muchos pacientes en el contexto posterior a la comercialización para eliminar TYSABRI más rápidamente de la circulación. El análisis del anticuerpo anti-vjc no debe realizarse por al menos dos semanas después de la plasmaféresis debido a la extracción de anticuerpos del suero. Se ha informado de síndrome inflamatorio de reconstitución inmunitaria (SIRI) en la mayoría de los pacientes tratados con TYSABRI que desarrollaron LMP y que posteriormente interrumpieron TYSABRI. En casi todos los casos, se produjo SIRI después de usar la plasmaféresis para eliminar TYSABRI en circulación. Se manifiesta como un empeoramiento clínico de la enfermedad del paciente después de retirar TYSABRI (y en algunos casos después de una mejora clínica aparente) que puede ser rápida, puede generar complicaciones neurológicas graves o la muerte y, a menudo, se asocia con cambios característicos en la IRM. TYSABRI no se ha asociado con el SIRI en pacientes que interrumpieron el tratamiento con TYSABRI por razones no relacionadas con la LMP. En pacientes tratados con TYSABRI que tenían LMP, se ha informado de SIRI entre días y semanas después de la plasmaféresis. Debe hacerse el control del desarrollo del SIRI y el tratamiento correspondiente de la inflamación asociada Programa de prescripción TOUCH de TYSABRI TYSABRI solo se encuentra disponible a través de un programa restringido conforme a una REMS llamada Programa de prescripción TOUCH debido al riesgo de contraer LMP [consulte Advertencias y precauciones (5.1)]. Para los prescriptores y para los pacientes, el Programa de prescripción TOUCH tiene dos componentes: TOUCH para la EM (para pacientes con esclerosis múltiple) y TOUCH para la EC (para pacientes con enfermedad de Crohn). Los requisitos seleccionados del Programa de prescripción TOUCH incluyen lo siguiente: Los prescriptores deben tener certificación y cumplir con lo siguiente: Deben revisar los materiales educativos del Programa de prescripción TOUCH para los prescriptores, incluida la información completa de prescripción. Deben enseñar a los pacientes los beneficios y riesgos del tratamiento con TYSABRI, garantizar que los pacientes reciban la Guía de medicamentos y alentarlos a que hagan preguntas.
56 Deben revisar, completar y firmar el Formulario de inscripción para el prescriptor/paciente. Deben evaluar a los pacientes tres meses después de la primera infusión, seis meses después de la primera infusión, cada seis meses desde ese momento y durante al menos seis meses tras interrumpir TYSABRI. Deben determinar cada seis meses si los pacientes deben continuar con el tratamiento y, si es así, autorizar el tratamiento durante otros seis meses. Deben presentar ante Biogen el Cuestionario de nueva autorización y el Informe de estado del paciente de TYSABRI seis meses después de iniciar el tratamiento y cada seis meses desde ese momento. Deben completar un Cuestionario de interrupción inicial cuando se interrumpa TYSABRI y un Cuestionario de interrupción a los 6 meses tras la interrupción de TYSABRI. Se debe informar de casos de LMP, hospitalizaciones por infecciones oportunistas y muertes ante Biogen llamando al lo antes posible. Los pacientes deben inscribirse en el Programa de prescripción TOUCH, leer la Guía de medicamentos, comprender los riesgos asociados con TYSABRI y completar y firmar el Formulario de inscripción para el prescriptor/paciente. Las farmacias y los centros de infusión deben tener una certificación especial para entregar TYSABRI o administrar su infusión Meningitis y encefalitis por herpes TYSABRI aumenta el riesgo de desarrollar encefalitis y meningitis provocadas por los virus herpes simple y varicela zóster. Se ha informado de casos graves, posiblemente mortales y, en ocasiones, mortales en el contexto posterior a la comercialización en pacientes con esclerosis múltiple que recibieron TYSABRI. La confirmación del laboratorio en esos casos se basó en un resultado positivo de la RCP para el ADN del virus en el líquido cefalorraquídeo. La duración del tratamiento con TYSABRI antes del inicio varió de algunos meses a varios años. Controle a los pacientes que reciben TYSABRI para determinar si tienen signos y síntomas de meningitis y encefalitis. Si se produce meningitis o encefalitis por herpes, debe interrumpirse TYSABRI y debe suministrarse el tratamiento correspondiente para la meningitis/encefalitis por herpes Hepatotoxicidad Se ha informado de lesión hepática clínicamente significativa, que incluye insuficiencia hepática aguda que requirió trasplante, en pacientes tratados con TYSABRI en el contexto posterior a la comercialización. Los signos de lesión hepática, que incluyen niveles notablemente elevados de enzimas hepáticas séricas y bilirrubina total elevada, se produjeron tan solo seis días después de la primera dosis; también se ha informado de signos de lesión hepática por primera vez después de varias dosis. En algunos pacientes, la lesión hepática se reiteró posteriormente a una nueva exposición, lo cual ofrece evidencia de que TYSABRI causó la lesión. La combinación de niveles elevados de transaminasas y bilirrubina sin evidencia de obstrucción se reconoce
57 generalmente como un factor importante de predicción de la lesión hepática grave que puede provocar la muerte o la necesidad de un trasplante de hígado en algunos pacientes. Debe interrumpirse TYSABRI en pacientes con ictericia u otra evidencia de lesión hepática significativa (p. ej., evidencia de laboratorio) Hipersensibilidad/formación de anticuerpos Se han producido reacciones de hipersensibilidad en pacientes que recibieron TYSABRI, que incluyen reacciones sistémicas graves (p. ej., anafilaxia), que se produjeron con una incidencia de <1%. Estas reacciones ocurren generalmente dentro de las dos horas del inicio de la infusión. Los síntomas asociados con estas reacciones pueden incluir urticaria, mareos, fiebre, sarpullido, escalofríos, prurito, náuseas, sofocos, hipotensión, disnea y dolor en el pecho. En general, estas reacciones se asocian a los anticuerpos contra TYSABRI. Si se produce una reacción de hipersensibilidad, interrumpa la administración de TYSABRI e inicie el tratamiento correspondiente. Los pacientes que tienen una reacción de hipersensibilidad no deben recibir un nuevo tratamiento con TYSABRI. Las reacciones de hipersensibilidad fueron más frecuentes en pacientes con anticuerpos contra TYSABRI en comparación con los pacientes que no desarrollaron anticuerpos contra TYSABRI en estudios de la EM y de la EC. En consecuencia, la posibilidad de desarrollar anticuerpos contra TYSABRI debe considerarse en pacientes que tienen reacciones de hipersensibilidad [consulte Reacciones adversas (6.2)]. Análisis de anticuerpos: Si se sospecha la presencia de anticuerpos persistentes, debe hacerse un análisis de anticuerpos. Estos pueden detectarse y confirmarse con análisis de anticuerpos séricos secuenciales. Los anticuerpos detectados de manera temprana durante el tratamiento (p. ej., durante los primeros seis meses) pueden ser pasajeros y pueden desaparecer al continuar con la administración. Se recomienda repetir los análisis tres meses después de un resultado positivo inicial para confirmar que los anticuerpos persisten. Los prescriptores deben considerar todos los riesgos y beneficios de TYSABRI en un paciente con anticuerpos persistentes. Los pacientes que reciben TYSABRI durante una corta exposición (1 a 2 infusiones) seguida de un período extendido sin tratamiento tienen más riesgo de desarrollar anticuerpos contra el natalizumab y/o reacciones de hipersensibilidad al volver a exponerlos, en comparación con los pacientes que recibieron el tratamiento programado regularmente. Debido a que los pacientes con anticuerpos persistentes contra TYSABRI presentan una menor eficacia y que las reacciones de hipersensibilidad son más frecuentes en estos pacientes, debe considerarse analizar la presencia de anticuerpos en pacientes que deseen recomenzar la terapia tras una interrupción de la dosis. Después de un período de interrupción de la dosis, los pacientes con resultados negativos en los análisis de anticuerpos antes de una nueva administración de la dosis tienen un riesgo de desarrollo de anticuerpos con el nuevo tratamiento que es similar al de los pacientes que nunca recibieron TYSABRI [consulte Reacciones adversas (6.2)] Inmunodepresión/infecciones Los efectos de TYSABRI en el sistema inmunológico pueden aumentar el riesgo de infecciones. En el estudio EM1 [consulte Estudios clínicos (14.1)], ciertos tipos de infecciones, que incluyen neumonías e infecciones urinarias (entre ellas, casos graves), gastroenteritis, infecciones vaginales, infecciones dentales, amigdalitis e infecciones por herpes, se produjeron con más
58 frecuencia en pacientes tratados con TYSABRI que en pacientes tratados con placebo [consulte Advertencias y precauciones (5.1) y Reacciones adversas (6.1)]. Se observó una infección oportunista, una gastroenteritis prolongada por criptosporidios, en un paciente que recibió TYSABRI en el estudio EM1. En los estudios EM1 y EM2, se observó un aumento de las infecciones en pacientes que recibían de manera concurrente tratamientos breves con corticoesteroides. Sin embargo, el aumento de las infecciones en los pacientes tratados con TYSABRI que recibían esteroides fue similar al aumento en pacientes tratados con placebo que recibían esteroides. En estudios clínicos de la EC, se han observado infecciones oportunistas (neumonía por pneumocystis carinii, infección pulmonar por el complejo Mycobacterium avium-intracellulare, aspergilosis broncopulmonar e infección por burkholderia cepacia) en <1% de los pacientes tratados con TYSABRI; algunos de estos pacientes estaban recibiendo inmunodepresores de manera concurrente [consulte Advertencias y precauciones (5.1) y Reacciones adversas (6.1)]. En los estudios EC1 y EC2, se observó un aumento de las infecciones en los pacientes que recibían corticoesteroides de manera concurrente. Sin embargo, el aumento de las infecciones fue similar en los pacientes tratados con placebo y con TYSABRI que recibían esteroides. El uso concurrente de agentes antineoplásicos, inmunodepresores o inmunomoduladores puede aumentar aún más el riesgo de infecciones, que incluyen LMP y otras infecciones oportunistas, en relación con el riesgo observado con el uso de TYSABRI solo [consulte Advertencias y precauciones (5.1) y Reacciones adversas (6.1)]. No se han establecido la seguridad ni la eficacia de TYSABRI en combinación con agentes antineoplásicos, inmunodepresores o inmunomoduladores. Los pacientes que reciben una terapia inmunodepresora o una terapia inmunomoduladora crónica, o que tienen afecciones médicas sistémicas que afectan la función del sistema inmunológico de manera significativa, no deben recibir tratamiento con TYSABRI. El riesgo de contraer LMP también aumenta en pacientes que han recibido tratamiento con un inmunodepresor antes de recibir TYSABRI [consulte Advertencias y precauciones (5.1)]. En el caso de los pacientes con enfermedad de Crohn que comiencen el tratamiento con TYSABRI mientras reciben corticoesteroides de manera crónica, comience el retiro de los esteroides tan pronto como se obtenga un beneficio terapéutico. Si el paciente no puede interrumpir los corticoesteroides sistémicos dentro de los seis meses, interrumpa TYSABRI Anomalías en los análisis de laboratorio En los ensayos clínicos, se observó que TYSABRI induce aumentos en los linfocitos, monocitos, eosinófilos, basófilos y glóbulos rojos nucleados en circulación. Los cambios observados persistieron durante la exposición a TYSABRI, pero fueron reversibles y generalmente regresaron a los niveles iniciales dentro de las 16 semanas posteriores a la última dosis. No se observaron elevaciones de neutrófilos. TYSABRI induce leves reducciones en los niveles de hemoglobina (disminución media de 0.6 g/dl) que con frecuencia son pasajeros.
59 5.8. Vacunas No hay datos disponibles sobre los efectos de la vacunación en pacientes que recibieron TYSABRI. No hay datos disponibles sobre la transmisión secundaria de infecciones por vacunas elaboradas con microbios vivos en pacientes que recibieron TYSABRI. 6. REACCIONES ADVERSAS Las siguientes reacciones adversas graves se describen a continuación y en otro lugar de la ficha técnica: Leucoencefalopatía multifocal progresiva (LMP) [consulte Advertencias y precauciones (5.1)] Hipersensibilidad [consulte Advertencias y precauciones (5.5)] Inmunodepresión/infecciones [consulte Advertencias y precauciones (5.6)] 6.1. Experiencia en ensayos clínicos Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variadas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y puede que no reflejen las tasas observadas en la práctica. Las reacciones adversas más frecuentes (incidencia 10%) fueron dolor de cabeza y fatiga en ambos estudios, de esclerosis múltiple (EM) y enfermedad de Crohn (EC). Otras reacciones adversas frecuentes (incidencia 10%) en la población de EM fueron artralgia, infección urinaria, infección de las vías respiratorias bajas, gastroenteritis, vaginitis, depresión, dolor en las extremidades, molestia abdominal, diarrea sin especificación y sarpullido. Otras reacciones adversas frecuentes (incidencia 10%) en la población de EC fueron infecciones de las vías respiratorias altas y náuseas. Las reacciones adversas informadas con más frecuencia que dieron lugar a una intervención clínica (es decir, interrupción de TYSABRI) en los estudios de la EM fueron urticaria (1%) y otras reacciones de hipersensibilidad (1%), y en los estudios de la EC (estudios EC1 y EC2) fueron exacerbación de la enfermedad de Crohn (4.2%) y reacciones de hipersensibilidad agudas (1.5%) [consulte Advertencias y precauciones (5.5)]. En total 1617 pacientes con esclerosis múltiple en estudios controlados recibieron TYSABRI, con una duración mediana de exposición de 28 meses. En total 1563 pacientes recibieron TYSABRI en todos los estudios de la EC para una exposición mediana de 5 meses; de estos pacientes, el 33% (n = 518) recibió al menos un año de tratamiento y el 19% (n = 297) recibió al menos dos años de tratamiento.
60 Estudios clínicos de la esclerosis múltiple Las reacciones adversas graves más frecuentes en el estudio EM1 [consulte Estudios clínicos (14.1)] con TYSABRI fueron infecciones (3.2% frente a 2.6% en el grupo de placebo, incluidas infecciones urinarias [0.8% frente a 0.3%] y neumonía [0.6% frente a 0%]), reacciones de hipersensibilidad aguda (1.1% frente a 0.3%, incluidas anafilaxia/reacción anafilactoide [0.8% frente a 0%]), depresión (1.0% frente a 1.0%, incluidos intento de suicidio o ideación suicida [0.6% frente a 0.3%]) y colelitiasis (1.0% frente a 0.3%). En el estudio EM2, las reacciones adversas graves de apendicitis también fueron más frecuentes en pacientes que recibieron TYSABRI (0.8% frente a 0.2% en el grupo de placebo). La Tabla 2 enumera las reacciones adversas y anomalías de laboratorio seleccionadas que se produjeron en el estudio EM1 con una incidencia de al menos 1 punto porcentual más en pacientes tratados con TYSABRI que la observada en los pacientes tratados con placebo.
61 Tabla 2: Reacciones adversas en el estudio EM1 (estudio de monoterapia) Reacciones adversas (Término preferido) Generales Dolor de cabeza Fatiga Artralgia Molestia en el pecho Reacciones de hipersensibilidad aguda** Otras reacciones de hipersensibilidad** Alergia estacional Escalofríos Aumento de peso Pérdida de peso TYSABRI n = 627 % Placebo n = 312 % <1 2 2 <1 <1 <1 Infecciones Infección urinaria Infección de las vías respiratorias bajas Gastroenteritis Vaginitis* Infecciones dentales Herpes Amigdalitis Trastornos psiquiátricos Depresión Trastornos musculoesqueléticos/del tejido conjuntivo Dolor en las extremidades Calambre muscular Hinchazón articular
62 Reacciones adversas (Término preferido) Eventos gastrointestinales Molestia abdominal Diarrea sin especificación Prueba de la función hepática anormal Trastornos de la piel Sarpullido Dermatitis Prurito Sudoraciones nocturnas Trastornos menstruales* Menstruación irregular Dismenorrea Amenorrea Quiste de ovario Trastornos neurológicos Somnolencia Vértigo TYSABRI n = 627 % Placebo n = 312 % <1 1 <1 <1 5 Trastornos renales y urinarios Incontinencia urinaria Micción urgente/frecuente Lesiones Lesión en las extremidades sin especificación Laceración de la piel Quemadura térmica * Porcentaje basado solo en pacientes de sexo femenino. ** Las reacciones de hipersensibilidad aguda frente a otras reacciones de hipersensibilidad se definen como producidas dentro de las 2 horas posteriores a la infusión frente a más de 2 horas desde la infusión <1 <1 En el estudio EM2, el edema periférico fue más frecuente en pacientes que recibieron TYSABRI (5% frente a 1% en el grupo de placebo).
63 Estudios clínicos de la enfermedad de Crohn Las siguientes reacciones adversas graves en la inducción de estudios EC1 y EC2 [consulte Estudios clínicos (14.2)] se informaron con mayor frecuencia con TYSABRI que en el grupo de placebo y ocurrió en una incidencia de al menos 0.3%: obstrucción o estenosis intestinal (2% frente a 1% en el grupo de placebo), reacciones de hipersensibilidad aguda (0.5% frente a 0%), adhesiones abdominales (0.3% frente a 0%), y colelitiasis (0.3% frente a 0%). Se observaron reacciones adversas graves similares en el estudio de mantenimiento EC3. La Tabla 3 enumera las reacciones adversas que se produjeron en los estudios EC1 y EC2 (exposición mediana de 2.8 meses). La Tabla 4 enumera las reacciones adversas que se produjeron en el estudio EC3 (exposición mediana de 11.0 meses).
64 Tabla 3: Reacciones adversas* Reacciones adversas en los estudios EC1 y EC2 (estudios de inducción) Generales Dolor de cabeza Fatiga Artralgia Enfermedad similar a la gripe Reacciones de hipersensibilidad aguda Temblores TYSABRI n = 983 % Placebo n = 431 % <1 <1 Infecciones Infección de las vías respiratorias altas Infecciones vaginales ** Infección viral Infección urinaria Infección respiratoria Dolor faringolaringeo Tos Eventos gastrointestinales Náuseas Dispepsia Estreñimiento Flatulencias Estomatitis aftosa Trastornos de la piel Sarpullido Sequedad de la piel Trastorno menstrual Dismenorrea ** < <1 4 0 <1 * Se produjeron con una incidencia de al menos un 1% más en los pacientes tratados con TYSABRI que en los pacientes tratados con placebo. ** Porcentaje basado solo en pacientes de sexo femenino.
65 Tabla 4: Reacciones adversas* Reacciones adversas en el estudio EC3 (estudio de mantenimiento) Generales Dolor de cabeza Enfermedad similar a la gripe Dolor de muelas Edema periférico TYSABRI n = 214 % Placebo n = 214 % 31 6 <1 3 Infecciones Gripe Sinusitis Infección viral Infecciones vaginales ** Infección respiratoria Tos Eventos gastrointestinales Dolor abdominal inferior Trastornos musculoesqueléticos y del tejido conjuntivo Dolor de espalda Trastorno menstrual Dismenorrea ** < * Se produjeron con una incidencia de al menos un 2% más en los pacientes tratados con TYSABRI que en los pacientes tratados con placebo. ** Porcentaje basado solo en pacientes de sexo femenino. Infecciones Se produjo leucoencefalopatía multifocal progresiva (LMP) en tres pacientes que recibieron TYSABRI en ensayos clínicos [consulte Advertencias y precauciones (5.1)]. Se observaron dos casos de LMP en los 1869 pacientes con esclerosis múltiple tratados durante una mediana de 120 semanas. Estos dos pacientes habían recibido TYSABRI además de interferón beta-1a [consulte Advertencias y precauciones (5.1)]. El tercer caso se produjo después de ocho dosis en uno de los 1043 pacientes con enfermedad de Crohn que fueron evaluados para determinar si tenían LMP. En el contexto posterior a la comercialización, se informaron casos adicionales de LMP en pacientes con esclerosis múltiple y enfermedad de Crohn tratados con TYSABRI que no recibían una terapia inmunomoduladora concomitante. En los estudios EM1 y EM2 [consulte Estudios clínicos (14.1)], la tasa de cualquier tipo de infección fue de aproximadamente 1.5 por años-paciente en pacientes tratados tanto con TYSABRI como con placebo. Las infecciones fueron principalmente infecciones de las vías
66 respiratorias altas, gripe e infecciones urinarias. En el estudio EM1, la incidencia de infecciones graves fue de aproximadamente el 3% en pacientes tratados con TYSABRI y con placebo. La mayoría de los pacientes no interrumpió el tratamiento con TYSABRI durante las infecciones. La única infección oportunista en los ensayos clínicos de la esclerosis múltiple fue un caso de gastroenteritis prolongada por criptosporidios. En los estudios EC1 y EC2 [consulte Estudios clínicos (14.2)], la tasa de cualquier tipo de infección fue de aproximadamente 1.7 por años-paciente en los pacientes tratados con TYSABRI y de 1.4 por años-paciente en los pacientes tratados con placebo. En el estudio EC3, la incidencia de cualquier tipo de infección fue 1.7 por años-paciente en los pacientes tratados con TYSABRI y fue similar en los pacientes tratados con placebo. Las infecciones más frecuentes fueron nasofaringitis, infección de las vías respiratorias altas y gripe. La mayoría de los pacientes no interrumpió la terapia con TYSABRI durante las infecciones y se recuperó con el tratamiento correspondiente. El uso concurrente de TYSABRI en ensayos clínicos de la EC con esteroides crónicos o metotrexato, 6-MP y azatioprina no generó un aumento en las infecciones generales en comparación con TYSABRI solo; no obstante, el uso concomitante de dichos agentes podría generar un mayor riesgo de infecciones graves. En los estudios EC1 y EC2, la incidencia de infecciones graves fue de aproximadamente el 2.1% en pacientes tratados con TYSABRI y con placebo. En el estudio EC3, la incidencia de infecciones graves fue de aproximadamente el 3.3% en pacientes tratados con TYSABRI y de alrededor del 2.8% en los pacientes tratados con placebo. En estudios clínicos de la EC, se han observado infecciones oportunistas (neumonía por pneumocystis carinii, infección pulmonar por el complejo Mycobacterium avium-intracellulare, aspergilosis broncopulmonar e infección por burkholderia cepacia) en <1% de los pacientes tratados con TYSABRI; algunos de estos pacientes estaban recibiendo inmunodepresores de manera concurrente [consulte Advertencias y precauciones (5.6)]. Se produjeron dos casos graves de meningitis no bacteriana en pacientes tratados con TYSABRI en comparación con ninguno en los pacientes tratados con placebo. Reacciones relacionadas con la infusión Una reacción relacionada con la infusión se definió en los ensayos clínicos como cualquier evento adverso que se produce dentro de las dos horas del inicio de una infusión. En los ensayos clínicos de la EM, aproximadamente el 24% de los pacientes con esclerosis múltiple tratados con TYSABRI tuvo una reacción relacionada con la infusión, en comparación con el 18% de los pacientes tratados con placebo. En los ensayos clínicos controlados de la EC, se produjeron reacciones relacionadas con la infusión en aproximadamente el 11% de los pacientes tratados con TYSABRI en comparación con el 7% de los pacientes tratados con placebo. Las reacciones más frecuentes en los pacientes con EM tratados con TYSABRI en comparación con los pacientes con EM tratados con placebo incluyen dolor de cabeza, mareos, fatiga, urticaria, prurito y escalofríos. Se observó urticaria aguda en aproximadamente el 2% de los pacientes. Se observaron otras reacciones de hipersensibilidad en el 1% de los pacientes que recibieron TYSABRI. Se produjeron reacciones de hipersensibilidad sistémica grave a la infusión en <1% de los pacientes [consulte Advertencias y precauciones (5.5)]. Todos los pacientes se recuperaron con tratamiento y con la interrupción de la infusión.
67 Las reacciones relacionadas con la infusión que fueron más frecuentes en los pacientes con EC que recibieron TYSABRI que en aquellos que recibieron placebo incluyeron dolor de cabeza, náuseas, urticaria, prurito y sofocos. Se produjeron reacciones graves a la infusión en los estudios EC1, EC2 y EC3 con una incidencia de <1% en los pacientes tratados con TYSABRI. Los pacientes con EM y EC que comenzaron a tener resultados positivos persistentes en los análisis de anticuerpos contra TYSABRI fueron más propensos a tener una reacción relacionada con la infusión que aquellos que tenían resultados negativos Inmunogenicidad A los pacientes del estudio EM1 [consulte Estudios clínicos (14.1)] se les hicieron análisis de anticuerpos contra el natalizumab cada 12 semanas. Los ensayos usados no pudieron detectar niveles bajos a moderados de anticuerpos contra el natalizumab. Aproximadamente el 9% de los pacientes que recibieron TYSABRI desarrollaron anticuerpos detectables, al menos una vez durante el tratamiento. Cerca del 6% de los pacientes tuvo resultados positivos al anticuerpo en más de una ocasión. Alrededor del 82% de los pacientes que tuvieron resultados positivos persistentes al anticuerpo desarrolló anticuerpos detectables al cabo de 12 semanas. Los anticuerpos contra el natalizumab fueron neutralizantes in vitro. La presencia de anticuerpos contra el natalizumab estuvo correlacionada con una reducción en los niveles séricos de natalizumab. En el estudio EM1, la concentración sérica media de natalizumab previa a la infusión de la semana 12 en pacientes con resultados negativos al anticuerpo fue 15 mcg/ml en comparación con 1.3 mcg/ml en pacientes con resultados positivos al anticuerpo. La persistencia de resultados positivos al anticuerpo generó una disminución sustancial en la eficacia de TYSABRI. El riesgo de una mayor discapacidad y la tasa de recaídas anualizada fueron similares en los pacientes tratados con TYSABRI y en los pacientes que recibieron placebo con persistencia de resultados positivos al anticuerpo. También se observó un fenómeno similar en el estudio EM2. Las reacciones relacionadas con la infusión que se asociaron con mayor frecuencia con la persistencia de resultados positivos al anticuerpo incluyeron urticaria, escalofríos, náuseas, vómitos, dolor de cabeza, sofocos, mareos, prurito, temblores, sensación de frío y pirexia. Otras reacciones adversas más frecuentes en pacientes con persistencia de resultados positivos al anticuerpo incluyeron mialgia, hipertensión, disnea, ansiedad y taquicardia. A los pacientes de los estudios de la EC [consulte Estudios clínicos (14.2)] se les hizo el primer análisis de anticuerpos en la semana 12 y, en una importante proporción de pacientes, este fue el único análisis realizado, dada la duración de 12 semanas de los estudios controlados con placebo. Se determinó que aproximadamente el 10% de los pacientes tenía anticuerpos contra el natalizumab en al menos una ocasión. El 5% de los pacientes tuvo resultados positivos al anticuerpo en más de una ocasión. La persistencia de los anticuerpos generó una reducción de la eficacia y un aumento de las reacciones relacionadas con la infusión con síntomas que incluyen urticaria, prurito, náuseas, sofocos y disnea. Se desconocen la inmunogenicidad a largo plazo de TYSABRI y los efectos de niveles bajos a moderados de anticuerpo contra el natalizumab [consulte Advertencias y precauciones (5.5) y Reacciones adversas (6.1)].
68 Los datos sobre la inmunogenicidad dependen en gran parte de la sensibilidad y la especificidad del ensayo. Además, la incidencia observada de positividad de anticuerpos en un ensayo puede verse afectada por varios factores, que incluyen la manipulación de las muestras, el cronograma de recogida de muestras, los medicamentos concomitantes y la enfermedad subyacente. Por estas razones, la comparación de la incidencia de los anticuerpos contra TYSABRI con la incidencia de los anticuerpos contra otros productos puede llevar a conclusiones erradas. 7. INTERACCIONES FARMACOLÓGICAS Dado el potencial de mayor riesgo de desarrollar LMP y otras infecciones, los pacientes con enfermedad de Crohn que recibieron TYSABRI no deben ser tratados con inmunodepresores concomitantes (p. ej., 6-mercaptopurina, azatioprina, ciclosporina o metotrexato) ni con inhibidores del FNT-α; asimismo, deben reducirse los corticoesteroides en aquellos pacientes con enfermedad de Crohn que usan corticoesteroides de manera crónica cuando comiencen la terapia con TYSABRI [consulte Indicaciones y uso (1.2) y Advertencias y precauciones (5.1, 5.6)]. Generalmente, los pacientes con EM que reciben tratamiento inmunodepresor o inmunomodulador crónico no deben tratarse con TYSABRI [consulte Indicaciones y uso (1.1) y Advertencias y precauciones (5.1, 5.6)]. 8. USO EN POBLACIONES ESPECÍFICAS 8.1. Embarazo Categoría C para el embarazo. Se ha demostrado que TYSABRI reduce la supervivencia de las crías de conejillos de Indias cuando se administra en dosis de 7 veces la dosis para seres humanos y se ha demostrado que tiene efectos hematológicos en los fetos de monos cuando se administra en dosis de 2.3 veces la dosis para seres humanos [consulte Toxicología no clínica (13.2)]. No hay estudios adecuados ni bien controlados en embarazadas. TYSABRI debe usarse durante el embarazo únicamente si el posible beneficio justifica el posible riesgo para el feto Madres lactantes Se ha detectado TYSABRI en la leche humana. Se desconocen los efectos de esta exposición en el lactante Uso pediátrico No se ha establecido la seguridad ni la efectividad de TYSABRI en pacientes pediátricos con esclerosis múltiple o enfermedad de Crohn en menores de 18 años. TYSABRI no está indicado para usar en pacientes pediátricos Uso geriátrico En los estudios clínicos de TYSABRI no se incluyó una cantidad suficiente de pacientes de más de 65 años para determinar si responden de manera diferente a los pacientes más jóvenes. Otra experiencia clínica informada no identificó diferencias en las respuestas entre pacientes mayores y más jóvenes.
69 10. SOBREDOSIS No se ha evaluado la seguridad de las dosis mayores de 300 mg. No se ha determinado la cantidad máxima de TYSABRI que puede administrarse de manera segura. 11. DESCRIPCIÓN TYSABRI (natalizumab) es un anticuerpo monoclonal IgG4κ humanizado recombinante producido en células de mieloma murino. Natalizumab contiene regiones FW humanas y las regiones determinantes de complementariedad de un anticuerpo murino que se une a α4-integrina. El peso molecular de natalizumab es 149 kilodalton. TYSABRI se suministra como un concentrado estéril, incoloro y de transparente a ligeramente opalescente para infusión intravenosa. Cada dosis de 15 ml contiene 300 mg de natalizumab; 123 mg de cloruro de sodio, conforme a la USP; 17.0 mg de fosfato de sodio, monobásico, monohidrato, conforme a la USP; 7.24 mg de fosfato de sodio, dibásico, heptahidrato, conforme a la USP; 3.0 mg de polisorbato 80, conforme a la USP/NF, en agua para inyección, conforme a la USP, con un ph de FARMACOLOGÍA CLÍNICA Mecanismo de acción Natalizumab se une a la subunidad α4 de las integrinas α4β1 y α4β7 expresadas en la superficie de todos los leucocitos, excepto los neutrófilos, e inhibe la adhesión mediada por α4 de los leucocitos a sus contrarreceptores. Los receptores de la familia α4 de las integrinas incluyen la molécula de adhesión a las células vasculares-1 (vascular cell adhesion molecule-1, VCAM-1), que se expresa en el endotelio vascular activado, y la molécula de adhesión celular adresina de la mucosa-1 (mucosal addressin cell adhesion molecule-1, MAdCAM-1) presentes en las células endoteliales vasculares del tubo digestivo. La alteración de estas interacciones moleculares evita la transmigración de los leucocitos a través del endotelio hacia el tejido parenquimatoso inflamado. In vitro, los anticuerpos anti-α4-integrina también bloquean la unión celular a los ligandos mediada por α4, como osteopontina y un dominio unido de forma alternativa de fibronectina, el segmento conector-1 (connecting segment-1, CS-1). In vivo, natalizumab además puede actuar para inhibir la interacción de leucocitos que expresan α4 con sus ligandos en la matriz extracelular y en hepatocitos, por lo cual inhibe aún más la actividad inflamatoria y de reclutamiento de las células inmunitarias activadas. Todavía no se definieron por completo los mecanismos específicos mediante los cuales TYSABRI ejerce sus efectos en la esclerosis múltiple y en la enfermedad de Crohn. En la esclerosis múltiple, se cree que las lesiones se producen cuando las células inflamatorias activadas, que incluyen linfocitos T, cruzan la barrera hematoencefálica (BHE). La migración de leucocitos a través de la BHE involucra la interacción entre las moléculas de adhesión de las células inflamatorias y de sus contrarreceptores presentes en las células endoteliales de la pared del vaso. El efecto clínico de natalizumab en la esclerosis múltiple puede ser secundario al bloqueo de la interacción molecular de la α4β1-integrina expresada por células inflamatorias con la VCAM-1 en células endoteliales vasculares y con el CS-1 u osteopontina expresada por
70 hepatocitos en el cerebro. Los datos de un modelo experimental de esclerosis múltiple en animales con encefalitis autoinmunitaria demuestran una reducción de la migración de leucocitos al parénquima cerebral y una reducción de la formación de placa detectada mediante resonancia magnética (IRM) tras la administración repetida de natalizumab. Se desconoce la significación clínica de estos datos derivados de animales. En la enfermedad de Crohn, la interacción de la α4β7-integrina con el receptor endotelial MAdCAM-1 se ha implicado como un factor importante que contribuye a la inflamación crónica, que es un aspecto distintivo de la enfermedad. La MAdCAM-1 se expresa principalmente en las células endoteliales intestinales y desempeña un rol fundamental en la migración de los linfocitos T hacia el tejido linfático intestinal que se encuentra en las placas de Peyer. Se ha determinado que la expresión de la MAdCAM-1 aumenta en los sitios activos de inflamación en pacientes con EC, lo cual sugiere que posiblemente desempeñe un rol en el reclutamiento de leucocitos hacia la mucosa y contribuya a la respuesta inflamatoria característica de la EC. En consecuencia, el efecto clínico de natalizumab en la EC puede ser secundario al bloqueo de la interacción molecular del receptor de la α4ß7-integrina con la MAdCAM-1 expresada en el endotelio venular en los focos inflamatorios. Se ha determinado que la expresión de la VCAM-1 se regula de manera ascendente en las células endoteliales colónicas en un modelo murino de EII y parece desempeñar un rol importante en el reclutamiento de leucocitos hacia sitios de inflamación. No obstante, el rol de la VCAM-1 en la EC no es claro Farmacodinámica La administración de TYSABRI aumenta la cantidad de leucocitos en circulación (que incluyen linfocitos, monocitos, basófilos y eosinófilos) debido a la inhibición de transmigración fuera del espacio vascular. TYSABRI no afecta el recuento absoluto de neutrófilos en circulación [consulte Advertencias y precauciones (5.7)] Farmacocinética Pacientes con esclerosis múltiple (EM): En pacientes con EM, tras la administración intravenosa repetida de una dosis de 300 mg de TYSABRI, la concentración sérica observada máxima media ± DE fue 110 ± 52 mcg/ml. Las concentraciones mínimas medias promedio en estado estable variaron de 23 mcg/ml a 29 mcg/ml. El tiempo observado hasta el estado estable fue aproximadamente 24 semanas después de cada cuatro semanas de administración de la dosis. La semivida media ± DE, el volumen de distribución y la depuración de natalizumab fueron 11 ± 4 días, 5.7 ± 1.9 l y 16 ± 5 ml/hora, respectivamente. Se investigaron los efectos de las covariables, como el peso corporal, la edad, el sexo y la presencia de anticuerpos contra el natalizumab en la farmacocinética de natalizumab en un estudio de farmacocinética de población (n = 2195). La depuración de natalizumab aumentó con el peso corporal de manera menor a la proporcional, por ejemplo, un aumento del 43% en el peso corporal generó un aumento del 32% en la depuración. La presencia de anticuerpos contra el natalizumab persistentes aumentaron la depuración de natalizumab aproximadamente 3 veces [consulte Reacciones adversas (6.2)].
71 Pacientes con enfermedad de Crohn (EC): En pacientes con EC, tras la administración intravenosa repetida de una dosis de 300 mg de TYSABRI, la concentración sérica observada máxima media ± DE fue 101 ± 34 mcg/ml. La concentración mínima promedio media ± DE en estado estable fue 10 ± 9 mcg/ml. El tiempo estimado hasta el estado estable fue aproximadamente de 16 a 24 semanas después de cada cuatro semanas de administración de la dosis. La semivida media ± DE, el volumen de distribución y la depuración de natalizumab fueron 10 ± 7 días, 5.2 ± 2.8 l y 22 ± 22 ml/hora, respectivamente. Se investigaron los efectos del peso corporal total, la edad, el sexo, la raza, la hematología seleccionada y las mediciones de química sérica, los medicamentos coadministrados (infliximab, inmunodepresores o esteroides) y la presencia de anticuerpos contra el natalizumab en un análisis de farmacocinética de población (n = 1156). Se observó que la presencia de anticuerpos contra el natalizumab aumentó la depuración de natalizumab [consulte Reacciones adversas (6.2)]. No se estudió la farmacocinética de natalizumab en pacientes con insuficiencia renal o hepática. 13. TOXICOLOGÍA NO CLÍNICA Carcinogénesis, mutagénesis, alteración de la fertilidad No se observaron efectos clastógenos ni mutágenos de natalizumab en el ensayo de Ames ni en el ensayo de aberraciones cromosómicas in vitro en linfocitos humanos. Natalizumab no mostró efectos en los ensayos in vitro de citotoxicidad/proliferación en líneas tumorales humanas positivas para la α4-integrina. Modelos de xenotrasplante en ratones sin pelaje y con IDCG con dos líneas tumorales humanas positivas para la α4-integrina (leucemia, melanoma) no demostraron un aumento de las tasas de crecimiento tumoral ni de metástasis que derivan del tratamiento con natalizumab. Se observaron reducciones en la fertilidad de conejillos de Indias hembra en un estudio con una dosis de 30 mg/kg, pero no con el nivel de dosis de 10 mg/kg (2.3 veces la dosis clínica). Se observó una reducción del 47% en la preñez de conejillos de Indias que recibieron 30 mg/kg en relación con el control. Se observaron implantaciones solo en el 36% de los animales que tienen cuerpos lúteos en el grupo de 30 mg/kg frente a entre el 66 y 72% en los demás grupos. Natalizumab no afectó la fertilidad masculina con dosis de hasta 7 veces la dosis clínica Toxicología o farmacología en animales En estudios reproductivos realizados en monos y conejillos de Indias, no hubo evidencia de efectos teratogénicos con dosis de hasta 30 mg/kg (7 veces la dosis clínica para seres humanos en función de una comparación del peso corporal). En un estudio en el que conejillos de Indias hembra estuvieron expuestas a natalizumab durante la segunda mitad de la preñez, se observó una pequeña reducción en la supervivencia de las crías el día 14 después del nacimiento con respecto al control (3 crías/camada para el grupo tratado con 30 mg/kg de natalizumab y 4.3 crías/camada para el grupo de control). En uno de cinco estudios en los que se expusieron
72 monas o conejillos de Indias hembra durante la preñez, la cantidad de abortos en monas tratadas (30 mg/kg) fue del 33% frente al 17% en los controles. No se observaron efectos en las tasas de abortos en ningún otro estudio. TYSABRI atravesó la placenta y produjo una exposición en el útero en macacos y conejillos de Indias en desarrollo. Cuando las madres preñadas fueron expuestas a natalizumab a aproximadamente 7 veces la dosis clínica, los niveles séricos en fetos animales durante el parto fueron aproximadamente del 35% de los niveles séricos maternos de natalizumab. Un estudio en macacos preñadas tratadas con 2.3 veces la dosis clínica demostró cambios relacionados con natalizumab en el feto. Estos cambios incluyeron anemia leve, reducción en el recuento de plaquetas, aumento del peso del bazo y pérdida de peso del hígado y del timo asociados con un aumento de la hematopoyesis extramedular esplénica, atrofia tímica y reducción de la hematopoyesis hepática. En crías nacidas de madres tratadas con natalizumab a una dosis 7 veces la dosis clínica también se redujeron los recuentos plaquetarios. Este efecto se revirtió posteriormente a la depuración de natalizumab. No hubo evidencia de anemia en estas crías. Las crías expuestas en el útero y a través de la leche materna no tuvieron cambios relacionados con natalizumab en los órganos linfáticos y tuvieron una respuesta inmunitaria normal a la exposición con un antígeno dependiente de los linfocitos. 14. ESTUDIOS CLÍNICOS Esclerosis múltiple TYSABRI se evaluó en dos ensayos aleatorizados, doble ciegos, controlados con placebo en pacientes con esclerosis múltiple. En ambos estudios se inscribieron pacientes que tuvieron, al menos, una recaída clínica durante el año anterior y tuvieron un puntaje en la Escala ampliada del estado de discapacidad (Expanded Disability Status Scale, EDSS) de Kurtzke de entre 0 y 5.0. En la Tabla 5 y Tabla 6, se muestran los resultados para cada estudio. La mediana del tiempo en que se recibió el fármaco del estudio fue 120 semanas en cada estudio. En ambos estudios, se hicieron evaluaciones neurológicas cada 12 semanas y en el momento de una presunta recaída. Anualmente se hicieron evaluaciones mediante resonancia magnética de lesiones hiperintensas T2 y lesiones con ponderación T1 y contraste con gadolinio (Gd). En el estudio EM1 se inscribieron pacientes que no habían recibido ningún interferón-beta ni acetato de glatirámero durante al menos los 6 meses previos; aproximadamente el 94% nunca había recibido tratamiento con estos agentes. La mediana de la edad fue de 37 años, con una duración mediana de la enfermedad de 5 años. Se aleatorizaron los pacientes en una proporción de 2:1 para recibir TYSABRI 300 mg de infusión intravenosa (n = 627) o placebo (n = 315) cada 4 semanas durante un máximo de 28 meses (30 infusiones). En el estudio EM2 se inscribieron pacientes que habían tenido una o más recaídas mientras estaban en tratamiento con AVONEX (interferón beta-1a) 30 mcg por vía intramuscular (IM) una vez a la semana durante el año anterior al ingreso en el estudio. La mediana de la edad fue de 39 años, con una duración mediana de la enfermedad de 7 años. Se aleatorizaron los pacientes de manera proporcionada para recibir TYSABRI 300 mg (n = 589) o placebo (n = 582) cada 4 semanas durante un máximo de 28 meses (30 infusiones). Todos los pacientes continuaron recibiendo AVONEX 30 mcg IM una vez a la semana. La eficacia de TYSABRI solo no se comparó con la eficacia de TYSABRI más AVONEX.
73 El criterio de valoración principal a 2 años fue el tiempo hasta el inicio del aumento sostenido en la discapacidad, que se define como un aumento de al menos 1 punto en la EDSS desde la EDSS inicial 1.0 que fue sostenido durante 12 semanas o un aumento de al menos 1.5 puntos en la EDSS desde la EDSS inicial = 0 que fue sostenido durante 12 semanas. El tiempo hasta el inicio del aumento sostenido en la discapacidad fue mayor en los pacientes tratados con TYSABRI que en los pacientes tratados con placebo en los estudios EM1 (Figura 1) y EM2. La proporción de pacientes con aumento en la discapacidad y la tasa de recaídas anualizada también fueron más bajas en los pacientes tratados con TYSABRI que en los pacientes tratados con placebo en los estudios EM1 y EM2 (Tabla 5 y Tabla 6). Tabla 5: Criterios de valoración clínicos y de IRM en el estudio EM1 (estudio de monoterapia) a 2 años TYSABRI Placebo n = 627 n = 315 CRITERIOS DE VALORACIÓN CLÍNICOS Porcentaje con aumento sostenido en la discapacidad 17% 29% Reducción relativa del riesgo Tasa de recaídas anualizada Reducción relativa (porcentaje) Porcentaje de pacientes que no tuvo recaídas 42% (IC del 95%: 23%, 57%) % 67% 41% CRITERIOS DE VALORACIÓN DE IRM Lesiones hiperintensas T2 nuevas o con hipertrofia reciente Mediana Porcentaje de pacientes con*: 0 lesiones 1 lesión 2 lesiones 3 o más lesiones Lesiones con contraste con Gadolinio Mediana Porcentaje de pacientes con: 0 lesiones 1 lesión 2 o más lesiones % 15% 17% 10% 8% 8% 18% 68% % 72% 2% 12% 1% 16% Todos los análisis fueron según la intención de tratamiento. Para cada criterio de valoración, p < Determinación de los valores de p: Aumento en la discapacidad según el modelo de riesgos proporcional de Cox ajustado para la edad y la EDSS inicial; tasa de recaídas según la regresión de Poisson ajustada para la tasa de recaídas inicial, la EDSS, la presencia de lesiones
74 con contraste con Gadolinio y la edad; porcentaje que no tuvo recaídas según la regresión logística ajustada para la tasa de recaídas inicial; y número de lesiones según la regresión logística ordinal ajustada para el número de lesiones inicial. La tasa de recaídas anualizada se calcula como el número de recaídas para cada sujeto dividido por el número de años de seguimiento en el estudio para ese sujeto. El valor informado es la media de todos los sujetos. *Los valores no ascienden a un total del 100% debido al redondeo. Tabla 6: Criterios de valoración clínicos y de IRM en el estudio EM2 (estudio complementario) a 2 años TYSABRI Placebo más AVONEX más AVONEX n = 589 n = 582 CRITERIOS DE VALORACIÓN CLÍNICOS Porcentaje con aumento sostenido en la discapacidad 23% 29% Reducción relativa del riesgo Tasa de recaídas anualizada Reducción relativa (porcentaje) Porcentaje de pacientes que no tuvo recaídas 24% (IC del 95%: 4%, 39%) % 54% 32% CRITERIOS DE VALORACIÓN DE IRM Lesiones hiperintensas T2 nuevas o con hipertrofia reciente Mediana Porcentaje de pacientes con*: 0 lesiones 1 lesión 2 lesiones 3 o más lesiones Lesiones con contraste con Gadolinio Mediana Porcentaje de pacientes con*: 0 lesiones 1 lesión 2 o más lesiones % 30% 13% 9% 7% 10% 14% 50% % 75% 2% 12% 1% 14% Todos los análisis fueron según la intención de tratamiento. Para la acumulación de discapacidad: p = 0.024; para todos los demás criterios de valoración: p < Determinación de los valores de p:aumento en la discapacidad según el modelo de riesgos proporcional de Cox ajustado para la EDSS inicial; tasa de recaídas según la regresión de Poisson ajustada para la tasa de recaídas inicial, la EDSS, la presencia de lesiones con contraste con Gadolinio y la edad; porcentaje que no tuvo recaídas según la regresión logística ajustada para la tasa de recaídas inicial; y número de lesiones según la regresión logística ordinal ajustada para el número de lesiones inicial. La tasa de recaídas anualizada se calcula como el número de recaídas para cada sujeto dividido por el número de años de seguimiento en el estudio para ese sujeto. El valor informado es la media de todos los sujetos. *Los valores no ascienden a un total del 100% debido al redondeo.
75 Figura 1: Tiempo hasta el aumento en la discapacidad sostenido durante 12 semanas en el estudio EM1 Valor de p < Proporción con aumento sostenido en la discapacidad Tiempo en tratamiento (semanas) Enfermedad de Crohn Se evaluaron la eficacia y seguridad de TYSABRI en tres ensayos clínicos aleatorizados, doble ciegos, controlados con placebo en 1414 pacientes adultos con enfermedad de Crohn moderada a gravemente activa (índice de actividad de la enfermedad de Crohn [IAEC] 220 y 450) [consulte Referencias (15)]. No se permitió el uso de inhibidores del FNT-α concomitantes. Se permitieron dosis estables concomitantes de aminosalicilatos, corticoesteroides y/o inmunodepresores (p. ej., 6-mercatopurina, azatioprina o metotrexato) y el 89% de los pacientes continuó recibiendo al menos uno de estos medicamentos. Si bien está permitido en los ensayos clínicos, no se recomienda combinar la terapia con inmunodepresores [consulte Indicaciones y uso (1.2)]. En total, aproximadamente dos tercios de los pacientes no estaban tomando inmunodepresores concomitantes y cerca de un tercio de los pacientes no estaban tomando inmunodepresores ni corticoesteroides concomitantes. Se evaluó la inducción de la respuesta clínica (que se define como una reducción de 70 puntos en el IAEC desde el inicio) en dos estudios. En el estudio EC1, se aleatorizaron 896 pacientes en una proporción de 4:1 para recibir tres infusiones mensuales de 300 mg de TYSABRI o placebo. Se evaluaron los resultados clínicos en la semana 10 y los pacientes con información incompleta se consideraron sin respuesta clínica. En la semana 10, el 56% de los 717 pacientes que recibieron TYSABRI lograron una respuesta en comparación con el 49% de los 179 pacientes que recibieron placebo (efecto del tratamiento: 7%; intervalo de confianza [IC] del 95%: [-1%, 16%]; p = 0.067). En un análisis post hoc del subconjunto de 653 pacientes con proteína C reactiva (PCR) inicial elevada, lo cual indica inflamación activa, el 57% de los pacientes que
76 recibieron TYSABRI logró una respuesta en comparación con el 45% de los que recibieron placebo (efecto del tratamiento:12%; IC del 95%:[3%, 22%]; valor de p nominal = 0.01). En el segundo ensayo de inducción, el estudio EC2, solo se estudiaron los pacientes con proteína C reactiva (PCR) sérica elevada. En total se aleatorizaron 509 pacientes en una proporción de 1:1 para recibir tres infusiones mensuales de 300 mg de TYSABRI o placebo. En el estudio EC2, en oposición al estudio EC1, era necesario lograr una respuesta clínica y remisión clínica (definidas como un puntaje del IAEC <150) tanto en la semana 8 como en la semana 12, en lugar de en un solo momento; los pacientes con información incompleta se consideraron sin respuesta (Tabla 7). Tabla 7: Inducción de la respuesta y la remisión clínicas en el estudio EC2 Respuesta clínica en: Semana 8 Semana 12 Semanas 8 y 12* Remisión clínica en: Semana 8 Semana 12 Semanas 8 y 12* TYSABRI n = % 60% 48% 32% 37% 26% Placebo n = % 44% 32% 21% 25% 16% Diferencia de tratamiento (IC del 95%) 16% (8%, 26%) 16% (7%, 25%) 16% (7%, 24%) 11% (3%, 19%) 12% (4%, 21%) 10% (3%, 18%) *p <0.005 La respuesta se define como una reducción de 70 puntos en el puntaje del IAEC desde el inicio. La remisión se define como un IAEC <150. En los estudios EC1 y EC2, para los subgrupos definidos por el uso previo de terapias anteriores o por la respuesta inadecuada a estas (p. ej., corticoesteroides, inmunodepresores e inhibidores del FNT-α), el efecto del tratamiento fue generalmente similar al observado en toda la población de estudio. En el subgrupo de pacientes que no estaban tomando inmunodepresores concomitantes ni corticoesteroides concomitantes, el efecto del tratamiento fue generalmente similar al observado en toda la población de estudio. Los pacientes con una respuesta inadecuada a los inhibidores del FNT-α aparentemente tuvieron una respuesta clínica más baja y una remisión clínica más baja en el grupo de tratamiento y en el de placebo. En el caso de los pacientes del estudio EC2 con una respuesta inadecuada al tratamiento anterior con inhibidores del FNT-α, la respuesta clínica tanto en la semana 8 como en la semana 12 se observó en el 38% de los pacientes aleatorizados a TYSABRI, y la remisión clínica tanto en la semana 8 como en la semana 12 se observó en el 17%. La terapia de mantenimiento se evaluó en el estudio EC3. En este estudio, 331 pacientes del estudio EC1 que habían tenido una respuesta clínica a TYSABRI tanto en la semana 10 como en la semana 12 fueron aleatorizados nuevamente a una proporción de 1:1 al tratamiento con infusiones mensuales continuas de 300 mg de TYSABRI o placebo. Se evaluó el mantenimiento de la respuesta según la proporción de pacientes que no perdieron la respuesta clínica en ninguna visita del estudio durante 6 y 12 meses adicionales de tratamiento (es decir, mes 9 y mes 15 después del tratamiento inicial con TYSABRI). El estudio también
77 evaluó la proporción de pacientes que no perdieron la remisión clínica en ninguna visita del estudio dentro del subconjunto de aquellos que estaban en remisión durante el ingreso en el estudio. Requerir el mantenimiento de la respuesta o la remisión en cada visita, en oposición a solo en el mes 9 o 15, puede generar menores proporciones de pacientes que cumplan con los criterios de valoración y puede dar lugar a una comparación errónea de estos resultados con los de otros productos usados para tratar la enfermedad de Crohn (Tabla 8). Tabla 8: Mantenimiento de la respuesta y la remisión clínicas en el estudio EC3 TYSABRI Placebo Diferencia de tratamiento Respuesta clínica durante: Mes 9* Mes 15 n = % 54% n = 128 n = % 20% n = 118 (IC del 95%) 32% (21%, 43%) 34% (23%, 44%) Remisión clínica durante: Mes 9* Mes 15 45% 40% 26% 15% 19% (6%, 31%) 25% (13%, 36%) *p <0.005 El número de pacientes incluidos para el análisis durante el mes 9 y mes 15 incluye solo aquellos en remisión posteriormente al ingreso en el estudio EC3. La respuesta se define como un IAEC <220 y una reducción de 70 puntos en el puntaje del IAEC en comparación con el inicio del estudio EC1. La remisión se define como un IAEC <150. En el estudio EC3, para los subgrupos definidos por el uso previo de terapias anteriores o por la respuesta inadecuada a estas (p. ej., corticoesteroides, inmunodepresores e inhibidores del FNTα), el efecto del tratamiento fue generalmente similar al observado en toda la población de estudio. En el subgrupo de pacientes que no estaban tomando inmunodepresores concomitantes ni corticoesteroides concomitantes, el efecto del tratamiento fue generalmente similar al observado en toda la población de estudio. Los pacientes con una respuesta inadecuada a los inhibidores del FNT-α aparentemente tuvieron un mantenimiento de la respuesta clínica más bajo y un mantenimiento de la remisión clínica más bajo tanto en el grupo de tratamiento como en el de placebo. En el caso de los pacientes del estudio EC3 con una respuesta inadecuada al tratamiento anterior con inhibidores del FNT-α, el mantenimiento de la respuesta clínica durante el mes 9 se observó en el 52% de los pacientes aleatorizados a TYSABRI y el mantenimiento de la remisión clínica durante el mes 9 se observó en el 30%. Dado el requisito de interrumpir el uso crónico de esteroides, es importante observar que en el subgrupo de pacientes (n = 65) que recibieron corticoesteroides al inicio, respondieron a TYSABRI en el estudio EC1 y fueron aleatorizados nuevamente a TYSABRI en el estudio EC3, aproximadamente dos tercios pudieron interrumpir los esteroides dentro de las 10 semanas posteriores al inicio de una reducción de estos.
78 15. REFERENCIAS Best WR, Becktel JM, Singleton JW, Kern F: Development of a Crohn s Disease Activity Index, National Cooperative Crohn s Disease Study. Gastroenterology 1976; 70(3): FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN NDC La inyección TYSABRI se suministra como 300 mg de natalizumab en 15 ml en un vial estéril de dosis única sin conservantes. Cada paquete contiene un vial de dosis única. TYSABRI es una solución incolora y de transparente a ligeramente opalescente para dilución antes de la infusión intravenosa. TYSABRI solo se encuentra disponible a través de los centros de infusión registrados que participan en el Programa de prescripción TOUCH. Para ubicar estos centros de infusión, comuníquese con Biogen llamando al Los viales de uso único de TYSABRI deben refrigerarse a una temperatura de entre 2 C y 8 C (entre 36 F y 46 F). No use el producto después de la fecha de vencimiento impreso en la caja y en la etiqueta del vial. NO LO AGITE NI CONGELE. Protéjalo de la luz. Si no la usa de inmediato, guarde la solución TYSABRI diluida para infusión a una temperatura de entre 2 C y 8 C (entre 36 F y 46 F). La solución Tysabri para infusión debe administrarse dentro de las 8 horas de su preparación. 17. INFORMACIÓN DE ASESORAMIENTO AL PACIENTE Aconséjele al paciente que lea la ficha técnica para el paciente aprobada por la FDA (Guía de medicamentos). Información de asesoramiento general Oriente a los pacientes para que comprendan los riesgos y beneficios de TYSABRI antes de que les extiendan una primera receta. El paciente puede recibir información por parte del prescriptor o de un proveedor de atención médica bajo la dirección de esta persona. INDIQUE LO SIGUIENTE A LOS PACIENTES QUE USEN TYSABRI: Deben leer la Guía de medicamentos antes de comenzar el tratamiento con TYSABRI y antes de cada infusión de TYSABRI. Deben informar cualquier síntoma nuevo o de empeoramiento continuo que persista durante varios días al prescriptor [consulte Advertencias y precauciones (5.1)]. Deben informar a todos sus médicos que están recibiendo TYSABRI. Deben planificar una cita con el prescriptor tres meses después de la primera infusión, seis meses después de la primera infusión, cada seis meses desde ese momento y durante al menos seis meses tras interrumpir TYSABRI.
79 Leucoencefalopatía multifocal progresiva Informe a los pacientes que se produjo leucoencefalopatía multifocal progresiva (LMP) en pacientes que recibieron TYSABRI. Indique al paciente la importancia de comunicarse con su médico si presenta síntomas indicativos de LPM. Indique al paciente que los síntomas típicos asociados a la LMP son diversos, evolucionan en el transcurso de días a semanas e incluyen debilidad progresiva en un costado del cuerpo o torpeza de las extremidades, alteración de la vista y cambios en el pensamiento, la memoria y la orientación que provocan confusión y cambios de personalidad. Indique al paciente que la progresión de los déficits generalmente provoca muerte o discapacidad grave en el transcurso de semanas o meses. Indique a los pacientes que deben continuar observando si se presentan signos y síntomas nuevos indicativos de LMP durante aproximadamente 6 meses tras la interrupción de TYSABRI [consulte Advertencias y precauciones (5.1)]. Programa de prescripción TOUCH de TYSABRI Informe al paciente que TYSABRI solo se encuentra disponible a través de un programa restringido llamado Programa de prescripción TOUCH. Informe al paciente los siguientes requisitos: Los pacientes deben leer la Guía de medicamentos y firmar el Formulario de inscripción para el prescriptor/paciente. Informe a los pacientes que TYSABRI solo está disponible en farmacias y centros de infusión certificados que participen en el programa [consulte Advertencias y precauciones (5.2)]. Meningitis y encefalitis por herpes Informe a los pacientes que TYSABRI aumenta el riesgo de desarrollar encefalitis y meningitis provocadas por los virus herpes simple y varicela zóster. Indique a los pacientes que deben informar de inmediato si tienen síntomas como fiebre, dolor de cabeza y confusión [consulte Advertencias y precauciones (5.3)]. Hepatotoxicidad Informe a los pacientes que TYSABRI puede causar lesión hepática. Indique a los pacientes tratados con TYSABRI que deben informar de inmediato cualquier síntoma que pueda indicar lesión hepática, lo que incluye fatiga, anorexia, molestia abdominal superior derecha, orina oscura o ictericia[consulte Advertencias y precauciones (5.4)]. Reacciones de hipersensibilidad Indique a los pacientes que deben informar de inmediato si tienen síntomas que concuerden con una reacción de hipersensibilidad (p. ej., urticaria con o sin síntomas asociados) durante o tras una infusión de TYSABRI [consulte Advertencias y precauciones (5.5)]. Inmunodepresión/infecciones Informe a los pacientes que TYSABRI puede reducir la capacidad del sistema inmunológico de combatir infecciones. Indique al paciente la importancia de comunicarse con su médico si tiene algún síntoma de infección [consulte Advertencias y precauciones (5.6)].
80 I TYSABRI (natalizumab) Fabricado por: Biogen Inc. Cambridge, MA EE. UU Biogen, Inc. Reservados todos los derechos. Números de patentes en EE. UU.: 5,840,299; 6,602,503
81 GUÍA DE MEDICAMENTOS TYSABRI (natalizumab) inyectable, para uso por vía intravenosa Lea esta Guía de medicamentos antes de comenzar a recibir TYSABRI y antes de recibir cada dosis, ya que podría incluir información nueva. Esta Guía de medicamentos no reemplaza la consulta con su médico sobre su padecimiento médico o su tratamiento. Cuál es la información más importante que debería conocer sobre TYSABRI? TYSABRI aumenta su probabilidad (riesgo) de contraer una infección cerebral rara que generalmente provoca la muerte o discapacidad grave. Esta infección se llama leucoencefalopatía multifocal progresiva (LMP). En caso de que llegara a presentarse, la LMP generalmente ocurre en personas que tienen el sistema inmunitario debilitado. o No se conoce ningún tratamiento, prevención ni cura para la LMP. o Es posible que tenga una mayor probabilidad de contraer LMP si también está recibiendo tratamiento con otros medicamentos que pueden debilitar el sistema inmunitario, incluidos otros tratamientos para la esclerosis múltiple (EM) y la enfermedad de Crohn (EC). No deberá usar ciertos medicamentos que debilitan el sistema inmunitario mientras usa TYSABRI. Incluso si solo usa TYSABRI para tratar su EM o EC, aún puede contraer LMP. o El riesgo de contraer LMP es mayor en estos casos: si ha recibido TYSABRI durante mucho tiempo, especialmente durante más de 2 años si ha recibido determinados medicamentos que pueden debilitar el sistema inmunológico antes de comenzar a recibir TYSABRI si ha tenido una infección por el virus de John Cunningham (VJC). El VJC es un virus frecuente que es inofensivo en la mayoría de las personas, pero que puede provocar LMP en personas con un sistema inmunitario debilitado, como las personas que toman TYSABRI. La mayoría de las personas que tienen una infección por VJC no lo saben ni tienen síntomas. Esta infección generalmente ocurre en la infancia. Antes de comenzar a recibir TYSABRI o durante su tratamiento, es posible que su médico le haga un análisis de sangre para verificar si tiene una infección por VJC. El riesgo de contraer LMP es mayor si usted tiene los 3 factores de riesgo mencionados anteriormente a la vez. Es posible que haya otros factores de riesgo de contraer LMP durante el tratamiento con TYSABRI que todavía no se conozcan. Su médico debe analizar los riesgos y beneficios del tratamiento con TYSABRI con usted antes de que decida si desea recibir TYSABRI. Consulte Cuáles son los posibles efectos secundarios de TYSABRI? o Mientras recibe TYSABRI y durante 6 meses después de que haya dejado de recibir TYSABRI, es importante que llame a su médico de inmediato si tiene algún problema médico nuevo o que haya empeorado y que haya durado varios días. Estos pueden ser nuevos o repentinos e incluir problemas de: razonamiento visión fuerza equilibrio debilidad en 1 lado del cuerpo uso de brazos y piernas Comuníqueles a todos sus médicos que está recibiendo TYSABRI. Debido al riesgo de contraer LMP mientras recibe TYSABRI, este fármaco solo se encuentra disponible a través de un programa de distribución restringida llamado Programa de prescripción TOUCH. Para recibir TYSABRI, debe hablar con su médico, comprender los beneficios y los riesgos de TYSABRI y aceptar seguir todas las instrucciones del Programa de prescripción TOUCH. o TYSABRI solamente: lo pueden recetar médicos que estén inscritos en el Programa de prescripción TOUCH se administra en un centro de infusión que esté inscrito en el Programa de prescripción TOUCH se administra a personas que estén inscritas en el Programa de prescripción TOUCH o Antes de recibir TYSABRI, su médico hará lo siguiente: le explicará el Programa de prescripción TOUCH le pedirá que firme el Formulario de inscripción al Programa TOUCH para prescriptores y pacientes Qué es TYSABRI? TYSABRI es un medicamento de venta con receta que se utiliza para tratar a adultos que tienen estas enfermedades: formas recurrentes de esclerosis múltiple (EM). TYSABRI puede: o retardar el empeoramiento de los síntomas que son frecuentes en personas con EM o disminuir el número de exacerbaciones (recaídas) TYSABRI aumenta el riesgo de contraer LMP. Cuando inicie y continúe el tratamiento con TYSABRI, es importante que hable con su médico para saber si el beneficio que se espera obtener de TYSABRI es suficiente para compensar este riesgo. Consulte Cuál es la información más importante que debería conocer sobre TYSABRI? enfermedad de Crohn (EC) moderada a grave. TYSABRI se usa: o para disminuir los signos y los síntomas de la EC o en personas que no han recibido un beneficio suficiente o que no pueden usar los medicamentos habituales para la EC y los medicamentos llamados inhibidores del factor de necrosis tumoral (FNT). Se desconoce si las personas mayores de 65 años responden de manera diferente a TYSABRI. Se desconoce si TYSABRI es seguro y eficaz en niños y adolescentes menores de 18 años.
82 Quién no debe recibir TYSABRI? No tome TYSABRI si usted: tiene LMP es alérgico a natalizumab o a cualquiera de los ingredientes de TYSABRI. Consulte la parte final de esta Guía de medicamentos para obtener una lista completa de los ingredientes de TYSABRI. Hable con su médico antes de recibir TYSABRI si tiene cualquiera de estos padecimientos. Qué debo informarle a mi médico antes de recibir cada dosis de TYSABRI? Antes de recibir TYSABRI, infórmele a su médico si usted: tiene padecimientos médicos que puedan debilitar su sistema inmunitario, incluidos: o infección por VIH o SIDA o leucemia o linfoma o un trasplante de órgano o otros padecimientos médicos que puedan debilitar su sistema inmunitario tiene algún problema médico nuevo o que haya empeorado y que haya durado varios días. Estos pueden ser nuevos o repentinos e incluir problemas de: o razonamiento o visión o equilibrio o fuerza o debilidad en 1 lado del cuerpo o uso de brazos y piernas ha tenido urticaria, picazón o problemas para respirar durante o después de recibir una dosis de TYSABRI tiene fiebre o una infección (que incluye herpes zóster o cualquier infección inusualmente prolongada) está embarazada o planea quedar embarazada. Se desconoce si TYSABRI puede dañar a un bebé en gestación. está amamantando o planea amamantar. TYSABRI puede pasar a la leche materna. Se desconoce si la cantidad de TYSABRI que pasa a la leche materna puede dañar a su bebé. Hable con su médico sobre la mejor forma de alimentar a su bebé mientras recibe TYSABRI. Dígale a su médico todos los medicamentos que usa, incluidos los medicamentos de venta con receta y de venta libre, vitaminas y suplementos a base de hierbas. Sobre todo, dígale a su médico si toma medicamentos que puedan debilitar su sistema inmunitario. Si no está seguro, hable con su médico. Conozca los medicamentos que usa. Conserve una lista de estos para mostrársela a su médico y a su farmacéutico cuando le den un medicamento nuevo. Cómo debo recibir TYSABRI? TYSABRI se administra 1 vez cada 4 semanas a través de una aguja colocada en la vena (infusión intravenosa o IV). Antes de cada dosis de TYSABRI, le harán preguntas para asegurarse de que TYSABRI siga siendo adecuado para usted. Cuáles son los posibles efectos secundarios de TYSABRI? TYSABRI puede causar efectos secundarios de gravedad, que incluyen los siguientes: Consulte Cuál es la información más importante que debería conocer sobre TYSABRI? Meningitis y encefalitis por herpes. TYSABRI puede aumentar el riesgo de contraer una infección del cerebro o del revestimiento del cerebro y de la médula espinal (encefalitis o meningitis) ocasionada por el virus del herpes que puede provocar la muerte. Llame a su médico de inmediato si tiene fiebre repentina, dolor de cabeza intenso o si se siente confundido después de recibir TYSABRI. Daño hepático. Los síntomas del daño hepático pueden incluir los siguientes: o coloración amarilla de la piel y los ojos (ictericia) o náuseas o vómitos o oscurecimiento anormal de la orina o cansancio o debilidad Comuníquese con su médico de inmediato si presenta síntomas de daño hepático. Su médico le puede hacer análisis de sangre para determinar si hay daño hepático. Reacciones alérgicas, incluidas reacciones alérgicas graves. Los síntomas de una reacción alérgica pueden incluir los siguientes: o urticaria o picazón o dificultad para respirar o dolor de pecho o mareo o sibilancia o escalofríos o sarpullido o náuseas o sofocos o presión arterial baja Las reacciones alérgicas graves suelen ocurrir dentro de un lapso de 2 horas después de haber iniciado la infusión, pero pueden ocurrir en cualquier momento después de recibir TYSABRI. Comuníquese con su médico de inmediato si tiene algún síntoma de reacción alérgica, incluso si sucede después de que se haya ido del centro de infusión. Si presenta una reacción alérgica, es posible que necesite tratamiento. Infecciones. TYSABRI puede aumentar su probabilidad de contraer una infección inusual o grave debido a que TYSABRI puede debilitar el sistema inmunitario. Usted corre un mayor riesgo de contraer infecciones si también usa otros medicamentos que puedan debilitar su sistema inmunitario. Los efectos secundarios más frecuentes de TYSABRI incluyen los siguientes: o dolor de cabeza o cansancio o infección de las vías urinarias o dolor articular o infección pulmonar o depresión o dolor en brazos y piernas o diarrea o vaginitis o sarpullido o infecciones de nariz y o náuseas garganta o dolor en la zona delmestómago Si tiene cualquier efecto secundario que le moleste o que no desaparezca, infórmeselo a su médico. Estos no son todos los efectos secundarios posibles de TYSABRI. Para más información, pregúntele a su médico. Comuníquese con su médico para que le dé información respecto de los efectos secundarios. Puede reportar los efectos secundarios a la FDA llamando al FDA-1088.
83 Información general sobre el uso seguro y eficaz de TYSABRI. A veces los medicamentos se recetan para fines distintos a los indicados en una Guía de medicamentos. Esta Guía de medicamentos resume la información más importante sobre TYSABRI. Si desea obtener más información, hable con su médico. Puede pedirle a su médico o a su farmacéutico información sobre TYSABRI que haya sido escrita para profesionales de la salud. Para más información, visite o llame al Cuáles son los ingredientes de TYSABRI? Principio activo: natalizumab Ingredientes inactivos: cloruro de sodio, fosfato de sodio monobásico monohidratado, fosfato de sodio dibásico heptahidratado, polisorbato 80 y agua para inyecciones Fabricado por: Biogen Inc., Cambridge, MA EE. UU. La Administración de Alimentos y Medicamentos de los EE. UU. ha aprobado esta Guía de medicamentos. Revisado en 05/16
84 PUNTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN Estos puntos destacados no incluyen toda la información necesaria para utilizar PLEGRIDY de forma segura y eficaz. Consulte la información completa de prescripción de PLEGRIDY. PLEGRIDY (peginterferón beta-1a), inyección subcutánea Aprobación inicial de EE. UU.: 2014 PRINCIPALES CAMBIOS RECIENTES Advertencias y precauciones; microangiopatía trombótica (5.8) 10/2015 INDICACIONES Y USO PLEGRIDY es un interferón beta indicado para el tratamiento de pacientes con formas recurrentes de esclerosis múltiple (1) POSOLOGÍA Y ADMINISTRACIÓN Solo para uso subcutáneo (2.1) Dosis recomendada: 125 microgramos cada 14 días (2.1) La dosis de PLEGRIDY debe ajustarse, comenzando con 63 microgramos el día 1, 94 microgramos el día 15 y 125 microgramos (dosis completa) el día 29 (2.1) Un profesional de atención médica debe enseñar a los pacientes la técnica correcta para autoadministrarse las inyecciones subcutáneas mediante la pluma o la jeringa precargadas (2.2) Los analgésicos y/o antipiréticos en los días de tratamiento pueden ayudar a aliviar los síntomas similares a los de la gripe (2.3) FORMULACIONES FARMACÉUTICAS Y CONCENTRACIONES Inyección: 125 microgramos por 0.5 ml de solución en una pluma precargada de dosis única (3) Paquete de inicio inyectable: 63 microgramos por 0.5 ml de solución en una pluma precargada de dosis única y 94 microgramos por 0.5 ml de solución en una pluma precargada de dosis única (3) Inyección: 125 microgramos por 0.5 ml de solución en una jeringa precargada de dosis única (3) Paquete de inicio inyectable: 63 microgramos por 0.5 ml de solución en una jeringa precargada de dosis única y 94 microgramos por 0.5 ml de solución en una jeringa precargada de dosis única (3) CONTRAINDICACIONES Antecedentes de hipersensibilidad al interferón beta o peginterferón natural o recombinante, o a cualquier otro componente de la formulación (4) ADVERTENCIAS Y PRECAUCIONES Lesión hepática: controle las pruebas de la función hepática; controle a los pacientes para detectar signos y síntomas de lesión hepática; considere la interrupción de PLEGRIDY si se produce una lesión hepática (5.1) Depresión y suicidio: recomiende a los pacientes que informen de inmediato cualquier síntoma de depresión o ideación suicida a su proveedor de atención médica; considere la interrupción de PLEGRIDY si se produce depresión (5.2) Convulsiones: las convulsiones se asocian al uso del interferón beta. Sea precavido al administrar PLEGRIDY a pacientes con un trastorno convulsivo (5.3) Anafilaxia y otras reacciones alérgicas: se han informado reacciones alérgicas graves como una complicación poco frecuente del tratamiento con interferón beta. Interrumpa PLEGRIDY si se produce una reacción alérgica grave (5.4) Reacciones en el lugar de la inyección: cambie el lugar de la inyección o considere la interrupción de PLEGRIDY si se produce necrosis (5.5) Insuficiencia cardíaca congestiva: controle a los pacientes con enfermedades cardíacas preexistentes significativas para determinar si empeoran los síntomas cardíacos (5.6) Disminución de los recuentos de sangre periférica: controle los hemogramas completos (5.7) Microangiopatía trombótica: se han informado casos de microangiopatía trombótica con productos con interferón beta. Interrumpa PLEGRIDY si se manifiestan síntomas clínicos y resultados de laboratorio congruentes con la MAT (5.8) Trastornos autoinmunitarios: considere la interrupción de PLEGRIDY si se produce un nuevo trastorno autoinmunitario (5.9) REACCIONES ADVERSAS Las reacciones adversas más frecuentes (incidencia de 10% y al menos 2% más frecuente con PLEGRIDY que con placebo) fueron eritema en el lugar de la inyección, enfermedad similar a la gripe, pirexia, dolor de cabeza, mialgia, escalofríos, dolor en el lugar de la inyección, astenia, prurito en el lugar de la inyección y artralgia (6.1) Para informar PRESUNTAS REACCIONES ADVERSAS, comuníquese con Biogen llamando al o con la FDA llamando al FDA-1088 o visitando USO EN POBLACIONES ESPECÍFICAS Embarazo: según información obtenida de estudios sobre animales, puede causar daño fetal (8.1) Deficiencia renal grave: controle si se producen reacciones adversas (8.6) Consulte la sección 17 para conocer la INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y la Guía de medicamentos Revisado: 07/2016 INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: ÍNDICE* 1 INDICACIONES Y USO 2 POSOLOGÍA Y ADMINISTRACIÓN 2.1 Información sobre la administración de dosis 2.2 Instrucciones importantes de administración (todas las formulaciones) 2.3 Premedicación para los síntomas similares a los de la gripe 3 FORMULACIONES FARMACÉUTICAS Y CONCENTRACIONES 4 CONTRAINDICACIONES 5 ADVERTENCIAS Y PRECAUCIONES 5.1 Lesión hepática 5.2 Depresión y suicidio 5.3 Convulsiones 5.4 Anafilaxia y otras reacciones alérgicas 5.5 Reacciones en el lugar de la inyección 5.6 Insuficiencia cardíaca congestiva 5.7 Disminución de los recuentos de sangre periférica 5.8 Microangiopatía trombótica 5.9 Trastornos autoinmunitarios 6 REACCIONES ADVERSAS 6.1 Experiencia en ensayos clínicos 8 USO EN POBLACIONES ESPECÍFICAS 8.1 Embarazo 8.3 Madres lactantes 8.4 Uso pediátrico 8.5 Uso geriátrico 8.6 Deficiencia renal 11 DESCRIPCIÓN 11.1 Pluma precargada de dosis única de PLEGRIDY PEN 11.2 Jeringa precargada de dosis única de PLEGRIDY 12 FARMACOLOGÍA CLÍNICA 12.1 Mecanismo de acción 12.2 Farmacodinámica 12.3 Farmacocinética 13 TOXICOLOGÍA NO CLÍNICA 13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad 14 ESTUDIOS CLÍNICOS 16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN 16.1 Pluma precargada de dosis única de PLEGRIDY PEN 16.2 Jeringa precargada de dosis única de PLEGRIDY 16.3 Almacenamiento y manipulación 16.4 Instrucciones para el desecho 17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE *No se indican las secciones ni subsecciones omitidas de la información de prescripción completa. 1
85 INFORMACIÓN DE PRESCRIPCIÓN COMPLETA 1 INDICACIONES Y USO PLEGRIDY (peginterferón beta-1a) está indicado para el tratamiento de pacientes con formas recurrentes de esclerosis múltiple. 2 POSOLOGÍA Y ADMINISTRACIÓN 2.1 Información sobre la administración de dosis PLEGRIDY se administra por vía subcutánea. La posología recomendada de PLEGRIDY es 125 microgramos inyectados por vía subcutánea cada 14 días. Inicio del tratamiento Los pacientes deben comenzar el tratamiento con 63 microgramos el día 1. El día 15 (14 días después), la dosis se aumenta a 94 microgramos y se alcanza la dosis completa de 125 microgramos el día 29 (después de otros 14 días). Desde ese momento, los pacientes continúan con la dosis completa (125 microgramos) cada 14 días (consulte la Tabla 1). Se encuentra disponible un Paquete de inicio de PLEGRIDY que contiene dos jeringas o dos plumas precargadas: 63 microgramos (dosis 1) y 94 microgramos (dosis 2). Tabla 1: Esquema de ajuste de dosis Dosis Momento de administración* Cantidad (microgramos) Color de la pluma o etiqueta de la jeringa Dosis 1 El día 1 63 Anaranjado Dosis 2 El día Azul Dosis 3 *Cada 14 días El día 29 y cada 14 días desde ese momento 125 (dosis completa) Gris 2.2 Instrucciones importantes de administración (todas las formulaciones) Los profesionales de la atención médica deben enseñar a los pacientes la técnica correcta para autoadministrarse las inyecciones subcutáneas mediante la pluma o la jeringa precargadas. Se debe aconsejar a los pacientes que alternen los lugares donde se colocan las inyecciones subcutáneas. Los lugares habituales para las inyecciones subcutáneas son el abdomen, la parte posterior del brazo superior y el muslo. Cada pluma y cada jeringa de PLEGRIDY vienen con la aguja precolocada. Las plumas y jeringas precargadas solo sirven para una dosis única y deben desecharse después de su uso. 2
86 2.3 Premedicación para los síntomas similares a los de la gripe El uso profiláctico y concurrente de analgésicos y/o antipiréticos puede prevenir o aliviar los síntomas similares a los de la gripe que a veces se presentan durante el tratamiento con PLEGRIDY. 3 FORMULACIONES FARMACÉUTICAS Y CONCENTRACIONES Pluma Inyección: 125 microgramos de PLEGRIDY por 0.5 ml de solución en una pluma precargada de dosis única Inyección: Paquete de inicio que contiene 63 microgramos por 0.5 ml de solución en una pluma precargada de dosis única y 94 microgramos por 0.5 ml de solución en una pluma precargada de dosis única Jeringa precargada Inyección: 125 microgramos de PLEGRIDY por 0.5 ml de solución en una jeringa precargada de dosis única Inyección: Paquete de inicio que contiene 63 microgramos por 0.5 ml de solución en una jeringa precargada de dosis única y 94 microgramos por 0.5 ml de solución en una jeringa precargada de dosis única 4 CONTRAINDICACIONES PLEGRIDY está contraindicado en pacientes con antecedentes de hipersensibilidad al interferón beta o peginterferón natural o recombinante, o a cualquier otro componente de la formulación [consulte Advertencias y precauciones (5.4)]. 5 ADVERTENCIAS Y PRECAUCIONES 5.1 Lesión hepática Se han informado lesiones hepáticas graves, que incluyen hepatitis, hepatitis autoinmunitaria y casos poco frecuentes de insuficiencia hepática grave, con interferón beta. También se ha informado un aumento asintomático de las transaminasas hepáticas y, en algunos pacientes, esto se ha reiterado posteriormente a una nueva exposición al interferón beta. Se han observado aumentos en las enzimas y lesiones hepáticas con el uso de PLEGRIDY en estudios clínicos. La incidencia de los aumentos de las transaminasas hepáticas fue mayor en los pacientes que tomaban PLEGRIDY que en los que tomaban placebo. La incidencia de los aumentos de la alanina-aminotransferasa mayores a 5 veces el límite superior de lo normal fue del 1% en los pacientes tratados con placebo y del 2% en los pacientes tratados con PLEGRIDY. La incidencia de los aumentos de la aspartato-aminotransferasa mayores a 5 veces el límite superior de lo normal fue del 1% en los pacientes tratados con placebo y del 1% en los pacientes 3
87 tratados con PLEGRIDY. En 2 pacientes se produjeron aumentos de las transaminasas hepáticas séricas junto con aumentos de la bilirrubina. Ambos casos se resolvieron tras la interrupción de PLEGRIDY. Controle a los pacientes para determinar si tienen signos y síntomas de lesión hepática. 5.2 Depresión y suicidio La depresión, la ideación suicida y el suicidio se producen con mayor frecuencia en los pacientes que reciben interferón beta que en los pacientes que reciben placebo. En estudios clínicos, la incidencia general de los eventos adversos relacionados con la depresión y la ideación suicida en pacientes con esclerosis múltiple fue del 8% en ambos grupos, los que recibieron PLEGRIDY y placebo. La incidencia de eventos graves relacionados con la depresión y la ideación suicida fue similar y menor del 1% en ambos grupos. Recomiende a los pacientes que informen de inmediato cualquier síntoma de depresión o ideación suicida a su proveedor de atención médica. Si un paciente tiene depresión u otros síntomas psiquiátricos graves, considere interrumpir el tratamiento con PLEGRIDY. 5.3 Convulsiones Las convulsiones se asocian al uso del interferón beta. La incidencia de las convulsiones en estudios clínicos sobre esclerosis múltiple fue menor del 1% en pacientes que recibieron PLEGRIDY y en los que recibieron placebo. Sea precavido al administrar PLEGRIDY a pacientes con un trastorno convulsivo. 5.4 Anafilaxia y otras reacciones alérgicas La anafilaxia y otras reacciones alérgicas son complicaciones poco frecuentes del tratamiento con interferón beta. Menos del 1% de los pacientes tratados con PLEGRIDY tuvo una reacción alérgica grave, como angioedema o urticaria. Las personas que tuvieron reacciones alérgicas graves se recuperaron rápidamente después del tratamiento con antihistamínicos o corticosteroides. Interrumpa PLEGRIDY si se produce una reacción alérgica grave. 5.5 Reacciones en el lugar de la inyección Pueden producirse reacciones en el lugar de la inyección, que incluyen necrosis en el lugar de la inyección, con el uso del interferón beta subcutáneo. En estudios clínicos, la incidencia de las reacciones en el lugar de la inyección (p. ej., eritema, dolor, prurito o edema en el lugar de la inyección) fue del 66% en el grupo de PLEGRIDY y del 11% en el grupo del placebo; la incidencia de las reacciones graves en el lugar de la inyección fue del 3% en el grupo de PLEGRIDY y del 0% en el grupo del placebo. Un paciente entre 1468 pacientes que recibieron PLEGRIDY en estudios clínicos tuvo necrosis en el lugar de la inyección. La lesión se resolvió con tratamiento médico estándar. Las decisiones sobre la interrupción de la terapia tras una necrosis en un solo lugar de la inyección deben basarse en el grado de la necrosis. En el caso de los pacientes que continúan con la terapia con PLEGRIDY después de producirse necrosis en el lugar de la inyección, 4
88 evite la administración de PLEGRIDY cerca del área afectada hasta que se cicatrice por completo. Si se producen varias lesiones, interrumpa PLEGRIDY hasta que se cicatricen las heridas. 5.6 Insuficiencia cardíaca congestiva Se producen insuficiencia cardíaca congestiva, cardiomiopatía y cardiomiopatía con insuficiencia cardíaca congestiva en pacientes que reciben interferón beta. En estudios clínicos, la incidencia de los eventos cardiovasculares fue del 7% en ambos grupos de tratamiento, con PLEGRIDY y placebo. No se informaron eventos cardiovasculares graves en el grupo de PLEGRIDY. Controle a los pacientes con enfermedades cardíacas significativas para determinar si empeoran las afecciones cardíacas durante el inicio y la continuación del tratamiento con PLEGRIDY. 5.7 Disminución de los recuentos de sangre periférica El interferón beta puede provocar una disminución de los recuentos de sangre periférica en todas las líneas celulares, que incluyen casos poco frecuentes de pancitopenia y trombocitopenia grave. En estudios clínicos, las disminuciones de los recuentos leucocitarios por debajo de 3.0 x 10 9 /l se produjeron en el 7% de los pacientes que recibieron PLEGRIDY y en el 1% de los pacientes que recibieron placebo. No hay una asociación aparente entre las disminuciones de los recuentos leucocitarios y un mayor riesgo de infecciones o infecciones graves. La incidencia de disminuciones clínicamente significativas de los recuentos linfocitarios (por debajo de 0.5 x 10 9 /l), recuentos de neutrófilos (por debajo de 1.0 x 10 9 /l) y recuentos plaquetarios (por debajo de 100 x 10 9 /l) fue menor del 1% en todos los casos y similar en ambos grupos, de PLEGRIDY y placebo. Se informaron dos casos graves en pacientes tratados con PLEGRIDY: un paciente (menos del 1%) tuvo trombocitopenia grave (definida como un recuento plaquetario menor de 10 x 10 9 /l o igual a esta cifra) y otro paciente (menos del 1%) tuvo neutropenia grave (definida como un recuento de neutrófilos menor de 0.5 x 10 9 /l o igual a esta cifra). En ambos pacientes, los recuentos celulares se recuperaron tras la interrupción de PLEGRIDY. En comparación con el placebo, no hubo diferencias significativas en los recuentos de glóbulos rojos en pacientes tratados con PLEGRIDY. Controle a los pacientes para determinar si tienen infecciones, sangrado y síntomas de anemia. Controle los hemogramas completos, las fórmulas leucocíticas y los recuentos plaquetarios durante el tratamiento con PLEGRIDY. Los pacientes con mielodepresión pueden requerir un control más intensivo de los recuentos de glóbulos. 5.8 Microangiopatía trombótica Se han informado casos de microangiopatía trombótica (MAT), que incluyen púrpura trombocitopénica trombótica y síndrome urémico hemolítico, algunos mortales, con productos con interferón beta. Se han informado casos entre varias semanas y años después de haber iniciado el tratamiento con productos con interferón beta. Interrumpa PLEGRIDY si se manifiestan síntomas clínicos y resultados de laboratorio congruentes con la MAT, y trate según las indicaciones clínicas. 5
89 5.9 Trastornos autoinmunitarios Se han informado trastornos autoinmunitarios de varios órganos específicos, que incluyen trombocitopenia idiopática, hiper- e hipotiroidismo y hepatitis autoinmunitaria, con interferón beta. En estudios clínicos, la incidencia de los trastornos autoinmunitarios fue menor del 1% en ambos grupos de tratamiento, con PLEGRIDY y placebo. Si los pacientes manifiestan un nuevo trastorno autoinmunitario, considere interrumpir PLEGRIDY. 6 REACCIONES ADVERSAS Las siguientes reacciones adversas graves se analizan en mayor detalle en las otras secciones de la ficha técnica: Lesión hepática [consulte Advertencias y precauciones (5.1)] Depresión y suicidio [consulte Advertencias y precauciones (5.2)] Convulsiones [consulte Advertencias y precauciones (5.3)] Anafilaxia y otras reacciones alérgicas [consulte Advertencias y precauciones (5.4)] Reacciones en el lugar de la inyección [consulte Advertencias y precauciones (5.5)] Insuficiencia cardíaca congestiva [consulte Advertencias y precauciones (5.6)] Disminución de los recuentos de sangre periférica [consulte Advertencias y precauciones (5.7)] Microangiopatía trombótica [consulte Advertencias y precauciones (5.8)] Trastornos autoinmunitarios [consulte Advertencias y precauciones (5.9)] 6.1 Experiencia en ensayos clínicos Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variadas, las tasas de reacciones adversas observadas en los ensayos clínicos de PLEGRIDY no pueden compararse directamente con las tasas en los ensayos clínicos de otros fármacos y puede que no reflejen las tasas observadas en la práctica. En estudios clínicos (estudio 1 y estudio 2), 1468 pacientes en total con esclerosis múltiple recurrente recibieron PLEGRIDY durante 177 semanas (41 meses) como máximo, con una exposición global equivalente a 1932 años-persona. En total, 1093 pacientes recibieron al menos 1 año, y 415 pacientes recibieron al menos 2 años de tratamiento con PLEGRIDY. En total, 512 y 500 pacientes, respectivamente, recibieron PLEGRIDY 125 microgramos cada 14 días o cada 28 días durante la fase controlada con placebo del estudio 1 (año 1). La experiencia en el año 2 del estudio 1 y en el estudio de extensión de seguridad de 2 años (estudio 2) concordó con la experiencia en la fase controlada con placebo de 1 año del estudio 1. 6
90 En la fase controlada con placebo del estudio 1, las reacciones adversas más frecuentes de PLEGRIDY 125 microgramos de administración subcutánea cada 14 días fueron eritema en el lugar de la inyección, enfermedad similar a la gripe, pirexia, dolor de cabeza, mialgia, escalofríos, dolor en el lugar de la inyección, astenia, prurito en el lugar de la inyección y artralgia (todos tuvieron una incidencia mayor del 10% y de al menos 2% más que el placebo). El evento adverso informado con mayor frecuencia que generó la interrupción en los pacientes tratados con PLEGRIDY 125 microgramos de administración subcutánea cada 14 días fue la enfermedad similar a la gripe (en menos del 1% de los pacientes). La Tabla 2 resume las reacciones adversas informadas durante 48 semanas en pacientes tratados en la fase controlada con placebo del estudio 1 que recibieron PLEGRIDY 125 microgramos de administración subcutánea (n = 512) o placebo (n = 500), cada 14 días. 7
91 Tabla 2: Reacciones adversas en la fase controlada con placebo de 48 semanas del estudio 1 con una incidencia 2% mayor para PLEGRIDY que para placebo PLEGRIDY (N = 512) % Placebo (N = 500) % Trastornos del sistema nervioso Dolor de cabeza Trastornos gastrointestinales Náuseas Vómitos Trastornos musculoesqueléticos y del tejido conjuntivo Mialgia Artralgia Trastornos generales y afecciones en el lugar de administración Eritema en el lugar de la inyección 62 7 Enfermedad similar a la gripe Pirexia Escalofríos 17 5 Dolor en el lugar de la inyección 15 3 Astenia 13 8 Prurito en el lugar de la inyección 13 1 Hipertermia 4 1 Dolor 5 3 Edema en el lugar de la inyección 3 0 Sensación de calor en el lugar de la inyección 3 0 Hematoma en el lugar de la inyección 3 1 Erupción en el lugar de la inyección 2 0 Análisis Aumento de la temperatura corporal 6 3 Aumento de la alanina-aminotransferasa 6 3 Aumento de la aspartato-aminotransferasa 4 2 Aumento de la gamma-glutamil-transferasa 3 1 Trastorno de la piel y del tejido subcutáneo Prurito 4 1 8
92 Inmunogenicidad En el caso de las proteínas terapéuticas, existe el potencial de inmunogenicidad. En el estudio 1, menos del 1% de los pacientes tratados con PLEGRIDY cada 14 días durante 1 año desarrolló anticuerpos neutralizantes. Aproximadamente el 7% de los pacientes tratados con PLEGRIDY desarrollaron anticuerpos contra el PEG. La detección de la formación de anticuerpos depende considerablemente de la sensibilidad y la especificidad del ensayo. Además, la incidencia observada de positividad de anticuerpos (incluidos los anticuerpos neutralizantes) en un ensayo puede verse afectada por varios factores, que incluyen la metodología del ensayo, la manipulación de las muestras, el cronograma de recogida de muestras, los medicamentos concomitantes y la enfermedad subyacente. Por estas razones, la comparación de la incidencia de los anticuerpos contra PLEGRIDY con la incidencia de los anticuerpos contra otros productos puede llevar a conclusiones erradas. Síntomas similares a los de la gripe El 47% de los pacientes que recibieron PLEGRIDY 125 microgramos cada 14 días y el 13% de los pacientes que recibieron placebo tuvieron una enfermedad similar a la gripe. Menos del 1% de los pacientes tratados con PLEGRIDY en el estudio 1 interrumpió el tratamiento debido a síntomas similares a los de la gripe. 8 USO EN POBLACIONES ESPECÍFICAS 8.1 Embarazo Categoría C para el embarazo No hay estudios adecuados ni bien controlados en embarazadas. PLEGRIDY debe utilizarse durante el embarazo únicamente si el posible beneficio justifica el posible riesgo para el feto. No se ha estudiado PLEGRIDY para determinar la toxicidad en el desarrollo en animales gestantes. En monas que recibieron interferón beta mediante inyección subcutánea en días alternos durante las primeras etapas del embarazo, no se observaron efectos teratogénicos ni otros efectos adversos en el desarrollo fetal. La actividad abortiva fue evidente después de 3 a 5 dosis. Registro de exposición durante el embarazo Existe un registro de exposición durante el embarazo que vigila los desenlaces de los embarazos de mujeres expuestas a PLEGRIDY durante el embarazo. Aliente a las pacientes a que se inscriban llamando al o visitando Madres lactantes Se desconoce si este fármaco se excreta en la leche materna. Debido a que muchos fármacos se excretan en la leche materna, se debe tener cautela cuando PLEGRIDY se administra a una mujer que está amamantando. 8.4 Uso pediátrico No se han establecido la seguridad ni la efectividad en pacientes pediátricos. 9
93 8.5 Uso geriátrico No se han establecido la seguridad ni la efectividad en pacientes geriátricos. 8.6 Deficiencia renal Controle si se producen reacciones adversas debido a una mayor exposición al fármaco en pacientes con deficiencia renal grave [consulte Farmacología clínica (12.3)]. 11 DESCRIPCIÓN PLEGRIDY (peginterferón beta-1a) es un interferón beta-1a al cual se une covalentemente una única molécula lineal de metoxi poli(etilenglicol)-o-2-metilpropionaldehído de 20,000 daltones (Da) en el grupo alfaamino del residuo aminoácido N-terminal. La parte de interferón beta-1a de PLEGRIDY se produce como una glucoproteína mediante células de ovario de hámster chino modificadas genéticamente a las que se incorporó el gen del interferón beta humano. La secuencia de aminoácidos del interferón beta-1a recombinante es idéntica a la de su contraparte, el interferón beta humano. La masa molecular de PLEGRIDY es aproximadamente 44,000 Da, lo cual concuerda con la masa de la proteína (cerca de 20,000 Da), las fracciones de carbohidrato (alrededor de 2,500 Da) y el poli(etilenglicol) unido. No obstante, dado el carácter flexible y extendido de la cadena de poli(etilenglicol) unido, la masa aparente de PLEGRIDY en solución es mayor de 300,000 Da. Se ha demostrado que el incremento en 10 veces en la masa aparente de PLEGRIDY en comparación con el interferón beta-1a contribuye a una menor depuración in vivo. PLEGRIDY 125 microgramos contiene 125 microgramos de interferón beta-1a más 125 microgramos de poli(etilenglicol). Conforme al Estándar Internacional de la Organización Mundial de la Salud para el interferón beta, PLEGRIDY tiene una actividad antiviral específica de 100 millones de unidades internacionales (MIU) por mg de proteína según lo determinado en un ensayo in vitro de efecto citopático. PLEGRIDY 125 microgramos contiene aproximadamente 12 MIU de actividad antiviral. PLEGRIDY no contiene conservantes Pluma precargada de dosis única de PLEGRIDY PEN PLEGRIDY PEN está compuesta por un autoinyector que rodea una jeringa de vidrio precargada que contiene 0.5 ml de una solución estéril en agua para la inyección de 63, 94 o 125 microgramos de peginterferón beta-1a, 15.8 mg de L-arginina HCl, 0.79 mg de trihidrato de acetato de sodio, 0.25 mg de ácido acético glacial y mg de polisorbato 20. El ph es aproximadamente Jeringa precargada de dosis única de PLEGRIDY Una jeringa precargada PLEGRIDY para inyección subcutánea contiene 0.5 ml de una solución estéril en agua para la inyección de 63, 94 o 125 microgramos de peginterferón beta-1a, 15.8 mg de L-arginina HCl, 0.79 mg de trihidrato de acetato de sodio, 0.25 mg de ácido acético glacial y mg de polisorbato 20. El ph es aproximadamente
94 12 FARMACOLOGÍA CLÍNICA 12.1 Mecanismo de acción Se desconoce el mecanismo mediante el cual PLEGRIDY ejerce su efecto en los pacientes con esclerosis múltiple Farmacodinámica No se conoce un efecto bioquímico ni fisiológico para relacionarlo directamente con el efecto clínico de PLEGRIDY Farmacocinética Después de la administración subcutánea de una dosis única o de dosis múltiples de PLEGRIDY a sujetos sanos, la concentración sérica máxima de PLEGRIDY (Cmáx) y la exposición total con el tiempo (área bajo la curva o ABC) aumentó en proporción a las dosis de 63 a 188 microgramos. PLEGRIDY no se acumuló en el suero después de varias dosis de 125 microgramos cada 14 días. Los parámetros farmacocinéticos de PLEGRIDY, que incluyen la Cmáx y el ABC, no difirieron significativamente entre los voluntarios sanos y los pacientes con esclerosis múltiple ni entre las administraciones de dosis únicas y de dosis múltiples. Sin embargo, el coeficiente de variación entre los pacientes individuales para el ABC, la Cmáx y la semivida fue alto (del 41% al 68%, del 74% al 89% y del 45% al 93%, respectivamente). Absorción Después de las dosis subcutáneas de 125 microgramos de PLEGRIDY en pacientes con esclerosis múltiple, la concentración máxima se alcanzó entre 1 y 1.5 días, la Cmáx media fue de 280 pg/ml y el ABC durante el intervalo de administración de la dosis de 14 días fue de 34.8 ng.h/ml. Distribución En los pacientes con esclerosis múltiple que recibieron dosis subcutáneas de 125 microgramos de PLEGRIDY cada 14 días, el volumen estimado de distribución fue de 481 litros. Metabolismo y eliminación Los mecanismos de depuración de PLEGRIDY incluyen catabolismo y excreción. La principal vía de eliminación es renal. La semivida es de aproximadamente 78 horas en pacientes con esclerosis múltiple. La depuración media en estado estable de PLEGRIDY es de aproximadamente 4.1 l/h. PLEGRIDY no se metaboliza ampliamente en el hígado. Poblaciones específicas No es necesario ajustar la dosis en función del peso, el sexo ni la edad. La deficiencia renal puede aumentar la Cmáx y el ABC para PLEGRIDY. Los resultados de un estudio farmacocinético en pacientes con deficiencia renal leve, moderada y grave (depuración de creatinina de 50 a 80, de 30 a 50 y de menos de 30 ml/minuto, respectivamente) mostraron aumentos por encima de los normales para la Cmáx del 27%, 26% y 42%, y para el ABC, aumentos del 30%, 40% y 53%. La semivida fue de 53, 49 y 82 horas en pacientes con deficiencia renal leve, moderada y grave, respectivamente, en comparación con 54 horas en sujetos normales. 11
95 En el mismo estudio, los sujetos con enfermedad renal en etapa terminal que necesitaban hemodiálisis dos o tres veces por semana tuvieron valores del ABC y la Cmáx de PLEGRIDY que fueron similares a los de los controles normales. Cada sesión de hemodiálisis eliminó aproximadamente el 24% de PLEGRIDY circulante de la circulación sistémica [consulte Uso en poblaciones específicas (8.6)]. 13 TOXICOLOGÍA NO CLÍNICA 13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad Carcinogénesis No se ha estudiado el potencial carcinogénico de PLEGRIDY en animales. Mutagénesis PLEGRIDY no fue mutágeno cuando se estudió en un ensayo de mutación bacteriana inversa (Ames) in vitro ni fue clastógeno en un ensayo in vitro en linfocitos humanos. Deterioro de la fertilidad En monas a las que se administró interferón beta mediante inyección subcutánea durante un ciclo menstrual, se observaron irregularidades menstruales, anovulación y disminución de los niveles séricos de progesterona. Estos efectos fueron reversibles luego de la interrupción del fármaco. 14 ESTUDIOS CLÍNICOS La eficacia de PLEGRIDY se demostró en la fase aleatorizada, doble ciega y controlada con placebo (año 1) del estudio 1. El ensayo comparó los resultados clínicos y de las IRM a las 48 semanas en pacientes que recibieron PLEGRIDY 125 microgramos (n = 512) o placebo (n = 500) por vía subcutánea, una vez cada 14 días. En el estudio 1 se inscribieron pacientes que tenían un puntaje inicial de la Escala ampliada del estado de discapacidad (Expanded Disability Status Scale, EDSS) de 0 a 5, que habían tenido al menos 2 recaídas dentro de los tres años previos y que habían tenido al menos 1 recaída el año anterior. El ensayo excluyó pacientes con formas progresivas de esclerosis múltiple. La edad media de la población de estudio fue de 37 años, la duración media de la enfermedad fue de 3.6 años y el puntaje medio de la EDSS al inicio fue de La mayoría de los pacientes fueron mujeres (71%). En el ensayo, se programaron evaluaciones neurológicas al inicio, cada 12 semanas y en el momento de una presunta recaída. Las evaluaciones por IRM del cerebro se programaron al inicio, a la semana 24 y a la semana 48. El criterio de valoración principal fue la tasa de recaídas anualizada a 1 año. Los criterios de valoración secundarios incluyeron la proporción de pacientes con recaídas, el número de lesiones hiperintensas T2 nuevas o con hipertrofia reciente y el tiempo hasta la progresión confirmada de la discapacidad. La progresión confirmada de la discapacidad se definió de la siguiente manera: si el puntaje inicial de la EDSS fue 0, se requería de un aumento sostenido de 12 semanas en el puntaje de la EDSS de 1.5 puntos; si el puntaje inicial de la EDSS fue mayor de 0, se requería de un aumento sostenido de 12 semanas en el puntaje de la EDSS de 1 punto. La Tabla 3 y la Figura 1 muestran los resultados del estudio 1. 12
96 Tabla 3: Resultados clínicos y de la IRM del estudio 1 Criterio de valoración PLEGRIDY 125 microgramos cada 14 días Placebo Resultados clínicos a las 48 semanas N = 512 N = 500 Valor de p Tasa de recaídas anualizada Reducción relativa % Proporción de pacientes con recaídas Reducción relativa del riesgo Proporción de pacientes con progresión de la discapacidad Reducción relativa del riesgo % % Resultados de la IRM a las 48 semanas N = 457 N = 476 Media de la cantidad de lesiones hiperintensas T2 nuevas o con hipertrofia reciente Reducción relativa Cantidad media de lesiones con contraste con gadolinio Reducción relativa % % < <
97 Figura 1: Tiempo hasta la primera recaída 35 Porcentaje de pacientes con recaídas 30 (29.1%) Placebo (18.7%) PLEGRIDY Inicio Tiempo en el estudio (semanas) Cantidad de sujetos en riesgo Placebo PLEGRIDY PLEGRIDY 125 mcg cada 14 días (n = 512) frente a placebo (n = 500): Índice de riesgo (intervalo de confianza del 95%) = 0.61 (0.47, 0.80), p = FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN PLEGRIDY se suministra como un líquido transparente y estéril para inyección subcutánea en dos presentaciones, una pluma precargada y una jeringa precargada. 14
Guía del medicamento para el paciente
 Guía del medicamento para el paciente Guía del medicamento para el paciente GUÍA DEL MEDICAMENTO TYSABRI (tai-sa-bri) (natalizumab) inyectable, para uso intravenoso Lea esta Guía del medicamento antes
Guía del medicamento para el paciente Guía del medicamento para el paciente GUÍA DEL MEDICAMENTO TYSABRI (tai-sa-bri) (natalizumab) inyectable, para uso intravenoso Lea esta Guía del medicamento antes
GUÍA DEL MEDICAMENTO. TYSABRI (natalizumab)
 GUÍA DEL MEDICAMENTO TYSABRI (natalizumab) Lea la Guía del Medicamento antes de comenzar a usar TYSABRI y antes de cada infusión. Puede haber información nueva. Esta Guía del Medicamento no reemplaza una
GUÍA DEL MEDICAMENTO TYSABRI (natalizumab) Lea la Guía del Medicamento antes de comenzar a usar TYSABRI y antes de cada infusión. Puede haber información nueva. Esta Guía del Medicamento no reemplaza una
Más de. objetivos del tratamiento cumplidos
 1 1 -a- objetivos del tratamiento cumplidos Más de 20 años de una combinación de estudios clínicos y experiencia con pacientes respaldan un perfil de seguridad consolidado 0 de copago* para las personas
1 1 -a- objetivos del tratamiento cumplidos Más de 20 años de una combinación de estudios clínicos y experiencia con pacientes respaldan un perfil de seguridad consolidado 0 de copago* para las personas
Información para el paciente. EGRIFTA (tesamorelin inyectable) para uso subcutáneo
 Información para el paciente EGRIFTA (tesamorelin inyectable) para uso subcutáneo Lea la Información para el paciente que viene con EGRIFTA antes de comenzar a tomar el medicamento y cada vez que resurta
Información para el paciente EGRIFTA (tesamorelin inyectable) para uso subcutáneo Lea la Información para el paciente que viene con EGRIFTA antes de comenzar a tomar el medicamento y cada vez que resurta
inicialcon uptravi (selexipag)
 comprimidos Tratamiento inicialcon uptravi (selexipag) Guía para el ajuste de la dosis Consulte la información de seguridad importante de manera completa y toda la información de prescripción completa
comprimidos Tratamiento inicialcon uptravi (selexipag) Guía para el ajuste de la dosis Consulte la información de seguridad importante de manera completa y toda la información de prescripción completa
Diario de Tratamiento
 PARA PACIENTES CON SÍNTOMAS DE SARCOIDOSIS Diario de Tratamiento H.P. Acthar Gel es un medicamento con receta que se usa para tratar los síntomas de sarcoidosis. INFORMACIÓN IMPORTANTE DE SEGURIDAD Quiénes
PARA PACIENTES CON SÍNTOMAS DE SARCOIDOSIS Diario de Tratamiento H.P. Acthar Gel es un medicamento con receta que se usa para tratar los síntomas de sarcoidosis. INFORMACIÓN IMPORTANTE DE SEGURIDAD Quiénes
GUÍA DEL MEDICAMENTO
 GUÍA DEL MEDICAMENTO Guía del medicamento GUÍA DEL MEDICAMENTO TYSABRI (tai-sa-bri) (natalizumab) inyectable, para uso por vía intravenosa Lea esta Guía del medicamento antes de comenzar a recibir TYSABRI
GUÍA DEL MEDICAMENTO Guía del medicamento GUÍA DEL MEDICAMENTO TYSABRI (tai-sa-bri) (natalizumab) inyectable, para uso por vía intravenosa Lea esta Guía del medicamento antes de comenzar a recibir TYSABRI
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)_Agosto_2016
 KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Salicilato de Sodio (Por vía oral)
 Salicilato de Sodio (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El salicilato de sodio
Salicilato de Sodio (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El salicilato de sodio
Bienvenido a OPEN DOORS
 Bienvenido a OPEN DOORS Programa de apoyo para pacientes con IFP en tratamiento con OFEV (nintedanib) capsules Para obtener más información, llame a OPEN DOORS al 1-866-OPENDOOR (1-866-673-6366) o visite
Bienvenido a OPEN DOORS Programa de apoyo para pacientes con IFP en tratamiento con OFEV (nintedanib) capsules Para obtener más información, llame a OPEN DOORS al 1-866-OPENDOOR (1-866-673-6366) o visite
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Probenecida (Por vía oral)
 Probenecida (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La probenecida se usa en el
Probenecida (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La probenecida se usa en el
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Consulte con su especialista si se encuentra en alguno de los siguientes casos:
 Colchicina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La colchicina se usa para prevenir
Colchicina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La colchicina se usa para prevenir
COMPRENDA SU TRATAMIENTO
 COMPRENDA SU TRATAMIENTO Para obtener más información acerca de una infusión con YONDELIS, mire el video en www.yondelisinfusion.com INTRODUCCIÓN Este folleto le ayudará a responder sus preguntas acerca
COMPRENDA SU TRATAMIENTO Para obtener más información acerca de una infusión con YONDELIS, mire el video en www.yondelisinfusion.com INTRODUCCIÓN Este folleto le ayudará a responder sus preguntas acerca
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Consulte con su especialista si se encuentra en alguno de los siguientes casos:
 Alopurinol (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El alopurinol se usa para tratar
Alopurinol (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El alopurinol se usa para tratar
Esta combinación se receta para compensar los niveles bajos de hormonas después de la menopausia.
 Andrógenos y Estrógenos (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los andrógenos
Andrógenos y Estrógenos (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los andrógenos
La combinación de probenecida y colchicina se usa para tratar la gota o la artritis gotosa.
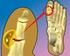 Probenecida y Colchicina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La combinación
Probenecida y Colchicina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La combinación
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Sulfametoxazol y Trimetoprima (Por vía inyectable)
 Sulfametoxazol y Trimetoprima (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La
Sulfametoxazol y Trimetoprima (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La
La mitoxantrona corresponde al grupo general de medicamentos llamados antineoplásicos. Se usa para tratar algunos tipos de cáncer.
 Mitoxantrona (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La mitoxantrona corresponde
Mitoxantrona (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La mitoxantrona corresponde
Diario del tratamiento de su hijo
 ACTHAR PARA LOS ESPASMOS INFANTILES: Diario del tratamiento de su hijo Qué es Acthar? Acthar es un medicamento recetado que se usa para tratar los espasmos infantiles en los bebés y niños de hasta 2 años
ACTHAR PARA LOS ESPASMOS INFANTILES: Diario del tratamiento de su hijo Qué es Acthar? Acthar es un medicamento recetado que se usa para tratar los espasmos infantiles en los bebés y niños de hasta 2 años
La aspirina también se usa para disminuir la posibilidad de una embolia, ataque al corazón u otros problemas causados por coágulos de sangre.
 Aspirina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La aspirina corresponde al grupo
Aspirina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La aspirina corresponde al grupo
Cuadernillo destinado a aquellos pacientes a quienes se les haya prescrito tratamiento con XALKORI (crizotinib)
 Cuadernillo destinado a aquellos pacientes a quienes se les haya prescrito tratamiento con XALKORI (crizotinib) Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
Cuadernillo destinado a aquellos pacientes a quienes se les haya prescrito tratamiento con XALKORI (crizotinib) Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
Inhibidor de la esterasa C1 (recombinante)
 Cuando sufra un ataque de AEH... Confíe en una terapia sin plasma Si está embarazada, planea quedar embarazada o está lactando, consulte a su proveedor de atención médica antes de usar RUCONEST. Los efectos
Cuando sufra un ataque de AEH... Confíe en una terapia sin plasma Si está embarazada, planea quedar embarazada o está lactando, consulte a su proveedor de atención médica antes de usar RUCONEST. Los efectos
GUÍA PARA EL PACIENTE
 (pasireotida) para suspensión inyectable GUÍA PARA EL PACIENTE Su guía del tratamiento con Signifor LAR para la acromegalia Signifor LAR está indicado para el tratamiento de pacientes adultos con acromegalia
(pasireotida) para suspensión inyectable GUÍA PARA EL PACIENTE Su guía del tratamiento con Signifor LAR para la acromegalia Signifor LAR está indicado para el tratamiento de pacientes adultos con acromegalia
Índice de contenidos DESCRIPCIÓN GENERAL. Suplementos de Hierro (Por vía inyectable)
 Suplementos de Hierro (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El hierro
Suplementos de Hierro (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El hierro
que trata eficazmente la esclerosis múltiple (EM) recurrente con 1 inyección cada 2 semanas
 CADA 2 SEMANAS INYECCIÓN SUBCUTÁNEA DE 125 microgramos El ÚNICO interferón que trata eficazmente la esclerosis múltiple (EM) recurrente con 1 inyección cada 2 semanas No tome PLEGRIDY si es alérgico al
CADA 2 SEMANAS INYECCIÓN SUBCUTÁNEA DE 125 microgramos El ÚNICO interferón que trata eficazmente la esclerosis múltiple (EM) recurrente con 1 inyección cada 2 semanas No tome PLEGRIDY si es alérgico al
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Topiramato (Por vía oral)
 Topiramato (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El topiramato se usa para ayudar
Topiramato (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El topiramato se usa para ayudar
Tratamiento de la HAP (grupo 1 de la OMS) para mejorar la capacidad de ejercicio
 Tratamiento de la HAP (grupo de la OMS) para mejorar la capacidad de ejercicio OMS=Organización Mundial de la Salud. Por favor, pase a la página para ver Información importante de seguridad. Cómo empezar
Tratamiento de la HAP (grupo de la OMS) para mejorar la capacidad de ejercicio OMS=Organización Mundial de la Salud. Por favor, pase a la página para ver Información importante de seguridad. Cómo empezar
La vacuna de virus vivos del sarampión es un agente de inmunización que se usa para prevenir la infección por el virus del sarampión.
 Vacuna Anti-Sarampión de Virus Vivos (Por Inyección) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL
Vacuna Anti-Sarampión de Virus Vivos (Por Inyección) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL
La quetiapina se usa para tratar los desórdenes psicóticos, tal como la esquizofrenia.
 Quetiapina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La quetiapina se usa para tratar
Quetiapina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La quetiapina se usa para tratar
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Consulte con su especialista si se encuentra en alguno de los siguientes casos:
 Amitriptilina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La amitriptilina corresponde
Amitriptilina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La amitriptilina corresponde
El metocarbamol también se usa para alivíar problemas de los músculos causados por el tétanos.
 Relajantes Musculares (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los relajantes para
Relajantes Musculares (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los relajantes para
Este medicamento es administrado únicamente bajo la supervisión de su médico.
 Trimetrexato (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El trimetrexato se
Trimetrexato (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El trimetrexato se
Saque el vial de ACTIMMUNE del refrigerador unos 15 minutos antes de la hora de la inyección, para que esté a temperatura ambiente al inyectarlo.
 Cómo inyectar ACTIMMUNE (Interferón gamma-b) Esta guía es un recordatorio útil de cómo preparar y administrar su terapia No administre ACTIMMUNE hasta que haya sido capacitado por un profesional médico
Cómo inyectar ACTIMMUNE (Interferón gamma-b) Esta guía es un recordatorio útil de cómo preparar y administrar su terapia No administre ACTIMMUNE hasta que haya sido capacitado por un profesional médico
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Consulte con su especialista si se encuentra en alguno de los siguientes casos:
 Sulfamidas y Fenazopiridina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Las combinaciones
Sulfamidas y Fenazopiridina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Las combinaciones
Paracetamol: cómo funciona, cuándo debe tomarlo, indicaciones y más
 Paracetamol: cómo funciona, cuándo debe tomarlo, indicaciones y más Para qué enfermedades y síntomas sirve el paracetamol? Usted puede tomar paracetamol en los siguientes casos: Si siente un dolor leve
Paracetamol: cómo funciona, cuándo debe tomarlo, indicaciones y más Para qué enfermedades y síntomas sirve el paracetamol? Usted puede tomar paracetamol en los siguientes casos: Si siente un dolor leve
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Consulte con su especialista si se encuentra en alguno de los siguientes casos:
 Heparina (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La heparina es un anticoagulante.
Heparina (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La heparina es un anticoagulante.
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Anticoagulantes (Por vía oral)
 Anticoagulantes (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los anticoagulantes orales
Anticoagulantes (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los anticoagulantes orales
Información para el paciente
 Garcia de Cossio 6160 C1408EWN Buenos Aires Argentina Tel/Fax: + 54 11 4642 1259 productos@everexpharma.com.ar www.everexpharma.com.ar Información para el paciente INFORMACIÓN PARA EL PACIENTE Lomustina
Garcia de Cossio 6160 C1408EWN Buenos Aires Argentina Tel/Fax: + 54 11 4642 1259 productos@everexpharma.com.ar www.everexpharma.com.ar Información para el paciente INFORMACIÓN PARA EL PACIENTE Lomustina
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Acetaminofeno, Bicarbonato de Sodio y Ácido Cítrico (Por vía oral)
 Acetaminofeno, Bicarbonato de Sodio y Ácido Cítrico (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN
Acetaminofeno, Bicarbonato de Sodio y Ácido Cítrico (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN
Sus movimientos involuntarios podrían deberse a la discinesia tardía (Tardive Dyskinesia, TD)?
 Sus movimientos involuntarios podrían deberse a la discinesia tardía (Tardive Dyskinesia, TD)? Para los adultos con TD, existe un tratamiento conveniente con INGREZZA: Una cápsula, una vez al día. Información
Sus movimientos involuntarios podrían deberse a la discinesia tardía (Tardive Dyskinesia, TD)? Para los adultos con TD, existe un tratamiento conveniente con INGREZZA: Una cápsula, una vez al día. Información
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Eritromicina y Sulfisoxazol (Por vía oral)
 Eritromicina y Sulfisoxazol (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La combinación
Eritromicina y Sulfisoxazol (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La combinación
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Subsalicilato de Bismuto, Metronidazol y Tetraciclina (Por vía oral)
 Subsalicilato de Bismuto, Metronidazol y Tetraciclina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN
Subsalicilato de Bismuto, Metronidazol y Tetraciclina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN
LA INFORMACIÓN QUE NECESITA PARA COMENZAR
 PARA PACIENTES CON SÍNTOMAS DE LA SARCOIDOSIS Su Guía para Acthar LA INFORMACIÓN QUE NECESITA PARA COMENZAR H.P. Acthar Gel es un medicamento con receta que se usa para tratar los síntomas de la sarcoidosis.
PARA PACIENTES CON SÍNTOMAS DE LA SARCOIDOSIS Su Guía para Acthar LA INFORMACIÓN QUE NECESITA PARA COMENZAR H.P. Acthar Gel es un medicamento con receta que se usa para tratar los síntomas de la sarcoidosis.
AVONEX Tratamiento para personas con EM recurrente durante aproximadamente 2 décadas
 AVONEX Tratamiento para personas con EM recurrente durante aproximadamente 2 décadas Consulte a su médico acerca de AVONEX (interferón beta-1a) Para obtener información de seguridad importante, consulte
AVONEX Tratamiento para personas con EM recurrente durante aproximadamente 2 décadas Consulte a su médico acerca de AVONEX (interferón beta-1a) Para obtener información de seguridad importante, consulte
Explorar Opciones de Tratamiento
 PARA PACIENTES CON SÍNTOMAS DE LA SARCOIDOSIS Explorar Opciones de Tratamiento H.P. Acthar Gel es un medicamento con receta que se usa para tratar los síntomas de la sarcoidosis. 2 INFORMACIÓN IMPORTANTE
PARA PACIENTES CON SÍNTOMAS DE LA SARCOIDOSIS Explorar Opciones de Tratamiento H.P. Acthar Gel es un medicamento con receta que se usa para tratar los síntomas de la sarcoidosis. 2 INFORMACIÓN IMPORTANTE
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Consulte con su especialista si se encuentra en alguno de los siguientes casos:
 Doxiciclina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La doxiciclina se usa para
Doxiciclina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La doxiciclina se usa para
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Consulte con su especialista si se encuentra en alguno de los siguientes
 Metoclopramida (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La metoclopramida es un
Metoclopramida (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La metoclopramida es un
Los antiarrítmicos de tipo I se usan para corregir los latidos irregulares a un ritmo normal y para retardar un corazón sobreactivo.
 Antiarrítmicos, Tipo I (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los antiarrítmicos
Antiarrítmicos, Tipo I (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los antiarrítmicos
Los diuréticos ahorradores de potasio se usan comúnmente para ayudar a reducir la cantidad de agua en el cuerpo al aumentar el flujo de orina.
 Diuréticos Ahorradores de Potasio (Por via oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los
Diuréticos Ahorradores de Potasio (Por via oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los
Comunicación dirigida a profesionales sanitarios
 Comunicación dirigida a profesionales sanitarios Tecfidera (dimetilfumarato): Nuevas recomendaciones para minimizar el riesgo de leucoencefalopatía multifocal progresiva. Intensificación de las medidas
Comunicación dirigida a profesionales sanitarios Tecfidera (dimetilfumarato): Nuevas recomendaciones para minimizar el riesgo de leucoencefalopatía multifocal progresiva. Intensificación de las medidas
Guía de infecciones de transmisión sexual (ITS) seleccionadas
 Clamidia Una bacteria que puede infectar el cuello uterino y el útero de la mujer, así como la uretra, la garganta o el ano de hombres y mujeres. La infección por clamidia sin tratar puede ocasionar infertilidad
Clamidia Una bacteria que puede infectar el cuello uterino y el útero de la mujer, así como la uretra, la garganta o el ano de hombres y mujeres. La infección por clamidia sin tratar puede ocasionar infertilidad
La vitamina K se encuentra en varios alimentos incluyendo las verduras de hojas verdes, la carne y los productos lácteos.
 Vitamina K (Por via inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Las vitaminas son compuestos
Vitamina K (Por via inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Las vitaminas son compuestos
PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg
 PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg Lea cuidadosamente este folleto antes de la administración de este medicamento, contiene información importante acerca de su tratamiento. Si
PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg Lea cuidadosamente este folleto antes de la administración de este medicamento, contiene información importante acerca de su tratamiento. Si
Haga frente a la evolución de la IPF con OFEV
 Cada respiración cuenta Haga frente a la evolución de la IPF con OFEV Infórmese más en www.ofev.com IPF=fibrosis pulmonar idiopática Entienda cómo le afecta la IPF La fibrosis pulmonar idiopática (Idiopathic
Cada respiración cuenta Haga frente a la evolución de la IPF con OFEV Infórmese más en www.ofev.com IPF=fibrosis pulmonar idiopática Entienda cómo le afecta la IPF La fibrosis pulmonar idiopática (Idiopathic
Comprender su tratamiento con Tecfidera
 Comprender su tratamiento con Tecfidera Información para pacientes a los que se les ha recetado el tratamiento con Tecfidera. (dimetilfumarato) Contenidos Sobre la esclerosis múltiple (EM) Qué es la EM?
Comprender su tratamiento con Tecfidera Información para pacientes a los que se les ha recetado el tratamiento con Tecfidera. (dimetilfumarato) Contenidos Sobre la esclerosis múltiple (EM) Qué es la EM?
Comprender su tratamiento con Tecfidera
 Comprender su tratamiento con Tecfidera Información para pacientes a los que se les ha recetado el tratamiento con Tecfidera. (dimetilfumarato) Contenidos Sobre la esclerosis múltiple (EM) Qué es la EM?
Comprender su tratamiento con Tecfidera Información para pacientes a los que se les ha recetado el tratamiento con Tecfidera. (dimetilfumarato) Contenidos Sobre la esclerosis múltiple (EM) Qué es la EM?
FOLLETO DE INFORMACION AL PACIENTE. ABRAXANE LIOFILIZADO PARA SUSPENSIÓN INYECTABLE 100 mg
 FOLLETO INFORMACION AL PACIENTE ABRAXANE LIOFILIZADO PARA SUSPENSIÓN INYECTABLE 100 mg NANOPARTICULAS DE PACLITAXEL LIGADO A ALBÚMINA Leer esta Información para el paciente antes de empezar a recibir ABRAXANE
FOLLETO INFORMACION AL PACIENTE ABRAXANE LIOFILIZADO PARA SUSPENSIÓN INYECTABLE 100 mg NANOPARTICULAS DE PACLITAXEL LIGADO A ALBÚMINA Leer esta Información para el paciente antes de empezar a recibir ABRAXANE
Lea todo el Prospecto Información para el Paciente detenidamente antes de recibir este medicamento. Estos datos pueden ser importantes para usted.
 PROSPECTO INFORMACIÓN PARA EL PACIENTE Tecentriq 1.200 mg Concentrado para solución para infusión intravenosa Atezolizumab Autorizado bajo condiciones especiales Expendio bajo receta archivada (Adaptado
PROSPECTO INFORMACIÓN PARA EL PACIENTE Tecentriq 1.200 mg Concentrado para solución para infusión intravenosa Atezolizumab Autorizado bajo condiciones especiales Expendio bajo receta archivada (Adaptado
Haga que su día sea más liviano. Haga que su día sea más liviano. Con Velphoro. Mi meta en cuanto al fósforo es la siguiente:
 Antes de tomar Velphoro, infórmele a su médico si está embarazada, planea quedar embarazada o está amamantando. LA POTENCIA LO HACE POSIBLE Para informar efectos secundarios negativos asociados con Velphoro,
Antes de tomar Velphoro, infórmele a su médico si está embarazada, planea quedar embarazada o está amamantando. LA POTENCIA LO HACE POSIBLE Para informar efectos secundarios negativos asociados con Velphoro,
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Consulte con su especialista si se encuentra en alguno de los siguientes casos:
 Alfacalcidol (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El alfacalcidol es una forma
Alfacalcidol (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El alfacalcidol es una forma
Comprender su tratamiento con Tecfidera. Información para pacientes a los que se les ha recetado el tratamiento con Tecfidera.
 Comprender su tratamiento con Tecfidera Información para pacientes a los que se les ha recetado el tratamiento con Tecfidera. Contenidos Tratamiento con Tecfidera Información sobre la esclerosis múltiple
Comprender su tratamiento con Tecfidera Información para pacientes a los que se les ha recetado el tratamiento con Tecfidera. Contenidos Tratamiento con Tecfidera Información sobre la esclerosis múltiple
UNIDAD ONCOLÓGICA SOLCA TUNGURAHUA HOSPITAL Dr. Julio Enrique Paredes C.
 UNIDAD ONCOLÓGICA SOLCA TUNGURAHUA HOSPITAL Dr. Julio Enrique Paredes C. I CONGRESO INTERNACIONAL DE ONCOLOGÍA: Avances y Retos AVANCES RECIENTES EN LA ADMINISTRACION DE QUIMIOTERAPIA EN CANCER DE MAMA
UNIDAD ONCOLÓGICA SOLCA TUNGURAHUA HOSPITAL Dr. Julio Enrique Paredes C. I CONGRESO INTERNACIONAL DE ONCOLOGÍA: Avances y Retos AVANCES RECIENTES EN LA ADMINISTRACION DE QUIMIOTERAPIA EN CANCER DE MAMA
Sus movimientos involuntarios podrían deberse a la discinesia tardía (Tardive Dyskinesia, TD)? Existe un tratamiento con INGREZZA.
 Chasquidos con la boca, pestañeos, movimientos con las manos y los dedos, sacudones con la cadera... Sus movimientos involuntarios podrían deberse a la discinesia tardía (Tardive Dyskinesia, TD)? Existe
Chasquidos con la boca, pestañeos, movimientos con las manos y los dedos, sacudones con la cadera... Sus movimientos involuntarios podrían deberse a la discinesia tardía (Tardive Dyskinesia, TD)? Existe
EFFERALGAN 500 mg EFERVESCENTE Paracetamol
 Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Consulte con su especialista si se encuentra en alguno de los siguientes casos:
 Lincomicina (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Las lincomicinas corresponden
Lincomicina (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Las lincomicinas corresponden
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Consulte con su especialista si se encuentra en alguno de los siguientes casos:
 Timolol (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El timolol corresponde al grupo
Timolol (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El timolol corresponde al grupo
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Factor Antihemofílico (Por vía inyectable)
 Factor Antihemofílico (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El factor
Factor Antihemofílico (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El factor
Cómo empezar a tomar JYNARQUE (tolvaptan)
 Cómo empezar a tomar JYNARQUE (tolvaptan) Cómo prepararse para usar JYNARQUE (tolvaptan) Este recurso puede ayudarlo al el tratamiento si usted y su médico han decidido que JYNARQUE, el primer y único
Cómo empezar a tomar JYNARQUE (tolvaptan) Cómo prepararse para usar JYNARQUE (tolvaptan) Este recurso puede ayudarlo al el tratamiento si usted y su médico han decidido que JYNARQUE, el primer y único
FOLLETO DE INFORMACIÓN AL PACIENTE. SIMPONI I.V. GOLIMUMAB 50 mg/4,0 ml Solución para infusión intravenosa
 FOLLETO DE INFORMACIÓN AL PACIENTE SIMPONI I.V. GOLIMUMAB 50 mg/4,0 ml Solución para infusión intravenosa Industria Suiza Venta bajo receta médica Cuál es la información más importante que debo saber sobre
FOLLETO DE INFORMACIÓN AL PACIENTE SIMPONI I.V. GOLIMUMAB 50 mg/4,0 ml Solución para infusión intravenosa Industria Suiza Venta bajo receta médica Cuál es la información más importante que debo saber sobre
Este medicamento también se puede usar para otras condiciones según lo determine su médico.
 Yoduro de Potasio (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El yoduro de potasio
Yoduro de Potasio (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El yoduro de potasio
Lea todo el prospecto antes de empezar a usar el medicamento.
 Lea todo el prospecto antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este medicamento
Lea todo el prospecto antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este medicamento
SÍNDROME HEMOLÍTICO URÉMICO ATÍPICO
 70 SÍNDROME HEMOLÍTICO URÉMICO ATÍPICO 10 Introducción: El Síndrome Hemolítico Urémico Atípico (SHUa) es una enfermedad ultra rara que afecta principalmente a los riñones pero también puede afectar a otros
70 SÍNDROME HEMOLÍTICO URÉMICO ATÍPICO 10 Introducción: El Síndrome Hemolítico Urémico Atípico (SHUa) es una enfermedad ultra rara que afecta principalmente a los riñones pero también puede afectar a otros
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Caolín, Pectina y Paregórico (Por vía oral)
 Caolín, Pectina y Paregórico (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El medicamento
Caolín, Pectina y Paregórico (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El medicamento
ANASTROZOL COMPRIMIDOS RECUBIERTOS 1 mg. COMPOSICIÓN Cada comprimido recubierto contiene: Excipientes: Según lo aprobado en Registro
 ANASTROZOL COMPRIMIDOS RECUBIERTOS 1 mg COMPOSICIÓN Cada comprimido recubierto contiene: Anastrozol 1 mg Excipientes: Según lo aprobado en Registro CLASIFICACION TERAPEUTICA Antineoplásico INDICACIONES
ANASTROZOL COMPRIMIDOS RECUBIERTOS 1 mg COMPOSICIÓN Cada comprimido recubierto contiene: Anastrozol 1 mg Excipientes: Según lo aprobado en Registro CLASIFICACION TERAPEUTICA Antineoplásico INDICACIONES
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Consulte con su especialista si se encuentra en alguno de los siguientes casos:
 Minociclina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La minociclina se usa para
Minociclina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La minociclina se usa para
FICHA DE INFORMACIÓN AL PACIENTE: LINCOMICINA
 FICHA DE INFORMACIÓN AL PACIENTE: LINCOMICINA 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Antibiótico con acción bacteriostática. 1.2 Cómo actúa este fármaco: La lincomicina actúa impidiendo que las bacterias
FICHA DE INFORMACIÓN AL PACIENTE: LINCOMICINA 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Antibiótico con acción bacteriostática. 1.2 Cómo actúa este fármaco: La lincomicina actúa impidiendo que las bacterias
Deberá realizarse controles de la función cardiaca mientras toma este medicamento. Consulte con su médico.
 EDUCACIÓN DE PACIENTES Y CUIDADORES Trastuzumab Marcas estadounidenses Herceptin Marcas canadienses Herceptin Advertencia Se han producido reacciones a la infusión muy g raves con este medicamento. La
EDUCACIÓN DE PACIENTES Y CUIDADORES Trastuzumab Marcas estadounidenses Herceptin Marcas canadienses Herceptin Advertencia Se han producido reacciones a la infusión muy g raves con este medicamento. La
La cafeína también se puede usar para otras condiciones según lo determine su médico.
 Cafeína (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La cafeína corresponde al grupo
Cafeína (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La cafeína corresponde al grupo
INFORMACIÓN IMPORTANTE PARA EL PACIENTE
 Si experimenta cualquier po de efecto adverso, consulte a su médico o farmacéu co, incluso si se trata de posibles efectos adveros que no aparecen en el prospecto. También puede comunicarlos directamente
Si experimenta cualquier po de efecto adverso, consulte a su médico o farmacéu co, incluso si se trata de posibles efectos adveros que no aparecen en el prospecto. También puede comunicarlos directamente
Esclerosis múltiple: síntomas y tratamientos
 Esclerosis múltiple: síntomas y tratamientos La esclerosis múltiple, o EM, es una enfermedad de larga duración que puede afectar su cerebro, la médula espinal y los nervios ópticos en sus ojos. Puede causar
Esclerosis múltiple: síntomas y tratamientos La esclerosis múltiple, o EM, es una enfermedad de larga duración que puede afectar su cerebro, la médula espinal y los nervios ópticos en sus ojos. Puede causar
FICHA DE INFORMACIÓN AL PACIENTE: AMPICILINA
 FICHA DE INFORMACIÓN AL PACIENTE: AMPICILINA 1.1 Acción: Antibiótico con acción bactericida. 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.2 Cómo actúa este fármaco: Las penicilinas bloquean la formación de las paredes
FICHA DE INFORMACIÓN AL PACIENTE: AMPICILINA 1.1 Acción: Antibiótico con acción bactericida. 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.2 Cómo actúa este fármaco: Las penicilinas bloquean la formación de las paredes
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Radiofármacos (Diagnósticos)
 Radiofármacos (Diagnósticos) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los radiofármacos son agentes
Radiofármacos (Diagnósticos) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los radiofármacos son agentes
Prospecto: información para el usuario
 Prospecto: información para el usuario TERBINAFINA ALTER 250 mg comprimidos EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto. Puede tener que volver
Prospecto: información para el usuario TERBINAFINA ALTER 250 mg comprimidos EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto. Puede tener que volver
Confidencial INFORMACIÓN PARA EL PACIENTE BENDAMUSTINA 25 BENDAMUSTINA 100. Polvo Liofilizado para Solución Inyectable
 INFORMACIÓN PARA EL PACIENTE BENDAMUSTINA 25 BENDAMUSTINA 100 Polvo Liofilizado para Solución Inyectable Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto,
INFORMACIÓN PARA EL PACIENTE BENDAMUSTINA 25 BENDAMUSTINA 100 Polvo Liofilizado para Solución Inyectable Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto,
sistema inmunitario está diseñado para combatir las substancias ajenas o extrañas al cuerpo. En las personas con lupus, el sistema inmunitario se
 LUPUS El sistema inmunitario está diseñado para combatir las substancias ajenas o extrañas al cuerpo. En las personas con lupus, el sistema inmunitario se afecta y ataca a las células y tejidos sanos.
LUPUS El sistema inmunitario está diseñado para combatir las substancias ajenas o extrañas al cuerpo. En las personas con lupus, el sistema inmunitario se afecta y ataca a las células y tejidos sanos.
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Consulte con su especialista si se encuentra en alguno de los siguientes casos:
 Oxitetraciclina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La oxitetraciclina se
Oxitetraciclina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La oxitetraciclina se
tarjeta de seguridad para el paciente tarjeta de seguridad para el paciente Qué es Soliris? Es importante que usted:
 Su médico le entregará una tarjeta de seguridad para el paciente en la que se describe el riesgo de contraer infecciones meningocócicas. Llévela siempre con usted durante el tratamiento y durante 3 meses
Su médico le entregará una tarjeta de seguridad para el paciente en la que se describe el riesgo de contraer infecciones meningocócicas. Llévela siempre con usted durante el tratamiento y durante 3 meses
Prospecto. Terbinafina Pensa 250 mg comprimidos EFG. Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento.
 Prospecto Terbinafina Pensa 250 mg comprimidos EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna
Prospecto Terbinafina Pensa 250 mg comprimidos EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna
PARA PERSONAS TRATADAS CON XELJANZ,
 SPANISH XELJANZ Este folleto está dirigido a personas a quienes se ha prescrito XELJANZ. Encontrará más información en el prospecto de envase incluido en el fármaco. PARA PERSONAS TRATADAS CON XELJANZ,
SPANISH XELJANZ Este folleto está dirigido a personas a quienes se ha prescrito XELJANZ. Encontrará más información en el prospecto de envase incluido en el fármaco. PARA PERSONAS TRATADAS CON XELJANZ,
Antes de comenzar su tratamiento con Soliris.
 Desea obtener más información acerca de Soliris? Visite www.soliris.net o www.solirisrems.com Llame al 1.888.SOLIRIS (1.888.765.4747) Para analizar con los pacientes: Información importante de seguridad
Desea obtener más información acerca de Soliris? Visite www.soliris.net o www.solirisrems.com Llame al 1.888.SOLIRIS (1.888.765.4747) Para analizar con los pacientes: Información importante de seguridad
FICHA DE INFORMACIÓN AL PACIENTE: CLINDAMICINA
 FICHA DE INFORMACIÓN AL PACIENTE: CLINDAMICINA 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Antibiótico con acción bacteriostática. 1.2 Cómo actúa este fármaco: La clindamicina actúa impidiendo que las
FICHA DE INFORMACIÓN AL PACIENTE: CLINDAMICINA 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Antibiótico con acción bacteriostática. 1.2 Cómo actúa este fármaco: La clindamicina actúa impidiendo que las
Anexo III. Modificaciones a las secciones relevantes de ficha técnica y prospecto
 Anexo III Modificaciones a las secciones relevantes de ficha técnica y prospecto Nota: La ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados posteriormente
Anexo III Modificaciones a las secciones relevantes de ficha técnica y prospecto Nota: La ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados posteriormente
Aurene. Oxcarbazepina. Comprimidos Industria Argentina Venta bajo receta archivada
 Aurene Oxcarbazepina Comprimidos Industria Argentina Venta bajo receta archivada FORMULA: Cada comprimido de contiene: Aurene 300 mg: Oxcarbazepina 300 mg Aurene 600 mg: Oxcarbazepina 600 mg Excipientes:
Aurene Oxcarbazepina Comprimidos Industria Argentina Venta bajo receta archivada FORMULA: Cada comprimido de contiene: Aurene 300 mg: Oxcarbazepina 300 mg Aurene 600 mg: Oxcarbazepina 600 mg Excipientes:
Nombre comercial: Herceptin Nombre genérico: Trastuzumab
 Trastuzumab Nombre comercial: Herceptin Nombre genérico: Trastuzumab Tipo de fármaco: trastuzumab es un anticuerpo monoclonal. (Para obtener más detalles, vea más abajo la sección "Cómo actúa este fármaco").
Trastuzumab Nombre comercial: Herceptin Nombre genérico: Trastuzumab Tipo de fármaco: trastuzumab es un anticuerpo monoclonal. (Para obtener más detalles, vea más abajo la sección "Cómo actúa este fármaco").
FICHA DE INFORMACIÓN AL PACIENTE: TRANILCIPROMINA
 FICHA DE INFORMACIÓN AL PACIENTE: TRANILCIPROMINA 1.1 Acción: Antidepresivo. 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.2 Cómo actúa este fármaco: Inhibe un enzima (MAO) que interviene en la degradación de neurotransmisores,
FICHA DE INFORMACIÓN AL PACIENTE: TRANILCIPROMINA 1.1 Acción: Antidepresivo. 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.2 Cómo actúa este fármaco: Inhibe un enzima (MAO) que interviene en la degradación de neurotransmisores,
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA
 La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
GUÍA PARA MI CONVERSACIÓN
 PBC Actualmente estoy tomando OCALIVA (ácido obeticólico) GUÍA PARA MI CONVERSACIÓN Obtenga el mayor provecho de su tratamiento con OCALIVA. Esta guía no está concebida para reemplazar los consejos de
PBC Actualmente estoy tomando OCALIVA (ácido obeticólico) GUÍA PARA MI CONVERSACIÓN Obtenga el mayor provecho de su tratamiento con OCALIVA. Esta guía no está concebida para reemplazar los consejos de
Cuestionario de Historia de la Salud
 MRN# RANCHO MEMORY CLINIC RANCHO LOS AMIGOS REHABILITATION HOSPITAL FECHA: NOMBRE: OCUPACIÓN: Cuestionario de Historia de la Salud EDUCACIÓN: EDAD: HANDEDNESS: DERECHO IZQUIERDA QUIEN LO REFIRO A NUESTRA
MRN# RANCHO MEMORY CLINIC RANCHO LOS AMIGOS REHABILITATION HOSPITAL FECHA: NOMBRE: OCUPACIÓN: Cuestionario de Historia de la Salud EDUCACIÓN: EDAD: HANDEDNESS: DERECHO IZQUIERDA QUIEN LO REFIRO A NUESTRA
La aminofilina y la teofilina también se pueden usar para otras condiciones según lo determine su médico.
 Broncodilatadores de Teofilina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los broncodilatadores
Broncodilatadores de Teofilina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los broncodilatadores
