Soluciones y dispersiones
|
|
|
- Marta Lozano Ortíz
- hace 9 años
- Vistas:
Transcripción
1 COLOIDES 2016
2 Soluciones y dispersiones Soluciones verdaderas Mezcla de especies dispersadas como moléculas individuales Soluto y disolvente con pesos moleculares comparables DG < 0: Termodinam. estables Dispersiones coloidales Fase dispersa y fase dispersante partículas 1 nm 10 mm DG < 0 o > 0. Requieren energía mecánica Inestables, se separan espontáneamente (requieren agentes estabilizantes)
3 Soluciones y dispersiones SOLUCIONES COLOIDES SUSPENSIONES No sedimentan No sedimentan Sedimentan en reposo Pasan a través de papel de filtro ordinario y a través de membranas No dispersan la luz Afectan a las propiedades coligativas Tamaño de partícula > 1nm No presentan movimiento browniano Pasan a través de papel de filtro ordinario y se separan mediante una membrana Dispersan la luz (efecto Tyndall) No afectan a las propiedades coligativas Tamaño de partícula entre nm Presentan movimiento browniano Se separan mediante papel de filtro ordinario y mediante una membrana Dispersan la luz (opacas) No afectan a las propiedades coligativas Tamaño de partícula > nm No presentan movimiento browniano
4 Sistemas coloidales leche, manteca, mayonesa niebla pinturas cosméticos prod. farmacéuticos, agroquímicos
5 Soluciones y dispersiones Soluciones verdaderas Dispersiones coloidales DG=DH-T DS DH > 0 o < 0 DS >0 DG < 0 DH 0 DS pequeño DG < 0 o > 0 La línea entre solubilidad e insolubilidad es frágil
6 Cómo diferenciar soluciones verdaderas de dispersiones coloidales? Efecto Tyndall Solución No ocurre dispersión de la luz Solución Ocurre dispersión de la luz
7 Características principales de las dispersiones coloidales Gran relación área/volumen Efectos superficiales Dispersión de la luz Efecto Tyndall, opalescencia, observables con microscopio Potencial de superficie Esencial en la estabilidad de la suspensión Sedimentación en campo centrífugo Método de separación de coloides de la dispersión Propiedades reológicas, viscosidad Textura
8 Clasificación en función del estado físico de las fases F. dispersa F. dispersante Nombre Ejemplos Gas Líquido Espuma líquida Espuma de afeitar, de jabón o de cerveza; merengue, crema batida Gas Sólido Espuma sólida, xerogel Espuma de poliuretano, lava, piedra pómez, esponja, malvavisco Líquido Gas Aerosol líquido Niebla, neblina, nubes Líquido Líquido Emulsión Leche, mayonesa, aderezo para ensalada, cremas Líquido Sólido Emulsión sólida o Gel Manteca, queso, helado, jaleas, gelatina, mermeladas Sólido Gas Aerosol sólido Humo, virus que se transporta por el aire Sólido Líquido Dispersión, Sol, Suspensión Sólido Sólido Dispersión o sol o suspensión sólida Pintura, tinta, pasta dientes, suspensiones de almidón, leche de magnesia, lodo Aleaciones, vidrios de colores, ópalo, porcelana, plásticos pigmentados, cauchos reforzados, perlas
9 Clasificación en función de la afinidad por la fase dispersante LIÓFILOS LIÓFOBOS Afinidad por el medio de dispersión No hay afinidad por el medio de dispersión Componentes miscibles Componentes inmiscibles Termodinámicamente estables (DG<0) Termodinámicamente inestables (DG>0) Admiten altas concentraciones de fase dispersa Incluyen a los coloides de asociación y disoluciones de macromoléculas Son reversibles Efecto Tyndall poco notable Poca sensibilidad a los electrolitos Más cinéticamente estables Agentes espesantes Viscosidad muy aumentada respecto de la del medio dispersante Tensión superficial menor que la del medio dispersante Estables sólo a pequeñas concentraciones de fase dispersa Son irreversibles Movimiento browniano Intenso efecto Tyndall Alta sensibilidad a los electrolitos Presentan una gran área superficial La agregación de las partículas de la fase dispersa se previene mediante un mecanismo de repulsión adecuado Viscosidad y tensión superficial similar a la del medio dispersante
10 Clasificación en función de la estabilidad DISPERSIÓN COLOIDAL Termodinámicamente inestables debido a la enegía libre de superficie. Estables cinéticamente DISOLUCIÓN DE MACROMOLÉCULAS Termodinámicamente estables COLOIDES DE ASOCIACIÓN Termodinámicamente metaestables, se forman por reducción del área superficial
11 ESTABILIDAD TERMODINÁMICA Estable Inestable Liófilos Liófobos CINÉTICA Estable Inestable
12 ESTABILIDAD COLOIDAL Un sistema evolucionará espontáneamente hacia el estado con menor energía libre (DG < 0) SOLUCIONES DG < 0 Mezcla espontánea DISPERSIONES DG > 0 Sistema estable cinéticamente Si es lenta Mezcla no espontánea Separación de fases espontánea Cinética? Energéticamente metaestable Proteger a las partículas dispersadas contra la agregación Interacciones repulsivas
13 Estabilidad de coloides liófilos Interacciones de las moléculas dispersadas con las del dispersante en el seno de la solución Estudio termodinámico con enfoques similares a los utilizados para soluciones verdaderas Varias teorías desarrollan el cálculo de m 1 modelos propuestos para la disolución y m 2 a través de distintos Para concentraciones en que m 1 < m 10, la macromolécula será soluble dando un solución coloidad estable Para concentraciones en que m 1 m 10, el exceso de soluto por encima de una concentración S se separará como soluto sólido. La solubilidad es función del sistema disolvente (solvente mismo y cosolventes).
14 Coloides obligados Polisacáridos Lípidos, fosfolípidos Proteínas Lipopolisacáridos Ácidos nucleicos Macromoléculas biológicas o biomoléculas Coloides liófilos Propiedades coloidales Propiedades reológicas,visc. Turbidez Dispersión de luz Agregación y sedimentación Electroforesis Gelificación Agregados macromoleculares Carácter anfifílico Coloides de asociación Micelas Lamelas Vesículas Agregados coloidales
15 Estabilidad de coloides liófobos La dispersión se lleva a cabo con un aumento de energía libre La asociación de sus partículas o separación de fases progresa con disminución de G Prevención de la asociación: barrera de energía el sistema permanece en un estado metaestable por algún tiempo útil o vital para alguna aplicación Energía necesaria movimiento browniano de las partículas coloidales: energía traslacional promedio (por partícula) = 3/2 k B T
16 Estabilidad de coloides liófobos Barrera de energía = nk B T probabilidad de colisiones con suficiente energía para superar la barrera estará en relación al valor de n Un coloide es estable si permanece en un estado energéticamente metaestable por un tiempo arbitraria o funcionalmente fijado Es inestable si el sistema comienza a perder propiedades coloidales antes que el tiempo predeterminado haya pasado. Estos términos son relativos y son utilizados en el contexto de una aplicación
17 Estabilidad de coloides liófobos ESTABILIDAD Intensidad de la barrera de energía Estabililidad electroestática Estabililidad estérica Fuerzas atractivas Fuerzas repulsivas
18 Estabilización electrostática Fuerzas atractivas (F A ) Fuerzas atractivas de van der Waals dipolo permanente-dipolo inducido (Debye) dipolo permanente-dipolo permanente (Keesom) dipolo inducido-dipolo inducido (London)
19 Estabilización electrostática Fuerzas atractivas (F A ) Repulsión de Born x x DG = A x 6 Las FA aumentan a medida que x decrece DG = B x 12 Cuando las nubes electrónicas de las dos partículas interactúan y se solapan DG A B 12 r DG A = B x 12 A x 6 A 6 r x a = radio de la partícula
20 Fuerzas electrostáticas repulsivas La ionización de los grupos de la superficie de una partícula o la adsorción de iones le proporcionan carga eléctrica potencial electrostático superficial Y 0 dependen del ph fuerza de repulsión entre las partículas que tienen un Y 0 del mismo signo DG R x
21 Fuerzas electrostáticas repulsivas Doble capa eléctrica -1 = l Y = Y 0 e - x aproximación de Debye-Hückel cuando x 0 0 cuando x 0
22 Fuerzas electrostáticas repulsivas Doble capa eléctrica Y = Y 0 e - x = 2 8 e N 1000 k A B m T m = 1 2 = la constante dieléctrica k B = constante de Boltzman m = fuerza iónica i 2 z i M i dependencia de con la concentración y valencia de los electrolitos en solución
23 TEORÍA DLVO (Deryagin-Landau-Verwey-Overbeek) Estudia los efectos combinados de la repulsión electrostática y de la atracción de Van der Waals DG neta = DG R + DG A DG neta barrera de energía a x Cuando x 0 DG R constante y DG A Cuando x DG R y DG A 0, con DG R disminuyendo más rápidamente mínimo secundario floculación reversible mínimo primario coagulación irreversible Si DG max < k B T sistema flocula inestable Si DG max >> k B T part. no contactan sist. estable Si DG max > k B T floculación reversible
24 ESTABILIDAD COLOIDAL DG g = m g Dh C) Cae espontáneamente DG < 0 A Dh C Niveles relativos de energía
25 ESTABILIDAD COLOIDAL DG g = m g Dh > 0 A B B) No supera la barrera de energía DGmax >> k B T Dh C C) Supera la barrera de energía (DG < k B T ) Niveles relativos de energía
26 Estabilidad estérica porción estabilizante presencia de cadenas moleculares poliméricas sobre la superficie de la partícula soluble en el medio de dispersión ancla o amarradura copolímero anfipático Interpenetración Compresión Efecto osmótico Restricción entrópica o de volumen
27 Estabilidad estérica Tamaño de la porción estabilizante Principales factores de la estabilización estérica Número de colas o lazos por unidad de área Interacciones polímero-solvente (F-H) Forma de anclaje del polímero a la superficie Estabilidad estérica óptima Superficie de la partícula está totalmente cubierta por el copolímero anfipático Firme anclaje del polímero Capa de un cierto grosor La porción estabilizante debe estar en un entorno adecuado La repulsión estérica puede ser contrarrestada por tres mecanismos Desorción de las cadenas desde la superficie Movimientos laterales de las cadenas estabilizadoras Uniones entre partículas a través de las cadenas estabilizantes de una en la superficie de la otra
28 Estabilidad estérica La inestabilidad puede ser inducida por disminución de la capacidad solvente del medio de dispersión sobre las porciones extendidas Cambios de temperatura Incrementos de presión Agregado de un solvente no miscible Escisión de la porción estabilizante (enzimas) punto crítico de floculación
Coloides en la vida diaria
 COLOIDES 2017 Por qué la leche es blanca? Por qué se corta si la dejamos fuera de la heladera? Por qué para preparar mayonesa hay que batir? Por qué la receta lleva huevo? Por qué la clara de huevo es
COLOIDES 2017 Por qué la leche es blanca? Por qué se corta si la dejamos fuera de la heladera? Por qué para preparar mayonesa hay que batir? Por qué la receta lleva huevo? Por qué la clara de huevo es
UNIVERSIDAD CENTRAL DE VENEZUELA ESCUELA DE AGRONOMÍA FACULTAD DE AGRONOMÍA DEPARTAMENTO DE QUIMÍCA Y TECNOLOGÍA CÁTEDRA QUÍMICA ANALÍTICA
 UNIVERSIDAD CENTRAL DE VENEZUELA ESCUELA DE AGRONOMÍA FACULTAD DE AGRONOMÍA DEPARTAMENTO DE QUIMÍCA Y TECNOLOGÍA CÁTEDRA QUÍMICA ANALÍTICA Venezuela-Maracay Contenido: Importancia. Qué es un coloide? Clasificación
UNIVERSIDAD CENTRAL DE VENEZUELA ESCUELA DE AGRONOMÍA FACULTAD DE AGRONOMÍA DEPARTAMENTO DE QUIMÍCA Y TECNOLOGÍA CÁTEDRA QUÍMICA ANALÍTICA Venezuela-Maracay Contenido: Importancia. Qué es un coloide? Clasificación
Tema 2: Dispersiones (1) Material preparado por VChan 1
 MATERIA: Cualquier cosa que ocupa espacio y tiene masa. Es todo lo que nos rodea. 2.1 Proceso de disolución Velocidad de disolución Material preparado por: Licda. Victoria Chan Escuela de Química/ ITCR
MATERIA: Cualquier cosa que ocupa espacio y tiene masa. Es todo lo que nos rodea. 2.1 Proceso de disolución Velocidad de disolución Material preparado por: Licda. Victoria Chan Escuela de Química/ ITCR
C O L O I D E S Y SUSPENCIONES
 C O L O I D E S Y SUSPENCIONES 1 C O L O I D E S SOLUCIÓN IDEAL SUSPENSIÓN COLOIDAL CRISTALES PRECIPITADOS HOMOGÉNEA SEMI-HOMOGÉNEA HETEROGÉNEA Fase dispersa : Partículas (sólidos) suspendidas en un medio
C O L O I D E S Y SUSPENCIONES 1 C O L O I D E S SOLUCIÓN IDEAL SUSPENSIÓN COLOIDAL CRISTALES PRECIPITADOS HOMOGÉNEA SEMI-HOMOGÉNEA HETEROGÉNEA Fase dispersa : Partículas (sólidos) suspendidas en un medio
Coloides y Suspensiones Osmosis y Diálisis. SEMANA 10 Licda. Lilian Judith Guzmán Melgar
 Coloides y Suspensiones Osmosis y Diálisis SEMANA 10 Licda. Lilian Judith Guzmán Melgar SUSPENSIONES Las suspensiones son mezclas heterogéneas formadas por una fase sólida (polvo o pequeñas partículas
Coloides y Suspensiones Osmosis y Diálisis SEMANA 10 Licda. Lilian Judith Guzmán Melgar SUSPENSIONES Las suspensiones son mezclas heterogéneas formadas por una fase sólida (polvo o pequeñas partículas
Interacciones a nivel de la interfase y otros fenómenos interfaciales. Capítulo 3: Propiedades físicoquímicas de sistemas dispersos
 Interacciones a nivel de la interfase y otros fenómenos interfaciales Capítulo 3: Propiedades físicoquímicas de sistemas dispersos Lunes, 7 de septiembre de 2009 Las fuerzas de interacción entre interfases
Interacciones a nivel de la interfase y otros fenómenos interfaciales Capítulo 3: Propiedades físicoquímicas de sistemas dispersos Lunes, 7 de septiembre de 2009 Las fuerzas de interacción entre interfases
M A T E R I A L E S. Sistemas dispersivos
 M A T E R I A L E S Sistemas dispersivos I FISICOQUIMICA DE SUPERFICIES SUPERFICIE: es la superficie de contacto entre un gas y una fase condensada (líquido o sólido). INTERFASE: es la superficie de contacto
M A T E R I A L E S Sistemas dispersivos I FISICOQUIMICA DE SUPERFICIES SUPERFICIE: es la superficie de contacto entre un gas y una fase condensada (líquido o sólido). INTERFASE: es la superficie de contacto
M A T E R I A L E S. Sistemas dispersivos
 M A T E R I A L E S Sistemas dispersivos I FISICOQUIMICA DE SUPERFICIES SUPERFICIE: es la superficie de contacto entre un gas y una fase condensada (líquido o sólido). INTERFASE: es la superficie de contacto
M A T E R I A L E S Sistemas dispersivos I FISICOQUIMICA DE SUPERFICIES SUPERFICIE: es la superficie de contacto entre un gas y una fase condensada (líquido o sólido). INTERFASE: es la superficie de contacto
SISTEMA DISPERSO. Fase interna, discontinua o dispersa. Fase externa, continua o dispersante
 SISTEMA DISPERSO Fase interna, discontinua o dispersa Fase externa, continua o dispersante Tipos de sistema disperso TIPO DE DISPERSION TAMAÑO DE PARTICULA EJEMPLO Molecular (disolución) Coloidal < 1 nm
SISTEMA DISPERSO Fase interna, discontinua o dispersa Fase externa, continua o dispersante Tipos de sistema disperso TIPO DE DISPERSION TAMAÑO DE PARTICULA EJEMPLO Molecular (disolución) Coloidal < 1 nm
FACULTAD DE MEDICINA LICENCIATURA EN NUTRICIÓN FISICOQUÍMICA SEPTIEMBRE 2015
 UNIVERSIDAD AUTÓNOMA DEL ESTADO DE MÉXICO FACULTAD DE MEDICINA LICENCIATURA EN NUTRICIÓN FISICOQUÍMICA SEPTIEMBRE 2015 ESTADOS DE DISPERSIÓN Dra. en C.A.R.N YAMEL LIBIEN JIMÉNEZ SEPTIEMBRE 2015 OBJETIVO
UNIVERSIDAD AUTÓNOMA DEL ESTADO DE MÉXICO FACULTAD DE MEDICINA LICENCIATURA EN NUTRICIÓN FISICOQUÍMICA SEPTIEMBRE 2015 ESTADOS DE DISPERSIÓN Dra. en C.A.R.N YAMEL LIBIEN JIMÉNEZ SEPTIEMBRE 2015 OBJETIVO
Clasificación de la materia
 Clasificación de la materia La materia puede estar en forma de sustancias puras o mezclas. Materia Sustancias Puras Mezclas Elemento Compuesto Homogéneas Heterogéneas Disoluciones Coloides Suspensiones
Clasificación de la materia La materia puede estar en forma de sustancias puras o mezclas. Materia Sustancias Puras Mezclas Elemento Compuesto Homogéneas Heterogéneas Disoluciones Coloides Suspensiones
Propiedades funcionales
 Propiedades funcionales Se define como: toda propiedad no nutricional que influencia la utilidad de un ingrediente en un alimento. La mayor parte de las propiedades funcionales influyen sobre el carácter
Propiedades funcionales Se define como: toda propiedad no nutricional que influencia la utilidad de un ingrediente en un alimento. La mayor parte de las propiedades funcionales influyen sobre el carácter
Tema 2 Dispersiones (1)
 Tema 2 Dispersiones (1) 2.1 Velocidad de disolución Material preparado por: Licda. Victoria Chan Escuela de Química/ ITCR MATERIA:Cualquier cosa que ocupa espacio y tiene masa. Es todo lo que nos rodea.
Tema 2 Dispersiones (1) 2.1 Velocidad de disolución Material preparado por: Licda. Victoria Chan Escuela de Química/ ITCR MATERIA:Cualquier cosa que ocupa espacio y tiene masa. Es todo lo que nos rodea.
Clasificación de los sistemas dispersos según el tamaño de las partículas de la fase interna
 Clasificación de los sistemas dispersos según el tamaño de las partículas de la fase interna Denominación Características Ejemplo Disoluciones Tamaño de partícula de la fase dispersa menor de 1 nm. La
Clasificación de los sistemas dispersos según el tamaño de las partículas de la fase interna Denominación Características Ejemplo Disoluciones Tamaño de partícula de la fase dispersa menor de 1 nm. La
SISTEMAS MATERIALES. Departamento de Física y Química 2º ESO
 SISTEMAS MATERIALES Departamento de Física y Química 2º ESO 0. Mapa conceptual MATERIA Sustancias puras Mezclas Heterogéneas Homogéneas Sistemas coloidales Técnicas de separación Disoluciones Soluto Disolvente
SISTEMAS MATERIALES Departamento de Física y Química 2º ESO 0. Mapa conceptual MATERIA Sustancias puras Mezclas Heterogéneas Homogéneas Sistemas coloidales Técnicas de separación Disoluciones Soluto Disolvente
Tema 8: Disoluciones y sus propiedades
 Tema 8: Disoluciones y sus propiedades Francisco G. Calvo-Flores Contenidos 8-1 Disoluciones y tipos 8-2 Unidades de concentración 8-3 Disoluciones ideales y no ideales 8-4 Formación de disoluciones: equilibrio
Tema 8: Disoluciones y sus propiedades Francisco G. Calvo-Flores Contenidos 8-1 Disoluciones y tipos 8-2 Unidades de concentración 8-3 Disoluciones ideales y no ideales 8-4 Formación de disoluciones: equilibrio
TRATADO DE TECNOLOGÍA FARMACÉUTICA (VOL. I) HACIA UNA QUÍMICA PARA EL SIGLO XXI
 TRATADO DE TECNOLOGÍA FARMACÉUTICA (VOL. I) HACIA UNA QUÍMICA PARA EL SIGLO XXI Proyecto editorial BiBlioteca de Químicas director: Carlos Seoane Prado catedrático de Química orgánica universidad complutense
TRATADO DE TECNOLOGÍA FARMACÉUTICA (VOL. I) HACIA UNA QUÍMICA PARA EL SIGLO XXI Proyecto editorial BiBlioteca de Químicas director: Carlos Seoane Prado catedrático de Química orgánica universidad complutense
El primer caso es un ejemplo de mezcla heterogénea porque aprecias los componentes que la forman.
 Otras disoluciones por Cristina Andrade Guevara Figura 1. Glass of water Figura 3. Glass of water Supón que tienes un vaso con agua y le agregas aserrín. Durante algún tiempo, las partículas de aserrín
Otras disoluciones por Cristina Andrade Guevara Figura 1. Glass of water Figura 3. Glass of water Supón que tienes un vaso con agua y le agregas aserrín. Durante algún tiempo, las partículas de aserrín
1. MATERIA Y SU ASPECTO
 1. MATERIA Y SU ASPECTO El aspecto de un sistema material puede variar según el método de observación. Algunos sistemas materiales como la leche, la sangre o la mantequilla a simple vista parecen uniformes,
1. MATERIA Y SU ASPECTO El aspecto de un sistema material puede variar según el método de observación. Algunos sistemas materiales como la leche, la sangre o la mantequilla a simple vista parecen uniformes,
SUSPENSIONES. Mercedes Fernández Arévalo
 Mercedes Fernández Arévalo CLASIFICACIÓN DE OSTWALD FI Ø part. > 0.1 µm Dispersiones groseras 0.1 µm m > Ø part. > 0.001 µm Coloides Ø part. < 0.1 µm Soluciones verdades ESTADO DE AGREGACIÓN DE LA MATERIA
Mercedes Fernández Arévalo CLASIFICACIÓN DE OSTWALD FI Ø part. > 0.1 µm Dispersiones groseras 0.1 µm m > Ø part. > 0.001 µm Coloides Ø part. < 0.1 µm Soluciones verdades ESTADO DE AGREGACIÓN DE LA MATERIA
PROPIEDADES FUNCIONALES DE LAS PROTEÍNAS
 PROPIEDADES FUNCIONALES DE LAS PROTEÍNAS Que es una Propiedad Funcional? Propiedades físicas y químicas que derivan del comportamiento de proteínas en sistemas alimenticios durante procesado, almacenamiento,
PROPIEDADES FUNCIONALES DE LAS PROTEÍNAS Que es una Propiedad Funcional? Propiedades físicas y químicas que derivan del comportamiento de proteínas en sistemas alimenticios durante procesado, almacenamiento,
14/08/2017. Mezcla Es la unión física de 2 o más sustancias
 Compilado por: Ing. Nelson Velásquez MATERIA Sustancias Formadas por el mismo tipo de átomos o moléculas. Responden a una sola fórmula definida. Mezclas Formadas por distintos tipos de átomos y moléculas,
Compilado por: Ing. Nelson Velásquez MATERIA Sustancias Formadas por el mismo tipo de átomos o moléculas. Responden a una sola fórmula definida. Mezclas Formadas por distintos tipos de átomos y moléculas,
Para que se cristaliza una sustancia?
 OPERACIONES UNITARIAS DE SEPARACION Y ESTABILIZACION Teóricos Prof. G. Picó 2016 CRISTALIZACION 245 Para que se cristaliza una sustancia? - Eliminar el solvente (agua) y otros cosolutos. - Se incrementa
OPERACIONES UNITARIAS DE SEPARACION Y ESTABILIZACION Teóricos Prof. G. Picó 2016 CRISTALIZACION 245 Para que se cristaliza una sustancia? - Eliminar el solvente (agua) y otros cosolutos. - Se incrementa
Estabilidad de los Sistemas Coloidales
 Capítulo 5 Estabilidad de los Sistemas Coloidales SISTEMAS COLOIDALES en FARMACIA c Dr. Licesio J. Rodríguez [email protected] - http://www3.usal.es/licesio/ Departamento de Química física - Facultad de Farmacia
Capítulo 5 Estabilidad de los Sistemas Coloidales SISTEMAS COLOIDALES en FARMACIA c Dr. Licesio J. Rodríguez [email protected] - http://www3.usal.es/licesio/ Departamento de Química física - Facultad de Farmacia
Dispersiones Alimenticias
 Los Sistemas Alimenticios se dividen en dos grupos principales: a).- TEJIDOS COMESTIBLES INTACTOS: Son aquellos que no han sido modificados mecánicamente por el hombre. Dentro de estos tenemos: El tejido
Los Sistemas Alimenticios se dividen en dos grupos principales: a).- TEJIDOS COMESTIBLES INTACTOS: Son aquellos que no han sido modificados mecánicamente por el hombre. Dentro de estos tenemos: El tejido
COMPOSICIÓN QUÍMICA DE LA MATERIA VIVA
 COMPOSICIÓN QUÍMICA DE LA MATERIA VIVA ELEMENTOS QUÍMICOS: 110 BIOELEMENTOS ( Elementos biogénicos): 25-30 Forman parte de la materia viva, aunque no son exclusivos de ella No son los más abundantes, pero
COMPOSICIÓN QUÍMICA DE LA MATERIA VIVA ELEMENTOS QUÍMICOS: 110 BIOELEMENTOS ( Elementos biogénicos): 25-30 Forman parte de la materia viva, aunque no son exclusivos de ella No son los más abundantes, pero
SISTEMAS DISPERSOS PROPIEDADES FUNCIONALES DE PROTEINAS
 SISTEMAS DISPERSOS PROPIEDADES FUNCIONALES DE PROTEINAS Sistema disperso Partículas discretas (fase dispersa o discontinua) distribuidas en el seno de un fluido (fase dispersante o continua) Fase Dominio
SISTEMAS DISPERSOS PROPIEDADES FUNCIONALES DE PROTEINAS Sistema disperso Partículas discretas (fase dispersa o discontinua) distribuidas en el seno de un fluido (fase dispersante o continua) Fase Dominio
Tema 18. Tema 18 (II) Disoluciones Tipos de disoluciones Tipos de disoluciones Propiedades físicas de las disoluciones
 Tema 18 (II) 18.1 Tipos de disoluciones 18.2 Propiedades físicas de las disoluciones Disoluciones 18.3 Macromoléculas y coloides 1 2 18.1 Tipos de disoluciones Una DISOLUCIÓN es una mezcla homogénea de
Tema 18 (II) 18.1 Tipos de disoluciones 18.2 Propiedades físicas de las disoluciones Disoluciones 18.3 Macromoléculas y coloides 1 2 18.1 Tipos de disoluciones Una DISOLUCIÓN es una mezcla homogénea de
Disoluciones. Qué es una mezcla? Concepto de Mezcla 12/05/2014
 Disoluciones Profesora: Karina Oñate Fuentes Asignatura: Química- Plan común Nivel: 2º año medio Qué es una mezcla? Los compuestos químicos pueden unirse para reaccionar o mezclarse. En el primer caso
Disoluciones Profesora: Karina Oñate Fuentes Asignatura: Química- Plan común Nivel: 2º año medio Qué es una mezcla? Los compuestos químicos pueden unirse para reaccionar o mezclarse. En el primer caso
PROPIEDADES Y FUNCIONES BIOLÓGICAS
 EL PROPIEDADES Y FUNCIONES BIOLÓGICAS MOLÉCULA DE AGUA LA MOLÉCULA DE AGUA 104,5º δ = densidad de carga Enlace covalente Puentes de H Aunque es eléctricamente neutra, las moléculas de agua tienen carácter
EL PROPIEDADES Y FUNCIONES BIOLÓGICAS MOLÉCULA DE AGUA LA MOLÉCULA DE AGUA 104,5º δ = densidad de carga Enlace covalente Puentes de H Aunque es eléctricamente neutra, las moléculas de agua tienen carácter
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
Propiedades fisicoquímicas y funcionales de los alimentos 2015
 TRABAJO PRÁCTICO N 3: ESPUMAS ESTUDIO DE LA CAPACIDAD Y ESTABILIDAD ESPUMANTE DE CLARA DE HUEVO FORMADA POR BATIDO Y BURBUJEO. OBJETIVO: 1. Determinar la capacidad y estabilidad de espumas por conductimetría
TRABAJO PRÁCTICO N 3: ESPUMAS ESTUDIO DE LA CAPACIDAD Y ESTABILIDAD ESPUMANTE DE CLARA DE HUEVO FORMADA POR BATIDO Y BURBUJEO. OBJETIVO: 1. Determinar la capacidad y estabilidad de espumas por conductimetría
TEMA 6. APLICACIONES DE LOS EQUILIBRIOS ACIDO-BASE Y COMPLEJACIÓN
 TEMA 6. APLICACIONES DE LOS EQUILIBRIOS ACIDO-BASE Y COMPLEJACIÓN 6.1 COAGULACIÓN FLOCULACIÓN... 2 6.1.1 CARGA ELÉCTRICA Y DOBLE CAPA... 3 6.1.2 FACTORES DE ESTABILIDAD E INESTABILIDAD... 4 6.2 FUNDAMENTOS
TEMA 6. APLICACIONES DE LOS EQUILIBRIOS ACIDO-BASE Y COMPLEJACIÓN 6.1 COAGULACIÓN FLOCULACIÓN... 2 6.1.1 CARGA ELÉCTRICA Y DOBLE CAPA... 3 6.1.2 FACTORES DE ESTABILIDAD E INESTABILIDAD... 4 6.2 FUNDAMENTOS
Por qué la leche se ve blanca?
 Grado 11 Ciencias naturales Unidad 2 De qué está hecho todo lo que nos rodea? Tema Por qué la leche se ve blanca? Nombre: Curso: En esta unidad, conoceremos acerca de los coloides y los usos que se les
Grado 11 Ciencias naturales Unidad 2 De qué está hecho todo lo que nos rodea? Tema Por qué la leche se ve blanca? Nombre: Curso: En esta unidad, conoceremos acerca de los coloides y los usos que se les
INTRODUCCIÓN A LA TECNOLOGÍA DE MEMBRANAS. Raúl Moliner Salvador. Unidad de Medio Ambiente. 15 Octubre 2009, Castellón de la Plana.
 INTRODUCCIÓN A LA TECNOLOGÍA DE MEMBRANAS Raúl Moliner Salvador. Unidad de Medio Ambiente. 15 Octubre 2009, Castellón de la Plana. Estructura de la presentación 1. Definición y clasificación de las membranas.
INTRODUCCIÓN A LA TECNOLOGÍA DE MEMBRANAS Raúl Moliner Salvador. Unidad de Medio Ambiente. 15 Octubre 2009, Castellón de la Plana. Estructura de la presentación 1. Definición y clasificación de las membranas.
FUERZAS INTERMOLECULARES
 FUERZAS INTERMOLECULARES FUERZAS INTRAMOLECULARES: Fuerzas que se dan en el interior de las moléculas :Enlace Químico. FUERZAS INTERMOLECULARES: Interacciones entre moléculas. Mantienen unidas las moléculas
FUERZAS INTERMOLECULARES FUERZAS INTRAMOLECULARES: Fuerzas que se dan en el interior de las moléculas :Enlace Químico. FUERZAS INTERMOLECULARES: Interacciones entre moléculas. Mantienen unidas las moléculas
PROGRAMA ACADÉMICO SEMILLERO DE QUÍMICA
 PROGRAMA ACADÉMICO SEMILLERO DE QUÍMICA UNIDAD 1: MATERIA Y MEDICIÓN CLASE TEMAS SUBTEMAS JUSTIFICACIÓN 1 2 3 MATERIA Y MEDICIÓN La química. Ramas de la química. La materia. Estados de la Materia Clasificación
PROGRAMA ACADÉMICO SEMILLERO DE QUÍMICA UNIDAD 1: MATERIA Y MEDICIÓN CLASE TEMAS SUBTEMAS JUSTIFICACIÓN 1 2 3 MATERIA Y MEDICIÓN La química. Ramas de la química. La materia. Estados de la Materia Clasificación
MODULO III SECCION 3 SISTEMAS DISPERSOS HETEROGENEOS. Mercedes Fernández Arévalo
 MODULO III SECCION 3 SISTEMAS DISPERSOS HETEROGENEOS Mercedes Fernández Arévalo SISTEMAS DISPERSOS HETEROGÉNEOS Sistemas en el que una sustancia está dispersada,, en forma de unidades discretas, en el
MODULO III SECCION 3 SISTEMAS DISPERSOS HETEROGENEOS Mercedes Fernández Arévalo SISTEMAS DISPERSOS HETEROGÉNEOS Sistemas en el que una sustancia está dispersada,, en forma de unidades discretas, en el
Sales minerales (2-3%) Ciertos gases (CO 2, O 2, N 2, etc) Moléculas orgánicas: Carbohidratos Lípidos Proteínas Ácidos nucleicos (12-23%)
 AGUA y SALES MINERALES Dra. Sandra Orellana Verdejo Clase 5 Clasificación de moléculas inorgánicas y orgánicas Moléculas inorgánicas: Agua (75-85%) Sales minerales (2-3%) Ciertos gases (CO 2, O 2, N 2,
AGUA y SALES MINERALES Dra. Sandra Orellana Verdejo Clase 5 Clasificación de moléculas inorgánicas y orgánicas Moléculas inorgánicas: Agua (75-85%) Sales minerales (2-3%) Ciertos gases (CO 2, O 2, N 2,
TEMA 6 MEZCLAS Y DISOLUCIONES
 TEMA 6 MEZCLAS Y DISOLUCIONES 1 Contenidos: 1. Tipos de disoluciones 2. El proceso de disolución 3. Formas de expresar la concentración. 4. Solubilidad. Factores que afectan a la solubilidad 5. Propiedades
TEMA 6 MEZCLAS Y DISOLUCIONES 1 Contenidos: 1. Tipos de disoluciones 2. El proceso de disolución 3. Formas de expresar la concentración. 4. Solubilidad. Factores que afectan a la solubilidad 5. Propiedades
DISPERSIONES ACUOSAS Fisicoquímica de las dispersiones acuosas. Difusión, ósmosis y diálisis.
 DISPERSIONES ACUOSAS Fisicoquímica de las dispersiones acuosas. Difusión, ósmosis y diálisis. Introducción. Propiedades de las disoluciones verdaderas, ósmosis, estabilidad del grado de acidez o ph, disoluciones
DISPERSIONES ACUOSAS Fisicoquímica de las dispersiones acuosas. Difusión, ósmosis y diálisis. Introducción. Propiedades de las disoluciones verdaderas, ósmosis, estabilidad del grado de acidez o ph, disoluciones
líquido sólido Interfase sólido-líquido
 INTERFASES La mayoría de los procesos fisicoquímicos naturales y artificiales ocurren en sistemas heterogéneos en donde las diferentes fases que las componen están separadas por una interfase, definida
INTERFASES La mayoría de los procesos fisicoquímicos naturales y artificiales ocurren en sistemas heterogéneos en donde las diferentes fases que las componen están separadas por una interfase, definida
UNIVERSIDAD DE BURGOS Facultad de Ciencias Área de Química Física EL DOMINIO COLOIDAL. El tamaño de la partícula importa!!!
 UNIVERSIDAD DE BURGOS Facultad de Ciencias Área de Química Física EL DOMINIO COLOIDAL El tamaño de la partícula importa!!! Profesores: Rafael Alcalde García Santiago Aparicio Martínez -1 - CIENCIA COLOIDAL
UNIVERSIDAD DE BURGOS Facultad de Ciencias Área de Química Física EL DOMINIO COLOIDAL El tamaño de la partícula importa!!! Profesores: Rafael Alcalde García Santiago Aparicio Martínez -1 - CIENCIA COLOIDAL
FUERZAS INTERMOLECULARES
 FUERZAS INTERMOLECULARES Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (enlaces iónicos, metálicos o covalentes, principalmente). Estas son las fuerzas que se deben
FUERZAS INTERMOLECULARES Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (enlaces iónicos, metálicos o covalentes, principalmente). Estas son las fuerzas que se deben
Polaridad de una molécula
 Polaridad de una molécula Una molécula se considera polar si existe un momento dipolar neto debido a sus enlaces Depende de su geometría Una molécula formada por enlaces polares no necesariamente debe
Polaridad de una molécula Una molécula se considera polar si existe un momento dipolar neto debido a sus enlaces Depende de su geometría Una molécula formada por enlaces polares no necesariamente debe
Espesantes o gelificantes ( soluciones coloidales de alta viscosidad)
 Macromoléculas (polisacáridos y proteínas) que tienen la propiedad de absorber agua fácilmente, modifican su reología, aumentando la viscosidad del líquido Espesantes o gelificantes ( soluciones coloidales
Macromoléculas (polisacáridos y proteínas) que tienen la propiedad de absorber agua fácilmente, modifican su reología, aumentando la viscosidad del líquido Espesantes o gelificantes ( soluciones coloidales
Disoluciones y su contexto dentro de la química. Tipos de disoluciones LA TÉCNICA AL SERVICIO DE LA PATRIA
 LA TÉCNICA AL SERVICIO DE LA PATRIA Realizan en IPN estudio sobre disoluciones ``La mayoría de las reacciones químicas ocurren no entre sólidos, líquidos o gases puros, sino entre iones y moléculas disueltos
LA TÉCNICA AL SERVICIO DE LA PATRIA Realizan en IPN estudio sobre disoluciones ``La mayoría de las reacciones químicas ocurren no entre sólidos, líquidos o gases puros, sino entre iones y moléculas disueltos
UNIDADES DE ESTUDIO Y SUS CONTENIDOS Unidad 1: PROPIEDADES DE LOS FLUIDOS PUROS.
 1. DATOS INFORMATIVOS ASIGNATURA: QUÌMICA-FÌSICA DEPARTAMENTO: CIENCIAS EXACTAS ELEMENTO DE COMPETENCIA: CÓDIGO: EXCT-22318 CARRERAS: PETROQUÌMICA NRC 4548 NIVEL: QUINTO ÁREA DEL CONOCIMIENTO: QUÌMICA
1. DATOS INFORMATIVOS ASIGNATURA: QUÌMICA-FÌSICA DEPARTAMENTO: CIENCIAS EXACTAS ELEMENTO DE COMPETENCIA: CÓDIGO: EXCT-22318 CARRERAS: PETROQUÌMICA NRC 4548 NIVEL: QUINTO ÁREA DEL CONOCIMIENTO: QUÌMICA
1. La materia: sustancias puras y mezclas
 RESUMEN de la UNIDAD 3. DIVERSIDAD DE LA MATERIA 1. La materia: sustancias puras y mezclas La principal clasificación que se hace de la materia es en sustancias puras y mezclas. Las sustancias puras tienen
RESUMEN de la UNIDAD 3. DIVERSIDAD DE LA MATERIA 1. La materia: sustancias puras y mezclas La principal clasificación que se hace de la materia es en sustancias puras y mezclas. Las sustancias puras tienen
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual Disoluciones I: mezclas, disoluciones y unidades porcentuales de concentración SGUICES010CB33-A16V1 Ítem Alternativa Habilidad 1 D Reconocimiento 2 A Reconocimiento 3 C
SOLUCIONARIO Guía Estándar Anual Disoluciones I: mezclas, disoluciones y unidades porcentuales de concentración SGUICES010CB33-A16V1 Ítem Alternativa Habilidad 1 D Reconocimiento 2 A Reconocimiento 3 C
Para la solución de algunos de los ejercicios propuestos, se adjunta una parte del sistema periódico hasta el elemento Nº 20.
 Programa Estándar Anual Nº Guía práctica Disoluciones I: mezclas, disoluciones y unidades porcentuales de concentración Ejercicios PSU Para la solución de algunos de los ejercicios propuestos, se adjunta
Programa Estándar Anual Nº Guía práctica Disoluciones I: mezclas, disoluciones y unidades porcentuales de concentración Ejercicios PSU Para la solución de algunos de los ejercicios propuestos, se adjunta
Materia es todo aquello que tiene masa y ocupa un lugar en el espacio (tiene volumen). La ciencia que estudia la materia es la Química.
 Alfonso García Materia es todo aquello que tiene masa y ocupa un lugar en el espacio (tiene volumen). La ciencia que estudia la materia es la Química. Un sistema material es una porción de materia. Ejemplos:
Alfonso García Materia es todo aquello que tiene masa y ocupa un lugar en el espacio (tiene volumen). La ciencia que estudia la materia es la Química. Un sistema material es una porción de materia. Ejemplos:
GAS GAS GASESOSA GAS LIQUIDO LIQUIDA LIQUIDO LIQUIDO LIQUIDA LIQUIDO SOLIDO SOLIDA SOLIDO LIQUIDO LIQUIDA SOLIDO SOLIDO SOLIDA
 Resumen química segundo modulo SEMANA 7 (AGUA, SOLUCIONES, DENSIDAD Y UNIDADES RELATIVAS) AGUA: forma puentes de hidrogeno muy fuertes Punto de ebullición 100 C y fusión 0 Densidad 1g/mL Calor especifico
Resumen química segundo modulo SEMANA 7 (AGUA, SOLUCIONES, DENSIDAD Y UNIDADES RELATIVAS) AGUA: forma puentes de hidrogeno muy fuertes Punto de ebullición 100 C y fusión 0 Densidad 1g/mL Calor especifico
SEMINARIO MENOR DIOCESANO SAN JOSÉ DE CÚCUTA
 Laboratorio de separación de mezclas La mayor parte de la materia de nuestro planeta se encuentra en forma de ezclas. Es decir, esta materia es la combinación de dos o más sustancias que rmanecen juntas,
Laboratorio de separación de mezclas La mayor parte de la materia de nuestro planeta se encuentra en forma de ezclas. Es decir, esta materia es la combinación de dos o más sustancias que rmanecen juntas,
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AGUA Y SOLUCIONES
 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AGUA Y SOLUCIONES La molécula de agua La molécula de agua Líquido, sólido o gaseoso: existen los tres en la tierra Solvente Universal: por lo que es casi imposible
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AGUA Y SOLUCIONES La molécula de agua La molécula de agua Líquido, sólido o gaseoso: existen los tres en la tierra Solvente Universal: por lo que es casi imposible
Disoluciones Químicas
 Disoluciones Químicas Las disoluciones son mezclas homogéneas de dos o más sustancias, es decir, cuyos componentes no se pueden distinguir a simple vista. Siempre que se esta en presencia de una mezcla
Disoluciones Químicas Las disoluciones son mezclas homogéneas de dos o más sustancias, es decir, cuyos componentes no se pueden distinguir a simple vista. Siempre que se esta en presencia de una mezcla
Reología de una dispersión: Un método rápido para predecir la sedimentación de partículas en las dispersiones líquidas
 Reología de una dispersión: Un método rápido para predecir la sedimentación de partículas en las dispersiones líquidas Introducción Existe una gran variedad de productos que pueden clasificarse como dispersiones
Reología de una dispersión: Un método rápido para predecir la sedimentación de partículas en las dispersiones líquidas Introducción Existe una gran variedad de productos que pueden clasificarse como dispersiones
CLASIFICACIÓN DE LA MATERIA
 CLASIFICACIÓN DE LA MATERIA Clasificación de la materia SUSTACIACIAS PURAS SIMPLES UN SOLO TIPO DE ÁTOMO Mercurio (l) átomo de Hg Cloro(g) átomo de Cl SUSTANCIA PURA COMPUESTA S C O Zn Un solo tipo de
CLASIFICACIÓN DE LA MATERIA Clasificación de la materia SUSTACIACIAS PURAS SIMPLES UN SOLO TIPO DE ÁTOMO Mercurio (l) átomo de Hg Cloro(g) átomo de Cl SUSTANCIA PURA COMPUESTA S C O Zn Un solo tipo de
Proceso de Manufactura y Tipos de formulación del MANCOZEB. Ronald Arrieta M Industria Julio 2013
 Proceso de Manufactura y Tipos de formulación del MANCOZEB Ronald Arrieta M Industria Julio 2013 Síntesis del MANCOZEB La síntesis de Nabam puede llevarse a cabo de manera continua o por batch. La EDA
Proceso de Manufactura y Tipos de formulación del MANCOZEB Ronald Arrieta M Industria Julio 2013 Síntesis del MANCOZEB La síntesis de Nabam puede llevarse a cabo de manera continua o por batch. La EDA
FÍSICA Y QUÍMICA 2º ESO Tema 2: LA MATERIA Mezclas y Soluciones. Sustancias puras y mezclas
 Sustancias puras y mezclas La materia que nos rodea es, en la mayoría de los casos, una mezcla de sustancias. Los científicos han intentado clasificar las sustancias desde el principio de los tiempos.
Sustancias puras y mezclas La materia que nos rodea es, en la mayoría de los casos, una mezcla de sustancias. Los científicos han intentado clasificar las sustancias desde el principio de los tiempos.
qué es lo que mantiene unidas a las MOLECULAS en los sólidos o líquidos?
 qué es lo que mantiene unidas a las MOLECULAS en los sólidos o líquidos? Academia de Química, ITESM, campus Qro. 1 FUERZAS INTERMOLECULARES Academia de Química, ITESM, campus Qro. 2 FUERZAS INTERMOLECULARES
qué es lo que mantiene unidas a las MOLECULAS en los sólidos o líquidos? Academia de Química, ITESM, campus Qro. 1 FUERZAS INTERMOLECULARES Academia de Química, ITESM, campus Qro. 2 FUERZAS INTERMOLECULARES
TEMA 5 ENLACE QUIMICO. Propiedades de las sustancias iónicas, covalentes y metálicas. Prof: Noemy Quirós
 TEMA 5 ENLACE QUIMICO Propiedades de las sustancias iónicas, covalentes y metálicas 1 Prof: Noemy Quirós ESTADOS DE AGREGACIÓN A 298 K A 298 K, cuanto mayor es la atracción entre las partículas (átomos,
TEMA 5 ENLACE QUIMICO Propiedades de las sustancias iónicas, covalentes y metálicas 1 Prof: Noemy Quirós ESTADOS DE AGREGACIÓN A 298 K A 298 K, cuanto mayor es la atracción entre las partículas (átomos,
PREGUNTAS SOBRE CONCEPTOS
 PREGUNTAS SOBRE CONCEPTOS 49 Gases ideales y reales 1.- Por qué la ley de Dalton es una ley límite? 2.- a) Cómo el factor de compresibilidad varía con la temperatura y con la presión? b) Describa cómo
PREGUNTAS SOBRE CONCEPTOS 49 Gases ideales y reales 1.- Por qué la ley de Dalton es una ley límite? 2.- a) Cómo el factor de compresibilidad varía con la temperatura y con la presión? b) Describa cómo
Puentes de Hidrógeno en el Agua EL AGUA FORMA PUENTES DE HIDROGENO CON LOS SOLUTOS
 Los puentes de hidrogeno son más débiles que los enlaces covalentes. Los puentes de hidrogeno en el agua liquida tienen una energía de enlace (la energía requerida para romper un enlace) de solo unos 20
Los puentes de hidrogeno son más débiles que los enlaces covalentes. Los puentes de hidrogeno en el agua liquida tienen una energía de enlace (la energía requerida para romper un enlace) de solo unos 20
DISOLUCIONES UNIDAD IV. Licda. Miriam Marroquín Leiva
 DISOLUCIONES UNIDAD IV 1 DISOLUCIÓN Es una mezcla homogénea de dos o más sustancias; el soluto y el disolvente. Es un término utilizado para describir un sistema en el cual una o más sustancias están mezcladas
DISOLUCIONES UNIDAD IV 1 DISOLUCIÓN Es una mezcla homogénea de dos o más sustancias; el soluto y el disolvente. Es un término utilizado para describir un sistema en el cual una o más sustancias están mezcladas
TEMA 1 LA COMPOSICIÓN DE LA MATERIA VIVA EL AGUA Y LAS SALES MINERALES
 TEMA 1 LA COMPOSICIÓN DE LA MATERIA VIVA EL AGUA Y LAS SALES MINERALES 1. LA BASE QUÍMICA DE LA VIDA: COMPONENTES ORGÁNICOS E INORGÁNICOS 1.1. Bioelementos: 1.1.1. Clasificación de los bioelementos 1.1.2.
TEMA 1 LA COMPOSICIÓN DE LA MATERIA VIVA EL AGUA Y LAS SALES MINERALES 1. LA BASE QUÍMICA DE LA VIDA: COMPONENTES ORGÁNICOS E INORGÁNICOS 1.1. Bioelementos: 1.1.1. Clasificación de los bioelementos 1.1.2.
ESTABILIDAD Y DESNATURALIZACIÓN DE PROTEÍNAS
 ESTABILIDAD Y DESNATURALIZACIÓN DE PROTEÍNAS Estabilidad conformacional Adaptabilidad de proteínas Dependerá de: La diferencia de energía libre entre estados nativo y desnaturalizado Mecanismo de desnaturalización
ESTABILIDAD Y DESNATURALIZACIÓN DE PROTEÍNAS Estabilidad conformacional Adaptabilidad de proteínas Dependerá de: La diferencia de energía libre entre estados nativo y desnaturalizado Mecanismo de desnaturalización
Tema: Estados de agregación de la materia
 Colegio Ambientalista de Pejibaye Departamento de Ciencias Naturales Prof. Pablo Sandoval Ramírez Puntaje Total: 38 Puntos Valor Porcentual: 5% Trabajo Extra Clase N 2 I TRIMESTRE 2017 Fecha de Asignación:
Colegio Ambientalista de Pejibaye Departamento de Ciencias Naturales Prof. Pablo Sandoval Ramírez Puntaje Total: 38 Puntos Valor Porcentual: 5% Trabajo Extra Clase N 2 I TRIMESTRE 2017 Fecha de Asignación:
CIENCIA DE LAS EMULSIONES. Dispersiones coloidales
 LAS EMULSIONES 1 CIENCIA DE LAS EMULSIONES Dispersiones coloidales Tipo Medio de dispersión Fase dispersa Aerosol Gas Sólido Líquido Ejemplos Humo Nieblas y nubes Características Normalmente son utilizados
LAS EMULSIONES 1 CIENCIA DE LAS EMULSIONES Dispersiones coloidales Tipo Medio de dispersión Fase dispersa Aerosol Gas Sólido Líquido Ejemplos Humo Nieblas y nubes Características Normalmente son utilizados
Tema 5: Disoluciones. (Químic General) Disoluciones 6 de noviembre de / 38
 Tema 5: Disoluciones Tipos de disoluciones. Concentración. Solubilidad de gases. Diagramas de fases de dos componentes. Propiedades coligativas: presión osmótica, disminución del punto de fusión y aumento
Tema 5: Disoluciones Tipos de disoluciones. Concentración. Solubilidad de gases. Diagramas de fases de dos componentes. Propiedades coligativas: presión osmótica, disminución del punto de fusión y aumento
Diálisis y Ultrafiltración
 Bioquímica I 2013 Diálisis y Ultrafiltración INTEGRANTES: Amorós, Leslie Amaya, Eugenia Errico, Mariana Lambertucci, Mauro Miers, Jessica Mogro, Ezequiel Quispe, Leonardo Recalt, Micaela Tocho, Eugenia
Bioquímica I 2013 Diálisis y Ultrafiltración INTEGRANTES: Amorós, Leslie Amaya, Eugenia Errico, Mariana Lambertucci, Mauro Miers, Jessica Mogro, Ezequiel Quispe, Leonardo Recalt, Micaela Tocho, Eugenia
FISICOQUÍMICA DE ALIMENTOS (1514) UNIDAD 4. COLOIDES.
 FISICOQUÍMICA DE ALIMENTOS (1514) UNIDAD 4. COLOIDES. Mtra. Josefina Viades Trejo 22 de marzo de 2012 4.1. Definición y descripción de sistemas coloidales. 4.1.1.Definición. Qué son los coloides? Son soluciones
FISICOQUÍMICA DE ALIMENTOS (1514) UNIDAD 4. COLOIDES. Mtra. Josefina Viades Trejo 22 de marzo de 2012 4.1. Definición y descripción de sistemas coloidales. 4.1.1.Definición. Qué son los coloides? Son soluciones
GELES LABORATORIO TECNOLOGÍA FARMACÉUTICA III SEMESTRE 2009-I
 GELES LABORATORIO TECNOLOGÍA FARMACÉUTICA III SEMESTRE 2009-I GELES Se denominan geles a coloides transparentes; sistema de dos componentes, rico en líquido, de naturaleza semisólida. La característica
GELES LABORATORIO TECNOLOGÍA FARMACÉUTICA III SEMESTRE 2009-I GELES Se denominan geles a coloides transparentes; sistema de dos componentes, rico en líquido, de naturaleza semisólida. La característica
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas.
 La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
Base molecular de la vida. TEMA 6 LIBRO (Pág. 131)
 Base molecular de la vida TEMA 6 LIBRO (Pág. 131) GUIÓN TEMA Bioelementos Biomoléculas inorgánicas Agua Sales minerales Ósmosis Biomoléculas orgánicas Glúcidos Lípidos Proteínas Ácidos nucleicos Bioelementos
Base molecular de la vida TEMA 6 LIBRO (Pág. 131) GUIÓN TEMA Bioelementos Biomoléculas inorgánicas Agua Sales minerales Ósmosis Biomoléculas orgánicas Glúcidos Lípidos Proteínas Ácidos nucleicos Bioelementos
UNIDAD 1 La materia y sus cambios
 UNIDAD 1 La materia y sus cambios Tema 1.2 Composición de la materia. Sustancias y mezclas. Mezclas homogéneas, heterogéneas y coloides. Introducción a las disoluciones: no saturadas, saturadas y sobresaturadas.
UNIDAD 1 La materia y sus cambios Tema 1.2 Composición de la materia. Sustancias y mezclas. Mezclas homogéneas, heterogéneas y coloides. Introducción a las disoluciones: no saturadas, saturadas y sobresaturadas.
Teoría Disoluciones Fórmula empírica y molecular Física y Química. 1º bachiller DISOLUCIONES
 Teoría Disoluciones Fórmula empírica y molecular Física y Química. 1º bachiller 18-1-2015 CONCEPTO DE DISOLUCIÓN DISOLUCIONES Una disolución es una mezcla homogénea de sustancias en igual o distintos estados
Teoría Disoluciones Fórmula empírica y molecular Física y Química. 1º bachiller 18-1-2015 CONCEPTO DE DISOLUCIÓN DISOLUCIONES Una disolución es una mezcla homogénea de sustancias en igual o distintos estados
GELES. Itzel Pacheco
 GELES Itzel Pacheco GELES Se denominan geles a coloides transparentes. Sistema de dos componentes, rico en líquido, de naturaleza semisólida. Debido a que las partículas brownianas están cargadas eléctricamente,
GELES Itzel Pacheco GELES Se denominan geles a coloides transparentes. Sistema de dos componentes, rico en líquido, de naturaleza semisólida. Debido a que las partículas brownianas están cargadas eléctricamente,
Materia. Mezclas Son aquellas que están formados por 2 o más sustancias.
 Qué es la materia? Materia Sustancias Puras Son aquellas que tienen una composición y propiedades DEFINIDAS. Mezclas Son aquellas que están formados por 2 o más sustancias. Elementos No se pueden separar
Qué es la materia? Materia Sustancias Puras Son aquellas que tienen una composición y propiedades DEFINIDAS. Mezclas Son aquellas que están formados por 2 o más sustancias. Elementos No se pueden separar
BLOQUE I: LA BASE MOLECULAR Y FÍSICO-QUÍMICA DE LA VIDA. Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas
 BLOQUE I: LA BASE MOLECULAR Y FÍSICO-QUÍMICA DE LA VIDA Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas A.- Los
BLOQUE I: LA BASE MOLECULAR Y FÍSICO-QUÍMICA DE LA VIDA Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas A.- Los
Disoluciones. Química General II 2011
 Disoluciones Química General II 2011 Disolución Es una mezcla homogénea de dos o mas sustancias. Componentes: Soluto: Sustancia (s) presente (s) en menor cantidad en una disolución, son las sustancias
Disoluciones Química General II 2011 Disolución Es una mezcla homogénea de dos o mas sustancias. Componentes: Soluto: Sustancia (s) presente (s) en menor cantidad en una disolución, son las sustancias
ENLACE QUÍMICO COVALENTE IÓNICO METÁLICO
 ENLACE QUÍMICO IÓNICO COVALENTE METÁLICO 1- DEFINICIÓN DE ENLACE Enlace químico: fuerza que hace que los átomos se unan para formar un sistema químico más estable Situación antienlazante: predominan las
ENLACE QUÍMICO IÓNICO COVALENTE METÁLICO 1- DEFINICIÓN DE ENLACE Enlace químico: fuerza que hace que los átomos se unan para formar un sistema químico más estable Situación antienlazante: predominan las
PROBLEMAS MEZCLAS Y DISOLUCIONES
 PROBLEMAS MEZCLAS Y DISOLUCIONES 1. Clasifica como homogéneos o heterogéneos los siguientes sistemas materiales: un trozo de cobre, agua salada, hierro oxidado, una ensalada. 2. Al mezclar dos sistemas
PROBLEMAS MEZCLAS Y DISOLUCIONES 1. Clasifica como homogéneos o heterogéneos los siguientes sistemas materiales: un trozo de cobre, agua salada, hierro oxidado, una ensalada. 2. Al mezclar dos sistemas
Tipos de enlaces. Intramoleculares: Intermoleculares: Metálico. Iónico. Covalente. Fuerzas de Van de Waals Enlaces de hidrógeno.
 El enlace químico Tipos de enlaces Intramoleculares: Iónico. Covalente. Intermoleculares: Fuerzas de Van de Waals Enlaces de hidrógeno. Metálico. Enlace iónico Se define como la fuerza electrostática
El enlace químico Tipos de enlaces Intramoleculares: Iónico. Covalente. Intermoleculares: Fuerzas de Van de Waals Enlaces de hidrógeno. Metálico. Enlace iónico Se define como la fuerza electrostática
Décimo novena sesión. Fuerzas Intermoleculares
 Décimo novena sesión Fuerzas Intermoleculares Introducción Las fuerzas que unen a los átomos en una molécula se deben al enlace químico. La energía requerida para romper este tipo de enlaces se llama energía
Décimo novena sesión Fuerzas Intermoleculares Introducción Las fuerzas que unen a los átomos en una molécula se deben al enlace químico. La energía requerida para romper este tipo de enlaces se llama energía
Laboratorio De Química TRABAJO PRÁCTICO Nº 3 SISTEMAS MATERIALES
 TRABAJO PRÁCTICO Nº 3 SISTEMAS MATERIALES - Materia Es todo lo que posee masa, y ocupa un lugar en el espacio. - Sistema Materi al Porción de materia que se aisla para su estudio. - Sistema Homogéneo Es
TRABAJO PRÁCTICO Nº 3 SISTEMAS MATERIALES - Materia Es todo lo que posee masa, y ocupa un lugar en el espacio. - Sistema Materi al Porción de materia que se aisla para su estudio. - Sistema Homogéneo Es
UD 1. LA MATERIA VIVA: BIOELEMENTOS Y BIOMOLÉCULAS. ANEXO: Tipos de enlaces y formas de representar las moléculas
 UD 1. LA MATERIA VIVA: BIOELEMENTOS Y BIOMOLÉCULAS. ANEXO: Tipos de enlaces y formas de representar las moléculas 1. BIOELEMENTOS O ELEMENTOS BIOGÉNICOS Son los elementos químicos que se encuentran en
UD 1. LA MATERIA VIVA: BIOELEMENTOS Y BIOMOLÉCULAS. ANEXO: Tipos de enlaces y formas de representar las moléculas 1. BIOELEMENTOS O ELEMENTOS BIOGÉNICOS Son los elementos químicos que se encuentran en
Aprendizajes esperados
 Disoluciones II Aprendizajes esperados Identificar diluciones. Identificar los factores que afectan la solubilidad. Definir propiedades coligativas. Pregunta oficial PSU Al bajar gradualmente la temperatura,
Disoluciones II Aprendizajes esperados Identificar diluciones. Identificar los factores que afectan la solubilidad. Definir propiedades coligativas. Pregunta oficial PSU Al bajar gradualmente la temperatura,
DISOLUCIONES. Las disoluciones son mezclas homogéneas de dos o más sustancias (componentes) en proporciones variables.
 DISOLUCIONES Las disoluciones son mezclas homogéneas de dos o más sustancias (componentes) en proporciones variables. Soluto es la sustancia que se encuentra en menor proporción. Disolvente es la sustancia
DISOLUCIONES Las disoluciones son mezclas homogéneas de dos o más sustancias (componentes) en proporciones variables. Soluto es la sustancia que se encuentra en menor proporción. Disolvente es la sustancia
Termoquímica 2.5 Cambios de entalpía standards 2.6 Entalpías de formación 2.7 Dependencia de la temperatura de las entalpías de reacción
 FACULTAD DE CIENCIAS ESCUELA DE QUIMICA FISICOQUIMICA I DURACIÓN DEL CURSO: 16 semanas HORARIO : martes, miércoles y jueves de 9 a 11 am PROGRAMA DE LA ASIGNATURA FISICOQUIMICA I. SEMESTRE II-2001 (OCTUBRE
FACULTAD DE CIENCIAS ESCUELA DE QUIMICA FISICOQUIMICA I DURACIÓN DEL CURSO: 16 semanas HORARIO : martes, miércoles y jueves de 9 a 11 am PROGRAMA DE LA ASIGNATURA FISICOQUIMICA I. SEMESTRE II-2001 (OCTUBRE
TRANSPORTE A TRAVÉS DE LA MEMBRANA CELULAR
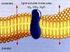 TRANSPORTE A TRAVÉS DE LA MEMBRANA CELULAR Introducción Compartimientos Acuosos separados por Barreras Biológicas Organelos selectivos, autocatalíticos, autoreproductivos, competitivos, adaptativos...
TRANSPORTE A TRAVÉS DE LA MEMBRANA CELULAR Introducción Compartimientos Acuosos separados por Barreras Biológicas Organelos selectivos, autocatalíticos, autoreproductivos, competitivos, adaptativos...
COLEGIO DE BACHILLERES DEL ESTADO DE TLAXCALA DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS ACTIVIDAD EXPERIMENTAL 6 DE: QUÍMICA III
 COLEGIO DE BACHILLERES DEL ESTADO DE TLAXCALA DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS ACTIVIDAD EXPERIMENTAL 6 DE: QUÍMICA III 1.- IDENTIFICANDO LAS PROPIEDADES EN LAS DISOLUCIONES,
COLEGIO DE BACHILLERES DEL ESTADO DE TLAXCALA DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS ACTIVIDAD EXPERIMENTAL 6 DE: QUÍMICA III 1.- IDENTIFICANDO LAS PROPIEDADES EN LAS DISOLUCIONES,
