UNIVERSIDAD DE CHILE GISELA ANDREA GONZÁLEZ HEIN
|
|
|
- Antonia Sáez Revuelta
- hace 7 años
- Vistas:
Transcripción
1 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS VETERINARIAS Y PECUARIAS ESCUELA DE CIENCIAS VETERINARIAS ESTUDIO SEROLÓGICO DE Chlamydophila psittaci, Salmonella spp., VIRUS POX AVIAR, ADENOVIRUS Y VIRUS POLIOMA EN AVES DEL ORDEN PSITTACIFORME EN CAUTIVERIO EN CHILE CENTRAL GISELA ANDREA GONZÁLEZ HEIN Memoria para optar al Título Profesional de Médico Veterinario Departamento Patología Animal PROFESOR GUIA: HÉCTOR HIDALGO O. Financiamiento FAVET: Proyecto interno Nº 3647; Infectious Diseases Laboratory, College of Veterinary Medicine, University of Georgia, Athens. U.S.A SANTIAGO, CHILE. 2006
2 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS VETERINARIAS Y PECUARIAS ESCUELA DE CIENCIAS VETERINARIAS ESTUDIO SEROLÓGICO DE Chlamydophila psittaci, Salmonella spp., VIRUS POX AVIAR, ADENOVIRUS Y VIRUS POLIOMA EN AVES DEL ORDEN PSITTACIFORME EN CAUTIVERIO EN CHILE CENTRAL GISELA ANDREA GONZÁLEZ HEIN Memoria para optar al Título Profesional de Médico Veterinario Departamento Patología Animal NOTA FINAL: NOTA FIRMA PROFESOR GUIA: HÉCTOR HIDALGO OLATE PROFESOR CONSEJERO: SERGIO ROSENDE OLLARZÚ PROFESOR CONSEJERO: MARÍA O. CELEDÓN VENEGAS SANTIAGO, CHILE. 2006
3 DEDICATORIA Las aves siempre han atraído la atención del hombre, especialmente por su capacidad de volar, también han generado su admiración y la alegría al ser observadas o escuchadas. Motivada por la admiración que siento por ellas, dedico esta tesis a ellas, como también a los médicos veterinarios aviares que hayan definido su ética de conservación y que trabajan junto a conservacionistas, avicultores y biólogos para asegurar el bienestar de las aves.
4 AGRADECIMIENTOS Deseo expresar mis más sinceros agradecimientos a mi profesor guía Dr. Héctor Hidalgo, al Dr. Sergio Rosende y a la Dra. María O. Celedón. Agradezco a la Dra. Paula Ciembor y al Dr. Branson Ritchie por hacer posible el análisis de muestras para detección de anticuerpos contra virus polioma aviar en la Universidad de Georgia. Agradezco también a la doctora Viviana Cachicas (Instituto de Salud Pública) por facilitarnos la cepa de S. typhimurium empleada en el estudio y al doctor Christian Mathieu (Servicio Agrícola y Ganadero) por facilitarnos un aislado de virus CELO. Agradezco la buena disposición e información aportada por los doctores Charif Tala González y Guillermo Quintero. Agradezco la autorización y la colaboración en las capturas realizadas y procedimientos de muestreo a los doctores: Mauricio Fabry, Ricardo León, Sebastián Celis, Ignacio Idalzoaga y a las doctoras Pilar Soto y Bárbara Zentilli y a la Bióloga Loreto Matthews. Agradezco la colaboración de las siguientes instituciones: Zoológico Nacional, Buin Zoo y Centro de Rehabilitación Codeff. Toda mi gratitud a cada uno de los criadores particulares y coleccionistas privados de aves, que depositaron su confianza en nosotros y nos permitieron la obtención de muestras para este estudio. Gracias a la Sra. Paula Muñoz por su ayuda y gentileza. Gracias por la colaboración constante en el trabajo de laboratorio a Miguel Martínez, Teresa Heredia, Paola Rivera y Paola Tobar. Gracias a Joxe Iturbe por su apoyo constante y ayuda en terreno en la obtención de muestras y gracias también a mi familia y a Dios por el apoyo que me han brindado.
5 RESUMEN Mediante un estudio serológico se evaluó la presencia de infecciones virales por virus de la diftero viruela aviar (vdva), adenovirus aviar (AVA) y virus polioma aviar (VPA) e infecciones bacterianas por Salmonella enteritidis, S. typhimurium y Chlamydophila psittaci en muestras de sangre provenientes de diez poblaciones de aves Psittaciformes en cautiverio: nativas (Enicognathus ferrugineus, Enicognathus leptorhynchus, Cyanoliseus patagonus bloxami) y exóticas (30 especies), localizadas en diversos lugares de la Región Metropolitana de Chile. Se demostró que las aves psitácidas incluidas en esta investigación presentaban seropositividad frente a infección por vdva en 8 de 201 aves (4%); a AVA del grupo I en 9 de 184 aves (4,9%) y particularmente a VPA en 36 de 100 aves (36%). Estas infecciones virales, reconocidas por primera vez en aves psitácidas exóticas en Chile, también han sido comunicadas en este mismo tipo de aves en otros lugares del mundo. Pero se debe agregar que es la primera evidencia de infección por VPA, vdva y AVA en psitácidas nativas en nuestro país. En este estudio, también se detectó la presencia de anticuerpos séricos contra C. psittaci en 11 de 49 aves (22,4%) y contra S. enteritidis en 2 de 184 aves (1,1%). No se detectó la presencia de anticuerpos séricos contra S. typhimurium en las 184 aves psitácidas monitoreadas.
6 SUMMARY A serological survey was done to evaluate the presence of viral infections by avian pox virus (PV), avian adenovirus (AAV) and avian polyomavirus (APV) and bacteriological infections by Salmonella enteritidis, S. typhimurium and Chlamydophila psittaci in blood samples obtained from ten captive psittaciforme bird populations: natives (Enicognathus ferrugineus, Enicognathus leptorhynchus, Cyanoliseus patagonus bloxami) and exotics (30 species) located in different areas of Metropolitan Region of Chile. It was demonstrated that the psittacine birds included in this study were seropositives to PV in 8 of 201 individuals (4%); to AAV (type I) in 9 of 184 individuals (4,9%) and to APV in 36 of 100 individuals (36%). This is the first detection of these viral infections in exotic psittacine birds in Chile, even though they have been recognized in other places on the world. This research shows the first evidence of infection by APV, PV and AAV in native psittacines in our country. In this study, also were found serum antibodies for C. psittaci in 11 of 49 birds (22,4%) and for S. enteritidis in 2 of 184 birds (1,1%). Antibodies against S. typhimurium were not detected in the 184 psittacine birds tested.
7 INDICE 1.-INTRODUCCIÓN 1 2.-REVISIÓN BIBLIOGRÁFICA Las aves del orden Psittaciforme 3 3 Diftero viruela aviar 9 Adenovirus aviar 12 Infecciones por virus polioma aviar 16 Chlamydophila psittaci 21 Salmonela en aves de compañía y de vida libre (S. typhimurium y S. enteritidis) HIPÓTESIS OBJETIVO GENERAL OBJETIVOS ESPECÍFICOS MATERIAL Y MÉTODO 36 Aves Psittaciformes sometidas a estudio y procedencia 36 Tamaño de muestra 36 Obtención de muestras y transporte 37 Permisos oficiales para el envío de muestras al exterior 39 Determinación de anticuerpos contra virus diftero viruela aviar 39 Determinación de anticuerpos contra adenovirus aviar grupo I 40 Determinación de anticuerpos contra virus polioma aviar 41 Determinación de anticuerpos contra C. psittaci 42 Determinación de anticuerpos contra S. enteritidis 42 Determinación de anticuerpos contra S. typhimurium RESULTADOS 45 Detección de anticuerpos contra virus diftero viruela aviar 45 Detección de anticuerpos contra adenovirus aviar grupo I 49 Detección de anticuerpos contra virus polioma aviar 52 Detección de anticuerpos contra C. psittaci 55 Detección de anticuerpos contra S. enteritidis 58 Detección de anticuerpos contra S. typhimurium DISCUSIÓN 64 Detección de anticuerpos contra virus diftero viruela aviar 64 Detección de anticuerpos contra adenovirus aviar grupo I 64 Detección de anticuerpos contra virus polioma aviar 65 Detección de anticuerpos contra C. psittaci 67 Detección de anticuerpos contra S. enteritidis y S. typhimurium CONCLUSIONES BIBLIOGRAFÍA ANEXOS 92
8 1.- INTRODUCCIÓN En Chile habitan cuatro especies nativas de vida libre de la familia Psittacidae que se encuentran actualmente protegidas: la cachaña (Enicognathus ferrugineus), el perico cordillerano (Bolborhiynchus aurifrons); el choroy (Enicognathus leptorhynchus), loro endémico de Chile y la subespecie Cyanoliseus patagonus bloxami o tricahue, considerada como una subespecie propia de Chile. En la década de los sesenta se introdujo en nuestro país la cotorra argentina (Myiopsitta monachus) cuya distribución natural comprende Argentina, Brasil, Paraguay y Uruguay. Actualmente se encuentra restringida fundamentalmente a zonas urbanas de ciudades de Chile central. El número de loros exóticos o psitácidas no nativas de nuestro país que son mantenidos en cautiverio, en Chile, se desconoce. Sólo hay información parcial sobre aquellas especies que están protegidas por legislación. El Servicio Agrícola y Ganadero (SAG) mantiene un registro de los especímenes de loros incluidos en la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES), que han ingresado al país en los últimos años. De acuerdo con los certificados CITES fueron ingresadas al país legalmente en los últimos años ( ), aves del orden Psittaciforme procedentes de África, Oceanía, Asia y América; de éstas, correspondieron a la cotorra argentina. De las aves ingresadas legalmente al país, se excluyen las catitas australianas y las cotorritas ninfas por ser especies no incluidas en CITES. Por otro lado existe un número indeterminado de especímenes que son ingresados ilegalmente al país, burlando las disposiciones CITES, Ley de Caza y normativas sanitarias y aduaneras del país. Otra aproximación a la descripción poblacional de psitácidas en cautiverio, es a través de las declaraciones semestrales de existencias de loros nativos y exóticos que deben realizar criadores inscritos en el SAG, centros de rehabilitación, centros de exhibición y zoológicos; y a través de los registros de tenencia de estas aves. De acuerdo a la información registrada, la mayoría de las aves psitácidas en cautiverio corresponde a loros exóticos (excluyendo a catitas y cotorritas ninfas) y 340 corresponden a loros nativos en cautiverio (choroy, cachaña y tricahue). Estos últimos son encontrados mayoritariamente en zoológicos, centros de exhibición y de rehabilitación de fauna silvestre. En el país son escasos o no hay estudios sistemáticos sobre aspectos como el bienestar, conservación, reproducción, crianza, nutrición, enfermedades carenciales, metabólicas, infecciosas y tratamientos de aves de compañía u ornamentales. Las enfermedades de etiología bacteriana y viral, en psitácidas, generan pérdidas económicas a criadores de estas aves, zoológicos, y tiendas de ventas de mascotas, así como también un costo emocional en los propietarios asociado a las pérdidas de éstas. La susceptibilidad a contraer infecciones secundarias y desarrollo de enfermedades aumenta con las condiciones inadecuadas de crianza y con otros factores estresantes. La mayoría de los brotes de enfermedades 1
9 ocurre en aves en cautiverio debido a la alta densidad poblacional, estrés social y no uso de medidas profilácticas. Infecciones por Chlamydophila psittaci, Salmonella typhimurium y Salmonella enteritidis, virus de la diftero viruela aviar (vdva), virus polioma aviar (VPA) y adenovirus aviar (AVA) pueden conducir a enfermedades clínicas en estas aves, inducir la condición de portadores y significar el riesgo de propagación de enfermedades a otras especies. La infección por C. psittaci posee además un riesgo para el hombre por ser una zoonosis al igual que S. typhimurium y S. enteritidis. En Chile hay desde una ausencia a una escasez de información objetiva o científica con respecto a la presencia de estos agentes patógenos en Psittaciformes en cautiverio, de allí la necesidad e importancia de contribuir al conocimiento de las enfermedades infecto contagiosas que afectan a estas aves. Esperamos con ello, también contribuir a la investigación sobre las enfermedades de poblaciones aviares de Chile amenazadas o en peligro. Esta investigación pretende identificar, en un grupo restringido de una población de aves psitácidas nativas y exóticas mantenidas en cautiverio, infecciones por vdva, AVA, VPA, C. psittaci, S. enteritidis y S. typhimurium mediante estudios serológicos. 2
10 2.-REVISIÓN BIBLIOGRÁFICA LAS AVES DEL ORDEN PSITTACIFORME. El orden Psittaciforme comprende más de 330 especies extendidas en el mundo, principalmente ubicadas en regiones tropicales del hemisferio sur (Forshaw, 1989). Como grupo de aves en el mundo, es el que tiene un mayor número de aves en peligro; 90 especies (26%) están "amenazadas" de extinción y otras 40 especies (11%) están en la categoría "cerca de ser amenazadas" de acuerdo con La Unión Mundial para la Conservación de la Naturaleza (UICN) (Low, 2003). Las aves Psittaciformes tienen una larga historia como aves de compañía, pero la avicultura de psitácidas es relativamente reciente, comenzando en Europa a fines del siglo XIX. A mediados del siglo XX, con el advenimiento del incremento de los viajes aéreos, la obtención de "stocks" de aves fue más factible (Nilsson, 1981). En un comienzo las aves fueron importadas sobre una base irregular y fueron prohibitivamente caras. El monomorfismo sexual de la mayoría de las especies psitácidas hacía que fuese díficil determinar el sexo y generar parejas viables. En adición, poco era sabido de las enfermedades y los veterinarios aún no tenían interés ni una adecuada formación en medicina de aves exóticas (Darrel, 2002). Entre 1960 y 1970 la demanda por aves exóticas psitácidas creció estadísticamente. La producción de catitas y cotorritas ninfas era considerable, pero con la excepción de algunas especies australianas, la producción de grandes psitácidas fue poco significativa y el comercio de importación de aves cogidas de la vida libre fue infrecuente (Nilsson, 1981). Un concomitante incremento en el interés por las enfermedades de las psitácidas ocurre en la década de los setenta y la comunidad de avicultores demandan una mayor atención por parte de los veterinarios porque muchas de estas especies son de altos precios y son difíciles de reemplazar. La continua importación de psitácidas, cogidas de vida libre, aún suministraba un amplio número para reponer los "stocks" de criadores cuando las pérdidas se producían. Muchos países restringieron completamente la exportación de aves Psittaciformes, desde 1970 hasta 1990, por considerarlo una amenaza a la supervivencia. En 1992 el "Wild Bird Conservation Act" (WBCA) cierra la importación de psitácidas a Estados Unidos de Norteamérica (EE.UU), excepto bajo programas especiales. El valor comercial de las aves psitácidas incrementó y la producción doméstica fue requerida para satisfacer las necesidades de avicultores y al público propietario de mascotas. En recientes años el valor de algunas especies de polluelos producidos domésticamente, ha caído más bajo que los precios de importación debido a un incremento en la producción doméstica y a una reducción de la demanda. Por otro lado, los avicultores recurren a la asistencia profesional veterinaria en el manejo de sus bandadas (Darrel, 2002). 3
11 Un reciente ensayo de la "American Veterinary Medical Association" (AVMA), conducido desde 1991 hasta 1996, encuentra que el número de propietarios en cada categoría de mascotas exóticas ha incrementado al menos en un 8%. En comparación, los perros mascotas incrementaron sólo un 0,7%, los gatos, 3,6% y los caballos decrecieron un 18% (Gerke, 1997). Este incremento en el número de mascotas exóticas sugiere un incremento en la necesidad de servicios veterinarios para estas mascotas. Por otro lado, el aumento de conciencia del estado de loros de vida libre en peligro y el que muchas de estas poblaciones requiera algún grado de manejo para que permanezcan viables, ha generado interés en la biología y ecología de las poblaciones de loros de vida libre. La necesidad de incrementar los esfuerzos en investigación sobre las enfermedades de poblaciones aviares amenazadas o en peligro fue ya enfatizada por un simposio sobre enfermedades y aves amenazadas sostenido durante la "XIX World Conference of the International Council for Bird Preservation" (ICBP) en 1986 (International Council for Bird Preservation, 1989). Los miembros de ICBP alientan el monitoreo de salud de especies aviares amenazadas a la luz de incrementar la evidencia que las enfermedades han generado un impacto adverso sobre las poblaciones aviares. En efecto, epizootias han resultado en significativas morbilidades y mortalidades en poblaciones de vida libre (Gilardi et al., 1995). Mientras el conocimiento sobre las enfermedades de aves de vida libre y de aves exóticas de compañía, ha recibido una mayor atención en los países desarrollados; en Chile ha recibido poca atención, reflejándose esto en los escasos trabajos de investigación existentes en psitácidas (González e Hidalgo, 2004; Sobarzo, 2004; Herrera, 2001) y en otras aves de vida libre (Verdugo et al., 2005; Fabry, 2004; Saucedo, 1998; Pavez, 1996; Cubillos et al., 1979). Psittaciformes en Chile de vida libre. En Chile, la avifauna representa alrededor del 4,76% del total mundial de aves, que se calcula en especies (Monroe y Sibley, 1993). En Chile corresponden a 462 especies representadas en 55 familias (Araya y Millie, 1998). Una de ellas corresponde a la familia Psittacidae, conformada por cuatro especies nativas de vida libre que se encuentran actualmente protegidas, la cachaña Enicognathus ferrugineus (Müller), el perico cordillerano Bolborhiynchus aurifrons (Lesson), el choroy Enicognathus leptorhynchus (King), siendo esta última endémica de Chile de acuerdo a información del Departamento de Protección de los Recursos Naturales Renovables (DEPROREN) del SAG (DEPROREN, 2003) y la subespecie Cyanoliseus patagonus bloxami o tricahue considerada una subespecie propia de Chile (Olson, 1995). a) La cachaña. La cachaña tiene una longitud total de 35 cm. Posee una coloración general verde oscura, de frente y bridas pardas rojizas, con una mancha roja obscura en el centro del abdomen y una cola roja obscura. Vive en zonas boscosas. En Chile hay dos subespecies: Enicognathus ferrugineus minor 4
12 que se distribuye desde Colchagua hasta la Región de Aisén y Enicognathus ferrugineus ferrugineus, de tamaño un poco mayor, que se ubica en la zona del Estrecho de Magallanes y Tierra del Fuego (Araya y Millie, 1998). Referente a su estado de conservación, su caza está prohibida por considerarse una especie benéfica para la mantención del ecosistema natural (DEPROREN, 2003). Internacionalmente está protegida por el convenio CITES, incluida en el Apéndice II (CITES, 2005). b) El choroy. El choroy tiene una longitud total de 41 cm. Es de coloración general verde oscura y su frente, bridas y anillo que rodea la parte desnuda alrededor del ojo son de color rojo anaranjado; en el abdomen posee una mancha roja poco conspicua y la cola es roja obscura. El pico posee la maxila larga. Vive en zonas boscosas comprendidas entre la Región de Valparaíso y la Región de Aisén (Araya y Millie, 1998). El estado de conservación de esta especie corresponde a la categoría Vulnerable en el Libro Rojo de los Vertebrados Terrestres de Chile (Glade, 1993). Su caza está prohibida (DEPROREN, 2003) y está incluida en el Apéndice II de CITES (CITES, 2005). c) El perico cordillerano. El perico cordillerano tiene un largo total de 18,5 cm. Es de coloración general verde clara, con un leve tinte azulado o amarillento en garganta, pecho, abdomen y subcaudales. Las alas son azulejas y la cola verde azul. Posee una rayita amarilla poco conspicua en el borde de la frente y un pico rosado. Vive en la cordillera. En nuestro país viven dos subespecies: B.a. rubrirostris Burmeister, en las cordilleras de Santiago y el perico cordillerano del Norte B.a margaritae Belioz y Dorst de distribución restringida a las Regiones de Tarapacá y Antofagasta (Araya y Millie, 1998). Esta ave está incluida en el Apéndice II de CITES (CITES, 2005) y no se encuentra catalogada como amenazada, pero su caza está prohibida por considerarse con densidades poblacionales reducidas y benéfica para el equilibrio de los ecosistemas naturales (DEPROREN, 2001). d) El tricahue. La subespecie Cyanoliseus patagonus bloxami tiene una longitud de 45 cm. Presenta el lomo amarillo y las partes superiores y cabeza de color café oliváceo, con una línea gris en la base de la frente. Por su parte ventral es café grisáceo con una banda blanquecina y el abdomen es amarillo con un centro rojo. La cola es larga del mismo color del dorso y el pico, gris obscuro. Vive en regiones boscosas en la precordillera de Chile. Su distribución original fue desde la Región de Atacama hasta la Región de Los Lagos (Araya y Millie, 1998). Actualmente se le encuentra concentrado en ciertas localidades de las Regiones de O'Higgins y del Maule y en algunas poblaciones aisladas en la Región de Coquimbo (Valverde, 1998). El tricahue se encuentra en la categoría En Peligro en el Libro Rojo de los Vertebrados Terrestres de Chile, debido a la gran reducción de su población y área de distribución (Glade, 1993). Su caza está prohibida según el artículo 3º de la Ley Nº (Chile. Ministerio de Agricultura, 1996a) y es catalogada como 5
13 especie benéfica para la mantención del equilibrio de los ecosistemas naturales y con densidades poblacionales reducidas de acuerdo con el artículo 4º del Reglamento de la Ley de Caza, D. S. Nº 5 de enero 1998 (Chile. Ministerio de Agricultura, 1998). Está incluida en el Apéndice II CITES (CITES, 2005). e) La cotorra argentina. La distribución natural de la cotorra argentina (Myiopsitta monachus) comprende las planicies subtropicales de Argentina, Brasil, Paraguay y Uruguay. En la década de los sesenta se introduce en Chile esta especie, ingresando ilegalmente, para su venta como mascota. Las primeras colonias silvestres comienzan a formarse en esa misma década. Con el inicio de las importaciones comerciales masivas ingresaron a Chile entre los años , unas cotorras argentinas, comenzando también el rápido asilvestramiento debido al escape y liberación intencional de éstas. Actualmente se encuentra restringida fundamentalmente a zonas urbanas de ciudades de Chile central, sin embargo se han registrado estas aves entre la Región de Antofagasta y la Región de Los Lagos (DEPROREN, 2003). Esta especie es considerada dañina, por lo que su caza está permitida en cualquier época del año, en todo el territorio nacional y sin limitación en el número de ejemplares de acuerdo con el artículo 6º del Reglamento de la Ley de Caza (Chile. Ministerio de Agricultura, 1998). Está incluida en el Apéndice II CITES (CITES, 2005). El SAG restringió el ingreso al interior del país mediante la publicación en el Diario Oficial de la Resolución Nº 863 del 26 de Marzo de 1999, así mismo es catalogada como una especie que puede perturbar el equilibrio ecológico y la conservación del patrimonio ambiental del país. Psittaciformes en cautiverio en Chile. a) Caracterización de la población de psitácidas en cautiverio en Chile. En cautiverio podemos encontrar a loros nativos de Chile como son el choroy, tricahue y cachaña principalmente en zoológicos, centros de exhibición y de rehabilitación de fauna silvestre. También existe exepcionalmente una tenencia permitida de sólo algunos particulares y una tenencia ilegal de estas aves en cautiverio. La mayor parte de la población de psitácidas en cautiverio en Chile son exóticas. Existe un número importante de loros exóticos en cautiverio, incluidos en CITES, como inseparables, rosellas, periquitos, cotorritas de collar, guacamayos, loros Amazona, etc., que de acuerdo a los registros del SAG corresponden a aves aproximadamente. Por otro lado, existe también una tenencia en cautiverio de especies de psitácidas exóticas populares, como cotorritas ninfas y catitas que aún no ha sido dimensionada. De acuerdo a información entregada por el Departamento de Protección Pecuaria (SAG) el número de aves ornamentales importadas (incluyendo también los huevos fértiles) entre el 1996 y 2003 fue (0,5%) (99,5%) corresponden a las importaciones en el mismo período de aves y huevos fértiles para cría comercial (avestruz, emu, pavos, pollos, patos, gansos, otros). 6
14 El control, al interior del país, de especímenes de fauna incluidos en CITES (promulgada como Ley de la República mediante el Decreto Ley Nº 873 de 1975) fue posible sólo a partir de 1993, con la publicación del D.S. Nº 133 (Reglamento de la Ley de Caza) en el cual se estableció la necesidad de acreditar el origen de los animales exóticos mantenidos en cautiverio (DEPROREN, 2001). Con la publicación de la nueva Ley de Caza de Chile, Ley Nº , en el inciso segundo del artículo 22, se confirmó la facultad de controlar la tenencia de animales CITES al interior del país, debiéndose acreditar la procedencia u obtención de animales exóticos pertenecientes a especies o subespecies listadas en los Apéndices I-II-III de CITES (Chile. Ministerio de Agricultura, 1996a). El número de loros mantenidos, actualmente en cautiverio en Chile, se desconoce. Sólo existe información parcial sobre aquellas especies que están protegidas por legislación. El SAG mantiene un registro de los especímenes de loros incluidos en CITES que han ingresado al país en los últimos años, siendo ingresadas legalmente al país en los años 1993 a 2002, aves del orden Psittaciforme procedentes de África, Oceanía, Asia y América; de éstas, correspondieron a la cotorra argentina (Subdepartamento de Vida Silvestre, SAG). De las especies de loros incluidas en CITES, se deben excluir las catitas australianas y las ninfas, y a partir de enero del 2005 se deben excluir también los inseparables de cara de melocotón (Agapornis roseicollis) (CITES, 2005). Por otro lado existe un número indeterminado de especímenes que son ingresados ilegalmente al país, burlando la Ley de Caza de Chile, las normativas sanitarias y aduaneras y las disposiciones CITES. Según datos reunidos de información provenientes de las Regiones de Arica, Antofagasta y Metropolitana, entre los especímenes de fauna CITES decomisados entre en Chile, hubo 518 loros vivos, que equivale al 86,62% del grupo taxonómico de aves vivas decomisadas y al 38,6% del total de fauna viva (reptiles, aves, mamíferos) que fue decomisada. Los loros decomisados son en su mayoría neotropicales, especialmente Amazona aestiva y Aratinga sp. Se cree que el contrabando de especies no CITES es posiblemente igual o superior (Subdepartamento de Vida Silvestre, SAG). Otra aproximación a la descripción poblacional de aves psitácidas en Chile, es a través de las declaraciones semestrales de existencias de loros nativos y exóticos que deben realizar criadores inscritos en el SAG, centros de rehabilitación, centros de exhibición, zoológicos y de los registros de tenencia de estas aves. De acuerdo a la información actualizada hasta el año 2003, aportada por el Subdepartamento de Vida Silvestre (SAG), la población corresponde a aproximadamente a loros exóticos, excluyendo a catitas y ninfas, y a 337 loros nativos. b) Legislación sanitaria de aves psitácidas en Chile. Las aves psitácidas importadas a Chile deben cumplir con cierta normativa sanitaria: Ley de Sanidad Animal (DFL. RRA. Nº 16 de 1963) y con requisitos específicos como son la Resol Ex. De 9/09/96 que fija exigencias sanitarias para internación de aves de recreación (Chile. Ministerio de 7
15 Agricultura, 1996b) o la Resol Ex. De 29/11/96 que fija exigencias sanitarias para internación de aves de recreación de compañía (mascotas) (Chile. Ministerio de Agricultura, 1996c). Las aves psitácidas para ser internadas deben provenir de un país declarado oficialmente libre de la influenza aviar y enfermedad de Newcastle, no deben presentar signos clínicos de psitacosis y al momento del embarque no deben presentar signos de enfermedades transmisibles. Previo a su embarque se practican pruebas diagnósticas para psitacosis, dentro de otras, y tratamientos con tetraciclinas sí fuesen necesarios. Las aves una vez que ingresan a Chile, deben cumplir con una cuarentena mínima de 30 días en un recinto autorizado por el Director Regional del Servicio Agrícola y Ganadero que corresponda, durante la cual serán sometidas a las pruebas diagnósticas y tratamientos que determine el Servicio. Dentro de los exámenes realizados por el SAG a las psitácidas, se encuentran los coproparasitarios, ectoparasitarios, la detección de Salmonellas spp. en heces frescas a través de cultivo bacteriológico, la prueba de fijación del complemento (FC) en búsqueda de psitacosis y la detección de la infección por virus de la influenza aviar y enfermedad de Newcastle (Chile. Ministerio de Agricultura, 1996b; Chile. Ministerio de Agricultura, 1996c). Las enfermedades de etiología viral son consideradas la principal causa de morbilidad y mortalidad en aves psitácidas de compañía y de aviarios, siendo ya 11 las familias de virus que han sido asociadas a enfermedad en estas aves (Ritchie, 1995). En muchos de los casos, el daño en un ave infectada es causado por infecciones concurrentes bacterianas, parasitarias y fúngicas que enmascaran la patología inicial inducida por un patógeno viral primario (Ritchie, 1995). El incremento de la ocurrencia de enfermedades virales en aves de compañía se asocia a la existencia de mezcla de diferentes especies aviares y de diversos orígenes, al confinamiento con una alta densidad, a la frecuente recolocación de aves jóvenes con sistemas inmune inmaduros, a la inhabilidad para detectar portadores subclínicos y a la relativa carencia de vacunas. Por otro lado, el movimiento global de numerosas especies aviares para satisfacer las demandas del mercado aviar, resulta en la exposición de animales nativos a una amplia variedad de microflora endógena que podría ser endémica de determinadas poblaciones aviares aisladas geográficamente. Los virus que son endémicos de aves de otros continentes son particularmente peligrosos cuando son introducidos a nuevas áreas porque especies de aves de un género relacionado podrían también ser susceptibles a la infección (Ritchie, 1995). En Chile hay escasa información objetiva y científica con respecto a la presencia de agentes patógenos virales y bacterianos en Psittaciformes en cautiverio. En este escenario, se desconoce la presencia de infecciones virales por vdva, VPA y AVA y de infecciones bacterianas por C. psittaci, S. typhimurium y S. enteritidis en psitácidas en cautiverio presentes en diversas localidades. La escasa información existente corresponde a un brote de DVA en aves Psittaciformes exóticas confinadas en un aviario en Chile (González e Hidalgo, 2004) y a Sobarzo, (2004) quién hizo un muestreo de heces 8
16 frescas de 9 jaulas con aves Psittaciformes y de 1 jaula con aves Columbiformes para aislamiento bacteriano de Salmonella spp. En esta investigación no se aisló la bacteria desde Psittaciformes en cautiverio en la Región Metropolitana de Chile. Por otro lado, existe un estudio microbiano y parasitario de coana y cloaca de loros tricahues en cautiverio donde se detectaron otros agentes patógenos (Herrera, 2001). Existe así la necesidad de contribuir al conocimiento de las enfermedades infecto contagiosas que afectan a psitácidas nativas y exóticas en Chile. DIFTERO VIRUELA AVIAR. La diftero viruela aviar (DVA) es una enfermedad infecto contagiosa de distribución cosmopolita que afecta a aves comerciales, de vida libre y de compañía. El virus causal (vdva) pertenece a la familia Poxviridae, subfamilia Chordopoxvirinae y al género Avipoxvirus (Tripathy y Reed, 2003; Bolte et al., 1999). Cerca de 232 especies de aves representadas en 23 órdenes adquieren naturalmente la infección, incluyendo al orden Psittaciforme (Bolte et al., 1999). Dentro de los treinta y seis taxones del virus descritos con su espectro presumido de huésped se encuentran: el vdva de psitácidas (Psittacinepoxvirus) que posee un amplio espectro de huésped, el vdva de inseparables (Agapornispox) y vdva de catitas (Budgerigarpox) (Gerlach et al., 1998; Gerlach, 1999a). Un aislado de vdva de inseparables fue ya reconocido genéticamente distinto a los otros vdva estudiados en Alemania mediante la técnica de reacción en cadena polimerasa (RCP) en combinación con el análisis por enzimas de restricción y de secuencias de nucleótidos (Lüschow et al., 2004). Se describen dos formas clásicas de infección en aves por Avipoxvirus; la forma cutánea y la forma diftérica. La forma cutánea consiste en lesiones proliferativas nodulares sobre cara, piernas y áreas del cuerpo sin plumas, mientras que en la forma mucosal o diftérica, las lesiones proliferativas ocurren sobre la membrana mucosa del tracto digestivo y respiratorio (Riddell, 1987; Phalen, 1997a; Tripathy y Reed, 2003). Existe también una forma de presentación mixta, donde las dos formas anteriormente descritas ocurren simultaneamente. Una forma septicémica aguda, con alta mortalidad y muerte después de pocos días de desarrollar los signos clínicos de cianosis, anorexia, somnolencia, plumaje erizado y disnea se ha descrito en canarios y pinzones (Gerlach, 1999a, Johnson y Castro, 1986). Aparte de estas formas de presentación, cambios neoplásicos en el epitelio escamoso de la piel podrían desarrollarse en algunas especies de aves (Gerlach, 1999a; Bolte et al., 1999; Phalen, 1997a). Aves Passeriformes y Columbiformes que sobreviven a la infección por vdva son propensos a la formación de tumores de piel (Gerlach, 1999a). En aves del orden Psittaciforme las formas de presentación generalmente descritas son la local y diftérica y a veces, mixta (Bolte et al., 1999). Esta última forma de presentación ha sido descrita en un loro de gorra azul (Psephotus haematogaster), recientemente introducido a un aviario 9
17 en Italia (Terregino et al., 1999) y en un guacamayo militar (Ara militaris mexicana) de dos meses de edad que pertenecía a un aviario de Texas (EE.UU.) (Dustan et al., 1988). Tsai et al., (1997) describieron en Japón un brote de DVA en inseparables (Agapornis roseicollis) asociado a una variedad de lesiones cutáneas, diftéricas, sistémicas y oncogénicas. Este brote, con inusual distribución de lesiones y con una alta incidencia de mortalidad en aves jóvenes, se presentó en un aviario comercial. En 1964, en el laboratorio estatal de diagnóstico de la Universidad de Illinosis, EE.UU., fue aislado un virus de viruela de un periquito con historia clínica de párpados hinchados, anorexia y decaimiento (Sharma et al., 1968). Así mismo, se aisló un virus pox de psitácida en loros Amazona recientemente importados que presentaban lesiones diftéricas en la cavidad oral, esófago y buche (Boosinger et al, 1982). Otro aislado obtenido de lesiones de DVA de aves psitácidas importadas originarias de Argentina fue aportado por el laboratorio de diagnóstico aviar, Dade City, Florida para realizar estudios de infectividad e inmunidad (Winterfield y Reed, 1985) Los brotes de DVA son comúnmente reportados en aviarios, centros de rehabilitación (Bailey et al., 2002), centros de investigación (Donnelly y Crane, 1984) y en otros lugares donde el confinamiento provee un estrecho contacto entre las aves (Hansen, 1999). Brotes de DVA también han ocurrido en zoológicos afectando a aves ornamentales (Ensley et al., 1978). El incremento de la popularidad de las aves exóticas, de jaula, ha resultado en un incremento en la importación y crianza en cautiverio de muchas psitácidas. La DVA ha emergido como una enfermedad seria en aves de compañía recientemente importadas, siendo los brotes de DVA en estas aves, comunes de ver en estaciones cuarentenarias (Boosinger et al., 1982). En psitácidas, ya han afectado a loros Amazona frente azul con signos clínicos de conjuntivitis, blefaritis, variados grados de anorexia y distress respiratorio (McDonald et al., 1981; Jakoby et al., 1990). La DVA también fue la causa de muerte de un loro (Amazona albifrons) que había sido importado desde México y que después de pasar la cuarentena, fue adquirido como mascota. El diagnóstico se basó en histopatología y microscopía electrónica (Graham, 1978). También fue la causa de muerte de un inseparable (Agapornis personata) recientemente importado y de su compañero de jaula. Ambas aves desarrollaron lesiones oculares y no respondieron al tratamiento de soporte (Emanuelson et al., 1978). La presencia de infección por Avipoxvirus también ha sido reportada en aves del género Neopsittacus y familia Loriinae, que enfermaron y murieron dentro de 2 a 14 días después del arribo en una estación cuarentenaria. Clínicamente e histopatológicamente la forma de presentación de DVA en estas aves fue la septicémica y diftérica (Gerlach et al., 1998). Un caso en Nueva Zelandia de muertes de rosellas por vdva de psitácidas, antes de ser exportadas, fue asociado al ingreso del virus por contrabando de aves (Health & Wellness Resource Center, 2002). Entre las aves de compañía la infección por vdva generalmente ocurre en loros Amazona frente azul (Amazona aestiva) y en grandes aviarios de canarios (Tripathy y Reed, 2003; Johnson y 10
18 Castro, 1986). El vdva de psitácidas es de especial significación para los avicultores debido a que la enfermedad puede generar grandes pérdidas en un corto período de tiempo (Tripathy y Reed, 2003). Bolte et al., (1999) realizaron una revisión sobre la ocurrencia de DVA señalando que las siguientes especies del orden Psittaciforme: Amazona spp., Agaporni spp., Loriculu spp., Deropyus spp., Pionus spp., Pionites spp., Ara spp. y Anodorhynchus hyacinthinus, Psittacara spp., Aratinga spp., Eupsittula spp., Enicognathus leptorhynchus, Brotogeris pyrrhoptera, Aprosmictus erythropterus, Psephotus spp., Platycercus eximius, Melopsittacus undulatus y Nymphicus hollandicus han sido afectadas en diversas localidades (Alemania, EE.UU, Japón, México, Bolivia, África, y América del Sur) causando el vdva alteraciones clínicas y patológicas en éstas. Las infecciones por el vdva de psitácidas han sido, así, documentadas en loros de Sur América, en cotorritas, cotorras y periquitos (parakeets) 1, siendo las especies afectadas más severamente, Amazona spp. y Ara spp. Los signos clínicos predominantes en el género Amazona son coriza y lesiones oculares y hallazgos habituales en la necropsia son la enteritis difteroide y necrosis de miocardio (Gerlach, 1999a). Minski y Petrak, (1982) describieron los casos de un guacamayo azul amarillo (Ara ararauna) y de un loro Amazona (Amazona ochrocephala) que presentaron membranas diftéricas alrededor de la laringe y dificultad para comer. Ambas aves murieron y presentaron cuerpos de inclusión característicos de DVA al exámen microscópico de tejidos (Minski y Petrak, 1982). La forma diftérica o pox húmedo es común en las crías importadas de Amazona aestiva aestiva, Pionus sp. y de inseparables (Agapornis sp.) (Phalen, 1997a). En estos últimos, el vdva asociado a lesiones cutáneas también ha sido descrito y la morbilidad y mortalidad podría alcanzar al 75% de la población en riesgo (Gerlach, 1999a). El vdva ha sido aislado de catitas, sin embargo la infección experimental con el virus aislado causó sólo una disnea de tres a cuatro días de duración sin lesiones cutáneas o muerte (Gerlach, 1999a; Sharma et al., 1968). DVA en aves de vida libre y de compañía de Chile. En Chile, Cubillos et al., (1979) diagnosticaron la DVA en Torcaza (Columba araucana, Lesson). El primer reporte de DVA en el país en psitácidas ocurrió en un aviario de aves exóticas en la zona central de Chile y afectó clínicamente al 27% de la población de aves del orden Psittaciforme. De las 50 aves con signología clínica 11 murieron durante el desarrollo del brote. Los géneros de aves afectadas clínicamente fueron Agapornis, Polytelis, Platycercus y Neophema. El diagnóstico se 1 Parakeets: (Brotogeris spp., Polytelis spp., Psittacula spp., Neophema spp., Cyanoramphus spp., Myiopsitta spp.) 11
19 basó en signología clínica, aislamiento viral, empleo de la técnica de inmunodifusión doble (ID) e histopatología (González e Hidalgo, 2004). Transmisión El vdva se transmite con facilidad en poblaciones en confinamiento a través de vectores, como moscas (Stomoxys calcitrans), mosquitos y ácaros (Damassa, 1966). La transmisión directa por contacto entre infectados y aves susceptibles o indirecta por contacto con objetos contaminados, como perchas o bebederos, también se describe (Donnelly y Crane, 1984). En ambientes contaminados, el aereosol generado por plumas y costras secas que contienen partículas virales proveen una fuente de infección respiratoria o cutánea (Tripathy y Reed, 2003). Los vdva no pueden penetrar el epitelio intacto, sin embargo, lesiones pequeñas como leves abrasiones durante el transporte de las aves podría ser una entrada para el vdva (Gerlach et al., 1998). Las aves que se recuperan de la DVA, pueden desarrollar una infección persistente y eliminar intermitentemente el virus desde piel, plumas y sistema gastrointestinal (Ritchie, 1995). Las infecciones por vdva, particularmente en situaciones de bandadas, pueden permanecer latentes por años y los factores estresantes no específicos se asocian con reactivación viral (Gerlach et al., 1998). Diagnóstico serológico. Dentro de las posibilidades de diagnóstico de infecciones por vdva, se encuentra la serología. Los anticuerpos contra vdva pueden ser demostrados a través de hemoaglutinación pasiva, enzyme-linked immunosorbent assay (ELISA), ID o Neutralización Viral (NV) (Gerlach, 1999a; Tripathy y Reed, 2003). A través del uso de la neutralización, FC y de ID se ha demostrado que reacciones cruzadas ocurren entre varios vdvas (Uppal y Nilakantan, 1970). La técnica de ID ha sido empleada en psitácidas acompañada de otras herramientas diagnósticas (Ramos et al., 1986; Jakoby et al., 1990). El diagnóstico definitivo se realiza a través de la demostración histopatológica de los cuerpos de Bollinger en muestras de biopsias sospechosas y aislamiento viral (Gerlach, 1999a). ADENOVIRUS AVIAR. La familia Adenoviridae es conformada el género Mastadenivirus que infecta a mamíferos y el género Aviadenovirus compuesto por adenovirus aviares del grupo I, que infecta a aves. Pertenecientes a la misma familia se han propuesto otros dos géneros: Siadenovirus y Atadenovirus (McFerran, 2003). Los AVA son virus DNA, icosaédricos, no envueltos, de diámetro 70 a 90 nm, y son divididos en los grupos I-II-III acorde a su diversidad biológica (McFerran y Adair, 2003). Dentro del grupo I se encuentran los AVA de pollos (AVAP) que se clasifican en doce serotipos numerados de 1 a 12 (AVAP 1-12), los AVA de gansos, los AVA de patos, los AVA de pavos y los AVA de paloma (Hess, 12
20 2000). Los AVA del grupo I tienen en común antígenos específicos de grupo y han sido aislados desde pollos, pavos, palomas, catitas, patos mallard, patos muscovy, faisanes, gansos y gallinetas (McFerran y Adair, 2003). La clasificación reciente de AVA del grupo I, de acuerdo con "The International Committee on Taxonomy of Viruses" (ICTV), divide los serotipos AVAP 1-12, en 5 especies de AVA designados con las letras A-B-C-D y E, basado en un criterio molecular, y como especies tentativas del grupo I a AVA de patos, AVA de palomas y AVA de pavos (Benkö et al., 2000). Los virus de la enteritis hemorrágica de los pavos, de la enfermedad del bazo marmóreo del faisán y de esplenomegalia por AVA pertenecen al grupo II y al género Siadenovirus. El virus del síndrome de la caída de la postura es el único miembro del grupo III y pertenece al género Atadenovirus (Hess, 2000; Mc Ferran, 2003). La mayoría de las infecciones por AVA del grupo I, pueden ser latentes o subclínicas. Los AVA podrían además ser patógenos primarios o tal vez causa de enfermedades en conjunción con otras infecciones virales (Phalen, 1997a). Generalmente los AVA son considerados patógenos oportunistas y casi siempre están relacionados con inmunodepresión o enfermedades concomitantes (Greenacre, 2005). Muchas aves psitácidas no presentan signos clínicos de infección por AVA, pero exhiben cuerpos de inclusión basófilos intranucleares generalmente en enterocitos y hepatocitos, que son consistentes con adenovirus, sugiriendo que infecciones asintomáticas pueden ocurrir en estas aves (Greenacre, 2005; Droual et al., 1995). Las enfermedades asociadas a AVA han sido reportadas esporádicamente en aves individuales o en brotes aislados y son poco común en aves mascotas (Phalen, 1997a). No obstante, en psitácidas han sido reportados varios casos que asocian a AVA a enfermedad clínica y a presentación de brotes con presentación repentina de la enfermedad, progresión aguda y elevada mortalidad (Ramis et al., 1992). En algunas especies de psitácidas (loros Amazona, loros barranqueros, rosellas eximius, guacamayos Jacinto, algunas cacatúas y catitas) que cursan con infección por AVA, muertes repentinas podrían suceder (Greenacre, 2005). Las cepas del grupo I están ampliamente distribuidas en el mundo y han sido asociadas con signos respiratorios, anemia, hepatitis con cuerpos de inclusión, enfermedades intestinales, pancreatitis y nefropatías (McFerran y Adair, 2003). En aves del orden Psittaciforme las infecciones por AVA pueden ser un hallazgo incidental o estar asociado con depresión, anorexia, pancreatitis con cuerpos de inclusión, encefalitis, hepatitis con cuerpo de inclusión, esplenitis, enteritis hemorrágica o catarral, nefrosis con cuerpos de inclusión, o conjuntivitis (Greenacre, 2005; Droual et al., 1995; Soike et al., 1998; Gómez-Villamandos et al., 1992; Ramis et al., 1992; Okita, 1989; Mori et al., 1989; Mackie et al., 2003; Ritchie, 1995). Infección respiratoria asociada a AVA, también ha sido reportada en una cotorrita de collar (Psittacula krameri), que presentó en células del epitelio bronquial cuerpos de inclusión intranucleares y en la microscopía electrónica (ME), partículas de 13
21 morfología semejante a AVA (Desmidt et al., 1991); rinitis, aereosaculitis y neumonías también han sido asociado con adenovirosis en aves psitácidas (Mori et al., 1989; Ramis et al., 1992). En algunos casos, en psitácidas, la presentación clínica de la enfermedad por AVA se asocia a stress (Mori et al., 1989; Ramis et al., 1992; Gómez- Villamandos et al., 1992; Desmidt et al., 1991; Mackie et al, 2003). En otros, la expresión de una infección latente por AVA en estas aves puede presentarse en asociación con enfermedades inmunosupresivas u otras infecciones (Desmidt et al., 1991). Existe por otro lado, evidencia creciente que ciertos genotipos de AVA del grupo I pueden ser patógenos primarios en pollos, palomas y codornices (McFerran y Adair, 2003). Droual et al., (1995) describieron el caso de dos loros grises africanos que sufrieron una hepatitis con cuerpos de inclusión y una enteritis hemorrágica, asociadas con adenovirus como patógeno primario ante la falla para aislar o identificar a otros agentes biológicos que explicasen las lesiones sufridas en estas aves. En psitácidas, los AVA fueron inicialmente aislados de dos catitas (Melopsittacus undulatus) con historias de muerte repentina y enteritis respectivamente por McFerran et al., (1976) y fueron reconocidos como un serotipo dentro de AVAP. Existen posterior a ello, informes que asocian signos clínicos y lesiones histopatológicas a AVA en catitas australianas, inseparables, cotorritas ninfas, cotorritas de collar, guacamayos Jacinto, rosellas, loros eclectus, loros Amazona, loros pionus, conuros, cacatúas (Cacatua alba, Eolophus roseicapillus, Cacatua moluccensis, Cacatua sulphurea), periquitos (Neophema spp.), loros grises africanos (Psittacus erithacus) y loros poicephalus (Poicephalus robustus, P. gulielmi, P. rubiventris, P. senegalus, P. meyeri) (Gerlach, 1999a; Lowenstine, 1987; Pass, 1987; Scott et al., 1986; Ramis et al., 1992; Gómez- Villamandos et al, 1992; Desmidt et al., 1991; Droual et al., 1995; Latimer et al., 1998; Soike et al., 1998; Wellehan et al., 2005). Hunter et al., (1979) comunicaron altos índices de mortalidad en varios aviares de catitas comerciales en Ontario, Canadá. Éstas presentaron hepatomegalia asociada a una hepatitis difusa con cuerpos de inclusión eosinofílicos identificándose partículas virales de adenovirus por ME. Epizootias por adenovirus también han sido descritas. Un caso, de un año de duración fue reportado en Alemania, en catitas, incluyendo signos clínicos de tortícolis, opistótonos, temblores y convulsiones. De una ave se obtuvo un aislado relacionado serológicamente con AVAP 2 y AVAP 11, y de otra ave un aislado con relación serológica con AVAP 4 (Gassmann, 1981). Una enfermedad fatal afectó a varios loros grises africanos y a loros Poicephalus (Poicephalus robustus) en una instalación de crianza. Las aves presentaron necrosis hepática y enteritis hemorrágica. AVA fueron aislados desde hígado e intestino y fueron relacionados serológicamente con AVAP 4. A través de análisis con enzimas de restricción los aislados mostraron identidad con la cepa de referencia KR5 (AVAP 4) (Soike et al., 1998), que pertenece a la especie C de acuerdo a la clasificación de Benkö et al., (2000). Droual et al., (1995) también reportaron un 14
22 caso de hepatitis por cuerpos de inclusión y de enteritis hemorrágica en dos loros grises africanos asciado con AVA del grupo I. Otra epizootia de hepatitis inducida por adenovirus ha sido descrita en un grupo de Psittaciformes en una colección de zoológico de aves. Las especies afectadas fueron la Cacatua sulphurea, Platycercus eximius, Andorhynchus hyacinthus, Cyanoliseus patagonus, y Amazona viridiginalis (Bryant y Montali, 1987). En un zoológico de Barcelona, también fue detectada en una colonia de loros eclectus (Eclectus roratus), una enfermedad epidémica donde el modelo epidemiológico y patológico junto a los hallazgos histopatológicos y de ultraestructura indicó que se debería a una hepatitis por cuerpo de inclusión por AVA. Los 59 loros del grupo murieron (Ramis et al., 1992). Mackie et al., (2003) describieron un caso en una tienda de ventas de mascotas en Victoria (Australia), que generó la muerte de tres lories (Trichoglossus spp.). Las aves presentaron una enteritis asociada a cuerpos de inclusión intranucleares y partículas virales concordantes con AVA. Se sospecha que aves psitácidas también podrían ser infectadas naturalmente con AVA del grupo II. Una infección por AVA del grupo II fue estudiada mediante histopatología, inmunohistoquímica y técnicas de ultraestrucura en cuatro aves psitácidas que al exámen postmortem presentaron esplenomegalias, bazos friables y pálidos. Las aves habían presentado 4 a 6 días antes de morir signos clínicos de disnea y depresión (Gómez- Villamandos et al., 1995). Transmisión. Los AVA del grupo I son de transmisión horizontal y vertical, siendo esta última forma de transmisión importante en la mantención de la infección en bandadas. El virus se encuentra en heces, en mucosa nasal y traqueal y en riñones, pudiendo ser transmitido por todas estas excresiones. El virus podría además estar presente en el semen. La diseminación a través de fomites, del personal y medios de transportes, también puede ocurrir (McFerran y Adair, 2003). Diagnóstico Los anticuerpos contra antígenos específicos de grupo pueden ser demostrados por inmunofluorescencia indirecta, ELISA o ID. Esta última, ha sido comúnmente usada para detectar infección por AVA y para demostrar reactividad específica de grupo. Anticuerpos tipo específico pueden ser detectados mediante la prueba de seroneutralización o ELISA (McFerran y Adair, 2003). El diagnóstico de infecciones por AVA es usualmente acompañado por aislamiento viral y serotipificación (Latimer et al., 1997). En aves psitácidas y palomas, la ME e histología han sido usadas ampliamente para diagnosticar infecciones por AVA (Hess, 2000). Avances histológicos recientes en el diagnóstico de AVA son la tinción inmunoperoxidasa e inmunofluorescencia (Latimer et al., 1997, McFerran y Adair, 2003). Infecciones por AVA en psitácidas han sido también diagnosticadas utilizando la prueba de hibridación de DNA in situ a través de sondas de oligonucleótidos en muestras de tejidos fijados en formalina e incluidos posteriormente en parafina 15
23 (Latimer et al., 1997; Latimer et al., 1998; Campagnoli y Latimer, 1998) siendo esta última para Greenacre, (2005) la mejor prueba disponible comercialmente para psitácidas actualmente. La prueba de reacción en cadena de la polimerasa (RCP) también ha sido empleada ampliamente para detectar adenovirosis del grupo I y puede ser usado para asignar especies y serotipos de aislados (McFerran y Adair, 2003). INFECCIONES POR VIRUS POLIOMA AVIAR. Las infecciones por VPA (anteriormente llamado papovavirus o virus de la enfermedad de los polluelos de las catitas) son causadas por un virus DNA, no envuelto, icosaédrico, de nm de diámetro, perteneciente a la familia Papovaviridae. El virus es la principal causa de morbilidad y mortalidad en psitácidas de aviarios y colecciones de zoológicos (Ritchie et al., 1991). La primera infección aguda y generalizada asociada con un VPA fue descrita en aves jóvenes psitácidas de aviarios de la provincia de Quebec (Canadá) en respuesta a la solicitud de criadores de catitas por asistencia diagnóstica de sus bandadas. Desde 1976, criadores comerciales de aves exóticas (Melopsittacus undulatus) habían reportado en la provincia, altos índices de mortalidad en polluelos de catitas y serias pérdidas económicas. La mortalidad fue del 25% al 100% en catitas de 1 a 15 días de edad y los signos clínicos más consistentes de la enfermedad fueron distención abdominal y ausencia a desarrollo incompleto de las plumas. Partículas virales de 50 a 55 nm semejantes en tamaño y morfología a Papovavirus fueron observadas en diferentes órganos de las aves afectadas (Bernier et al., 1981). Davis et al., (1981) describieron en aviarios de Texas y Georgia, mortalidades del 30 a 80% en catitas de 1 a 3 semanas de edad. Las aves afectadas presentaban muertes agudas, distención abdominal y piel enrojecida. Las lesiones post mortem fueron hidropericardio, cardiomegalia y hepatomegalia con áreas de necrosis y riñones congestivos. Histológicamente el exámen de varios tejidos reveló la presencia de células con núcleos engrandecidos con cuerpos de inclusión. La ME reveló la presencia de partículas virales de 42 a 49 nm de diámetro en los núcleos de las células epiteliales de los túbulos renales. El aislamiento y caracterización del virus observado en estos tejidos, fueron realizados por Bozeman et al., (1981) y correspondería a un Papovavirus (familia Papovaviridae). Se refiere así a la condición descrita por Davis et al., (1981), como la enfermedad de los polluelos de las catitas o "budgerigar fledgling disease" (BFD) y al virus en estudio como VBFD (Bozeman et al., 1981). Posteriormente Lehn y Muller, (1986) clasifican al virus dentro del género Polyomavirus. Los brotes de BFD en aviarios de catitas en Ontario también fueron asociados a morbilidad, mortalidad y a importantes pérdidas económicas para los criadores. BFD fue relacionado en un aviario de Ontario con la caída en los nacimientos de las aves de un 80% a un 40% y en otro aviario, 16
24 con mortalidades de hasta 90% en polluelos de 7 a 10 días de edad, dentro de un período de dos a tres semanas (Gough, 1989). Las infecciones por VPA en catitas, también fueron reconocidas en Italia, Japón, Hungría, Alemania (Graham y Calnek, 1987) y Reino Unido (Randall et al., 1987). Los neonatos de catitas típicamente infectados por VPA presentan distención abdominal, hemorragia subcutánea y también pueden desarrollar tremor del cuello y cabeza y ataxia. Las aves que sobreviven a la infección pueden exhibir anormalidades simétricas en las plumas caracterizadas por la formación anormal de las plumas de la cola (timoneras) y de las remeras primarias, pérdida del plumón sobre espalda y abdomen y pérdida de filoplumas sobre cabeza y cuello (Ritchie et al., 2003). Esta enfermedad no había sido reportada en otras psitácidas, hasta que Jacobson et al., (1984) reportaron mortalidad en polluelos de guacamayos (Ara sp. y Anadorhynchus sp.) y en loros conuros (Aratinga sp.) en cautiverio en EE.UU, que fue atribuida mediante el exámen de necropsia, histopatología y ME a infección por VPA. Posteriormente, se describe una enfermedad que causó muertes repentinas y lesiones en hígado, bazo y riñón, en inseparables (Agapornis roseicollis, A. personata y A. lilianae), usualmente menores de 1 año de edad, de aviarios del oeste de Australia. La enfermedad se asoció a infección por Papovavirus (Pass, 1985). Posteriormente, en 44 loros pertenecientes a 18 especies, que eran alimentadas a mano y que tenían entre 14 días a 4 meses de edad, se diagnosticó infección por VPA. Las aves habían sido encontradas muertas sin signos premonitorios de enfermedad o murieron después de 12 a 48 horas de presentar debilidad y anorexia (Graham y Calnek, 1987). En periquitos espléndidos (Neophema splendida) también se han descrito infecciones por un virus semejante a Papovavirus asociado a morbilidad (Pass et al., 1987). Las infecciones por VPA han sido reconocidas en aves psitácidas de compañía en EE.UU (Davis et al, 1981; Jacobson et al., 1984; Graham y Calnek, 1987), Canadá (Bernier et al., 1981; Bernier et al, 1984; Lynch et al, 1984; Gough, 1989), Reino Unidos (Scotland) (Randall et al, 1987), Italia, Japón, Hungría, Alemania (Graham y Calnek, 1987; Sandmeier et al., 1999), y Australia (Pass, 1987). Los VPA que infectan a varios huéspedes aviares parecen ser similares morfológicamente y antigénicamente, sin embargo la presentación clínica y distribución de lesiones y efectos epidemiológicos del virus parecen ser diferentes según la especie susceptible (Gerlach, 1999a). El VPA es la principal causa de muerte en aves psitácidas jóvenes ( 150 días de edad), informándose índices de mortalidad del 10 % a 93% en neonatos (Ritchie et al., 1998b; Ritchie et al., 1998a). Las aves psitácidas adultas también son susceptibles a la infección; sin embargo, en la mayoría de los casos, sólo se aprecia seroconversión y una enfermedad transiente con letargia, anorexia y diarrea (Ritchie et al., 1998c). 17
25 El que la infección genere enfermedad es dependiente de la edad, especie y características individuales del ave infectada (Phalen et al., 2000; Jacobson et al., 1984). Las catitas afectadas por VPA, típicamente mueren entre los 10 a 20 días de edad (Davis et al., 1981); los conuros afectados por VPA, entre 1 a 6 semanas de edad y los guacamayos y loros eclectus, entre las 4 semanas y 14 semanas de edad (Jacobson et al., 1984; Graham y Calnek, 1987; Phalen, 1997b). La enfermedad en aves psitácidas adultas es poco frecuente y a menudo es asociada con infección concurrente con el virus de la enfermedad del pico y de las plumas de los psitácidos (Latimer et al., 1996). Algunas aves psitácidas adultas pueden morir sin presentar signos clínicos de la enfermedad, otras pueden presentar signos clínicos de depresión, pérdida del apetito, baja de peso, retardo en el vaciamiento del buche, vómito, biliverdinuria, diarrea y sangramiento bajo la piel 12 a 48 horas antes de morir. Las aves psitácidas no catitas afectadas por VPA evidencian una pérdida generalizada de integridad vascular con hemorragias subcutáneas y subserosas y distintos grados de ascitis y efusiones pericárdicas (Jacobson et al., 1984; Graham y Calnek, 1987). Micróscopicamente, tienen una moderada a masiva necrosis hepática y en un tercio de los casos aproximadamente se observa glomerulopatías (Jacobson et al., 1984; Graham y Calnek, 1987). Glomerulopatías asociadas a VPA, también han sido descritas en loritos recién nacidos Ara spp., Aratinga spp. y Pyrrhura spp. (Phalen et al., 1996). Una encefalopatía atribuída a infección por VPA en una cacatúa Ducorp (Cacatua ducorpsii) mediante ME y la prueba de hibridización de DNA in situ también ha sido reportada. El ave presentó una infección concurrente con el virus de la enfermedad del pico y de las plumas de las psitácidas (Latimer et al., 1996). Algunas aves jóvenes psitácidas no catitas, infectadas con VPA, se recuperan después de la enfermedad, otras no muestran evidencias clínicas de enfermedad; y otras podrían ser infectadas persistentemente con VPA. Se ha confirmado en la circulación sanguínea de un loro Aratinga, VPA durante 4 años, siendo considerado un portador. Pareciera ser que las aves pueden permanecer asintomáticamente infectadas con VPA durante extensos períodos de tiempo (Dalhausen y Radabaugh, 2005). Las infecciones subclínicas son comunes en aves adultas y jóvenes que vierten intermitentemente el virus, siendo responsables de la persistencia y transmisión en varias poblaciones aviares (Gerlach, 1999a). Las infecciones por VPA han sido descritas a través del mundo y han sido asociadas a enfermedades en diferentes géneros y especies de aves de compañía y aviarios incluyendo a catitas, inseparables, caiques (Pionites leucogaster), guacamayos, loros Amazona, conuros, loros pionus, loros grises africanos, loros eclectus, lories, cacatúas, cotorritas ninfas, periquitos espléndidos, periquitos bourke, cotorritas de collar (Ritchie et al., 2003; Ritchie, 1995; Graham y Calnek, 1987; Pass, 1989), loritos del género Forpus y en el loro de las montañas de Nueva Zelandia (Nestor notabilis) (Sandmeier et al, 1999). Otras especies susceptibles naturalmente a VPA son las especies 18
26 Poicephalus meyeri y Poicephalus senegalus, Brotogeris pyrrhopterus, Deroptyus accipitrinus y Myiopsitta monachus (Ritchie, 1995). En aves psitácidas de vida libre, son escasos los reportes de infecciones por VPA. En un primer reporte, se detectó anticuerpos anti-vpa en loros Aratinga (Aratinga weddellii) del sureste de Perú, mediante las prueba de FC y de NV (Gilardi et al., 1995). En el otro, se encontró evidencia serológica de infección por VPA mediante la prueba de NV, en cacatúas de penacho amarillo (Cacatua galerita) en New South Wales (Australia) (Raidal et al., 1998). También han sido descritos casos en psitácidas salvajes capturadas para ser mantenidas en cautiverio. Un caso fue en una cacatúa (Cacatua ducorpsii) (Latimer et al., 1996) y el otro en una cuarentena, donde un grupo de aves conformado por inseparables de cara roja (Agapornis pullaria) adultos, capturados de vida libre e importados desde África, presentó una infección que generó la muerte repentina, sin signología previa, de todo el grupo (Enders et al., 1997). El VPA podría infectar y generar enfermedad en otras especies aviares no Psittaciformes como Passeriformes (Sandmeier et al., 1999), diamantes de gould (Erythrura goldiae) (Rossi et al., 2003) y Pyrenentes sp., Spermophaga haematina (familia: Estrildidae) (Garcia et al., 1994b) y Pteroglossus viridis (familia Ramphastidae) (Lafferty et al., 1999). Aves gallináceas también parecen ser susceptibles a VPA (Phalen, 1997a). En gansos ha sido descrito una enteritis y nefritis hemorrágica generada por un virus polioma (polioma virus del ganso hemorrágico) (Guerin et al., 2000) que ha sido confirmado filogenéticamente y por análisis estructural del genoma como un virus diferente al VBFD (Johne y Muller, 2003). El VPA, es uno de los patógenos más importantes de las aves psitácidas domésticas y se sospecha que uno o más VPA pueden infectar a aves de jaula no psitácidas, pero la relación entre estos virus con la infección de VPA en loros permanece sin aclarar. Una infección y enfermedad causada por VPA en un tilingo limón (Pteroglossus viridis) ocurrió en un aviario y de acuerdo con los resultados serológicos, algunas aves restantes del aviario (cacatúas, ninfas australianas, turacos, diamantes, mandarinos, y una cucaburra risueña), presentaron anticuerpos contra VPA. Los resultados de la secuenciación de DNA viral y los resultados serológicos sugieren que el VPA que infectó a los tilingos fue transmitido por un loro y este fue capaz de infectar por lo menos a cuatro órdenes diferentes (Lafferty et al., 1999). Transmisión Informaciones experimentales y observaciones de la ocurrencia natural de la enfermedad sugieren que la transmisión de VPA es horizontal y vertical (Gerlach, 1999a). Las aves son expuestas al virus a través del contacto directo con aves infectadas o a través del contacto con ambientes contaminados (Ritchie et al., 1998a). La estabilidad ambiental del VPA causa un considerable problema en el aviario porque las aves infectadas en forma persistente pueden eliminar el virus a través de sus excrementos (heces, orina, secreciones respiratorias) y caspa de las plumas (Ritchie et 19
27 al., 2003). La transmisión vertical ha sido vista en catitas y se sospecha que pueda ocurrir en otras especies. El período de incubación es de 2 a 14 días (Greenacre, 2005). Los brotes de VPA, han sido relacionados con inadecuados procedimientos de cuarentena, nidos o incubadoras contaminados con virus, cargamentos de aves no vacunadas o incompletamente vacunadas para la venta, mezcla de aves no vacunadas de diversos lugares, exposición de bandadas residentes no vacunadas o neonatos con aves infectadas o con un ambiente contaminado y retorno de ellas al aviario sin cuarentena (Ritchie et al, 1998b). Diagnóstico Debido a que las infecciones por VPA, son una de las mayores preocupaciones en un aviario, el diagnóstico de la infección por VPA es importante para implementar medidas de control y mantener el ambiente libre de la enfermedad (Roy et al., 2004). En el pasado, el diagnóstico de infecciones por VPA fue basado en los hallazgos de lesiones características, la observación de cuerpos de inclusión intra-nucleares amfofílicos teñidos en hematoxilina-eosina y de partículas virales por ME, o aislamiento viral (Phalen et al., 1991). Recientemente se emplean técnicas moleculares como la prueba de RCP con sondas DNA (Phalen et al., 1991; Roy et al., 2004) y la prueba de hibridación de DNA in situ con sondas DNA, en tejidos inmersos en parafina (Campagnoli y Latimer, 1998; Garcia et al., 1994a). Las sondas de DNA virales específicas han sido usadas para demostrar ácidos nucleicos de VPA en varios tejidos incluyendo hígado, bazo, riñón, secreción intestinal, secreción de cloaca, suero y sangre (Gerlach, 1999a). Recientemente, se realizó un ensayo para detectar infecciones subclínicas de VPA en aves psitácidas en cautiverio en Alemania. La presencia de VPA mediante la prueba RCP indicó que la existencia de una subpoblación de aves psitácidas en cautiverio que tienen infección persistente parece ser relativamente baja (Rahaus y Wolff, 2005). Sí un ave es infectada con VPA y sobrevive, desarrollará anticuerpos contra el virus (Phalen et al., 1993). Los anticuerpos anti-vpa pueden ser detectados en catitas 9 días después de la infección y en la mayor parte de otras aves psitácidas son detectados 2 a 3 semanas después de la infección (Phalen, 1997b). La concentración de anticuerpos anti-vpa incrementa rápidamente y alcanza la máxima concentración 4 a 6 semanas post infección (Phalen, 1997b). Los anticuerpos anti- VPA pueden ser detectados en la sangre desde meses a muchos años después de la infección dependiendo de la especie. En el caso de las catitas, una vez infectadas con VPA, no son infectadas de por vida todas ellas (Dalhausen y Radabaugh, 2005). Se describe también que estas aves mantienen los títulos de anticuerpos anti-vpa de por vida (Phalen et al., 1993), comunicándose que podrían mantener los títulos de anticuerpos neutralizantes detectables por al menos 5 años (Phalen et al., 1995); las cotorritas ninfas, cerca de 6 meses y en la mayoría de las especies de loros, pueden ser detectados por al menos 2 a 3 años post infección (Phalen et al., 1997). 20
28 En serodiagnóstico se han usado la inmunodifusión en gel agar (Lynch et al., 1984), la FC (Gilardi et al., 1995), la seroneutralización viral (SNV) (Swaine et al., 1998; Phalen et al., 1993; Ritchie et al., 1996; Lukert, 1989) y ELISA (Herrera et al., 2001) para demostrar en aves expuestas anticuerpos contra VPA. La prueba de SNV ha sido una herramienta de alta sensibilidad y especificidad empleada para detectar anticuerpos anti-vpa en aves exóticas, por muchos investigadores (Wainright et al., 1987; Gilardi et al., 1995; Phalen et al., 1996; Phalen et al., 2000; Enders et al., 1997; Raidal et al., 1998; Ritchie et al., 1996; Ritchie et al., 1998d). Una evaluación serológica para VPA, de Psittaciformes de diversos géneros pertenecientes a tres aviarios arrojó títulos serológicos positivos en el 45%, 25% y 11% de las aves monitoreadas (Wainright et al., 1987). En otros seis aviarios que contenían especies mixtas de aves psitácidas, excluyendo a catitas, la seroprevalencia de VPA fue de un rango del 11% a 63% de las aves en riesgo (Ritchie et al., 1998a; Ritchie et al., 1998d). Las seroprevalencias pueden llegar hasta el 100%, en catitas saludables adultas (Phalen et al., 1993). La prevalencia de anticuerpos específicos para VPA fue del 9,37% utilizando una prueba de ELISA de bloqueo desarrollado por (Khan et al., 2000), en guacamayos (Ara macao) en Costa Rica (Herrera et al., 2001). Chalmydophila psittaci. Esta bacteria (antiguamente llamada Chlamydia psittaci) gram negativa intracelular obligada perteneciente al género Chlamydophila, familia Chlamydiaceae, y orden Chlamydiales; posee una importancia médica, veterinaria, zoonótica y ornitológica (Kaleta y Taday, 2003). Es considerada el agente etiológico de una de las más importantes enfermedades infecciosas de aves de compañía y de la principal enfermedad zoonótica de las aves (Ramsay, 2003). La infección puede ser transmitida al humano y es de atingencia en salud pública por la popularidad de las aves psitácidas como mascotas. Ha sido aislada desde 100 especies aviares, más comúnmente de psitácidas y especialmente de cotorritas ninfas y catitas (NASPHV, 2005). De acuerdo a una revisión realizada por Kaleta y Taday, (2003) sobre el rango hospedero de Chlamydophila, basado en el aislamiento, detección del antígeno y serología, las aves positivas a Chlamydia incluyen a especies aviares domésticas (pollos, pavos, patos, gansos, palomas, codornices y pavos reales) y a un total de 460 aves de vida libre y aves mascotas representadas en 30 órdenes. El orden Psittaciforme contiene el mayor número de aves positivas a Chlamydophila (153 especies de 342; 45%). Los géneros y especies del orden Psittaciforme en que se ha descrito clamidiosis aviar son: Agapornis sp., Forpus sp., Bolborhynchus ferrugineiforons, Bolborhynchus lineola, Amoropsittaca aymara, Anodorhynchus hyacinthicus, Ara sp., Eupsittula sp., Aratinga sp., Nandayus nanday, Diopsitta nobilis, Conuropsis carolinensis, Pyrrhura sp., Brotogeris sp., Gyopsitta barrabandi, Amazona sp., Deroptys accipitrinus, Pionus sp., Pionites 21
29 sp., Poicephlus guilielmi, Poicephalus senegalus, Psittacus erithacus, Psittacula spp., Eclectus roratus, Prioniturus platurus, Aprosmictus sp., Alisterus sp., Spathopterus spp., Graydidascalus brachyuris, Polytelis sp., Nestor notabilis, Cacatúa sp., Probosciger aterrinus, Eolophus rosicapillus, Nymphicus hollandicus, Neophema sp., Neopsephotus bourkii, Cyanoramphu sp., Platycercu sp., Eunymphicus cornutus, Psephotus sp., Barnardius sp., Purpureicephalus spurinus, Trichoglossus sp., Eos bornea, Charmosyna pulchella, Hypocharmosyna toxopei. También ha sido descrita en Cyanolysius patagonus y en la cotorrita argentina (Myiopsitta monachus) (Kaleta y Taday, 2003). La infección con C. psittaci, referida como clamidiosis aviar, es una causa importante de enfermedades sistémicas en aves de compañía (NASPHV, 2005). Los signos clínicos de clamidiosis aviar son letargia, anorexia, plumas erizadas, descarga nasal u ocular serosa a mucupurulenta, diarrea y excresión verdosa de los uratos, emaciación, deshidratación (NASPHV, 2005). Ocasionalmente, las psitácidas desarrollan signos del sistema nervioso central, como tremor, opistótonos y paresis (Desmidt et al., 1998). Los rangos de mortalidad son sobre el 30% (Andersen y Vanrompy, 2003). Recientemente fue reportado un brote de clamidiosis aviar en 58 polluelos de loros Amazona frente azul (Amazona aestiva) en un centro de rehabilitación de fauna de Brazil, después de haber sido recuperadas del comercio ilegal. Los signos clínicos observados fueron inespecíficos y la mortalidad fue del 96,5%. La elevada mortalidad observada se atribuyó a pobres condiciones de crianza y al retraso en el diagnóstico y tratamiento de la enfermedad. El diagnóstico fue mediante RCP en muestras de tejido (Raso et al., 2004). El progreso clínico de la infección varía con la virulencia de la cepa infectante y de la especie (Gerlach, 1999b). Las aves psitácidas jóvenes son más susceptibles a la infección, que las adultas. Los guacamayos y los loros Amazona parecen ser más susceptibles que los loros de Australia y sur de Asia; y los loros de África son menos susceptibles que estos últimos (Gerlach, 1999b). Aunque los loros grises africanos (Psittacus erithacus erithacus) son generalmente considerados resistentes a clamidiosis aviar, casos con signología clínica han sido descritos (Desmidt et al., 1998; Gerlach, 1999b). La infección asintomática es característica de aves adultas expuestas a un moderado número de cepas moderadamente virulentas. Estas aves pueden eliminar el organismo durante varios meses (Gerlach, 1999b). Las aves expuestas a altas dosis de cepas virulentas desarrollan una infección sistémica aguda y frecuentemente mueren (Jara y Borie, 2001). Esta forma de presentación también es vista en aves jóvenes o que son infectadas con cepas no adaptadas al huésped (Gerlach, 1999b). Las infecciones subagudas o enfermedades prolongadas son típicas para todas las especies aviares con una menor susceptibilidad o para aves infectadas con cepas moderadamente virulentas (Jara y Borie, 2001). La infección queda latente luego de la primoinfección con períodos intermitentes de reactivación y excresión (Martínez, 2002). 22
30 Es estimado que entre 15 a 30% de las aves mascotas eran infectadas en EE.UU. con C. psittaci (Mohan, 1984; Lipman et al., 1994). Entre los años 1980 a 1983 se realizó un estudio epidemiológico y observaciones de laboratorio de la infección por C. psittaci. Clamidiosis fue diagnosticada en 13 (24%) de 55 aves mascotas enviadas en 1983 a un laboratorio de EE.UU. En 1982 fue diagnosticada en 18 (17%) de 103 aves mascotas; 4 (4,6%) de 87 en 1981 y 3 (8%) de 36 en La mayoría de las aves (39%) provino de propietarios de aves mascotas, 21% de tiendas de ventas de mascotas, 18% de criadores de estas aves y aficionados y 13% de aves mascotas de minoristas e intermediarios (Mohan, 1984). También clamidiosis ha sido reportada en loros de vida libre. En Tasmania se asoció a clamidiosis aviar con el estrés ocasionado por la muda en pericos orientales (Platycercus eximius) y a mortalidad (Burnet, 1939). La infección por C. psittaci también se ha encontrado en loritos rosellas (Platycercus elegans) de vida libre en el Santuario Healesville (Holz et al., 2003) y es sabido que es endémica en la avifauna de Australia (Gerlach, 1999b; Holz et al., 2003). Burnet, (1935) ya había diagnosticado clamidiosis aviar en varias especies de loros de vida libre de Australia. C. psittaci es considerada también endémica en el mundo, donde es distribuída ampliamente entre las aves de vida libre. Por lo general, el organismo está bien adaptado al huésped aviar y causa leves (sí los hay) signos clínicos o lesiones patológicas. La enfermedad con signos clínicos es precipitada, la mayoría de las veces, por procedimientos y condiciones inducidas por el humano (Gerlach, 1999b). La sobrepoblación, inadecuada higiene, malnutrición, cambios en la temperatura ambiental e infecciones concomitantes pueden generar estrés en el ave y activar infecciones clamidiales latentes, conduciendo a la enfermedad clínica y diseminación del agente. Estos factores pueden además influenciar la frecuencia e intensidad de eliminación de cuerpos elementales clamidiales a través de secreciones del hospedero (Fudge, 1996). Otros factores que también pueden reactivar la eliminación, son el cambio de jaula de un ave, los embarques de aves y la crianza. Las aves infectadas diseminan la bacteria a través de las heces y descargas nasales y las aves se infectan por la exposición de estos materiales vía ingestión o inspiración (Andersen y Vanrompay, 2003). Algunas aves infectadas pueden aparecer saludables y vierten el organismo al exterior en forma intermitente (NASPHV, 2005). Las cotorritas ninfas son frecuentemente portadores y vierten el agente en forma intermitente en las heces por períodos de tiempo mayores a un año, después de haber presentado la infección activa (Gerlach, 1999b). La transmisión a través de insectos o ácaros también es posible. La transmisión vertical a través del huevo ha sido documentada en catitas (Gerlach, 1999b) y otras especies. Su ocurrencia perece ser baja, sin embargo puede servir como un método de introducción de Chlamydophila en una bandada (Andersen y Vanrompay, 2003). Son conocidos 8 serovars o serotipos de C. psittaci, todos los cuales son considerados transmisibles al humano. Los serotipos A y F son endémicos entre aves Psittaciformes (Everett et al., 23
31 2000). El serotipo B ha sido ocasionalmente aislado de aves Psittaciformes y el serotipo E también ha sido aislado de una catita (Duan et al., 1999). Es sabido que el serovar A, puede causar esporádicamente enfermedad zoonótica en humanos, otros mamíferos y tortugas (Everett, 2000). Son pocos los reportes de transmisión de C. psittaci de aves a mamíferos no humanos. La probable transmisión de C. psittaci de un guacamayo Ara ararauna aparentemente saludable a un gato, basándose en la historia y epidemiología del caso, ha sido descrita. El gato afectado presentó letargia, anorexia, fiebre y una conjuntivitis bilateral atribuída a la bacteria (Lipman et al., 1994). Psitacosis humana. Entre 1975 y 1984 hubo 1136 casos de psitacosis en humanos, con ocho muertes reportadas al Center For Disease Control (CDC) en EE.UU. La fuente de infección fue conocida en 1025 casos y cerca del 70% de estos casos, tuvieron su origen en aves mascotas y aves de corral (Salisch et al., 1996; Williams, 1989). Entre 1988 y el 2003, fueron reportados al CDC en EE.UU 935 casos de psitacosis (NASPHV, 2005). Pero para Gregory y Schaffner, (1997) las neumonías causadas por C. psittaci ocurren más frecuentemente que los 100 a 200 casos registrados anualmente por las autoridades de Salud Pública en EE.UU. Por otro lado, de los 935 casos de psitacosis reportados, la mayor parte de estos resultó desde la exposición de personas con aves mascotas infectadas, casi siempre loros, guacamayos, cotorritas ninfas, y "parakeets" (NASPHV, 2005). Otras personas en riesgo incluyen aficionados de palomas o personas con una ocupación específica (veterinarios, empleados de plantas faenadoras de aves de corral, trabajadores de laboratorios y de estaciones de cuarentena, granjeros, trabajadores de zoológicos y de centros de rehabilitación de fauna) (NASPHV, 2005). En otro estudio realizado en el hospital Fairfield, de los 135 casos de psitacosis serológicamente confirmados de pacientes que habían sido admitidos en el hospital entre 1972 a 1982, el 85% había descrito una historia de reciente exposición con aves (Yung y Grayson, 1988). En el hombre la psitacosis es una enfermedad que se presenta usualmente en forma esporádica o en pequeños brotes en asociación al contacto con aves psitácidas, palomas y aves domésticas (NASPHV, 2005; Schlosssberg et al., 1993). Una epidemia de psitacosis aviar y humana ocurrió en Filadelfia. C. psittaci fue aislada de las aves infectadas de un aviario y los pacientes humanos fueron evaluados clinicamente y serológicamente. De los 24 pacientes examinados, fueron identificados 13 casos de psitacosis estimándose una tasa de ataque del 54% (Schlosssberg et al., 1993). Brotes de psitacosis en miembros de dos familias de Massachusetts y Tennessee, asociados a la adquisición de un "parakeet" y una cotorrita ninfa de tiendas de ventas de mascotas locales, relacionados con un mismo distribuidor de aves en Mississippi fueron reportados (Lardner et al., 1992). Otros brotes familiares de psitacosis, asociada a la adquicisión de loros también han sido descritos (Bano et al., 1992). 24
32 La psitacosis humana también se presentó en forma de pandemia entre los años 1929 y 1930 (Andersen y Vanrompay, 2003). En 1929 más de 100 casos de una inusual y seria pneumonía fueron reportados en Argentina, el diagnóstico de psitacosis se basó en los signos clínicos de los pacientes y que los pacientes infectados habían sido expuestos a un gran cargamento de aves desde Brazil. Muchas de las aves enfermaron y murieron y otras fueron vendidas rápidamente. Psitacosis también fue reportada en Inglaterra en 1929 y también diagnosticada en EE.UU en el mismo año. En 1930, la enfermedad había sido expandida a Austria, Dinamarca, Checoslovakia, Francia, Alemania, Holanda, Islandia, Italia, Paises Bajos (Netherlands), Polonia, España, Suiza, Suecia, Argelia, Egypto, México, Canadá, Japón y Australia. En muchos de estos países, recientes cargamentos de loros enfermos fueron citados como la causa de los brotes. En EE.UU., fueron registrados 169 casos, estimándose 74 focos de infección y 33 muertes fueron atribuidas a psitacosis desde Noviembre de 1929 hasta De los 74 focos de infección, 43 fueron atribuidos a loros Amazona, las otras especies incriminadas fueron en orden decreciente loros, inseparables, canarios, "parakeets" y catitas. Las aves que habían sido importadas desde Sur América, El Caribe, Centro América, México, Alemania y Japón fueron todas asociadas con la infección en humanos en EE.UU (Ramsay, 2003). Los casos registrados en el brote de 1929 a 1930 fueron estimados entre 750 a 800, con una tasa de mortalidad de aproximadamente 15%. Alemania fue el país más severamente afectado con 215 casos y 45 muertes. Inglaterra y Argentina fueron los únicos países además de EE.UU, que tuvieron más de 100 casos de psitacosis en humanos (Ramsay, 2003). La infección con C. psittaci en el humano puede ser asintomática o manifestarse a través de una enfermedad leve semejante a una gripe o como una enfermedad sistémica fulminante con una severa neumonía (Eidson, 2002; NASPHV, 2005). Los humanos con infección sintomática manifiestan fiebre, escalofríos, cefalea intensa y difusa, malestar general, mialgia, tos no productiva que puede llegar a ser mucosa o sanguinolienta, faringitis y/o epistaxis. (NASPHV, 2005; Stamm, 1998). La psitacosis puede afectar otros órganos, además del tracto respiratorio, y producir miocarditis, pericarditis, hepatitis, artritis, queratoconjuntivitis, fotofobia, esplenomegalia, ligeras erupciones maculosas (erupsiones de Horder) (Stamm, 1998) y molestias digestivas (Bourne et al., 2003). Una severa psitacosis multiorgánica ocurrió en un niño en Bélgica, que había revelado la presencia de dos loros en su hogar (Henrion et al., 2002). C. psittaci puede causar también endocarditis en humanos: Shapiro et al., (1992) describió un caso de endocarditis atribuida a la bacteria, en una mujer que había sido expuesta a un "parakeet". Una neumonía asociada con un abdomen agudo en una mujer que tuvo una exposición con aves psitácidas fue atribuída a C. psittaci (Bourne et al., 2003). La tasa de mortalidad atribuida a psitacosis fue aproximadamente de un 20% antes de que los antibióticos fuesen usados, pero actualmente es menor al 1% (NASPHV, 2005). Algunas cepas de C. psittaci causan una psitacosis fatal en los humanos (Everett, 2000). Dos casos de psitacosis fulminante en humanos atribuída a la virulencia de cepa clamidial y retardo en el diagnóstico 25
33 condujeron a la muerte a dos pacientes después de presentar una toxemia generalizada, falla renal y pancreatitis en EE.UU. La infección fue adquirida de una cotorrita ninfa aparentemente saludable, que había sido importada y mantenida en cuarentena (Byrom et al., 1979). Otros casos de psitacosis fatal han sido reportados (Verweij et al., 1995). La infección con C. psittaci ocurre cuando una persona inhala el organismo que ha sido aerosolizado desde heces secas o secreciones del tracto respiratorio de aves infectadas. Otra forma de exposición incluye el picaje de un ave o manejo de plumaje y tejidos de aves infectadas. La transmisión entre personas infectadas ha sido sugerida, pero no demostrada (Byrom et al., 1979; NASPHV, 2005). Clamidiosis aviar y psitacosis en Chile. En Chile la psitacosis se ha notificado ocasionalmente, en forma de casos aislados o pequeños brotes epidémicos, estando la mayoría de los casos relacionados con aves psitácidas (Jara y Borie, 2001). Un brote familiar de psitacosis asociado a una catita enferma fue reportado por Wolff, (1984). Las tres personas afectadas manifestaron cuadros febriles de diversa gravedad y manifestaciones respiratorias variables. A través de serología se confirmó el diagnóstico. Otro brote ocurrido en Chile, afectó a cuatro personas de un grupo familiar con una neumopatía atípica, con el antecedente epidemiológico de contacto reciente con un ave psitácida enferma que posteriormente murió. El diagnóstico de psitacosis fue confirmado mediante inmunofluorescencia indirecta (IFI) en las personas afectadas (Santibañez et al., 1990). En Chile sólo hay un estudio publicado sobre la detección de anticuerpos contra C. psittaci en palomas de vida libre capturadas en la ciudad de Santiago (Chile). Trece de los 92 sueros de aves (14,1%) analizados mediante IFI, fueron seropositivos (Borie et al., 2001). La totalidad de las aves seropositivas, no mostraron signos clínicos, atribuyéndose esta situación a exposición previa o a infección inaparente (Jara y Borie, 2001). No hay otros estudios publicados sobre la presencia de anticuerpos contra C. psittaci en otras poblaciones aviares de vida libre ó de aves de compañía en Chile, que pueden ser posibles reservorios. La clamidiosis es una enfermedad de notificación obligatoria en muchos países (Gerlach, 1999b). En Alemania se describen anualmente 140 a 180 casos de psitacosis; en EE.UU., 80 a 100 casos y en Dinamarca 20 a 25 casos (Martínez, 2002). En Chile se describen anualmente entre 1 a 3 casos y se considera que la enfermedad está subnotificada porque no siempre se obtiene el antecedente de contacto con aves y el diagnóstico microbiológico (Martínez, 2002). Entre los métodos diagnósticos directos se describe las técnicas de cultivo, RCP, inmunofluorescencia directa con anticuerpos monoclonales y ELISA. Entre los indirectos se encuentran la aglutinación de cuerpos elementales (ACE), FC, aglutinación en latex (AL), ELISA e inmunofluorescencia indirecta (Andersen y Vanrompay, 2003). Las ventajas y desventajas de algunos 26
34 de los métodos serológicos anteriormente mencionados, ha sido descito por (Grimes, 1989; Grimes et al., 1996). En Chile el diagnóstico de la enfermedad se realiza en escasos laboratorios especializados y debe contemplar además datos epidemiológicos, clínicos y patológicos. El SAG somete a cuarentena a las aves psitácidas que ingresan al país y realiza la prueba de FC (Jara y Borie, 2001). Diagnóstico serológico de C. psittaci. El diagnóstico serológico para detectar anticuerpos contra C. psittaci ha sido sugerido como una herramienta complementaria o alternativa a la prueba de detección de antígeno desde las heces (Grimes et al., 1996; NASPHV, 2005), siendo la serología frecuentemente usada para identificar aves infectadas (Kaleta y Taday, 2003). Las pruebas serológicas pueden ser usadas por sí sólas para detectar una infección actual o una infección clamidial pasada en una bandada o grupo de aves (Grimes, 1989). La prueba de ELISA es un método rápido, sensible y de gran valor diagnóstico y epidemiólogico para detectar exposición de Chlamydophila. Esta prueba podría ser usado también como método de "screening" en poblaciones de aves mascotas (Ruppaner et al., 1984). Herrera et al., (2001) han comunicado seroprevalencias del 12,39% en guacamayos (Ara macao) en cautiverio de Costa Rica utilizando una prueba ELISA que detecta anticuerpos contra C. psittaci. Raso et al., (2002) han demostrado una alta seroprevalencia de C. psittaci (77,3%) mediante el uso de una prueba comercial de ELISA, en tres bandadas de loros Amazona en Brazil, con un 60%, 87,5% y 100% de aves seropositivas y que el 35,8% de estos loros Amazona sp. en cautiverio aparentemente saludables, tenían excresión cloacal intermitente de C. psittaci. No hay otro reporte de prevalencia de clamidiosis en aves psitácidas en cautiverio en países de América del Sur (Raso et al., 2002). En psitácidas de vida libre, en Perú se realizó un estudio donde todos los 35 loros (Aratinga weddellii) muestrados fueron negativos a C. psittaci por FC, AL y ACE; y todos los 13 loros (Brotogeris sanctithomae) fueron también serológicamente negativos por FC (Gilardi et al., 1995). En el "Compendium of Measures to Control Chlamydophila psittaci (formerly Chlamydia psittaci) Infection Among Humans (psittacosis) and Pet Birds" (NASPHV, 2005) se establecen las medidas de prevención, de control de clamidiosis aviar, y distintos protocolos de tratamientos para aves mascotas. SALMONELA EN AVES DE COMPAÑÍA Y DE VIDA LIBRE (S. typhimurium y S. enteritidis). El género Salmonella pertenece al orden Enterobacteriales y a la familia Enterobacteriaceae e incluye a un número elevadísimo de serotipos (más de 2300) (Friend, 1999; Goyache y Briones, 2002). La nomenclatura taxonómica actual considera que los 2300 serotipos son variantes de 2 especies, Salmonella enterica y Salmonella bongori. Las antiguas denominaciones S. enteritidis, S. 27
35 typhimurium eran consideradas como especies, aunque en realidad eran serovariedades. En la nueva propuesta son consideradas como sinónimos de Salmonella enterica subsp. enterica. La especie S. enterica estaría a su vez dividida en 6 subespecies: enterica, arizonae, diarizonae, houtenae, indica y salamae (Goyache y Briones, 2002). No obstante, nosotros emplearemos la denominación antigua, refiriéndonos a Salmonella enterica subsp. enterica serovar typhimurium como S. typhimurium y a Salmonella enterica subsp. enterica serovar enteritidis como S. enteritidis. La salmonelosis es uno de los problemas de salud pública más importantes, que afecta a más personas y animales que cualquier otra enfermedad (Steele, 1969; Woodward et al., 1997). Se estima que anualmente esta bacteria infecta a 1.4 millones de personas en EE.UU. (Mead et al., 1999) siendo una de las cepas más frecuentemente aislada Salmonella enterica serotipo typhimurium (Ribot et al., 2002). Las infecciones por S. enteritidis han experimentado un aumento en el ámbito mundial en los últimos años, especialmente en Norteamérica, Sur América y Europa (Fica et al., 1997). En Chile también hubo un aumento de los casos de salmonelosis por S. enteritidis en humanos, desde un promedio de 0,35 casos/ habitantes en el período hasta 3/ habitantes en 1994 y sobre 5/ en 1998 (Fica et al., 1997; Fica et al., 2001). De acuerdo con referencias del laboratorio del Instituto de Salud Pública de Chile (ISP), de un total de 917 aislados de salmonelas obtenidos de personas enfermas durante 1994, el 84,4% pertenece a Salmonella serogrupos B y D (Fernández, 1995); en otro estudio realizado en 1998, el primer lugar de los aislamientos de salmonela con un 69% del total correspondió a S. enteritidis (Heitmann et al., 1999). En Canadá, el número de casos de salmonelosis estimado por año es de equivalente al 2,4% de la población total de ese país (Woodward et al., 1997). Desde 1993 hasta 1995, hubo más de casos humanos de salmonelosis confirmado por laboratorio en Canadá siendo la mayor parte de las veces el origen de la infección el alimento. También, se estimó que el 3% al 5 % de los casos de salmonelosis en humanos estaban asociados a la exposición de amimales exóticos siendo los más frecuentemente implicados tortugas, iguanas, lagartijas y erizos de tierra. De este modo la salmonelosis asociada con la importación de mascotas exóticas comienza a ser reconocida como una enfermedad emergente en Canadá y a constituir un problema serio de salud pública (Woodward et al., 1997). El habitat de los miembros del género Salmonella es el tracto intestinal de vertebrados de sangre fría y caliente, desde dónde el organismo es liberado al ambiente (Woodward et al., 1997). La infección por salmonela es reconocida como una zoonosis y generalmente el modelo epidemiológico se relaciona predominantemente con reservorios animales (Woodward et al., 1997). Las mismas cepas de salmonela han sido aisladas desde humanos y especies de vida libre, sugiriendo que estas especies sirven como un reservorio de infección en humanos (Refsum et al., 2002; Tauni y Österlund, 2000). Las aves dómesticas de corral y otras especies aviares constituyen el más grande reservorio de salmonelas en la naturaleza (Steele, 1969). Las infecciones por salmonelas en aves de 28
36 vida libre han sido descritas por muchos autores (Hernández et al., 2003; Refsum et al., 2003; Refsum et al., 2002; Tauni y Österlund, 2000; Pennycott et al., 1998; Euden, 1990, Wobeser y Fimlayson, 1969; Kapperud y Rosef, 1983) y también han generado mortalidades en aves de vida libre como ocurrió en aves passerinas en Noruega infectadas con S. typhimurium (Refsum et al., 2003) y en Passeriformes infectados con S. typhimurium DT40 que frecuentaban los jardines de las casas en Britaña (Pennycott et al., 1998). En nuestro país, se detectó Salmonella spp. (pertenecientes a los serogrupos B y D) en un 3% de palomas de vida libre, aparentemente sanas, capturadas en Santiago (Toro et al., 1999) quedando aún por evaluar el rol de las aves migratorias en la infección de planteles avícolas y personas. Estudios en Chile de infección por salmonela en aves exóticas no han sido publicados aún, pero ya hubo un intento de aislar la bacteria de heces recolectadas de los pisos de jaula de aves exóticas Psittaciformes y Columbiformes en cautiverio. En esa oportunidad, la bacteria no se aisló de ninguna de las muestras (Sobarzo, 2004). Las aves importadas a menudo han sido encontradas infectadas con Salmonella spp. y podrían ser reservorios de especies no indígenas que podrían causar devastadores brotes (Gerlach, 1999c). Harrington et al., (1975) describieron la ocurrencia de salmonelosis en aves de jaula recientemente importadas a EE.UU., por S. typhimurium de un fago previamente no conocido, en una estación cuarentenaria. De los canarios importados murieron aproximadamente En el Laboratorio de Salud Pública Central en Colindale, se observó que un número de aislados de S. typhimurium de loros grises africanos importados tenía un modelo fago similar, previamente no reconocido, designándose como S. typhimurium U286 (Edwards, 1981). Aunque cerca de más de serotipos diferentes de Salmonella son reconocidos (Goyache y Briones, 2002), sólo relativamente pocos infectan a aves. En el Departamento de Patología Veterinaria de la Universidad de Utrecht, Holanda; el 67% de las salmonelas aisladas de psitácidas, durante un período de 25 años, provenían de grandes loros (guacamayo, loro gris africano, loro Amazona y cacatúas). En el mismo estudio, la serotipificación de cepas diferentes de salmonelas aisladas de 225 loros, arrojó que el 84,9% correspondía a S. typhimurium y el 15,1% a otras salmonelas incluyendo a S. enteritidis (Dorrestein, 1997). En otro estudio de aislamiento bacteriológico y serotipificación de Salmonella, realizado a 270 aves Psittaciformes en cautiverio en Texas, se identificó a 25 (9,25%) aves infectadas con salmonela. De los 25 aislados, 16 fueron identificados como S. typhimurium, y uno como S. arizonae. Los restantes 8 aislados fueron reconocidos como Salmonella del serogrupo B (no tipificable) (Panigrahy et al., 1979). En la literatura Phillips y Hatkin, (1978) describieron el caso de aislamiento bacteriano de Salmonella enteritidi ser Houten (S. houtenae) de una carcasa de una cotorrita ninfa. Otro caso de 29
37 infección de curso fatal por Salmonella arizonae ocurrió en una cacatúa de cresta amarilla (Cacatua galerita galerita) (Orós et al., 1998). S. typhimurium. S. typhimurium es el organismo usualmente involucrado en la salmonelosis de aves psitácidas, seguido por S. enteritidis. La prevalencia de S. typhimurium var. copenhagen en aves en cautiverio psitácidas es baja, con cifras menores al 1% o 2% en la mayoría de las poblaciones (Ward et al., 2003). La salmonelosis puede ser una enfermedad seria en aves psitácidas siendo el organismo usualmente involucrado en estas especies S. typhimurium var. copenhagen (Grimes y Arizmendi, 1992). La ausencia de un completo funcionamiento cecal en psitácidas podría explicar él por qué estas aves parecen ser más suceptibles a infecciones por Salmonellas que otras especies aviares (Gerlach, 1999c). Esta enfermedad ha sido involucrada en morbilidad y mortalidad de aves de zoológicos (Ward et al., 2003) y en centros de rehabilitación de fauna silvestre también se ha detectado infección por salmonelas en aves (Smith et al., 2002). Ward et al., (2003) describieron un brote de salmonelosis atribuida a S. typhimurium en una colección de Trichoglossus, Lorius y Eos spp. en un zoológico con un índice de mortalidad de un 22%. Las aves psitácidas presentaron disnea y letargo y a la necropsia macroscópicamente hepatomegalia, pulmones congestivos y rojizos y congestión de la serosa de intestino. Otro caso similar ocurrió en un zoológico en San Diego en una población de 40 lories y loriquitos en que la tasa de mortalidad fue del 17% (Shima y Osburn, 1989). Komorowski y Hensley, (1973) reportaron un brote de salmonelosis en loros grises africanos que fue atribuida a la adquisición recientemente de un grupo de éstos, por un zoológico. Los loros habían sido capturados en África y habían pasado el período de cuarentena. Dos días después del arribo al zoológico una de las aves enfermó, bajó de peso y murió. Pronto dos aves más, que habían también arribado recientemente, presentaron similares signos, heces acuosas y verdosas antes de morir. Los cultivos cloacales y de contenido intestinal rebelaron la presencia de S. typhimurium. De algunos cultivos de tórulas cloacales y de heces de las aves compañeras de jaula también se aisló a Salmonella. También se realizó una prueba serológica y todos los "pools" de suero fueron positivos a la reacción de aglutinación con Salmonella del grupo B. Sato et al., (1999) describieron una infección por S. typhimurium en un zoológico de Japón que afectó a 11 aves de corral (pavos y gansos) y a 85 mamíferos. Inicialmente, fueron infectados los cobayos, que transmitieron la infección a las aves y conejos. Los métodos de diagnóstico empleados en las aves fueron el aislamiento bacteriano a través de tórulas cloacales y serología. Smith et al., (2002) aislaron Salmonella spp. de 9 (4%) de 212 muestras de heces de aves rapaces y marinas y de mamíferos marinos obtenidas de varios Centros de Rehabilitación de Fauna 30
38 Silvestre en California. Salmonella spp. podría causar enfermedad en especies de vida libre existentes en estos centros y en las personas que cuidan a estos animales. La incidencia de infección por salmonela en aves de compañía que se encuentran en los hogares es muy importante en Salud Pública, porque están en estrecho contacto con humanos (Sato et al., 1993). De 533 aves psitácidas (procedentes de casas, tiendas de venta de mascotas y aviarios de Texas) llevadas a necropsia, se aisló Salmonella en 29 aves (5,4%) y Chlamydophila en 97 (18,2%) de las aves. En este estudio la alta incidencia de ambas bacterias en aves psitácidas y la potencial transmisión de estas enfermedades a humanos la constituyen en un problema que concierne a la Salud Pública. Cabe mencionar además que de los 29 aislados de Salmonella, 27 fueron serotipificados como S. typhimurium, uno como S. typhimurium var copenhagen y otro como S. arizonae (Panigrahy et al., 1984). La infección además en aviarios de aves exóticas de coleccionistas o criadores puede llegar a causar grandes mortalidades. Sato et al., (1993) reportaron en un aviario de Japón una tasa de mortalidad de 74% atribuída a la infección por S. typhimurium en bengalíes (Lonchura striata), una de las aves de compañía más populares de ese país. Cofactores como el estrés, otras enfermedades concomitantes y un clima no óptimo podrían potencialmente incrementar la tasa de mortalidad observada en los brotes de salmonelas en aves (Ward et al., 2003). Ejemplifica esto lo ocurrido en el brote reportado por Shima y Osburn, (1989) en que el tiempo caluroso contribuyó al brote por estrés por calor en las aves y daño apresurado de la dieta líquida de las aves o rápido crecimiento bacteriano en ésta. Komorowski y Hensley, (1973) atribuyen el brote de loros grises africanos a la presencia de aves portadoras asintomáticas, que enfermaron clínicamente bajo los efectos del estrés de captura, transporte y cambio nutricional. Los signos clínicos de salmonelosis en aves varían desde una leve enteritis a un estado de severa enfermedad con anorexia, letargia, polidipsia, diarrea, deshidratación y estasis de buche. Muertes agudas resultan de una enfermedad sistémica con poliserositis o hemorragias petequiales. En los casos subagudos a crónicos pueden haber signos neurológicos, disnea y signos de daño cardíaco, hepático, renal y esplénico (Dorrestein, 1997). Coleman, (1993) identificó a Salmonella grupo B, serotipo typhimurium como la responsable de una septicemia fatal asociada a una encefalitis piogranulomatosa y hepatitis en un loro gris africano de compañía. Los loros grises aficanos han mostrado ser más susceptibles a desarrollar la fase subaguda en que se desarrollan lesiones granulomatosas en distintos órganos (Panigrahy y Gilmore, 1983). S. enteritidis. S. enteritidis es de rara ocurrencia en aves mascotas y puede llegar a generar enfermedad seria en psitácidas (Orosz et al., 1992). En un ensayo realizado en 1991 en una estación de importación del Departamento de Agricultura de Estados Unidos (USDA) se encontró un aislado de S. enteritidis (fagotipo 8) en
39 aves compradas para el comercio de mascotas (Cummins et al., 1991). El primer reporte en E.E.U.U de S. enteritidis fagotipo 4 en dos especies de loros (Amazona finschi Schlater y Pyrrhura molinae), fue realizado por (Orosz et al., 1992). El rol de S. enteritidis fago tipo 4 en la presentación clínica fue difícil de determinar debido a que varios agentes infecciosos estaban presentes simultaneamente en las dos aves. S. enteritidis puede manifestarse como un patógeno primario en aves jóvenes o debilitadas o como una infección subclínica (Orosz et al., 1992). Las aves Psittaciformes constituyen el grueso del comercio de las aves mascotas y podrían ser portadoras de S. enteritidis introduciéndola dentro de aves de corral o humanos. Transmisión de salmonelas paratíficas. La forma de transmisión de las salmonelas paratíficas es horizontal a través del contacto directo entre aves, ingestión de heces, cama o agua contaminadas o a través del personal y equipos (Gast, 2003). La transmisión a través de aves de vida libre y roedores también puede ocurrir (Dorrestein, 1997). Los reptiles y tortugas también pueden ser una fuente de descarga fecal de salmonelas paratíficas (Friend, 1999) que también podrían estar involucrados en la infección de aves mascotas. Orós et al., (1998) comunicaron un caso fatal de infección por Salmonella arizonae en una cacatúa mantenida en cautiverio en una tienda de venta de mascotas, relacionada con la llegada de un grupo de iguanas al mismo establecimiento. Por otro lado, el origen sugerido del brote en loris y loriquitos descrito por Ward et al., (2003) fue una serpiente que fue atacada y muerta por algunas aves. Las aves reproductoras infectadas también pueden transmitir S. enteritidis en forma vertical a su progenie (Gast, 2003). Algunas aves de compañía pueden presentar la enfermedad o ser portadoras sanas de Salmonellas, y con ello pueden generar problemas en infantes, pacientes geriátricos, pacientes con enfermedades inmunosupresivas (Dorrestein, 1997) o mujeres embarazadas (Woodward et al., 1997). Las aves mascotas en cautiverio pueden actuar como reservorio de la bacteria, favoreciendo el contagio directo o bien que la infección ocurra por medio de otras personas o fomites. Por otro lado, humanos portadores de salmonela, pueden infectar a aves de compañía (Gerlach, 1999c). Un caso descrito en la literatura que ejemplifica esto fue reportado por Madewel y McChesney, (1975). Ambos autores describen el caso de dos catitas (Melopsittacus undulatus) que habían sido recientemente adquiridas como mascotas, como la probable fuente de infección de salmonelosis en un niño de 4 meses de edad y de un gato de 4 años. Una semana después del ingreso de las dos aves el niño presentó una enfermedad aguda con vómitos, diarrea y fiebre. De las heces del niño se aisló S. typhimurium var copenhagen. El gato que habitaba en la misma casa, enfermó después presentando anorexia y vómito intermitente. De una tórula rectal tomada se aisló el mismo serotipo. Las dos catitas a los 3 días de haber llegado a la casa presentaron escalofríos, plumaje erizado, y heces verdosas y finalmente murieron. La necropsia y el cultivo bacteriológico de 32
40 intestino, hígado y pulmones identificó a S. typhimurium var copenhagen como la causal de muerte. Es posible también que el gato o las personas que habitaban en la casa fueran la fuente primaria de infección. La salmonelosis no tifoidicas, en humanos, pueden cursar como diarrea aguda, síndrome septicémico, abscesos focales, meningitis, osteomielitis, endocarditis o aneurisma micótico, o bien pueden ser asintomáticas. El período de incubación de la gastroenteritis por salmonela es 24 a 48 hrs. La enfermedad suele ser leve y desaparece sin tratamiento específico, aunque en algunos casos puede generar deshidatación grave o diseminación con fallecimiento del paciente anciano debilitado o neonato (Keusch, 1998). Diagnóstico serológico. Aunque el diagnóstico confirmatorio requiere el aislamiento e identificación de la especie de salmonela, el monitoreo masivo de una población aviar se efectúa mediante procedimientos serológicos como ELISA y diversos métodos de aglutinación (Gast, 2003; Wunderwald y Hoop, 2002). Los exámenes bacteriológicos para detectar infección por salmonela en bandadas son laboriosos, consumidores de tiempo y caros, especialmente cuando un gran número de muestras fecales por bandada son analizadas (Van Zijderveld et al., 1992). Por otro lado ha sido reconocido que el muestreo bacteriológico no provee una indicación segura de infección en una bandada por la baja incidencia de la infección y por la eliminación intermitente de la bacteria en las heces (Hassan et al., 1990). El uso de métodos serológicos es una herramienta valiosa adicional para la detección de salmonela en aves y puede ser usado junto con métodos bacteriológicos y programas de vigilancia epidemiológica, para detectar particularmente los estadíos tempranos de la infección, antes que se haya iniciado una respuesta serológica detectable (Skov et al., 2001). Skov et al., (2001) demostraron que el 50% de las aves pertenecientes a dos grupos y que habían sido infectadas experimentalmente al día de edad con S. enteritidis y S. typhimurium respectivamente, tuvieron una respuesta serológica detectable a las 6 a 7 semanas de edad. Esta respuesta serológica persistió en el suero de las aves durante 1 año. En el mismo estudio, se realizaron exámenes de hisopados cloacales y dentro de la primera semana, el 100% de las aves en ambos grupos infectadas eliminaron salmonela en las excretas. Sin embargo, el número de aves que eliminaban salmonela disminuyó rapidamente con el tiempo, en el caso de S. typhimurium llegó por debajo del 6% en 16 semanas y con relación a S. enteritidis se encontraron niveles similares dentro de las primeras 8 semanas. Van Zijderveld et al., (1992) detectaron en aves ponedoras de 27 semanas de edad, infectadas con S. enteritidis, títulos séricos contra los flagelos gm ya a los 7 días pos infección, alcanzando el máximo a los 14 días y luego describe un descenso gradual de los títulos al utilizar la prueba de ELISA. De acuerdo a lo expuesto en esta revisión, son varios los agentes que pueden afectar a las aves Psittaciformes generando morbilidad y mortalidad. Se hace necesario así, conocer su estado 33
41 sanitario en Chile, considerando además que algunos de estos agentes pueden constituir zoonosis y otros pueden afectar a otras poblaciones aviares. 34
42 3.-HIPÓTESIS Dada la distribución mundial de infecciones por S. enteritidis, S. typhimurium, C. psittaci, vdva, AVA y VPA en aves del orden Psittaciforme en cautiverio y la procedencia directamente del exterior de las aves exóticas presentes en Chile o la de sus ancestros, es esperable encontrar estas infecciones en el país en este tipo de aves. 4.-OBJETIVO GENERAL Aportar al conocimiento sobre algunas enfermedades infecto contagiosas que afectan a aves del orden Psittaciforme nativas y exóticas en cautiverio en Chile Central. 5.-OBJETIVOS ESPECÍFICOS 1.- Reconocimiento serológico de infecciones bacterianas producidas por S. enteritidis, S. typhimurium y C. psittaci en aves del orden Psittaciforme en cautiverio. 2.- Reconocimiento serológico de infecciones virales producidas por vdva, AVA y VPA en aves del orden Psittaciforme en cautiverio. 35
43 6.-MATERIAL Y MÉTODO - Aves Psittaciformes sometidas al estudio y su procedencia. Las muestras de sangre para determinar la presencia o ausencia de anticuerpos séricos contra v DVA, AVA, VPA, C. psittaci, S. enteritidis y S. typhimurium fueron recolectadas entre Marzo del 2004 y Agosto del 2005, desde un grupo miscélaneo de aves del orden Psittaciforme tanto nativas como exóticas que se encontraban confinadas en 10 poblaciones de la Región Metropolitana (dos zoológicos, un centro de rehabilitación de fauna silvestre y siete colecciones privadas). Debido a que la procedencia de estas aves es confidencial a petición de los involucrados y para permitir además, el análisis comparativo de los resultados entre las diez poblaciones de las cuales se obtuvo las muestras de sangre de psitácidas; designaremos al centro de rehabilitación de fauna silvestre como A, a los dos zoológicos como B y C y a los aviarios de los siete coleccionistas privados como D, E, F, G, H, I y J. Se extrajo muestras de sangre de Psittaciformes nativas de Chile: Enicognathus ferrugineus, Enicognathus leptorhynchus y Cyanoliseus patagonus bloxami confinadas en dos zoológicos y en un centro de rehabilitación de fauna silvestre; y de Psittaciformes exóticas: Agapornis sp., Amazona sp., Ara sp., Aratinga sp., Cyanoliseus sp., Cyanorhamphus sp., Melopssitacus sp., Myiopsitta sp., Nandayu sp., Pionu sp., Platycercu sp., Polyteli sp., Psittacula sp., Psephotu sp., Pyrrhura sp., Nymphicu sp. y Cacatúa sp. confinadas en dos zoológicos y en siete colecciones privadas en Chile central (anexo Nº1). La mayor parte de las aves psitácidas fueron clínicamente sanas al momento del muestreo. Exepcionalmente, entre las muestras para vdva se incluyó las muestras procedentes de un lote de aves que presentaron signos clínicos similares a los descritos por Gerlach, (1999a) para esta enfermedad. Por otro lado, una de las muestras para C. psittaci fue obtenida de un loro Amazona con signos clínicos característicos de clamidiosis aviar. Las aves del muestreo eran jóvenes y adultas y la mayor parte de las aves exóticas habían nacido en Chile, exeptuando a loros de gran tamaño. -Tamaño de Muestra La población en estudio es representada por aproximadamente aves del orden Psittaciforme distribuidas en diez aviarios descritos anteriormente. De éstas, 253 (17%) corresponden a psitácidas nativas y (83%) a exóticas. El total de aves del orden Psittaciforme muestreadas fueron 401, lo que corresponde al 27% de la población total en estudio, tomando muestras de sangre a 91 psitácidas nativas y a 310 psitácidas exóticas (anexo Nº1). Las 401 muestras de suero analizadas fueron distribuidas de la siguiente forma: 36
44 201 muestras de suero a analizar mediante la prueba de ID para detección de anticuerpos séricos contra vdva. 184 muestras fueron analizadas mediante la prueba de ID para detección de anticuerpos séricos contra AVA del grupo I. 100 muestras fueron analizadas mediante la prueba de SNV para detección de anticuerpos séricos contra VPA. 49 muestras fueron analizadas mediante ELISA para detección de anticuerpos séricos anti-c. psittaci. 184 muestras de suero se destinaron para la prueba de ELISA que detecta anticuerpos séricos anti-s. enteritidis. 184 muestras se destinaron para la prueba de detección de aglutininas para S. typhimurium. La heterogenicidad en la distribución de las muestras según el diagnóstico realizado se explica por una limitante económica que impidió adquirir una mayor cantidad de "kits" diagnósticos para C. psittaci, como también el enviar un mayor número de muestras a analizar mediante SNV para detección de anticuerpos contra VPA. Por otro lado, se incrementó el número de muestras destinadas a la detección de anticuerpos contra vdva a 201 muestras, dada la ocurrencia en uno de los aviarios de un brote natural de DVA. - Obtención de muestras y transporte. Muestras de sangre de 0,3ml a 3ml fueron extraídas desde la vena yugular, vena metatarsial medial o basilar dependiendo el sitio de punción de la especie, tamaño del ave y destreza personal (ver figuras 1 y 2). La cantidad de sangre obtenida por espécimen correspondió al 1% del peso corporal aproximadamente. Para el procedimiento de extracción de sangre fueron empleadas jeringas de 1ml y de 3ml, agujas 27G ½ y de 25G ⅝, tubos Eppendorff y frascos de vidrio estériles. Las muestras de sangre obtenidas, luego fueron transportadas al laboratorio de Patología Aviar de la Facultad de Ciencias Veterinarias y Pecuarias de la Universidad de Chile, en un contenedor refrigerado, para la obtención posterior de suero. Los sueros fueron centrifugados a 2500 rpm durante 20 minutos (600g) y conservados congelados hasta el momento de su análisis. 37
45 Figura Nº 1. Vena basilar del ala de un loro Amazona (Amazona spp.). Figura Nº 2. Vena yugular derecha de un kakariki (Cyanoramphus novazelandiae) 38
46 - Permisos oficiales para el envío de muestras al exterior. Las 100 muestras de suero de psitácidas fueron analizadas mediante SNV para detección de anticuerpos contra-vpa en el Laboratorio de Enfermedades Infecciosas de la Universidad de Georgia (EE.UU). Para el envío de estas muestras al exterior debimos cumplir con la normativa CITES: un permiso CITES de exportación del país exportador para especímenes. Además, debimos contar con una autorización del Departamento de Protección Pecuaria del Servicio Agrícola y Ganadero. Información adicional fue requerida sobre las muestras por el "US Fish and Wildllife", Departamento del Interior, EE.UU y un permiso del Departamento de Agricultura de Estados Unidos para la importación y transporte controlado de materiales, organismos y vectores; fue también requerido. Los sueros fueron enviados en tubos Eppendorff estériles contenidos en una caja de cartón diseñada especialmente para estos y todo esto en el interior de una caja de aislapol con hielo seco. - Determinación de anticuerpos contra virus diftero viruela aviar: la determinación de anticuerpos contra vdva se realizó mediante la técnica de ID, utilizando un gel agar compuesto por 0,7 gramos de fosfato disódico, 0,13 gramos de fosfato potásico, 7,5 gramos de agar noble, 1 gramo de azida de sodio, 40 gramos de cloruro de sodio y agua destilada hasta completar 600 cc de solución. En la realización de la prueba de ID se emplearon placas petri, una micropipeta y puntas. Antígeno: se usó como antígeno una mezcla en cantidades equivalentes de dos aislados virales de DVA consistentes en homogenizados de membranas corio alantoídeas (MCA). a) Suspensión de MCA de un tercer pasaje que fueron infectadas con virus pox, después de la inoculación en huevos embrionados (HE) de gallinas de 10 días de edad, de una cepa vacunal de virus pox de gallina (vacuna virus pox viruela modificado DCEP25- Pox Diftosec CT 1000 dosis Rhone Merieux). b) Suspensión de MCA correspondientes a un tercer pasaje en HE de gallinas de 10 días de edad, que fueron infectadas con un virus pox aislado a partir de lesiones cutáneas de la cera de dos aves Psittaciformes vivas de la especie Polytelis swainsonii (González e Hidalgo, 2004). (Ver Figura 3). Sueros control positivo y negativo: en la prueba de ID fueron usados un suero control positivo y un suero control negativo SPF (Swaine et al., 1998). Para obtener el suero control positivo, stock de anti-sueros fueron colectados desde pollos broiler, una semana después de haber recibido la última inoculación con una vacuna de virus pox viruela modificado DCEP25 (Pox Diftosec CT 1000 dosis Rhone Merieux). Cada ave recibió una inoculación por semana, por tres veces, aplicadas mediante el método de estilete en la membrana alar. Se requirió 50 ul de suero a analizar mediante ID, por ave. 39
47 Las placas fueron incubadas a temperatura ambiente y fueron leídas desde las 24 horas hasta las 72 horas. Figura Nº 3. Polytelis swainsonii afectado por vdva. Costras de la cera fueron recolectadas para aislamiento viral Chile. - Determinación de anticuerpos contra adenovirus aviar grupo I: la determinación de anticuerpos contra AVA del grupo I, se realizó mediante la prueba de ID, empleando el mismo gel agar descrito anteriormente. En la realización de la prueba de ID se emplearon placas petri, una micropipeta y puntas. Antígeno: se utilizó un "pool" antigénico viral de dos antígenos AVA del grupo I. Se emplearon las cepas AVA: serotipo 4, hepatitis cuerpo inclusión (HCI) (Laboratorio de Patología Aviaria, Facultad de Ciencias Veterinarias y Pecuarias de la Universidad de Chile) y serotipo 1, CELO (Laboratorio Virología del SAG). a) HCI. Suspensión de MCA de un tercer pasaje que fueron infectadas con una cepa viral HCI 11442, después de la inoculación en HE de gallinas de 10 días de edad. La suspensión de MCA fue tratada con cloroformo a una concentración del 5% de la suspención viral total, durante 10 minutos (Calnek y Cowen, 1975) y finalmente fue centrifugada a 2000g durante 30 minutos. b) CELO. Propagación virus CELO en HE de gallina de 6 días de edad vía saco vitelino. EL Líquido alantoídeo de un segundo pasaje fue colectado y usado como antígeno para la prueba de ID. El antígeno de trabajo para la prueba de ID fue una mezcla en partes iguales de los serotipos 4 y 1 (Cowen, 1987). Suero control positivo. Se emplearon 2 sueros positivos. Un suero anti-serotipo 4, el que se preparó en pollos Leghorn de 6 semanas de edad que recibieron como primovacunación una dosis (0,5 ml, im) de la vacuna inactivada y emulsionada contra hepatitis con cuerpos de inclusión (SHP) serotipo 4, grupo I (Investigación aplicada SA de CV, México) y de la misma vacuna 4 semanas 40
48 después. La sangre se recolectó 3 semanas después para la obtención del suero. El segundo suero anti-celo se preparó de la misma forma inoculando pollos con virus CELO diluído (0,4cc i.v.). Suero control negativo. Un suero control negativo SPF de pollo fue empleado (Swaine et al., 1998). Las placas de agar para inmunodifusión fueron incubadas a temperatura ambiente y leídas entre las 24 horas y 72 horas (Boyle, 1973). - Determinación de anticuerpos contra virus polioma aviar: la técnica se desarrolló en el Laboratorio de Enfermedades Infecciosas de la Escuela de Medicina Veterinaria, Universidad de Georgia, Athens, EE.UU. Se utilizó la técnica de SNV para la detección de anticuerpos anti-vpa previamente descrita por Lukert, (1989) y modificada por Ritchie et al., (1996). Los sueros fueron contenidos en tubos Eppendorff estériles y almacenados en congelación. Previo al análisis el suero fue inactivado con calor a 57 C por 30 minutos. El antígeno que se empleó en la prueba de SNV correspondió a un VPA aislado de catita adaptado a células de fibroblastos de embrión de pollo. La cepa viral de VPA correspondió a la misma que fue utilizada por Ritchie et al., (1996) en la prueba de SNV. Se empleó como sustrato un cultivo celular (CC) de fibroblastos de embrión de pollo que fue inoculado con diluciones séricas al doble mezcladas con 100 dosis infectantes cultivo celular (DICC 50 ) de virus (Lukert, 1989; Ritchie et al, 1996). Las diluciones séricas al doble comenzaron con la dilución 1:10 y finalizaron con una dilución 1: Los fibroblastos de embrión de pollo fueron fijados con etanol al 95% y teñidos con cristal violeta y fueron examinados posteriormente para detectar efectos citopáticos (Ritchie et al., 1996). La prueba de SNV para VPA realizada según la manifestación de efecto citopátco en el 50% de los CCs inoculados, requirió 7 a 9 días en completarse (Lukert, 1989). Un suero de pollo con anticuerpos anti-vpa y un suero de pollo normal con un título de NV de < 2 fueron usados como suero control positivo y negativo respectivamente (Ritchie et al., 1996). Los títulos de anticuerpos fueron expresados como el valor recíproco de la dilución sérica que protege el 50% de la población celular de fibroblastos de embriones de pollo del efecto citopático provocado por 100 DICC 50 de virus (Ritchie et al., 1996). En esta prueba de SNV, los títulos neutralizantes 20 fueron considerados positivos para la detección de anticuerpos contra VPA (Jacobson et al., 1984; Lukert, 1989). Un título de 20 fue considerado un débil positivo. Por otro lado, los títulos de anticuerpos mayores de 160 se consideran característicos de las aves que se recuperan de una infección reciente de VPA (Laboratorio de Enfermedades Infecciosas, Universidad de Georgia). 41
49 - Determinación de anticuerpos contra C. psittaci: 49 muestras fueron examinadas para la detección de anticuerpos contra C. psittaci con la técnica de ELISA en fase sólida mediante el "kit" comercial (test ImmunoComb Enzime- linked inmunosorbent assay (ELISA) Biogal, Kibbuz Ghaled, Israel). Esta prueba inmunoenzimática detecta anticuerpos (IgG) dirigidos contra C. psittaci en psitácidas y ha sido empleada o recomendada por diversos autores (Herrera et al., 2001; Raso et al., 2002; Bendheim et al., 1998; Ryll et al., 1994; Bellington, 2005). El antígeno C. psittaci inactivado está fijado en el extremo de 12 dientes de una tarjeta plástica. Los sueros en estudio (5µl) se diluyen en 12 orificios de una placa con una solución de extracción. De esta forma, al incorporar los dientes con el antígeno en los orificios, los posibles anticuerpos presentes dispersos en la solución se unen específicamente con el antígeno clamidial. Después de fases sucesivas de lavado, conjugado de anticuerpos marcados con fosfatasa alcalina anti- IG psitácida y cromógeno, se efectúa la lectura colorimétrica. El análisis comparativo de la intensidad de color de la reacción antígeno-anticuerpo en las muestras de campo con una escala colorimétrica y estandares (+) y (-) del "kit", permiten evaluar en forma semi-cuantitativa el nivel de anticuerpos anti-c. psittaci (negativa, sospechosa y positiva). Los valores de la escala de color fueron comparados con la intensidad de color de las muestras de campo. Controles negativos fueron equivalentes a un valor 0, mientras que valores 1-2 indican bajo desarrollo de color, fueron interpretados como un contenido de anticuerpos bajo a cuestionable y fueron consideradas como sospechosas. Valores de 3-4 y mayor a 5 indica títulos de anticuerpos medianos y altos respectivamente considerandose como positivas en nuestro estudio. - Determinación de anticuerpos contra S. enteritidis: por medio de un "Kit" comercial ELISA en fase sólida (Flock Chek Salmonella enteritidis antibody test kit IDEXX, Westbrook, Maine, USA). Para esta prueba fueron requeridos 100 µl de suero por ave analizada. Así un total de 184 muestras de suero fueron examinadas para detectar anticuerpos anti-s. enteritidis mediante esta prueba que emplea anticuerpos monoclonales específicos de serotipo, en un ELISA de bloqueo, contra el antígeno flagelar gm de S. enteritidis. El ELISA basado en la detección flagelar gm muestra una alta especificidad (98%-100%) y una alta sensibilidad (96%) (Timoney et al., 1990; Van Zijderveld et al., 1992; Comunicación IDEXX). El Kit provee el control negativo (suero no reactivo hacia la S. enteritidis) y el control positivo (anti- S. enteritidis). Interpretación de los resultados ELISA: La densidad óptica (DO) fue medida a 650 nm. La presencia o ausencia de anticuerpos contra S. enteritidis fue determinada por la razón (M/N) de cada muestra. Razón M/N= DO muestra DO promedio controles negativos 42
50 Las muestras de suero con una razón M/N 0,59 (S. enteritidis) fueron consideradas positivas. Las muestras de suero con una razón M/N entre 0,74 y 0,60 debieran analizarce nuevamente y en el presente estudio se consideraron sospechosas. Las muestras que dieron relaciones M/N 0,75 se consideraron negativas. Es posible que reacciones cruzadas pueden ocurrir con otros serotipos de Salmonella que almacenen los mismos antígenos flagelares como S. agona, S. derby, S. montevideo que son infrecuentes de encontrar en aves de corral (Timoney et al., 1990) y que en psitácidas no han sido descritas. Ya que esta prueba de ELISA se basa en los antígenos flagelares gm otros serotipos de Salmonella que comparten los epítopos gm flagelares pueden potencialmente dar resultados positivos. Por lo tanto, se recomienda que los resultados de screening positivos se confirmen con métodos bacteriológicos estándar. - Determinación de anticuerpos contra S. typhimurium: la determinación de anticuerpos contra S. typhimurium se realizó mediante la prueba de aglutinación. La detección de aglutininas se realizó mediante el método descrito por Grimes et al., (1992). Antígeno: el antígeno S. typhimurium corresponde a una solución bacteriana (células muertas, enteras, no teñidas) a una concentración equivalente a 100x la concentración del tubo Nº1 de Mc Farland. Antes de usar, 150µl de una solución de cristal violeta 1% en alcohol fue añadido a 10 ml de antígeno (Grimes et al., 1992). La cepa de S. typhimurium empleada (ATCC número: 14028) fue obtenida en el ISP. Previa confirmación del género Salmonella sobre la base de las pruebas bioquímicas primarias y secundarias, y de grupo, mediante una prueba de aglutinación con suero anti- grupo B (DIFCO), se procedió a la preparación del antígeno"o" para la prueba de aglutinación de S. typhimurium, basándose en la técnica descrita por el Departamento de Agricultura de Estados Unidos (USDA, 1997). Para esta etapa, se requirió agar infusión de ternera, agar corriente, agar MIO, caldo triptosa, acriflavina 0,2%, solución fisiológica fenolizada 0,25% y al 0,5%, agar sulfito de bismuto, agar Mc Conkey, una botella Roux, un embudo con gasa estéril y piedras de cristal estériles. Suero control positivo y negativo. Se utilizó un suero positivo comercial que contiene anticuerpos para antígenos somáticos predominantes de Salmonella serogrupo B (BD Difco BBL Salmonella O Antiserum Group B, 3 ml) y un suero control negativo de gallina Leghorn de experimentación (Arizona). El método serológico para detectar aglutininas para S. typhimurium consistió en colocar 10 µl de suero sin diluir por ave, dentro de un pocillo de una microplaca de titulación, de fondo redondo. Por cada muestra de suero de psitácida fue añadido 10 µl del antígeno teñido y preparado previamente. Luego se emplearon vaguetas para mezclar el contenido de cada pocillo y finalmente la placa fue sometida a agitación a 130 rpm durante 2 minutos y fue leído macroscópicamente sobre 43
51 un fondo blanco. Los resultados se clasificaron en: (-) = negativos (no aglutinación), (+) = sospechosa (leve aglutinación), (+) = positivo (fuerte aglutinación) (Grimes et al., 1992). 44
52 7.-RESULTADOS Siendo éste un estudio descriptivo, los resultados se expresan como porcentajes de individuos serológicamente positivos a la infección correspondiente sobre el total de muestras analizadas. - Detección de anticuerpos contra virus diftero viruela aviar: de acuerdo con el cuadro Nº 1, de 201 muestras de suero de psitácidas nativas y exóticas, 8 (4%) fueron positivas a la presencia de anticuerpos contra vdva. De las 68 muestras de suero de aves nativas, una (1,5%) fue positiva a la presencia de anticuerpos anti-vdva y pertenece al zoológico C. De 133 muestras de suero de aves psitácidas exóticas, 7 (5,3%) fueron positivos a la presencia de anticuerpos anti- vdva y todas ellas provenían de la colección privada D. En el cuadro del anexo Nº 2, se puede observar que sólo en dos aviarios (C y D) se demostró casos seropositivos a vdva. Las 8 muestras de suero positivas dieron sólo una banda de precipitación en la prueba de ID. En la figura 4 se observa la banda de precipitación que demuestra la presencia de anticuerpos séricos contra el vdva, en una psitácida (Polytelis swainsonii). En el cuadro Nº 2 se muestra la historia clínica e información pertinente sobre las 8 aves que presentaron anticuerpos anti-vdva detectados por ID. Figura Nº 4. Formación de banda de precipitación en la prueba de ID para vdva. El pool antigénico de DVA se dispone en el pocillo central, en el pocillo 1 está el suero control positivo (SC+), en el pocillo 2, el suero control negativo de gallina (SC-) y en el pocillo 5, el suero de un Polytelis swainsonii con anticuerpos precipitantes anti -vdva. En los pocillos 3, 4 y 6, sueros de Agapornis roseicollis. 45
53 Cuadro Nº 1. Aves Psittaciformes nativas y exóticas mantenidas en cautiverio en la zona central de Chile serológicamente positivas* a diftero-viruela aviar (DVA) DIFTERO VIRUELA AVIAR ESPECIE PSITTACIFORME N Nº positivas NATIVAS Enicognathus leptorhynchus 47 0 Cyanoliseus p. bloxami 15 0 Enicognathus ferrugineus 6 1 NATIVAS TOTAL (%) 68 (100%) 1 (1,47%) EXÓTICAS Agapornis fischeri 13 0 Agapornis personatus 6 0 Agapornis roseicollis 26 4 Amazona aestiva 4 0 Amazona farinosa 1 0 Amazona festiva 1 0 Amazona ochrocephala 1 0 Ara ararauna 4 0 Ara auricollis 1 0 Ara chloroptera 5 0 Ara macao 3 0 Aratinga erythrogenys 3 0 Aratinga mitrata 4 0 Aratinga wagleri 1 0 Melopssitacus undulatus 21 0 Nymphicus hollandicus 8 0 Cyanoramphus novaezelandiae 2 0 Cyanoliseus patagonus 2 0 Myiopsitta monachus 2 0 Nandayus nenday 1 0 Pionus menstruus 1 0 Platycercus elegans 1 0 Platycercus eximius 5 1 Polytelis alexandrae 2 0 Polytelis swainsonii 4 2 Psephotus haematonotus 3 0 Psittacula krameri 6 0 Pyrrhura frontalis 2 0 EXÓTICAS TOTAL (%) 133 (100%) 7 (5,26%) PSITTACIFORMES TOTAL (%) 201 (100%) 8 (3,98%) N= Número de psitácidas muestreadas. Nº positivas= Número de psitácidas serológicamente positivas. (*)= Se empleó la prueba de inmunodifusión doble (ID). 46
54 Cuadro Nº 2. Historia clínica e información pertinente sobre 8 aves psitácidas que fueron positivas a la presencia de anticuerpos contra virus de la diftero viruela aviar (vdva), al momento de obtención de muestras. NOMBRE COMÚN NOMBRE CIENTÍFICO HISTORIA CLÍNICA E INFORMACIÓN 1. Cachaña Enicognathus ferrugineus El ave estaba aparentemente saludable. 2. Cotorra de Swanson Polytelis swainsonii Ave de 6 meses de edad con tejido proliferativo amarillo sobre cera, atribuida a vdva 3. Perico oriental Platycercus eximius Ave de 8 meses de edad con conjuntivitis unilateral atribuida a vdva. 4. Cotorra de Swanson Polytelis swainsonii Ave de 6 meses de edad con tejido proliferativo amarillo sobre cera y blefaritis unilateral, atribuida a vdva 5. Inseparable de cara melocotón Agapornis roseicollis Ave de 4 meses de edad traída recientemente al aviario. Presentaba signología clínica de DVA. 6. Inseparable de cara melocotón Agapornis roseicollis Ave de 5 meses de edad con signología clínica de DVA 7. Inseparable de cara melocotón Agapornis roseicollis Ave de 5 meses de edad con signología clínica de DVA. Presencia de costras distal al tibiotarso. 8. Inseparable de cara melocotón Agapornis roseicollis Ave de 7 meses de edad con signología clínica de DVA. Presencia de una cosrtra sobre un párpado y un dedo. 47
55 Figura Nº 5. Distribución porcentual de presencia de anticuerpos contra diftero viruela aviar en 201 psitácidas en cautiverio en Chile central. 96% 4% Positivos Negativos Figura Nº 6. Distribución porcentual de presencia de anticuerpos contra diftero viruela aviar en 133 psitácidas exóticas en cautiverio en Chile central. 94,7% 5,3% Positivos Negativos Figura Nº 7. Distribución porcentual de presencia de anticuerpos contra diftero viruela aviar en 68 loros nativos en cautiverio en Chile central 98,5% 1,5% Positivos Negativos 48
56 - Detección de anticuerpos contra adenovirus aviar grupo I: de acuerdo con el cuadro Nº 3, de 184 muestras de suero de psitácidas nativas y exóticas, 9 (4,9%) fueron positivas a la presencia de anticuerpos contra AVA del grupo I. De las 68 muestras de suero de aves nativas, 2 (2,9%) fueron positivas a la presencia de anticuerpos anti- AVA del grupo I y de 116 muestras de suero de aves psitácidas exóticas, 7 (6%) fueron positivas a la presencia de anticuerpos anti- AVA del grupo I (ver figuras 8, 9 y 10). Las 9 muestras de suero positivas dieron sólo una banda de precipitación en la prueba de ID. Las aves positivas a la presencia de anticuerpos anti-ava del grupo I, proceden de 4 de las 10 poblaciones estudiadas (cuadro del anexo Nº3). Las aves seropositivas según especie y procedencia fueron: un tricahue (Cyanoliseus p. bloxami) y un guacamayo azul amarillo (Ara ararauna) confinadas en el zoológico C; una cachaña (Enicognathus ferrugineus) del centro de rehabilitación A; un inseparable (Agapornis fischeri), un lorito de espalda roja (Psephotus haematonotus) y una catita (M. undulatus) de la colección privada D y finalmente, dos cotorritas ninfas (Nymphicus hollandicus ) y una catita (M. undulatus ) de la colección privada J. En el cuadro Nº 3 se especifica el número de aves del orden Psittaciforme muestreadas y el número de aves con presencia de anticuerpos contra AVA del grupo I, según especie aviar. 49
57 Cuadro Nº 3. Aves Psittaciformes nativas y exóticas mantenidas en cautiverio en la zona central de Chile serológicamente positivas* a adenovirus aviar (grupo I). ADENOVIRUS AVIAR (GRUPO I) ESPECIE PSITTACIFORME N Nº positivas NATIVAS Enicognathus leptorhynchus 47 0 Cyanoliseus p. bloxami 15 1 Enicognathus ferrugineus 6 1 NATIVAS TOTAL (%) 68 (100%) 2 (2,94 %) EXÓTICAS Agapornis fischeri 12 1 Agapornis personatus 2 0 Agapornis roseicollis 15 0 Amazona aestiva 4 0 Amazona farinosa 1 0 Amazona festiva 1 0 Amazona ochrocephala 1 0 Ara ararauna 5 1 Ara auricollis 1 0 Ara chloroptera 4 0 Ara macao 3 0 Aratinga erythrogenys 3 0 Aratinga mitrata 4 0 Aratinga wagleri 1 0 Melopssitacus undulatus 21 2 Nymphicus hollandicus 8 2 Cyanoramphus novaezelandiae 2 0 Cyanoliseus patagonus 2 0 Myiopsitta monachus 2 0 Nandayus nenday 1 0 Pionus menstruus 1 0 Platycercus elegans 1 0 Platycercus eximius 5 0 Polytelis alexandrae 1 0 Polytelis swainsonii 4 0 Psephotus haematonotus 3 1 Psittacula krameri 6 0 Pyrrhura frontalis 2 0 EXÓTICAS TOTAL (%) 116 (100%) 7(6,0%) PSITTACIFORMES TOTAL (%) 184 (100%) 9(4,9%) N= número de psitácidas muestreadas Nºpositivas= número de psitácidas serológicamente positivas (*)= Se empleó la prueba de inmunodifusión doble (ID). 50
58 Figura Nº 8 Distribución porcentual de presencia de anticuerpos anti-adenovirus aviar grupo I en 184 ejemplares de psitácidas en cautiverio en Chile central 95,1% 4,9% Positivos Negativos Figura Nº 9 Distribución porcentual de presencia de anticuerpos anti-adenovirus aviar grupoi en 116 ejemplares de psitácidas exóticas en cautiverio en Chile central 94% 6% Positivos Negativos Figura Nº 10 Distribución porcentual de presencia de anticuerpos anti-adenovirus aviar grupo I en 68 ejemplares de psitácidas nativas en cautiverio en Chile central 97,1% 2,9% Positivos Negativos 51
59 - Detección de anticuerpos contra virus polioma aviar: de acuerdo con el cuadro Nº 4, de 100 muestras de suero de psitácidas nativas y exóticas, 36 (36%) fueron positivas a la presencia de anticuerpos neutralizantes séricos contra VPA. De las 25 muestras de suero de aves nativas, 2 (8 %) fueron positivas a la presencia de anticuerpos anti-vpa y de 75 muestras de suero de aves psitácidas exóticas, 34 (45,3%) fueron positivas a la presencia de anticuerpos anti-vpa (ver figuras 11, 12 y 13). Los sueros positivos a la presencia de anticuerpos contra VPA, provinieron de 8 poblaciones aviares de la zona central de Chile, de las 10 en estudio (cuadro del anexo Nº 4). Las aves seropositivas según especie y procedencia fueron: 2 choroy (Enicognathus leptorhynchus) del centro de rehabilitación A; 1 cotorrita de collar (Psittacula krameri) y 1 guacamayo rojo de alas verdes (Ara chloroptera) del zoológico B; 1 Aratinga mitrata del zoológico C; 10 inseparables de cara melocotón (Agapornis roseicollis), 1 princesa Alejandra (Polytelis alexandrae), 1 rosella eximius (Platycercus eximius), 1 Psittacula krameri y 2 catitas (Melopsittacus undulatus) del aviario D; 2 Agapornis roseicollis, un Polytelis alexandrae y un Psittacula krameri del aviario F; 2 Agapornis roseicollis del aviario G; 1 Melopsittacus undulatus, 6 Agapornis roseicollis y un Psittacula krameri del aviario J; y finalmente, 2 Agapornis personatus del aviario I (ver anexo Nº 4). En el grupo de catitas consideradas positivas los títulos de anticuerpos neutralizantes contra VPA tuvieron un rango de 160 a 1280 y fueron detectados en 3 de las 15 catitas que fueron monitoreadas. Las aves eran aparentemente saludables. En el grupo de loros nativos seropositivos los títulos de anticuerpos neutralizantes contra VPA fueron de 20 y en el grupo de psitácidas exóticas "no catitas" seropositivas, el rango de título de anticuerpos tuvo un rango de 20 a
60 Cuadro Nº 4. Aves Psittaciformes nativas y exóticas mantenidas en cautiverio en la zona central de Chile serológicamente positivas* a virus polioma aviar. NATIVAS VIRUS POLIOMA AVIAR ESPECIE PSITTACIFORME N Nº positivas. Enicognathus leptorhynchus 13 2 Cyanoliseus p. bloxami 6 0 Enicognathus ferrugineus 6 0 TOTAL NATIVAS (%) 25 (100%) 2 (8%) EXÓTICAS Agapornis personatus 3 2 Agapornis roseicollis Amazona aestiva 2 0 Amazona farinosa 1 0 Ara ararauna 2 0 Ara chloroptera 5 1 Aratinga wagleri 1 0 Aratinga erythrogenys 2 0 Aratinga mitrata 2 1 Cacatua sanguinea 1 0 Cyanoliseus patagonus 1 0 Melopssitacus undulatus 15 3 Nymphicus hollandicus 6 0 Myiopsitta monachus 2 0 Platycercus elegans 1 0 Platycercus eximius 2 1 Polytelis alexandrae 3 2 Psephotus haematonotus 1 0 Psittacula krameri 5 4 TOTAL EXÓTICAS (%) 75 (100%) 34 (45%) PSITTACIFORMES TOTAL (%) 100 (100%) 36 (36%) N= número de psitácidas muestreadas Nº positivas = número de psitácidas serológicamente positivas (*)= Se empléo la técnica de SNV (Universidad de Georgia). 53
61 Figura Nº 11 Distribución porcentual de presencia de anticuerpos contra virus polioma aviar en 100 psitácidas en cautiverio en Chile central 64% 36% Positivos Negativos Figura Nº 12 Distribución porcentual de presencia de anticuerpos contra virus polioma aviar en 75 psitácidas exóticas en cautiverio en Chile central 54,7% 45,3% Positivos Negativos Figura Nº 13 Distribución porcentual de presencia de anticuerpos contra virus polioma aviar en 25 psitácidas nativas en cautiverio en Chile central 8% 92% Positivos Negativos 54
62 - Detección de anticuerpos contra C. psittaci: de acuerdo con el cuadro Nº 5, de 49 muestras de suero de aves del orden Psittaciforme, 11 (22,4%) fueron positivas a la presencia de anticuerpos contra C. psittaci. De 10 muestras de suero de aves nativas, un tricahue (Cyanoliseus p. bloxami) fue positivo a la presencia de anticuerpos anti-c. psittaci y de 39 sueros de psitácidas exóticas, 10 sueros fueron positivos a la presencia de anticuerpos anti-c. psittaci (ver figuras 12, 13 y 14). Las especies de psitácidas exóticas confinadas seropositivas fueron 1 cotorrita argentina (Myiopsitta monachus), 2 inseparables (Agapornis roseicollis y Agapornis personata), 2 loros Amazona frente azul (Amazona aestiva), 2 catitas (Melopssitacus undulatus), 1 lorito de espalda roja (Psephotus haematonotus) y 2 cotorritas ninfas (Nymphicus hollandicus). En el cuadro del anexo Nº 5, se especifica el "score" de las aves positivas a la presencia de anticuerpos anti-c. psittaci. De las 49 muestras de suero analizadas para la detección de anticuerpos contra C. psittaci, 13 muestras fueron sospechosas a la prueba de ELISA; de estas 5 procedían de loros nativos y 8 de psitácidas exóticas (anexo Nº 6). En el cuadro Nº 5 se especifica el número de aves del orden Psittaciforme muestreadas y el número de aves con presencia de anticuerpos contra C. psittaci, según especie aviar. Los sueros positivos provinieron de 7 poblaciones aviares de la zona central de Chile, de las 10 en estudio (ver anexo Nº 7). 55
63 Cuadro Nº 5. Aves Psittaciformes nativas y exóticas mantenidas en cautiverio en la zona central de Chile serológicamente positivas* a C. psittaci. C. psittaci ESPECIE PSITTACIFORME N Nº Positivas NATIVAS Enicognathus leptorhynchus 6 0 Cyanoliseus p. bloxami 2 1 Enicognathus ferrugineus 2 0 TOTAL NATIVAS (%) 10 (100%) 1 (10%) EXÓTICAS Agapornis fischeri 5 0 Agapornis personatus 1 1 Agapornis roseicollis 6 1 Amazona aestiva 2 2 Amazona ochrocephala 1 0 Amazona o. oratrix 1 0 Ara ararauna 1 0 Ara chloroptera 1 0 Ara macao 2 0 Aratinga erythrogenys 1 0 Aratinga mitrata 1 0 Melopssitacus undulatus 6 2 Nymphicus hollandicus 3 2 Cyanoramphus novaezelandiae 1 0 Cyanoliseus patagonus 1 0 Myiopsitta monachus 1 1 Platycercus elegans 1 0 Polytelis swainsonii 1 0 Psephotus haematonotus 1 1 Psittacula krameri 2 0 TOTAL EXÓTICAS (%) 39 (100%) 10 (25,6%) PSITTACIFORMES TOTAL (%) 49 (100%) 11 (22,4%) N= número de psitácidas muestreadas Nº positivas = número de psitácidas serológicamente positivas (*)= Se empléo la técnica de ELISA en fase sólida mediante el "kit" comercial (test ImmunoComb Enzime- linked inmunosorbent assay (ELISA) Biogal, Kibbuz Ghaled, Israel). 56
64 Figura Nº 14 Porcentaje de psitácidas muestreadas en cautiverio seropositivas a C. psittaci. 51,0% 22,4% 26,5% Sospechosos Positivos Negativos Figura Nº 15 Distribución porcentual de presencia de anticuerpos contra C. psittaci en 10 psitácidas nativas en cautiverio de Chile central 40% Sospechosos Positivos 50% Negativos 10% Figura Nº 16 Distribución porcentual de presencia de anticuerpos contra C. psittaci en 39 psitácidas exóticas en cautiverio en Chile central 53,8% 20,5% 25,6% Sospechosos Positivos Negativos 57
65 - Detección de anticuerpos contra S. enteritidis: de acuerdo con el cuadro Nº 6, de 184 muestras de suero provenientes de psitácidas nativas y exóticas confinadas, 2 (1,1%) presentaron niveles significativos de anticuerpos contra S. enteritidis empleando el ELISA- FlockChek - para S. enteritidis y 10 (5,4%) muestras fueron sospechosas (anexo Nº 8). Las poblaciones aviares seropositivas fueron 2 de las 10 en estudio (ver cuadro del anexo Nº 9). Cada una de ellas, presentó un individuo seropositivo. Un ave nativa (1,5%) de 68 muestras de suero de aves nativas, presentó niveles significativos de anticuerpos considerándose positiva y un ave exótica (0,9%) de 116 muestras de suero de aves exóticas fue positiva a la prueba inmunoenzimática. Las aves seropositivas fueron un choroy (Enicognathus leptorhynchus) proveniente del centro de rehabilitación A y una cotorrita ninfa (Nymphicus hollandicus) procedente del aviario J, de un coleccionista particular. En el cuadro Nº 6 se especifica el número de aves del orden Psittaciforme muestreadas y el número de aves con presencia de anticuerpos contra S. enteritidis según especie aviar. 58
66 Cuadro Nº 6. Aves Psittaciformes nativas y exóticas mantenidas en cautiverio en la zona central de Chile serológicamente positivas* a S. enteritidis. S. enteritidis ESPECIE PSITTACIFORME N Nº INF. NATIVAS Enicognathus leptorhynchus 47 1 Cyanoliseus p. bloxami 15 0 Enicognathus ferrugineus 6 0 NATIVAS TOTAL (%) 68 (100%) 1 (1,47 %) EXÓTICAS Agapornis fischeri 11 0 Agapornis personata 2 0 Agapornis roseicollis 15 0 Amazona aestiva 5 0 Amazona farinosa 1 0 Amazona festiva 1 0 Amazona ochrocephala 1 0 Ara ararauna 4 0 Ara auricollis 1 0 Ara chloroptera 5 0 Ara macao 3 0 Aratinga erythrogenys 3 0 Aratinga mitrata 4 0 Aratinga wagleri 1 0 Melopssitacus undulatus 21 0 Nymphicus hollandicus 8 1 Cyanoramphus novaezelandiae 2 0 Cyanoliseus patagonus 2 0 Myiopsitta monachus 2 0 Nandayus nenday 1 0 Pionus menstruus 1 0 Platycercus elegans 1 0 Platycercus eximius 5 0 Polytelis alexandrae 1 0 Polytelis swainsonii 4 0 Psephotus haematonotus 3 0 Psittacula krameri 6 0 Pyrrhura frontalis 2 0 EXÓTICAS TOTAL (%) 116 (100%) 1 (0,86%) PSITTACIFORMES TOTAL (%) 184 (100%) 2 (1,08%) N= número de psitácidas muestreadas Nº positivas = número de psitácidas seropositivas. (*)= Se empleó la técnica de ELISA en fase sólida mediante un "kit" comercial (Flock Chek Salmonella enteritidis antibody test kit IDEXX, Westbrook, Maine, USA). 59
67 Figura Nº 17 Distribución porcentual de presencia de anticuerpos contra S. enteritidis en 184 psitácidas de cautiverio en Chile central. 93,5% 1,1% 5,4% Sospechoso Positivo Negativo Figura Nº 18 Distribución porcentual de presencia de anticuerpos contra S. enteritidis en 116 psitácidas exóticas en cautiverio en Chile central 0,9% 5,2% 94,0% Sospechoso Positivo Negativo Figura Nº 19 Distribución porcentual de presencia de anticuerpos contra S. enteritidis en 68 psitácidas nativas de cautiverio en Chile central. 1,5% 5,9% 92,6% Sospechoso Positivo Negativo 60
68 - Determinación de anticuerpos contra S. typhimurium: no se detectaron anticuerpos séricos contra S. typhimurium en las 68 muestras de suero de loros nativos, ni tampoco en las 116 muestras de suero procedentes de loros exóticos, al momento de realizar el estudio. Las 184 muestras procedentes de Psittaciformes pertenecientes a 10 poblaciones fueron negativas (anexo Nº 10). Ninguna de las muestras fue sospechosa. En el cuadro Nº 7 se especifica el número de aves Psittaciformes muestradas según especie. 61
69 Cuadro Nº 7. Aves Psittaciformes nativas y exóticas mantenidas en cautiverio en la zona central de Chile serológicamente positivas* a S. typhimurium. S. typhimurium ESPECIE PSITTACIFORME N Nº positivas NATIVAS Enicognathus leptorhynchus 47 0 Cyanoliseus p. bloxami 15 0 Enicognathus ferrugineus 6 0 NATIVAS TOTAL (%) 68 (100%) 0 (0%) EXÓTICAS Agapornis fischeri 12 0 Agapornis personata 2 0 Agapornis roseicollis 15 0 Amazona aestiva 4 0 Amazona farinosa 1 0 Amazona festiva 1 0 Amazona ochrocephala 1 0 Ara ararauna 4 0 Ara auricollis 1 0 Ara chloroptera 5 0 Ara macao 3 0 Aratinga erythrogenys 3 0 Aratinga mitrata 4 0 Aratinga wagleri 1 0 Melopssitacus undulatus 21 0 Nymphicus hollandicus 8 0 Cyanoramphus novaezelandiae 2 0 Cyanoliseus patagonus 2 0 Myiopsitta monachus 2 0 Nandayus nenday 1 0 Pionus menstruus 1 0 Platycercus elegans 1 0 Platycercus eximius 5 0 Polytelis alexandrae 1 0 Polytelis swainsonii 4 0 Psephotus haematonotus 3 0 Psittacula krameri 6 0 Pyrrhura frontalis 2 0 EXÓTICAS TOTAL (%) 116 (100%) 0 (0%) PSITTACIFORMES TOTAL (%) 184 (100%) 0 (0%) N= número de psitácidas muestreadas Nº positivas = número de psitácidas serológicamente positiva (*)Se empleó la prueba de aglutinación de S. typhimurium descrita por Grimes et al., (1992). 62
70 Un resumen de los resultados serológicos positivos obtenidos en este estudio, con respecto a las muestras de sangre tomadas a un grupo restringido de aves del orden Psittaciforme pertenecientes a 10 aviarios o poblaciones aviares en cautiverio de la zona central de Chile, según el agente infeccioso investigado es entregado en el cuadro Nº 8. En este cuadro se puede observar que la infección que se presenta con mayor frecuencia en psitácidas es la provocada por VPA, estando además ampliamente distribuida (80% de los aviarios estudiados); le sigue en frecuencia la infección generada por el agente bacteriano C. psittaci (22,4%) que también tiene una amplia distribución de los casos seropositivos (7 de 10 aviarios). En contraste S. enteritidis presenta un bajo porcentaje de casos seropositivos (1,1%) y compromete a sólo 2 aviarios, mientras que no se detectaron casos seropositivos a S. typhimurium. Cuadro Nº 8. Resultados del screening serológico de las muestras de sangre tomadas de 10 aviarios de psitácidas en la zona central de Chile Agente infeccioso Aves positivas / total de aves Virus diftero viruela aviar 8/201 (4%) 2/10 Adenovirus aviar (grupo I) 9/184 (4,9%) 4/10 Virus polioma aviar 36/100 (36%) 8/10 Chlamydophila psittaci 11/49 (22,4%) 7/10 Salmonella enteritidis 2/184 (1,1%) 2/10 Salmonella typhimurium 0/184 (0%) 0/10 Aviarios seropositivos/total aviarios Los cuadros del anexo Nº 11 y 12 indican la frecuencia absoluta y número de aves seropositivas según agente viral y bacteriano en estudio de acuerdo a la especie de Psittaciforme en cautiverio en la zona central de Chile, respectivamente. El cuadro Nº 13 del anexo resume las especies de Psittaciformes seropositivas a determinado agente infeccioso estudiado, según aviario. 63
71 8.-DISCUSIÓN - Detección de anticuerpos contra virus diftero viruela aviar. En este estudio se detectó anticuerpos contra vdva en 2 de las 10 poblaciones de psitácidas mediante la prueba de ID. Esta prueba, que es de fácil y simple ejecución, tiene como desventaja su baja sensibilidad, por lo que estos resultados sólo permiten verificar que este tipo de aves se pueden infectar con este tipo de virus pero no es una herramienta diagnóstica efectiva para evaluar la prevalencia. Los anticuerpos precipitantes contra el vdva son detectables por sólo un corto período de tiempo post infección, por lo que las muestras de sangre deben ser obtenidas usualmente entre los 15 a 20 días post infección (Tripathy y Reed, 2003). Además los anticuerpos humorales son raramente o irregularmente producidos en infecciones por vdva en aves (Gerlach, 1999a). En el aviario C, de 41 psitácidas serológicamente monitoreadas, sólo un ave nativa (E. ferrugineus) clinicamente sana al momento del muestreo, fue positiva a la presencia de anticuerpos contra-vdva. Esta baja tasa de detección de anticuerpos se explica por lo anteriomente señalado por Gerlach, (1999a) y Tripathy y Reed, (2003). En cambio en el aviario D donde se detectaron anticuerpos séricos anti-vdva en 7 de 48 psitácidas (15%), la población de aves había cursado un brote de DVA (González e Hidalgo, 2004) entre 3 y 10 semanas previas a la toma de muestras para este estudio. Las aves que enfermaron presentaron lesiones cutáneas en diferentes regiones de la cabeza, y/o zonas descubiertas de plumas de las patas y algunos individuos presentaron blefaritis y conjuntivitis, semejantes a las descritas para DVA (Gerlach, 1999a). Otro hallazgo interesante es el diagnóstico de infección por vdva en un Polytelis swainsonii del aviario D, especie en la cual aún no se ha descrito la infección por este virus. La ocurrencia del brote de DVA en el aviario D, influye en gran medida en el 4% de aves psitácidas en cautiverio serológicamente positivas a la infección por el vdva, de las 201 muestras analizadas. Los resultados de otro estudio realizado en el transcurso de un año en Europa señala que de 38 muestras de psitácidas mantenidas en cautiverio y enviadas a un laboratorio de diagnóstico, en 2 (5%) de ellas se detectó la infección por vdva mediante ME ó aislamiento en HE (Gough et al., 1988). - Detección de anticuerpos contra adenovirus aviar grupo I. De las 9 aves psitácidas (1 cachaña, 1 tricahue, 1 guacamayo azul-amarillo, 1 cotorrita ninfa, 1 cotorrita de collar, 1 inseparable, 1 lorito de espalda roja y dos catitas) positivas a la presencia de anticuerpos séricos contra AVA grupo I, 8 psitácidas no presentaban signos clínicos característicos de infección por AVA al momento del muestreo (Phalen, 1997a). Sólo una catita que fue seropositiva presentaba una conjuntivitis, pero no se descartó a otros agentes infecciosos como agentes causales de la lesión. Adenovirosis ha sido más consistentemente asociado con enfermedad en inseparables 64
72 asociado a conjuntivitis, hepatitis, pancreatitis, como también a hallazgos incidentales a la necropsia (Phalen, 1997a). Las aves psitácidas con anticuerpos séricos contra AVA grupo I, muy posiblemente presentaban al momento del estudio, infecciones subclínicas por este tipo de virus. La presencia de infecciones asintomáticas se describen en aves psitácidas basado en el hallazgo de cuerpos de inclusión concordantes con AVA en aves sin signos clínicos (Greenacre, 2005). Estas infecciones subclínicas son más comúnmente vistas en inseparables y catitas (Phalen, 1997a). Se describe también que infecciones latentes con períodos de eliminación viral intermitente o eliminación de bajos niveles de virus ocurren en las aves (Greenacre, 2005; Phalen, 1997a). Numerosos agentes estresantes incluyendo a otros agentes infecciosos pueden reactivar la adenovirosis (Phalen, 1997a). Dado que la infección por AVA generalmente es un hallazgo incidental, especialmente en catitas e inseparables, bajos niveles de eliminación viral a través del tracto urinario y digestivo podrían perpetuar la infección en estas especies (Phalen, 1997a). No hay información bibliográfica sobre seroprevalencia de esta infección en psitácidas. Por esta razón nos resulta difícil hacer una evaluación del 4,9% de serología positiva a AVA (grupo I) obtenida en nuestro estudio. La infección de psitácidas con AVA ha sido diagnosticada especialmente en aves en cautiverio mediante la clínica, histopatología, aislamiento viral, ME y hibridación in situ de DNA (Gerlach, 1999a; Mackie et al., 2003; Latimer et al., 1998; Gómez-Villamandos et al., 1995; Droual et al., 1995; Scott et al., 1986). Así en un estudio realizado en Europa, en 2 de 38 (5 %) psitácidas se aisló AVA en cultivos celulares (Gough et al., 1988); en otro estudio, los cuerpos de inclusión con partículas semejantes a AVA fueron detectadas en el hígado de 2 de 1426 (0,14 %) aves psitácidas (Fuchs y Weissenbock, 1993). La seropositividad contra AVA del grupo I de 2 individuos de loros nativos: Enicognathus ferrugineus (cachaña) y C. patagonus bloxami (tricahue), temporalmente en cautiverio, es un hallazgo relevante de este estudio, ya que no ha sido descrito anteriormente en esta especie y subespecie respectivamente; aunque la adenovirosis asociada a una hepatitis con cuerpos de inclusión ya ha sido descrita en la especie Cyanoliseus patagonus en una colección de zoológico (Bryant y Montali, 1987). -Detección de anticuerpos contra virus polioma aviar. La realización de pruebas moleculares para el diagnóstico de infecciones por VPA basadas en identificación del su ndna, tienen una sensibilidad de 98,2% y una especificidad del 100% (Dahlhausen y Radabaugh, 2005). Por otra parte, la sensibilidad de la prueba de SNV para detección de infección por VPA, es del 100% (Phalen et al., 1993). Phalen et al., (1993) han demostrado en catitas de 6 meses de edad 100% de seropositividad mediante la prueba de SNV versus un 33 % de detección de la infección viral por RCP en las heces de estas aves. 65
73 En nuestro estudio, del grupo de 15 catitas aparentemente saludables del muestreo para VPA, 3 (20%) fueron positivas con títulos de anticuerpos neutralizantes contra VPA en un rango de 160 a En Puerto Rico, no fueron detectados anticuerpos neutralizantes contra VPA en ninguno de los loros Amazona que eran mantenidos en cautiverio (Ritchie, 1995), ni tampoco DNA viral fue aislado de plumas provenientes de 85 aves psitácidas en cautiverio en Alemania mediante la prueba de RCP (Rahaus y Wolff, 2005). En contraste, en un grupo heterogéneo de aves psitácidas en cautiverio en EE.UU, que no incluia catitas, la seroprevalencia fue de un 63% (Ritchie, 1995; Ritchie et al., 1996). En otra evaluación serológica para VPA de diversos Psittaciformes (guacamayos, loros Amazona y conuros), pertenecientes a tres aviarios con una historia previa de infección por VPA en neonatos, hubo títulos serológicos positivos en el 45%-25%-11% de las aves muestreadas (Wainright et al., 1987). En nuestro monitoreo de un grupo misceláneo de 60 psitácidas exóticas, excluyendo a las catitas, 31 (51,6%) fueron consideradas seropositivas. Por otro lado de 25 psitácidas nativas monitoreadas para la presencia de anticuerpos neutralizantes anti-vpa, dos choroy (Enicognathus leptorhynchus) fueron seropositivos (8%). Esto reviste especial importancia porque la infección por VPA no había sido detectada en esta especie, aunque ya había sido descrita en varias especies de conuros (Graham y Calnek, 1987; Wainright et al., 1987; Ritchie, 1995). La demostración de anticuerpos anti- VPA después de una infección natural en psitácidas que no son catitas, aparentemente saludables sugiere que muchas de estas aves desarrollan infecciones subclínicas (Ritchie, 1995; Jacobson et al., 1984). Existen estudios de seroprevalencia que sugieren que la mayor parte de las psitácidas que "no son catitas", infectadas con VPA desarrollan anticuerpos y permanecen clinicamente normales (Jacobson et al, 1984; Wainright et al., 1987). Los anticuerpos también han sido detectados en algunas aves que mueren con VPA y también pueden estar presentes en aves que sobreviven a una infección aguda (Jacobson et al., 1984; Phalen et al., 2000; Phalen et al., 1996; Phalen et al., 1993; Wainright et al., 1987). Los sobrevivientes a la infección por VPA, podrían ser portadores asintomáticos y mantener en forma persistente los títulos de anticuerpos altos (Ritchie, 1995). En otros casos, en los sobrevivientes, los títulos de anticuerpos contra el virus decrecen, sugiriendo que las aves no son continuamente estimuladas por el virus (Wainright et al., 1987). Wainright et al., (1987) mostraron una disminución de los títulos de anticuerpos contra VPA, en aves psitácidas después de uno a dos meses y medio después del primer muestreo. Las catitas que se recuperan de una infección por VPA se piensa que desarrollan infecciones latentes y mantienen los títulos de anticuerpos altos (Phalen et al., 1993). Un amplio rango de aves psitácidas distribuidas en el mundo, podrían estar infectadas con este virus (Wainright et al., 1987), lo que puede llegar a ser una amenaza para la crianza en cautiverio de aves de compañía, como también para aves nativas de Chile de vida libre o que se encuentran confinadas. Dado los resultados del presente estudio (una amplia distribución de la 66
74 detección de anticuerpos anti-vpa en 8 de 10 poblaciones aviares, como también la presencia de aves con altos títulos de anticuerpos neutralizantes anti-vpa (>160) característicos de aves que se recuperan de una infección reciente por VPA, además de la presencia de psitácidas serológicamente positivas que son nativas de Chile y que se encontraban en un centro de rehabilitación) sugerimos incrementar la investigación sobre la presencia de infecciones por VPA en psitácidas nativas de vida libre, como también conocer las prevalencias de infección en aves de compañía de aviarios y los efectos de morbilidad y mortalidad que podría estar generando la presencia de este agente viral en las psitácidas en Chile. Cabe mencionar, que el movimiento de aves psitácidas exóticas (que han tenido exposición con VPA) hacia aviarios con psitácidas de vida libre nativas de Chile que no hallan sido expuestas a VPA, puede resultar en la diseminación de un virus dentro de una población de aves donde previamente no existía. Por esta razón consideramos que temas importantes a abordar son: - La situación sanitaria de especímenes de fauna silvestre mantenidos en cautiverio en los zoológicos y centros de rehabilitación, como también las de los ejemplares de fauna silvestre cautivos que son posteriormente reincertados en sus ambientes naturales. - La transmisión de agentes etiológicos entre fauna de origen exótico y silvestre (en ambas direcciones). Por otro lado métodos diagnósticos para VPA debieran ser implementados en Chile. - Detección de anticuerpos contra C. psittaci. Un ave serológicamente negativa nos indica no contacto previo con Chlamydophila, mientras que un ave seropositiva puede ser un potencial portador (Ruppanner et al., 1984). La prueba comercial ELISA ha sido considerada efectiva cómo método de "screening" para detectar anticuerpos anti-c. psittaci (Bendheim et al., 1996). Su sensibilidad es de 95% y su especificidad de 85%. En nuestro estudio fueron detectados niveles de anticuerpos contra C. psittaci en el 22,4% de las 49 aves psitácidas monitoreadas. Entre las aves de la población I, sólo una tenía los signos clínicos característicos de clamidiosis aviar (figura 16) y presentó anticuerpos séricos "score" de 5 utilizando el "Kit" de ELISA ImmunoComb. Esta ave había tenido contacto indirecto con otras 6 aves psitácidas sin manifestaciones clínicas que también fueron muestreadas, resultando 3 aves con una cantidad moderada a alta de anticuerpos contra C. psittaci. El resto de las aves de las otras poblaciones analizadas se encontraban aparentemente saludables, salvo un choroy de la población B y un guacamayo Ara chloroptera de la población C, que tenían conjuntivitis al momento del muestreo y que fueron serológicamente sospechosos. Los resultados del presente estudio se asemejan a los obtenidos en un estudio en Israel, en que se utilizó el mismo "kit" comercial, obteniéndose resultados serológicos positivos en el 23,5% de las muestras de suero tomadas de aves psitácidas saludables y en el 77% de las muestras de suero 67
75 provenientes de aves con signos clínicos de clamidiosis (Bendheim et al., 1998). En Noruega, Reither, (1999) determinó una prevalencia alta de infección por Clamydophila en aves mascotas utilizando el "Kit" de ELISA ImmunoComb, el 60% de las 138 aves muestradas presentaron niveles de anticuerpos significativos y muy pocas tenían signos típicos de clamidiosis. La prueba empleada en nuestro estudio fue desarrollada en 1993 (Bendheim et al., 1998) y ha sido empleada por diversos autores en aves psitácidas (Raso et al., 2002; Herrera et al., 2001; Bendheim et al., 1998; Ryll et al., 1994; Reither, 1999). Figura Nº 16. Amazona aestiva con signos característicos de clamidiosis aviar: rinitis, sinucitis, conjuntivitis bilateral, emaciación y biliverdinuria. Presentaba también metaplasia escamosa. Al hemograma: Leucocitosis y en el perfil bioquímico: AST 8340u/l. Radiográficamente presentaba hepatomegalia. Foto tomada en Octubre Chile. Cuando un título serológico positivo es obtenido en aves clínicamente normales, es necesario determinar si está cursando con infección en ese momento. Un cultivo de una tórula de coana u orofaringe o la demostración de seroconverción dilucidará esta situación. La determinación de niveles séricos de enzimas hepáticas y recuento de leucocitos pueden orientar a establecer si el ave está cursando con el proceso infeccioso (Grimes et al., 1996). Los resultados serológicos encontrados en este estudio, demuestran la presencia de infección por C. psittaci en una psitácida nativa (Cyanoliseus patagonus bloxami) del aviario A y en una cotorrita argentina (Myiopsitta monachus) del aviario B, ambas en cautiverio, pero que en nuestro país son aves de vida libre. Sería necesario ampliar este estudio preliminar a poblaciones de loros nativos de vida libre de Chile como también a poblaciones de cotorritas argentinas de vida libre por ser posibles reservorios, mediante el serodiagnóstico u otras técnicas diagnósticas enfocadas en la detección del agente. Considerando que la alta proporción de aves serológicamente positivas a C. psittaci, en esta investigación, fueron psitácidas exóticas (26%) y que la distribución de la infección detectada en estas últimas, es amplia (6 de 9 aviarios), se justifican realizar estudios de seroprevalencia en este tipo de aves en cautiverio en el país. Las condiciones de confinamiento como 68
ENFERMEDAD DEL NILO OCCIDENTAL West Nile Virus
 (WNV) Flavivirus transmitido por 43 especies de mosquitos (Culex sp.), nativo de África, Europa y Asia Occidental. ENFERMEDAD DEL NILO OCCIDENTAL WNV circula entre aves e infecta muchas especies de mamíferos
(WNV) Flavivirus transmitido por 43 especies de mosquitos (Culex sp.), nativo de África, Europa y Asia Occidental. ENFERMEDAD DEL NILO OCCIDENTAL WNV circula entre aves e infecta muchas especies de mamíferos
FIEBRE DEL NILO OCCIDENTAL
 CAPÍTULO 8.16. FIEBRE DEL NILO OCCIDENTAL Artículo 8.16.1. Disposiciones generales La fiebre del Nilo Occidental es una zoonosis causada por determinadas cepas del virus del Nilo Occidental transmitidas
CAPÍTULO 8.16. FIEBRE DEL NILO OCCIDENTAL Artículo 8.16.1. Disposiciones generales La fiebre del Nilo Occidental es una zoonosis causada por determinadas cepas del virus del Nilo Occidental transmitidas
1. Conceptos de infectología
 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS VETERINARIAS Y PECUARIAS DEPARTAMENTO DE MEDICINA PREVENTIVA 1. Conceptos de infectología Características de los agentes patógenos 1. Conceptos de infectología.
UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS VETERINARIAS Y PECUARIAS DEPARTAMENTO DE MEDICINA PREVENTIVA 1. Conceptos de infectología Características de los agentes patógenos 1. Conceptos de infectología.
INFLUENZA AVIAR ALTAMENTE PATÓGENA (PESTE AVIAR)
 INFLUENZA AVIAR ALTAMENTE PATÓGENA (PESTE AVIAR) 1) Señala la respuesta falsa sobre la inactivación del virus de la influenza aviar altamente a. A 53 ºC durante 3 horas o a 60 Cº durante 30 minutos. b.
INFLUENZA AVIAR ALTAMENTE PATÓGENA (PESTE AVIAR) 1) Señala la respuesta falsa sobre la inactivación del virus de la influenza aviar altamente a. A 53 ºC durante 3 horas o a 60 Cº durante 30 minutos. b.
INFORME SOBRE UN PROBABLE FOCO DE INFLUENZA CANINA EN EL VALLE CENTRAL Informe N 1 Fecha: 16/10/2012
 Versión 01 Página 1 de 5 INFORME SOBRE UN PROBABLE FOCO DE INFLUENZA CANINA EN EL VALLE CENTRAL Informe N 1 Fecha: 16/10/2012 1. Antecedentes: El SENASA recibe notificación por parte de la Escuela de Medicina
Versión 01 Página 1 de 5 INFORME SOBRE UN PROBABLE FOCO DE INFLUENZA CANINA EN EL VALLE CENTRAL Informe N 1 Fecha: 16/10/2012 1. Antecedentes: El SENASA recibe notificación por parte de la Escuela de Medicina
VIRUELA OVINA Y CAPRINA. 1) El agente causal de la Viruela Ovina y Caprina:
 VIRUELA OVINA Y CAPRINA 1) El agente causal de la Viruela Ovina y Caprina: a. No se puede distinguir serológicamente del virus causante de la Dermatosis Nodular Contagiosa (DNC). b. Es un virus ARN monocatenario
VIRUELA OVINA Y CAPRINA 1) El agente causal de la Viruela Ovina y Caprina: a. No se puede distinguir serológicamente del virus causante de la Dermatosis Nodular Contagiosa (DNC). b. Es un virus ARN monocatenario
A D E N O V I R U S. Los Adenovirus son causa de un amplio espectro de enfermedades agudas y crónicas.
 Dr. Raúl L. Riverón Corteguera Profesor Titular Consultante Facultad Gral Calixto García Universidad de Ciencias Médicas de La Habana Los Adenovirus son causa de un amplio espectro de enfermedades agudas
Dr. Raúl L. Riverón Corteguera Profesor Titular Consultante Facultad Gral Calixto García Universidad de Ciencias Médicas de La Habana Los Adenovirus son causa de un amplio espectro de enfermedades agudas
Solicitud de importación de Palomas Deportivas procedentes de Establecimientos de Cria (art. 26)
 ANEXO I Ministerio de Agricultura, Ganadería y, Pesca Servicio Nacional de Sanidad y Calidad Agroalimentaria SOLICITUD Nº: Solicitud de importación de Palomas Deportivas procedentes de Establecimientos
ANEXO I Ministerio de Agricultura, Ganadería y, Pesca Servicio Nacional de Sanidad y Calidad Agroalimentaria SOLICITUD Nº: Solicitud de importación de Palomas Deportivas procedentes de Establecimientos
Peste Porcina. Qué es la Peste Porcina?
 Peste Porcina Qué es la Peste Porcina? Enfermedad infectocontagiosa que afecta exclusivamente al ganado porcino, y cerdos salvajes de todas las edades, producida por un virus de carácter hemorrágico que
Peste Porcina Qué es la Peste Porcina? Enfermedad infectocontagiosa que afecta exclusivamente al ganado porcino, y cerdos salvajes de todas las edades, producida por un virus de carácter hemorrágico que
INSTRUCTIVO PARA MAESTROS Y MAESTRAS
 INSTRUCTIVO PARA MAESTROS Y MAESTRAS PREVENCIÓN DE INFLUENZA AVIAR Y PANDÉMICA Para mayor información, llame al Logo Logo Logo Este documento corresponde a un esfuerzo para la prevención de la Influenza
INSTRUCTIVO PARA MAESTROS Y MAESTRAS PREVENCIÓN DE INFLUENZA AVIAR Y PANDÉMICA Para mayor información, llame al Logo Logo Logo Este documento corresponde a un esfuerzo para la prevención de la Influenza
INSTITUTO DE SALUD PÚBLICA DE CHILE Newsletter Científico. Vigilancia de Salmonella spp. Laboratorio de Referencia 2010
 1 INSTITUTO DE SALUD PÚBLICA DE CHILE Newsletter Científico Vigilancia de Salmonella spp. Laboratorio de Referencia 2010 Salmonella es el agente etiológico de la salmonelosis, enfermedad de transmisión
1 INSTITUTO DE SALUD PÚBLICA DE CHILE Newsletter Científico Vigilancia de Salmonella spp. Laboratorio de Referencia 2010 Salmonella es el agente etiológico de la salmonelosis, enfermedad de transmisión
Incidencia de Hepatitis por cuerpos de inclusión y Planes de Control
 Introducción Incidencia de Hepatitis por cuerpos de inclusión y Planes de Control Pedro Villegas-Narváez Universidad de Georgia Centro de Diagnóstico e Investigación Aviar Facultad de Medicina Veterinaria
Introducción Incidencia de Hepatitis por cuerpos de inclusión y Planes de Control Pedro Villegas-Narváez Universidad de Georgia Centro de Diagnóstico e Investigación Aviar Facultad de Medicina Veterinaria
Tenencia de fauna silvestre en cautiverio: una cuestión de normas legales, aunque también de ética y bienestar animal (*)
 Volver a portada Imprima este artículo Envíe el Boletín a un amigo Contáctenos Tenencia de fauna silvestre en cautiverio: una cuestión de normas legales, aunque también de ética y bienestar animal (*)
Volver a portada Imprima este artículo Envíe el Boletín a un amigo Contáctenos Tenencia de fauna silvestre en cautiverio: una cuestión de normas legales, aunque también de ética y bienestar animal (*)
Aves domésticas de la República Argentina
 INFORME 2015 Aves domésticas de la República Argentina Programa de Aves y Animales de Granja - Dirección de Programación Sanitaria Dirección Nacional de Sanidad Animal 1-Vigilancia ACTIVA 1.2- Industriales
INFORME 2015 Aves domésticas de la República Argentina Programa de Aves y Animales de Granja - Dirección de Programación Sanitaria Dirección Nacional de Sanidad Animal 1-Vigilancia ACTIVA 1.2- Industriales
REQUISITOS ZOOSANITARIOS DE LA REPÚBLICA DOMINICANA PARA IMPORTAR EQUINOS PROVENIENTES DE BRASIL
 REQUISITOS ZOOSANITARIOS DE LA REPÚBLICA DOMINICANA PARA IMPORTAR EQUINOS PROVENIENTES DE BRASIL Los animales deben venir acompañados por un Certificado de Salud de Brasil expedido por un veterinario autorizado
REQUISITOS ZOOSANITARIOS DE LA REPÚBLICA DOMINICANA PARA IMPORTAR EQUINOS PROVENIENTES DE BRASIL Los animales deben venir acompañados por un Certificado de Salud de Brasil expedido por un veterinario autorizado
En un principio se desconocía si este problema era de tipo infeccioso o no. Actualmente ya se sabe que está provocada por un virus, más concretamente
 PBFD EN LOROS El PBFD es una enfermedad vírica que en los últimos años, debido al comercio mundial de las aves, se ha extendido por todos los continentes afectando a miles de psitácidas con fatales consecuencias.
PBFD EN LOROS El PBFD es una enfermedad vírica que en los últimos años, debido al comercio mundial de las aves, se ha extendido por todos los continentes afectando a miles de psitácidas con fatales consecuencias.
Dr. Francisco Aspée B.
 Dr. Francisco Aspée B. Enfermedad respiratoria viral aguda, altamente contagiosa de los pollos, caracterizada por estertores traqueales, tos y estornudos, en algunos casos se presenta con alteraciones
Dr. Francisco Aspée B. Enfermedad respiratoria viral aguda, altamente contagiosa de los pollos, caracterizada por estertores traqueales, tos y estornudos, en algunos casos se presenta con alteraciones
Descripción epidemiológica de los casos humanos de infección por el nuevo virus de la gripe aviar A (H7N9) detectados en China.
 Fecha del informe: 7 abril de 2013 DETECCIÓN DE UN NUEVO VIRUS DE LA GRIPE AVIAR A(H7N9) EN HUMANOS EN CHINA. EVALUACIÓN DEL RIESGO PARA ESPAÑA. Antecedentes La gripe aviar se refiere a la enfermedad de
Fecha del informe: 7 abril de 2013 DETECCIÓN DE UN NUEVO VIRUS DE LA GRIPE AVIAR A(H7N9) EN HUMANOS EN CHINA. EVALUACIÓN DEL RIESGO PARA ESPAÑA. Antecedentes La gripe aviar se refiere a la enfermedad de
Detección de un brote de Influenza AH1N1 en aves reproductoras de pavos, Comunas de Nogales y Quilpue, Región de Valparaíso.
 Detección de un brote de Influenza AH1N1 en aves reproductoras de pavos, Comunas de Nogales y Quilpue, Región de Valparaíso. 1. Resumen del evento: Informe Epidemiológico al 26.08.09 1.1 Con fecha 19 de
Detección de un brote de Influenza AH1N1 en aves reproductoras de pavos, Comunas de Nogales y Quilpue, Región de Valparaíso. 1. Resumen del evento: Informe Epidemiológico al 26.08.09 1.1 Con fecha 19 de
RESOLUCION DIRECTORAL Nº AG-SENASA-DSA
 Establecen requisitos sanitarios específicos de cumplimiento obligatorio en la importación de Pollos recién nacidos y Huevos fértiles de gallina, de origen y procedencia Brasil RESOLUCION DIRECTORAL Nº
Establecen requisitos sanitarios específicos de cumplimiento obligatorio en la importación de Pollos recién nacidos y Huevos fértiles de gallina, de origen y procedencia Brasil RESOLUCION DIRECTORAL Nº
INFLUENZA AVIAR SERVICIO DE GANADERIA - NEGOCIADO DE EPIZOOTIOLOGIA
 INFLUENZA AVIAR INFLUENZA AVIAR PESTE AVIAR (Fowl disease) GRIPE AVIAR (Grippe bird) Enfermedad viral altamente contagiosa, de las aves, que produce lesiones necróticas, hemorrágicas o inflamatorias en
INFLUENZA AVIAR INFLUENZA AVIAR PESTE AVIAR (Fowl disease) GRIPE AVIAR (Grippe bird) Enfermedad viral altamente contagiosa, de las aves, que produce lesiones necróticas, hemorrágicas o inflamatorias en
INFORME DE COQUELUCHE Semana Epidemiológica 1 a 24 (02 de Enero al 18 de Junio)
 INFORME DE COQUELUCHE Semana Epidemiológica a 2 (2 de Enero al 8 de Junio). ANTECEDENTES: El Coqueluche es una enfermedad infecciosa bacteriana aguda que afecta el tracto respiratorio. Es causada por un
INFORME DE COQUELUCHE Semana Epidemiológica a 2 (2 de Enero al 8 de Junio). ANTECEDENTES: El Coqueluche es una enfermedad infecciosa bacteriana aguda que afecta el tracto respiratorio. Es causada por un
Tema 12. Enfermedades Transmisibles. Cadena epidemiológica
 Tema 12 Enfermedades Transmisibles Cadena epidemiológica Enfermedades Transmisibles Definición Conceptos previos Importancia Cadena Epidemiológica Medidas de prevención y control Presentación en la población
Tema 12 Enfermedades Transmisibles Cadena epidemiológica Enfermedades Transmisibles Definición Conceptos previos Importancia Cadena Epidemiológica Medidas de prevención y control Presentación en la población
PROYECTO NACIONAL DE VIGILANCIA EPIDEMIOLÓGICA EN ENFERMEDADES AVIARES EXÓTICAS DE LA LISTA A DE LA OIE Y EN BRONQUITIS INFECCIOSA RENAL
 PROYECTO NACIONAL DE VIGILANCIA EPIDEMIOLÓGICA EN ENFERMEDADES AVIARES EXÓTICAS DE LA LISTA A DE LA OIE Y EN BRONQUITIS INFECCIOSA RENAL 2004-2007 INTRODUCCIÓN La influenza aviar y la enfermedad de Newcastle
PROYECTO NACIONAL DE VIGILANCIA EPIDEMIOLÓGICA EN ENFERMEDADES AVIARES EXÓTICAS DE LA LISTA A DE LA OIE Y EN BRONQUITIS INFECCIOSA RENAL 2004-2007 INTRODUCCIÓN La influenza aviar y la enfermedad de Newcastle
Para la Exportacion de Semen Bovino a Chile
 MODELO DE CERTIFICADO SANITARIO Para la Exportacion de Semen Bovino a Chile Norma de Referencia: Resolución Nº 2374 de 1997, modificada por las Resoluciones N 625 de 1999 y 1091 del 2003 SECCION I IDENTIFICACION
MODELO DE CERTIFICADO SANITARIO Para la Exportacion de Semen Bovino a Chile Norma de Referencia: Resolución Nº 2374 de 1997, modificada por las Resoluciones N 625 de 1999 y 1091 del 2003 SECCION I IDENTIFICACION
c. Ingestión de agua y alimentos contaminados con heces u orina de enfermos portadores. Correcta
 Cuál es el modo de transmisión de la fiebre tifoidea? a. Animales salvajes. b. Contacto directo con sangre y fluidos corporales. c. Ingestión de agua y alimentos contaminados con heces u orina de enfermos
Cuál es el modo de transmisión de la fiebre tifoidea? a. Animales salvajes. b. Contacto directo con sangre y fluidos corporales. c. Ingestión de agua y alimentos contaminados con heces u orina de enfermos
Informe de Resultados de Vigilancia de Laboratorio Enfermedad Invasora Neisseria meningitidis 2016
 1 Informe de Resultados de Vigilancia de Laboratorio Enfermedad Invasora Neisseria meningitidis 2016 Resumen Ejecutivo: Hasta la SE N 10 del año 2016 el Laboratorio de Referencia ha confirmado 11 casos
1 Informe de Resultados de Vigilancia de Laboratorio Enfermedad Invasora Neisseria meningitidis 2016 Resumen Ejecutivo: Hasta la SE N 10 del año 2016 el Laboratorio de Referencia ha confirmado 11 casos
LA ENFERMEDAD. La gripe aviar o influenza aviar es una enfermedad peligrosa debido a que puede causar la muerte de todas las aves de una granja
 LA ENFERMEDAD 9 La gripe aviar o influenza aviar es una enfermedad peligrosa debido a que puede causar la muerte de todas las aves de una granja La gripe aviar es una enfermedad peligrosa debido a que
LA ENFERMEDAD 9 La gripe aviar o influenza aviar es una enfermedad peligrosa debido a que puede causar la muerte de todas las aves de una granja La gripe aviar es una enfermedad peligrosa debido a que
Informe de Resultados de Vigilancia de Laboratorio Enfermedad Invasora Neisseria meningitidis 2017
 1 Informe de Resultados de Vigilancia de Laboratorio Enfermedad Invasora Neisseria meningitidis 2017 Resumen Ejecutivo: Hasta la SE N 6 del año 2017 el Laboratorio de Referencia ha confirmado 9 casos de
1 Informe de Resultados de Vigilancia de Laboratorio Enfermedad Invasora Neisseria meningitidis 2017 Resumen Ejecutivo: Hasta la SE N 6 del año 2017 el Laboratorio de Referencia ha confirmado 9 casos de
ESPECIALIDAD EN AVICULTURAA
 ESPECIALIDAD EN AVICULTURAA Perfil El médico veterinario peruano especialista en avicultura es un profesional que está capacidad de ejercer su profesión de contribuir al desarrollo del Perú ejerciendo
ESPECIALIDAD EN AVICULTURAA Perfil El médico veterinario peruano especialista en avicultura es un profesional que está capacidad de ejercer su profesión de contribuir al desarrollo del Perú ejerciendo
INFORME DEL PARQUE ZOOLÓGICO LORO SEXI. A. Información general
 INFORME DEL PARQUE ZOOLÓGICO LORO SEXI A. Información general El Parque Ornitológico Loro Sexi está situado dentro de la misma localidad de Almuñécar rodeado de edificios a unos 150 metros de la playa.
INFORME DEL PARQUE ZOOLÓGICO LORO SEXI A. Información general El Parque Ornitológico Loro Sexi está situado dentro de la misma localidad de Almuñécar rodeado de edificios a unos 150 metros de la playa.
GENERALIDADES & MANEJO IN SITU Y EX SITU
 GENERALIDADES & MANEJO IN SITU Y EX SITU CLASE 01 MVZ. Nancy Carlos E Introducción & generalidades Biodiversidad Variedad de seres vivos sobre la Tierra y los patrones naturales que la conforman, resultado
GENERALIDADES & MANEJO IN SITU Y EX SITU CLASE 01 MVZ. Nancy Carlos E Introducción & generalidades Biodiversidad Variedad de seres vivos sobre la Tierra y los patrones naturales que la conforman, resultado
Informe Mataderos Aves Faena y Hallazgos Patológicos en plantas faenadoras de aves
 Informe Mataderos Aves de Faena y Hallazgos Patológicos en plantas faenadoras de aves INTRODUCCIÓN La Vigilancia epidemiológica es una herramienta esencial en sanidad animal, debido a que es la encargada
Informe Mataderos Aves de Faena y Hallazgos Patológicos en plantas faenadoras de aves INTRODUCCIÓN La Vigilancia epidemiológica es una herramienta esencial en sanidad animal, debido a que es la encargada
Diario Oficial de la Unión Europea L 8/29
 13.1.2007 Diario Oficial de la Unión Europea L 8/29 DECISIÓN DE LA COMISIÓN de 22 de diciembre de 2006 relativa a determinadas medidas de protección frente a la gripe aviar altamente patógena y a los desplazamientos
13.1.2007 Diario Oficial de la Unión Europea L 8/29 DECISIÓN DE LA COMISIÓN de 22 de diciembre de 2006 relativa a determinadas medidas de protección frente a la gripe aviar altamente patógena y a los desplazamientos
Informe de Resultados de Vigilancia de Laboratorio Enfermedad Invasora Neisseria meningitidis 2015
 1 Informe de Resultados de Vigilancia de Laboratorio Enfermedad Invasora Neisseria meningitidis 2015 Resumen Ejecutivo: En la SE N 1 del año 2015 el Laboratorio de Referencia ha confirmado 5 casos de Neisseria
1 Informe de Resultados de Vigilancia de Laboratorio Enfermedad Invasora Neisseria meningitidis 2015 Resumen Ejecutivo: En la SE N 1 del año 2015 el Laboratorio de Referencia ha confirmado 5 casos de Neisseria
SUBDIRECCIÓN DE VIGILANCIA Y CONTROL EN SALUD PÚBLICA SUBDIRECCIÓN RED NACIONAL DE LABORATORIOS
 SUBDIRECCIÓN DE VIGILANCIA Y CONTROL EN SALUD PÚBLICA SUBDIRECCIÓN RED NACIONAL DE LABORATORIOS Protocolo de vigilancia v de Enfermedad Similar a la Influenza Subdirección de Vigilancia y Control en Salud
SUBDIRECCIÓN DE VIGILANCIA Y CONTROL EN SALUD PÚBLICA SUBDIRECCIÓN RED NACIONAL DE LABORATORIOS Protocolo de vigilancia v de Enfermedad Similar a la Influenza Subdirección de Vigilancia y Control en Salud
El microorganismo responsable de la difteria faríngea es: Seleccione una: a. Corynebacterium diphtheriae.
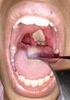 Pregunta 1 El microorganismo responsable de la difteria faríngea es: a. Corynebacterium diphtheriae. b. Mycobacterium tuberculosis. c. Haemophilus influenzae. d. Bacillus anthracis. La respuesta correcta
Pregunta 1 El microorganismo responsable de la difteria faríngea es: a. Corynebacterium diphtheriae. b. Mycobacterium tuberculosis. c. Haemophilus influenzae. d. Bacillus anthracis. La respuesta correcta
Diario Oficial de la Unión Europea L 278/59. (Actos cuya publicación no es una condición para su aplicabilidad) COMISIÓN
 27.8.2004 Diario Oficial de la Unión Europea L 278/59 II (Actos cuya publicación no es una condición para su aplicabilidad) COMISIÓN DECISIÓN DE LA COMISIÓN de 23 de julio de 2004 por la que se modifica
27.8.2004 Diario Oficial de la Unión Europea L 278/59 II (Actos cuya publicación no es una condición para su aplicabilidad) COMISIÓN DECISIÓN DE LA COMISIÓN de 23 de julio de 2004 por la que se modifica
HPAI - Influenza aviar altamente patógena
 Influenza Aviar (AI) HPAI - Influenza aviar altamente patógena Lista A de la OIE (Enfermedad de declaración obligatoria) Directiva 92/40/CEE del Consejo Real decreto 1025/1993 BOE num.240 LPAI - Influenza
Influenza Aviar (AI) HPAI - Influenza aviar altamente patógena Lista A de la OIE (Enfermedad de declaración obligatoria) Directiva 92/40/CEE del Consejo Real decreto 1025/1993 BOE num.240 LPAI - Influenza
Pruebas diagnósticas basadas en la respuesta inmunitaria
 Pruebas diagnósticas basadas en la respuesta inmunitaria 1 Por qué utilizamos el diagnóstico inmunológico? El diagnóstico clínico no suele ser definitivo. Las lesiones histológicas pueden ser indicativas
Pruebas diagnósticas basadas en la respuesta inmunitaria 1 Por qué utilizamos el diagnóstico inmunológico? El diagnóstico clínico no suele ser definitivo. Las lesiones histológicas pueden ser indicativas
Clamidia MIF IgG. Características de rendimiento. Código del producto IF1250G Rev. J. No para su distribución en Estados Unidos
 Código del producto IF1250G Rev. J Características de rendimiento No para su distribución en Estados Unidos VALORES ESPERADOS Población con neumonía adquirida en la comunidad Dos investigadores externos
Código del producto IF1250G Rev. J Características de rendimiento No para su distribución en Estados Unidos VALORES ESPERADOS Población con neumonía adquirida en la comunidad Dos investigadores externos
REQUISITOS ZOOSANITARIOS DE LOS ESTADOS PARTES PARA LA IMPORTACIÓN DE CERDOS DOMÉSTICOS PARA REPRODUCCIÓN (DEROGACIÓN DE LA RES.
 MERCOSUR/GMC/RES. Nº 56/14 REQUISITOS ZOOSANITARIOS DE LOS ESTADOS PARTES PARA LA IMPORTACIÓN DE CERDOS DOMÉSTICOS PARA REPRODUCCIÓN (DEROGACIÓN DE LA RES. GMC N 19/97) VISTO: El Tratado de Asunción, el
MERCOSUR/GMC/RES. Nº 56/14 REQUISITOS ZOOSANITARIOS DE LOS ESTADOS PARTES PARA LA IMPORTACIÓN DE CERDOS DOMÉSTICOS PARA REPRODUCCIÓN (DEROGACIÓN DE LA RES. GMC N 19/97) VISTO: El Tratado de Asunción, el
Enfermedad de Transmisión por alimentos (ETA)
 Acumulado a la semana epidemiológica (SE) 27 (3 al 9 de julio del 2011) Para acceder al evento, haga clic en el nombre. Dengue Meningitis Varicela Leptospirosis Hepatitis A Infección Respiratoria Aguda
Acumulado a la semana epidemiológica (SE) 27 (3 al 9 de julio del 2011) Para acceder al evento, haga clic en el nombre. Dengue Meningitis Varicela Leptospirosis Hepatitis A Infección Respiratoria Aguda
Es la Influenza Aviar una verdadera amenaza para el país?: Aspectos epidemiológicos
 Es la Influenza Aviar una verdadera amenaza para el país?: Aspectos epidemiológicos Juan Raúl Zegarra Valencia, MV M en C XVII Congreso Nacional de Ciencias veterinarias Tacna-Perú Indice Distribución
Es la Influenza Aviar una verdadera amenaza para el país?: Aspectos epidemiológicos Juan Raúl Zegarra Valencia, MV M en C XVII Congreso Nacional de Ciencias veterinarias Tacna-Perú Indice Distribución
Barcelona, 15 de octubre de Ana I. Martínez Mateo SG Vigilància I Resposta a Emergències de Salut Pública Agència de Salut Pública de Catalunya
 Barcelona, 15 de octubre de 2015 Ana I. Martínez Mateo SG Vigilància I Resposta a Emergències de Salut Pública Agència de Salut Pública de Catalunya GRIPE AVIAR Enfermedad infecciosa de las aves, producida
Barcelona, 15 de octubre de 2015 Ana I. Martínez Mateo SG Vigilància I Resposta a Emergències de Salut Pública Agència de Salut Pública de Catalunya GRIPE AVIAR Enfermedad infecciosa de las aves, producida
Bursitis Infecciosa Aviar
 Bursitis Infecciosa Aviar (Enfermedad de Gumboro) ETIOLOGIA Bursitis Infecciosa Aviar Fam. Birnaviridae Aquabirnavirus virus de peces Entomobirnavirus virus de insectos Virus ds RNA, sin envuelta Aibi
Bursitis Infecciosa Aviar (Enfermedad de Gumboro) ETIOLOGIA Bursitis Infecciosa Aviar Fam. Birnaviridae Aquabirnavirus virus de peces Entomobirnavirus virus de insectos Virus ds RNA, sin envuelta Aibi
RESOLUCION 1285 Norma Sanitaria Andina para el comercio y la movilización intrasubregional y con terceros países de aves y sus productos
 RESOLUCION 1285 Norma Sanitaria Andina para el comercio y la movilización intrasubregional y con terceros países de aves y sus productos LA SECRETARIA GENERAL DE LA COMUNIDAD ANDINA, VISTOS: Los artículos
RESOLUCION 1285 Norma Sanitaria Andina para el comercio y la movilización intrasubregional y con terceros países de aves y sus productos LA SECRETARIA GENERAL DE LA COMUNIDAD ANDINA, VISTOS: Los artículos
Departamento de Sanidad Animal Ministerio de Agricultura, Ganadería y Abastecimiento Brasil
 Situación Epidemiologica de la EEB en Brasil Departamento de Sanidad Animal Ministerio de Agricultura, Ganadería y Abastecimiento Brasil Proteína normal (PrP c ) Sofre mudança na conformação e se converte
Situación Epidemiologica de la EEB en Brasil Departamento de Sanidad Animal Ministerio de Agricultura, Ganadería y Abastecimiento Brasil Proteína normal (PrP c ) Sofre mudança na conformação e se converte
SANTIAGO C O N S I D E R A N D O
 ESTABLECE EXIGENCIAS SANITARIAS PARA LA INTERNACIÓN A CHILE DE ESPECIES DE BOMBUS spp. SANTIAGO N / VISTOS: Lo dispuesto en la Ley N 18.755, Orgánica del Servicio Agrícola y Ganadero; la Ley N 18.164,
ESTABLECE EXIGENCIAS SANITARIAS PARA LA INTERNACIÓN A CHILE DE ESPECIES DE BOMBUS spp. SANTIAGO N / VISTOS: Lo dispuesto en la Ley N 18.755, Orgánica del Servicio Agrícola y Ganadero; la Ley N 18.164,
Situación Epidemiológica de la Fiebre Amarilla.
 Situación Epidemiológica de la Fiebre Amarilla. Para: Todas las Unidades de Vigilancia Epidemiológica del país y los Centros Estatales de Enlace para el Reglamento Sanitario Internacional. Estimados epidemiólogos,
Situación Epidemiológica de la Fiebre Amarilla. Para: Todas las Unidades de Vigilancia Epidemiológica del país y los Centros Estatales de Enlace para el Reglamento Sanitario Internacional. Estimados epidemiólogos,
VACUNAS Y PRINCIPALES ENFERMEDADES AVIARES. Ing. Agr. Roberto Olivero
 VACUNAS Y PRINCIPALES ENFERMEDADES AVIARES Ing. Agr. Roberto Olivero Vacunas 1.Definición: Vacunar es estimular el sistema inmunitario del ave para que cuando ingrese el patógeno ésta pueda impedir la
VACUNAS Y PRINCIPALES ENFERMEDADES AVIARES Ing. Agr. Roberto Olivero Vacunas 1.Definición: Vacunar es estimular el sistema inmunitario del ave para que cuando ingrese el patógeno ésta pueda impedir la
Detección de un brote de Influenza AH1N1 en aves reproductoras de pavos, Comunas de Nogales y Quilpue, Región de Valparaíso.
 Detección de un brote de Influenza AH1N1 en aves reproductoras de pavos, Comunas de Nogales y Quilpue, Región de Valparaíso. Informe Epidemiológico al 01.09.09. 1. Resumen del evento: 1.1 Con fecha 28
Detección de un brote de Influenza AH1N1 en aves reproductoras de pavos, Comunas de Nogales y Quilpue, Región de Valparaíso. Informe Epidemiológico al 01.09.09. 1. Resumen del evento: 1.1 Con fecha 28
ENFERMEDAD DE NEWCASTLE: GRAN PROBLEMA DE LA AVICULTURA ECUATORIANA. QUE HACER?
 ENFERMEDAD DE NEWCASTLE: GRAN PROBLEMA DE LA AVICULTURA ECUATORIANA. QUE HACER? Dr. Manuel Enrique Acosta J. INTRODUCCION La enfermedad de Newcastle (EN), es causada por un paramyxovirus aviar, el cual
ENFERMEDAD DE NEWCASTLE: GRAN PROBLEMA DE LA AVICULTURA ECUATORIANA. QUE HACER? Dr. Manuel Enrique Acosta J. INTRODUCCION La enfermedad de Newcastle (EN), es causada por un paramyxovirus aviar, el cual
Salmonella entérica serotipo Typhi, Semana epidemiológica 38, 2011.
 Salmonella entérica serotipo Typhi, 2-211. Semana epidemiológica 38, 211. Este reporte considera los casos confirmados de Salmonella Typhi recibidos hasta la semana 38, que finaliza el sábado 24 de septiembre
Salmonella entérica serotipo Typhi, 2-211. Semana epidemiológica 38, 211. Este reporte considera los casos confirmados de Salmonella Typhi recibidos hasta la semana 38, que finaliza el sábado 24 de septiembre
Leptospirosis: un problema o una verdad incómoda? por Dra. Blanca Herrera Medico Veterinario
 Leptospirosis: un problema o una verdad incómoda? por Dra. Blanca Herrera Medico Veterinario blan@adinet.com.uy La leptospirosis es una enfermedad producida por una bacteria llamada leptospira spp. Esta
Leptospirosis: un problema o una verdad incómoda? por Dra. Blanca Herrera Medico Veterinario blan@adinet.com.uy La leptospirosis es una enfermedad producida por una bacteria llamada leptospira spp. Esta
Proyecto internacional multinacional de investigación :
 Proyecto internacional multinacional de investigación : Interacción humano-animal y vigilancia de vectores en zonas de transmisión propensas a virus Zika. Introducción. El virus Zika (ZIKV) inicio su actividad
Proyecto internacional multinacional de investigación : Interacción humano-animal y vigilancia de vectores en zonas de transmisión propensas a virus Zika. Introducción. El virus Zika (ZIKV) inicio su actividad
INFORME BENEFICIO Y HALLAZGOS PATOLÓGICOS EN MATADEROS NACIONALES 2015
 INFORME BENEFICIO Y HALLAZGOS PATOLÓGICOS EN MATADEROS NACIONALES 2015 Abril 2016 DEPARTAMENTO DE SANIDAD ANIMAL SUBDEPARTAMENTO DE VIGILACIA Y CONTROL DE ENFERMEDADES DIVISIÓN DE PROTECCIÓN PECUARIA SERVICIO
INFORME BENEFICIO Y HALLAZGOS PATOLÓGICOS EN MATADEROS NACIONALES 2015 Abril 2016 DEPARTAMENTO DE SANIDAD ANIMAL SUBDEPARTAMENTO DE VIGILACIA Y CONTROL DE ENFERMEDADES DIVISIÓN DE PROTECCIÓN PECUARIA SERVICIO
REQUISITOS ZOOSANITARIOS PARA LA IMPORTACIÓN DE ÉQUIDOS PARA FAENA INMEDIATA DESTINADOS A LOS ESTADOS PARTES
 MERCOSUR/GMC/RES Nº 43/07 REQUISITOS ZOOSANITARIOS PARA LA IMPORTACIÓN DE ÉQUIDOS PARA FAENA INMEDIATA DESTINADOS A LOS ESTADOS PARTES VISTO: El Tratado de Asunción, el Protocolo de Ouro Preto y la Decisión
MERCOSUR/GMC/RES Nº 43/07 REQUISITOS ZOOSANITARIOS PARA LA IMPORTACIÓN DE ÉQUIDOS PARA FAENA INMEDIATA DESTINADOS A LOS ESTADOS PARTES VISTO: El Tratado de Asunción, el Protocolo de Ouro Preto y la Decisión
Conceptos básicos de epidemiología en sanidad acuícola
 Espacio para foto o imagen Conceptos básicos de epidemiología en sanidad acuícola DR. ASSAD HENEIDI ZECKUA TRIADA EPIDEMIOLOGICA Agente Etiológico. Microorganismo que por presencia o ausencia, es condición
Espacio para foto o imagen Conceptos básicos de epidemiología en sanidad acuícola DR. ASSAD HENEIDI ZECKUA TRIADA EPIDEMIOLOGICA Agente Etiológico. Microorganismo que por presencia o ausencia, es condición
7/19/2013. Dr. Marcos X. Sanchez-Plata, 2013 Agentes Patógenos Complejo respiratorio crónico: Afectan calidad y rendimiento.
 Sanidad Animal en la Producción Avícola Ericka Calderón S. Médico Veterinario IICA Agentes Patógenos Complejo respiratorio crónico: Afectan calidad y rendimiento. Origen bacteriano: Mycoplasma E. coli
Sanidad Animal en la Producción Avícola Ericka Calderón S. Médico Veterinario IICA Agentes Patógenos Complejo respiratorio crónico: Afectan calidad y rendimiento. Origen bacteriano: Mycoplasma E. coli
Resumen de la situación de enfermedades respiratorias 2011 Semana Epidemiológica 1 39 (del 25 de septiembre al 1 de octubre)
 Resumen de la situación de enfermedades respiratorias 211 Semana Epidemiológica 1 39 (del 25 de septiembre al 1 de octubre) Presentación Las enfermedades respiratorias representan una de las primeras causas
Resumen de la situación de enfermedades respiratorias 211 Semana Epidemiológica 1 39 (del 25 de septiembre al 1 de octubre) Presentación Las enfermedades respiratorias representan una de las primeras causas
VIRUELA AVIAR EN PONEDORAS: UN RESUMEN
 VIRUELA AVIAR EN PONEDORAS: UN RESUMEN Volver a: Enfermedades de las aves Boletín técnico de Hy-Line. 2016. El Sitio Avícola.com. www.produccion-animal.com.ar INTRODUCCIÓN La viruela aviar es una enfermedad
VIRUELA AVIAR EN PONEDORAS: UN RESUMEN Volver a: Enfermedades de las aves Boletín técnico de Hy-Line. 2016. El Sitio Avícola.com. www.produccion-animal.com.ar INTRODUCCIÓN La viruela aviar es una enfermedad
Aves domésticas de la República Argentina
 INFORME 2014 Aves domésticas de la República Argentina Programa de Aves y Animales de Granja - Dirección de Programación Sanitaria Dirección Nacional de Sanidad Animal CONTENIDO 1. INTRODUCCIÓN... 2 2.
INFORME 2014 Aves domésticas de la República Argentina Programa de Aves y Animales de Granja - Dirección de Programación Sanitaria Dirección Nacional de Sanidad Animal CONTENIDO 1. INTRODUCCIÓN... 2 2.
La prevención frente a la rinoneumonitis equina. guía de prevención
 02 La prevención frente a la rinoneumonitis equina guía de prevención Qué es la rinoneumonitis equina? La rinoneumonitis equina es una enfermedad vírica contagiosa producida por los herpesvirus equino
02 La prevención frente a la rinoneumonitis equina guía de prevención Qué es la rinoneumonitis equina? La rinoneumonitis equina es una enfermedad vírica contagiosa producida por los herpesvirus equino
Situación sanitaria equina en Chile. Resultados vigilancia epidemiológica, primer semestre del 2011
 Situación sanitaria equina en Chile Resultados vigilancia epidemiológica, primer semestre del 2011 1 INTRODUCCIÓN La vigilancia epidemiológica en el rubro se realiza sobre la Familia equidae, y contempla
Situación sanitaria equina en Chile Resultados vigilancia epidemiológica, primer semestre del 2011 1 INTRODUCCIÓN La vigilancia epidemiológica en el rubro se realiza sobre la Familia equidae, y contempla
Sala de Situación Dengue Hasta SE 16 REGIÓN SANITARIA VI 2013
 Sala de Situación Dengue Hasta SE 6 REGIÓN SANITARIA VI 23 Área de Epidemiología- Región Sanitaria VI epidemiologia6@yahoo.com.ar 4244-898 Definición de Caso Caso sospechoso de dengue clásico: Toda persona
Sala de Situación Dengue Hasta SE 6 REGIÓN SANITARIA VI 23 Área de Epidemiología- Región Sanitaria VI epidemiologia6@yahoo.com.ar 4244-898 Definición de Caso Caso sospechoso de dengue clásico: Toda persona
Clínico, Pruebas básicas de laboratorio (ej. parasitología, bacteriología, micología, histopatología)
 Influenza aviar altamente patógena, México Imprimir Cerrar Información recibida el 09/01/2013 desde Dr Hugo Fragoso Sánchez, Director general de salud animal, Servicio nacional de sanidad, inocuidad y
Influenza aviar altamente patógena, México Imprimir Cerrar Información recibida el 09/01/2013 desde Dr Hugo Fragoso Sánchez, Director general de salud animal, Servicio nacional de sanidad, inocuidad y
CAPACITACION ACREDITACION DE TERCEROS PARA LA REALIZACION DE MUESTREOS EN EL MARCO DEL PROGRAMA OFICIAL PARA EL CONTROL DE PPV- D
 CAPACITACION ACREDITACION DE TERCEROS PARA LA REALIZACION DE MUESTREOS EN EL MARCO DEL PROGRAMA OFICIAL PARA EL CONTROL DE PPV- D ANTECEDENTES GENERALES Y CONTROL OBLIGATORIO PLUM POX VIRUS (PPV) MARCO
CAPACITACION ACREDITACION DE TERCEROS PARA LA REALIZACION DE MUESTREOS EN EL MARCO DEL PROGRAMA OFICIAL PARA EL CONTROL DE PPV- D ANTECEDENTES GENERALES Y CONTROL OBLIGATORIO PLUM POX VIRUS (PPV) MARCO
MINISTERIO DEL AMBIENTE Y LOS RECURSOS NATURALES (MARENA) INFORME NACIONAL CITES NICARAGUA NOVIEMBRE 2004
 MINISTERIO DEL AMBIENTE Y LOS RECURSOS NATURALES (MARENA) INFORME NACIONAL CITES 2003 - NICARAGUA NOVIEMBRE 2004 Tabla Página I- INTRODUCCION 4 II- CLASIFICACION DE EXPORTACIONES AUTORIZADAS 5 Mascota
MINISTERIO DEL AMBIENTE Y LOS RECURSOS NATURALES (MARENA) INFORME NACIONAL CITES 2003 - NICARAGUA NOVIEMBRE 2004 Tabla Página I- INTRODUCCION 4 II- CLASIFICACION DE EXPORTACIONES AUTORIZADAS 5 Mascota
Si desea ampliar la información de estos y otros eventos pueden consultar en nuestro sitio Web medellin.gov.co/salud
 Boletín Epidemiológico Boletín número 3, año 2013 Presentación El Boletín Epidemiológico Medellín, Ciudad Saludable es una publicación de la Secretaría de Salud de Medellín, que pretende ofrecer a los
Boletín Epidemiológico Boletín número 3, año 2013 Presentación El Boletín Epidemiológico Medellín, Ciudad Saludable es una publicación de la Secretaría de Salud de Medellín, que pretende ofrecer a los
LILIANA PATIÑO CLINICA VERSALLES- URGENCIAS FEBRERO 2010
 LILIANA PATIÑO CLINICA VERSALLES- URGENCIAS FEBRERO 2010 Es una enfermedad febril aguda, de origen viral, transmitida por la picadura de mosquitos Aedes Aegypti y Aedes Albopictus infectados con el virus
LILIANA PATIÑO CLINICA VERSALLES- URGENCIAS FEBRERO 2010 Es una enfermedad febril aguda, de origen viral, transmitida por la picadura de mosquitos Aedes Aegypti y Aedes Albopictus infectados con el virus
VIGILANCIA EPIDEMIOLOGICA SINDROME FEBRIL. Agosto 2012
 VIGILANCIA EPIDEMIOLOGICA SINDROME FEBRIL Agosto 2012 ANTECEDENTES Las enfermedades infecciosas siguen constituyendo un serio problema de salud pública en el país. Un grupo de ellas como el Dengue, malaria,
VIGILANCIA EPIDEMIOLOGICA SINDROME FEBRIL Agosto 2012 ANTECEDENTES Las enfermedades infecciosas siguen constituyendo un serio problema de salud pública en el país. Un grupo de ellas como el Dengue, malaria,
Estimación de las consecuencias sanitarias de epidemias animales. Caso práctico con PPC.
 Estimación de las consecuencias sanitarias de epidemias animales. Caso práctico con PPC. Curso de gestión de alertas sanitarias RASVE-MAGRAMA, 10/06/2015 E. Fernández Carrión 1, M. Martínez Avilés 1 1
Estimación de las consecuencias sanitarias de epidemias animales. Caso práctico con PPC. Curso de gestión de alertas sanitarias RASVE-MAGRAMA, 10/06/2015 E. Fernández Carrión 1, M. Martínez Avilés 1 1
MEDICINA DE LA CONSERVACIÓN Y ENFERMEDADES EMERGENTES
 MEDICINA DE LA CONSERVACIÓN Y ENFERMEDADES C. Bonacic Medicina de la Conservación (CCM) El objetivo es avanzar en el conocimiento de la biodiversidad del planeta y la salud de los ecosistemas a través
MEDICINA DE LA CONSERVACIÓN Y ENFERMEDADES C. Bonacic Medicina de la Conservación (CCM) El objetivo es avanzar en el conocimiento de la biodiversidad del planeta y la salud de los ecosistemas a través
Si ahorita empezamos, desde ya la evitamos
 Un Ministerio en el Aula Abogacía el abc DE LA GRIPE AVIAR DE LA GRIPE AVIAR Si ahorita empezamos, desde ya la evitamos Nicaragua libre de gripe a iar FOLLETO EL ABC DE LOS MENSAJES BASICOS A COMUNICAR
Un Ministerio en el Aula Abogacía el abc DE LA GRIPE AVIAR DE LA GRIPE AVIAR Si ahorita empezamos, desde ya la evitamos Nicaragua libre de gripe a iar FOLLETO EL ABC DE LOS MENSAJES BASICOS A COMUNICAR
CCV Ag / CPV Ag. SensPERT CONCEPTO SENSPERT
 SensPERT CCV Ag / CPV Ag CONCEPTO SENSPERT La línea de diagnóstico SensPERT de Rapid Test proporciona una solución rápida, específica y fiable para los médicos veterinarios en su práctica clínica diaria
SensPERT CCV Ag / CPV Ag CONCEPTO SENSPERT La línea de diagnóstico SensPERT de Rapid Test proporciona una solución rápida, específica y fiable para los médicos veterinarios en su práctica clínica diaria
Vigilancia epidemiológica. Dra. M Teresa Valenzuela Jefa Depto. Salud Pública y Epidemiología Universidad de los Andes
 Vigilancia epidemiológica Dra. M Teresa Valenzuela Jefa Depto. Salud Pública y Epidemiología Universidad de los Andes Contenidos Presentación Vigilancia en Salud Pública. Significado Modelo Vigilancia
Vigilancia epidemiológica Dra. M Teresa Valenzuela Jefa Depto. Salud Pública y Epidemiología Universidad de los Andes Contenidos Presentación Vigilancia en Salud Pública. Significado Modelo Vigilancia
Sanidad - Enfermedades Virales Los virus son parásitos intracelulares obligados
 Sanidad - Enfermedades Virales Los virus son parásitos intracelulares obligados Están formados por un núcleo o genoma de ADN o ARN, una cápside proteica que los recubre (nucleocápside) y algunos poseen
Sanidad - Enfermedades Virales Los virus son parásitos intracelulares obligados Están formados por un núcleo o genoma de ADN o ARN, una cápside proteica que los recubre (nucleocápside) y algunos poseen
Aves Migratoria y Gripe Aviar. Gilberto Real FAO/SLM
 Aves Migratoria y Gripe Aviar Gilberto Real FAO/SLM Consideraciones La gripe aviar constituye una grave amenaza para los pequeños avicultores rurales, de manera directa debido a la mortandad en aves que
Aves Migratoria y Gripe Aviar Gilberto Real FAO/SLM Consideraciones La gripe aviar constituye una grave amenaza para los pequeños avicultores rurales, de manera directa debido a la mortandad en aves que
Avances en Conocimiento y Conservación del Gato Guiña (Leopardus guigna) & Zorro de Darwin (Lycalopex fulvipes)
 Avances en Conocimiento y Conservación del Gato Guiña (Leopardus guigna) & Zorro de Darwin (Lycalopex fulvipes) Fernando Vidal M. Unidad de Conservación y Fauna Silvestre. Escuela de Medicina Veterinaria.
Avances en Conocimiento y Conservación del Gato Guiña (Leopardus guigna) & Zorro de Darwin (Lycalopex fulvipes) Fernando Vidal M. Unidad de Conservación y Fauna Silvestre. Escuela de Medicina Veterinaria.
Situación de la Anemia Infecciosa Equina en establecimientos de Deporte y Recreación en la República Argentina durante el 2015
 Situación de la Anemia Infecciosa Equina en establecimientos de Deporte y Recreación en la República Argentina durante el 2015 Introducción La AIE es una enfermedad infecciosa transmisible producida por
Situación de la Anemia Infecciosa Equina en establecimientos de Deporte y Recreación en la República Argentina durante el 2015 Introducción La AIE es una enfermedad infecciosa transmisible producida por
Sirex noctilio (Hym.: Siricidae) Situación y Marco Regulatorio en Chile.
 Sirex noctilio (Hym.: Siricidae) Situación y Marco Regulatorio en Chile. Marcos Beèche C. Ingeniero Forestal, Magister en Ciencias Encargado Nacional Programa Control Oficial Sirex noctilio SubDepto. Sanidad
Sirex noctilio (Hym.: Siricidae) Situación y Marco Regulatorio en Chile. Marcos Beèche C. Ingeniero Forestal, Magister en Ciencias Encargado Nacional Programa Control Oficial Sirex noctilio SubDepto. Sanidad
Update on the AI situation in Hispaniola SITUACION DE LA INFLUENZA EN REPUBLICA DOMINICANA
 Update on the AI situation in Hispaniola SITUACION DE LA INFLUENZA EN REPUBLICA DOMINICANA V Meeting of the Carib VET Steering committee Hotel Embajador Dominican Republic Ministerio de Agricultura Dirección
Update on the AI situation in Hispaniola SITUACION DE LA INFLUENZA EN REPUBLICA DOMINICANA V Meeting of the Carib VET Steering committee Hotel Embajador Dominican Republic Ministerio de Agricultura Dirección
BOLETÍN PUNTO INFORMATIVO EXTRAORDINARIO VIGILANCIA DE LA INFECCIÓN RESPIRATORIA AGUDA GRAVE Y ENFERMEDAD SIMILAR A INFLUENZA
 BOLETÍN PUNTO INFORMATIVO EXTRAORDINARIO VIGILANCIA DE LA INFECCIÓN RESPIRATORIA AGUDA GRAVE Y ENFERMEDAD SIMILAR A INFLUENZA La actividad de Influenza, tanto en Estados Unidos como Canadá, continua siendo
BOLETÍN PUNTO INFORMATIVO EXTRAORDINARIO VIGILANCIA DE LA INFECCIÓN RESPIRATORIA AGUDA GRAVE Y ENFERMEDAD SIMILAR A INFLUENZA La actividad de Influenza, tanto en Estados Unidos como Canadá, continua siendo
Es la Influenza Aviar una verdadera amenaza para el país?: Aspectos epidemiológicos. Juan Raúl Zegarra Valencia, MV M en C
 Es la Influenza Aviar una verdadera amenaza para el país?: Aspectos epidemiológicos Juan Raúl Zegarra Valencia, MV M en C Indice Distribución geográfica y cronológica Impacto económico Factores de riesgo:
Es la Influenza Aviar una verdadera amenaza para el país?: Aspectos epidemiológicos Juan Raúl Zegarra Valencia, MV M en C Indice Distribución geográfica y cronológica Impacto económico Factores de riesgo:
Situación Epidemiológica de Fiebre Amarilla.
 Situación Epidemiológica de Fiebre Amarilla. Para: Todas las Unidades de Vigilancia Epidemiológica del país y los Centros Estatales de Enlace para el Reglamento Sanitario Internacional. Estimados epidemiólogos,
Situación Epidemiológica de Fiebre Amarilla. Para: Todas las Unidades de Vigilancia Epidemiológica del país y los Centros Estatales de Enlace para el Reglamento Sanitario Internacional. Estimados epidemiólogos,
Introducción a la Epidemiología. Dr. Fernando Arrieta Dpto. Inmunizaciones CHLA-EP
 Introducción a la Epidemiología Dr. Fernando Arrieta Dpto. Inmunizaciones CHLA-EP Salud: Definición OMS (1946) La salud es el completo estado de bienestar físico, mental y social, y no la mera ausencia
Introducción a la Epidemiología Dr. Fernando Arrieta Dpto. Inmunizaciones CHLA-EP Salud: Definición OMS (1946) La salud es el completo estado de bienestar físico, mental y social, y no la mera ausencia
Cadena Epidemiológica
 Cadena Epidemiológica Para que ocurra una enfermedad debe darse una serie de acontecimientos o hechos que faciliten dicha enfermedad, estos hechos constituyen la llamada triada ecológica, compuesta por
Cadena Epidemiológica Para que ocurra una enfermedad debe darse una serie de acontecimientos o hechos que faciliten dicha enfermedad, estos hechos constituyen la llamada triada ecológica, compuesta por
Centro de prensa Hepatitis E
 Centro de prensa Hepatitis E Nota descriptiva N. 280 Junio de 2014 Datos y cifras Cada año se registran unos 20 millones de casos de infección por el virus de la hepatitis E, más de tres millones de casos
Centro de prensa Hepatitis E Nota descriptiva N. 280 Junio de 2014 Datos y cifras Cada año se registran unos 20 millones de casos de infección por el virus de la hepatitis E, más de tres millones de casos
Epidemiología veterinaria
 Epidemiología veterinaria Michael Thrusfield Department of Animal Health Royal School of Veterinary Studies University of Edinburgh Editorial ACRIBIA, S. A. ZARAGOZA (España) Contenido PREFACIO Capítulo
Epidemiología veterinaria Michael Thrusfield Department of Animal Health Royal School of Veterinary Studies University of Edinburgh Editorial ACRIBIA, S. A. ZARAGOZA (España) Contenido PREFACIO Capítulo
Moquillo. Tomado de Club Pastor Alemán. jueves, 24 de marzo de 2011 Modificado el jueves, 24 de marzo de 2011
 Moquillo. Tomado de Club Pastor Alemán. jueves, 24 de marzo de 2011 Modificado el jueves, 24 de marzo de 2011 Moquillo El moquillo, también conocido como distemper, en la literatura inglesa, o enfermedad
Moquillo. Tomado de Club Pastor Alemán. jueves, 24 de marzo de 2011 Modificado el jueves, 24 de marzo de 2011 Moquillo El moquillo, también conocido como distemper, en la literatura inglesa, o enfermedad
Número 41 Volumen 30 Semana 41 Del 6 al 12 de octubre del 2013
 Número 41 Volumen 30 Semana 41 Del 6 al 12 de octubre del 2013 Casos de notificación inmediata y semanal pág. 6 Casos por entidad federativa: enfermedades prevenibles por vacunación pág. 7 infecciosas
Número 41 Volumen 30 Semana 41 Del 6 al 12 de octubre del 2013 Casos de notificación inmediata y semanal pág. 6 Casos por entidad federativa: enfermedades prevenibles por vacunación pág. 7 infecciosas
EVOLUCION DEL VIH-SIDA CHILE, Departamento de Epidemiología Septiembre 2009
 EVOLUCION DEL VIH-SIDA CHILE, 1984-2008 Departamento de Epidemiología Septiembre 2009 1 EVOLUCION DEL VIH-SIDA CHILE, 1984-2008 En Chile la epidemia de VIH-SIDA se inició en 1984, con la detección de 6
EVOLUCION DEL VIH-SIDA CHILE, 1984-2008 Departamento de Epidemiología Septiembre 2009 1 EVOLUCION DEL VIH-SIDA CHILE, 1984-2008 En Chile la epidemia de VIH-SIDA se inició en 1984, con la detección de 6
REGISTRO Y CONTROL DE PRODUCTOS FARMACEUTICOS DE USO VETERINARIO MANUAL DE PROCEDIMIENTOS Nº2 FARMA/MP2
 Página 1 de 7 REGISTRO Y CONTROL DE PRODUCTOS FARMACEUTICOS DE USO VETERINARIO MANUAL DE PROCEDIMIENTOS Nº2 DIVISION PROTECCION PECUARIA SERVICIO AGRÍCOLA Y GANADERO -CHILE Página 2 de 7 INDICE I. INTRODUCCIÓN
Página 1 de 7 REGISTRO Y CONTROL DE PRODUCTOS FARMACEUTICOS DE USO VETERINARIO MANUAL DE PROCEDIMIENTOS Nº2 DIVISION PROTECCION PECUARIA SERVICIO AGRÍCOLA Y GANADERO -CHILE Página 2 de 7 INDICE I. INTRODUCCIÓN
AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública
 Fiebre Amarilla AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública La fiebre amarilla es una infección aguda causada por un Arbovirus del género flavivirus, transmitida por la picadura
Fiebre Amarilla AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública La fiebre amarilla es una infección aguda causada por un Arbovirus del género flavivirus, transmitida por la picadura
