ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
|
|
|
- Irene María Jesús Soto Torregrosa
- hace 6 años
- Vistas:
Transcripción
1 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1
2 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas. 1. NOMBRE DEL MEDICAMENTO ADCETRIS 50 mg polvo para concentrado para solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene 50 mg de brentuximab vedotina. Tras la reconstitución (ver sección 6.6), cada ml contiene 5 mg de brentuximab vedotina. ADCETRIS es un anticuerpo conjugado formado por un anticuerpo monoclonal dirigido contra CD30 (inmunoglobulina G1 [IgG1] quimérica recombinante, producida mediante tecnología de ADN recombinante en células de ovario de hámster chino) que se une de forma covalente al agente antimicrotúbulos monometil auristatina E (MMAE). Excipientes con efecto conocido Cada vial contiene aproximadamente 13,2 mg de sodio. Para consultar la lista completa de excipientes, ver sección FORMA FARMACÉUTICA Polvo para concentrado para solución para perfusión. Pasta o polvo de color blanco o blanquecino. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas ADCETRIS está indicado para el tratamiento de pacientes adultos con linfoma de Hodgkin (LH) CD30+ en recaída o refractario: 1. después de trasplante autólogo de células madre o 2. después de al menos dos tratamientos previos cuando el trasplante autólogo de células madre o la poliquimioterapia no es una opción terapéutica. ADCETRIS está indicado para el tratamiento de pacientes adultos con LH CD30+ con mayor riesgo de recaída o progresión después de un trasplante autólogo de células madre (ver sección 5.1). ADCETRIS está indicado para el tratamiento de pacientes adultos con linfoma anaplásico de células grandes (LACG) sistémico en recaída o refractario. 4.2 Posología y forma de administración Brentuximab vedotina debe administrarse bajo la supervisión de un médico con experiencia en el uso de fármacos antineoplásicos. 2
3 Posología La dosis recomendada es de 1,8 mg/kg, administrados en perfusión intravenosa a lo largo de 30 minutos cada 3 semanas. La dosis de inicio recomendada para el retratamiento de pacientes con LH en recaída o refractario o LACG sistémico que previamente respondieron al tratamiento con ADCETRIS es de 1,8 mg/kg administrados en perfusión intravenosa a lo largo de 30 minutos cada 3 semanas. De forma alternativa, el tratamiento se puede iniciar con la última dosis tolerada (véase sección 5.1). Insuficiencia renal La dosis recomendada de inicio de tratamiento en pacientes con insuficiencia renal grave es 1,2 mg/kg administrados en perfusión intravenosa a lo largo de 30 minutos cada 3 semanas. Los pacientes con insuficiencia renal deben ser vigilados estrechamente debido a los efectos adversos (ver sección 5.2). Insuficiencia hepática La dosis recomendada de inicio de tratamiento en pacientes con insuficiencia hepática grave es 1,2 mg/kg administrados en perfusión intravenosa a lo largo de 30 minutos cada 3 semanas. Los pacientes con insuficiencia hepática deben ser vigilados estrechamente debido a los efectos adversos (ver sección 5.2). Si el paciente pesa más de 100 kg, la dosis debe calcularse basándose en un peso de 100 kg (ver sección 6.6). Debe vigilarse el hemograma completo antes de administrar cada dosis de este tratamiento (ver sección 4.4). Se debe vigilar a los pacientes durante y después de la perfusión (ver sección 4.4). Debe continuarse el tratamiento hasta que se produzca una progresión de la enfermedad o una toxicidad inaceptable (ver sección 4.4). Los pacientes con LH en recaída o refractario o LACG que logren un resultado de enfermedad estable o mejoría deben recibir un mínimo de 8 ciclos y un máximo de hasta 16 ciclos (aproximadamente 1 año) (ver sección 5.1). En los pacientes con LH con mayor riesgo de recaída o progresión después de un trasplante autólogo de células madre, el tratamiento con ADCETRIS debe iniciarse tras recuperación del trasplante autólogo de células madre atendiendo al juicio clínico. Estos pacientes deben recibir hasta 16 ciclos (ver sección 5.1). Ajustes de dosis Neutropenia Si aparece neutropenia durante el tratamiento, ésta debe controlarse mediante aplazamientos de la dosis. Véanse en la tabla 1 siguiente las recomendaciones posológicas adecuadas (ver también sección 4.4). 3
4 Tabla 1: Recomendaciones de administración en caso de neutropenia Grado de intensidad de la neutropenia (signos y síntomas [descripción abreviada de los CTCAE a ]) Grado 1 (<LIN-1500/mm 3 <LIN-1, /l) o Grado 2 (< /mm 3 <1,5-1, /l) Grado 3 (< /mm 3 <1,0-0, /l) o Grado 4 (<500/mm 3 <0, /l) a. b. Modificación del régimen de administración Continuar con la misma dosis y régimen Aplazar la dosis hasta la disminución de la toxicidad a un grado 2 o al estado basal y reanudar luego el tratamiento con la misma dosis y régimen b. Considerar el apoyo con factores de crecimiento (G-CSF o GM-CSF) en ciclos posteriores en los pacientes que desarrollen neutropenia de grado 3 o 4. Gradación basada en los Criterios terminológicos comunes para acontecimientos adversos (CTCAE) del National Cancer Institute (NCI), v3.0; véase Neutrófilos/granulocitos; LIN = límite inferior normal. Los pacientes que desarrollen linfopenia de grado 3 ó 4 pueden continuar el tratamiento sin interrupción. Neuropatía periférica Si durante el tratamiento aparece o empeora una neuropatía sensorial o motora periférica, véanse las recomendaciones posológicas apropiadas en la tabla 2 siguiente (ver sección 4.4). Tabla 2: Recomendaciones de administración en caso de neuropatía sensorial o motora periférica nueva o agravada Gravedad de la neuropatía sensorial o motora periférica Modificación de la dosis y (signos y síntomas [descripción abreviada de los CTCAE a ]) del régimen Grado 1 (parestesia y/o pérdida de reflejos sin pérdida de función) Continuar con la misma dosis y régimen Grado 2 (interfiere en la función pero no en las actividades de la vida Aplazar la dosis hasta la diaria) o disminución de la toxicidad Grado 3 (interfiere en las actividades de la vida diaria) a un grado 1 o al estado basal y reiniciar luego el tratamiento a una dosis reducida de 1,2 mg/kg cada 3 semanas Grado 4 (neuropatía sensorial incapacitante, o neuropatía motora que Interrumpir el tratamiento amenaza la vida u origina parálisis) a. Gradación basada en los Criterios terminológicos comunes para acontecimientos adversos (CTCAE) del National Cancer Institute (NCI), v3.0; véanse neuropatía: motora; neuropatía: sensorial, y dolor neuropático. Pacientes de edad avanzada No se han establecido la seguridad y la eficacia en pacientes de edad avanzada de 65 o más años de edad. No se dispone de datos. 4
5 Población pediátrica No se han establecido aún la seguridad y la eficacia en niños menores de 18 años. No se dispone de datos. Se ha observado depleción del timo en estudios no clínicos (ver sección 5.3). Forma de administración La dosis recomendada de ADCETRIS se perfunde en 30 minutos. Para consultar las instrucciones de reconstitución y dilución del medicamento antes de la administración, ver sección 6.6. Brentuximab vedotina no se debe administrar en inyección intravenosa rápida o en bolo. Brentuximab vedotina se debe administrar a través de una vía intravenosa específica y no debe mezclarse con otros medicamentos (ver sección 6.2). 4.3 Contraindicaciones Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1. El uso combinado de bleomicina y brentuximab vedotina causa toxicidad pulmonar. 4.4 Advertencias y precauciones especiales de empleo Leucoencefalopatía multifocal progresiva La reactivación del virus de John Cunningham (VJC), que provoca la aparición de leucoencefalopatía multifocal progresiva (LMP) y muerte, puede ocurrir en pacientes tratados con brentuximab vedotina. Se ha notificado LMP en pacientes que recibían este tratamiento después de varios regímenes quimioterapéuticos previos. La LMP es una enfermedad desmielinizante rara del sistema nervioso central originada por la reactivación del VJC latente y es a menudo mortal. Se debe vigilar estrechamente a los pacientes en busca de la aparición o empeoramiento de signos o síntomas neurológicos, cognitivos o conductuales, que pueden sugerir la presencia de LMP. En cualquier caso con sospecha de LMP debe suspenderse la administración de brentuximab vedotina. La evaluación sugerida de la LMP comprende una consulta neurológica, resonancia magnética cerebral con gadolinio y análisis de ADN del VJC en el líquido cefalorraquídeo mediante reacción en cadena de la polimerasa o una biopsia cerebral con indicios del VJC. Una RCP del VJC negativa no descarta la LMP. Si no puede establecerse un diagnóstico alternativo, el seguimiento y la evaluación adicionales pueden estar justificados. La administración de brentuximab vedotina debe interrumpirse permanentemente si se confirma el diagnóstico de LMP. El médico debe estar especialmente alerta a los síntomas indicativos de LMP que el paciente pueda no observar (p. ej., síntomas cognitivos, neurológicos o psiquiátricos). Pancreatitis Se ha observado pancreatitis aguda en pacientes tratados con brentuximab vedotina. Se ha notificado algún caso mortal. Se debe vigilar de cerca a los pacientes que presenten o empeoren un dolor abdominal, que pueda sugerir pancreatitis aguda. La evaluación del paciente puede incluir un examen físico, análisis de laboratorio para evaluar la amilasa y la lipasa séricas, y estudios de imagen abdominal, como ecografía y otros métodos diagnósticos adecuados. Se debe evaluar el uso de brentuximab vedotina en cualquier 5
6 caso de sospecha de pancreatitis aguda. Si se confirma el diagnóstico de pancreatitis aguda se debe suspender el tratamiento con brentuximab vedotina. Toxicidad pulmonar Se han notificado algunos casos de toxicidad pulmonar, entre los que se incluyen neumonitis, enfermedad pulmonar intersticial, síndrome de dificultad respiratoria aguda (SDRA), algunos con desenlace mortal, en pacientes tratados con brentuximab vedotina. Aunque no se ha establecido una asociación causal con el uso de brentuximab vedotina, no se puede descartar el riesgo de toxicidad pulmonar. En caso de aparición o empeoramiento de síntomas pulmonares (ej. tos, disnea), se debe evaluar rápidamente el diagnóstico y tratar de forma conveniente a los pacientes. Se debe considerar la posibilidad de continuar con la medicación con brentuximab vedotina durante la evaluación y hasta que haya mejoría sintomática. Infecciones graves y oportunistas Se han notificado infecciones graves como neumonía, bacteriemia estafilocócica, sepsis/shock séptico (incluyendo desenlaces mortales) y herpes zoster, e infecciones oportunistas como neumonía por Pneumocystis jiroveci y candidiasis oral, en pacientes tratados con brentuximab vedotina. Debe vigilarse atentamente a los pacientes durante el tratamiento en busca de posibles infecciones graves y oportunistas. Reacciones relacionadas con la perfusión Se han notificado reacciones relacionadas con la perfusión (RRP) inmediatas y retardadas, así como reacciones anafilácticas. Debe vigilarse cuidadosamente a los pacientes durante y después de la perfusión. Si se produce una reacción anafiláctica, se debe interrumpir inmediata y permanentemente la administración de brentuximab vedotina y se debe administrar tratamiento médico apropiado. Si se produce una RRP, se debe interrumpir la perfusión e instaurarse tratamiento médico apropiado. La perfusión puede reiniciarse a una velocidad menor tras la resolución de los síntomas. Los pacientes que hayan sufrido una RRP previa se deben premedicar antes de las perfusiones siguientes. La premedicación puede incluir paracetamol, un antihistamínico y un corticosteroide. Las RRP son más frecuentes y más graves en los pacientes con anticuerpos frente a brentuximab vedotina (ver sección 4.8). Síndrome de lisis tumoral Se ha notificado síndrome de lisis tumoral (SLT) con brentuximab vedotina. Los pacientes con tumor en proliferación rápida y carga tumoral elevada corren riesgo de sufrir síndrome de lisis tumoral. Se debe vigilar estrechamente a estos pacientes y tratarlos de acuerdo con la mejor práctica médica. El tratamiento del SLT debería incluir hidratación intensiva, vigilancia de la función renal, corrección de las anomalías electrolíticas, tratamiento antihiperuricémico y cuidados de soporte. Neuropatía periférica El tratamiento con brentuximab vedotina puede causar una neuropatía periférica, tanto sensorial como motora. La neuropatía periférica inducida por brentuximab vedotina es un efecto característico de la exposición acumulada a este medicamento y es reversible en la mayoría de los casos. En los ensayos clínicos pivotales de fase II (SG y SG ), la incidencia de neuropatía periférica preexistente fue del 24%. Un 56% de los pacientes fueron tratados de neuropatía emergente. En el momento de la última evaluación, la mayoría de los pacientes (83%) mostraron mejoría o resolución de sus síntomas de neuropatía periférica. Entre los pacientes que presentaron neuropatía 6
7 periférica, el 17% abandonaron el tratamiento con brentuximab vedotina, un 13% redujo la dosis y en un 21% las dosis se retrasaron. La incidencia de neuropatía periférica preexistente en pacientes con LH en recaída o refractario o con LACG sistémico retratados con brentuximab vedotina fue del 48%. Un 69% de los pacientes fueron tratados de neuropatía emergente. En el momento de la última evaluación, la mayoría de los pacientes retratados con neuropatía periférica relacionada con el tratamiento (80%) habían mejorado o habían dejado de presentar síntomas de neuropatía emergente. La neuropatía periférica emergente determinó la interrupción del tratamiento en un 21% y modificación de dosis en un 34% de los pacientes retratados. En los ensayos clínicos de fase 3, en el momento de la última evaluación, la mayoría de los pacientes incluidos en el brazo brentuximab vedotina (85%) mostraron mejoría o resolución de sus síntomas de neuropatía periférica. Entre los pacientes que notificaron neuropatía periférica, el 23% interrumpieron el tratamiento con brentuximab vedotina, un 29% redujo la dosis y en un 22% las dosis se retrasaron. Se debe vigilar a los pacientes en busca de síntomas de neuropatía como hipoestesia, hiperestesia, parestesia, molestias, sensación de quemazón, dolor neuropático o debilidad. En los pacientes que sufran neuropatía periférica nueva o agravada pueden precisarse un aplazamiento y una reducción de la dosis de brentuximab vedotina o la interrupción del tratamiento (ver sección 4.2). Toxicidad hematológica Con brentuximab vedotina pueden aparecer anemia de grado 3 ó 4, trombocitopenia y neutropenia de grado 3 ó 4 prolongada ( 1 semana). Se debe vigilar el hemograma completo antes de la administración de cada dosis. Si aparece neutropenia de grado 3 ó 4, véase la sección 4.2. Neutropenia febril Se ha notificado neutropenia febril (fiebre de origen desconocido sin infección clínica o microbiológicamente comprobada con un recuento absoluto de neutrófilos <1,0 x 10 9 /l, fiebre 38,5 C; véase CTCAE v3) con el tratamiento de brentuximab vedotina. Se debe vigilar el hemograma completo antes de la administración de cada dosis de este tratamiento. Si aparece neutropenia febril, se debe vigilar estrechamente a los pacientes en busca de fiebre y tratarlos según la práctica médica óptima. Síndrome de Stevens-Johnson y necrólisis epidérmica tóxica Se ha notificado la aparición del síndrome de Stevens-Johnson (SSJ) y de necrólisis epidérmica tóxica (NET) con brentuximab vedotina. Se han notificado casos mortales. Si se producen SSJ o NET, se debe interrumpir el tratamiento con brentuximab vedotina y administrarse el tratamiento médico apropiado. Complicaciones gastrointestinales En pacientes tratados con brentuximab vedotina se han notificado complicaciones gastrointestinales (GI), entre las que se incluyen obstrucción intestinal, íleo, enterocolitis, colitis neutropénica, erosiones, úlceras, perforaciones y hemorragias, algunas con desenlace mortal. En el caso de que se presenten nuevos síntomas, o empeoramiento de los síntomas de GI, se debe realizar una evaluación para un diagnóstico rápido y tratarse convenientemente. Hepatotoxicidad Se ha notificado hepatotoxicidad en forma de elevación en los niveles de alanino aminotransferasa (ALT) y aspartato aminotransferasa (AST) con brentuximab vedotina. También se han producido casos graves de hepatotoxicidad con desenlace mortal. La presencia previa de la enfermedad hepática, las comorbilidades y las medicaciones concomitantes también pueden aumentar el riesgo. Se deben 7
8 realizar pruebas de la función hepática antes de iniciar el tratamiento y mantener una vigilancia de forma rutinaria en los pacientes tratados con brentuximab vedotina. Los pacientes que experimenten hepatotoxicidad pueden requerir un retraso o cambio en la dosis, o la interrupción del tratamiento con brentuximab vedotina. Hiperglucemia Se ha notificado hiperglucemia durante los ensayos clínicos en pacientes con un índice de masa corporal (IMC) elevado, con o sin antecedentes de diabetes mellitus. No obstante, se debe vigilar estrechamente la glucosa sérica de cualquier paciente que sufra un episodio de hiperglucemia. Debe administrarse tratamiento antidiabético según proceda. Insuficiencia renal y hepática La experiencia en pacientes con insuficiencia renal y hepática es limitada. Los datos disponibles indican que la insuficiencia renal grave, la insuficiencia hepática y las concentraciones séricas bajas de albúmina podrían afectar al aclaramiento de la MMAE (ver sección 5.2). Contenido de sodio de los excipientes Este medicamento contiene un máximo de 2,1 mmol (o 47 mg) de sodio por dosis, lo que debe tenerse en cuenta en el tratamiento de pacientes con dietas pobres en sodio. 4.5 Interacción con otros medicamentos y otras formas de interacción Interacción con medicamentos metabolizados por la vía de la CYP3A4 (inhibidores o inductores de la CYP3A4) La administración concomitante de brentuximab vedotina con el ketoconazol, un inhibidor potente de la CYP3A4 y de la P-gp, aumentó la exposición al fármaco antimicrotúbulos MMAE en alrededor del 73% y no alteró la exposición plasmática a brentuximab vedotina. En consecuencia, la administración concomitante de brentuximab vedotina con inhibidores potentes de la CYP3A4 y la P-gp puede aumentar la incidencia de neutropenia. Si aparece neutropenia, consúltese la tabla 1: Recomendaciones de administración en caso de neutropenia (ver sección 4.2). La administración concomitante de brentuximab vedotina con la rifampicina, un inductor potente de la CYP3A4, no alteró la exposición plasmática a brentuximab vedotina. A pesar de que los datos escasos sobre PK, la administración concomitante de rifampicina parece reducir las concentraciones en plasma de metabolitos de MMAE que podían analizarse. La administración concomitante de midazolam, un sustrato de la CYP3A4, con brentuximab vedotina no alteró el metabolismo del midazolam; en consecuencia, no se espera que brentuximab vedotina altere la exposición a los medicamentos metabolizados por enzimas CYP3A Fertilidad, embarazo y lactancia Mujeres en edad fértil Las mujeres en edad fértil deben utilizar dos métodos anticonceptivos eficaces durante el tratamiento con brentuximab vedotina y hasta 6 meses después del tratamiento. Embarazo No se dispone de datos sobre el uso de brentuximab vedotina en mujeres embarazadas. Los estudios en animales han mostrado toxicidad para la reproducción (ver sección 5.3). 8
9 Brentuximab vedotina no se debe utilizar durante el embarazo a menos que el beneficio para la madre supere al potencial riesgo para el feto. Si es necesario tratar a una mujer embarazada, debe advertírsele claramente del potencial riesgo para el feto. Ver en el apartado siguiente sobre fertilidad los consejos para las mujeres cuyas parejas masculinas estén siendo tratadas con brentuximab vedotina. Lactancia No se dispone de datos sobre si brentuximab vedotina o sus metabolitos se excretan en la leche humana. No se puede excluir el riesgo en recién nacidos/lactantes. Debe decidirse si se interrumpe la lactancia, o se interrumpe este tratamiento, o se prescinde de él, teniendo en cuenta el posible riesgo de la lactancia para el niño y el efecto beneficioso del tratamiento para la madre. Fertilidad En estudios no clínicos, el tratamiento con brentuximab vedotina ha originado toxicidad testicular, y puede alterar la fertilidad masculina. Se ha demostrado que la MMAE tiene propiedades aneugénicas (ver sección 5.3). Por consiguiente, se aconseja a los hombres tratados con este medicamento que hagan congelar y conservar muestras de su semen antes del tratamiento. Se aconseja a los hombres tratados con este medicamento que no engendren un hijo durante el tratamiento ni hasta 6 meses después de la última dosis. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas La influencia de brentuximab vedotina sobre la capacidad para conducir y utilizar máquinas es pequeña. 4.8 Reacciones adversas Resumen del perfil de seguridad El perfil de seguridad de ADCETRIS está basado en los datos de los ensayos clínicos disponibles, en el programa de suministro de medicamentos en situaciones especiales (NPP) y en la experiencia poscomercialización hasta la fecha. Las frecuencias de las reacciones adversas que se describen a continuación y en la Tabla 3 se han determinado en base a los datos generados en estudios clínicos. En dos ensayos clínicos de fase 2 realizados en pacientes con LH en recaída o refractario o LACG ADCETRIS se administró en monoterapia en 160 pacientes. La mediana del número de ciclos fue de 9 en pacientes con LH en recaída o refractario y de 7 en pacientes con LACG en recaída o refractario. ADCETRIS también se administró en monoterapia en 167 pacientes de los 329 pacientes con LH con mayor riesgo de recaída o progresión después de un trasplante autólogo de células madre, incluidos en un ensayo clínico aleatorio controlado por placebo de fase 3. La mediana del número de ciclos recibidos en ambos brazos fue de 15. Las infecciones graves y oportunistas fueron muy frecuentes en pacientes tratados con este medicamento (ver sección 4.4). En la población de los estudios de fase 2 y fase 3, las infecciones oportunistas notificadas con más frecuencia fueron herpes zoster y herpes simple. Las reacciones adversas graves al medicamento en la población de los estudios pivotales de fase 2 y fase 3 fueron: neumonía, síndrome de distress respiratorio agudo, cefalea, neutropenia, trombocitopenia, estreñimiento, diarrea, vómitos, náuseas, pirexia, neuropatía motora periférica, 9
10 neuropatía sensorial periférica, hiperglucemia, polineuropatía desmielinizante, síndrome de lisis tumoral y síndrome de Stevens-Johnson. Las reacciones adversas observadas con más frecuencia (>20%) en la población de los estudios pivotales de fase 2 y fase 3 fueron: neuropatía sensorial periférica, cansancio, náuseas, diarrea, infección respiratoria del tracto superior, neutropenia ytos. Además, también se observaron reacciones adversas en >20 % en forma de vómitos y pirexia en los ensayos clínicos de fase 2, y de neuropatía motora periférica en los ensayos clínicos de fase 3. Las reacciones adversas originaron la interrupción del tratamiento en el 23% y el 32% de los pacientes que recibían brentuximab vedotina en los ensayos clínicos de fase 2 y de fase 3 respectivamente. Las reacciones adversas graves que originaron la interrupción del tratamiento en dos o más pacientes, tanto en el ensayo clínico de fase 2 como en el de fase 3, fueron neuropatía sensorial periférica, neuropatía motora periférica, polineuropatía desmielinizante y enfermedad de Hodgkin recurrente, vómitos y síndrome de distress respiratorio agudo. La parestesia también originó la interrupción del tratamiento en dos o más pacientes, tanto en el ensayo clínico de fase 2 como en el de fase 3. Los datos de seguridad de los pacientes con LH en recaída o refractario que no habían recibido un trasplante autólogo de células madre y que habían sido tratados con la dosis recomendada de 1,8 mg/kg cada tres semanas en el ensayo fase I de escalado de dosis, en los estudios clínicos farmacológicos (n=15 pacientes), y en el NPP (n=26 pacientes) (ver sección 5.1) resultaron consistentes con el perfil de seguridad de los estudios pivotales. Tabla de reacciones adversas Las reacciones adversas de ADCETRIS se enumeran según el sistema de clasificación de órganos y término preferido del MedDRA (ver tabla 3). Dentro de cada sistema de clasificación de órganos, las reacciones adversas se enumeran en las categorías de frecuencia siguientes: muy frecuentes ( 1/10); frecuentes ( 1/100 a < 1/10); poco frecuentes ( 1/1.000 a < 1/100); raras ( 1/ a <1/1.000); muy raras (<1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles). 10
11 Tabla 3: Reacciones adversas a ADCETRIS Sistema de Clasificación de Reacciones adversas Órganos Infecciones e infestaciones Muy frecuentes: Infección a, infección respiratoria del tracto superior Frecuentes: Sepsis/shock séptico, herpes zoster, neumonía, herpes simple Poco frecuentes: Candidiasis oral, neumonía por Pneumocystis jiroveci, bacteriemia estafilocócica Frecuencia no conocida Leucoencefalopatía multifocal progresiva Trastornos de la sangre y del sistema linfático Muy frecuentes: Neutropenia Frecuentes: Anemia, trombocitopenia Frecuencia no conocida Neutropenia febril Trastornos del sistema inmunológico Frecuencia no conocida Reacción anafiláctica Trastornos del metabolismo y de la nutrición Frecuentes: Hiperglucemia Poco frecuentes: Síndrome de lisis tumoral Trastornos del sistema nervioso Muy frecuentes: Neuropatía sensorial periférica, neuropatía motora periférica Frecuentes: Mareos, polineuropatía desmielinizante Trastornos respiratorios, torácicos y mediastínicos Muy frecuentes: Tos, disnea Trastornos gastrointestinales Muy frecuentes: Diarrea, náuseas, vómitos, estreñimiento, dolor abdominal Poco frecuentes Pancreatitis aguda Trastornos hepatobiliares Frecuentes: Aumento de alanina aminotransferasa/aspartato aminotransferasa (ALT/AST) Trastornos de la piel y del tejido subcutáneo Muy frecuentes: Alopecia, prurito Frecuentes: Raros: Exantema Síndrome de Stevens-Johnson / necrólisis epidérmica tóxica Trastornos musculoesqueléticos y del tejido conjuntivo Muy frecuentes: Mialgia, artralgia Frecuentes: Dolor de espalda Trastornos generales y alteraciones en el lugar de administración Muy frecuentes: Cansancio, escalofríos, pirexia, reacciones relacionadas con la perfusión b Exploraciones complementarias: Muy frecuentes Disminución de peso a. Los términos preferidos que se notificaron en el apartado Infecciones e Infestaciones son sepsis/shock séptico, infección respiratoria superior, herpes zoster y neumonía. b. Los términos preferidos asociados con las RRP fueroncefalea, exantema, dolor de espalda, vómitos, escalofríos, náuseas, disnea, prurito y tos. 11
12 Descripción de reacciones adversas seleccionadas La neutropenia causó el aplazamiento de la administración en el 14% y el 22% de los pacientes en los ensayos clínicos de fase 2 y de fase 3 respectivamente. Con este tratamiento puede aparecer neutropenia grave y prolongada ( 1 semana), que puede aumentar el riesgo de que los pacientes contraigan infecciones graves. En la población del ensayo clínico de fase 2, la mediana de duración de la neutropenia de grado 3 ó 4 fue limitada (1 semana); el 2% de los pacientes tuvieron neutropenia de grado 4 de 7 días de duración. Menos de la mitad de los pacientes de la población de los estudios pivotales de fase 2 con neutropenia de grado 3 ó 4 sufrieron temporalmente infecciones asociadas, de las cuales la mayoría fueron de grado 1 ó 2. En la población del ensayo clínico de fase 3, se notificaron neutropenia de grado 3 en el 22% de los pacientes en el brazo con brentuximab vedotina y neutropenia de grado 4 en el 7% de los pacientes en el brazo con brentuximab vedotina. Ninguno de los pacientes requirió de una reducción de la dosis ni de interrupción del tratamiento por la neutropenia. En la población del ensayo clínico de fase 3, se notificaron infecciones graves en el 9% de los pacientes en el brazo con brentuximab vedotina. No se notificaron casos de bacteriemia, sepsis o shock séptico en el brazo con brentuximab vedotina. La neuropatía sensorial periférica causó el aplazamiento de la administración en el 13% y el 16% de los pacientes en los ensayos clínicos de fase 2 y de fase 3 respectivamente. Además, la neuropatía motoraperiférica y la infección del tracto respiratorio superior causaron aplazamientos en la administración de la dosis en el 6% de los pacientes en el ensayo de fase 3. La neuropatía sensorial periférica causó el aplazamiento de la administración de la dosis en el 9% y el 22% de los pacientes en los ensayos clínicos de fase 2 y de fase 3 respectivamente. Además, la neuropatía motora periférica también causó reducciones de dosis en el 6% de los pacientes en el ensayo clínico de fase 3. El noventa por ciento (90%) y el sesenta y ocho por ciento (68%) de los pacientes en el ensayo clínico de fase 2 y de fase 3 respectivamente mantuvieron la dosis recomendada de 1,8 mg/kg durante el tratamiento. En los pacientes que sufrieron neuropatía periférica en el ensayo clínico de fase 2, la mediana de seguimiento desde el final del tratamiento hasta la última evaluación fue de alrededor de 48,9 semanas. En el momento de la última evaluación, el 83% de los 89 pacientes que sufrieron neuropatía periférica mostraban resolución o mejoría de sus síntomas de neuropatía periférica. La media del tiempo desde el comienzo hasta la resolución o la mejoría de todos los episodios fue de 16 semanas (desde 0,3 a 106,6 semanas). Entre los pacientes que experimentaron neuropatía periférica en el ensayo clínico de fase 3, la mediana de seguimiento desde el final de tratamiento hasta la última evaluación fue de alrededor de 98 semanas. En el momento de la última evaluación, el 85% de los pacientes con neuropatía periférica en el brazo con brentuximab vedotina ya no presentaban síntomas de neuropatía periférica o los síntomas habían mejorado. En términos generales, la mediana de tiempo hasta la resolución o mejora de los casos de neuropatía periférica en el brazo con brentuximab vedotina fue de 23,4 semanas (intervalo de 0,1 semanas a 138,3 semanas). Se notificaron RRP en el 11% y el 15% de los pacientes en los ensayos clínicos de fase 2 y de fase 3 respectivamente. Tanto en el ensayo de fase 2 como en el de fase 3, las reacciones adversas más comúnmente asociadas a las RRP fueron de leves a moderadas (grado 2 y grado 2), e incluyeron cefalea, erupción, dolor de espalda, vómitos, escalofríos, náuseas, disnea, prurito y tos. Se ha notificado la aparición de reacciones anafilácticas (ver sección 4.4). Los síntomas de una reacción anafiláctica pueden ser, entre otros, urticaria, angioedema, hipotensión y broncospasmo. 12
13 Se ha notificado la aparición de neutropenia febril (ver sección 4,2). Un paciente reclutado para un ensayo fase 1 de escalado de dosis sufrió neutropenia febril de grado 5 después de recibir una sola dosis de 3,6 mg/kg de brentuximab vedotina. Inmunogenicidad En dos estudios pivotales de fase 2, se hicieron análisis de anticuerpos contra brentuximab vedotina cada 3 semanas en pacientes con LH o LACGs en recaída o refractario empleando un inmunoensayo electroquimioluminiscente sensible. También se realizaron análisis a los pacientes con LH en mayor riesgo de recaída o progresión después de un trasplante autólogo de células madre en el estudio clínico de fase 3. Alrededor del 7% de los pacientes del estudio de fase 2 y el 6% de los pacientes en el brazo con brentuximab vedotina del estudio de fase 3 desarrollaron positividad persistente a anticuerpos anti tratamiento (AAT)Dos pacientes en los estudios de fase 2 y dos pacientes en el estudio de fase 3 sufrieron reacciones adversas congruentes con RRP que determinaron la interrupción del tratamiento. La presencia de anticuerpos contra brentuximab vedotina no estuvo acompañada de una reducción clínicamente significativa de las concentraciones séricas de brentuximab vedotina, y no originó un descenso de la eficacia de brentuximab vedotina. Aunque la presencia de anticuerpos contra brentuximab vedotina no predice necesariamente la aparición de una RRP, se observó una mayor incidencia de RRP en los pacientes con AAT persistentemente positivos que en los que presentaban AAT positivos de forma temporal y en los que nunca los tuvieron. Retratamiento El retratamiento con Adcetris se administró a 21 pacientes con LH en recaída o refractario y en 8 pacientes con LACG sistémico en recaída. La mediana del número de ciclos fue de 7 (rango de 2 a 37 ciclos) (ver sección 5.1). Los tipos y grados de reacciones adversas notificados en pacientes retratados con Adcetris fueron consistentes con los observados en la combinación de los ensayos pivotales de fase II, con la excepción de la neuropatía periférica motora, cuya incidencia fue mayor (28% vs. 9% en los ensayos pivotales de fase II) y fue principalmente de grados 1 ó 2. Los pacientes también presentaron una incidencia mayor de artralgia, anemia de grado 3 y dolor de espalda en comparación con los pacientes observados en la combinación de los ensayos pivotales de fase II. Notificación de sospechas de reacciones adversas Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V. 4.9 Sobredosis Se desconoce un antídoto para la sobredosis de brentuximab vedotina. En caso de sobredosis, debe vigilarse estrechamente al paciente en busca de reacciones adversas, especialmente neutropenia, y debe administrarse tratamiento de soporte (ver sección 4.4). 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas Grupo farmacoterapéutico: fármacos antineoplásicos; otros fármacos antineoplásicos; anticuerpos monoclonales, código ATC: L01XC12. 13
14 Mecanismo de acción Brentuximab vedotina es un anticuerpo conjugado (ACC) que libera un fármaco antineoplásico que origina selectivamente la muerte celular apoptótica de las células tumorales que expresan CD30. Los datos preclínicos indican que la actividad biológica de brentuximab vedotina es resultado de un proceso de varias etapas. La unión del ACC a CD30 sobre la superficie celular inicia la incorporación del complejo ACC-CD30, que se desplaza luego al compartimento lisosomal. Dentro de la célula, se libera una sola especie activa definida, la MMAE, mediante escisión proteolítica. La unión de la MMAE a la tubulina altera la red de microtúbulos del interior de la célula, induce a la detención del ciclo celular y origina la muerte apoptótica de la célula tumoral que expresa CD-30. El LH clásico y el LACG sistémico expresan CD30 como un antígeno de superficie de sus células malignas. Esta expresión es independiente del estadío de la enfermedad, de la línea de tratamiento o de la situación en relación al trasplante. Esos aspectos hacen que CD30 sea una diana para la intervención terapéutica. Debido al mecanismo de acción dirigido al CD30, brentuximab vedotina es capaz de superar la quimiorresistencia dado que CD30 se expresa de manera consistente en pacientes que son refractarios a poliquimioterapia, independientemente del estado previo en relación al trasplante. El mecanismo de acción dirigido al CD30 de brentuximab vedotina, la expresión persistente de CD30 en el LH clásico y en el LACG sistémico y el espectro terapéutico y la evidencia clínica en dos patologías tumorales CD30-positivas, tras múltiples líneas de tratamiento, proporcionan una base biológica para su uso en pacientes con LH clásico en recaída y refractario y en LACG sistémico con o sin previo trasplante autólogo de células madre. No se han descartado contribuciones de otras funciones asociadas con anticuerpos al mecanismo de acción. Efectos farmacodinámicos Electrofisiología cardíaca Cuarenta y seis (46) de los 52 pacientes con procesos hematológicos malignos que expresaban CD30 que recibieron 1,8 mg/kg de brentuximab vedotina cada 3 semanas como parte de un estudio de fase 1 de seguridad cardíaca multicéntrico abierto de un solo brazo fueron evaluables. El objetivo principal fue evaluar el efecto de brentuximab vedotina sobre la repolarización ventricular cardíaca, y el análisis principal predefinido fue el del cambio del QTc desde el momento basal hasta varios puntos temporales del ciclo 1. El intervalo de confianza (IC) del 90% superior alrededor del efecto medio en el QTc fue <10 ms en cada uno de los puntos temporales post-basales de los ciclos 1 y 3. Estos datos indican la ausencia de prolongación del QT de importancia clínica debida a la administración de brentuximab vedotina en dosis de 1,8 mg/kg cada 3 semanas en pacientes con procesos malignos que expresan CD30. Eficacia clínica Linfoma de Hodgkin Estudio SG Se evaluaron la eficacia y la seguridad de brentuximab vedotina como fármaco único en un estudio pivotal multicéntrico abierto de un solo brazo en 102 pacientes con LH en recaída o refractario. Véase un resumen de las características basales de los pacientes y de la enfermedad en la tabla 4 siguiente. 14
15 Tabla 4: Resumen de las características basales de los pacientes y de la enfermedad en el estudio de fase 2 en LH en recaída o refractario Características de los pacientes N = 102 Mediana de edad, años (intervalo) 31 años (15-77) Sexo 48V (47%)/54M (53%) Estado funcional del ECOG 0 42 (41%) 1 60 (59%) Trasplante autólogo de células madre previo 102 (100%) Regímenes de quimioterapia previos 3,5 (1-13) Tiempo desde el trasplante autólogo de células madre hasta la 6,7 meses (0-131) primera recidiva post-trasplante Enfermedad que expresa CD30 confirmada histológicamente 102 (100%) Características de la enfermedad a. Refractaria al tratamiento de primera línea a 72 (71%) Refractaria al tratamiento más reciente 43 (42%) Síntomas B basales 35 (33%) Estadío III en el diagnóstico inicial 27 (26%) Estadío IV en el diagnóstico inicial 20 (20%) Se define como LH refractario al que no experimenta remisión completa o progresa en los 3 meses siguientes a la finalización del tratamiento de primera línea. Dieciocho (18) pacientes (18%) recibieron 16 ciclos de brentuximab vedotina, y la mediana del número de ciclos recibidos fue de 9 (entre 1 y 16). La respuesta al tratamiento con brentuximab vedotina fue valorada por un Centro de Revisión Independiente (CRI) empleando los Criterios de Respuesta Revisados para el Linfoma Maligno (Cheson, 2007). La respuesta al tratamiento se valoró mediante TC helicoidal de tórax, cuello, abdomen y pelvis, AGPET y datos clínicos. Se hicieron valoraciones de la respuesta en los ciclos 2, 4, 7, 10, 13 y 16 con PET en los ciclos 4 y 7. La tasa de respuesta objetiva (TRO) por valoración del CRI fue del 75% (76 de 102 pacientes del conjunto por intención de tratar [IT]), y se logró la reducción del tumor en el 94% de los pacientes. La tasa de remisión completa (RC) fue del 33% (34 de 102 pacientes del conjunto por IT). La mediana de supervivencia global (SG) es de 40,5 meses (la mediana del tiempo de observación (tiempo hasta la muerte o el último contacto) desde la primera dosis fue de 35,1 meses (intervalo de 1,8 a 72,9+ meses). La tasa de supervivencia global estimada a los 5 años fue del 41% (IC del 95% [31%, 51%]). Las valoraciones de los investigadores fueron en general congruentes con la revisión independiente de las exploraciones de imagen. De los pacientes tratados, 8 de los que respondían pasaron a recibir un TCM alogénico. Para más resultados de eficacia, véase la tabla 5. 15
16 Tabla 5: Resultados de eficacia en pacientes con linfoma de Hodgkin en recaída o refractario tratados con 1,8 mg/kg de brentuximab vedotina cada 3 semanas Mejor respuesta clínica (N = 102) CRI N (%) IC del 95% Tasa de respuesta objetiva (RC + RP) 76 (75) 64,9, 82,6 Remisión completa (RC) 34 (33) 24,3, 43,4 Remisión parcial (RP) 42 (41) NP Tasa de control de la enfermedad (RC + 98 (96) 90,3, 98,9 RP + EE) Duración de la respuesta Mediana según el CRI IC del 95% Tasa de respuesta objetiva (RC + RP) a 6,7 meses 3,6, 14,8 Remisión completa (RC) 27,9 meses 10,8, NC b Supervivencia global IC del 95% Mediana 40,5 meses 28,7, 61,9 Tasa de SG estimada a los 5 años 41% 31%, 51% a. La duración de la respuesta osciló entre 1,2+ meses y 43+ meses, y la mediana de seguimiento desde la primera dosis de los pacientes que lograron respuesta objetiva (RO) según el CRI fue de 9,0 meses. b. No calculable. Un análisis exploratorio intrapaciente mostró que aproximadamente el 64% de los pacientes con LH tratados con brentuximab vedotina dentro del ensayo clínicosg , experimentaban una mejoría en el beneficio clínico medido por una supervivencia libre de progresión (SLP) más prolongada en comparación con su línea de tratamiento previo más reciente. De los 35 pacientes (33%) que tenían síntomas B basales, 27 pacientes (77%) experimentaron resolución de todos los síntomas B a una mediana de tiempo de 0,7 meses desde la instauración de brentuximab vedotina. Se recogieron datos de pacientes (n=15) incluidos en el ensayo fase I de escalado de dosis y de los estudios farmacológicos, así como de pacientes (n=26) del programa de suministro de medicamentos en situaciones especiales con LH en recaída o refractario que no habían recibido trasplante autólogo de células madre, y que fueron tratados con 1,8 mg/kg de brentuximab vedotina cada 3 semanas. Las características basales de los pacientes mostraron fracaso de múltiples regímenes quimioterápicos previos (mediana de 3 con un intervalo entre 1 y 7) antes de la primera administración de brentuximab vedotina. El cincuenta y nueve por ciento (59%) de los pacientes tenían estadío avanzado de su enfermedad (estadíos III y IV) en el diagnóstico inicial. Los resultados de estos estudios fase I y de la experiencia del NPP mostraron que, en pacientes con LH en recaída o refractario sin trasplante autólogo de células madre previo, se pueden alcanzar respuestas clínicas significativas evidenciadas por el análisis del investigador, una tasa de respuesta objetiva del 54% y una tasa de respuestas completas del 22% después de una mediana de cinco ciclos de brentuximab vedotina. 16
17 Estudio SGN Se evaluaron la eficacia y la seguridad de brentuximab vedotina en un estudio multicéntrico aleatorio, doble ciego, controlado con placebo y de dos brazos realizado en 329 pacientes con LH con riesgo de recaída o progresión después del trasplante autólogo de células madre. Se excluyeron del ensayo los pacientes con enfermedad cerebral/meníngea conocida, con inclusión de MLP. Ver tabla 6 para conocer las características de esos pacientes. De los 329 pacientes, 165 pacientes se asignaron de forma aleatoria al brazo de tratamiento y 164 pacientes se asignaron al azar al brazo de placebo. En el estudio, los pacientes debían recibir la primera dosis tras recuperación del trasplante autólogo de células madre (entre 30 y 45 días después del trasplante autólogo de células madre). Los pacientes fueron tratados con 1,8 mg/kg de ADCETRIS o con el placebo correspondiente por vía intravenosa durante 30 minutos cada 3 semanas hasta un total de 16 ciclos. Los pacientes elegibles debían presentar al menos uno de los factores de riesgo siguientes: LH refractario al tratamiento de primera línea LH en recaída o progresión producido <12 meses después del final del tratamiento de primera línea Compromiso extraganglionar en el momento previo a la recaída después del trasplante autólogo de células madre, con inclusión de extensión extraganglionar de masas ganglionares adyacentes a órganos vitales. Tabla 6: Resumen de las características basales de los pacientes y de la enfermedad en el ensayo de fase 3 tras trasplante autólogo de células madre. Características de los pacientes Brentuximab vedotina N = 165 Placebo N = 164 Mediana de edad, años (intervalo) 33 años (18-71) 32 años (18-76) Sexo 76V (46%)/89F (54%) 97V (59%)/67F (41%) Estado funcional de ECOG 0 87 (53%) 97 (59%) 1 77 (47%) 67 (41%) 2 1 (1%) 0 Características de la enfermedad Mediana de número de regímenes de 2 (2-8) 2 (2-7) quimioterapia previa (intervalo) Mediana de tiempo desde diagnóstico de 18.7 meses ( ) 18.8 meses ( ) LH hasta primera dosis (intervalo) Estadío de la enfermedad al inicio del diagnóstico de HL Estadío I 1 (1%) 5 (3%) Estadío II 73 (44%) 61 (37%) Estadío III 48 (29%) 45 (27%) Estadío IV 43 (26%) 51 (31%) Desconocido 0 2 (1%) PET-CT Estadío previo a trasplante autólogo de células madre FDG-POSITIVO 64 (39%) 51 (31%) FDG-NEGATIVO 56 (34%) 57 (35%) NO REALIZADO 45 (27%) 56 (34%) 17
18 a. b. Compromiso extraganglionar en el 54 (33%) 53 (32%) momento previo a la recaída después de trasplante autólogo de células madre Síntomas B a 47 (28%) 40 (24%) Mejor respuesta a tratamiento de rescate antes de trasplante autólogo de células madre b Respuesta completa 61 (37%) 62 (38%) Respuesta parcial 57 (35%) 56 (34%) Respuesta estable 47 (28%) 46 (28%) Estado LH tras el final del tratamiento estándar de quimioterapia de primera línea b Refractario 99 (60%) 97 (59%) Refractario <12 meses 53 (32%) 54 (33%) Recaída >=12 meses 13 (8%) 13 (8%) En enfermedad refractaria o hasta progresión o recaída después de tratamiento de primera línea. Factores de estratificación en asignación aleatoria. Los resultados de la eficacia se muestran en la Tabla 7. La variable principal de evaluación de SLP se cumplió y mostró una diferencia en la mediana de SLP de 18,8 meses a favor del brazo de tratamiento. 18
19 Tabla 7: Resultados de la eficacia en pacientes LH con mayor riesgo de recaída o progresión después de trasplante autólogo de células madre tratados con 1,8 mg/kg de brentuximab vedotina cada 3 semanas Brentuximab vedotina N = 165 Mediana por CRI Placebo N = 164 Estratificación de cociente de riesgo 0.57 Supervivencia libre de progresión a 42,9 meses (IC del 95% [30,4, 42.9]) 24,1 meses (IC del 95% [11,5, -]) (IC del 95% [0,40, 0,81]) Test log-rank estratificado P=0,001 Mediana por investigador No alcanzada (IC del 95% [26,4, -]) 15,8 meses (IC del 95% [8,5, -]) 0,5 (IC del 95% [0,36, 0,70]) b Supervivencia general Número de muertes (%) 28 (17) 25 (15) 1.15 (IC del 95% [0,67, 1,97] a. b. En el momento del primer análisis, la mediana de tiempo de seguimiento en ambos brazos era de 30 meses [intervalo 0 a 50]. No se realizó el test de log-rank estratificado de SLP por investigador. Se realizaron análisis de SLP de subgrupo previamente especificado por mejor respuesta de paciente hasta terapia de rescate antes de trasplante autólogo de células madre, estado de LH después del tratamiento de primera línea, edad, sexo, peso basal, escala ECOG, número de tratamientos antes de trasplante autólogo con células madre, región geográfica, estado PET antes de trasplante autólogo con células madre, estado de síntoma B después del fracaso del tratamiento de primera línea y estado de enfermedad extraganglionar antes de trasplante autólogo de células madre. Los análisis mostraron una tendencia sólida en beneficio de los pacientes a los que se había administrado brentuximab vedotina en comparación con pacientes a los que se había administrado placebo, con excepción de pacientes > 65 años de edad (n=8). No se observaron diferencias en la calidad de vida entre los brazos de tratamiento y placebo. Los análisis del uso racional de medicamentos mostraron que las hospitalizaciones y las visitas ambulatorias, así como los días laborables/otras actividades perdidos por los pacientes y cuidadores fueron menores con brentuximab vedotina en comparación con placebo en pacientes con LH con mayor riesgo de recaída. Un análisis actualizado realizado tres años después del seguimiento mostró una mejora de la SLP sostenible por CRI (HR = 0,58 [IC del 95% (0,41, 0,81)]). 19
20 Análisis post hoc del factor de riesgo Se realizaron análisis post hoc para evaluar el impacto del mayor riesgo (número de factores de riesgo) sobre el beneficio clínico (Tabla 8). Los factores de riesgo representativos para estos análisis fueron: LH producido <12 meses o LH refractario al tratamiento de primera línea Mejor respuesta RP o SD al tratamiento de rescate reciente determinada por TC y/o PET Enfermedad extraganglionar en el momento de la recaída previa al trasplante autólogo de células madre Síntomas B en el momento de la recaída previa al trasplante autólogo con células madre Dos o más tratamientos de rescate previos Los resultados de estos análisis post hoc sugieren un mayor beneficio clínico para pacientes con dos o más factores de riesgo, pero ninguna diferencia sobre ninguno de los factores de riesgo individuales. No se ha observado beneficio en términos de SLP o SG en pacientes con un factor de riesgo de recaída o progresión. Tabla 8: Resumen de SLP por CRI y SG por número de factores de riesgo en el ensayo clínico de fase 3 de LH tras trasplante autólogo de células madre Supervivencia libre de progresión por CRI Número de factores de riesgo = 1 Número de factores de riesgo 2 Número de factores de riesgo 3 Brentuximab vedotina N = 21 Placebo N = 28 Brentuximab vedotina N = 144 Placebo N = 136 Brentuximab vedotina N = 82 Placebo N = 84 Número de pacientes con progresión de la enfermedad o muerte a (%) Cociente de riesgo estratificado 9 (43) 7 (25) 51 (35) 68 (50) 32 (39) 49 (58) 1,65 0,49 0,43 (IC del 95% [0,60, 4,55]) b (IC del 95% [0,34, 0,71]) (IC del 95% [0,27, 0,68]) Supervivencia general Número de factores de riesgo = 1 Brentuximab Placebo vedotina N = 28 N = 21 Número de factores de riesgo 2 Brentuximab Placebo vedotina N = 136 N = 144 Número de factores de riesgo 3 Brentuximab Placebo vedotina N = 84 N = 82 Número de muertes c (%) 5 (24) 1 (4) 23 (16) 24 (18) 15 (18) 16 (19) Cociente de riesgo estratificado 7,94 (IC del 95% [0,93, 68,06]) b 0,94 (IC del 95% [0,53, 1,67]) 0,92 (IC del 95% [0,45, 1,88]) a. Muerte sin progresión previa o más de una visita de evaluación perdida b. Indica resultados del análisis no estratificado. c. Los casos son muertes debido a cualquier otra causa. 20
Takeda presenta su constante compromiso con la patología durante el. Décimo Simposio Internacional del Linfoma de Hodgkin
 COMUNICADO DE PRENSA Cambridge, Massachusetts y Osaka 18 de Octubre, el año 2016 Takeda presenta su constante compromiso con la patología durante el Décimo Simposio Internacional del Linfoma de Hodgkin
COMUNICADO DE PRENSA Cambridge, Massachusetts y Osaka 18 de Octubre, el año 2016 Takeda presenta su constante compromiso con la patología durante el Décimo Simposio Internacional del Linfoma de Hodgkin
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
FICHA TECNICA. Adultos en prediálisis o en diálisis: 1 dosis (40 µg) de 1 ml en cada inyección.
 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
INFORME CFT- HOSPITAL REINA SOFÍA CÓRDOBA
 BRENTUXIMAB VEDOTIN en el tratamiento del linfoma de Hodgkin CD30+ y del linfoma anaplásico de células grandes. INFORME CFT- HOSPITAL REINA SOFÍA CÓRDOBA 1.- Identificación del fármaco: Nombre Genérico:
BRENTUXIMAB VEDOTIN en el tratamiento del linfoma de Hodgkin CD30+ y del linfoma anaplásico de células grandes. INFORME CFT- HOSPITAL REINA SOFÍA CÓRDOBA 1.- Identificación del fármaco: Nombre Genérico:
ANEXO III ENMIENDA DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y PROSPECTO
 ANEXO III ENMIENDA DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y PROSPECTO 1 ENMIENDA A INCLUIR EN LAS SECCIONES RELEVANTES DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL
ANEXO III ENMIENDA DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y PROSPECTO 1 ENMIENDA A INCLUIR EN LAS SECCIONES RELEVANTES DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL
FICHA TÉCNICA. Virus de la gripe fraccionados*, inactivados, que contienen antígenos equivalentes a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
FLUCONAZOL. Solución para infusión IV. 200 mg. ALFARMA S.A., PANAMÁ, REPÚBLICA DE PANAMÁ. Fabricante, país:
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: Presentación: FLUCONAZOL Solución para infusión IV 200 mg Estuche por un frasco de PEBD con 100 ml. Titular
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: Presentación: FLUCONAZOL Solución para infusión IV 200 mg Estuche por un frasco de PEBD con 100 ml. Titular
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
El Inmunomomento en Melanoma: Nivolumab más respuestas y larga supervivencia? Alfonso Berrocal
 El Inmunomomento en Melanoma: Nivolumab más respuestas y larga supervivencia? Alfonso Berrocal Proporción vivos Supervivencia con Ipilumumab en acceso expandido 1.0 0.9 0.8 Mediana de supervivencia meses
El Inmunomomento en Melanoma: Nivolumab más respuestas y larga supervivencia? Alfonso Berrocal Proporción vivos Supervivencia con Ipilumumab en acceso expandido 1.0 0.9 0.8 Mediana de supervivencia meses
CONTROVERSIAS HIPERTENSION PULMONAR
 CONTROVERSIAS HIPERTENSION PULMONAR Mª Carmen Torreiro Penas Hospital Xeral-Calde Lugo Eficacia/precio de los fármacos f aprobados? Es necesario evaluar los fármacos f aprobados? TRATAMIENTO Importantes
CONTROVERSIAS HIPERTENSION PULMONAR Mª Carmen Torreiro Penas Hospital Xeral-Calde Lugo Eficacia/precio de los fármacos f aprobados? Es necesario evaluar los fármacos f aprobados? TRATAMIENTO Importantes
PROSPECTO. CEFTRIAXONA REIG JOFRÉ 1 g IM. Polvo y disolvente para solución inyectable. E.F.G. Ceftriaxona (D.C.I.)
 PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico.
PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico.
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA
 La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
Excipientes con efecto conocido: propilenglicol 200 mg/g
 FELDENE* 0.5% (Piroxicam) Gel 1. NOMBRE DEL PRODUCTO FARMACÉUTICO FELDENE* 0.5% Gel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 gramos de FELDENE 0.5% Gel contiene: Piroxicam 0.5 g Excipientes con
FELDENE* 0.5% (Piroxicam) Gel 1. NOMBRE DEL PRODUCTO FARMACÉUTICO FELDENE* 0.5% Gel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 gramos de FELDENE 0.5% Gel contiene: Piroxicam 0.5 g Excipientes con
Después de la reconstitución, 1 ml de concentrado contiene 25 mg de pembrolizumab.
 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Glucosamina KERN PHARMA 1.500 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Glucosamina KERN PHARMA 1.500 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre
Es frecuente la infección crónica por el virus de hepatitis B (VHB)?
 HEPATITIS B Qué es la hepatitis B y tipos? La hepatitis B es una enfermedad producida por la infección de un virus de tipo ADN, que infecta e inflama el hígado. Puede producir un cuadro agudo (hepatitis
HEPATITIS B Qué es la hepatitis B y tipos? La hepatitis B es una enfermedad producida por la infección de un virus de tipo ADN, que infecta e inflama el hígado. Puede producir un cuadro agudo (hepatitis
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
Dr. Juan Carlos Valia Vera, Dr. Guido Mazzinari
 Dr. Juan Carlos Valia Vera, Dr. Guido Mazzinari Servicio de Anestesia Reanimación n y Tratamiento del Dolor Consorcio Hospital General Universitario Valencia Caso Clinico Varón de 34 años VIH estadio C3,
Dr. Juan Carlos Valia Vera, Dr. Guido Mazzinari Servicio de Anestesia Reanimación n y Tratamiento del Dolor Consorcio Hospital General Universitario Valencia Caso Clinico Varón de 34 años VIH estadio C3,
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox
 TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
SERPIENTES Definición:
 SERPIENTES Definición: Las serpientes u ofidios son reptiles caracterizados por la ausencia de extremidades y un cuerpo muy alargado. En España hay solo dos familias de serpientes venenosas: las víboras
SERPIENTES Definición: Las serpientes u ofidios son reptiles caracterizados por la ausencia de extremidades y un cuerpo muy alargado. En España hay solo dos familias de serpientes venenosas: las víboras
FICHA TÉCNICA. KETOISDIN 400 mg óvulos está indicado en adultos para el tratamiento local de
 1. NOMBRE DEL MEDICAMENTO KETOISDIN 400 mg óvulos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada óvulo contiene: 400 mg de ketoconazol Excipientes con efecto conocido: Butilhidroxianisol
1. NOMBRE DEL MEDICAMENTO KETOISDIN 400 mg óvulos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada óvulo contiene: 400 mg de ketoconazol Excipientes con efecto conocido: Butilhidroxianisol
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
Excipientes con efecto conocido: Cada gramo de crema contiene 200 mg de propilenglicol, 75 mg de alcohol estearílico y 20 mg de alcohol cetílico.
 1. NOMBRE DEL MEDICAMENTO Ketoisdin 20 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene 20 mg de ketoconazol. Excipientes con efecto conocido: Cada gramo de crema contiene
1. NOMBRE DEL MEDICAMENTO Ketoisdin 20 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene 20 mg de ketoconazol. Excipientes con efecto conocido: Cada gramo de crema contiene
LLD Abreviado de Zoloft. Todo medicamento debe conservarse fuera del alcance de los niños.
 LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
FICHA TÉCNICA. Por sobre: Acetato de calcio, 2,5 g (equivale a 635 mg de calcio), almidón de maíz, manitol (E421)
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
PROPUESTA DE FICHA TÉCNICA
 PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO Hodernal 800 mg/ml solución oral Parafina líquida 1. NOMBRE DEL MEDICAMENTO Hodernal 800 mg/ml solución oral. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO Hodernal 800 mg/ml solución oral Parafina líquida 1. NOMBRE DEL MEDICAMENTO Hodernal 800 mg/ml solución oral. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 42 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN CABERGOLINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 42 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN CABERGOLINA 4.2 Posología y forma
Las definiciones básicas (ACC/AHA)
 Las definiciones básicas (ACC/AHA) Qué es la? Cuáles son sus modalidades y criterios de diagnóstico? Qué significa IC con fracción de eyección reducida o preservada? El American College of Cardiology y
Las definiciones básicas (ACC/AHA) Qué es la? Cuáles son sus modalidades y criterios de diagnóstico? Qué significa IC con fracción de eyección reducida o preservada? El American College of Cardiology y
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)_Agosto_2016
 KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. RESINCALCIO polvo para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RESINCALCIO polvo para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 g de polvo para suspensión oral contienen 99,75 g de poliestireno sulfonato
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RESINCALCIO polvo para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 g de polvo para suspensión oral contienen 99,75 g de poliestireno sulfonato
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. ACICLOVIR COMBIX 800 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ACICLOVIR COMBIX 800 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de 800 mg contiene: Aciclovir (DCI) 800 mg. 3. FORMA FARMACÉUTICA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ACICLOVIR COMBIX 800 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de 800 mg contiene: Aciclovir (DCI) 800 mg. 3. FORMA FARMACÉUTICA
FICHA TÉCNICA. Azelastina hidrocloruro al 0,05% (0,5 mg/ml). Cada gota contiene 0,015 mg de azelastina hidrocloruro
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
ARIPIPRAZOL En adolescentes contrastorno Bipolar I
 ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS
 COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: Bortezomib
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: Bortezomib
NOMBRE DEL MEDICAMENTO COMPOSICIÓN CUALITATIVA Y CUANTITATIVA FORMA FARMACÉUTICA DATOS CLÍNICOS. Edad Peso corporal (aprox.) Posología (cada 6 horas)
 NOMBRE DEL MEDICAMENTO APIRETAL 100 mg/ml solución oral COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Fórmula por ml: Paracetamol... 100 mg Azorrubina (E-122)... 50 μg También contiene AGUA FORMA FARMACÉUTICA
NOMBRE DEL MEDICAMENTO APIRETAL 100 mg/ml solución oral COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Fórmula por ml: Paracetamol... 100 mg Azorrubina (E-122)... 50 μg También contiene AGUA FORMA FARMACÉUTICA
FICHA TÉCNICA. Tratamiento de la incontinencia urinaria asociada a la insuficiencia del esfínter uretral en la perra.
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp
 Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp Enf. María Guadalupe Vega Jefe de Piso Unidad de Terapia Intensiva Hospital General Las Américas, Ecatepec
Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp Enf. María Guadalupe Vega Jefe de Piso Unidad de Terapia Intensiva Hospital General Las Américas, Ecatepec
600 U.I. 480 mg 95% Ig. 67,5 mg 9,0 mg 3 ml. Solución inyectable con inmunoglobulinas, principalmente inmunoglobulina G (IgG).
 1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-HEPATITIS B GRIFOLS 600 U.I. GAMMA ANTI-HEPATITIS B GRIFOLS 1000 U.I. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 600 U.I. 1000 U.I. Inmunoglobulina
1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-HEPATITIS B GRIFOLS 600 U.I. GAMMA ANTI-HEPATITIS B GRIFOLS 1000 U.I. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 600 U.I. 1000 U.I. Inmunoglobulina
FICHA TÉCNICA. VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable
 FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
Enfermedad de Kawasaki
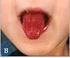 www.printo.it/pediatric-rheumatology/ar/intro Enfermedad de Kawasaki Versión de 2016 2. DIAGNÓSTICO Y TRATAMIENTO 2.1 Cómo se diagnostica? El diagnóstico de la enfermedad de Kawasaki se realiza en base
www.printo.it/pediatric-rheumatology/ar/intro Enfermedad de Kawasaki Versión de 2016 2. DIAGNÓSTICO Y TRATAMIENTO 2.1 Cómo se diagnostica? El diagnóstico de la enfermedad de Kawasaki se realiza en base
Patricia Novas Vidal R4 oncología médica H.U. Marqués de Valdecilla, Santander
 Neutropenia Febril Patricia Novas Vidal R4 oncología médica H.U. Marqués de Valdecilla, Santander 1. Introducción 2. Definición 3. Epidemiología 4. Evaluación inicial Índice 5. Paciente con bajo riesgo
Neutropenia Febril Patricia Novas Vidal R4 oncología médica H.U. Marqués de Valdecilla, Santander 1. Introducción 2. Definición 3. Epidemiología 4. Evaluación inicial Índice 5. Paciente con bajo riesgo
FICHA TÉCNICA. Glucosamina Teva 1.500 mg polvo para solución oral EFG
 1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
TEST DE INTOLERANCIA ALIMENTARIA
 TEST DE INTOLERANCIA ALIMENTARIA PUNTOS CLAVE Permite determinar la presencia y niveles de anticuerpos del tipo IgG frente a más de 200 alimentos diferentes. Se realiza el análisis de cada alimento por
TEST DE INTOLERANCIA ALIMENTARIA PUNTOS CLAVE Permite determinar la presencia y niveles de anticuerpos del tipo IgG frente a más de 200 alimentos diferentes. Se realiza el análisis de cada alimento por
Alivio de los sofocos que aparecen durante la menopausia como consecuencia de la deprivación estrogénica.
 1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
1. Tratamiento del estreñimiento 2. Tratamiento de la encefalopatia hepática (encefalopatía porto-sistémica); coma hepático
 1. NOMBRE DEL MEDICAMENTO Lactulosa Resolution 3,3 g/5 ml, solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 5 mililitros de solución oral contienen 3,3 g de lactulosa Para la lista completa
1. NOMBRE DEL MEDICAMENTO Lactulosa Resolution 3,3 g/5 ml, solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 5 mililitros de solución oral contienen 3,3 g de lactulosa Para la lista completa
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS
 COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: (erbitux
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: (erbitux
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
Reducción de la viscosidad de las secreciones mucosas, facilitando su expulsión, en resfriados y procesos gripales para niños de 2 a 12 años.
 1. NOMBRE DEL MEDICAMENTO Bisolvon Mucolítico infantil 0,8 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene 0,8 mg de bromhexina hidrocloruro. Excipientes con efecto conocido: Maltitol
1. NOMBRE DEL MEDICAMENTO Bisolvon Mucolítico infantil 0,8 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene 0,8 mg de bromhexina hidrocloruro. Excipientes con efecto conocido: Maltitol
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina
 FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
* producido en levadura Saccharomyces cerevisiae (cepa ) mediante tecnología recombinante de ADN.
 1. NOMBRE DEL MEDICAMENTO HBVAXPRO 40 microgramos, suspensión inyectable Vacuna antihepatitis B (radn) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis (1 ml) contiene: Antígeno de superficie del virus
1. NOMBRE DEL MEDICAMENTO HBVAXPRO 40 microgramos, suspensión inyectable Vacuna antihepatitis B (radn) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis (1 ml) contiene: Antígeno de superficie del virus
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
Sección 9: Antiparkinsonianos
 201 Sección 9: Antiparkinsonianos 9.1 Fármacos utilizados en el parkinsonismo...202 9.2 Fármacos utilizados en el temblor esencial y trastornos relacionados...204 202 9.1 Fármacos utilizados en el parkinsonismo
201 Sección 9: Antiparkinsonianos 9.1 Fármacos utilizados en el parkinsonismo...202 9.2 Fármacos utilizados en el temblor esencial y trastornos relacionados...204 202 9.1 Fármacos utilizados en el parkinsonismo
FICHA TÉCNICA. Solución estéril inyectable por vía intramuscular (preferiblemente) o subcutánea. Pneumo 23 es un líquido transparente e incoloro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA. Las personas con infección sintomática o asintomática por VIH, deben ser vacunadas lo antes posible, una vez confirmado el diagnóstico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
Cepa derivada de A/California/7/2009 (H1N1)pdm09: (NYMC X-181) 15 microgramos HA** Cepa derivada de A/Victoria/361/2011 (H3N2): (IVR-165)
 1. NOMBRE DEL MEDICAMENTO CHIROFLU, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Antígenos
1. NOMBRE DEL MEDICAMENTO CHIROFLU, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Antígenos
Uso Clínico-Oncológico- Bioquímico de Marcadores tumorales. Angel Gabriel D Annunzio Médico Oncólogo
 Uso Clínico-Oncológico- Bioquímico de Marcadores tumorales Angel Gabriel D Annunzio Médico Oncólogo Ca 19.9 Baja Especificidad Cancer de Colon Tumores de vía biliar Cáncer de estómago Tumores de la vía
Uso Clínico-Oncológico- Bioquímico de Marcadores tumorales Angel Gabriel D Annunzio Médico Oncólogo Ca 19.9 Baja Especificidad Cancer de Colon Tumores de vía biliar Cáncer de estómago Tumores de la vía
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
Se recomiendan las siguientes modificaciones en caso de disfunción renal.
 1. NOMBRE DEL MEDICAMENTO ACICLOVIR TEDEC 25 mg/ml solución para perfusión EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla contiene: Aciclovir (D.O.E.) 250 mg Para excipientes, ver 6.1. 3. FORMA
1. NOMBRE DEL MEDICAMENTO ACICLOVIR TEDEC 25 mg/ml solución para perfusión EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla contiene: Aciclovir (D.O.E.) 250 mg Para excipientes, ver 6.1. 3. FORMA
FICHA TÉCNICA. Niños menores de 1 año: no se ha establecido la seguridad y eficacia de Thrombocid Forte en niños menores de 1 año.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Thrombocid Forte 5 mg/g pomada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene: Pentosano polisulfato sódico...5 mg Excipientes: Alcohol
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Thrombocid Forte 5 mg/g pomada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene: Pentosano polisulfato sódico...5 mg Excipientes: Alcohol
SUTENT (Sunitinib) Cápsulas
 SUTENT (Sunitinib) Cápsulas 1. NOMBRE DEL PRODUCTO FARMACÉUTICO SUTENT 12.5 mg Cápsulas SUTENT 25 mg Cápsulas SUTENT 50 mg Cápsulas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula de SUTENT 12.5
SUTENT (Sunitinib) Cápsulas 1. NOMBRE DEL PRODUCTO FARMACÉUTICO SUTENT 12.5 mg Cápsulas SUTENT 25 mg Cápsulas SUTENT 50 mg Cápsulas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula de SUTENT 12.5
ETOPOSIDO 100mg/5mL. 1. Identificación del Medicamento. Nombre Comercial. Etoposido 100mg/5mL Solución Inyectable. Nombre Genérico.
 ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
GPC. Guía de Referencia Rápida. Diagnóstico y manejo en niños con Bronquiolitis en fase aguda
 Guía de Referencia Rápida Diagnóstico y manejo en niños con Bronquiolitis en fase aguda GPC Guía de Práctica Clínica Catalogo Maestro de Guías de Práctica Clínica: IMSS-032-08. Guía de Referencia Rápida
Guía de Referencia Rápida Diagnóstico y manejo en niños con Bronquiolitis en fase aguda GPC Guía de Práctica Clínica Catalogo Maestro de Guías de Práctica Clínica: IMSS-032-08. Guía de Referencia Rápida
9. Profilaxis de la ITU
 9. Profilaxis de la ITU 9.1. Profilaxis antibiótica en población pediátrica sin alteraciones estructurales y/o funcionales del tracto urinario comprobadas En lactantes y población pediátrica sin alteraciones
9. Profilaxis de la ITU 9.1. Profilaxis antibiótica en población pediátrica sin alteraciones estructurales y/o funcionales del tracto urinario comprobadas En lactantes y población pediátrica sin alteraciones
Preguntas para responder
 Preguntas para responder TRATAMIENTO DE LA EPOC EN FASE ESTABLE 1. Existe evidencia para aconsejar un tipo concreto de broncodilatador de acción mantenida en monoterapia cuando se inicia el tratamiento
Preguntas para responder TRATAMIENTO DE LA EPOC EN FASE ESTABLE 1. Existe evidencia para aconsejar un tipo concreto de broncodilatador de acción mantenida en monoterapia cuando se inicia el tratamiento
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 BROMHEXINA 4 mg/5 ml JARABE MUCOLÍTICO, EXPECTORANTE Página 1 BROMHEXINA 4 mg/5 ml Jarabe Principio Activo Bromhexina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 BROMHEXINA 4 mg/5 ml JARABE MUCOLÍTICO, EXPECTORANTE Página 1 BROMHEXINA 4 mg/5 ml Jarabe Principio Activo Bromhexina
SIM EXPRESS Información dirigida a los profesionales de la salud Teriflunomida
 COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos 23/04/2015 SIM EXPRESS Información dirigida
COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos 23/04/2015 SIM EXPRESS Información dirigida
Para más información sobre el tratamiento con Simponi, el paciente deberá leer el prospecto o consultar a su médico o farmacéutico.
 EMA/412395/2016 EMEA/H/C/000992 Resumen del EPAR para el público general golimumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo la Agencia ha evaluado
EMA/412395/2016 EMEA/H/C/000992 Resumen del EPAR para el público general golimumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo la Agencia ha evaluado
Contraindicaciones de las Vacunas
 Contraindicaciones de las Vacunas Alergias Los alérgicos a la levadura no deberían recibir la vacuna de la hepatitis B. Los que tienen una historia de anafilaxia (alergia grave) a la gelatina no deben
Contraindicaciones de las Vacunas Alergias Los alérgicos a la levadura no deberían recibir la vacuna de la hepatitis B. Los que tienen una historia de anafilaxia (alergia grave) a la gelatina no deben
PROSPECTO: INFORMACIÓN PARA EL PACIENTE BISOLVON MUCOLÍTICO INFANTIL 0,8 MG/ML JARABE. Bromhexina hidrocloruro
 PROSPECTO: INFORMACIÓN PARA EL PACIENTE BISOLVON MUCOLÍTICO INFANTIL 0,8 MG/ML JARABE Bromhexina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
PROSPECTO: INFORMACIÓN PARA EL PACIENTE BISOLVON MUCOLÍTICO INFANTIL 0,8 MG/ML JARABE Bromhexina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Ceccato F, Gontero R, Negri M, Rolla I, Crabbe E, Ortiz A, Paira S. Sección Reumatología, Hospital Cullen. Santa Fe, Argentina.
 Elevación de las enzimas hepáticas y leucopenia en pacientes con Artritis Reumatoidea y Artropatía Psoriática tratados con metotrexate y/o leflunomida. Ceccato F, Gontero R, Negri M, Rolla I, Crabbe E,
Elevación de las enzimas hepáticas y leucopenia en pacientes con Artritis Reumatoidea y Artropatía Psoriática tratados con metotrexate y/o leflunomida. Ceccato F, Gontero R, Negri M, Rolla I, Crabbe E,
ESTATINAS EN PERSONAS MAYORES
 ESTATINAS EN PERSONAS MAYORES Farmacia Atención Primaria Sevilla Servicios de Farmacia de las Áreas y Distritos Sanitarios Aljarafe Norte, Sevilla, Sur y Osuna Consideraciones previas Principalmente prescritas
ESTATINAS EN PERSONAS MAYORES Farmacia Atención Primaria Sevilla Servicios de Farmacia de las Áreas y Distritos Sanitarios Aljarafe Norte, Sevilla, Sur y Osuna Consideraciones previas Principalmente prescritas
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Docetaxel Winthrop20 mg/1 ml concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Docetaxel Winthrop20 mg/1 ml concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA 3. FORMA FARMACÉUTICA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
CENAVUL Suspensión inyectable
 Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
FICHA TÉCNICA. Vispring 500 microgramos/ml colirio en solución en envases unidosis
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vispring 500 microgramos/ml colirio en solución en envases unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de colirio en solución contiene: Tetrizolina
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vispring 500 microgramos/ml colirio en solución en envases unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de colirio en solución contiene: Tetrizolina
No. el alcohol no altera el mecanismo de acción o los efectos del Andanza.
 GUÍA SOBRE 1 1. Qué es Es un fármaco aprobado para su uso como adyuvante, del plan alimentario hipocalórico y la práctica de ejercicio, en el manejo del sobrepeso y la obesidad en adolescentes y adultos.
GUÍA SOBRE 1 1. Qué es Es un fármaco aprobado para su uso como adyuvante, del plan alimentario hipocalórico y la práctica de ejercicio, en el manejo del sobrepeso y la obesidad en adolescentes y adultos.
COMITÉ REGIONAL DE CONTROL Y VIGILANCIA PARA EL HANTA
 COMITÉ REGIONAL DE CONTROL Y VIGILANCIA PARA EL HANTA SINDROME PULMONAR POR HANTA VIRUS Por orden del SEREMI Res. Nº 0476/05 T.M. EDUARDO RETAMALES CASTELLETTO INSTITUTO DE SALUD PÚBLICA DE CHILE ANTECEDENTES
COMITÉ REGIONAL DE CONTROL Y VIGILANCIA PARA EL HANTA SINDROME PULMONAR POR HANTA VIRUS Por orden del SEREMI Res. Nº 0476/05 T.M. EDUARDO RETAMALES CASTELLETTO INSTITUTO DE SALUD PÚBLICA DE CHILE ANTECEDENTES
INFLUENZA. Curso de Capacitación para Vacunadores. CHLA-EP Setiembre 2008
 INFLUENZA Curso de Capacitación para Vacunadores. CHLA-EP Setiembre 2008 Infecciones respiratorias agudas de potencial pandemico 1. Influenza estacional 2. Influenza aviar 3. SARS VIRUS INFLUENZA FAMILIA
INFLUENZA Curso de Capacitación para Vacunadores. CHLA-EP Setiembre 2008 Infecciones respiratorias agudas de potencial pandemico 1. Influenza estacional 2. Influenza aviar 3. SARS VIRUS INFLUENZA FAMILIA
FICHA TÉCNICA. Albutein 5% es una solución que contiene 50 g/l de proteína total, de las cuales al menos un 95% es albúmina humana.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Albutein 5% solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Albúmina humana. Albutein 5% es una solución que contiene 50 g/l de proteína total,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Albutein 5% solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Albúmina humana. Albutein 5% es una solución que contiene 50 g/l de proteína total,
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA. Gotas Óticas. Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g.
 DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
FICHA TÉCNICA. Cada gramo de crema de Aciclovir Sandoz 50 mg/g crema contiene 50 mg de aciclovir.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Sandoz 50 mg/g crema EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema de Aciclovir Sandoz 50 mg/g crema contiene 50 mg de aciclovir. Excipientes
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Sandoz 50 mg/g crema EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema de Aciclovir Sandoz 50 mg/g crema contiene 50 mg de aciclovir. Excipientes
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
Procedimiento para la administración de la vacuna frente al Virus del Papiloma Humano (VPH) en la Comunidad Valenciana
 Procedimiento para la administración de la vacuna frente al Virus del Papiloma Humano (VPH) en la Comunidad Valenciana Desde la aparición de dos casos de adolescentes que experimentaron una posible reacción
Procedimiento para la administración de la vacuna frente al Virus del Papiloma Humano (VPH) en la Comunidad Valenciana Desde la aparición de dos casos de adolescentes que experimentaron una posible reacción
Dr. Max Santiago Bordelois Abdo Esp. 2do Grado en Medicina Intensiva y Emergencias. Profesor Auxiliar CUBA
 Dr. Max Santiago Bordelois Abdo Esp. 2do Grado en Medicina Intensiva y Emergencias. Profesor Auxiliar CUBA Se presenta entre un 5 y 7 % del embarazo. TA diastólica > ó = a 110 mmhg en una toma aislada.
Dr. Max Santiago Bordelois Abdo Esp. 2do Grado en Medicina Intensiva y Emergencias. Profesor Auxiliar CUBA Se presenta entre un 5 y 7 % del embarazo. TA diastólica > ó = a 110 mmhg en una toma aislada.
