Anexo II. Conclusiones científicas y motivos para la modificación de los términos de la autorización de comercialización
|
|
|
- Inés Godoy Rico
- hace 6 años
- Vistas:
Transcripción
1 Anexo II Conclusiones científicas y motivos para la modificación de los términos de la autorización de comercialización 13
2 Conclusiones científicas 15. Resumen general de la evaluación científica de Plendil y denominaciones asociadas (ver anexo I) 16. Felodipino es un antagonista del calcio (bloqueante de los canales del calcio) dihidropiridínico, indicado para el control de la hipertensión y, en muchos países, también para el tratamiento de la angina de pecho estable. Plendil se aprobó para su comercialización por primera vez en Dinamarca el 16 de marzo de 1987, como comprimidos de liberación inmediata. Esta formulación estuvo disponible hasta 1994 y en ese intervalo solo se comercializó en Australia. Hoy en día, Plendil está disponible en todo el mundo para administración oral en forma de comprimidos de liberación prolongada (excepto en Japón, donde se comercializa en una presentación distinta de liberación inmediata). En Europa, los comprimidos de liberación prolongada se aprobaron por primera vez en diciembre de 1987 y se comercializaron por primera vez en Dinamarca en Se presentan en tres concentraciones distintas: 2,5 mg, 5 mg y 10 mg. Plendil se ha aprobado por medio de procedimientos nacionales en los siguientes países del Espacio Económico Europeo (EEE): Alemania, Austria, Bélgica, Bulgaria, Chipre, Croacia, Dinamarca, Eslovaquia, España, Estonia, Finlandia, Francia, Grecia, Hungría, Irlanda, Islandia, Italia, Letonia, Lituania, Luxemburgo, Malta, Noruega, Países Bajos, Polonia, Portugal, República Checa, Rumanía, Reino Unido y Suecia. Se han llevado a cabo tres procedimientos europeos para acordar el texto del Resumen de las Características del Producto (RCP) de Plendil: UK/W/002/pdWS/001, división del trabajo pediátrico de conformidad con el artículo 45, finalizado el 15 de octubre de SK/H/PSUR/0006/001, IPS (1 de enero de 2007 a 31 de diciembre de 2009), finalizado el 20 de octubre de 2011 con acuerdo sobre el perfil de seguridad básico (PSB). SK/H/PSUR/0006/002, IPS (1 de enero de 2010 a 31 de diciembre de 2012), finalizado el 4 de diciembre de 2013 sin cambios propuestos en la información sobre el producto. Dadas las decisiones nacionales divergentes tomadas por los Estados miembros (EM) con respecto a la autorización de Plendil y denominaciones asociadas, estos productos se incluyeron en la lista de productos para la armonización del RCP, solicitada por el Grupo de Coordinación de los Procedimientos de Reconocimiento Mutuo y Descentralizados - Medicamentos Humanos (CMDh). La Comisión Europea notificó a la secretaría de la Agencia Europea de Medicamentos/Comité de Medicamentos de Uso Humano (EMA/CHMP) el establecimiento de un procedimiento de arbitraje conforme al artículo 30 de la Directiva 2001/83/CE con el fin de solucionar las diferencias en las informaciones sobre el producto (IP) autorizadas por procedimientos nacionales para los productos antes mencionados y, en consecuencia, armonizarlas en toda la UE. El 14 de octubre de 2013 tuvo lugar un encuentro entre la EMA y el titular de la autorización de comercialización (TAC). El CHMP planteó al TAC una serie de preguntas sobre las partes del RCP en las que existían diferencias. A continuación se resumen los principales puntos examinados para la armonización de las distintas secciones del RCP. 14
3 Sección Indicaciones terapéuticas Plendil está indicado en la: hipertensión; angina de pecho estable. El texto relativo a la hipertensión no coincidía en todos los EM de la UE. El CHMP respaldó la propuesta del TAC de utilizar el término «hipertensión» para esta indicación. Para la indicación «angina de pecho estable» se encontraron varias divergencias. Los distintos EM utilizaban «angina de pecho estable y angina vasoespástica (variante de la angina de Prinzmetal», «profilaxis de la angina de pecho (formas estables y vasoespásticas)», «angina de pecho» y «angina de esfuerzo estable; Plendil puede administrarse en monoterapia o combinado con un betabloqueante. Plendil puede utilizarse también para tratar la angina vasoespástica (de Prinzmetal)». El TAC propuso no incluir la indicación de angina vasoespástica en el RCP armonizado. El CHMP solicitó al TAC un análisis más exhaustivo de todos los datos disponibles sobre felodipino y los antagonistas del calcio dihidropiridínicos para respaldar la indicación de angina vasoespástica, ya que actualmente los antagonistas del calcio ocupan un lugar destacado en esta indicación. Los resultados de los estudios realizados con felodipino en la angina vasoespástica demuestran un efecto sobre la enfermedad, con mejora de los síntomas de la angina y disminución o desaparición de las elevaciones transitorias del segmento ST en hiperventilación o provocación sistémica con ergometrina. Sin embargo, fuera de los ensayos de referencia no se han encontrado publicaciones significativas y todo el material comunicado sobre el uso de felodipino en la angina vasoespástica se reduce a unos 30 pacientes. Las experiencias publicadas sobre felodipino en la angina vasoespástica y la información sobre seguridad acumulada son, en conjunto, demasiado limitadas como para definir una relación beneficio/riesgo sólida. Los datos sobre eficacia y seguridad específicos de felodipino en esta indicación son muy escasos y el TAC no ha analizado la extrapolabilidad de los resultados obtenidos con otras dihidropiridinas en esta indicación. En consecuencia, el CHMP estuvo de acuerdo con el TAC en que, aunque la angina vasoespástica es un trastorno para el cual las directrices clínicas actuales de la Sociedad Europea de Cardiología recomiendan el uso de antagonistas del calcio como felodipino como primera línea de tratamiento, no puede justificarse una indicación en la angina vasoespástica. Sección Posología y forma de administración La sección 4.2 no coincidía entre los EM. Las divergencias se debían a diferencias en la indicación, la recomendación posológica máxima diaria y el ajuste descendente de la dosis. También se encontraron diferencias en las recomendaciones para grupos especiales de población como los pacientes de edad avanzada y los pacientes pediátricos, los pacientes con insuficiencia renal y hepática, y respecto a la administración con o sin alimentos. El CHMP apoya la propuesta del TAC de adoptar el texto del PSB como el texto armonizado, suprimiendo el texto que no figure en dicho documento. Sección Contraindicaciones Se encontraron divergencias en la sección 4.3 del RCP. El CHMP pidió al TAC que aclarase las siguientes contraindicaciones: accidente cerebrovascular en los 6 meses anteriores, miocardiopatía hipertrófica, bloqueo auriculoventricular de grados 2 y 3, insuficiencia renal grave (TFG < 30 ml/min, creatinina > 1,8 mg/dl), insuficiencia hepática graves/cirrosis hepática, mujeres/niños lactantes y tratamiento con antagonistas del calcio. 15
4 El CHMP aceptó la propuesta del TAC de adoptar las siguientes contraindicaciones: embarazo; hipersensibilidad a felodipino, o a alguno de los excipientes incluidos en la sección 6.1; insuficiencia cardíaca descompensada, en lugar de insuficiencia cardíaca no compensada, como se indicaba anteriormente; infarto agudo de miocardio; angina de pecho inestable; obstrucción de las válvulas cardíacas hemodinámicamente significativa y obstrucción del flujo cardíaco dinámico, como texto armonizado. Sección Advertencias y precauciones especiales de empleo Se encontraron divergencias en la sección 4.4 del RCP. En algunos EM faltaba texto del PSB y en otros EM el texto era distinto. Teniendo en cuenta que el aumento gingival es una de las reacciones adversas conocidas al tratamiento con felodipino y que puede prevenirse mediante una cuidadosa higiene dental, el CHMP aceptó la propuesta del TAC de incluir en la sección 4.4 del RCP armonizado para la UE de Plendil la advertencia siguiente: «Se ha notificado un leve aumento gingival en pacientes con gingivitis o periodontitis pronunciadas». El uso junto con inhibidores o inductores potentes de la enzima CYP3A4 se aborda más específicamente en las secciones 4.5 y 5.2 de la propuesta del TAC para un RCP armonizado para la UE de Plendil. El CHMP considera, por tanto, que es necesario incluir el texto siguiente en la sección 4.4, con una referencia a la sección 4.5: «La administración concomitante de fármacos inhibidores o inductores potentes de la enzima CYP3A4 puede aumentar o disminuir las concentraciones plasmáticas de felodipino, respectivamente, de forma considerable. Por tanto, tales combinaciones deben evitarse (ver sección 4.5)». En vista de la falta de pruebas que avalen el uso de felodipino en las urgencias hipertensivas, y de acuerdo con la información sobre el producto de amlodipino, los ponentes han considerado necesario, además de la advertencia «No se ha estudiado la eficacia y seguridad de felodipino en el tratamiento de las urgencias hipertensivas», incluir también la advertencia tal como se propone en la lista de cuestiones pendientes. Por último, el CHMP solicitó al TAC que añadiera una advertencia respecto al aceite de ricino. La información sobre el aceite de ricino se facilita en la sección 2 y la sección 6 del texto propuesto para el RCP armonizado; el TAC considera que el aceite de ricino utilizado como excipiente en los comprimidos de Plendil se encuentra en una concentración demasiado baja como para provocar algún efecto, excepto por una posible hipersensibilidad, y la hipersensibilidad a cualquiera de los componentes del producto es en sí misma una contraindicación. El TAC estuvo de acuerdo e incluyó la advertencia siguiente: «Plendil contiene aceite de ricino, que puede producir molestias de estómago y diarrea». Sección Interacción con otros medicamentos y otras formas de interacción El TAC propuso utilizar en la sección 4.5 el texto del PSB, con adiciones o supresiones según la ficha de información básica (FIB). El texto de esta sección difería en los distintos RCP de la UE. El CHMP solicitó al TAC que insertase texto relativo a las interacciones que pueden provocar un aumento de la concentración plasmática de felodipino y las interacciones que pueden provocar una disminución de la misma. Tales cambios se acordaron en consecuencia. 16
5 Sección Fertilidad, embarazo y lactancia El texto de la sección 4.6 no coincidía. El TAC facilitó al CHMP la justificación del motivo por el cual la frase «Los estudios de toxicidad para la reproducción han demostrado efectos fetotóxicos» no se debería incluir en el RCP armonizado para la UE de Plendil. Los resultados de los estudios de reproducción no demuestran una fetotoxicidad directa. El TAC considera que los resultados sobre el desarrollo fetal en conejos y las consecuencias de la prolongación del parto en ratas se deben a la acción farmacológica de felodipino. El TAC aceptó incluir la siguiente advertencia: «En los estudios no clínicos de toxicidad reproductiva se han observado efectos sobre el desarrollo fetal que se consideran debidos a la acción farmacológica de felodipino». Embarazo Respecto a la frase «Debe excluirse un posible embarazo antes de comenzar el tratamiento con felodipino/deben adoptarse métodos anticonceptivos adecuados para prevenir el embarazo», en los estudios de farmacovigilancia de Plendil realizados por el TAC no se ha encontrado un aumento del número o la intensidad de los efectos adversos relacionados con la fertilidad o el embarazo. Además, durante las primeras semanas del embarazo, el embrión se alimenta del saco vitelino y, por tanto, no está expuesto al felodipino que tome la madre. El reconocimiento subjetivo del embarazo suele producirse al final de este periodo. Es de esperar que se haya informado a la paciente de que, en tal situación, debe consultar a un médico, y que se valoren todos los aspectos terapéuticos, incluyendo las medidas con respecto a la interrupción del tratamiento con felodipino. El CHMP estuvo de acuerdo con la postura del TAC de no incluir la frase «Debe excluirse un posible embarazo antes de comenzar el tratamiento con felodipino/deben adoptarse métodos anticonceptivos adecuados para prevenir el embarazo» en la sección 4.6 del RCP armonizado para la UE de Plendil. El texto final acordado es el siguiente: «Felodipino no debe utilizarse durante el embarazo. En los estudios no clínicos de toxicidad reproductiva se han observado efectos sobre el desarrollo fetal que se consideran debidos a la acción farmacológica de felodipino». Lactancia La propuesta inicial del TAC para el texto armonizado en la UE sobre el embarazo era «Felodipino se excreta en la leche materna, pero si se administra a la madre lactante en dosis terapéuticas, es improbable que afecte al lactante». El CHMP solicitó al TAC que aportase más datos para respaldar esta frase y, en caso de que no hubiera datos disponibles, debía añadir que no era recomendable la lactancia durante el tratamiento con felodipino dada la falta de datos al respecto. El TAC volvió a redactar el texto conforme a la solicitud del CHMP, de la siguiente manera: «Felodipino se excreta en la leche materna y, debido a que los datos sobre el posible efecto para el lactante son insuficientes, no se recomienda el tratamiento durante la lactancia». Fertilidad Se acordó el texto siguiente: No hay datos clínicos sobre los efectos de felodipino sobre la fertilidad del paciente. En un estudio no clínico sobre reproducción en ratas (ver sección 5.3) se observaron efectos sobre el desarrollo fetal, pero no efectos sobre la fertilidad, a dosis equivalentes a las dosis terapéuticas en seres humanos. Sección Efectos sobre la capacidad para conducir y utilizar máquinas El CHMP propuso un texto alternativo de acuerdo con el RCP armonizado de amlodipino para esta sección: «Felodipino puede tener una influencia escasa o moderada sobre la capacidad para conducir y 17
6 utilizar máquinas. Si los pacientes que toman felodipino sufren cefalea, náuseas, mareos o fatiga, la capacidad de reacción puede verse afectada. Se recomienda precaución especialmente al inicio del tratamiento». El TAC estuvo de acuerdo con el texto propuesto más arriba. Sección 4.8 Reacciones adversas El texto de la sección 4.8 no coincidía. Las propuestas para el RCP armonizado para la UE se basan en el PSB de 2011 y la FIB de octubre de Las modificaciones se refieren a la supresión de texto innecesario y obsoleto, el formato de las tablas y la inclusión de la hipotensión como reacción adversa. El TAC justificó la eliminación de reacciones adversas utilizando el método bayesiano empírico de prospección de datos para computar los valores desproporcionados de la base de datos de seguridad global del TAC. Este método genera la media geométrica bayesiana empírica con un intervalo de confianza del 90 % (EB05 a EB95). El TAC consideró una EB05 > 1,8 como una posible señal, es decir, el episodio se notifica como desproporcionado con frecuencia en asociación con ese fármaco. También se realizaron búsquedas en la base de datos del sistema de notificación de reacciones adversas de la FDA (AERS) y en la base de datos de farmacovigilancia de la OMS. En general, el CHMP consideró aceptables los motivos señalados para no incluir los acontecimientos adversos que se recogen en uno o unos pocos textos nacionales. Sección 4.9 Sobredosis El CHMP estuvo de acuerdo con la propuesta del TAC de realizar pequeños cambios en el texto de la sección 4.9 de la FIB y de aplicarlos al texto armonizado en todos los EM de la UE. El CHMP solicitó al TAC que añadiera información sobre las circunstancias en las que estaría indicado un lavado gástrico. Sección Propiedades farmacodinámicas El CHMP solicitó al TAC que acortase el texto relativo a las propiedades farmacodinámicas, ya que incluye partes de escasa relevancia clínica o que se consideran no justificadas mediante pruebas clínicas. El TAC estuvo de acuerdo en eliminar las partes indicadas por el CHMP. Sección Propiedades farmacocinéticas El texto de la sección 5.2 no coincidía entre los EM. Algunos EM no incluían información relativa a la absorción, distribución, metabolismo y eliminación. El CHMP estuvo de acuerdo con la opinión del TAC de adoptar el texto de la FIB con algunas modificaciones, puesto que abarca las propiedades farmacocinéticas de felodipino. Sección 5.3 Datos preclínicos sobre seguridad El TAC propuso utilizar la sección 5.3 de la FIB para la sección de datos preclínicos del RCP armonizado de felodipino, ya que el texto se basa en la nomenclatura no clínica actual. El CHMP solicitó la adición de texto. El TAC incluyó la información relativa a los datos preclínicos, así como el correspondiente texto declarando que no puede determinarse con certeza que los efectos farmacológicos no sean relevantes para los seres humanos. 18
7 Motivos para la modificación de los términos de las autorizaciones de comercialización En resumen, a partir de la evaluación de la propuesta y las respuestas del TAC, y tras los correspondientes debates internos en el seno del Comité, el CHMP aprobó los documentos armonizados de información sobre el producto de Plendil y denominaciones asociadas. Considerando que el ámbito del procedimiento de arbitraje era la armonización del Resumen de las Características del Producto, el etiquetado y el prospecto, se ha evaluado el Resumen de las Características del Producto, el etiquetado y el prospecto propuestos por los titulares de la autorización de comercialización, a partir de la documentación presentada y del debate científico mantenido en el seno del Comité, el CHMP ha recomendado la modificación de los términos de las autorizaciones de comercialización, a cuyo efecto se incluyen en el anexo III el Resumen de las Características del Producto, el etiquetado y el prospecto para Plendil y denominaciones asociadas (ver anexo I). 19
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO bucomax pastillas para chupar sabor menta bucomax pastillas para chupar sabor fresa bucomax pastillas para chupar sabor miel y limón 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
1. NOMBRE DEL MEDICAMENTO bucomax pastillas para chupar sabor menta bucomax pastillas para chupar sabor fresa bucomax pastillas para chupar sabor miel y limón 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
Resumen general de la evaluación científica de los medicamentos que contienen nimesulida para uso sistémico (Ver Anexo I)
 Anexo II Conclusiones científicas y motivos de la modificación de los resúmenes de las características del producto y los prospectos presentados por la EMA 41 Conclusiones científicas Resumen general de
Anexo II Conclusiones científicas y motivos de la modificación de los resúmenes de las características del producto y los prospectos presentados por la EMA 41 Conclusiones científicas Resumen general de
FICHA TÉCNICA. Sorbitol líquido (no cristalizante); 1 ml de jarabe contiene 495,6 mg de sorbitol (E 420).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Bisolvon Expectorante jarabe Extracto seco de hojas de hiedra 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa 1 ml de jarabe de
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Bisolvon Expectorante jarabe Extracto seco de hojas de hiedra 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa 1 ml de jarabe de
FICHA TÉCNICA. Excipientes con efecto conocido 1,38 g de sacarosa y 1,10 g glucosa. Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor menta 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor menta 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
FICHA TÉCNICA. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución contiene 100 mg de simeticona. Excipientes con efecto conocido:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 100 mg/ml gotas orales en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución contiene 100 mg de simeticona. Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 100 mg/ml gotas orales en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución contiene 100 mg de simeticona. Excipientes con efecto conocido:
FICHA TÉCNICA. Adultos y niños mayores de 12 años: máximo 10 mg al día en una única toma
 1. NOMBRE DEL MEDICAMENTO REACTINE 10 mg Comprimidos FICHA TÉCNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de cetirizina (DOE) dihidrocloruro Lista de excipientes, en 6.1
1. NOMBRE DEL MEDICAMENTO REACTINE 10 mg Comprimidos FICHA TÉCNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de cetirizina (DOE) dihidrocloruro Lista de excipientes, en 6.1
Posología Adultos y adolescentes mayores de 12 años: administrar 30 ml (195 mg) cada 4 horas. La dosis máxima mg / 24 h.
 1. NOMBRE DEL MEDICAMENTO Frispec 6,5 mg/ ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Guaifenesina 6,5 mg Excipientes con efecto conocido: Parahidroxibenzoato de metilo
1. NOMBRE DEL MEDICAMENTO Frispec 6,5 mg/ ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Guaifenesina 6,5 mg Excipientes con efecto conocido: Parahidroxibenzoato de metilo
FICHA TECNICA. Acamprosato 333 mg Para consultar la lista completa de excipientes, ver sección 6.1
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO ZULEX 333 mg, Comprimidos recubiertos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Acamprosato 333 mg Para consultar la lista completa de excipientes, ver sección 6.1
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO ZULEX 333 mg, Comprimidos recubiertos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Acamprosato 333 mg Para consultar la lista completa de excipientes, ver sección 6.1
FICHA TÉCNICA. Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Oculotect 50 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 50 mg de povidona K25. Para consultar la lista
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Oculotect 50 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 50 mg de povidona K25. Para consultar la lista
L 90/106 Diario Oficial de la Unión Europea
 L 90/106 Diario Oficial de la Unión Europea 28.3.2013 DECISIÓN DE LA COMISIÓN de 26 de marzo de 2013 por la que se determinan las asignaciones anuales de emisiones de los Estados miembros para el período
L 90/106 Diario Oficial de la Unión Europea 28.3.2013 DECISIÓN DE LA COMISIÓN de 26 de marzo de 2013 por la que se determinan las asignaciones anuales de emisiones de los Estados miembros para el período
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TÉCNICA. LORATADINA KERN PHARMA está indicado para el tratamiento sintomático de rinitis alérgica y urticaria idiopática crónica.
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO LORATADINA KERN PHARMA 10 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Lista de excipientes,
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO LORATADINA KERN PHARMA 10 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Lista de excipientes,
PROPUESTA DE FICHA TÉCNICA
 PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
Potenciator 5 g solución oral está indicado en adultos y adolescentes mayores de 12 años.
 POTENCIATOR 1. NOMBRE DEL MEDICAMENTO. Potenciator 5 g solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla de 10 ml contiene 5 g de Aspartato de arginina Excipientes con efecto conocido:
POTENCIATOR 1. NOMBRE DEL MEDICAMENTO. Potenciator 5 g solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla de 10 ml contiene 5 g de Aspartato de arginina Excipientes con efecto conocido:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Dolovet vet 2,4 g polvo para uso oral. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Principio(s) activo(s): Ketoprofeno
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Dolovet vet 2,4 g polvo para uso oral. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Principio(s) activo(s): Ketoprofeno
Forma farmacéutica Vía de administración. Contenido (Concentración) Estado miembro. Nombre. Dinamarca. Vantas 50 mg Implante Subcutánea 50 mg
 ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA FARMACÉUTICA, DOSIS, VÍA DE ADMINISTRACIÓN, SOLICITANTE, TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS Estado miembro Dinamarca
ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA FARMACÉUTICA, DOSIS, VÍA DE ADMINISTRACIÓN, SOLICITANTE, TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS Estado miembro Dinamarca
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
POBLACIÓN EN JEREZ DE LA FRONTERA, SEGÚN PROCEDENCIA Nacidos en España Nacidos en la misma Comunidad Nacidos en la misma
 POBLACIÓN EN JEREZ DE LA FRONTERA, SEGÚN PROCEDENCIA Nacidos en España 2011 203.431 Nacidos en la misma Comunidad 2011 191.725 Nacidos en la misma Comunidad y en la misma provincia 2011 179.709 Nacidos
POBLACIÓN EN JEREZ DE LA FRONTERA, SEGÚN PROCEDENCIA Nacidos en España 2011 203.431 Nacidos en la misma Comunidad 2011 191.725 Nacidos en la misma Comunidad y en la misma provincia 2011 179.709 Nacidos
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Ultra Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Ultra Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 GRISEOFULVINA 125 mg/5 ml SUSPENSION ANTIMICÓTICO Página 1 GRISEOFULVINA 125 mg/5 ml Suspensión Principio Activo
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 GRISEOFULVINA 125 mg/5 ml SUSPENSION ANTIMICÓTICO Página 1 GRISEOFULVINA 125 mg/5 ml Suspensión Principio Activo
Anexo II. Modificaciones a las secciones pertinentes de la ficha técnica y el prospecto
 Anexo II Modificaciones a las secciones pertinentes de la ficha técnica y el prospecto 6 Para los medicamentos que contienen los inhibidores de la enzima convertidora de angiotensina (IECA) benazepril,
Anexo II Modificaciones a las secciones pertinentes de la ficha técnica y el prospecto 6 Para los medicamentos que contienen los inhibidores de la enzima convertidora de angiotensina (IECA) benazepril,
AYUDA ECONÓMICA PARA BENEFICIARIOS
 AYUDA ECONÓMICA PARA BENEFICIARIOS BECA ERASMUS+ CURSO 2015/16 ORGANISMOS Servicio Español para la Internacionalización de la Educación (SEPIE) anteriormente (OAPEE). Secretaría de Estado. Junta de Andalucía.
AYUDA ECONÓMICA PARA BENEFICIARIOS BECA ERASMUS+ CURSO 2015/16 ORGANISMOS Servicio Español para la Internacionalización de la Educación (SEPIE) anteriormente (OAPEE). Secretaría de Estado. Junta de Andalucía.
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSCTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSCTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Cellufresh 5 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSCTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Cellufresh 5 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea
 FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
FICHA TÉCNICA. Supositorios incoloros semitransparentes envasados en blíster de aluminio-polietileno.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO SUPOSITORIOS DE GLICERINA MICRALAX ADULTOS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Supositorios incoloros semitransparentes envasados en
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO SUPOSITORIOS DE GLICERINA MICRALAX ADULTOS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Supositorios incoloros semitransparentes envasados en
FICHA TÉCNICA. Azelastina hidrocloruro al 0,05% (0,5 mg/ml). Cada gota contiene 0,015 mg de azelastina hidrocloruro
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
1 comprimido de mg contiene los siguientes principios activos:
 1. NOMBRE DEL MEDICAMENTO Rennie Refluxine Comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 comprimido de 3.486 mg contiene los siguientes principios activos: Carbonato cálcico 1.250
1. NOMBRE DEL MEDICAMENTO Rennie Refluxine Comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 comprimido de 3.486 mg contiene los siguientes principios activos: Carbonato cálcico 1.250
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
TIOCOLCHICÓSIDO ( ADALGUR ): INFORMACIÓN IMPORTANTE CON RESPECTO A LAS INDICACIONES, DOSIFICACIÓN, CONTRAINDICACIONES Y PRECAUCIONES DE USO
 TIOCOLCHICÓSIDO ( ADALGUR ): INFORMACIÓN IMPORTANTE CON RESPECTO A LAS INDICACIONES, DOSIFICACIÓN, CONTRAINDICACIONES Y PRECAUCIONES DE USO Estimado profesional sanitario, Febrero 2014 Teofarma S.r.l,
TIOCOLCHICÓSIDO ( ADALGUR ): INFORMACIÓN IMPORTANTE CON RESPECTO A LAS INDICACIONES, DOSIFICACIÓN, CONTRAINDICACIONES Y PRECAUCIONES DE USO Estimado profesional sanitario, Febrero 2014 Teofarma S.r.l,
Anexo I. Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
1. NOMBRE DEL MEDICAMENTO. VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio activo: Extracto seco
1. NOMBRE DEL MEDICAMENTO VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio activo: Extracto seco
Coste de vida en Europa
 Coste de vida en Europa La guía se divide en dos secciones, en la primera se encuentra los niveles de precios analizados por Europa. En la segunda, figuran los datos facilitados por el índice de análisis
Coste de vida en Europa La guía se divide en dos secciones, en la primera se encuentra los niveles de precios analizados por Europa. En la segunda, figuran los datos facilitados por el índice de análisis
Nombre. Vertimen 8 mg Tabletten. Vertimen 16 mg Tabletten. Vertisan 16 mg Таблетка. Vertisan 8 mg Tableta 8 mg Comprimido Vía oral
 ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA(S) FARMACÉUTICA(S), DOSIS, VÍA(S) DE ADMINISTRACIÓN, SOLICITANTE(S), TITULAR(ES) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1
ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA(S) FARMACÉUTICA(S), DOSIS, VÍA(S) DE ADMINISTRACIÓN, SOLICITANTE(S), TITULAR(ES) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1
Alivio de los sofocos que aparecen durante la menopausia como consecuencia de la deprivación estrogénica.
 1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
FICHA TÉCNICA. Población pediátrica Tebarat no se debe utilizar en niños menores de 4 años debido a la ausencia de datos de seguridad y eficacia.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Tebarat 0,5 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución contiene 0,5 mg de hidrocloruro de azelastina
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Tebarat 0,5 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución contiene 0,5 mg de hidrocloruro de azelastina
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina
 FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
LLD Abreviado de Zoloft. Todo medicamento debe conservarse fuera del alcance de los niños.
 LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
Sesión 13: Precalificación en el Contexto de las Adquisiciones del Fondo Mundial
 Sesión 13: Precalificación en el Contexto de las Adquisiciones del Fondo Mundial Creado el año 2002 Fondo Mundial Atrae y desembolsa recursos adicionales para prevenir y tratar el SIDA, tuberculosis (TB)
Sesión 13: Precalificación en el Contexto de las Adquisiciones del Fondo Mundial Creado el año 2002 Fondo Mundial Atrae y desembolsa recursos adicionales para prevenir y tratar el SIDA, tuberculosis (TB)
Resumen general de la evaluación científica de los supositorios que contienen derivados terpénicos (ver Anexo I)
 ANEXO II CONCLUSIONES CIENTÍFICAS Y MOTIVOS DE LA REVOCACIÓN O MODIFICACIÓN DE LAS SECCIONES PERTINENTES DE LOS RESÚMENES DE LAS CARACTERÍSTICAS DEL PRODUCTO, ETIQUETADOS Y PROSPECTOS PRESENTADOS POR LA
ANEXO II CONCLUSIONES CIENTÍFICAS Y MOTIVOS DE LA REVOCACIÓN O MODIFICACIÓN DE LAS SECCIONES PERTINENTES DE LOS RESÚMENES DE LAS CARACTERÍSTICAS DEL PRODUCTO, ETIQUETADOS Y PROSPECTOS PRESENTADOS POR LA
Anexo II. Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización
 Anexo II Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización 28 Conclusiones científicas Resumen general de la evaluación científica de Zinnat
Anexo II Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización 28 Conclusiones científicas Resumen general de la evaluación científica de Zinnat
FICHA TÉCNICA 4. DATOS CLÍNICOS
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO EBASTINA ALPROFARMA 10 mg Comprimidos recubiertos con película EFG. EBASTINA ALPROFARMA 20 mg Comprimidos recubiertos con película EFG. 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO EBASTINA ALPROFARMA 10 mg Comprimidos recubiertos con película EFG. EBASTINA ALPROFARMA 20 mg Comprimidos recubiertos con película EFG. 2. COMPOSICIÓN CUALITATIVA
ANEXO III MODIFICACIONES AL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y AL PROSPECTO
 ANEXO III MODIFICACIONES AL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y AL PROSPECTO Estas modificaciones del SPC (ficha técnica) y prospecto entran en vigor en el momento de la Decisión de la Comisión.
ANEXO III MODIFICACIONES AL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y AL PROSPECTO Estas modificaciones del SPC (ficha técnica) y prospecto entran en vigor en el momento de la Decisión de la Comisión.
FICHA TÉCNICA. La posología media recomendada para la acetilcisteína en estos casos es la siguiente:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Acetilcisteína Pensa 200 mg polvo para solución oral EFG Acetilcisteína Pensa 600 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Acetilcisteína Pensa 200 mg polvo para solución oral EFG Acetilcisteína Pensa 600 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
1. NOMBRE DE LA ESPECIALIDAD. PRODERMA 50 mg PRODERMA 100 mg PRODERMA 200 mg 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DE LA ESPECIALIDAD PRODERMA 50 mg PRODERMA 100 mg PRODERMA 200 mg 2. COMPOSICION CUALITATIVA Y CUANTITATIVA PRODERMA 50 mg Doxiciclina (hiclato) 50 mg PRODERMA 100 mg Doxiciclina (hiclato) 100
1. NOMBRE DE LA ESPECIALIDAD PRODERMA 50 mg PRODERMA 100 mg PRODERMA 200 mg 2. COMPOSICION CUALITATIVA Y CUANTITATIVA PRODERMA 50 mg Doxiciclina (hiclato) 50 mg PRODERMA 100 mg Doxiciclina (hiclato) 100
FICHA TÉCNICA. Cetirizina ANGENERICO 10 mg/ml gotas orales en solución EFG
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO Cetirizina ANGENERICO 10 mg/ml gotas orales en solución EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cetirizina ANGENERICO gotas orales en solución: cada
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO Cetirizina ANGENERICO 10 mg/ml gotas orales en solución EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cetirizina ANGENERICO gotas orales en solución: cada
FICHA TÉCNICA. KETOISDIN 400 mg óvulos está indicado en adultos para el tratamiento local de
 1. NOMBRE DEL MEDICAMENTO KETOISDIN 400 mg óvulos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada óvulo contiene: 400 mg de ketoconazol Excipientes con efecto conocido: Butilhidroxianisol
1. NOMBRE DEL MEDICAMENTO KETOISDIN 400 mg óvulos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada óvulo contiene: 400 mg de ketoconazol Excipientes con efecto conocido: Butilhidroxianisol
1) Movilidad de estudiantes para estudios hacia países del programa
 MINISTERIO DE EDUCACIÓN, CULTURA Y DEPORTE Unidad de Educación Superior ERASMUS+ CONVOCATORIA 2016 ACCIÓN CLAVE 1: MOVILIDAD DE LAS PERSONAS POR MOTIVOS DE APRENDIZAJE IMPORTES DE LAS AYUDAS DE LA MOVILIDAD
MINISTERIO DE EDUCACIÓN, CULTURA Y DEPORTE Unidad de Educación Superior ERASMUS+ CONVOCATORIA 2016 ACCIÓN CLAVE 1: MOVILIDAD DE LAS PERSONAS POR MOTIVOS DE APRENDIZAJE IMPORTES DE LAS AYUDAS DE LA MOVILIDAD
PROSPECTO PARA: ACTICAM 1 mg COMPRIMIDOS MASTICABLES PARA PERROS ACTICAM 2,5 mg COMPRIMIDOS MASTICABLES PARA PERROS
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS PROSPECTO PARA: ACTICAM 1 mg COMPRIMIDOS MASTICABLES PARA PERROS ACTICAM 2,5 mg COMPRIMIDOS MASTICABLES PARA PERROS 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS PROSPECTO PARA: ACTICAM 1 mg COMPRIMIDOS MASTICABLES PARA PERROS ACTICAM 2,5 mg COMPRIMIDOS MASTICABLES PARA PERROS 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. LORATADINA RANBAXY 10 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO LORATADINA RANBAXY 10 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO LORATADINA RANBAXY 10 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Excipientes con efecto conocido:
ANASTROZOL COMPRIMIDOS RECUBIERTOS 1 mg. COMPOSICIÓN Cada comprimido recubierto contiene: Excipientes: Según lo aprobado en Registro
 ANASTROZOL COMPRIMIDOS RECUBIERTOS 1 mg COMPOSICIÓN Cada comprimido recubierto contiene: Anastrozol 1 mg Excipientes: Según lo aprobado en Registro CLASIFICACION TERAPEUTICA Antineoplásico INDICACIONES
ANASTROZOL COMPRIMIDOS RECUBIERTOS 1 mg COMPOSICIÓN Cada comprimido recubierto contiene: Anastrozol 1 mg Excipientes: Según lo aprobado en Registro CLASIFICACION TERAPEUTICA Antineoplásico INDICACIONES
Anexo II. Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización
 Anexo II Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización 12 Conclusiones científicas y motivos para la modificación de los términos de
Anexo II Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización 12 Conclusiones científicas y motivos para la modificación de los términos de
Restricciones de uso de los medicamentos que contienen domperidona
 1 de septiembre de 2014 EMA/465179/2014 Restricciones de uso de los medicamentos que contienen domperidona El 23 de abril de 2014, el Grupo de Coordinación de los Procedimientos de Reconocimiento Mutuo
1 de septiembre de 2014 EMA/465179/2014 Restricciones de uso de los medicamentos que contienen domperidona El 23 de abril de 2014, el Grupo de Coordinación de los Procedimientos de Reconocimiento Mutuo
Fibra Óptica. Producto Fecha Actualización Antes Ahora
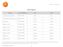 Fibra Óptica Producto Fecha Actualización Antes Ahora Tarifa Plana Empresa Euskadi Noviembre 2007 10 /mes 7 /mes Tarifa Plana Empresa Interprovincial Noviembre 2007 18 /mes 13 /mes Despega 12 M Noviembre
Fibra Óptica Producto Fecha Actualización Antes Ahora Tarifa Plana Empresa Euskadi Noviembre 2007 10 /mes 7 /mes Tarifa Plana Empresa Interprovincial Noviembre 2007 18 /mes 13 /mes Despega 12 M Noviembre
FICHA DE INFORMACIÓN AL PACIENTE: ESPIRONOLACTONA
 FICHA DE INFORMACIÓN AL PACIENTE: ESPIRONOLACTONA 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Diurético y antihipertensivo, por alteración del mecanismo de funcionamiento renal con aumento de la eliminación
FICHA DE INFORMACIÓN AL PACIENTE: ESPIRONOLACTONA 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Diurético y antihipertensivo, por alteración del mecanismo de funcionamiento renal con aumento de la eliminación
Prospecto: información para el usuario. Clarityne 10 mg comprimidos Loratadina
 Prospecto: información para el usuario Clarityne 10 mg comprimidos Loratadina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
Prospecto: información para el usuario Clarityne 10 mg comprimidos Loratadina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
FICHA TÉCNICA. Excipientes con efecto conocido: Cada pastilla para chupar contiene 1,37 g de sorbitol (E420) y 6,3 mg de sacarosa.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lizipadol 20 mg pastillas para chupar 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una pastilla para chupar contiene 20 mg de ambroxol hidrocloruro. Excipientes con
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lizipadol 20 mg pastillas para chupar 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una pastilla para chupar contiene 20 mg de ambroxol hidrocloruro. Excipientes con
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
Comunicación dirigida a los profesionales sanitarios
 Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto
 23 April 2015 EMA/PRAC/273926/2015 Pharmacovigilance Risk Assessment Committee Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto Adoptado por el PRAC
23 April 2015 EMA/PRAC/273926/2015 Pharmacovigilance Risk Assessment Committee Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto Adoptado por el PRAC
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Ambroxol Apotex 3 mg/ ml jarabe EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ambroxol Apotex 3 mg/ ml jarabe EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contienen 3 mg de ambroxol hidrocloruro. Excipiente(s) con efecto
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ambroxol Apotex 3 mg/ ml jarabe EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contienen 3 mg de ambroxol hidrocloruro. Excipiente(s) con efecto
FICHA TÉCNICA. Este medicamento contiene 20 mg de Guaifenesina por ml (100mg en 5ml). Para consultar la lista completa de excipientes ver sección 6.1.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Inistón EXPECTORANTE 20mg/ml solución oral sabor menta 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Este medicamento contiene 20 mg de Guaifenesina por ml (100mg en
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Inistón EXPECTORANTE 20mg/ml solución oral sabor menta 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Este medicamento contiene 20 mg de Guaifenesina por ml (100mg en
Adultos y niños mayores de 12 años 10 mg una vez al día (una cápsula). Las cápsulas se pueden tomar con independencia de las comidas.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Loratadina Farmalider 10 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula blanda de Loratadina Farmalider 10 mg contiene: Loratadina...10
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Loratadina Farmalider 10 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula blanda de Loratadina Farmalider 10 mg contiene: Loratadina...10
Evolución de los indicadores del estado de salud en España y su magnitud en el contexto de la Unión Europea
 Indicadores de Salud 2013 Evolución de los indicadores del estado de salud en España y su magnitud en el contexto de la Unión Europea -Documento Resumen- INFORMACIÓN Y ESTADÍSTICAS SANITARIAS 2013 MINISTERIO
Indicadores de Salud 2013 Evolución de los indicadores del estado de salud en España y su magnitud en el contexto de la Unión Europea -Documento Resumen- INFORMACIÓN Y ESTADÍSTICAS SANITARIAS 2013 MINISTERIO
FICHA TÉCNICA O RECUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Para consultar la lista completa de excipientes, ver sección 6.1.
 FICHA TÉCNICA O RECUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO SOBREPIN infantil 100 mg supositorios SOBREPIN adultos 200 mg supositorios 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA O RECUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO SOBREPIN infantil 100 mg supositorios SOBREPIN adultos 200 mg supositorios 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
FICHA TÉCNICA. Comprimidos de liberación prolongada recubiertos con película.
 FICHA TÉCNICA 1. DENOMINACIÓN DE LA ESPECIALIDAD Thrombescina comprimidos de liberación prolongada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: 2.1. Principio Activo 263,2 mg de
FICHA TÉCNICA 1. DENOMINACIÓN DE LA ESPECIALIDAD Thrombescina comprimidos de liberación prolongada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: 2.1. Principio Activo 263,2 mg de
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MAGNESIUM PYRE 64 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MAGNESIUM PYRE 64 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 64 mg de magnesio (en forma de 550 mg de cloruro de magnesio,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MAGNESIUM PYRE 64 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 64 mg de magnesio (en forma de 550 mg de cloruro de magnesio,
Tratamiento de los síntomas asociados a nerviosismo moderado, tales como tensión nerviosa, irritabilidad, palpitaciones y alteraciones del sueño.
 1. NOMBRE DEL MEDICAMENTO VALERIANA LEO comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto contiene: 100 mg de extracto seco de raíz de Valeriana officinalis L,
1. NOMBRE DEL MEDICAMENTO VALERIANA LEO comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto contiene: 100 mg de extracto seco de raíz de Valeriana officinalis L,
Diario Oficial de la Unión Europea
 9.. L / REGLAMENTO DE EJECUCIÓN (UE) / DE LA COMISIÓN de de febrero de por el que se establece información técnica para el cálculo de las provisiones técnicas y los fondos propios básicos a efectos de
9.. L / REGLAMENTO DE EJECUCIÓN (UE) / DE LA COMISIÓN de de febrero de por el que se establece información técnica para el cálculo de las provisiones técnicas y los fondos propios básicos a efectos de
(Actos no legislativos) REGLAMENTOS
 .. L 9/ II (Actos no legislativos) REGLAMENTOS REGLAMENTO DE EJECUCIÓN (UE) /97 DE LA COMISIÓN de de noviembre de por el que se establece información técnica para el cálculo de las provisiones técnicas
.. L 9/ II (Actos no legislativos) REGLAMENTOS REGLAMENTO DE EJECUCIÓN (UE) /97 DE LA COMISIÓN de de noviembre de por el que se establece información técnica para el cálculo de las provisiones técnicas
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Fenistil 1 mg/g gel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fenistil 1 mg/g gel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de Fenistil gel contiene: dimetindeno maleato. 1 mg Excipiente(s) con efecto conocido: propilenglicol...150
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fenistil 1 mg/g gel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de Fenistil gel contiene: dimetindeno maleato. 1 mg Excipiente(s) con efecto conocido: propilenglicol...150
LABORATORIOS NORMON, S.A.
 1. NOMBRE DEL MEDICAMENTO normoval 250 mg comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto de normoval contiene: 250 mg de extracto hidroalcohólico seco de raíz
1. NOMBRE DEL MEDICAMENTO normoval 250 mg comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto de normoval contiene: 250 mg de extracto hidroalcohólico seco de raíz
(Actos no legislativos) REGLAMENTOS
 8.8. L / II (Actos no legislativos) REGLAMENTOS REGLAMENTO DE EJECUCIÓN (UE) /7 DE LA COMISIÓN de 8 de agosto de por el que se establece información técnica para el cálculo de las provisiones técnicas
8.8. L / II (Actos no legislativos) REGLAMENTOS REGLAMENTO DE EJECUCIÓN (UE) /7 DE LA COMISIÓN de 8 de agosto de por el que se establece información técnica para el cálculo de las provisiones técnicas
FICHA TÉCNICA. Por sobre: Acetato de calcio, 2,5 g (equivale a 635 mg de calcio), almidón de maíz, manitol (E421)
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SILDENAFIL PARA HOMBRES 50 mg COMPRIMIDOS RECUBIERTOS PARA LA DISFUNCIÓN ERÉCTIL Página 1 SILDENAFIL PARA HOMBRES
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SILDENAFIL PARA HOMBRES 50 mg COMPRIMIDOS RECUBIERTOS PARA LA DISFUNCIÓN ERÉCTIL Página 1 SILDENAFIL PARA HOMBRES
L 192/4 Diario Oficial de la Unión Europea
 L 192/4 Diario Oficial de la Unión Europea 24.7.2007 REGLAMENTO (CE) N o 866/2007 DEL CONSEJO de 23 de julio de 2007 por el que se modifica el Reglamento (CE) n o 234/2004 relativo a determinadas medidas
L 192/4 Diario Oficial de la Unión Europea 24.7.2007 REGLAMENTO (CE) N o 866/2007 DEL CONSEJO de 23 de julio de 2007 por el que se modifica el Reglamento (CE) n o 234/2004 relativo a determinadas medidas
Bisolvon Expectorante jarabe
 PROSPECTO: INFORMACIÓN PARA EL PACIENTE Bisolvon Expectorante jarabe Extracto seco de hojas de hiedra Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
PROSPECTO: INFORMACIÓN PARA EL PACIENTE Bisolvon Expectorante jarabe Extracto seco de hojas de hiedra Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
EVALUACION DE LAS RELACIONES COMERCIALES ENTRE CANARIAS Y EUROPA
 EVALUACION DE LAS RELACIONES COMERCIALES ENTRE CANARIAS Y EUROPA La balanza comercial entre Canarias y Europa muestra un déficit comercial de 1.005,27 millones de euros según los datos provisionales de
EVALUACION DE LAS RELACIONES COMERCIALES ENTRE CANARIAS Y EUROPA La balanza comercial entre Canarias y Europa muestra un déficit comercial de 1.005,27 millones de euros según los datos provisionales de
INN Nombre inventado Concentración Forma farmacéutica. Caustinerf Arsenical
 Estado Miembro (en EEA) Autorización de Comercialización Titular INN Nombre inventado Concentración Forma farmacéutica Vía de administración Lituania Septodont 58, rue du Pont de Creteil clorhidrato de
Estado Miembro (en EEA) Autorización de Comercialización Titular INN Nombre inventado Concentración Forma farmacéutica Vía de administración Lituania Septodont 58, rue du Pont de Creteil clorhidrato de
FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO. URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Benzbromarona (D.C.I.)...100 mg
FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Benzbromarona (D.C.I.)...100 mg
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
PARLAMENTO EUROPEO. Comisión de Transportes y Turismo * PROYECTO DE INFORME
 PARLAMENTO EUROPEO 2004 2009 Comisión de Transportes y Turismo 2008/0068(CNS) 19.1.2009 * PROYECTO DE INFORME sobre la propuesta de Decisión del Consejo relativa a la celebración del Acuerdo entre la Comunidad
PARLAMENTO EUROPEO 2004 2009 Comisión de Transportes y Turismo 2008/0068(CNS) 19.1.2009 * PROYECTO DE INFORME sobre la propuesta de Decisión del Consejo relativa a la celebración del Acuerdo entre la Comunidad
H1. LA COMPARACIÓN INTERNACIONAL
 H1.0. Contenido, notas explicativas y fuentes de información Se presenta en este capítulo la situación de la educación de nuestro país en relación a los demás países, a través de una selección de indicadores
H1.0. Contenido, notas explicativas y fuentes de información Se presenta en este capítulo la situación de la educación de nuestro país en relación a los demás países, a través de una selección de indicadores
3/5 Salud : Año Europeo del Envejecimiento Activo y la Solidaridad Intergeneracional. Envejecimiento. Activo. Fuentes utilizadas
 2012: Año Europeo del y la Solidaridad Intergeneracional 3/5 Salud 2012 ha sido declarado por la Unión Europea Año del y la Solidaridad Intergeneracional (Decisión nº 940/2011/UE del Parlamento Europeo
2012: Año Europeo del y la Solidaridad Intergeneracional 3/5 Salud 2012 ha sido declarado por la Unión Europea Año del y la Solidaridad Intergeneracional (Decisión nº 940/2011/UE del Parlamento Europeo
SKELID 200 mg comprimidos
 SKELID 200 mg comprimidos 1. DENOMINACIÓN DEL MEDICAMENTO SKELID 200 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Acido tiludrónico (D.C.I.) sal disódica cantidad correspondiente a ácido
SKELID 200 mg comprimidos 1. DENOMINACIÓN DEL MEDICAMENTO SKELID 200 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Acido tiludrónico (D.C.I.) sal disódica cantidad correspondiente a ácido
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Auxina E-50, Auxina E-200, Auxina E-400 Vitamina E (Acetato de dl-? -tocoferol)
 1. NOMBRE DEL MEDICAMENTO Auxina E-50, Auxina E-200, Auxina E-400 Vitamina E (Acetato de dl-? -tocoferol) FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por cápsula: Principio Activo:?? Auxina
1. NOMBRE DEL MEDICAMENTO Auxina E-50, Auxina E-200, Auxina E-400 Vitamina E (Acetato de dl-? -tocoferol) FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por cápsula: Principio Activo:?? Auxina
FICHA TÉCNICA. Tratamiento de la incontinencia urinaria asociada a la insuficiencia del esfínter uretral en la perra.
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. DAIVONEX Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DAIVONEX Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Calcipotriol 50 microgramos/g (como hidrato). Para la lista completa de excipientes, ver sección 6.1. 3.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DAIVONEX Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Calcipotriol 50 microgramos/g (como hidrato). Para la lista completa de excipientes, ver sección 6.1. 3.
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Normovagil 100 mg/g emulsión vaginal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Normovagil 100 mg/g emulsión vaginal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Glicerol... 100 mg (10%). Excipientes con efecto conocido: parahidroxibenzoato
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Normovagil 100 mg/g emulsión vaginal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Glicerol... 100 mg (10%). Excipientes con efecto conocido: parahidroxibenzoato
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TÉCNICA. (fitomenadiona, DCI) en 0,2 ml (volumen de llenado: 0,3 ml). Solución contenida en ampollas para administración oral o parenteral.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Konakion 2 mg pediátrico 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ampolla contiene 2 mg de vitamina K 1 (fitomenadiona, DCI) en 0,2 ml (volumen de llenado:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Konakion 2 mg pediátrico 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ampolla contiene 2 mg de vitamina K 1 (fitomenadiona, DCI) en 0,2 ml (volumen de llenado:
FICHA TÉCNICA. Comprimidos ovalados, blancos, con una ranura en un lado y planos en el otro lado, marcados L y 10 a cada lado de la ranura.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Loratadina Teva 10 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Excipiente(s) con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Loratadina Teva 10 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Excipiente(s) con efecto conocido:
FICHA DE INFORMACIÓN AL PACIENTE: LINCOMICINA
 FICHA DE INFORMACIÓN AL PACIENTE: LINCOMICINA 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Antibiótico con acción bacteriostática. 1.2 Cómo actúa este fármaco: La lincomicina actúa impidiendo que las bacterias
FICHA DE INFORMACIÓN AL PACIENTE: LINCOMICINA 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Antibiótico con acción bacteriostática. 1.2 Cómo actúa este fármaco: La lincomicina actúa impidiendo que las bacterias
FICHA TÉCNICA. Por envase monodosis de 5 ml: Citrato trisódico dihidratado mg Laurilsulfoacetato de sodio...45 mg
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO CLISTERAN solución rectal 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA Por envase monodosis de 5 ml: Citrato trisódico dihidratado... 450 mg Laurilsulfoacetato de
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO CLISTERAN solución rectal 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA Por envase monodosis de 5 ml: Citrato trisódico dihidratado... 450 mg Laurilsulfoacetato de
Tablas de mortalidad La esperanza de vida al nacimiento aumenta en más de dos años desde 1995 y se sitúa en 80,23 años
 29 de octubre de 2007 actualizada 30 de octubre de 2007 Tablas de mortalidad 1992-2005 La esperanza de vida al nacimiento aumenta en más de dos años desde 1995 y se sitúa en 80,23 años Navarra, Madrid,
29 de octubre de 2007 actualizada 30 de octubre de 2007 Tablas de mortalidad 1992-2005 La esperanza de vida al nacimiento aumenta en más de dos años desde 1995 y se sitúa en 80,23 años Navarra, Madrid,
