REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURIDICA FMP/ARC/AMSCH
|
|
|
- Juan Luis Valenzuela Márquez
- hace 5 años
- Vistas:
Transcripción
1 REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURIDICA FMP/ARC/AMSCH REGLAMENTO DEL FORMULARIO NACIONAL DE MEDICAMENTOS DECRETO N 264/03 Publicado en el Diario Oficial de 16 de marzo de 2004
2 REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURIDICA FMP/ARC/AMSCH APRUEBA REGLAMENTO DEL FORMULARIO NACIONAL DE MEDICAMENTOS N Publicado en el Diario Oficial de 16 de marzo de 2004 Santiago, 10 de diciembre de Vistos: lo dispuesto en el artículo 100 del Código Sanitario, decreto con fuerza de ley Nº725 de 1967, del Ministerio de Salud; lo dispuesto en el decreto supremo Nº2.309 de 1994, que aprueba el Formulario Nacional de Medicamentos, y Considerando: 1.- Que la salud es una de las necesidades esenciales de la persona humana y su satisfacción plena constituye un mandato social prioritario para el Estado. 2.- Que en la atención de la salud, tanto preventiva como curativa, los medicamentos juegan un papel insustituible. 3.- Que es imperativo asegurar la disponibilidad y el acceso a toda la población de los medicamentos indispensables para una terapia efectiva y segura y de un acceso efectivo a la población que sea compatible con los recursos que la sociedad pueda disponer para este efecto. 4.- Que para una eficaz terapéutica se requiere un listado determinado de drogas científicamente escogidas, identificadas por su nombre genérico, y las formas farmacéuticas que correspondan para ser utilizadas con fines preventivos, de diagnóstico y terapéuticos. 5.- Que en el mismo sentido se requiere disponer de un listado de productos biológicos, sustancias químicas radiactivas de uso clínico y cualquier otra droga natural o sintética que correspondan al concepto de productos farmacéuticos. 6.- Que este listado históricamente se ha denominado Formulario Nacional de Medicamentos y su elaboración es una tarea esencialmente técnica en la que
3 deben intervenir expertos, los cuales sobre la base de conocimientos, investigaciones, experiencia clínica, científica y docente propondrán la incorporación o eliminación de los medicamentos al Formulario Nacional de Medicamentos, en la medida que sea compatible con el sistema antes enunciado y con los avances de la ciencia. Teniendo presente las facultades que me confiere el artículo 32 Nº8 de la Constitución Política del Estado, Decreto: Artículo 1º.- El Formulario Nacional de Medicamentos es el documento oficial de la República de Chile que contiene la nómina seleccionada de productos farmacéuticos indispensables para una eficiente terapéutica sustentada en la realidad epidemiológica del país y la evidencia científica, cuya calidad debe ser garantizada. Artículo 2º.- Para los efectos de este reglamento, se entenderá por: a) Producto farmacéutico indispensable: Medicamento que es básico, de la mayor importancia y preciso para satisfacer las necesidades de atención de salud de la mayor parte de la población y para abordar aquellas patologías declaradas prioritarias en los planes de salud del Gobierno. b) Nombre genérico: Denominación aceptada por la Organización Mundial de la Salud, bajo distintivos y siglas "Denominaciones Comunes Internacionales" (D.C.I.) o "International Nonpropietary Names (I.N.N.)" o en las farmacopeas oficialmente reconocidas en el país. c) Medicamento genérico: Medicamento que se distribuye o expende rotulado con el nombre genérico del principio activo. d) Relación riesgo-beneficio (relación beneficio-riesgo): Relación entre los beneficios y los riesgos que presenta el empleo de un medicamento. Expresa un juicio sobre la función del medicamento en la práctica médica, basado en datos sobre su eficacia y seguridad y en consideraciones sobre su posible uso indebido, la gravedad y el pronóstico de la enfermedad, etc. El concepto puede aplicarse a un solo medicamento o a las comparaciones entre dos o más medicamentos empleados para una misma indicación. e) Efectividad en función del costo: Relación entre costo, medido en valor monetario, y efectividad, cuantificada mediante indicadores específicos de efecto.
4 f) Medicina basada en evidencia: Uso consciente, juicioso y explícito de la mejor información disponible sobre la efectividad de las intervenciones, al momento de tomar decisiones en salud. g) Estudios de utilización de medicamentos: Son aquellos que tienen por objeto de análisis la comercialización, distribución, prescripción y uso de medicamentos en una sociedad, especialmente sobre las consecuencias médicas, sociales y económicas resultantes. h) Farmacovigilancia: Ciencia o conjunto de actividades relacionadas con la detección, evaluación, comprensión y prevención de las reacciones adversas o de cualquier otro problema relacionado con medicamentos. Artículo 3º.- El Formulario Nacional de Medicamentos está constituido por los siguientes documentos: A. La nómina de productos estructurados por grupo y subgrupo terapéutico. Cada producto se describe por el nombre genérico de su principio activo, la sal o éster cuando corresponda, forma(s) farmacéutica(s) y dosis por forma(s) farmacéutica(s) o por unidad de administración. Esta nómina será aprobada por decreto supremo. Podrán incluirse productos farmacéuticos que signifiquen una alternativa de tratamiento a los productos definidos en la lista, aun cuando estén constituidos por principios activos diferentes. B. Las monografías de cada producto farmacéutico, incluyendo los productos alternativos, deberán consignar la estructura química y propiedades físicoquímicas, estabilidad cuando corresponda, acción o acciones farmacológicas, farmacocinética, uso o usos terapéuticos, forma o formas farmacéuticas, vías de administración y dosis para cada uso terapéutico, reacciones adversas, contraindicaciones, interacciones, precauciones, advertencias sobre peligros que entrañe su administración, manera de evitarlos y combatirlos. Las monografías serán aprobadas como anexo del decreto supremo aludido en la letra A precedente. Artículo 4º.- Los medicamentos que integran la nómina del Formulario deben estar disponibles en el país para toda la población que lo requiera y corresponderá a la autoridad sanitaria arbitrar los mecanismos que permitan la disponibilidad de aquellos que no se encuentren comercializados en el país, en casos excepcionales y para usos medicinales urgentes. La nómina de los productos farmacéuticos señalados en la letra A del artículo anterior, que constituyen el Formulario Nacional de Medicamentos, que están registrados y comercializados en el país, se enunciará por orden alfabético de la denominación genérica de los productos farmacéuticos de la lista aprobada,
5 señalando la sal o éster cuando corresponda, forma(s) farmacéutica(s) y dosis (expresada como base según corresponda) por forma(s) farmacéutica(s) o por unidad de administración y será aprobada por resolución del Ministerio de Salud de disposición obligatoria en farmacias. Esta nómina consignará el medicamento correspondiente, por su denominación genérica y la marca comercial, si existiere, el respectivo fabricante o importador. Los arsenales farmacológicos de los establecimientos asistenciales públicos y privados del país deben incluir medicamentos del Formulario Nacional para su administración a los enfermos que requieren de su atención. Igual obligación deberán cumplir las farmacias y demás establecimientos del área farmacéutica, respecto de los petitorios que les son reglamentariamente exigibles. Artículo 5º.- Los medicamentos que integran el Formulario Nacional serán seleccionados sobre la base de los siguientes criterios: 1. Eficacia y seguridad en el uso. 2. Adecuada relación riesgo-beneficio y efectividad en función del costo. 3. Cumplimiento de los principios de la medicina basada en la evidencia, en especial si integran la farmacoterapia incorporada en las normas clínicas, guías terapéuticas o protocolos que se aprueben para abordar las patologías de mayor prevalencia y aquellas prioritarias, en el marco de los objetivos sanitarios del país. Artículo 6º.- Para la actualización del Formulario se deberán tener presentes los siguientes antecedentes: 1.- Los informes sobre el logro del objetivo terapéutico de la farmacoterapia contenida en las normas, protocolos o guías clínicas en uso. 2.- Las sugerencias fundamentadas que realicen los comités de farmacia y terapéutica de los establecimientos asistenciales de los Servicios de Salud y de otras instituciones públicas y privadas del país. 3.- Las opiniones de las sociedades científicas. 4.- Los resultados de los estudios de utilización disponibles para grupos terapéuticos específicos. 5.- Los informes de farmacovigilancia nacionales e internacionales. 6.- Las revisiones sistemáticas sobre medicina basada en la evidencia. La actualización de la nómina y monografías del Formulario deberá ser aprobada cada dos años. Artículo 7º.- La responsabilidad del seguimiento y actualización del Formulario corresponderá al Ministerio de Salud, el que mediante decreto supremo constituirá una comisión técnico-científica, de carácter asesor, de funcionamiento
6 permanente, cuyas funciones y demás regulaciones serán determinadas en el mismo decreto. Esta Comisión estará constituida por un grupo multiprofesional, en el cual se integrará a profesionales que formen parte de los estamentos de rectoría, regulación y control, en materia de productos farmacéuticos, de los organismos públicos del sector salud, sin perjuicio de los expertos que sea necesario convocar en la oportunidad que sean requeridos. Artículo 8º.- Toda publicación o edición que se realice sobre el Formulario Nacional de Medicamentos requerirá de autorización previa del Ministerio de Salud. Artículo 9º.- Derógase el decreto supremo Nº2.505, de 1º de diciembre de 1995, del Ministerio de Salud, que aprueba el Reglamento del Formulario Nacional de Medicamentos, publicado en el Diario Oficial de 5 de febrero de Artículo 10º.- Reemplázase el Nº2 del artículo 17 del decreto supremo Nº466 de 1984, del Ministerio de Salud, publicado en el Diario Oficial de 12 de marzo de 1985, que aprobó el Reglamento de Farmacias, Droguerías, Almacenes Farmacéuticos, Botiquines y Depósitos Autorizados, por el siguiente: "2.- Un ejemplar actualizado de la Nómina de Medicamentos Registrados y Comercializados del Formulario Nacional, aprobada por resolución del Ministerio de Salud.". Anótese, tómese razón y publíquese en el Diario Oficial e insértese en la Recopilación Oficial de Reglamentos de la Contraloría General de la República.- RICARDO LAGOS ESCOBAR, Presidente de la República.- Pedro García Aspillaga, Ministro de Salud.
ESTABLECE MECANISMOS PARA LA PROTECCIÓN DE DATOS DE NATURALEZA NO DIVULGADOS POR PARTE DEL INSTITUTO DE SALUD PUBLICA
 REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURÍDICA ESTABLECE MECANISMOS PARA LA PROTECCIÓN DE DATOS DE NATURALEZA NO DIVULGADOS POR PARTE DEL INSTITUTO DE SALUD PUBLICA N 153, de 2005 Publicado
REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURÍDICA ESTABLECE MECANISMOS PARA LA PROTECCIÓN DE DATOS DE NATURALEZA NO DIVULGADOS POR PARTE DEL INSTITUTO DE SALUD PUBLICA N 153, de 2005 Publicado
SUBDIRECCIÓN DE REGISTRO SANITARIO GRUPO DE MEDICAMENTOS IN IMA
 SUBDIRECCIÓN DE GRUPO DE MEDICAMENTOS IN IMA Bogotá, Junio 2008 DECRETO 677 DE 1995 ARTICULO 27 COMISION REVISORA De la evaluación farmacológica Comprende el procedimiento mediante el cual la autoridad
SUBDIRECCIÓN DE GRUPO DE MEDICAMENTOS IN IMA Bogotá, Junio 2008 DECRETO 677 DE 1995 ARTICULO 27 COMISION REVISORA De la evaluación farmacológica Comprende el procedimiento mediante el cual la autoridad
PROGRAMA DE CONTROL DE FÁRMACOS NORMA TÉCNICA SECCIÓN 2
 PROGRAMA DE CONTROL DE FÁRMACOS NORMA TÉCNICA SECCIÓN 2 Requisitos para la Evaluación de Productos Farmacéuticos de Uso en Acuicultura DEPARTAMENTO DE SANIDAD PESQUERA CHILE INDICE Pág. I.- Registro de
PROGRAMA DE CONTROL DE FÁRMACOS NORMA TÉCNICA SECCIÓN 2 Requisitos para la Evaluación de Productos Farmacéuticos de Uso en Acuicultura DEPARTAMENTO DE SANIDAD PESQUERA CHILE INDICE Pág. I.- Registro de
APRUEBA REGLAMENTO SOBRE SALAS DE PROCEDIMIENTOS Y PABELLONES DE CIRUGIA MENOR
 1 REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURIDICA Mmh. APRUEBA REGLAMENTO SOBRE SALAS DE PROCEDIMIENTOS Y PABELLONES DE CIRUGIA MENOR DTO. N 283, DE 1997 Publicado en el Diario Oficial de
1 REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURIDICA Mmh. APRUEBA REGLAMENTO SOBRE SALAS DE PROCEDIMIENTOS Y PABELLONES DE CIRUGIA MENOR DTO. N 283, DE 1997 Publicado en el Diario Oficial de
Adquisición de Medicamentos en Página 1 de 6 Unidad Abastecimiento Vigencia: Marzo 2014
 Adquisición de Medicamentos en Página 1 de 6 1 Adquisición de Medicamentos en Página 2 de 6 4. Definiciones: 4.1 Arsenal Farmacológico: Corresponderá a aquellos medicamentos que por Resolución estarán
Adquisición de Medicamentos en Página 1 de 6 1 Adquisición de Medicamentos en Página 2 de 6 4. Definiciones: 4.1 Arsenal Farmacológico: Corresponderá a aquellos medicamentos que por Resolución estarán
MINISTERIO DE SALUD SUBSECRETARIA DE SALUD DPTO. ASESORIA JURIDICA N DE Publicado en el Diario Oficial de
 MINISTERIO DE SALUD SUBSECRETARIA DE SALUD DPTO. ASESORIA JURIDICA REGLAMENTO DE LABORATORIOS DE MEDICION Y ANALISIS DE EMISIONES ATMOSFERICAS PROVENIENTES DE FUENTES ESTACIONARIAS N 2.467 DE 1993 Publicado
MINISTERIO DE SALUD SUBSECRETARIA DE SALUD DPTO. ASESORIA JURIDICA REGLAMENTO DE LABORATORIOS DE MEDICION Y ANALISIS DE EMISIONES ATMOSFERICAS PROVENIENTES DE FUENTES ESTACIONARIAS N 2.467 DE 1993 Publicado
Consenso sobre plantas medicinales. Opción terapéutica validada
 Consenso sobre plantas medicinales. Contenidos Definición, objetivos y ámbito de aplicación de la Fitoterapia Preparados fitoterápicos Calidad, seguridad y eficacia El farmacéutico, el profesional más
Consenso sobre plantas medicinales. Contenidos Definición, objetivos y ámbito de aplicación de la Fitoterapia Preparados fitoterápicos Calidad, seguridad y eficacia El farmacéutico, el profesional más
SELECCIÓN DE MEDICAMENTOS Y/O INSUMOS MEDICO- QUIRÚRGICOS
 SELECCIÓN DE MEDICAMENTOS Y/O INSUMOS MEDICO- QUIRÚRGICOS CODIGO: FAR-05-02 VERSION: 0 FECHA: Marzo de 2013 PAGINAS: 5 1. OBJETIVO 1. Asegurar que la Clinica cuente con todos los medicamentos e insumos
SELECCIÓN DE MEDICAMENTOS Y/O INSUMOS MEDICO- QUIRÚRGICOS CODIGO: FAR-05-02 VERSION: 0 FECHA: Marzo de 2013 PAGINAS: 5 1. OBJETIVO 1. Asegurar que la Clinica cuente con todos los medicamentos e insumos
DECRETO N 814, DE 2003
 DECRETO N 814, DE 2003 Reglamento del artículo 19 bis del decreto ley Nº 1.263, de 1975, sobre identificación presupuestaria de los estudios preinversionales, programas o proyectos de inversión TEXTO ACTUALIZADO
DECRETO N 814, DE 2003 Reglamento del artículo 19 bis del decreto ley Nº 1.263, de 1975, sobre identificación presupuestaria de los estudios preinversionales, programas o proyectos de inversión TEXTO ACTUALIZADO
1.1.RPM ANMAT ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS ALIMENTOS Y TECNOLOGÍA MEDICA A.- DATOS A COMPLETAR EN EL FORMULARIO.
 DE ESPECIALIDADES MEDICINALES ÍNDICE DE LA PRESENTACIÓN - TEMA / DOCUMENTO A.- DATOS A COMPLETAR EN EL FORMULARIO. 1. DEL SOLICITANTE. 1.1 Carácter. 1.2. Nombre o Razón Social. 1.3. Número de legajo. 1.4.
DE ESPECIALIDADES MEDICINALES ÍNDICE DE LA PRESENTACIÓN - TEMA / DOCUMENTO A.- DATOS A COMPLETAR EN EL FORMULARIO. 1. DEL SOLICITANTE. 1.1 Carácter. 1.2. Nombre o Razón Social. 1.3. Número de legajo. 1.4.
COMITÉS DE FARMACOTERÁPIA. Unidad de Asistencia Técnica y Logística Farmacéutica Ministerio de Salud Pública y Asistencia Social
 COMITÉS DE FARMACOTERÁPIA Unidad de Asistencia Técnica y Logística Farmacéutica Ministerio de Salud Pública y Asistencia Social DEFINICIÓN COMITÉ DE FARMACOTERÁPIA El Comité de Farmacoterápia es un ente
COMITÉS DE FARMACOTERÁPIA Unidad de Asistencia Técnica y Logística Farmacéutica Ministerio de Salud Pública y Asistencia Social DEFINICIÓN COMITÉ DE FARMACOTERÁPIA El Comité de Farmacoterápia es un ente
DTO. Nº 951/68 MODIFICACIONES: REPÚBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORÍA JURÍDICA mmh. Publicado en el Diario Oficial de
 REPÚBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORÍA JURÍDICA mmh. REGLAMENTO PARA EJERCER LA PROFESIÓN DE PODOLOGO DTO. Nº 951/68 Publicado en el Diario Oficial de 20.12.68 MODIFICACIONES: DTO. 221/78,
REPÚBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORÍA JURÍDICA mmh. REGLAMENTO PARA EJERCER LA PROFESIÓN DE PODOLOGO DTO. Nº 951/68 Publicado en el Diario Oficial de 20.12.68 MODIFICACIONES: DTO. 221/78,
DTO. Nº 951/68 MODIFICACIONES: REPÚBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORÍA JURÍDICA mmh. Publicado en el Diario Oficial de
 REPÚBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORÍA JURÍDICA mmh. REGLAMENTO PARA EJERCER LA PROFESIÓN DE PODOLOGO DTO. Nº 951/68 Publicado en el Diario Oficial de 20.12.68 MODIFICACIONES: DTO. 221/78,
REPÚBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORÍA JURÍDICA mmh. REGLAMENTO PARA EJERCER LA PROFESIÓN DE PODOLOGO DTO. Nº 951/68 Publicado en el Diario Oficial de 20.12.68 MODIFICACIONES: DTO. 221/78,
Tema 1: Introducción a la farmacología
 Tema 1: Introducción a la farmacología Farmacología en fisioterapia OpenCourseWare UPV/EHU OCW-2017 Dr. Iván Manuel Vicente Dra. María Torrecilla Sesma Dpto. Farmacología-UPV/EHU Resumen del contenido
Tema 1: Introducción a la farmacología Farmacología en fisioterapia OpenCourseWare UPV/EHU OCW-2017 Dr. Iván Manuel Vicente Dra. María Torrecilla Sesma Dpto. Farmacología-UPV/EHU Resumen del contenido
SERVICIOS FARMACÉUTICOS
 SERVICIOS FARMACÉUTICOS Antecedentes Documentos estratégicos para desarrollar SF Objetivo Definición Los mexicas Panamacani 1833 1er código sanitario 1890 Reforma del código sanitario 1984 publicación
SERVICIOS FARMACÉUTICOS Antecedentes Documentos estratégicos para desarrollar SF Objetivo Definición Los mexicas Panamacani 1833 1er código sanitario 1890 Reforma del código sanitario 1984 publicación
RED PANAMERICANA PARA LA ARMONIZACIÓN DE LA REGULACIÓN FARMACÉUTICA (RED PARF) GUIA DEL MANUAL DEL INVESTIGADOR
 RED PANAMERICANA PARA LA ARMONIZACIÓN DE LA REGULACIÓN FARMACÉUTICA (RED PARF) GRUPO DE TRABAJO BUENAS PRÁCTICAS CLÍNICAS DOCUMENTO DE TRABAJO GUIA DEL MANUAL DEL INVESTIGADOR ÍNDICE 1. Introducción y
RED PANAMERICANA PARA LA ARMONIZACIÓN DE LA REGULACIÓN FARMACÉUTICA (RED PARF) GRUPO DE TRABAJO BUENAS PRÁCTICAS CLÍNICAS DOCUMENTO DE TRABAJO GUIA DEL MANUAL DEL INVESTIGADOR ÍNDICE 1. Introducción y
LEGISLACIÓN CONSOLIDADA. TEXTO CONSOLIDADO Última modificación: 23 de septiembre de 2011
 Real Decreto 294/1995, de 24 de febrero, por el que se regula la Real Farmacopea Española, el formulario nacional y los órganos consultivos del Ministerio de Sanidad y Consumo en esta materia. Ministerio
Real Decreto 294/1995, de 24 de febrero, por el que se regula la Real Farmacopea Española, el formulario nacional y los órganos consultivos del Ministerio de Sanidad y Consumo en esta materia. Ministerio
Seminario La Propiedad Intelectual en la Industria Farmacéutica del Siglo XXI
 Seminario La Propiedad Intelectual en la Industria Farmacéutica del Siglo XXI Asociación Interamericana de la Propiedad Intelectual Bogotá, Colombia 10 de abril, 2018 Dr. Hugo Carrasco Soulé Sistema de
Seminario La Propiedad Intelectual en la Industria Farmacéutica del Siglo XXI Asociación Interamericana de la Propiedad Intelectual Bogotá, Colombia 10 de abril, 2018 Dr. Hugo Carrasco Soulé Sistema de
REGLAMENTO A LA LEY ORGANICA DE SALUD. Rafael Correa Delgado PRESIDENTE CONSTITUCIONAL DE LA REPUBLICA
 REGLAMENTO A LA LEY ORGANICA DE SALUD NORMA: Decreto Ejecutivo 1395 STATUS: Vigente PUBLICADO: Registro Oficial 457 FECHA: 30 de Octubre de 2008 Rafael Correa Delgado PRESIDENTE CONSTITUCIONAL DE LA REPUBLICA
REGLAMENTO A LA LEY ORGANICA DE SALUD NORMA: Decreto Ejecutivo 1395 STATUS: Vigente PUBLICADO: Registro Oficial 457 FECHA: 30 de Octubre de 2008 Rafael Correa Delgado PRESIDENTE CONSTITUCIONAL DE LA REPUBLICA
EXENTA N 504. Santiago,
 REPUBLICA DE CHILE MINISTERIO DE SALUD SUBSECRETARIA REDES ASISTENCIALES DPTO. ASESORIA JURIDICA JMV/ISZ/SPJ/HLC APRUEBA NORMA GENERAL TECNICA Nº 113, SOBRE ORGANIZACIÓN Y FUNCIONAMIENTO DE LOS COMITES
REPUBLICA DE CHILE MINISTERIO DE SALUD SUBSECRETARIA REDES ASISTENCIALES DPTO. ASESORIA JURIDICA JMV/ISZ/SPJ/HLC APRUEBA NORMA GENERAL TECNICA Nº 113, SOBRE ORGANIZACIÓN Y FUNCIONAMIENTO DE LOS COMITES
DOCUMENTO DE POSICIONAMIENTO DE LA SOCIEDAD ESPAÑOLA DE FARMACIA HOSPITALARIA SOBRE LOS MEDICAMENTOS BIOSIMILARES
 DOCUMENTO DE POSICIONAMIENTO DE LA SOCIEDAD ESPAÑOLA DE FARMACIA HOSPITALARIA SOBRE LOS MEDICAMENTOS BIOSIMILARES Se define un medicamento biosimilar como aquel que contiene una versión de una sustancia
DOCUMENTO DE POSICIONAMIENTO DE LA SOCIEDAD ESPAÑOLA DE FARMACIA HOSPITALARIA SOBRE LOS MEDICAMENTOS BIOSIMILARES Se define un medicamento biosimilar como aquel que contiene una versión de una sustancia
Selección de Medicamentos
 Selección de Medicamentos a) INTRODUCCIÓN Las Direcciones de Área de Salud utilizan los medicamentos que se consideran básicos según el perfil epidemiológico y capacidad resolutiva de los servicios. La
Selección de Medicamentos a) INTRODUCCIÓN Las Direcciones de Área de Salud utilizan los medicamentos que se consideran básicos según el perfil epidemiológico y capacidad resolutiva de los servicios. La
EDUCACIÓN AL PACIENTE Y SU FAMILIA SOBRE EL USO DE MEDICAMENTOS
 Hoja: 1 de 6 EDUCACIÓN AL PACIENTE Y SU FAMILIA SOBRE EL USO DE MEDICAMENTOS Elaboró: Revisó: Autorizó: Puesto Jefe de División Control del Dopaje Subdirector de Medicina del Deporte Director Médico Firma
Hoja: 1 de 6 EDUCACIÓN AL PACIENTE Y SU FAMILIA SOBRE EL USO DE MEDICAMENTOS Elaboró: Revisó: Autorizó: Puesto Jefe de División Control del Dopaje Subdirector de Medicina del Deporte Director Médico Firma
Introducción a la Farmacia Galénica. Tema 1
 Introducción a la Farmacia Galénica Tema 1 Índice de contenidos Concepto de Farmacia Galénica Tecnología Farmacéutica Biofarmacia Farmacocinética Definición de medicamento y términos relacionados 2 Principio
Introducción a la Farmacia Galénica Tema 1 Índice de contenidos Concepto de Farmacia Galénica Tecnología Farmacéutica Biofarmacia Farmacocinética Definición de medicamento y términos relacionados 2 Principio
11. Los casos que no se encuentren contemplados en estos criterios y acciones, serán evaluados caso a caso por la ANM. CRITERIOS ESPECÍFICOS:
 INFORME DEL GRUPO DE TRABAJO ENCARGADO DE ELABORAR LOS CRITERIOS Y ACCIONES PARA EVALUACION Y CUMPLIMIENTO DE LA EFICACIA Y SEGURIDAD DE LAS ESPECIALIDADES FARMACEUTICAS - RESOLUCION MINISTERIAL N 707-2014/MINSA
INFORME DEL GRUPO DE TRABAJO ENCARGADO DE ELABORAR LOS CRITERIOS Y ACCIONES PARA EVALUACION Y CUMPLIMIENTO DE LA EFICACIA Y SEGURIDAD DE LAS ESPECIALIDADES FARMACEUTICAS - RESOLUCION MINISTERIAL N 707-2014/MINSA
Control de sustancias estupefacientes y psicotrópicas que ingresan a través del Aeropuerto
 Control de sustancias estupefacientes y psicotrópicas que ingresan a través del Aeropuerto 1. Legislación sobre la materia: 1.1 Código Sanitario 1.2 Decreto Nº 404 Reglamento de Estupefacientes. 1.3 Decreto
Control de sustancias estupefacientes y psicotrópicas que ingresan a través del Aeropuerto 1. Legislación sobre la materia: 1.1 Código Sanitario 1.2 Decreto Nº 404 Reglamento de Estupefacientes. 1.3 Decreto
HOSPITAL DE PROCEDENCIA DE LA SOLICITUD: PRINCIPIO ACTIVO SOLICITADO:
 ANEXO I Cuestionario de solicitud de incorporación de nuevos medicamentos a los hospitales del Sistema Sanitario Público de Aragón 1 HOSPITAL DE PROCEDENCIA DE LA SOLICITUD: PRINCIPIO ACTIVO SOLICITADO:
ANEXO I Cuestionario de solicitud de incorporación de nuevos medicamentos a los hospitales del Sistema Sanitario Público de Aragón 1 HOSPITAL DE PROCEDENCIA DE LA SOLICITUD: PRINCIPIO ACTIVO SOLICITADO:
REPÚBLICA DE PANAMÁ MINISTERIO DE SALUD. DECRETO EJECUTIVO No (De 27 de agosto de 2007 ) EL PRESIDENTE DE LA REPÚBLICA,
 1 REPÚBLICA DE PANAMÁ MINISTERIO DE SALUD DECRETO EJECUTIVO No. 340 (De 27 de agosto de 2007 ) "Por el cual se modifica el Capítulo V del Título II del Decreto Ejecutivo 178 de 12 de julio de 2001, Que
1 REPÚBLICA DE PANAMÁ MINISTERIO DE SALUD DECRETO EJECUTIVO No. 340 (De 27 de agosto de 2007 ) "Por el cual se modifica el Capítulo V del Título II del Decreto Ejecutivo 178 de 12 de julio de 2001, Que
APRUEBA REGLAMENTO QUE ESTABLECE NORMAS PARA LA ELABORACIÓN Y DETERMINACIÓN DE LAS GARANTÍAS EXPLÍCITAS EN SALUD A QUE SE REFIERE LA LEY N
 REPUBLICA DE CHILE MINISTERIO DE HACIENDA MINISTERIO DE SALUD ARC/GAG/HLDC/LEDS APRUEBA REGLAMENTO QUE ESTABLECE NORMAS PARA LA ELABORACIÓN Y DETERMINACIÓN DE LAS GARANTÍAS EXPLÍCITAS EN SALUD A QUE SE
REPUBLICA DE CHILE MINISTERIO DE HACIENDA MINISTERIO DE SALUD ARC/GAG/HLDC/LEDS APRUEBA REGLAMENTO QUE ESTABLECE NORMAS PARA LA ELABORACIÓN Y DETERMINACIÓN DE LAS GARANTÍAS EXPLÍCITAS EN SALUD A QUE SE
ASUNTO: ORDENACIÓN DE LOS PROCEDIMIENTOS DE EVALUACIÓN DE PRODUCTOS FARMACÉUTICOS, GUÍAS
 ASUNTO: ORDENACIÓN DE LOS PROCEDIMIENTOS DE EVALUACIÓN DE PRODUCTOS FARMACÉUTICOS, GUÍAS Y PROTOCOLOS FARMACOTERAPÉUTICOS INTERACTIVOS, MEDICAMENTOS DE ALTO IMPACTO SANITARIO Y/O ECONÓMICO Y OBSERVATORIOS
ASUNTO: ORDENACIÓN DE LOS PROCEDIMIENTOS DE EVALUACIÓN DE PRODUCTOS FARMACÉUTICOS, GUÍAS Y PROTOCOLOS FARMACOTERAPÉUTICOS INTERACTIVOS, MEDICAMENTOS DE ALTO IMPACTO SANITARIO Y/O ECONÓMICO Y OBSERVATORIOS
DIRECCION GENERAL DE MEDICAMENTOS, INSUMOS Y DROGAS ( DIGEMID -PERU) PRODUCTOS BIOLOGICOS SITUACION ACTUAL
 DIGEMID DIRECCION GENERAL DE MEDICAMENTOS, INSUMOS Y DROGAS ( DIGEMID -PERU) PRODUCTOS BIOLOGICOS SITUACION ACTUAL DRA. AMANDA MARTINEZ ROJO EQUIPO DE REGISTRO DE PRODUCTOS FARMACEUTICOS JUNIO - 2008 SITUACION
DIGEMID DIRECCION GENERAL DE MEDICAMENTOS, INSUMOS Y DROGAS ( DIGEMID -PERU) PRODUCTOS BIOLOGICOS SITUACION ACTUAL DRA. AMANDA MARTINEZ ROJO EQUIPO DE REGISTRO DE PRODUCTOS FARMACEUTICOS JUNIO - 2008 SITUACION
APRUEBA REGLAMENTO DE LABORATORIOS DE MEDICION Y ANALISIS DE EMISIONES ATMOSFERICAS PROVENIENTES DE FUENTES ESTACIONARIAS
 Decreto Supremo 2467 Ministerio de Salud Promulgación: 24.12.1993 Publicación Diario Oficial: 18.02.1994 Original APRUEBA REGLAMENTO DE LABORATORIOS DE MEDICION Y ANALISIS DE EMISIONES ATMOSFERICAS PROVENIENTES
Decreto Supremo 2467 Ministerio de Salud Promulgación: 24.12.1993 Publicación Diario Oficial: 18.02.1994 Original APRUEBA REGLAMENTO DE LABORATORIOS DE MEDICION Y ANALISIS DE EMISIONES ATMOSFERICAS PROVENIENTES
TÍTULO REGLAMENTO TÉCNICO QUE REGULA LOS MEDICAMENTOS DE VENTA LIBRE SIN RECETA
 TÍTULO REGLAMENTO TÉCNICO QUE REGULA LOS MEDICAMENTOS DE VENTA LIBRE SIN RECETA UNIDAD RESPONSABLE DIRECCIÓN GENERAL DE MEDICAMENTOS, ALIMENTOS Y PRODUCTOS SANITARIOS CÓDIGO MSP/DIGEMAPS 02-15 COORDINACIÓN
TÍTULO REGLAMENTO TÉCNICO QUE REGULA LOS MEDICAMENTOS DE VENTA LIBRE SIN RECETA UNIDAD RESPONSABLE DIRECCIÓN GENERAL DE MEDICAMENTOS, ALIMENTOS Y PRODUCTOS SANITARIOS CÓDIGO MSP/DIGEMAPS 02-15 COORDINACIÓN
REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURÍDICA Mmh.
 REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURÍDICA Mmh. DETERMINA FORMATO DE RECETA CHEQUE Y RECETA MEDICA RETENIDA Y FIJA CLAVES CORRESPONDIENTES A ESTUPEFACIENTES Y PRODUCTOS SICOTROPICOS
REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURÍDICA Mmh. DETERMINA FORMATO DE RECETA CHEQUE Y RECETA MEDICA RETENIDA Y FIJA CLAVES CORRESPONDIENTES A ESTUPEFACIENTES Y PRODUCTOS SICOTROPICOS
a) En la Capital Federal, territorios nacionales y lugares sujetos a la jurisdicción del Gobierno Nacional.
 Texto actualizado del Decreto 9763/64 Ministerio de Asistencia Social y Salud Pública Ministerio de Asistencia Social y Salud Pública MEDICAMENTOS Reglaméntase Ley 16.463. DECRETO Nº 9.763. Bs. As., 2/12/64
Texto actualizado del Decreto 9763/64 Ministerio de Asistencia Social y Salud Pública Ministerio de Asistencia Social y Salud Pública MEDICAMENTOS Reglaméntase Ley 16.463. DECRETO Nº 9.763. Bs. As., 2/12/64
ANEXO II INFORMACION DEL PRODUCTO Descripción general del producto, en su caso con dibujos explicativos y
 ANEXO II INFORMACION DEL PRODUCTO Resumen de las características del producto 1. Nombre del medicamento 2. Composición del producto: 2.1. Descripción general del producto, en su caso con dibujos explicativos
ANEXO II INFORMACION DEL PRODUCTO Resumen de las características del producto 1. Nombre del medicamento 2. Composición del producto: 2.1. Descripción general del producto, en su caso con dibujos explicativos
Cambios en el Proyecto de Ley de Farmacia de Madrid
 Cambios en el Proyecto de Ley de Farmacia de Madrid Exposición de Motivos. Apartado 11 sexto párrafo in fine. Artículo 2. Definiciones. Apartados a), b), c). Artículo 4. Derechos y obligaciones de los
Cambios en el Proyecto de Ley de Farmacia de Madrid Exposición de Motivos. Apartado 11 sexto párrafo in fine. Artículo 2. Definiciones. Apartados a), b), c). Artículo 4. Derechos y obligaciones de los
REGULACIÓN SANITARIA EN MATERIA DE MEDICAMENTOS BIOTECNOLÓGICOS
 REGULACIÓN SANITARIA EN MATERIA DE MEDICAMENTOS BIOTECNOLÓGICOS Lilia Ramírez Morales Subdirectora Ejecutiva de Legislación y Consulta de la Coordinación General Jurídica y Consultiva de la Comisión Federal
REGULACIÓN SANITARIA EN MATERIA DE MEDICAMENTOS BIOTECNOLÓGICOS Lilia Ramírez Morales Subdirectora Ejecutiva de Legislación y Consulta de la Coordinación General Jurídica y Consultiva de la Comisión Federal
TARIFAS DE LAS ACTIVIDADES REALIZADAS POR EL SERVICIO AUTÓNOMO DE CONTRALORIA SANITARIA (SACS) NIVEL CENTRAL DROGAS, MEDICAMENTOS Y COSMÉTICOS
 TARIFAS DE LAS ACTIVIDADES REALIZADAS POR EL SERVICIO AUTÓNOMO DE CONTRALORIA SANITARIA (SACS) NIVEL CENTRAL DROGAS, MEDICAMENTOS Y COSMÉTICOS 1 Constancias y Copias Certificadas. 30 (por hoja) 2 Anulación
TARIFAS DE LAS ACTIVIDADES REALIZADAS POR EL SERVICIO AUTÓNOMO DE CONTRALORIA SANITARIA (SACS) NIVEL CENTRAL DROGAS, MEDICAMENTOS Y COSMÉTICOS 1 Constancias y Copias Certificadas. 30 (por hoja) 2 Anulación
JORNADA PARA PROFESIONALES SOBRE USO MEDICINAL DE CANNABIS
 JORNADA PARA PROFESIONALES SOBRE USO MEDICINAL DE CANNABIS Acceso actual a la utilización de Cannabis en la Provincia de Santa Fe. Comisión Provincial de Medicamentos Valeria Palchik Rosario, 10 de Noviembre
JORNADA PARA PROFESIONALES SOBRE USO MEDICINAL DE CANNABIS Acceso actual a la utilización de Cannabis en la Provincia de Santa Fe. Comisión Provincial de Medicamentos Valeria Palchik Rosario, 10 de Noviembre
I. Comunidad Autónoma
 Página 6018 I. Comunidad Autónoma 2. Autoridades y Personal Consejería de Economía y Hacienda 1857 Orden de 7 de febrero 2014, de la Consejería de Economía y Hacienda, por la que se aprueba el programa
Página 6018 I. Comunidad Autónoma 2. Autoridades y Personal Consejería de Economía y Hacienda 1857 Orden de 7 de febrero 2014, de la Consejería de Economía y Hacienda, por la que se aprueba el programa
DEJA SIN EFECTO DECRETO Nº 404, DE 1998, Y APRUEBA NUEVO REGLAMENTO DE MONTOS DE CONTRATOS DE OBRAS PUBLICAS
 Biblioteca del Congreso Nacional ------------------------------------------------------------------------- Identificación de la Norma : DTO-1093 Fecha de Publicación : 29.11.2003 Subsecretario de Obras
Biblioteca del Congreso Nacional ------------------------------------------------------------------------- Identificación de la Norma : DTO-1093 Fecha de Publicación : 29.11.2003 Subsecretario de Obras
TARIFAS DE LAS ACTIVIDADES REALIZADAS POR EL SERVICIO AUTÓNOMO DE CONTRALORIA SANITARIA (SACS) NIVEL CENTRAL DROGAS, MEDICAMENTOS Y COSMÉTICOS
 TARIFAS DE LAS ACTIVIDADES REALIZADAS POR EL SERVICIO AUTÓNOMO DE CONTRALORIA SANITARIA (SACS) NIVEL CENTRAL DROGAS, MEDICAMENTOS Y COSMÉTICOS 1 Constancias y Copias Certificadas. 70 (por hoja) Anulación
TARIFAS DE LAS ACTIVIDADES REALIZADAS POR EL SERVICIO AUTÓNOMO DE CONTRALORIA SANITARIA (SACS) NIVEL CENTRAL DROGAS, MEDICAMENTOS Y COSMÉTICOS 1 Constancias y Copias Certificadas. 70 (por hoja) Anulación
DECRETO N 324, DE 1991
 DECRETO N 324, DE 1991 MINISTERIO DE EDUCACIÓN Procedimiento para la aplicación de los artículos 7, inciso segundo y 11 transitorios de la ley N 19.070 ACTUALIZADO HASTA EL DECRETO N 884, DE 1992, DEL
DECRETO N 324, DE 1991 MINISTERIO DE EDUCACIÓN Procedimiento para la aplicación de los artículos 7, inciso segundo y 11 transitorios de la ley N 19.070 ACTUALIZADO HASTA EL DECRETO N 884, DE 1992, DEL
REGLAMENTO DE LABORATORIOS PRIVADOS DE SALUD PÚBLICA DE CARACTERIZACIÓN DE RESIDUOS PELIGROSOS
 REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURIDICA ARC/ISL REGLAMENTO DE LABORATORIOS PRIVADOS DE SALUD PÚBLICA DE CARACTERIZACIÓN DE RESIDUOS PELIGROSOS DTO. N 173 DE 2005 Publicado en el
REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURIDICA ARC/ISL REGLAMENTO DE LABORATORIOS PRIVADOS DE SALUD PÚBLICA DE CARACTERIZACIÓN DE RESIDUOS PELIGROSOS DTO. N 173 DE 2005 Publicado en el
Biblioteca del Congreso Nacional de Chile - - documento generado el 12-Ago-2014
 Tipo Norma :Resolución 1823 EXENTA Fecha Publicación :17-07-2014 Fecha Promulgación :27-05-2014 Organismo :MINISTERIO DE SALUD; SUBSECRETARÍA DE SALUD PÚBLICA; INSTITUTO DE SALUD PÚBLICA Título :MODIFICA
Tipo Norma :Resolución 1823 EXENTA Fecha Publicación :17-07-2014 Fecha Promulgación :27-05-2014 Organismo :MINISTERIO DE SALUD; SUBSECRETARÍA DE SALUD PÚBLICA; INSTITUTO DE SALUD PÚBLICA Título :MODIFICA
Marco normativo para el desarrollo de la Farmacovigilancia en Colombia. Shirley Chapetón Montes Coordinadora Grupo Apoyo Jurídico Institucional
 Marco normativo para el desarrollo de la Farmacovigilancia en Colombia Shirley Chapetón Montes Coordinadora Grupo Apoyo Jurídico Institucional CONTENIDO Conceptos Básicos Normatividad Guía de farmacovigilancia
Marco normativo para el desarrollo de la Farmacovigilancia en Colombia Shirley Chapetón Montes Coordinadora Grupo Apoyo Jurídico Institucional CONTENIDO Conceptos Básicos Normatividad Guía de farmacovigilancia
REGLAMENTO DE PROTECCION RADIOLOGICA DE INSTALACIONES RADIACTIVAS DTO. Nº 3, DE 1985
 REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURÍDICA Mmh. REGLAMENTO DE PROTECCION RADIOLOGICA DE INSTALACIONES RADIACTIVAS DTO. Nº 3, DE 1985 Publicado en el Diario Oficial de 25.04.85 2 REPUBLICA
REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURÍDICA Mmh. REGLAMENTO DE PROTECCION RADIOLOGICA DE INSTALACIONES RADIACTIVAS DTO. Nº 3, DE 1985 Publicado en el Diario Oficial de 25.04.85 2 REPUBLICA
Formulario Iberoamericano: Red EAMI
 Formulario Iberoamericano: Red EAMI El Formulario Iberoamericano, línea prioritaria de la red de Autoridades en Medicamentos de Iberoamérica (EAMI), que se concibe, como una necesidad existente en la mayoría
Formulario Iberoamericano: Red EAMI El Formulario Iberoamericano, línea prioritaria de la red de Autoridades en Medicamentos de Iberoamérica (EAMI), que se concibe, como una necesidad existente en la mayoría
REGLAMENTA PRODUCCION, DISTRIBUCION, EXPENDIO Y USO DE LOS SOLVENTES ORGANICOS NOCIVOS PARA LA SALUD QUE INDICA DTO. Nº 144/85
 REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURIDICA Mmh. REGLAMENTA PRODUCCION, DISTRIBUCION, EXPENDIO Y USO DE LOS SOLVENTES ORGANICOS NOCIVOS PARA LA SALUD QUE INDICA DTO. Nº 144/85 Publicado
REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURIDICA Mmh. REGLAMENTA PRODUCCION, DISTRIBUCION, EXPENDIO Y USO DE LOS SOLVENTES ORGANICOS NOCIVOS PARA LA SALUD QUE INDICA DTO. Nº 144/85 Publicado
Ley de aprovechamiento sostenible de las plantas medicinales LEY Nº 27300
 Ley de aprovechamiento sostenible de las plantas medicinales LEY Nº 27300 CONCORDANCIAS: D.S. Nº 068-2001-PCM (Reglamento de la Ley sobre Conservación y Aprovechamiento Sostenible de la Diversidad Biológica)
Ley de aprovechamiento sostenible de las plantas medicinales LEY Nº 27300 CONCORDANCIAS: D.S. Nº 068-2001-PCM (Reglamento de la Ley sobre Conservación y Aprovechamiento Sostenible de la Diversidad Biológica)
Farmacología y otras ciencias relacionadas
 Farmacología y otras ciencias relacionadas La Farmacología es la ciencia que estudia todos los aspectos relacionados con los medicamentos. Está formada por campos de estudio específicos o ramas, como:
Farmacología y otras ciencias relacionadas La Farmacología es la ciencia que estudia todos los aspectos relacionados con los medicamentos. Está formada por campos de estudio específicos o ramas, como:
[PROCEDIMIENTO PARA LA ADQUISICIÓN DE MEDICAMENTOS E INSUMOS QUE CONSIDERAN EVALUACIÓN TÉCNICA]
![[PROCEDIMIENTO PARA LA ADQUISICIÓN DE MEDICAMENTOS E INSUMOS QUE CONSIDERAN EVALUACIÓN TÉCNICA] [PROCEDIMIENTO PARA LA ADQUISICIÓN DE MEDICAMENTOS E INSUMOS QUE CONSIDERAN EVALUACIÓN TÉCNICA]](/thumbs/76/74495117.jpg) 2015 [PROCEDIMIENTO PARA LA ADQUISICIÓN DE MEDICAMENTOS E INSUMOS QUE CONSIDERAN Característica: APF 1.2 Elaborado por: Q.F. Rosana Cartes C. Marzo 2015. Revisado por: Comité de Calidad Marzo 2015. Aprobado
2015 [PROCEDIMIENTO PARA LA ADQUISICIÓN DE MEDICAMENTOS E INSUMOS QUE CONSIDERAN Característica: APF 1.2 Elaborado por: Q.F. Rosana Cartes C. Marzo 2015. Revisado por: Comité de Calidad Marzo 2015. Aprobado
FORMULARIO PARA EL REGISTRO DE INMUNÓGENOS DE SUBUNIDADES OBTENIDOS POR MÉTODOS BIOTECNOLÓGICOS
 FORMULARIO PARA EL REGISTRO DE INMUNÓGENOS DE SUBUNIDADES OBTENIDOS POR MÉTODOS BIOTECNOLÓGICOS FORMULARIO DE INSCRIPCIÓN PARA INMUNÓGENOS DE SUBUNIDADES OBTENIDOS POR VIA BIOTECNOLÓGICA. FECHA: 1.- NOMBRE
FORMULARIO PARA EL REGISTRO DE INMUNÓGENOS DE SUBUNIDADES OBTENIDOS POR MÉTODOS BIOTECNOLÓGICOS FORMULARIO DE INSCRIPCIÓN PARA INMUNÓGENOS DE SUBUNIDADES OBTENIDOS POR VIA BIOTECNOLÓGICA. FECHA: 1.- NOMBRE
I. MOTIVO IMPOSIBILIDAD DE ACCESO Y REGISTRO EN MIPRES II. DATOS DE LA INSTITUCIÓN PRESTADORA DE SERVICIOS
 V. MEDICAMENTOS 19) Tipo de Medicamento: Medicamento Vital no Disponible Preparación Magistral 20) Al diligenciar este formulario certifico que: 1. EL MEDICAMENTO A PRESCRIBIR NO ESTÁ CUBIERTO POR EL PLAN
V. MEDICAMENTOS 19) Tipo de Medicamento: Medicamento Vital no Disponible Preparación Magistral 20) Al diligenciar este formulario certifico que: 1. EL MEDICAMENTO A PRESCRIBIR NO ESTÁ CUBIERTO POR EL PLAN
Fases de la I&D de un nuevo medicamento
 DEPARTAMENTO INTEGRADO DE FARMACOLOGÍA CLÍNICA CAMPUS BIOMEDICO FACULTAD DE MEDICINA CLÍNICA UNIVERSIDAD DE LA SABANA PROGRAMA DE ESPECIALIZACION EN FARMACOLOGIA CLINICA Fases de la I&D de un nuevo medicamento
DEPARTAMENTO INTEGRADO DE FARMACOLOGÍA CLÍNICA CAMPUS BIOMEDICO FACULTAD DE MEDICINA CLÍNICA UNIVERSIDAD DE LA SABANA PROGRAMA DE ESPECIALIZACION EN FARMACOLOGIA CLINICA Fases de la I&D de un nuevo medicamento
MEDICAMENTOS GENERICOS
 MEDICAMENTOS GENERICOS ACLARACIONES AL CONCEPTO DE GENERICOS En general, Médicos y Farmacéuticos identifican inmediatamente como genérico a los medicamentos sin marca y se aplican a ellos conceptos en
MEDICAMENTOS GENERICOS ACLARACIONES AL CONCEPTO DE GENERICOS En general, Médicos y Farmacéuticos identifican inmediatamente como genérico a los medicamentos sin marca y se aplican a ellos conceptos en
NOMBRE DEL FÁRMACO e indicación clínica (Informe para la Comisión de Farmacia y Terapéutica del Hospital xxxxxxxxxx) Fecha xx/xx/xx
 NOMBRE DEL FÁRMACO e indicación clínica (Informe para la Comisión de Farmacia y Terapéutica del Hospital xxxxxxxxxx) Fecha xx/xx/xx 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco: Indicación
NOMBRE DEL FÁRMACO e indicación clínica (Informe para la Comisión de Farmacia y Terapéutica del Hospital xxxxxxxxxx) Fecha xx/xx/xx 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco: Indicación
D.F.L. N 1, DE 2002 ACTUALIZADO HASTA LA LEY N
 D.F.L. N 1, DE 2002 MINISTERIO DE EDUCACIÓN Fija las normas que estructuran y organizan el funcionamiento y organización de la asignación de excelencia pedagógica y la Red Maestros de Maestros, a que se
D.F.L. N 1, DE 2002 MINISTERIO DE EDUCACIÓN Fija las normas que estructuran y organizan el funcionamiento y organización de la asignación de excelencia pedagógica y la Red Maestros de Maestros, a que se
LISTADO DE ARANCELES VIGENTES DE MEDICAMENTOS
 LISTADO DE ARANCELES VIGENTES DE MEDICAMENTOS códigos A) ESPECIALIDADES MEDICINALES ARTÍCULO 3º DECRETO Nº 150/92 (T.O. 1993) 1) AUTORIZACIÓN Y/O MODIFICACION 2000 REGISTRO INICIAL (ARTÍCULO 3º) $ 7.100,00
LISTADO DE ARANCELES VIGENTES DE MEDICAMENTOS códigos A) ESPECIALIDADES MEDICINALES ARTÍCULO 3º DECRETO Nº 150/92 (T.O. 1993) 1) AUTORIZACIÓN Y/O MODIFICACION 2000 REGISTRO INICIAL (ARTÍCULO 3º) $ 7.100,00
ADQUISICIÓN DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS
 Página 1 de 10 Página 2 de 10 1. OBJETIVO Describir el proceso de Adquisición de insumos medico quirúrgicos, dispositivos médicos y medicamentos, requeridos para la prestación de cada uno de los servicios
Página 1 de 10 Página 2 de 10 1. OBJETIVO Describir el proceso de Adquisición de insumos medico quirúrgicos, dispositivos médicos y medicamentos, requeridos para la prestación de cada uno de los servicios
Clasificación de Medicamentos. Por su forma de preparación Magistrales Oficinales Especialidad farmacéutica
 Artículo 17 bis Ley General de Salud.- La Secretaría de Salud ejercerá las atribuciones de regulación, control y fomento sanitarios a través de un órgano desconcentrado que se denominará Comisión Federal
Artículo 17 bis Ley General de Salud.- La Secretaría de Salud ejercerá las atribuciones de regulación, control y fomento sanitarios a través de un órgano desconcentrado que se denominará Comisión Federal
Función comercial. Función asistencial RELACIÓN CON EL PACIENTE RELACIÓN CON EL CLIENTE
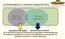 Función comercial Función asistencial RELACIÓN CON EL CLIENTE RELACIÓN CON EL PACIENTE MANUAL DE BUENAS PRÁCTICAS DE DISPENSACIÓN R. M. N 013-2009-MINSA Q.F. DANIEL CESAR GUERRA TUDELA SUPERVISOR II DEMID
Función comercial Función asistencial RELACIÓN CON EL CLIENTE RELACIÓN CON EL PACIENTE MANUAL DE BUENAS PRÁCTICAS DE DISPENSACIÓN R. M. N 013-2009-MINSA Q.F. DANIEL CESAR GUERRA TUDELA SUPERVISOR II DEMID
RETOS EN REGULACIÓN:FARMACOVIGILANCIA FUNDAMENTOS, PROPÓSITOS E IMPORTANCIA DE LA FARMACOVIGILANCIA
 RETOS EN REGULACIÓN:FARMACOVIGILANCIA FUNDAMENTOS, PROPÓSITOS E IMPORTANCIA DE LA FARMACOVIGILANCIA PROF. INÉS RUIZ DEPTO. DE CIENCIAS Y TECNOLOGÍA FARMACÉUTICA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACÉUTICAS
RETOS EN REGULACIÓN:FARMACOVIGILANCIA FUNDAMENTOS, PROPÓSITOS E IMPORTANCIA DE LA FARMACOVIGILANCIA PROF. INÉS RUIZ DEPTO. DE CIENCIAS Y TECNOLOGÍA FARMACÉUTICA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACÉUTICAS
GUÍA PARA CAMBIOS JURÍDICOS POSTERIORES AL REGISTRO SANITARIO DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS
 Página 1 de 8 GUÍA PARA CAMBIOS JURÍDICOS POSTERIORES AL REGISTRO SANITARIO DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS Página 2 de 8 1. INTRODUCCIÓN Este documento es una herramienta jurídica que tiene por
Página 1 de 8 GUÍA PARA CAMBIOS JURÍDICOS POSTERIORES AL REGISTRO SANITARIO DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS Página 2 de 8 1. INTRODUCCIÓN Este documento es una herramienta jurídica que tiene por
GUIA DE APRENDIZAJE. Nombre de la Guía: DESPACHO DE PRODUCTOS FARMACÉUTICOS
 PÁGINA 1 DE 5 FECHA DE ACTUALIZACIÒN: Agosto - 201 1. IDENTIFICACIÓN DE LA GUÍA DE Código Guía: 08-01-01 Nombre de la Guía: DESPACHO DE PRODUCTOS FARMACÉUTICOS Programa: Técnico Laboral Auxiliar en Servicios
PÁGINA 1 DE 5 FECHA DE ACTUALIZACIÒN: Agosto - 201 1. IDENTIFICACIÓN DE LA GUÍA DE Código Guía: 08-01-01 Nombre de la Guía: DESPACHO DE PRODUCTOS FARMACÉUTICOS Programa: Técnico Laboral Auxiliar en Servicios
Atención farmacéutica en pacientes ambulatorios
 Año 4 Vol. 1 AGOSTO Atención farmacéutica en pacientes ambulatorios Autoridades: Presentación En cada acto farmacéutico debe estar presente la calidad de la atención, los principios de la correspondencia
Año 4 Vol. 1 AGOSTO Atención farmacéutica en pacientes ambulatorios Autoridades: Presentación En cada acto farmacéutico debe estar presente la calidad de la atención, los principios de la correspondencia
SITUACION ACTUAL CHILE
 SITUACION ACTUAL CHILE PREPARADOS ELABORADOS EN FARMACIAS - Jueves 27 Septiembre 2012- QF Gladys Chicago Cabrera Mg AGENCIA NACIONAL DE MEDICAMENTOS Subdepto Inspecciones. Sección n Farmacia TEMARIO Preparados
SITUACION ACTUAL CHILE PREPARADOS ELABORADOS EN FARMACIAS - Jueves 27 Septiembre 2012- QF Gladys Chicago Cabrera Mg AGENCIA NACIONAL DE MEDICAMENTOS Subdepto Inspecciones. Sección n Farmacia TEMARIO Preparados
Documentación científica
 Documentación científica Unidad 5: Documentación para la práctica farmacéutica Tema 14. Documentación para la práctica farmacéutica: Farmacopea, Vademécum, Guías de práctica clínica. jsanz@umh.es Farmacopea
Documentación científica Unidad 5: Documentación para la práctica farmacéutica Tema 14. Documentación para la práctica farmacéutica: Farmacopea, Vademécum, Guías de práctica clínica. jsanz@umh.es Farmacopea
PANORAMA ACTUAL DE LA FARMACOVIGILANCIA EN MÉXICO CAMBIOS RELEVANTES DE LA NOM-220M
 PANORAMA ACTUAL DE LA FARMACOVIGILANCIA EN MÉXICO CAMBIOS RELEVANTES DE LA NOM-220M 1 EVALUACIÓN Y CALIFICACIÓN DE COFEPRIS AUTORIDADES REGULADORAS NACIONALES DE REFERENCIA MUNDIAL 2 2014 Autoridad Reguladora
PANORAMA ACTUAL DE LA FARMACOVIGILANCIA EN MÉXICO CAMBIOS RELEVANTES DE LA NOM-220M 1 EVALUACIÓN Y CALIFICACIÓN DE COFEPRIS AUTORIDADES REGULADORAS NACIONALES DE REFERENCIA MUNDIAL 2 2014 Autoridad Reguladora
RESOLUCIÓN MINISTERIAL SA-DM Lima 08 de Noviembre de 1999
 RESOLUCIÓN MINISTERIAL 548-99-SA-DM Lima 08 de Noviembre de 999 Visto el Oficio N 359-99-DG-AL-DIGEMID, cursado por la Dirección General de Medicamentos, Insumos y Drogas; CONSIDERANDO: Que por Resolución
RESOLUCIÓN MINISTERIAL 548-99-SA-DM Lima 08 de Noviembre de 999 Visto el Oficio N 359-99-DG-AL-DIGEMID, cursado por la Dirección General de Medicamentos, Insumos y Drogas; CONSIDERANDO: Que por Resolución
REGLAMENTO PARA EJERCER LAS ACTIVIDADES DE COSMETOLOGÍA DTO. N 88, DE 1980
 REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURÍDICA Sam. REGLAMENTO PARA EJERCER LAS ACTIVIDADES DE COSMETOLOGÍA DTO. N 88, DE 1980 Publicado en el Diario Oficial del 10 de Septiembre de 1980
REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURÍDICA Sam. REGLAMENTO PARA EJERCER LAS ACTIVIDADES DE COSMETOLOGÍA DTO. N 88, DE 1980 Publicado en el Diario Oficial del 10 de Septiembre de 1980
FICHA PROCESOO. Comisión e calidad y consultiva PROCESO FARMACIAA. FP /11/14 01 Ana Saez. Primera edición. Página 1 de 6
 Entradas del proceso: FICHA Resultados del proceso: Departamentos Implicados: -Necesidad de medicación y material sanitario por parte de los pacientes -Necesidad de información por parte de los profesionales
Entradas del proceso: FICHA Resultados del proceso: Departamentos Implicados: -Necesidad de medicación y material sanitario por parte de los pacientes -Necesidad de información por parte de los profesionales
LINEAMIENTOS Y MEDIDAS DE REFORMA DEL SECTOR SALUD
 Consejo Nacional de Salud LINEAMIENTOS Y MEDIDAS DE REFORMA DEL SECTOR SALUD EN MEDICAMENTOS PROPUESTA PRELIMINAR JUNIO DE 2013 SITUACIÓN ACTUAL SITUACIÓN ACTUAL (DISPONIBILIDAD) SITUACIÓN ACTUAL PROBLEMÁTICA
Consejo Nacional de Salud LINEAMIENTOS Y MEDIDAS DE REFORMA DEL SECTOR SALUD EN MEDICAMENTOS PROPUESTA PRELIMINAR JUNIO DE 2013 SITUACIÓN ACTUAL SITUACIÓN ACTUAL (DISPONIBILIDAD) SITUACIÓN ACTUAL PROBLEMÁTICA
MESA REDONDA Promoción del uso adecuado de los Medicamentos en Latinoamérica
 MESA REDONDA Promoción del uso adecuado de los Medicamentos en Latinoamérica Iván Torres Marquina Presidente de la Asociación Peruana de Facultades y Escuelas de Farmacia y Bioquímica (ASPEFEFB) Decano
MESA REDONDA Promoción del uso adecuado de los Medicamentos en Latinoamérica Iván Torres Marquina Presidente de la Asociación Peruana de Facultades y Escuelas de Farmacia y Bioquímica (ASPEFEFB) Decano
APRUEBA REGLAMENTO DE LA LEY N QUE OTORGA BENEFICIOS A LA SALUD PRIMARIA.
 REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURIDICA Mmh. APRUEBA REGLAMENTO DE LA LEY N 19.813 QUE OTORGA BENEFICIOS A LA SALUD PRIMARIA. D. Oficial 14.01.03 N 324 _/ SANTIAGO, 17.12.2002 VISTO:
REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURIDICA Mmh. APRUEBA REGLAMENTO DE LA LEY N 19.813 QUE OTORGA BENEFICIOS A LA SALUD PRIMARIA. D. Oficial 14.01.03 N 324 _/ SANTIAGO, 17.12.2002 VISTO:
Depto. de Tecnologías de la Información
 Telemedicina Diferida Inscripción de Paciente Urgencia APS Agendamiento Registro de Atención APS Gestión de Interconsultas Gestión de Controles Gestión Solicitudes Medios Diagnósticos Gestión de Farmacia
Telemedicina Diferida Inscripción de Paciente Urgencia APS Agendamiento Registro de Atención APS Gestión de Interconsultas Gestión de Controles Gestión Solicitudes Medios Diagnósticos Gestión de Farmacia
DIRECCIÓN NACIONAL DE VIGILANCIA SANITARIA -PARAGUAY-
 DIRECCIÓN NACIONAL DE VIGILANCIA SANITARIA -PARAGUAY- Iturbe N 883 e/ Manuel Domínguez y Fulgencio R. Moreno. Asunción - Paraguay La Dirección Nacional de Vigilancia Sanitaria, es un organismo dependiente
DIRECCIÓN NACIONAL DE VIGILANCIA SANITARIA -PARAGUAY- Iturbe N 883 e/ Manuel Domínguez y Fulgencio R. Moreno. Asunción - Paraguay La Dirección Nacional de Vigilancia Sanitaria, es un organismo dependiente
Unidad Docente Farmacia Hospitalaria
 Unidad Docente Farmacia Hospitalaria Plan de Supervisión Id: 2526 PLAN DE SUPERVISIÓN FARMACIA HOSPITALARIA Coordinadora: Dra. Mònica Rodríguez Carballeira (cap d estudis) Autores: Dra. M.ª Rosa Garriga
Unidad Docente Farmacia Hospitalaria Plan de Supervisión Id: 2526 PLAN DE SUPERVISIÓN FARMACIA HOSPITALARIA Coordinadora: Dra. Mònica Rodríguez Carballeira (cap d estudis) Autores: Dra. M.ª Rosa Garriga
REGLAMENTO DE NOTIFICACIÓN OBLIGATORIA DE LAS INTOXICACIONES AGUDAS CON PESTICIDAS
 REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURÍDICA Mmh. REGLAMENTO DE NOTIFICACIÓN OBLIGATORIA DE LAS INTOXICACIONES AGUDAS CON PESTICIDAS Dto. Nº 88, de 2004 Publicado en el Diario Oficial
REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURÍDICA Mmh. REGLAMENTO DE NOTIFICACIÓN OBLIGATORIA DE LAS INTOXICACIONES AGUDAS CON PESTICIDAS Dto. Nº 88, de 2004 Publicado en el Diario Oficial
Datos Generales de Panamá. Organización del Sector Salud. Políticas del Sector Salud. Competencias y Capacidades
 Datos Generales de Panamá Organización del Sector Salud Financiamiento del Sector Salud Políticas del Sector Salud Dirección Nacional de Farmacia y Drogas Competencias y Capacidades Proyectos Población
Datos Generales de Panamá Organización del Sector Salud Financiamiento del Sector Salud Políticas del Sector Salud Dirección Nacional de Farmacia y Drogas Competencias y Capacidades Proyectos Población
REGLAMENTA EL INCISO 2º DEL ARTICULO 3º DE LA LEY Nº , SOBRE JARDINES INFANTILES COMUNITARIOS
 Biblioteca del Congreso Nacional -------------------------------------------------------------------------------- Identificación de la Norma : DTO-138 Fecha de Publicación : 04.05.2006 Fecha de Promulgación
Biblioteca del Congreso Nacional -------------------------------------------------------------------------------- Identificación de la Norma : DTO-138 Fecha de Publicación : 04.05.2006 Fecha de Promulgación
Políticas Públicas en el mercado de los Medicamentos en Chile
 Políticas Públicas en el mercado de los Medicamentos en Chile Dr. Patricio Huenchuñir Gómez Departamento de Políticas Farmacéuticas y Profesiones Médicas Los Medicamentos Prioridad para el Gobierno Mensaje
Políticas Públicas en el mercado de los Medicamentos en Chile Dr. Patricio Huenchuñir Gómez Departamento de Políticas Farmacéuticas y Profesiones Médicas Los Medicamentos Prioridad para el Gobierno Mensaje
PROVIDENCIA ADMINISTRATIVA Nº
 CARACAS, 01 DE AGOSTO DE 2016 206º 157º Y 17 PROVIDENCIA ADMINISTRATIVA Nº 133-2016 MAURICIO ERASMO VEGA MENDEZ, venezolano, mayor de edad, titular de la cédula de identidad Nº V- 15.991.853, en su carácter
CARACAS, 01 DE AGOSTO DE 2016 206º 157º Y 17 PROVIDENCIA ADMINISTRATIVA Nº 133-2016 MAURICIO ERASMO VEGA MENDEZ, venezolano, mayor de edad, titular de la cédula de identidad Nº V- 15.991.853, en su carácter
Artículo 2. Adscripción del Registro.
 ORDEN FORAL /2015, de, del Consejero de Salud, por la que se crea y regula el Registro de Sospechas de Reacciones Adversas a Medicamentos de Navarra y se crea el fichero de datos de carácter personal correspondiente.
ORDEN FORAL /2015, de, del Consejero de Salud, por la que se crea y regula el Registro de Sospechas de Reacciones Adversas a Medicamentos de Navarra y se crea el fichero de datos de carácter personal correspondiente.
Reunión de Autoridades Nacionales Reguladoras Latinoamérica Caribe Santo Domingo-República Dominicana Junio del 2008
 Reunión de Autoridades Nacionales Reguladoras Latinoamérica Caribe Santo Domingo-República Dominicana 12 13 Junio del 2008 Dra. Leonor Suárez de Cozzarelli Ecuador Instituto Nacional de Higiene y Medicina
Reunión de Autoridades Nacionales Reguladoras Latinoamérica Caribe Santo Domingo-República Dominicana 12 13 Junio del 2008 Dra. Leonor Suárez de Cozzarelli Ecuador Instituto Nacional de Higiene y Medicina
DTO. Nº 951/68. REPÚBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORÍA JURÍDICA mmh. Publicado en el Diario Oficial de
 REPÚBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORÍA JURÍDICA mmh. REGLAMENTO PARA EJERCER LA PROFESIÓN DE PODOLOGO DTO. Nº 951/68 Publicado en el Diario Oficial de 20.12.68 MODIFICACIONES: DTO. 221/78,
REPÚBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORÍA JURÍDICA mmh. REGLAMENTO PARA EJERCER LA PROFESIÓN DE PODOLOGO DTO. Nº 951/68 Publicado en el Diario Oficial de 20.12.68 MODIFICACIONES: DTO. 221/78,
CURSO DE AUXILIAR DE FARMACIA MODULO I 1. INTRODUCCIÓN
 1. INTRODUCCIÓN La importancia del conocimiento del manejo de medicamentos a nivel de las Farmacias y de su uso por el paciente, es de vital importancia, no solo por lo delicado que pueda ser en cuanto
1. INTRODUCCIÓN La importancia del conocimiento del manejo de medicamentos a nivel de las Farmacias y de su uso por el paciente, es de vital importancia, no solo por lo delicado que pueda ser en cuanto
DECRETO SUPREMO Nº 155, (V. y U.), DE 2001, (D.O. DE )
 MINISTERIO DE VIVIENDA Y URBANISMO DIVISIÓN JURÍDICA MJM/CMR/pml. DECRETO SUPREMO Nº 155, (V. y U.), DE 2001, (D.O. DE 14.09.01) REGLAMENTA OTORGAMIENTO DE SUBSIDIOS HABITACIONALES MODALIDAD FONDO CONCURSABLE
MINISTERIO DE VIVIENDA Y URBANISMO DIVISIÓN JURÍDICA MJM/CMR/pml. DECRETO SUPREMO Nº 155, (V. y U.), DE 2001, (D.O. DE 14.09.01) REGLAMENTA OTORGAMIENTO DE SUBSIDIOS HABITACIONALES MODALIDAD FONDO CONCURSABLE
PLAN ESTRATEGICO DEPARTAMENTAL DE USO RACIONAL DE PRODUCTOS FARMACÉUTICOS ( )
 PLAN ESTRATEGICO DEPARTAMENTAL DE USO RACIONAL DE PRODUCTOS FARMACÉUTICOS (2013-2014) Departamento de Salud de la Plana Plan Estratégico Farmacia. Departamento de la Plana. 2013-2014 v1 Página 1/10 PLAN
PLAN ESTRATEGICO DEPARTAMENTAL DE USO RACIONAL DE PRODUCTOS FARMACÉUTICOS (2013-2014) Departamento de Salud de la Plana Plan Estratégico Farmacia. Departamento de la Plana. 2013-2014 v1 Página 1/10 PLAN
Artículo 1º.- Definiciones. Para efectos de este reglamento, se entenderá
 Tipo Norma :Decreto 78 Fecha Publicación :17-04-2015 Fecha Promulgación :22-10-2014 Organismo Título :MINISTERIO DEL MEDIO AMBIENTE :APRUEBA REGLAMENTO DEL REGISTRO PÚBLICO DE CONSULTORES CERTIFICADOS
Tipo Norma :Decreto 78 Fecha Publicación :17-04-2015 Fecha Promulgación :22-10-2014 Organismo Título :MINISTERIO DEL MEDIO AMBIENTE :APRUEBA REGLAMENTO DEL REGISTRO PÚBLICO DE CONSULTORES CERTIFICADOS
EL ENVASE DEL MEDICAMENTO
 EL ENVASE DEL MEDICAMENTO Una fuente de información para su correcta dispensación y uso Si aparece una línea negra bordeando la parte superior del cupón (cupón precinto diferenciado ), el medicamento requiere
EL ENVASE DEL MEDICAMENTO Una fuente de información para su correcta dispensación y uso Si aparece una línea negra bordeando la parte superior del cupón (cupón precinto diferenciado ), el medicamento requiere
Cuestiones de Protección al Consumidor en el sector de medicamentos
 Cuestiones de Protección al Consumidor en el sector de medicamentos Anahí Chávez Ruesta Directora de la Autoridad Nacional de Protección del Consumidor 1 Problemas que afectan a los consumidores 2 Qué
Cuestiones de Protección al Consumidor en el sector de medicamentos Anahí Chávez Ruesta Directora de la Autoridad Nacional de Protección del Consumidor 1 Problemas que afectan a los consumidores 2 Qué
ANEXO III - A. SOLICITUD MERCOSUR DE INSCRIPCION para PRODUCTOS FARMACOLOGICOS Nombre : Domicilio :...
 ANEXO III - A SOLICITUD MERCOSUR DE INSCRIPCION para PRODUCTOS FARMACOLOGICOS 1.- Nombre Comercial del Producto: (Marca) 2.- Clasificación: (Uso Oficial Exclusivo) 3.- ESTABLECIMIENTO SOLICITANTE 3.1-
ANEXO III - A SOLICITUD MERCOSUR DE INSCRIPCION para PRODUCTOS FARMACOLOGICOS 1.- Nombre Comercial del Producto: (Marca) 2.- Clasificación: (Uso Oficial Exclusivo) 3.- ESTABLECIMIENTO SOLICITANTE 3.1-
