Información general sobre Eylea y sobre los motivos por los que se autoriza su uso en la UE
|
|
|
- Guillermo Quintero Prado
- hace 5 años
- Vistas:
Transcripción
1 EMA/481361/2018 EMEA/H/C/ Información general sobre Eylea y sobre los motivos por los que se autoriza su uso en la UE Qué es Eylea y para qué se utiliza? Eylea es un medicamento que se usa para tratar a adultos con: La forma «húmeda» de la degeneración macular asociada a la edad (DMAE), una enfermedad que afecta a la parte central de la retina (denominada mácula) en la parte posterior del ojo. La forma húmeda de la DMAE está provocada por una neovascularización coroidea (crecimiento anormal de vasos sanguíneos bajo la mácula), que puede estar asociada a pérdidas de líquido y sangre y provocar inflamación. Deterioro de la visión causado por edema (inflamación) macular secundario a la obstrucción de la vena principal que transporta la sangre desde la retina (conocido como oclusión venosa central de la retina, OVCR) o de pequeñas ramas venosas (conocida como oclusión de la rama venosa retiniana, ORVR). Deterioro de la visión debido a edema macular causado por la diabetes. Deterioro de la visión debido a neovascularización coroidea miópica (un tipo grave de miopía en la que el globo ocular sigue creciendo y es más grande de lo que debería). La mácula proporciona la visión central, necesaria para ver detalles en las tareas cotidianas, como conducir, leer y reconocer rostros. Estas enfermedades provocan una pérdida progresiva de la parte central de la visión. Eylea contiene el principio activo aflibercept. Cómo se usa Eylea? Eylea se presenta en jeringas precargadas o en viales que contienen una solución para inyección intravítrea (inyección en el humor vítreo, el líquido gelatinoso dentro del ojo). Eylea solo se podrá dispensar con receta médica y deberá ser administrado únicamente por un médico cualificado con experiencia en la administración de inyecciones intravítreas. 30 Churchill Place Canary Wharf London E14 5EU United Kingdom Telephone +44 (0) Facsimile +44 (0) Send a question via our website An agency of the European Union European Medicines Agency, Reproduction is authorised provided the source is acknowledged.
2 Eylea se administra mediante una inyección de 2 mg en el ojo afectado, que se repetirá según proceda a intervalos de un mes o más. La frecuencia con la que se administran las inyecciones depende de la enfermedad que se esté tratando y de la respuesta del paciente al tratamiento. El procedimiento debe llevarse a cabo en condiciones estériles. La jeringa precargada y el vial son para un solo uso. La jeringa precargada contiene una dosis superior a la recomendada, por lo que, a la hora de preparar la inyección, el médico debe eliminar el volumen sobrante y asegurarse de que inyecta la dosis adecuada. Después de la inyección, debe comprobarse la presión intraocular. Para mayor información sobre el uso de Eylea, consulte el prospecto o contacte con su médico o farmacéutico. Cómo actúa Eylea? El aflibercept es una proteína modificada genéticamente que se ha diseñado para unirse a una sustancia denominada factor de crecimiento endotelial vascular A (VEGF-A) y bloquear así sus efectos. También puede unirse a otras proteínas, como el factor de crecimiento placentario (PlGF). El VEGF-A y el PlGF intervienen en la estimulación del crecimiento anormal de los vasos sanguíneos en los pacientes con DMAE, ciertos tipos de edema macular y neovascularización coroidea miópica. Gracias al bloqueo de estos factores, el aflibercept reduce el crecimiento de los vasos sanguíneos y limita la filtración y la inflamación. Qué beneficios ha demostrado tener Eylea en los estudios realizados? DMAE húmeda Eylea se ha investigado en dos estudios principales realizados en un total de aproximadamente pacientes afectados por la forma húmeda de la DMAE. Los estudios compararon Eylea (administrado en una dosis de 0,5 mg cada cuatro semanas, 2 mg cada cuatro semanas o 2 mg cada ocho semanas, en todos los casos después de tres dosis mensuales iniciales) con ranibizumab, otro tratamiento para la DMAE que se administra en inyección intraocular cada cuatro semanas. El criterio principal de evaluación de la eficacia fue la proporción de pacientes que conservaron la visión (lo que se definió como la pérdida de menos de 15 letras en una prueba de visión normal) después del primer año de tratamiento. En ambos estudios, se examinó también el mantenimiento del efecto durante el segundo año de tratamiento, en el que se ajustó el número de inyecciones y el intervalo entre las inyecciones en función de la visión y las alteraciones en el ojo. Eylea ha demostrado ser tan eficaz como el ranibizumab para mantener la visión en pacientes con DMAE: examinando los resultados de los dos estudios a la vez, las proporciones de pacientes que conservaron la visión fueron de 96,1 % (517 de 538), 95,4 % (533 de 559) y 95,3 % (510 de 535) con 0,5 mg de Eylea cada cuatro semanas, 2 mg de Eylea cada cuatro semanas y 2 mg de Eylea cada ocho semanas, respectivamente, frente al 94,4 % (508 de 538) de los pacientes tratados con ranibizumab cada cuatro semanas. Durante el segundo año de tratamiento, se mantuvo generalmente la eficacia. La mayoría de los pacientes recibió inyecciones con un intervalo mayor entre las dosis, de 10 semanas, aunque un reducido número de pacientes necesitó ocasionalmente inyecciones más frecuentes (por ejemplo, mensuales). Los resultados posteriores de un estudio de apoyo indicaron la eficacia de los intervalos de tratamiento prolongados en pacientes con DMAE húmeda. Edema macular secundario a la oclusión de la vena retiniana EMA/481361/2018 Página 2/5
3 Eylea también se investigó en otros dos estudios principales practicados en 366 pacientes con edema macular secundario a OVCR. En estos estudios se compararon inyecciones mensuales de 2 mg de Eylea con una inyección simulada empleando una jeringa sin aguja. En otro estudio con 181 pacientes afectos de edema macular por ORVR se compararon inyecciones mensuales 2 mg de Eylea con el tratamiento por láser. En todos los estudios, el principal criterio para la evaluación de la eficacia fue la proporción de pacientes que respondieron y cuya visión había mejorado en al menos 15 letras en una prueba de visión realizada tras 24 semanas de tratamiento. En los estudios de pacientes con edema macular secundario a OVCR se examinaron también los efectos del tratamiento en función de las necesidades después de 24 semanas. Eylea también produjo una mejoría significativa de la visión en pacientes con edema macular secundario a OVCR y ORVR. En el caso de la OVCR, en torno al 60 % de los pacientes a los que se administró Eylea presentaron una mejoría de 15 letras o más en la prueba de visión de la semana 24, frente al 17 % de los que recibieron inyecciones simuladas. El beneficio se mantuvo en gran medida hasta 52 semanas con un tratamiento en función de las necesidades, aunque aparentemente se perdió parte del beneficio cuando el tratamiento y el seguimiento se prolongaron durante más tiempo. En cuanto a la ORVR, en torno al 53 % de los pacientes a los que se administró Eylea presentaron una mejoría de 15 letras o más en la prueba de visión de la semana 24, frente al 27 % de aquellos que fueron tratados con láser. Este efecto se mantuvo durante 52 semanas, a pesar de la administración menos frecuente de Eylea entre las semanas 24 y 52. Edema macular diabético Otros dos estudios principales en los que participaron 872 pacientes con edema macular diabético analizaron los efectos de Eylea en comparación con el tratamiento con láser. Eylea se administró una vez al mes o una vez cada dos meses después de las cinco primeras inyecciones mensuales. El principal criterio de valoración de la eficacia de ambos estudios fue la variación del número de letras que los pacientes podían leer durante una prueba de visión realizada tras un año de tratamiento. En los pacientes con edema macular diabético, el número medio de letras que podían leer en una prueba de visión antes del tratamiento era de 59 a 60; en los pacientes tratados con Eylea una vez al mes, la cifra mejoró en unas 12 letras y en los que recibieron Eylea cada dos meses, en aproximadamente 11 letras. En cambio, los pacientes que recibieron tratamiento con láser mostraron una mejoría de solo 1 letra aproximadamente después de un año. Neovascularización coroidea miópica En la neovascularización coroidea miópica, Eylea se investigó en un estudio principal realizado en 122 pacientes, en el que se comparó Eylea con una inyección simulada. El criterio principal de valoración de la eficacia fue la variación del número de letras que los pacientes podían leer durante una prueba de visión realizada tras 24 semanas de tratamiento. En el estudio de la neovascularización coroidea miópica, el número medio de letras que los pacientes podían leer en una prueba de visión antes del tratamiento era de unas 56; los pacientes tratados con Eylea podían leer por término medio 12 letras más después de 24 semanas de tratamiento, mientras que en el caso de los que recibieron inyecciones simuladas el número total de letras que podían leer disminuyó un promedio de 2. EMA/481361/2018 Página 3/5
4 Cuál es el riesgo asociado a Eylea? Los efectos adversos más frecuentes de Eylea (afectan al menos a 1 de cada 20 pacientes) son hemorragia conjuntival (sangrado de los pequeños vasos sanguíneos de la superficie del ojo en el lugar de inyección), disminución de la visión, dolor ocular, desprendimiento del vítreo (sustancia de consistencia gelatinosa del ojo), cataratas (opacificación del cristalino), moscas flotantes en el humor vítreo (pequeñas partículas o manchas en la visión) y aumento de la presión intraocular (aumento de la presión dentro del ojo). Los efectos adversos graves relacionados con la inyección (que han aparecido con menos de 1 de cada inyecciones) son ceguera, endoftalmitis (infección grave o inflamación dentro del ojo), cataratas, presión intraocular elevada, hemorragia vítrea (sangrado en el líquido gelatinoso del ojo que produce una pérdida temporal de la visión) y desprendimiento del vítreo o de la retina. Para consultar la lista completa de efectos adversos notificados con Eylea, consultar el prospecto. Eylea no debe usarse en pacientes que hayan padecido o puedan haber padecido infecciones oculares o perioculares (infecciones de los ojos o a su alrededor) ni en pacientes que presenten inflamación grave en el interior del ojo. La lista completa de restricciones se puede consultar en el prospecto. Por qué se ha autorizado Eylea en la UE? La Agencia Europea de Medicamentos señaló que para el tratamiento de la forma húmeda de DMAE, Eylea era tan eficaz como ranibizumab en el mantenimiento de la visión de los pacientes después del primer año de tratamiento. Además, la Agencia consideró que Eylea era beneficiosa para mejorar la visión de los pacientes con edema macular secundario a OVCR, ORVR o diabetes, así como de los pacientes con neovascularización coroidea miópica. La Agencia indicó además que no existían reservas importantes ni inesperadas en relación con la seguridad de Eylea. Por consiguiente, la Agencia decidió que los beneficios de Eylea son mayores que sus riesgos y recomendó autorizar su uso en la UE. Qué medidas se han adoptado para garantizar un uso seguro y eficaz de Eylea? La empresa que comercializa Eylea facilitará material formativo actualizado a los médicos (para minimizar los riesgos asociados a la inyección intraocular) y a los pacientes (para que puedan reconocer los efectos adversos graves y sepan cuándo han de solicitar atención urgente a su médico). Además, la empresa llevará a cabo un estudio para investigar el tratamiento con Eylea durante intervalos prolongados en el edema macular diabético, así como un estudio para investigar los efectos del tratamiento con Eylea cuando se administra en función de las necesidades en la DMAE húmeda. Las recomendaciones y precauciones que deben seguir los profesionales sanitarios y los pacientes para un uso seguro y eficaz de Eylea se han incluido también en la ficha técnica o resumen de las características del producto y el prospecto. Como para todos los medicamentos, los datos sobre el uso de Eylea se controlan de forma continua. Los efectos adversos notificados con Eylea son evaluados cuidadosamente, adoptándose las medidas que pudieran resultar necesarias para proteger a los pacientes. Otra información sobre Eylea Eylea recibió una autorización de comercialización válida en toda la UE el 22 de noviembre de EMA/481361/2018 Página 4/5
5 Puede encontrar información adicional sobre Eylea en la página web de la Agencia: ema.europa.eu/find medicine/human medicines/european public assessment reports. Fecha de la última actualización de este resumen: EMA/481361/2018 Página 5/5
deterioro de la visión causado por un edema macular provocado por la diabetes;
 EMA/677928/2015 EMA/H/C/002392 Resumen del EPAR para el público general aflibercept El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo el Comité de Medicamentos
EMA/677928/2015 EMA/H/C/002392 Resumen del EPAR para el público general aflibercept El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo el Comité de Medicamentos
Para más información sobre el tratamiento con Simponi, el paciente deberá leer el prospecto o consultar a su médico o farmacéutico.
 EMA/412395/2016 EMEA/H/C/000992 Resumen del EPAR para el público general golimumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo la Agencia ha evaluado
EMA/412395/2016 EMEA/H/C/000992 Resumen del EPAR para el público general golimumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo la Agencia ha evaluado
EYLEA (aflibercept) INFORMACIÓN IMPORTANTE PARA EL PACIENTE SOBRE LA INYECCIÓN INTRAOCULAR DE EYLEA
 INFORMACIÓN IMPORTANTE PARA EL PACIENTE SOBRE LA INYECCIÓN INTRAOCULAR DE EYLEA EYLEA (aflibercept) Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos
INFORMACIÓN IMPORTANTE PARA EL PACIENTE SOBRE LA INYECCIÓN INTRAOCULAR DE EYLEA EYLEA (aflibercept) Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos
Para más información sobre el tratamiento con Keytruda, el paciente deberá leer el prospecto o consultar a su médico o farmacéutico.
 EMA/524789/2017 EMEA/H/C/003820 Resumen del EPAR para el público general pembrolizumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) para. En él se explica cómo la Agencia
EMA/524789/2017 EMEA/H/C/003820 Resumen del EPAR para el público general pembrolizumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) para. En él se explica cómo la Agencia
En el mieloma múltiple, un cáncer de un tipo de glóbulos blancos denominados células de descarga, Revlimid se utiliza:
 EMA/113870/2017 EMEA/H/C/000717 Resumen del EPAR para el público lenalidomida El presente documento resume el Informe Público Europeo de Evaluación (EPAR) para. En él se explica cómo la Agencia ha evaluado
EMA/113870/2017 EMEA/H/C/000717 Resumen del EPAR para el público lenalidomida El presente documento resume el Informe Público Europeo de Evaluación (EPAR) para. En él se explica cómo la Agencia ha evaluado
Materiales educativos para los profesionales sanitarios y los pacientes que utilizan el medicamento antidiabético Suliqua
 19 de enero de 2017 EMA/747766/2016 Materiales educativos para los profesionales sanitarios y los pacientes que utilizan el medicamento antidiabético Suliqua Medidas para reducir el riesgo de confusión
19 de enero de 2017 EMA/747766/2016 Materiales educativos para los profesionales sanitarios y los pacientes que utilizan el medicamento antidiabético Suliqua Medidas para reducir el riesgo de confusión
Eylia debe ser administrado únicamente por un médico cualificado con experiencia en la administración de inyecciones intravítreas.
 1. NOMBRE DEL MEDICAMENTO Eylia 40 mg/ml solución inyectable en jeringa precargada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución inyectable contiene 40 mg de aflibercept. 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Eylia 40 mg/ml solución inyectable en jeringa precargada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución inyectable contiene 40 mg de aflibercept. 3. FORMA FARMACÉUTICA
Grants4Apps Bogotá 2017 Ficha Técnica Reto B
 Grants4Apps Bogotá 2017 Ficha Técnica Reto B Identificar una solución que movilice a los actores que están involucrados en el tratamiento del Edema macular diabético (EMD) 1. Relevancia de la problemática
Grants4Apps Bogotá 2017 Ficha Técnica Reto B Identificar una solución que movilice a los actores que están involucrados en el tratamiento del Edema macular diabético (EMD) 1. Relevancia de la problemática
Información general sobre Opdivo y sobre los motivos por los que se autoriza su uso en la UE
 EMA/489091/2018 EMEA/H/C/003985 Información general sobre Opdivo y sobre los motivos por los que se autoriza su uso en la UE Qué es Opdivo y para qué se utiliza? Opdivo es un medicamento contra el cáncer
EMA/489091/2018 EMEA/H/C/003985 Información general sobre Opdivo y sobre los motivos por los que se autoriza su uso en la UE Qué es Opdivo y para qué se utiliza? Opdivo es un medicamento contra el cáncer
Para obtener información práctica sobre el tratamiento con Opdivo, el paciente deberá leer el prospecto o consultar a su médico o farmacéutico.
 EMA/691693/2017 EMEA/H/C/003985 Resumen del EPAR para el público general nivolumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) para. En él se explica cómo la Agencia ha
EMA/691693/2017 EMEA/H/C/003985 Resumen del EPAR para el público general nivolumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) para. En él se explica cómo la Agencia ha
Recomendaciones del PRAC sobre señales: nuevo texto de información sobre el producto
 25 January 2018 EMA/PRAC/35608/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Recomendaciones del PRAC sobre señales: nuevo texto de información sobre el producto Adoptado por el PRAC en su reunión
25 January 2018 EMA/PRAC/35608/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Recomendaciones del PRAC sobre señales: nuevo texto de información sobre el producto Adoptado por el PRAC en su reunión
Recomendaciones del PRAC sobre señales: nuevo texto de la información sobre el producto:
 17 December 2015 EMA/PRAC/835774/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Recomendaciones del PRAC sobre señales: nuevo texto de la información sobre el producto: Adoptado por el PRAC, 30
17 December 2015 EMA/PRAC/835774/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Recomendaciones del PRAC sobre señales: nuevo texto de la información sobre el producto: Adoptado por el PRAC, 30
Prospecto: Información para el paciente. Eylea 40 mg/ml solución inyectable en vial Aflibercept
 Prospecto: Información para el paciente Eylea 40 mg/ml solución inyectable en vial Aflibercept Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre
Prospecto: Información para el paciente Eylea 40 mg/ml solución inyectable en vial Aflibercept Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre
Recomendaciones del PRAC sobre señales: nuevo texto de la información sobre el producto
 25 February 2016 EMA/PRAC/137780/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Recomendaciones del PRAC sobre señales: nuevo texto de la información sobre el producto Adoptado por el PRAC el
25 February 2016 EMA/PRAC/137780/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Recomendaciones del PRAC sobre señales: nuevo texto de la información sobre el producto Adoptado por el PRAC el
Prospecto: Información para el paciente. Eylea 40 mg/ml solución inyectable en vial Aflibercept
 Prospecto: Información para el paciente Eylea 40 mg/ml solución inyectable en vial Aflibercept Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre
Prospecto: Información para el paciente Eylea 40 mg/ml solución inyectable en vial Aflibercept Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre
Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto
 23 April 2015 EMA/PRAC/273926/2015 Pharmacovigilance Risk Assessment Committee Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto Adoptado por el PRAC
23 April 2015 EMA/PRAC/273926/2015 Pharmacovigilance Risk Assessment Committee Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto Adoptado por el PRAC
Información para el paciente Lucentis (Ranibizumab)
 Información para el paciente Lucentis (Ranibizumab) Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) julio 2015 APARTADO 1 - INFORMACIÓN
Información para el paciente Lucentis (Ranibizumab) Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) julio 2015 APARTADO 1 - INFORMACIÓN
PROGRAMA DE ESTÍMULOS A LA INNOVACIÓN
 TÍTULO DEL PROYECTO: TRIAMCINOLONA ACETÓNIDO CONTENIDO EN UNA FORMULACIÓN INNOVADORA QUE PERMITE LLEGAR AL SEGMENTO POSTERIOR DEL OJO. EMPRESA BENEFICIADA: PHARMACOS EXAKTA, S.A. DE C.V. MODALIDAD: INNOVAPYME
TÍTULO DEL PROYECTO: TRIAMCINOLONA ACETÓNIDO CONTENIDO EN UNA FORMULACIÓN INNOVADORA QUE PERMITE LLEGAR AL SEGMENTO POSTERIOR DEL OJO. EMPRESA BENEFICIADA: PHARMACOS EXAKTA, S.A. DE C.V. MODALIDAD: INNOVAPYME
Tratamiento con JETREA Ocriplasmina
 Tratamiento con JETREA Ocriplasmina [Información para el paciente] ( ) Este medicamento está sujeto a seguimiento adicional, es importante comunicar los efectos adversos que pudiera usted tener. Puede
Tratamiento con JETREA Ocriplasmina [Información para el paciente] ( ) Este medicamento está sujeto a seguimiento adicional, es importante comunicar los efectos adversos que pudiera usted tener. Puede
Recomendaciones del PRAC sobre señales: nuevo texto de información sobre el producto
 15 September 2016 EMA/PRAC/603550/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Recomendaciones del PRAC sobre señales: nuevo texto de información sobre el producto Adoptado por el PRAC el 30
15 September 2016 EMA/PRAC/603550/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Recomendaciones del PRAC sobre señales: nuevo texto de información sobre el producto Adoptado por el PRAC el 30
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Eylea 40 mg/ml solución inyectable en jeringa precargada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Eylea 40 mg/ml solución inyectable en jeringa precargada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Eylea 40 mg/ml solución inyectable en jeringa precargada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Eylea 40 mg/ml solución inyectable en jeringa precargada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml
Eylea debe ser administrado únicamente por un médico cualificado con experiencia en la administración de inyecciones intravítreas.
 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones
RETINOPATÍA DIABÉTICA
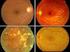 Qué es la retinopatía diabética? Las personas con diabetes pueden tener una enfermedad ocular llamada retinopatía diabética. Esta enfermedad ocurre porque los niveles altos de azúcar en la sangre causan
Qué es la retinopatía diabética? Las personas con diabetes pueden tener una enfermedad ocular llamada retinopatía diabética. Esta enfermedad ocurre porque los niveles altos de azúcar en la sangre causan
Eylea debe ser administrado únicamente por un médico cualificado con experiencia en la administración de inyecciones intravítreas.
 1. NOMBRE DEL MEDICAMENTO Eylea 40 mg/ml solución inyectable en vial. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución inyectable contiene 40 mg de aflibercept*. Cada vial contiene 100 microlitros,
1. NOMBRE DEL MEDICAMENTO Eylea 40 mg/ml solución inyectable en vial. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución inyectable contiene 40 mg de aflibercept*. Cada vial contiene 100 microlitros,
Eylea debe ser administrado únicamente por un médico cualificado con experiencia en la administración de inyecciones intravítreas.
 1. NOMBRE DEL MEDICAMENTO Eylea 40 mg/ml solución inyectable en vial. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución inyectable contiene 40 mg de aflibercept*. Cada vial contiene 100 microlitros,
1. NOMBRE DEL MEDICAMENTO Eylea 40 mg/ml solución inyectable en vial. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución inyectable contiene 40 mg de aflibercept*. Cada vial contiene 100 microlitros,
Eylea debe ser administrado únicamente por un médico cualificado con experiencia en la administración de inyecciones intravítreas.
 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones
Información general sobre Metacam y sobre los motivos por los que se autoriza su uso en la UE
 EMA/CVMP/259397/2006 EMEA/V/C/000033 Información general sobre Metacam y sobre los motivos por los que se autoriza su uso en la UE Qué es Metacam y para qué se utiliza? Metacam es un medicamento antiinflamatorio
EMA/CVMP/259397/2006 EMEA/V/C/000033 Información general sobre Metacam y sobre los motivos por los que se autoriza su uso en la UE Qué es Metacam y para qué se utiliza? Metacam es un medicamento antiinflamatorio
DG de Farmacia y Productos Sanitarios PAISE
 Plan de Gestión riesgos para la administración de fármacos antiangiogénicos en la degeneración macular asociada a la edad, edema macular diabético, edema macular secundario a la oclusión de la vena retiniana,
Plan de Gestión riesgos para la administración de fármacos antiangiogénicos en la degeneración macular asociada a la edad, edema macular diabético, edema macular secundario a la oclusión de la vena retiniana,
vacuna antineumocócica polisacárida conjugada (13-valente, adsorbida)
 EMA/90006/2015 EMEA/H/C/001104 Resumen del EPAR para el público general vacuna antineumocócica polisacárida conjugada (13-valente, adsorbida) El presente documento resume el Informe Público Europeo de
EMA/90006/2015 EMEA/H/C/001104 Resumen del EPAR para el público general vacuna antineumocócica polisacárida conjugada (13-valente, adsorbida) El presente documento resume el Informe Público Europeo de
CONSENTIMIENTO PARA LA REALIZACIÓN DE CIRUGÍA VITREA
 DE CIRUGÍA VITREA Por medio del presente, expreso mi consentimiento para la realización de la cirugía en ojo..., dándome por notificado/a de las posibles complicaciones, alcances, limitaciones y riesgos
DE CIRUGÍA VITREA Por medio del presente, expreso mi consentimiento para la realización de la cirugía en ojo..., dándome por notificado/a de las posibles complicaciones, alcances, limitaciones y riesgos
Metacam. meloxicam. Qué es Metacam y para qué se utiliza? Resumen del EPAR para el público general
 EMA/CVMP/259397/2006 EMEA/V/C/000033 Resumen del EPAR para el público general meloxicam El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo la Agencia
EMA/CVMP/259397/2006 EMEA/V/C/000033 Resumen del EPAR para el público general meloxicam El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo la Agencia
Avastin se utiliza para el tratamiento de adultos con los siguientes tipos de cáncer en combinación con otros medicamentos contra el cáncer:
 EMA/175824/2015 EMEA/H/C/000582 Resumen del EPAR para el público general bevacizumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo el Comité de
EMA/175824/2015 EMEA/H/C/000582 Resumen del EPAR para el público general bevacizumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo el Comité de
Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto
 22 de enero de 2015 EMA/PRAC/63326/2015 Comité para la Determinación del Riesgo en farmacovigilancia Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto
22 de enero de 2015 EMA/PRAC/63326/2015 Comité para la Determinación del Riesgo en farmacovigilancia Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto
La EMA confirma las recomendaciones para minimizar el riesgo de LMP, una infección cerebral, con Tysabri
 25/04/2016 EMA/266665/2016 La EMA confirma las recomendaciones para minimizar el riesgo de LMP, una infección Se deberá considerar la realización de resonancias magnéticas más frecuentes en los pacientes
25/04/2016 EMA/266665/2016 La EMA confirma las recomendaciones para minimizar el riesgo de LMP, una infección Se deberá considerar la realización de resonancias magnéticas más frecuentes en los pacientes
*Ranibizumab es un fragmento de anticuerpo monoclonal humanizado producido en células de Escherichia coli mediante tecnología de ADN recombinante.
 NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable Lucentis 10 mg/ml solución inyectable en jeringa precargada COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab*. *Ranibizumab
NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable Lucentis 10 mg/ml solución inyectable en jeringa precargada COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab*. *Ranibizumab
Guía de usuario para los informes de web
 Protección de la salud de los pacientes Esta guía de usuario para los informes de web facilita información sobre tipos de datos, presentacion, interpretación y funcionalidades del informe de web. 1. Tipos
Protección de la salud de los pacientes Esta guía de usuario para los informes de web facilita información sobre tipos de datos, presentacion, interpretación y funcionalidades del informe de web. 1. Tipos
Prospecto: información para el paciente. Lucentis 10 mg/ml solución inyectable Ranibizumab
 Prospecto: información para el paciente Lucentis 10 mg/ml solución inyectable Ranibizumab Lea todo el prospecto detenidamente antes de que le administren este medicamento, porque contiene información importante
Prospecto: información para el paciente Lucentis 10 mg/ml solución inyectable Ranibizumab Lea todo el prospecto detenidamente antes de que le administren este medicamento, porque contiene información importante
Prospecto: información para el paciente. Lucentis 10 mg/ml solución inyectable ranibizumab
 Prospecto: información para el paciente Lucentis 10 mg/ml solución inyectable ranibizumab Lea todo el prospecto detenidamente antes de que le administren este medicamento, porque contiene información importante
Prospecto: información para el paciente Lucentis 10 mg/ml solución inyectable ranibizumab Lea todo el prospecto detenidamente antes de que le administren este medicamento, porque contiene información importante
Plan de Gestión riesgos para la administración de fármacos antiangiogénicos en la degeneración macular asociada a la edad.
 Plan de Gestión riesgos para la administración de fármacos antiangiogénicos en la degeneración macular asociada a la edad. (Adaptado de la plantilla Doc.Ref. EMEA/192632/2006) 1 Objeto Definir el plan
Plan de Gestión riesgos para la administración de fármacos antiangiogénicos en la degeneración macular asociada a la edad. (Adaptado de la plantilla Doc.Ref. EMEA/192632/2006) 1 Objeto Definir el plan
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
Prospecto: información para el paciente. Lucentis 10 mg/ml solución inyectable en jeringa precargada Ranibizumab
 Prospecto: información para el paciente Lucentis 10 mg/ml solución inyectable en jeringa precargada Ranibizumab Lea todo el prospecto detenidamente antes de que le administren este medicamento, porque
Prospecto: información para el paciente Lucentis 10 mg/ml solución inyectable en jeringa precargada Ranibizumab Lea todo el prospecto detenidamente antes de que le administren este medicamento, porque
(Leyes y Decreto Reglamentario 1089 / 2012)
 CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN DE UN DISPOSITIVO INTRAVÍTREO DE LIBERACIÓN DE CORTICOIDE EN EL EDEMA MACULAR DIABÉTICO. ( OZURDEX - DEXAMETASONA-) (Leyes 26.529-26742 y Decreto Reglamentario
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN DE UN DISPOSITIVO INTRAVÍTREO DE LIBERACIÓN DE CORTICOIDE EN EL EDEMA MACULAR DIABÉTICO. ( OZURDEX - DEXAMETASONA-) (Leyes 26.529-26742 y Decreto Reglamentario
Guía para la interpretación de informes espontáneos de presuntas reacciones adversas a medicamentos
 30 de enero de 2017 Inspecciones, Farmacovigilancia de Medicamentos de Uso Humano y Comités EMA/749446/2016 Revisión 1* Guía para la interpretación de informes espontáneos de presuntas reacciones adversas
30 de enero de 2017 Inspecciones, Farmacovigilancia de Medicamentos de Uso Humano y Comités EMA/749446/2016 Revisión 1* Guía para la interpretación de informes espontáneos de presuntas reacciones adversas
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE RANIBIZUMAB (LUCENTIS) EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN VENOSA DE LA RETINA
 CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE RANIBIZUMAB (LUCENTIS) EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN VENOSA DE LA RETINA (Leyes 26.529-26742 y Decreto Reglamentario 1089 / 2012)
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE RANIBIZUMAB (LUCENTIS) EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN VENOSA DE LA RETINA (Leyes 26.529-26742 y Decreto Reglamentario 1089 / 2012)
Un ml contiene 10 mg de ranibizumab*. Cada vial contiene 2,3 mg de ranibizumab en 0,23 ml de solución.
 1. NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab*. Cada vial contiene 2,3 mg de ranibizumab en 0,23 ml de solución.
1. NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab*. Cada vial contiene 2,3 mg de ranibizumab en 0,23 ml de solución.
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE RANIBIZUMAB (LUCENTIS) EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN VENOSA DE LA RETINA
 CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE RANIBIZUMAB (LUCENTIS) EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN VENOSA DE LA RETINA (Leyes 26.529-26742 y Decreto Reglamentario 1089 / 2012)
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE RANIBIZUMAB (LUCENTIS) EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN VENOSA DE LA RETINA (Leyes 26.529-26742 y Decreto Reglamentario 1089 / 2012)
PROTOCOLO CONSENSO DE TRATAMIENTO DEL EDEMA MACULAR SECUNDARIO A OCLUSIÓN DE LA VENA DE LA RETINA. COMUNIDAD VALENCIANA Noviembre 2012
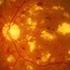 PROTOCOLO CONSENSO DE TRATAMIENTO DEL EDEMA MACULAR SECUNDARIO A OCLUSIÓN DE LA VENA DE LA RETINA COMUNIDAD VALENCIANA Noviembre 2012 PROTOCOLO CONSENSO DE TRATAMIENTO DEL EDEMA MACULAR SECUNDARIO A OCLUSIÓN
PROTOCOLO CONSENSO DE TRATAMIENTO DEL EDEMA MACULAR SECUNDARIO A OCLUSIÓN DE LA VENA DE LA RETINA COMUNIDAD VALENCIANA Noviembre 2012 PROTOCOLO CONSENSO DE TRATAMIENTO DEL EDEMA MACULAR SECUNDARIO A OCLUSIÓN
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE RANIBIZUMAB (LUCENTIS) EN EL EDEMA MACULAR DIABÉTICO.
 CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE RANIBIZUMAB (LUCENTIS) EN EL EDEMA MACULAR DIABÉTICO. (Leyes 26.529-26742 y Decreto Reglamentario 1089 / 2012) Nota: El diseño y contenido de este
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE RANIBIZUMAB (LUCENTIS) EN EL EDEMA MACULAR DIABÉTICO. (Leyes 26.529-26742 y Decreto Reglamentario 1089 / 2012) Nota: El diseño y contenido de este
Hablemos sobre Maculopatía. Dr. Rodrigo Santos.
 Hablemos sobre Maculopatía. Dr. Rodrigo Santos. Uno de los temas mas problemáticos con que debemos lidiar los médicos es el exceso de información a la que tienen acceso los pacientes en la actualidad.
Hablemos sobre Maculopatía. Dr. Rodrigo Santos. Uno de los temas mas problemáticos con que debemos lidiar los médicos es el exceso de información a la que tienen acceso los pacientes en la actualidad.
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab*.
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab*.
Dra. Jaysi Pastrana Arias Oftalmología Especialista en Retina y Vítreo
 Dra. Jaysi Pastrana Arias Oftalmología Especialista en Retina y Vítreo Medicina Oftalmología Retina y Vítreo Universidad de Cartagena Universidad de Panamá Caja del Seguro Social Universidad Autónoma de
Dra. Jaysi Pastrana Arias Oftalmología Especialista en Retina y Vítreo Medicina Oftalmología Retina y Vítreo Universidad de Cartagena Universidad de Panamá Caja del Seguro Social Universidad Autónoma de
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE AFLIBERCEPT (EYLIA) EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN VENOSA DE LA RETINA
 CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE AFLIBERCEPT (EYLIA) EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN VENOSA DE LA RETINA (Leyes 26.529 y 26742 y Decreto Reglamentario 1089/2012)
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE AFLIBERCEPT (EYLIA) EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN VENOSA DE LA RETINA (Leyes 26.529 y 26742 y Decreto Reglamentario 1089/2012)
URGENCIAS EN OFTALMOLOGÍA
 URGENCIAS EN OFTALMOLOGÍA OJO ROJO NO DOLOROSO 99% de casos: HEMORRAGIA SUBCONJUNTIVAL. NIVEL 1 Actitud: Control de TA por su médico de cabecera; si se repite varias veces en poco tiempo, búsqueda sistémica
URGENCIAS EN OFTALMOLOGÍA OJO ROJO NO DOLOROSO 99% de casos: HEMORRAGIA SUBCONJUNTIVAL. NIVEL 1 Actitud: Control de TA por su médico de cabecera; si se repite varias veces en poco tiempo, búsqueda sistémica
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab*.
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab*.
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE AFLIBERCEPT (EYLIA) EN EL EDEMA MACULAR DIABÉTICO.
 CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE AFLIBERCEPT (EYLIA) EN EL EDEMA MACULAR DIABÉTICO. (Leyes 26.529-26742 y Decreto Reglamentario 1089 / 2012) Nota: El diseño y contenido de este
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE AFLIBERCEPT (EYLIA) EN EL EDEMA MACULAR DIABÉTICO. (Leyes 26.529-26742 y Decreto Reglamentario 1089 / 2012) Nota: El diseño y contenido de este
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
CONSENTIMIENTO INFORMADO PARA LA CAPSULOTOMÍA POSTERIOR CON YAG LÁSER. (Leyes y y Decreto Reglamentario 1089/2012)
 CONSENTIMIENTO INFORMADO PARA LA CAPSULOTOMÍA POSTERIOR CON YAG LÁSER (Leyes 26.529 y 26742 y Decreto Reglamentario 1089/2012) Nota: El diseño y contenido de este consentimiento, evaluado y aprobado por
CONSENTIMIENTO INFORMADO PARA LA CAPSULOTOMÍA POSTERIOR CON YAG LÁSER (Leyes 26.529 y 26742 y Decreto Reglamentario 1089/2012) Nota: El diseño y contenido de este consentimiento, evaluado y aprobado por
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE AFLIBERCEPT (EYLIA) EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN VENOSA DE LA RETINA
 CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE AFLIBERCEPT (EYLIA) EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN VENOSA DE LA RETINA (Leyes 26.529-26742 y Decreto Reglamentario 1089 / 2012)
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE AFLIBERCEPT (EYLIA) EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN VENOSA DE LA RETINA (Leyes 26.529-26742 y Decreto Reglamentario 1089 / 2012)
Lucentis debe ser administrado por un oftalmólogo que tenga experiencia en la administración de inyecciones intravítreas.
 1. NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable en jeringa precargada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab*. Una jeringa precargada contiene 0,165
1. NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable en jeringa precargada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab*. Una jeringa precargada contiene 0,165
LA RETINOPATÍA DIABÉTICA
 EL OJO DIABÉTICO LA RETINOPATÍA DIABÉTICA La diabetes en una enfermedad que afecta al 13% de la población española, una alta prevalencia que va en aumento y que la convierte en la enfermedad metabólica
EL OJO DIABÉTICO LA RETINOPATÍA DIABÉTICA La diabetes en una enfermedad que afecta al 13% de la población española, una alta prevalencia que va en aumento y que la convierte en la enfermedad metabólica
(Leyes y Decreto Reglamentario 1089 / 2012)
 CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN DE UN DISPOSITIVO INTRAVÍTREO DE LIBERACIÓN DE CORTICOIDE EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN DE RAMA VENOSA DE LA RETINA. ( OZURDEX - DEXAMETASONA-)
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN DE UN DISPOSITIVO INTRAVÍTREO DE LIBERACIÓN DE CORTICOIDE EN EL EDEMA MACULAR SECUNDARIO A UNA OCLUSIÓN DE RAMA VENOSA DE LA RETINA. ( OZURDEX - DEXAMETASONA-)
1. DOCUMENTO DE INFORMACIÓN PARA (*) TRATAMIENTO LÁSER ARGÓN DE LESIONES RETINIANAS
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
Quirófano de Oftalmología Inyección intravítrea
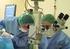 Preparación de la técnica de inyección intravítrea de sustancia medicamentosa. OBJETIVO DEL PROCEDIMIENTO Recepción correcta del paciente, así como disponer del material e instrumental suficiente para
Preparación de la técnica de inyección intravítrea de sustancia medicamentosa. OBJETIVO DEL PROCEDIMIENTO Recepción correcta del paciente, así como disponer del material e instrumental suficiente para
Preguntas más frecuentes
 4 de noviembre de 2011 EMA/527628/2011 Dirección Este documento contiene respuestas a las preguntas más frecuentes recibidas por la Agencia Europea de Medicamentos. Si no encuentra aquí la respuesta a
4 de noviembre de 2011 EMA/527628/2011 Dirección Este documento contiene respuestas a las preguntas más frecuentes recibidas por la Agencia Europea de Medicamentos. Si no encuentra aquí la respuesta a
Precio adquisición: Precio final= /40mg Grupo Terapéutico: S01LA05: Agentes oftalmoógicos. Agentes antineovascularización
 Aflibercept - EN DEGENERACIÓN MACULAR ASOCIADA A LA EDAD - EDEMA MACULAR SECUNDARIO A OCLUSIÓN DE VENA CENTRAL RETINIANA INFORME CFT- HOSPITAL REINA SOFÍA CÓRDOBA 1.- Identificación del fármaco: Nombre
Aflibercept - EN DEGENERACIÓN MACULAR ASOCIADA A LA EDAD - EDEMA MACULAR SECUNDARIO A OCLUSIÓN DE VENA CENTRAL RETINIANA INFORME CFT- HOSPITAL REINA SOFÍA CÓRDOBA 1.- Identificación del fármaco: Nombre
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
Información de seguridad para el Profesional Sanitario sobre la inyección intravítrea
 Lucentis (ranibizumab) Información de seguridad para el Profesional Sanitario sobre la inyección intravítrea Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y
Lucentis (ranibizumab) Información de seguridad para el Profesional Sanitario sobre la inyección intravítrea Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y
INFORMACIÓN DE SEGURIDAD PARA EL PROFESIONAL SANITARIO
 INFORMACIÓN DE SEGURIDAD PARA EL PROFESIONAL SANITARIO RECOMENDACIONES PARA EL TRATAMIENTO MEDIANTE INYECCIÓN INTRAVÍTREA (aflibercept) Material informativo autorizado por la Agencia Española de Medicamentos
INFORMACIÓN DE SEGURIDAD PARA EL PROFESIONAL SANITARIO RECOMENDACIONES PARA EL TRATAMIENTO MEDIANTE INYECCIÓN INTRAVÍTREA (aflibercept) Material informativo autorizado por la Agencia Española de Medicamentos
CUESTIONARIO PARA NIÑOS Y ADOLESCENTES
 Punto de vista acerca del consumo de medicamentos Por qué preguntamos? El Comité Pediátrico (PDCO) trabaja con la Agencia Europea de Medicamentos, y es su trabajo asegurarse de que los medicamentos para
Punto de vista acerca del consumo de medicamentos Por qué preguntamos? El Comité Pediátrico (PDCO) trabaja con la Agencia Europea de Medicamentos, y es su trabajo asegurarse de que los medicamentos para
INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA LUCENTIS (RANIBIZUMAB) (1/10/2007)
 Centro de Información de Medicamentos Servicio de Farmacia INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA LUCENTIS (RANIBIZUMAB) (1/10/2007) Datos del solicitante El Dr.Juan Lopez Moya, Jefe de Servicio
Centro de Información de Medicamentos Servicio de Farmacia INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA LUCENTIS (RANIBIZUMAB) (1/10/2007) Datos del solicitante El Dr.Juan Lopez Moya, Jefe de Servicio
RETINA QUÉ ES LA RETINA? DEGENERACIÓN MACULAR ASOCIADA A LA EDAD (DMAE)
 QUÉ ES LA? La retina es la capa más interna del ojo. Está formada por un conjunto de neuronas cuya misión es transformar la información que recibe el ojo en forma de luz en impulsos nerviosos que viajarán
QUÉ ES LA? La retina es la capa más interna del ojo. Está formada por un conjunto de neuronas cuya misión es transformar la información que recibe el ojo en forma de luz en impulsos nerviosos que viajarán
Preguntas más frecuentes
 13 de febrero de 2017 EMA/527628/2011 Rev. 1 Dirección Este documento contiene respuestas a las preguntas más frecuentes recibidas por la Agencia Europea de Medicamentos (EMA). Si no encuentra aquí la
13 de febrero de 2017 EMA/527628/2011 Rev. 1 Dirección Este documento contiene respuestas a las preguntas más frecuentes recibidas por la Agencia Europea de Medicamentos (EMA). Si no encuentra aquí la
La Agencia Europea de Medicamentos recomienda cambios en el uso de la metoclopramida
 20 de diciembre de 2013 EMA/13239/2014 Corr. 1 La Agencia Europea de Medicamentos recomienda cambios en el uso de la El principal objetivo de los cambios es reducir el riesgo de efectos neurológicos secundarios
20 de diciembre de 2013 EMA/13239/2014 Corr. 1 La Agencia Europea de Medicamentos recomienda cambios en el uso de la El principal objetivo de los cambios es reducir el riesgo de efectos neurológicos secundarios
INFORMACIÓN PARA EL PROFESIONAL DEL SECTOR SANITARIO
 --------------------------------------------------------------------------------------------------------------------------- [A proporcionar en la caja] Esta información está destinada únicamente a médicos
--------------------------------------------------------------------------------------------------------------------------- [A proporcionar en la caja] Esta información está destinada únicamente a médicos
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAVÍTREA DE BEVACIZUMAB ( AVASTÍN ) EN EL EDEMA MACULAR DIABÉTICO.
 CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAVÍTREA DE BEVACIZUMAB ( AVASTÍN ) EN EL EDEMA MACULAR DIABÉTICO. (Leyes 26.529-26742 y Decreto Reglamentario 1089 / 2012) Nota: El diseño y contenido de
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAVÍTREA DE BEVACIZUMAB ( AVASTÍN ) EN EL EDEMA MACULAR DIABÉTICO. (Leyes 26.529-26742 y Decreto Reglamentario 1089 / 2012) Nota: El diseño y contenido de
Un ml contiene 10 mg de ranibizumab*. Cada vial contiene 2,3 mg de ranibizumab en 0,23 ml de solución.
 1. NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab*. Cada vial contiene 2,3 mg de ranibizumab en 0,23 ml de solución.
1. NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab*. Cada vial contiene 2,3 mg de ranibizumab en 0,23 ml de solución.
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab*.
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Lucentis 10 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 10 mg de ranibizumab*.
CONSENTIMIENTO INFORMADO PARA ELTRATAMIENTO DE LA VASCULOPATÍA COROIDEA POLIPOIDEA CON TERAPIA FOTODINÁMICA
 CONSENTIMIENTO INFORMADO PARA ELTRATAMIENTO DE LA VASCULOPATÍA COROIDEA POLIPOIDEA CON TERAPIA FOTODINÁMICA (Leyes 26.529-26742 y Decreto Reglamentario 1089 / 2012) Nota: El diseño y contenido de este
CONSENTIMIENTO INFORMADO PARA ELTRATAMIENTO DE LA VASCULOPATÍA COROIDEA POLIPOIDEA CON TERAPIA FOTODINÁMICA (Leyes 26.529-26742 y Decreto Reglamentario 1089 / 2012) Nota: El diseño y contenido de este
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE RANIBIZUMAB (LUCENTIS) EN LA DEGENERACIÓN MACULAR RELACIONADA CON LA EDAD EXUDATIVA ó HÚMEDA
 CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE RANIBIZUMAB (LUCENTIS) EN LA DEGENERACIÓN MACULAR RELACIONADA CON LA EDAD EXUDATIVA ó HÚMEDA (Leyes 26.529 y 26742 y Decreto Reglamentario 1089/2012)
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE RANIBIZUMAB (LUCENTIS) EN LA DEGENERACIÓN MACULAR RELACIONADA CON LA EDAD EXUDATIVA ó HÚMEDA (Leyes 26.529 y 26742 y Decreto Reglamentario 1089/2012)
Información sobre La Degeneración Macular Asociada a la Edad (DMAE)
 Información sobre La Degeneración Macular Asociada a la Edad (DMAE) Consulte a su oftalmólogo Por gentileza de: QUÉ ES LA DMAE? La DMAE es una patología que genera la pérdida progresiva de la visión y
Información sobre La Degeneración Macular Asociada a la Edad (DMAE) Consulte a su oftalmólogo Por gentileza de: QUÉ ES LA DMAE? La DMAE es una patología que genera la pérdida progresiva de la visión y
(Leyes y / Decreto Reglamentario 1089/2012)
 CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE BEVACIZUMAB UNIDOSIS ( LUMIERE ) EN LA DEGENERACIÓN MACULAR RELACIONADA CON LA EDAD EXUDATIVA ( Húmeda o Neovascular ) (Leyes 26.529 y 26742 /
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE BEVACIZUMAB UNIDOSIS ( LUMIERE ) EN LA DEGENERACIÓN MACULAR RELACIONADA CON LA EDAD EXUDATIVA ( Húmeda o Neovascular ) (Leyes 26.529 y 26742 /
La Drospirenona como principio activo en Anticonceptivos orales y riesgo de Eventos Tromboembólicos.
 Pág. 1 de 5 La Drospirenona como principio activo en Anticonceptivos orales y riesgo de Eventos Tromboembólicos. El objetivo es difundir información sobre la seguridad y eficacia de los medicamentos basados
Pág. 1 de 5 La Drospirenona como principio activo en Anticonceptivos orales y riesgo de Eventos Tromboembólicos. El objetivo es difundir información sobre la seguridad y eficacia de los medicamentos basados
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE AFLIBERCEPT (EYLIA) EN LA DEGENERACIÓN MACULAR RELACIONADA CON LA EDAD EXUDATIVA ó HÚMEDA
 CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE AFLIBERCEPT (EYLIA) EN LA DEGENERACIÓN MACULAR RELACIONADA CON LA EDAD EXUDATIVA ó HÚMEDA (Leyes 26.529 y 26742 y Decreto Reglamentario 1089/2012)
CONSENTIMIENTO INFORMADO PARA LA INYECCIÓN INTRAOCULAR DE AFLIBERCEPT (EYLIA) EN LA DEGENERACIÓN MACULAR RELACIONADA CON LA EDAD EXUDATIVA ó HÚMEDA (Leyes 26.529 y 26742 y Decreto Reglamentario 1089/2012)
LUCENTIS RANIBIZUMAB Solución Inyectable Venta bajo receta
 Novartis LUCENTIS RANIBIZUMAB Solución Inyectable Venta bajo receta FÓRMULA Cada Vial de 0,23 ml contiene: Ranibizumab.......2,3 mg Excipientes: α,α-trehalosa dihidrato 23 mg; clorhidrato de L-histidina
Novartis LUCENTIS RANIBIZUMAB Solución Inyectable Venta bajo receta FÓRMULA Cada Vial de 0,23 ml contiene: Ranibizumab.......2,3 mg Excipientes: α,α-trehalosa dihidrato 23 mg; clorhidrato de L-histidina
Procedimiento operativo estandarizado (POE) de ADMINISTRACION DE MEDICACION INTRAVITREA. POE-OFT-11 V2 Fecha entrada en vigor: JUNIO 2018
 Procedimiento operativo estandarizado (POE) de ADMINISTRACION DE MEDICACION INTRAVITREA POE-OFT-11 V2 Fecha entrada en vigor: JUNIO 2018 FECHA REALIZADO: Noviembre 2016 REVISADO: Mayo 2018 APROBADO: Junio
Procedimiento operativo estandarizado (POE) de ADMINISTRACION DE MEDICACION INTRAVITREA POE-OFT-11 V2 Fecha entrada en vigor: JUNIO 2018 FECHA REALIZADO: Noviembre 2016 REVISADO: Mayo 2018 APROBADO: Junio
En la audiencia pública, se tendrá debidamente en cuenta el efecto terapéutico del medicamento.
 13 de abril de 2016 EMA/389918/2016 Normas reguladoras del procedimiento para la organización y realización de audiencias públicas en el Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC)
13 de abril de 2016 EMA/389918/2016 Normas reguladoras del procedimiento para la organización y realización de audiencias públicas en el Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC)
Enfermedad diabética del ojo. Una guía para el educador
 Enfermedad diabética del ojo Una guía para el educador Desarrollado por el Programa Nacional de Educación sobre la Salud del Ojo (NEHEP, por sus siglas en inglés), Enfermedad diabética del ojo: Una guía
Enfermedad diabética del ojo Una guía para el educador Desarrollado por el Programa Nacional de Educación sobre la Salud del Ojo (NEHEP, por sus siglas en inglés), Enfermedad diabética del ojo: Una guía
Prospecto: información para el usuario. ACETILCOLINA 10mg/ml CUSÍ polvo y disolvente para solución para instilación por vía intraocular
 Prospecto: información para el usuario ACETILCOLINA 10mg/ml CUSÍ polvo y disolvente para solución para instilación por vía intraocular Lea todo el prospecto detenidamente antes de empezar a usar este medicamento,
Prospecto: información para el usuario ACETILCOLINA 10mg/ml CUSÍ polvo y disolvente para solución para instilación por vía intraocular Lea todo el prospecto detenidamente antes de empezar a usar este medicamento,
X-Plain Exploración fotográfica para retinopatía diabética Sumario
 X-Plain Exploración fotográfica para retinopatía diabética Sumario Introducción Los pacientes con diabetes tienen más posibilidad de desarrollar problemas oculares que pueden conducir a la ceguera. La
X-Plain Exploración fotográfica para retinopatía diabética Sumario Introducción Los pacientes con diabetes tienen más posibilidad de desarrollar problemas oculares que pueden conducir a la ceguera. La
1. DOCUMENTO DE INFORMACIÓN PARA (*) INYECCIÓN INTRAVÍTREA DE ANTIANGIOGÉNICOS
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
Tratamientos para la Degeneración Macular
 Tratamientos para la Degeneración Macular La mayoría de los tratamientos más comunes que se describen aquí impactan la degeneración macular húmeda relacionada a la edad (DMRE). Es importante señalar que
Tratamientos para la Degeneración Macular La mayoría de los tratamientos más comunes que se describen aquí impactan la degeneración macular húmeda relacionada a la edad (DMRE). Es importante señalar que
Introducción al programa de trabajo de la Agencia para 2015
 7 agosto 2015 EMA/372784/2015 Director Ejecutivo Adjunto Introducción al programa de trabajo de la Agencia para 2015 Por Andreas Pott, Director Ejecutivo Adjunto Prioridades de la EMA y circunstancias
7 agosto 2015 EMA/372784/2015 Director Ejecutivo Adjunto Introducción al programa de trabajo de la Agencia para 2015 Por Andreas Pott, Director Ejecutivo Adjunto Prioridades de la EMA y circunstancias
1. DOCUMENTO DE INFORMACIÓN PARA (*) CRIOTERAPIA TRANSESCLERAL
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
