ESTRUCTURA ATÓMICA TEORÍA ATÓMICA DE DALTON
|
|
|
- José Miguel Coronel Agüero
- hace 7 años
- Vistas:
Transcripción
1 1 TEORÍA ATÓMICA DE DALTON John Dalton propuso, en 1803, una teoría sobre la constitución de la materia basada en los puntos que a continuación se indican. Aunque hoy sabemos que algunos de ellos son en parte incorrectos, su idea general es muy acertada: 1) La materia está formada por unas unidades muy pequeñas llamadas átomos, indivisibles e inalterables. Hoy se conoce que los átomos son divisibles. 2) Los átomos de un elemento químico son todos iguales, tienen la misma masa y las mismas propiedades. Actualmente sabemos que todos los átomos del mismo elemento no son necesariamente iguales; pueden diferenciarse en la masa (isótopos), pero sí presentan las mismas propiedades químicas. 3) Los átomos de elementos distintos difieren en masa y propiedades. En la actualidad sabemos que hay más de cien clases de átomos diferentes. A cada clase de átomos (elemento químico) se le asigna un nombre y un símbolo químico. Por ejemplo, hidrógeno H, cloro Cl o uranio U. 4) Los compuestos químicos se forman por unión de átomos de los elementos correspondientes, en una relación química constante y sencilla. Así el agua se forma por la unión de hidrógeno y oxígeno en la proporción de dos átomos del primero por cada átomo del segundo. Sustancias puras, elementos y compuestos Un sistema se clasifica como homogéneo o heterogéneo según presente o no las mismas propiedades en todos sus puntos. Por ejemplo, el agua, el vino, la sal de mesa o el plomo son homogéneos porque en ellos no se pueden apreciar zonas que sean diferentes las unas de las otras. En cambio, el granito, la pólvora, la madera o un trozo de carne son heterogéneos porque se pueden apreciar zonas con una composición y propiedades diferentes las unas de las otras. Tanto si los sistemas son homogéneos como si son heterogéneos, puede que estén formados por una o por más de una sustancia. Si es así, se podrán separar mediante procedimientos físicos como la evaporación, la filtración, la cristalización, etc. Por ejemplo, una disolución de agua con sal es homogénea pero si la calentamos se puede evaporar el agua quedando la sal como residuo. Una sustancia pura es un sistema homogéneo que no se puede separar en diversos componentes por métodos físicos. Por ejemplo, el oro, la sal de cocina, el alcohol o el azufre. Las sustancias puras con átomos de la misma clase son los elementos químicos y no se descomponen en sustancias más sencillas por procedimientos físicos ni químicos habituales. Son ejemplos el oro, la plata, el plomo o el oxígeno. Los elementos se representan mediante su símbolo químico. Hay sustancias puras formadas por átomos de dos o más clases. Son los compuestos químicos, que se pueden separar en sustancias más sencillas. Por ejemplo el agua puede separarse en hidrógeno y oxígeno o la sal de cocina puede separarse en sodio y cloro.
2 2 MATERIA SUSTANCIAS PURAS MEZCLAS ELEMENTOS QUÍMICOS (HIERRO, ALUMINIO) COMPUESTOS QUÍMICOS (SAL, AZÚCAR) HOMOGÉNEAS (DISOLUCIONES, ALEACIONES) HETEROGÉNEAS (GRANITO, MADERA) LAS PARTÍCULAS ELEMENTALES En el siglo XIX se creía que los átomos eran indestructibles y se trataba de las últimas partículas a las que se podía llegar en la división de la materia. Hacia 1900 se conocían unos cien átomos diferentes. En 1897 los experimentos de Thomson llevaron al descubrimiento del electrón. En 1909, Rutherford descubrió el protón y en 1932 Chadwick descubrió el neutrón. Pronto quedó claro que los átomos están formados fundamentalmente por estos tres tipos de partículas: protones, neutrones y electrones. Protones y neutrones tienen una masa semejante (aproximadamente 1 unidad de masa atómica u.m.a.), mientras que un electrón tiene una masa unas dos mil veces menor que aquéllos. En cuanto a su carga eléctrica, los neutrones no tienen mientras que protones y electrones presentan cargas del mismo valor absoluto, los protones positiva y los electrones negativa. masa carga eléctrica electrón (e - ) 9, kg (0,00055 u.m.a.) -1, C protón (p + ) 1, kg (1 u.m.a.) +1, C neutrón (n) 1, kg (1 u.m.a.) 0 FENÓMENOS RADIACTIVOS La radiactividad fue descubierta casualmente por Becquerel, en 1896, al observar cómo una sal de uranio había impresionado una placa fotográfica tapada y preservada de la luz del sol. Más tarde, los esposos Curie descubrieron el mismo fenómeno, aunque más acentuado, en el polonio y en el radio y le dieron el nombre, hoy familiar, de radiactividad. Las radiaciones que emiten los cuerpos radiactivos se clasifican esencialmente en tres grupos: a) partículas α, formadas por dos protones y dos neutrones; su masa aproximada es de 4 u.m.a. y su carga es positiva equivalente a dos veces la carga elemental; b) rayos β, constituidos por electrones; su velocidad se aproxima a km/s y pueden atravesar láminas de aluminio de 5 mm de espesor; c) rayos γ, que no están constituidos por partículas; son emisiones energéticas de naturaleza ondulatoria. El descubrimiento de la radiactividad contribuyó a mostrar que el átomo era divisible, pues emitía partículas más pequeñas que éstos. MODELO ATÓMICO DE RUTHERFORD El modelo atómico de Ernest Rutherford es la base de los modelos atómicos posteriores y se basa en la observación del siguiente
3 3 experimento: cuando se bombardea con partículas α procedentes de un material radiactivo láminas muy finas de oro o plata (de unos 500 A de espesor) la inmensa mayoría de las partículas α atraviesan la lámina sin sufrir desviación alguna, sólo algunas se desvían de su trayectoria y poquísimas (en torno al 0,005%) rebotan en la lámina. Hacia 1911, Rutherford explicó este resultado experimental de la siguiente forma: a) el átomo tiene un núcleo central pequeño comparado con el tamaño total del átomo; el núcleo presenta carga positiva debida a protones y contiene prácticamente toda la masa del átomo; b) en órbitas circulares en torno al núcleo y a grandes distancias en comparación con el tamaño de éste giran electrones atraídos por el núcleo eléctricamente; c) la suma de las cargas negativas de los electrones es igual a la carga positiva del núcleo, porque el átomo es eléctricamente neutro; por tanto en un átomo neutro el número de protones del núcleo es igual al número de electrones de la corteza. De esta forma, al estar el átomo en su mayor parte vacío, la mayoría de las partículas α del experimento anterior atraviesan la lámina sin desviarse; una pequeña fracción que pasa relativamente cerca del núcleo o algún electrón se desvía por la repulsión o atracción eléctrica y solamente aquellas que inciden directamente contra un núcleo (poco probable a consecuencia del pequeño tamaño de éste), rebotan. Así calculó Rutherford el tamaño de un átomo (del orden de m) y de su núcleo (sobre m). Esto es, el núcleo tiene un diámetro diez mil veces más pequeño que el átomo entero; ello significa que la materia se halla prácticamente "vacía". Este modelo tiene la virtud de ser sencillo, comprensible y fácilmente representable. Como se puede comparar con el sistema solar (con el sol como núcleo y los planetas como electrones) a menudo se le denomina modelo planetario. No obstante, el modelo de Rutherford tiene deficiencias. Una de ellas es que el electrón al girar en torno al núcleo perdería energía continuamente, pues toda carga eléctrica en movimiento emite energía; así se precipitaría contra el núcleo. Ésta y otras deficiencias fueron subsanadas por modelos atómicos posteriores. NÚMERO ATÓMICO Y MASA ATÓMICA A consecuencia del descubrimiento del neutrón por Chadwick en 1932 y del cálculo de las masas de los átomos se concluyó que éstos están formados por protones, neutrones y electrones. Así en el núcleo se hallan los protones y neutrones y girando en torno al núcleo los electrones en número igual al de protones del núcleo. Al número de protones del núcleo, igual al de electrones de la corteza en un átomo neutro, se le denomina número atómico Z. El número atómico Z caracteriza a los átomos de un determinado elemento. A lo largo de distintos procesos químicos un átomo puede ganar o perder electrones convirtiéndose en una entidad cargada denominada ion. En los iones el número de protones no es igual al de electrones, pero el número atómico no varía, sigue siendo el número de protones. Se puede considerar que prácticamente toda la masa del átomo se halla en el núcleo ya que la masa de los electrones, como anteriormente se indicó, es despre-
4 4 ciable frente a la de protones y neutrones. Además, como la masa de protón y neutrón es aproximadamente 1 u.m.a., la masa de un átomo puede considerarse (en u.m.a.) la suma del número de protones (Z) y neutrones (N). A esta suma se le denomina número másico A A = Z + N El número de neutrones de todos los átomos de un mismo elemento químico no es siempre el mismo. A cada una de los conjuntos de átomos de un mismo elemento que difieren en el número de neutrones se les denomina isótopos. La mayor parte de los elementos tienen varios isótopos. El hidrógeno, por ejemplo tiene tres distintos: todos contienen un protón, pero se diferencian en el número de neutrones (cero, uno o dos). El carbono también presenta tres isótopos con seis protones y seis, siete u ocho neutrones. Para diferenciar los isótopos entre sí se utiliza la simbología X A Z donde X es el símbolo del elemento correspondiente, Z su número atómico y A su número másico. De esta forma los isótopos del hidrógeno se representan H 1 1 H 2 1 H 3 1 y los del carbono C 12 6 C 13 6 C 14 6 MODELO ATÓMICO DE BÖHR El modelo atómico de Böhr supone una modificación del modelo de Rutherford. Sigue suponiendo que los electrones giran en torno al núcleo en órbitas circulares, pero estas órbitas no pueden ser cualesquiera. Böhr supone que existen ciertas órbitas, denominadas órbitas permitidas o estacionarias en las cuales el electrón no emite energía; esto es, mientras los electrones se encuentren en estas órbitas el átomo será estable. De las condiciones físicas que impone Böhr a las órbitas estacionarias para el átomo de hidrógeno (el más sencillo, con un protón y un electrón) llega a la conclusión de que si las numeramos de dentro a fuera con los números 1, 2, 3,... el radio r n de la órbita n es r n = n 2 r 1 siendo r 1 el radio de la primera órbita permitida, esto es, la más cercana al núcleo. De esta forma los radios de la segunda, tercera o cuarta órbitas permitidas son cuatro, nueve o dieciséis veces mayores, respectivamente, que el de la primera. Por otra parte, la energía total del electrón en su órbita es la suma de las energías cinética y potencial (eléctrica): E = 1/2 m v 2 + K q p q e /r donde m es la masa del electrón, v su velocidad, K la constante de la ley de Coulomb ( N m 2 /C 2 ), q p la carga del protón, q e la carga del electrón y r el radio de la órbita. Ya que q p = - q e = e, resulta: E = 1/2 m v 2 - K e 2 /r Puede demostrarse que para que una órbita sea estable (sea la de la Luna alrededor de la Tierra o la del electrón alrededor del núcleo) la energía total ha de ser negativa. Si se hace cero o superior la partícula que gira queda desligada del centro (Tierra o núcleo). Por tanto, la energía total del electrón alrededor del núcleo es negativa en todas las órbitas permitidas. Su valor viene dado por E n = -R/n 2
5 5 R es una constante positiva. Así la primera órbita (n=1) tiene la energía más baja (más estable) y a medida que aumenta n, va aumentando el valor de la energía. Esta teoría supuso un rotundo éxito para Böhr, puesto que justifica el espectro de emisión del hidrógeno (conjunto de luces emitidas por el átomo al calentarse) que no había podido explicarse hasta entonces. Sin embargo, cuando se aplica la teoría a átomos con más de un electrón los resultados ya no son válidos; por otra parte, se sabe que el comportamiento del electrón no es tan sencillo como el de una simple partícula (como Böhr supone); ello hizo buscar otros modelos atómicos. EL MODELO ATÓMICO DE LA MECÁNICA CUÁNTICA El átomo de hidrógeno no es tan simple como lo representaba el modelo atómico de Böhr. El electrón no queda confinado dentro de ciertas órbitas circulares, sino que existen ciertas zonas que rodean al núcleo donde existe una gran probabilidad de encontrar el electrón; estas zonas se denominan orbitales. En el átomo de Böhr las órbitas quedaban determinadas a partir de un número n; sin embargo, los orbitales necesitan de tres números, llamados números cuánticos para identificar sus propiedades (energía, tamaño, forma y orientación espacial). Estos números cuánticos son los siguientes: Símbolo Nombre Valores posibles Magnitudes relacionadas n nº cuántico principal 1, 2, 3,... energía, tamaño l nº cuántico azimutal 0... n-1 energía, forma m nº cuántico magnético -l l orientación espacial Así cada orbital viene caracterizado por los tres números cuánticos n,l,m. Para n=1, l puede tomar valores desde 0 hasta 1-1=0, esto es, sólo puede valer cero, y m puede valer desde -0 hasta 0, esto es cero. De esta forma para n=1 sólo existe un orbital caracterizado por los números cuánticos (1,0,0). Para n=2, l puede tomar los valores 0 y 1, pudiendo encontrar los orbitales (2,0,0), (2,1,-1), (2,1,0) y (2,1,1), cuatro en total. En la siguiente tabla se encuentran todos los posibles orbitales hasta n=4 n l m (n,l,m) n l m (n,l,m) ,0, ,0, ,1, ,0,0 0 4,1, ,1,-1 1 4,1,1 0 2,1, ,2,-2
6 6 1 2,1,1-1 4,2,-1 0 4,2, ,0,0 1 4,2, ,1,-1 2 4,2,2 0 3,1, ,3,-3 1 3,1,1-2 4,3, ,2,-2-1 4,3,-1-1 3,2,-1 0 4,3,0 0 3,2,0 1 4,3,1 1 3,2,1 2 4,3,2 2 3,2,2 3 4,3,3 El tamaño del orbital depende del número cuántico principal n; cuanto mayor es n, mayor es el tamaño. La energía del orbital depende fundamentalmente de n: a mayor n, mayor energía; también depende algo del número cuántico azimutal l de manera que para igual n la energía es mayor cuanto mayor es el valor de l; esto es, un orbital con n=2, l=1 tiene mayor energía que otro con n=2, l=0. La forma del orbital depende de l. Los orbitales con l=0 son esféricos con el núcleo en el centro. Los orbitales con l=1 tienen forma de doble lóbulo con el núcleo en el punto de unión de ambos lóbulos. Los orbitales con n=2 o mayor tienen formas más complejas. Ya que el nombrar los orbitales con sus números cuánticos a veces resulta engorroso, se utiliza otra notación más sencilla. Así, a cada valor de l se le asigna una letra, del modo siguiente: De esta forma, el orbital con n=1, l=0 se denomina 1s; el n=2, l=0 es 2s; los tres orbitales con n=2, l=1 son 2p; los cinco orbitales con n=3, l=2 se llaman 3d; los siete con n=4, l=3 son 4f. Así en cada nivel el orbital s es único, los p van en grupos de tres, los d en grupos de cinco y los f en grupos de siete. La orientación espacial depende del número cuántico magnético m. Los orbitales s no tienen orientación, pues son esféricos. Para los orbitales p, m puede tomar los valores -1, 0 ó 1 y se orientan perpendiculares entre sí, de manera que se les hace coincidir con cada uno de los ejes de coordenadas denominándose p x, p y o p z. Para caracterizar un electrón situado en un orbital atómico necesitamos, además de los tres números cuánticos (n, l, m) que caracterizan el orbital un cuarto número cuántico propio del electrón, el número cuántico de spin s que tiene que ver con el giro del electrón en torno a su propio eje. Este número cuántico s puede tomar únicamente dos valores: +1/2 y -1/2. En definitiva, un electrón en el interior de un átomo viene caracterizado por cuatro números cuánticos: n, l, m, s. ORDENACIÓN ENERGÉTICA DE LOS ORBITALES l Símbolo s p d f
7 7 En los átomos polielectrónicos la ordenación (de menor a mayor) de la energía de los orbitales puede conocerse a partir de la siguiente tabla CONFIGURACIÓN ELÉCTRÓNICA DE LOS ÁTOMOS Para establecer la disposición de los electrones en los átomos, denominada configuración electrónica, seguiremos los siguientes principios: 1) Mínima energía: Los electrones ocupan los orbitales disponibles de más baja energía 2) Principio de exclusión de Pauli: En un mismo átomo no puede haber dos electrones con los cuatro números cuánticos iguales. Ello implica que en un orbital atómico caben como máximo dos electrones, que han de tener distinto spin. Por ejemplo, en un orbital 2s podemos encontrar como máximo dos electrones con números cuánticos (2,0,0,+1/2) o (2,0,0,-1/2). Un tercer electrón en este orbital habría de repetir los cuatro números cuánticos, hecho prohibido por el principio de exclusión de Pauli. Usando estos dos principios podemos escribir las configuraciones electrónicas de los átomos más sencillos. Al emplear estos dos principios para realizar la distribución electrónica de los elementos más sencillos el primer problema surge con el carbono, ya que los dos electrones situados en orbitales 2p podrían hallarse de las dos formas indicadas previamente: ocupando orbitales distintos o apareados en el mismo orbital. Para elegir la configuración adecuada se ha de utilizar el principio siguiente. 3) Principio de Hund de la máxima multiplicidad: Si un electrón puede optar por ocupar dos orbitales de la misma energía, uno vacío y otro semilleno, ocupará el vacío y su spin habrá de ser el mismo que el de electrón que ocupa el orbital semilleno.
8 8 Según esto, la configuración correcta para el carbono es la indicada en primer lugar, con los dos electrones 2p en orbitales diferentes. Las configuraciones para los siguientes elementos son: Habitualmente, la configuración electrónica de un elemento se da indicando el número de electrones en cada grupo de orbitales, esto es, para el cloro, Z=17 sería: 1s 2 2s 2 2p 6 3s 2 3p 5 y para el hierro (Z=26) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6. Sin embargo, cuando se quiere visualizar la distribución de los electrones de la última capa (la de número cuántico principal mayor) se usa el diagrama de distribución electrónica orbital a orbital. De esta forma para fósforo (Z=15: 1s 2 2s 2 2p 6 3s 2 3p 3 ) y bromo (Z=35 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 ) se representa: IONES Los átomos neutros tienen el mismo número de protones en el núcleo que electrones en la corteza. Pero en ocasiones pueden ganar o perder electrones convirtiéndose en iones, especies con carga. Si un átomo pierde electrones se convierte en un ion positivo (catión). Si los gana en un ion negativo (anión). Por ejemplo: Na 11p + 11e - -e - Na + 11p + 10e - 1s 2 2s 2 2p 6 Ca 20p + 20e - -2e - Ca 2+ 20p + 18e - 1s 2 2s 2 2p 6 3s 2 3p 6 Cl 17p + 17e - +e - Cl - 17p + 18e - 1s 2 2s 2 2p 6 3s 2 3p 6 O 8p + 8e - +2e - O 2-8p + 8e - 1s 2 2s 2 2p 6 Puedes observar que el número atómico de un átomo es igual que el de su correspondiente ion, pero cambia el número de electrones y la configuración electrónica.
Modelos atómicos: Dalton, Thomson, Rutherford, Bohr y Mecánica Cuántica. Clasificación de los elementos y propiedades periódicas
 Modelos atómicos: Dalton, Thomson, Rutherford, Bohr y Mecánica Cuántica Clasificación de los elementos y propiedades periódicas Modelos atómicos: Átomo de Dalton NOMBRE EN QUÉ CONSISTE QUÉ EXPLICA QUÉ
Modelos atómicos: Dalton, Thomson, Rutherford, Bohr y Mecánica Cuántica Clasificación de los elementos y propiedades periódicas Modelos atómicos: Átomo de Dalton NOMBRE EN QUÉ CONSISTE QUÉ EXPLICA QUÉ
Los números indican los niveles de energía. 2s 2p Las letras la forma del orbital. 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p
 1s Los números indican los niveles de energía. 2s 2p Las letras la forma del orbital. 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p Diagrama de orbitales: Consiste en dibujar los orbitales como cuadrados
1s Los números indican los niveles de energía. 2s 2p Las letras la forma del orbital. 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p Diagrama de orbitales: Consiste en dibujar los orbitales como cuadrados
Tema 9 Naturaleza eléctrica de la materia
 Tema 9 Naturaleza eléctrica de la materia 1.- El átomo Toda materia está formada por partículas como éstas llamadas átomos. Un átomo a su vez está compuesto por pequeños elementos, llamados partículas
Tema 9 Naturaleza eléctrica de la materia 1.- El átomo Toda materia está formada por partículas como éstas llamadas átomos. Un átomo a su vez está compuesto por pequeños elementos, llamados partículas
QUÍMICA 3ºESO ACT TEMA 4. EL ÁTOMO. 1. UN ÁTOMO MUY ANTIGUO.
 TEMA 4. EL ÁTOMO. 1. UN ÁTOMO MUY ANTIGUO. En el siglo V a.c., Leucipo ya decía que había un solo tipo de materia. Pensaba, además que si dividíamos la materia en partes cada vez más pequeñas encontraríamos
TEMA 4. EL ÁTOMO. 1. UN ÁTOMO MUY ANTIGUO. En el siglo V a.c., Leucipo ya decía que había un solo tipo de materia. Pensaba, además que si dividíamos la materia en partes cada vez más pequeñas encontraríamos
EVOLUCIÓN HISTÓRICA DE LOS MODELOS ATÓMICOS.
 Mapa conceptual. EVOLUCIÓN HISTÓRICA DE LOS MODELOS ATÓMICOS. AUTOR DALTON (1808) THOMSON (1900) RUTHERFORD (1911) HECHOS EN LOS QUE SE BASÓ. Ley de conservación de la masa en las reacciones químicas (Lavoisier,
Mapa conceptual. EVOLUCIÓN HISTÓRICA DE LOS MODELOS ATÓMICOS. AUTOR DALTON (1808) THOMSON (1900) RUTHERFORD (1911) HECHOS EN LOS QUE SE BASÓ. Ley de conservación de la masa en las reacciones químicas (Lavoisier,
1. Cuál de los siguientes enunciados es uno de los postulados correspondientes al modelo atómico de Bohr?
 Programa Estándar Anual Nº Guía práctica: Teoría atómica I: modelos atómicos, estructura atómica y tipos de átomos Ejercicios PSU 1. Cuál de los siguientes enunciados es uno de los postulados correspondientes
Programa Estándar Anual Nº Guía práctica: Teoría atómica I: modelos atómicos, estructura atómica y tipos de átomos Ejercicios PSU 1. Cuál de los siguientes enunciados es uno de los postulados correspondientes
Estructura de los átomos.
 Estructura de los átomos. Teoría atomística de Demócrito: Átomo, del griego: que no se puede cortar. Demócrito, filósofo griego (s. IV a.c.): Si dividimos la materia de forma sucesiva llegará un momento
Estructura de los átomos. Teoría atomística de Demócrito: Átomo, del griego: que no se puede cortar. Demócrito, filósofo griego (s. IV a.c.): Si dividimos la materia de forma sucesiva llegará un momento
Ejercicios y respuestas del apartado: Teoría atómica. Z, A, isótopos, n, p, e-. Iones
 Ejercicios y respuestas del apartado: Teoría atómica. Z, A, isótopos, n, p, e-. Iones Teorías atómicas 1. Qué explica el modelo atómico de Dalton? a) La materia está constituida por átomos b) Los átomos
Ejercicios y respuestas del apartado: Teoría atómica. Z, A, isótopos, n, p, e-. Iones Teorías atómicas 1. Qué explica el modelo atómico de Dalton? a) La materia está constituida por átomos b) Los átomos
UNIDAD DIDÁCTICA 2: ESTRUCTURA DE LA MATERIA
 UNIDAD DIDÁCTICA 2: ESTRUCTURA DE LA MATERIA 1. Qué explica el modelo atómico de Dalton? a) La materia está constituida por átomos b) Los átomos tienen un núcleo muy pequeño donde se concentra casi toda
UNIDAD DIDÁCTICA 2: ESTRUCTURA DE LA MATERIA 1. Qué explica el modelo atómico de Dalton? a) La materia está constituida por átomos b) Los átomos tienen un núcleo muy pequeño donde se concentra casi toda
ETIMOLOGÍA DEL ÁTOMO. A = Sin Tomo = División TEORÍAS Y MODELOS ATÓMICOS
 ETIMOLOGÍA DEL ÁTOMO A = Sin Tomo = División TEORÍAS Y MODELOS ATÓMICOS 1. TEORÍA GRIEGA: En Grecia los pensadores filósofos por año 460 a. C. fueron los primeros en hablar que todos los cuerpos estaban
ETIMOLOGÍA DEL ÁTOMO A = Sin Tomo = División TEORÍAS Y MODELOS ATÓMICOS 1. TEORÍA GRIEGA: En Grecia los pensadores filósofos por año 460 a. C. fueron los primeros en hablar que todos los cuerpos estaban
INTRODUCCIÓN A RADIACTIVIDAD
 INTRODUCCIÓN A RADIACTIVIDAD Que es un átomo? Qué partículas se encuentran en el átomo? En que zonas? Es la unidad más pequeña de un elemento químico que no es posible dividir mediante procesos químicos.
INTRODUCCIÓN A RADIACTIVIDAD Que es un átomo? Qué partículas se encuentran en el átomo? En que zonas? Es la unidad más pequeña de un elemento químico que no es posible dividir mediante procesos químicos.
6.1. LAS CARACTERÍSTICAS DE LOS SERES VIVOS. Átomos y estructura atómica
 6.1. LAS CARACTERÍSTICAS DE LOS SERES VIVOS En este epígrafe se desarrollan las características que diferencian a los seres vivos. Una de ellas es la complejidad molecular, que se debe a la inmensa variedad
6.1. LAS CARACTERÍSTICAS DE LOS SERES VIVOS En este epígrafe se desarrollan las características que diferencian a los seres vivos. Una de ellas es la complejidad molecular, que se debe a la inmensa variedad
27. (b) 28. (a) 29. (b) 30. (c) 31. (a) 32. (c) 33. (d) 34. (d) 35. (b) 36. (a) 37. (b) 38. (d) 39. (c) TEMA 4
 grado de pulverización de la muestra 62. Se dice que dos líquidos son inmiscibles entre sí, cuando: a) se disuelven el uno en el otro b) no se disuelven el uno en el otro c) las partículas que forman los
grado de pulverización de la muestra 62. Se dice que dos líquidos son inmiscibles entre sí, cuando: a) se disuelven el uno en el otro b) no se disuelven el uno en el otro c) las partículas que forman los
B. Cuál es su número atómico y másico? Di cuántos protones y neutrones hay en el núcleo y electrones en la corteza.
 Problema nº 0 Los isótopos del boro se representan así: B 5 5 B. Cuál es su número atómico másico? Di cuántos protones neutrones ha en el núcleo electrones en la corteza. El número atómico es Z = 5, el
Problema nº 0 Los isótopos del boro se representan así: B 5 5 B. Cuál es su número atómico másico? Di cuántos protones neutrones ha en el núcleo electrones en la corteza. El número atómico es Z = 5, el
Mundo Atómico. Profesor: Robinson Pino H.
 Mundo Atómico Profesor: Robinson Pino H. 1 ÁTOMO En el siglo V a.c., el filósofo griego Demócrito expresó la idea de que toda la materia estaba formada por partículas muy pequeñas e indivisibles a las
Mundo Atómico Profesor: Robinson Pino H. 1 ÁTOMO En el siglo V a.c., el filósofo griego Demócrito expresó la idea de que toda la materia estaba formada por partículas muy pequeñas e indivisibles a las
GUÍA DE TRABAJO: TEORÍA ATÓMICA. I_ Haciendo uso de tu libro y cuaderno responde las siguientes preguntas:
 GUÍA DE TRABAJO: TEORÍA ATÓMICA I_ Haciendo uso de tu libro y cuaderno responde las siguientes preguntas: 1_ Dibuja el modelo atómico de: _ Thomson _ Rutherford 2_ Nombra las diferencias que observas entre
GUÍA DE TRABAJO: TEORÍA ATÓMICA I_ Haciendo uso de tu libro y cuaderno responde las siguientes preguntas: 1_ Dibuja el modelo atómico de: _ Thomson _ Rutherford 2_ Nombra las diferencias que observas entre
quimica2univia.wordpress.com www.youtube.com/watch?v=6-jfwqiv-q0
 quimica2univia.wordpress.com www.youtube.com/watch?v=6-jfwqiv-q0 Átomo definición 1 En física y química, átomo (del latín atomus, y éste del griego άτομος, indivisible) es la unidad más pequeña de un elemento
quimica2univia.wordpress.com www.youtube.com/watch?v=6-jfwqiv-q0 Átomo definición 1 En física y química, átomo (del latín atomus, y éste del griego άτομος, indivisible) es la unidad más pequeña de un elemento
EL ÁTOMO. Se supuso que estas partículas deberían estar en todos los átomos. Thomson las llamó electrones.
 ANTECEDENTES HISTÓRICOS. () EL ÁTOMO Leucipo y Demócrito. Proponen la Discontinuidad de la materia. Dalton. Formula la primera Teoría atómica. Volta, Davy, Faraday, Berzelius, descubren la Naturaleza eléctrica
ANTECEDENTES HISTÓRICOS. () EL ÁTOMO Leucipo y Demócrito. Proponen la Discontinuidad de la materia. Dalton. Formula la primera Teoría atómica. Volta, Davy, Faraday, Berzelius, descubren la Naturaleza eléctrica
UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 3
 UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 3 NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: DOCENTES: Química General ESTRUCTURA ATÓMICA
UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 3 NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: DOCENTES: Química General ESTRUCTURA ATÓMICA
EL INTERIOR DE LA MATERIA. De qué está hecha la materia?
 EL INTERIOR DE LA MATERIA De qué está hecha la materia? Esta cuestión ha preocupado a los seres humanos desde los tiempos más remotos. Algunas de las ideas propuestas a lo largo de la historia, más o menos
EL INTERIOR DE LA MATERIA De qué está hecha la materia? Esta cuestión ha preocupado a los seres humanos desde los tiempos más remotos. Algunas de las ideas propuestas a lo largo de la historia, más o menos
ESTRUCTURA ATÓMICA TABLA PERIÓDICA UNIÓN QUÍMICA
 ESTRUCTURA ATÓMICA TABLA PERIÓDICA UNIÓN QUÍMICA Teoría Atómica de DALTON 1- Los elementos químicos están constituidos por partículas denominadas átomos 2- Átomos de un mismo elemento, tienen las mismas
ESTRUCTURA ATÓMICA TABLA PERIÓDICA UNIÓN QUÍMICA Teoría Atómica de DALTON 1- Los elementos químicos están constituidos por partículas denominadas átomos 2- Átomos de un mismo elemento, tienen las mismas
MODELOS ATÓMICOS Y PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS. CUESTIONES.
 MODELOS ATÓMICOS Y PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS. CUESTIONES. E2A.S2013 Para los siguientes elementos Na, P, S y Cl, diga razonadamente cuál es: a.- El de menor energía de ionización. b.- El
MODELOS ATÓMICOS Y PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS. CUESTIONES. E2A.S2013 Para los siguientes elementos Na, P, S y Cl, diga razonadamente cuál es: a.- El de menor energía de ionización. b.- El
Modelos atómicos. El valor de la energía de estos niveles de energía está en función de un número n, denominado número cuántico principal 18 J.
 MODELO ATÓMICO DE BOHR (1913) El modelo atómico de Rutherfod tuvo poca vigencia, ya que inmediatamente a su publicación, se le puso una objeción que no supo rebatir: según la teoría del electromagnetismo
MODELO ATÓMICO DE BOHR (1913) El modelo atómico de Rutherfod tuvo poca vigencia, ya que inmediatamente a su publicación, se le puso una objeción que no supo rebatir: según la teoría del electromagnetismo
Guía 2. Actividad 3 Trabajo extra clase. Determinar y comprender las partículas subatómicas mediante ejercicios prácticos.
 Guía 2 Actividad 3 Trabajo extra clase Objetivo: Docente: Javier Alexander Prada Comas Determinar y comprender las partículas subatómicas mediante ejercicios prácticos. Marco teórico Qué es átomo? Es la
Guía 2 Actividad 3 Trabajo extra clase Objetivo: Docente: Javier Alexander Prada Comas Determinar y comprender las partículas subatómicas mediante ejercicios prácticos. Marco teórico Qué es átomo? Es la
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 008 QUÍMICA TEMA : LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva 3, Ejercicio 3, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 008 QUÍMICA TEMA : LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva 3, Ejercicio 3, Opción
NATURALEZA ELECTRICA DE LA MATERIA Y EL ATOMO
 NATURALEZA ELECTRICA DE LA MATERIA Y EL ATOMO PARTÍCULAS SUBATÓMICAS Y MODELOS ATÓMICOS MODELO ATÓMICO DE THOMSON Al final del s. XIX los experimentos realizados sobre la conducción de la electricidad
NATURALEZA ELECTRICA DE LA MATERIA Y EL ATOMO PARTÍCULAS SUBATÓMICAS Y MODELOS ATÓMICOS MODELO ATÓMICO DE THOMSON Al final del s. XIX los experimentos realizados sobre la conducción de la electricidad
IES Menéndez Tolosa Dpto. Física y Química 4º ESO - Modelos atómicos 1S
 IES Menéndez Tolosa Dpto. Física y Química 4º ESO - Modelos atómicos 1S 1 Escribe tres isótopos de oxígeno que tengan, y 10 neutrones. Cuál de ellos tendrá mayor Z? 16 17 1 O, O, O Todos ellos tienen el
IES Menéndez Tolosa Dpto. Física y Química 4º ESO - Modelos atómicos 1S 1 Escribe tres isótopos de oxígeno que tengan, y 10 neutrones. Cuál de ellos tendrá mayor Z? 16 17 1 O, O, O Todos ellos tienen el
UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS
 UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS Lee atentamente: 1. LA MISMA SUSTANCIA EN LOS TRES ESTADOS Todos los cuerpos están formados por sustancias: las personas, los coches, los muebles, el aire, etc. Todas
UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS Lee atentamente: 1. LA MISMA SUSTANCIA EN LOS TRES ESTADOS Todos los cuerpos están formados por sustancias: las personas, los coches, los muebles, el aire, etc. Todas
CLASE Nº 2 TEORÍA ATÓMICA DE LA MATERIA
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 2 TEORÍA ATÓMICA DE LA MATERIA 2012 1 Teorías
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 2 TEORÍA ATÓMICA DE LA MATERIA 2012 1 Teorías
qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq
 qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq Actividades de recuperación de 2º trimestre 3º ESO wertyuiopasdfghjklzxcvbnmqwertyui
qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq Actividades de recuperación de 2º trimestre 3º ESO wertyuiopasdfghjklzxcvbnmqwertyui
Todo lo que puedas imaginar está compuesto por átomos.
 Todo lo que puedas imaginar está compuesto por átomos. El átomo es la partícula más pequeña de un elemento químico (materia formada por átomos iguales) y posee las características del mismo. Cuando se
Todo lo que puedas imaginar está compuesto por átomos. El átomo es la partícula más pequeña de un elemento químico (materia formada por átomos iguales) y posee las características del mismo. Cuando se
A-1 - Indique cual de las siguientes afirmaciones es correcta:
 ESTRUCTURA ATÓMICA - PREGUNTAS DE TEST ))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))Q Serie A: PARTICULAS SUBATOMICAS: Serie B- ESPECTROS: Serie
ESTRUCTURA ATÓMICA - PREGUNTAS DE TEST ))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))Q Serie A: PARTICULAS SUBATOMICAS: Serie B- ESPECTROS: Serie
RESUMEN DE LOS APORTES DE LOS CIENTÍFICOS AL MODELO ACTUAL
 Demócrito: El átomo es indivisible. DALTON Para Dalton los átomos eran esferas macizas. atómica: teoría se puede resumir en: Estableció la teoría 1.- Los elementos químicos están formados por partículas
Demócrito: El átomo es indivisible. DALTON Para Dalton los átomos eran esferas macizas. atómica: teoría se puede resumir en: Estableció la teoría 1.- Los elementos químicos están formados por partículas
1. Teoría atómica de Dalton
 1. Teoría atómica de Dalton Tipos de sustancias Las sustancias puras ( una única sustancia!) pueden ser simples o compuestas. Sustancia simple: a partir de ella no se pueden obtener otras más sencillas.
1. Teoría atómica de Dalton Tipos de sustancias Las sustancias puras ( una única sustancia!) pueden ser simples o compuestas. Sustancia simple: a partir de ella no se pueden obtener otras más sencillas.
TEMA 3: La materia. Propiedades eléctricas y el átomo. 1.- En la siguiente sopa de letras puedes encontrar los nombres de 13 elementos químicos.
 Física y Química Curso 2012/13 3º E.S.O. TEMA 3: La materia. Propiedades eléctricas y el átomo. 1.- En la siguiente sopa de letras puedes encontrar los nombres de 13 elementos químicos. A O M O L P B A
Física y Química Curso 2012/13 3º E.S.O. TEMA 3: La materia. Propiedades eléctricas y el átomo. 1.- En la siguiente sopa de letras puedes encontrar los nombres de 13 elementos químicos. A O M O L P B A
Estructura atómica: tipos de enlaces
 Estructura atómica: tipos de enlaces Estructura de los átomos Modelo atómico de Bohr Masa (g) Carga (C) Protón 1.673 x 10-24 1.602 x 10-19 Neutrón 1.675 x 10-24 0 Electrón 9.109 x 10-28 1.602 x 10-19 Los
Estructura atómica: tipos de enlaces Estructura de los átomos Modelo atómico de Bohr Masa (g) Carga (C) Protón 1.673 x 10-24 1.602 x 10-19 Neutrón 1.675 x 10-24 0 Electrón 9.109 x 10-28 1.602 x 10-19 Los
Solución: a) Falso, porque la carga que se apiña en lo que se denomina núcleo es toda la carga positiva.
 ies menéndez tolosa 1 De las siguientes proposiciones, señala las que considere correctas: a) Todos los isótopos de un elemento tienen el mismo número de electrones. b) Dos isótopos de un elemento pueden
ies menéndez tolosa 1 De las siguientes proposiciones, señala las que considere correctas: a) Todos los isótopos de un elemento tienen el mismo número de electrones. b) Dos isótopos de un elemento pueden
ESTRUCTURA DE LA MATERIA
 ESTRUCTURA DE LA MATERIA 1. En la antigua Grecia ( 450 años a.c.) Demócrito y Leucipo sostuvieron la existencia de átomos (partículas indivisibles) como constituyentes finales de la materia. 2. Sin embargo,
ESTRUCTURA DE LA MATERIA 1. En la antigua Grecia ( 450 años a.c.) Demócrito y Leucipo sostuvieron la existencia de átomos (partículas indivisibles) como constituyentes finales de la materia. 2. Sin embargo,
Qué información podemos obtener de ella?
 Qué información podemos obtener de ella? Dmitri Mendeleiev (1834-1907) Elementos enlistados según su masa atómica Propiedades periódicas de los elementos Predice existencia de elementos con determinadas
Qué información podemos obtener de ella? Dmitri Mendeleiev (1834-1907) Elementos enlistados según su masa atómica Propiedades periódicas de los elementos Predice existencia de elementos con determinadas
EL ÁTOMO. Contenidos (1)
 EL ÁTOMO 2 Contenidos (1) 1.- Antecedentes históricos. 2.- Partículas subatómicas. 3.- Modelo atómico de Thomsom. 4.- Los rayos X. 5.- La radiactividad. 6.- Modelo atómico de Rutherford. 1 3 Contenidos
EL ÁTOMO 2 Contenidos (1) 1.- Antecedentes históricos. 2.- Partículas subatómicas. 3.- Modelo atómico de Thomsom. 4.- Los rayos X. 5.- La radiactividad. 6.- Modelo atómico de Rutherford. 1 3 Contenidos
Departamento de Física y Química Adaptaciones para 3º E.S.O.
 El átomo está formado por tres clases de partículas fundamentales: los protones, p +, que se encuentran en el núcleo o zona central del átomo y que tienen carga positiva y una masa apreciable. Los neutrones,
El átomo está formado por tres clases de partículas fundamentales: los protones, p +, que se encuentran en el núcleo o zona central del átomo y que tienen carga positiva y una masa apreciable. Los neutrones,
ESTRUCTURA ATÓMICA I. MODELOS ATÓMICOS.
 ESTRUCTURA ATÓMICA I. MODELOS ATÓMICOS. 1. MODELOS ATÓMICOS. 2. PARTÍCULAS CONSTITUYENTES DEL ÁTOMO. 3. MODELO ATÓMICO DE BOHR. 4. ACTIVIDADES. 1. MODELOS ATÓMICOS. La idea de la existencia de los átomos
ESTRUCTURA ATÓMICA I. MODELOS ATÓMICOS. 1. MODELOS ATÓMICOS. 2. PARTÍCULAS CONSTITUYENTES DEL ÁTOMO. 3. MODELO ATÓMICO DE BOHR. 4. ACTIVIDADES. 1. MODELOS ATÓMICOS. La idea de la existencia de los átomos
ACTIVIDADES 3º E.S.O. Tema 4.- La estructura de la materia. Agrupaciones de átomos
 ACTIVIDADES 3º E.S.O. Tema 4.- La estructura de la materia. Agrupaciones de átomos Pág. 74 3. Responde a las siguientes cuestiones basándote en la teoría atómica de Dalton: a) Pueden dos elementos distintos
ACTIVIDADES 3º E.S.O. Tema 4.- La estructura de la materia. Agrupaciones de átomos Pág. 74 3. Responde a las siguientes cuestiones basándote en la teoría atómica de Dalton: a) Pueden dos elementos distintos
De qué se Compone la Materia?
 8vo Básico> Ciencias Naturales Composición de la materia De qué se Compone la Materia? Observa la siguiente situación y responde las preguntas propuestas: La profesora comienza su clase y pregunta: Profesora:
8vo Básico> Ciencias Naturales Composición de la materia De qué se Compone la Materia? Observa la siguiente situación y responde las preguntas propuestas: La profesora comienza su clase y pregunta: Profesora:
Átomos Repaso Química
 Átomos Repaso Química I. SELECCIÓN MÚLTIPLE. ESCOGE LA MEJOR CONTESTACIÓN. 1. La materia está compuesta de: (a) masa. (b) átomos. (c) volumen. 2. Parte más pequeña que retiene las características de un
Átomos Repaso Química I. SELECCIÓN MÚLTIPLE. ESCOGE LA MEJOR CONTESTACIÓN. 1. La materia está compuesta de: (a) masa. (b) átomos. (c) volumen. 2. Parte más pequeña que retiene las características de un
NIVELES DE ENERGÍA, SUBNIVELES, ORBITALES Y ELECTRONES
 Universidad de San Carlos de Guatemala Escuela de Formación de Profesores de Enseñanza Media Programa Académico Preparatorio Curso: Química NIVELES DE ENERGÍA, SUBNIVELES, ORBITALES Y ELECTRONES PAP-QUÍMICA
Universidad de San Carlos de Guatemala Escuela de Formación de Profesores de Enseñanza Media Programa Académico Preparatorio Curso: Química NIVELES DE ENERGÍA, SUBNIVELES, ORBITALES Y ELECTRONES PAP-QUÍMICA
ESTRUCTURA DEL ÁTOMO SISTEMA PERIÓDICO. TEMA 2 Pág. 228 libro (Unidad 11)
 ESTRUCTURA DEL ÁTOMO SISTEMA PERIÓDICO TEMA 2 Pág. 228 libro (Unidad 11) PÁGS. 234-235 MAGNITUDES ATÓMICAS. REPASO MAGNITUDES ATÓMICAS. Conceptos clave - Repaso NÚMERO ATÓMICO (Z) Es el número de protones
ESTRUCTURA DEL ÁTOMO SISTEMA PERIÓDICO TEMA 2 Pág. 228 libro (Unidad 11) PÁGS. 234-235 MAGNITUDES ATÓMICAS. REPASO MAGNITUDES ATÓMICAS. Conceptos clave - Repaso NÚMERO ATÓMICO (Z) Es el número de protones
El átomo. Aristóteles (384-322 a.c) Demócrito (460-370 a.c)
 El átomo Demócrito (460-370 a.c) En la antigua Grecia dos concepciones compitieron por dar una interpretación racional a cómo estaba formada la materia. Demócrito consideraba que la materia estaba formada
El átomo Demócrito (460-370 a.c) En la antigua Grecia dos concepciones compitieron por dar una interpretación racional a cómo estaba formada la materia. Demócrito consideraba que la materia estaba formada
qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq
 qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq ACTIVIDADES DE RECUPERACIÓN DE FÍSICA Y QUÍMICA 3º ESO 2º TRIMESTRE
qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq ACTIVIDADES DE RECUPERACIÓN DE FÍSICA Y QUÍMICA 3º ESO 2º TRIMESTRE
Unidad didáctica 1. Naturaleza de la materia. El átomo
 Unidad didáctica 1 Naturaleza de la materia. El átomo 1.- Qué es la materia? Materia: es todo lo que tiene masa y ocupa un lugar en el espacio (tiene volumen). Sustancia: es el tipo de materia de que están
Unidad didáctica 1 Naturaleza de la materia. El átomo 1.- Qué es la materia? Materia: es todo lo que tiene masa y ocupa un lugar en el espacio (tiene volumen). Sustancia: es el tipo de materia de que están
NOMBRE: CURSO: HOJAS DE ACTIVIDADES FÍSICA Y QUÍMICA 3º DE ESO
 NOMBRE: URSO: HOJAS DE ATIVIDADES FÍSIA Y QUÍMIA 3º DE ESO Tema 4 EL ÁTOMO Los trozos de una piedra partida en dos, incluso reducida a polvo, siguen siendo piedra, y cada uno de los fragmentos resultantes
NOMBRE: URSO: HOJAS DE ATIVIDADES FÍSIA Y QUÍMIA 3º DE ESO Tema 4 EL ÁTOMO Los trozos de una piedra partida en dos, incluso reducida a polvo, siguen siendo piedra, y cada uno de los fragmentos resultantes
Enseñanza - Aprendizaje
 El modelo atómico de Bohr funcionaba muy bien para el átomo de hidrógeno, sin embargo, en los espectros realizados para átomos de otros elementos se observaba que electrones de un mismo nivel energético
El modelo atómico de Bohr funcionaba muy bien para el átomo de hidrógeno, sin embargo, en los espectros realizados para átomos de otros elementos se observaba que electrones de un mismo nivel energético
Configuraciones electrónicas. Química General I 2012
 Configuraciones electrónicas Química General I 2012 Configuración o notación electrónica Es el ordenamiento de los electrones dentro de la nube electrónica utilizando los números cuánticos. Se utiliza
Configuraciones electrónicas Química General I 2012 Configuración o notación electrónica Es el ordenamiento de los electrones dentro de la nube electrónica utilizando los números cuánticos. Se utiliza
TEORÍA ATÓMICA: Objetivos: -Describir los distintos modelos atómicos -Definir términos usados en la teoría atómica
 SUBSECTOR PROFESOR NIVEL AÑO UNIDAD SEMESTRE Química Paulina Gómez Octavo básico 2016 Teoría atómica, estructura del átomo Primero GUIA DE ESTUDIO N 1 MODELOS ATÓMICOS DALTON, THOMSON, RUTHERFORD Nombre
SUBSECTOR PROFESOR NIVEL AÑO UNIDAD SEMESTRE Química Paulina Gómez Octavo básico 2016 Teoría atómica, estructura del átomo Primero GUIA DE ESTUDIO N 1 MODELOS ATÓMICOS DALTON, THOMSON, RUTHERFORD Nombre
TEMA 2: DISTRIBUCIÓN ELECTRÓNICA Y TABLA PERIÓDICA.
 TEMA 2: DISTRIBUCIÓN ELECTRÓNICA Y TABLA PERIÓDICA. 1.- Distribución electrónica. La distribución electrónica o configuración electrónica es el modo en que se sitúan los electrones en la corteza de los
TEMA 2: DISTRIBUCIÓN ELECTRÓNICA Y TABLA PERIÓDICA. 1.- Distribución electrónica. La distribución electrónica o configuración electrónica es el modo en que se sitúan los electrones en la corteza de los
La estructura del átomo
 SECCIÓN 3.2 La estructura del átomo La teoría atómica propuesta por John Dalton establecía que los átomos eran indivisibles. Hacia fines del siglo xix, se comprobó que esa idea era incorrecta. Se hizo
SECCIÓN 3.2 La estructura del átomo La teoría atómica propuesta por John Dalton establecía que los átomos eran indivisibles. Hacia fines del siglo xix, se comprobó que esa idea era incorrecta. Se hizo
BLOQUE 2. EL ÁTOMO: MODELOS, TABLA PERIÓDICA Y ENLACE QUÍMICO.
 BLOQUE 2. EL ÁTOMO: MODELOS, TABLA PERIÓDICA Y ENLACE QUÍMICO. Modelos Atómicos. 1. Ordena cronológicamente los siguientes hechos. a) Descubrimiento del protón. b) Experimento de Millikan. c) Experimento
BLOQUE 2. EL ÁTOMO: MODELOS, TABLA PERIÓDICA Y ENLACE QUÍMICO. Modelos Atómicos. 1. Ordena cronológicamente los siguientes hechos. a) Descubrimiento del protón. b) Experimento de Millikan. c) Experimento
PROTONES Y ELECTRONES
 reflexiona Imagina que tienes un tazón de naranjas, plátanos, piñas, bayas, peras y sandía. Cómo identificas cada trozo de fruta? Es muy probable que estés familiarizado con las características de cada
reflexiona Imagina que tienes un tazón de naranjas, plátanos, piñas, bayas, peras y sandía. Cómo identificas cada trozo de fruta? Es muy probable que estés familiarizado con las características de cada
Liceo 1 Javiera Carrera Dpto. Biología Prof. Danilo Parra l. Nivel Octavo Básico. Aprendizajes Esperados
 Liceo 1 Javiera Carrera Dpto. Biología Prof. Danilo Parra l. Nivel Octavo Básico INSTRUCCIONES: este tema no fue tratado en clases presenciales, por lo tanto, lean y desarrollen esta guía que será parte
Liceo 1 Javiera Carrera Dpto. Biología Prof. Danilo Parra l. Nivel Octavo Básico INSTRUCCIONES: este tema no fue tratado en clases presenciales, por lo tanto, lean y desarrollen esta guía que será parte
Trataba de explicar las leyes de la época sobre la composición de las sustancias (leyes ponderales). La materia está constituida por unidades de
 EL ÁTOMO Configuración Cómo está formada la materia en su interior? Desde los tiempos de la antigua Grecia,los pensadores venían haciéndose esta pregunta, acerca de cómo estaba constituida id la materia
EL ÁTOMO Configuración Cómo está formada la materia en su interior? Desde los tiempos de la antigua Grecia,los pensadores venían haciéndose esta pregunta, acerca de cómo estaba constituida id la materia
1.2 Principios fundamentales de la electricidad
 CAPÍTULO 1 PRINCIPIOS FUNDAMENTALES DE LA ELECTRICIDAD 1.1 Introducción Se puede decir que la Electrónica es una extensión de la electricidad, aparecida como consecuencia de los avances en la evolución
CAPÍTULO 1 PRINCIPIOS FUNDAMENTALES DE LA ELECTRICIDAD 1.1 Introducción Se puede decir que la Electrónica es una extensión de la electricidad, aparecida como consecuencia de los avances en la evolución
UNIDAD 1: ATOMOS Y MOLÉCULAS
 UNIDAD 1: ATOMOS Y MOLÉCULAS 1 Se define átomo como la menor porción de un elemento que se puede intercambiar por medio de una reacción química. Se define molécula como la menor porción de materia que
UNIDAD 1: ATOMOS Y MOLÉCULAS 1 Se define átomo como la menor porción de un elemento que se puede intercambiar por medio de una reacción química. Se define molécula como la menor porción de materia que
LA TABLA PERIÓDICA. 2ºbachillerato QUÍMICA
 LA TABLA PERIÓDICA 2ºbachillerato QUÍMICA 1 A lo lo largo de la la historia, los químicos han intentado ordenar los elementos de forma agrupada, de tal manera que aquellos que posean propiedades similares
LA TABLA PERIÓDICA 2ºbachillerato QUÍMICA 1 A lo lo largo de la la historia, los químicos han intentado ordenar los elementos de forma agrupada, de tal manera que aquellos que posean propiedades similares
UNIDAD 4. ESTRUCTURA DE LA MATERIA.
 UNIDAD 4. ESTRUCTURA DE LA MATERIA. 1.- Resume las características principales de los distintos modelos atómicos que has estudiado y ordénalos cronológicamente. (Pág. 74 a 78) 2.- Indica si las siguientes
UNIDAD 4. ESTRUCTURA DE LA MATERIA. 1.- Resume las características principales de los distintos modelos atómicos que has estudiado y ordénalos cronológicamente. (Pág. 74 a 78) 2.- Indica si las siguientes
MODELO ATÓMICO DE DALTON 1808
 ESTRUCTURA ATÓMICA MODELO ATÓMICO DE DALTON 1808 Sienta las bases para la estequiometría de composición y la estequiometría de reacción. 1. Un elemento se compone de partículas extremadamente pequeñas,
ESTRUCTURA ATÓMICA MODELO ATÓMICO DE DALTON 1808 Sienta las bases para la estequiometría de composición y la estequiometría de reacción. 1. Un elemento se compone de partículas extremadamente pequeñas,
ISÓTOPOS, NÚMEROS ATÓMICOS Y NÚMEROS DE MASA
 El átomo nuclear Modelo del átomo de J.J. Thompson (antes de 1900) El átomo consiste de una esfera de carga positiva que tiene sepultados electrones con carga negativa. A este modelo se le conoce como
El átomo nuclear Modelo del átomo de J.J. Thompson (antes de 1900) El átomo consiste de una esfera de carga positiva que tiene sepultados electrones con carga negativa. A este modelo se le conoce como
Tendencias Periódicas- Problemas de Revisión
 Tendencias Periódicas- Problemas de Revisión PSI Química Nombre Tamaño atómico 1. Ordena los siguientes elementos según su tamaño atómico creciente: P, Cs, Sn, F, Sr, Tl 2. Ordena los siguientes elementos
Tendencias Periódicas- Problemas de Revisión PSI Química Nombre Tamaño atómico 1. Ordena los siguientes elementos según su tamaño atómico creciente: P, Cs, Sn, F, Sr, Tl 2. Ordena los siguientes elementos
ESTRUCTURA DEL ATOMO
 ESTRUCTURA ATÓMICA ESTRUCTURA DEL ATOMO PROTONES NUCLEO NEUTRONES ELECTRONES Los electrones giran alrededor del núcleo en regiones del espacio denominadas órbitas. Los átomos grandes albergan a varias
ESTRUCTURA ATÓMICA ESTRUCTURA DEL ATOMO PROTONES NUCLEO NEUTRONES ELECTRONES Los electrones giran alrededor del núcleo en regiones del espacio denominadas órbitas. Los átomos grandes albergan a varias
Tema 4.-Teoría atómica de la materia
 Tema 4.-Teoría atómica de la materia Tema 4.-Teoría atómica de la materia 1.- Concepto de átomo 2.- Partículas que forman el átomo 3.- Estructura del átomo 4.- Átomos, isótopos e iones 5.- Configuración
Tema 4.-Teoría atómica de la materia Tema 4.-Teoría atómica de la materia 1.- Concepto de átomo 2.- Partículas que forman el átomo 3.- Estructura del átomo 4.- Átomos, isótopos e iones 5.- Configuración
4.- Establezca las diferencias entre los siguientes términos: a) órbita y orbital; b) nivel y subnivel
 TEMA 3 CONFIGURACIÓN ELECTRÓNICA Y TABLA PERIÓDICA. A. Números Cuánticos. Significado y Valores Permitidos 1.- Compare los modelos atómicos de Thomson, Rufherford y Bohr. 2.- Mencione el aporte fundamental
TEMA 3 CONFIGURACIÓN ELECTRÓNICA Y TABLA PERIÓDICA. A. Números Cuánticos. Significado y Valores Permitidos 1.- Compare los modelos atómicos de Thomson, Rufherford y Bohr. 2.- Mencione el aporte fundamental
ESTRUCTURA DE LA MATERIA
 ESTRUCTURA DE LA MATERIA Tema : Estructura de la materia 1. Espectros atómicos de emisión 1.1. Espectro atómico de emisión del hidrógeno Si disponemos de un tubo de vidrio transparente que contiene hidrógeno
ESTRUCTURA DE LA MATERIA Tema : Estructura de la materia 1. Espectros atómicos de emisión 1.1. Espectro atómico de emisión del hidrógeno Si disponemos de un tubo de vidrio transparente que contiene hidrógeno
CÁTEDRA DE QUÍMICA INGENIERÍA ELECTRÓNICA - BIOINGENIERÍA
 Departamento de Electrónica y Automática Facultad de Ingeniería CÁTEDRA DE QUÍMICA INGENIERÍA ELECTRÓNICA - BIOINGENIERÍA GUÍA DE TRABAJOS PRÁCTICOS DE AULA Nº 2 Estructura Atómica Tabla Periódica Profesor
Departamento de Electrónica y Automática Facultad de Ingeniería CÁTEDRA DE QUÍMICA INGENIERÍA ELECTRÓNICA - BIOINGENIERÍA GUÍA DE TRABAJOS PRÁCTICOS DE AULA Nº 2 Estructura Atómica Tabla Periódica Profesor
Ejercicios Estructura atómica y tabla periódica.
 Ejercicios Estructura atómica y tabla periódica. 1. Los números atómicos de los elementos P y Mn son 15 y 25, respectivamente. a) Escribe la configuración electrónica de cada uno de ellos. b) Indica los
Ejercicios Estructura atómica y tabla periódica. 1. Los números atómicos de los elementos P y Mn son 15 y 25, respectivamente. a) Escribe la configuración electrónica de cada uno de ellos. b) Indica los
EJERCICIOS DE SELECTIVIDAD 99/00
 EJERCICIOS DE SELECTIVIDAD 99/00 1. Tres elementos tienen de número atómico 25, 35 y 38, respectivamente. a) Escriba la configuración electrónica de los mismos. b) Indique, razonadamente, el grupo y periodo
EJERCICIOS DE SELECTIVIDAD 99/00 1. Tres elementos tienen de número atómico 25, 35 y 38, respectivamente. a) Escriba la configuración electrónica de los mismos. b) Indique, razonadamente, el grupo y periodo
Propiedades Tabla Periódica
 Propiedades Tabla Periódica Profesor Gustavo L. Propiedades Tabla Periódica 1 Un poco de historia... 2 En 1869, el químico ruso Dimitri Mendeleev propuso por primera vez que los elementos químicos exhibían
Propiedades Tabla Periódica Profesor Gustavo L. Propiedades Tabla Periódica 1 Un poco de historia... 2 En 1869, el químico ruso Dimitri Mendeleev propuso por primera vez que los elementos químicos exhibían
ies menéndez tolosa 1 Cuántos orbitales tiene un átomo de hidrógeno en el quinto nivel de energía (E5)?
 ies menéndez tolosa 1 Cuántos orbitales tiene un átomo de idrógeno en el quinto nivel de energía (E5)? Para el quinto nivel de energía, el número cuántico principal es 5. Luego ay: n 2 = 5 2 = 25 orbitales
ies menéndez tolosa 1 Cuántos orbitales tiene un átomo de idrógeno en el quinto nivel de energía (E5)? Para el quinto nivel de energía, el número cuántico principal es 5. Luego ay: n 2 = 5 2 = 25 orbitales
Colegio Superior de Señoritas Profesora: Noylen Vega Martínez Practica 8 avo año Química: - 1 -
 Profesora: Noylen Vega Martínez Practica 8 avo año Química: - 1 - Complete el siguiente cuadro calculando en cada caso los valores faltantes. Características de algunas especies químicas Especie química
Profesora: Noylen Vega Martínez Practica 8 avo año Química: - 1 - Complete el siguiente cuadro calculando en cada caso los valores faltantes. Características de algunas especies químicas Especie química
En una reacción química, los átomos se agrupan de forma diferente a como lo estaban inicialmente, pero ni aparecen ni desaparecen
 ESTRUCTURA DE LA MATERIA 1. Conceptos generales 2. Modelos atómicos. 3. Teoría cuántica. Fundamentos. 4. Números cuánticos. 5. Distribución de los electrones en el átomo: configuraciones electrónicas ÁTOMO:
ESTRUCTURA DE LA MATERIA 1. Conceptos generales 2. Modelos atómicos. 3. Teoría cuántica. Fundamentos. 4. Números cuánticos. 5. Distribución de los electrones en el átomo: configuraciones electrónicas ÁTOMO:
La materia. Clasificación de la materia
 27 de marzo de 2005 Contenidos 1 Introducción La materia 2 La materia Qué es la materia? Materia es todo aquello que tiene masa y posee volumen. La materia Qué es la materia? Materia es todo aquello que
27 de marzo de 2005 Contenidos 1 Introducción La materia 2 La materia Qué es la materia? Materia es todo aquello que tiene masa y posee volumen. La materia Qué es la materia? Materia es todo aquello que
FÍSICA Y QUÍMICA 1º Bachillerato PRESENTACIÓN DE ASIGNATURA
 FÍSICA Y QUÍMICA 1º Bachillerato PRESENTACIÓN DE ASIGNATURA TEMARIO CONTENIDOS FÍSICA Y QUÍMICA QUÍMICA 1. Estructura del átomo. Sistema periódico 2. Formulación y nomenclatura inorgánicas 3. Enlace químico
FÍSICA Y QUÍMICA 1º Bachillerato PRESENTACIÓN DE ASIGNATURA TEMARIO CONTENIDOS FÍSICA Y QUÍMICA QUÍMICA 1. Estructura del átomo. Sistema periódico 2. Formulación y nomenclatura inorgánicas 3. Enlace químico
FÍSICA Y QUÍMICA TEMA 4: LOS ÁTOMOS Y SU COMPLEJIDAD
 Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2015/2016 1 FÍSICA Y QUÍMICA TEMA 4: LOS ÁTOMOS Y SU COMPLEJIDAD Física y Química 3º Curso Educación Secundaria Obligatoria Curso
Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2015/2016 1 FÍSICA Y QUÍMICA TEMA 4: LOS ÁTOMOS Y SU COMPLEJIDAD Física y Química 3º Curso Educación Secundaria Obligatoria Curso
ESTRUCTURA DEL ÁTOMO SISTEMA PERIÓDICO. TEMA 2 Pág. 228 libro (Unidad 11)
 ESTRUCTURA DEL ÁTOMO SISTEMA PERIÓDICO TEMA 2 Pág. 228 libro (Unidad 11) PÁGS. 234-235 MAGNITUDES ATÓMICAS. REPASO MAGNITUDES ATÓMICAS. Conceptos clave - Repaso NÚMERO ATÓMICO (Z) Es el número de protones
ESTRUCTURA DEL ÁTOMO SISTEMA PERIÓDICO TEMA 2 Pág. 228 libro (Unidad 11) PÁGS. 234-235 MAGNITUDES ATÓMICAS. REPASO MAGNITUDES ATÓMICAS. Conceptos clave - Repaso NÚMERO ATÓMICO (Z) Es el número de protones
Modelo atómico de la materia. Tabla periódica, configuración electrónica y propiedades periódicas
 Eje temático: Modelo atómico de la materia Enlace químico Química orgánica Disoluciones químicas Contenido: Propiedades periódicas: configuración electrónica y tabla periódica Nivel: Segundo medio Modelo
Eje temático: Modelo atómico de la materia Enlace químico Química orgánica Disoluciones químicas Contenido: Propiedades periódicas: configuración electrónica y tabla periódica Nivel: Segundo medio Modelo
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 3, Opción B Reserva 1, Ejercicio 2, Opción B Reserva 2, Ejercicio 2, Opción A Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 3, Opción B Reserva 1, Ejercicio 2, Opción B Reserva 2, Ejercicio 2, Opción A Reserva 3, Ejercicio
Los símbolos químicos son distintos signos abreviados que se utilizan para identificar los elementos y compuestos químicos en lugar de sus nombres
 Los símbolos químicos son distintos signos abreviados que se utilizan para identificar los elementos y compuestos químicos en lugar de sus nombres completos. La mayoría de los símbolos se derivan de las
Los símbolos químicos son distintos signos abreviados que se utilizan para identificar los elementos y compuestos químicos en lugar de sus nombres completos. La mayoría de los símbolos se derivan de las
GUIA DE APRENDIZAJE QUIMICA 1º MEDIO TEMA : CONFIGURACIÓN ELECTRÓNICA
 Liceo Juan Antonio Ríos Quinta Normal GUIA DE APRENDIZAJE QUIMICA 1º MEDIO TEMA : CONFIGURACIÓN ELECTRÓNICA Unidad temática: Estructura atómica Objetivo General:Comprender el comportamiento de los electrones
Liceo Juan Antonio Ríos Quinta Normal GUIA DE APRENDIZAJE QUIMICA 1º MEDIO TEMA : CONFIGURACIÓN ELECTRÓNICA Unidad temática: Estructura atómica Objetivo General:Comprender el comportamiento de los electrones
ESTRUCTURA DE LA MATERIA.
 Repaso de los modelos atómicos. ESTRUCTURA DE LA MATERIA. 1.- Razona si son verdaderas o falsas las siguientes afirmaciones: a) cuando un electrón pasa de un estado fundamental a un excitado emite energía;
Repaso de los modelos atómicos. ESTRUCTURA DE LA MATERIA. 1.- Razona si son verdaderas o falsas las siguientes afirmaciones: a) cuando un electrón pasa de un estado fundamental a un excitado emite energía;
1 Qué le sucede a un electrón si cae a un nivel de energía inferior? 2 Cómo puede un electrón cambiar a un nivel de energía superior?
 1 Qué le sucede a un electrón si cae a un nivel de energía inferior? 2 Cómo puede un electrón cambiar a un nivel de energía superior? 3 Según el modelo atómico de Bohr, cómo se origina un espectro de absorción?
1 Qué le sucede a un electrón si cae a un nivel de energía inferior? 2 Cómo puede un electrón cambiar a un nivel de energía superior? 3 Según el modelo atómico de Bohr, cómo se origina un espectro de absorción?
El átomo a través de la historia
 I.MUNICIPALIDAD DE PROVIDENCIA CORPORACIÓN DE DESARROLLO SOCIAL LICEO POLIVALENTE ARTURO ALESSANDRI PALMA DEPARTAMENTO DE QUÍMICA MARTA HERMOSILLA ARCE GUIA DE ESTUDIO OCTAVO BÁSICO QUÍMICA HISTORIA DEL
I.MUNICIPALIDAD DE PROVIDENCIA CORPORACIÓN DE DESARROLLO SOCIAL LICEO POLIVALENTE ARTURO ALESSANDRI PALMA DEPARTAMENTO DE QUÍMICA MARTA HERMOSILLA ARCE GUIA DE ESTUDIO OCTAVO BÁSICO QUÍMICA HISTORIA DEL
El átomo. Índice. 2. Modelos prenucleares. Contenidos. 1.1. Modelos atómicos. 2.1. Modelo atómico de Dalton
 5 El átomo Contenidos Índice 1 2 3 4 Estructura interna del átomo: modelos atómicos Modelos prenucleares Modelos nucleares Átomos y elementos 1. Estructura interna del átomo: modelos atómicos Los fenómenos
5 El átomo Contenidos Índice 1 2 3 4 Estructura interna del átomo: modelos atómicos Modelos prenucleares Modelos nucleares Átomos y elementos 1. Estructura interna del átomo: modelos atómicos Los fenómenos
Podemos definir la materia como todo aquello que ocupa un lugar en el espacio.
 Podemos definir la materia como todo aquello que ocupa un lugar en el espacio. MATERIA está formada por moléculas, las cuales son la parte más pequeña que poseen todas las propiedades físicas y químicas
Podemos definir la materia como todo aquello que ocupa un lugar en el espacio. MATERIA está formada por moléculas, las cuales son la parte más pequeña que poseen todas las propiedades físicas y químicas
UNIDAD 4. La materia: propiedades eléctricas y el átomo
 PRUEBAS EXTRAORDINARIA DE FÍSICA Y QUÍMICA DE 3º y 4º ESO 1.- CONTENIDOS MÍNIMOS 3º DE LA ESO UNIDAD 1. La ciencia, la materia y su medida 1. Diferenciar ciencia y pseudociencia. 2. Distinguir entre propiedades
PRUEBAS EXTRAORDINARIA DE FÍSICA Y QUÍMICA DE 3º y 4º ESO 1.- CONTENIDOS MÍNIMOS 3º DE LA ESO UNIDAD 1. La ciencia, la materia y su medida 1. Diferenciar ciencia y pseudociencia. 2. Distinguir entre propiedades
PCPI Ámbito Científico-Tecnológico LA MATERIA
 LA MATERIA La materia es todo aquello que ocupa lugar en el espacio y tiene masa. Un sistema material es una porción de materia que, para su estudio, aislamos del resto. La materia está formada por partículas
LA MATERIA La materia es todo aquello que ocupa lugar en el espacio y tiene masa. Un sistema material es una porción de materia que, para su estudio, aislamos del resto. La materia está formada por partículas
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2013 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 013 QUÍMICA TEMA : LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio, Opción A Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio, Opción A Reserva 3, Ejercicio, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 013 QUÍMICA TEMA : LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio, Opción A Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio, Opción A Reserva 3, Ejercicio, Opción
ESTRUCTURA ATOMICA. PARTICULAS FUNDAMENTALES. El átomo esta formado de partículas de muchos tipos:
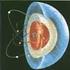 ESTRUCTURA ATOMICA. PARTICULAS FUNDAMENTALES. El átomo esta formado de partículas de muchos tipos: Protón (p, p, P) PARTICULAS ESTABLES Electrón (e, e, B) Neutrón (n, n, N) Electrón positivo o positrón
ESTRUCTURA ATOMICA. PARTICULAS FUNDAMENTALES. El átomo esta formado de partículas de muchos tipos: Protón (p, p, P) PARTICULAS ESTABLES Electrón (e, e, B) Neutrón (n, n, N) Electrón positivo o positrón
Tema 4: LOS ÁTOMOS. 1.- El incompleto átomo de Dalton.
 1 Tema 4: LOS ÁTOMOS 1.- El incompleto átomo de Dalton. 2 1.1.- Antecedentes históricos. La naturaleza eléctrica de la materia. 1.2.- Descubrimiento del electrón. 2.- Los primeros modelos átomicos. 2.1-
1 Tema 4: LOS ÁTOMOS 1.- El incompleto átomo de Dalton. 2 1.1.- Antecedentes históricos. La naturaleza eléctrica de la materia. 1.2.- Descubrimiento del electrón. 2.- Los primeros modelos átomicos. 2.1-
Física y Química - 3º ESO
 C O L L E G I S A N A N T O N I O D E P A D U A F R A N C I S C A N S L C A R C A I X E N T C U R S 2 0 1 1 / 2 0 1 2 Física y Química - 3º ESO Tema 1 La ciencia y su método. Medida de magnitudes. Anexo
C O L L E G I S A N A N T O N I O D E P A D U A F R A N C I S C A N S L C A R C A I X E N T C U R S 2 0 1 1 / 2 0 1 2 Física y Química - 3º ESO Tema 1 La ciencia y su método. Medida de magnitudes. Anexo
Elemento químico: es el conjunto formado por átomos del mismo número atómico (Z)
 Tabla Periodica En 1913, al realizar experiencias de bombardeo de varios elementos químicos con rayos X, Moseley percibió que el comportamiento de cada elemento químico estaba relacionado con la cantidad
Tabla Periodica En 1913, al realizar experiencias de bombardeo de varios elementos químicos con rayos X, Moseley percibió que el comportamiento de cada elemento químico estaba relacionado con la cantidad
Universidad de Chile Preuniversitario Facultad de Medicina Subsector ciencias: Química Común. TALLER Nº1 Modelo Atómico de la Materia
 TALLER Nº1 Modelo Atómico de la Materia Escrito por: Juan Ceballo P. Editado por : Este taller tiene como finalidad ejercitar el primer eje temático de la PSU correspondiente al nivel de 2º medio: Modelo
TALLER Nº1 Modelo Atómico de la Materia Escrito por: Juan Ceballo P. Editado por : Este taller tiene como finalidad ejercitar el primer eje temático de la PSU correspondiente al nivel de 2º medio: Modelo
MATERIALES Y DISPOSITIVOS ELECTRÓNICOS (Ing Computación) MATERIALES ELÉCTRICOS (Ing. Eléctrica, Electrónica y Biomédica)
 MATERIALES Y DISPOSITIVOS ELECTRÓNICOS (Ing Computación) MATERIALES ELÉCTRICOS (Ing. Eléctrica, Electrónica y Biomédica) GUIA DE ESTUDIO MODELOS ATÓMICOS Los átomos están compuesto por: Núcleo, de carga
MATERIALES Y DISPOSITIVOS ELECTRÓNICOS (Ing Computación) MATERIALES ELÉCTRICOS (Ing. Eléctrica, Electrónica y Biomédica) GUIA DE ESTUDIO MODELOS ATÓMICOS Los átomos están compuesto por: Núcleo, de carga
