SISTEMAS COLOIDALES en FARMACIA
|
|
|
- Francisco Alcaraz Gómez
- hace 6 años
- Vistas:
Transcripción
1 Capítulo 4 Emulsiones y Espumas SISTEMAS COLOIDALES en FARMACIA c Dr. Licesio J. Rodríguez ljr@usal.es - Departamento de Química física - Facultad de Farmacia - Campus Miguel de Unamuno - Universidad de Salamanca 22 de noviembre de 2007 En el interior de pequeñas gotas (o burbujas) esféricas, la presión es mayor que en el exterior. Este fenómeno resulta crucial a la hora de interpretar y comprender la estabilidad de emulsiones y espumas, sistemas constituídos por pequeñas gotas de líquido o burbujas de gas dispersas en un medio continuo, por lo que su estudio precederá al análisis de estos tipos de sistemas coloidales Presión de curvatura Para una gota, considerada esférica con radio r, en equilibrio, la tendencia a la expansión se encuentra compensada tanto por la compresión que sobre ella ejerce el medio exterior como por la energía superficial, es decir: dw exp = dw comp + dw sup p exp dv = p int dv + γda (4.1) de donde se deduce: p int p ext = γ da dv = γ 8πrdr 4πr 2 dr = 2γ r (4.2) En general, para cualquier superficie: ( 1 p int p ext = γ + 1 ) r 1 r 2 (4.3) 13
2 Licesio J. Rodríguez Sistemas Coloidales en Farmacia donde r 1 y r 2 son los radios de curvatura. Esta expresión se conoce como ecuación de Young- Laplace 1 A modo de ejemplo ilustrativo, para una gota de agua, (γ = N m 1 ), de radio r, a 25 o C: p = N m 1 r 1,00atm 1, N m 2 = 1, atm r/m (4.4) Presión en el interior de una gota de agua de radio r r/m p/atm 1, , , , , ,142 1, ,42 1, , Presión de vapor de gotas El equilibrio líquido-vapor queda afectado por la curvatura de la interfase: µ L = µ V (4.5) dµ L = dµ V (4.6) V L dp L S L dt = V V dp V S V dt a T constante, dt = 0 (4.7) pgota(r) p V L dp L = p p p = exp 2γV L rrt expresión que recibe el nombre de ecuación de Kelvin 2 p V V dp V (4.8) V L (p r p ) = V L 2γ r = RT ln p p (4.9) Para gotas, r > 0 resulta p > p. Para burbujas, r < 0, por lo que p < p. p p p = exp 2γV L rrt 1 2γV L rrt ya que (4.10) (4.11) exp (x) 1 + x 1! + x2 2! + (4.12) 1 Thomas Young ( ), notable físico británico Pierre Simon, marqués de Laplace ( ), insigne matemático francés 2 William Thompson, Lord Kelvin ( ), renombrado físico y matemático británico. 14
3 Sistemas Coloidales en Farmacia Licesio J. Rodríguez Como Ejemplo, si se trata de agua, a 25 o C, p p 2γV L RT = 2γV L rrt (4.13) 0,144 J m m3 mol 8,31 J mol K 298 K 1, m (4.14) Presión de vapor en gotas y en burbujas de agua r/m p/p p/p (gotas) (burbujas) 1, ,1 % 0,1 % 1, % 1 % 1, % 10 % En las superficies convexas (gotas) aumenta la presión de vapor, es decir, los líquidos finamente pulverizados se vaporizan con mayor rapidez. De modo equivalente, la pulverización de un sólido incrementa la velocidad de su disolución en un disolvente. De modo contrario, en las superficies cóncavas (burbujas) la presión de vapor disminuye, es decir, los líquidos hierven con mayor facilidad y los vapores condensan antes en las superficies con pequeños huecos que el las superficies más pulidas Ángulo de contacto y capilaridad La humectación es la capacidad que un líquido posee de extenderse sobre una superficie. El mayor o menor grado de extensión viene determinado por el ángulo de contacto. γ 1 + γ 3 cos θ = γ 2 cos θ = γ 2 γ 1 γ 3 (4.15) Figura 1. Ángulo de contacto y formación de meniscos Un ángulo de contacto, θ < 90 o, indica que el líquido moja. En caso contrario existe repelencia entre el líquido y la superficie. La superficie curva en la zona de contacto se denomina menisco. La formación de meniscos en el interior de capilares determina la aparición de concavidades o convexidades en las que la presión a ambos lados de la interfase no es la misma, en virtud de 15
4 Licesio J. Rodríguez Sistemas Coloidales en Farmacia lo establecido en la Ley de Young-Laplace. Esta diferencia de presión impulsa al líquido a fluir a través del capilar, fenómeno que recibe el nombre de capilaridad. p = ρ g h = 2γ r = 2γ cos θ R (4.16) Figura 2. Presión de la columna capilar La medida de la presión capilar puede ser útil en la determinación de ángulos de contacto (porosimetría). Figura 3. a) Humectación y adhesión entre partículas, b) Repelencia frente al agua, c) Flotación. La formación de meniscos en torno a pequeñas partículas en suspensión, permite interpretar fenómenos tales como la adhesión entre partículas, la repelencia al líquido de un retículo (tejido, pelo, plumas, etc.) o la flotación de partículas de sólidos finamente divididos Emulsiones Una emulsión es una suspensión suficientemente estable de pequeñas gotas de un líquido en otro líquido con el que es inmiscible. La estabilidad de estos sistemas puede abarcar desde días hasta varios años. Dependiendo del tamaño de las partículas de la fase dispersa las emulsiones pueden ser: macroemulsiones o microemulsiones. En las primeras el tamaño de la gota se encuentra entre 0,2 y 50 µm, siendo, por ello, visibles al microscopio. En el otro tipo, en las microemulsiones, el tamaño de la gota es mucho más pequeño, entre 10 y 200 nm. Si el tamaño de la gota es del orden de 1 µm la emulsión presenta un aspecto blanco lechoso, si el tamaño está entre µm, blanco-azulado; µm, gris semitransparente; 0.05 µm, transparente. Dos líquidos puros inmiscibles no pueden formar una emulsión. Para que tal suspensión sea cinéticamente estable debe de participar un tercer componente, llamado emulgente, que estabilice la interfase. Este componente es, generalmente, un tensioactivo, aunque otros agentes, como sólidos finamente divididos, por ejemplo, pueden tambien producir el efecto de emulsificación. El emulgente es, además, en la mayor parte de los casos, una mezcla de sustancias. 16
5 Sistemas Coloidales en Farmacia Licesio J. Rodríguez Las emulsiones pueden ser de dos tipos atendiendo a la naturaleza de la fase dispersa: de aceite (fase orgánica) en agua (o/w) y de agua en aceite (w/o). La emulsión que preferentemente se forma en cada circunstancia depende primordialmente de la naturaleza del emulgente. En general, la formación de emulsiones o/w se produce con la intervención de emulgentes más solubles en agua que en la fase orgánica, mientras que las emulsiones w/o se forman preferentemente con emulgentes más solubles en la fase orgánica que en el agua. A este principio se le conoce como Regla de Bancroft (1913). Un tipo de emulsión puede, sin embargo transformarse en el otro mediante una modificación conveniente de las condiciones. A esto se le llama inversión de la emulsión. El tipo de emulsión puede fácilmente establecerse ya que 1) Una emulsión se diluye de modo espontáneo en el líquido que constituye la fase contínua; 2) Las emulsiones o/w presentan conductividad eléctrica similar a la de la fase acuosa, las w/o no conducen la corriente de modo significativo; 3) Una emulsión puede teñirse mediante el uso de un colorante soluble en el líquido que constituye la fase continua; 4) Una gota de emulsión o/w humedece ampliamente el papel de filtro, produciendo una mancha de contorno amplio y extendido; esto no se produce con una emulsión w/o. Figura 4. Emulsificación por partículas pulverizadas. El medio de dispersión es el que presenta un menor ángulo de contacto (Regla de Bancroft) Estabilidad de las emulsiones. El término estabilidad, como se ha dicho, se usa en este contexto como resistencia de las gotas a la coalescencia. Cuando se produce la flotación o sedimentación de las gotas como consecuencia de la diferencia de densidad entre las fases, sin crecimiento del tamaño de las gotas, normalmente no se habla de destrucción de la emulsión sino de floculación. La redispersión del sistema puede conseguirse nuevamente sin dificultad. La velocidad del proceso de coalescencia es la única medida de la estabilidad de la emulsión. Puede seguirse determinando el número de gotas en función del tiempo. Esta velocidad depende, entre otros, de los factores siguientes: 1) la naturaleza del recubimiento interfacial; 2) la existencia de barreras electrostáticas en la interfase que previenen el contacto entre gotas; 3) la viscosidad de la fase continua; la distribución del tamaño de gotas; 4) la temperatura Espumas La espuma se produce al hacer burbujear aire o cualquier otro gas por debajo de la superficie de un líquido que se expande para encerrar dicho gas en celdas separadas por láminas de líquido. Estas láminas son pequeñas películas de líquido con caras aproximadamente paralelas, que se curvan cuando dos o tres de estas láminas se juntan, formando superficies cóncavas hacia el gas, denominadas bordes de Plateau 3. La existencia de estas concavidades hace que la presión del hueco de líquido entre las celdas sea menor que la del líquido entre caras paralelas (Young - Laplace), lo que produce el flujo de líquido hacia estas zonas, denominado escurrimiento; esta 3 Joseph Plateau ( ), físico belga. 17
6 Licesio J. Rodríguez Sistemas Coloidales en Farmacia es una de las principales causas de la destrucción de la espuma. El líquido también escurre impulsado por la presión hidrostática, lo que produce láminas más finas en las partes superiores de la espuma que en la base. El espesor crítico que hace desaparecer la lámina está alrededor de los 5-10 nm. Los líquidos puros no producen espuma. La espuma tampoco se produce en mezclas de sustancias de similares propiedades (i.e. disoluciones acuosas de sustancias hidrófilas). las burbujas de gas introducidas debajo de la superficie de un líquido puro se rompen de inmediato al contacto entre ellas. Para conseguir verdaderamente la formación de espumas es necesaria la participación de un soluto que pueda adsorberse en la interfase L/G, con la consiguiente formación de capas monomoleculares a cada lado de la lámina. Estas capas adsorbidas proporcionan al sistema la capacidad de resistencia al excesivo adelgazamiento de la película, en forma de elasticidad. Las espumas pueden clasificarse en persistentes y transitorias. En las primeras el mecanismo contra la ruptura de las láminas hace que el tiempo de vida media sea de horas o días. En las transitorias dicho mecanismo es muy débil y la duración es de segundos. Figura 5. Superficies de Plateau en la intersección de tres burbujas. Debido a la curvatura, la presión del líquido en A es menor que en B, favoreciendo el escurrimiento de líquido y la destrucción de la espuma Factores que determinan la persistencia de la lámina. La existencia de elasticidad es condición necesaria para una espuma persistente. Los mecanismos que pueden retardar la ruptura de las láminas son varios; algunos se citan a continuación Escurrimiento del líquido. Este puede ocurrir impulsado por dos factores: gravedad y tensión superficial. El escurrimiento por gravedad es de importancia en las láminas gruesas, como las que se forman en los primeros instantes de la espuma. El escurrimiento por tensión superficial toma importancia a medida que la láminas van adelgazandose. En este contexto la viscosidad del líquido que constituye la espuma representa un factor esencial determinante de la velocidad con que el líquido fluye a través de los canales durante este proceso. Como ya se ha indicado, el escurrimiento por tensión superficial viene impulsado por la diferencia de presión capilar que se establece en las zonas de diferente curvatura de la lámina (bordes de Plateau) Difusión del gas a través de las láminas. Otro factor importante que determina la estabilidad de una espuma es la velocidad con que el gas difunde a través de la lámina que separa una y otra burbuja. La presión en el interior de las burbujas pequeñas es mayor que la de las grandes; en consecuencia las burbujas grandes crecen a costa de las pequeñas. Este crecimiento termina cambiando el aspecto de la espuma con el tiempo. Una espuma diluída, formada por burbujas de pequeño tamaño, evoluciona hacia una espuma concentrada, con burbujas grandes que se empaquetan formando grandes burbujas poliédricas con caras poligonales. Esto incrementa la curvatura en los bordes de Plateau con lo que aumentan las fuerzas que producen el escurrimiento por tensión superficial a través de estos bordes. Este crecimiento puede también producir cierto reorganizamiento entre las burbujas, lo que a veces lleva a la ruptura de las 18
7 Sistemas Coloidales en Farmacia Licesio J. Rodríguez láminas en algunos puntos, debido a las tensiones. El valor del coeficiente de permeabilidad del gas a través de las láminas. La experiencia indica que esta transferencia tiene lugar a través de los poros que abren las moléculas del tensioactivo. Un alto empaquetamiento de estas moléculas (alta concentración) disminuye la posibilidad de esta transferencia. En este sentido, también, tensioactivos con cadena larga presentan mayor resistencia a la transferencia del gas que los tensioactivos con cadema más corta. Asímismo, el menor tamaño del grupo hidrófilo produce un poro más pequeño e incrementa la resistencia a la permeabilidad Viscosidad superficial. Si la viscosidad del líquido en la superficie es muy alta puede dificultarse el cierre de los puntos de ruptura por adelgazamiento por parte de más disolución de tensioactivo, al tardar más tiempo en el transporte Existencia de la doble capa eléctrica. Otro factor que previene del excesivo adelgazamiento de las láminas es, por ejemplo, la repulsión electrostática entre las cargas eléctricas de los grupos iónicos del tensioactivo a ambos lados de la lámina. Este efecto permite la existencia de películas muy delgadas ( 0,2 µm). En este sentido, la adición de electrolito a una espuma pruce la neutralización de esta doble capa y la consiguiente destrucción de la espuma Agentes antiespumantes. Los agentes destructores de espuma ejercen su acción reemplazando las sustancias formadoras de capas tensioactivas elásticas por otras sustancias formadoras de capas rígidas y, por lo tanto, más frágiles. Tienen que tener, por tanto, tensión superficial suficientemente pequeña para que puedan extenderse sin dificultad al mismo tiempo que tener mucha tendencia a acumularse en la superficie, es decir, tener baja solubilidad en la disolución del agente espumante. En este contexto cabe destacar dos tipos de agentes antiespumantes: destructores de espuma e inhibidores de espuma. Los destructores de espuma actúan, generalmente, reduciendo excesivamente la tensión superficial en algunas zonas, de modo que se provoca el adelgazamiento hasta la ruptura (etil éter, isoamil alcohol, etc). Los agentes inhibidores de espuma, como su nombre indica, previenen su formación eliminando la elasticidad de las láminas. esto se consigue añadiendo sustancias con tensión superficial independiente de la expansión o compresión de la lámina. Se sustituye así la capa monomolecular elástica por otra más empaquetada y menos deformable que produce la ruptura con facilidad (sales cálcicas de ácidos grasos de cadena larga, polisiliconas, etc.). 19
SISTEMAS COLOIDALES en FARMACIA
 Capítulo 3 Emulsiones y Espumas SISTEMAS COLOIDALES en FARMACIA c Dr. Licesio J. Rodríguez sistemas.coloidales@gmail.com - http://www.usal.es/licesio/ Departamento de Química física - Facultad de Farmacia
Capítulo 3 Emulsiones y Espumas SISTEMAS COLOIDALES en FARMACIA c Dr. Licesio J. Rodríguez sistemas.coloidales@gmail.com - http://www.usal.es/licesio/ Departamento de Química física - Facultad de Farmacia
Tema 4. Fuerzas intermoleculares
 Tema 4: Fuerzas intermoleculares Química para biólogos Slide 1 of 35 Contenidos 4-1 Electronegatividad 4-2 Polaridad de enlace y molécula: momento dipolar 4-3 Fuerzas intermoleclares 4-4 Puentes de hidrógeno
Tema 4: Fuerzas intermoleculares Química para biólogos Slide 1 of 35 Contenidos 4-1 Electronegatividad 4-2 Polaridad de enlace y molécula: momento dipolar 4-3 Fuerzas intermoleclares 4-4 Puentes de hidrógeno
Curso er. semestre. Gotas y burbujas
 1. Tensión superficial Gotas y burbujas Ismael Núñez La membrana superficial es una película delgada de liquido que se forma sobre su superficie cuando el fluido está en reposo. Una molécula en el seno
1. Tensión superficial Gotas y burbujas Ismael Núñez La membrana superficial es una película delgada de liquido que se forma sobre su superficie cuando el fluido está en reposo. Una molécula en el seno
Propiedades de la materia. Características de sólidos, líquidos y gases
 Propiedades de la materia Características de sólidos, líquidos y gases Fluidos Líquidos Ej: H 2 O Estados de la materia Gases Ej: O 2 Amorfos Ej: caucho Cristalinos Ej: sal, azúcar Sólidos Metálicos Enlace
Propiedades de la materia Características de sólidos, líquidos y gases Fluidos Líquidos Ej: H 2 O Estados de la materia Gases Ej: O 2 Amorfos Ej: caucho Cristalinos Ej: sal, azúcar Sólidos Metálicos Enlace
Capítulo 10. Efectos de superficie. Sistema respiratorio
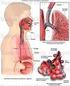 Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
PROPIEDADES FUNCIONALES DE LAS PROTEÍNAS
 PROPIEDADES FUNCIONALES DE LAS PROTEÍNAS Que es una Propiedad Funcional? Propiedades físicas y químicas que derivan del comportamiento de proteínas en sistemas alimenticios durante procesado, almacenamiento,
PROPIEDADES FUNCIONALES DE LAS PROTEÍNAS Que es una Propiedad Funcional? Propiedades físicas y químicas que derivan del comportamiento de proteínas en sistemas alimenticios durante procesado, almacenamiento,
líquido sólido Interfase sólido-líquido
 INTERFASES La mayoría de los procesos fisicoquímicos naturales y artificiales ocurren en sistemas heterogéneos en donde las diferentes fases que las componen están separadas por una interfase, definida
INTERFASES La mayoría de los procesos fisicoquímicos naturales y artificiales ocurren en sistemas heterogéneos en donde las diferentes fases que las componen están separadas por una interfase, definida
UNIDAD 1 La materia y sus cambios
 UNIDAD 1 La materia y sus cambios Tema 1.3 Propiedades características de las sustancias: físicas, organolépticas, químicas; intensivas y extensivas. NMLV 1 Propiedades de las sustancias Organolépticas
UNIDAD 1 La materia y sus cambios Tema 1.3 Propiedades características de las sustancias: físicas, organolépticas, químicas; intensivas y extensivas. NMLV 1 Propiedades de las sustancias Organolépticas
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas.
 La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
Actividad: Cómo ocurren las reacciones químicas?
 Cinética química Cómo ocurren las reacciones químicas? Nivel: 3º Medio Subsector: Ciencias químicas Unidad temática: Cinética Actividad: Cómo ocurren las reacciones químicas? Qué es la cinética de una
Cinética química Cómo ocurren las reacciones químicas? Nivel: 3º Medio Subsector: Ciencias químicas Unidad temática: Cinética Actividad: Cómo ocurren las reacciones químicas? Qué es la cinética de una
FLOTACIÓN. La flotación es uno de los procesos más selectivos para la separación de especies sulfurosas, y de Plomo- zinc y cobre zinc.
 La flotación es uno de los procesos más selectivos para la separación de especies sulfurosas, y de Plomo- zinc y cobre zinc. La separación de las especies a través del proceso de flotación, se produce
La flotación es uno de los procesos más selectivos para la separación de especies sulfurosas, y de Plomo- zinc y cobre zinc. La separación de las especies a través del proceso de flotación, se produce
LA MATERIA: ESTADOS DE AGREGACIÓN
 LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo.
 Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo. N 2 g 3 H 2 g 2 NH 3 g 2 NH 3 g N 2 g 3 H 2 g concentración H 2 N 2 NH 3 concentración NH 3 H 2
Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo. N 2 g 3 H 2 g 2 NH 3 g 2 NH 3 g N 2 g 3 H 2 g concentración H 2 N 2 NH 3 concentración NH 3 H 2
Dispersiones Alimenticias
 Los Sistemas Alimenticios se dividen en dos grupos principales: a).- TEJIDOS COMESTIBLES INTACTOS: Son aquellos que no han sido modificados mecánicamente por el hombre. Dentro de estos tenemos: El tejido
Los Sistemas Alimenticios se dividen en dos grupos principales: a).- TEJIDOS COMESTIBLES INTACTOS: Son aquellos que no han sido modificados mecánicamente por el hombre. Dentro de estos tenemos: El tejido
Transformación física de sustancias puras
 Transformación física de sustancias puras Muchas procesos termodinámicos ocurren sin FDPELRV HQ OD FRPRVLFLyQ TXtPLFDGHOVLVWHPD, ej.: vaporización, sublimación, ebullición, etc. En tales procesos se GLVWLQJXH
Transformación física de sustancias puras Muchas procesos termodinámicos ocurren sin FDPELRV HQ OD FRPRVLFLyQ TXtPLFDGHOVLVWHPD, ej.: vaporización, sublimación, ebullición, etc. En tales procesos se GLVWLQJXH
TEMA 7: POROSIDAD Y ÁREA SUPERFICIAL
 1 TEMA 7: POROSIDAD Y ÁREA SUPERFICIAL 1.- Clasificación de los poros de acuerdo a su tamaño Los materiales porosos se clasifican como microporosos con un tamaño de poro de 0.3-2 nm, mesoporosos de 2-50
1 TEMA 7: POROSIDAD Y ÁREA SUPERFICIAL 1.- Clasificación de los poros de acuerdo a su tamaño Los materiales porosos se clasifican como microporosos con un tamaño de poro de 0.3-2 nm, mesoporosos de 2-50
Determinación de la concentración micelar crítica (cmc) y grado de disociación (α) de un tensioactivo iónico mediante medidas de conductividad
 Determinación de la concentración micelar crítica (cmc) y grado de disociación (α) de un tensioactivo iónico mediante medidas de conductividad OBJETIVO: Determinación de la concentración micelar crítica
Determinación de la concentración micelar crítica (cmc) y grado de disociación (α) de un tensioactivo iónico mediante medidas de conductividad OBJETIVO: Determinación de la concentración micelar crítica
Facultad de Ingeniería y Arquitectura PROPIEDADES HIDRÁULICAS DE LOS SUELOS
 PROPIEDADES HIDRÁULICAS DE LOS SUELOS Capilaridad El proceso de capilaridad es el ascenso que tiene el agua cuando se introduce verticalmente un tubo de vidrio de diámetro pequeño (desde unos milímetros
PROPIEDADES HIDRÁULICAS DE LOS SUELOS Capilaridad El proceso de capilaridad es el ascenso que tiene el agua cuando se introduce verticalmente un tubo de vidrio de diámetro pequeño (desde unos milímetros
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1)
 PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1) Un gas es sometido a tres procesos identificados con las letras X, Y y Z. Estos procesos son esquematizados en los gráficos que se presentan
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1) Un gas es sometido a tres procesos identificados con las letras X, Y y Z. Estos procesos son esquematizados en los gráficos que se presentan
Fundamentos de Química. Horario de Tutorías
 Fundamentos de Química Segundo Cuatrimestre Horario de Tutorías Martes 12:00-14:00 16:00-19:00 Edificio 24B.Tercera Planta 14/02/2006 Tema 11: Propiedades de las disoluciones 11.1 Definición de disolución
Fundamentos de Química Segundo Cuatrimestre Horario de Tutorías Martes 12:00-14:00 16:00-19:00 Edificio 24B.Tercera Planta 14/02/2006 Tema 11: Propiedades de las disoluciones 11.1 Definición de disolución
FISICOQUÍMICA APLICADA
 UNIVERSIDAD NACIONAL DE TUCUMAN FACULTAD DE BIOQUIMICA QUIMICA Y FARMACIA INSTITUTO DE QUIMICA FISICA San Miguel de Tucumán República Argentina FISICOQUÍMICA APLICADA Cambio de fase. Superficies. Coloides
UNIVERSIDAD NACIONAL DE TUCUMAN FACULTAD DE BIOQUIMICA QUIMICA Y FARMACIA INSTITUTO DE QUIMICA FISICA San Miguel de Tucumán República Argentina FISICOQUÍMICA APLICADA Cambio de fase. Superficies. Coloides
Física y Química 3º ESO
 1. Física y Química. Ciencias de la medida forman parte de las necesitan Ciencias de la naturaleza medir las propiedades de los cuerpos que se dividen en para lo cual se emplean lo que siempre conlleva
1. Física y Química. Ciencias de la medida forman parte de las necesitan Ciencias de la naturaleza medir las propiedades de los cuerpos que se dividen en para lo cual se emplean lo que siempre conlleva
TEMA 1. MECANISMOS BÁSICOS DE TRANSMISIÓN DE CALOR
 TEMA 1. MECANISMOS BÁSICOS DE TRANSMISIÓN DE CALOR El calor: Es una forma de energía en tránsito. La Termodinámica y La Transferencia de calor. Diferencias. TERMODINAMICA 1er. Principio.Permite determinar
TEMA 1. MECANISMOS BÁSICOS DE TRANSMISIÓN DE CALOR El calor: Es una forma de energía en tránsito. La Termodinámica y La Transferencia de calor. Diferencias. TERMODINAMICA 1er. Principio.Permite determinar
Estados de la materia y cambios de fase
 3 Año de Química: Sistemas Materiales Prof. Javier Ponce Qué es Ciencia? Ciencia (en latíns cientia, de scire, conocer ), término que en su sentido más amplio se emplea para referirse al conocimiento sistematizado
3 Año de Química: Sistemas Materiales Prof. Javier Ponce Qué es Ciencia? Ciencia (en latíns cientia, de scire, conocer ), término que en su sentido más amplio se emplea para referirse al conocimiento sistematizado
GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS
 A FUERZAS INTERMOLECULARES GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS 1. Menciona y describe las propiedades macroscópicas de los estados de agregación más comunes en que se presenta la materia. 2. Para cada
A FUERZAS INTERMOLECULARES GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS 1. Menciona y describe las propiedades macroscópicas de los estados de agregación más comunes en que se presenta la materia. 2. Para cada
HIDROSTÁTICA-TENSIÓN SUPERFICIAL
 HIDROSTÁTICA-TENSIÓN SUPERFICIAL Los líquidos son sistemas materiales caracterizados por: Su tendencia a fluir si se les aplica un impulso externo. Los movimientos de translación de las moléculas que lo
HIDROSTÁTICA-TENSIÓN SUPERFICIAL Los líquidos son sistemas materiales caracterizados por: Su tendencia a fluir si se les aplica un impulso externo. Los movimientos de translación de las moléculas que lo
NUEVAS TEXTURAS EN LA COCINA
 QUÍMICA Y COCINA NUEVAS TEXTURAS EN LA COCINA Almería, 15 de Noviembre de 2008 Mª Dolores Garrido Fernández M Dolores Garrido Fernández Tecnología Alimentos. Universidad de Murcia Cocina y ciencia: una
QUÍMICA Y COCINA NUEVAS TEXTURAS EN LA COCINA Almería, 15 de Noviembre de 2008 Mª Dolores Garrido Fernández M Dolores Garrido Fernández Tecnología Alimentos. Universidad de Murcia Cocina y ciencia: una
FACULTAD DE MEDICINA LICENCIATURA EN NUTRICIÓN FISICOQUÍMICA SEPTIEMBRE 2015
 UNIVERSIDAD AUTÓNOMA DEL ESTADO DE MÉXICO FACULTAD DE MEDICINA LICENCIATURA EN NUTRICIÓN FISICOQUÍMICA SEPTIEMBRE 2015 ESTADOS DE DISPERSIÓN Dra. en C.A.R.N YAMEL LIBIEN JIMÉNEZ SEPTIEMBRE 2015 OBJETIVO
UNIVERSIDAD AUTÓNOMA DEL ESTADO DE MÉXICO FACULTAD DE MEDICINA LICENCIATURA EN NUTRICIÓN FISICOQUÍMICA SEPTIEMBRE 2015 ESTADOS DE DISPERSIÓN Dra. en C.A.R.N YAMEL LIBIEN JIMÉNEZ SEPTIEMBRE 2015 OBJETIVO
JUNIO FASE GENERAL QUÍMICA. OPCIÓN A
 JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
MATERIALES METALICOS 2do Ingeniería Mecánica. Diagramas de Equilibrio de Fases
 MATERIALES METALICOS 2do Ingeniería Mecánica Diagramas de Equilibrio de Fases Ing. Víctor Gómez Universidad Tecnológica Nacional Facultad Regional Tucumán Aleaciones Ø Aleación: Sustancia que tiene propiedades
MATERIALES METALICOS 2do Ingeniería Mecánica Diagramas de Equilibrio de Fases Ing. Víctor Gómez Universidad Tecnológica Nacional Facultad Regional Tucumán Aleaciones Ø Aleación: Sustancia que tiene propiedades
El ascenso del agua en las plantas
 El ascenso del agua en las plantas Los árboles más grandes del mundo: Harry Cole (California): Secoya 113.1 m de altura. Ferguson (Australia): Eucalipto Australiano: mide 132.6 m y 6 m de diámetro Eucaliptis
El ascenso del agua en las plantas Los árboles más grandes del mundo: Harry Cole (California): Secoya 113.1 m de altura. Ferguson (Australia): Eucalipto Australiano: mide 132.6 m y 6 m de diámetro Eucaliptis
DIFERENCIA ENTRE FLUIDOS Y SÓLIDOS
 DIFERENCIA ENTRE FLUIDOS Y SÓLIDOS Se le llama fluido a toda aquella sustancia continua que puede fluir. Los fluidos pueden ser gaseosos y líquidos. Esta es la diferencia fundamental entre un sólido, cuya
DIFERENCIA ENTRE FLUIDOS Y SÓLIDOS Se le llama fluido a toda aquella sustancia continua que puede fluir. Los fluidos pueden ser gaseosos y líquidos. Esta es la diferencia fundamental entre un sólido, cuya
Conceptos basicos del equilibrio de quimico en medio acuoso
 Conceptos basicos del equilibrio de quimico en medio acuoso Elaborado por: Gustavo Gomez Sosa Facultad de Quimica UNAM QU ÍM IC A A N A LÍTIC A I C LAV E 1402 G rupo 4, s em es tre 2010-2 CONCEPTOS BASICOS
Conceptos basicos del equilibrio de quimico en medio acuoso Elaborado por: Gustavo Gomez Sosa Facultad de Quimica UNAM QU ÍM IC A A N A LÍTIC A I C LAV E 1402 G rupo 4, s em es tre 2010-2 CONCEPTOS BASICOS
CAPITULO 5 PROCESO DE SECADO. Se entiende por secado de alimentos la extracción deliberada del agua que contienen,
 CAPITULO 5 PROCESO DE SECADO 5.1 SECADO DE ALIMENTOS Se entiende por secado de alimentos la extracción deliberada del agua que contienen, operación que se lleva a cabo en la mayoría de los casos evaporando
CAPITULO 5 PROCESO DE SECADO 5.1 SECADO DE ALIMENTOS Se entiende por secado de alimentos la extracción deliberada del agua que contienen, operación que se lleva a cabo en la mayoría de los casos evaporando
SUSTANCIA QUÍMICA mercurio oxígeno
 ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
TEMA 2: DIAGRAMAS DE FASES
 TEMA 2: DIAGRAMAS DE FASES 1.- LAS ALEACIONES 2.- FUSIÓN Y SOLIDIFICACIÓN 3.- DIAGRAMAS DE EQUILIBRIO O DE FASES 4.- TIPOS DE DIAGRAMAS 5.- REPASO - 1 - 1.- ALEACIONES Una aleación es una sustancia compuesta
TEMA 2: DIAGRAMAS DE FASES 1.- LAS ALEACIONES 2.- FUSIÓN Y SOLIDIFICACIÓN 3.- DIAGRAMAS DE EQUILIBRIO O DE FASES 4.- TIPOS DE DIAGRAMAS 5.- REPASO - 1 - 1.- ALEACIONES Una aleación es una sustancia compuesta
Concepto de difusión. Leyes de Fick
 Difusión en Química Concepto de difusión. Leyes de Fick Concepto de difusión. Leyes de Fick fuerza impulsora sólo existe cambio en una coordenada Difusión. Primera ley de Fick Flujo de soluto, J, se define
Difusión en Química Concepto de difusión. Leyes de Fick Concepto de difusión. Leyes de Fick fuerza impulsora sólo existe cambio en una coordenada Difusión. Primera ley de Fick Flujo de soluto, J, se define
DESESTABILIZACIÓN DE ESPUMAS: MECANISMOS
 DESESTABILIZACIÓN DE ESPUMAS: MECANISMOS 1- Drenaje de líquido Por gravedad Pasaje de líquido de lamela a borde de Plateau Pasaje de líquido de borde de Plateau a fase continua 2- Cremado o flotación de
DESESTABILIZACIÓN DE ESPUMAS: MECANISMOS 1- Drenaje de líquido Por gravedad Pasaje de líquido de lamela a borde de Plateau Pasaje de líquido de borde de Plateau a fase continua 2- Cremado o flotación de
ESTO NO ES UN EXAMEN, ES UNA HOJA DEL CUADERNILLO DE EJERCICIOS. Heroica Escuela Naval
 CUADERNILLO DE FÍSICA. TERCER GRADO. I.- SUBRAYE LA RESPUESTA CORRECTA EN LOS SIGUIENTES ENUNCIADOS. 1.- CUANDO DOS CUERPOS CON DIFERENTE TEMPERATURA SE PONEN EN CONTACTO, HAY TRANSMISIÓN DE: A) FUERZA.
CUADERNILLO DE FÍSICA. TERCER GRADO. I.- SUBRAYE LA RESPUESTA CORRECTA EN LOS SIGUIENTES ENUNCIADOS. 1.- CUANDO DOS CUERPOS CON DIFERENTE TEMPERATURA SE PONEN EN CONTACTO, HAY TRANSMISIÓN DE: A) FUERZA.
TEMA 6 MEZCLAS Y DISOLUCIONES
 TEMA 6 MEZCLAS Y DISOLUCIONES 1 Contenidos: 1. Tipos de disoluciones 2. El proceso de disolución 3. Formas de expresar la concentración. 4. Solubilidad. Factores que afectan a la solubilidad 5. Propiedades
TEMA 6 MEZCLAS Y DISOLUCIONES 1 Contenidos: 1. Tipos de disoluciones 2. El proceso de disolución 3. Formas de expresar la concentración. 4. Solubilidad. Factores que afectan a la solubilidad 5. Propiedades
Operaciones Básicas de Transferencia de Materia Problemas Tema 6
 1º.- En una torre de relleno, se va a absorber acetona de una corriente de aire. La sección de la torre es de 0.186 m 2, la temperatura de trabajo es 293 K y la presión total es de 101.32 kpa. La corriente
1º.- En una torre de relleno, se va a absorber acetona de una corriente de aire. La sección de la torre es de 0.186 m 2, la temperatura de trabajo es 293 K y la presión total es de 101.32 kpa. La corriente
DINÁMICA DE LAS MARCAS DE FUEGO
 DINÁMICA DE LAS MARCAS DE FUEGO Dentro de esta disciplina, la identificación y análisis correcto de estas señales de la combustión supone conocer que marcas producen los tres tipos de transmisión de calor,
DINÁMICA DE LAS MARCAS DE FUEGO Dentro de esta disciplina, la identificación y análisis correcto de estas señales de la combustión supone conocer que marcas producen los tres tipos de transmisión de calor,
SEGUNDO DE BACHILLERATO QUÍMICA. a A + b B c C + d D
 TEMA 5. CINÉTICA QUÍMICA a A + b B c C + d D 1 d[a] 1 d[b] 1 d[c] 1 d[d] mol v = = = + = + a dt b dt c dt d dt L s El signo negativo en la expresión de velocidad es debido a que los reactivos desaparecen,
TEMA 5. CINÉTICA QUÍMICA a A + b B c C + d D 1 d[a] 1 d[b] 1 d[c] 1 d[d] mol v = = = + = + a dt b dt c dt d dt L s El signo negativo en la expresión de velocidad es debido a que los reactivos desaparecen,
TEMA 3: MATERIALES COMPUESTOS DE MATRIZ ORGÁNICA: INTERFASE Y ARQUITECTURA
 TEA 3: ATERIALES CPUESTS DE ATRIZ RGÁNICA: INTERFASE Y ARQUITECTURA 3.1- Interfase Las propiedades mecánicas de un material compuesto dependen de las propiedades de sus componentes, fibra y matriz y de
TEA 3: ATERIALES CPUESTS DE ATRIZ RGÁNICA: INTERFASE Y ARQUITECTURA 3.1- Interfase Las propiedades mecánicas de un material compuesto dependen de las propiedades de sus componentes, fibra y matriz y de
MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN.
 MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN. CLASIFICACIÓN DE LA MATERIA: SEGÚN: A. ESTADO DE AGREGACIÓN. B. COMPOSICIÓN. A. ESTADO DE AGREGACIÓN. SE REFIERE A LA FORMA DE INTERACCIÓN ENTRE LAS MOLÉCULAS
MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN. CLASIFICACIÓN DE LA MATERIA: SEGÚN: A. ESTADO DE AGREGACIÓN. B. COMPOSICIÓN. A. ESTADO DE AGREGACIÓN. SE REFIERE A LA FORMA DE INTERACCIÓN ENTRE LAS MOLÉCULAS
Apuntes de Electroquímica
 En la región donde interaccionan electrodo y disolución pueden ocurrir dos tipos de reacciones: de oxidación o de reducción. La velocidad de una reacción elemental depende de la concentración de las especies
En la región donde interaccionan electrodo y disolución pueden ocurrir dos tipos de reacciones: de oxidación o de reducción. La velocidad de una reacción elemental depende de la concentración de las especies
SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA
 I. CONTENIDOS: 1. Leyes de los gases. 2. Presión y temperatura. 3. Principio de Le Chatelier. 4. Constante de equilibrio. SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA II. OBJETIVOS: Al término de la Sesión,
I. CONTENIDOS: 1. Leyes de los gases. 2. Presión y temperatura. 3. Principio de Le Chatelier. 4. Constante de equilibrio. SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA II. OBJETIVOS: Al término de la Sesión,
IMPERFECCIONES EN SÓLIDOSS
 IMPERFECCIONES EN SÓLIDOSS UN ORDENAMIENTO PERFECTO DE LOS ÁTOMOS EN LOS MATERIALES CRISTALINOS SOLAMENTE PUEDE OCURRIR A UNA TEMPERATURA DE 0 K. TAL SÓLIDO IDEAL NO EXISTE: TODOS TIENEN GRAN NÚMERO DE
IMPERFECCIONES EN SÓLIDOSS UN ORDENAMIENTO PERFECTO DE LOS ÁTOMOS EN LOS MATERIALES CRISTALINOS SOLAMENTE PUEDE OCURRIR A UNA TEMPERATURA DE 0 K. TAL SÓLIDO IDEAL NO EXISTE: TODOS TIENEN GRAN NÚMERO DE
REGIMENES DE CORRIENTES O FLUJOS
 LINEAS DE CORRIENTE Ø Las líneas de corriente son líneas imaginarias dibujadas a través de un fluido en movimiento y que indican la dirección de éste en los diversos puntos del flujo de fluidos. Ø Una
LINEAS DE CORRIENTE Ø Las líneas de corriente son líneas imaginarias dibujadas a través de un fluido en movimiento y que indican la dirección de éste en los diversos puntos del flujo de fluidos. Ø Una
MEZCLADO DE SÓLIDOS OBJETIVOS
 MEZCLADO DE SÓLIDOS Operación n unitaria cuyo objetivo es tratar a dos o más m s componentes de forma que cada unidad (part( partícula,, molécula,...) de uno de los componentes contacte lo más m posible
MEZCLADO DE SÓLIDOS Operación n unitaria cuyo objetivo es tratar a dos o más m s componentes de forma que cada unidad (part( partícula,, molécula,...) de uno de los componentes contacte lo más m posible
Derivación por Equilibrio de Complejo Activado
 1/3/14 Energía Libre de Gibbs reactivos G Estado de transición Productos Coordenada de reacción Reacción: HO + CH 3 r [HO --- CH 3 --- r] + CH 3 OH + r http://upload.wikimedia.org/wikipedia/commons/thumb/9/99/rxn_coordinate_diagram_5.pg/4px-rxn_coordinate_diagram_5.pg
1/3/14 Energía Libre de Gibbs reactivos G Estado de transición Productos Coordenada de reacción Reacción: HO + CH 3 r [HO --- CH 3 --- r] + CH 3 OH + r http://upload.wikimedia.org/wikipedia/commons/thumb/9/99/rxn_coordinate_diagram_5.pg/4px-rxn_coordinate_diagram_5.pg
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
LA NUTRICIÓN EN LAS PLANTAS
 LA NUTRICIÓN EN LAS PLANTAS LOS SERES VIVOS COMO SISTEMAS LA NUTRICIÓN COMO INTERCAMBIO DE MATERIA Y ENERGÍA LOS ORGANISMOS SEGÚN LA FORMA DE OBTENER LA ENERGÍA PROCESOS EN LA NUTRICIÓN EN LAS PLANTAS
LA NUTRICIÓN EN LAS PLANTAS LOS SERES VIVOS COMO SISTEMAS LA NUTRICIÓN COMO INTERCAMBIO DE MATERIA Y ENERGÍA LOS ORGANISMOS SEGÚN LA FORMA DE OBTENER LA ENERGÍA PROCESOS EN LA NUTRICIÓN EN LAS PLANTAS
MÓDULO III SECCIÓN V EMULSIONES. Mercedes Fernández Arévalo
 MÓDULO III SECCIÓN V EMULSIONES Mercedes Fernández Arévalo EMULSIONES Sistema disperso heterogéneo Dispersión de dos líquidos inmiscibles FI: Líquido1 (gotas( gotas) FE: Líquido2 Suspensión EMULSIONES
MÓDULO III SECCIÓN V EMULSIONES Mercedes Fernández Arévalo EMULSIONES Sistema disperso heterogéneo Dispersión de dos líquidos inmiscibles FI: Líquido1 (gotas( gotas) FE: Líquido2 Suspensión EMULSIONES
Electricidad y calor
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Respuesta: a) La fracción molar de NaCl es 0,072 b) La concentración másica volumétrica de NaCl es 0,231 g/cc
 Ejercicio 1: La densidad a 4 ºC de una solución acuosa de NaCl al 20% en peso es 1,155 g/cc a) Calcule la fracción molar de NaCl b) Calcule la concentración másica volumétrica de NaCl La masa molecular
Ejercicio 1: La densidad a 4 ºC de una solución acuosa de NaCl al 20% en peso es 1,155 g/cc a) Calcule la fracción molar de NaCl b) Calcule la concentración másica volumétrica de NaCl La masa molecular
Electricidad y calor. Webpage: Departamento de Física Universidad de Sonora
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Departamento de Física Aplicada III
 Departamento de Física Aplicada III Escuela Superior de Ingenieros Camino de los Descubrimientos s/n 4109 Sevilla Examen de Campos electromagnéticos. o Curso de Ingeniería Industrial. Septiembre de 011
Departamento de Física Aplicada III Escuela Superior de Ingenieros Camino de los Descubrimientos s/n 4109 Sevilla Examen de Campos electromagnéticos. o Curso de Ingeniería Industrial. Septiembre de 011
Interacciones químicas de no enlace. Fuerzas de van der Waals
 Interacciones químicas de no enlace IES La Magdalena. Avilés. Asturias En el mundo material, además de los enlaces entre átomos existen otras interacciones, más débiles, pero lo suficientemente intensas
Interacciones químicas de no enlace IES La Magdalena. Avilés. Asturias En el mundo material, además de los enlaces entre átomos existen otras interacciones, más débiles, pero lo suficientemente intensas
Fisiología a Vegetal. Ciencia: Proceso de diseño de analogías o modelos (semejanzas) para permitirnos comprender la naturaleza.
 Fisiología a Vegetal Es una ciencia cuyo objeto de estudio son los procesos vitales que ocurren en la planta. Estudia como funcionan las plantas. Qué ocurre en ellas para que se mantengan vivas?. Ciencia:
Fisiología a Vegetal Es una ciencia cuyo objeto de estudio son los procesos vitales que ocurren en la planta. Estudia como funcionan las plantas. Qué ocurre en ellas para que se mantengan vivas?. Ciencia:
FÍSICA APLICADA Y FISICOQUÍMICA I. Tema 8. Equilibrio de fases en sistemas multicomponentes II
 María del Pilar García Santos GRADO EN FARMACIA FÍSICA APLICADA Y FISICOQUÍMICA I Tema 8 Equilibrio de fases en sistemas multicomponentes II Esquema Tema 8. Equilibrios de fases en sistemas multicomponentes
María del Pilar García Santos GRADO EN FARMACIA FÍSICA APLICADA Y FISICOQUÍMICA I Tema 8 Equilibrio de fases en sistemas multicomponentes II Esquema Tema 8. Equilibrios de fases en sistemas multicomponentes
Departamento de Ciencia y Tecnología QUIMICA 1. Comisión B. Dra. Silvia Alonso Lic. Evelina Maranzana
 Departamento de Ciencia y Tecnología QUIMICA 1 Comisión B Dra. Silvia Alonso (salonso@unq.edu.ar) Lic. Evelina Maranzana (emaran@unq.edu.ar) ACIDEZ-BASICIDAD: EL YING-YANG YANG DE LA QUIMICA Dra Silvia
Departamento de Ciencia y Tecnología QUIMICA 1 Comisión B Dra. Silvia Alonso (salonso@unq.edu.ar) Lic. Evelina Maranzana (emaran@unq.edu.ar) ACIDEZ-BASICIDAD: EL YING-YANG YANG DE LA QUIMICA Dra Silvia
CENTRIFUGACIÓN. Fundamentos. Teoría de la centrifugación
 CENTRIFUGACIÓN Fundamentos. Teoría de la centrifugación Fuerzas intervinientes Tipos de centrífugas Tubular De discos Filtración centrífuga 1 SEDIMENTACIÓN Se basa en la diferencia de densidades entre
CENTRIFUGACIÓN Fundamentos. Teoría de la centrifugación Fuerzas intervinientes Tipos de centrífugas Tubular De discos Filtración centrífuga 1 SEDIMENTACIÓN Se basa en la diferencia de densidades entre
PPT DE APOYO CCNN FÍSICA NIVEL: 8 BÁSICO PROFESORA: GUISLAINE LOAYZA TEMA: LA FUERZA Y LA PRESIÓN
 PPT DE APOYO CCNN FÍSICA NIVEL: 8 BÁSICO PROFESORA: GUISLAINE LOAYZA TEMA: LA FUERZA Y LA PRESIÓN TEMA DE LA CLASE: LA FUERZA Y LA PRESIÓN OBJETIVO DE LA CLASE: Describir la relación entre la fuerza y
PPT DE APOYO CCNN FÍSICA NIVEL: 8 BÁSICO PROFESORA: GUISLAINE LOAYZA TEMA: LA FUERZA Y LA PRESIÓN TEMA DE LA CLASE: LA FUERZA Y LA PRESIÓN OBJETIVO DE LA CLASE: Describir la relación entre la fuerza y
Tipos de Suelos desde el punto de vista de la mecanica de suelos
 Tipos de Suelos desde el punto de vista de la mecanica de suelos Suelos NO cohesivos: Las partículas de suelo no tienden a juntarse ni a adherirse, sus partículas son relativamente grandes, tambien llamados
Tipos de Suelos desde el punto de vista de la mecanica de suelos Suelos NO cohesivos: Las partículas de suelo no tienden a juntarse ni a adherirse, sus partículas son relativamente grandes, tambien llamados
TEMA 21 SISTEMAS DISPERSOS HETEROGENEOS LÍQUIDO-LÍQUIDO: EMULSIONES. Dra. Mireia Oliva i Herrera
 TEMA 21 SISTEMAS DISPERSOS HETEROGENEOS LÍQUIDO-LÍQUIDO: EMULSIONES Dra. Mireia Oliva i Herrera Definición Las emulsiones son sistemas heterogéneos constituidos por dos líquidos no miscibles entre sí,
TEMA 21 SISTEMAS DISPERSOS HETEROGENEOS LÍQUIDO-LÍQUIDO: EMULSIONES Dra. Mireia Oliva i Herrera Definición Las emulsiones son sistemas heterogéneos constituidos por dos líquidos no miscibles entre sí,
Tema 12 Termoquímica. Desprende o absorbe calor? Cuánto calor? Criterio de espontaneidad En qué dirección se produce? Reacciones Químicas
 Tema 1 Estequiometría Cuánto se produce? Cuánto reacciona? Tema 15 Equilibrio Cuándo se alcanza? Cómo modificarlo? Tema 12 Termoquímica Desprende o absorbe calor? Cuánto calor? Criterio de espontaneidad
Tema 1 Estequiometría Cuánto se produce? Cuánto reacciona? Tema 15 Equilibrio Cuándo se alcanza? Cómo modificarlo? Tema 12 Termoquímica Desprende o absorbe calor? Cuánto calor? Criterio de espontaneidad
ESTRUCTURA, VALORACIÓN Y CONTENIDOS DEL EXAMEN DE QUÍMICA DE LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA PARA MAYORES DE 25 AÑOS.
 ESTRUCTURA, VALORACIÓN Y CONTENIDOS DEL EXAMEN DE QUÍMICA DE LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA PARA MAYORES DE 25 AÑOS. ESTRUCTURA La prueba constará de cuatro bloques, existiendo
ESTRUCTURA, VALORACIÓN Y CONTENIDOS DEL EXAMEN DE QUÍMICA DE LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA PARA MAYORES DE 25 AÑOS. ESTRUCTURA La prueba constará de cuatro bloques, existiendo
4. DIFUSION EN SÓLIDO
 4. DIFUSION EN SÓLIDO MATERIALES 13/14 ÍNDICE 1. Conceptos generales. Mecanismos de difusión. 3. Leyes de Fick. 1. Estado estacionario.. Estado no estacionario. 4. Factores de difusión. 5. Aplicaciones
4. DIFUSION EN SÓLIDO MATERIALES 13/14 ÍNDICE 1. Conceptos generales. Mecanismos de difusión. 3. Leyes de Fick. 1. Estado estacionario.. Estado no estacionario. 4. Factores de difusión. 5. Aplicaciones
TEMA II.3. Tensión superficial. Dr. Juan Pablo Torres-Papaqui
 TEMA II.3 Tensión superficial Dr. Juan Pablo Torres-Papaqui Departamento de Astronomía Universidad de Guanajuato DA-UG (México) papaqui@astro.ugto.mx División de Ciencias Naturales y Exactas, Campus Guanajuato,
TEMA II.3 Tensión superficial Dr. Juan Pablo Torres-Papaqui Departamento de Astronomía Universidad de Guanajuato DA-UG (México) papaqui@astro.ugto.mx División de Ciencias Naturales y Exactas, Campus Guanajuato,
Efecto del dieléctrico en un capacitor
 Efecto del dieléctrico en un capacitor La mayor parte de los capacitores llevan entre sus placas conductoras una sustancia no conductora o dieléctrica. Efecto del dieléctrico en un capacitor Un capacitor
Efecto del dieléctrico en un capacitor La mayor parte de los capacitores llevan entre sus placas conductoras una sustancia no conductora o dieléctrica. Efecto del dieléctrico en un capacitor Un capacitor
EQUILIBRIO QUÍMICO. Concentración. C ó D. Tiempo. Las concentraciones no cambian mucho con el tiempo. El Equilibrio es estable A+B C + D
 EQUILIBRIO QUÍMICO En química definimos equilibrio químico como el balance exacto entre dos procesos, uno de los cuales es opuesto a otro. Cuando ocurre una reacción química, los reactivos se va transformando
EQUILIBRIO QUÍMICO En química definimos equilibrio químico como el balance exacto entre dos procesos, uno de los cuales es opuesto a otro. Cuando ocurre una reacción química, los reactivos se va transformando
MÓDULO: CONTAMINACIÓN DE LAS AGUAS TEMA: FILTRACIÓN
 MÓDULO: CONTAMINACIÓN DE LAS AGUAS TEMA: FILTRACIÓN DOCUMENTACIÓN ELABORADA POR: NIEVES CIFUENTES MASTE EN INGENIERÍA MEDIOAMBIENTAL Y GESTION DEL AGUA C. DE LAS AGUAS ÍNDICE 1. INTRODUCCIÓN... 1 2. FILTROS
MÓDULO: CONTAMINACIÓN DE LAS AGUAS TEMA: FILTRACIÓN DOCUMENTACIÓN ELABORADA POR: NIEVES CIFUENTES MASTE EN INGENIERÍA MEDIOAMBIENTAL Y GESTION DEL AGUA C. DE LAS AGUAS ÍNDICE 1. INTRODUCCIÓN... 1 2. FILTROS
MECÁNICA DE FLUIDOS. Docente: Ing. Alba Díaz Corrales
 MECÁNICA DE FLUIDOS Docente: Ing. Alba Díaz Corrales Fecha: 1 de septiembre 2010 Mecánica de Fluidos Tipo de asignatura: Básica Específica Total de horas semanales: 6 Total de horas semestrales: 84 Asignatura
MECÁNICA DE FLUIDOS Docente: Ing. Alba Díaz Corrales Fecha: 1 de septiembre 2010 Mecánica de Fluidos Tipo de asignatura: Básica Específica Total de horas semanales: 6 Total de horas semestrales: 84 Asignatura
Tabla de Contenidos. 1. Introducción... 19. 2. El agua y su importancia en la vivienda... 29. 1.1. Antecedentes... 19. 1.2. Alcances...
 Tabla de Contenidos 1. Introducción... 19 1.1. Antecedentes... 19 1.2. Alcances... 19 1.3. La Humedad... 20 1.3.1. Humedad de lluvia... 20 1.3.2. Humedad accidental... 20 1.3.3. Humedad del suelo... 21
Tabla de Contenidos 1. Introducción... 19 1.1. Antecedentes... 19 1.2. Alcances... 19 1.3. La Humedad... 20 1.3.1. Humedad de lluvia... 20 1.3.2. Humedad accidental... 20 1.3.3. Humedad del suelo... 21
TUTORIAL BÁSICO DE MECÁNICA FLUIDOS
 TUTORIAL BÁSICO DE MECÁNICA FLUIDOS El tutorial es básico pues como habréis visto en muchos de ellos es haceros entender no sólo la aplicación práctica de cada teoría sino su propia existencia y justificación.
TUTORIAL BÁSICO DE MECÁNICA FLUIDOS El tutorial es básico pues como habréis visto en muchos de ellos es haceros entender no sólo la aplicación práctica de cada teoría sino su propia existencia y justificación.
Clase 2: Sustancias puras
 Teórico Física Térmica 2012 02 de Marzo de 2012 Agenda... 1 Referencias 2 Sustancias puras Intro Propiedades independientes 3 Fases Definiciones Cambios (o transiciones) de fase Mezcla Superficies P-v-T
Teórico Física Térmica 2012 02 de Marzo de 2012 Agenda... 1 Referencias 2 Sustancias puras Intro Propiedades independientes 3 Fases Definiciones Cambios (o transiciones) de fase Mezcla Superficies P-v-T
UNIVERSIDAD DE BURGOS Facultad de Ciencias Área de Química Física EL DOMINIO COLOIDAL. El tamaño de la partícula importa!!!
 UNIVERSIDAD DE BURGOS Facultad de Ciencias Área de Química Física EL DOMINIO COLOIDAL El tamaño de la partícula importa!!! Profesores: Rafael Alcalde García Santiago Aparicio Martínez -1 - CIENCIA COLOIDAL
UNIVERSIDAD DE BURGOS Facultad de Ciencias Área de Química Física EL DOMINIO COLOIDAL El tamaño de la partícula importa!!! Profesores: Rafael Alcalde García Santiago Aparicio Martínez -1 - CIENCIA COLOIDAL
ESPUMOGENOS EXTINCION RAPIDA EXCEPCIONAL SEGURIDAD CONTRA REIGNICION GRAN RESISTENCIA A LA MEZCLA CON COMBUSTIBLE GRAN VERSATILIDAD
 ESPUMOGENOS EXTINCION RAPIDA EXCEPCIONAL SEGURIDAD CONTRA REIGNICION GRAN RESISTENCIA A LA MEZCLA CON COMBUSTIBLE GRAN VERSATILIDAD BAJO IMPACTO MEDIOAMBIENTAL GRAN ESTABILIDAD DE ALMACENAJE FACIL DE PROPORCIONAR
ESPUMOGENOS EXTINCION RAPIDA EXCEPCIONAL SEGURIDAD CONTRA REIGNICION GRAN RESISTENCIA A LA MEZCLA CON COMBUSTIBLE GRAN VERSATILIDAD BAJO IMPACTO MEDIOAMBIENTAL GRAN ESTABILIDAD DE ALMACENAJE FACIL DE PROPORCIONAR
Shell Térmico Oil B. Aceite para transferencia térmica
 Shell Térmico B es un aceite mineral puro de baja viscosidad, baja tensión de vapor y alta resistencia a la oxidación desarrollado para transferencia de calor ya sea en sistemas de calefacción cerrados
Shell Térmico B es un aceite mineral puro de baja viscosidad, baja tensión de vapor y alta resistencia a la oxidación desarrollado para transferencia de calor ya sea en sistemas de calefacción cerrados
Introducción. Flujo Eléctrico.
 Introducción La descripción cualitativa del campo eléctrico mediante las líneas de fuerza, está relacionada con una ecuación matemática llamada Ley de Gauss, que relaciona el campo eléctrico sobre una
Introducción La descripción cualitativa del campo eléctrico mediante las líneas de fuerza, está relacionada con una ecuación matemática llamada Ley de Gauss, que relaciona el campo eléctrico sobre una
1.5 Hidrodinámica. Dr. Willy H. Gerber Instituto de Fisica Universidad Austral Valdivia, Chile
 1.5 Hidrodinámica Dr. Willy H. Gerber Instituto de Fisica Universidad Austral Valdivia, Chile Objetivos: Comprender como se genera en los capilares de la dentina las fluctuaciones de presión que originan
1.5 Hidrodinámica Dr. Willy H. Gerber Instituto de Fisica Universidad Austral Valdivia, Chile Objetivos: Comprender como se genera en los capilares de la dentina las fluctuaciones de presión que originan
CINÉTICA QUÍMICA. Dr. Hugo Cerecetto. Prof. Titular de Química
 CINÉTICA QUÍMICA Dr. Hugo Cerecetto Prof. Titular de Química Temario 2) La reacción química: - Nociones de Termoquímica y Termodinámica. Conceptos de entalpía y entropía de reacción. Energía libre. Espontaneidad
CINÉTICA QUÍMICA Dr. Hugo Cerecetto Prof. Titular de Química Temario 2) La reacción química: - Nociones de Termoquímica y Termodinámica. Conceptos de entalpía y entropía de reacción. Energía libre. Espontaneidad
LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO.
 LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO. Prácticamente todos los elementos conocidos, metales y no metales, reaccionan o son oxidados por el oxígeno formando
LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO. Prácticamente todos los elementos conocidos, metales y no metales, reaccionan o son oxidados por el oxígeno formando
Unidad 16: Temperatura y gases ideales
 Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
Resultado de aprendizaje:
 Objetivo: Describir composición y arquitectura de las membranas biológicas Resultado de aprendizaje: Explicar la dinámica de las membranas biologicas y su implicación funcional. INTRODUCCION La mayoría
Objetivo: Describir composición y arquitectura de las membranas biológicas Resultado de aprendizaje: Explicar la dinámica de las membranas biologicas y su implicación funcional. INTRODUCCION La mayoría
DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4
 Universidad Tecnológica Nacional Facultad Regional La Plata DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4 Descenso crioscópico Objeto de la experiencia:
Universidad Tecnológica Nacional Facultad Regional La Plata DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4 Descenso crioscópico Objeto de la experiencia:
Química. Equilibrio ácido-base Nombre:
 Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO
 PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
SISTEMAS DE PROTECCION CONTRA INCENDIOS EN AEROGENERADORES. PONENTE: D. Antonio Tortosa
 SISTEMAS DE PROTECCION CONTRA INCENDIOS EN AEROGENERADORES PONENTE: D. Antonio Tortosa Quienes somos y que hacemos Una Empresa con 30 años de antigüedad en el sector Instaladora y Mantenedora de Protección
SISTEMAS DE PROTECCION CONTRA INCENDIOS EN AEROGENERADORES PONENTE: D. Antonio Tortosa Quienes somos y que hacemos Una Empresa con 30 años de antigüedad en el sector Instaladora y Mantenedora de Protección
Profesor: Carlos Gutiérrez Arancibia. Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares
 Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Electricidad y calor. Dr. Roberto Pedro Duarte Zamorano. Departamento de Física
 Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea.
 Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea. Mezcla de aceite y agua Mezcla de hielo y agua Las sustancias existen
Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea. Mezcla de aceite y agua Mezcla de hielo y agua Las sustancias existen
TEMA 4: OPTICA. s, y s, y Espejos y lentes FINALIDAD: dado un objeto imagen
 4.2.- Espejos y lentes FINALIDAD: dado un objeto imagen s, y s, y Objeto o imagen real: aquél para el cual los rayos de luz se cruzan de forma real. El punto de corte se puede recoger en una pantalla Figura
4.2.- Espejos y lentes FINALIDAD: dado un objeto imagen s, y s, y Objeto o imagen real: aquél para el cual los rayos de luz se cruzan de forma real. El punto de corte se puede recoger en una pantalla Figura
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López.
 Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
ADAPTACIÓN CURRICULAR TEMA 11 CIENCIAS NATURALES 2º E.S.O
 ADAPTACIÓN CURRICULAR TEMA 11 CIENCIAS NATURALES 2º E.S.O Calor y temperatura 1ª) Qué es la energía térmica? La energía térmica es la energía que posee un cuerpo (o un sistema material) debido al movimiento
ADAPTACIÓN CURRICULAR TEMA 11 CIENCIAS NATURALES 2º E.S.O Calor y temperatura 1ª) Qué es la energía térmica? La energía térmica es la energía que posee un cuerpo (o un sistema material) debido al movimiento
Acuerdo 286. Química. Disoluciones. Recopiló: M.C. Macaria Hernández Chávez
 Acuerdo 286 Química Disoluciones Recopiló: M.C. Macaria Hernández Chávez Disolución: Es una mezcla homogénea de dos o más sustancias. La sustancia que se encuentra en mayor proporción se llama disolvente
Acuerdo 286 Química Disoluciones Recopiló: M.C. Macaria Hernández Chávez Disolución: Es una mezcla homogénea de dos o más sustancias. La sustancia que se encuentra en mayor proporción se llama disolvente
Los coagulantes neutralizan las cargas eléctricas repulsivas, y permiten que se aglomeren formando flóculos, que sedimentarán.. Los floculantes facili
 4.3. SEPARACIÓN DE FASES SÓLIDO-LÍQUIDO Separación sólido-líquido física Separador S/L Fracción líquida Fracción sólida Proceso físico que permite separar los sólidos contenidos en unas deyecciones de
4.3. SEPARACIÓN DE FASES SÓLIDO-LÍQUIDO Separación sólido-líquido física Separador S/L Fracción líquida Fracción sólida Proceso físico que permite separar los sólidos contenidos en unas deyecciones de
LABORATORIO DE FENÓMENOS COLECTIVOS
 LABORATORIO DE FENÓMENOS COLECTIVOS LA VISCOSIDAD DE LOS LÍQUIDOS CRUZ DE SAN PEDRO JULIO CÉSAR RESUMEN La finalidad de esta práctica es la determinación de la viscosidad de diferentes sustancias (agua,
LABORATORIO DE FENÓMENOS COLECTIVOS LA VISCOSIDAD DE LOS LÍQUIDOS CRUZ DE SAN PEDRO JULIO CÉSAR RESUMEN La finalidad de esta práctica es la determinación de la viscosidad de diferentes sustancias (agua,
