PRÁCTICA 4: DETERMINACIÓN DE LA TENSIÓN SUPERFICIAL DE MEZCLAS HIDROETANÓLICAS POR EL MÉTODO DE DU NOUY
|
|
|
- Juan José Ortíz Cruz
- hace 6 años
- Vistas:
Transcripción
1 PRÁCTICA 4: DETERMINACIÓN DE LA TENSIÓN SUPERFICIAL DE MEZCLAS HIDROETANÓLICAS POR EL MÉTODO DE DU NOUY Práctica 4: Determinación de la Tensión Superficial de Mezclas Hidroetanólicas por el Método de Du Nouy Objetivos. La práctica tiene como objeto: La determinación de la tensión superficial (γ) de mezclas binarias etanol-agua. Establecer una ecuación para la variación de γ con la concentración de etanol en disoluciones acuosas. Determinación aproximada del exceso superficial de etanol y del área media de una molécula superficial Revisión: Introducción La energía media de las moléculas situadas en la superficie de un líquido es diferente de la energía de las moléculas situadas en el seno de la fase líquida. Para las moléculas superficiales, la resultante de las fuerzas atractivas no es nula y está dirigida perpendicularmente a la superficie hacia el interior del líquido. Experimentalmente se ha comprobado que para aumentar la superficie de un líquido es necesario realizar un trabajo que es proporcional al incremento del área superficial: dw=γda (1) El coeficiente γ es la tensión superficial del líquido, y es siempre positiva e independiente del área A. De acuerdo con la ecuación 1, la tensión superficial se puede medir como el trabajo realizado por unidad de área (J m -2 ), lo cual es equivalente a medir la fuerza por unidad de longitud (N m -1 ): γ = F l (2) En el método de Du Nouy, se utiliza un dinamómetro de torsión para medir la fuerza necesaria para separar un anillo metálico de la superficie de un líquido. La fuerza es ejercida contra la tensión superficial del líquido y actúa a lo largo de la circunferencia del anillo. En la ecuación 2, la longitud es igual al doble de la circunferencia del anillo, ya que el líquido está en contacto tanto con el interior como con el exterior del mismo: l=2 2πr. Este método requiere un factor de corrección empírico, f, para tener en cuenta la forma del líquido elevado y el grosor del anillo. Con todas estas consideraciones podemos escribir: γ = f F 4π r (3) El diámetro del anillo metálico utilizado es: 2r = mm. Laboratorio Química Física II Grado en Química
2 2. Procedimiento Experimental 1. En la Figura 1 se muestra el dispositivo utilizado en el método de Du Nouy. El anillo de medida ha de estar escrupulosamente limpio. Por tanto, cogiendo el anillo siempre por la horquilla, primero límpielo con alcohol para desengrasarlo y después lávelo con agua destilada y escúrralo. Esta operación ha de realizarse con mucho cuidado, ya que la soldadura entre el anillo y la horquilla es muy frágil y puede romperse con facilidad. El anillo se cuelga del brazo izquierdo del dinamómetro de torsión mediante un hilo de seda que se ata a la horquilla del anillo. El dinamómetro se calibra (ajuste a cero) situando el indicador de la escala en la posición 0 y el peso del anillo se compensa con el botón de ajuste (situado en la parte posterior de la escala de medida) de manera que el brazo de la balanza quede en la zona blanca entre las marcas. En esta posición el brazo está nivelado. Para realizar la medida se procede de la siguiente manera. El líquido bajo investigación se vierte en la cubeta de vidrio limpia. La cubeta se sitúa sobre la plataforma móvil, la cual se eleva hasta que el anillo se sumerge en el líquido y se nivela el brazo girando el indicador de la escala hacia la derecha. Entonces, giramos muy lentamente el indicador de la escala hacia la derecha y al mismo tiempo bajamos la plataforma de forma que el brazo se mantenga continuamente nivelado (zona blanca entre las marcas). En el instante en el que el anillo se libera de la superficie líquida, se anota la lectura de la escala que corresponde a la fuerza de separación en mn. 2. Utilizando la técnica descrita en el apartado anterior, realizamos una serie de experimentos para determinar la tensión superficial de diferentes mezclas etanol-agua a temperatura ambiente. A partir de agua, se añade sucesivamente diferentes volúmenes de etanol absoluto con el fin de conseguir las mezclas que se indican en la tabla (SERIE 1). En una segunda serie de experimentos, se repite la operación pero partiendo de
3 Práctica 4: Determinación de la Tensión Superficial de Mezclas Hidroetanólicas por el Método de Du Nouy etanol y añadiendo agua (SERIE 2). Es conveniente repetir tres veces cada una de las medidas. 3. Mida la temperatura de las mezclas. Tabla 1. Volúmenes de etanol y agua en las series de mezclas a realizar. Serie1: 100 ml de H 2 O añadiendo x ml de etanol Serie2: 100 ml de etanol añadiendo x ml de H 2 O Medida x ml EtOH Medida x ml de H2O Laboratorio Química Física II Grado en Química
4 3. Cuestiones previas 1. Busque en la bibliografía el valor de la tensión superficial del agua y del etanol absoluto entre 20 y 30 ºC. 2. Busque en la bibliografía el valor de la densidad de las disoluciones de agua y de etanol absoluto entre 20 y 30 ºC. Sugerencia: Puede conectar con ChemNetBase mediante conexión por VPN si lo realiza desde fuera de la UVEG. 4. Cuestiones post-laboratorio 1. Calcule el valor del factor de corrección f a partir de la tensión superficial del agua para la serie 1 y del etanol absoluto para la serie 2 a la temperatura de la disolución. Calcule la tensión superficial de las mezclas de las dos series de experiencias empleando la ecuación (3). 2. Represente γ frente a la fracción volumétrica (recuerde que los volúmenes de agua y etanol no son aditivos), y, a la fracción másica de etanol. Compare ambas gráficas. 3. Calcule la concentración molar (c 2 ) de etanol en cada una de las mezclas y represente la gráfica de γ vs c 2 y, sólo para las disoluciones más diluidas, encuentre la función γ=γ(c 2 ) que mejor ajuste los resultados obtenidos. 4. La ecuación empírica de Szyszkowsky da la tensión superficial de disoluciones acuosas diluidas de compuestos orgánicos como: o equivalentemente γ = γ 0 α ln( 1+ β c 2 ) (4) γ = γ 0 RT Γ ln( 1+ Kc 2 ) (5) donde γ 0 es la tensión superficial del agua pura, c 2 la concentración del soluto; T la temperatura, K la constante de equilibrio entre etanol en disolución y etanol adsorbido en la superficie, y Γ, es la concentración superficial de exceso máxima de EtOH en la interfase (concentración máxima de moléculas por unidad de superficie). α y β son constantes características del compuesto orgánico. Compruebe si los valores de γ obtenidos se ajustan a este tipo de ecuación 4 y si es el caso, determine los mejores valores de α y β; a partir de ellos mediante la ecuacion 5 determine Γ y K para el etanol. 5. En el supuesto de que las mezclas hidroetanólicas se comporten como disoluciones ideales, calcule para algunas de las mezclas el exceso de concentración superficial de etanol, Γ y el área media ocupada por una molécula de etanol en la superficie (σ).
5 Práctica 4: Determinación de la Tensión Superficial de Mezclas Hidroetanólicas por el Método de Du Nouy # Kc & Γ = Γ % ( (6) $ 1+ Kc ' σ = 1 Γ N A (7) Recuerde que la isoterma de adsorción (relativa) de Gibbs es: Γ = n σ 2 A = $ γ ' & ) % µ 2 ( T (8) y que para las disoluciones ideales el potencial químico del soluto, µ 2, viene dado por: µ 2 =µ0,2+rtln(c 2 ) (9) En la ecuación 8, nσ,2 es el número de moles de soluto adsorbidos en la superficie de área A. Por tanto, Γ se define como la concentración superficial de exceso. (A veces, Γ se escribe como Γ 21 ). 6. En el modelo de Langmuir se considera que el equilibrio de adsorción de una especie sobre una superficie de cualquier naturaleza (gases sobre sólidos o solutos tensioactivos en interfases fluidas) resulta del balance de dos procesos cinéticos competitivos: adsorción y desorción. Suponiendo que ambos procesos siguen cinéticas de primer orden, se obtiene la isoterma de adsorción de Langmuir: K = θ c 2 (1 θ) (10) donde K es la constante de equilibrio de adsorción-desorción, c es la 2 concentración del soluto en la disolución y Θ es la fracción de moléculas adsorbidas en la superficie, que se define como el cociente entre el número de moléculas adsorbidas en la superficie (N) y el máximo número de moléculas que poden ser adsorbidas (N ): θ = N N = N A N A = Γ Γ (11) a) Compruebe que la sustitución de la ecuación 11 en la isoterma de adsorción de Langmuir (10) conduce a la ecuación 6. b) Compruebe que la combinación de las isotermas de adsorción de Gibbs y de Langmuir conduce a una ecuación, la ecuación de estado de Langmuir (5), que es equivalente a la ecuación empírica de Szyszkowsky y, por tanto, pueden identificarse las constantes de la ecuación 4 con las de la 5, β = K y α=γ RT. 7. El comportamiento de algunas substancias adsorbidas en la interfase responde a una ecuación de estado análoga a la de un gas ideal en dos dimensiones (p=crt): Laboratorio Química Física II Grado en Química
6 Π = Γ RT (12) donde Γ es la concentración superficial y Π = γ o -γ, es la presión superficial (fuerza por unidad de longitud). Represente Π frente a Γ ideal y a Γ real (ecuación 6) y compruebe si en el caso del etanol se cumple esta ecuación de estado y, en cualquier caso, señale en qué región debería de cumplirse mejor. Γ ideal = Π RT = γ o γ RT (13) Material Material por pareja: 1 cristalizador de vidrio 500 ml. 1 vaso de precipitados de 100 ml. 1 montaje de dinamómetro de torsión con plataforma móvil. 1 anillo para la medida de la tensión superficial. Material compartido: 1 pipeta 1 ml. 1 pipeta 5 ml. 1 termómetro. 4 buretas de 50 ml con depósito. Productos: Agua destilada. Etanol absoluto. Referencias [1] G.W. Castellan. Físicoquímica. Addison-Wesley. [2] W.J. Moore. Química Física, volumen I. Urmo, Bilbao, [3] M. Díaz-Peña y A. Roig-Muntaner. Química Física, volumen 2. Alahambra Universidad, Madrid, [4] J. Bertrán y J. Núñez-Delgado. Química Física. Ariel Ciencia, [5] E.R. Boyko y J.F. Belliveua. J. Chem. Educ., 63: , 1986.
VOLUMEN MOLAR PARCIAL DE UNA MEZCLA BINARIA
 Práctica VOLUMEN MOLAR PARCIAL DE UNA MEZCLA BINARIA. INTRODUCCIÓN Las magnitudes termodinámicas como la entropía S, energía interna E, volumen V ó entalpía H son magnitudes extensivas, que dependen de
Práctica VOLUMEN MOLAR PARCIAL DE UNA MEZCLA BINARIA. INTRODUCCIÓN Las magnitudes termodinámicas como la entropía S, energía interna E, volumen V ó entalpía H son magnitudes extensivas, que dependen de
Introducción a la Física Experimental Guía de la experiencia Determinación de la tensión superficial de un. Método del anillo o de Du Nouy.
 Introducción a la Física Experimental Guía de la experiencia Determinación de la tensión superficial de un líquido. Método del anillo o de Du Nouy. Departamento de Física Aplicada. Universidad de Cantabria.
Introducción a la Física Experimental Guía de la experiencia Determinación de la tensión superficial de un líquido. Método del anillo o de Du Nouy. Departamento de Física Aplicada. Universidad de Cantabria.
Determinación de la Masa Molar del Magnesio
 Determinación de la Masa Molar del Magnesio Introducción teórica Como en muchas reacciones químicas, los reactivos o sus productos o ambos son gases, es más común medir éstos en función del volumen usando
Determinación de la Masa Molar del Magnesio Introducción teórica Como en muchas reacciones químicas, los reactivos o sus productos o ambos son gases, es más común medir éstos en función del volumen usando
QUÉ ES LA TEMPERATURA?
 1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
CINÉTICA QUÍMICA DETERMINACIÓN DEL ORDEN DE REACCIÓN Y ENERGÍA DE ACTIVACIÓN
 II PRÁCTICA 2 CINÉTICA QUÍMICA DETERMINACIÓN DEL ORDEN DE REACCIÓN Y ENERGÍA DE ACTIVACIÓN En esta experiencia comprobaremos la influencia de la concentración de los reactivos, de la temperatura, y de
II PRÁCTICA 2 CINÉTICA QUÍMICA DETERMINACIÓN DEL ORDEN DE REACCIÓN Y ENERGÍA DE ACTIVACIÓN En esta experiencia comprobaremos la influencia de la concentración de los reactivos, de la temperatura, y de
CINÉTICA. FACTORES QUE AFECTAN LA VELOCIDAD DE UNA REACCIÓN QUÍMICA
 1. INTRODUCCION El área de la química que estudia la velocidad de las reacciones es llamada Cinética Química. La velocidad de reacción se refiere al cambio de concentración de un reactivo o producto en
1. INTRODUCCION El área de la química que estudia la velocidad de las reacciones es llamada Cinética Química. La velocidad de reacción se refiere al cambio de concentración de un reactivo o producto en
OBJETIVO Aprender a preparar disoluciones de concentración dada, ya que la mayor parte de las reacciones químicas tienen lugar en forma de disolución.
 OBJETIVO Aprender a preparar disoluciones de concentración dada, ya que la mayor parte de las reacciones químicas tienen lugar en forma de disolución. FUNDAMENTO TEÓRICO Una disolución es una mezcla homogénea
OBJETIVO Aprender a preparar disoluciones de concentración dada, ya que la mayor parte de las reacciones químicas tienen lugar en forma de disolución. FUNDAMENTO TEÓRICO Una disolución es una mezcla homogénea
PRÁCTICA Nº 1: MEDIDA EXPERIMENTAL DE DENSIDADES
 PRÁCTICA Nº 1: MEDIDA EXPERIMENTAL DE DENSIDADES INTRODUCCIÓN: Las magnitudes son propiedades de los cuerpos que se pueden medir. Existen magnitudes fundamentales, como la MASA, el TIEMPO y la LONGITUD,
PRÁCTICA Nº 1: MEDIDA EXPERIMENTAL DE DENSIDADES INTRODUCCIÓN: Las magnitudes son propiedades de los cuerpos que se pueden medir. Existen magnitudes fundamentales, como la MASA, el TIEMPO y la LONGITUD,
Operaciones Básicas de Transferencia de Materia Problemas Tema 6
 1º.- En una torre de relleno, se va a absorber acetona de una corriente de aire. La sección de la torre es de 0.186 m 2, la temperatura de trabajo es 293 K y la presión total es de 101.32 kpa. La corriente
1º.- En una torre de relleno, se va a absorber acetona de una corriente de aire. La sección de la torre es de 0.186 m 2, la temperatura de trabajo es 293 K y la presión total es de 101.32 kpa. La corriente
PRÁCTICO 3: SOLUCIONES
 Curso de Laboratorio Página: 1/6 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 3: SOLUCIONES Bibliografía: Química, La Ciencia Central, T.L. Brown, H.E.LeMay, Jr., B.Bursten; Ed. Prentice-Hall Hispanoamericana,
Curso de Laboratorio Página: 1/6 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 3: SOLUCIONES Bibliografía: Química, La Ciencia Central, T.L. Brown, H.E.LeMay, Jr., B.Bursten; Ed. Prentice-Hall Hispanoamericana,
EQUILIBRIO QUÍMICO: DETERMINACIÓN DE LA CONSTANTE DE PRODUCTO DE SOLUBILIDAD DEL Ba(NO 3 ) 2
 Página: 1/5 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 9: EQUILIBRIO QUÍMICO: DETERMINACIÓN DE LA CONSTANTE DE PRODUCTO DE SOLUBILIDAD DEL Ba(NO 3 ) 2 Bibliografía: Química, La Ciencia Central, T.L. Brown,
Página: 1/5 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 9: EQUILIBRIO QUÍMICO: DETERMINACIÓN DE LA CONSTANTE DE PRODUCTO DE SOLUBILIDAD DEL Ba(NO 3 ) 2 Bibliografía: Química, La Ciencia Central, T.L. Brown,
LABORATORIO 6. TITULO : Propiedades de los Gases
 37 LABORATORIO 6. TITULO : Propiedades de los Gases OBJETIVOS: Demostrar la ley de difusión de los gases (ley de Graham) Comparar la velocidad de difusión de los gases con la de los líquidos. MATERIALES
37 LABORATORIO 6. TITULO : Propiedades de los Gases OBJETIVOS: Demostrar la ley de difusión de los gases (ley de Graham) Comparar la velocidad de difusión de los gases con la de los líquidos. MATERIALES
Capítulo 10. Efectos de superficie. Sistema respiratorio
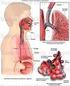 Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Determinación de la concentración micelar crítica (cmc) y grado de disociación (α) de un tensioactivo iónico mediante medidas de conductividad
 Determinación de la concentración micelar crítica (cmc) y grado de disociación (α) de un tensioactivo iónico mediante medidas de conductividad OBJETIVO: Determinación de la concentración micelar crítica
Determinación de la concentración micelar crítica (cmc) y grado de disociación (α) de un tensioactivo iónico mediante medidas de conductividad OBJETIVO: Determinación de la concentración micelar crítica
Unidad 16: Temperatura y gases ideales
 Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico.
 FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico. OBJETIVOS 1. Reconocer las etapas del trabajo científico y elaborar informes
FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico. OBJETIVOS 1. Reconocer las etapas del trabajo científico y elaborar informes
PREPARACIÓN DE SOLUCIONES
 1. INTRODUCCION Las soluciones se definen como mezclas homogéneas de dos o más especies moleculares o iónicas. Las soluciones gaseosas son por lo general mezclas moleculares. Sin embargo las soluciones
1. INTRODUCCION Las soluciones se definen como mezclas homogéneas de dos o más especies moleculares o iónicas. Las soluciones gaseosas son por lo general mezclas moleculares. Sin embargo las soluciones
TERMODINÁMICA y FÍSICA ESTADÍSTICA I
 TERMODINÁMICA y FÍSICA ESTADÍSTICA I Tema 1 - LA TEMPERATURA Y OTROS CONCEPTOS BÁSICOS DE LA TERMODINÁMICA Introducción: características generales y objetivos de la termodinámica. Comparación de los criterios
TERMODINÁMICA y FÍSICA ESTADÍSTICA I Tema 1 - LA TEMPERATURA Y OTROS CONCEPTOS BÁSICOS DE LA TERMODINÁMICA Introducción: características generales y objetivos de la termodinámica. Comparación de los criterios
Física y Química de 2º de ESO Tema Alumno/a: Curso:
 Física y Química de 2º de ESO Tema 1 25-11-2016 Alumno/a: Curso: 1. a) Determina el valor de la densidad del metal a partir de la gráfica. (15) b) De qué metal puede tratarse? (utiliza la tabla de datos)
Física y Química de 2º de ESO Tema 1 25-11-2016 Alumno/a: Curso: 1. a) Determina el valor de la densidad del metal a partir de la gráfica. (15) b) De qué metal puede tratarse? (utiliza la tabla de datos)
Práctica No 12. Determinación experimental de la Presión de vapor de un líquido puro
 Práctica No 12 Determinación experimental de la Presión de vapor de un líquido puro 1. Objetivo general: Evaluar la entalpía de vaporización mediante el modelo de Clausius y Clapeyron. 2. Marco teórico:
Práctica No 12 Determinación experimental de la Presión de vapor de un líquido puro 1. Objetivo general: Evaluar la entalpía de vaporización mediante el modelo de Clausius y Clapeyron. 2. Marco teórico:
FÍSICA APLICADA Y FISICOQUÍMICA I. Tema 2. El Primer Principio de la Termodinámica
 María del Pilar García Santos GRADO EN FARMACIA FÍSICA APLICADA Y FISICOQUÍMICA I Tema 2 El Primer Principio de la Termodinámica Esquema Tema 2. Primer Principio de la Termodinámica 2.1 Primer Principio
María del Pilar García Santos GRADO EN FARMACIA FÍSICA APLICADA Y FISICOQUÍMICA I Tema 2 El Primer Principio de la Termodinámica Esquema Tema 2. Primer Principio de la Termodinámica 2.1 Primer Principio
1.- La materia y clasificación. La materia es cualquier cosa que ocupa un espacio y tiene masas Estados: sólido, líquido, gaseoso
 La Química La Química se encarga del estudio de las propiedades de la materia y de los cambios que en ella se producen. La Química es una ciencia cuantitativa y requiere el uso de mediciones. Las cantidades
La Química La Química se encarga del estudio de las propiedades de la materia y de los cambios que en ella se producen. La Química es una ciencia cuantitativa y requiere el uso de mediciones. Las cantidades
1 PRACTICA # 1 PROPIEDADES FISICAS DE LOS FLUIDOS
 1 PRACTICA # 1 PROPIEDADE FIICA DE LO FLUIDO 1.1 DENIDAD Es una propiedad intensiva que se define como la masa (m) por unidad de volumen (V), y es denotada con la letra "ρ", donde: masa de la sustancia
1 PRACTICA # 1 PROPIEDADE FIICA DE LO FLUIDO 1.1 DENIDAD Es una propiedad intensiva que se define como la masa (m) por unidad de volumen (V), y es denotada con la letra "ρ", donde: masa de la sustancia
PRÁCTICA 1 HERRAMIENTAS Y OPERACIONES BÁSICAS EN EL LABORATORIO BIOANALÍTICO
 PRÁCTICA 1 HERRAMIENTAS Y OPERACIONES BÁSICAS EN EL LABORATORIO BIOANALÍTICO INTRODUCCIÓN Todos los instrumentos de medida que se utilizan en el laboratorio tienen algún tipo de escala para medir una magnitud,
PRÁCTICA 1 HERRAMIENTAS Y OPERACIONES BÁSICAS EN EL LABORATORIO BIOANALÍTICO INTRODUCCIÓN Todos los instrumentos de medida que se utilizan en el laboratorio tienen algún tipo de escala para medir una magnitud,
LOS GASES Y LAS DISOLUCIONES. Departamento de Física y Química 3º ESO
 LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
Práctica No 9. Ley Cero de la Termodinámica y su aplicación en El establecimiento de una escala empírica de temperatura.
 Práctica No 9 Ley Cero de la Termodinámica y su aplicación en El establecimiento de una escala empírica de temperatura. 1. Objetivo general: Establecer empíricamente una escala de temperatura, aplicándose
Práctica No 9 Ley Cero de la Termodinámica y su aplicación en El establecimiento de una escala empírica de temperatura. 1. Objetivo general: Establecer empíricamente una escala de temperatura, aplicándose
EQUILIBRIO ENTRE FASES
 UNCUYO FCULTD DE CIENCIS GRRIS Cát. de Química General e Inorgánica EQUILIRIO ENTRE FSES S I S T E M S D E D O S C O M O N E N T E S 2 da RTE INTRODUCCIÓN Efecto de las condiciones externas (,T) sobre
UNCUYO FCULTD DE CIENCIS GRRIS Cát. de Química General e Inorgánica EQUILIRIO ENTRE FSES S I S T E M S D E D O S C O M O N E N T E S 2 da RTE INTRODUCCIÓN Efecto de las condiciones externas (,T) sobre
DETERMINACION DEL PM. DE LA FRUCTOSA
 1. INTRODUCCIÓN Las propiedades coligativas de las soluciones son aquellas que dependen del número (cantidad) pero no del tipo de partículas de soluto en una cantidad dada de disolvente, las principales
1. INTRODUCCIÓN Las propiedades coligativas de las soluciones son aquellas que dependen del número (cantidad) pero no del tipo de partículas de soluto en una cantidad dada de disolvente, las principales
PRÁCTICA 6 CINÉTICA QUÍMICA DETERMINACIÓN DE LA CONSTANTE DE VELOCIDAD DE REACCIÓN EN LA HIDRÓLISIS DEL CLORURO DE TERBUTILO
 PRÁCTICA 6 CINÉTICA QUÍMICA DETERMINACIÓN DE LA CONSTANTE DE VELOCIDAD DE REACCIÓN EN LA HIDRÓLISIS DEL CLORURO DE TERBUTILO OBJETIVO. El alumno aprenderá a comprobar experimentalmente el mecanismo de
PRÁCTICA 6 CINÉTICA QUÍMICA DETERMINACIÓN DE LA CONSTANTE DE VELOCIDAD DE REACCIÓN EN LA HIDRÓLISIS DEL CLORURO DE TERBUTILO OBJETIVO. El alumno aprenderá a comprobar experimentalmente el mecanismo de
Práctica No 5. Capacidad calorífica de un sólido
 Práctica No 5 Capacidad calorífica de un sólido 1. Objetivo general: Determinación de la capacidad calorífica especifica de un sólido en un proceso a presión constante. 2. Objetivos específicos: 1) Identificar
Práctica No 5 Capacidad calorífica de un sólido 1. Objetivo general: Determinación de la capacidad calorífica especifica de un sólido en un proceso a presión constante. 2. Objetivos específicos: 1) Identificar
A continuación se detallan cada una de las propiedades coligativas:
 PREGUNTA (Técnico Profesional) Se prepara una solución con 2 mol de agua y 0,5 mol de un electrolito no volátil. Al respecto, cuál es la presión de vapor a 25 ºC de esta solución, si la presión del agua
PREGUNTA (Técnico Profesional) Se prepara una solución con 2 mol de agua y 0,5 mol de un electrolito no volátil. Al respecto, cuál es la presión de vapor a 25 ºC de esta solución, si la presión del agua
Objetivos: Principal: Investigar las propiedades de un gas a presión constante. Secundario: Determinar la tasa de enfriamiento de un cuerpo.
 ! " # $ %& ' () ) Objetivos: Principal: Investigar las propiedades de un gas a presión constante. Secundario: Determinar la tasa de enfriamiento de un cuerpo. Conceptos a afianzar: Descripción termodinámica
! " # $ %& ' () ) Objetivos: Principal: Investigar las propiedades de un gas a presión constante. Secundario: Determinar la tasa de enfriamiento de un cuerpo. Conceptos a afianzar: Descripción termodinámica
PRÁCTICA Nº 3 PROPIEDADES COLIGATIVAS: DETERMINACIÓN DE LA MASA MOLECULAR DE UN SOLUTO PROBLEMA POR CRIOSCOPIA
 PRÁCTICA Nº 3 PROPIEDADES COLIGATIVAS: DETERINACIÓN DE LA ASA OLECULAR DE UN SOLUTO PROBLEA POR CRIOSCOPIA OBJETIVOS: El objetivo de la práctica es el estudio del efecto que produce la adición de un soluto
PRÁCTICA Nº 3 PROPIEDADES COLIGATIVAS: DETERINACIÓN DE LA ASA OLECULAR DE UN SOLUTO PROBLEA POR CRIOSCOPIA OBJETIVOS: El objetivo de la práctica es el estudio del efecto que produce la adición de un soluto
Titulaciones en Química Analítica. Capítulo 13 CHEM 3320 Rosamil Rey Santos, Ph.D.
 Titulaciones en Química Analítica Capítulo 13 CHEM 3320 Rosamil Rey Santos, Ph.D. Introducción En el análisis volumétrico, la concentración se determina midiendo su capacidad de reaccionar con un reactivo
Titulaciones en Química Analítica Capítulo 13 CHEM 3320 Rosamil Rey Santos, Ph.D. Introducción En el análisis volumétrico, la concentración se determina midiendo su capacidad de reaccionar con un reactivo
EQUILIBRIO QUÍMICO. 1. Equilibrio químico. 2. La constante de equilibrio. 3. EL principio de LeChatelier. Química 2º bachillerato Equilibrio químico 1
 EQUILIBRIO QUÍMICO 1. Equilibrio químico. 2. La constante de equilibrio. 3. EL principio de LeChatelier. Química 2º bachillerato Equilibrio químico 1 0. CONOCIMIENTOS Los conocimientos previos que son
EQUILIBRIO QUÍMICO 1. Equilibrio químico. 2. La constante de equilibrio. 3. EL principio de LeChatelier. Química 2º bachillerato Equilibrio químico 1 0. CONOCIMIENTOS Los conocimientos previos que son
Profesora: Teresa Esparza Araña LA CANTIDAD DE SUSTANCIA EN QUÍMICA. UNIDAD 6: Los gases ideales
 Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla LA CANTIDAD DE SUSTANCIA EN QUÍMICA UNIDAD 6: Los gases ideales 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA DE LA
Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla LA CANTIDAD DE SUSTANCIA EN QUÍMICA UNIDAD 6: Los gases ideales 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA DE LA
Balance de masa con reacción química. Balances de masa con reacción química en reactores discontinuos y continuos.
 Balance de masa con química. Balances de masa con química en reactores discontinuos y continuos. La aparición de una química en un proceso impone las restricciones adicionales dadas por la ecuación estequiométrica
Balance de masa con química. Balances de masa con química en reactores discontinuos y continuos. La aparición de una química en un proceso impone las restricciones adicionales dadas por la ecuación estequiométrica
TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS
 TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS 1. LA MATERIA Y SU ASPECTO Los sistemas materiales, formados por una o varias sustancias, pueden clasificarse en: - Sistemas materiales heterogéneos: presentan
TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS 1. LA MATERIA Y SU ASPECTO Los sistemas materiales, formados por una o varias sustancias, pueden clasificarse en: - Sistemas materiales heterogéneos: presentan
MECANISMOS DISIPATIVOS Y SUS FUERZAS IMPULSORAS
 MECANISMOS DISIPATIVOS Y SUS FUERZAS IMPULSORAS Temas de Biofísica Mario Parisi Bibliografía Capítulo 3: Los Grandes Mecanismos Disipativos y sus Fuerzas Impulsoras Gradiente Variación de una cierta cantidad
MECANISMOS DISIPATIVOS Y SUS FUERZAS IMPULSORAS Temas de Biofísica Mario Parisi Bibliografía Capítulo 3: Los Grandes Mecanismos Disipativos y sus Fuerzas Impulsoras Gradiente Variación de una cierta cantidad
EQUILIBRIO LÍQUIDO-VAPOR PRESIÓN DE VAPOR Y ENTALPÍA DE VAPORIZACIÓN DEL AGUA
 EQUILIBRIO LÍQUIDO-VAPOR PRESIÓN DE VAPOR Y ENTALPÍA DE VAPORIZACIÓN DEL AGUA I. OBJETIVO GENERAL Comprender e interpretar el significado de las variables termodinámicas involucradas en la ecuación de
EQUILIBRIO LÍQUIDO-VAPOR PRESIÓN DE VAPOR Y ENTALPÍA DE VAPORIZACIÓN DEL AGUA I. OBJETIVO GENERAL Comprender e interpretar el significado de las variables termodinámicas involucradas en la ecuación de
Física y Química 1ºBachillerato Ejemplo Examen. Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Ioduro de Calcio:
 Física y Química 1ºBachillerato Ejemplo Examen Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Óxido Fosfórico: Silano: Carburo Potásico: Ácido perclórico: Fosfato de Sodio: Hidruro
Física y Química 1ºBachillerato Ejemplo Examen Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Óxido Fosfórico: Silano: Carburo Potásico: Ácido perclórico: Fosfato de Sodio: Hidruro
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA DEPARTAMENTO DE FISICOQUÍMICA GUÍA DE ESTUDIO DE TERMODINÁMICA E.T.
 UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA DEPARTAMENTO DE FISICOQUÍMICA GUÍA DE ESTUDIO DE TERMODINÁMICA E.T. (CLAVE 1212) UNIDAD 1. INTRODUCCIÓN A LA TERMODINÁMICA 1.1 Definición, campo
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA DEPARTAMENTO DE FISICOQUÍMICA GUÍA DE ESTUDIO DE TERMODINÁMICA E.T. (CLAVE 1212) UNIDAD 1. INTRODUCCIÓN A LA TERMODINÁMICA 1.1 Definición, campo
Determinación de entalpías de vaporización
 Prácticas de Química. Determinación de entalpías de vaporización I. Introducción teórica y objetivos........................................ 2 II. Desarrollo experimental...............................................
Prácticas de Química. Determinación de entalpías de vaporización I. Introducción teórica y objetivos........................................ 2 II. Desarrollo experimental...............................................
Cálculo aproximado de la carga específica del electrón Fundamento
 Cálculo aproximado de la carga específica del electrón Fundamento La medida de la carga específica del electrón, esto es, la relación entre su carga y su masa, se realizó por vez primera en los años ochenta
Cálculo aproximado de la carga específica del electrón Fundamento La medida de la carga específica del electrón, esto es, la relación entre su carga y su masa, se realizó por vez primera en los años ochenta
Profesora: Teresa Esparza Araña ASPECTOS CUANTITATIVOS DE LA QUÍMICA. UNIDAD 2: Los gases ideales
 Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla ASPECTOS CUANTITATIVOS DE LA QUÍMICA UNIDAD 2: Los gases ideales ÍNDICE 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA
Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla ASPECTOS CUANTITATIVOS DE LA QUÍMICA UNIDAD 2: Los gases ideales ÍNDICE 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA
DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE FISICOQUIMICA TRABAJO PRACTICO DE LABORATORIO N 2
 Universidad Tecnológica Nacional Facultad Regional La Plata DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE FISICOQUIMICA TRABAJO PRACTICO DE LABORATORIO N 2 TENSION SUPERFICIAL Objeto de la experiencia:
Universidad Tecnológica Nacional Facultad Regional La Plata DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE FISICOQUIMICA TRABAJO PRACTICO DE LABORATORIO N 2 TENSION SUPERFICIAL Objeto de la experiencia:
Flujo de Fluidos: Interacción Sólido-Fluido
 Flujo de Fluidos: Interacción Sólido-Fluido Existen operaciones básicas de separación sólido-fluido que tienen gran aplicación y se presentan en muchos de los procesos industriales: filtración, sedimentación,
Flujo de Fluidos: Interacción Sólido-Fluido Existen operaciones básicas de separación sólido-fluido que tienen gran aplicación y se presentan en muchos de los procesos industriales: filtración, sedimentación,
Práctica No 13. Determinación de la calidad de vapor
 Práctica No 13 Determinación de la calidad de vapor 1. Objetivo general: Determinar la cantidad de vapor húmedo generado a presión atmosférica. 2. Marco teórico: Entalpía del sistema: Si un sistema consiste
Práctica No 13 Determinación de la calidad de vapor 1. Objetivo general: Determinar la cantidad de vapor húmedo generado a presión atmosférica. 2. Marco teórico: Entalpía del sistema: Si un sistema consiste
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1)
 PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1) Un gas es sometido a tres procesos identificados con las letras X, Y y Z. Estos procesos son esquematizados en los gráficos que se presentan
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1) Un gas es sometido a tres procesos identificados con las letras X, Y y Z. Estos procesos son esquematizados en los gráficos que se presentan
ISOTERMAS, HUMEDADES DE MONOCAPA Y CALORES DE SORCIÓN DE AGUA EN GRANOS DE QUINUA Juan de Dios Alvarado
 UNIVERSIDAD TÉCNICA DE AMBATO ECUADOR FACULTAD DE CIENCIA E INGENIERÍA EN ALIMENTOS ISOTERMAS, HUMEDADES DE MONOCAPA Y CALORES DE SORCIÓN DE AGUA EN GRANOS DE QUINUA Juan de Dios Alvarado Congreso Mundial
UNIVERSIDAD TÉCNICA DE AMBATO ECUADOR FACULTAD DE CIENCIA E INGENIERÍA EN ALIMENTOS ISOTERMAS, HUMEDADES DE MONOCAPA Y CALORES DE SORCIÓN DE AGUA EN GRANOS DE QUINUA Juan de Dios Alvarado Congreso Mundial
LABORATORIO DE FENÓMENOS COLECTIVOS
 LABORATORIO DE FENÓMENOS COLECTIVOS LA VISCOSIDAD DE LOS LÍQUIDOS CRUZ DE SAN PEDRO JULIO CÉSAR RESUMEN La finalidad de esta práctica es la determinación de la viscosidad de diferentes sustancias (agua,
LABORATORIO DE FENÓMENOS COLECTIVOS LA VISCOSIDAD DE LOS LÍQUIDOS CRUZ DE SAN PEDRO JULIO CÉSAR RESUMEN La finalidad de esta práctica es la determinación de la viscosidad de diferentes sustancias (agua,
LA MATERIA: ESTADOS DE AGREGACIÓN
 LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO
 PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
PROPIEDADES DE LA MATERIA. Nombre del Alumno: Profesor: Grupo:
 PROPIEDADES DE LA MATERIA Nombre del Alumno: Profesor: Grupo: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeños y habilidades. 1. Identifica problemas, formula preguntas de carácter científico
PROPIEDADES DE LA MATERIA Nombre del Alumno: Profesor: Grupo: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeños y habilidades. 1. Identifica problemas, formula preguntas de carácter científico
Clasifica los siguientes sistemas materiales en elementos, compuestos o mezclas homogéneas o heterogéneas:
 TITULO (edite antes de imprimir) NOMBRE: CURSO: 1) Clasifica los siguientes sistemas materiales en elementos, compuestos o mezclas homogéneas o heterogéneas: Plomo ; acero ; mercurio ; óxido de hierro
TITULO (edite antes de imprimir) NOMBRE: CURSO: 1) Clasifica los siguientes sistemas materiales en elementos, compuestos o mezclas homogéneas o heterogéneas: Plomo ; acero ; mercurio ; óxido de hierro
UNIVERSIDAD POLITÉCNICA DE EL SALVADOR ESCUELA DE FORMACIÓN BÁSICA. FÍSICA II PRÁCTICA 42 EXPANSIÓN VOLUMÉTRICA EN GASES. OBJETIVOS DEL APRENDIZAJE:
 UNIVERSIDAD POLITÉCNICA DE EL SALVADOR ESCUELA DE FORMACIÓN BÁSICA. FÍSICA II PRÁCTICA 42 EXPANSIÓN VOLUMÉTRICA EN GASES. OBJETIVOS DEL APRENDIZAJE: DETERMINAR EL CAMBIO DE LAS DIMENSIONES VOLUMÉTRICAS
UNIVERSIDAD POLITÉCNICA DE EL SALVADOR ESCUELA DE FORMACIÓN BÁSICA. FÍSICA II PRÁCTICA 42 EXPANSIÓN VOLUMÉTRICA EN GASES. OBJETIVOS DEL APRENDIZAJE: DETERMINAR EL CAMBIO DE LAS DIMENSIONES VOLUMÉTRICAS
Química. Equilibrio ácido-base Nombre:
 Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
TRBAJO PRÁCTICO N 5: ph. Objetivo: Determinar el ph de soluciones ácidas y básicas de concentraciones diferentes.
 QUÍMICA GENERAL Y TECNOLÓGICA 2010 TRBAJO PRÁCTICO N 5: ph Objetivo: Determinar el ph de soluciones ácidas y básicas de concentraciones diferentes. Fundamentos Teóricos: La mayoría de las reacciones químicas
QUÍMICA GENERAL Y TECNOLÓGICA 2010 TRBAJO PRÁCTICO N 5: ph Objetivo: Determinar el ph de soluciones ácidas y básicas de concentraciones diferentes. Fundamentos Teóricos: La mayoría de las reacciones químicas
DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4
 Universidad Tecnológica Nacional Facultad Regional La Plata DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4 Descenso crioscópico Objeto de la experiencia:
Universidad Tecnológica Nacional Facultad Regional La Plata DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4 Descenso crioscópico Objeto de la experiencia:
PRÁCTICA NÚMERO 12 DILATACIÓN VOLUMÉTRICA DE UN LÍQUIDO
 PRÁCTICA NÚMERO 12 DILATACIÓN VOLUMÉTRICA DE UN LÍQUIDO I. Objetivo. Observar el fenómeno de la dilatación térmica de un líquido y medir su coeficiente de dilatación volumétrica. II. Material. 1. 50 ml
PRÁCTICA NÚMERO 12 DILATACIÓN VOLUMÉTRICA DE UN LÍQUIDO I. Objetivo. Observar el fenómeno de la dilatación térmica de un líquido y medir su coeficiente de dilatación volumétrica. II. Material. 1. 50 ml
Práctica Módulo de torsión
 Práctica Módulo de torsión Objetivo eterminar el módulo de torsión de varillas de distintos materiales por los métodos estático y dinámico. Material Aparato de torsión representado en la figura, varillas
Práctica Módulo de torsión Objetivo eterminar el módulo de torsión de varillas de distintos materiales por los métodos estático y dinámico. Material Aparato de torsión representado en la figura, varillas
BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA
 BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA Unidad 2: Los gases ideales Teresa Esparza araña 1 Índice 1. Los estados de agregación de la materia a. Los estados de la materia b. Explicación según la teoría
BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA Unidad 2: Los gases ideales Teresa Esparza araña 1 Índice 1. Los estados de agregación de la materia a. Los estados de la materia b. Explicación según la teoría
1. MEDIDA Y MÉTODO CIENTÍFICO
 1. MEDIDA Y MÉTODO CIENTÍFICO 1. Introduce un recipiente con agua caliente en el congelador del frigorífico. Observa y describe lo que sucede con el tiempo. En la superficie libre del agua aparece una
1. MEDIDA Y MÉTODO CIENTÍFICO 1. Introduce un recipiente con agua caliente en el congelador del frigorífico. Observa y describe lo que sucede con el tiempo. En la superficie libre del agua aparece una
Laboratorio de Física para Ingeniería
 Laboratorio de para Ingeniería 1. Al medir la longitud de un cilindro se obtuvieron las siguientes medidas: x [cm] 8,45 8,10 8,40 8,55 8,45 8,30 Al expresar la medida en la forma x = x + x resulta: (a)
Laboratorio de para Ingeniería 1. Al medir la longitud de un cilindro se obtuvieron las siguientes medidas: x [cm] 8,45 8,10 8,40 8,55 8,45 8,30 Al expresar la medida en la forma x = x + x resulta: (a)
6 APENDICE. A. Curvas de Calibración
 6 APENDICE A. Curvas de Calibración Las muestras colectadas en las hidrólisis contenían básicamente carbohidratos como, glucosa, xilosa y arabinosa, entre otros. Se realizaron curvas de calibración para
6 APENDICE A. Curvas de Calibración Las muestras colectadas en las hidrólisis contenían básicamente carbohidratos como, glucosa, xilosa y arabinosa, entre otros. Se realizaron curvas de calibración para
U.D. 2 LA MATERIA. Para describir un cuerpo o un sistema material, necesitamos conocer sus propiedades. Así, distinguimos entre:
 U.D. 2 LA MATERIA 1. Propiedades de la materia La materia, o sistema material, es todo lo que posee una propiedad fundamental llamada masa, y que ocupa un espacio, es decir, un volumen. Para describir
U.D. 2 LA MATERIA 1. Propiedades de la materia La materia, o sistema material, es todo lo que posee una propiedad fundamental llamada masa, y que ocupa un espacio, es decir, un volumen. Para describir
Ecuaciones diferenciales de primer orden: Aplicaciones a la Ingeniería Química
 Lección 7 Ecuaciones diferenciales de primer orden: Aplicaciones a la Ingeniería Química 1 Ecuaciones Diferenciales en Cinética Química Ecuación estequiométrica: o a A b B = p P q Q 0 = a A b B... p P
Lección 7 Ecuaciones diferenciales de primer orden: Aplicaciones a la Ingeniería Química 1 Ecuaciones Diferenciales en Cinética Química Ecuación estequiométrica: o a A b B = p P q Q 0 = a A b B... p P
PRÁCTICA 2: MEDIDORES DE FLUJO
 Universidad Nacional Experimental Francisco De Miranda Área De Tecnología Programa De Ingeniería Química Departamento de Energética Laboratorio de Operaciones Unitarias I PRÁCTICA 2: MEDIDORES DE FLUJO
Universidad Nacional Experimental Francisco De Miranda Área De Tecnología Programa De Ingeniería Química Departamento de Energética Laboratorio de Operaciones Unitarias I PRÁCTICA 2: MEDIDORES DE FLUJO
Tema 5. Aleaciones metálicas. El sistema Fe-C.
 Tema 5. Aleaciones metálicas. El sistema Fe-C. Problemas sobre aleaciones Fe-C, y cinética de las transformaciones (W.D. Callister Ed. Reverté - Cap 9 y 10). 9.47. Cuál es el porcentaje de carbono de un
Tema 5. Aleaciones metálicas. El sistema Fe-C. Problemas sobre aleaciones Fe-C, y cinética de las transformaciones (W.D. Callister Ed. Reverté - Cap 9 y 10). 9.47. Cuál es el porcentaje de carbono de un
PRÁCTICA 1: CONTROL DE CALIBRACIÓN DEL MATERIAL VOLUMÉTRICO. ELABORÓ: Silvia Citlalli Gama González. REVISÓ: Alain Queré Thorent
 PRÁCTICA 1: CONTROL DE CALIBRACIÓN DEL MATERIAL VOLUMÉTRICO. ELABORÓ: Silvia Citlalli Gama González. REVISÓ: Alain Queré Thorent INTRODUCCIÓN: Cuál es la importancia de realizar un control de calibración
PRÁCTICA 1: CONTROL DE CALIBRACIÓN DEL MATERIAL VOLUMÉTRICO. ELABORÓ: Silvia Citlalli Gama González. REVISÓ: Alain Queré Thorent INTRODUCCIÓN: Cuál es la importancia de realizar un control de calibración
DENSIDAD Y PESO ESPECÍFICO
 DENSIDAD Y PESO ESPECÍFICO Adaptación del Experimento Nº 2 de la Guía de Ensayos y Teoría del Error del profesor Ricardo Nitsche, página 43-47. Autorizado por el Autor. Materiales: Cilindros graduados
DENSIDAD Y PESO ESPECÍFICO Adaptación del Experimento Nº 2 de la Guía de Ensayos y Teoría del Error del profesor Ricardo Nitsche, página 43-47. Autorizado por el Autor. Materiales: Cilindros graduados
8. DETERMINACIÓN DE LA DENSIDAD DE UN SÓLIDO
 8. DETERMINACIÓN DE LA DENSIDAD DE UN SÓLIDO OBJETIVO El objetivo de la practica es determinar la densidad de un sólido. Para ello vamos a utilizar dos métodos: Método 1 : Cálculo de la densidad de un
8. DETERMINACIÓN DE LA DENSIDAD DE UN SÓLIDO OBJETIVO El objetivo de la practica es determinar la densidad de un sólido. Para ello vamos a utilizar dos métodos: Método 1 : Cálculo de la densidad de un
10. DETERMINACIÓN DE LA TENSIÓN SUPERFICIAL DE UN LÍQUIDO
 10. DETERMINACIÓN DE LA TENSIÓN SUPERFICIAL DE UN LÍQUIDO OBJETIVO. Determinación del coeficiente de tensión superficial de un líquido problema calibrando previamente el sistema a través de la medida de
10. DETERMINACIÓN DE LA TENSIÓN SUPERFICIAL DE UN LÍQUIDO OBJETIVO. Determinación del coeficiente de tensión superficial de un líquido problema calibrando previamente el sistema a través de la medida de
DILATACIÓN PREGUNTAS PROBLEMAS
 DILATACIÓN 1. Qué es la temperatura? PREGUNTAS PROBLEMAS 1. Dos barras idénticas de fierro (α = 12 x 10-6 /Cº) de 1m de longitud, fijas en uno de sus extremos se encuentran a una temperatura de 20ºC si
DILATACIÓN 1. Qué es la temperatura? PREGUNTAS PROBLEMAS 1. Dos barras idénticas de fierro (α = 12 x 10-6 /Cº) de 1m de longitud, fijas en uno de sus extremos se encuentran a una temperatura de 20ºC si
LAS MEDICIONES FÍSICAS. Estimación y unidades
 LAS MEDICIONES FÍSICAS Estimación y unidades 1. Cuánto tiempo tarda la luz en atravesar un protón? 2. A cuántos átomos de hidrógeno equivale la masa de la Tierra? 3. Cuál es la edad del universo expresada
LAS MEDICIONES FÍSICAS Estimación y unidades 1. Cuánto tiempo tarda la luz en atravesar un protón? 2. A cuántos átomos de hidrógeno equivale la masa de la Tierra? 3. Cuál es la edad del universo expresada
IDENTIFICACIÓN DE LAS PROPIEDADES GENERALES DE LA MATERIA
 NOMBRE: GPO. N.L OBJETIVOS: IDENTIFICACIÓN DE LAS PROPIEDADES GENERALES DE LA MATERIA ü Identificar propiedades de la materia. ü Reconocer que calor y la temperatura son los factores que causan un cambio
NOMBRE: GPO. N.L OBJETIVOS: IDENTIFICACIÓN DE LAS PROPIEDADES GENERALES DE LA MATERIA ü Identificar propiedades de la materia. ü Reconocer que calor y la temperatura son los factores que causan un cambio
Ecuación de estado del gas ideal
 Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES
 PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES Los estudios teóricos y experimentales han permitido establecer, que los líquidos poseen propiedades físicas características. Entre ellas cabe mencionar: la densidad,
PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES Los estudios teóricos y experimentales han permitido establecer, que los líquidos poseen propiedades físicas características. Entre ellas cabe mencionar: la densidad,
Masas atómicas (g/mol): O = 16; S = 32; Zn = 65,4. Sol: a) 847 L; b) 710,9 g; c) 1,01 atm.
 1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
V B. g (1) V B ) g, (2) +ρ B. =( m H. m H (3) ρ 1. ρ B. Aplicando al aire la ecuación de estado de los gases perfectos, en la forma.
 Un globo de aire caliente de volumen =, m 3 está abierto por su parte inferior. La masa de la envoltura es =,87 kg y el volumen de la misma se considera despreciable. La temperatura inicial del aire es
Un globo de aire caliente de volumen =, m 3 está abierto por su parte inferior. La masa de la envoltura es =,87 kg y el volumen de la misma se considera despreciable. La temperatura inicial del aire es
DEPARTAMENTO DE INGENIERÍA QUÍMICA. Laboratorio de Ingeniería Química BALANCE DE ENERGÍA EN ESTADO NO ESTACIONARIO
 DEPARAMENO DE INGENIERÍA QUÍMICA Laboratorio de Ingeniería Química BALANCE DE ENERGÍA EN ESADO NO ESACIONARIO 1. INRODUCCIÓN El sistema al que se va a plantear el balance de energía calorífica consiste
DEPARAMENO DE INGENIERÍA QUÍMICA Laboratorio de Ingeniería Química BALANCE DE ENERGÍA EN ESADO NO ESACIONARIO 1. INRODUCCIÓN El sistema al que se va a plantear el balance de energía calorífica consiste
Respuesta: a) La fracción molar de NaCl es 0,072 b) La concentración másica volumétrica de NaCl es 0,231 g/cc
 Ejercicio 1: La densidad a 4 ºC de una solución acuosa de NaCl al 20% en peso es 1,155 g/cc a) Calcule la fracción molar de NaCl b) Calcule la concentración másica volumétrica de NaCl La masa molecular
Ejercicio 1: La densidad a 4 ºC de una solución acuosa de NaCl al 20% en peso es 1,155 g/cc a) Calcule la fracción molar de NaCl b) Calcule la concentración másica volumétrica de NaCl La masa molecular
PREPARACIÓN Y CONDUCTIVIDAD DE DISOLUCIONES
 PREPARACIÓN Y CONDUCTIVIDAD DE DISOLUCIONES M. C. Q. Alfredo Velásquez Márquez Objetivos de la práctica El alumno: 1. Preparará disoluciones de diferentes concentraciones mediante el manejo del material
PREPARACIÓN Y CONDUCTIVIDAD DE DISOLUCIONES M. C. Q. Alfredo Velásquez Márquez Objetivos de la práctica El alumno: 1. Preparará disoluciones de diferentes concentraciones mediante el manejo del material
So S l o u l c u i c o i n o e n s e
 Soluciones SOLUCIONES mezclas homogéneas de dos sustancias: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA GASEOSA Cuando un sólido se disuelve en un líquido las partículas que lo
Soluciones SOLUCIONES mezclas homogéneas de dos sustancias: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA GASEOSA Cuando un sólido se disuelve en un líquido las partículas que lo
1. Disoluciones una disolución es cualquier mezcla homogénea disolvente soluto Medidas de composición
 1. Disoluciones En general, una disolución es cualquier mezcla homogénea. Por ejemplo, el aire, mezcla de nitrógeno, oxígeno y otros gases en proporciones menores; o el bronce, que es una aleación metálica
1. Disoluciones En general, una disolución es cualquier mezcla homogénea. Por ejemplo, el aire, mezcla de nitrógeno, oxígeno y otros gases en proporciones menores; o el bronce, que es una aleación metálica
15/03/2010. Definición:
 ph Definición: El ph es una medida de la acidez El ph es una medida de la acidez o alcalinidad de una sustancia. Es un valor numérico que expresa la concentración de iones de hidrógeno (H + ). El ph no
ph Definición: El ph es una medida de la acidez El ph es una medida de la acidez o alcalinidad de una sustancia. Es un valor numérico que expresa la concentración de iones de hidrógeno (H + ). El ph no
Fundamentos de Química. Horario de Tutorías
 Fundamentos de Química Segundo Cuatrimestre Horario de Tutorías Martes 12:00-14:00 16:00-19:00 Edificio 24B.Tercera Planta 14/02/2006 Tema 11: Propiedades de las disoluciones 11.1 Definición de disolución
Fundamentos de Química Segundo Cuatrimestre Horario de Tutorías Martes 12:00-14:00 16:00-19:00 Edificio 24B.Tercera Planta 14/02/2006 Tema 11: Propiedades de las disoluciones 11.1 Definición de disolución
UNIDADES DE ESTUDIO Y SUS CONTENIDOS Unidad 1: PROPIEDADES DE LOS FLUIDOS PUROS.
 1. DATOS INFORMATIVOS ASIGNATURA: QUÌMICA-FÌSICA DEPARTAMENTO: CIENCIAS EXACTAS ELEMENTO DE COMPETENCIA: CÓDIGO: EXCT-22318 CARRERAS: PETROQUÌMICA NRC 4548 NIVEL: QUINTO ÁREA DEL CONOCIMIENTO: QUÌMICA
1. DATOS INFORMATIVOS ASIGNATURA: QUÌMICA-FÌSICA DEPARTAMENTO: CIENCIAS EXACTAS ELEMENTO DE COMPETENCIA: CÓDIGO: EXCT-22318 CARRERAS: PETROQUÌMICA NRC 4548 NIVEL: QUINTO ÁREA DEL CONOCIMIENTO: QUÌMICA
 TRABAJO PRÁCTICO N 2 CAMBIOS DE ESTADO SÓLIDO LÍQUIDO GASEOSO Manteniendo constante la presión, a baja temperatura los cuerpos se presentan en forma sólida tal que los átomos se encuentran entrelazados
TRABAJO PRÁCTICO N 2 CAMBIOS DE ESTADO SÓLIDO LÍQUIDO GASEOSO Manteniendo constante la presión, a baja temperatura los cuerpos se presentan en forma sólida tal que los átomos se encuentran entrelazados
TUBO DE KUNDT ONDAS ESTACIONARIAS
 TUBO DE KUNDT ONDAS ESTACIONARIAS 1. OBJETIVO Estudio de ondas acústicas y su propagación en el interior del tubo de Kundt. Cálculo de la velocidad del sonido. 2.- FUNDAMENTO TEÓRICO La resultante de dos
TUBO DE KUNDT ONDAS ESTACIONARIAS 1. OBJETIVO Estudio de ondas acústicas y su propagación en el interior del tubo de Kundt. Cálculo de la velocidad del sonido. 2.- FUNDAMENTO TEÓRICO La resultante de dos
PRACTICA 3: ESPECTROSCOPIA DE FLUORESCENCIA
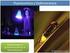 PRACTICA 3: ESPECTROSCOPIA DE FLUORESCENCIA Objetivos. La práctica se divide en dos partes. En la primera, se registran los espectros de absorción, fluorescencia y excitación de un conjunto de colorantes
PRACTICA 3: ESPECTROSCOPIA DE FLUORESCENCIA Objetivos. La práctica se divide en dos partes. En la primera, se registran los espectros de absorción, fluorescencia y excitación de un conjunto de colorantes
EJERCICIOS DE TERMOQUÍMICA
 EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
PROCEDIMIENTO. 1. Si todavía no lo has hecho, ponte los guantes y las gafas de seguridad. Cinética química Página 2
 CINÉTICA QUÍMICA DETERMINACIÓN DEL EFECTO DE LA TEMPERATURA SOBRE LA VELOCIDAD DE REACCIÓN Las reacciones tienen lugar más deprisa a altas temperaturas, porque al incrementar la temperatura también se
CINÉTICA QUÍMICA DETERMINACIÓN DEL EFECTO DE LA TEMPERATURA SOBRE LA VELOCIDAD DE REACCIÓN Las reacciones tienen lugar más deprisa a altas temperaturas, porque al incrementar la temperatura también se
Ley de Charles. Por qué ocurre esto?
 Ley de Charles En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y, observó que cuando se aumentaba la temperatura el
Ley de Charles En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y, observó que cuando se aumentaba la temperatura el
UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA LABORATORIO DE QUÍMICA GENERAL Profesor: Jaime O. Pérez
 UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA LABORATORIO DE QUÍMICA GENERAL Profesor: Jaime O. Pérez Práctica: Determinación de Densidades. Fecha: 24 de noviembre de 2009 DEYMER GÓMEZ CORREA:
UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA LABORATORIO DE QUÍMICA GENERAL Profesor: Jaime O. Pérez Práctica: Determinación de Densidades. Fecha: 24 de noviembre de 2009 DEYMER GÓMEZ CORREA:
Problemas disoluciones
 Problemas disoluciones Determinar la concentración de una disolución expresada de diferentes formas: g/l, % en masa y en volumen, Molaridad y fracción molar Preparar disoluciones a partir de solutos sólidos
Problemas disoluciones Determinar la concentración de una disolución expresada de diferentes formas: g/l, % en masa y en volumen, Molaridad y fracción molar Preparar disoluciones a partir de solutos sólidos
QUÍMICA 2º BACHILLERATO
 DISOLUCIONES: CONCENTRACIÓN DE LAS MISMAS 1.-/ Se disuelven 7 g de cloruro de sodio en 43 g de agua. Determine la concentración centesimal de la disolución, así como la fracción molar de cada componente
DISOLUCIONES: CONCENTRACIÓN DE LAS MISMAS 1.-/ Se disuelven 7 g de cloruro de sodio en 43 g de agua. Determine la concentración centesimal de la disolución, así como la fracción molar de cada componente
13. REACTOR CSTR. X r
 13. REACTOR CSTR 1. OBJETIVOS 1.1. Definir paquetes fluidos que incluyan reacciones de tipo cinético 1.2. Determinar los grados de libertad requeridos para simular un reactor CSTR de tipo cinético 1.3.
13. REACTOR CSTR 1. OBJETIVOS 1.1. Definir paquetes fluidos que incluyan reacciones de tipo cinético 1.2. Determinar los grados de libertad requeridos para simular un reactor CSTR de tipo cinético 1.3.
5. Equilibrio químico
 5. Equilibrio químico Química (1S, Grado Biología) UAM 5. Equilibrio químico Contenidos Equilibrio químico Concepto Condición de uilibro químico Energía libre de Gibbs de reacción Cociente de reacción
5. Equilibrio químico Química (1S, Grado Biología) UAM 5. Equilibrio químico Contenidos Equilibrio químico Concepto Condición de uilibro químico Energía libre de Gibbs de reacción Cociente de reacción
