Ámbito Científico - Tecnolóxico ESA MÓDULO 3. Unidade Didáctica 3 MESTURAS E DISOLUCIÓNS
|
|
|
- José Manuel Serrano Moreno
- hace 6 años
- Vistas:
Transcripción
1 Ámbito Científico - Tecnolóxico ESA MÓDULO 3 Unidade Didáctica 3 MESTURAS E DISOLUCIÓNS
2 Índice da Unidade: 1 - Substancias puras e mesturas Diferenza entre mesturas e compostos Técnicas de separación de mesturas Disolucións O proceso da disolución Solubilidade Concentración das disolucións Masa de soluto por volume de disolución (g/l) Porcentaxe en masa Porcentaxe en volume Como preparar unha disolución?...10
3 1 - SUBSTANCIAS PURAS E MESTURAS Todos os corpos están formados por materia, pero cada corpo pode estar constituído por varias clases distintas de materia. Por iso debemos distinguir entre substancias puras e mesturas. As substancias puras son aquelas nas que a materia da que están compostos está formada por un só tipo de substancia, presentan unha composición definida e unhas propiedades características e invariables que permiten distinguila de calquera outra substancia. Unha das propiedades características dunha substancia pura é a temperatura de cambio de estado: Cando unha substancia pura cambia de estado, a temperatura mantense constante durante todo o cambio de estado. Existen moitas substancias puras, pero a inmensa maioría delas está formada pola combinación de dúas ou máis substancias máis sinxelas. Segundo se poidan descompoñer ou non en substancias máis sinxelas, podemos clasificar as substancias puras en elementos e compostos químicos. Elementos químicos: Son substancias puras que están formadas por un único tipo de átomo e que non se poden descompoñer por procedementos químicos noutras substancias máis sinxelas. Por exemplo, o osíxeno, o hidróxeno, o nitróxeno, o ferro, o cobre, ou o cinc son elementos químicos. Os dous elementos máis abundantes na codia terrestre son o osíxeno e o silicio, e os máis abundantes nos seres vivos son o carbono, o osíxeno, o hidróxeno e o nitróxeno. Compostos químicos: Son substancias puras formadas por dous ou máis elementos combinados sempre en proporcións fixas e que se poden descompoñer mediante procedementos químicos nos elementos que as constitúen Por exemplo, a auga pódese descompoñer, mediante un proceso chamado electrólise, en dúas substancias puras: o hidróxeno e o osíxeno. Esquema da electrólise 3
4 Os compostos poden ser: Orgánicos: son aqueles compostos que proceden dos organismos vivos e que case sempre conteñen carbono. Por exemplo, o alcohol, o leite, o butano e o azucre. Inorgánicos, son todos os demais. Por exemplo a auga, o amoníaco, o cal vivo, o óxido de ferro e o dióxido de carbono. As mesturas son combinacións de dúas ou máis substancias puras, chamadas compoñentes, de xeito que a súa composición non está definida e as súas propiedades dependen da clase e da proporción dos seus compoñentes. As mesturas poden ser de dous tipos: Mesturas homoxéneas: son as que teñen un aspecto uniforme (todo igual) e non se poden diferenciar a simple vista nin con ningún medio óptico as substancias que a compoñen. As propiedades da mestura (cor, sabor, densidade, temperaturas de fusión e ebulición, etc.) son as mesmas en todo o seu volume, en todos os puntos da mestura homoxénea. Exemplo: auga de mar, leite,... Mesturas heteroxéneas: non presentan un aspecto uniforme a simple vista, as partículas das diferentes substancias que a compoñen poden observarse a simple vista ou con instrumentos ópticos de poucos aumentos (lupa, microscopio). Exemplo: o granito Diferenza entre mesturas e compostos Os compoñentes das mesturas poden existir en calquera proporción mentres que os compostos teñen unha composición fixa e invariable. As substancias que constitúen as mesturas poden separarse por métodos físicos pero os elementos que constitúen os compostos só se poden obter mediante procedementos químicos. Os compoñentes que forman as mesturas conservan as súas propiedades; porén, os compostos teñen propiedades características diferentes das dos elementos que os forman por separado. Nas mesturas os valores da densidade e as temperaturas de cambio de estado varían segundo a proporción na que se atopen os seus compoñentes. Polo contrario, en calquera substancia pura estas propiedades son características e constantes. 4
5 1.2. Técnicas de separación de mesturas Posto que as substancias adoitan atoparse mesturadas entre si, moitas veces é preciso separar os compoñentes, sexa para coñecer cales son estes compoñentes ou sexa para utilizalos por separado. Unha técnica de separación é o procedemento que nos permite separar os compoñentes dunha mestura. Para separar os compoñentes dunha mestura heteroxénea podemos recorrer a unha serie de procedementos físicos dependendo das propiedades das substancias mesturadas. Como: Peneirado. Útil para separar sólidos mesturados que teñan grans de distinto tamaño. Por exemplo podemos separar a area fina mesturada con grava, o café da borra, ou o zume de laranxa da polpa. Filtración. Úsase para separar un sólido que estea en suspensión nun líquido. Consiste en facer atravesar a mestura por un filtro que permite o paso do líquido pero non do sólido así as partículas sólidas quedan retidas no filtro e o liquido pasa a través del (filtrado). Decantación. Permite separar un sólido mesturado cun líquido no cal é insoluble ou ben dous líquidos inmiscibles de diferente densidade. Decantación dun sólido: ao remexer unha mestura entre sólido e líquido e deixar a mestura en repouso durante o tempo suficiente, prodúcese a separación dos compoñentes debido á súa diferente densidade. O sólido deposítase no fondo do recipiente, polo que podémolos separar inclinando o vaso e derramando o líquido noutro recipiente; os sólidos quedarán no vaso orixinal. Podemos así separar, por exemplo, auga e area, ou sal de limaduras de ferro se antes disolvemos o sal. Decantación dun líquido: para separar dous líquidos inmiscibles (que non se mesturan entre si), como auga e aceite introdúcese a mestura nun funil de decantación e se deixa repousar ata que os dous líquidos se separen en dúas capas, logo ábrese a billa e péchase cando falte pouco para que saia o outro líquido. area e auga Peneirado area papel filtro auga Decantación Filtración 5
6 Separación magnética. Está indicada cando un dos compoñentes da mestura é un metal ferromagnético (ferro, cobalto, níquel, etc.). Pódense separar estes metais simplemente pasando un imán pola mestura. Por exemplo, podemos separar así limaduras de ferro mesturadas con limaduras de aluminio. Separación magnética Para separar os compoñentes dunha mestura homoxénea temos que recorrer a outras técnicas que se basean nos cambios de estado, como son: Cristalización. Esta técnica é adecuada cando un sólido se disolveu nun líquido; evaporando o líquido o sólido quedará no fondo do recipiente. Se a evaporación é lenta o sólido formará cristais con formas xeométricas. Este procedemento usase, por exemplo, para extraer o sal da auga do mar. Cristalización Destilación. Permite separar os líquidos dunha mestura se ferven a temperaturas bastante diferentes. Ao quentar a mestura evapórase antes a substancia que ferve a temperatura máis baixa. O vapor desprendido arrefríase, condensa a líquido e recóllese aparte. Destilación 6
7 Cromatografía. Esta técnica baséase en que,cando un disolvente arrastra unha mestura de substancias a través dun soporte, estas móvense a diferente velocidade, o que permite separalas. Hainas de varios tipos sendo a cromatografía en papel unha das mais sinxelas. 2 - DISOLUCIÓNS Unha disolución é unha mestura homoxénea de dúas ou máis substancias. Xa que logo, os seus compoñentes non se distinguen a simple vista e o seu aspecto e uniforme. Hai disolucións por todas as partes: o aire, o sangue, medicinas, carburantes, produtos de limpeza, moedas, etc. Nas disolucións hai que distinguir o soluto, o disolvente e a propia disolución. Soluto, é a substancia que se disolve. Disolvente, é a sustancia na que se disolve o soluto. Disolución, é o conxunto formado polo soluto e o disolvente. Habitualmente coñecemos como disolvente o que está en maior proporción; outras veces o disolvente é o que está no mesmo estado de agregación que a disolución final (por exemplo, en liquido + gas gas, o disolvente é o gas). Pero non sempre está claro cal é o soluto e cal o disolvente. Como o soluto e o disolvente poden ser sólidos, líquidos ou gases, temos nove tipos de disolucións posibles: Estado dos compoñentes Estado físico da Soluto Disolvente disolución Cromatografía en papel Gas Gas Gas Aire Líquido Gas Gas Aire húmido, aerosois Exemplos Sólido Gas Gas Partícula de po no aire Gas Líquido Líquido Bebidas gasosas Líquido Líquido Líquido Gasolina, alcohol sanitario Sólido Líquido Líquido Azucre en auga Gas Sólido Sólido Hidróxeno en paladio Líquido Sólido Sólido Sulfato de cobre pentahidrato, amalgamas Sólido Sólido Sólido Aliaxes metálicas (por exemplo o bronce) 7
8 2.1. O proceso da disolución A teoría cinética explica o proceso da disolución: cando se forma unha disolución prodúcense reaxustes entre as posicións das partículas do disolvente e do soluto. Na disolución dun sólido nun líquido prodúcese un derrubamento da estrutura do sólido debido a que as súas partículas son atraídas pola auga. As partículas do sólido distribúense entre as do auga. Sólido (NaCl) Líquido (H 2O) 2.2. Solubilidade Canto soluto se pode disolver nunha cantidade dada de disolvente? Disolución Podemos contestar que unha cantidade máxima. Se imos engadindo soluto (p.e. azucre) pouco a pouco, observamos que ao principio se disolve sen dificultade, pero se seguimos engadindo chega un momento en que o disolvente non é capaz de disolver máis soluto e este permanece en estado sólido, pousado no fondo do recipiente. A cantidade máxima de soluto que se pode disolver recibe o nome de solubilidade e depende de varios factores: De quen sexa o soluto e o disolvente. Hai substancias que se disolven mellor nuns disolventes que noutros. Unha substancia que teña unha solubilidade extremadamente pequena nun determinado disolvente dise que é insoluble ou, se se trata de líquidos, inmiscible. Da temperatura. Normalmente a solubilidade dunha substancia aumenta coa temperatura. Na seguinte páxina web poderás observar unha animación sobre o proceso de disolución: Na seguinte páxina web podes atopar unha práctica interactiva sobre a velocidade das disolucións: 8
9 2.3. Concentración das disolucións Como as disolucións se poden preparar mesturando cantidades variables de soluto e disolvente, cómpre establecer unha forma para poder indicar estas cantidades, o que se coñece col nome de concentración da disolución. Concentración: nunha disolución, é a proporción relativa en que están mesturados o soluto e o disolvente. Unha maneira (moi poco precisa) de indicar a concentración dunha disolución é coas palabras: diluída, concentrada e saturada. Disolución diluída: éo cando ten pouca cantidade de soluto respecto do disolvente, e dicir, cando é moi pouco concentrada. Disolución concentrada: cando a proporción de soluto é grande. Disolución saturada: cando ten tanto soluto que xa non sería posible disolver máis cantidade na disolución; ten a concentración máxima para ese soluto. É fácil entender que expresar a concentración dunha disolución usando estes termos é moi impreciso, por iso a concentración exprésase de forma numérica. Hai moitos xeitos de expresar a concentración e de calculala. Estudaremos só algunhas delas Masa de soluto por volume de disolución (g/l) Calcúlase dividindo a masa do soluto disolta entre o volume da disolución resultante (non o volume do disolvente!). masa de soluto en g concentración = volume de disolución en L Exemplo: disolvemos 30 g de azucre en auga, resultando 250 ml de disolución. concentración = 30 g de azucre L de disolución = 120 g L Este resultado indica que en cada litro de disolución hai disoltos 120 g de azucre. Non debemos confundir a concentración coa cantidade total de disolución Porcentaxe en masa Calculámola dividindo a masa do soluto entre a masa da disolución (soluto + disolvente), multiplicando logo por cen para o expresar como porcentaxe: masa dosoluto % enmasa= masa dadisolución x 100 Exemplo: disolvemos 30 g de azucre en 400 g de leite. Cal e a porcentaxe en masa da disolución? % en masa = 30 g 30 g 400 g x 100 = 8.8 % en masa Este resultado significa que na disolución hai 8.8 gramos de azucre por cada 100 g de disolución. Ou o que e o mesmo, en cada 100 g da disolución hai 8.8 g de azucre e 91.2 g de leite. 9
10 Porcentaxe en volume Adoita empregarse esta forma de expresar a concentración cando os dous compoñentes son líquidos ou gases. Calcúlase dividindo o volume de soluto entre o volume da disolución, multiplicando por cen: % envolume= volumedosoluto volumededisolución x 100 Exemplo: dunha botella de viño albariño de 750 ml, 90 ml son do etanol (alcohol). Cal é a porcentaxe en volume da disolución? 90 ml de alcohol % en volume= 750 ml de disolución x 100 = 12 % en volume Isto significa que en cada 100 ml de viño hai 12 ml de alcohol. Podes repasar a concentración das disolucións nestas páxinas web: Como preparar unha disolución? Para preparar unha disolución cunha concentración determinada: por exemplo 250 ml dunha disolución de sal común cun concentración de 25 g/l procederemos do seguinte modo: 1. Calculamos e pesamos a cantidade de sal necesario: 25 g de sal m sal = 0,25 L de disolución = 6,25 g de sal 1 L de disolución 2. Poñemos nun vaso de precipitados graduado un volume menor que os 250 ml. Engadimos o sal e axitamos ata a súa total disolución. 3. Vertemos a disolución nun recipiente aforado (graduado). 4. Completamos con auga ata chegar o volume pedido (250 ml). Tapamos o recipiente e axitamos. 10
A MATERIA. Propiedades, estados, substancias puras e mesturas. Método de separación de mesturas. Pepe
 A MATERIA Propiedades, estados, substancias puras e mesturas. Método de separación de mesturas Pepe A materia e as súas propiedades esenciais Fragmento dunha rocha A materia integra todo o que nos rodea
A MATERIA Propiedades, estados, substancias puras e mesturas. Método de separación de mesturas Pepe A materia e as súas propiedades esenciais Fragmento dunha rocha A materia integra todo o que nos rodea
SISTEMAS MATERIALES. Departamento de Física y Química 2º ESO
 SISTEMAS MATERIALES Departamento de Física y Química 2º ESO 0. Mapa conceptual MATERIA Sustancias puras Mezclas Heterogéneas Homogéneas Sistemas coloidales Técnicas de separación Disoluciones Soluto Disolvente
SISTEMAS MATERIALES Departamento de Física y Química 2º ESO 0. Mapa conceptual MATERIA Sustancias puras Mezclas Heterogéneas Homogéneas Sistemas coloidales Técnicas de separación Disoluciones Soluto Disolvente
La materia se puede definir como todo aquello que tiene masa y ocupa un volumen.
 Tema 2: LA MATERIA Que es la materia? La materia se puede definir como todo aquello que tiene masa y ocupa un volumen. Clasificación de la materia (criterio: separación) Mezclas Sustancias puras Composición
Tema 2: LA MATERIA Que es la materia? La materia se puede definir como todo aquello que tiene masa y ocupa un volumen. Clasificación de la materia (criterio: separación) Mezclas Sustancias puras Composición
1. La materia: sustancias puras y mezclas
 RESUMEN de la UNIDAD 3. DIVERSIDAD DE LA MATERIA 1. La materia: sustancias puras y mezclas La principal clasificación que se hace de la materia es en sustancias puras y mezclas. Las sustancias puras tienen
RESUMEN de la UNIDAD 3. DIVERSIDAD DE LA MATERIA 1. La materia: sustancias puras y mezclas La principal clasificación que se hace de la materia es en sustancias puras y mezclas. Las sustancias puras tienen
MEZCLAS Y DISOLUCIONES. Física y Química 3º de E.S.O. IES Isidra de Guzmán
 MEZCLAS Y DISOLUCIONES Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción Ya sabes que los sistemas materiales se pueden clasificar según su composición en sustancias puras y mezclas. Las
MEZCLAS Y DISOLUCIONES Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción Ya sabes que los sistemas materiales se pueden clasificar según su composición en sustancias puras y mezclas. Las
2. Métodos de separación de los componentes de una mezcla.
 TEMA 3: Mezclas, disoluciones y sustancias puras. 1. Clasificación de la materia. 2. Métodos de separación de los componentes de una mezcla. 3. Disoluciones. a) Definición. b) Cómo se preparan. c) Concentración.
TEMA 3: Mezclas, disoluciones y sustancias puras. 1. Clasificación de la materia. 2. Métodos de separación de los componentes de una mezcla. 3. Disoluciones. a) Definición. b) Cómo se preparan. c) Concentración.
Apuntes Disoluciones
 Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos a más sustancias. En las disoluciones hay que distinguir el soluto, el disolvente y la propia disolución
Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos a más sustancias. En las disoluciones hay que distinguir el soluto, el disolvente y la propia disolución
TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS
 TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS 1. LA MATERIA Y SU ASPECTO Los sistemas materiales, formados por una o varias sustancias, pueden clasificarse en: - Sistemas materiales heterogéneos: presentan
TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS 1. LA MATERIA Y SU ASPECTO Los sistemas materiales, formados por una o varias sustancias, pueden clasificarse en: - Sistemas materiales heterogéneos: presentan
Tema 7. Las mezclas. Introducción
 Tema 7. Las mezclas Introducción Ya sabes que los sistemas materiales se pueden clasificar según su composición en sustancias puras y mezclas. Las sustancias puras son los elementos y los compuestos que
Tema 7. Las mezclas Introducción Ya sabes que los sistemas materiales se pueden clasificar según su composición en sustancias puras y mezclas. Las sustancias puras son los elementos y los compuestos que
GLÍCIDOS. Carmen Cid Manzano. I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía.
 GLÍCIDOS Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía. CONCEPTO DE GLÍCIDOS Antigamente chamóuselle Hidratos de Carbono, xa que a súa fórmula empírica: C n ( H 2 O
GLÍCIDOS Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía. CONCEPTO DE GLÍCIDOS Antigamente chamóuselle Hidratos de Carbono, xa que a súa fórmula empírica: C n ( H 2 O
Materia. Mezclas Son aquellas que están formados por 2 o más sustancias.
 Qué es la materia? Materia Sustancias Puras Son aquellas que tienen una composición y propiedades DEFINIDAS. Mezclas Son aquellas que están formados por 2 o más sustancias. Elementos No se pueden separar
Qué es la materia? Materia Sustancias Puras Son aquellas que tienen una composición y propiedades DEFINIDAS. Mezclas Son aquellas que están formados por 2 o más sustancias. Elementos No se pueden separar
TÉCNICAS DE SEPARACIÓN DE SUBSTANCIAS CAPÍTULO OBXECTIVOS XERAIS 4.2 SEPARACIÓN DUNHA MESTURA CON SUBSTANCIAS SÓLIDAS
 CAPÍTULO 4 TÉCNICAS DE SEPARACIÓN DE SUBSTANCIAS CAPÍTULO 4 4.1 OBXECTIVOS XERAIS Un dos problemas máis habituais no laboratorio é ter que separar substancias que están mesturadas. A mestura resultante
CAPÍTULO 4 TÉCNICAS DE SEPARACIÓN DE SUBSTANCIAS CAPÍTULO 4 4.1 OBXECTIVOS XERAIS Un dos problemas máis habituais no laboratorio é ter que separar substancias que están mesturadas. A mestura resultante
TEMA 2: LA MATERIA: CÓMO SE PRESENTA?
 TEMA 2: LA MATERIA: CÓMO SE PRESENTA? 1.- La materia: sustancias puras y mezclas. 1.1.- Recordatorio. 1.2.- Sustancias puras. 1.3.- Mezclas. 1.4.- Cómo distinguir un coloide de una mezcla homogénea. 2.-
TEMA 2: LA MATERIA: CÓMO SE PRESENTA? 1.- La materia: sustancias puras y mezclas. 1.1.- Recordatorio. 1.2.- Sustancias puras. 1.3.- Mezclas. 1.4.- Cómo distinguir un coloide de una mezcla homogénea. 2.-
FÍSICA Y QUÍMICA TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS
 Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2015/2016 1 FÍSICA Y QUÍMICA TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS Física y Química 3º Curso Educación Secundaria Obligatoria
Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2015/2016 1 FÍSICA Y QUÍMICA TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS Física y Química 3º Curso Educación Secundaria Obligatoria
2. A codia oceánica e a codia continental A plataforma continental galega
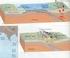 O INTERIOR DA TERRA 1. Aproximación descriptiva ao modelo en capas e dinámico do interior da terra. As capas: Codia. Manto. Núcleo. A Dinámica da terra. As Placas tectónicas. 2. A codia oceánica e a codia
O INTERIOR DA TERRA 1. Aproximación descriptiva ao modelo en capas e dinámico do interior da terra. As capas: Codia. Manto. Núcleo. A Dinámica da terra. As Placas tectónicas. 2. A codia oceánica e a codia
DISOLUCIONES. Líquido (H 2 O)
 DISOLUCIONES Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos a más sustancias. En las disoluciones hay que distinguir el soluto, el disolvente y la
DISOLUCIONES Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos a más sustancias. En las disoluciones hay que distinguir el soluto, el disolvente y la
TEMA 2: LA DIVERSIDAD DE LA MATERIA 3º ESO
 TEMA 2: LA DIVERSIDAD DE LA MATERIA 3º ESO 1. Clasificaciones de los sistema materiales. Un sistema material es una porción de materia que se separa para facilitar su estudio experimental. Como existe
TEMA 2: LA DIVERSIDAD DE LA MATERIA 3º ESO 1. Clasificaciones de los sistema materiales. Un sistema material es una porción de materia que se separa para facilitar su estudio experimental. Como existe
CLASIFICACIÓN DE LA MATERIA
 1. Clasificación de la materia por su aspecto CLASIFICACIÓN DE LA MATERIA La materia homogénea es la que presenta un aspecto uniforme, en la cual no se pueden distinguir a simple vista sus componentes.
1. Clasificación de la materia por su aspecto CLASIFICACIÓN DE LA MATERIA La materia homogénea es la que presenta un aspecto uniforme, en la cual no se pueden distinguir a simple vista sus componentes.
LA MATERIA. - Masa - Volumen -Energía - Carga eléctrica. Propiedades generales
 TEMA 2 La Materia LA MATERIA Propiedades generales - Masa - Volumen -Energía - Carga eléctrica Propiedades características - Densidad - Punto de fusión - Punto de ebullición -Conductividad eléctrica -
TEMA 2 La Materia LA MATERIA Propiedades generales - Masa - Volumen -Energía - Carga eléctrica Propiedades características - Densidad - Punto de fusión - Punto de ebullición -Conductividad eléctrica -
2.2 MATERIAL DUN LABORATORIO QUÍMICO: RECOÑECEMENTO E
 13 Manual Práctico dun laboratorio de Química 2.2 MATERIAL DUN LABORATORIO QUÍMICO: RECOÑECEMENTO E MANEXO MATERIAL METÁLICO Soporte Aro (con noz) Espátula Reixiña Gradiña Placa calefactora ou axitadora
13 Manual Práctico dun laboratorio de Química 2.2 MATERIAL DUN LABORATORIO QUÍMICO: RECOÑECEMENTO E MANEXO MATERIAL METÁLICO Soporte Aro (con noz) Espátula Reixiña Gradiña Placa calefactora ou axitadora
Unidad 2. La materia
 Física y Química Unidad 2: La materia Unidad 2. La materia Índice de contenido 1. Estados de agregación de la materia...3 2. Cambios de estado...4 3. Clasificación de la materia...6 3.1.- Métodos de separación
Física y Química Unidad 2: La materia Unidad 2. La materia Índice de contenido 1. Estados de agregación de la materia...3 2. Cambios de estado...4 3. Clasificación de la materia...6 3.1.- Métodos de separación
1. MATERIA Y SU ASPECTO
 1. MATERIA Y SU ASPECTO El aspecto de un sistema material puede variar según el método de observación. Algunos sistemas materiales como la leche, la sangre o la mantequilla a simple vista parecen uniformes,
1. MATERIA Y SU ASPECTO El aspecto de un sistema material puede variar según el método de observación. Algunos sistemas materiales como la leche, la sangre o la mantequilla a simple vista parecen uniformes,
Escuela del Petróleo - Química
 Escuela del Petróleo - Química 2012 1 Unidad 2 1) Sistema Materiales 2) Materiales Homogéneos y Heterogéneos. a. Separación de las fases b. Sustancia Pura 3) extensivas e intensivas 4) Sistemas dispersos
Escuela del Petróleo - Química 2012 1 Unidad 2 1) Sistema Materiales 2) Materiales Homogéneos y Heterogéneos. a. Separación de las fases b. Sustancia Pura 3) extensivas e intensivas 4) Sistemas dispersos
FÍSICA Y QUÍMICA 2º ESO TEMA VI COMPOSICIÓN DE LA MATERIA
 FÍSICA Y QUÍMICA 2º ESO TEMA VI COMPOSICIÓN DE LA MATERIA 1) MEZCLAS HOMOGÉNEAS Y HETEROGÉNEAS Una mezcla es una composición de sustancias con distintas propiedades. Una mezcla es homogénea si está formada
FÍSICA Y QUÍMICA 2º ESO TEMA VI COMPOSICIÓN DE LA MATERIA 1) MEZCLAS HOMOGÉNEAS Y HETEROGÉNEAS Una mezcla es una composición de sustancias con distintas propiedades. Una mezcla es homogénea si está formada
1º exame, 3ª avaliación
 1º exame, 3ª avaliación 1. Tipos de texto: O diálogo (130) A entrevista (184) Os textos informativos (239) 2. O tecido da lingua: Cohesión: repetición, substitución e deíxe (102) Puntuación (132/158) 3.
1º exame, 3ª avaliación 1. Tipos de texto: O diálogo (130) A entrevista (184) Os textos informativos (239) 2. O tecido da lingua: Cohesión: repetición, substitución e deíxe (102) Puntuación (132/158) 3.
SOLUCIONES SOLIDA LIQUIDA GASEOSA. mezclas homogéneas de dos sustancias: SEGÚN EL ESTADO FISICO DEL SOLVENTE
 Soluciones SOLUCIONES mezclas homogéneas de dos sustancias: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA GASEOSA Cuando un sólido se disuelve en un líquido las partículas que lo
Soluciones SOLUCIONES mezclas homogéneas de dos sustancias: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA GASEOSA Cuando un sólido se disuelve en un líquido las partículas que lo
TEMA 2: DIVERSIDAD DE LA MATERIA
 TEMA 2: DIVERSIDAD DE LA MATERIA 1.- La materia: sustancias puras y mezclas. 1.1.- La materia. 1.1.1.- Estados de agregación de la materia. 1.1.2.- Propiedades generales y características de la materia.
TEMA 2: DIVERSIDAD DE LA MATERIA 1.- La materia: sustancias puras y mezclas. 1.1.- La materia. 1.1.1.- Estados de agregación de la materia. 1.1.2.- Propiedades generales y características de la materia.
CODIFICADORES CIRCUÍTOS COMBINACIONAIS
 1 CIRCUÍTOS COMBINACIONAIS Nos circuítos combinacionais, as saídas dependen directamente dos valor das entradas, non poden almacenar ningunha información, só realizan transformacións nas entradas mediante
1 CIRCUÍTOS COMBINACIONAIS Nos circuítos combinacionais, as saídas dependen directamente dos valor das entradas, non poden almacenar ningunha información, só realizan transformacións nas entradas mediante
Volume dos corpos xeométricos
 Volume dos corpos xeométricos Contidos 1. Volume e capacidade Unidades de volume Capacidade e volume 2. Volume dun prisma Cubo Ortoedro Resto de prismas 3. Volume dunha pirámide Relación entre prisma e
Volume dos corpos xeométricos Contidos 1. Volume e capacidade Unidades de volume Capacidade e volume 2. Volume dun prisma Cubo Ortoedro Resto de prismas 3. Volume dunha pirámide Relación entre prisma e
Materia: es aquello que ocupa un lugar en el espacio y cuyas propiedades percibimos por los sentidos. Es diversa y discontinua.
 Sistemas materiales Materia: es aquello que ocupa un lugar en el espacio y cuyas propiedades percibimos por los sentidos. Es diversa y discontinua. Mezcla Heterogénea: unión de dos o más sustancias de
Sistemas materiales Materia: es aquello que ocupa un lugar en el espacio y cuyas propiedades percibimos por los sentidos. Es diversa y discontinua. Mezcla Heterogénea: unión de dos o más sustancias de
1. Disoluciones una disolución es cualquier mezcla homogénea disolvente soluto Medidas de composición
 1. Disoluciones En general, una disolución es cualquier mezcla homogénea. Por ejemplo, el aire, mezcla de nitrógeno, oxígeno y otros gases en proporciones menores; o el bronce, que es una aleación metálica
1. Disoluciones En general, una disolución es cualquier mezcla homogénea. Por ejemplo, el aire, mezcla de nitrógeno, oxígeno y otros gases en proporciones menores; o el bronce, que es una aleación metálica
ÍNDICE 1 MANUAL BÁSICO 2 TONS DE CHAMADA 2 COMO ESTABLECER UNHA COMUNICACION INTERNA? 2 COMO ESTABLECER UNHA COMUNICACION EXTERNA?
 ÍNDICE ÍNDICE 1 MANUAL BÁSICO 2 TONS DE CHAMADA 2 COMO ESTABLECER UNHA COMUNICACION INTERNA? 2 COMO ESTABLECER UNHA COMUNICACION EXTERNA? 2 COMO ESTABLECER UNHA COMUNICACIÓN COA OPERADORA? 3 PRESTACIÓNS
ÍNDICE ÍNDICE 1 MANUAL BÁSICO 2 TONS DE CHAMADA 2 COMO ESTABLECER UNHA COMUNICACION INTERNA? 2 COMO ESTABLECER UNHA COMUNICACION EXTERNA? 2 COMO ESTABLECER UNHA COMUNICACIÓN COA OPERADORA? 3 PRESTACIÓNS
LÍPIDOS A P A L A B R A L Í P I D O P R O C E D E D O G R E G O L Y P O S, Q U E S I G N I F I C A G R A X A.
 LÍPIDOS A P A L A B R A L Í P I D O P R O C E D E D O G R E G O L Y P O S, Q U E S I G N I F I C A G R A X A. LÍPIDOS Constitúen un grupo moi heteroxéneo de moléculas orgánicas que realizan funcións moi
LÍPIDOS A P A L A B R A L Í P I D O P R O C E D E D O G R E G O L Y P O S, Q U E S I G N I F I C A G R A X A. LÍPIDOS Constitúen un grupo moi heteroxéneo de moléculas orgánicas que realizan funcións moi
MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN.
 MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN. CLASIFICACIÓN DE LA MATERIA: SEGÚN: A. ESTADO DE AGREGACIÓN. B. COMPOSICIÓN. A. ESTADO DE AGREGACIÓN. SE REFIERE A LA FORMA DE INTERACCIÓN ENTRE LAS MOLÉCULAS
MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN. CLASIFICACIÓN DE LA MATERIA: SEGÚN: A. ESTADO DE AGREGACIÓN. B. COMPOSICIÓN. A. ESTADO DE AGREGACIÓN. SE REFIERE A LA FORMA DE INTERACCIÓN ENTRE LAS MOLÉCULAS
Materia es todo aquello que tiene masa y ocupa un lugar en el espacio (tiene volumen). La ciencia que estudia la materia es la Química.
 Alfonso García Materia es todo aquello que tiene masa y ocupa un lugar en el espacio (tiene volumen). La ciencia que estudia la materia es la Química. Un sistema material es una porción de materia. Ejemplos:
Alfonso García Materia es todo aquello que tiene masa y ocupa un lugar en el espacio (tiene volumen). La ciencia que estudia la materia es la Química. Un sistema material es una porción de materia. Ejemplos:
LOS GASES Y LAS DISOLUCIONES. Departamento de Física y Química 3º ESO
 LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
La materia y sus propiedades
 La materia y sus propiedades Las sustancias puras simples: ELEMENTOS QUÍMICOS Los elementos químicos Algunos pueden encontrarse fácilmente en nuestro entorno Hierro (Fe) Cobre (Cu) ASPECTO HOMOGÉNEO Oxígeno
La materia y sus propiedades Las sustancias puras simples: ELEMENTOS QUÍMICOS Los elementos químicos Algunos pueden encontrarse fácilmente en nuestro entorno Hierro (Fe) Cobre (Cu) ASPECTO HOMOGÉNEO Oxígeno
La diversidad de la materia
 3 La diversidad de la materia Contenidos Índice 1 2 3 4 Clasificación de los sistemas materiales Separación de mezclas heterogéneas Las disoluciones Sustancias puras: elementos y compuestos 1. Clasificación
3 La diversidad de la materia Contenidos Índice 1 2 3 4 Clasificación de los sistemas materiales Separación de mezclas heterogéneas Las disoluciones Sustancias puras: elementos y compuestos 1. Clasificación
Ámbito científico tecnolóxico. Números racionais Mesturas e disolucións. Módulo 3 Unidade didáctica 2. Educación a distancia semipresencial
 Educación secundaria para persoas adultas Ámbito científico tecnolóxico Educación a distancia semipresencial Módulo 3 Unidade didáctica 2 Números racionais Mesturas e disolucións Páxina 1 de 52 Índice
Educación secundaria para persoas adultas Ámbito científico tecnolóxico Educación a distancia semipresencial Módulo 3 Unidade didáctica 2 Números racionais Mesturas e disolucións Páxina 1 de 52 Índice
Componentes de una disolución. El disolvente El soluto Concentración de una disolución. concentración solubilidad
 Componentes de una disolución. Todas las disoluciones tienen dos componentes: El disolvente es el componente que se encuentra en mayor proporción. Este componente no cambia de estado. El soluto es el componente
Componentes de una disolución. Todas las disoluciones tienen dos componentes: El disolvente es el componente que se encuentra en mayor proporción. Este componente no cambia de estado. El soluto es el componente
PROPIEDADES DE LA MATERIA. Prof. Jackeline Ruttell torres Química Febrero 2017
 PROPIEDADES DE LA MATERIA Prof. Jackeline Ruttell torres Química Febrero 2017 DEFINICIONES IMPORTANTES Sustancia: materia con composición uniforme y constante Ej. Agua siempre posee dos átomos de hidrógeno
PROPIEDADES DE LA MATERIA Prof. Jackeline Ruttell torres Química Febrero 2017 DEFINICIONES IMPORTANTES Sustancia: materia con composición uniforme y constante Ej. Agua siempre posee dos átomos de hidrógeno
So S l o u l c u i c o i n o e n s e
 Soluciones SOLUCIONES mezclas homogéneas de dos sustancias: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA GASEOSA Cuando un sólido se disuelve en un líquido las partículas que lo
Soluciones SOLUCIONES mezclas homogéneas de dos sustancias: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA GASEOSA Cuando un sólido se disuelve en un líquido las partículas que lo
Clasificación de la materia
 Clasificación de la materia Sustancias Puras Son caracterizados por su composición y propiedades definidas y constantes bajo condiciones determinadas. Sustancias puras: Elementos Son sustancias puras formadas
Clasificación de la materia Sustancias Puras Son caracterizados por su composición y propiedades definidas y constantes bajo condiciones determinadas. Sustancias puras: Elementos Son sustancias puras formadas
SUSTANCIAS PURAS (Repaso) MEZCLAS (Repaso)
 Física y Química 4 ESO DISOLUCIONES Pág. 1 SUSTANCIAS PURAS (Repaso) MEZCLAS (Repaso) Pág. 2 DISOLUCIONES Física y Química 4 ESO DISOLUCIONES CONCEPTO DE DISOLUCIÓN. COMPONENTES DE UNA DISOLUCIÓN. Una
Física y Química 4 ESO DISOLUCIONES Pág. 1 SUSTANCIAS PURAS (Repaso) MEZCLAS (Repaso) Pág. 2 DISOLUCIONES Física y Química 4 ESO DISOLUCIONES CONCEPTO DE DISOLUCIÓN. COMPONENTES DE UNA DISOLUCIÓN. Una
Crear un Blog. Primeiros pasos. XX Semana da Educación. Pontevedra
 Crear un Blog. Primeiros pasos. XX Semana da Educación Pontevedra 2008 http://www.recursosmatematicos.com/galego 1 Crear un blog en Blogger Se queres empezar nisto dos blogs, o mellor é crear un en Blogger,
Crear un Blog. Primeiros pasos. XX Semana da Educación Pontevedra 2008 http://www.recursosmatematicos.com/galego 1 Crear un blog en Blogger Se queres empezar nisto dos blogs, o mellor é crear un en Blogger,
ACTIVIDADES DE PENDIENTES DE FÍSICA Y QUÍMICA DE 3º ESO
 ACTIVIDADES DE PENDIENTES DE FÍSICA Y QUÍMICA DE 3º ESO 1. a) Qué es la Ciencia? Qué es la Física? Qué es la Química? b) Señala qué procesos se estudian la Física y cuáles estudia la Química: a. Descenso
ACTIVIDADES DE PENDIENTES DE FÍSICA Y QUÍMICA DE 3º ESO 1. a) Qué es la Ciencia? Qué es la Física? Qué es la Química? b) Señala qué procesos se estudian la Física y cuáles estudia la Química: a. Descenso
ESTADOS DE AGREGACIÓN DE LA MATERIA
 LA MATERIA LA MATERIA Materia es todo aquello que ocupa un lugar en el espacio y tiene masa. La madera, el agua, el corcho, la sal,.. Son clases diferentes de materia. Las clases de materia que se utilizan
LA MATERIA LA MATERIA Materia es todo aquello que ocupa un lugar en el espacio y tiene masa. La madera, el agua, el corcho, la sal,.. Son clases diferentes de materia. Las clases de materia que se utilizan
Clasifica los siguientes sistemas materiales en elementos, compuestos o mezclas homogéneas o heterogéneas:
 TITULO (edite antes de imprimir) NOMBRE: CURSO: 1) Clasifica los siguientes sistemas materiales en elementos, compuestos o mezclas homogéneas o heterogéneas: Plomo ; acero ; mercurio ; óxido de hierro
TITULO (edite antes de imprimir) NOMBRE: CURSO: 1) Clasifica los siguientes sistemas materiales en elementos, compuestos o mezclas homogéneas o heterogéneas: Plomo ; acero ; mercurio ; óxido de hierro
U.D. 2 LA MATERIA. Para describir un cuerpo o un sistema material, necesitamos conocer sus propiedades. Así, distinguimos entre:
 U.D. 2 LA MATERIA 1. Propiedades de la materia La materia, o sistema material, es todo lo que posee una propiedad fundamental llamada masa, y que ocupa un espacio, es decir, un volumen. Para describir
U.D. 2 LA MATERIA 1. Propiedades de la materia La materia, o sistema material, es todo lo que posee una propiedad fundamental llamada masa, y que ocupa un espacio, es decir, un volumen. Para describir
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
FyQ 1. IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química Unidad Didáctica 2
 Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 2015 2016 Unidad Didáctica 2 Rev 01 Las Disoluciones. Métodos Actuales para el Análisis de Sustancias
Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 2015 2016 Unidad Didáctica 2 Rev 01 Las Disoluciones. Métodos Actuales para el Análisis de Sustancias
Información e instrucións para realizar solicitudes web
 Dirección Xeral de Educación, Formación Profesional e Innovación Educativa Admisión a ciclos de Formación Profesional 2013-2014 Información e instrucións para realizar solicitudes web Páxina 1 de 9 Índice
Dirección Xeral de Educación, Formación Profesional e Innovación Educativa Admisión a ciclos de Formación Profesional 2013-2014 Información e instrucións para realizar solicitudes web Páxina 1 de 9 Índice
03 DISOLUCIONES. 2 Observando la curva de solubilidad del clorato potásico, responder:
 03 DISOLUCIONES 1 Sabemos que cierta disolución tiene una concentración de c = 512 g/l. Si su densidad es1,43 g/l, expresa el valor de su concentración en tanto por ciento. 2 Observando la curva de solubilidad
03 DISOLUCIONES 1 Sabemos que cierta disolución tiene una concentración de c = 512 g/l. Si su densidad es1,43 g/l, expresa el valor de su concentración en tanto por ciento. 2 Observando la curva de solubilidad
Disoluciones Químicas
 Disoluciones Químicas Las disoluciones son mezclas homogéneas de dos o más sustancias, es decir, cuyos componentes no se pueden distinguir a simple vista. Siempre que se esta en presencia de una mezcla
Disoluciones Químicas Las disoluciones son mezclas homogéneas de dos o más sustancias, es decir, cuyos componentes no se pueden distinguir a simple vista. Siempre que se esta en presencia de una mezcla
LOS ESTADOS DE LA MATERIA
 LOS ESTADOS DE LA MATERIA Como ya hemos estudiado, la materia se presenta en cuatro estados físicos: sólido, líquido, gas y plasma. El plasma es el estado de la materia en las estrellas. Una sustancia,
LOS ESTADOS DE LA MATERIA Como ya hemos estudiado, la materia se presenta en cuatro estados físicos: sólido, líquido, gas y plasma. El plasma es el estado de la materia en las estrellas. Una sustancia,
Unidade 4: Pneumática
 Unidade 4: Pneumática Sistemas pneumáticos Elementos dun circuíto pneumático Xeradores e accesorios De transporte Receptores: cilindros (efecto simple e dobre efecto) De distribución: válvulas (distribuidoras
Unidade 4: Pneumática Sistemas pneumáticos Elementos dun circuíto pneumático Xeradores e accesorios De transporte Receptores: cilindros (efecto simple e dobre efecto) De distribución: válvulas (distribuidoras
Qué es la materia? A qué llamamos sustancias? Qué dos clases de propiedades posee la materia? Por qué se llaman propiedades generales?
 La materia es aquello que ocupa un lugar en el espacio y cuyas propiedades percibimos por los sentidos ( vista, tacto...). Todos los objetos que observamos a nuestro alrededor tienen algo en común : es
La materia es aquello que ocupa un lugar en el espacio y cuyas propiedades percibimos por los sentidos ( vista, tacto...). Todos los objetos que observamos a nuestro alrededor tienen algo en común : es
TEMA 2: Diversidad de la materia. T_m[ 2: Div_rsi^[^ ^_ l[ m[t_ri[ 1
 TEMA 2: Diversidad de la materia T_m[ 2: Div_rsi^[^ ^_ l[ m[t_ri[ 1 ESQUEMA DE LA UNIDAD 1.- La materia: sustancias puras y mezclas. 1.1.- La materia. 1.1.1.- Estados de agregación de la materia. 1.1.2.-
TEMA 2: Diversidad de la materia T_m[ 2: Div_rsi^[^ ^_ l[ m[t_ri[ 1 ESQUEMA DE LA UNIDAD 1.- La materia: sustancias puras y mezclas. 1.1.- La materia. 1.1.1.- Estados de agregación de la materia. 1.1.2.-
ROCHAS SEDIMENTARIAS
 ROCHAS SEDIMENTARIAS Minerais das rochas sedimentarias Minerais salinos: a)halita:haluro (NaCl).Branca. Sabor salgado b)anhidrita:caso 4.Cores claras,brillo nacarado a vítreo c)xeso: Sulfato de calcio
ROCHAS SEDIMENTARIAS Minerais das rochas sedimentarias Minerais salinos: a)halita:haluro (NaCl).Branca. Sabor salgado b)anhidrita:caso 4.Cores claras,brillo nacarado a vítreo c)xeso: Sulfato de calcio
Probas de acceso a ciclos formativos de grao superior CSPEA01. Código. Proba de. Economía da empresa. Páxina 1 de 10
 Probas de acceso a ciclos formativos de grao superior Proba de Economía da empresa Código CSPEA01 Páxina 1 de 10 1. Formato da proba Formato A proba constará de 20 cuestións tipo test. As cuestións tipo
Probas de acceso a ciclos formativos de grao superior Proba de Economía da empresa Código CSPEA01 Páxina 1 de 10 1. Formato da proba Formato A proba constará de 20 cuestións tipo test. As cuestións tipo
ELECTRÓNICA DIXITAL. SISTEMAS DE NUMERACIÓN.
 1 ELECTRÓNICA DIXITAL. SISTEMAS DE NUMERACIÓN. A Electrónica Dixital é aquela que traballa con sinais discretos (normalmente tensión no tensión ou 1-0) a diferencia da electrónica analóxica que traballa
1 ELECTRÓNICA DIXITAL. SISTEMAS DE NUMERACIÓN. A Electrónica Dixital é aquela que traballa con sinais discretos (normalmente tensión no tensión ou 1-0) a diferencia da electrónica analóxica que traballa
INFORME SOBRE A POBREZA EN GALICIA
 INFORME SOBRE A POBREZA EN GALICIA Seguimento do indicador de risco de pobreza e exclusión social en Galicia 2009-2014 REDE GALEGA CONTRA A POBREZA (EAPN-Galicia) Outubro 2015 GALICIA TAXA AROPE (TAXA
INFORME SOBRE A POBREZA EN GALICIA Seguimento do indicador de risco de pobreza e exclusión social en Galicia 2009-2014 REDE GALEGA CONTRA A POBREZA (EAPN-Galicia) Outubro 2015 GALICIA TAXA AROPE (TAXA
CLASIFICACIÓN DE LA MATERIA
 CLASIFICACIÓN DE LA MATERIA Clasificación de la materia SUSTACIACIAS PURAS SIMPLES UN SOLO TIPO DE ÁTOMO Mercurio (l) átomo de Hg Cloro(g) átomo de Cl SUSTANCIA PURA COMPUESTA S C O Zn Un solo tipo de
CLASIFICACIÓN DE LA MATERIA Clasificación de la materia SUSTACIACIAS PURAS SIMPLES UN SOLO TIPO DE ÁTOMO Mercurio (l) átomo de Hg Cloro(g) átomo de Cl SUSTANCIA PURA COMPUESTA S C O Zn Un solo tipo de
U3. CLASIFICACIÓN DE LA MATERIA: METODOS DE SEPARACIÓN
 FÍSICA Y QUÍMICA. 3º ESO 1 NOM: ; GRUP: U3. CLASIFICACIÓN DE LA MATERIA: METODOS DE SEPARACIÓN (Puedes encontrar más información del punto que vamos a tratar en las páginas siguientes del libro: Pag. 53,
FÍSICA Y QUÍMICA. 3º ESO 1 NOM: ; GRUP: U3. CLASIFICACIÓN DE LA MATERIA: METODOS DE SEPARACIÓN (Puedes encontrar más información del punto que vamos a tratar en las páginas siguientes del libro: Pag. 53,
Teoría Disoluciones Fórmula empírica y molecular Física y Química. 1º bachiller DISOLUCIONES
 Teoría Disoluciones Fórmula empírica y molecular Física y Química. 1º bachiller 18-1-2015 CONCEPTO DE DISOLUCIÓN DISOLUCIONES Una disolución es una mezcla homogénea de sustancias en igual o distintos estados
Teoría Disoluciones Fórmula empírica y molecular Física y Química. 1º bachiller 18-1-2015 CONCEPTO DE DISOLUCIÓN DISOLUCIONES Una disolución es una mezcla homogénea de sustancias en igual o distintos estados
Audio e vídeo en Ardora 7
 Nos distintos tipos de contidos que crea Ardora se poden incluír arquivos multimedia, tanto de audio como de video. AUDIO: Por exemplo, nas actividades interactivas, xunto coas mensaxes de "felicitación"
Nos distintos tipos de contidos que crea Ardora se poden incluír arquivos multimedia, tanto de audio como de video. AUDIO: Por exemplo, nas actividades interactivas, xunto coas mensaxes de "felicitación"
CLASIFICACIÓN DE LA MATERIA
 CLASIFICACIÓN DE LA MATERIA Clasificación de la materia. Sistemas materiales Sustancias puras Mezclas Un solo componente Dos o mas componentes Simples Compuestas Homogénas Heterogénas Un solo tipo de átomo.
CLASIFICACIÓN DE LA MATERIA Clasificación de la materia. Sistemas materiales Sustancias puras Mezclas Un solo componente Dos o mas componentes Simples Compuestas Homogénas Heterogénas Un solo tipo de átomo.
BICICLETA ELÉCTRICA TUCANO ESTILO STD 36V LITIO MANUAL DE USO
 BICICLETA ELÉCTRICA TUCANO ESTILO STD 36V LITIO MANUAL DE USO Aula de Enerxías Renovables Departamento de Electrónica IES Escolas Proval (Nigrán) 1 ÍNDICE PRESENTACIÓN... 3 USO E CONSERVACIÓN... 3 MODOS
BICICLETA ELÉCTRICA TUCANO ESTILO STD 36V LITIO MANUAL DE USO Aula de Enerxías Renovables Departamento de Electrónica IES Escolas Proval (Nigrán) 1 ÍNDICE PRESENTACIÓN... 3 USO E CONSERVACIÓN... 3 MODOS
Múltiplos e divisores. Múltiplos e divisores. Obxectivos. Antes de comezar
 2 Múltiplos e divisores Múltiplos e divisores Obxectivos Nesta quincena aprenderás a: Saber se un número é múltiplo doutro. Recoñecer as divisións exactas. Achar todos os divisores dun número. Recoñecer
2 Múltiplos e divisores Múltiplos e divisores Obxectivos Nesta quincena aprenderás a: Saber se un número é múltiplo doutro. Recoñecer as divisións exactas. Achar todos os divisores dun número. Recoñecer
PREGUNTA (Módulo Electivo) El siguiente equipo de laboratorio: Se utiliza para
 PREGUNTA (Módulo Electivo) El siguiente equipo de laboratorio: Se utiliza para A) separar los componentes de una solución. B) aumentar la solubilidad de una solución. C) demostrar que el agua es un compuesto.
PREGUNTA (Módulo Electivo) El siguiente equipo de laboratorio: Se utiliza para A) separar los componentes de una solución. B) aumentar la solubilidad de una solución. C) demostrar que el agua es un compuesto.
Probas de acceso a ciclos formativos de grao superior CSPC003. Código. Proba de. Matemáticas. Páxina 1 de 11
 Probas de acceso a ciclos formativos de grao superior Proba de Matemáticas Código CSPC003 Páxina 1 de 11 1. Formato da proba Formato A proba consta de vinte cuestións distribuídas en catro problemas, do
Probas de acceso a ciclos formativos de grao superior Proba de Matemáticas Código CSPC003 Páxina 1 de 11 1. Formato da proba Formato A proba consta de vinte cuestións distribuídas en catro problemas, do
RAM son as siglas de random access memory, un tipo de memoria de
 RAM son as siglas de random access memory, un tipo de memoria de computador á que se pode acceder aleatoriamente; é dicir, pódese acceder a calquera byte de memoria sen acceder aos bytes precedentes. A
RAM son as siglas de random access memory, un tipo de memoria de computador á que se pode acceder aleatoriamente; é dicir, pódese acceder a calquera byte de memoria sen acceder aos bytes precedentes. A
SUSTANCIA QUÍMICA mercurio oxígeno
 ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
CMUS Profesional de Viveiro
 CMUS Profesional de Viveiro CONCELLO DE VIVEIRO PROBAS DE ACCESO LINGUAXE MUSICAL ÍNDICE PROBAS DE ACCESO... 3 Proba de acceso a 1º de grao elemental L.O.E.... 3 Proba de acceso a 2º de grao elemental
CMUS Profesional de Viveiro CONCELLO DE VIVEIRO PROBAS DE ACCESO LINGUAXE MUSICAL ÍNDICE PROBAS DE ACCESO... 3 Proba de acceso a 1º de grao elemental L.O.E.... 3 Proba de acceso a 2º de grao elemental
GUÍA DA VENDA DIRECTA DOS PRODUTOS PRIMARIOS
 GUÍA DA VENDA DIRECTA DOS PRODUTOS PRIMARIOS O DÍA 20 DE OUTUBRO DE 2014 ENTROU EN VIGOR O DECRETO POLO QUE SE REGULAN EN GALICIA AS CONDICIÓNS DE VENDA DIRECTA DOS PRODUTOS PRIMARIOS DESDE AS EXPLOTACIÓNS
GUÍA DA VENDA DIRECTA DOS PRODUTOS PRIMARIOS O DÍA 20 DE OUTUBRO DE 2014 ENTROU EN VIGOR O DECRETO POLO QUE SE REGULAN EN GALICIA AS CONDICIÓNS DE VENDA DIRECTA DOS PRODUTOS PRIMARIOS DESDE AS EXPLOTACIÓNS
MANUAL APLICACIÓN SUBVENCIÓNS A PROXECTOS DE RENOVACIÓN DAS INSTALACIÓNS DE ILUMINACIÓN PÚBLICA EXTERIOR (ILE) 2015
 MANUAL APLICACIÓN SUBVENCIÓNS A PROXECTOS DE RENOVACIÓN DAS INSTALACIÓNS DE ILUMINACIÓN PÚBLICA EXTERIOR (ILE) 2015 Páxina 1 Índice 1. Obxecto da aplicación... 3 2. Acceso á aplicación... 3 2. Introdución
MANUAL APLICACIÓN SUBVENCIÓNS A PROXECTOS DE RENOVACIÓN DAS INSTALACIÓNS DE ILUMINACIÓN PÚBLICA EXTERIOR (ILE) 2015 Páxina 1 Índice 1. Obxecto da aplicación... 3 2. Acceso á aplicación... 3 2. Introdución
Qué es la Química? Es una ciencia que estudia la materia, sus propiedades, su composición, su estructura y los cambios que experimenta.
 Qué es la Química? Es una ciencia que estudia la materia, sus propiedades, su composición, su estructura y los cambios que experimenta. Qué es la materia? Es todo lo que ocupa un lugar en el espacio y
Qué es la Química? Es una ciencia que estudia la materia, sus propiedades, su composición, su estructura y los cambios que experimenta. Qué es la materia? Es todo lo que ocupa un lugar en el espacio y
Convocatoria ordinaria de 2012
 Preguntas frecuentes Probas de acceso a ciclos de grao medio Convocatoria ordinaria de 2012 Nota informativa Probas de acceso a ciclos de grao medio Convocatoria ordinaria de 2012 Consellería de Cultura,
Preguntas frecuentes Probas de acceso a ciclos de grao medio Convocatoria ordinaria de 2012 Nota informativa Probas de acceso a ciclos de grao medio Convocatoria ordinaria de 2012 Consellería de Cultura,
2.4. Os seres vivos e a paisaxe
 Ecosistema Comunidade ou biocenose O conxunto dos seres vivos do ecosistema ou compoñentes bióticos. Cada especie diferente que vive nun ecosistema forma unha poboación. Biótopo O espazo físico natural
Ecosistema Comunidade ou biocenose O conxunto dos seres vivos do ecosistema ou compoñentes bióticos. Cada especie diferente que vive nun ecosistema forma unha poboación. Biótopo O espazo físico natural
Métodos de separación de sistemas materiales sencillos
 Métodos de separación de sistemas materiales sencillos SISTEMAS MATERIALES Mezclas Separación física Sustancias Puras no Son uniformes? si si Pueden descomponerse por reacciones químicas? no Mezclas heterogéneas
Métodos de separación de sistemas materiales sencillos SISTEMAS MATERIALES Mezclas Separación física Sustancias Puras no Son uniformes? si si Pueden descomponerse por reacciones químicas? no Mezclas heterogéneas
Teoría atómica: Leyes de la combinación química
 Teoría atómica: Leyes de la combinación química La materia y la química. Disoluciones vs sustancias. Sustancias puras (elementos y compuestos) I. La materia y la química Uno de los primeros objetivos que
Teoría atómica: Leyes de la combinación química La materia y la química. Disoluciones vs sustancias. Sustancias puras (elementos y compuestos) I. La materia y la química Uno de los primeros objetivos que
O servidor do centro
 O servidor do centro Índice 1. Introdución 2. O servidor do centro I. Obxectivo e servizos específicos do Servidor do Centro II. III. Aplicación de Xestión de Recursos Educativos Outros servizos do Servidor
O servidor do centro Índice 1. Introdución 2. O servidor do centro I. Obxectivo e servizos específicos do Servidor do Centro II. III. Aplicación de Xestión de Recursos Educativos Outros servizos do Servidor
LA MATERIA: ESTADOS DE AGREGACIÓN
 LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
UN AMOR POR DESCUBRIR
 Un amor por descubrir 1 de 5 UN AMOR POR DESCUBRIR Esta é a unidade didáctica sobre a película Un amor por descubrir. Está realizada co obxectivo de que o profesorado despois de ver a película poida traballar
Un amor por descubrir 1 de 5 UN AMOR POR DESCUBRIR Esta é a unidade didáctica sobre a película Un amor por descubrir. Está realizada co obxectivo de que o profesorado despois de ver a película poida traballar
TEMA 1: A POBOACIÓN NO MUNDO
 TEMA 1: A POBOACIÓN NO MUNDO A.-INTRODUCIÓN: ACLARANDO CONCEPTOS A.1.- Concepto de Demografía É a ciencia que estuda a poboación. Interésase por coñecer o número de habitantes dun determinado territorio,
TEMA 1: A POBOACIÓN NO MUNDO A.-INTRODUCIÓN: ACLARANDO CONCEPTOS A.1.- Concepto de Demografía É a ciencia que estuda a poboación. Interésase por coñecer o número de habitantes dun determinado territorio,
PENDIENTES DE 3º ESO. DEPARTAMENTO DE FÍSICA Y QUÍMICA. CURSO 13-14
 PENDIENTES DE 3º ESO. DEPARTAMENTO DE FÍSICA Y QUÍMICA. CURSO 13-14 INFORMACIÓN Y CONTENIDOS MÍNIMOS PARA LA EVALUACIÓN Información Para que los alumnos puedan recuperar esta asignatura lo más pronto posible,
PENDIENTES DE 3º ESO. DEPARTAMENTO DE FÍSICA Y QUÍMICA. CURSO 13-14 INFORMACIÓN Y CONTENIDOS MÍNIMOS PARA LA EVALUACIÓN Información Para que los alumnos puedan recuperar esta asignatura lo más pronto posible,
Materia. La materia es cualquier sustancia que tenga masa y ocupe un espacio.
 Materia La materia es cualquier sustancia que tenga masa y ocupe un espacio. Propiedades fundamentales de la materia Generales o extensivas Específicas o intensivas Físicas Químicas Propiedades generales
Materia La materia es cualquier sustancia que tenga masa y ocupe un espacio. Propiedades fundamentales de la materia Generales o extensivas Específicas o intensivas Físicas Químicas Propiedades generales
CONDICIÓNS DO SERVIZO INTERNET MÓVIL
 CONDICIÓNS DO SERVIZO INTERNET MÓVIL As presentes condicións de uso regulan o servizo de datos Internet y Conectividad Móvil (en diante o Servizo ) en calquera das súas modalidades, incluíndo as modalidades
CONDICIÓNS DO SERVIZO INTERNET MÓVIL As presentes condicións de uso regulan o servizo de datos Internet y Conectividad Móvil (en diante o Servizo ) en calquera das súas modalidades, incluíndo as modalidades
TEMA 3. CLASIFICACIÓN DE LA MATERIA.
 TEMA 3. CLASIFICACIÓN DE LA MATERIA. FÍSICA Y QUÍMICA 3º ESO 1. CLASIFICACIÓN DE LA MATERIA SUSTANCIAS PURAS. Son las que tienen siempre las mismas propiedades físicas y químicas. - Elemento. Es una sustancia
TEMA 3. CLASIFICACIÓN DE LA MATERIA. FÍSICA Y QUÍMICA 3º ESO 1. CLASIFICACIÓN DE LA MATERIA SUSTANCIAS PURAS. Son las que tienen siempre las mismas propiedades físicas y químicas. - Elemento. Es una sustancia
1.5 Métodos de separación de mezclas Decantación, filtración, extracción, cristalización, destilación, cromatografía.
 1.5 Métodos de separación de mezclas Decantación, filtración, extracción, cristalización, destilación, cromatografía. 1 Para tomar apuntes MÉTODO DE SEPARACIÓN PROPIEDAD(ES) EN LAS QUE SE BASA MEZCLAS
1.5 Métodos de separación de mezclas Decantación, filtración, extracción, cristalización, destilación, cromatografía. 1 Para tomar apuntes MÉTODO DE SEPARACIÓN PROPIEDAD(ES) EN LAS QUE SE BASA MEZCLAS
AFORRO ENERXÉTICO NOS FOGARES MANUAL DE BOAS PRÁCTICAS
 AFORRO ENERXÉTICO NOS FOGARES MANUAL DE BOAS PRÁCTICAS INTRODUCIÓN Das familias galegas depende o 30% do consumo final de enerxía na nosa comunidade, sendo a enerxía a principal causante das emisións de
AFORRO ENERXÉTICO NOS FOGARES MANUAL DE BOAS PRÁCTICAS INTRODUCIÓN Das familias galegas depende o 30% do consumo final de enerxía na nosa comunidade, sendo a enerxía a principal causante das emisións de
Bioquímica Tema 2: Soluciones. Unidades Año: 2013
 TEMA 2: SOLUCIONES Al estudio de las soluciones se le asigna gran importancia, teniendo en cuenta que la mayoría de las reacciones químicas ocurren entre soluciones, particularmente en medios acuosos.
TEMA 2: SOLUCIONES Al estudio de las soluciones se le asigna gran importancia, teniendo en cuenta que la mayoría de las reacciones químicas ocurren entre soluciones, particularmente en medios acuosos.
A LUZ. ÓPTICA XEOMÉTRICA 0,40
 A LUZ. ÓPTICA XEOMÉTRICA 1. Un espello esférico ten 0,80 m de radio. a) Se o espello é cóncavo, calcular a qué distancia hai que colocar un obxecto para obter unha imaxe real dúas veces maior que o obxecto.
A LUZ. ÓPTICA XEOMÉTRICA 1. Un espello esférico ten 0,80 m de radio. a) Se o espello é cóncavo, calcular a qué distancia hai que colocar un obxecto para obter unha imaxe real dúas veces maior que o obxecto.
BIBLIOTECA DE GALICIA. Del 5 de diciembre 2015 al 24 de enero Lino. González Rubido: un dibujante olvidado en la prensa compostelana
 BIBLIOTECA DE GALICIA Del 5 de diciembre 2015 al 24 de enero 2016 Lino González Rubido: un dibujante olvidado en la prensa compostelana Se sabe muy poco de la vida y la obra de este dibujante. Nació en
BIBLIOTECA DE GALICIA Del 5 de diciembre 2015 al 24 de enero 2016 Lino González Rubido: un dibujante olvidado en la prensa compostelana Se sabe muy poco de la vida y la obra de este dibujante. Nació en
Es una ciencia porque tiene un objeto de estudio (la materia), y un método (el método experimental).
 Objetivos: La Química es una ciencia que estudia la materia en sentido general, su estructura, sus propiedades y las reacciones que transforman sustancias en otras. Es una ciencia porque tiene un objeto
Objetivos: La Química es una ciencia que estudia la materia en sentido general, su estructura, sus propiedades y las reacciones que transforman sustancias en otras. Es una ciencia porque tiene un objeto
A TEORÍA CINÉTICA. explica propiedades dos tres estados. líquido gas sólido gas leis sólido líquido
 PROGRAMACIÓN DE AULA MAPA DE CONTIDOS explica propiedades dos tres estados A TEORÍA CINÉTICA tamén explica PROGRAMACIÓN DE AULA E SÓLIDO LÍQUIDO GAS DISOLUCIÓN DIFUSIÓN pode pasar a pode pasar a réxese
PROGRAMACIÓN DE AULA MAPA DE CONTIDOS explica propiedades dos tres estados A TEORÍA CINÉTICA tamén explica PROGRAMACIÓN DE AULA E SÓLIDO LÍQUIDO GAS DISOLUCIÓN DIFUSIÓN pode pasar a pode pasar a réxese
A CARTA DE PRESENTACIÓN
 A CARTA DE PRESENTACIÓN 1. QUE É UNHA CARTA DE PRESENTACIÓN? É unha carta que acompaña ao Currículum vitae e que serve como tarxeta de visita, nela dámonos a coñecer á empresa e solicitamos unha entrevista
A CARTA DE PRESENTACIÓN 1. QUE É UNHA CARTA DE PRESENTACIÓN? É unha carta que acompaña ao Currículum vitae e que serve como tarxeta de visita, nela dámonos a coñecer á empresa e solicitamos unha entrevista
CURSO INTRODUCTORIO DE QUÍMICA
 CURSO INTRODUCTORIO DE QUÍMICA UNIDAD II. S MATERIALES INTRODUCCIÓN Se llama sistema material a una porción limitada de materia, dentro del universo, que se separa real o imaginariamente, para su estudio.
CURSO INTRODUCTORIO DE QUÍMICA UNIDAD II. S MATERIALES INTRODUCCIÓN Se llama sistema material a una porción limitada de materia, dentro del universo, que se separa real o imaginariamente, para su estudio.
Aplicación del método científico: estudio del péndulo
 Aplicación del método científico: estudio del péndulo El método científico introducido por Galileo se aplica siguiendo las siguientes etapas: Planteamiento de hipótesis Verificación experimental, análisis
Aplicación del método científico: estudio del péndulo El método científico introducido por Galileo se aplica siguiendo las siguientes etapas: Planteamiento de hipótesis Verificación experimental, análisis
TEMA 3 MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS. 1. Distinguir mezcla homogénea de mezcla heterogénea.* х
 TEMA 3 MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS 3º F/Q OBJETIVOS Estudiar los distintos tipos de mezclas, sus aplicaciones y sus técnicas de separación. Realizar su clasificación atendiendo a diversos
TEMA 3 MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS 3º F/Q OBJETIVOS Estudiar los distintos tipos de mezclas, sus aplicaciones y sus técnicas de separación. Realizar su clasificación atendiendo a diversos
