DETECTIVES FORENSES DESCRIPCIÓN
|
|
|
- Alberto Contreras Martin
- hace 8 años
- Vistas:
Transcripción
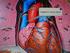
1 DURACIÓN: 60 GRADO: 4-12 MATERIA: HISTORIA, GEOGRAFÍA, CIENCIAS SOCIALES, CIVISMO, ARTE DETECTIVES FORENSES DESCRIPCIÓN Claves de la Química: Los científicos ayudan a resolver un misterio de carácter internacional al analizar granos de arena encontrada en un globo bomba. En otros lugares se utilizan perros como detectives químicos para descubrir criminales incendiarios. Aprende cómo los elementos de la tabla periódica están organizados y cómo se relacionan entre sí. CRÉDITOS: Mónica Fuhrken, profesora universitaria. OBJETIVO Aprender sobre la tabla periódica, los diversos elementos químicos y su uso por parte de detectives para la resolución de crímenes. Pg. 1
2 MATERIALES Video, televisión, mapamundi, papel, lápiz, plastilina, cartulina, plumones, pegamento, computadora I. ACTIVACIÓN DE CONOCIMIENTOS PREVIOS. DISCUTIR Y RESPONDER LAS SIGUIENTES PREGUNTAS. 1) Qué crees que hace un detective forense? 2) Qué es la tabla periódica? 3) Para qué sirve la tabla periódica? 4) Cómo utilizan la química los detectives forenses? 5) Sabes cuántos elementos químicos existen? Explica II. VER EL VIDEO DEL MINUTO 3.30 AL MINUTO 9.30 Y RESPONDER LAS SIGUIENTES PREGUNTAS. 1. Cuántos elementos químicos existen en el universo? 2. Cómo son diferentes y similares los elementos químicos? 3. En qué ayuda la tabla periódica? 4. En qué consiste la fiebre del oro? 5. Qué tipo de elemento es el oro?. 6. Encuentra Annie oro en el río? Qué hace con él? 7. Cuál es la ambición de Annie?. H Qué hace que el oro sea ideal para la joyería? I J Con qué no reacciona el oro y qué no le sucede? Qué tipo de metal es el oro? 11. Qué tipo de metal es el acero? 12. Qué puede hacer el acero? 13. Cuál es uno de los pocos elementos que se pueden encontrar en forma pura? 14. Qué hace que cada elemento sea único? 15. Cada cuándo se actualiza la tabla periódica y porqué? 16. Cómo describe la tabla periódica el químico Peter Atkins? 17. Qué características tienen los no metales? 18. Qué colores ve el químico Peter Atkins en la tabla periódica? Pg. 2
3 19. Qué metal es y qué características tiene el que se ha utilizado para las tapaduras dentales y los termómetros? 20. Qué analogía utiliza el químico Peter Atkins para describir el oro? 21. Qué domina la tabla periódica y porqué? 22. Qué características tiene cada elemento? 23. Qué representa el número atómico de cada elemento? 24. Cómo se les llama a las líneas horizontales de elementos? 25. Cómo están organizados los elementos en la tabla periódica? 26. Qué sucede al moverse hacia la izquierda en la tabla periódica? 27. Cómo se les llama a las columnas verticales de la tabla periódica? 28. Qué característica similar tienen los elementos de cada grupo? 29.Menciona una característica común en los elementos de un grupo. 30. Qué se puede predecir si se conocen las características de un grupo de la tabla periódica? III. VER EL VIDEO DEL MINUTO 9.27 AL MINUTO 12 Y RELACIONA LAS SIGUIENTES COLUMNAS. ESCRIBIR EL NÚMERO DE LA ORACIÓN QUE CORRESPONDA PARA COMPLETAR LA IDEA CORRECTAMENTE. ( ) 1.El litio es un metal A. Más reactivo es el elemento ( ) 2.Es un metal más suave que el litio B. Se encuentra en sus átomos ( ) 3. Los metales reactivos pertenecen al C. Se forma hidrógeno ( ) 4.Mientras más alta es la columna D. Suave y gris ( ) 5.Cuando un metal reacciona al agua E. El fluor ( ) 6.Cuando el litio y el sodio reaccionan al agua F. Carga negativa ( ) 7.El rubidio y el cesio explotan G. El sodio ( ) 8.El gas más reactivo de la tabla periódica es H. Al hacer contacto con agua ( ) 9.Es un gas muy reactivo del grupo 17 I. Se forma óxido ( ) 10.Al mezclarse sus átomos forman ácido clorhídrico J. Partículas llamadas protones y neutrones ( ) 11.La razón por la que unos elementos son reactivos K. Grupo 1 ( ) 12.Los átomos poseen el mismo L. Cloro y agua ( ) 13.En los átomos los electrones rodean al núcleo con M. Carga positiva ( ) 14.Los electrones poseen N. El cloro ( ) 15.Los protones poseen O. Recubrimiento ( ) 16.Los neutrones poseen P. Carga neutral Pg. 3
4 IV. VER EL VIDEO DEL MINUTO AL MINUTO Y DECIDIR SI LOS SIGUIENTES ENUNCIADOS SON VERDADEROS (V) O FALSOS (F). ( ) 1. En la reacción de un elemento es primordial lo que sucede a los electrones. ( ) 2. Se pueden observar los átomos en el microscopio. ( ) 3. Si se observara un átomo en el microscopio se verían sus electrones como anillos, llamados caparazones. ( ) 4. El caparazón interno se llena con 8 electrones. ( ) 5. La capa más superficial de un átomo puede contener hasta 2 electrones. ( ) 6. Cuando los electrones de un átomo se combinan con los electrones de otro átomo se forman uniones químicas. ( ) 7. La tendencia de ganar o perder electrones es la clave para acomodar un átomo en la tabla periódica. ( ) 8. Un ruso se basó en las similitudes de los elementos para construir la tabla periódica original. ( ) 9. Actualmente ya no se agregan elementos a la tabla periódica. ( ) 10.La química sirve para resolver crímenes. ( ) 11.Los rastros químicos silenciosos se consideran testigos de la verdad. ( ) 12.La química no se utiliza para descubrir evidencias ocultas de un crimen. V. VER EL VIDEO DEL MINUTO 15 AL MINUTO 27. USAR LA TABLA DE LETRAS Y LAS CLAVES PARA COMPLETAR LAS PALABRAS. ENCONTRAR LAS COORDENADAS QUE FALTAN PARA CADA LETRA DE LAS PALABRAS Y ESCRIBIRLAS EN PARÉNTESIS DEBAJO DE CADA LETRA. SEGUIR EL EJEMPLO. Un felino: G A T O (3,5) (1,5) (3,4) (2,1) 5 A L G V D 4 K N T P H 3 Q C B Ñ S 2 F U J Y Z 1 I O R E M En 1944 aparecieron.. en los Estados Unidos de Norteamérica. (3,5) (3,3) 2. El aterrizaje de globos era un. (5,1) (3,4) (4,1) Pg. 4
5 3. Los globos contenían. (3,3) (3,3) (5,3) 4. Las bombas contenían.. para controlar la altura. de (3,3) (5,3) (1,5) (4,1) 5. Se creyó que los globos eran enviados por los. (3,2) (2,1) (2,4) (5,3) 6. La información de la investigación sobre los globos se mantuvo en (5,3) (2,3) 7. Cada de arena contiene su propio mensaje. (3,5) (3,1) 8. Cada grano de arena contiene una mezcla diferente de (5,1) (2,4) (3,1) (5,3) 9. En la investigación se separaron los granos de acuerdo con su. y X (2,3) (2,5) (3,4) (3,4) (1,5) 10. Algunos granos eran. (3,4) (1,5) (5,3) (2,5) (1,1) Pg. 5
6 11. Se estudiaron los granos de arena con un microscopio. (4,4) (2,5) (1,1) (5,2) (2,1) 12. Los diferentes.de la arena denotan su contenido mineral. (2,3) (2,5) (3,1) 13. La arena fue estudiada por. (3,5) (2,1) (3,5) 14. Los globos fueron estudiados por (1,1) (3,5) (1,1) (2,1) 15.Los globos estaban hechos de.. de (4,4) (4,4) (1,5) (5,2) VI. TABLA PERIÓDICA. ORGANIZAR EQUIPOS DE CUATRO INTEGRANTES Y DESARROLLAR LA TABLA PERIÓDICA CON MATERIALES DE SU ELECCIÓN (UTILIZAR, CARTULINA, PLUMONES, PAPEL DE COLORES, PLASTILINA, CARTONCILLO, COMPUTADORA, ETC.) PRESENTAR LA TABLA PERIÓDICA Y PRESENTARLA A OTRO EQUIPO EXPLICANDO SUS CONTENIDOS. Pg. 6
7 VII. VER EL VIDEO DEL MINUTO 22 AL MINUTO 24 Y COMPLETAR EL PÁRRAFO CON LAS PALABRAS QUE FALTAN Cuando los 1. fueron liberados, volaron hacia 2.. Al calentarse el globo con el 3., se expandió y elevó. Pero si se 4. demasiado, podía explotar, por lo tanto una 5. se abría y dejaba escapar la 6 excesiva. Al caer la noche y 7. el globo, descendía. Pero si bajaba demasiado se podía 8.. Para prevenir esto, un 9. cerraba un interruptor que detonaba una 10..La detonación liberaba un par de sacos de 11., encendía la carga y enviaba el 12. de regreso hacia arriba. Cuando todos los sacos habían sido 13., una carga final detonaba la 14.. Ahora que se comprendía la manera en que volaban los globos, los 15. se preguntaban porqué los globos tenían tantos 16. de arena, suficiente para 17. varios días y noches, si provenían de los Estados Unidos de Norteamérica. Porque no provenían de los 18.. Los 19. venían de 20.. VIII. VE EL VIDEO DEL MINUTO 23 AL MINUTO 35 Y RESPONDE LAS SIGUIENTES PREGUNTAS SELECCIONANDO LA RESPUESTA CORRECTA. OPCIÓN MÚLTIPLE. 1. Existen sobre el Pacífico vientos elevados en la atmósfera que son muy rápidos y se llaman: A) Vientos rápidos B) Corrientes de chorro C) Vientos elevados 2. Normalmente un viaje en globo de Japón a los Estados Unidos de Norteamérica toma: A) De 6 a 8 días B) De 6 a 8 horas C) De 6 a 8 semanas 3. Con la corriente de chorro, el viaje del globo de Japón a los Estados Unidos de Norteamérica toma: A) De 6 a 8 horas B) 33 días C) 33 horas 4. La arena japonesa no tenía: A) Minerales B) Granito y coral C) Piedras 5. La arena japonesa tenía: A) Minerales volcánicos B) Coral C) Granito 6. El coral se localiza en aguas: A) Templadas B) Calientes C) Frías 7. La composición de la arena de los globos se localiza en: 1. Las playas abajo del paralelo La península al este de Japón 3. La península al este de Tokio 8. En la arena de los globos se encontraron: A) Plantas y animales B) Fósiles de plantas y animales C) Algas marinas 9. Los fósiles de animales y plantas encontradas en la arena de los globos fueron descubiertos en el: A) Siglo XVIII B) Siglo XIX C) Siglo XX Pg. 7
8 10. Se descubrió el lugar de donde se lanzaban los globos: A) Por los aviones fotodetectores enviados B) Por la expedición a Japón en C) Experimentos realizados en las playas 11. Se localizaron: - Animales y plantas - Fósiles de todo tipo - Globos y generadores de hidrógeno 12. De noviembre de 1943 a abril de 1945, Japón lanzó: A) 90,000 globos bomba B) 9,000 globos bomba C) 900 globos bomba 13. De acuerdo con los registros estadounidenses solamente llegaron a E.U.A.: A) 300 globos B) 3,000 globos C) 30,000 globos 14. La gente realiza crímenes intencionales por: A ) Placer B) Venganza, terror o dinero C) Trabajo 15. Uno de los crímenes intencionales es: A) Construir bombas de globo B) Causar incendios C) Hacer bombas de arena 16. El sentido más importante para un perro es: A) El olfato B) La vista C) El gusto 17. El sentido primordial para un perro es al menos: A) 100 veces mejor que el del ser humano B) 100 mil veces mejor que el del ser humano C) 10 veces mejor que el del ser humano IX. VE EL VIDEO DEL MINUTO 26 AL MINUTO 42 Y RELACIONA LAS COLUMNAS, LA COLUMNA DE LOS NOMBRES CON LA DESCRIPCIÓN QUE LE CORRESPONDE. ( ) A.Pirotécnico 1. 4 de julio en E.U.A. ( ) B.Químicas son 2. Por computadora ( ) C.Día de desfiles, fiesta y diversión 3. A mano ( ) D.Casi 1000 fuegos artificiales 4. Una esfera, cubo o cilindro ( ) E.La preparacion de fuegos se realiza 5. Químico especializado en fuegos artificiales ( ) F.Los fuegos artificiales se detonan 6. Químicos que proporcionan oxígeno, color y que queman ( ) G.Una estrella es 7. Se necesitan para un buen evento de fuegos artificiales ( ) H.Una estrella en fuego artificial es 8. Son el tipo de recetas necesarias para fuegos artificiales ( ) I. Las estrellas proporcionan 9. Un explosiva mezcla de químicos ( ) J.Los químicos de los fuegos tienen 10. Sonido, luz y color Pg. 8
9 X. EN EQUIPO REALIZA UN DISEÑO DE FUEGO ARTIFICIAL QUE NUNCA HAYAS VISTO. UTILIZA CARTULINA, CARTONCILLO, PLUMONES, DIAMANTINA, PEGAMENTO. REDACTA UNA EXPLICACIÓN DEL SIGNIFICADO DEL DISEÑO QUE REALICES. XI. SOPA DE LETRAS. ENCONTRAR LAS SIGUIENTES PALABRAS: Luz Rubidio Microscopio Color Arena Composición Litio Bomba Detective Cesio Carga Pirotécnico Globo Núcleo Hidrógeno Óxido Átomo Elemento Metal Vientos Periódica Ácido Química Protones Fuego Artificial Electrones Tabla Forense Neutrones M I C R O S C O P I O A C E Q U I M I C A A T D E T N A O P I E R I X S N E U T R O N E S A O E T D R A R A S U O Y I M U L F G J Z T I O R N T A I U R A G V I T D D C C E L E M E N T O B E E L E L S I O A A O F O A L C E I I U N P O P G C N V S O P T T P N S O C E T J S T D I Q I M O T O A N O O E A T E A C A O R R U B I D I O E R I I L A M A X O B S E I R F O R O S O O M O E D V C D O I C A D A L N N E S N C M E G N I S S I E I D I M O C G U D A C L S E I A C T A Z A N H A S R U B I D L T A T E I O S R A O E U A D E L A O R I S O I O N A R T I F I C I A L Q C K R E R P D U I E I B V L I O A U N O M C A U I E O O E M E S D O U O A L F R E E M E N A R G D L F A N O E L I S E N O R T I O G E L P E R I O D I C A C O L O R O C A R C P S O T N E I V N A B M O B Pg. 9
Los elementos químicos
 Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
3.2. PARTÍCULAS SUBATÓMICAS.
 3.2. PARTÍCULAS SUBATÓMICAS. 3.2.1. PROTONES Y ELECTRONES. Aunque Dalton creía que los átomos eran indivisibles e inalterables, a lo largo del siglo XIX aparecieron cada vez más evidencias de que los átomos
3.2. PARTÍCULAS SUBATÓMICAS. 3.2.1. PROTONES Y ELECTRONES. Aunque Dalton creía que los átomos eran indivisibles e inalterables, a lo largo del siglo XIX aparecieron cada vez más evidencias de que los átomos
Ejercicios y respuestas del apartado: Propiedades de los períodos y de los grupos. Electronegatividad
 Ejercicios y respuestas del apartado: Propiedades de los períodos y de los grupos. Electronegatividad Propiedades periódicas (1) La electronegatividad en la tabla periódica disminuye cuanto más a la (1)
Ejercicios y respuestas del apartado: Propiedades de los períodos y de los grupos. Electronegatividad Propiedades periódicas (1) La electronegatividad en la tabla periódica disminuye cuanto más a la (1)
5ª UNIDAD ELEMENTOS Y COMPUESTOS
 5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
LA LA ESTRUCTURA DE LA MATERIA. 1.-Desarrollo histórico del concepto de átomo. Teoría de Demócrito. Teoría de Dalton. Componentes del átomo
 ANEXO AL TEMA 4 LA LA ESTRUCTURA DE LA MATERIA 1.-Desarrollo histórico del concepto de átomo Teoría de Demócrito Teoría de Dalton Modelo actual Componentes del átomo Concepto de ión 2.-Elememtos y compuestos
ANEXO AL TEMA 4 LA LA ESTRUCTURA DE LA MATERIA 1.-Desarrollo histórico del concepto de átomo Teoría de Demócrito Teoría de Dalton Modelo actual Componentes del átomo Concepto de ión 2.-Elememtos y compuestos
Colección de problemas Unidad 2
 Facultad de Química, UNAM Curso: Química General I Colección de problemas Unidad 2 1. Describe una contribución importante a la ciencia hecha por cada uno de los científicos siguientes: Dalton, Thomson,
Facultad de Química, UNAM Curso: Química General I Colección de problemas Unidad 2 1. Describe una contribución importante a la ciencia hecha por cada uno de los científicos siguientes: Dalton, Thomson,
Física y Química 3º E.S.O. 2013/14
 Física y Química 3º E.S.O. 2013/14 TEMA 3: La materia. Propiedades eléctricas y el átomo 1.- En la siguiente sopa de letras puedes encontrar los nombres de 13 elementos químicos. A O M O L P B A C E E
Física y Química 3º E.S.O. 2013/14 TEMA 3: La materia. Propiedades eléctricas y el átomo 1.- En la siguiente sopa de letras puedes encontrar los nombres de 13 elementos químicos. A O M O L P B A C E E
RELACIONES PERIÓDICAS Y FAMILIAS DE LOS ELEMENTOS
 RELACIONES PERIÓDICAS Y FAMILIAS DE LOS ELEMENTOS Guía de Química EXPERIMENTO N 7 RELACIONES PERIODICAS Y FAMILIAS DE LOS ELEMENTOS OBJETIVO GENERAL: El estudiante: Interpretará las variaciones periódicas
RELACIONES PERIÓDICAS Y FAMILIAS DE LOS ELEMENTOS Guía de Química EXPERIMENTO N 7 RELACIONES PERIODICAS Y FAMILIAS DE LOS ELEMENTOS OBJETIVO GENERAL: El estudiante: Interpretará las variaciones periódicas
Colegio Superior de Señoritas Profesora: Noylen Vega Martínez Practica 8 avo año Química: - 1 -
 Profesora: Noylen Vega Martínez Practica 8 avo año Química: - 1 - Respuesta Corta: Escriba en las líneas lo que se le solicita. 1. Cuál es el número atómico, de protones y de electrones de los siguientes
Profesora: Noylen Vega Martínez Practica 8 avo año Química: - 1 - Respuesta Corta: Escriba en las líneas lo que se le solicita. 1. Cuál es el número atómico, de protones y de electrones de los siguientes
Tema 5: El átomo y sus uniones.
 Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
Contenidos. 1.- Primeras clasificaciones periódicas.
 LA TABLA PERIÓDICA. Contenidos 1.- Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 3.- Propiedades periódicas: 3.1. Tamaño de los átomos. Radios atómicos
LA TABLA PERIÓDICA. Contenidos 1.- Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 3.- Propiedades periódicas: 3.1. Tamaño de los átomos. Radios atómicos
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA.
 PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
GUÍA PARA EXAMEN DE REGULARIZACIÓN DE QUÍMICA 1
 GUÍA PARA EXAMEN DE REGULARIZACIÓN DE QUÍMICA 1 1.- Ciencia que estudia la composición, estructura de la materia y sus transformaciones. R= Química 2.-Es todo lo que tiene masa y posee inercia R= Materia
GUÍA PARA EXAMEN DE REGULARIZACIÓN DE QUÍMICA 1 1.- Ciencia que estudia la composición, estructura de la materia y sus transformaciones. R= Química 2.-Es todo lo que tiene masa y posee inercia R= Materia
Actividad: Cómo son las configuraciones electrónicas?
 Cómo son las configuraciones electrónicas de los elementos que forman una familia? Nivel: 2º Medio Subsector: Ciencias químicas Unidad temática: Actividad: Cómo son las configuraciones electrónicas? En
Cómo son las configuraciones electrónicas de los elementos que forman una familia? Nivel: 2º Medio Subsector: Ciencias químicas Unidad temática: Actividad: Cómo son las configuraciones electrónicas? En
Colección de ejercicios UNIDAD 2
 Facultad de Química, UNAM Curso: Química General I, gpo 8 Colección de ejercicios UNIDAD 2 1. Describe cuál fue la contribución al conocimiento de la estructura atómica hecha por cada uno de los siguientes
Facultad de Química, UNAM Curso: Química General I, gpo 8 Colección de ejercicios UNIDAD 2 1. Describe cuál fue la contribución al conocimiento de la estructura atómica hecha por cada uno de los siguientes
GUÍA DIDÁCTICA QUÍMICA CAPÍTULO 2 - COMPUESTOS INORGÁNICOS. Norma Demichelis Página 1 de 8
 GUÍA DIDÁCTICA QUÍMICA CAPÍTULO 2 - COMPUESTOS INORGÁNICOS Norma Demichelis Página 1 de 8 ÍNDICE: Página 1- Presentación y objetivos 3 2- Sesión de estudio N 1: Tabla Periódica 4 2-1- Introducción 4 2-2-
GUÍA DIDÁCTICA QUÍMICA CAPÍTULO 2 - COMPUESTOS INORGÁNICOS Norma Demichelis Página 1 de 8 ÍNDICE: Página 1- Presentación y objetivos 3 2- Sesión de estudio N 1: Tabla Periódica 4 2-1- Introducción 4 2-2-
LOS COLORES DE LOS ELEMENTOS
 LOS COLORES DE LOS ELEMENTOS Expresiones tan comunes y sugestivas como "rojo cadmio", "verde esmeralda", "blanco de titanio" o "azul turquesa" relacionan muy directamente un color con un material. Como
LOS COLORES DE LOS ELEMENTOS Expresiones tan comunes y sugestivas como "rojo cadmio", "verde esmeralda", "blanco de titanio" o "azul turquesa" relacionan muy directamente un color con un material. Como
TABLA PERIÓDICA. La clasificación más sencilla de los elementos químicos consiste en catalogarlos en metales, no metales y gases nobles.
 TABLA PERIÓDICA En la tabla periódica, los elementos químicos se encuentran ordenados en orden creciente a su número atómico (Z), es decir, al número de protones que tienen en el núcleo. La tabla periódica
TABLA PERIÓDICA En la tabla periódica, los elementos químicos se encuentran ordenados en orden creciente a su número atómico (Z), es decir, al número de protones que tienen en el núcleo. La tabla periódica
Departamento de Física y Química. 2.- Deduce el número de neutrones, protones y electrones de los átomos siguientes:
 1.- Para el átomo de Galio, 69 31Ga ; deduce el número de protones, electrones y neutrones. 2.- Deduce el número de neutrones, protones y electrones de los átomos siguientes: U ; Hg ; Th ; He; Ne 235 200
1.- Para el átomo de Galio, 69 31Ga ; deduce el número de protones, electrones y neutrones. 2.- Deduce el número de neutrones, protones y electrones de los átomos siguientes: U ; Hg ; Th ; He; Ne 235 200
UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 4
 UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 4 NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: DOCENTES: Química General La Tabla Periódica
UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 4 NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: DOCENTES: Química General La Tabla Periódica
COLEGIO SAN JOSÉ - Hijas de María Auxiliadora C/ Emilio Ferrari, 87 - Madrid Departamento de Ciencias Naturales
 TEMA 1. ELEMENTOS Y COMPUESTOS EJERCICIOS Y SOLUCIONES 4. El sistema periódico 1. Escribe la configuración electrónica de los 3 primeros elementos alcalinotérreos y explica razonadamente si estos elementos
TEMA 1. ELEMENTOS Y COMPUESTOS EJERCICIOS Y SOLUCIONES 4. El sistema periódico 1. Escribe la configuración electrónica de los 3 primeros elementos alcalinotérreos y explica razonadamente si estos elementos
Observa la imagen de la derecha. Puedes identificar el núcleo y la nube de electrones? Qué crees que representan las esferas azules, rojas y grises?
 reflexiona Nuestro mundo está lleno de diversidad. Existe una variedad asombrosa en todos los materiales, sustancias y seres vivos que existen en la Tierra. Observa la imagen de la derecha. Incluso en
reflexiona Nuestro mundo está lleno de diversidad. Existe una variedad asombrosa en todos los materiales, sustancias y seres vivos que existen en la Tierra. Observa la imagen de la derecha. Incluso en
1.5. TABLA PERIÓDICA.
 1.5. TABLA PERIÓDICA. 1.5.1. TABLA PERIÓDICA. La tabla periódica ordena todos los elementos conocidos según sus propiedades. Los últimos elementos, todavía no han recibido nombre oficial. El orden de los
1.5. TABLA PERIÓDICA. 1.5.1. TABLA PERIÓDICA. La tabla periódica ordena todos los elementos conocidos según sus propiedades. Los últimos elementos, todavía no han recibido nombre oficial. El orden de los
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN
 FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2012/13 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2012/13 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
Colegio CEMEP Proyecto Nº 2 Química. 1º Media. Enero-Febrero Profesor Melvyn García
 Colegio CEMEP Proyecto Nº 2 Química. 1º Media. Enero-Febrero Profesor Melvyn García Propósito 1 Analizar la teoría atómica y el átomo como partícula fundamental de la materia. Qué es un modelo atómico?
Colegio CEMEP Proyecto Nº 2 Química. 1º Media. Enero-Febrero Profesor Melvyn García Propósito 1 Analizar la teoría atómica y el átomo como partícula fundamental de la materia. Qué es un modelo atómico?
b) La zona externa del átomo se llama CORTEZA. y ahí es donde se mueven los ELECTRONES
 PREGUNTAS DE RESPUESTA BREVE 1. Completa las siguientes frases relativas a los átomos de los elementos: a) La parte del átomo en donde se puede considerar que se concentra toda su masa es el NÚCLEO y ahí
PREGUNTAS DE RESPUESTA BREVE 1. Completa las siguientes frases relativas a los átomos de los elementos: a) La parte del átomo en donde se puede considerar que se concentra toda su masa es el NÚCLEO y ahí
LA MATERIA. Características de los átomos
 LA MATERIA Características de los átomos Años más tarde del modelo atómico de Rutherford (1911) se descubrió una nueva partícula en el núcleo, el neutrón. Esta fue descubierta por Chadwick en 1932, y se
LA MATERIA Características de los átomos Años más tarde del modelo atómico de Rutherford (1911) se descubrió una nueva partícula en el núcleo, el neutrón. Esta fue descubierta por Chadwick en 1932, y se
BIOMAS, TERRITORIO INUIT
 DURACIÓN: 60 GRADO: 5-12 MATERIA: CIENCIAS SOCIALES, FÍSICA, GEOGRAFÍA, CIENCIAS, BIOLOGÍA BIOMAS, TERRITORIO INUIT DESCRIPCIÓN: Nueve meses de frío intenso y tres meses de clima cálido así es la vida
DURACIÓN: 60 GRADO: 5-12 MATERIA: CIENCIAS SOCIALES, FÍSICA, GEOGRAFÍA, CIENCIAS, BIOLOGÍA BIOMAS, TERRITORIO INUIT DESCRIPCIÓN: Nueve meses de frío intenso y tres meses de clima cálido así es la vida
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
3 - Cómo podemos diferenciar un elemento químico de un compuesto, según la teoría de Dalton?
 TEORÍA ATÓMICA 1- A partir de los siguientes datos, cuántas veces es maor la masa del protón que la del electrón? Masa del protón =1,673 10-27 kg Masa del electrón =9,1 10-31 kg 2 - El modelo del átomo
TEORÍA ATÓMICA 1- A partir de los siguientes datos, cuántas veces es maor la masa del protón que la del electrón? Masa del protón =1,673 10-27 kg Masa del electrón =9,1 10-31 kg 2 - El modelo del átomo
CIENCIAS QUÍMICA Métodos de balanceo
 1 estoy-prendiendo.com CIENCIAS QUÍMICA Métodos de balanceo Tanteo Algebraico 2 Reacción química Una reacción química es un proceso mediante el cual una o varias sustancias modifican su estructura para
1 estoy-prendiendo.com CIENCIAS QUÍMICA Métodos de balanceo Tanteo Algebraico 2 Reacción química Una reacción química es un proceso mediante el cual una o varias sustancias modifican su estructura para
ACTIVIDADES PARA LA RECUPERACIÓN Y SUPERACIÓN DE INDICADORES PENDIENTES
 DOCENTE: Luisa Medina GRADO: Sexto ASIGNATURA: Química PERIODO: IV Tenga en cuenta: Todas las actividades escritas deben entregarse en hojas cuadriculadas (carta u oficio) legajadas en una carpeta. En
DOCENTE: Luisa Medina GRADO: Sexto ASIGNATURA: Química PERIODO: IV Tenga en cuenta: Todas las actividades escritas deben entregarse en hojas cuadriculadas (carta u oficio) legajadas en una carpeta. En
Un modelo atómico, por lo tanto consiste en representar de manera grafica, la dimensión atómica de la materia. El objetivo de estos modelos es que el
 Modelos atómicos Debido a que no se podían ver los átomos los científicos crearon modelos para describirlos, éstos fueron evolucionando a lo largo de la historia a medida que se descubrieron nuevas cosas.
Modelos atómicos Debido a que no se podían ver los átomos los científicos crearon modelos para describirlos, éstos fueron evolucionando a lo largo de la historia a medida que se descubrieron nuevas cosas.
ACTIVIDAD ACUMULATIVA
 1 Primer Semestre ACTIVIDAD ACUMULATIVA ENLACE QUÍMICO ESTRUCTURA DE LEWIS NOMBRE: NOTA (ACUMULATIVA): CURSO: 1º MEDIO PUNTAJE: FECA: Objetivos: 1. Comprender los aspectos esenciales del modelo atómico
1 Primer Semestre ACTIVIDAD ACUMULATIVA ENLACE QUÍMICO ESTRUCTURA DE LEWIS NOMBRE: NOTA (ACUMULATIVA): CURSO: 1º MEDIO PUNTAJE: FECA: Objetivos: 1. Comprender los aspectos esenciales del modelo atómico
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2
 FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
ESTRUCTURA ATÓMICA DE LA MATERIA. SISTEMA PERIÓDICO ESTRUCTURA ATÓMICA DE LA MATERIA
 ESTRUCTURA ATÓMICA DE LA MATERIA. SISTEMA PERIÓDICO ESTRUCTURA ATÓMICA DE LA MATERIA La teoría atómica de Dalton se mantuvo con éxito durante casi un siglo pero tuvo que ser abandonada a partir del descubrimiento
ESTRUCTURA ATÓMICA DE LA MATERIA. SISTEMA PERIÓDICO ESTRUCTURA ATÓMICA DE LA MATERIA La teoría atómica de Dalton se mantuvo con éxito durante casi un siglo pero tuvo que ser abandonada a partir del descubrimiento
Física y Química 3º ESO
 1. Física y Química. Ciencias de la medida forman parte de las necesitan Ciencias de la naturaleza medir las propiedades de los cuerpos que se dividen en para lo cual se emplean lo que siempre conlleva
1. Física y Química. Ciencias de la medida forman parte de las necesitan Ciencias de la naturaleza medir las propiedades de los cuerpos que se dividen en para lo cual se emplean lo que siempre conlleva
INTRODUCCIÓN A LA QUÍMICA
 INTRODUCCIÓN A LA QUÍMICA TRABAJO PRÁCTICO N 1 4 Año A, B, C, D 2.015 Prof. María Laura Sepúlveda Broky INTRODUCCIÓN A LA QUÍMICA Prof. María Laura Sepúlveda Broky 1)A- Realizar un esquema de la Tabla
INTRODUCCIÓN A LA QUÍMICA TRABAJO PRÁCTICO N 1 4 Año A, B, C, D 2.015 Prof. María Laura Sepúlveda Broky INTRODUCCIÓN A LA QUÍMICA Prof. María Laura Sepúlveda Broky 1)A- Realizar un esquema de la Tabla
Estequiometría. Química General I 2013
 Estequiometría Química General I 2013 Estequiometría Es el estudio cuantitativo de reactivos y productos en una reacción química. Conceptos importantes Masa atómica Mol Peso molecular Masa atómica En química
Estequiometría Química General I 2013 Estequiometría Es el estudio cuantitativo de reactivos y productos en una reacción química. Conceptos importantes Masa atómica Mol Peso molecular Masa atómica En química
ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS
 ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS 1.- Escriba la configuración electrónica de los siguientes iones o elementos: 8 O -2, 9 F - y 10 Ne, e indique el período y grupo de los elementos correspondientes.
ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS 1.- Escriba la configuración electrónica de los siguientes iones o elementos: 8 O -2, 9 F - y 10 Ne, e indique el período y grupo de los elementos correspondientes.
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 3, Opción B Reserva 1, Ejercicio 2, Opción B Reserva 2, Ejercicio 2, Opción A Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 3, Opción B Reserva 1, Ejercicio 2, Opción B Reserva 2, Ejercicio 2, Opción A Reserva 3, Ejercicio
SEMANA 01 Estructura Atómica y Tabla Periódica. Licda. Lilian Judith Guzmán Melgar
 SEMANA 01 Estructura Atómica y Tabla Periódica Licda. Lilian Judith Guzmán Melgar 2016 ATOMO Es la partícula mas pequeña de un elemento que mantiene sus características. John Dalton formuló la TEORIA ATOMICA
SEMANA 01 Estructura Atómica y Tabla Periódica Licda. Lilian Judith Guzmán Melgar 2016 ATOMO Es la partícula mas pequeña de un elemento que mantiene sus características. John Dalton formuló la TEORIA ATOMICA
LEYES FUNDAMENTALES DE LA QUÍMICA
 LEYES FUNDAMENTALES DE LA QUÍMICA CONTENIDOS 1.- Sustancias homogéneas y heterogéneas. Elementos y compuestos..- Leyes fundamentales de la Química..1. Ley de conservación de la masa... Ley de las proporciones
LEYES FUNDAMENTALES DE LA QUÍMICA CONTENIDOS 1.- Sustancias homogéneas y heterogéneas. Elementos y compuestos..- Leyes fundamentales de la Química..1. Ley de conservación de la masa... Ley de las proporciones
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 2, Opción B Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 2, Opción B Reserva 3, Ejercicio
Tabla Periódica y Propiedades Periódicas
 Tabla Periódica y Propiedades Periódicas Primeras clasificaciones periódicas. Fines S. XVIII Metales y no metales. 1829, Döbereiner Tríadas de comportamiento químico similar. A principios del siglo XIX
Tabla Periódica y Propiedades Periódicas Primeras clasificaciones periódicas. Fines S. XVIII Metales y no metales. 1829, Döbereiner Tríadas de comportamiento químico similar. A principios del siglo XIX
Estequiometría y Leyes Ponderales
 Estequiometría y Leyes Ponderales Equipo de Educación en Química Verde Centro Interdisciplinario de Líquidos Iónicos Programa de Educación Continua para el Magisterio Introducción Leyes fundamentales de
Estequiometría y Leyes Ponderales Equipo de Educación en Química Verde Centro Interdisciplinario de Líquidos Iónicos Programa de Educación Continua para el Magisterio Introducción Leyes fundamentales de
Reacciones Químicas. Homogéneas.
 Como se sabe, la materia está formada por partículas, dependiendo el comportamiento de esta (la materia) del estado físico en que se encuentran las partículas. Igualmente, sabemos que la materia no es
Como se sabe, la materia está formada por partículas, dependiendo el comportamiento de esta (la materia) del estado físico en que se encuentran las partículas. Igualmente, sabemos que la materia no es
1. Uno de los grandes aciertos de los postulados de Mendeleiev respecto a la ordenación de los elementos fue:
 miniprueba Clase 04 Problemas 1. Uno de los grandes aciertos de los postulados de Mendeleiev respecto a la ordenación de los elementos fue: a. Designar un lugar fijo para el hidrogeno. b. Ordenar los elementos
miniprueba Clase 04 Problemas 1. Uno de los grandes aciertos de los postulados de Mendeleiev respecto a la ordenación de los elementos fue: a. Designar un lugar fijo para el hidrogeno. b. Ordenar los elementos
Configuraciones Electrónicas y Tabla Periódica: Problemas Prácticos
 Configuraciones Electrónicas y Tabla Periódica: Problemas Prácticos Historia del Átomo 1. Por qué no es posible para un electrón continuar girando en órbita alrededor del núcleo como un planeta alrededor
Configuraciones Electrónicas y Tabla Periódica: Problemas Prácticos Historia del Átomo 1. Por qué no es posible para un electrón continuar girando en órbita alrededor del núcleo como un planeta alrededor
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 3, Opción B Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 3, Opción B Reserva 3, Ejercicio
2.- Los átomos de un mismo elemento son iguales en masa y propiedades. Y los átomos de elementos diferentes son diferentes en masa y propiedades.
 FICHA 1 TEMA 3: ESTRUCTURA DE LA MATERIA PRIMEROS MODELOS ATÓMICOS La discusión sobre la continuidad o discontinuidad de la materia viene desde muy antiguo. Ya en la antigua Grecia había varias corrientes
FICHA 1 TEMA 3: ESTRUCTURA DE LA MATERIA PRIMEROS MODELOS ATÓMICOS La discusión sobre la continuidad o discontinuidad de la materia viene desde muy antiguo. Ya en la antigua Grecia había varias corrientes
Cronología de las diferentes clasificaciones de los elementos químicos
 La tabla periódica Los seres humanos siempre hemos estado tentados a encontrar una explicación a la complejidad de la materia que nos rodea. Al principio se pensaba que los elementos de toda materia se
La tabla periódica Los seres humanos siempre hemos estado tentados a encontrar una explicación a la complejidad de la materia que nos rodea. Al principio se pensaba que los elementos de toda materia se
Unidad I: Propiedades Periódicas: Masa y Enlace
 Unidad I: Propiedades Periódicas: Masa y Enlace 1. Nociones de teoría atómica moderna 2. Propiedades periódicas de los elementos 3. Enlace iónico y covalente 4. Masas atómicas y moleculares 1. Nociones
Unidad I: Propiedades Periódicas: Masa y Enlace 1. Nociones de teoría atómica moderna 2. Propiedades periódicas de los elementos 3. Enlace iónico y covalente 4. Masas atómicas y moleculares 1. Nociones
REFUERZO ESPECIAL CIENCIAS NATURALES. APRENDIZAJE ESPERADO: Afianzar los procesos básicos del área para su promoción al siguiente grado.
 REFUERZO ESPECIAL CIENCIAS NATURALES SÉPTIMO PERIODO IV IVON GÓMEZ APRENDIZAJE ESPERADO: Afianzar los procesos básicos del área para su promoción al siguiente grado. Apreciado estudiante: Las actividades
REFUERZO ESPECIAL CIENCIAS NATURALES SÉPTIMO PERIODO IV IVON GÓMEZ APRENDIZAJE ESPERADO: Afianzar los procesos básicos del área para su promoción al siguiente grado. Apreciado estudiante: Las actividades
UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS
 UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS Lee atentamente: 1. LA MISMA SUSTANCIA EN LOS TRES ESTADOS Todos los cuerpos están formados por sustancias: las personas, los coches, los muebles, el aire, etc. Todas
UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS Lee atentamente: 1. LA MISMA SUSTANCIA EN LOS TRES ESTADOS Todos los cuerpos están formados por sustancias: las personas, los coches, los muebles, el aire, etc. Todas
AÑO: HORAS CÁTEDRA SEMANALES:...3 horas... CURSO: cuarto año bachiller Decreto 6680/56
 Escuela del caminante Instituto Privado Incorporado a la Enseñanza Oficial AÑO: 2014 ASIGNATURA:... QUIMICA HORAS CÁTEDRA SEMANALES:...3 horas... CURSO: cuarto año bachiller Decreto 6680/56 PROFESOR/A:...Guillermo
Escuela del caminante Instituto Privado Incorporado a la Enseñanza Oficial AÑO: 2014 ASIGNATURA:... QUIMICA HORAS CÁTEDRA SEMANALES:...3 horas... CURSO: cuarto año bachiller Decreto 6680/56 PROFESOR/A:...Guillermo
Elementos ordenados según su número atómico (Z, número de p + ) Hay 18 PERÍODOS
 TABLA PERIÓDICA Elementos ordenados según su número atómico (Z, número de p + ) Columnas Filas GRUPOS PERÍODOS Familias de elementos con propiedades comunes Hay 18 División principal Elementos representativos
TABLA PERIÓDICA Elementos ordenados según su número atómico (Z, número de p + ) Columnas Filas GRUPOS PERÍODOS Familias de elementos con propiedades comunes Hay 18 División principal Elementos representativos
UNIDAD 10.- LAS UNIONES ENTRE ÁTOMOS. Cuestiones de evaluación inicial. 2.- Cuántos protones y cuantos neutrones tiene el Carbono?
 UNIDAD 10.- LAS UNIONES ENTRE ÁTOMOS Cuestiones de evaluación inicial 1.- Cuántos elementos químicos conoces? 2.- Cuántos protones y cuantos neutrones tiene el Carbono? 3.- Qué es el sistema periódico?
UNIDAD 10.- LAS UNIONES ENTRE ÁTOMOS Cuestiones de evaluación inicial 1.- Cuántos elementos químicos conoces? 2.- Cuántos protones y cuantos neutrones tiene el Carbono? 3.- Qué es el sistema periódico?
SESIÓN 2 ESTUDIO DE LA ESTEQUIOMETRIA
 I. CONTENIDOS: 1. Ley de las proporciones definidas. 2. Ley de las proporciones múltiples. 3. Fórmulas mínimas. 4. Ecuación química. 5. Balanceo de ecuaciones químicas. SESIÓN 2 ESTUDIO DE LA ESTEQUIOMETRIA
I. CONTENIDOS: 1. Ley de las proporciones definidas. 2. Ley de las proporciones múltiples. 3. Fórmulas mínimas. 4. Ecuación química. 5. Balanceo de ecuaciones químicas. SESIÓN 2 ESTUDIO DE LA ESTEQUIOMETRIA
2. Cómo dividen la Tierra los paralelos y los meridianos? Cómo se llama el paralelo cero? Y el meridiano cero?
 9. Reparte de la manera más equitativa posible esta cantidad de caramelos entre 3 amigos: 1 25057kgdefresa,0 57892kgdementay0 8999kgdecafé.Redondeaalamilésima. 1 25057kg+0 57892kg+0 8999kg=2 72939kg 2
9. Reparte de la manera más equitativa posible esta cantidad de caramelos entre 3 amigos: 1 25057kgdefresa,0 57892kgdementay0 8999kgdecafé.Redondeaalamilésima. 1 25057kg+0 57892kg+0 8999kg=2 72939kg 2
ACADEMIA DE QUÍMICA TURNO VESPERTINO
 INSTITUTO POLITÉCNICO NACIONAL CENTRO DE ESTUDIOS CIENTÍFICOS Y TECNOLÓGICOS No. 3 ESTANISLAO RAMÍREZ RUIZ ACADEMIA DE QUÍMICA TURNO VESPERTINO GUIA PARA EL SEGUNDO EXAMEN DEPARTAMENTALDE QUÍMICA I UNIDAD
INSTITUTO POLITÉCNICO NACIONAL CENTRO DE ESTUDIOS CIENTÍFICOS Y TECNOLÓGICOS No. 3 ESTANISLAO RAMÍREZ RUIZ ACADEMIA DE QUÍMICA TURNO VESPERTINO GUIA PARA EL SEGUNDO EXAMEN DEPARTAMENTALDE QUÍMICA I UNIDAD
Colección de ejercicios UNIDAD 2
 Facultad de Química, UNAM Curso: Química General I, gpo 14 Colección de ejercicios UNIDAD 2 1. Describe cuál fue la contribución al conocimiento de la estructura atómica hecha por: J. Dalton, J. J. Thomson,
Facultad de Química, UNAM Curso: Química General I, gpo 14 Colección de ejercicios UNIDAD 2 1. Describe cuál fue la contribución al conocimiento de la estructura atómica hecha por: J. Dalton, J. J. Thomson,
GUIA TALLER QUIMICA GRADO 8 FORMACION DE MOLECULAS
 GUIA TALLER QUIMICA GRADO 8 FORMACION DE MOLECULAS Composición de la materia: como ya se ha establecido, está formada por átomos. La materia se puede encontrar en la naturaleza como: Elementos químicos:
GUIA TALLER QUIMICA GRADO 8 FORMACION DE MOLECULAS Composición de la materia: como ya se ha establecido, está formada por átomos. La materia se puede encontrar en la naturaleza como: Elementos químicos:
M. Eugenia Villaseca R. Licenciada y Profesora de Biología PUCV
 M. Eugenia Villaseca R. Licenciada y Profesora de Biología PUCV Comprender la utilidad de los modelos atómicos y de la teoría atómica para explicar los procesos de transformación físico-química de la materia
M. Eugenia Villaseca R. Licenciada y Profesora de Biología PUCV Comprender la utilidad de los modelos atómicos y de la teoría atómica para explicar los procesos de transformación físico-química de la materia
Antecedentes históricos. Clasificación periódica
 Antecedentes históricos Clasificación periódica El descubrimiento de un gran número de elementos y el estudio de sus propiedades puso de manifiesto entre algunos de ellos ciertas semejanzas. Esto indujo
Antecedentes históricos Clasificación periódica El descubrimiento de un gran número de elementos y el estudio de sus propiedades puso de manifiesto entre algunos de ellos ciertas semejanzas. Esto indujo
Guía de Estudio para 1er Parcial Temas Selectos de Química
 Guía de Estudio para 1er Parcial Temas Selectos de Química 1. Menciona que científicos ordenaron los elementos conocidos en su época en triadas (grupos de tres), en octavas, por número atómico y quien
Guía de Estudio para 1er Parcial Temas Selectos de Química 1. Menciona que científicos ordenaron los elementos conocidos en su época en triadas (grupos de tres), en octavas, por número atómico y quien
Conceptos básicos en estequiometría
 Conceptos básicos en estequiometría Tomado de: http://www.eis.uva.es/~qgintro/esteq/tutorial-01.html El Mol Un mol se define como la cantidad de materia que tiene tantos objetos como el número de átomos
Conceptos básicos en estequiometría Tomado de: http://www.eis.uva.es/~qgintro/esteq/tutorial-01.html El Mol Un mol se define como la cantidad de materia que tiene tantos objetos como el número de átomos
DEPARTAMENTO DE FÍSICA Y QUÍMICA LUIS RUIZ MARTÍN FÍSICA Y QUÍMICA 3º DE ESO
 DEPARTAMENTO DE FÍSIA Y QUÍMIA LUIS RUIZ MARTÍN FÍSIA Y QUÍMIA 3º DE ESO ATIVIDAD 1: El modelo atómico de Dalton LOS ÁTOMOS Y SU OMPLEJIDAD 1.- uántos tipos de átomos hay en el dibujo de arriba? 2.- Qué
DEPARTAMENTO DE FÍSIA Y QUÍMIA LUIS RUIZ MARTÍN FÍSIA Y QUÍMIA 3º DE ESO ATIVIDAD 1: El modelo atómico de Dalton LOS ÁTOMOS Y SU OMPLEJIDAD 1.- uántos tipos de átomos hay en el dibujo de arriba? 2.- Qué
CONFIGURACIÓN ELECTRÓNICA
 ÁTOMOS Y MOLÉCULAS CONFIGURACIÓN ELECTRÓNICA Cada uno de estos niveles puede contener a su vez varios subniveles energéticos que se designan con las letras s, p, d y f. Cada nivel energético dispone sólo
ÁTOMOS Y MOLÉCULAS CONFIGURACIÓN ELECTRÓNICA Cada uno de estos niveles puede contener a su vez varios subniveles energéticos que se designan con las letras s, p, d y f. Cada nivel energético dispone sólo
TABLA PERIODICA. Ciencias naturales Ambientes Raymond Chang
 TABLA PERIODICA Ciencias naturales Ambientes Raymond Chang TABLA PERIODICA La organización más satisfactoria de los elementos fue obra de Dmitri Mendeleev, quien señalo que las propiedades, tanto físicas
TABLA PERIODICA Ciencias naturales Ambientes Raymond Chang TABLA PERIODICA La organización más satisfactoria de los elementos fue obra de Dmitri Mendeleev, quien señalo que las propiedades, tanto físicas
Aprendizaje esperado. Conocer la tabla periódica y sus características generales, estableciendo una relación con la configuración electrónica.
 Aprendizaje esperado Conocer la tabla periódica y sus características generales, estableciendo una relación con la configuración electrónica. Formulación de la Tabla Periódica En 1869 los trabajos realizados
Aprendizaje esperado Conocer la tabla periódica y sus características generales, estableciendo una relación con la configuración electrónica. Formulación de la Tabla Periódica En 1869 los trabajos realizados
Universidad de Belgrano - Cátedra de Ecología - Dr. Jorge Deschamps y Lic. Morales-Yokobori
 Acidez y ph Conocimiento del problema de la lluvia ácida Lluvia ácida. Dispersión. Reacciones químicas. Origen de los reactivos. Alcances geográficos y efectos. Grande Lagos de Norteamérica, Selva Negra
Acidez y ph Conocimiento del problema de la lluvia ácida Lluvia ácida. Dispersión. Reacciones químicas. Origen de los reactivos. Alcances geográficos y efectos. Grande Lagos de Norteamérica, Selva Negra
Unidad II Química I PERIODICIDAD QUÍMICA Y TABLA PERIÓDICA
 Unidad II Química I PERIODICIDAD QUÍMICA Y TABLA PERIÓDICA Gloria Angélica Fuentes Zenteno 1 Índice 2.3.1 Antecedentes 2.3.2 Componentes de la Tabla Periódica Nombre Símbolo Número y Masa atómica Estructura
Unidad II Química I PERIODICIDAD QUÍMICA Y TABLA PERIÓDICA Gloria Angélica Fuentes Zenteno 1 Índice 2.3.1 Antecedentes 2.3.2 Componentes de la Tabla Periódica Nombre Símbolo Número y Masa atómica Estructura
Ordenando Electrones. De qué forma? 2do Medio > Química Configuración Electrónica. Analiza la siguiente situación:
 do Medio > Química Ordenando Electrones Analiza la siguiente situación: Uno de los mayores logros de la ciencia de la primera mitad del siglo XX se dio en el área de la física, y fue el desarrollo de la
do Medio > Química Ordenando Electrones Analiza la siguiente situación: Uno de los mayores logros de la ciencia de la primera mitad del siglo XX se dio en el área de la física, y fue el desarrollo de la
Colegio Superior de Señoritas Tema: Formación de Compuestos Químicos Septiembre 2010 Prof.: NVM 8vo Nivel Departamento de Ciencias
 COMPUESTOS QUÍMICOS Y SU CLASIFICACIÓN El número de oxidación: representa la cantidad de electrones que puede ganar o perder un elemento. El hidrógeno tiene número de oxidación +1 y puede perder un electrón;
COMPUESTOS QUÍMICOS Y SU CLASIFICACIÓN El número de oxidación: representa la cantidad de electrones que puede ganar o perder un elemento. El hidrógeno tiene número de oxidación +1 y puede perder un electrón;
CIENCIAS II CON ENFASIS EN QUIMICA
 CIENCIAS II CON ENFASIS EN QUIMICA P1-TEMA 2.2 Propiedades intensivas y extensivas de los materiales y Proyectos 1. Explica con tus propias palabras en que consiste un proyecto. 2. Explica brevemente en
CIENCIAS II CON ENFASIS EN QUIMICA P1-TEMA 2.2 Propiedades intensivas y extensivas de los materiales y Proyectos 1. Explica con tus propias palabras en que consiste un proyecto. 2. Explica brevemente en
Paquete de Actividades de Maggie
 Paquete de Actividades de Maggie Nombre Fecha Las Materias Químicas! Acaso la química ayuda a capturar insectos? Puede la química ayudar a un perro a salvar a su dueño? Sigue leyendo para descubrirlo!
Paquete de Actividades de Maggie Nombre Fecha Las Materias Químicas! Acaso la química ayuda a capturar insectos? Puede la química ayudar a un perro a salvar a su dueño? Sigue leyendo para descubrirlo!
*TABLA PERIODICA. Esp. Harrison Meléndez Tarazona
 *TABLA PERIODICA Esp. Harrison Meléndez Tarazona *Surgimiento En 1869 Lothar Meyer publicó un esquema de clasificación basado en orden creciente de peso atómico En marzo de 1869 Dimitri Mendeléiev entregaba
*TABLA PERIODICA Esp. Harrison Meléndez Tarazona *Surgimiento En 1869 Lothar Meyer publicó un esquema de clasificación basado en orden creciente de peso atómico En marzo de 1869 Dimitri Mendeléiev entregaba
Química I. Contenido. Bloque I Reconoces a la Química como una herramienta para la vida 2
 Contenido Bloque I Reconoces a la Química como una herramienta para la vida 2 Sesión A. Qué es la Química? 5 Qué es la Química? 5 La Química en nuestro mundo cotidiano 6 Sesión B. Desarrollo histórico
Contenido Bloque I Reconoces a la Química como una herramienta para la vida 2 Sesión A. Qué es la Química? 5 Qué es la Química? 5 La Química en nuestro mundo cotidiano 6 Sesión B. Desarrollo histórico
Cómo contar átomos. Litio [He]2 s 1 SECCIÓN CAPÍTULO 3
![Cómo contar átomos. Litio [He]2 s 1 SECCIÓN CAPÍTULO 3 Cómo contar átomos. Litio [He]2 s 1 SECCIÓN CAPÍTULO 3](/thumbs/53/30991880.jpg) SECCIÓN 3.3 Cómo contar átomos El aire que respiramos contiene solo un 0.002% de gas neón. Sin embargo, hay 5 10 17 átomos de neón en cada bocanada de aire que tomamos. En la mayoría de los experimentos,
SECCIÓN 3.3 Cómo contar átomos El aire que respiramos contiene solo un 0.002% de gas neón. Sin embargo, hay 5 10 17 átomos de neón en cada bocanada de aire que tomamos. En la mayoría de los experimentos,
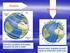
La Tierra es un planeta con una característica muy especial: el aire. Gracias a él, los seres vivos podemos respirar.
 UNIDAD 2. LA TIERRA UN PLANETA DIFERENTE: 1. Entre la Tierra y el universo. La Tierra es un planeta con una característica muy especial: el aire. Gracias a él, los seres vivos podemos respirar. Qué es
UNIDAD 2. LA TIERRA UN PLANETA DIFERENTE: 1. Entre la Tierra y el universo. La Tierra es un planeta con una característica muy especial: el aire. Gracias a él, los seres vivos podemos respirar. Qué es
UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS
 UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS Lee atentamente: 1. LA MISMA SUSTANCIA EN LOS TRES ESTADOS Todos los cuerpos están formados por sustancias: las personas, los coches, los muebles, el aire, etc. Todas
UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS Lee atentamente: 1. LA MISMA SUSTANCIA EN LOS TRES ESTADOS Todos los cuerpos están formados por sustancias: las personas, los coches, los muebles, el aire, etc. Todas
ORGANIZACIÓN DE LOS ELEMENTOS EN LA TABLA PERIÓICA PROPIEDADES PERIÓDICAS
 Nombre del estudiante: Grado: Asignatura: Química Tema: Organización de los elementos en la tabla periódica. Propiedades periódicas. Indicador de logro: Ubico un determinado elemento en la tabla periódica
Nombre del estudiante: Grado: Asignatura: Química Tema: Organización de los elementos en la tabla periódica. Propiedades periódicas. Indicador de logro: Ubico un determinado elemento en la tabla periódica
Guía Temática de Química
 Guía Temática de Química Introducción a la Química Definición de química y de ciencias afines a ella Diferenciación de las ciencias afines a la química 1 Conceptos básicos de química y el método científico
Guía Temática de Química Introducción a la Química Definición de química y de ciencias afines a ella Diferenciación de las ciencias afines a la química 1 Conceptos básicos de química y el método científico
EL ÁTOMO Modelos Atómicos
 EL ÁTOMO Modelos Atómicos Cómo está formada la materia en su interior? Desde los tiempos de la antigua Grecia,los pensadores venían haciéndose esta pregunta, acerca de cómo estaba constituida la materia
EL ÁTOMO Modelos Atómicos Cómo está formada la materia en su interior? Desde los tiempos de la antigua Grecia,los pensadores venían haciéndose esta pregunta, acerca de cómo estaba constituida la materia
A su vez, una molécula está compuesta por átomos. Cada uno de ellos posee unas propiedades diferentes en el interior de la molécula que constituyen.
 Constitución de la materia. Supongamos que cualquier sustancia de la naturaleza la dividimos en partes cada vez más pequeñas, conservando cada una de ellas las propiedades de la sustancia inicial. Si seguimos
Constitución de la materia. Supongamos que cualquier sustancia de la naturaleza la dividimos en partes cada vez más pequeñas, conservando cada una de ellas las propiedades de la sustancia inicial. Si seguimos
PROTONES Y ELECTRONES
 reflexiona Imagina que tienes un tazón de naranjas, plátanos, piñas, bayas, peras y sandía. Cómo identificas cada trozo de fruta? Es muy probable que estés familiarizado con las características de cada
reflexiona Imagina que tienes un tazón de naranjas, plátanos, piñas, bayas, peras y sandía. Cómo identificas cada trozo de fruta? Es muy probable que estés familiarizado con las características de cada
Tema 1. Conceptos Básicos en Química
 Tema 1. Conceptos Básicos en Química Química Átomo: números másicos y atómicos Mol Fórmulas empíricas y moleculares Reacciones químicas Gases Disoluciones Qué es la Química? Ciencia que estudia la composición
Tema 1. Conceptos Básicos en Química Química Átomo: números másicos y atómicos Mol Fórmulas empíricas y moleculares Reacciones químicas Gases Disoluciones Qué es la Química? Ciencia que estudia la composición
Como esta formada la materia?
 Como esta formada la materia? Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería llegarse a una porción que ya no podría
Como esta formada la materia? Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería llegarse a una porción que ya no podría
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN
 FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2011/12 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2011/12 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
QUÍMICA FUNDAMENTAL. Tabla Periódica
 QUÍMICA FUNDAMENTAL Tabla Periódica 1 TEMAS DE ESTUDIO Construcción de la Tabla Periódica con base en la configuración electrónica Propiedades periódicas de los elementos 2 ANTECEDENTES HISTÓRICOS: ELEMENTOS
QUÍMICA FUNDAMENTAL Tabla Periódica 1 TEMAS DE ESTUDIO Construcción de la Tabla Periódica con base en la configuración electrónica Propiedades periódicas de los elementos 2 ANTECEDENTES HISTÓRICOS: ELEMENTOS
DEPARTAMENTO DE CIENCIAS NATURALES Y EDUCACIÓN AMBIENTAL NOMBRE DEL ESTUDIANTE: GRADO: SÉPTIMO 2 PERIODO CURSO INDICADORES DE DESEMPEÑO
 DEPARTAMENTO DE CIENCIAS NATURALES Y EDUCACIÓN AMBIENTAL NOMBRE DEL ESTUDIANTE: GRADO: SÉPTIMO 2 PERIODO CURSO ASIGNATURA: QUÍMICA 7 PROFESOR: FREDY A. MARTÍNEZ INDICADORES DE DESEMPEÑO 201. Identifica
DEPARTAMENTO DE CIENCIAS NATURALES Y EDUCACIÓN AMBIENTAL NOMBRE DEL ESTUDIANTE: GRADO: SÉPTIMO 2 PERIODO CURSO ASIGNATURA: QUÍMICA 7 PROFESOR: FREDY A. MARTÍNEZ INDICADORES DE DESEMPEÑO 201. Identifica
Alumno:.. 1. Rellena la siguiente tabla convirtiendo la columna de la izquierda en las unidades indicadas a su derecha.
 Control de Ciencias de la Naturaleza. 1º ESO A Alumno:.. Cada pregunta vale 1.7 puntos. 1. Rellena la siguiente tabla convirtiendo la columna de la izquierda en las unidades indicadas a su derecha. 200
Control de Ciencias de la Naturaleza. 1º ESO A Alumno:.. Cada pregunta vale 1.7 puntos. 1. Rellena la siguiente tabla convirtiendo la columna de la izquierda en las unidades indicadas a su derecha. 200
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
PROYECTO PLATAFORMA VIRTUAL PRUEBA SABER 11 COLEGIO ANDRES BELLO
 PROYECTO PLATAFORMA VIRTUAL PRUEBA SABER 11 COLEGIO ANDRES BELLO QUÍMICA PROFESORA: ADRIANA GUTIERREZ RIVAS GRADO 11 SAN JOSE DE CÚCUTA 20/07/12 1451. El elemento Q reacciona con el oxígeno formando el
PROYECTO PLATAFORMA VIRTUAL PRUEBA SABER 11 COLEGIO ANDRES BELLO QUÍMICA PROFESORA: ADRIANA GUTIERREZ RIVAS GRADO 11 SAN JOSE DE CÚCUTA 20/07/12 1451. El elemento Q reacciona con el oxígeno formando el
Cómo Fabrican su Alimento las Plantas?
 2do Medio> Biología Fotosíntesis Fotosíntesis Cómo Fabrican su Alimento las Plantas? Martín estudiaba el proceso de fotosíntesis, por lo que diseñó el siguiente experimento: 1. Tomó tres tubos de ensayo,
2do Medio> Biología Fotosíntesis Fotosíntesis Cómo Fabrican su Alimento las Plantas? Martín estudiaba el proceso de fotosíntesis, por lo que diseñó el siguiente experimento: 1. Tomó tres tubos de ensayo,
La tabla periódica de los elementos
 La tabla periódica de los elementos 4 año secundario Vamos a iniciar este tema realizando un vistazo a la tabla periódica de los elementos. Aquí les doy varios sitios a los que pueden acudir para conocerla.
La tabla periódica de los elementos 4 año secundario Vamos a iniciar este tema realizando un vistazo a la tabla periódica de los elementos. Aquí les doy varios sitios a los que pueden acudir para conocerla.
Enseñanza - Aprendizaje.
 Una forma útil es el uso de tarjetas de memoria flash. Se escribe las palabras del vocabulario, los términos de lenguas extranjeras, las fórmulas matemáticas, las reacciones químicas - cualquier cosa que
Una forma útil es el uso de tarjetas de memoria flash. Se escribe las palabras del vocabulario, los términos de lenguas extranjeras, las fórmulas matemáticas, las reacciones químicas - cualquier cosa que
INSTITUTO TÉCNICO MARIA INMACULADA CIENCIA, VIRTUD Y LABOR FORMANDO LIDERES ESTUDIANTILES PARA UN FUTURO MEJOR PLAN DE CLASE GRADO: SEPTIMO
 INSTITUTO TÉCNICO MARIA INMACULADA CIENCIA, VIRTUD Y LABOR FORMANDO LIDERES ESTUDIANTILES PARA UN FUTURO MEJOR PLAN DE CLASE GRADO: SEPTIMO ÁREA: Ciencias naturales ASIGNATURA: Química TEMA: Tabla periódica
INSTITUTO TÉCNICO MARIA INMACULADA CIENCIA, VIRTUD Y LABOR FORMANDO LIDERES ESTUDIANTILES PARA UN FUTURO MEJOR PLAN DE CLASE GRADO: SEPTIMO ÁREA: Ciencias naturales ASIGNATURA: Química TEMA: Tabla periódica
