FICHA TECNICA. Excipientes: Alcohol bencílico 60 mg por ampolla (20 mg/ml). Para consultar la lista completa de excipientes ver sección 6.1.
|
|
|
- Julián Cordero Salinas
- hace 6 años
- Vistas:
Transcripción
1 1. NOMBRE DEL MEDICAMENTO TRANGOREX 150 mg/3ml solución inyectable. FICHA TECNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla de 3 ml contiene 150 mg de amiodarona clorhidrato. Excipientes: Alcohol bencílico 60 mg por ampolla (20 mg/ml). Para consultar la lista completa de excipientes ver sección FORMA FARMACÉUTICA Solución inyectable. La solución inyectable es un líquido de color amarillo pálido. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas Tratamiento de las arritmias graves citadas a continuación, cuando no respondan a otros antiarrítmicos o cuando los fármacos alternativos no se toleren: Taquiarritmias asociadas con el síndrome de Wolff-Parkinson-White. Prevención de la recidiva de la fibrilación y "flutter" auricular. Todos los tipos de taquiarritmias de naturaleza paroxística incluyendo: taquicardias supraventricular, nodal y ventricular, fibrilación ventricular. La vía intravenosa se empleará cuando sea necesaria una respuesta rápida. Debe utilizarse en unidades con medios adecuados para la monitorización cardiaca y reanimación cardiopulmonar. 4.2 Posología y forma de administración Tratamiento de ataque o inicial, son posibles dos alternativas: Perfusión intravenosa Dosis inicial o de ataque: la dosis habitual es de 5 mg/kg de peso administrada en 250 ml de dextrosa al 5 % exclusivamente, administrado en un periodo de 20 minutos a 2 horas. La perfusión puede repetirse de 2 a 3 veces en 24 horas. Se debe ajustar la velocidad de perfusión según la respuesta clínica. La acción se manifiesta desde los primeros minutos y va disminuyendo paulatinamente, por lo que debe instaurarse una perfusión de mantenimiento. 1
2 Dosis de mantenimiento: de 10 a 20 mg/kg de peso / 24 horas (generalmente de 600 a 800 mg/24 horas, límite mg/24 horas) en 250 ml de dextrosa al 5% durante varios días. Tomar el relevo de la administración oral desde el primer día de perfusión. Inyección intravenosa (ver sección 4.4) La dosis es de 5 mg/kg de peso. La duración de la inyección no debe ser nunca inferior a 3 minutos. No debe mezclarse con otras preparaciones en la misma jeringa. Resucitación cardiopulmonar en el tratamiento de fibrilación ventricular resistente a la desfibrilación: La dosis inicial IV es de 300 mg (o 5 mg/kg de peso) diluidos en 20 ml de dextrosa al 5%, e inyectados rápidamente. Se debe tener en cuenta una dosis IV adicional de 150 mg (o 2,5 mg/kg de peso) si la fibrilación ventricular persiste. Población pediátrica No se ha establecido la seguridad y eficacia de amiodarona en niños. En las secciones 5.1 y 5.2 se incluyen los datos disponibles actualizados. Debido a la presencia de alcohol bencílico, la administración intravenosa de amiodarona está contraindicada en neonatos (menores de un mes de edad) y niños de hasta 3 años de edad. 4.3 Contraindicaciones Hipersensibilidad conocida al yodo, yodina, amiodarona o a alguno de los excipientes. Bradicardia sinusal, bloqueo sino-auricular. Bloqueo auriculoventricular, Trastornos de la transmisión bi- o trifascicular, en pacientes a los que no se les haya implantado un marcapasos o pacientes en unidad de cuidados intensivos y bajo monitorización electrocardiográfica. Enfermedad del seno, en pacientes a los que no se les haya implantado un marcapasos (riesgo de paro sinusal). Colapso cardiovascular, hipotensión arterial grave. Trastornos de la función tiroidea.. Asociación con fármacos que puedan inducir torsade de pointes (ver sección 4.5 ).. Embarazo: excepto en circunstancias especiales (ver sección 4.6).. Lactancia (ver sección 4.6).. La administración IV está contraindicada en caso de hipotensión, insuficiencia respiratoria grave, miocardiopatía o insuficiencia cardiaca (posible empeoramiento).. Debido a la presencia de alcohol bencílico, la administración intravenosa de amiodarona está contraindicada en neonatos y niños de hasta 3 años de edad. Todas las contraindicaciones arriba mencionadas no se tienen en cuenta en el uso de amiodarona para la resucitación cardiopulmonar en el tratamiento de fibrilación ventricular resistente a la desfibrilación. 4.4 Advertencias y precauciones especiales de empleo 2
3 Específico para la inyección intravenosa: ver sección 4.3 La administración IV directa en bolus está generalmente desaconsejada a causa de los riesgos hemodinámicos (hipotensión grave, colapso circulatorio); por tanto, siempre que sea posible es preferible la administración mediante perfusión intravenosa. La administración IV debe limitarse a las situaciones de urgencia cuando las demás alternativas terapéuticas fracasen. Sólo debe utilizarse en unidades de cuidados intensivos y bajo monitorización (ECG, tensión arterial). Excepto en resucitación cardiopulmonar en el tratamiento de fibrilación ventricular resistente a la desfibrilación, la amiodarona debe inyectarse en un tiempo nunca inferior a 3 minutos y no debe ser administrada una segunda inyección intravenosa directa antes de que pasen 15 minutos tras la primera inyección, aunque solamente se haya administrado una única ampolla (riesgo de colapso irreversible). No añadir ningún otro producto en la misma jeringa. No administrar otras preparaciones en la misma línea. Si el tratamiento debe prolongarse, iniciar una perfusión continua (ver sección 4.2). Trastornos cardiacos: - En pacientes ancianos puede aparecer bradicardia grave como consecuencia de una disminución marcada del gasto cardiaco. - El tratamiento debe ser interrumpido en caso de inicio de bloqueo cardiaco. - Se ha notificado la aparición de nuevas arritmias o empeoramiento de las arritmias tratadas, a veces de desenlace mortal. En estos casos se debe valorar la necesidad de retirada del tratamiento con amiodarona. Asimismo, es importante, aunque difícil, diferenciar la falta de eficacia del medicamento, de la agravación de la patología cardiaca. Los efectos proarrítmicos se producen con menor frecuencia con amiodarona que con otros antiarrítmicos y generalmente están relacionados con asociaciones medicamentosas y/o trastornos electrolíticos (ver sección 4.5 y 4.8). Trastornos pulmonares: El inicio de disnea o tos no productiva puede estar relacionado con toxicidad pulmonar como neumonitis intersticial. Muy raramente se han reportado casos de neumonitis intersticial con amiodarona intravenosa. Cuando se sospeche dicho diagnóstico, en pacientes que desarrollen disnea por esfuerzo aislada o asociada con un deterioro del estado de salud (fatiga, pérdida de peso, fiebre), debe practicarse una radiografía de tórax. La terapia con amiodarona debería ser reevaluada dado que la pronta retirada de amiodarona conlleva la regresión de la neumonitis intersticial (los signos clínicos desaparecen habitualmente en 3 ó 4 semanas, siendo más lenta (varios meses) la mejoría radiológica y de la función pulmonar), debiéndose considerar una terapia con corticoteroides (ver sección 4.8). Se han observado casos muy raros de complicaciones respiratorias graves, algunas veces mortal, generalmente en el periodo inmediatamente posterior a cirugía (síndrome de distrés respiratorio del adulto); puede estar implicada una posible interacción con una alta concentración de oxígeno (ver sección 4.5 y sección 4.8). 3
4 Trastornos hepatobiliares (ver sección 4.8): - Antes de iniciar el tratamiento con amiodarona y regularmente durante éste, se recomienda una monitorización estrecha de las pruebas de función hepática (transaminasas). - Durante la administración oral o intravenosa y en las primeras 24 horas tras la administración de amiodarona IV, pueden aparecer alteraciones hepáticas agudas (incluyendo insuficiencia hepatocelular grave o fallo hepático, a veces mortal) y trastornos hepáticos crónicos. Debido a esto, se debe reducir la dosis de amiodarona o interrumpir el tratamiento si el aumento de las transaminasas excede tres veces el nivel normal. - Los signos clínicos y cambios biológicos de alteraciones hepáticas crónicas debidos a la administración oral de amiodarona pueden ser mínimos (hepatomegalia, transaminasas aumentadas 5 veces los valores normales) y reversibles tras la interrupción del tratamiento, pero se han detectado algunos casos de desenlace mortal. Interacciones farmacológicas (ver sección 4.5): No se recomienda la asociación con los siguientes fármacos: beta-bloqueantes, inhibidores de los canales de calcio que disminuyen la frecuencia cardiaca (verapamilo, diltiazem), laxantes estimulantes que pueden causar hipopotasemia. Amiodarona por vía intravenosa debe ser empleada únicamente en medio hospitalario especializado y bajo control permanente (ECG, tensión arterial). Para evitar reacciones en el lugar de inyección, amiodarona IV deberá, siempre que sea posible, administrarse por una vía venosa central (ver sección 4.8). Se debería tener precaución en casos de hipotensión, insuficiencia respiratoria grave, insuficiencia cardiaca grave o no compensada. Recientemente se han comunicado casos de hepatotoxicidad con amiodarona tras su administración IV que pudieran deberse al disolvente (polisorbato 80) que la vehiculiza, en lugar del propio medicamento. - Población pediátrica: no se ha establecido la seguridad y eficacia de amiodarona en pacientes pediátricos. Amiodarona inyectable contiene alcohol bencílico (20 mg/ml) (ver sección 2). El alcohol bencílico podría provocar reacciones tóxicas y reacciones alérgicas en niños menores de 3 años de edad. Se han descrito casos de síndrome de respiración jadeante fatales en neonatos tras la administración intravenosa de soluciones que contienen este conservante. Los síntomas incluyen un inicio destacado del síndrome de respiración jadeante, hipotensión, bradicardia y colapso cardiovascular. - Anestesia: antes de una intervención quirúrgica, debe advertirse al anestesista que al paciente se le está administrando amiodarona (ver sección 4.5). - Monitorización: Durante el tratamiento es necesario monitorizar los niveles de potasio sérico y transaminasas (ver sección 4.4). 4
5 - Trastornos electrolíticos: La hipokaliemia puede modificar los efectos de la amiodarona e incrementar la prolongación del espacio QT y el riesgo de torsades de pointes. Debe corregirse el déficit de potasio sérico antes de iniciar un tratamiento con amiodarona. Advertencia sobre excipientes Este medicamento no se debe administrar a niños prematuros ni recién nacidos porque contiene alcohol bencílico. Puede provocar reacciones tóxicas y reacciones anafilactoides en niños menores de 3 años de edad. 4.5 Interacción con otros medicamentos y otras formas de interacción Está contraindicado el tratamiento asociado con fármacos que puedan inducir "torsades de pointes" (ver sección 4.3): - Fármacos antiarrítmicos de Clase Ia (quinidina, hidroquinidina, disopiramida, sotalol, bepridil). - Fármacos no antiarrítmicos como vincamina algunos fármacos neurolépticos (clorpromazina, levomepromazina, tioridazina, trifluoperazina, haloperidol, amisulprida, sulpirida, tiaprida, pimozida), cisaprida, eritromicina intravenosa, pentamidina (cuando se administra por vía parenteral) ya que hay mayor riesgo de "torsades de pointes" potencialmente fatales debido a que estos fármacos presentan un efecto arritmogénico y/o inhibir la actividad del CYP3A4 incrementan los niveles plasmáticos de amiodarona. No se recomienda el tratamiento con los siguientes fármacos: - El uso de amiodarona con otros antiarrítmicos o fármacos con potencial arritmogénico (fenotiazinas, antidepresivos tricíclicos, terfenadina) puede incrementar la incidencia de arritmias cardiacas y debería evitarse. - Beta-bloqueantes e inhibidores de los canales de calcio que disminuyen la frecuencia cardiaca (verapamilo, diltiazem): posibilidad de Trastornos del automatismo (bradicardia excesiva) y de la conducción. - Laxantes estimulantes: que pueden causar hipopotasemia y, por tanto, aumentar el riesgo de "torsades de pointes"; se aconseja utilizar otro tipo de laxantes. - Fluoroquinolonas: deben evitarse en pacientes en tratamiento con Amiodarona. Se debe tener especial cuidado cuando amiodarona se combina con los siguientes fármacos: - Fármacos que pueden inducir hipopotasemia: Diuréticos hipopotasemicos solos o asociados. Corticosteroides sistémicos (glucocorticoides, mineralocorticoides), tetracosactida. Amfotericina B (vía intravenosa). Es necesario prevenir la aparición de la hipokaliemia (y corregirla): controlar el intervalo QT y, en caso de "torsades de pointes", no administrar antiarrítmicos (colocar un marcapasos ventricular y puede administrarse sulfato de magnesio por vía intravenosa). - Anticoagulantes orales: Amiodarona aumenta las concentraciones de warfarina por inhibición del citocromo P450 2C9. La combinación de warfarina con amiodarona puede potenciar el efecto de los anticoagulantes orales ya que aumenta el riesgo hemorrágico. Es necesario un control más frecuente del tiempo 5
6 de protrombina y una adaptación de la posología de los anticoagulantes orales durante y después del tratamiento con amiodarona. - Digitálicos: Posibilidad de alteración del automatismo (bradicardia excesiva) y de la conducción aurículoventricular (por acción sinérgica); además puede producirse un aumento de las concentraciones plasmáticas de digoxina por disminución de su aclaramiento. Es necesario realizar un control de ECG, y de los niveles plásmaticos de digoxina, y los pacientes deben ser observados para detectar signos clínicos de toxicidad digitálica. Puede ser necesario ajustar la posología de los digitálicos. - Fenitoína: La combinación de fenitoína con amiodarona puede llevar a una sobredosificación de fenitoína debido a la inhibición del citocromo P450 2C9. La combinación de fenitoína con amiodarona puede, por lo tanto, conducir a una sobredosis de fenitoína, dando lugar a síntomas neurológicos. Por ello debe realizarse un seguimiento clínico con control de los niveles plasmático de fenitoína, y en caso de sobredosificación debe reducirse la dosis de fenitoína. - Flecainida: Amiodarona aumenta los niveles plasmáticos de flecainida por inhibición del citocromo CYP 2D6. En consecuencia cuando se administra flecainida en pacientes que reciben amiodarona debería reducirse un 50% y monitorizar la presentación de posibles efectos adversos. - Fármacos metabolizados por el citocromo P 450 3A4: Cuando estos fármacos son administrados conjuntamente con amiodarona, un inhibidor del citocromo CYP 3A4, se puede producir un incremento de las concentraciones plasmáticas de dichos fármacos, lo que podría conducir a un incremento de su toxicidad. - Ciclosporina: su combinación con amiodarona puede producir un incremento plasmático de los niveles de ciclosporina, debiéndose ajustar la dosificación. - Fentanilo: su combinación con amiodarona puede aumentar los efectos farmacológicos del fentanilo e incrementar el riesgo de su toxicidad. - Estatinas: el riesgo de toxicidad muscular aumenta con la administración conjunta de amiodarona con estatinas metabolizadas por el citocromo CYP 3A 4 como la simvastatina, atorvastatina y lovastatina. Se recomienda el uso de una estatina no metabolizada por el citocromo CYP 3A4 cuando se administre conjuntamente con amiodarona. - Otras substancias metabolizadas por CYP 3A4: lidocaina, tacrolimo, sildenafilo, midazolam, triazolam, dihidroergotamina, ergotamina. - Anestesia general (ver secciones 4.4 y 4.8): Se han observado complicaciones potencialmente graves tras la asociación con anestésicos generales: bradicardia resistente a la atropina, hipotensión, Trastornos de la conducción, disminución del gasto cardiaco. Muy raramente, se han observado complicaciones respiratorias graves (síndrome de distress respiratorio agudo del adulto), algunas con desenlace mortal, inmediatamente después de una 6
7 intervención quirúrgica; dichos efectos se han relacionado a una posible interacción con altas concentraciones de oxígeno. Amiodarona contiene yodo (ver sección 5.2) y puede interferir en la captación de yodo marcado. Sin embargo, las pruebas tiroideas (T 3 libre, T 4 libre y TSHus) siguen siendo interpretables. 4.6 Fertilidad, embarazo y lactancia Embarazo Debido al riesgo de alteración del tiroides del feto, la administración de amiodarona durante el embarazo está contraindicada, salvo si los beneficios superan los riesgos. Lactancia Debido al paso de amiodarona a la leche materna en cantidad significativa y el contendio en yodo de esta, su administración está contraindicada durante la lactancia. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas Los datos de seguridad de amiodarona disponibles no muestran que amiodarona influya en la capacidad para conducir y utilizar máquinas. 4.8 Reacciones adversas La presentación de reacciones adversas con amiodarona es frecuente, particularmente toxicidad cardiaca, pulmonar y hepática. En ocasiones estas manifestaciones están relacionadas con la dosis y revierten tras una reducción de la dosis. Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia. Las siguientes reacciones adversas están clasificadas según el sistema orgánico y su frecuencia, tomando como referencia la siguiente conversión: muy frecuentes ( 10%), frecuentes ( 1% y 10%); poco frecuentes ( 0.1% y 1%); raras ( 0.01% y 0.1%), muy raras ( 0.01%); frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Trastornos cardiacos: - Frecuentes: bradicardia, generalmente moderada. - Muy raros: - bradicardia acusada, requiriéndose la discontinuación de amiodarona en caso de paro sinusal, especialmente en pacientes con disfunción del nodo sinusal y / o pacientes mayores de 65 años. - Se han detectado episodios de inicio o agravación de las arritmias, seguidas en algunos casos de paro cardiaco (ver sección y 4.5). - trastornos de la conducción. - aparición o empeoramiento de la arritmia, a veces seguido de paro cardiaco (ver sección 4.4 y 4.5). 7
8 Trastornos endocrinos: - Frecuencia no conocida: hipertiroidismo. Trastornos gastrointestinales: - Muy raros: náuseas. Trastornos generales y alteraciones en el lugar de administración: - Frecuentes: reacciones en el lugar de la inyección tales como: dolor, eritema, edema, necrosis, extravasación, infiltración, inflamación, induración, tromboflebitis, flebitis, celulitis, infección, cambios de la pigmentación. Trastornos hepatobiliares: - Muy raros: - elevación aislada y a menudo moderada de las transaminasas (de 1,5 a 3 veces los valores normales) al inicio de la terapia. Éstas pueden volver a la normalidad con una reducción de la dosis e incluso espontáneamente. - trastornos hepáticos agudos con elevación de transaminasas séricas y/o ictericia (incluyendo insuficiencia hepática) siendo alguno de ellos de desenlace mortal (ver sección 4.4). Trastornos del sistema inmunológico: - Muy raros: shock anafiláctico - Frecuencia no conocida: edema angioneurótico (edema de Quincke). Trastornos musculoesqueléticos y del tejido conjuntivo: - Frecuencia no conocida: dolor de espalda. Trastornos del sistema nervioso central: - Muy raros: - hipertensión intracraneal benigna (pseudotumor cerebri), - dolor de cabeza Trastornos respiratorios, torácicos y mediastínicos: - Muy raros: - pneumonitis intersticial (ver sección 4.4) - complicaciones respiratorias graves (síndrome de sufrimiento respiratorio agudo del adulto), algunas veces mortal (ver sección 4.4 y 4.5) - broncoespasmo y/o apnea en caso de insuficiencia respiratoria grave, principalmente en pacientes asmáticos. Trastornos de la piel y del tejido subcutáneo: - Muy raros: sudoración - Frecuencia no conocida: urticaria. Trastornos vasculares: 8
9 - Frecuentes: disminución de la presión sanguínea, generalmente moderada y de forma transitoria. Se han notificado casos de hipotensión grave o colapso después de una sobredosis o una inyección demasiado rápida. - Muy raros: sofocos 4.9 Sobredosis No hay información disponible acerca de la sobredosificación con amiodarona intravenosa. La ingestión aguda de altas dosis de amiodarona no está muy documentada. Se ha descrito un número reducido de casos de bradicardia sinusal, bloqueo cardiaco o de episodios de taquicardia ventricular, torsade de pointes, insuficiencia circulatoria y lesión hepática. El tratamiento debe ser sintomático y ni amiodarona ni sus metabolitos son dializables. 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas Grupo farmacoterapéutico: Antiarrítmicos, clase III.código ATC: C01B D01 Propiedades anti-isquémicas: Disminución del consumo de oxígeno por caída moderada de las resistencias periféricas y reducción de la frecuencia cardiaca. Actividad anti-adrenérgica alfa y beta no competitiva. Mantenimiento del gasto cardiaco gracias a una disminución de la presión aórtica y de las resistencias periféricas. Aumento del flujo coronario gracias a un efecto directo sobre la musculatura lisa de las arterias miocárdicas. Propiedades antiarrítmicas: Prolonga la duración del potencial de acción de la fibra cardiaca debido principalmente a una disminución del potasio actual (clase III de Vaughan Williams). Esta prolongación no se relaciona con la frecuencia cardiaca. Efecto bradicardizante por disminución del automatismo sinusal. Este efecto no es antagonizado por la atropina. Antagonista adrenérgico y, no competitivo. Enlentecimiento de la conducción sinoauricular, auricular y nodal; tanto más marcado cuanto más rápido sea el ritmo. No modifica la conducción a nivel ventricular. Aumento del periodo refractario y disminución de la excitabilidad miocárdica a nivel auricular, nodal y ventricular. Enlentecimiento de la conducción y aumento del periodo refractario de la vías accesorias auriculoventriculares. Otras propiedades: Reducción de la contractilidad cardiaca principalmente tras inyección intravenosa. 9
10 La seguridad y eficacia de amiodarona IV en pacientes con parada cardiaca extrahospitalaria debido a la fibrilación ventricular resistente a la desfibrilación se han evaluado en 2 estudios doble-ciego: el estudio ARREST, donde se compara amiodarona con placebo, y el estudio ALIVE, en el que se compara amiodarona con lidocaína. La principal conclusión de ambos estudios fue la supervivencia en el momento del ingreso hospitalario. En el estudio ARREST, 504 pacientes con parada cardiaca extrahospitalaria, como consecuencia de una fibrilación ventricular o una taquicardia ventricular sin pulso que persiste a 3 o más intentos de desfibrilación y epinefrina, se asignaron aleatoriamente al grupo que recibió una inyección rápida en vena periférica de amiodarona 300 mg diluidos en 20 ml de dextrosa al 5% (246 pacientes), o al grupo placebo (258 pacientes). De los 197 pacientes que sobrevivieron (39%) al ser admitidos en el hospital, la amiodarona aumentó significativamente la posibilidad de resucitación y admisión en el hospital: 44% en el grupo tratado con amiodarona frente al 34% en el grupo tratado con placebo, p = 0,03. Después del ajuste por otros factores de resultado independientes, el odds ratio ajustado para la supervivencia en el momento del ingreso hospitalario en el grupo de la amiodarona comparado con el grupo placebo fue de 1,6 (intervalo de confianza del 95%, 1,1 a 2,4; p = 0,02). Más pacientes en el grupo de la amiodarona, comparado con el grupo placebo, sufrieron hipotensión (59% frente a 25%, p = 0,04) o bradicardia (41% frente a 25 %, p = 0,004). En el estudio ALIVE, 347 pacientes con fibrilación ventricular que persiste a 3 intentos de desfibrilación y epinefrina, y a un intento de desfibrilación posterior, o con fibrilación ventricular recurrente tras un intento de desfibrilación eléctrica con éxito, se asignaron aleatoriamente para recibir amiodarona (5 mg por kilogramo de peso estimado, diluido en 30 ml de dextrosa al 5 %) y lidocaína simulando placebo, o lidocaína (1,5 mg por kilogramo a una concentración de 10 mg por mililitro) y amiodarona simulando placebo conteniendo el mismo disolvente (polisorbato 80). De los 347 pacientes reclutados, la amiodarona aumentó significativamante la posibilidad de resucitación y admisión en el hospital: 22,8% en el grupo amiodarona (41 pacientes de 180) y 12% en el grupo de la lidocaína (2 pacientes de 167), p = 0,009. Después del ajuste por otros factores que pueden influir en la probabilidad de supervivencia, el odds ratio ajustado para la supervivencia en el momento del ingreso hospitalario en pacientes que recibieron amiodarona comparado con los que recibieron lidocaína fue de 2,49 (intervalo de confianza del 95%, 1,28 a 4,85; p = 0,007). No hubo diferencias entre los grupos tratamiento en la proporción de pacientes que necesitaron tratamiento por bradicardia con atropina o tratamiento vasopresor con dopamina o en las proporciones de pacientes que recibieron lidocaína en el grupo abierto. La proporción de pacientes en los que la asistolia ocurre tras los intentos de desfibrilación, después de la administración del medicamento inicial de estudio, fue significativamente mayor en el grupo que recibió lidocaína (28,9%) que en el grupo tratado con amiodarona (18,4%), p = 0,04. Población pediátrica No se ha realizado ningún estudio pediátrico controlado. En estudios publicados se evaluó la seguridad de amiodarona en pacientes pediátricos con varias arritmias. Se utilizaron las siguientes dosis en los ensayos clínicos pediátricos: Oral - Dosis de inicio: de 10 a 20 mg/kg/día de 7 a 10 días (o 500 mg/m 2 /día si se expresa por metro cuadrado), 10
11 - dosis de mantenimiento: debe utilizarse la dosis mínima efectiva; dependiendo de la respuesta individual, podría variar de 5 a 10 mg/kg/día (o 250 mg/m 2 /día si se expresa por metro cuadrado), Intravenoso - Dosis de inicio: 5 mg/kg de peso corporal de 20 minutos a 2 horas, - dosis de mantenimiento: de 10 a 15 mg/kg/día desde pocas horas a varios días. Si fuera necesario un tratamiento por vía oral se podría iniciar de forma concomitante a la dosis de inicio habitual. 5.2 Propiedades farmacocinéticas Tras la inyección, las concentraciones séricas de amiodarona rápidamente disminuyen al impregnarse los tejidos. Las concentraciones plasmáticas máximas se alcanzan a los 15 minutos tras la inyección y luego disminuyen durante las 4 horas siguientes. En ausencia de dosis repetidas, el fármaco se elimina gradualmente; el fármaco se acumula en el tejido cuando las inyecciones son repetidas o se continúa con terapia oral. El principal metabolito activo de amiodarona en humanos es la desetilamiodarona (DEA). Se piensa que la enzima responsable de la desetilación es el citocromo P450 3A4. Amiodarona se elimina principalmente por metabolismo hepático y excreción biliar. La eliminación urinaria es mínima tanto de amiodarona como de DEA. Los valores medios de los parámetros farmacocinéticos para la amiodarona después de una dosis única de amiodarona i.v. (5 mg/kg en 15 minutos) son los siguientes: aclaramiento: ml/h/kg; volumen de distribución central: 0,2 L/kg y en fase estacionaria: L/kg y t½ : días. Asimismo para su metabolito activo son: aclaramiento: ml/h/kg; volumen de distribución en fase estacionaria: L/kg y t½ : t½ de amiodarona. La edad, sexo, alteraciones en la función renal o hepática no presentan efectos marcados sobre la disposición de amiodarona ni su metabolito activo. Población pediátrica No se ha realizado ningún estudio pediátrico controlado. En estudios publicados en pacientes pediátricos, no hubo ninguna diferencia destacada comparado con adultos. 5.3 Datos preclínicos sobre seguridad Toxicidad aguda La toxicidad aguda de amiodarona clorhidrato es relativamente baja y los valores de LD 50 son algo mayores de 3 g/kg peso corporal. Los síntomas clínicos son vómitos en perros y efectos a nivel de SNS (sedación, temblor, convulsiones y dificultades para respirar) en roedores. Toxicidad crónica/toxicidad subcrónica 11
12 En estudios de toxicidad crónica, amiodarona clorhidrato produjo efectos tóxicos similares en animales y en humanos. Amiodarona clorhidrato produjo daño pulmonar (fibrosis, fosfolipidosis; en hámsters, ratas y perros) así como alteraciones a nivel de SNS (en ratas). El estrés oxidativo y los radicales libres parecen jugar un papel importante en el daño pulmonar. Además, amiodarona clorhidrato produjo daño hepático en ratas. Amiodarona tuvo efectos indirectos en los lípidos séricos con cambios en las concentraciones plasmáticas de las hormonas tiroideas. Potencial mutagénico y carcinogénico En un estudio carcinogenético en ratas, amiodarona clorhidrato causó un aumento de tumores foliculares de la glándula tiroides (en animales macho desde 5 mg/kg/día y en hembras desde 16 mg/kg/día). Estos efectos parecen estar causados por la acción de la amiodarona clorhidrato en la síntesis y/o liberación de hormonas tiroideas, y por lo tanto, estas investigaciones no indican ningún potencial carcinogénico en el uso terapéutico de amiodarona clorhidrato en humanos. 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes Cada ampolla contiene: alcohol bencílico, polisorbato 80, y agua para preparaciones inyectables. 6.2 Incompatibilidades La utilización de equipo médico o productos sanitarios que contengan material plástico de tipo DEHP (di-2-etilexil ftalato) en presencia de amiodarona puede producir la dilución de DEHP. Con el fin de minimizar la exposición de los pacientes al DEHP, la dilución final de amiodarona para infusión debe administrarse preferiblemente con materiales que no contengan DEHP. Ver sección Periodo de validez 2 años. 6.4 Precauciones especiales de conservación Las ampollas no se deben conservar a temperatura superior a 25 C. Proteger de la luz. 6.5 Naturaleza y contenido del envase Ampolla de vidrio incoloro de tipo I. Trangorex solución inyectable se presenta en envases de 6 ampollas conteniendo cada ampolla 3 ml de solución inyectable. 6.6 Precauciones especiales de eliminación y otras manipulaciones Por razones galénicas no emplear concentraciones menores de 600 mg/litro de suero glucosado isotónico de dextrosa al 5%, ni otro diluyente que el citado. Evitar la extravasación del líquido inyectado. No mezclar ningún otro producto en el líquido de perfusión. No administrar una segunda inyección i.v. directa antes de haber transcurrido 15 minutos de la primera. 12
13 La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN sanofi-aventis, S.A. C/ Josep Pla Barcelona 8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN 02 abril 1980 / 02 junio FECHA DE LA REVISIÓN DEL TEXTO Junio
FICHA TÉCNICA. Excipiente con efecto conocido: alcohol bencílico 60 mg por ampolla (20 mg/ml).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Trangorex 150 mg/3ml solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla de 3 ml contiene 150 mg de amiodarona clorhidrato. Excipiente con
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Trangorex 150 mg/3ml solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla de 3 ml contiene 150 mg de amiodarona clorhidrato. Excipiente con
FICHA TECNICA. La vía oral se utilizará para el tratamiento prolongado y la estabilización inicial.
 1. NOMBRE DEL MEDICAMENTO TRANGOREX 200 mg comprimidos FICHA TECNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Amiodarona (D.C.I.) clorhidrato... 200 mg Excipientes:Cada comprimido contiene 71 mg de lactosa.
1. NOMBRE DEL MEDICAMENTO TRANGOREX 200 mg comprimidos FICHA TECNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Amiodarona (D.C.I.) clorhidrato... 200 mg Excipientes:Cada comprimido contiene 71 mg de lactosa.
FICHA TECNICA DE TRANGOREX comprimidos
 FICHA TECNICA DE TRANGOREX comprimidos 1. DENOMINACIÓN DEL MEDICAMENTO TRANGOREX, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Amiodarona (D.C.I.) clorhidrato... 200 mg Lista de excipientes,
FICHA TECNICA DE TRANGOREX comprimidos 1. DENOMINACIÓN DEL MEDICAMENTO TRANGOREX, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Amiodarona (D.C.I.) clorhidrato... 200 mg Lista de excipientes,
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
Lección 30. Fármacos Antiarrítmicos UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS. Ricardo Brage e Isabel Trapero - Farmacología Lección 30
 Ricardo Brage e Isabel Trapero - Lección 30 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 30 Fármacos Antiarrítmicos Guión Ricardo Brage e Isabel Trapero - Lección 30 1. BASES CONCEPTUALES
Ricardo Brage e Isabel Trapero - Lección 30 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 30 Fármacos Antiarrítmicos Guión Ricardo Brage e Isabel Trapero - Lección 30 1. BASES CONCEPTUALES
FARMACOS ANTIARRITMICOS. Arritmias Supraventriculares
 FARMACOS ANTIARRITMICOS 3er. Año Enfermería Lunes 14 de Mayo de 2012 Prof. Asoc. Gabriela Díaz-Véliz, M. Sci., M. Ed. Programa Farmacología Molecular y Clínica ICBM, Facultad de Medicina Universidad de
FARMACOS ANTIARRITMICOS 3er. Año Enfermería Lunes 14 de Mayo de 2012 Prof. Asoc. Gabriela Díaz-Véliz, M. Sci., M. Ed. Programa Farmacología Molecular y Clínica ICBM, Facultad de Medicina Universidad de
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Trangorex 200 mg comprimidos Amiodarona
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Trangorex 200 mg comprimidos Amiodarona Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto, ya que puede tener
PROSPECTO: INFORMACIÓN PARA EL USUARIO Trangorex 200 mg comprimidos Amiodarona Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto, ya que puede tener
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
SOPORTE VITAL AVANZADO. Fármacos PLAN NACIONAL DE RCP LOS PROFESIONALES DEL ENFERMO CRÍTICO
 5 PLAN NACIONAL DE RCP LOS PROFESIONALES DEL ENFERMO CRÍTICO OBJETIVOS Proporcionar los conocimientos necesarios sobre los fármacos esenciales en la RCP: A. Adrenalina. B. Atropina - Magnesio - Lidocaina
5 PLAN NACIONAL DE RCP LOS PROFESIONALES DEL ENFERMO CRÍTICO OBJETIVOS Proporcionar los conocimientos necesarios sobre los fármacos esenciales en la RCP: A. Adrenalina. B. Atropina - Magnesio - Lidocaina
LLD Abreviado de Zoloft. Todo medicamento debe conservarse fuera del alcance de los niños.
 LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
DRONEDARONA. Dr Antonio Címbora Ortega. Servicio de Cardiología Hospital de Mérida
 DRONEDARONA Dr Antonio Címbora Ortega. Servicio de Cardiología Hospital de Mérida FARMACOLOGÍA ESTUDIOS CONCLUSIONES 1. FARMACOLOGÍA La Dronedarona es una molécula de benzofurano relacionada con la Amiodarona
DRONEDARONA Dr Antonio Címbora Ortega. Servicio de Cardiología Hospital de Mérida FARMACOLOGÍA ESTUDIOS CONCLUSIONES 1. FARMACOLOGÍA La Dronedarona es una molécula de benzofurano relacionada con la Amiodarona
- Como disolvente de medicamentos en polvo o liofilizados, previamente a su administración. - Como diluyente de soluciones y/o medicamentos.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables SERRACLINICS. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen agua para preparaciones inyectables. ph: 5,0-7,0
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables SERRACLINICS. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen agua para preparaciones inyectables. ph: 5,0-7,0
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
FICHA TÉCNICA. Vispring 500 microgramos/ml colirio en solución en envases unidosis
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vispring 500 microgramos/ml colirio en solución en envases unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de colirio en solución contiene: Tetrizolina
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vispring 500 microgramos/ml colirio en solución en envases unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de colirio en solución contiene: Tetrizolina
FICHA TÉCNICA. Tratamiento de la incontinencia urinaria asociada a la insuficiencia del esfínter uretral en la perra.
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
FICHA TÉCNICA. Azelastina hidrocloruro al 0,05% (0,5 mg/ml). Cada gota contiene 0,015 mg de azelastina hidrocloruro
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
PROSPECTO: INFORMACIÓN PARA EL USUARIO. CITICOLINA Normon 1000 mg solución inyectable EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO CITICOLINA Normon 1000 mg solución inyectable EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante
PROSPECTO: INFORMACIÓN PARA EL USUARIO CITICOLINA Normon 1000 mg solución inyectable EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante
Cordarone. Amiodarona Clorhidrato Comprimidos 200 mg Vía oral COMPOSICIÓN
 Cordarone Amiodarona Clorhidrato Comprimidos 200 mg Vía oral COMPOSICIÓN Cordarone comprimidos Cada comprimido contiene: Amiodarona Clorhidrato 200 mg. Excipientes: Lactosa en polvo, almidón de maíz, polivinilpirrolidona,
Cordarone Amiodarona Clorhidrato Comprimidos 200 mg Vía oral COMPOSICIÓN Cordarone comprimidos Cada comprimido contiene: Amiodarona Clorhidrato 200 mg. Excipientes: Lactosa en polvo, almidón de maíz, polivinilpirrolidona,
ARRITMIAS. TRATAMIENTO
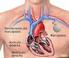 ARRITMIAS. RITMO SINUSAL BRADIARRITMIAS ALGORITMO BRADICARDIA Atropina 500 μgr. iv. Respuesta satisfactoria? NO SI SIGNOS ADVERSOS? TA sistólica < 90 mmhg FC < 40 lat/min. Arritmias ventriculares Fallo
ARRITMIAS. RITMO SINUSAL BRADIARRITMIAS ALGORITMO BRADICARDIA Atropina 500 μgr. iv. Respuesta satisfactoria? NO SI SIGNOS ADVERSOS? TA sistólica < 90 mmhg FC < 40 lat/min. Arritmias ventriculares Fallo
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO LAMBDALINA 40 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 g de crema contiene 40 mg de lidocaína Excipientes:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO LAMBDALINA 40 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 g de crema contiene 40 mg de lidocaína Excipientes:
FICHA TÉCNICA. Por sobre: Acetato de calcio, 2,5 g (equivale a 635 mg de calcio), almidón de maíz, manitol (E421)
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
CRONODINE (Diltiazem clorhidrato)
 CRONODINE (Diltiazem clorhidrato) 1. NOMBRE DEL MEDICAMENTO: CRONODINE 120 mg y 240 mg 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: CRONODINE 120: Diltiazem (DCI) clorhidrato 120 mg CRONODINE 240: Diltiazem
CRONODINE (Diltiazem clorhidrato) 1. NOMBRE DEL MEDICAMENTO: CRONODINE 120 mg y 240 mg 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: CRONODINE 120: Diltiazem (DCI) clorhidrato 120 mg CRONODINE 240: Diltiazem
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DICLOVET 50 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DICLOVET 50 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
La osmolaridad calculada de la solución es de 154 mosm/l y el ph de 4,5-7,0. El contenido teórico en sodio y en cloruro es de 77 mmol/l.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Cloruro de Sodio Grifols 0,45% solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml de solución contienen: Cloruro de sodio, 0,45 g La osmolaridad
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Cloruro de Sodio Grifols 0,45% solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml de solución contienen: Cloruro de sodio, 0,45 g La osmolaridad
Departamento de Farmacología y Terapéutica. Antiarrítmicos. Dra. Camila Ramos DFT Septiembre 2013
 Departamento de Farmacología y Terapéutica Antiarrítmicos Dra. Camila Ramos DFT Septiembre 2013 ECG normal Conceptos... Frecuencia cardíaca: manifiesta el automatismo del nódulo sinusal P: propagación
Departamento de Farmacología y Terapéutica Antiarrítmicos Dra. Camila Ramos DFT Septiembre 2013 ECG normal Conceptos... Frecuencia cardíaca: manifiesta el automatismo del nódulo sinusal P: propagación
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SUPOSITORIO BRONQUIAL LACTANTE SUPOSITORIO ANALGÉSICO, EXPECTORANTE BALSÁMICO Página 1 SUPOSITORIO BRONQUIAL LACTANTE
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SUPOSITORIO BRONQUIAL LACTANTE SUPOSITORIO ANALGÉSICO, EXPECTORANTE BALSÁMICO Página 1 SUPOSITORIO BRONQUIAL LACTANTE
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MAGNESIUM PYRE 64 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MAGNESIUM PYRE 64 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 64 mg de magnesio (en forma de 550 mg de cloruro de magnesio,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MAGNESIUM PYRE 64 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 64 mg de magnesio (en forma de 550 mg de cloruro de magnesio,
Alivio de los sofocos que aparecen durante la menopausia como consecuencia de la deprivación estrogénica.
 1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
CENAVUL Suspensión inyectable
 Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
Enfermedad del nodo sinusal Lunes, 18 de Noviembre de :25 - Actualizado Sábado, 28 de Mayo de :25
 Qué es la enfermedad del nodo sinusal? Se puede definir la enfermedad del nodo sinusal como el conjunto de alteraciones electrocardiográficas, con o sin manifestaciones clínicas, secundarias a un funcionamiento
Qué es la enfermedad del nodo sinusal? Se puede definir la enfermedad del nodo sinusal como el conjunto de alteraciones electrocardiográficas, con o sin manifestaciones clínicas, secundarias a un funcionamiento
FICHA TÉCNICA. La duración estimada del tratamiento será de dos semanas.
 FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD UVALETTE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Contenido por comprimido recubierto: - 120,00 mg de extracto seco etanólico al 30%, de planta entera de Taraxacum
FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD UVALETTE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Contenido por comprimido recubierto: - 120,00 mg de extracto seco etanólico al 30%, de planta entera de Taraxacum
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FARMACOCINÉTICA Y METABOLISMO
 RYTMOL Propafenona Noas Farma Uruguay La propafenona es un antiarrítmico de la clase 1C. Los antiarrítmicos de la clase 1C entre ellos la propafenona bloquea los canales rápidos de sodio disminuyendo la
RYTMOL Propafenona Noas Farma Uruguay La propafenona es un antiarrítmico de la clase 1C. Los antiarrítmicos de la clase 1C entre ellos la propafenona bloquea los canales rápidos de sodio disminuyendo la
1. NOMBRE DEL MEDICAMENTO. VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio activo: Extracto seco
1. NOMBRE DEL MEDICAMENTO VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio activo: Extracto seco
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ventolin 5 mg/ml solución para inhalación por nebulizador 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Ventolin 5 mg/ml
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ventolin 5 mg/ml solución para inhalación por nebulizador 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Ventolin 5 mg/ml
FICHA TÉCNICA. Virus de la gripe fraccionados*, inactivados, que contienen antígenos equivalentes a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
1. Tratamiento del estreñimiento 2. Tratamiento de la encefalopatia hepática (encefalopatía porto-sistémica); coma hepático
 1. NOMBRE DEL MEDICAMENTO Lactulosa Resolution 3,3 g/5 ml, solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 5 mililitros de solución oral contienen 3,3 g de lactulosa Para la lista completa
1. NOMBRE DEL MEDICAMENTO Lactulosa Resolution 3,3 g/5 ml, solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 5 mililitros de solución oral contienen 3,3 g de lactulosa Para la lista completa
ACTUACIÓN N EN ARRITMIAS EN LOS SERVICIOS DE URGENCIAS
 ACTUACIÓN N EN ARRITMIAS EN LOS SERVICIOS DE URGENCIAS EL ELECTROCARDIOGRAMA ÀNGELS CURCÓ CHIMENO MÉDICO ADJUNTO SERVICIO URGENCIAS HOSPITAL GENERAL DE CASTELLÓN TRATAMIENTO DE LAS ARRITMIAS SIGNOS ADVERSOS
ACTUACIÓN N EN ARRITMIAS EN LOS SERVICIOS DE URGENCIAS EL ELECTROCARDIOGRAMA ÀNGELS CURCÓ CHIMENO MÉDICO ADJUNTO SERVICIO URGENCIAS HOSPITAL GENERAL DE CASTELLÓN TRATAMIENTO DE LAS ARRITMIAS SIGNOS ADVERSOS
1.- NOMBRE DEL MEDICAMENTO. ATEPODIN INYECTABLE 2.- COMPOSICIÓN CUANTITATIVA Y CUALITATIVA. Adenosina Trifosfato (sal disódica)
 FICHA TECNICA agencia española de medicamentos y productos sanitarios 1.- NOMBRE DEL MEDICAMENTO. ATEPODIN INYECTABLE 2.- COMPOSICIÓN CUANTITATIVA Y CUALITATIVA. Composición Adenosina Trifosfato (sal disódica)
FICHA TECNICA agencia española de medicamentos y productos sanitarios 1.- NOMBRE DEL MEDICAMENTO. ATEPODIN INYECTABLE 2.- COMPOSICIÓN CUANTITATIVA Y CUALITATIVA. Composición Adenosina Trifosfato (sal disódica)
FICHA TÉCNICA. La dosis debe ajustarse según los requerimientos individuales de agua y electrolitos:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Suero Fisiológico Vitulia 0,9 % solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición Principio Activo Cloruro de sodio Por 100 ml 0,9 g
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Suero Fisiológico Vitulia 0,9 % solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición Principio Activo Cloruro de sodio Por 100 ml 0,9 g
Para la lista completa de excipientes, véase la sección Indicaciones de uso, especificando las especies de destino
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 2 mg/ml solución inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam Excipientes: Etanol 2 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 2 mg/ml solución inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam Excipientes: Etanol 2 mg
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. RESINCALCIO polvo para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RESINCALCIO polvo para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 g de polvo para suspensión oral contienen 99,75 g de poliestireno sulfonato
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RESINCALCIO polvo para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 g de polvo para suspensión oral contienen 99,75 g de poliestireno sulfonato
PROSPECTO. CEFTRIAXONA REIG JOFRÉ 1 g IM. Polvo y disolvente para solución inyectable. E.F.G. Ceftriaxona (D.C.I.)
 PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico.
PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico.
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 BROMHEXINA 4 mg/5 ml JARABE MUCOLÍTICO, EXPECTORANTE Página 1 BROMHEXINA 4 mg/5 ml Jarabe Principio Activo Bromhexina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 BROMHEXINA 4 mg/5 ml JARABE MUCOLÍTICO, EXPECTORANTE Página 1 BROMHEXINA 4 mg/5 ml Jarabe Principio Activo Bromhexina
CATEGORIAS DE ARRITMIAS
 CATEGORIAS DE ARRITMIAS Las arritmias generalmente se dividen en dos categorías: ventriculares y supraventriculares. Las arritmias ventriculares se producen en las cavidades inferiores del corazón, denominadas
CATEGORIAS DE ARRITMIAS Las arritmias generalmente se dividen en dos categorías: ventriculares y supraventriculares. Las arritmias ventriculares se producen en las cavidades inferiores del corazón, denominadas
FICHA TÉCNICA. ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA 3. FORMA FARMACÉUTICA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Emeprid 1 mg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Emeprid 1 mg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO. URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Benzbromarona (D.C.I.)...100 mg
FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Benzbromarona (D.C.I.)...100 mg
ACTUALIZACIÓN CLÍNICA EN URGENCIAS EN ATENCIÓN PRIMARIA SOPORTE VITAL AVANZADO PEDIÁTRICO. Ritmos de paro cardiaco
 ACTUALIZACIÓN CLÍNICA EN URGENCIAS EN ATENCIÓN PRIMARIA SOPORTE VITAL AVANZADO PEDIÁTRICO Ritmos de paro cardiaco INTRODUCCIÓN El diagnóstico del ritmo cardiaco durante una parada cardiorrespiratoria en
ACTUALIZACIÓN CLÍNICA EN URGENCIAS EN ATENCIÓN PRIMARIA SOPORTE VITAL AVANZADO PEDIÁTRICO Ritmos de paro cardiaco INTRODUCCIÓN El diagnóstico del ritmo cardiaco durante una parada cardiorrespiratoria en
Psicofàrmacos. Escuela de parteras 2013
 Psicofàrmacos Escuela de parteras 2013 Psicofàrmacos Fàrmacos que actùan sobre las funciones cerebrales como sedantes o estimulantes, lo que produce cambios en la percepciòn, estado de ànimo, conciencia
Psicofàrmacos Escuela de parteras 2013 Psicofàrmacos Fàrmacos que actùan sobre las funciones cerebrales como sedantes o estimulantes, lo que produce cambios en la percepciòn, estado de ànimo, conciencia
PROSPECTO: INFORMACIÓN PARA EL USUARIO. ACETILCISTEÍNA BEXAL 100 mg polvo para solución oral EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO ACETILCISTEÍNA BEXAL 100 mg polvo para solución oral EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya
PROSPECTO: INFORMACIÓN PARA EL USUARIO ACETILCISTEÍNA BEXAL 100 mg polvo para solución oral EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Principio activo: 18,42 mg de benazepril (equivalente a 20 mg de benazepril hidrocloruro)
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BENAKOR 20 mg COMPRIMIDOS PARA PERROS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BENAKOR 20 mg COMPRIMIDOS PARA PERROS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio
Excipientes con efecto conocido: propilenglicol 200 mg/g
 FELDENE* 0.5% (Piroxicam) Gel 1. NOMBRE DEL PRODUCTO FARMACÉUTICO FELDENE* 0.5% Gel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 gramos de FELDENE 0.5% Gel contiene: Piroxicam 0.5 g Excipientes con
FELDENE* 0.5% (Piroxicam) Gel 1. NOMBRE DEL PRODUCTO FARMACÉUTICO FELDENE* 0.5% Gel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 gramos de FELDENE 0.5% Gel contiene: Piroxicam 0.5 g Excipientes con
4.2 Indicaciones de uso, especificando las especies a las que va destinado
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 1 mg comprimidos masticables para perros Metacam 2,5 mg comprimidos masticables para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 1 mg comprimidos masticables para perros Metacam 2,5 mg comprimidos masticables para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
4.2 Indicaciones de uso, especificando las especies a las que va destinado
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 5 mg/ml solución inyectable para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Principio activo: Meloxicam Excipientes:
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 5 mg/ml solución inyectable para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Principio activo: Meloxicam Excipientes:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SILDENAFIL PARA HOMBRES 50 mg COMPRIMIDOS RECUBIERTOS PARA LA DISFUNCIÓN ERÉCTIL Página 1 SILDENAFIL PARA HOMBRES
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SILDENAFIL PARA HOMBRES 50 mg COMPRIMIDOS RECUBIERTOS PARA LA DISFUNCIÓN ERÉCTIL Página 1 SILDENAFIL PARA HOMBRES
FICHA DE INFORMACIÓN AL PACIENTE: VERAPAMILO
 FICHA DE INFORMACIÓN AL PACIENTE: VERAPAMILO 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Antihipertensivo, antianginoso y antiarrítmico, bloqueante de los canales del calcio. 1.2 Cómo actúa este fármaco:
FICHA DE INFORMACIÓN AL PACIENTE: VERAPAMILO 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Antihipertensivo, antianginoso y antiarrítmico, bloqueante de los canales del calcio. 1.2 Cómo actúa este fármaco:
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina
 FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA TECNICA. Adultos en prediálisis o en diálisis: 1 dosis (40 µg) de 1 ml en cada inyección.
 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
Se recomiendan las siguientes modificaciones en caso de disfunción renal.
 1. NOMBRE DEL MEDICAMENTO ACICLOVIR TEDEC 25 mg/ml solución para perfusión EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla contiene: Aciclovir (D.O.E.) 250 mg Para excipientes, ver 6.1. 3. FORMA
1. NOMBRE DEL MEDICAMENTO ACICLOVIR TEDEC 25 mg/ml solución para perfusión EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla contiene: Aciclovir (D.O.E.) 250 mg Para excipientes, ver 6.1. 3. FORMA
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
Universidad Abierta Interamericana
 RESUCITACION CARDIOPULMONAR Guillermo Chiappero HOSPITAL UNIVERSITARIO UAI SATI RESUCITACION CARDIOPULMONAR MUERTE SUBITA Ritmo inicial en Muerte Súbita Holter TV/FV 79% Brad. 21% Bayes y col 1989 RESUCITACION
RESUCITACION CARDIOPULMONAR Guillermo Chiappero HOSPITAL UNIVERSITARIO UAI SATI RESUCITACION CARDIOPULMONAR MUERTE SUBITA Ritmo inicial en Muerte Súbita Holter TV/FV 79% Brad. 21% Bayes y col 1989 RESUCITACION
Cómo funciona una Unidad de Insuficiencia Cardiaca?
 2 Curso de Aspectos Prácticos en Cardiología Clínica Cómo funciona una Unidad de Insuficiencia Cardiaca? Dr. Ramón Bover Unidad de Insuficiencia Cardiaca Servicio de Cardiología Insuficiencia Cardiaca
2 Curso de Aspectos Prácticos en Cardiología Clínica Cómo funciona una Unidad de Insuficiencia Cardiaca? Dr. Ramón Bover Unidad de Insuficiencia Cardiaca Servicio de Cardiología Insuficiencia Cardiaca
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FORDIURAN 1 mg Comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Bumetanida 1 mg. Excipientes: 100 mg de almidón de maíz y 52,3
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FORDIURAN 1 mg Comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Bumetanida 1 mg. Excipientes: 100 mg de almidón de maíz y 52,3
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO EQUIPULMIN 25 microgramos/ml JARABE PARA CABALLOS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO EQUIPULMIN 25 microgramos/ml JARABE PARA CABALLOS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO Hodernal 800 mg/ml solución oral Parafina líquida 1. NOMBRE DEL MEDICAMENTO Hodernal 800 mg/ml solución oral. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO Hodernal 800 mg/ml solución oral Parafina líquida 1. NOMBRE DEL MEDICAMENTO Hodernal 800 mg/ml solución oral. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA
ANEXO III ENMIENDA DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y PROSPECTO
 ANEXO III ENMIENDA DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y PROSPECTO 1 ENMIENDA A INCLUIR EN LAS SECCIONES RELEVANTES DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL
ANEXO III ENMIENDA DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y PROSPECTO 1 ENMIENDA A INCLUIR EN LAS SECCIONES RELEVANTES DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
PROPUESTA DE FICHA TÉCNICA
 PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CALCIO-500 D COMPRIMIDOS RECUBIERTOS SUPLEMENTO MINERAL Página 1 CALCIO-500 D Comprimidos Recubiertos Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CALCIO-500 D COMPRIMIDOS RECUBIERTOS SUPLEMENTO MINERAL Página 1 CALCIO-500 D Comprimidos Recubiertos Principio
La osmolaridad calculada de la solución es de 307 mosm/l y el ph de 4,5-7,0. El contenido teórico en sodio y en cloruro es de 154 mmol/l.
 1. NOMBRE DEL MEDICAMENTO Fleboflex Salina Fisiológica Grifols Solución para perfusión Cloruro de sodio 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml de solución contienen: Cloruro de sodio (D.C.I.),
1. NOMBRE DEL MEDICAMENTO Fleboflex Salina Fisiológica Grifols Solución para perfusión Cloruro de sodio 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml de solución contienen: Cloruro de sodio (D.C.I.),
No. el alcohol no altera el mecanismo de acción o los efectos del Andanza.
 GUÍA SOBRE 1 1. Qué es Es un fármaco aprobado para su uso como adyuvante, del plan alimentario hipocalórico y la práctica de ejercicio, en el manejo del sobrepeso y la obesidad en adolescentes y adultos.
GUÍA SOBRE 1 1. Qué es Es un fármaco aprobado para su uso como adyuvante, del plan alimentario hipocalórico y la práctica de ejercicio, en el manejo del sobrepeso y la obesidad en adolescentes y adultos.
THIPENTHAL. TIOPENTAL SÓDICO 1 g INYECTABLE. VENTA BAJO RECETA ARCHIVADA (Lista III) FÓRMULA CUALI Y CUANTITATIVA. Cada frasco ampolla contiene:
 THIPENTHAL TIOPENTALSÓDICO1g INYECTABLE VENTABAJORECETAARCHIVADA(ListaIII) FÓRMULACUALIYCUANTITATIVA Cadafrascoampollacontiene: Tiopentalsódicoestéril 1g ACCIÓNTERAPÉUTICA: Anestésicogeneral,barbitúrico.CódigoATC:N01AF03.
THIPENTHAL TIOPENTALSÓDICO1g INYECTABLE VENTABAJORECETAARCHIVADA(ListaIII) FÓRMULACUALIYCUANTITATIVA Cadafrascoampollacontiene: Tiopentalsódicoestéril 1g ACCIÓNTERAPÉUTICA: Anestésicogeneral,barbitúrico.CódigoATC:N01AF03.
TUSQUIM Paracetamol - Dextrometorfano bromhidrato - Fenilefrina clorhidrato Bromhexina clorhidrato Tabletas Recubiertas
 TUSQUIM Paracetamol - Dextrometorfano bromhidrato - Fenilefrina clorhidrato Bromhexina clorhidrato Tabletas Recubiertas TUSQUIM Comprimidos recubiertos Antitusivo Analgésico Antipirético Mucolítico COMPOSICION:
TUSQUIM Paracetamol - Dextrometorfano bromhidrato - Fenilefrina clorhidrato Bromhexina clorhidrato Tabletas Recubiertas TUSQUIM Comprimidos recubiertos Antitusivo Analgésico Antipirético Mucolítico COMPOSICION:
FICHA TÉCNICA. CLORURO SÓDICO SERRA PAMIES 9 mg/ml disolvente para uso parenteral Cloruro de sodio
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO CLORURO SÓDICO SERRA PAMIES 9 mg/ml disolvente para uso parenteral Cloruro de sodio 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición centesimal: Electrolitos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO CLORURO SÓDICO SERRA PAMIES 9 mg/ml disolvente para uso parenteral Cloruro de sodio 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición centesimal: Electrolitos
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Fevaxyn Pentofel, suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Fevaxyn Pentofel, suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Excipientes con efecto conocido: Cada gramo de crema contiene 200 mg de propilenglicol, 75 mg de alcohol estearílico y 20 mg de alcohol cetílico.
 1. NOMBRE DEL MEDICAMENTO Ketoisdin 20 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene 20 mg de ketoconazol. Excipientes con efecto conocido: Cada gramo de crema contiene
1. NOMBRE DEL MEDICAMENTO Ketoisdin 20 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene 20 mg de ketoconazol. Excipientes con efecto conocido: Cada gramo de crema contiene
Reducción de la viscosidad de las secreciones mucosas, facilitando su expulsión, en resfriados y procesos gripales para niños de 2 a 12 años.
 1. NOMBRE DEL MEDICAMENTO Bisolvon Mucolítico infantil 0,8 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene 0,8 mg de bromhexina hidrocloruro. Excipientes con efecto conocido: Maltitol
1. NOMBRE DEL MEDICAMENTO Bisolvon Mucolítico infantil 0,8 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene 0,8 mg de bromhexina hidrocloruro. Excipientes con efecto conocido: Maltitol
FICHA TÉCNICA. Cada comprimido contiene 250 mg de halofantrina hidrocloruro (equivalente a 233 mg de base libre).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Halfan 250 mg Comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 250 mg de halofantrina hidrocloruro (equivalente a 233 mg de base libre).
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Halfan 250 mg Comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 250 mg de halofantrina hidrocloruro (equivalente a 233 mg de base libre).
LABORATORIOS NORMON, S.A.
 1. NOMBRE DEL MEDICAMENTO normoval 250 mg comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto de normoval contiene: 250 mg de extracto hidroalcohólico seco de raíz
1. NOMBRE DEL MEDICAMENTO normoval 250 mg comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto de normoval contiene: 250 mg de extracto hidroalcohólico seco de raíz
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO IMIZOL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO IMIZOL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
Pacientes de edad avanzada: debe considerarse la conveniencia de ampliar el intervalo de dosificación (Ver Propiedades Famacocinéticas).
 FT290191-B+2 1. NOMBRE DEL MEDICAMENTO DARVON 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextropropoxifeno (D.C.I.) napsilato 100 mg. 3. FORMA FARMACÉUTICA Cápsulas para administración por vía oral. 4.
FT290191-B+2 1. NOMBRE DEL MEDICAMENTO DARVON 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextropropoxifeno (D.C.I.) napsilato 100 mg. 3. FORMA FARMACÉUTICA Cápsulas para administración por vía oral. 4.
La Tormenta Eléctrica
 ATIARRITMICOS Y DISPOSITIVOS La Tormenta Eléctrica You're in my mind all of the time I know that's not enough If the sky can crack there must be someway back For love and only love Electrical Storm Electrical
ATIARRITMICOS Y DISPOSITIVOS La Tormenta Eléctrica You're in my mind all of the time I know that's not enough If the sky can crack there must be someway back For love and only love Electrical Storm Electrical
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
Cada ml contiene levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina.
 1. NOMBRE DEL MEDICAMENTO Bilina 0,5 mg/ml colirio en suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina. Excipiente
1. NOMBRE DEL MEDICAMENTO Bilina 0,5 mg/ml colirio en suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina. Excipiente
SERPIENTES Definición:
 SERPIENTES Definición: Las serpientes u ofidios son reptiles caracterizados por la ausencia de extremidades y un cuerpo muy alargado. En España hay solo dos familias de serpientes venenosas: las víboras
SERPIENTES Definición: Las serpientes u ofidios son reptiles caracterizados por la ausencia de extremidades y un cuerpo muy alargado. En España hay solo dos familias de serpientes venenosas: las víboras
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Glucosamina KERN PHARMA 1.500 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Glucosamina KERN PHARMA 1.500 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre
LEXATUSSIN Dextrometorfano Bromhidrato 15 mg / 5 ml Jarabe
 LEXATUSSIN Dextrometorfano Bromhidrato 15 mg / 5 ml Jarabe LEXATUSSIN (Dextrometorfano Bromhidrato 15 mg/5 ml) Jarabe COMPOSICIÓN: Cada 100 ml de Jarabe contiene: Dextrometorfano Bromhidrato monohidrato...
LEXATUSSIN Dextrometorfano Bromhidrato 15 mg / 5 ml Jarabe LEXATUSSIN (Dextrometorfano Bromhidrato 15 mg/5 ml) Jarabe COMPOSICIÓN: Cada 100 ml de Jarabe contiene: Dextrometorfano Bromhidrato monohidrato...
