HercepTest for Dako Autostainer
|
|
|
- Consuelo San Martín Venegas
- hace 6 años
- Vistas:
Transcripción
1 HercepTest for Dako Autostainer N de catálogo K ª edición Para tinción inmunocitoquímica. El kit es para 50 pruebas (100 portaobjetos). ( ) P04455ES_01_K / p. 1/53
2 Índice Página Indicaciones de uso 4 Resumen y explicación - Mama 5 Antecedentes 5 Características 5 Principio del procedimiento - Mama 5 Reactivos - Mama 6 Materiales suministrados 6 Materiales necesarios que no se suministran 7 Almacenamiento - Mama 8 Preparación de las muestras - Mama 8 Secciones incluidas en parafina 8 Tratamiento de los tejidos antes de la tinción 8 Precauciones - Mama 9 INSTRUCCIONES DE USO - Mama 11 A. Preparación del reactivo 11 A.1 Epitope Retrieval Solution 11 A.2 Wash Buffer 11 A.3 Substrate-Chromogen Solution (DAB) 11 A.4 Contratinción 11 A.5 Medio de montaje 11 B. Procedimiento de tinción realizado en el Autostainer 12 B.1 Notas referentes al procedimiento 12 B.2 Protocolo de tinción 12 Control de calidad - Mama 14 Interpretación de la tinción - Mama 16 Limitaciones - Mama 19 Limitaciones generales 19 Limitaciones específicas del producto 20 Características de resultados - Mama 20 Antecedentes 20 Estudios comparativos 21 Comparación con el ensayo clínico (CTA) 21 Precisión 22 Reproducibilidad 22 Inmunorreactividad 23 Solución de problemas - Mama 24 Resumen y explicación - Gástrico 27 Antecedentes 27 Características 27 Principio del procedimiento - Gástrico 27 Reactivos - Gástrico 28 Materiales suministrados 28 Materiales necesarios que no se suministran 29 Almacenamiento - Gástrico 30 Preparación de las muestras - Gástrico 30 Secciones incluidas en parafina 30 Tratamiento de los tejidos antes de la tinción 31 Precauciones - Gástrico 32 INSTRUCCIONES DE USO - Gástrico 34 A. Preparación del reactivo 34 A.1 Epitope Retrieval Solution 34 A.2 Wash Buffer 34 A.3 Substrate-Chromogen Solution (DAB) 34 A.4 Contratinción 34 A.5 Medio de montaje 34 B. Procedimiento de tinción realizado en el Autostainer 35 B.1 Notas referentes al procedimiento 35 B.2 Protocolo de tinción 35 Control de calidad - Gástrico 37 Interpretación de la tinción - Gástrico 39 Limitaciones - Gástrico 42 Limitaciones generales 42 ( ) P04455ES_01_K / p. 2/53
3 Limitaciones específicas del producto 43 Características de resultados - Gástrico 44 Antecedentes 44 Reproducibilidad 45 Inmunorreactividad 47 Solución de problemas - Gástrico 48 Referencias 51 Explicación de símbolos 53 ( ) P04455ES_01_K / p. 3/53
4 Indicaciones de uso Para uso diagnóstico in vitro. HercepTest es un ensayo inmunocitoquímico semicuantitativo para determinar la sobreexpresión de la proteína HER2 en tejidos mamarios cancerosos procesados de forma rutinaria para su evaluación histológica y tejidos cancerosos fijados con formol e incluidos en parafina procedentes de pacientes con adenocarcinoma de estómago incluido el de la unión gastroesofágica. HercepTest está indicado como ayuda en la evaluación de pacientes para los que se está considerando un tratamiento con Herceptin (trastuzumab) (véase el prospecto de Herceptin ). NOTA sólo para el cáncer de mama: Todos los pacientes de los ensayos clínicos con Herceptin se seleccionaron mediante un ensayo clínico (CTA, por sus siglas en inglés) inmunocitoquímico de investigación. de los pacientes de estos ensayos se seleccionó utilizando la prueba HercepTest. HercepTest se comparó con el CTA en un grupo independiente de muestras y se determinó que ofrecía resultados concordantes aceptables. La correlación real de HercepTest y Herceptin en el resultado clínico todavía no se ha determinado. NOTA sólo para el cáncer gástrico: Todos los pacientes del estudio BO18255 (ToGA) de fase III, patrocinado por Hoffmann-La Roche, se seleccionaron utilizando el kit Dako HercepTest (IHC) y Dako HER2 FISH pharmdx (FISH). El estudio demostró la utilidad clínica de ambas pruebas para la evaluación del estado en cuanto a la HER2 en pacientes con adenocarcinoma inoperable localmente avanzado, recurrente y/o metastásico de estómago o de la unión gastroesofágica. Para este kit, N.º de catálogo K5207, se han ajustado los volúmenes de reactivo especialmente para utilizarlos con el Autostainer. El adenocarcinoma de estómago, incluida la unión gastroesofágica, también recibe el nombre de cáncer gástrico en este documento. Consulte las páginas 5-26 para obtener información sobre su aplicación para el cáncer de mama. Consulte las páginas para obtener información sobre su aplicación para el cáncer gástrico. Importante: Obsérvense las diferencias para el tejido de cáncer de mama y el tejido de cáncer gástrico especialmente en la interpretación de las Secciones de Tinción. ( ) P04455ES_01_K / p. 4/53
5 Cáncer de mama Resumen y explicación - Mama Antecedentes El gen humano HER2 (también conocido como ERBB2 o NEU) codifica una proteína a menudo llamada proteína HER2 o p185 HER2. La proteína HER2 es una tirosinquinasa del receptor de membrana homóloga con el receptor del factor de crecimiento epidérmico (EGFR o HER1) (1 8). La proteína HER2 es un componente normal expresado por una variedad de tipos de células epiteliales (8). En una parte de los pacientes con cáncer de mama, la proteína HER2 aparece sobreexpresada, como parte del proceso de transformación maligna y de progresión tumoral (9). La sobreexpresión de la proteína HER2 en la superficie de las células con cáncer de mama sugería que podría tratarse de un objetivo de una terapia con anticuerpos. Herceptin (trastuzumab) es un anticuerpo monoclonal humanizado (10) que se liga con gran afinidad a la proteína HER2 y que ha demostrado ser un inhibidor de la proliferación de células tumorales humanas que sobreexpresan la proteína HER2 in vitro e in vivo (11 13). Características HercepTest se desarrolló para ofrecer una alternativa al CTA de investigación utilizado en los estudios clínicos de Herceptin. El rendimiento de HercepTest en la determinación de la sobreexpresión de la proteína HER2 se evaluó en un estudio independiente comparando los resultados de HercepTest con los del CTA en 548 especímenes de cáncer de mama, ninguno de los cuales se obtuvo de pacientes de los estudios clínicos de Herceptin. Los resultados indicaron una concordancia del 79% entre los resultados de los dos ensayos en estos especímenes de tejido. Los datos de concordancia también muestran que es muy probable que una lectura de 3+ con HercepTest corresponda con una lectura positiva en el CTA, lo que se ajustaría a los criterios de entrada del ensayo (2+ ó 3+). Los resultados de 2+ en HercepTest no mostraron una correlación tan buena con los resultados del CTA. Alrededor de un 42% (53 de los 126 casos) de los resultados 2+ del HercepTest resultaron negativos en el CTA (0-1+), lo que no habría posibilitado la entrada en los ensayos clínicos de Herceptin. HercepTest se interpreta como negativo para la sobreexpresión de la proteína HER2 (con intensidad de tinción 0 y 1+), débilmente positivo (con intensidad de tinción 2+) y altamente positivo (con intensidad de tinción 3+). HercepTest no está pensado para ofrecer información de pronóstico a los pacientes y médicos y no se ha validado a este efecto. Principio del procedimiento - Mama HercepTest contiene los reactivos necesarios para completar un procedimiento de tinción inmunocitoquímica en dos pasos con especímenes procesados de forma rutinaria e incluidos en parafina. Después de la incubación con el anticuerpo primario de conejo de la proteína HER2 humana, este kit utiliza un reactivo de visualización listo para su uso basado en tecnología de dextrano. Este reactivo consta tanto de moléculas secundarias de inmunoglobulina de cabra anti-inmunoglobulinas de conejo como de moléculas de peroxidasa de rábano rusticano ligadas a un esqueleto de polímero de dextrano común, lo que elimina la necesidad de una aplicación secuencial de anticuerpos de enlace y anticuerpos conjugados con peroxidasa. La reacción cruzada del reactivo de visualización con las inmunoglobulinas humanas y el suero fetal bovino se ha eliminado por absorción en fase sólida. La conversión enzimática del cromógeno añadido posteriormente provoca la formación de un producto de reacción visible en el lugar del antígeno. Entonces, el espécimen puede someterse a contratinción y se puede colocar el cubreobjetos. Los resultados se interpretan utilizando un microscopio óptico. Los portaobjetos de control que contienen tres líneas celulares humanas con cáncer de mama incluidas en parafina y fijadas en formol con puntuaciones de intensidad de tinción de 0, 1+ y 3+ se suministran para validar las secuencias de tinción. La intensidad de tinción de estas líneas celulares se ha relacionado con el número de receptores por célula. ( ) P04455ES_01_K / p. 5/53
6 Cáncer de mama HercepTest, N.º de catálogo K5207, se puede aplicar en tinción automática, utilizando el Autostainer. Reactivos - Mama Materiales suministrados Los materiales enumerados a continuación son suficientes para 50 pruebas (50 portaobjetos incubados con anticuerpo primario de proteína HER2 y 50 portaobjetos incubados con el reactivo de control negativo correspondiente). El número de pruebas se basa en la utilización de 200 µl por corte de tejido (22 x 22 mm) de los viales núm. 1, 2, 3 y 4 y de la solución Substrate-Chromogen Solution (DAB). El kit suministra material suficiente para un máximo de 15 secuencias individuales de tinción. Núm. vial Cantidad 1 2 x 11 ml 2 1 x 12 ml 3 2 x 11 ml 4 1 x 12 ml 5 15 x 11 ml 6 3 x 3 ml 7 3 x 500mL Descripción Peroxidase-Blocking Reagent: peróxido de hidrógeno al 3% con azida sódica (NaN 3 ) a 15 mmol/l. Rabbit Anti-Human HER2 Protein: anticuerpo aislado por afinidad listo para su uso. Suministrado en Tris/HCl a 0,05 mol/l, NaCl a 0,1 mol/l, NaN 3 a 15 mmol/l, a ph 7,2 con proteína estabilizadora. Inmunógeno: fragmento sintético de la terminación C (parte intracitoplasmática) de la proteína HER2 enlazado con hemocianina de lapa californiana. Especificidad: proteína HER2 Método de purificación: el anticuerpo se aísla por afinidad utilizando un péptido de la proteína HER2 inmovilizado. Visualization Reagent: polímero de dextrano conjugado con peroxidasa de rábano rusticano e inmunoglobulinas de cabra anti-inmunoglobulinas de conejo aisladas por afinidad. Suministrado en tampón Tris/HCl con proteína estabilizadora y agente antimicrobiano. Negative Control Reagent: fracción de inmunoglobulina de suero de conejo normal a una concentración de proteína equivalente a la del anticuerpo de la proteína HER2. Suministrado en Tris/HCl a 0,05 mol/l, NaCl a 0,1 mol/l, NaN 3 a 15 mmol/l, a ph 7,2 con proteína estabilizadora. DAB Buffered Substrate: solución tampón de sustrato, a ph 7,5, con <0,1% peróxido de hidrógeno, estabilizadores, incrementadores y agente antimicrobiano. DAB Chromogen: solución cromógeno de tetraclorhidrato de 3,3'- diaminobenzidina al 5%. Epitope Retrieval Solution (Containing Detergent) (10x): tampón ( ) P04455ES_01_K / p. 6/53
7 8 2 x 1 L 3 x 5 portaobjetos citrato a 0,1 mol/l con detergente. Cáncer de mama Wash Buffer (10x): tampón Tris/HCl con detergente y agente antimicrobiano. Control Slides: cada portaobjetos contiene cortes de tres líneas celulares de carcinoma de mama incluidos en parafina y fijados con formol que representan diferentes niveles de expresión de la proteína HER2. MDA-231 (0), MDA-175 (1+) y SK-BR-3 (3+). Los portaobjetos de control se han tratado con calor para mejorar la adherencia de los cortes a los portaobjetos. Cualquier otro tratamiento por calor de los portaobjetos de control realizado para mejorar la adherencia de los cortes a los portaobjetos puede afectar a los resultados de la tinción. NOTA: todos los reactivos, incluidos Epitope Retrieval Solution y Wash Buffer, están formulados para utilizarse específicamente en esta prueba. Para que la prueba pueda realizarse según las especificaciones, no deben realizarse sustituciones, salvo en el caso de Wash Buffer, cuando pueda utilizarse el N.º de catálogo S3006. Materiales necesarios que no se suministran Hidróxido amónico, a 15 mol/l diluido a 37 mmol/l Contratinción: Hematoxilina, como la solución acuosa Mayer's Hematoxylin, N.º de catálogo S3301 (véanse INSTRUCCIONES DE USO, A.4) Cubreobjetos Agua destilada o desionizada (agua de lavado) Horno de secado, capaz de mantener una temperatura de 60 C o inferior Etanol, absoluto y al 95% Microscopio óptico (aumento del objetivo de 4 40x) Medio de montaje, como Dako Faramount, N.º de catálogo S3025, o Glycergel, N.º de catálogo C0563 Tejidos positivos y negativos para utilizar como controles de proceso (véase la sección Control de calidad) Portaobjetos, SuperFrost Plus, portaobjetos recubiertos de poli-l-lisina o Dako Silanized Slides, N.º de catálogo S3003 (véase Preparación del espécimen) Jarras o baños de tinción Cronómetro (capaz de cronometrar intervalos de 2 40 minutos) Baño de agua con tapa (capaz de conservar la Epitope Retrieval Solution entre 95 y 99 C). Xileno, tolueno o sustitutos de xileno K5207 se ha personalizado para su uso con el Autostainer Immunostaining System, N.º de catálogo S3400. Consulte la Guía del usuario del Autostainer para conocer los componentes necesarios del Autostainer. ( ) P04455ES_01_K / p. 7/53
8 Cáncer de mama Almacenamiento - Mama Almacénelo a una temperatura de 2 a 8 C. No utilice el kit después de la fecha de caducidad impresa en la parte exterior del embalaje. Si los reactivos se almacenan en condiciones diferentes de las especificadas en este prospecto, deben recibir la validación del usuario (14a, 14b). Obsérvese que los portaobjetos de control también deben almacenarse a una temperatura de entre 2 y 8 C. No existen signos obvios que indiquen que este producto sea inestable. Por lo tanto, deben llevarse a cabo controles positivos y negativos en simultaneidad con el ensayo en los especímenes de los pacientes. En caso de que se observen tinciones imprevistas que no puedan explicarse por variaciones en los procedimientos del laboratorio y se sospeche que existe un problema con HercepTest, póngase en contacto inmediatamente con los Servicios de asistencia técnica de Dako. Preparación de las muestras - Mama Los especímenes de biopsia deben manipularse de forma que se conserve el tejido para la tinción inmunocitoquímica. Deben utilizarse los métodos estándar de procesamiento de tejidos para todos los especímenes (15). Secciones incluidas en parafina Los tejidos conservados en formol tamponado neutro o fijados con Bouin para su procesamiento rutinario y la inclusión en parafina son adecuados para el uso. Por ejemplo, con los especímenes de biopsia deben hacerse bloques de un grosor de 3 ó 4 mm y fijarse durante horas en formol tamponado neutro. Los tejidos se deshidratan en una serie de alcoholes y xileno, y luego se realiza una infiltración con parafina fundida a no menos de 60 C. Los tejidos correctamente fijados e incluido s que expresan la proteína HER2 se conservarán indefinidamente antes de su corte y montaje en portaobjetos si se almacenan en un sitio fresco (15 25 C) (15, 16). En EE.UU., la Ley de Mejoras de Laboratorio Clínico de 1988 exige en el apartado 42 CFR (b) que El laboratorio debe conservar los portaobjetos teñidos como mínimo durante diez años a partir de la fecha del análisis y los bloques de espécimen como mínimo durante dos años a partir de la fecha del análisis (16). Las muestras de tejido se deben cortar en secciones de 4 5 µm, montar en portaobjetos y dejarlas secar al aire a temperatura ambiente por un mínimo de 12 horas (o hasta que estén secas) o a 37 ºC durante toda la noche o a 60 ºC durante una hora. CUIDADO: El calentamiento excesivo durante más de una hora a 60 C puede causar una disminución significativa o la pérdida de la inmunorreactividad para HER2 asociada a la membrana específica (17). Para conservar la antigenicidad, los cortes de tejido, montados en portaobjetos (portaobjetos SuperFrost Plus, con Poli-L-lysine o silanizados) deben teñirse dentro de un período de 4 a 6 semanas tras ser cortados si se mantienen a temperatura ambiente (20 25 C) (18). Los portaobjetos necesarios para la evaluación de la proteína HER2 y la verificación de la presencia tumoral deben prepararse simultáneamente. Se recomienda un mínimo de 5 portaobjetos: 1 para la presencia tumoral, 2 para la evaluación de la proteína HER2 (1 para la incubación con el vial núm. 2 y 1 para la incubación con el vial núm. 4) y 2 portaobjetos de reserva. La utilización de HercepTest TM en tejidos decalcificados no se ha validado y no se recomienda. Consultar la Education Guide: Immunohistochemical Staining Methods (19) de Dako y con las referencias 15 y 16 para más detalles sobre la preparación de muestras. Tratamiento de los tejidos antes de la tinción Para un rendimiento óptimo del ensayo, debe utilizarse un método específico de recuperación de epítopo, en tampón citrato a 10 mmol/l. La Epitope Retrieval Solution se suministra con el kit HercepTest. Este método implica el calentamiento de los cortes de tejido montados en ( ) P04455ES_01_K / p. 8/53
9 Cáncer de mama portaobjetos sumergidos en tampón citrato a 10 mmol/l (20) en un baño de agua calibrado capaz de mantener la Epitope Retrieval Solution a la temperatura necesaria (95 99 C). Los laboratorios situados en zonas elevadas deben determinar el mejor método para mantener la temperatura necesaria del baño de agua. La recuperación de epítopo debe realizarse en un baño de agua. Se han probado otros métodos de calentamiento que no han arrojado resultados reproducibles. Inmediatamente después de la recuperación de epítopo, inicie el procedimiento de tinción. Una desviación del procedimiento descrito puede alterar los resultados. Precauciones - Mama 1. Para uso diagnóstico in vitro. 2. Para uso por profesionales. 3. El vial 1, Peroxidase-Blocking Reagent, contiene un peróxido de hidrógeno al 3%. Hoja de datos sobre seguridad de los materiales disponible previa solicitud para usuarios profesionales. 4. El vial 6, DAB Chromogen, contiene 5-<10% biphenyl-3,3',4,4'-tetrayltetraammonium tetrachloride y está etiquetado como: H350 H341 P201 P280 Peligro P308 + P313 P405 P501 Puede provocar cáncer. Se sospecha que provoca defectos genéticos. Procurarse las instrucciones antes del uso. Llevar guantes de protección. Llevar gafas o máscara de protección. Llevar prendas de protección. EN CASO DE exposición manifiesta o presunta: Consultar a un médico. Guardar bajo llave. Eliminar el contenido y el recipiente de acuerdo con las normativas locales, regionales, nacionales e internacionales. Es una regla general que los menores de 18 años tienen prohibido trabajar con este producto. Los usuarios deben recibir formación detallada sobre el procedimiento de trabajo adecuado, las propiedades peligrosas del producto y las instrucciones de seguridad necesarias. Para obtener información adicional, consulte la hoja de datos sobre seguridad de los materiales. 5. El vial 8, Wash Buffer, contiene 5-<10% 2-amino-2-(hidroximetil)propano-1,3-diol clorhidrato y 0.1-<0.2% 5-bromo-5-nitro-1,3-dioxano. Puede provocar una reacción alérgica. Wash Buffer (10x) tiene la etiqueta: Atención H319 P280 P264 P305 + P351 + P338 Provoca irritación ocular grave. Usar protección para los ojos o la cara. Lavarse las manos cuidadosamente después de la manipulación. EN CASO DE CONTACTO CON LOS OJOS: Enjuagar con agua cuidadosamente durante varios minutos. Quitar las lentes de contacto cuando estén presentes y pueda hacerse con facilidad. Proseguir con el lavado. 6. Este producto contiene azida sódica (NaN 3 ), un producto químico muy tóxico en su forma pura. A las concentraciones en las que está presente en el producto, aunque no se clasifican como peligrosas, la azida sódica puede reaccionar con las cañerías de plomo y cobre, lo que formará acumulaciones de azidas metálicas muy explosivas. En el momento ( ) P04455ES_01_K / p. 9/53
10 Cáncer de mama de su desecho, aclare con agua abundante, para impedir que la azida metálica se acumule en las tuberías (21, 22). 7. Los viales 2, 3 y 4 contienen material de origen animal. Como con cualquier producto derivado de fuentes biológicas, deben utilizarse los procedimientos de manipulación apropiados. 8. Los portaobjetos de control y los especímenes, antes y después de la fijación, y todos los materiales expuestos a ellos, deben manipularse como si pudieran transmitir una infección y deben desecharse tomando las precauciones adecuadas (23). Nunca pipetee los reactivos con la boca y evite el contacto de la piel y las membranas mucosas con los reactivos y las muestras. Si los reactivos entran en contacto con zonas sensibles, lávelas con abundante agua. 9. Minimice la contaminación microbiana de los reactivos para evitar una tinción no específica. 10. Los tiempos, las temperaturas o los métodos de incubación diferentes de los especificados pueden producir resultados erróneos. El secado excesivo durante más de una hora a 60 C puede causar una disminución significativa o pérdida de la inmunorreactividad para HER2 asociada a la membrana específica (17). 11. Los reactivos se suministran a la dilución óptima. Una nueva dilución puede ocasionar la pérdida de la tinción antigénica. 12. Todos los reactivos, incluidos Epitope Retrieval Solution y Wash Buffer, están formulados para utilizarse específicamente en esta prueba. Para que la prueba pueda realizarse según las especificaciones, no deben realizarse sustituciones salvo en el caso del Wash Buffer, cuando pueda utilizarse el N.º de catálogo S El Visualization Reagent y DAB Chromogen pueden verse perjudicados si quedan expuestos a niveles de luz demasiado intensos. No almacene componentes del sistema ni realice la tinción bajo una luz demasiado intensa, como la luz solar directa. 14. Lleve puesto equipo protector personal apropiado a fin de evitar que el producto entre en contacto con los ojos y la piel. Para obtener información adicional, consulte la Hoja de datos sobre seguridad de los materiales (MSDS, por sus siglas en inglés). 15. Los residuos de parafina pueden dar lugar a falsos negativos. 16. El uso de volúmenes de reactivo distintos de los recomendados puede dar lugar a una pérdida de inmunoreactividad visible a HER2. Los cortes de tejido mayores de 22 x 22 mm requerirán 2-3x 200 µl de reactivo aplicados en 2-3 áreas de aplicación automatizada. ( ) P04455ES_01_K / p. 10/53
11 Cáncer de mama INSTRUCCIONES DE USO - Mama A. Preparación del reactivo Es conveniente preparar los siguientes reactivos antes de realizar la tinción: A.1 Epitope Retrieval Solution Diluya una cantidad suficiente del vial 7 (Epitope Retrieval Solution x 10) a 1:10 utilizando agua destilada o desionizada para el procedimiento de tinción previsto. La solución diluida sin usar puede almacenarse a 2 8 C durante un mes. Si la solución diluida presenta un aspecto turbio, deséchela. A.2 Wash Buffer Diluya una cantidad suficiente del vial 8 (Wash Buffer x 10) a 1:10 utilizando agua destilada o desionizada para los pasos del lavado. El tampón diluido sin usar puede almacenarse a 2 8 C durante un mes. Deseche la solución tampón si tiene un aspecto turbio. El Autostainer está programado para aclarar cortes de tejido tras la aplicación del Peroxidase- Blocking Reagent y la Substrate-Chromogen Solution. Tenga en cuenta que, para estos pasos de aclarado, se puede utilizar agua destilada (o desionizada) o Wash Buffer. El resto de pasos de aclarado requieren el uso del Wash Buffer. A.3 Substrate-Chromogen Solution (DAB) Prepare la solución sustrato-cromógeno añadiendo 11 gotas (25 30 µl por gota) de cromógeno líquido DAB del vial 6 a un vial 5 que contiene tampón de sustrato DAB (11 ml) y mézclelo. La solución preparada Substrate-Chromogen Solution (DAB) se mantiene estable aproximadamente unos 5 días si se almacena a entre 2 y 8 C. Esta solución debe mezclarse minuciosamente antes de su utilización. La calidad de la tinción no se verá afectada por la formación de precipitado en la solución. NOTA: el color del DAB Chromogen del vial 6 puede variar de un marrón-azul lavanda claro a uno suave. Esto no alterará el rendimiento de este producto. Realice la dilución con arreglo a las pautas de este prospecto. La adición excesiva de DAB Chromogen al DAB Buffered Substrate ocasionará el deterioro de la señal positiva. A.4 Contratinción El producto final teñido resultante de la reacción de tinción de DAB es insoluble en alcohol y agua. Utilice una contratinción de hematoxilina y ajuste la intensidad de tinción de la hematoxilina a un nivel similar al mostrado en el HercepTest Interpretation Manual Breast Cancer de Dako. Puede utilizarse hematoxilina, ya sea en solución acuosa o de alcohol, como Dako Mayer's Hematoxylin, N.º de catálogo S3301. Tras la contratinción con hematoxilina, realice un aclarado intenso en agua destilada o desionizada y, seguidamente, sumerja los cortes de tejido en un baño de agua de amoníaco a 37 mmol/l (véase el paso 3 de la sección B.2). El agua de amoníaco (37 mmol/l) se prepara mezclando 2,5 ml de hidróxido amónico a 15 mol/l (concentrado) con 1 litro de agua destilada o desionizada. El agua de amoníaco a 37 mmol/l que no se utilice puede conservarse a temperatura ambiente (20 25 C) en un frasco tapado herméticame nte hasta 12 meses. A.5 Medio de montaje Se recomienda un medio de montaje no acuoso y permanente. No obstante, el montaje acuoso también resulta aceptable. Se recomienda la utilización de Dako Faramount Aqueous Mounting Medium, Ready-to-Use, N.º de catálogo S3025 o Glycergel Mounting Medium, N.º de catálogo C0563 para un montaje acuoso. Licue Glycergel calentándolo a aproximadamente 40 (±5) C antes de su uso. ( ) P04455ES_01_K / p. 11/53
12 Cáncer de mama B Procedimiento de tinción realizado en el Autostainer B.1 Notas referentes al procedimiento El usuario debe leer estas instrucciones atentamente y familiarizarse con todos los componentes y los instrumentos antes de la utilización (véase el apartado Precauciones ). Todos los reactivos deben equilibrarse a temperatura ambiente (20 25 C) antes de la inmunotinción. De forma similar, todas las incubaciones deben realizarse a temperatura ambiente. No permita que los cortes de tejido se sequen durante la carga de portaobjetos en el Autostainer ni durante el procedimiento de tinción. Los cortes de tejido secos pueden mostrar una mayor tinción no específica. Si se interrumpe el procedimiento de tinción, los portaobjetos pueden conservarse en un baño de tampón después de la incubación del anticuerpo primario como máximo una hora a temperatura ambiente (20 25 C) sin que afecte al r endimiento de la tinción. Desparafinado y rehidratación: antes de la tinción, los portaobjetos con los tejidos deben desparafinarse, para eliminar el medio de inclusión, y rehidratarse. Evite una retirada incompleta de la parafina. Cualquier residuo del medio de inclusión provocaría un aumento de la tinción no específica. Este paso debe realizarse a temperatura ambiente (20 25 C). 1. Coloque los portaobjetos en un baño de xileno e incube durante 5 (±1) minutos. Cambie los baños y repita una vez. 2. Elimine el exceso de líquido golpeando suavemente los portaobjetos e introdúzcalos en etanol absoluto durante 3 (±1) minutos. Cambie los baños y repita una vez. 3. Golpee suavemente para eliminar el exceso de líquido e introduzca los portaobjetos en etanol al 95% durante 3 (±1) minutos. Cambie los baños y repita una vez. 4. Elimine el exceso de líquido golpeando suavemente los portaobjetos e introdúzcalos en agua destilada o desionizada un mínimo de 30 segundos. Inicie el proceso de tinción tal y como se expone en el paso 1 Recuperación de epítopo de la sección B.2. Las soluciones de xileno y alcohol deben cambiarse después de 40 portaobjetos. En lugar de xileno, pueden utilizarse sustitutos de tolueno o xileno, como Histoclear. NOTA: los reactivos y las instrucciones suministradas en este kit han sido diseñados para una eficacia óptima. Una mayor dilución de los reactivos o la alteración de las temperaturas de incubación puede conducir a resultados erróneos o discordantes. Las diferencias en el procesamiento de tejidos y los procedimientos técnicos en el laboratorio del usuario pueden invalidar los resultados del ensayo para su utilización en la selección de pacientes para la terapia de Herceptin. B.2 Protocolo de tinción Realizado a temperatura ambiente, C. Paso 1: Recuperación de epítopo Llene los recipientes de tinción, por ejemplo, cubetas de Coplin, con la Epitope Retrieval Solution diluida (consulte las INSTRUCCIONES DE USO en la sección A.1). Coloque los recipientes de tinción con Epitope Retrieval Solution en un baño de agua. Caliente el baño de agua y la Epitope Retrieval Solution a una temperatura de C. La Epitope Retrieval Solution adquiere un aspecto turbio al calentarla. Cubra los recipientes con tapas para estabilizar la temperatura y evitar la evaporación. Sumerja los cortes desparafinados a temperatura ambiente en la Epitope Retrieval Solution precalentada de los recipientes de tinción. VUELVA A SITUAR LA TEMPERATURA DEL BAÑO DE AGUA Y LA EPITOPE RETRIEVAL SOLUTION DE NUEVO A C. Incúbela durante 40 (±1) minutos a C. ( ) P04455ES_01_K / p. 12/53
13 Cáncer de mama Saque la jarra entera con los portaobjetos del baño de agua. Deje que los portaobjetos se enfríen en la Epitope Retrieval Solution durante 20 (±1) minutos a temperatura ambiente. Decante la Epitope Retrieval Solution y aclare los portaobjetos en el Wash Buffer (consulte las INSTRUCCIONES DE USO de la sección A.2). Para un rendimiento óptimo, empape los cortes en Wash Buffer entre 5 y 20 minutos después de la recuperación de epítopo y antes de la tinción. NOTA: la Epitope Retrieval Solution está pensada para una aplicación de un solo uso. No la reutilice. Paso 2: Procedimiento del Autostainer 1. Utilice el mapa generado con el Autostainer sobre el autoprograma de HercepTest TM para establecer los tiempos de programa y los volúmenes de reactivo necesarios (consulte el punto 4 para conocer los volúmenes específicos). 2. Coloque los viales de reactivo del Autostainer en la rejilla de reactivos del Autostainer según indica el mapa de reactivos generado por ordenador. 3. Cargue los portaobjetos en el Autostainer según indica el mapa de portaobjetos generado por ordenador. 4. Seleccione Program e inicie el programa de HercepTest TM : Lo que sigue a continuación es un esquema de la secuencia del programa: Aclarado 200 µl Peroxidase-Blocking Reagent - 5 minutos Aclarado 200 µl Primary Anti-HER2 Protein (o Negative Control Reagent) - 30 minutos Aclarado 200 µl Visualization Reagent - 30 minutos Aclarado Aclarado Cambio 200 µl Substrate-Chromogen Solution (DAB) - 10 minutos Después del paso con sustrato cromógeno, aclare los portaobjetos con agua desionizada. NOTA: el Autostainer Hardware versión 01 aclara los portaobjetos con tampón. Por tanto, una vez retirados los portaobjetos del Autostainer, deben aclararse con agua desionizada. Paso 3: Contratinción (instrucciones válidas para la hematoxilina) Retire los portaobjetos del Autostainer y realice la contratinción con hematoxilina como se describe a continuación. Sumerja los portaobjetos en un baño de hematoxilina. Incúbelos entre 2 y 5 minutos, en función de la potencia de la hematoxilina utilizada. Aclárelos suavemente en un baño de agua destilada o desionizada. Asegúrese de que se han eliminado todos los residuos de hematoxilina. Opcional: introduzca los portaobjetos 10 veces en un baño de agua de amoníaco a 37 mmol/l (véase la sección A.4). Aclare los portaobjetos suavemente en un baño de agua destilada o desionizada entre 2 y 5 minutos. ( ) P04455ES_01_K / p. 13/53
14 Cáncer de mama NOTA: en función de la duración de la incubación y la potencia de la hematoxilina utilizada, la contratinción dará como resultado una coloración entre azul pálido y azul oscuro de los núcleos celulares. Una contratinción excesiva o incompleta puede invalidar la interpretación correcta de los resultados. Paso 4: Montaje Se recomienda un medio de montaje no acuoso y permanente. De todas formas, un medio de montaje acuoso también resulta aceptable. Los especímenes pueden montarse y taparse con cubreobjetos con un medio de montaje acuoso como DakoCytomation Faramount, N.º de catálogo S3025, o Glycergel, N.º de catálogo C0563. NOTA: los portaobjetos pueden leerse cuando resulte apropiado. No obstante, puede que se pierda el color si los portaobjetos se cubren con un medio de montaje acuoso y se exponen a una luz intensa durante una semana. Para minimizar la pérdida de tinte, almacene los portaobjetos en un lugar oscuro a temperatura ambiente (20 25 C). Control de calidad - Mama Las diferencias en la fijación, el procesamiento y la inclusión de tejidos en el laboratorio del usuario pueden generar una variabilidad significativa de los resultados, lo que requeriría un rendimiento regular de los controles internos además de los portaobjetos de control suministrados por Dako. En EE.UU., consulte las indicaciones de control de calidad del Programa de certificación de inmunocitoquímica del Colegio de patólogos americanos (CAP, por sus siglas en inglés), así como la Quality Assurance for Immunocytochemestry, Approved Guideline del CLSI (anteriormente NCCLS) (24) y la referencia 25 para obtener información adicional. Tabla 1. Finalidad del control de calidad diario. Tejido: muestra equivalente a paciente fijada y procesada Control positivo: El tejido o las células que contengan el antígeno objetivo que deba detectarse (puede estar situado en el tejido del paciente). El control ideal es un tejido con una tinción ligeramente positiva, ya que de este modo es más sensible a la degradación del anticuerpo o el antígeno. Anticuerpo específico y anticuerpo secundario Controla todos los pasos del análisis. Valida el reactivo y los procedimientos utilizados para la tinción de la proteína HER2. Anticuerpo no específico* o tampón más el mismo anticuerpo secundario al utilizado con el anticuerpo específico Detección de tinción de fondo no específica. Control negativo: Tejidos o células que se prevén negativos (pueden estar situados en el tejido del paciente o el tejido de control positivo) Detección de reactividad cruzada no buscada del anticuerpo con las células o componentes celulares. Detección de tinción de fondo no específica. Tejido de paciente Detección de tinción específica Detección de tinción de fondo no específica. Portaobjeto de control suministrado por Dako Controla solamente el procedimiento de tinción * El suero es de la misma especie que el anticuerpo específico, pero no va dirigido al mismo antígeno objetivo. Para detectar un ligamiento de anticuerpo no específico, por ejemplo, ligamiento de la porción Fc del anticuerpo al tejido. ( ) P04455ES_01_K / p. 14/53
15 Cáncer de mama Portaobjeto de control (suministrado): cada uno de los portaobjetos de control contiene tres líneas celulares con cáncer de mama humano en pellet, incluidas en parafina y fijadas en formol con unas puntuaciones de intensidad de tinción de 0, 1+ y 3+. En cada secuencia de tinción debe teñirse sólo un portaobjeto. La evaluación de las líneas celulares del portaobjeto de control suministrado por Dako indica la validez de la secuencia de tinción. Tejido de control positivo: los controles deben ser especímenes procedentes de autopsia, biopsia o quirúrgicos fijados, procesados e incluidos tan rápido como sea posible de la misma forma que las muestras de pacientes. Los controles de tejido positivos indican si los tejidos se han preparado correctamente y si se han utilizado las técnicas de tinción oportunas. Debe incluirse un tejido de control positivo para cada conjunto de condiciones de prueba en cada secuencia de tinción. Los tejidos de control positivo deben mostrar una tinción positiva débil para que puedan detectar cambios leves en la sensibilidad del anticuerpo primario. Los portaobjetos de control suministrados con este kit o los especímenes procesados de forma diferente de la(s) muestra(s) del paciente validan sólo el rendimiento del reactivo y no verifican la preparación del tejido. Utilice la proteína HER2 2+ determinada con anterioridad que sobreexprese tejido de carcinoma de mama humano invasivo (infiltrado) para un tejido de control positivo óptimo. NOTA: el tejido de control positivo conocido sólo debe utilizarse para realizar el seguimiento del rendimiento correcto de los tejidos procesados y los reactivos de la prueba y NO como una ayuda para formular un diagnóstico específico de las muestras de paciente. Si el tejido de control positivo no consigue demostrar una tinción positiva apropiada, los resultados de los especímenes de paciente deberán considerarse inválidos. Tejido de control negativo: utilice un tejido de control negativo (que se haya demostrado negativo para la proteína HER2) fijado, procesado e incluido de idéntica forma a la muestra o las muestras de paciente de cada secuencia de tinción para verificar la especificidad del anticuerpo primario y ofrecer una indicación de una tinción de fondo específica. El colon, el hígado o el tiroides son apropiados como tejido de control negativo. La variedad de tipos celulares diferentes presentes en la mayoría de cortes de tejido ofrece puntos de control negativo internos (debe verificarlo el usuario). Los conductos mamarios normales pueden actuar como controles negativos internos. Si se produce una tinción específica en el tejido de control negativo o en el tejido de control negativo interno, los resultados de los especímenes de pacientes deben considerarse inválidos y debe repetirse la prueba. Reactivo de control negativo no específico: utilice el reactivo de control negativo suministrado en lugar del anticuerpo primario con un corte de cada espécimen de paciente para evaluar la tinción no específica y permitir una mejor interpretación de la tinción específica en la zona del antígeno. El periodo de incubación para el reactivo de control negativo debe corresponderse con el del anticuerpo primario. Verificación del ensayo: antes del uso inicial de un anticuerpo o un sistema de tinción en un procedimiento de diagnóstico, el usuario debe verificar la especificidad del anticuerpo sometiéndolo a una prueba en un conjunto de tejidos internos con unas características de rendimiento inmunocitoquímico demostradas que representen tejidos positivos y negativos conocidos. Consulte los procedimientos de control de calidad descritos anteriormente en esta sección del prospecto y los requisitos de control de calidad del Programa de certificación del CAP respecto a la inmunocitoquímica y/o la Quality Assurance for Immunocytochemestry, Approved Guideline (24) del CLSI (anteriormente NCCLS). Estos procedimientos de control de calidad deben repetirse para cada nuevo lote de anticuerpos o siempre que se produzca un cambio en los parámetros de ensayo. Los carcinomas de mama con intensidades demostradas de tinción de la proteína HER2 de entre 0 y 3+ y los tejidos negativos, como el colon, el hígado o el tiroides, son válidos para la verificación del ensayo. ( ) P04455ES_01_K / p. 15/53
16 Cáncer de mama Interpretación de la tinción - Mama En la determinación de la sobreexpresión de la proteína HER2, sólo deben evaluarse la intensidad y el patrón de tinción de la membrana, utilizando la escala presentada en la tabla 2. La evaluación del portaobjetos debe realizarla un patólogo con la ayuda de un microscopio óptico. Para la evaluación de la tinción y la puntuación inmunocitoquímicas, resulta apropiado un objetivo de aumento 10x. La utilización de un objetivo de aumento 20 40x puede resultar de utilidad para confirmar la puntuación. La tinción citoplasmática debe considerarse como tinción no específica y no se incluirá en la evaluación de la intensidad de tinción de la membrana (8). Para obtener ayuda con la diferenciación de la tinción de 0, 1+, 2+ y 3+, consulte el HercepTest Interpretation Manual Breast Cancer de Dako en el que hallará fotografías representativas de las intensidades de tinción. Sólo deben contabilizarse los especímenes de pacientes con carcinoma de mama invasivo. En los casos con carcinoma in situ y carcinoma invasivo en la misma muestra, sólo debe puntuar el componente invasivo. Tabla 2. Criterios de intensidad de tinción de la membrana celular. Patrón de tinción No se observa tinción o la tinción de la membrana se observa en menos de un 10% de las células tumorales Se detecta una tinción de la membrana débil o prácticamente imperceptible en más de un 10% de las células tumorales. Las células sólo presentan tinción en parte de su membrana Se observa una tinción de membrana completa entre débil y moderada en más de un 10% de las células tumorales Se observa una tinción de membrana completa fuerte en más de un 10% de las células tumorales Puntuación (Comunicar al médico responsable del tratamiento) Evaluación de la sobreexpresión de la proteína HER2 (informe al médico tratante) Negativa Negativa Ligeramente positiva Notablemente positiva HercepTest se interpreta como negativo para la sobreexpresión de la proteína HER2 (con intensidad de tinción 0 y 1+), débilmente positivo (con intensidad de tinción 2+) y altamente positivo (con intensidad de tinción 3+). HercepTest no está pensado para ofrecer información de pronóstico a los pacientes y médicos y no se ha validado a este efecto. Para cada secuencia de tinción, deben examinarse los portaobjetos del modo presentado en la tabla 3 para determinar la validez de la secuencia de tinción y permitir una evaluación semicuantitativa de la intensidad de tinción del tejido muestra. ( ) P04455ES_01_K / p. 16/53
17 Cáncer de mama Tabla 3. Orden de evaluación de los portaobjetos. Orden de lectura de los portaobjetos Exposición de motivos 1. Portaobjetos de control con tres líneas celulares La presencia de tinción marrón 3+ en la membrana celular (desoxidación) en la línea celular de control 3+ SK-BR-3, desoxidación marrón parcial en la línea celular de control 1+ MDA- 175 y la ausencia de tinción en la línea celular de control 0 MDA-231 indican la validez del ensayo. Se observa tinción de membrana punteada y discontinua en un número de pequeño a moderado de las células de la línea de células de control 1+ MDA-175 que presentan tinción levemente positiva, así como una inmunotinción punteada de la región de Golgi del citoplasma en esta misma línea de células. La presencia de tinción marrón en la línea celular de control 0 MDA-231 (negativa para la tinción de la proteína HER2) indica que no se produjo tinción no específica durante el ensayo. Los resultados del ensayo pueden quedar invalidados debido a la sobretinción. 2. Portaobjetos de tejido de control positivo Debe observarse presencia de tinción marrón en la membrana. La tinción del citoplasma y los tejidos negativos no debe ser superior a Portaobjetos de tejido de control negativo La AUSENCIA de tinción específica en el portaobjeto de tejido de control negativo confirma la inexistencia de reactividad cruzada del kit con las células o los componentes celulares. Si se produce tinción de una membrana específica en el portaobjeto de tejido de control negativo, los resultados del espécimen del paciente deben considerarse inválidos. 4. Portaobjetos con tejido de paciente teñido con reactivo de control negativo 5. Portaobjetos con tejido de paciente teñido utilizando el anticuerpo primario La ausencia de tinción de una membrana específica verifica el marcado específico del antígeno de objetivo por parte del anticuerpo primario. La tinción oscura o marrón que pueda producirse en el citoplasma del espécimen tratado con el reactivo de control negativo, como en el tejido conjuntivo, los leucocitos, eritrocitos o tejido necrótico, debe considerarse como tinción de fondo no específica e incluirse en la sección de comentarios de la hoja de datos. Cuando se detecta sobreexposición de la proteína HER2 en el espécimen, aparecerá como desoxidación marrón localizada en la membrana celular de las células tumorales tratadas con el anticuerpo primario. 1. Portaobjeto de control (suministrado): el portaobjeto de control teñido con HercepTest debe examinarse en primer lugar para determinar que todos los reactivos funcionan correctamente. La presencia de un producto de reacción marrón (3,3'- diaminobenzidina, DAB) en la membrana celular indica una reactividad positiva. La presencia de tinción marrón en circunferencia en la membrana celular (desoxidación) en la línea celular de control 3+ SK-BR-3, desoxidación marrón parcial en la línea celular de control 1+ MDA-175 y la ausencia de tinción en la línea celular de control 0 MDA-231 indican la validez del ensayo. Si alguna de las líneas celulares de control muestran comportamientos diferentes a los señalados, todos los resultados de los especímenes de pacientes deberán considerarse inválidos. 2. Tejido de control positivo: el portaobjeto del tejido de control positivo deberá examinarse a continuación. Este portaobjeto verifica que el método de fijación y el proceso de recuperación de epítopo son efectivos. Utilice células intactas para la interpretación de los resultados de tinción, puesto que las células necróticas o degeneradas a menudo muestran tinción no específica (26). La tinción debe observarse en el tejido tumoral como una tinción marrón en la membrana celular. La tinción marrón del citoplasma y los tejidos negativos del espécimen no debe superar la puntuación de intensidad de tinción de 1+ correspondiente. ( ) P04455ES_01_K / p. 17/53
18 Cáncer de mama 3. Tejido de control negativo: el portaobjeto con tejido de control negativo debe examinarse después del tejido de control positivo para verificar la especificidad del etiquetado del antígeno objetivo por parte del anticuerpo primario. La ausencia de tinción específica en el tejido de control negativo confirma la inexistencia de reactividad cruzada del kit con las células o los componentes celulares. Si se produce tinción específica en el tejido de control negativo, los resultados del espécimen del paciente deben considerarse inválidos. De forma alternativa, las porciones negativas del tejido de control positivo pueden funcionar igual que el tejido de control negativo, aunque debe verificarlo el usuario. Debe tenerse en cuenta que es posible observar una reacción débil (intensidad de tinción de 0 a 1+) en la mayor parte del tejido epitelial normal. Los posibles tejidos de control negativo incluyen: colon, hígado y tiroides. La tinción no específica, en su caso, tendrá una apariencia difusa. También es posible que se observe una tinción esporádica del tejido conjuntivo en cortes de tejido excesivamente fijados con formol Tejido de paciente: examine en último lugar los especímenes de pacientes teñidos con HercepTest. Debe evaluarse la intensidad de tinción positiva dentro del contexto de una tinción de fondo no específica del reactivo de control negativo. Igual que con cualquier prueba inmunocitoquímica, un resultado negativo significa que el antígeno no se ha detectado, y no que esté ausente de las células o el tejido sometido a ensayo. Consulte los apartados Resumen y explicación, Limitaciones y Características de rendimiento para obtener información específica respecto a la inmunorreactividad de HercepTest. Recomendaciones adicionales para la interpretación de la tinción con HercepTest La mayoría de carcinomas metastásicos de mama sometidos a prueba para determinar la sobreexpresión de la proteína HER2 reciben una puntuación de 0 ó 3+. Aunque la mayoría de estos casos están perfectamente definidos, un pequeño porcentaje de las muestras 1+ y 2+ restantes pueden resultar más difíciles de interpretar. Utilice las siguientes indicaciones para la interpretación de la tinción de HercepTest en su laboratorio. Evalúe las líneas celulares de control para validar el rendimiento del ensayo. Evalúe los portaobjetos de control negativo y positivo. Se recomienda una tinción de hematoxilina y eosina del espécimen del tejido para la primera evaluación. (Puede que el tumor no parezca evidente al observar la muestra teñida con HercepTest. Se requiere un portaobjeto teñido con hematoxilina y eosina para que el patólogo pueda verificar la presencia del tumor.) HercepTest TM debe realizarse en un corte emparejado (corte estándar) del mismo bloque de parafina del espécimen. Evalúe en primer lugar los cortes teñidos para la sobreexpresión de la proteína HER2 a baja potencia. La mayoría de casos positivos serán evidentes con aumento a baja potencia. Las áreas preservadas y teñidas correctamente del espécimen deben utilizarse para realizar una determinación del porcentaje de células tumorales positivas. En general, la puntuación de los casos debería mostrarse evidente con un aumento bajo. Si la determinación de los casos a caballo entre 1+ y 2+ resulta difícil con un aumento bajo, la puntuación suele ser 1+. Para verificar la tinción de la membrana, utilice un objetivo de 20 40x aumentos. Si la mayoría de las células tumorales muestran una tinción completa de la membrana, la tinción será 2+ ó 3+. Recurra al objetivo de 20 40x aumentos para confirmar la puntuación. En la mayoría de los casos de 3+, por lo menos un 80% de las células tumorales presentan tinción, y la tinción de la membrana es intensa. Si el espécimen se halla cerca del punto de corte del 10% de las células tumorales positivas, se recomienda realizar un recuento de un mínimo de 100 células tumorales para determinar el porcentaje de células teñidas. ( ) P04455ES_01_K / p. 18/53
19 Cáncer de mama Si existe una tinción completa de la membrana con una intensidad entre débil y moderada en un porcentaje de células tumorales superior al 10%, la puntuación del espécimen es 2+. Esto suele venir acompañado de una tinción incompleta de la membrana en la mayoría de las células tumorales restantes. Si menos de un 10% de las células tumorales presenta tinción circunferencial completa de la membrana, aunque otras células tumorales puedan mostrar una tinción completa de la membrana, la puntuación es 1+. Si menos de un 10% de las células tumorales presenta tinción circunferencial completa o incompleta de la membrana, la puntuación es 0. Limitaciones - Mama Limitaciones generales 1. La inmunocitoquímica es un proceso de diagnóstico de varias etapas que requiere formación especializada en la selección de los reactivos apropiados; la selección, la fijación y el procesamiento de tejidos; la preparación del portaobjeto de inmunocitoquímica, y la interpretación de los resultados de la tinción. 2. El resultado de la tinción de tejidos depende de la manipulación y el procesamiento que se haga del tejido antes de su tinción. Si el tejido se fija, congela, descongela, lava, seca, calienta o corta incorrectamente, o si se contamina por contacto con otros tejidos o líquidos, pueden producirse artefactos, atrapamiento de anticuerpos o resultados falso negativos. La aparición de resultados no coherentes puede deberse a variaciones en los métodos de fijación y de inclusión, o a irregularidades inherentes al tejido. 3. Una contratinción excesiva o incompleta puede invalidar la interpretación correcta de los resultados. 4. La interpretación clínica de toda tinción positiva o de su ausencia debe evaluarse en el contexto de la presentación clínica, la morfología y otros criterios histopatológicos. La interpretación clínica de toda tinción, o de su ausencia, debe complementarse con estudios morfológicos y controles adecuados, así como con otras pruebas diagnósticas. Un patólogo certificado y familiarizado con los anticuerpos, reactivos y métodos utilizados, debe responsabilizarse de interpretar la preparación teñida. La tinción debe realizarse en un laboratorio certificado y con licencia, bajo la supervisión de un patólogo responsable de la revisión de los portaobjetos teñidos y de garantizar la corrección de los controles positivos y negativos. 5. Es posible que los tejidos de las personas infectadas con el virus de la hepatitis B y con antígeno de superficie de hepatitis B (HBsAg) muestren tinción no específica con peroxidasa de rábano rusticano (27). 6. Los reactivos pueden mostrar reacciones imprevistas en tipos de tejidos no probados previamente. La posibilidad de reacciones imprevistas incluso en tipos de tejido probados no puede eliminarse por completo, debido a la variabilidad de la expresión del antígeno en las neoplasias u otros tejidos patológicos (28). Póngase en contacto con los Servicios técnicos de Dako con pruebas documentales de la reacción imprevista. 7. Pueden observarse resultados falso positivos debidos a un ligamiento no inmunológico de las proteínas o de los productos de reacción del sustrato. También pueden estar provocados por la actividad de la pseudoperoxidasa (eritrocitos) y la actividad de la peroxidasa endógena (citocromo C) (28). 8. El procedimiento de tinción debe realizarse a una temperatura ambiente de entre 20 y 25 C. ( ) P04455ES_01_K / p. 19/53
20 Cáncer de mama Limitaciones específicas del producto 1. El antígeno presente en la línea celular de control 1+ MDA-175 se degradará con el tiempo. Evalúe los resultados del portaobjeto de control teniendo en cuenta la fecha de caducidad del mismo. Una tinción negativa de las células MDA-175 puede indicar que el portaobjeto de control se ha degradado. Los portaobjetos de control deben almacenarse a una temperatura de entre 2 y 8 C. 2. Es posible que la degradación del antígeno en los tejidos provocase con el tiempo resultados falso negativos. Cuando se almacenan a temperatura ambiente (20 25 C), los especímenes deben teñirse antes de que transcurran de 4 a 6 semanas desde el montaje de los tejidos en los portaobjetos (29). 3. Para obtener unos resultados óptimos y reproducibles, la proteína HER2 exige una recuperación de epítopo por calor cuando los tejidos se fijan de la forma rutinaria (formol tamponado neutro o fijador de Bouin) y se incluyen en parafina. Este pretratamiento debe completarse al principio de todo el proceso de tinción. Consulte la sección Preparación del espécimen. Tratamiento de los tejidos antes de la tinción, para obtener instrucciones. 4. La recuperación de epítopo por calor de la proteína HER2 sólo debe realizarse mediante un baño de agua calibrado. Se han probado otros métodos de calentamiento que no han arrojado resultados reproducibles. 5. No sustituya los reactivos del kit por reactivos con otros números de lote o con reactivos de otros fabricantes. La única excepción es el tampón de lavado, que puede reemplazarse por el tampón de lavado Dako con número de catálogo S Pueden obtenerse resultados falsos de la evaluación de la tinción citoplasmática. Al interpretar los resultados, tenga sólo en cuenta la intensidad de la tinción de la membrana celular. 7. Los portaobjetos de control de tinción deben utilizarse exclusivamente para validar la secuencia de tinción y no como guía para registrar la reacción de tinción en secciones de tejidos. 8. En ocasiones puede observarse una tinción focal fuerte (3+), es decir, puntos calientes. Este resultado puede deberse a una fijación o a un procesamiento irregular del tejido. En este caso, se recomienda la inmunotinción de un segundo bloque de tejidos del mismo espécimen. 9. No se ha validado el uso de HercepTest en especímenes fijados con fijadores distintos del formol tamponado neutro o el fijador de Bouin. 10. El epitelio normal del tejido mamario debe producir una tinción de entre 0 y 1+. Si se observa una tinción del epitelio normal superior a 1+, debe repetirse la prueba. Tenga en cuenta que los epitelios normales de las amígdalas y el esófago pueden ofrecer una intensidad de tinción superior a 2+. Características de resultados - Mama Antecedentes El ensayo clínico (CTA) utilizado para identificar a los pacientes idóneos para participar en los estudios clínicos de Herceptin estaba destinado a usos en investigación y ya no se encuentra disponible. El HercepTest se desarrolló para ofrecer una alternativa comparable al CTA. Se evaluaron la seguridad y la efectividad de Herceptin en un ensayo clínico controlado y aleatorizado y en un ensayo abierto de dimensiones considerables (véase el prospecto de Herceptin ). Todos los pacientes seleccionados para los ensayos clínicos de Herceptin mostraron una sobreexpresión de la proteína HER2 en pruebas inmunocitoquímicas realizadas con el CTA en un laboratorio central. Se consideraba que los pacientes eran idóneos para el tratamiento con Herceptin si presentaban un tumor con niveles 2+ ó 3+ de sobreexpresión de proteína HER2 (conforme a una escala de 0 a 3+, en la que 3+ representaba el nivel más alto). ( ) P04455ES_01_K / p. 20/53
21 Cáncer de mama El análisis de subgrupo de los resultados de estos estudios indica que los pacientes cuyos tejidos muestran una sobreexpresión de proteína HER2 fuertemente positiva (3+) pueden obtener mayores beneficios de Herceptin que aquellos con resultados menos positivos (2+). Así pues, el grado de sobreexpresión de la proteína HER2 puede ser un factor de predicción importante del efecto del tratamiento con Herceptin. Puesto que ninguno de los pacientes de los estudios de Herceptin se seleccionó a través del HercepTest, se desconoce la correlación entre el grado de positividad y la probabilidad de beneficio clínico del tratamiento con Herceptin. Estudios comparativos Se realizaron dos estudios para caracterizar el HercepTest. 1) Comparación con el ensayo clínico (CTA) 2) Precisión al compararlo con otros cinco ensayos. Comparación con el ensayo clínico (CTA) Se comparó el HercepTest con el CTA utilizado para identificar a los pacientes idóneos para la terapia con Herceptin mediante 274 especímenes con sobreexpresión de proteína HER2 positiva (2+ ó 3+) y un número igual de especímenes de tejido mamario canceroso con sobreexpresión de proteína HER2 negativa. En la tabla 4 se incluyen los resultados en un diagrama 2 x 2, en el que 0 y 1+ se consideraron resultados negativos y 2+ y 3+, resultados positivos. Tabla 4. Concordancia 2 x 2 del HercepTest comparado con el CTA (número de especímenes). Ensayo de pruebas clínicas Positivo Negativa Total HercepTest Positivo Negativa Total Concordancia: 79%, intervalo de confianza al 95% (76 82%). La concordancia binaria total del HercepTest comparado con el CTA fue de un 79% (431 de los 548 casos), con un intervalo de confianza 2 x 2 al 95% de 76 82%. El veintiuno por ciento (21%) de los resultados eran discordantes entre los dos métodos. Los resultados del HercepTest se registraron en una escala de 0 a 3+, en la que la intensidad de tinción 0 a 1+ representaba una sobreexpresión negativa de la proteína HER2; la intensidad de tinción 2+, una sobreexpresión ligeramente positiva, y la intensidad de tinción 3+, una sobreexpresión fuertemente positiva. Tabla 5. Concordancia 3 x 3 del HercepTest y el CTA. Ensayo de pruebas clínicas Total HercepTest Total Esta presentación 3 x 3 del estudio de concordancia indica que una lectura de 3+ en el HercepTest tiene una alta probabilidad de corresponderse con un resultado positivo en el CTA, lo que habría satisfecho los criterios de entrada del ensayo de Herceptin (2+ ó 3+). Los resultados de 2+ en HercepTest no mostraron una correlación tan buena con los resultados del CTA. Alrededor de un 42% (53 de los 126 casos) de los resultados 2+ del HercepTest resultaron negativos en el CTA (0-1+), lo que no habría posibilitado la entrada en los ensayos clínicos de Herceptin. ( ) P04455ES_01_K / p. 21/53
22 Cáncer de mama Precisión También se realizó una prueba del HercepTest con 2 portaobjetos de microscopio que contenían cortes de tejido incluidos en parafina procedentes de 168 tumores de mama. Estos tumores ya se habían caracterizado anteriormente con otros cinco métodos de determinación de la amplificación del gen HER2 y de sobreexpresión de la proteína HER2, como el Southern blot in situ, la hibridación in situ fluorescente (FISH) para la amplificación de ADN, el análisis de ARN de Northern blot, Western blot e inmunocitoquímica en tejidos congelados (29). Los resultados se muestran en la tabla 6. Tabla 6. Comparación del HercepTest con los resultados combinados (OE) de las pruebas de amplificación de genes y de sobreexpresión de proteína HER2. Clasificación de la referencia OE + - Total HercepTest Coincidencia positiva: 43/69 = 62% Coincidencia negativa: 99/99 = 100% Total Los resultados mostraban un nivel de confianza del 85% (142 de los 168 casos; intervalo de confianza al 95% de 78 89%) entre la intensidad de tinción positiva (2+ y 3+) y negativa (0 y 1+) en el HercepTest. Ninguna de las muestras negativas en los otros cinco métodos resultaron positivas en el HercepTest, aunque los resultados combinados de los otros cinco métodos presentaban un mayor número de casos positivos. Reproducibilidad Reproducibilidad interna: la reproducibilidad interna se probó en un laboratorio con 5 especímenes con diferentes intensidades de tinción en inmunocitoquímica. Cada espécimen se probó por triplicado en formato aleatorio enmascarado. Este protocolo se utilizó con tinción automática. Todos los especímenes dieron un 100% de resultados reproducibles. Reproducibilidad entre secuencias: la reproducibilidad entre secuencias se probó en tres laboratorios durante un periodo de 4 días con 5 especímenes con diferentes intensidades de tinción en inmunocitoquímica aleatorizados y enmascarados, utilizando una metodología automatizada. Se observó una reproducibilidad excelente para los resultados positivos en comparación con los resultados negativos (0 y 1+ frente a 2+ y 3+), con la excepción de dos muestras de un laboratorio que variaban entre 1+ y 2+. Hubo un 100% de reproducibilidad de las muestras con 2+ y 3+. Reproducibilidad entre laboratorios: se probó la reproducibilidad entre laboratorios en tres laboratorios separados geográficamente con 40 especímenes idénticos aleatorizados y enmascarados con diferentes intensidades de tinción en inmunocitoquímica. Se enviaron portaobjetos recién cortados a cada uno de los laboratorios para que se realizara una tinción automática y un patólogo evaluara los resultados. El porcentaje de coincidencia entre laboratorios iba de un 83% a un 90% en el caso de la determinación dicotómica positivo/negativo, en la que 0 y 1+ eran resultados negativos y 2+ y 3+ eran resultados positivos de la sobreexpresión de la proteína HER2. En comparación con los resultados obtenidos en el laboratorio de referencia que había realizado el CTA, un 12,5% (15 de los 120 casos) de los resultados comparados discrepaban en cuanto a la determinación de resultado negativo (0 y 1+) y positivo (2+ y 3+). Además, otro 10% (12 de los 120 casos) de los resultados discrepaba en cuanto a la clasificación en 2+ o en 3+. ( ) P04455ES_01_K / p. 22/53
23 Cáncer de mama Inmunorreactividad En la tabla 7 aparece un resumen de la inmunorreactividad del HercepTest junto con el panel recomendado de tejidos normales. Todos los tejidos estaban fijados con formol e incluidos en parafina y se habían teñido con el HercepTest de acuerdo con las instrucciones del prospecto. Tabla 7. Resumen de la reactividad de tejido normal en el HercepTest. Tipo de tejido (N.º analizado) Suprarrenal (3) Medula ósea (3) Encefálico/cerebral (3) Encefálico/cerebral (3) Mamario (3) Cuello uterino (3) Colónico (3) Esofágico (3) Cardiaco (3) Renal (3) Hepático (3) Pulmonar (3) Mesotelial (3) Ovárico (3) Pancreático (3) Paratiroideo (3) Nervio periférico (3) Hipófisis (3) Prostático (3) Glándula salivar (3) Músculo esquelético (3) Cutáneo (3) Intestino delgado (3) Esplénico (3) Gástrico (3) Testicular (3) Tímico (3) Tiroideo (3) Amigdalino (3) Uterino (3) Tinción de elemento tisular positivo y patrón de tinción Glándula mamaria (2/3 tejidos, intensidad de tinción 1+, <5% de las células) Células epiteliales (1/3 tejidos, intensidad de tinción 1+, <5% de las células, membrana y citoplasma, granular) Células epiteliales foliculares (1/3 tejidos, intensidad de tinción 1+, <5% de las células, membrana y citoplasma) Epitelio escamoso (1/3 tejidos, intensidad de tinción 1+, 5% de las células. 2/3 tejidos, intensidad de tinción 2+, 10-20% de las células. Membrana y citoplasma) Tejido endometrial (2/3 tejidos, intensidad de tinción 1+, 30-60% de las células, citoplasma, granular) La tinción registrada en todos los tejidos se refiere a la membrana, a menos que se indique lo contrario. Los tres especímenes de cada tipo de tejido presentaron la misma intensidad de tinción a menos que se especifique lo contrario. ( ) P04455ES_01_K / p. 23/53
24 Cáncer de mama Solución de problemas - Mama Consulte la sección de resolución de problemas del manual de Dako indicado anteriormente (19) para encontrar una solución o póngase en contacto con el Departamento de servicio técnico de Dako para informar de la tinción inusual. Problema Causa probable Acción sugerida 1a. Error de programación. Los reactivos no se utilizaron en el orden correcto 1a. Compruebe la parrilla de programación para verificar si la secuencia de tinción se ha programado correctamente 2. Tinción débil de los portaobjetos 1b. Los viales de reactivo no se cargaron en las ubicaciones correctas en las rejillas de reactivos 1c. No hay reactivo suficiente en el vial de reactivo 1d. Presencia de azida sódica en la solución de lavado 1e. Es probable que el calentamiento excesivo de los cortes de tejido montados antes de la desparafinización y la recuperación del antígeno inducida por calor causen la pérdida de la inmunorreactividad visible para HER2. 2a. Recuperación de epítopo insuficiente 2b. Incubación incorrecta del reactivo 2c. Método de fijación no apropiado 2d. Es probable que el calentamiento excesivo de los cortes de tejido montados antes de la desparafinización y la recuperación del antígeno inducida por calor causen una disminución significativa de la inmunorreactividad visible para HER2. 2e. Aplicado un volumen insuficiente de reactivo. 1b. Compruebe el mapa de reactivos para verificar la ubicación correcta de los viales de reactivo 1c. Asegúrese de que se introduce reactivo suficiente en los viales de reactivo antes de iniciar la secuencia. Consulte el mapa de reactivos para conocer los volúmenes necesarios 1d. Utilice una preparación reciente del Wash Buffer suministrado en el kit 1e. Seque los cortes de tejido a temperatura ambiente durante un mínimo de 12 horas o hasta que estén secos. Como alternativa, seque a 37 C durante toda la noche o bien seque a 60 C durante un máximo de una hora. El secado de cortes de tejidos a temperaturas altas solo debe efectuarse en un horno calibrado con distribución uniforme del calor (17). 2a. Compruebe que la Epitope Retrieval Solution alcanza los C durante 40 minutos y que se deja enfriar durante 20 minutos 2b. Revise las instrucciones del procedimiento de tinción 2c. Asegúrese de que el tejido del paciente no está sobrefijado y de que no se ha utilizado otro fijador 2d. Seque los cortes de tejido a temperatura ambiente durante un mínimo de 12 horas o hasta que estén secos. Como alternativa, seque a 37 C durante toda la noche o bien seque a 60 C durante un máximo de una hora. El secado de cortes de tejidos a temperaturas altas solo debe efec-tuarse en un horno calibrado con distribución uniforme del calor (17). 2e. Compruebe el tamaño del corte de tejido (22 x 22 mm) y el volumen de reactivo aplicado. ( ) P04455ES_01_K / p. 24/53
25 Cáncer de mama 3. Tinción de fondo de portaobjetos excesiva 4. El tejido se despega del portaobjeto 5. Tinción específica excesivamente fuerte 3a. No se ha retirado por completo la parafina 3b. Se han utilizado aditivos de almidón al montar los cortes en los portaobjetos 3c. No se han aclarado los portaobjetos correctamente 3d. Las secciones se han secado durante el procedimiento de tinción 3e. Cortes secados durante la carga del Autostainer 3f. Método de fijación no apropiado 3g. Enlace no específico de los reactivos con el tejido 4a. Se han utilizado portaobjetos inadecuados 5a. Método de fijación no apropiado 5b. Utilización de una fuente de calor no adecuada para la recuperación de epítopo, como un vaporizador, un horno microondas o un autoclave 5c. Incubación del reactivo demasiado prolongada 5d. Solución de lavado no adecuada 3a. Utilice soluciones de eliminación recientes y siga el procedimiento tal y como se indica en la sección B.1 3b. No utilice aditivos de almidón para adherir los cortes al portaobjeto. Muchos aditivos son inmunorreactivos 3c. Asegúrese de que el Autostainer está cebado correctamente antes de iniciar la secuencia. Asegúrese de que se dispone de suficiente tampón para toda la secuencia. Utilice soluciones recién preparadas de tampones y lavado 3d. Compruebe que se aplica el volumen correcto de reactivo a los portaobjetos. Asegúrese de que la secuencia del Autostainer se ejecuta con la tapa en la posición correcta y que no se expone ni a calor excesivo ni a corrientes de aire 3e. Asegúrese de que los cortes se conservan humedecidos con tampón durante la carga y antes de iniciar la secuencia 3f. Asegúrese de que se ha utilizado un fijador aprobado. Los fijadores alternativos pueden producir un exceso de tinción de fondo 3g. Compruebe el método de fijación del espécimen y la presencia de necrosis 4a. Utilice portaobjetos silinizados, como los Dako Silanized Slides, N.º de catálogo S3003, los portaobjetos SuperFrost Plus o portaobjetos recubiertos de poli-l-lisina 5a. Asegúrese de que sólo se emplearon fijadores y métodos de fijación aprobados 5b. Asegúrese de que sólo se utiliza un baño de agua para la recuperación de epítopo 5c. Revise las instrucciones del procedimiento de tinción 5d. Utilice únicamente el tampón de lavado recomendado para el kit ( ) P04455ES_01_K / p. 25/53
26 6. Tinción débil de la línea celular del portaobjeto de control Epitope Retrieval Solution adquiere un aspecto turbio cuando se calienta 8. Epitope Retrieval Solution adquiere un aspecto turbio cuando se almacena (antes de calentarla) 6a. No se ha seguido el protocolo de recuperación de epítopo correcto 6b. No hay reacción con la Substrate Chromogen Solution (DAB) 6c. Degradación del portaobjeto de control 7. La solución adquiere un aspecto turbio cuando se calienta 8. La solución se ha almacenado incorrectamente o ha pasado la fecha de caducidad de la solución Cáncer de mama 6a. Sumerja los portaobjetos en la Epitope Retrieval Solution precalentada. Haga que la Epitope Retrieval Solution vuelva a alcanzar los C y precaliente durante 40 minutos 6b. Asegúrese de incubarla durante 10 minutos. Asegúrese de que sólo se agregó una gota de cromógeno DAB a 1 ml de DAB Buffered Substrate 6c. Compruebe la fecha de caducidad del kit y las condiciones de almacenamiento del mismo en la parte exterior del paquete 7. Esto es normal y no influye en la tinción 8. Compruebe la fecha de caducidad y las condiciones de almacenamiento del kit impresas en la parte exterior del envase. Deseche la epitope retrieval solution NOTA: si el problema no puede atribuirse a ninguna de las causas expuestas anteriormente o si la medida de corrección que se sugiere no resuelve el problema, llame a los Servicios técnicos de Dako para obtener más ayuda. Puede encontrar información adicional sobre las técnicas de tinción y sobre la preparación de especímenes en el manual de Dako citado anteriormente (19) (disponible en Dako), en Atlas of Immunohistology (30) y en Immunoperoxidase Techniques. A Practical Approach to Tumor Diagnosis (31). ( ) P04455ES_01_K / p. 26/53
27 Cáncer gástrico Resumen y explicación - Gástrico Antecedentes El gen humano HER2 (también conocido como ERBB2 o NEU) codifica una proteína a menudo llamada proteína HER2 o p185 HER2. La proteína HER2 es una tirosinquinasa del receptor de membrana homóloga con el receptor del factor de crecimiento epidérmico (EGFR o HER1) (1 8). La proteína HER2 es un componente normal expresado por una variedad de tipos de células epiteliales (8). La sobreexpresión de la proteína HER2 y la amplificación del gen HER2 en el cáncer gástrico se ha puesto de manifiesto en un gran número de estudios (32). La positividad para HER2 se puede detectar en aproximadamente el 20% de los pacientes mediante IHQ o FISH (32). Estudios preclínicos in vitro e in vivo han puesto de manifiesto que trastuzumab (Herceptin ) es eficaz en diferentes tipos de cáncer gástrico lo que condujo al inicio de varios estudios clínicos (32-36). En un estudio de fase III BO18255, denominado como ToGA Trial, se aleatorizaron pacientes con adenocarcinoma inoperable localmente avanzado, recurrente y/o metastásico de estómago o de la unión gastroesofágica con HER2 positivo para que recibieran tratamiento con 5-FU o capecitabina y cisplatino en monoterapia o en combinación con trastuzumab. En los pacientes que recibieron el tratamiento combinado de trastuzumab y quimioterapia se observó un aumento estadísticamente significativo de la supervivencia global (SG) (37, 38). Trastuzumab es un anticuerpo monoclonal humanizado que se une con gran afinidad a la proteína HER2 y que ha demostrado ser un inhibidor de la proliferación de células tumorales humanas que sobreexpresan la proteína HER2 in vitro e in vivo (33 36). Características Se ha cribado a pacientes para detectar su estado de HER2 para la participación en el estudio ToGA. En este estudio se detectó tanto la sobreexpresión de la proteína HER2 mediante IHQ (HercepTest, Dako) y de la amplificación del gen HER2 mediante FISH (HER2 FISH pharmdx, Dako). Se obtuvieron resultados de prueba válidos en muestras con pruebas de IHQ o FISH y en muestras con ambas pruebas. Los resultados correspondientes al estudio ToGA mostraron que el 22,1% de los pacientes con cáncer gástrico avanzado dieron positivo para HER2 mediante IHQ o FISH de acuerdo con la definición de los criterios de selección de HER2 de ToGA (38). Con respecto al uso de HercepTest en la evaluación de pacientes para los que se está considerando un tratamiento con trastuzumab, véase el prospecto de Herceptin para obtener más información. Principio del procedimiento - Gástrico HercepTest contiene los reactivos necesarios para completar un procedimiento de tinción inmunocitoquímica en dos pasos con especímenes procesados de forma rutinaria e incluidos en parafina. Después de la incubación con el anticuerpo primario de conejo de la proteína HER2 humana, este kit utiliza un reactivo de visualización listo para su uso basado en tecnología de dextrano. Este reactivo consta tanto de moléculas secundarias de inmunoglobulina de cabra anti-inmunoglobulinas de conejo como de moléculas de peroxidasa de rábano rusticano ligadas a un esqueleto de polímero de dextrano común, lo que elimina la necesidad de una aplicación secuencial de anticuerpos de enlace y anticuerpos conjugados con peroxidasa. La reacción cruzada del reactivo de visualización con las inmunoglobulinas humanas y el suero fetal bovino se ha eliminado por absorción en fase sólida. La conversión enzimática del cromógeno añadido posteriormente provoca la formación de un producto de reacción visible en el lugar del antígeno. Entonces, el espécimen puede someterse a contratinción y se puede colocar el cubreobjetos. Los resultados se interpretan utilizando un microscopio óptico. Los portaobjetos de control que contienen tres líneas celulares humanas ( ) P04455ES_01_K / p. 27/53
28 Cáncer gástrico con cáncer de mama incluidas en parafina y fijadas en formol con puntuaciones de intensidad de tinción de 0, 1+ y 3+ se suministran para validar las secuencias de tinción. La intensidad de tinción de estas líneas celulares se ha relacionado con el número de receptores por célula. HercepTest, N.º de catálogo K5207, se puede aplicar en tinción automática, utilizando el Autostainer. Reactivos - Gástrico Materiales suministrados Los materiales enumerados a continuación son suficientes para 50 pruebas (50 portaobjetos incubados con anticuerpo primario de proteína HER2 y 50 portaobjetos incubados con el reactivo de control negativo correspondiente). El número de pruebas se basa en la utilización de 200 µl por corte de tejido (22 x 22 mm) de los viales núm. 1, 2, 3 y 4 y de la solución Substrate-Chromogen Solution (DAB). El kit suministra material suficiente para un máximo de 15 secuencias individuales de tinción. Núm. vial Cantidad 1 2 x 11 ml 2 1 x 12 ml 3 2 x 11 ml 4 1 x 12 ml 5 15 x 11 ml 6 3 x 3 ml Descripción Peroxidase-Blocking Reagent: peróxido de hidrógeno al 3% con azida sódica (NaN 3 ) a 15 mmol/l. Rabbit Anti-Human HER2 Protein: anticuerpo aislado por afinidad listo para su uso. Suministrado en Tris/HCl a 0,05 mol/l, NaCl a 0,1 mol/l, NaN 3 a 15 mmol/l, a ph 7,2 con proteína estabilizadora. Inmunógeno: fragmento sintético de la terminación C (parte intracitoplasmática) de la proteína HER2 enlazado con hemocianina de lapa californiana. Especificidad: proteína HER2 Método de purificación: el anticuerpo se aísla por afinidad utilizando un péptido de la proteína HER2 inmovilizado. Visualization Reagent: polímero de dextrano conjugado con peroxidasa de rábano rusticano e inmunoglobulinas de cabra anti-inmunoglobulinas de conejo aisladas por afinidad. Suministrado en tampón Tris/HCl con proteína estabilizadora y agente antimicrobiano. Negative Control Reagent: fracción de inmunoglobulina de suero de conejo normal a una concentración de proteína equivalente a la del anticuerpo de la proteína HER2. Suministrado en Tris/HCl a 0,05 mol/l, NaCl a 0,1 mol/l, NaN 3 a 15 mmol/l, a ph 7,2 con proteína estabilizadora. DAB Buffered Substrate: solución tampón de sustrato, a ph 7,5, con <0,1% peróxido de hidrógeno, estabilizadores, incrementadores y agente antimicrobiano. DAB Chromogen: solución cromógeno de tetraclorhidrato de ( ) P04455ES_01_K / p. 28/53
29 7 3 x 500 ml 8 2 x 1 L 3 x 5 portaobjetos 3,3'- diaminobenzidina al 5%. Cáncer gástrico Epitope Retrieval Solution (Containing Detergent) (10x): tampón citrato a 0,1 mol/l con detergente. Wash Buffer (10x): tampón Tris/HCl con detergente y agente antimicrobiano. Control Slides: cada portaobjetos contiene cortes de tres líneas celulares de carcinoma de mama incluidos en parafina y fijados con formol que representan diferentes niveles de expresión de la proteína HER2. MDA-231 (0), MDA-175 (1+) y SK-BR-3 (3+). Los portaobjetos de control se han tratado con calor para mejorar la adherencia de los cortes a los portaobjetos. Cualquier otro tratamiento por calor de los portaobjetos de control realizado para mejorar la adherencia de los cortes a los portaobjetos puede afectar a los resultados de la tinción. NOTA: todos los reactivos, incluidos Epitope Retrieval Solution y Wash Buffer, están formulados para utilizarse específicamente en esta prueba. Para que la prueba pueda realizarse según las especificaciones, no deben realizarse sustituciones, salvo en el caso de Wash Buffer, cuando pueda utilizarse el N.º de catálogo S3006. Materiales necesarios que no se suministran Hidróxido amónico, a 15 mol/l diluido a 37 mmol/l Contratinción: hematoxilina, como la solución acuosa Mayer's Hematoxylin, Dako N.º de catálogo S3301 (véanse INSTRUCCIONES DE USO, A.4) Cubreobjetos Agua destilada o desionizada (agua de lavado) Horno de secado, capaz de mantener una temperatura de 60 C o inferior Etanol, absoluto y al 95% Microscopio óptico (aumento del objetivo de 4 40x) Medio de montaje, como Dako Faramount, N.º de catálogo S3025, o Glycergel, N.º de catálogo C0563 Tejidos positivos y negativos para utilizar como controles de proceso (véase la sección Control de calidad) Portaobjetos, SuperFrost Plus, portaobjetos recubiertos de poli-l-lisina o Dako Silanized Slides, N.º de catálogo S3003 (véase Preparación del espécimen) Jarras o baños de tinción Cronómetro (capaz de cronometrar intervalos de 2 40 minutos) Baño de agua con tapa (capaz de conservar la Epitope Retrieval Solution entre 95 y 99 C) Xileno, tolueno o sustitutos de xileno K5207 se ha personalizado para su uso con el Autostainer Immunostaining System, N.º de catálogo S3400. Consulte la Guía del usuario del Autostainer para conocer los componentes necesarios del Autostainer. ( ) P04455ES_01_K / p. 29/53
30 Cáncer gástrico Almacenamiento - Gástrico Almacénelo a una temperatura de 2 a 8 C. No utilice el kit después de la fecha de caducidad impresa en la parte exterior del embalaje. Si los reactivos se almacenan en condiciones diferentes de las especificadas en este prospecto, deben recibir la validación del usuario (14a, 14b). Obsérvese que los portaobjetos de control también deben almacenarse a una temperatura de entre 2 y 8 C. No existen signos obvios que indiquen que este producto sea inestable. Por lo tanto, deben llevarse a cabo controles positivos y negativos en simultaneidad con el ensayo en los especímenes de los pacientes. En caso de que se observen tinciones imprevistas que no puedan explicarse por variaciones en los procedimientos del laboratorio y se sospeche que existe un problema con HercepTest, póngase en contacto inmediatamente con los Servicios de asistencia técnica de Dako. Preparación de las muestras - Gástrico Las muestras de adenocarcinoma de las biopsias, escisiones o resecciones del estómago, incluida la unión gastroesofágica, deben manipularse correctamente para conservar el tejido para la tinción inmunocitoquímica. Deben utilizarse los métodos estándar de procesamiento de tejidos para todas las muestras (15). Cuando se analicen muestras pequeñas de biopsia, se determinará con precisión la morfología intacta del tumor y la presencia de células tumorales suficientes para realizar la evaluación mediante IHC. Si el análisis HercepTest se realiza en una muestra de biopsia, para garantizar una determinación fiable del estado en cuanto a HER2 se deberán analizar varias (7-8) muestras de biopsia de diferentes regiones del tumor. Secciones incluidas en parafina Debe utilizarse tejido conservado en formol tamponado neutro e incluido en parafina. Las muestras deben cortarse en bloques de 3 ó 4 mm de grosor, y fijarse durante horas en formol tamponado neutro. Las muestras de biopsia se fijaron durante 6-8 horas en el ToGA trial (para obtener información sobre el estudio, consulte el punto (37)). Los tejidos se deshidratan en una serie de alcoholes y xileno, y luego se realiza una infiltración con parafina fundida a no menos de 60 C. Los tejidos correctamente fijados e incluidos que expresan la proteína HER2, se conservarán indefinidamente antes de su corte y montaje en portaobjetos si se almacenan en un sitio fresco (15 25 C) (15, 16). En EE.UU., la Ley de Mejoras de Laboratorio Clínico de 1988 exige en el apartado 42 CFR (b) que El laboratorio debe conservar los portaobjetos teñidos como mínimo durante diez años a partir de la fecha del análisis y los bloques de espécimen como mínimo durante dos años a partir de la fecha del análisis (16). Las muestras de tejido se deben cortar en secciones de 4 5 µm, montar en portaobjetos y dejarlas secar al aire a temperatura ambiente por un mínimo de 12 horas (o hasta que estén secas) o a 37 ºC durante toda la noche o a 60 ºC durante una hora. CUIDADO: El calentamiento excesivo durante más de una hora a 60 C puede causar una disminución significativa o la pérdida de la inmunorreactividad para HER2 asociada a la membrana específica (17). Para conservar la antigenicidad, los cortes de tejido, montados en portaobjetos (portaobjetos SuperFrost Plus, con Poli-L-lysine o silanizados) deben teñirse dentro de un período de 4 a 6 semanas tras ser cortados si se mantienen a temperatura ambiente (20 25 C) (18). Los portaobjetos necesarios para la evaluación de la proteína HER2 y la verificación de la presencia tumoral deben prepararse simultáneamente. Se recomienda un mínimo de 5 portaobjetos: 1 para la presencia tumoral, 2 para la evaluación de la proteína HER2 (1 para la incubación con el vial núm. 2 y 1 para la incubación con el vial núm. 4) y 2 portaobjetos de reserva. La utilización de HercepTest TM en tejidos decalcificados no se ha validado y no se recomienda. Consultar la Education Guide: Immunohistochemical Staining Methods (19) de Dako y con las referencias 15 y 16 para más detalles sobre la preparación de muestras. ( ) P04455ES_01_K / p. 30/53
31 Cáncer gástrico Tratamiento de los tejidos antes de la tinción Para un rendimiento óptimo del ensayo, debe utilizarse un método específico de recuperación de epítopo, en tampón citrato a 10 mmol/l. La Epitope Retrieval Solution se suministra con el kit HercepTest. Este método implica el calentamiento de los cortes de tejido montados en portaobjetos sumergidos en tampón citrato a 10 mmol/l (20) en un baño de agua calibrado capaz de mantener la Epitope Retrieval Solution a la temperatura necesaria (95 99 C). Los laboratorios situados en zonas elevadas deben determinar el mejor método para mantener la temperatura necesaria del baño de agua. La recuperación de epítopo debe realizarse en un baño de agua. Se han probado otros métodos de calentamiento que no han arrojado resultados reproducibles. Inmediatamente después de la recuperación de epítopo, inicie el procedimiento de tinción. Una desviación del procedimiento descrito puede alterar los resultados. ( ) P04455ES_01_K / p. 31/53
32 Cáncer gástrico Precauciones - Gástrico 1. Para uso diagnóstico in vitro. 2. Para uso por profesionales. 3. El vial 1, Peroxidase-Blocking Reagent, contiene un peróxido de hidrógeno al 3%. Hoja de datos sobre seguridad de los materiales disponible previa solicitud para usuarios profesionales. 4. El vial 6, DAB Chromogen, contiene 5-<10% biphenyl-3,3',4,4'-tetrayltetraammonium tetrachloride y está etiquetado como: H350 H341 P201 P280 Peligro P308 + P313 P405 P501 Puede provocar cáncer. Se sospecha que provoca defectos genéticos. Procurarse las instrucciones antes del uso. Llevar guantes de protección. Llevar gafas o máscara de protección. Llevar prendas de protección. EN CASO DE exposición manifiesta o presunta: Consultar a un médico. Guardar bajo llave. Eliminar el contenido y el recipiente de acuerdo con las normativas locales, regionales, nacionales e internacionales. Es una regla general que los menores de 18 años tienen prohibido trabajar con este producto. Los usuarios deben recibir formación detallada sobre el procedimiento de trabajo adecuado, las propiedades peligrosas del producto y las instrucciones de seguridad necesarias. Para obtener información adicionatales o locales sobre el desecho de este producto. 5. El vial 8, Wash Buffer, contiene 5-<10% 2-amino-2-(hidroximetil)propano-1,3-diol clorhidrato y 0.1-<0.2% 5-bromo-5-nitro-1,3-dioxano. Puede provocar una reacción alérgica. Wash Buffer (10x) tiene la etiqueta: Atención H319 P280 P264 P305 + P351 + P338 Provoca irritación ocular grave. Usar protección para los ojos o la cara. Lavarse las manos cuidadosamente después de la manipulación. EN CASO DE CONTACTO CON LOS OJOS: Enjuagar con agua cuidadosamente durante varios minutos. Quitar las lentes de contacto cuando estén presentes y pueda hacerse con facilidad. Proseguir con el lavado. 6. Este producto contiene azida sódica (NaN 3 ), un producto químico muy tóxico en su forma pura. A las concentraciones en las que está presente en el producto, aunque no se clasifican como peligrosas, la azida sódica puede reaccionar con las cañerías de plomo y cobre, lo que formará acumulaciones de azidas metálicas muy explosivas. En el momento de su desecho, aclare con agua abundante, para impedir que la azida metálica se acumule en las tuberías (21, 22). 7. Los viales 2, 3 y 4 contienen material de origen animal. Como con cualquier producto derivado de fuentes biológicas, deben utilizarse los procedimientos de manipulación apropiados. ( ) P04455ES_01_K / p. 32/53
33 Cáncer gástrico 8. Los portaobjetos de control y los especímenes, antes y después de la fijación, y todos los materiales expuestos a ellos, deben manipularse como si pudieran transmitir una infección y deben desecharse tomando las precauciones adecuadas (23). Nunca pipetee los reactivos con la boca y evite el contacto de la piel y las membranas mucosas con los reactivos y las muestras. Si los reactivos entran en contacto con zonas sensibles, lávelas con abundante agua. 9. Minimice la contaminación microbiana de los reactivos para evitar una tinción no específica. 10. Los tiempos, las temperaturas o los métodos de incubación diferentes de los especificados pueden producir resultados erróneos. El secado excesivo durante más de una hora a 60 C puede causar una disminución significativa o pérdida de la inmunorreactividad para HER2 asociada a la membrana específica (17). 11. Los reactivos se suministran a la dilución óptima. Una nueva dilución puede ocasionar la pérdida de la tinción antigénica. 12. Todos los reactivos, incluidos Epitope Retrieval Solution y Wash Buffer, están formulados para utilizarse específicamente en esta prueba. Para que la prueba pueda realizarse según las especificaciones, no deben realizarse sustituciones salvo en el caso del Wash Buffer, cuando pueda utilizarse el N.º de catálogo S El Visualization Reagent y DAB Chromogen pueden verse perjudicados si quedan expuestos a niveles de luz demasiado intensos. No almacene componentes del sistema ni realice la tinción bajo una luz demasiado intensa, como la luz solar directa. 14. Lleve puesto equipo protector personal apropiado a fin de evitar que el producto entre en contacto con los ojos y la piel. Para obtener información adicional, consulte la Hoja de datos sobre seguridad de los materiales (MSDS, por sus siglas en inglés). 15. Los residuos de parafina pueden dar lugar a falsos negativos. 16. Para la interpretación exacta de los resultados del HercepTest en muestras de biopsia teñidas de adenocarcinoma de estómago, incluida la unión gastroesofágica, se recomienda utilizar un grupo de al menos 5 células tumorales teñidas. Un grupo de al menos 5 células tumorales teñidas consta de 5 células tumorales conectadas teñidas para HER Debido a la naturaleza heterogénea de las muestras de biopsia de cáncer gástrico, para obtener un resultado fiable, es importante realizar las pruebas IHC de la HER2 en varias piezas (7-8) de biopsia de diferentes regiones del tumor. 18. El uso de volúmenes de reactivo distintos de los recomendados puede dar lugar a una pérdida de inmunoreactividad visible a HER2. Los cortes de tejido mayores de 22 x 22 mm requerirán 2-3x 200 µl de reactivo aplicados en 2-3 áreas de aplicación automatizada. 19. Se recomienda comprobar más de un bloque de tejido de resecciones de cáncer gástrico si la muestra presenta un alto nivel de heterogeneidad (41). ( ) P04455ES_01_K / p. 33/53
34 Cáncer gástrico INSTRUCCIONES DE USO - Gástrico A. Preparación del reactivo Es conveniente preparar los siguientes reactivos antes de realizar la tinción: A.1 Epitope Retrieval Solution Diluya una cantidad suficiente del vial 7 (Epitope Retrieval Solution x 10) a 1:10 utilizando agua destilada o desionizada para el procedimiento de tinción previsto. La solución diluida sin usar puede almacenarse a 2 8 C durante un mes. Si la solución diluida presenta un aspecto turbio, deséchela. A.2 Wash Buffer Diluya una cantidad suficiente del vial 8 (Wash Buffer x 10) a 1:10 utilizando agua destilada o desionizada para los pasos del lavado. El tampón diluido sin usar puede almacenarse a 2 8 C durante un mes. Deseche la solución tampón s i tiene un aspecto turbio. El Autostainer está programado para aclarar cortes de tejido tras la aplicación del Peroxidase- Blocking Reagent y la Substrate-Chromogen Solution. Tenga en cuenta que, para estos pasos de aclarado, se puede utilizar agua destilada (o desionizada) o Wash Buffer. El resto de pasos de aclarado requieren el uso del Wash Buffer. A.3 Substrate-Chromogen Solution (DAB) Prepare la solución sustrato-cromógeno añadiendo 11 gotas (25 30 µl por gota) de cromógeno líquido DAB del vial 6 a un vial 5 que contiene tampón de sustrato DAB (11 ml) y mézclelo. La solución preparada Substrate-Chromogen Solution (DAB) se mantiene estable aproximadamente unos 5 días si se almacena a entre 2 y 8 C. Esta solución debe mezclarse minuciosamente antes de su utilización. La calidad de la tinción no se verá afectada por la formación de precipitado en la solución. NOTA: el color del DAB Chromogen del vial 6 puede variar de un marrón-azul lavanda claro a uno suave. Esto no alterará el rendimiento de este producto. Realice la dilución con arreglo a las pautas de este prospecto. La adición excesiva de DAB Chromogen al DAB Buffered Substrate ocasionará el deterioro de la señal positiva. A.4 Contratinción El producto final teñido resultante de la reacción de tinción de DAB es insoluble en alcohol y agua. Utilice una contratinción de hematoxilina y ajuste la intensidad de tinción de la hematoxilina a un nivel similar al mostrado en el HercepTest Interpretation Manual Gastric Cancer de Dako. Puede utilizarse hematoxilina, ya sea en solución acuosa o de alcohol, como Dako Mayer's Hematoxylin, N.º de catálogo S3301. Tras la contratinción con hematoxilina, realice un aclarado intenso en agua destilada o desionizada y, seguidamente, sumerja los cortes de tejido en un baño de agua de amoníaco a 37 mmol/l (véase el paso 3 de la sección B.2). El agua de amoníaco (37 mmol/l) se prepara mezclando 2,5 ml de hidróxido amónico a 15 mol/l (concentrado) con 1 litro de agua destilada o desionizada. El agua de amoníaco a 37 mmol/l que no se utilice puede conservarse a temperatura ambiente (20 25 C) en un frasco tapado herméticamente hasta 12 meses. A.5 Medio de montaje Se recomienda un medio de montaje no acuoso y permanente. No obstante, el montaje acuoso también resulta aceptable. Se recomienda la utilización de Dako Faramount Aqueous Mounting Medium, Ready-to-Use, N.º de catálogo S3025 o Glycergel Mounting Medium, N.º de catálogo C0563 para un montaje acuoso. Licue Glycergel calentándolo a aproximadamente 40 (±5) C antes de su uso. ( ) P04455ES_01_K / p. 34/53
35 B Procedimiento de tinción realizado en el Autostainer Cáncer gástrico B.1 Notas referentes al procedimiento El usuario debe leer estas instrucciones atentamente y familiarizarse con todos los componentes y los instrumentos antes de la utilización (véase el apartado Precauciones ). Todos los reactivos deben equilibrarse a temperatura ambiente (20 25 C) antes de la inmunotinción. De forma similar, todas las incubaciones deben realizarse a temperatura ambiente. No permita que los cortes de tejido se sequen durante la carga de portaobjetos en el Autostainer ni durante el procedimiento de tinción. Los cortes de tejido secos pueden mostrar una mayor tinción no específica. Si se interrumpe el procedimiento de tinción, los portaobjetos pueden conservarse en un baño de tampón después de la incubación del anticuerpo primario como máximo una hora a temperatura ambiente (20 25 C) sin que afecte al r endimiento de la tinción. Desparafinado y rehidratación: antes de la tinción, los portaobjetos con los tejidos deben desparafinarse, para eliminar el medio de inclusión, y rehidratarse. Evite una retirada incompleta de la parafina. Cualquier residuo del medio de inclusión provocaría un aumento de la tinción no específica. Este paso debe realizarse a temperatura ambiente (20 25 C). 1. Coloque los portaobjetos en un baño de xileno e incube durante 5 (±1) minutos. Cambie los baños y repita una vez. 2. Elimine el exceso de líquido golpeando suavemente los portaobjetos e introdúzcalos en etanol absoluto durante 3 (±1) minutos. Cambie los baños y repita una vez. 3. Golpee suavemente para eliminar el exceso de líquido e introduzca los portaobjetos en etanol al 95% durante 3 (±1) minutos. Cambie los baños y repita una vez. 4. Elimine el exceso de líquido golpeando suavemente los portaobjetos e introdúzcalos en agua destilada o desionizada un mínimo de 30 segundos. Inicie el proceso de tinción tal y como se expone en el paso 1 Recuperación de epítopo de la sección B.2. Las soluciones de xileno y alcohol deben cambiarse después de 40 portaobjetos. En lugar de xileno, pueden utilizarse sustitutos de tolueno o xileno, como Histoclear. NOTA: los reactivos y las instrucciones suministradas en este kit han sido diseñados para una eficacia óptima. Una mayor dilución de los reactivos o la alteración de las temperaturas de incubación puede conducir a resultados erróneos o discordantes. Las diferencias en el procesamiento de tejidos y los procedimientos técnicos en el laboratorio del usuario pueden invalidar los resultados del ensayo para su utilización en la selección de pacientes para la terapia de Herceptin. B.2 Protocolo de tinción Realizado a temperatura ambiente, C. Paso 1: Recuperación de epítopo Llene los recipientes de tinción, por ejemplo, cubetas de Coplin, con la Epitope Retrieval Solution diluida (consulte las INSTRUCCIONES DE USO en la sección A.1). Coloque los recipientes de tinción con Epitope Retrieval Solution en un baño de agua. Caliente el baño de agua y la Epitope Retrieval Solution a una temperatura de C. La Epitope Retrieval Solution adquiere un aspecto turbio al calentarla. Cubra los recipientes con tapas para estabilizar la temperatura y evitar la evaporación. Sumerja los cortes desparafinados a temperatura ambiente en la Epitope Retrieval Solution precalentada de los recipientes de tinción. VUELVA A SITUAR LA TEMPERATURA DEL BAÑO DE AGUA Y LA EPITOPE RETRIEVAL SOLUTION DE NUEVO A C. Incúbela durante 40 (±1) minutos a C. ( ) P04455ES_01_K / p. 35/53
36 Cáncer gástrico Saque la jarra entera con los portaobjetos del baño de agua. Deje que los portaobjetos se enfríen en la Epitope Retrieval Solution durante 20 (±1) minutos a temperatura ambiente. Decante la Epitope Retrieval Solution y aclare los portaobjetos en el Wash Buffer (consulte las INSTRUCCIONES DE USO de la sección A.2). Para un rendimiento óptimo, empape los cortes en Wash Buffer entre 5 y 20 minutos después de la recuperación de epítopo y antes de la tinción. NOTA: la Epitope Retrieval Solution está pensada para una aplicación de un solo uso. No la reutilice. Paso 2: Procedimiento del Autostainer 1. Utilice el mapa generado con el Autostainer sobre el autoprograma de HercepTest TM para establecer los tiempos de programa y los volúmenes de reactivo necesarios (consulte el punto 4 para conocer los volúmenes específicos). 2. Coloque los viales de reactivo del Autostainer en la rejilla de reactivos del Autostainer según indica el mapa de reactivos generado por ordenador. 3. Cargue los portaobjetos en el Autostainer según indica el mapa de portaobjetos generado por ordenador. 4. Seleccione Program e inicie el programa de HercepTest TM : Lo que sigue a continuación es un esquema de la secuencia del programa: Aclarado 200 µl Peroxidase-Blocking Reagent - 5 minutos Aclarado 200 µl Primary Anti-HER2 Protein (o Negative Control Reagent) - 30 minutos Aclarado 200 µl Visualization Reagent - 30 minutos Aclarado Aclarado Cambio 200 µl Substrate-Chromogen Solution (DAB) - 10 minutos Después del paso con sustrato cromógeno, aclare los portaobjetos con agua desionizada. NOTA: el Autostainer Hardware versión 01 aclara los portaobjetos con tampón. Por tanto, una vez retirados los portaobjetos del Autostainer, deben aclararse con agua desionizada. Paso 3: Contratinción (instrucciones válidas para la hematoxilina) Retire los portaobjetos del Autostainer y realice la contratinción con hematoxilina como se describe a continuación. Sumerja los portaobjetos en un baño de hematoxilina. Incúbelos entre 2 y 5 minutos, en función de la potencia de la hematoxilina utilizada. Aclárelos suavemente en un baño de agua destilada o desionizada. Asegúrese de que se han eliminado todos los residuos de hematoxilina. Opcional: introduzca los portaobjetos 10 veces en un baño de agua de amoníaco a 37 mmol/l (véase la sección A.4). Aclare los portaobjetos suavemente en un baño de agua destilada o desionizada entre 2 y 5 minutos. ( ) P04455ES_01_K / p. 36/53
37 Cáncer gástrico NOTA: en función de la duración de la incubación y la potencia de la hematoxilina utilizada, la contratinción dará como resultado una coloración entre azul pálido y azul oscuro de los núcleos celulares. Una contratinción excesiva o incompleta puede invalidar la interpretación correcta de los resultados. Paso 4: Montaje Se recomienda un medio de montaje no acuoso y permanente. De todas formas, un medio de montaje acuoso también resulta aceptable. Los especímenes pueden montarse y taparse con cubreobjetos con un medio de montaje acuoso como DakoCytomation Faramount, N.º de catálogo S3025, o Glycergel, N.º de catálogo C0563. NOTA: los portaobjetos pueden leerse cuando resulte apropiado. No obstante, puede que se pierda el color si los portaobjetos se cubren con un medio de montaje acuoso y se exponen a una luz intensa durante una semana. Para minimizar la pérdida de tinte, almacene los portaobjetos en un lugar oscuro a temperatura ambiente (20 25 C). Control de calidad - Gástrico Las diferencias en la fijación, el procesamiento y la inclusión de tejidos en el laboratorio del usuario pueden generar una variabilidad significativa de los resultados, lo que requeriría un rendimiento regular de los controles internos además de los portaobjetos de control suministrados por Dako. En EE.UU., consulte las indicaciones de control de calidad del Programa de certificación de inmunocitoquímica del Colegio de patólogos americanos (CAP, por sus siglas en inglés), así como la Quality Assurance for Immunocytochemestry, Approved Guideline del CLSI (anteriormente NCCLS) (24) y la referencia 25 para obtener información adicional. Tabla 8. Finalidad del control de calidad diario. Tejido: muestra equivalente a paciente fijada y procesada Control positivo: El tejido o las células que contengan el antígeno objetivo que deba detectarse (puede estar situado en el tejido del paciente). El control ideal es un tejido con una tinción ligeramente positiva, ya que de este modo es más sensible a la degradación del anticuerpo o el antígeno. Anticuerpo específico y anticuerpo secundario Controla todos los pasos del análisis. Valida el reactivo y los procedimientos utilizados para la tinción de la proteína HER2. Anticuerpo no específico* o tampón más el mismo anticuerpo secundario al utilizado con el anticuerpo específico Detección de tinción de fondo no específica. Control negativo: Tejidos o células que se prevén negativos (pueden estar situados en el tejido del paciente o el tejido de control positivo) Detección de reactividad cruzada no buscada del anticuerpo con las células o componentes celulares. Detección de tinción de fondo no específica. Tejido de paciente Detección de tinción específica Detección de tinción de fondo no específica. Portaobjeto de control suministrado por Dako Controla solamente el procedimiento de tinción * El suero es de la misma especie que el anticuerpo específico, pero no va dirigido al mismo antígeno objetivo. Para detectar un ligamiento de anticuerpo no específico, por ejemplo, ligamiento de la porción Fc del anticuerpo al tejido. Portaobjeto de control (suministrado): cada uno de los portaobjetos de control contiene tres líneas celulares con cáncer de mama humano en pellet, incluidas en parafina y fijadas en formol con unas puntuaciones de intensidad de tinción de 0, 1+ y 3+. En cada secuencia de tinción debe teñirse sólo un portaobjeto. La evaluación de las líneas celulares del portaobjeto de control suministrado por Dako indica la validez de la secuencia de tinción. ( ) P04455ES_01_K / p. 37/53
38 Cáncer gástrico Tejido de control positivo: los controles deben ser especímenes procedentes de autopsia, biopsia o quirúrgicos fijados, procesados e incluidos tan rápido como sea posible de la misma forma que las muestras de pacientes. Los controles de tejido positivos indican si los tejidos se han preparado correctamente y si se han utilizado las técnicas de tinción oportunas. Debe incluirse un tejido de control positivo para cada conjunto de condiciones de prueba en cada secuencia de tinción. Los tejidos de control positivo deben mostrar una tinción positiva débil para que puedan detectar cambios leves en la sensibilidad del anticuerpo primario. Los portaobjetos de control suministrados con este kit o los especímenes procesados de forma diferente de la(s) muestra(s) del paciente validan sólo el rendimiento del reactivo y no verifican la preparación del tejido. Utilice la proteína HER2 2+ determinada con anterioridad que sobreexprese tejido de adenocarcinoma de estómago, incluida la unión gastroesofágica, para un control de tejido positivo óptimo. NOTA: el tejido de control positivo conocido sólo debe utilizarse para realizar el seguimiento del rendimiento correcto de los tejidos procesados y los reactivos de la prueba y NO como una ayuda para formular un diagnóstico específico de las muestras de paciente. Si el tejido de control positivo no consigue demostrar una tinción positiva apropiada, los resultados de los especímenes de paciente deberán considerarse inválidos. Tejido de control negativo: utilice un tejido de control negativo (que se haya demostrado negativo para la proteína HER2) fijado, procesado e incluido de idéntica forma a la muestra o las muestras de paciente de cada secuencia de tinción para verificar la especificidad del anticuerpo primario y ofrecer una indicación de una tinción de fondo específica. El colon, el hígado o el tiroides son apropiados como tejido de control negativo. La variedad de tipos celulares diferentes presentes en la mayoría de cortes de tejido ofrece puntos de control negativo internos (debe verificarlo el usuario). Si se produce tinción específica en el tejido de control negativo, los resultados de la muestra del paciente deben considerarse no válidos y debe repetirse la prueba. Reactivo de control negativo no específico: utilice el reactivo de control negativo suministrado en lugar del anticuerpo primario con un corte de cada espécimen de paciente para evaluar la tinción no específica y permitir una mejor interpretación de la tinción específica en la zona del antígeno. El periodo de incubación para el reactivo de control negativo debe corresponderse con el del anticuerpo primario. Verificación del ensayo: antes del uso inicial de un anticuerpo o un sistema de tinción en un procedimiento de diagnóstico, el usuario debe verificar la especificidad del anticuerpo sometiéndolo a una prueba en un conjunto de tejidos internos con unas características de rendimiento inmunocitoquímico demostradas que representen tejidos positivos y negativos conocidos. Consulte los procedimientos de control de calidad descritos anteriormente en esta sección del prospecto y los requisitos de control de calidad del Programa de certificación del CAP respecto a la inmunocitoquímica y/o la Quality Assurance for Immunocytochemestry, Approved Guideline (24) del CLSI (anteriormente NCCLS). Estos procedimientos de control de calidad deben repetirse para cada nuevo lote de anticuerpos o siempre que se produzca un cambio en los parámetros de ensayo. Los adenocarcinomas de estómago, incluida la unión gastroesofágica, con intensidades demostradas de tinción de la proteína HER2 de entre 0 y 3+ y los tejidos negativos, como el colon, el hígado o la tiroides, son válidos para la verificación del ensayo. ( ) P04455ES_01_K / p. 38/53
39 Cáncer gástrico Interpretación de la tinción - Gástrico En la determinación de la expresión de la proteína HER2, sólo deben evaluarse la intensidad y el patrón de tinción de la membrana, utilizando la escala presentada en la tabla 9. La evaluación del portaobjetos debe realizarla un patólogo con la ayuda de un microscopio óptico. Para la evaluación de la tinción y la puntuación inmunohistoquímicas, resulta apropiado un objetivo de aumento 10x. La utilización de un objetivo de aumento 5 40x puede resultar de utilidad para confirmar la puntuación. La tinción citoplasmática debe considerarse como tinción no específica y no se incluirá en la evaluación de la intensidad de tinción de la membrana (8). Para obtener ayuda con la diferenciación de tinciones 0, 1+, 2+ y 3+, consulte el HercepTest Interpretation Manual Gastric Cancer de Dako, en el que hallará fotografías representativas de las intensidades y patrones de tinción. Sólo deben contabilizarse las muestras de pacientes con adenocarcinoma de estómago, incluida la unión gastroesofágica. En los casos con metaplasia intestinal y adenocarcinoma gástrico en la misma muestra, sólo debe contabilizarse el componente de adenocarcinoma gástrico. Para la interpretación de las biopsias teñidas con HercepTest se recomienda utilizar un grupo de al menos 5 células tumorales teñidas. Un grupo de al menos 5 células tumorales teñidas consta de 5 células tumorales conectadas teñidas para HER2. Tabla 9. Interpretación y puntuación de la tinción inmunohistoquímica de HER2 Puntuación Muestras quirúrgicas Patrón de tinción Muestras de biopsia Patrón de tinción Evaluación de la sobreexpresión de HER2 0 Sin reactividad o reactividad membranosa en <10% de las células tumorales Sin reactividad o sin reactividad membranosa en ninguna (o < 5 en grupo)de las células tumorales Negativa 1+ Reactividad membranosa débil o prácticamente imperceptible en 10% de las células tumorales; las células son reactivas sólo en parte de su membrana Grupos de células tumorales ( 5 células) con una reactividad membranosa débil o prácticamente imperceptible con independencia del porcentaje de células tumorales teñidas Negativa 2+ Reactividad membranosa completa, basolateral o lateral de débil a moderada en 10% de las células tumorales Grupos de células tumorales ( 5 células) con una reactividad membranosa completa, basolateral o lateral de débil a moderada con independencia del porcentaje de células tumorales teñidas Ambigua 3+ Reactividad membranosa completa, basolateral o lateral fuerte en 10% de las células tumorales Grupos de células tumorales ( 5 células) con una reactividad membranosa completa, basolateral o lateral fuerte con independencia del porcentaje de células tumorales teñidas Positivo Indicaciones según Hofmann et al. (40). HercepTest se interpreta para la sobreexpresión de la proteína HER2 como negativo (con puntuación 0 y 1+), ambiguo (con puntuación 2+) y positivo (con puntuación 3+). HercepTest no está pensado para ofrecer información de pronóstico a los pacientes y médicos y no se ha validado a este efecto. Para cada secuencia de tinción, deben examinarse los portaobjetos del modo presentado en la tabla 10 para determinar la validez de la secuencia de tinción y permitir una evaluación semicuantitativa de la intensidad de tinción del tejido muestra. ( ) P04455ES_01_K / p. 39/53
40 Cáncer gástrico Tabla 10. Orden de evaluación de los portaobjetos. Orden de lectura de los portaobjetos Exposición de motivos 1. Portaobjetos de control con tres líneas celulares La presencia de tinción marrón 3+ en la membrana celular (desoxidación) en la línea celular de control 3+ SK-BR-3, desoxidación marrón parcial en la línea celular de control 1+ MDA- 175 y la ausencia de tinción en la línea celular de control 0 MDA-231 indican la validez del ensayo. Se observa tinción de membrana punteada y discontinua en un número de pequeño a moderado de las células de la línea de células de control 1+ MDA-175, así como una inmunotinción punteada de la región de Golgi del citoplasma en esta misma línea de células La presencia de tinción marrón en la línea celular de control 0 MDA-231 (negativa para la tinción de la proteína HER2) indica que no se produjo tinción no específica durante el ensayo. Los resultados del ensayo pueden quedar invalidados debido a la sobretinción. 2. Portaobjetos de tejido de control positivo Debe observarse presencia de tinción marrón en la membrana. La tinción del citoplasma y los tejidos negativos no debe ser superior a Portaobjetos de tejido de control negativo La AUSENCIA de tinción específica en el portaobjeto de tejido de control negativo confirma la inexistencia de reactividad cruzada del kit con las células o los componentes celulares. Si se produce tinción de una membrana específica en el portaobjeto de tejido de control negativo, los resultados del espécimen del paciente deben considerarse inválidos. 4. Portaobjetos con tejido de paciente teñido con reactivo de control negativo 5. Portaobjetos con tejido de paciente teñido utilizando el anticuerpo primario La ausencia de tinción de una membrana específica verifica el marcado específico del antígeno de objetivo por parte del anticuerpo primario. La tinción oscura o marrón que pueda producirse en el citoplasma del espécimen tratado con el reactivo de control negativo, como en el tejido conjuntivo, los leucocitos, eritrocitos o tejido necrótico, debe considerarse como tinción de fondo no específica e incluirse en la sección de comentarios de la hoja de datos. Cuando se detecta sobreexposición de la proteína HER2 en el espécimen, aparecerá como desoxidación marrón localizada en la membrana celular de las células tumorales tratadas con el anticuerpo primario. 1. Portaobjeto de control (suministrado): el portaobjeto de control teñido con HercepTest debe examinarse en primer lugar para determinar que todos los reactivos funcionan correctamente. La presencia de un producto de reacción marrón (3,3'- diaminobenzidina, DAB) en la membrana celular indica una reactividad positiva. La presencia de tinción marrón en circunferencia en la membrana celular (desoxidación) en la línea celular de control 3+ SK-BR-3, desoxidación marrón parcial en la línea celular de control 1+ MDA-175 y la ausencia de tinción en la línea celular de control 0 MDA-231 indican la validez del ensayo. Si alguna de las líneas celulares de control muestran comportamientos diferentes a los señalados, todos los resultados de los especímenes de pacientes deberán considerarse inválidos. 2. Tejido de control positivo: el portaobjeto del tejido de control positivo deberá examinarse a continuación. Este portaobjeto verifica que el método de fijación y el proceso de recuperación de epítopo son efectivos. Utilice células intactas para la interpretación de los resultados de tinción, puesto que las células necróticas o degeneradas a menudo muestran tinción no específica (26). La tinción debe observarse en el tejido tumoral como una tinción marrón en la membrana celular. La tinción marrón del citoplasma y los tejidos negativos del espécimen no debe superar la puntuación de intensidad de tinción de 1+ correspondiente. ( ) P04455ES_01_K / p. 40/53
41 Cáncer gástrico 3. Tejido de control negativo: el portaobjeto con tejido de control negativo debe examinarse después del tejido de control positivo para verificar la especificidad del etiquetado del antígeno objetivo por parte del anticuerpo primario. La ausencia de tinción específica en el tejido de control negativo confirma la inexistencia de reactividad cruzada del kit con las células o los componentes celulares. Si se produce tinción específica en el tejido de control negativo, los resultados del espécimen del paciente deben considerarse inválidos. De forma alternativa, las porciones negativas del tejido de control positivo pueden funcionar igual que el tejido de control negativo, aunque debe verificarlo el usuario. Debe tenerse en cuenta que es posible observar una reacción débil (intensidad de tinción de 0 a 1+) en la mayor parte del tejido epitelial normal. Los posibles tejidos de control negativo incluyen: colon, hígado y tiroides. La tinción no específica, en su caso, tendrá una apariencia difusa. También es posible que se observe una tinción esporádica del tejido conjuntivo en cortes de tejido excesivamente fijados con formol Tejido de paciente: examine en último lugar los especímenes de pacientes teñidos con HercepTest. Debe evaluarse la intensidad de tinción positiva dentro del contexto de una tinción de fondo no específica del reactivo de control negativo. Igual que con cualquier prueba inmunocitoquímica, un resultado negativo significa que el antígeno no se ha detectado, y no que esté ausente de las células o el tejido sometido a ensayo. Consulte los apartados Resumen y explicación, Limitaciones y Características de rendimiento para obtener información específica respecto a la inmunorreactividad de HercepTest. Recomendaciones adicionales para la interpretación de la tinción con HercepTest Los adenocarcinomas de estómago, incluida la unión gastroesofágica analizados para la sobreexpresión de la proteína HER2 se puntúan de 0 a 3+. Aunque los casos 0 y 3+ están perfectamente definidos, un pequeño porcentaje de las muestras 1+ y 2+ restantes pueden resultar más difíciles de interpretar. Utilice las siguientes indicaciones para la interpretación de la tinción de HercepTest en su laboratorio. Evalúe las líneas celulares de control para validar el rendimiento del ensayo. Evalúe los portaobjetos de control negativo y positivo. Se recomienda una tinción de hematoxilina y eosina del espécimen del tejido para la primera evaluación. (Puede que el tumor no parezca evidente al observar la muestra teñida con HercepTest. Se requiere un portaobjeto teñido con hematoxilina y eosina para que el patólogo pueda verificar la presencia del tumor.) HercepTest TM debe realizarse en un corte emparejado (corte estándar) del mismo bloque de parafina del espécimen. Evalúe en primer lugar los cortes teñidos para la sobreexpresión de la proteína HER2 a baja potencia. La mayoría de casos positivos serán evidentes con aumento a baja potencia. Para los casos 1+, utilice un objetivo de 40x aumentos para verificar la tinción de la membrana. Para los casos 2+, utilice un objetivo de 10 a 20x aumentos para verificar la tinción de la membrana. Muestras quirúrgicas Las áreas conservadas y teñidas correctamente de la muestra deben utilizarse para realizar una determinación del porcentaje de células tumorales positivas. Si la mayoría de las células tumorales muestran una tinción completa, basolateral o lateral de la membrana, la tinción será 2+ o 3+. Si hay una tinción completa, basolateral o lateral de la membrana de intensidad fuerte en el 10% o más de las células tumorales de las muestras quirúrgicas, la puntuación de la muestra será 3+. ( ) P04455ES_01_K / p. 41/53
42 Cáncer gástrico Si hay una tinción completa, basolateral, lateral de la membrana de intensidad débil a moderada en el 10% o más de las células tumorales de las muestras quirúrgicas, la puntuación de la muestra será 2+. Si el 10% o más de las células tumorales de las muestras quirúrgicas, con tinción sólo en parte de la membrana, tienen una intensidad débil o prácticamente imperceptible, la puntuación de la muestra será de 1+. Si menos del 10% de las células tumorales de las muestras quirúrgicas presentan tinción, independientemente del patrón de tinción (p. ej. completa, basolateral o lateral o en parte de la membrana), la puntuación será 0. Si no se observa tinción alguna la muestra quirúrgica es 0. Muestras de biopsia Un grupo de al menos 5 células tumorales teñidas consta de 5 células tumorales conectadas teñidas para HER2. Si hay un grupo de células tumorales de al menos 5 células tumorales teñidas con una intensidad de la membrana completa, basolateral o lateral fuerte, la puntuación de la muestra de biopsia es 3+, con independencia del porcentaje de células tumorales teñidas. Si hay un grupo de células tumorales de al menos 5 células tumorales teñidas con una intensidad de la membrana completa, basolateral o lateral de débil a moderada, la puntuación de la muestra de biopsia es 2+, con independencia del porcentaje de células tumorales teñidas. Si hay un grupo de células tumorales de al menos 5 células tumorales teñidas con una tinción de la membrana débil o prácticamente imperceptible y las células sólo están teñidas en parte de la membrana, la puntuación de la muestra de biopsia es 1+, con independencia del porcentaje de células tumorales teñidas. Si no se observa tinción alguna la puntuación de la muestra de biopsia es 0. Si se observa una tinción de la membrana (independientemente de la intensidad) en menos de 5 células tumorales agrupadas, la puntuación de la muestra de biopsia es 0. Limitaciones - Gástrico Limitaciones generales 1. La inmunocitoquímica es un proceso de diagnóstico de varias etapas que requiere formación especializada en la selección de los reactivos apropiados; la selección, la fijación y el procesamiento de tejidos; la preparación del portaobjeto de inmunocitoquímica, y la interpretación de los resultados de la tinción. 2. El resultado de la tinción de tejidos depende de la manipulación y el procesamiento que se haga del tejido antes de su tinción. Si el tejido se fija, congela, descongela, lava, seca, calienta o corta incorrectamente, o si se contamina por contacto con otros tejidos o líquidos, pueden producirse artefactos, atrapamiento de anticuerpos o resultados falso negativos. La aparición de resultados no coherentes puede deberse a variaciones en los métodos de fijación y de inclusión, o a irregularidades inherentes al tejido. 3. Una contratinción excesiva o incompleta puede invalidar la interpretación correcta de los resultados. 4. La interpretación clínica de toda tinción positiva o de su ausencia debe evaluarse en el contexto de la presentación clínica, la morfología y otros criterios histopatológicos. La interpretación clínica de toda tinción, o de su ausencia, debe complementarse con estudios morfológicos y controles adecuados, así como con otras pruebas diagnósticas. Un patólogo certificado y familiarizado con los anticuerpos, reactivos y métodos utilizados, debe responsabilizarse de interpretar la preparación teñida. La tinción debe realizarse en un laboratorio certificado y con licencia, bajo la supervisión de un patólogo responsable de la revisión de los portaobjetos teñidos y de garantizar la corrección de los controles positivos y negativos. ( ) P04455ES_01_K / p. 42/53
43 Cáncer gástrico 5. Es posible que los tejidos de las personas infectadas con el virus de la hepatitis B y con antígeno de superficie de hepatitis B (HBsAg) muestren tinción no específica con peroxidasa de rábano rusticano (27). Los reactivos pueden mostrar reacciones imprevistas en tipos de tejidos no probados previamente. La posibilidad de reacciones imprevistas incluso en tipos de tejido probados no puede eliminarse por completo, debido a la variabilidad de la expresión del antígeno en las neoplasias u otros tejidos patológicos (28). Póngase en contacto con los Servicios técnicos de Dako con pruebas documentales de la reacción imprevista. 6. Pueden observarse resultados falso positivos debidos a un ligamiento no inmunológico de las proteínas o de los productos de reacción del sustrato. También pueden estar provocados por la actividad de la pseudoperoxidasa (eritrocitos) y la actividad de la peroxidasa endógena (citocromo C) (28). 7. El procedimiento de tinción debe realizarse a una temperatura ambiente de entre C. Limitaciones específicas del producto 1. El antígeno presente en la línea celular de control 1+ MDA-175 se degradará con el tiempo. Evalúe los resultados del portaobjeto de control teniendo en cuenta la fecha de caducidad del mismo. Una tinción negativa de las células MDA-175 puede indicar que el portaobjeto de control se ha degradado. Los portaobjetos de control deben almacenarse a una temperatura de entre 2 y 8 C. 2. Es posible que la degradación del antígeno en los tejidos provocase con el tiempo resultados falso negativos. Cuando se almacenan a temperatura ambiente (20 25 C), los especímenes deben teñirse antes de que transcurran de 4 a 6 semanas desde el montaje de los tejidos en los portaobjetos (29). 3. Para obtener unos resultados óptimos y reproducibles, la proteína HER2 exige una recuperación de epítopo por calor cuando los tejidos se fijan de la forma rutinaria (formol tamponado neutro) y se incluyen en parafina. Este pretratamiento debe completarse al principio de todo el proceso de tinción. Consulte la sección Preparación del espécimen. Tratamiento de los tejidos antes de la tinción, para obtener instrucciones. 4. La recuperación de epítopo por calor de la proteína HER2 sólo debe realizarse mediante un baño de agua calibrado. Se han probado otros métodos de calentamiento que no han arrojado resultados reproducibles. 5. No sustituya los reactivos del kit por reactivos con otros números de lote o con reactivos de otros fabricantes. La única excepción es el tampón de lavado, que puede reemplazarse por el tampón de lavado Dako con N.º de catálogo S Pueden obtenerse resultados falsos de la evaluación de la tinción citoplasmática. Al interpretar los resultados, tenga sólo en cuenta la intensidad de la tinción de la membrana celular. 7. Los portaobjetos de control de tinción deben utilizarse exclusivamente para validar la secuencia de tinción y no como guía para registrar la reacción de tinción en secciones de tejidos. 8. En ocasiones puede observarse una tinción focal fuerte (3+), es decir, puntos calientes. Este resultado puede deberse a una fijación o a un procesamiento irregular del tejido. En este caso, se recomienda la inmunotinción de un segundo bloque de tejidos del mismo espécimen. 9. No se ha validado el uso de HercepTest en muestras fijadas con fijadores distintos del formol tamponado neutro. 10. Tenga en cuenta que los epitelios normales de las amígdalas y el esófago pueden ofrecer una intensidad de tinción superior a Deben evitarse tanto el uso de muestras de cáncer gástrico trituradas como la interpretación de tinciones de artefacto alrededor de los contornos de una biopsia. ( ) P04455ES_01_K / p. 43/53
44 Cáncer gástrico Características de resultados - Gástrico Antecedentes La seguridad y eficacia de trastuzumab (Herceptin ) se ha demostrado en un estudio clínico (el ToGA Trial) (38, 39). El estudio fue diseñado como un estudio multicéntrico de fase III, abierto, aleatorizado realizado en pacientes con HER2 positivo con adenocarcinoma inoperable localmente avanzado, recurrente y/o metastásico de estómago o de la unión gastroesofágica. La positividad para HER2 en el ToGA Trial se definió según si era positiva con IHC (3+) (HercepTest de Dako) y/o positiva con HER2 FISH (HER2/CEN17 2.0) (HER2 FISH pharmdx Kit de Dako). Después de la inclusión en el estudio, los pacientes fueron aleatorizados para que recibieran quimioterapia (5-FU o capecitabina y cisplatino) o quimioterapia más trastuzumab. El criterio de valoración principal del estudio fue la supervivencia global (SG). En el estudio se aleatorizaron 594 pacientes y 584 recibieron la medicación objeto del estudio y fueron incluidos en el conjunto de análisis completo (FAS). Para el criterio de valoración principal la combinación de quimioterapia más trastuzumab mostró ser superior estadísticamente que la quimioterapia sola. La mediana de la SG aumentó de 11,1 a 13,8 meses (p=0,0046) con un índice de riesgo de 0,74 (IC 95%: 0,60 0,91). Las curvas de Kaplan-Meier para la SG se muestran en la figura 1. Probabilidad de supervivencia 1,0 0,9 0,8 0,7 Prueba de rangos logarítmicos P = 0,0046 0,6 0,5 0,4 0,3 0,2 0,1 0 11,1 13,8 Tiempo (meses) N. izquierda Fluoro/Cisp Tras/Fluoro/Cisp Grupo de tratamiento Fluoro/Cisp Tras/Fluoro/Cisp Grupo 1 ( grupo de baja expresión de HER2 ): IHC 0/FISH+ e IHC 1+/FISH+ (n=131) Grupo 2 ( grupo de alta expresión de HER2 ): IHC 2+/FISH+ e IHC 3+ incluido IHC 3+ (FISH+ o FISH- o FISH sin resultado (n=446) Cuando se repitió el análisis principal de la SG para el grupo de alta expresión de HER2 (n=446) el beneficio a favor del tratamiento combinado fue incluso mayor. La mediana de la SG del grupo de pacientes que habían recibido quimioterapia más trastuzumab aumentó a 16,0 meses en comparación con 11,8 meses de los pacientes que solamente recibieron quimioterapia. El índice de riesgo de este análisis disminuyó a 0,65 (IC 95%: 0,51 0,83). Las curvas de SG de Kaplan-Meier para el grupo de alta expresión de HER2 se muestran en la figura 2. ( ) P04455ES_01_K / p. 44/53
45 Cáncer gástrico Probabilidad de supervivencia 1,0 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0 11,8 16,0 Tiempo (meses) N. izquierda Fluoro/Cisp Tras/Fluoro/Cisp Grupo de tratamiento Fluoro/Cisp Tras/Fluoro/Cisp Figura 2.Curva de SG de Kaplan-Meier para el grupo de alta expresión de HER2 (n=446). El ToGA Trial ha demostrado que la combinación de las pruebas de ICH y FISH son predictivas del efecto del tratamiento combinado de quimioterapia y trastuzumab, no obstante, los análisis exploratorios posteriores parecen indicar que los pacientes con altos niveles de expresión de la proteína HER2 (IHC2+/FISH+ y IHC3+) experimentan un beneficio mayor. Esto puede explicarse por el hecho de que la proteína es la diana de trastuzumab. Si desea obtener más información sobre el ToGA Trial, consulte el prospecto de Herceptin. Reproducibilidad Reproducibilidad interna: la reproducibilidad interna se probó en un laboratorio con 3 muestras con diferentes intensidades de tinción en IHC. Cada muestra se probó por triplicado. Este protocolo se utilizó con tinción automática. Todos los especímenes dieron un 100% de resultados reproducibles. la reproducibilidad interna se probó en un laboratorio con 11 muestras con diferentes intensidades de tinción en IHC. Cada muestra se probó por triplicado. Este protocolo se utilizó con tinción manual. Todos los especímenes dieron un 100% de resultados reproducibles. Reproducibilidad entre secuencias y entre laboratorios: Se realizaron los análisis con HercepTest de 60 muestras de cáncer gástrico diferentes, obtenidas de áreas del estómago y de la unión gastroesofágica que representaban resecciones y biopsias quirúrgicas, en cinco días alternos en tres centros de estudio. Las 60 muestras del estudio se distribuyeron equitativamente en las tres categorías de estado en cuanto a HER2. Seis patólogos realizaron un total de 2040 puntuaciones de la HER2. Cada día el consenso (negativo, ambiguo, positivo) variaba del 83,1% al 98,3%. En 47 de 60 comparaciones posibles, los consensos fueron del 90,0% o superior. En Tabla 1, se muestran los ejemplos específicos de las comparaciones realizadas cada día con una media de consensos del 91,2%, 92,5% y 92,5% para los tres centros. Los consensos entre todos los centros fueron del 82,7%, 75,0% y 88,0%, respectivamente para la comparación en los centros por pares (consulte Tabla 12). Según la prueba exacta de Fisher, los resultados fueron los mismos entre los centros. Los consensos de todos los observadores entre los patólogos en cada centro fueron del 88,0%, 83,6% y 81,0% para los tres centros de estudio, respectivamente (tabla 13). ( ) P04455ES_01_K / p. 45/53
46 Cáncer gástrico En conclusión los análisis realizados con HercepTest de las muestras de cáncer gástrico en los tres centros de estudio demostraron un buen consenso entre observaciones en cuanto a los días, centros y observadores. Tabla 11. Consensos totales diarios en porcentaje - Subconjunto de 12 de 60 comparaciones Observador 1 Observador 2 Consenso Consenso CI95 LL 1 Consenso CI95 LL 1 medio Centro 1 Centro 2 Centro 3 Día 1 vs. Día 2 85,0 74,4 93,3 84,9 Día 3 vs. Día 4 93,3 84,9 93,3 84,9 Día 1 vs. Día 2 95,0 87,3 83,1 72,0 Día 3 vs. Día 4 96,7 89,7 95,0 87,3 Día 1 vs. Día 2 90,0 80,5 91,7 82,7 Día 3 vs. Día 4 96,7 89,7 91,7 82,7 91,2 92,5 92,5 1 CI95 LL: intervalo de confianza límite inferior al 95%. Tabla 12. Consensos totales entre los centros en porcentaje Consenso CI95 LL 1 Consenso medio Centro 1 vs. Centro 2 Centro 1 vs. Centro 3 Centro 2 vs. Centro 3 Día 1 vs. Día 1 83,3 72,4 Día 2 vs. Día 2 85,0 74,4 Día 3 vs. Día 3 85,0 74,4 Día 4 vs. Día 4 81,7 70,5 Día 5 vs. Día 5 78,3 66,7 Día 1 vs. Día 1 80,0 68,6 Día 2 vs. Día 2 73,3 61,2 Día 3 vs. Día 3 78,3 66,7 Día 4 vs. Día 4 68,3 55,9 Día 5 vs. Día 5 75,0 63,0 Día 1 vs. Día 1 88,3 78,5 Día 2 vs. Día 2 86,7 76,4 Día 3 vs. Día 3 90,0 80,5 Día 4 vs. Día 4 86,7 76,4 Día 5 vs. Día 5 88,3 78,5 82,7 75,0 88,0 1 CI95 LL: intervalo de confianza límite inferior al 95%. ( ) P04455ES_01_K / p. 46/53
47 Cáncer gástrico Tabla 13. Consensos entre Observadores en porcentaje Centro 1 Centro 2 Centro 3 Consenso CI 95 LL 1 Consenso medio Día 1 91,7 82,7 Día 2 91,7 82,7 Día 3 93,3 84,9 88,0 Día 4 83,3 72,4 Día 5 80,0 68,6 Día 1 86,4 76,0 Día 2 83,3 72,4 Día 3 83,3 72,4 83,6 Día 4 83,3 72,4 Día 5 81,7 70,5 Día 1 80,0 68,6 Día 2 78,3 66,7 Día 3 80,0 68,6 81,0 Día 4 78,3 66,7 Día 5 90,0 80,5 1 CI95 LL: intervalo de confianza límite inferior al 95%. Inmunorreactividad En la tabla 14 aparece un resumen de la inmunorreactividad del HercepTest junto con el panel recomendado de tejidos normales. Todos los tejidos estaban fijados con formol e incluidos en parafina y se habían teñido con el HercepTest de acuerdo con las instrucciones del prospecto. Tabla 14. Resumen de la reactividad de tejido normal en el HercepTest. Tipo de tejido (N.º analizado) Suprarrenal (3) Medula ósea (3) Encefálico/cerebral (3) Encefálico/cerebral (3) Mamario (3) Cuello uterino (3) Colónico (3) Esofágico (3) Cardiaco (3) Renal (3) Hepático (3) Pulmonar (3) Mesotelial (3) Ovárico (3) Pancreático (3) Paratiroideo (3) Nervio periférico (3) Hipófisis (3) Prostático (3) Glándula salivar (3) Músculo esquelético (3) Cutáneo (3) Intestino delgado (3) Esplénico (3) Gástrico (3) Testicular (3) Tímico (3) Tiroideo (3) Amigdalino (3) Uterino (3) Tinción de elemento tisular positivo y patrón de tinción Glándula mamaria (2/3 tejidos, intensidad de tinción 1+, <5% de las células) Células epiteliales (1/3 tejidos, intensidad de tinción 1+, <5% de las células, membrana y citoplasma, granular) Células epiteliales foliculares (1/3 tejidos, intensidad de tinción 1+, <5% de las células, membrana y citoplasma) Epitelio escamoso (1/3 tejidos, intensidad de tinción 1+, 5% de las células. 2/3 tejidos, intensidad de tinción 2+, 10-20% de las células. Membrana y citoplasma) Tejido endometrial (2/3 tejidos, intensidad de tinción 1+, 30-60% de las células, citoplasma, granular) La tinción registrada en todos los tejidos se refiere a la membrana, a menos que se indique lo contrario. Las tres muestras de cada tipo de tejido tuvieron la misma intensidad de tinción, a menos que se indique lo contrario. ( ) P04455ES_01_K / p. 47/53
48 Cáncer gástrico Solución de problemas - Gástrico Consulte la sección de resolución de problemas del manual de Dako indicado anteriormente (19) para encontrar una solución o póngase en contacto con el Departamento de servicio técnico de Dako para informar de la tinción inusual. Problema Causa probable Acción sugerida 1. Los portaobjetos no se tiñeron 1a. Error de programación. Los reactivos no se utilizaron en el orden correcto 1a. Compruebe la parrilla de programación para verificar si la secuencia de tinción se ha programado correctamente 2. Tinción débil de los portaobjetos 1b. Los viales de reactivo no se cargaron en las ubicaciones correctas en las rejillas de reactivos 1c. No hay reactivo suficiente en el vial de reactivo 1d. Presencia de azida sódica en la solución de lavado 1e. Es probable que el calentamiento excesivo de los cortes de tejido montados antes de la desparafinización y la recuperación del antígeno inducida por calor causen la pérdida de la inmunorreactividad visible para HER2. 2a. Recuperación de epítopo insuficiente 2b. Incubación incorrecta del reactivo 2c. Método de fijación no apropiado 2d. Es probable que el calentamiento excesivo de los cortes de tejido montados antes de la desparafinización y la recuperación del antígeno inducida por calor causen una disminución significativa de la inmunorreactividad visible para HER2. 1b. Compruebe el mapa de reactivos para verificar la ubicación correcta de los viales de reactivo 1c. Asegúrese de que se introduce reactivo suficiente en los viales de reactivo antes de iniciar la secuencia. Consulte el mapa de reactivos para conocer los volúmenes necesarios 1d. Utilice una preparación reciente del Wash Buffer suministrado en el kit 1e. Seque los cortes de tejido a temperatura ambiente durante un mínimo de 12 horas o hasta que estén secos. Como alternativa, seque a 37 C durante toda la noche o bien seque a 60 C durante un máximo de una hora. El secado de cortes de tejidos a temperaturas altas solo debe efec-tuarse en un horno calibrado con distribución uniforme del calor (17). 2a. Compruebe que la Epitope Retrieval Solution alcanza los C durante 40 minutos y que se deja enfriar durante 20 minutos 2b. Revise las instrucciones del procedimiento de tinción 2c. Asegúrese de que el tejido del paciente no está sobrefijado y de que no se ha utilizado otro fijador 2d. Seque los cortes de tejido a temperatura ambiente durante un mínimo de 12 horas o hasta que estén secos. Como alternativa, seque a 37 C durante toda la noche o bien seque a 60 C durante un máximo de una hora. El secado de cortes de tejidos a temperaturas altas solo debe efectuarse en un horno calibrado con distribución uniforme del calor (17). ( ) P04455ES_01_K / p. 48/53
49 Cáncer gástrico 3. Tinción de fondo de portaobjetos excesiva 4. El tejido se despega del portaobjeto 5. Tinción específica excesivamente fuerte 2e. Aplicado un volumen insuficiente de reactivo. 3a. No se ha retirado por completo la parafina 3b. Se han utilizado aditivos de almidón al montar los cortes en los portaobjetos 3c. No se han aclarado los portaobjetos correctamente 3d. Las secciones se han secado durante el procedimiento de tinción 3e. Cortes secados durante la carga del Autostainer 3f. Método de fijación no apropiado 3g. Enlace no específico de los reactivos con el tejido 4a. Se han utilizado portaobjetos inadecuados 5a. Método de fijación no apropiado 5b. Utilización de una fuente de calor no adecuada para la recuperación de epítopo, como un vaporizador, un horno microondas o un autoclave 2e. Compruebe el tamaño del corte de tejido (22 x 22 mm) y el volumen de reactivo aplicado. 3a. Utilice soluciones de eliminación recientes y siga el procedimiento tal y como se indica en la sección B.1 3b. No utilice aditivos de almidón para adherir los cortes al portaobjeto. Muchos aditivos son inmunorreactivos 3c. Asegúrese de que el Autostainer está cebado correctamente antes de iniciar la secuencia. Asegúrese de que se dispone de suficiente tampón para toda la secuencia. Utilice soluciones recién preparadas de tampones y lavado 3d. Compruebe que se aplica el volumen correcto de reactivo a los portaobjetos. Asegúrese de que la secuencia del Autostainer se ejecuta con la tapa en la posición correcta y que no se expone ni a calor excesivo ni a corrientes de aire 3e. Asegúrese de que los cortes se conservan humedecidos con tampón durante la carga y antes de iniciar la secuencia 3f. Asegúrese de que se ha utilizado un fijador aprobado. Los fijadores alternativos pueden producir un exceso de tinción de fondo 3g. Compruebe el método de fijación del espécimen y la presencia de necrosis 4a. Utilice portaobjetos silinizados, como los Dako Silanized Slides, N.º de catálogo S3003, los portaobjetos SuperFrost Plus o portaobjetos recubiertos de poli-l-lisina 5a. Asegúrese de que sólo se emplearon fijadores y métodos de fijación aprobados 5b. Asegúrese de que sólo se utiliza un baño de agua para la recuperación de epítopo ( ) P04455ES_01_K / p. 49/53
50 Cáncer gástrico 6. Tinción débil de la línea celular del portaobjeto de control Epitope Retrieval Solution adquiere un aspecto turbio cuando se calienta 8. Epitope Retrieval Solution adquiere un aspecto turbio cuando se almacena (antes de calentarla) 5c. Incubación del reactivo demasiado prolongada 5d. Solución de lavado no adecuada 6a. No se ha seguido el protocolo de recuperación de epítopo correcto 6b. No hay reacción con la Substrate Chromogen Solution (DAB) 6c. Degradación del portaobjeto de control 7. La solución adquiere un aspecto turbio cuando se calienta 8. La solución se ha almacenado incorrectamente o ha pasado la fecha de caducidad de la solución 5c. Revise las instrucciones del procedimiento de tinción 5d. Utilice únicamente el tampón de lavado recomendado para el kit 6a. Sumerja los portaobjetos en la Epitope Retrieval Solution precalentada. Haga que la Epitope Retrieval Solution vuelva a alcanzar los C y precaliente durante 40 minutos 6b. Asegúrese de incubarla durante 10 minutos. Asegúrese de que sólo se agregó una gota de cromógeno DAB a 1 ml de DAB Buffered Substrate 6c. Compruebe la fecha de caducidad del kit y las condiciones de almacenamiento del mismo en la parte exterior del paquete 7. Esto es normal y no influye en la tinción 8. Compruebe la fecha de caducidad y las condiciones de almacenamiento del kit impresas en la parte exterior del envase. Deseche la epitope retrieval solution NOTA: si el problema no puede atribuirse a ninguna de las causas expuestas anteriormente o si la medida de corrección que se sugiere no resuelve el problema, llame a los Servicios técnicos de Dako para obtener más ayuda. Puede encontrar información adicional sobre las técnicas de tinción y sobre la preparación de especímenes en el manual de Dako citado anteriormente (19) (disponible en Dako), en Atlas of Immunohistology (30) y en Immunoperoxidase Techniques. A Practical Approach to Tumor Diagnosis (31). ( ) P04455ES_01_K / p. 50/53
51 Referencias 1. Coussens L, Yang-Feng TL, Liao Y-C, Chen E, Gray A, McGrath J, et al. Tyrosine kinase receptor with extensive homology to EGF receptor shares chromosomal location with neu oncogene. Science 1985;230: King CR, Kraus MH, Aaronson SA. Amplification of a novel v-erbb-related gene in a human mammary carcinoma. Science 1985;229: Semba K, Kamata N, Toyoshima K, Yamamoto T. A v-erbb-related protooncogene, c-erbb-2, is distinct from the c-erbb-1/epidermal growth factor-receptor gene and is amplified in a human salivary gland adenocarcinoma. Proc Natl Acad Sci USA 1985;82: Yamamoto T, Ikawa S, Akiyama T, Semba K, Nomura N, Miyajima N, et al. Similarity of protein encoded by the human c-erb-b-2 gene to epidermal growth factor receptor. Nature 1986;319: Schechter AL, Hung M-C, Vaidyanathan L, Weinberg RA, Yang-Feng TL, Francke U, et al. The neu gene: an erbb-homologous gene distinct from and unlinked to the gene encoding the EGF receptor. Science 1985;229: Bargmann CI, Hung M-C, Weinberg RA. The neu oncogene encodes an epidermal growth factor receptor-related protein. Nature 1986;319: Natali PG, Nicotra MR, Bigotti A, Venturo I, Slamon DJ, Fendly BM, et al. Expression of the p185 encoded by HER2 oncogene in normal and transformed human tissues. Int J Cancer 1990;45: Press MF, Cordon-Cardo C, Slamon DJ. Expression of the HER-2/neu proto-oncogene in normal human adult and fetal tissues. Oncogene 1990;5: Lonardo F, Di Marco E, King CR, Pierce JH, Segatto O, Aaronson SA, et al. The normal erbb-2 product is an atypical receptor-like tyrosine kinase with constitutive activity in the absence of ligand. New Biologist 1990;2: Carter P, Presta L, Gorman CM, Ridgway JBB, Henner D, Wong WLT, et al. Humanization of an anti-p185 HER2 antibody for human cancer therapy. Proc Natl Acad Sci USA 1992;89: Hudziak RM, Lewis GD, Winget M, Fendly BM, Shepard HM, Ullrich A. p185 HER2 monoclonal antibody has antiproliferative effects in vitro and sensitizes human breast tumor cells to tumor necrosis factor. Mol Cell Biol 1989;9: Lewis GD, Figari I, Fendly B, Wong WL, Carter P, Gorman C, et al. Differential responses of human tumor cell lines to anti-p185 HER2 monoclonal antibodies. Cancer Immunol Immunother 1993;37: Baselga J, Norton L, Albanell J, Kim Y-M, Mendelsohn J. Recombinant humanized anti-her2 antibody (Herceptin ) enhances the antitumor activity of paclitaxel and doxorubicin against HER2/neu overexpressing human breast cancer xenografts. Cancer Res 1998;58: a. Medical Laboratories Particular requirements for quality and competence, ISO 15189:2003. b. Clinical Laboratory Improvement Amendments of 1988: Final Rule, 57CFR7163, February 28, Sheehan DC, Hrapchak BB. Theory and practice of histotechnology. St. Louis: The C. V. Mosby Company; Kiernan JA. Histological and histochemical methods: theory & practice. New York: Pergamon Press; Lundgaard Hansen B, Winther H, Moller K. Excessive section drying of breast cancer tissue prior to deparaffinisation and antigen retrieval causes a loss in HER2 immunoreactivity, Immunocytochemistry 2008;6, DakoCytomation California Inc., Data on file. 19. Key M. Education Guide: Immunohistochemical Staining Methods. Fifth Edition. Dako, Carpinteria, California; Leong AS-Y, Milios J, Leong FJ. Epitope retrieval with microwaves. A comparison of citrate buffer and EDTA with three commercial retrieval solutions. Appl Immunohistochem 1996;4: Procedures for decontamination of plumbing systems containing copper and/or lead azides, Department of Health, Education, and Welfare, National Institute for Occupational Safety and Health, Rockville, MD, Decontamination of laboratory sink drains to remove azide salts. Center for Disease Control Manual Guide: Safety Management, No. CDC-22, Atlanta, GA, April 30, Clinical and Laboratory Standards Institute (formerly NCCLS). Protection of Laboratory Workers From Occupationally Acquired Infections; Approved Guideline Third Edition. CLSI document M29-A3 [ISBN ]. Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania USA, Clinical and Laboratory Standards Institute (formerly NCCLS). Quality assurance for immunocytochemistry; Approved guideline. CLSI document MM4-A ( ) CLSI, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania USA; ( ) P04455ES_01_K / p. 51/53
52 25. Elias JM, Gown AM, Nakamura RM, Wilbur DC, Herman GE, Jaffe ES, et al. Special report: quality control in immunohistochemistry. Am J Clin Pathol 1989;92: Nadji M, Morales AR. Immunoperoxidase: Part I. The technique and its pitfalls. Lab Med 1983;14: Omata M, Liew C-T, Ashcavai M, Peters RL. Nonimmunologic binding of horseradish peroxidase to hepatitis B surface antigen: a possible source of error in immunohistochemistry. Am J Clin Path 1980;73: Herman GE, Elfont EA. The taming of immunohistochemistry: the new era of quality control. Biotech & Histochem 1991; 66: Press MF, Hung G, Godolphin W, Slamon DJ. Sensitivity of HER-2/neu antibodies in archival tissue samples: potential source of error in immunohistochemical studies of oncogene expression. Cancer Res 1994;54: Tubbs RR, Gephardt GN, Petras RE. Specimen processing and quality assurance. In: Atlas of immunohistology. Chicago: Amer Soc Clin Pathol Press; 1986: Nadji M, Morales AR. Immunoperoxidase techniques. A practical approach to tumor diagnosis. Chicago: Amer Soc Clin Pathol Press; Jørgensen JT. Targeted HER2 Treatment in Advanced Gastric Cancer. Oncology 2010;78: Tanner M, Hollmén M, Junttila TT, Kapanen AI, Tomola S, SoiniY et al. Amplification of HER-2 in gastric carcinoma: association with Topoisomerase II alpha gene amplification, intestinal type, poor prognosis and sensitivity to trastuzumab. Ann Oncol 2005;16: Matsui Y, Inomata M, Tojigamori M, Sonoda K, Shiraishi N, Kitano S. Suppression of tumor growth in human gastric cancer with HER2 overexpression by an anti-her2 antibody in a murine model. Int J Oncol 2005; 27: Fujimoto-Ouchi K, Sekiguchi F, Yasuno H, Moriya Y, Mor K, Tanaka Y. Antitumor activity of trastuzumab in combination with chemotherapy in human gastric cancer xenograft models. Cancer Chemother Pharmacol 2007; 59: Kim SY, Kim HP, Kim YJ, Oh DY, Im S-A, Lee D et al. Trastuzumab inhibits the growth of human gastric cancer cell lines with HER2 amplification synergistically with cisplatin. Int J Oncol 2008; 32: Bang YJ, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastroesophageal junction cancer (ToGA): a phase 3, open-label, randomized controlled trial. Lancet Bang Y, Chung J, Xu J, Lordick F, Sawaki A, Lipatov O et al. Pathological features of advanced Gastric Cancer (GC): Relationship to human epidermal growth factor receptor 2 (HER2) positivity in the global screening programme of the ToGA trial. J Clin Oncol 2009; 27:15s (suppl; abstr 4556). 39. Van Cutsem E, Kang YK, Chung HC, Shen L, Sawaki A, Lordick F, et al. Efficacy results from the ToGA trial: a phase III study of trastuzumab added to standard chemotherapy in first-line human epidermal growth factor receptor 2 (HER2)-positive advanced gastric cancer. (presentation ASCO 2009). 40. Hofmann M, Stoss O, Shi D, Büttner R, van de Vijver M, Kim W, et al. Assessment of a HER2 scoring system for gastric cancer: results from a validation study. Histopath 2008;52: Asioli S, Maletta F, Verdun di Cantogno L, Satolli MA, Schena M, Pecchioni C, et al. Approaching heterogeneity of human epidermal growth factor receptor 2 in surgical specimens of gastric cancer. Human Pathol 2012; 43;11: ( ) P04455ES_01_K / p. 52/53
53 Explicación de símbolos Número de catálogo Límite de temperatura Código de lote Pictograma de peligro SGA (consulte la sección sobre precauciones) Producto sanitario para diagnóstico in vitro Frágil, manipular con precaución Fecha de caducidad Pictograma de peligro SGA (consulte la sección sobre precauciones) Consulte las instrucciones de uso Contenido suficiente para <n> ensayos Fabricante Fabricado por: Dako Denmark A/S Produktionsvej 42 DK-2600 Glostrup Dinamarca Tel Fax Distribuido en EE.UU. por Dako North America, Inc Via Real Carpinteria, California 93013, EE.UU. Tel. 805/ gratuito: 800/ Información para pedidos Tel. 800/ Fax: 805/ Servicios técnicos: Tel. 800/ HercepTest y Herceptin son marcas comerciales de Genentech, Inc. sujetas a licencias propiedad de Dako Denmark A/S y F. Hoffmann-La Roche Ltd. ( ) P04455ES_01_K / p. 53/53
Módulo de MAMA. Ronda nº 2
 SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de MAMA Ronda nº 2 Antígeno probado: P63 Tejido probado: Tejido mamario
SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de MAMA Ronda nº 2 Antígeno probado: P63 Tejido probado: Tejido mamario
HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS
 HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS INTERES CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS INTERES CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
Biología Celular e Histología. Prácticas de Biología Celular. Cultivos celulares y Procesamiento de tejidos.
 Biología Celular e Histología Prácticas de Biología Celular Cultivos celulares y Procesamiento de tejidos. Suspensiones celulares. Inmunodetección directa. Identificación celular tras cultivo. Manejo del
Biología Celular e Histología Prácticas de Biología Celular Cultivos celulares y Procesamiento de tejidos. Suspensiones celulares. Inmunodetección directa. Identificación celular tras cultivo. Manejo del
DIRECTRICES QUALANOD HOJA DE ACTUALIZACIÓN Nº 16 Edición Página 1 de 5 INSPECCIONES RUTINARIAS A LICENCIATARIOS
 Página 1 de 5 INSPECCIONES RUTINARIAS A LICENCIATARIOS Propuesta: Comité Técnico Decisión de QUALANOD: Reunión noviembre 2012 Fecha de aplicación: 1 de julio de 2013 Parte de las Directrices a la que afecta:
Página 1 de 5 INSPECCIONES RUTINARIAS A LICENCIATARIOS Propuesta: Comité Técnico Decisión de QUALANOD: Reunión noviembre 2012 Fecha de aplicación: 1 de julio de 2013 Parte de las Directrices a la que afecta:
TEMA 14. Métodos inmunológicos para la identificación microbiana
 TEMA 14 Métodos inmunológicos para la identificación microbiana Tema 14. Métodos inmunológicos para la identificación microbiana 1. Introducción 2. Detección de antígenos 2.1. Obtención de anticuerpos
TEMA 14 Métodos inmunológicos para la identificación microbiana Tema 14. Métodos inmunológicos para la identificación microbiana 1. Introducción 2. Detección de antígenos 2.1. Obtención de anticuerpos
A: Protocolo de Actuación para trabajos con Bromuro de Etidio.
 TRABAJOS CON BROMURO DE ETIDIO Y ACRILAMIDA. 1 A: Protocolo de Actuación para trabajos con Bromuro de Etidio. Objeto: Dar instrucciones de seguridad para todos los procedimientos que utilicen Bromuro de
TRABAJOS CON BROMURO DE ETIDIO Y ACRILAMIDA. 1 A: Protocolo de Actuación para trabajos con Bromuro de Etidio. Objeto: Dar instrucciones de seguridad para todos los procedimientos que utilicen Bromuro de
SSI IMMUVIEW LEGIONELLA BLOOD TEST ANÁLISIS DE SANGRE IMMUVIEW LEGIONELLA
 SSI IMMUVIEW LEGIONELLA BLOOD TEST ANÁLISIS DE SANGRE IMMUVIEW LEGIONELLA Aplicación El análisis de sangre ImmuView Legionella de Statens Serum Institute se ha creado para el diagnóstico de una infección
SSI IMMUVIEW LEGIONELLA BLOOD TEST ANÁLISIS DE SANGRE IMMUVIEW LEGIONELLA Aplicación El análisis de sangre ImmuView Legionella de Statens Serum Institute se ha creado para el diagnóstico de una infección
WITNESS RELAXIN (plasma, serum) RLX RLX u d 9 n n ersio V X RLX L R -W IO B S
 WITNESS RELAXIN (plasma, serum) SBIO-W Version n 9 du 28.07.2010 WITNESS RELAXIN WITNESS RELAXIN GENERALIDADES El kit WITNESS RELAXIN permite diagnosticar la gestación en la perra y en la gata, y permite
WITNESS RELAXIN (plasma, serum) SBIO-W Version n 9 du 28.07.2010 WITNESS RELAXIN WITNESS RELAXIN GENERALIDADES El kit WITNESS RELAXIN permite diagnosticar la gestación en la perra y en la gata, y permite
CANTIDAD DE PARTICULAS LIVIANAS EN LOS AGREGADOS PETREOS I.N.V. E
 CANTIDAD DE PARTICULAS LIVIANAS EN LOS AGREGADOS PETREOS I.N.V. E 221 07 1. OBJETO 1.1 Esta norma tiene por objeto establecer el método para determinar el porcentaje de partículas livianas en los agregados
CANTIDAD DE PARTICULAS LIVIANAS EN LOS AGREGADOS PETREOS I.N.V. E 221 07 1. OBJETO 1.1 Esta norma tiene por objeto establecer el método para determinar el porcentaje de partículas livianas en los agregados
CÓMO... Tomar Muestras de Tejido para Histopatología
 para Histopatología Por qué se deben tomar muestras de tejido para histopatología? El tomar muestras de tejido para histopatología es una manera barata y rápida de obtener información adicional importante
para Histopatología Por qué se deben tomar muestras de tejido para histopatología? El tomar muestras de tejido para histopatología es una manera barata y rápida de obtener información adicional importante
50 kits de recolección de muestras con torunda multitest Aptima (N.º de catálogo PRD-03546) Cada kit contiene:
 Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
EGFR pharmdx. Nº de catálogo K1494 50 pruebas para uso en el Dako Autostainer Edición 9/27/2006. Uso previsto Para uso en diagnóstico in vitro.
 EGFR pharmdx Nº de catálogo K1494 50 pruebas para uso en el Dako Autostainer Edición 9/27/2006 Uso previsto Para uso en diagnóstico in vitro. El ensayo EGFR pharmdx es un kit inmunohistoquímico (IHQ) para
EGFR pharmdx Nº de catálogo K1494 50 pruebas para uso en el Dako Autostainer Edición 9/27/2006 Uso previsto Para uso en diagnóstico in vitro. El ensayo EGFR pharmdx es un kit inmunohistoquímico (IHQ) para
HOJA DE INFORMACIÓN Y SEGURIDAD
 HOJA DE INFORMACIÓN Y SEGURIDAD 1. IDENTIFICACIÓN DEL PRODUCTO Nombre del producto: Neozime Código de identificación interno: NZ Fabricante: Labnews Industrias Químicas Ltda. Dirección: Rua Ademar Bombo,
HOJA DE INFORMACIÓN Y SEGURIDAD 1. IDENTIFICACIÓN DEL PRODUCTO Nombre del producto: Neozime Código de identificación interno: NZ Fabricante: Labnews Industrias Químicas Ltda. Dirección: Rua Ademar Bombo,
Preparación de agua de dilución :
 La determinación de la Demanda Bioquímica de Oxígeno es una prueba en la que se determina los requerimientos relativos de oxígeno en aguas contaminadas tal como aguas residuales domésticas e industriales,,
La determinación de la Demanda Bioquímica de Oxígeno es una prueba en la que se determina los requerimientos relativos de oxígeno en aguas contaminadas tal como aguas residuales domésticas e industriales,,
Fortel PROSTATE (PSA)
 Fortel PROSTATE (PSA) Test para Screening Simple, realizable y confidencial [Seleccione la fecha] Un test visual fácil, para detectar niveles anormales del Antígeno Prostático Específico (PSA), sobre rango
Fortel PROSTATE (PSA) Test para Screening Simple, realizable y confidencial [Seleccione la fecha] Un test visual fácil, para detectar niveles anormales del Antígeno Prostático Específico (PSA), sobre rango
La Patología a Molecular y el Control de Calidad
 UNIDAD DIDÁCTICA 7: LOS PROCESOS EN ANATOMÍA PATOLÓGICA La Patología a Molecular y el Control de Calidad Asunción n Olmo Sevilla Master Diagnóstica S. L. Patología Molecular: Patología del futuro X Personal:
UNIDAD DIDÁCTICA 7: LOS PROCESOS EN ANATOMÍA PATOLÓGICA La Patología a Molecular y el Control de Calidad Asunción n Olmo Sevilla Master Diagnóstica S. L. Patología Molecular: Patología del futuro X Personal:
Histology FISH Accessory Kit N.º de catálogo K5799
 Histology FISH Accessory Kit N.º de catálogo K5799 4ª edición Auflage Para hibridación in situ fluorescente (FISH) con cortes de tejidos fijados con formol e incluidos en parafina. El kit contiene reactivos
Histology FISH Accessory Kit N.º de catálogo K5799 4ª edición Auflage Para hibridación in situ fluorescente (FISH) con cortes de tejidos fijados con formol e incluidos en parafina. El kit contiene reactivos
Herpes Simplex Virus II (Polyclonal)
 Identificación del Producto N.º de ref. Descripción 44640 Herpes simplex virus II 0,1 R (Poly) 44641 Herpes simplex virus II 1 R (Poly) 44309 Herpes simplex virus II RTU R (Poly) Definiciones De Los Símbolos
Identificación del Producto N.º de ref. Descripción 44640 Herpes simplex virus II 0,1 R (Poly) 44641 Herpes simplex virus II 1 R (Poly) 44309 Herpes simplex virus II RTU R (Poly) Definiciones De Los Símbolos
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS
 PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
DANAGENE BLOOD DNA KIT
 Ref. 0601 100 ml Ref. 0602 200 ml DANAGENE BLOOD DNA KIT 1.INTRODUCCION DANAGENE BLOOD DNA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de sangre total o médula ósea.
Ref. 0601 100 ml Ref. 0602 200 ml DANAGENE BLOOD DNA KIT 1.INTRODUCCION DANAGENE BLOOD DNA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de sangre total o médula ósea.
Selección de pacientes
 2 Selección de pacientes MENSAJES CLAVE Aproximadamente entre el 20% y el 30% de las pacientes con cáncer de mama presentan tumores HER2 positivos. Hasta un 24% de los tumores con receptores de estrógenos
2 Selección de pacientes MENSAJES CLAVE Aproximadamente entre el 20% y el 30% de las pacientes con cáncer de mama presentan tumores HER2 positivos. Hasta un 24% de los tumores con receptores de estrógenos
FICHA DE SEGURIDAD (FDS Reglamento UE 1907/2006) Página 1 de 7
 Página 1 de 7 PRODUCTO: TERRAMOL COMPLET 1. IDENTIFICACION DE LA MEZCLA Y DE LA EMPRESA 1.1. Identificador del producto Nombre comercial: TERRAMOL COMPLET Caracterización química: Aminoácidos. 1.2. Usos
Página 1 de 7 PRODUCTO: TERRAMOL COMPLET 1. IDENTIFICACION DE LA MEZCLA Y DE LA EMPRESA 1.1. Identificador del producto Nombre comercial: TERRAMOL COMPLET Caracterización química: Aminoácidos. 1.2. Usos
INSTRUCCIONES DE REFERENCIA RÁPIDA Uso exclusivo con el Analizador Sofia.
 Analizador y FIA INSTRUCCIONES DE REFERENCIA RÁPIDA Uso exclusivo con el Analizador Sofia. Procedimiento de prueba Lea el Prospecto y el Manual del usuario detenidamente antes de usar las Instrucciones
Analizador y FIA INSTRUCCIONES DE REFERENCIA RÁPIDA Uso exclusivo con el Analizador Sofia. Procedimiento de prueba Lea el Prospecto y el Manual del usuario detenidamente antes de usar las Instrucciones
RESULTADOS Y DISCUSIÓN
 RESULTADOS Y DISCUSIÓN Estimación de la Concentración Proteica del Filtrado de Cultivo de Mycobacterium tuberculosis H37Rv La curva estándar con la que se estimó la concentración proteica del filtrado
RESULTADOS Y DISCUSIÓN Estimación de la Concentración Proteica del Filtrado de Cultivo de Mycobacterium tuberculosis H37Rv La curva estándar con la que se estimó la concentración proteica del filtrado
EL EQUIPO MULTIDISCIPLINAR XXVI CONGRESO DE LA SEAP/IAP PAPEL DEL PATOLOGO EN LOS TUMORES DEL APARATO DIGESTIVO BIOMARCADORES PREDICTIVOS
 XXVI CONGRESO DE LA SEAP/IAP PAPEL DEL PATOLOGO EN LOS TUMORES DEL APARATO DIGESTIVO ACTUALIZACION EN BIOMARCADORES Y GUIA DE RECOMENDACIONES EN TUMORES DEL APARATO DIGESTIVO # DIAGNOSTICO # APORTACION
XXVI CONGRESO DE LA SEAP/IAP PAPEL DEL PATOLOGO EN LOS TUMORES DEL APARATO DIGESTIVO ACTUALIZACION EN BIOMARCADORES Y GUIA DE RECOMENDACIONES EN TUMORES DEL APARATO DIGESTIVO # DIAGNOSTICO # APORTACION
Hoja de datos de seguridad XILONEN ZINC Fecha de actualización: 28/11/14 Página: 1/6
 Cafferata 3552 S2003EEP Rosario, Santa Fe República Argentina +54 341 432 7472 Informes: info@quimeco.com.ar Administración: administracion@quimeco.com.ar Ventas: ventas@quimeco.com.ar Hoja de datos de
Cafferata 3552 S2003EEP Rosario, Santa Fe República Argentina +54 341 432 7472 Informes: info@quimeco.com.ar Administración: administracion@quimeco.com.ar Ventas: ventas@quimeco.com.ar Hoja de datos de
Hoja de Datos de Seguridad
 Hoja de Datos de Seguridad 1. Identificación de la sustancia / preparación e identificación de la compañía Producto: Broder 4.6% PM (Bacillus thuringiensis) Agente de Control Biológico. Compañía: Dirección:
Hoja de Datos de Seguridad 1. Identificación de la sustancia / preparación e identificación de la compañía Producto: Broder 4.6% PM (Bacillus thuringiensis) Agente de Control Biológico. Compañía: Dirección:
Esmalte Directo Sobre Hierro y Óxido Forja
 Esmalte Directo Sobre Hierro y Óxido Forja DEFINICIÓN PRODUCTO Óxido brinda una protección óptima de hasta 8 años a las barandillas y rejas de metal. Su fórmula especial actúa a la vez como fondo eficaz
Esmalte Directo Sobre Hierro y Óxido Forja DEFINICIÓN PRODUCTO Óxido brinda una protección óptima de hasta 8 años a las barandillas y rejas de metal. Su fórmula especial actúa a la vez como fondo eficaz
TRABAJO PRÁCTICO N 0 3 TERMOQUÍMICA
 TRABAJO PRÁCTICO N 0 3 TERMOQUÍMICA OBJETIVOS Determinación de la variación de entalpía asociada a procesos químicos. Aplicación de conceptos termodinámicos: temperatura, calor, entalpía. Verificación
TRABAJO PRÁCTICO N 0 3 TERMOQUÍMICA OBJETIVOS Determinación de la variación de entalpía asociada a procesos químicos. Aplicación de conceptos termodinámicos: temperatura, calor, entalpía. Verificación
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 46928 c-myc 0,1 R (EP121) 46929 c-myc 1 R (EP121) 46927 c-myc RTU R (EP121) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Identificación del Producto N.º de ref. Descripción 46928 c-myc 0,1 R (EP121) 46929 c-myc 1 R (EP121) 46927 c-myc RTU R (EP121) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
INFORMACIÓN VOLUNTARIA DE PRODUCTO basada en el formato de la hoja de seguridad para abrasivos flexibles
 Página 1 de 6 INFORMACIÓN VOLUNTARIA DE PRODUCTO basada en el formato de la hoja de seguridad para abrasivos flexibles 1. Identificación de la sustancia o la mezcla y de la sociedad o la empresa 1.1. Identificaciór
Página 1 de 6 INFORMACIÓN VOLUNTARIA DE PRODUCTO basada en el formato de la hoja de seguridad para abrasivos flexibles 1. Identificación de la sustancia o la mezcla y de la sociedad o la empresa 1.1. Identificaciór
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 45622 GATA3 0,1 M (L50-823) 45623 GATA3 1 M (L50-823) 45639 GATA3 RTU M (L50-823) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
Identificación del Producto N.º de ref. Descripción 45622 GATA3 0,1 M (L50-823) 45623 GATA3 1 M (L50-823) 45639 GATA3 RTU M (L50-823) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO
 RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO Fundamento Los alimentos se diferencian entre sí por las sustancias o principios inmediatos que contienen y por la cantidad de cada uno
RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO Fundamento Los alimentos se diferencian entre sí por las sustancias o principios inmediatos que contienen y por la cantidad de cada uno
Jefe de laboratorio Coordinador del sistema de gestión de calidad e inocuidad Director de división químicos
 VERSIÓN: 3 Página 1 de 5 Preparó: T.Q.I. Rubi De Luna Revisó: TQA. Cinthia Morales Autorizó: Lic. Miguel Contreras CARGO: FIRMA: FECHA: Jefe de laboratorio Coordinador del sistema de gestión de calidad
VERSIÓN: 3 Página 1 de 5 Preparó: T.Q.I. Rubi De Luna Revisó: TQA. Cinthia Morales Autorizó: Lic. Miguel Contreras CARGO: FIRMA: FECHA: Jefe de laboratorio Coordinador del sistema de gestión de calidad
FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico.
 FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico. OBJETIVOS 1. Reconocer las etapas del trabajo científico y elaborar informes
FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico. OBJETIVOS 1. Reconocer las etapas del trabajo científico y elaborar informes
DuPont Protección de Cultivos Seguimiento de Etiquetas México
 Comunicado MACC DCP-02062014 DuPont Protección de Cultivos Junio 2014 DuPont Protección de Cultivos Seguimiento de Etiquetas México Estimados clientes: La presente comunicación quiere resaltar la importancia
Comunicado MACC DCP-02062014 DuPont Protección de Cultivos Junio 2014 DuPont Protección de Cultivos Seguimiento de Etiquetas México Estimados clientes: La presente comunicación quiere resaltar la importancia
Helicobacter pylori (Polyclonal)
 Identificación del Producto N.º de ref. Descripción 44626 Helicobacter pylori 0,1 R (Poly) 44627 Helicobacter pylori 1 R (Poly) 44302 Helicobacter pylori RTU R (Poly) Definiciones De Los Símbolos P C A
Identificación del Producto N.º de ref. Descripción 44626 Helicobacter pylori 0,1 R (Poly) 44627 Helicobacter pylori 1 R (Poly) 44302 Helicobacter pylori RTU R (Poly) Definiciones De Los Símbolos P C A
PCR gen 16S ARNr bacteriano
 PCR gen 16S ARNr bacteriano Ref. PCR16S 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y la práctica de la Reacción en Cadena de la Polimerasa
PCR gen 16S ARNr bacteriano Ref. PCR16S 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y la práctica de la Reacción en Cadena de la Polimerasa
LABORATORIO DE QUÍMICA ANALÍTICA I LQ-218. Práctica de Laboratorio No. 3 CALIBRACIÓN DE MATERIAL VOLUMÉTRICO ANALÍTICO
 UNIVERSIDAD NACIONAL AUTÓNOMA DE HONDURAS FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA DEPARTAMENTO DE QUÍMICA LABORATORIO DE QUÍMICA ANALÍTICA I LQ-218 Práctica de Laboratorio No. 3 COMPETENCIAS A LOGRAR:
UNIVERSIDAD NACIONAL AUTÓNOMA DE HONDURAS FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA DEPARTAMENTO DE QUÍMICA LABORATORIO DE QUÍMICA ANALÍTICA I LQ-218 Práctica de Laboratorio No. 3 COMPETENCIAS A LOGRAR:
2. Precauciones de Rutina para el Control de Infecciones de Enfermedades Respiratorias
 2. PRECAUCIONES DE RUTINA PARA EL CONTROL DE INFECCIONES DE ENFERMEDADES RESPIRATORIAS 2. Precauciones de Rutina para el Control de Infecciones de Enfermedades Respiratorias Precauciones estándar Las precauciones
2. PRECAUCIONES DE RUTINA PARA EL CONTROL DE INFECCIONES DE ENFERMEDADES RESPIRATORIAS 2. Precauciones de Rutina para el Control de Infecciones de Enfermedades Respiratorias Precauciones estándar Las precauciones
FICHA TECNICA M U L T I U S O S DETERGENTE DESINFECTANTE
 FICHA TECNICA M U L T I U S O S DETERGENTE DESINFECTANTE FICHA TECNICA. Producto líquido desinfectante altamente concentrado para todo tipo de lavado de Pisos y superficies. Es un producto elaborado a
FICHA TECNICA M U L T I U S O S DETERGENTE DESINFECTANTE FICHA TECNICA. Producto líquido desinfectante altamente concentrado para todo tipo de lavado de Pisos y superficies. Es un producto elaborado a
TECHNOLOGY. CROSSMATCH TEST canino. primer test inmunocromatografico para reaccion cruzada con antiglobulina canina especifica.
 CROSSMATCH TEST canino primer test inmunocromatografico para reaccion cruzada con antiglobulina canina especifica 20 minutos TECHNOLOGY - ahorra tiempo - facil manipulacion - resultados fiables - facil
CROSSMATCH TEST canino primer test inmunocromatografico para reaccion cruzada con antiglobulina canina especifica 20 minutos TECHNOLOGY - ahorra tiempo - facil manipulacion - resultados fiables - facil
Limpieza y desinfección Cuerpos de medición de tonómetros, cristales de contacto y Desinset
 SVENSKA NEDERLANDS PORTUGUÊS ESPAÑOL ITALIANO FRANÇAIS DEUTSCH ENGLISH INSTRUCCIONES DE USO Limpieza y desinfección Cuerpos de medición de tonómetros, cristales de contacto y Desinset 5. edición / 2015
SVENSKA NEDERLANDS PORTUGUÊS ESPAÑOL ITALIANO FRANÇAIS DEUTSCH ENGLISH INSTRUCCIONES DE USO Limpieza y desinfección Cuerpos de medición de tonómetros, cristales de contacto y Desinset 5. edición / 2015
SOLDADURA PATERNIT FICHA DE DATOS DE SEGURIDAD. 1. Identificación del producto y de la empresa
 1. Identificación del producto y de la empresa Identificación del producto: Nombre comercial: Soldadura Paternit FABRICANTE: Industria Paternit SA DIRECCION: Carrera 17F 23-01 CIUDAD: Cali PAIS: Colombia
1. Identificación del producto y de la empresa Identificación del producto: Nombre comercial: Soldadura Paternit FABRICANTE: Industria Paternit SA DIRECCION: Carrera 17F 23-01 CIUDAD: Cali PAIS: Colombia
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 44668 Kappa Light Chain 0,1 M (L1C1) 44669 Kappa Light Chain 1 M (L1C1) 44323 Kappa Light Chain RTU M (L1C1) Definiciones De Los Símbolos P C A E S DIL
Identificación del Producto N.º de ref. Descripción 44668 Kappa Light Chain 0,1 M (L1C1) 44669 Kappa Light Chain 1 M (L1C1) 44323 Kappa Light Chain RTU M (L1C1) Definiciones De Los Símbolos P C A E S DIL
PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS.
 PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS. OBJETIVOS En esta práctica se tratarán aspectos de interés relacionados con los equilibrios
PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS. OBJETIVOS En esta práctica se tratarán aspectos de interés relacionados con los equilibrios
DESIONIZADOR DE LOS VINOS Y MOSTOS
 DESIONIZADOR DE LOS VINOS Y MOSTOS Tras varios años de investigación se ha probado y desarrollado una técnica para la reducción de potasio en los vinos tintos, blancos y mostos de uva. Esta técnica es
DESIONIZADOR DE LOS VINOS Y MOSTOS Tras varios años de investigación se ha probado y desarrollado una técnica para la reducción de potasio en los vinos tintos, blancos y mostos de uva. Esta técnica es
RESOLUCIÓN OIV/OENO 427/2010
 RESOLUCIÓN OIV/OENO 427/2010 CRITERIOS PARA LOS MÉTODOS DE CUANTIFICACIÓN DE LOS RESIDUOS, POTENCIALMENTE ALERGÉNICOS, DE PROTEÍNAS USADAS EN LA CLARIFICACIÓN DE LOS VINOS La ASAMBLEA GENERAL, De conformidad
RESOLUCIÓN OIV/OENO 427/2010 CRITERIOS PARA LOS MÉTODOS DE CUANTIFICACIÓN DE LOS RESIDUOS, POTENCIALMENTE ALERGÉNICOS, DE PROTEÍNAS USADAS EN LA CLARIFICACIÓN DE LOS VINOS La ASAMBLEA GENERAL, De conformidad
Clasificación y cuidados de la ropa
 Clasificación y cuidados de la ropa Lavado y secado de ropa Para darle los cuidados necesarios a cada prenda debes leer su etiqueta e interpretar las indicaciones. Toma en cuenta los siguientes cuidados
Clasificación y cuidados de la ropa Lavado y secado de ropa Para darle los cuidados necesarios a cada prenda debes leer su etiqueta e interpretar las indicaciones. Toma en cuenta los siguientes cuidados
Determinación de Conductividad
 QUÍMICA ANALITICA APLICADA INORGÁNICA QMC 613 Determinación de Conductividad Procedimiento Operativo Estándar Luis Fernando Cáceres Choque 08/09/2013 Método Conductimétrico Página 2 de 7 en aguas y efluentes
QUÍMICA ANALITICA APLICADA INORGÁNICA QMC 613 Determinación de Conductividad Procedimiento Operativo Estándar Luis Fernando Cáceres Choque 08/09/2013 Método Conductimétrico Página 2 de 7 en aguas y efluentes
Trabajo Práctico de Biología Celular
 Trabajo Práctico de Biología Celular Objetivo General: Reconocimiento de estructuras subcelulares mediante transfección de proteínas fluorescentes e inmunocitoquímica Transfección: proceso por el cual
Trabajo Práctico de Biología Celular Objetivo General: Reconocimiento de estructuras subcelulares mediante transfección de proteínas fluorescentes e inmunocitoquímica Transfección: proceso por el cual
SECCION IV. PROPIEDADES FISICAS Y QUIMICAS
 3 2 0 SECCION IV. PROPIEDADES FISICAS Y QUIMICAS Temperatura de ebullición: 97 C (207 F) lit. Temperatura de fusión: 127 C ( 197 F) lit. Temperatura de inflamación: 22 C (72 F) copa cerrada. Temperatura
3 2 0 SECCION IV. PROPIEDADES FISICAS Y QUIMICAS Temperatura de ebullición: 97 C (207 F) lit. Temperatura de fusión: 127 C ( 197 F) lit. Temperatura de inflamación: 22 C (72 F) copa cerrada. Temperatura
BAX System ES Lysis Buffer
 El SDS cumple con los requisitos y las normas generales de los países de Latinoamérica, pero es posible que no satisfagan los requisitos normativos de otros países. SECCIÓN 1. IDENTIFICACIÓN DEL PRODUCTO
El SDS cumple con los requisitos y las normas generales de los países de Latinoamérica, pero es posible que no satisfagan los requisitos normativos de otros países. SECCIÓN 1. IDENTIFICACIÓN DEL PRODUCTO
ABRILLANTADOR SUELOS PIZARRA A-4
 FICHA DE SEGURIDAD Fecha de revisión: 7-02-07. 1. Identificación del preparado y de la empresa Descripción del producto: Abrillantador metalizante suelos pizarra A-4. Uso: Emulsión autobrillante para abrillantar
FICHA DE SEGURIDAD Fecha de revisión: 7-02-07. 1. Identificación del preparado y de la empresa Descripción del producto: Abrillantador metalizante suelos pizarra A-4. Uso: Emulsión autobrillante para abrillantar
CPS Screen Wash K3 Hoja Técnica
 CPS Screen Wash K3 (LIMPIADOR DE PANTALLAS K-3) Disolvente líquido con emulsificante. Envases de 5, 25 y 210 litros. Producto destinado a la limpieza de tintas en general, manualmente o en una instalación
CPS Screen Wash K3 (LIMPIADOR DE PANTALLAS K-3) Disolvente líquido con emulsificante. Envases de 5, 25 y 210 litros. Producto destinado a la limpieza de tintas en general, manualmente o en una instalación
Tenga en cuenta el espacio pequeño. Me pareció que el espacio aéreo más, un CDS más débiles se produjo. Tanto como el 50% menos!
 Cómo preparo CDS a través del "Shot Glass" Método Cómo preparar un litro o cuarto de galón de solución de 25 ppm de dióxido de cloro - 26 de septiembre 212 Descargo de responsabilidad: Este procedimiento
Cómo preparo CDS a través del "Shot Glass" Método Cómo preparar un litro o cuarto de galón de solución de 25 ppm de dióxido de cloro - 26 de septiembre 212 Descargo de responsabilidad: Este procedimiento
FICHAS PREVENTIVAS USO DE PRODUCTOS QUÍMICOS
 1 USO DE PRODUCTOS QUÍMICOS 1. Definición Producto químico peligroso es aquel que puede representar un riesgo para la seguridad y salud de los trabajadores debido a sus propiedades fisicoquímicas, químicas
1 USO DE PRODUCTOS QUÍMICOS 1. Definición Producto químico peligroso es aquel que puede representar un riesgo para la seguridad y salud de los trabajadores debido a sus propiedades fisicoquímicas, químicas
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR
 ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
Salida de refrigerante para calefacción externa. Información general
 Información general Información general El refrigerante del motor se puede utilizar para calentar elementos externos. Los ejemplos incluyen carrozados de caja, cabinas de grúas y cajas de almacenamiento.
Información general Información general El refrigerante del motor se puede utilizar para calentar elementos externos. Los ejemplos incluyen carrozados de caja, cabinas de grúas y cajas de almacenamiento.
2. ESTRATEGIA PARA EFECTUAR LA CLONACION Y EXPRESION DEL GEN
 1. CONTROL FINAL Nombre Internacional y nombre de la vacuna Nombre del propietario Nombre y dirección del fabricante Número de Lote Fecha de fabricación Fecha de caducidad Temperatura de almacenamiento
1. CONTROL FINAL Nombre Internacional y nombre de la vacuna Nombre del propietario Nombre y dirección del fabricante Número de Lote Fecha de fabricación Fecha de caducidad Temperatura de almacenamiento
HOJA DE DATOS DE SEGURIDAD DETERGENTE LAV-LAB AMARILLO NEUTRO
 1. Identificación de la sustancia/preparado y de la sociedad o empresa 1.1 Identificación de la sustancia o del preparado Denominación: Detergente Lav-Lab Amarillo Neutro. 1.2 Uso de la sustancia o preparado:
1. Identificación de la sustancia/preparado y de la sociedad o empresa 1.1 Identificación de la sustancia o del preparado Denominación: Detergente Lav-Lab Amarillo Neutro. 1.2 Uso de la sustancia o preparado:
LIMPIEZA Y DESINFECCION
 PAGINA: 1 de 7 1. DEFINICION: Es el procedimiento, mediante el cual son eliminados los diferentes desechos generados en los procesos de recolección y procesamiento de muestras; y además se describe el
PAGINA: 1 de 7 1. DEFINICION: Es el procedimiento, mediante el cual son eliminados los diferentes desechos generados en los procesos de recolección y procesamiento de muestras; y además se describe el
TÍTULO: Determinación colorimétrica de fenoles en agua por el método de la 4- aminoantipirina
 Página 1 de 6 1.- INTRODUCCIÓN Desde el punto de vista analítico el término fenol engloba este producto y sus homólogos inmediatamente superiores. El fenol se emplea como patrón y el resultado obtenido
Página 1 de 6 1.- INTRODUCCIÓN Desde el punto de vista analítico el término fenol engloba este producto y sus homólogos inmediatamente superiores. El fenol se emplea como patrón y el resultado obtenido
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO
 PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
Ficha de Datos de Seguridad Conforme al Reglamento (CE) Nº 1907/2006 (REACH)
 Ficha de Datos de Seguridad Conforme al Reglamento (CE) Nº 1907/2006 (REACH) PROGESTERONA.FDS ACOFARMA 1.- Identificación de la sustancia o del preparado y de la sociedad o empresa Identificación de la
Ficha de Datos de Seguridad Conforme al Reglamento (CE) Nº 1907/2006 (REACH) PROGESTERONA.FDS ACOFARMA 1.- Identificación de la sustancia o del preparado y de la sociedad o empresa Identificación de la
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA QUIMICA PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA QUIMICA PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010 CARBOHIDRATOS ELABORADO POR: LICDA. LUCRECIA CASASOLA DE LEIVA
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA QUIMICA PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010 CARBOHIDRATOS ELABORADO POR: LICDA. LUCRECIA CASASOLA DE LEIVA
Calcitonin (Polyclonal)
 Identificación del Producto N.º de ref. Descripción 45170 IMPATH Calcitonin RTU R (Poly) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número distribuido
Identificación del Producto N.º de ref. Descripción 45170 IMPATH Calcitonin RTU R (Poly) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número distribuido
SSI DERMATOPHYTE PCR KIT PRUEBA PCR DERMATOFITO
 SSI DERMATOPHYTE PCR KIT PRUEBA PCR DERMATOFITO 2 Prueba de PCR para la detección de dermatofitos y Trichophyton rubrum Para uso diagnóstico in vitro Aplicación La prueba de PCR para dermatofitos en uñas
SSI DERMATOPHYTE PCR KIT PRUEBA PCR DERMATOFITO 2 Prueba de PCR para la detección de dermatofitos y Trichophyton rubrum Para uso diagnóstico in vitro Aplicación La prueba de PCR para dermatofitos en uñas
Cálculo del rendimiento de una reacción química
 COLEGIO INTERNACIONAL SEK-CATALUNYA Curso 2011/12 Práctica Química 1 4º ESO Cálculo del rendimiento de una reacción química Introducción Para interpretar una reacción de manera cuantitativa, es necesario
COLEGIO INTERNACIONAL SEK-CATALUNYA Curso 2011/12 Práctica Química 1 4º ESO Cálculo del rendimiento de una reacción química Introducción Para interpretar una reacción de manera cuantitativa, es necesario
PROSPECTO. Para uso diagnóstico in vitro. Para uso en la preparación y aislamiento de linfocitos purificados directamente de sangre entera.
 Para uso en la preparación y aislamiento de linfocitos purificados directamente de sangre entera. PROSPECTO Para uso diagnóstico in vitro PI-TT.610-ES-V5 Información e instrucciones Uso previsto El reactivo
Para uso en la preparación y aislamiento de linfocitos purificados directamente de sangre entera. PROSPECTO Para uso diagnóstico in vitro PI-TT.610-ES-V5 Información e instrucciones Uso previsto El reactivo
HOJA DE SEGURIDAD DE MATERIALES
 HOJA DE SEGURIDAD DE MATERIALES 1 0 0 SECCIÓN 1. PRODUCTO E IDENTIFICACIÓN DE LA COMPAÑÍA NOMBRE DEL PRODUCTO: silicona construcción, baños y cocinas, puertas y ventanas NOMBRE QUIMICO: Sellador de silicón
HOJA DE SEGURIDAD DE MATERIALES 1 0 0 SECCIÓN 1. PRODUCTO E IDENTIFICACIÓN DE LA COMPAÑÍA NOMBRE DEL PRODUCTO: silicona construcción, baños y cocinas, puertas y ventanas NOMBRE QUIMICO: Sellador de silicón
ESPECIFICACIÓN DE LOS ÍTEMES DE PRUEBA
 Técnicas de Panadería Alimentación Química ESPECIFICACIÓN DE LOS ÍTEMES DE PRUEBA Aprendizaje Esperado Establecer relaciones cuantitativas en diversas reacciones químicas 1. Juan, debe diseñar un programa
Técnicas de Panadería Alimentación Química ESPECIFICACIÓN DE LOS ÍTEMES DE PRUEBA Aprendizaje Esperado Establecer relaciones cuantitativas en diversas reacciones químicas 1. Juan, debe diseñar un programa
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 44521 CD7 0,1 M (MRQ-56) 44522 CD7 1 M (MRQ-56) 44250 CD7 RTU M (MRQ-56) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Identificación del Producto N.º de ref. Descripción 44521 CD7 0,1 M (MRQ-56) 44522 CD7 1 M (MRQ-56) 44250 CD7 RTU M (MRQ-56) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
NycoCard CRP Single Test
 NycoCard CRP Single Test ES DESCRIPCION DEL PRODUCTO Aplicaciones NycoCard CRP Single Test es un test de diagnóstico in vitro para medir de una forma rápida la proteína C reactiva (CRP) en la sangre humana.
NycoCard CRP Single Test ES DESCRIPCION DEL PRODUCTO Aplicaciones NycoCard CRP Single Test es un test de diagnóstico in vitro para medir de una forma rápida la proteína C reactiva (CRP) en la sangre humana.
1/5 SECCION 1. IDENTIFICACION DEL PRODUCTO QUIMICO DENOMINACION: VERDE DE MALAQUITA
 SECCION 1. IDENTIFICACION DEL PRODUCTO QUIMICO DENOMINACION: VERDE DE MALAQUITA SECCION 2. COMPOSICION E INFORMACION SOBRE LOS INGREDIENTES CAS #: 13425-25-7 FÓRMULA: C25H26N2O4 Nº CEE: 241-922-5 SECCION
SECCION 1. IDENTIFICACION DEL PRODUCTO QUIMICO DENOMINACION: VERDE DE MALAQUITA SECCION 2. COMPOSICION E INFORMACION SOBRE LOS INGREDIENTES CAS #: 13425-25-7 FÓRMULA: C25H26N2O4 Nº CEE: 241-922-5 SECCION
PHMETRO L Manual del usuario
 Fecha edición 09/2011 N Versión 01 PHMETRO L0015632 Manual del usuario PHMETRO TIPO LAPIZ Modelo 8685 Lea este manual completamente antes de usar este medidor. Clasifique y guarde el manual para futuras
Fecha edición 09/2011 N Versión 01 PHMETRO L0015632 Manual del usuario PHMETRO TIPO LAPIZ Modelo 8685 Lea este manual completamente antes de usar este medidor. Clasifique y guarde el manual para futuras
SEGÚN REGLAMENTO CE 453/2010. Oleína bidestilada
 Página: 1/6 1. Identificación del Producto y la Empresa 1.1. Identificación del Producto Nombre: Familia Química: Ésteres 1.2. Principales usos aconsejados y desaconsejados Usos: Aplicaciones en la industria
Página: 1/6 1. Identificación del Producto y la Empresa 1.1. Identificación del Producto Nombre: Familia Química: Ésteres 1.2. Principales usos aconsejados y desaconsejados Usos: Aplicaciones en la industria
3.- Higiene de manos y Antisepsia cutánea
 Higiene de manos La medida más sencilla y eficaz para reducir la infección asociada a la asistencia sanitaria Transmisión cruzada de microorganismos a través de las manos: Las manos de los profesionales
Higiene de manos La medida más sencilla y eficaz para reducir la infección asociada a la asistencia sanitaria Transmisión cruzada de microorganismos a través de las manos: Las manos de los profesionales
ACCUTREND GCT Manual formación. Ref:
 ACCUTREND GCT Manual formación Ref: 04898249001 Accutrend GCT Determinación inmediata de los principales factores de riesgo cardiovascular Gracias a la tecnología de la química seca es posible realizar
ACCUTREND GCT Manual formación Ref: 04898249001 Accutrend GCT Determinación inmediata de los principales factores de riesgo cardiovascular Gracias a la tecnología de la química seca es posible realizar
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 45616 Her2/Neu 0,1 R (EP3) 45617 Her2/Neu 1 R (EP3) 45636 Her2/Neu RTU R (EP3) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Identificación del Producto N.º de ref. Descripción 45616 Her2/Neu 0,1 R (EP3) 45617 Her2/Neu 1 R (EP3) 45636 Her2/Neu RTU R (EP3) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Collagen Type IV (CIV22)
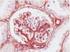 Identificación del Producto N.º de ref. Descripción 44543 Collagen Type IV 0,1 M (CIV22) 44544 Collagen Type IV 1 M (CIV22) 44261 Collagen Type IV RTU M (CIV22) Definiciones De Los Símbolos P C A E S DIL
Identificación del Producto N.º de ref. Descripción 44543 Collagen Type IV 0,1 M (CIV22) 44544 Collagen Type IV 1 M (CIV22) 44261 Collagen Type IV RTU M (CIV22) Definiciones De Los Símbolos P C A E S DIL
Hepatocyte Specific Antigen (Hep Par-1) (OCH1E5)
 Hepatocyte Specific Antigen (Hep Par-1) Identificación del Producto N.º de ref. Descripción 45147 IMPATH Hepatocyte Specific Antigen RTU M Definiciones De Los Símbolos P A E S DOC# DIS listo para usar
Hepatocyte Specific Antigen (Hep Par-1) Identificación del Producto N.º de ref. Descripción 45147 IMPATH Hepatocyte Specific Antigen RTU M Definiciones De Los Símbolos P A E S DOC# DIS listo para usar
Los productos prediluídos están diluido óptimamente para utilizarse con una amplia variedad de kits de detección que ofrecen otros fabricantes.
 Identificación del Producto N.º de ref. Descripción 45179 IMPATH CD3 (MRQ-39) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número distribuido por Uso
Identificación del Producto N.º de ref. Descripción 45179 IMPATH CD3 (MRQ-39) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número distribuido por Uso
NORMA MEXICANA NMX-F-492-SCFI-2009 ALIMENTOS ACEITES Y GRASAS VEGETALES DETERMINACIÓN DE CONTENIDO DE JABÓN- MÉTODO DE PRUEBA
 NORMA MEXICANA NMX-F-492-SCFI-2009 ALIMENTOS ACEITES Y GRASAS VEGETALES DETERMINACIÓN DE CONTENIDO DE JABÓN- MÉTODO DE PRUEBA FOODS VEGETABLE FATS AND OILS DETERMINATION OF SOAP CONTENT- TEST METHOD P
NORMA MEXICANA NMX-F-492-SCFI-2009 ALIMENTOS ACEITES Y GRASAS VEGETALES DETERMINACIÓN DE CONTENIDO DE JABÓN- MÉTODO DE PRUEBA FOODS VEGETABLE FATS AND OILS DETERMINATION OF SOAP CONTENT- TEST METHOD P
Manual de laboratorio
 UNIVERSIDAD NACIONAL DE INGENIERIA UNI-Norte Sede regional en Estelí Manual de laboratorio 2008 Química de Alimentos Objetivos Generales 1. Proporcionar a los estudiantes de Ingeniería Agroindustrial las
UNIVERSIDAD NACIONAL DE INGENIERIA UNI-Norte Sede regional en Estelí Manual de laboratorio 2008 Química de Alimentos Objetivos Generales 1. Proporcionar a los estudiantes de Ingeniería Agroindustrial las
PROCEDIMIENTOS DE GESTIÓN. Productos Químicos
 OBJETO: Establecer las pautas de adquisición, inventariado, almacenamiento y manipulación de los productos químicos puestos a disposición de los trabajadores. ALCANCE: Los productos químicos (sustancias,
OBJETO: Establecer las pautas de adquisición, inventariado, almacenamiento y manipulación de los productos químicos puestos a disposición de los trabajadores. ALCANCE: Los productos químicos (sustancias,
Ficha de Datos de Seguridad según la Directiva 91/155/CEE - ISO
 Ficha de Datos de Seguridad según la Directiva 91/155/CEE - ISO 11014-1 página 1 de 5 TEROSTAT-MS 939 WEISS 310ML EPI Nº SDB : 75818 V001.0 Revisión: 15.09.2005 Fecha de impresión: 28.11.2005 1. Identificación
Ficha de Datos de Seguridad según la Directiva 91/155/CEE - ISO 11014-1 página 1 de 5 TEROSTAT-MS 939 WEISS 310ML EPI Nº SDB : 75818 V001.0 Revisión: 15.09.2005 Fecha de impresión: 28.11.2005 1. Identificación
HOJA DE DATOS SOBRE SEGURIDAD DE MATERIALES
 WESTRADE GUATEMALA S.A. Aldea La Verde, Tecún Umán, San Marcos, Guatemala, Centro América PBX: (502) 2420-5400 FAX: (502) 2420-5450 HOJA DE DATOS SOBRE SEGURIDAD DE MATERIALES SECCION 1. IDENTIFICACION
WESTRADE GUATEMALA S.A. Aldea La Verde, Tecún Umán, San Marcos, Guatemala, Centro América PBX: (502) 2420-5400 FAX: (502) 2420-5450 HOJA DE DATOS SOBRE SEGURIDAD DE MATERIALES SECCION 1. IDENTIFICACION
RECOMENDACIONES PARA HER 2 IHQ EN CANCER DE MAMA. Dra. Valeria Cornejo C. Hospital Clínico San Borja Arriarán
 RECOMENDACIONES PARA HER 2 IHQ EN CANCER DE MAMA Dra. Valeria Cornejo C. Hospital Clínico San Borja Arriarán Introducción Realización de grandes estudios que evalúan efectividad de las nuevas drogas target
RECOMENDACIONES PARA HER 2 IHQ EN CANCER DE MAMA Dra. Valeria Cornejo C. Hospital Clínico San Borja Arriarán Introducción Realización de grandes estudios que evalúan efectividad de las nuevas drogas target
La preparación de su hogar
 INTRODUCCIÓN Cómo guardar y manipular sus suministros Cuando se autoadministra una infusión IV de medicamentos, las infecciones son una preocupación importante. Los gérmenes están en todos lados, tanto
INTRODUCCIÓN Cómo guardar y manipular sus suministros Cuando se autoadministra una infusión IV de medicamentos, las infecciones son una preocupación importante. Los gérmenes están en todos lados, tanto
Kit TOP2A FISH pharmdx Nº de catálogo K5333
 101752-001 / 20-01-03 Kit TOP2A FISH pharmdx Nº de catálogo K5333 3ª edición Para uso en diagnóstico in vitro El kit contiene reactivos suficientes para realizar 20 pruebas. (115086-002) K5333/ES/KVN/24.05.07
101752-001 / 20-01-03 Kit TOP2A FISH pharmdx Nº de catálogo K5333 3ª edición Para uso en diagnóstico in vitro El kit contiene reactivos suficientes para realizar 20 pruebas. (115086-002) K5333/ES/KVN/24.05.07
3. MATERIALES Y MÉTODOS
 3. MATERIALES Y MÉTODOS El proceso general llevado a cabo en la presente tesis se ilustra en el siguiente esquema: Exudado uretral/ cervical y/o biopsias Extracción del ADN PCR Digestión Algoritmo computacional:
3. MATERIALES Y MÉTODOS El proceso general llevado a cabo en la presente tesis se ilustra en el siguiente esquema: Exudado uretral/ cervical y/o biopsias Extracción del ADN PCR Digestión Algoritmo computacional:
MANUAL CORTINAS DE AIRE SERIE CAR/CAF
 1 ESTAS INSTRUCCIONES DEBEN DE LEERSE ATENTAMENTE Y CONSERVARSE PARA FUTURAS CONSULTAS Al recibir el aparato verificar su estado, controlando que no haya sufrido daños durante el transporte. No instalar
1 ESTAS INSTRUCCIONES DEBEN DE LEERSE ATENTAMENTE Y CONSERVARSE PARA FUTURAS CONSULTAS Al recibir el aparato verificar su estado, controlando que no haya sufrido daños durante el transporte. No instalar
PLIEGOS DE PRESCRIPCIONES TÉCNICAS PARA LA ADQUISICIÓN DE REACTIVOS PARA TECNICAS DE FARMACODIAGNOSTICO EXPEDIENTE Nº 2010-0-22
 PLIEGOS DE PRESCRIPCIONES TÉCNICAS PARA LA ADQUISICIÓN DE REACTIVOS PARA TECNICAS DE FARMACODIAGNOSTICO EXPEDIENTE Nº 2010-0-22 1.- CONFIGURACIÓN DE LAS OFERTAS TÉCNICAS. 1.1. El presente pliego tiene
PLIEGOS DE PRESCRIPCIONES TÉCNICAS PARA LA ADQUISICIÓN DE REACTIVOS PARA TECNICAS DE FARMACODIAGNOSTICO EXPEDIENTE Nº 2010-0-22 1.- CONFIGURACIÓN DE LAS OFERTAS TÉCNICAS. 1.1. El presente pliego tiene
PRÁCTICA 1 HERRAMIENTAS Y OPERACIONES BÁSICAS EN EL LABORATORIO BIOANALÍTICO
 PRÁCTICA 1 HERRAMIENTAS Y OPERACIONES BÁSICAS EN EL LABORATORIO BIOANALÍTICO INTRODUCCIÓN Todos los instrumentos de medida que se utilizan en el laboratorio tienen algún tipo de escala para medir una magnitud,
PRÁCTICA 1 HERRAMIENTAS Y OPERACIONES BÁSICAS EN EL LABORATORIO BIOANALÍTICO INTRODUCCIÓN Todos los instrumentos de medida que se utilizan en el laboratorio tienen algún tipo de escala para medir una magnitud,
ANALISIS DE ph. MEDIDOR DE ph
 ANALISIS DE ph El medidor de ph digital Barnant está diseñado con elementos electrónicos del estado sólido, y la pantalla LCD permite una fácil lectura, aún bajo condiciones ambientales de luz brillante.
ANALISIS DE ph El medidor de ph digital Barnant está diseñado con elementos electrónicos del estado sólido, y la pantalla LCD permite una fácil lectura, aún bajo condiciones ambientales de luz brillante.
Kit artus EBV QS-RGQ. Características de rendimiento. Mayo Sample & Assay Technologies. Sensibilidad analítica (plasma)
 Kit artus EBV QS-RGQ Características de rendimiento Kit artus EBV QS-RGQ, versión 1, 4501363 Compruebe la disponibilidad de nuevas revisiones electrónicas de las especificaciones en www.qiagen.com/products/artusebvpcrkitce.aspx
Kit artus EBV QS-RGQ Características de rendimiento Kit artus EBV QS-RGQ, versión 1, 4501363 Compruebe la disponibilidad de nuevas revisiones electrónicas de las especificaciones en www.qiagen.com/products/artusebvpcrkitce.aspx
AcuaNatura ÍNDICE TÉCNICAS DE TINCIÓN
 TÉCNICAS DE TINCIÓN ÍNDICE 1. Introducción 3 2. Tipos de tinciones 4 2.1. Tinción de Gram 4 2.2. Tinción ácido alcohol resistencia 5 2.3. Tinción de esporas 5 2.4. Tinción negativa 6 3. Precauciones 7
TÉCNICAS DE TINCIÓN ÍNDICE 1. Introducción 3 2. Tipos de tinciones 4 2.1. Tinción de Gram 4 2.2. Tinción ácido alcohol resistencia 5 2.3. Tinción de esporas 5 2.4. Tinción negativa 6 3. Precauciones 7
