TRABAJO PRÁCTICO N 3: IDENTIFICACIÓN MICROBIANA
|
|
|
- Luis San Martín Jiménez
- hace 6 años
- Vistas:
Transcripción
1 TRABAJO PRÁCTICO N 3: IDENTIFICACIÓN MICROBIANA PARTE A: IDENTIFICACIÓN FENOTÍPICA OBJETIVOS: - Caracterizar el desarrollo macroscópico de los microorganismos en medios de cultivo líquidos y sólidos. - Adquirir entrenamiento en la realización de exámenes en fresco y coloración de Gram para la observación microscópica de los microorganismos. INTRODUCCION TEÓRICA Qué debe observarse en los cultivos de microorganismos? 1. En medios de cultivo líquidos: crecimiento en superficie, turbidez, sedimento Crecimiento en superficie: floculento: contiene masas de formas diversas que flotan en el medio líquido. en anillo: desarrollo adherido al vidrio en el borde de la superficie del líquido de cultivo. película: desarrollo de una capa delgada uniforme. Turbidez: : ligera, regular, intensa, transitoria, persistente, nula. Sedimento: -caracterísiticas: compacto, granular, grumoso, escamoso, viscoso. -cantidad de sedimento: abundante, escaso, nulo. 2. En medios de cultivo semisólidos: desarrollo, movilidad 3. En medios de cultivo sólidos: en agar nutritivo inclinado: desarrollo abundante, moderado o escaso en placa de Petri: desarrollo con o sin aislamiento. En este caso se pueden observar colonias.
2 Toda especie bacteriana en medio de cultivo sólido forma un tipo característico de agrupación llamada colonia. Una colonia es la progenie de una sola célula al proliferar en un medio de cultivo sólido. Importante: No se forman colonias en medios de cultivo liquidos! Las colonias se diferencian por su tamaño, forma, altura o elevación, color y grado de adherencia al medio (consistencia). Forma: puntiforme: muy pequeñas (diámetro menor de 1 mm), circular (diámetro mayor de 1 mm),ramificada en forma de raíces, en forma de huso Elevación, altura o perfil: plana, convexa, pulvinada, pitting Margen, contorno o borde: entero, ondulado, borde sinuoso, lobulado, mellado, filamentosa: forma de largos hilos, festoneado Olor: ausente, pronunciado, parecido a.. Brillo: vivo, opaco, metálico Características ópticas: opaca,traslucida, Consistencia: butírica, viscosa, membranosa opalesce,coloreado quebradiza En agar sangre podemos observar tres tipos de hemolisis:.alfa hemolisis: es una hemolisis parcial, evidenciada por un halo de color verde alrededor de la colonia Beta hemolisis: es una hemolisis total, se observa un halo transparente alrededor de la colonia Gama hemolisis: cuando no se obsreva hemolisis en el cultivo,ej: enterococcus faecalis 2
3 Morfologías de las colonias ACTIVIDADES A REALIZAR Observar los cultivos e informar los resultados obtenidos en: - caldo nutritivo: membrana superficial, turbidez, sedimento? - agar SIM: hay movilidad? - agar nutritivo en pico de flauta: desarrollo abundante o escaso? Examinar el desarrollo en placa de Petri de diferentes muestras. - Informar si se trata de cultivos axénicos o mixtos - Tipos coloniales que se observan: en cada placa determinar número de colonias diferentes y caracterizarlas por sus propiedades macroscópicas. 3
4 1.-PRUEBAS BIOQUÍMICAS Todas las actividades de la célula bacteriana se realizan a través de enzimas. Realizando una serie de pruebas, denominadas pruebas bioquímicas, podemos establecer un patrón de actividad, el cual nos refleja la composición enzimática del microorganismo, y además nos puede ayudar en la identificación y diferenciación de un microorganismo dado entre otras especies estrechamente relacionadas. IMViC: conjunto de pruebas bioquímicas que comprende: I = Prueba del Indol M = Prueba de Rojo de Metilo V = Prueba de Voges-Proskauer C = Prueba de utilización de Citrato Las formulas de los medios utilizados en estas pruebas los pueden ver en el anexo Prueba del Indol Fundamento e interpretación: dentro de los aminoácidos que aportan las peptonas se encuentras el triptófano, el cual puede ser hidrolizado por ciertas especies de microorganismos liberándose entre los productos finales de esta reacción el indol, el cual se puede poner de manifiesto con cualquiera de los reactivos mencionados anteriormente. En caso positivo se observa un anillo de color rojo. En caso de emplear el reactivo de Ehrlich, previamente agregar al cultivo, un volumen igual de éter para extraer el indol. 4
5 Prueba de Voges-Proskauer (VP) y Rojo de Metilo (RM) Para la realización de estas pruebas se utiliza el medio de Clark y Lubs, que es una solución de peptona glucosada a) VP: a una alícuota de cultivo adicionar 0,1 a 0,2 ml de KOH al 40 %, agitar y añadir 0,2 ml de solución de alfa naftol. Una reacción positiva se manifiesta por el desarrollo de color violeta-rojizo. Esta reacción depende de la producción a partir de glucosa de acetil-carbinol (acetoína), que es un precursor de 2,2-butilenglicol. En presencia de oxígeno atmosférico y álcali, la acetoína es oxidada en diacetilo, y este reacciona con el reactivo colorante alfa naftol para dar el color violeta-rojizo de la reacción. b) RM: a la otra porción de cultivo agregarle 2-3 gotas de la solución de rojo de metilo. La aparición de color rojo indica reacción positiva, mientras que color amarillo indica reacción negativa. La finalidad es comprobar la capacidad de un organismo de producir y mantener estables los productos terminales ácidos de la fermentación de la glucosa, y vencer la capacidad amortiguadora del sistema. El rojo de metilo es un indicador de ph que vira al rojo cuando el ph del medio es igual a 4,2 o menor. Prueba de utilización del citrato Colocar en tubos de hemólisis 3 ml por tubo. Esterilizar. Inclinar. Inocular con ansa en estrías. Incubar 18 a 24 h a 37 C. El medio es de color verde, si el microorganismo usa el citrato como única fuente de carbono, el medio vira al azul por liberación de NaOH. 5
6 2.- COLORACIONES En la identificación de una especie microbiana se emplean, en primer lugar o en forma simultánea: la coloración de Gram que permite conocer formas y disposición celular y presencia de estructuras tales como esporas. OBJETIVOS Conocer y llevar a cabo correctamente los pasos de cada técnica de coloración, desde la preparación del frotis hasta el agregado de los colorantes. Manipular adecuadamente el microscopio óptico, diferenciando sus distintas partes y enfocando correctamente los preparados a visualizar. Diferenciar bacilos ácido alcohol resistentes (BAAR) de bacterias no BAAR, en la coloración de Ziehl Neelsen. Distinguir esporas, cápsulas y flagelos, describiendo el campo visual observado al microscopio. INTRODUCCIÓN La observación de los microorganismos se puede realizar: Teñidos con colorantes Vivos sin teñir o en fresco: se evalúa movilidad Los microorganismos son químicamente muy diferentes del medio que los rodea. Esta diferencia es la que permite distinguir las bacterias por tinción pues generalmente el colorante reacciona con la célula bacteriana pero no con el medio externo. Algunas de las ventajas que presenta la observación de los microorganismos coloreados son: Proporciona el contraste suficiente entre el microorganismo y el medio que los rodea, permitiendo diferenciar varios tipos morfológicos. Permite el estudio de estructuras de la célula bacteriana. Se puede obtener mayores amplificaciones con el empleo del objetivo de inmersión del microscopio. Qué es un colorante? Los colorantes son, generalmente, sales en las que uno de sus iones tiene color. Una sal es un compuesto formado por un ión cargado positivamente y un ión cargado negativamente. Ej. la sal cloruro de metileno, donde el color del colorante reside en el ión azul de metileno (AM), cargado positivamente. 6
7 ClAM CL - + AM + Los colorantes se pueden dividir en 2 grupos: básicos y ácidos. Si el colorante reside en el ión positivo, se dice que es un colorante básico. Si el color reside en el ión cargado negativamente, se dice que es un colorante ácido. PASOS A SEGUIR PARA REALIZAR UNA COLORACIÓN 1.- PREPARACIÓN DEL MATERIAL que se va a colorear se puede llevar a cabo realizando: frotis, extendido o impronta. - Frotis: se realiza colocando una ansada de cultivo líquido en le centro de un portaobjeto bien limpio; si el examen se debe efectuar desde un cultivo sólido, colocar previamente sobre el portaobjeto una gota de solución fisiológica y sobre ella emulsionar perfectamente el inóculo, de manera de lograr una película delgada y uniforme. - Extendido: se realiza en una técnica para colorear la cápsula en microorganismos que la poseen. Coloca en un extremo del portaobjetos una gota de tinta china* y se emulsiona sobre dicha gota la suspensión de gérmenes. Con el pulgar y el índice de la mano izquierda se sujeta el portaobjetos desde un extremo y con el pulgar y el índice de la mano derecha se sujeta por el extremo un segundo portaobjetos contra la superficie del primero, con un ángulo de La gota quedará en el ángulo de los 2 portaobjetos. Se empuja lentamente el portaextensor en la dirección opuesta a lo largo del otro, de manera que la gota fluya por detrás del borde del primero. Un buen extendido tiene una parte gruesa y una más delgada, con una transición gradual entre ambas. El aspecto debe ser liso y nivelado. *Una vez realizado el extendido se deja secar, se fija y se le coloca un contracolorante (cristal violeta). La bacteria se observa violeta, la cápsula clara y el medio circundante oscuro. El extendido se puede realzar también en materiales con gran cantidad de células. - Impronta: con un hisopo se presiona la zona que se desea estudiar (por ej. boca, encías, garganta, etc.) y luego se presiona suavemente sobre el portaobjetos. Este método se emplea para diferenciar distintas agrupaciones celulares (por ej. estreptococos de estafilococos) o agrupaciones en empalizada del bacilo de la difteria. 2.- SECADO: cualquiera sea el método seguido en la preparación, el segundo paso a seguir es el secado. Este se puede realizar secando el preparado al aire, a temperatura ambiente, o bien manteniéndolo encima de la llama del mechero. 3.- FIJACIÓN: el calor es el agente fijador mas comúnmente empleado, también se pueden emplear algunos agentes como el alcohol y varios compuestos químicos. Para fija el preparado utilizando el calor, se lo toma desde un extremo, y se lo pasa tres veces rápidamente por la llama del mechero. Dejarlo enfriar antes de proceder a la fijación. La capa de células debe estar siempre hacia arriba cuando se fija el preparado. El propósito de la fijación es matar a los microorganismos, coagular el 7
8 protoplasma de la célula y adherirla al portaobjetos, si no se fijase la capa de células se lavaría durante el proceso de tinción. Nota: los portaobjetos utilizados para coloraciones deben estar perfectamente limpios y desengrasados, para eso se los mantiene en alcohol de 95 hasta el momento de su uso. Deben ser en lo posible nuevos y no presentar rayaduras que puedan confundir la observación. Preparación del frotis para colorear 8
9 MECANISMO DE COLORACIÓN Coloración directa: La mayor parte de las proteínas bacterianas tienen un punto isoeléctrico entre ph 2 y ph 5, esto nos indica que, la célula bacteriana tiene una carga negativa neta cuando el ph del medio está cercano a la neutralidad (ph 7), que es lo que generalmente ocurre. La bacteria cargada negativamente se combina con el ión cargado positivamente (por ej. El ión azul de metileno) con lo cual se tiñe la bacteria. Las diferencias en la carga da lugar a una afinidad entre el colorante básico y la célula bacteriana. Los colorantes básicos más comúnmente empleados son: fucsina, azul de metileno, cristal violeta y fucsina fenicada. Estos se diferencian en la proporción y rapidez en que tiñen a la célula bacteriana. Coloración indirecta: La eosina es un ejemplo de colorante ácido y se emplea como sal soluble eosinato sódico que se ioniza en eosinato - + Na +. Como la capacidad colorante reside en el ión cargado negativamente, este no tendrá afinidad por la célula bacteriana cargada también negativamente. En lugar de ello, el colorante se deposita alrededor de la célula, quedando ésta incolora y el medio que la rodea coloreado. Otros preparados para la observación de microorganismos: MOVILIDAD 1. Colocar en el centro de un portaobjeto limpio una ansada de cultivo joven (18 a 24 h) en caldo nutritivo. 2. Cubrir la gota con un cubre objetos evitando formar burbujas de aire. 3. Colocar la preparación sobre la platina del microscopio, enfocar con objetivo de 40x 4. Observar si las bacterias presentan verdadero movimiento, diferenciándolo del browniano por el agregado de una gotita de formol por capilaridad. COLORACIÓN VITAL 1. Colocar sobre un portaobjetos una gota de solución acuosa de cristal violeta 1/ Con un ansa tomar una pequeña cantidad de cultivo y emulsionarlo perfectamente con la gota del colorante. 3. Cubrir suavemente la gota con un cubreobjetos, evitando la formación de burbujas de aire. 4. Examinar con el objetivo de inmersión. Las bacterias aparecen coloreadas sobre un fondo claro. COLORACIÓN SIMPLE O DIRECTA 1. Hacer el frotis. Secar. Fijar a la llama. 2. Cubrir el preparado con una solución diluida de fucsina 1/10 durante 1 min. 3. Lavar con agua corriente. Secar. Observar por inmersión. 9
10 COLORACIONES DIFERENCIALES De acuerdo a la composición de la pared celular de las bacterias, la coloración de Gram permite agruparlas en dos grandes grupos Gram positivas y Gram negativas. Además existen coloraciones especiales para poner en evidencia: la pared celular compleja de los bacilos ácido-alcohol resistentes (BAAR) estructuras facultativas especiales que presentan algunos géneros bacterianos: capsula y flagelos estructuras de resistencia que forman algunos géneros bacterianos: esporas Estudiar cada una de estas estructuras de la teoría y explicación de trabajos prácticos correspondiente. Los microorganismos difieren químicamente y físicamente entre sí y por eso reaccionan de una manera distinta frente a un determinado proceso de tinción. Este es el fundamento de las coloraciones diferenciales. Así se puede definir la tinción diferencial como un método para distinguir tipos de bacterias. Ejemplos: coloración de Gram y de Ziehl-Neelsen. Las formulas de los reactivos utilizados en estas coloraciones los pueden ver en el anexo Las 4 soluciones empleadas son: COLORACIÓN DE GRAM. a) Colorante básico: cristal violeta: el color reside en el ión cargado positivamente. b) Mordiente: lugol: es una sustancia que aumenta la afinidad o atracción entre la célula y el colorante, ayudando a que se fije el colorante a la célula. c) Agente decolorante: alcohol o alcohol-acetona. Sustancia que retira el colorante de la célula teñida. d) Contraste: fucsina 1/10: es un colorante de color distinto al colorante utilizado en primer lugar. La misión del contraste es dar a las células decolaradas un color diferente al de las células que no se han decolorado. Técnica 1. Hacer el frotis. Secar a la llama. Fijarlo. 2. Cubrir la preparación con cristal violeta y dejar actuar 2 minutos. 3. Escurrir el colorante y tratar con lugol dos veces consecutivas durante 30 seg o una vez durante un min. Volcar. 4. Decolorar con alcohol o alcohol-acetona. 5. Lavar con agua corriente y efectuar la coloración de fondo con la fucsina 1/10. dejar actuar 1 min. 10
11 6. Lavar. Secar. Observar por inmersión. 7. Las bacterias Gram positivas se observan violetas y las Gran negativas rojas. COLORACION DE ZIEHL NEELSEN Para bacilos ácido-alcohol resistentes: BAAR Reactivos: Alcohol-ácido: Fucsina de Ziehl (ver coloración de Gram),Usar sin diluir. Técnica: Hacer el frotis, secarlo y fijarlo a la llama. Cubrir la preparación con fucsina fenicada y calentar, para lo cual se pasa un hisopo encendido debajo del portaobjetos manteniendo la emisión de vapores durante 10 minutos, sin ebullición y agregando reactivo si se evapora. Decolorar con alcohol-ácido unos min. Repetir hasta obtener frotis libre de fucsina, aproximadamente por 2 minutos. Lavar con abundante agua y cubrir con azul de metileno diluido durante 5 minutos. Lavar. Secar. Observar por inmersión. Los gérmenes ácido-alcohol resistentes se ven rojos, y las demás bacterias, células epiteliales y otras estructuras se ven azules. 11
12 METODO DE MOELLER Para coloración de esporas Reactivos: Acido crómico: solución acuosa al 5%. Acido sulfúrico: solución acuosa al 5%. Fucsina de Ziehl: concentrada Azul de metileno: el mismo utilizado en Ziehl Neelsen. Técnica: Hacer el frotis. Secarlo. Fijar con alcohol absoluto, escurrir el alcohol y arder el resto.dejar enfriar. Lavar. Tratar con ácido crómico 5 minutos. Lavar. Cubrir con fucsina fenicada de Ziehl y calentar con hisopo encendido manteniendo la emisión de vapores 10 minutos. Dejar enfriar. Decolorar con ácido sulfúrico al 5% durante 1 ó 2 minutos. Descartar reactivo. Repetir. Completar la decoloración con alcohol durante 1 ó 2 minutos. Lavar y efectuar coloración de fondo con azul de metileno diluido durante 1 min. Lavar, secar. Observar con mayor aumento usando aceite de inmersión. Las esporas se ven rojas, y las bacterias y otras estructuras se ven azules. METODO DE WIRTZ CONKLIN Para coloración de esporas Reactivos: Verde de malaquita: solución acuosa al 5% Fucsina de Ziehl: diluida 1:10 (la misma de Gram) Técnica: Hacer el frotis. Secarlo. Cubrir con solución acuosa al 5% de verde malaquita y calentar con hisopo encendido manteniendo la emisión de vapores durante 10 minutos. Dejar enfriar. Lavar exhaustivamente para eliminar el colorante en exceso y efectuar coloración de fondo con fucsina 1:10 durante 1 min. Lavar, secar. Observar con mayor aumento usando aceite de inmersión. Las esporas se ven verdes, y las bacterias y otras estructuras se ven rojas. TECNICA DE BURRI Para observación de cápsula Técnica: Colocar en el extremo de un portaobjetos una gota de tinta china comercial. Emulsionar sobre esa gota una suspensión de gérmenes capsulados. Con otro portaobjetos, efectuar un extendido fino. Secar y fijar a la llama cuidadosamente. Cubrir con solución de cristal violeta durante 2 min. 12
13 Lavar cuidadosamente con agua corriente. Secar y observar. Las cápsulas se verán refringentes sobre el fondo oscuro y el cuerpo bacteriano se tiñe de violeta. Reactivos: Líquido de Rouge Mordiente Acido tánico Solución de Fontana IMPREGNACION ARGENTICA DE FONTANA TRIBONDEAU Para espiroquetas y espirilos En el momento de usar, colocar en un tubo de ensayo la solución A y agregar gota a gota la solución B hasta opalescencia debida al óxido de plata. Técnica: cubrir con líquido de Rouge el frotis, previamente seco pero sin fijar a la llama. Lavar. Fijar colocando alcohol etílico, dejar escurrir, arder el resto. Cubrir con el mordiente y calentar hasta emisión de vapores durante 30 seg. Lavar con abundante agua y luego volver a lavar con agua destilada (para evitar la precipitación de AgCl). Impregnar con solución de Fontana en frío, hasta que tome color castaño oscuro. Se remueve el líquido y se calienta hasta emisión de vapores, volcar a los 30 seg. Se colorea la preparación de castaño con reflejos metálicos. Lavar con agua destilada. Secar. Observar. Las espiroquetas y espirilos se ven de color marrón oscuro, sobre fondo pardo claro. COLORACION ARGENTICA DE FLAGELOS Reactivos: Solución I: mordiente Solución acuosa saturada de Acido tánico al 10% Solución de FeCl3 al 5% (p/v) 5 ml Mezclar y conservar en frasco oscuro a temperatura ambiente. La solución es estable durante varios meses. Solución II: colorante argéntico Preparar 100 ml de solución de nitrato de plata al 5% (p/v). Adicionar hidróxido de amonioi concentrado (2-5 ml) gota a gota a 80 ml de solución de nitrato de plata al 5% hasta que el precipitado marrón formado se redisuelva. Adicionar algo del remanente de la solución de nitrato de plata al 5%, gota a gota a la solución, hasta ligera opalescencia persistente. 13
14 Conservar la solución en frasco oscuro a temperatura ambiente. La solución es estable durante varios meses. Técnica: Limpiar los portaobjetos con alcohol-acetona, rotularlos y flamearlos en la parte azul de la llama para eliminar los residuos. Utilizar un cultivo joven (si es caldo: cuando presente turbidez aparente, si es de agar inclinado, un desarrollo de h). Los cultivos obtenidos a 25 C generalmente producen los mejores resultados. Tratar el cultivo con 1 ml de formalina al 1% en solución fisiológica durante una noche (12 h). Si se utiliza un cultivo inclinado, tratar cuidadosamente las células con la solución de formalina y dejar reposar toda la noche. Conservar en heladera hasta el momento de ser utilizada. Centrifugar cuidadosamente (1000 x g durante 15 min) para obtener el pellet, lavar con buffer isotónico, volver a centrifugar y resuspender en buffer. Colocar una ansada abundante o dejar deslizar una gota con pipeta Pasteur hasta el otro extremo del portaobjetos. Secar al aire. No fijar por calor. Cubrir el portaobjetos con la solución I durante 4 min. Lavar con agua destilada. Cubrir el portaobjetos con la solución II y calentar con hisopo hasta emisión de vapores. Dejar 4 min para que se coloree. Lavar con agua destilada e inclinar para secar al aire. Observar con objetivo de inmersión. Los flagelos ven de color marrón claro, sobre fondo marron oscuro (celula vegetativa bacteriana). MATERIALES Y MÉTODOS Cepas a utilizar desde cultivos frescos: Klebsiella pneumoniae (para técnica de Burri) Bacillus subtilis (tinción de Moeller y Wirtz Conklin) Frotis de Mycobacterium smegmatis (para colorear por Ziehl Neelsen) Frotis de Clostridium chauvoei teñidos por impregnación argéntica Portaobjetos y cubreobjetos Goteros con solución fisiológica. Microscopios ópticos provistos con objetivos de 4, 10, 40 y 100x. Aceite de inmersión. Reactivos de coloración para Ziehl Neelsen (para bacterias ácido alcohol resistentes BAAR): ACTIVIDADES A REALIZAR Cada equipo de alumnos: - realizará coloración de Gram a partir de los cultivos sembrados en el práctico anterior - observará frotis con coloración de Ziehl Neelsen. Identificará BAAR, células y estructuras no BAAR - observará frotis de K. Pneumoniae según el procedimiento detallado en tinción negativa de Burri y observará la cápsula bacteriana 14
15 - observará el aspecto característico de las esporas y de las formas vegetativas de bacterias en frotis teñidos - observará el resultado de la coloración argéntica aplicada a células de C. Chauvoei, un anaerobio flagelado - realizará dibujos y anotará en el informe todo lo observado Bibliografía: Madigan, M.T; Martinko, J.M; Stahl, D. A; Clark, D. P. Brock. Biology of microorganisms. 13th ed. Ed Pearson Educación, NSA Madigan, M.T; Martinko, J.M; Dunlap, P.V; Clark, D. P. Brock. Biología de los Microorganismos. 12ª ed. Ed Pearson Educación, NSA Tortora, G, J., Funke, B.R., Case, C. L. Introducción a la Microbiología. 9ª ed. Editorial Médica Panamericana, Buenos Aires, MANEJO DEL MANUAL BERGEY El primer Manual Bergey de Bacteriología Determinativa fue publicado en 1923, bajo el auspicio de la Sociedad Americana de Bacteriólogos, siendo su presidente David Bergey. Actualmente la sociedad encargada de la publicación del manual, es una organización sin fines de lucro, siendo los ingresos que percibe usados solamente con el propósito de preparar, editar y publicar sucesivas ediciones del manual y publicaciones suplementarias. El último manual publicado en el 2000, corresponde a la 2 edición y consta de 5 volúmenes, a diferencia de los anteriores que presentaban un solo. A grandes rasgos los 5 subvolúmenes se dividen en: 1. Archaea, Cyanobacteria, Fotótrofos y Géneros ramificados. 2. Proteobacteria. 3. Bajo contenido en G+C. Gram positivas. 4. Alto contenido en G+C. Gram positivas. 5. Plantomicetes, Espiroquetales, Fibrobacter, Bacteroides y Fusobacteria. El objetivo del Manual dividido en subvolúmenes es que cada parte puede ser actualizada y publicada mucho más rápidamente que si se tratase del manual completo. Permite además, que el microbiólogo acceda al subvolumen de su interés exclusivamente. La última edición amplía el objetivo original e incluye más información de importancia para la bacteriología sistemática, ya que trata la ecología, enriquecimiento, aislamiento y descripción de especies y sus características determinantes, mantenimiento y preservación. Uso del Manual El principal objetivo del manual es asistir a la identificación de las bacterias, pero además el otro objetivo es indicar las relaciones que existen entre las distintas clases de bacterias. Los métodos 15
16 de biología molecular hacen posible intentar una clasificación de las bacterias basadas en sus relaciones mutuas. PARTE B: IDENTIFICACIÓN GENOTIPICA La biología molecular es una disciplina relativamente joven, originada en los años 30s y los 40s, e institucionalizada en los años 50s y los 60s. El período clásico de ésta comenzó en 1953 con el descubrimiento de la doble hélice del ADN por James Watson y Francis Crick. La relación científica de Watson y Crick unificó varios acercamientos disciplinarios: Watson, estudiante de Luria y el grupo fago, reconocieron la necesidad de utilizar la cristalografía para aclarar la estructura del ADN, por lo que hicieron un uso amplio de datos a partir del trabajo de cristalografía con rayos X en ADN realizado por Maurice Wilkins y Rosalind Franklin en el King s College, de Londres (Darden y Tabery, 2005). Con la estructura del ADN a disposición, la biología molecular cambió su enfoque por lo que la estructura de la doble hélice ayudó a la elucidación de los mecanismos de replicación y función genética, las claves para entender el papel de los genes en la herencia. Esta investigación subsecuente fue guiada por la noción de que el gen era una molécula informativa. La secuencia linear de las bases de los ácidos nucleicos a lo largo de una hebra de ADN proporcionó la información codificada para dirigir el orden linear de aminoácidos en las proteínas (Darden y Tabery, 2005). Técnicas moleculares Las técnicas moleculares actuales han sido desarrolladas, en solo pocos años de investigación académica básica en muchos campos de la ciencia, de tal manera que en los últimos años, éstas técnicas han surgido como los métodos para el análisis y tipificación de los aislamientos bacterianos. Ellas son la huella dactilar de plásmidos o PF, el análisis de endonucleasas de restricción de ADN de plásmidos o REA; el análisis de endonucleasas de restricción de ADN cromosómico utilizando enzimas de corte y electroforesis convencional; el Polimorfismo de largos fragmentos de restricción o RFLP utilizando análisis de pruebas de ADN; La electroforesis en gel de campos pulsantes o PFGE; y el AP-PCR y otras técnicas relacionadas con la tipificación basada en la amplificación de ácidos nucleicos (Tenover et al., 1997). La caracterización molecular de microorganismos en un ambiente natural puede realizarse mediante la detección de genes específicos que permitan su identificación y tipificación. La principal ventaja de estas técnicas es la de no requerir el aislamiento de los microorganismos ni su identificación por microscopía con tinciones específicas. Las técnicas moleculares permiten evaluar la biodiversidad de un hábitat amplificando genes específicos. Algunos métodos de clasificación incluyen las especies genómicas, un grupo de microorganismos con altos valores de homología ADN-ADN, y las genoespecies, un grupo de organismos capaces de cambios genéticos. 16
17 Actualmente es aceptado por los taxonomistas microbianos que la hibridización de ácidos nucleicos y los estudios de secuenciación proveen los mejores y más racionales métodos disponibles para designar especies y determinar la relación entre microorganismos diferentes. Wayne y col. (1987), definen molecularmente especie indicando que una especie podría generalmente incluir cepas con 70% o más de homología ADN-ADN y con 5ºC o menos de diferencia en la temperatura de melting. La identificación a nivel de especies es el propósito primario de todo esquema de clasificación microbiano, la separación y reconocimiento exacto de subtipos dentro de una especie es importante en todas las ramas de la microbiología, y particularmente en la microbiología médica. Además, en muchos casos, el control de enfermedades no podría ser posible sin el uso de métodos de tipificación para ayudar a definir las fuentes de infección, mecanismos de transmisión y velocidad de diseminación de la infección en una población susceptible. Otras áreas en las cuales la exactitud de la tipificación microbiana es importante incluye estudios ecológicos que involucran el monitoreo de nuevos microorganismos en nuevos hábitats naturales, y programas industriales en la búsqueda de nuevos productos microbianos. La secuencia completa del ADN constituiría el método de referencia fundamental para reconocer los subtipos dentro de las especies. La tipificación puede proporcionar información sobre la distribución de tipos microbianos en poblaciones humanas y animales, lo cual puede ser aplicado en programas de vigilancia a nivel local, regional, nacional o global. De especial interés pueden ser el monitoreo de marcadores asociados con la patogenicidad, inmunogenicidad o resistencia a medicamentos, como se demuestra por ejemplo en la vigilancia del cólera con la emergencia de una nueva cepa epidémica en Asia. En síntesis, esta aplicación puede incluir análisis periódicos para la detección de grupos de patógenos con tipos similares y de origen común en espacio y tiempo, para mejorar las advertencias anticipadas de brotes potenciales. Asimismo, puede ayudar en la planeación de servicios de salud e intervenciones preventivas como desarrollo de vacunas y programas de inmunización. Estas técnicas también pueden ser usadas en estudios clínicos para la delineación de patrones de colonización y para la identificación de fuentes de transmisión de microorganismos infecciosos, lo cual puede contribuir a un entendimiento de la epidemiología y patogénesis ayudando con ello al desarrollo de estrategias de prevención de enfermedades (Struelens y MESGEM, 1996). Las tinciones fluorescentes se emplean para la enumeración de microorganismos en muestras clínicas, del ambiente y de alimentos. La tinción con DAPI (4`,6-diamido-2-fenilindol) no reacciona con materia inerte y se puede aplicar para muestras de agua y suelo; proporciona una estimación razonable del número de células presentes. Para muestras acuáticas, las células se tiñen en la superficie de un filtro después de haber filtrado un volumen determinado de líquido. Estas técnicas sencillas tienen la ventaja de no ser específicas (tiñen todos los microorganismos de una 17
18 muestra), pero el inconveniente que presentan es que no diferencian entre células vivas y muertas. La tinción con colorantes fluorescentes que diferencian entre células vivas y muertas como es el caso de Live/Dead BactoLigth Kit) proporcionan información no sólo del número de microorganismos de una muestra sino también de la viabilidad de la misma. Ver fundamento al final. Reacción en cadena de la Polimerasa (PCR) La Reacción en cadena de la Polimerasa (PCR por sus siglas en inglés) es una técnica que se utiliza comúnmente en los laboratorios de investigación médicos y biológicos para amplificar (crear copias múltiples de) el ADN, sin utilizar un organismo vivo, tal como la E. coli o una levadura. Asimismo, se emplea en una variedad de tareas, tales como la detección de enfermedades hereditarias, la identificación de huellas digitales genéticas, diagnóstico clínico, análisis forense del ADN, detección de patógenos en el hombre, animales, plantas, y alimentos, e investigación en biología molecular (Saunders et al., 2001). La PCR fue inventada a principios de los 80 s por Kary Mullis, al cual le fue otorgado el premio Nobel en química en octubre de 1993 por este logro, siete años después de haber publicado sus primeras ideas. La idea de Mullis fue la de desarrollar un proceso a través del cual el ADN se pudiera multiplicar artificialmente a través de ciclos repetidos duplicados llevados a cabo por una enzima llamada ADN-Polimerasa. La ADN-Polimerasa se produce naturalmente en los organismos vivos, donde funciona para duplicar el ADN cuando las células se dividen. Trabaja uniéndose a una sola hebra de ADN y creando una hebra complementaria. El proceso original de PCR actualmente ha sido mejorado mediante el uso de la ADN- Polimerasa que procede de una bacteria termofílica que vive a temperaturas arriba de 110 C (en aguas termales). La ADN-Polimerasa o Taq polimerasa tomada de estos organismos es termoestable (estable en las altas temperaturas). Actualmente la Taq polimerasa se utiliza frecuentemente en la práctica de PCR. Una desventaja de la Taq es que incurre a veces en equivocaciones al copiar el ADN, conduciendo a mutaciones (errores) en la secuencia del ADN (Saunders et al., 2001). La PCR que ha sido utilizada por varios años para la detección directa de muchos tipos de agentes infecciosos en muestras clínicas, ha sido adaptada para ser usada como una herramienta de tipificación. La ventaja de la PCR es su habilidad para producir literalmente millones de copias de un segmento de ADN particular con alta fidelidad en un tiempo de 3 a 4 horas (Tenover et al., 1997).El procedimiento requiere un molde de ADN que puede estar presente en la muestra en pequeñas cantidades; dos oligonucleótidos (primers) que flanquean las secuencias del molde de ADN que va a ser amplificado; y una DNA-polimerasa estable al calentamiento. Un ensayo típico de PCR requiere aproximadamente de 2,5-3 horas para completar 30 ciclos, donde cada ciclo consiste de una fase de desnaturalización, en donde la doble hebra de ADN es fundida en hebras únicas; una fase de alineación, en donde los primers se unen a las secuencias 18
19 blanco en las hebras separadas; y una fase de extensión, en donde la síntesis de ADN procede de los primers a partir de cada hebra de la plantilla de ADN, generando dos nuevas copias de la doble hebra de la plantilla original. Después de cada 30 ciclos, una sola copia inicial de la plantilla de ADN teóricamente puede ser amplificado a 1 billón de copias (Tenover et al., 1997; Saunders et al., 2003). El uso válido de esta técnica es crítico para mantener la calidad de muchas bases de datos de ADN producidas. Diversos factores pueden influenciar la validez de los resultados obtenidos por PCR, incluyendo la presencia de componentes inhibitorios, la calidad del ADN, y la carencia de optimización con respecto a componentes de la reacción y las condiciones de los ciclos termales. Todos estos factores pueden comprometer la especificidad y sensibilidad de la reacción, pudiendo llevar a resultados falsos-negativos, falsos-positivos, o no reproducibles. Pero menos conocido, sin embargo, es la variación de los resultados en la PCR atribuidos al subóptimo funcionamiento de los termocicladores, siendo este el aspecto particular de la técnica que constituye las bases de los estudios interlaboratorios (Saunders et al., 2003). Esquema: Fusión 95 C Hibridización 50-60ºC Extensión de La cadena Segundo ciclo se repiten las temperaturas: 95ºC, 50-60ºC y 72ºC y así se obtienen múltiples copias, repitiendo los ciclos según el protocolo estandarizado. 19
20 Electroforesis de geles con gradiente denaturante (DDGE) El uso de las técnicas microbiológicas tradicionales no es eficiente para evaluar comunidades bacterianas en muestras ambientales ya que la proporción de células bacterianas cultivables en medios convencionales esta en el orden de 0.1% al 10% de la población total. Por este motivo, los métodos moleculares están reemplazando a los métodos tradicionales para el estudio y análisis de comunidades bacterianas. La electroforesis de geles con gradiente denaturante (DGGE) es una técnica molecular introducida en la ecología microbiana por Muyzer (1993) y ha sido adaptada como una herramienta para determinar la diversidad microbiana en muestras ambientales (Schaefer, 2001). El DGGE se basa en el análisis de la información genética de la bacteria. El DNA es extraído de las muestras y amplificado por PCR con primers 16S rdna bacteriano. OBJETIVOS DEL TRABAJO PRÁCTICO: - Individualizar las características macroscópicas de cultivos de bacterias y hongos (miceliares y levaduriformes). Observación de cultivos. - Estudiar las características microscópicas (morfología) de bacterias y hongos (miceliares y levaduriformes). - Identificación de microorganismos a través de pruebas bioquímicas que reflejan su metabolismo. - Utilizar técnicas de tinción con colorantes fluorescentes para análisis de poblaciones (Live/ Dead). 1) Observación macroscópica del crecimiento de bacterias y levaduras en un medio de cultivo líquido 1- A partir de cultivos en caldo tripteína soja (TSB) y un caldo TSB sin inocular. Observar y comparar las características del desarrollo microbiano en medio líquido: turbidez uniforme, formación de película, sedimento. 2- A partir de cajas sembradas observe las características macroscópicas de las colonias desarrolladas en base a forma, tamaño, consistencia, color, etc. Forma: puntiforme, circular, rizoide, irregular, filamentosa. Tamaño: grande (más de 3 mm), mediana (2-3 mm), pequeña (1-2 mm) Color 20
21 Borde: entero, ondulado, lobulado, filamentoso, ondeado Elevación: plano, elevado, convexo, pulvinado, umbonado Superficie: suave, brillante, rugosa, plegada, seca, polvorienta 2) Realizar preparaciones en fresco y tinciones simples y diferenciales de bacterias y hongos levaduriformes A partir de una muestra líquida se realizarán las siguientes preparaciones para observar la presencia de microorganismos (bacterias y/o levaduras) en: 1-preparaciones en fresco (40x) 2-extendidos teñidos con Azul de Metileno (100x) 3-extendidos teñidos con colorantes de Gram (100x) Característica macroscópica de una colonia 3) Manejo del Manual Bergey 4) Análisis de poblaciones por microscopía de fluorescencia. 1. Tomar 1 ml de muestra de un crecimiento bacteriano, centrifugar a 9000g durante 10 min. 2. Lavar el pellet con SF, centrifugar y resuspender en microlitros de SF según volumen de pellet obtenido. 3. Se toman 80 microlitros y se colocan en un Eppendorf cubierto con papel de alumnio y se agrega la mezcla de colorantes fluorescentes: (65 microlitros de SYTO 9 que tiñe las células viables de verde, y 35 microlitros de Ioduro de Propidium que tiñe las células muertas de color rojo). 4. Se incuba a temperatura ambiente y en oscuridad durante min. 5. Se observa en microscopio de fluorescencia. Esta técnica también permite observar los cambios morfológicos observados durante cultivos prolongados, es decir se puede realizar un seguimiento de las características de la población. Entre los cambios morfológicos observados se encuentran las formas cocoides consideradas formas de resistencia en ambientes adversos y con importancia epidemiológica desde el punto de vista de transmisión de enfermedades. Fundamento del Kit: 21
22 El kit Live/Dead BactoLigth brinda información acerca de la viabilidad de las células (actividad metabólica) en un medio determinado. Contiene dos colorantes de ácidos nucleicos: SYTO 9 el cual penetra las membranas libremente y el ioduro de propidio, el cual se encuentra altamente cargado y no penetra normalmente células, salvo que las membranas se encuentren dañadas. Permite observar las células viables de color verde, las muertas de color rojo y las formas de muerte parcial de color naranja o amarillo. 22
23 Trabajo practico 3: Anexo 1: examen microscópico de los microorganismos COLORACIONES 1. Morfología Las bacterias tienen tamaños y formas muy variables. La mayoría mide entre 0,2 y 1 μm de diámetro, y entre 2 y 8 μm de largo. Básicamente las 3 formas principales de las bacterias son: - esférica: cocos - cilíndrica (como bastones): bacilos - helicoidal o espiral: espirilos y espiroquetas 23
24 Las formas esféricas se conocen como cocos. Según la orientación de sus planos de división surgen distintos tipos de agrupaciones: En el caso de cocos: - los grupos de 2 células se denominan diplococos - cuando los cocos se reúnen en cadenas de 5, 10, 100 células, se habla de estreptococos - cuando se dividen según múltiples planos y se agrupan como racimos de uva, se conocen como estafilococos - la división en 2 planos perpendiculares produce agrupaciones de 4 cocos llamadas tétradas - la división en 3 planos produce agrupaciones cúbicas de 8 cocos llamadas sarcinas En el caso de bacilos: - pueden ser rectos (bacilo entérico), curvos (bacilo del cólera) - por sus bordes: paralelos convergentes, cóncavos, convexos - por sus extremos: redondeados, afilados o en escuadra - como la división es por fisión binaria transversal (mediante un plano perpendicular al eje mayor del cuerpo bacteriano), los bacilos se presentan aislados, en pares o en cadenas conocidas como filamentos. En algunos géneros, al final de la división no hay una separación total de las células hijas: se deslizan unas sobre otras o giran entre sí por el punto de unión (representado por residuos de la pared) que actúa como bisagra. Entonces se originan agrupaciones de bacilos con forma de L, V, o letras chinas, esto es típico de Corynebacterium diphteriae. En el caso de bacterias helicoidales: Pueden presentarse como, - espirales rígidas (Spirillum) - hélices flexibles en forma de sacacorchos o tirabuzón (espiroquetas como Treponema pallidum) 2. Observación de microorganismos -Sin teñir Los microorganismos pueden ser observados vivos, sin teñir, mediante exámenes en fresco que permiten visualizar movilidad. - Teñidos Para evidenciar diferencias entre microorganismos distintos o destacar estructuras especiales, se pueden utilizar técnicas de coloración. Los colorantes son compuestos orgánicos y cada tipo de colorante suele tener afinidad por determinadas estructuras celulares. Muchos colorantes utilizados en Microbiología están cargados positivamente (catiónicos) y se combinan fuertemente con compuestos celulares cargados negativamente, como los ácidos nucleicos y los polisacáridos ácidos. Entre los colorantes catiónicos están: azul de metileno, cristal violeta, verde de malaquita y safranina. En general, son sales que en medio acuoso se disocian produciendo iones, uno de los cuales tiene color. Cuando está coloreado el catión, estamos en presencia de un colorante básico. Por ej., cloruro de azul de metileno, que en agua se disocia así: AM Cl AM +: lleva el color que toma la bacteria 3 Al ph neutro o ligeramente alcalino en que se encuentran, las bacterias presentan carga negativa débil en su pared. Esto se debe a los polisacáridos ácidos y a los ácidos nucleicos. Por lo tanto, los cationes se unen a las cargas negativas y se produce la coloración. 3. Pasos de una coloración La coloración se realiza en cultivos jóvenes de h de desarrollo, ya que con el envejecimiento las bacterias pierden afinidad por los colorantes. 24
25 3.1. Etapas en la preparación de un frotis: a. Cómo se realiza el frotis? se utitlizan portaobjetos nuevos, sin rayaduras, lavados con mezcla sulfocrómica, luego con agua jabonosa, bien enjuagados y conservados en alcohol para desengrasarlos. Antes de usar, secar a la llama, a temperatura ambiente o con un lienzo que no desprenda fibras. El frotis se realiza sobre el portaobjetos colocando directamente una gota de cultivo desde medio líquido, o si se parte de un cultivo en medio sólido, será necesario colocar previamente una gota de solución fisiológica y luego se emulsiona una ansada de gérmenes. Se distribuye con ansa en una superficie de 1 cm2 aproximadamente. Se debe llevar poca cantidad de material para que no se formen acúmulos que impiden una óptima visualización. b. Secado del frotis: se realiza a temperatura ambiente, en estufa de cultivo a 37ºC, o manteniéndolo cerca de la llama del mechero. c. Fijación del frotis: su objetivo es preservar las estructuras celulares y hacerlas más visibles. Un método de fijación no debe deformar las estructuras ni cambiar la afinidad de la célula hacia el colorante. Existen métodos físicos y químicos de fijación. En los métodos físicos, la fijación se realiza por calor, pasando el preparado por su revés (con el frotis hacia arriba) 3 veces por la llama del mechero. Esto produce coagulación de proteínas y 25
26 adhiere el preparado al portaobjetos. Este método deforma levemente las estructuras pero no altera la afinidad por el colorante. En los químicos, se cubre el preparado con alcohol metílico o etílico, se deja actuar por unos segundos, se escurre el exceso de alcohol y, se arde acercando un hisopo encendido. Existen otras sustancias que se utilizan como acentuadores o reforzadores de la fijación: ácido fénico, KOH, etc. d. Enfriado del frotis: dejar el portaobjetos sobre la mesada por breves minutos antes de colorear. Este paso no debe soslayarse pues de lo contrario precipitarán los colorantes sobre el frotis Coloración propiamente dicha, puede ser: -coloración simple: se utiliza un único colorante -coloración diferencial: se utiliza un primer colorante, seguido por un decolorante, y luego un segundo colorante Lavado final: salvo indicación en contrario, se lava con agua común, se seca sobre la llama, en estufa o a temperatura ambiente. Se observa con objetivo de inmersión. 4.- Mordientes Para estructuras muy difíciles de teñir se recurre al uso de mordientes, que son sustancias químicas que unidas a los colorantes forman una laca que se adhiere fuertemente a la estructura difícil de teñir. El mordiente se puede agregar antes o después de la adición del colorante con el que formará la laca. Ej.: en la coloración de Gram se agrega primero cristal violeta y luego el mordiente que es lugol; en la impregnación argéntica primero se agrega el mordiente que es ácido tánico y luego nitrato de plata que es el reactivo precipitante. 5- COLORACIÓN VITAL Permite apreciar si los gérmenes son móviles o no. Se colorea con colorantes muy diluidos para no matar a las bacterias. Se puede usar cristal violeta diluido 1:5000, más una ansada de gérmenes. Se cubre con un cubreobjeto y se observa al microscopio con objetivo de 10 X, luego 40 X y poca luz (condensador bajo). En el Trabajo Práctico, será reemplazada por examen en fresco. 6- COLORACIÓN SIMPLE Permite visualizar forma, tamaño y disposición de los gérmenes. Se usa un solo colorante y las bacterias toman el color del colorante usado. 7- COLORACIONES DIFERENCIALES 7.1 -COLORACIÓN DE GRAM Por medio de esta coloración las bacterias se dividen en dos grandes grupos: Gram negativas y Gram positivas. Esto se debe a que la tinción de Gram pone en evidencia diferencias en la composición química de la pared celular de las bacterias. La pared de todas las bacterias (Gram positivas y Gram negativas) posee una capa rígida llamada peptidoglicano o mureína. Éste es un polisacárido formado por dos aminoazúcares: - N-acetilglucosamina (NAG) - N-acetilmurámico (NAM) que se unen alternadamente por enlaces β1-4: NAG-NAM-NAG-NAM-NAG., 26
27 y un pequeño grupo de aminoácidos: L-alanina, D-alanina, D-glutámico y, lisina o ácido diaminopimélico (DAP). Esta estructura se repite a lo largo de toda la pared. La estructura básica del peptidoglicano está constituida por largas cadenas adyacentes del polisacárido y estas cadenas se conectan entre sí a través de puentes peptídicos formados por los aminoácidos mencionados. Diferencias entre la pared celular de las bacterias Gram negativas y la de Gram positivas? En las bacterias Gram negativas, como Escherichia coli, las cadenas de NAG-NAM-NAG- NAMNAG- se estabilizan a través de puentes peptídicos directos entre el grupo amino del ácido diaminopimélico de una cadena y el grupo carboxilo de la D-alanina terminal de otra cadena adyacente. En las Gram positivas, el entrecruzamiento entre cadenas NAG-NAM-NAG-NAM-NAG- se establece mediante un puente interpeptídico cuya composición varía en cuanto a número y tipo de aminoácidos, de un microorganismo a otro. En Staphylococcus aureus, que es la bacteria Gram positiva que mejor se conoce, el puente interpeptídico está formado por cinco glicinas. En las bacterias ácido alcohol resistentes, el aminoazúcar N-A-M es sustituido por Nglicosilmurámico (N-G-M); y cada cadena permanece unida a la otra mediante un tetrapéptido. En las bacterias Gram positivas, el peptidoglicano representa hasta el 90% de la pared, aunque pequeñas cantidades de ácido teicoico suelen formar parte de la misma. Los ácidos teicoicos son polímeros de fosfato de ribitol o fosfato de glicerol. A veces están unidos a los lípidos de membrana de las bacterias Gram positivas y se denominan ácidos lipoteicoicos. 27
28 En la figura anterior, (c) representa un esquema del peptidoglicano En las bacterias Gram negativas, el peptidoglicano constituye sólo el 10% de la pared. El resto de adentro hacia afuera: - una capa de lipoproteína que funciona como una especie de anclaje entre las membranas externas y el peptidoglicano, - una capa de lipopolisacárido (LPS), molécula que consta de 3 regiones: -lípido A, con efecto de endotoxina - núcleo del polisacárido, compuesto por cetodesoxioctonato (KDO), heptosas, glucosa, galactosa y N-acetilglucosamina. - el polisacárido O: formado por unidades repetitivas de 4-5 azúcares que constituyen el antígeno O, que permite la identificación serológica de la bacteria. El LPS es muy importante desde el punto de vista clínico! Cuando las bacterias Gram negativas ingresan excepcionalmente en la circulación sanguínea (por ej. en un cuadro de peritonitis), se hace evidente el efecto de la endotoxina del LPS por el desarrollo de fiebre, coagulación vascular diseminada, muerte. Pasos a seguir en la coloración de Gram: Se agrega cristal violeta (primer colorante), luego el mordiente lugol (I2/I-), se decolora con alcohol o alcohol-acetona, y finalmente se aplica fucsina fenicada diluida 1:10 (segundo colorante). Se verán: - las bacterias Gram positivas: azul violáceas - las bacterias Gram negativas: rojas Por qué esa diferencia?. La diferencia radica en la composición química y en la estructura física de la pared celular de las bacterias. Las bacterias Gram positivas no tienen lípidos en su pared, las Gram negativas sí lo tienen y en cantidad abundante. Con cristal violeta (CV) se tiñen todas. Al agregar el mordiente, éste forma un complejo con CV que mejora la tinción: CV + lugol lugol Luego, al agregar el decolorante alcohol. qué sucede? En las bacterias Gram negativas disuelve los lípidos de la pared, penetra en el protoplasma y quita el complejo cristal violeta iodo. En las bacterias Gram positivas, que no tienen lípidos en su pared, el decolorante produce deshidratación del peptidoglicano compactándolo, no ingresa al protoplasma y no puede remover el complejo CV iodo. Estas bacterias permanecen azules. Por último se agrega fucsina que teñirá solamente las bacterias que fueron decoloradas por el alcohol. Estas células se verán rojas. Nota: las levaduras teñidas al Gram se ven positivas, aunque presentan una pared celular con una estructura química distinta a la pared de las bacterias Gram positivas COLORACIÓN DE ZIEHL NEELSEN para bacterias ácido-alcohol resistentes Esta tinción se utiliza para identificar a todas las bacterias del género Mycobacterium, que comprende dos patógenos importantes para el hombre: M. tuberculosis, agente causal de la tuberculosis y M. leprae, agente de la lepra. También se utiliza para identificar cepas del género Nocardia. Estos microorganismos se consideran Gram positivos pero por la técnica de Gram se colorean difícil e irregularmente, de ahí que se emplee la coloración de Ziehl Neelsen. Son bacterias ácido-alcohol resistentes (BAAR). La pared de las BAAR está compuesta por: 28
29 - peptidoglicano, unido mediante enlaces covalentes a - un polímero de ácido micólico galactosa arabinosa, (el ácido micólico, que es un hidroxilípido de cadena larga y ramificada) - lípidos superficiales (micósidos, y cord factor: glicolípidos y sulfolípidos). El resto de la estructura es similar a la pared de las bacterias Gram positivas ya que así se viene considerando a este grupo, pero no se han descripto ácidos teicóicos. Pasos a seguir en la coloración de Ziehl Neelsen Esta técnica se basa en la propiedad que tienen algunas bacterias de resistir la decoloración con alcohol-ácido después de teñirlas con fucsina fenicada concentrada y en caliente. Se usa una mezcla de fucsina básica y fenol (fucsina fenicada) aplicando calentamiento progresivo para conseguir que el colorante penetre dentro de la célula. La reactividad radica en el grupo carboxilo del ácido micólico que reacciona con el ion amonio de la fucsina. El fenol facilita la penetración de la fucsina en la capa lipídica. Se decolora con alcohol-ácido y se agrega el contracolorante azul de metileno. En el preparado se verán: - BAAR: bacilos de color rojo -otras bacterias y células que no son BAAR: de color azul. Se considera que la ácido-resistencia de las BAAR se debe al alto contenido de lípidos de la pared de estas bacterias, fundamentalmente el ácido micólico. El ácido micólico forma un complejo con el peptidoglicano de la pared de estas bacterias y dicho complejo impide de alguna manera el contacto con el decolorante alcohol ácido en la etapa de decoloración. El complejo fucsina fenol resiste la decoloración porque está muy ligado a los lípidos ya que es más soluble en ellos que en el decolorante. Existen diferentes opiniones que señalan otras posibles causas, como la formación de un complejo estable de fucsina RNA bacteriano que se mantendría unido cuando se realiza una vigorosa decoloración 8. COLORACIONES ESPECIALES Las tinciones especiales se utilizan para colorear partes específicas de microorganismos, como endosporas, flagelos y para detectar la presencia de cápsulas. 8.1 CAPSULA La cápsula es un elemento no esencial para la fisiología bacteriana, y está presente en algunas bacterias Gram negativas y Gram positivas. Generalmente está formada por polisacáridos y raramente por proteínas. Algunas veces se utilizan los términos cápsula o capa mucosa para describir esta capa de polisacárido, aunque también se emplea el término glicocáliz. El glicocáliz contiene habitualmente glicoproteinas y un gran número de polisacáridos (polialcoholes y aminoazúcares). El glicocáliz puede ser grueso o delgado, rígido o flexible, dependiendo de la naturaleza química en cada organismo. Cuando las capas rígidas están organizadas en una matriz impermeable que excluye colorantes como la tinta china; a esta estructura se la denomina cápsula. Cuando el glicocáliz se deforma con facilidad, no excluye partículas y es más difícil de visualizar, se denomina capa mucosa. 29
30 Funciones:- Protege a la mayoría de las bacterias de la fagocitosis, favoreciendo la invasión y multiplicación en el organismo infectado. - Tiene poder antigénico, allí reside el antígeno K. - Su presencia es signo de virulencia. Las cápsulas desarrollan en los productos patológicos o en los medios de cultivo enriquecidos con proteínas animales, por ej. leche. La cápsula puede rodear a una célula bacteriana, a dos, y a varias cadenas. -TINCIÓN DE BURRI para cápsula La técnica de Burri es un método de tinción negativa que permite poner en evidencia la cápsula. Pasos a seguir en la técnica de Burri En el Trabajo Práctico se realiza en un portaobjetos una suspensión de gérmenes capsulados en una gota de tinta china, se hace el extendido, se seca, se fija a la llama, se cubre con cristal violeta, se lava y se observa La cápsula se verá como un halo claro refringente alrededor del cuerpo bacteriano teñido de violeta, sobre un fondo oscuro ESPORAS Las esporas son estructuras presentes en algunas especies bacterianas, principalmente de los géneros Clostridium y Bacillus. Pueden estar en el interior de una bacteria (endosporas) o permanecer libres. Son órganos refringentes, esféricos u ovales que constituyen la forma de resistencia bacteriana ante situaciones de deficiencia nutricional, desecación, radiación, calor, ácidos, y desinfectantes químicos. Características: - son muy impermeables a los colorantes, por lo que a veces se ven como regiones sin teñir dentro de las células que han sido teñidas con Gram. Para teñir las esporas se utilizan métodos especiales. - son muy termorresistentes, esto está en relación con el escaso contenido de agua y la gran cantidad de dipicolinato de calcio que se encuentra en el núcleo de la espora. - el núcleo se encuentra parcialmente deshidratado y de allí la consistencia gelatinosa del citoplasma del núcleo. - Contienen SASPs (pequeñas proteínas ácido solubles) que estabilizan y protegen el ADN. Algunas esporas no deforman el cuerpo bacteriano (Bacillus) y otras son deformantes (Clostridium). Pueden tener ubicación: central, subterminal o terminal. Estructura de la espora: La capa más externa es el exosporio, una fina y delicada cubierta de naturaleza proteica. Por debajo de esta se encuentran las cubiertas de la espora (externa e 30
31 interna), que se componen de varias capas de proteínas específicas de la espora. Por debajo de las cubiertas de la espora se localiza el cortex, que es una capa de peptidoglicano con uniones laxas. Internamente, y por debajo del cortex, se presenta el núcleo o protoplasto de la espora, que contiene la pared celular normal (similar a la de la célula vegetativa), la membrana citoplasmática, el citoplasma, el nucleoide, etc. El proceso de formación de endosporas en el interior de una célula vegetativa (progenitora) se denomina esporulación o esporogénesis. Las endosporas pueden permanecer en estado de latencia durante miles de años. Una endospora recupera el estado vegetativo mediante un proceso llamado germinación. a) TÉCNICA DE MOELLLER para esporas En esta técnica, la fijación se realiza por métodos químicos. El ácido crómico actúa como mordiente y sensibilizante de las cubiertas de la espora. La fucsina fenicada de Ziehl penetra más fácilmente a la espora por calentamiento. La decoloración se realiza con ácido sulfúrico al 5 % y alcohol, pero por ser la pared de la espora impermeable, la espora no se decolore y sí lo hace el resto de la bacteria. Finalmente, se agrega el contracolorante: azul de metileno, de modo que: - la espora se observará de color rojo - el cuerpo vegetativo se observará azul Nota: por la técnica de Gram, las esporas se ven como áreas incoloras dentro de las células teñidas. b) TÉCNICA DE WIRTZ CONKLIN para esporas 1. Tinción con verde de malaquita. 2. Calentamiento con emisión de vapores durante 6 a 10 minutos, para que el colorante penetre a través de las paredes de la endospora. 3. Lavado con agua, que elimina el colorante verde de todas las partes de la célula, con excepción de las esporas. 4. Tinción de contraste con el colorante fucsina de Ziehl o safranina. Al final del proceso: - las esporas bacterianas: de color verde - células: de color rojo. Las bacterias Bacillus anthracis y Clostridium perfringens, agentes etiológicos del carbunco y la gangrena, respectivamente, forman esporas y pueden ser identificadas mediante esta tinción. 31
32 8.3 -FLAGELOS Los flagelos son elementos facultativos, órganos de locomoción, responsables de la movilidad bacteriana. Se presentan en algunos procariotas y son responsables de su propulsión en medios líquidos. Son apéndices largos y finos que se encuentran libres por un extremo y unidos a la célula por el otro. Según la disposición de los flagelos sobre la superficie bacteriana, las bacterias se pueden clasificar en: - anfitrica: tienen un penacho de flagelos en cada polo. - lofotrica (lofos: penacho, tricos: pelo): tienen un penacho de flagelos en un solo polo. - monotrica: presentan un solo flagelo polar. - peritrica (peri: alrededor): alrededor de toda la superficie bacteriana. Las bacterias desprovistas de flagelos se conocen como atricas. Los flagelos se componen de tres partes: - filamento - gancho cuerpo basal. El filamento del flagelo bacteriano está compuesto de subunidades de una proteína llamada flagelina y tienen especificidad antigénica, allí reside el antígeno H. En las bacterias Gram negativas, existe un anillo externo que está anclado en la capa de lipopolisacárido (anillo L), otro en la capa de peptidoglicano de la pared celular (anillo P) y un anillo interno (S-M) situado en la membrana citoplasmática. En las bacterias Gram positivas, como carecen de la capa externa de lipopolisacárido, solo existe el par de anillos interno y el anillo P. a) IMPREGNACIÓN ARGÉNTICA para flagelos El método que veremos en el TP es una impregnación argéntica, ya que los flagelos al ser tan finos (20 nm de diámetro), no pueden observarse mediante coloraciones comunes, sino que hay que recurrir a tinciones específicas que aumentan su diámetro. Se deben examinar cultivos jóvenes ya que los cultivos con más de 24 h presentan células sin flagelos. Utiliza ácido tánico actúa como mordiente, luego el complejo formado por AgNO3 y NH4OH se deposita como Ag2O sobre la estructura flagelar. Ag+ + OH > Ag2O Todos los lavados se deben realizar con agua destilada, dado que el agua común tiene cloruros que reaccionarían con Ag+ formando un precipitado de AgCl lo cual impedirá la observación. b) IMPREGNACIÓN ARGÉNTICA DE FONTANA TRIBONDEAU para espiroquetas y espirilos. Esta técnica es útil para espiroquetas, entre las cuales está Treponema pallidum, el agente de la sífilis. Estos microorganismos son extremadamente finos por lo que no se colorean por los métodos habituales. Lo primero que se hace es una deshemoglobinización con líquido de Rouge. Esto se hace porque generalmente la muestra se toma directamente de la lesión o chancro y viene acompañada de sangre que dificulta la observación. El fundamento de esta técnica es similar al de la técnica para flagelos. NOTA: Al leer cada técnica por la Guía de TP., remitirse a la teoría de Estructura bacteriana. Referencias: - Brock Biología de los microorganismos. 10ª. ed. Prentice Hall Pumarola. Microbiología y Parasitología Médica. 2ª. ed. Ed.Salvat
33 EJERCICIOS DE APLICACIÓN (consulte la teoría para responder): 1. Esquematice la pared de una bacteria Gram positiva y la pared de una bacteria Gram negativa. Coloque el nombre de las estructuras que las forman. Qué diferencias notables existen entre la pared de una y de la otra? 2. Esquematice la estructura del peptidoglicano en las bacterias Gram positivas y en las bacterias Gram negativas. Coloque nombre de las moléculas que lo integran. Qué diferencias se destacan entre uno y otro? 3. Dónde está situado el lipopolisacárido (LPS) de las bacterias Gram negativas. Nombre las distintas regiones que lo integran. Dónde está situado el antígeno O? y la endotoxina? Qué efectos clínicos produce el LPS en un paciente afectado por peritonitis? 4. Dibuje una bacteria y señale cuáles son sus estructuras constantes y facultativas. 5.- a) Mencione diferentes formas que pueden adoptar las bacterias b) Mencione distintas formas de agrupación que adoptan los cocos. Cómo se observan al microscopio?. Dibuje. 6.- Describa en orden correcto los diferentes pasos a seguir en la preparación de un frotis. Cuántas horas deben tener los cultivos bacterianos para realizar una coloración? 7.- Explique el fundamento de la coloración de Gram. 8.- Si Ud. realiza la observación microscópica de un preparado que contiene una mezcla de microorganismos teñidos mediante la coloración de Gram, cómo identifica a las bacterias Gram positivas (+), Gram negativas (-), esporas y levaduras. Indique el color que presentan. 9.- Qué es un mordiente?. Dé ejemplos e indique en qué técnica de coloración los usa? 10.- Nombre los pasos de la coloración de gram, con sus reactivos y tinción de bacterias gram + y gram 11.- Flagelos:a) Esquematice un flagelo de una bacteria Gram negativa y de una Gram positiva.b) Cómo clasifica a las bacterias según la disposición de los flagelos?. Dibujec) Mencione la técnica que utiliza para poner en evidencia dicha estructura. Formule la reacción química que se produce entre los reactivos utilizados en dicha técnica Esporas:a) Dibuje e indique las distintas partes de una espora bacteriana. b) Menciones dos géneros bacterianos productores de esporas.c) A qué se atribuye la termorresistencia de las esporas?.qué son las SASPs.d) De qué color se visualizan las esporas mediante las coloraciones de Moeller y Wirtz Conklin? 13.- Mycobacterium tuberculosis es un BAAR?. Qué técnica usaría para evidenciarlo? Explique técnica y fundamento la misma. ESTA EXPLICACIÓN DE TP SE COMPRENDE MEJOR SI SU LECTURA VA EN PARALELO CON LA OBSERVACIÓN DE IMÁGENES DEL ARCHIVO EN POWERPOINT 33
34 Trabajo practico 3 ANEXO 2: EXPLICACION DE LAS COLORACIONES OBSERVACIÓN DE MICROORGANISMOS La observación de los microorganismos se puede realizar: Examen en fresco (vivos sin teñir) Técnicas de coloración (teñidos con colorantes) Ventajas que presentan los microorganismos coloreados: Proporciona el contraste suficiente entre la célula y el medio que la rodea, permitiendo diferenciar varios tipos morfológicos. Permite el estudio de estructuras propias de la célula. Se pueden obtener mayores amplificaciones con el empleo del objetivo de inmersión del microscopio COLORANTES Son compuestos orgánicos y cada tipo de colorante suele tener afinidad por determinadas estructuras celulares. Muchos de los colorantes usados en microbiología están cargados positivamente (catiónicos) y se combinan con compuestos celulares cargados negativamente, como ácidos nucleicos y polisacáridos ácidos. Colorantes catiónicos: azul de metileno, cristal violeta, zafranina. Son sales que en medio acuoso: Cl AM Cl- + AM+ COLORACIONES Las coloraciones se pueden clasificar en: Coloración vital Coloración simple Coloraciones diferenciales: Coloración de Gram Coloración de Ziehl-Neelsen Coloraciones especiales: Técnica de Moeller Técnica de Wirtz-Conklin Impregnación argéntica de flagelos Técnica de Burri Impregnación argéntica defontana Tribondeau COLORACIÓN VITAL Permite visualizar si los microorganismos son móviles o inmoviles 1.- Colocar sobre un portaobjeto una gota de solución acuosa de cristal violeta 1/ Con ansa tomar una pequeña cantidad de cultivo y emulsionarlo en la gota de colorante. 3.- Cubrir la gota con cubreobjeto evitando formación de burbujas de aire. 34
35 4.- Enfocar con poco aumento y luego 40 X (poca luz: condensador bajo). 5.- Observar si los microorganismos presentan verdadero movimiento. 1 Preparación del frotis 2 Secado 3 Fijación Métodos físicos: calor Métodos químicos: alcohol metílico o etílico 4 Enfriado 5 Coloración (simple o compuesta) 6 Lavado 7 Secado 8 Observación al microscopio con objetivo de inmersión 100 x Cultivos bacterianos: h 9 Fijación: preserva las estructuras y las hace más visibles Calor: coagula las proteínas y las adhiere sobre el portaobjetos, deforma levemente MORDIENTE Sustancia química que unida a los colorantes forma una laca que se adhiere fuertemente a la estructura Se utiliza para estructuras muy difíciles de teñir. Se puede agregar antes o después de la adición del colorante con el que formará la laca Ejemplos: lugol en coloración de Gram, ácido tánico en la impregnación argéntica COLORACIÓN SIMPLE Permite visualizar forma, tamaño y disposición de los microorganismos 1.- Hacer el frotis 2.- Secar la preparación en la parte alta del mechero 3.- Fijar tomando el preparado desde un extremo, pasándolo 3 veces por la llama del mechero. 4.- Una vez frío, colorear con un solo colorante. 5.- Lavar, secar y observar. Permite visualizar forma, tamaño y disposición de los microorganismos Estructura del peptidoglicano 35
36 GRAM + GRAM - 36
37 Ácidos teicoico: polímeros de fosfato de ribitol o fosfatos de glicerol Esquema de pared celular GRAM - GRAM + Cómo se observan las bacterias y esporas según la coloración de Gram? 37
38 Pared de bacterias ácido alcohol resistentes (BAAR) COLORACION DE ZIEHL-NEELSEN (BAAR) 1- Hacer el frotis 2-Secarlo 3-Fijarlo 4-Cubrir con Fucsina Ziehl concentrada, calentar con hisopo encendido hasta emisión de vapores durante 10 min. El fenol y el calor facilitan la penetración del colorante 5-Decolorar con alcohol-ácido 6- Lavar y cubrir con Azul de metileno 7- Lavar y Secar 8- Observar Ej: Mycobacterium Tuberculosis 38
39 Composición química: Polisacáridos y Proteínas Cápsula bacteriana Cápsula: estructura rígida Capa mucosa: se deforma con facilidad y no excluye partículas ETAPAS EN LA COLORACIÓN DE CAPSULA (TECNICA DE BURRI) 1.- Preparar extendido (colocar en el extremo de un portaobjeto una gota de tinta china comercial) 2.- Emulsionar sobre esa gota una suspensión de gérmenes cápsulados 3.- Con otro portaobjeto, efectuar un extendido fino. Secar y fijar a la llama. 4.-Cubrir con solución de cristal violeta 2 min. 5.- Lavar cuidadosamente con agua corriente. Secar y observar. CAPSULAS: REFRINGENTES SOBRE FONDO OSCURO Y EL CUERPO BACTERIANO TEÑIDO DE VIOLETA. 39
40 DIFERENTES ASPECTOS DE LA CAPSULA BACTERIANA ENDOSPORAS: ESPORAS Y ENDOSPORAS BACTERIANAS No es un método de multiplicación bacteriana sino una forma de reposo latente dentro del ciclo vital. Permanecen latentes por largos periodos de tiempo. La formación de la endospora se da por la falta de los nutrientes esenciales No se presenta en la etapa exponencial del crecimiento bacteriano ESPORAS Y ENDOSPORAS BACTERIANAS Órganos refringentes, esféricos u ovales, constituyen la forma de resistencia bacteriana ante deficiencia nutricional, radiación, calor, ácidos, altas temperaturas, etc. Son muy impermeables a los colorantes TIEMPO DE VIDA DE UNA ESPORA: Indefinido, hasta que las condiciones del medio sean favorables (Clostridium aceticum años) COLORACION PARA ENDOSPORA: Moeller Wirtz Conklin 40
41 TIPOS DE ENDOSPORAS: A. Central C. Subterminal D. Terminal ETAPAS EN LA COLORACIÓN DE ESPORAS (TECNICA DE MOELLER) 1.- Frotis. Secar 2.- Fijar con alcohol absoluto, escurrir el alcohol y arder el resto. 3.- Lavar. Tratar con ác. Crómico 5 min. Lavar. 4.- Cubrir con fuscina fenicada de Ziehl. Calentar 10 min. 5.- Decolorar con ác. Sulfúrico 5%. Descartar reactivo. Completar con alcohol. 6.- Lavar. Colorear con azul de metileno dil. 1 min. 7.- Lavar. Secar y observar. ESPORAS: ROJAS OTRAS ESTRUCTURAS: AZULES 41
42 COLORACIÓN DE ESPORAS Tinción de Moeller Tinción de Wirtz Conklin 42
43 Estructura de un flagelo bacteriano Diferentes disposiciones de flagelos bacterianos 43
44 IMPREGNACIÓN ARGENTICA PARA FLAGELOS MORDIENTE: ácido tánico REACTIVO PRECIPITANTE: Ag2O LAVAR: agua destilada FLAGELOS SE VEN DE COLOR MARRÓN CLARO Impregnación argéntica de Fontana Tribondeau: espiroquetas y espirilos MORDIENTE: ácido tánico REACTIVO PRECIPITANTE: Ag2O LAVAR: agua destilada ESPIROQUETAS Y ESPIRILOS SE VEN DE COLOR MARRÓN OSCURO SOBRE FONDO PARDO CLARO. 44
TRABAJO PRÁCTICO N 3: Identificación microbiana
 TRABAJO PRÁCTICO N 3: Identificación microbiana PARTE A: Identificación Fenotípica 1.-Pruebas Bioquímicas 2- Coloraciones 3. Uso del Manual Bergey Pruebas Bioquímicas Son una serie de pruebas que permiten
TRABAJO PRÁCTICO N 3: Identificación microbiana PARTE A: Identificación Fenotípica 1.-Pruebas Bioquímicas 2- Coloraciones 3. Uso del Manual Bergey Pruebas Bioquímicas Son una serie de pruebas que permiten
MANUAL DE OPERACIONES. DIRECCIÓN DE INVESTIGACIÓN Fecha: JUN 15 SUBDIRECCIÓN DE INVESTIGACIÓN BIOMÉDICA MANUAL DE TINCIONES
 A Hoja: de 0 MANUAL DE TINCIONES Elaboró: Autorizó: Puesto QUÍMICO JEFE DE LABORATORIO Firma Hoja: 2 de 0. Propósito Establecer las técnicas y condiciones para la realización de tinciones utilizadas en
A Hoja: de 0 MANUAL DE TINCIONES Elaboró: Autorizó: Puesto QUÍMICO JEFE DE LABORATORIO Firma Hoja: 2 de 0. Propósito Establecer las técnicas y condiciones para la realización de tinciones utilizadas en
AcuaNatura ÍNDICE TÉCNICAS DE TINCIÓN
 TÉCNICAS DE TINCIÓN ÍNDICE 1. Introducción 3 2. Tipos de tinciones 4 2.1. Tinción de Gram 4 2.2. Tinción ácido alcohol resistencia 5 2.3. Tinción de esporas 5 2.4. Tinción negativa 6 3. Precauciones 7
TÉCNICAS DE TINCIÓN ÍNDICE 1. Introducción 3 2. Tipos de tinciones 4 2.1. Tinción de Gram 4 2.2. Tinción ácido alcohol resistencia 5 2.3. Tinción de esporas 5 2.4. Tinción negativa 6 3. Precauciones 7
EXPLICACIÓN DE TP N 3 y 4 COLORACIONES I y II
 MICROBIOLOGÍA E INMUNOLOGÍA PARTE A EXPLICACIÓN DE TP N 3 y 4 COLORACIONES I y II 1. Forma o morfología de las bacterias Las bacterias tienen tamaños y formas muy variables. La mayoría mide entre 0,2 y
MICROBIOLOGÍA E INMUNOLOGÍA PARTE A EXPLICACIÓN DE TP N 3 y 4 COLORACIONES I y II 1. Forma o morfología de las bacterias Las bacterias tienen tamaños y formas muy variables. La mayoría mide entre 0,2 y
PRACTICA 2 TINCION DE GRAM
 PRACTICA 2 TINCION DE GRAM OBJETIVOS DE APRENDIZAJE: Cuando haya completado este experimento, usted debe comprender: 1. La base teórica y química de los procedimientos de tinción diferencial. 2. La base
PRACTICA 2 TINCION DE GRAM OBJETIVOS DE APRENDIZAJE: Cuando haya completado este experimento, usted debe comprender: 1. La base teórica y química de los procedimientos de tinción diferencial. 2. La base
GUÍA OBSERVACIÓN DE MICROORGANISMOS Y USO DE TINCIONES
 ESCUELA DE SALUD GUÍA OBSERVACIÓN DE MICROORGANISMOS Y USO DE TINCIONES DIRIGIDO A ALUMNOS DE: Técnico de laboratorio Clínico y Banco de Sangre Técnico de Enfermería Técnico de Radiodiagnóstico y Radioterapia
ESCUELA DE SALUD GUÍA OBSERVACIÓN DE MICROORGANISMOS Y USO DE TINCIONES DIRIGIDO A ALUMNOS DE: Técnico de laboratorio Clínico y Banco de Sangre Técnico de Enfermería Técnico de Radiodiagnóstico y Radioterapia
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA
 PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
PRÁCTICO N 3. Técnicas para la observación, aislamiento y conservación de microorganismos
 PRÁCTICO N 3 Técnicas para la observación, aislamiento y conservación de microorganismos Objetivos Conocer el manejo del microscopio óptico, sus partes y utilidad en el laboratorio de microbiología. Conocer
PRÁCTICO N 3 Técnicas para la observación, aislamiento y conservación de microorganismos Objetivos Conocer el manejo del microscopio óptico, sus partes y utilidad en el laboratorio de microbiología. Conocer
MICROBIOLOGÍA E INMUNOLOGÍA PARTE A LIC. en BIOLOGÍA MOLECULAR. EXPLICACIÓN DE TRABAJO PRÁCTICO N 2 COLORACIONES I y II
 MICROBIOLOGÍA E INMUNOLOGÍA PARTE A LIC. en BIOLOGÍA MOLECULAR EXPLICACIÓN DE TRABAJO PRÁCTICO N 2 COLORACIONES I y II 1. Forma o morfología de las bacterias Las bacterias tienen tamaños y formas muy variables.
MICROBIOLOGÍA E INMUNOLOGÍA PARTE A LIC. en BIOLOGÍA MOLECULAR EXPLICACIÓN DE TRABAJO PRÁCTICO N 2 COLORACIONES I y II 1. Forma o morfología de las bacterias Las bacterias tienen tamaños y formas muy variables.
Importancia. Una de las técnicas más utilizadas en los laboratorios para clasificar microorganismos.
 Tinciones OBJETIVOS Estudiar las bases teóricas y químicas de una tinción biológica Realizar la preparación de un frotis Hacer una tinción simple Efectuar una tinción diferencial (Tinción Gram) Estudia
Tinciones OBJETIVOS Estudiar las bases teóricas y químicas de una tinción biológica Realizar la preparación de un frotis Hacer una tinción simple Efectuar una tinción diferencial (Tinción Gram) Estudia
Técnicas de observación de microorganismos
 Fundamentos y técnicas de análisis microbiológicos Técnicas de observación de microorganismos - 1 Técnicas de observación de microorganismos El examen microscópico es el primer paso para el estudio de
Fundamentos y técnicas de análisis microbiológicos Técnicas de observación de microorganismos - 1 Técnicas de observación de microorganismos El examen microscópico es el primer paso para el estudio de
PCR gen 16S ARNr bacteriano
 PCR gen 16S ARNr bacteriano Ref. PCR16S 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y la práctica de la Reacción en Cadena de la Polimerasa
PCR gen 16S ARNr bacteriano Ref. PCR16S 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y la práctica de la Reacción en Cadena de la Polimerasa
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR
 UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR Catedrático: Dra. Ana Olivia cañas Urbina. PRACTICA No. 3: TINCIONES Equipo:
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR Catedrático: Dra. Ana Olivia cañas Urbina. PRACTICA No. 3: TINCIONES Equipo:
UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II
 UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II Maye Bernal Rivera PARTE II. LECTURA E INTERPRETACION DE LOS CULTIVOS
UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II Maye Bernal Rivera PARTE II. LECTURA E INTERPRETACION DE LOS CULTIVOS
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR
 ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE
 PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE I. OBJETIVO Conocer el procedimiento para preparar extensiones ó frotis y los diferentes métodos de tinción, así como su utilidad
PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE I. OBJETIVO Conocer el procedimiento para preparar extensiones ó frotis y los diferentes métodos de tinción, así como su utilidad
Logros. Crecimiento bacteriano. Crecimiento. Finalidad de las bacterias
 Fisiología bacteriana Dr. Juan C. Salazar jcsalazar@med.uchile.cl Programa de Microbiología y Micología ICBM, Facultad de Medicina Finalidad de las bacterias Logros Crecimiento Cómo lo hacen? Herramientas
Fisiología bacteriana Dr. Juan C. Salazar jcsalazar@med.uchile.cl Programa de Microbiología y Micología ICBM, Facultad de Medicina Finalidad de las bacterias Logros Crecimiento Cómo lo hacen? Herramientas
Laboratorio de Introducción a la Microbiología. Practico N 1
 Laboratorio de Introducción a la Microbiología Practico N 1 PREPARACIÓN PARA LA OBSERVACIÓN DE MICROORGANISMOS POR MICROSCOPIA Los microorganismos son demasiado pequeños para ser observados a simple vista,
Laboratorio de Introducción a la Microbiología Practico N 1 PREPARACIÓN PARA LA OBSERVACIÓN DE MICROORGANISMOS POR MICROSCOPIA Los microorganismos son demasiado pequeños para ser observados a simple vista,
QUÉ CONTIENE UN MEDIO? Aquellos requerimientos nutricionales que los microorganismos necesitan para crecer. Depende del ambiente en donde viven.
 OBJETIVOS u Diferenciar entre ciertos tipos de medios u Conocer actividades bioquímicas de las bacterias u Conocer los procesos bioquímicos de fermentación u Descibir los patrones de fermentación de carbohidratos
OBJETIVOS u Diferenciar entre ciertos tipos de medios u Conocer actividades bioquímicas de las bacterias u Conocer los procesos bioquímicos de fermentación u Descibir los patrones de fermentación de carbohidratos
Explique el significado de los términos magnificación, resolución y apertura numérica. Cuál es su importancia en microscopía?
 Fecha: dd / mm / aa Datos alumno Nombre: Informe de laboratorio Prácticas 2, 3, 4 y 5 PDF para impresión 1. Preguntas Explique el significado de los términos magnificación, resolución y apertura numérica.
Fecha: dd / mm / aa Datos alumno Nombre: Informe de laboratorio Prácticas 2, 3, 4 y 5 PDF para impresión 1. Preguntas Explique el significado de los términos magnificación, resolución y apertura numérica.
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS
 PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA BIORGÁNICA
 FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA BIORGÁNICA PRÁCTICA 3: PRUEBAS GENERALES PARA AMINOÁCIDOS Los aminoácidos constituyentes de las proteínas, contienen además
FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA BIORGÁNICA PRÁCTICA 3: PRUEBAS GENERALES PARA AMINOÁCIDOS Los aminoácidos constituyentes de las proteínas, contienen además
AISLAMIENTO DE MICROORGANISMOS
 PRÁCTICA5 AISLAMIENTO DE MICROORGANISMOS Introducción En la naturaleza, la mayoría de los microorganismos no se encuentran aislados, sino integrados en poblaciones mixtas. Para llevar a cabo el estudio
PRÁCTICA5 AISLAMIENTO DE MICROORGANISMOS Introducción En la naturaleza, la mayoría de los microorganismos no se encuentran aislados, sino integrados en poblaciones mixtas. Para llevar a cabo el estudio
Taxonomía bacteriana
 Página 1 Unidad Temática 5 Taxonomía bacteriana (Guía de estudio) Benintende, S; Sánchez, C., Sterren, M. Y Musante, C Objetivo El objetivo de la Taxonomía bacteriana es dar un ordenamiento de las unidades
Página 1 Unidad Temática 5 Taxonomía bacteriana (Guía de estudio) Benintende, S; Sánchez, C., Sterren, M. Y Musante, C Objetivo El objetivo de la Taxonomía bacteriana es dar un ordenamiento de las unidades
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 1 Bacteriología Veterinaria. TRABAJO PRÁCTICO No. 1 PRIMER PERIODO MICROSCOPÍA Y MORFOLOGÍA DE BACTERIAS OBJETIVOS 1. Manipular correctamente cada una de las partes del microscopio compuesto de campo claro.
1 Bacteriología Veterinaria. TRABAJO PRÁCTICO No. 1 PRIMER PERIODO MICROSCOPÍA Y MORFOLOGÍA DE BACTERIAS OBJETIVOS 1. Manipular correctamente cada una de las partes del microscopio compuesto de campo claro.
o Solución de KOH al 0,01% Disolver el colorante en el alcohol, y añadir la solución de KOH
 OBSERVACIÓN DE LAS BACTERIAS TINCIÓN SENCILLA 1.- Material necesario Cultivo bacteriano de 24 horas, en medio sólido Portaobjetos limpios y desengrasados Frasco lavador con agua de grifo o destilada Asa
OBSERVACIÓN DE LAS BACTERIAS TINCIÓN SENCILLA 1.- Material necesario Cultivo bacteriano de 24 horas, en medio sólido Portaobjetos limpios y desengrasados Frasco lavador con agua de grifo o destilada Asa
PROCEDIMIENTO DETECCIÓN Y ENUMERACIÓN POR NUMERO MAS PROBABLE (NMP) CON ETAPA DE PRE- ENRIQUECIMIENTO DE ENTEROBACTERIACEAE EN ALIMENTOS
 Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
GUÍA REALIZACIÓN DE CULTIVOS MICROBIOLÓGICOS
 ESCUELA DE SALUD GUÍA REALIZACIÓN DE CULTIVOS MICROBIOLÓGICOS DIRIGIDO A ALUMNOS DE: Técnico de laboratorio Clínico y Banco de Sangre Técnico de Enfermería Técnico de Radiodiagnóstico y Radioterapia Informática
ESCUELA DE SALUD GUÍA REALIZACIÓN DE CULTIVOS MICROBIOLÓGICOS DIRIGIDO A ALUMNOS DE: Técnico de laboratorio Clínico y Banco de Sangre Técnico de Enfermería Técnico de Radiodiagnóstico y Radioterapia Informática
TRABAJO PRACTICO Nº 1 COMPOSICION QUIMICA DE LA CELULA
 TRABAJO PRACTICO Nº 1 COMPOSICION QUIMICA DE LA CELULA Alumno:..... Comisión:.. OBJETIVOS: - Identificar los compuestos orgánicos de importancia biológica. - Detectar la presencia de algunos tipos de biomoléculas
TRABAJO PRACTICO Nº 1 COMPOSICION QUIMICA DE LA CELULA Alumno:..... Comisión:.. OBJETIVOS: - Identificar los compuestos orgánicos de importancia biológica. - Detectar la presencia de algunos tipos de biomoléculas
RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO
 RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO Fundamento Los alimentos se diferencian entre sí por las sustancias o principios inmediatos que contienen y por la cantidad de cada uno
RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO Fundamento Los alimentos se diferencian entre sí por las sustancias o principios inmediatos que contienen y por la cantidad de cada uno
TRABAJO PRÁCTICO Nº 3. Parte A: Examen macroscópico de los microorganismos.
 TRABAJO PRÁCTICO Nº 3 Parte A: Examen macroscópico de los microorganismos. OBJETIVOS - Caracterizar el desarrollo macroscópico de los microorganismos en medios de cultivo líquidos y sólidos - Adquirir
TRABAJO PRÁCTICO Nº 3 Parte A: Examen macroscópico de los microorganismos. OBJETIVOS - Caracterizar el desarrollo macroscópico de los microorganismos en medios de cultivo líquidos y sólidos - Adquirir
PRACTICA #2 ESTUDIO MICROSCOPICO DE LAS BACTERIAS
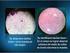 PRACTICA #2 ESTUDIO MICROSCOPICO DE LAS BACTERIAS OBJETIVO DE LA PRACTICA Desarrollar las técnicas microscópicas comunes para observar, teñir y medir a las bacterias y sus estructuras. INTRODUCCION El
PRACTICA #2 ESTUDIO MICROSCOPICO DE LAS BACTERIAS OBJETIVO DE LA PRACTICA Desarrollar las técnicas microscópicas comunes para observar, teñir y medir a las bacterias y sus estructuras. INTRODUCCION El
Laboratorio de Agroindustria II. Calidad de Leche
 Laboratorio de Agroindustria II. Calidad de Leche Medio de cultivo: Caldo lactosado biliado verde brillante (Brilliant Green Bile Lactose: BGBL) Composición - Peptona 10 g. - Lactosa 10 g. - Bilis de buey
Laboratorio de Agroindustria II. Calidad de Leche Medio de cultivo: Caldo lactosado biliado verde brillante (Brilliant Green Bile Lactose: BGBL) Composición - Peptona 10 g. - Lactosa 10 g. - Bilis de buey
PRÁCTICA No. 5 BASE QUIMICA DE LA VIDA
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA ESCUELA DE FORMACION DE PROFESORES DE ENSEÑANZA MEDIA-EFPEM- CURSO: BIOLOGÍA I I. INTRODUCCIÓN PRÁCTICA No. 5 BASE QUIMICA DE LA VIDA Los organismos vivos estamos
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA ESCUELA DE FORMACION DE PROFESORES DE ENSEÑANZA MEDIA-EFPEM- CURSO: BIOLOGÍA I I. INTRODUCCIÓN PRÁCTICA No. 5 BASE QUIMICA DE LA VIDA Los organismos vivos estamos
UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I
 UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I DRAS. MARÍA LUISA ORTIZ Y ANA PEDREGOSA 1 PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA
UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I DRAS. MARÍA LUISA ORTIZ Y ANA PEDREGOSA 1 PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA
- Mencionar las Normas de Bioseguridad y precauciones necesarias para trabajar en el laboratorio microbiológico.
 Microbiología General e Inmunología Año 2012 Trabajo Práctico Nº1 Objetivos: Que el alumno sea capaz de: - Mencionar las Normas de Bioseguridad y precauciones necesarias para trabajar en el laboratorio
Microbiología General e Inmunología Año 2012 Trabajo Práctico Nº1 Objetivos: Que el alumno sea capaz de: - Mencionar las Normas de Bioseguridad y precauciones necesarias para trabajar en el laboratorio
PRACTICA DE LABORATORIO SEMANA 19 y 20 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES Elaborado por: Licda. Lilian Judith Guzmán Melgar
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MEDICAS-CUM UNIDAD DIDACTICA QUIMICA, PRIMER AÑO PRACTICA DE LABORATORIO 2016 SEMANA 19 y 20 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MEDICAS-CUM UNIDAD DIDACTICA QUIMICA, PRIMER AÑO PRACTICA DE LABORATORIO 2016 SEMANA 19 y 20 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES
UNIVERSIDAD TECNOLOGICA NACIONAL
 UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE BIOTECNOLOGIA Trabajo práctico n 4 Tinción y observación de microorganismos. 2009 Jefe de Cátedra:
UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE BIOTECNOLOGIA Trabajo práctico n 4 Tinción y observación de microorganismos. 2009 Jefe de Cátedra:
PRÁCTICA 2. PREPARACIONES MICROSCOPICAS 1. CÉLULA EUCARIOTA VEGETAL: EPIDERMIS DE CEBOLLA.
 AMPLIACIÓN BIOLOGÍA 4º ESO Taller Biología 4º E.S.O. BLOQUE 2. MICROSCOPÍA Y CITOLOGÍA PRÁCTICA 2. PREPARACIONES MICROSCOPICAS 1. CÉLULA EUCARIOTA VEGETAL: EPIDERMIS DE CEBOLLA. OBJETIVOS o Adquirir práctica
AMPLIACIÓN BIOLOGÍA 4º ESO Taller Biología 4º E.S.O. BLOQUE 2. MICROSCOPÍA Y CITOLOGÍA PRÁCTICA 2. PREPARACIONES MICROSCOPICAS 1. CÉLULA EUCARIOTA VEGETAL: EPIDERMIS DE CEBOLLA. OBJETIVOS o Adquirir práctica
ACIDOS CARBOXILICOS Y ESTERES. ELABORADO POR: Lic. Raúl Hernández Mazariegos
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDÁCTICA QUÍMICA, PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010 ACIDOS CARBOXILICOS Y ESTERES ELABORADO POR: Lic. Raúl
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDÁCTICA QUÍMICA, PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010 ACIDOS CARBOXILICOS Y ESTERES ELABORADO POR: Lic. Raúl
Quiz #1 Repaso laboratorio #1. Características de Crecimiento Técnicas de Transferencias Técnicas asépticas
 Quiz #1 Repaso laboratorio #1 Introducción Características de Crecimiento Técnicas de Transferencias Técnicas asépticas Microscopio Importancia Mencionar tipos de Microscopios Magnificación Cuál es el
Quiz #1 Repaso laboratorio #1 Introducción Características de Crecimiento Técnicas de Transferencias Técnicas asépticas Microscopio Importancia Mencionar tipos de Microscopios Magnificación Cuál es el
ESTUDIO DE POLIMORFISMOS ALU HUMANOS POR PCR
 ESTUDIO DE POLIMORFISMOS ALU HUMANOS POR PCR Ref. PCRALU 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena
ESTUDIO DE POLIMORFISMOS ALU HUMANOS POR PCR Ref. PCRALU 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena
Laboratorio 4: Tinción de microorganismos. Biol 3725L
 Laboratorio 4: Tinción de microorganismos Biol 3725L 1 ml 1 ml Repaso de diluciones 0.1 ml 1 ml 1 ml 9 ml 1 / 10 10-1 99 ml 9.9ml 9 ml 1 / 100 10-3 1 ml 0.1/ 10 1/ 100 10-5 1/10 10-6 1 ml 9 ml 1/10 10-7
Laboratorio 4: Tinción de microorganismos Biol 3725L 1 ml 1 ml Repaso de diluciones 0.1 ml 1 ml 1 ml 9 ml 1 / 10 10-1 99 ml 9.9ml 9 ml 1 / 100 10-3 1 ml 0.1/ 10 1/ 100 10-5 1/10 10-6 1 ml 9 ml 1/10 10-7
Trabajo práctico Nº 6. Introducción. Ejercicio teórico MORFOLOGÍA Y TINCIÓN DE LOS MICROORGANISMOS. Objetivo. Procedimiento.
 Introducción Ejercicio teórico Objetivo Trabajo práctico Nº 6 MORFOLOGÍA Y TINCIÓN DE LOS MICROORGANISMOS Procedimiento Resultados Actividades adicionales Bibliografía INTRODUCCIÓN Una de las características
Introducción Ejercicio teórico Objetivo Trabajo práctico Nº 6 MORFOLOGÍA Y TINCIÓN DE LOS MICROORGANISMOS Procedimiento Resultados Actividades adicionales Bibliografía INTRODUCCIÓN Una de las características
Células. Tema 13 de Biología NS Diploma BI Curso
 Células procariotas 2ª Parte: Células Tema 13 de Biología NS Diploma BI Curso 2013-2015 Diversidad del dominio Eubacteria Grupo muy amplio de bacterias que, debido a su gran variedad genética, participan
Células procariotas 2ª Parte: Células Tema 13 de Biología NS Diploma BI Curso 2013-2015 Diversidad del dominio Eubacteria Grupo muy amplio de bacterias que, debido a su gran variedad genética, participan
Las bacterias poblaron la Tierra mucho antes de que ningún otro grupo de seres vivos la habitaran, carente de oxígeno para respirar, con temperaturas
 BACTERIAS Clasificación y Estructura Bacterias Las bacterias son seres vivos unicelulares Carecen de núcleo diferenciado y se reproducen por división celular sencilla. Las bacterias son tan pequeñas que
BACTERIAS Clasificación y Estructura Bacterias Las bacterias son seres vivos unicelulares Carecen de núcleo diferenciado y se reproducen por división celular sencilla. Las bacterias son tan pequeñas que
1. LEVINE EMB AGAR FOTO 6. Medios de cultivo Levine EMG Agar.
 1. LEVINE EMB AGAR. El Agar EMB Levine es un medio selectivo y diferencial, adecuado para el crecimiento de Enterobacterias. Es un medio adecuado para la búsqueda y diferenciación de bacilos entéricos,
1. LEVINE EMB AGAR. El Agar EMB Levine es un medio selectivo y diferencial, adecuado para el crecimiento de Enterobacterias. Es un medio adecuado para la búsqueda y diferenciación de bacilos entéricos,
TEMA 14. Métodos inmunológicos para la identificación microbiana
 TEMA 14 Métodos inmunológicos para la identificación microbiana Tema 14. Métodos inmunológicos para la identificación microbiana 1. Introducción 2. Detección de antígenos 2.1. Obtención de anticuerpos
TEMA 14 Métodos inmunológicos para la identificación microbiana Tema 14. Métodos inmunológicos para la identificación microbiana 1. Introducción 2. Detección de antígenos 2.1. Obtención de anticuerpos
CULTIVO DE MICROORGANISMOS MEDIOS DE CULTIVO
 CULTIVO DE MICROORGANISMOS MEDIOS DE CULTIVO CULTIVO DE MICROORGANISMOS fuente de energía exógena nutrientes esenciales: agua, carbón, nitrógeno, minerales condiciones ambientales apropiadas: ph, temperatura,
CULTIVO DE MICROORGANISMOS MEDIOS DE CULTIVO CULTIVO DE MICROORGANISMOS fuente de energía exógena nutrientes esenciales: agua, carbón, nitrógeno, minerales condiciones ambientales apropiadas: ph, temperatura,
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
Los principales mecanismos que intervienen en la separación cromatográfica son:
 TP 8 CROMATOGRAFIA EN PAPEL, Introducción Los métodos cromatográficos son un conjunto de técnicas empleadas para separar compuestos químicos de una mezcla. Su nombre significa escribir con color ya que
TP 8 CROMATOGRAFIA EN PAPEL, Introducción Los métodos cromatográficos son un conjunto de técnicas empleadas para separar compuestos químicos de una mezcla. Su nombre significa escribir con color ya que
Trabajo Práctico N 3. Reconocimiento de sustancias ácidas, básicas y neutras. mediante el empleo de indicadores químicos.
 Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
HISTOLOGÍA. Ciencia que estudia las células, tejidos y órganos, desde el punto de vista microscópico, relacionando la estructura con la función.
 HISTOLOGÍA HISTOLOGÍA Ciencia que estudia las células, tejidos y órganos, desde el punto de vista microscópico, relacionando la estructura con la función. MICROSCOPIOS TÉCNICAS HISTOLÓGICAS 1.Pie Microscopio
HISTOLOGÍA HISTOLOGÍA Ciencia que estudia las células, tejidos y órganos, desde el punto de vista microscópico, relacionando la estructura con la función. MICROSCOPIOS TÉCNICAS HISTOLÓGICAS 1.Pie Microscopio
Microscopio y observación de células
 I.E.S. Rayuela - Departamento de Biología y Geología Práctica nº1 de Anatomía Aplicada Microscopio y observación de células Las células suelen ser de tamaño muy pequeño de modo que permanecen invisibles
I.E.S. Rayuela - Departamento de Biología y Geología Práctica nº1 de Anatomía Aplicada Microscopio y observación de células Las células suelen ser de tamaño muy pequeño de modo que permanecen invisibles
Título de la gráfica: Crecimiento/ No crecimiento
 Resultados de la semana anterior (TSB) Título de la gráfica: # tubo TSB 1-24 Crecimiento/ No crecimiento Descripción del crecimiento Resultados de la semana anterior (TSA slant) Título de la gráfica: tubo
Resultados de la semana anterior (TSB) Título de la gráfica: # tubo TSB 1-24 Crecimiento/ No crecimiento Descripción del crecimiento Resultados de la semana anterior (TSA slant) Título de la gráfica: tubo
REACCIÓN EN CADENA DE LA POLIMERASA (PCR) Microbiología de los Alimentos Ingeniería en alimentos
 REACCIÓN EN CADENA DE LA POLIMERASA (PCR) Microbiología de los Alimentos Ingeniería en alimentos 2015 Desarrollada por Kary Mullis en 1986 Técnica in vitro que permite amplificar enzimáticamente una región
REACCIÓN EN CADENA DE LA POLIMERASA (PCR) Microbiología de los Alimentos Ingeniería en alimentos 2015 Desarrollada por Kary Mullis en 1986 Técnica in vitro que permite amplificar enzimáticamente una región
TRABAJO PRÁCTICO N 6 FERTILIZANTES BIOLÓGICOS: DESARROLLO Y CONTROL DE CALIDAD DE INOCULANTES
 TRABAJO PRÁCTICO N 6 FERTILIZANTES BIOLÓGICOS: DESARROLLO Y CONTROL DE CALIDAD DE INOCULANTES Objetivos Conocer los parámetros para la selección de cepas. Conocer las metodologías y procedimientos microbiológicos
TRABAJO PRÁCTICO N 6 FERTILIZANTES BIOLÓGICOS: DESARROLLO Y CONTROL DE CALIDAD DE INOCULANTES Objetivos Conocer los parámetros para la selección de cepas. Conocer las metodologías y procedimientos microbiológicos
FICHAS DE PRÁCTICAS DE BIOLOGÍA 4º ESO BIOLOGÍA
 FICHAS DE PRÁCTICAS DE BIOLOGÍA 4º ESO BIOLOGÍA UNIDAD DIDÁCTICA : CÉLULAS Y TEJIDOS 01.- Células animales y vegetales Duración Estimada: 1h 40 min Capacidad Terminal Observación de células animales y
FICHAS DE PRÁCTICAS DE BIOLOGÍA 4º ESO BIOLOGÍA UNIDAD DIDÁCTICA : CÉLULAS Y TEJIDOS 01.- Células animales y vegetales Duración Estimada: 1h 40 min Capacidad Terminal Observación de células animales y
SEMANA 29 PROPIEDADES FÍSICAS Y QUÍMICAS DE AMINOÁCIDOS Y PROTEÍNAS Elaborado por Lic. Fernando Andrade
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO PRACTICA DE LABORATORIO 2014 SEMANA 29 PROPIEDADES FÍSICAS Y QUÍMICAS DE AMINOÁCIDOS Y PROTEÍNAS
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO PRACTICA DE LABORATORIO 2014 SEMANA 29 PROPIEDADES FÍSICAS Y QUÍMICAS DE AMINOÁCIDOS Y PROTEÍNAS
Técnicas de Estudio de las células
 Técnicas de Estudio de las células Microscopia Preparaciones permanentes: Fijación Deshidratación Inclusión Corte Fijación: Acidos, solventes orgánicos como alcohol, aldehídos (Formaldehído, glutaraldehídos)
Técnicas de Estudio de las células Microscopia Preparaciones permanentes: Fijación Deshidratación Inclusión Corte Fijación: Acidos, solventes orgánicos como alcohol, aldehídos (Formaldehído, glutaraldehídos)
LABORATORIO No.3 OBSERVACIÓN DE CÉLULAS VEGETALES Y DIFERENCIACIONES CITOPLASMATICAS
 LABORATORIO No.3 OBSERVACIÓN DE CÉLULAS VEGETALES Y DIFERENCIACIONES CITOPLASMATICAS INTRODUCCIÓN En el universo biológico se encuentran dos tipos de células: procariotas y eucariotas. Estas últimas a
LABORATORIO No.3 OBSERVACIÓN DE CÉLULAS VEGETALES Y DIFERENCIACIONES CITOPLASMATICAS INTRODUCCIÓN En el universo biológico se encuentran dos tipos de células: procariotas y eucariotas. Estas últimas a
La célula procariota. Organelas: Golgi, REL; REG Ribosomas 80 S Pared: solo vegetales (celulosa) y hongos (quitina, y/o HdC)
 Nucleo verdadero (cromosomas; membrana nuclear, histonas) División : mitosis y meiosis (centríolos y microtúbulos) Tamaño Citocromo oxidasa en mitocondrias Organelas: Golgi, REL; REG Ribosomas 80 S Pared:
Nucleo verdadero (cromosomas; membrana nuclear, histonas) División : mitosis y meiosis (centríolos y microtúbulos) Tamaño Citocromo oxidasa en mitocondrias Organelas: Golgi, REL; REG Ribosomas 80 S Pared:
PLANIFICACIÓN DE ASIGNATURA
 PLANIFICACIÓN DE ASIGNATURA I IDENTIFICACION GENERAL DE LA ASIGNATURA CARRERA BIOQUIMICA DEPARTAMENTO BIOLOGIA ASIGNATURA BIOLOGIA MOLECULAR II CÓDIGO 1681 PRERREQUISITOS Biología Molecular I CREDITOS
PLANIFICACIÓN DE ASIGNATURA I IDENTIFICACION GENERAL DE LA ASIGNATURA CARRERA BIOQUIMICA DEPARTAMENTO BIOLOGIA ASIGNATURA BIOLOGIA MOLECULAR II CÓDIGO 1681 PRERREQUISITOS Biología Molecular I CREDITOS
UNIVERSIDAD AUTÓNOMA CHAPINGO DEPARTAMENTO DE INGENIERÍA AGROINDUSTRIAL FICHA CURRICULAR
 UNIVERSIDAD AUTÓNOMA CHAPINGO DEPARTAMENTO DE INGENIERÍA AGROINDUSTRIAL FICHA CURRICULAR 1. Datos Generales: Departamento Nombre del Programa Licenciatura Línea curricular Tecnológica Asignatura Biología
UNIVERSIDAD AUTÓNOMA CHAPINGO DEPARTAMENTO DE INGENIERÍA AGROINDUSTRIAL FICHA CURRICULAR 1. Datos Generales: Departamento Nombre del Programa Licenciatura Línea curricular Tecnológica Asignatura Biología
1. Contaminación de agua y alimentos por microorganismos patógenos 1
 INTRODUCCIÓN GENERAL 1. Contaminación de agua y alimentos por microorganismos patógenos 1 2. Papel del agua en la transmisión de enfermedades infecciosas 2 2.1. Las aguas residuales 2 2.2. El agua potable
INTRODUCCIÓN GENERAL 1. Contaminación de agua y alimentos por microorganismos patógenos 1 2. Papel del agua en la transmisión de enfermedades infecciosas 2 2.1. Las aguas residuales 2 2.2. El agua potable
PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS. Es un ácido capaz de formar sales con iones cargados
 Extracción de ADN Genética molecular PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS Es un ácido capaz de formar sales con iones cargados positivamente (cationes). Es soluble en soluciones concentradas
Extracción de ADN Genética molecular PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS Es un ácido capaz de formar sales con iones cargados positivamente (cationes). Es soluble en soluciones concentradas
SEMANA 29 PROPIEDADES FÍSICAS Y QUÍMICAS DE AMINOÁCIDOS Y PROTEÍNAS Elaborado por Lic. Fernando Andrade
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO PRACTICA DE LABORATORIO 2016 SEMANA 29 PROPIEDADES FÍSICAS Y QUÍMICAS DE AMINOÁCIDOS Y PROTEÍNAS
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO PRACTICA DE LABORATORIO 2016 SEMANA 29 PROPIEDADES FÍSICAS Y QUÍMICAS DE AMINOÁCIDOS Y PROTEÍNAS
IV Curso Avanzado WHO GSS 2006 Buenos Aires 15 al 24 de mayo de 2006
 IV Curso Avanzado WHO GSS 2006 Buenos Aires 15 al 24 de mayo de 2006 REACCION EN CADENA DE LA POLIMERASA (PCR) EN EL DIAGNOSTICO DE Campylobacter jejuni/coli Viernes 19 de mayo María Rosa Viñas Servicio
IV Curso Avanzado WHO GSS 2006 Buenos Aires 15 al 24 de mayo de 2006 REACCION EN CADENA DE LA POLIMERASA (PCR) EN EL DIAGNOSTICO DE Campylobacter jejuni/coli Viernes 19 de mayo María Rosa Viñas Servicio
Células. 2ª Parte: Células procariotas. Tema 13 de Biología NS Diploma BI Curso
 Células 2ª Parte: Células procariotas Tema 13 de Biología NS Diploma BI Curso 2012-2014 Estructura de la célula procariota: Escherichia coli Las bacterias son las células procariotas típicas. Tienen pequeño
Células 2ª Parte: Células procariotas Tema 13 de Biología NS Diploma BI Curso 2012-2014 Estructura de la célula procariota: Escherichia coli Las bacterias son las células procariotas típicas. Tienen pequeño
Protocolos Laboratorio de Microbiología Experimental 2014 PREPARACIONES MICROBIOLÓGICAS
 PREPARACIONES MICROBIOLÓGICAS Objetivos PREPARACIONES HÚMEDAS (EN FRESCO) Al finalizar esta práctica el alumno será capaz de: Realizar diferentes preparaciones microbiológicas a partir de muestras naturales.
PREPARACIONES MICROBIOLÓGICAS Objetivos PREPARACIONES HÚMEDAS (EN FRESCO) Al finalizar esta práctica el alumno será capaz de: Realizar diferentes preparaciones microbiológicas a partir de muestras naturales.
La célula procariota. Organelas: Golgi, REL; REG Ribosomas 80 S Pared: solo vegetales (celulosa) y hongos (quitina, y/o HdC)
 Nucleo verdadero (cromosomas; membrana nuclear, histonas) División : mitosis y meiosis (centríolos y microtúbulos) Tamaño Citocromo oxidasa en mitocondrias Organelas: Golgi, REL; REG Ribosomas 80 S Pared:
Nucleo verdadero (cromosomas; membrana nuclear, histonas) División : mitosis y meiosis (centríolos y microtúbulos) Tamaño Citocromo oxidasa en mitocondrias Organelas: Golgi, REL; REG Ribosomas 80 S Pared:
COLEGIO DE BACHILLERES DEL ESTADO DE TLAXCALA DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS BIOLOGÍA I ACTIVIDAD EXPERIMENTAL NUM
 DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS BIOLOGÍA I ACTIVIDAD EXPERIMENTAL NUM. 2 ESTRUCTURA CELULAR (BLOLQUE III) INTRODUCCIÓN La célula es la unidad anatómica y fisiológica de los
DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS BIOLOGÍA I ACTIVIDAD EXPERIMENTAL NUM. 2 ESTRUCTURA CELULAR (BLOLQUE III) INTRODUCCIÓN La célula es la unidad anatómica y fisiológica de los
EXTRACCIÓN DE ADN DE HONGOS FILAMENTOSOS
 EXTRACCIÓN DE ADN DE HONGOS FILAMENTOSOS Los hongos poseen un genoma complejo consistente en: ADN nuclear (n ADN) ADN mitocondrial (mt ADN) en algunos casos ADN plasmídico EXTRACCIÓN DE ADN DE HONGOS FILAMENTOSOS
EXTRACCIÓN DE ADN DE HONGOS FILAMENTOSOS Los hongos poseen un genoma complejo consistente en: ADN nuclear (n ADN) ADN mitocondrial (mt ADN) en algunos casos ADN plasmídico EXTRACCIÓN DE ADN DE HONGOS FILAMENTOSOS
Transferencia de material genético II. 1) Aislamiento de plásmidos Lisis alcalina
 Transferencia de material genético II 1) Aislamiento de plásmidos Lisis alcalina ESQUEMA GENERAL SESIÓN I: TRANSFORMAR cepas de E. coli con un plásmido. Verificar que hay células transformantes de acuerdo
Transferencia de material genético II 1) Aislamiento de plásmidos Lisis alcalina ESQUEMA GENERAL SESIÓN I: TRANSFORMAR cepas de E. coli con un plásmido. Verificar que hay células transformantes de acuerdo
PRÁCTICO N 4 CARBOHIDRATOS
 PRÁCTICO N 4 CARBOHIDRATOS I. INTRODUCCIÓN. Los compuestos químicos de la célula se clasifican en dos grandes grupos: moléculas inorgánicas y moléculas orgánicas. Las primeras se caracterizan por la ausencia
PRÁCTICO N 4 CARBOHIDRATOS I. INTRODUCCIÓN. Los compuestos químicos de la célula se clasifican en dos grandes grupos: moléculas inorgánicas y moléculas orgánicas. Las primeras se caracterizan por la ausencia
Cultivo Puro. Técnicas de aislamiento Mantenimiento y preservación de cultivos puros Morfología macroscópica Morfología microscópica
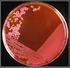 Cultivo Puro Técnicas de aislamiento Mantenimiento y preservación de cultivos puros Morfología macroscópica Morfología microscópica Definición El cultivo puro representa las condiciones artificiales para
Cultivo Puro Técnicas de aislamiento Mantenimiento y preservación de cultivos puros Morfología macroscópica Morfología microscópica Definición El cultivo puro representa las condiciones artificiales para
LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO.
 LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO. Prácticamente todos los elementos conocidos, metales y no metales, reaccionan o son oxidados por el oxígeno formando
LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO. Prácticamente todos los elementos conocidos, metales y no metales, reaccionan o son oxidados por el oxígeno formando
REACCIÓN EN CADENA DE LA POLIMERASA (PCR)
 REACCIÓN EN CADENA DE LA POLIMERASA (PCR) Microbiología General Microbiología M de los Alimentos Licenciatura en Bioquímica i Ingeniería en alimentos c Microbiología r 2015 Licenciatura en Biotecnología
REACCIÓN EN CADENA DE LA POLIMERASA (PCR) Microbiología General Microbiología M de los Alimentos Licenciatura en Bioquímica i Ingeniería en alimentos c Microbiología r 2015 Licenciatura en Biotecnología
PREPARACION DE MEDIOS DE CULTIVO
 PREPARACION DE MEDIOS DE CULTIVO MEDIOS DE CULTIVO Un medio de cultivo es un conjunto de nutrientes, factores de crecimiento y otros componentes que crean las condiciones necesarias para el desarrollo
PREPARACION DE MEDIOS DE CULTIVO MEDIOS DE CULTIVO Un medio de cultivo es un conjunto de nutrientes, factores de crecimiento y otros componentes que crean las condiciones necesarias para el desarrollo
Material elaborado por F. Agius, O. Borsani, P.Díaz, S. Gonnet, P. Irisarri, F. Milnitsky y J. Monza. Bioquímica. Facultad de Agronomía.
 AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO
 PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
Objetivos. S Determinar la presencia de bacterias coliformes en una muestra de agua
 Análisis del agua S Objetivos S Determinar la presencia de bacterias coliformes en una muestra de agua Introducción S Las tres pruebas básicas para determinar la presencia de bacterias coliformes (asociada
Análisis del agua S Objetivos S Determinar la presencia de bacterias coliformes en una muestra de agua Introducción S Las tres pruebas básicas para determinar la presencia de bacterias coliformes (asociada
3. Cubre la muestra con un cubreobjetos. El cubreobjeto debe estar plano.
 Laboratorio. Células de corcho y de cebolla PSI Biología Nombre Uno de los primeros científicos en observar las células bajo un microscopio fue un científico Inglés con el nombre de Robert Hooke. Él vio
Laboratorio. Células de corcho y de cebolla PSI Biología Nombre Uno de los primeros científicos en observar las células bajo un microscopio fue un científico Inglés con el nombre de Robert Hooke. Él vio
SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA
 PRÁCTICA Nº 3 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de diversas muestras problema. I. FUNDAMENTOS
PRÁCTICA Nº 3 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de diversas muestras problema. I. FUNDAMENTOS
MANUAL DE NORMAS Y PROCEDIMIENTOS PROCEDIMIENTO: OPERATIVOS DE ORINAS
 SERVICIO DE LABORATORIO 1 DE 5 1. OBJETIVO El objetivo del presente documento es describir el procedimiento para determinar las características físicas, química y microscópicas de muestras de orinas. 2.
SERVICIO DE LABORATORIO 1 DE 5 1. OBJETIVO El objetivo del presente documento es describir el procedimiento para determinar las características físicas, química y microscópicas de muestras de orinas. 2.
Por qué en un resultado positivo siempre cambia a amarillo intenso pero solo algunos emiten fluorescencia?
 Biología 3725 L COLILERT Por qué en un resultado positivo siempre cambia a amarillo intenso pero solo algunos emiten fluorescencia? ENTEROLERT Cuál es el propósito de utilizar enterolert, que nos dice
Biología 3725 L COLILERT Por qué en un resultado positivo siempre cambia a amarillo intenso pero solo algunos emiten fluorescencia? ENTEROLERT Cuál es el propósito de utilizar enterolert, que nos dice
OBJETIVO: -Identificar aminoácidos y proteínas por medio de métodos basados en reacciones químicas.
 Trabajo Práctico 4: PROTEINAS: Generalidades OBJETIVO: -Identificar aminoácidos y proteínas por medio de métodos basados en reacciones químicas. FUNDAMENTOS: Caracterización de las proteínas La caracterización
Trabajo Práctico 4: PROTEINAS: Generalidades OBJETIVO: -Identificar aminoácidos y proteínas por medio de métodos basados en reacciones químicas. FUNDAMENTOS: Caracterización de las proteínas La caracterización
PRACTICA No.9 REACCIONES QUIMICAS I
 PRACTICA No.9 REACCIONES QUIMICAS I INTRODUCCION: Las transformaciones de la materia se conocen como REACCIONES QUIMICAS. En ellas se opera un cambio en la estructura íntima de las sustancias reaccionantes
PRACTICA No.9 REACCIONES QUIMICAS I INTRODUCCION: Las transformaciones de la materia se conocen como REACCIONES QUIMICAS. En ellas se opera un cambio en la estructura íntima de las sustancias reaccionantes
 TRABAJO PRÁCTICO N 2 CAMBIOS DE ESTADO SÓLIDO LÍQUIDO GASEOSO Manteniendo constante la presión, a baja temperatura los cuerpos se presentan en forma sólida tal que los átomos se encuentran entrelazados
TRABAJO PRÁCTICO N 2 CAMBIOS DE ESTADO SÓLIDO LÍQUIDO GASEOSO Manteniendo constante la presión, a baja temperatura los cuerpos se presentan en forma sólida tal que los átomos se encuentran entrelazados
TEMA 3 EL DIAGNÓSTICO MICROBIOLÓGICO
 TEMA 3 EL DIAGNÓSTICO MICROBIOLÓGICO FUNDAMENTOS DEL DIAGNÓSTICO DE LAS INFECCIONES DE VIAS URINARIAS METODOLOGÍA UTILIZADA PARA EL DIAGNÓSTICO DE INFECCION URINARIA DIAGNÓSTICO MICROBIOLÓGICO DIAGNOSTICO
TEMA 3 EL DIAGNÓSTICO MICROBIOLÓGICO FUNDAMENTOS DEL DIAGNÓSTICO DE LAS INFECCIONES DE VIAS URINARIAS METODOLOGÍA UTILIZADA PARA EL DIAGNÓSTICO DE INFECCION URINARIA DIAGNÓSTICO MICROBIOLÓGICO DIAGNOSTICO
Universidad de Buenos Aires, Facultad de Medicina. Departamento de Microbiología, Parasitología e Inmunología. Cátedra 1 Microbiología II
 Universidad de Buenos Aires, Facultad de Medicina Departamento de Microbiología, Parasitología e Inmunología Cátedra 1 Microbiología II Teórico 1 Diagnóstico Bacteriológico Cristina Cerquetti ccerquetti@yahoo.com.ar
Universidad de Buenos Aires, Facultad de Medicina Departamento de Microbiología, Parasitología e Inmunología Cátedra 1 Microbiología II Teórico 1 Diagnóstico Bacteriológico Cristina Cerquetti ccerquetti@yahoo.com.ar
INFORME LABORATORIO, QUÍMICA ORGANICA DEYMER GÓMEZ CORREA FERNEY OSORIO BARAHONA DEISY CAROLINA CORDOBA (JUEVES 10-1)
 INFORME LABORATORIO, QUÍMICA ORGANICA DEYMER GÓMEZ CORREA FERNEY OSORIO BARAHONA DEISY CAROLINA CORDOBA (JUEVES 10-1) PROPIEDADES QUIMICAS DE LOS ALCOHOLES Y FENOLES PROFESORA SOL HELENA GIRALDO UNIVERSIDAD
INFORME LABORATORIO, QUÍMICA ORGANICA DEYMER GÓMEZ CORREA FERNEY OSORIO BARAHONA DEISY CAROLINA CORDOBA (JUEVES 10-1) PROPIEDADES QUIMICAS DE LOS ALCOHOLES Y FENOLES PROFESORA SOL HELENA GIRALDO UNIVERSIDAD
ANATOMIA PATOLOGICA Página 1 de 16. Instrucción técnica
 PATOLOGICA Página 1 de 16 Modificaciones Revisión Fecha Descripción A 15/07/09 Primera edición Preparado Revisado Aprobado Nombre: Magdalena García Bonafé Cargo: Jefe de Servicio A. Patológica Fecha: 15/07/09
PATOLOGICA Página 1 de 16 Modificaciones Revisión Fecha Descripción A 15/07/09 Primera edición Preparado Revisado Aprobado Nombre: Magdalena García Bonafé Cargo: Jefe de Servicio A. Patológica Fecha: 15/07/09
DIVISIÓN DE INGENIERÍA MECATRÓNICA
 DIRECCIÓN ACADÉMICA DIVISIÓN DE INGENIERÍA MECATRÓNICA QUIMICA PRACTICA NO. NOMBRE DE LA RÁCTICA. GRUPO: EQUIPO: ALUMNOS: PRACTICA No. 4 REACCIONES QUÍMICA COMPETENCIA ESPECÍFICA: Diferenciar prácticamente
DIRECCIÓN ACADÉMICA DIVISIÓN DE INGENIERÍA MECATRÓNICA QUIMICA PRACTICA NO. NOMBRE DE LA RÁCTICA. GRUPO: EQUIPO: ALUMNOS: PRACTICA No. 4 REACCIONES QUÍMICA COMPETENCIA ESPECÍFICA: Diferenciar prácticamente
SEMANA 25 PROPIEDADES QUÍMICAS Y FÍSICAS DE CARBOHIDRATOS Elaborado por: Licda. Vivian Margarita Sánchez Garrido
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS-CUM UNIDAD DIDÁCTICA QUÍMICA- PRIMER AÑO PRÁCTICAS DE LABORATORIO 2016 SEMANA 25 PROPIEDADES QUÍMICAS Y FÍSICAS DE CARBOHIDRATOS Elaborado
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS-CUM UNIDAD DIDÁCTICA QUÍMICA- PRIMER AÑO PRÁCTICAS DE LABORATORIO 2016 SEMANA 25 PROPIEDADES QUÍMICAS Y FÍSICAS DE CARBOHIDRATOS Elaborado
TEORÍA CELULAR. Matias Schleiden (1838) y Theodore Schwann (1839) LA CÉLULA ES LA UNIDAD FUNDAMENTAL DE TODOS LOS ORGANISMOS.
 TEORÍA CELULAR BIOLOGÍA CELULAR Matias Schleiden (1838) y Theodore Schwann (1839) LA CÉLULA ES LA UNIDAD FUNDAMENTAL DE TODOS LOS ORGANISMOS. En 1855 Rudolph Virchow: 1) Cada organismo vivo está formado
TEORÍA CELULAR BIOLOGÍA CELULAR Matias Schleiden (1838) y Theodore Schwann (1839) LA CÉLULA ES LA UNIDAD FUNDAMENTAL DE TODOS LOS ORGANISMOS. En 1855 Rudolph Virchow: 1) Cada organismo vivo está formado
LA NUEVA BIOTECNOLOGÍA
 LA NUEVA BIOTECNOLOGÍA Ingeniería genética: técnicas que permiten manipular la información genética de un ser vivo. TECNOLOGÍA TRADICIONAL DEL ADN RECOMBINANTE CLONACIÓN DE GENES: Obtención de muchas copias
LA NUEVA BIOTECNOLOGÍA Ingeniería genética: técnicas que permiten manipular la información genética de un ser vivo. TECNOLOGÍA TRADICIONAL DEL ADN RECOMBINANTE CLONACIÓN DE GENES: Obtención de muchas copias
TEMA 9. Métodos ópticos para el diagnóstico de laboratorio de enfermedades infecciosas
 TEMA 9 Métodos ópticos para el diagnóstico de laboratorio de enfermedades infecciosas Tema 9. Métodos ópticos para el diagnóstico de laboratorio de enfermedades infecciosas 1. Examen microscópico del material
TEMA 9 Métodos ópticos para el diagnóstico de laboratorio de enfermedades infecciosas Tema 9. Métodos ópticos para el diagnóstico de laboratorio de enfermedades infecciosas 1. Examen microscópico del material
MACROMOLECULAS NATURALES
 MACROMOLECULAS NATURALES NOMBRE DEL ALUMNO: PROFESOR: GRUPO: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeño y habilidades: 1. Identifica problemas, formula preguntas de carácter científico
MACROMOLECULAS NATURALES NOMBRE DEL ALUMNO: PROFESOR: GRUPO: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeño y habilidades: 1. Identifica problemas, formula preguntas de carácter científico
Los Microorganismos PROFESORA LUCÍA MUÑOZ ROJAS
 Los Microorganismos PROFESORA LUCÍA MUÑOZ ROJAS Qué son? 1. Seres vivos microscópicos que sólo son visibles usando microscopios. Su tamaño se mide en nanómetros, micrómetros o micras. 2. En su mayoría
Los Microorganismos PROFESORA LUCÍA MUÑOZ ROJAS Qué son? 1. Seres vivos microscópicos que sólo son visibles usando microscopios. Su tamaño se mide en nanómetros, micrómetros o micras. 2. En su mayoría
