En función del número de aminoácidos podemos tener:
|
|
|
- Benito Castellanos Correa
- hace 6 años
- Vistas:
Transcripción
1 TEMA 5. LAS PROTEÍNAS 1. DEFINICIÓN DE PROTEÍNAS 2. AMINOACIDOS: a. ESTRUCTURA b. CLASIFICACION c. PROPIEDADES 3. ENLACE PEPTIDICO 4. PEPTIDOS Y PROTEÍNAS 5. ESTRUCTURA DE LAS PROTEINAS 5.1 Estructura primaria 5.2 Estructura secundaria 5.3 Estructura terciaria 5.4 Estructura cuaternaria 6. PROPIEDADES DE LAS PROTEÍNAS 7. CLASIFICACIÓN DE LAS PROTEÍNAS 8. FUNCIONES PROTEÍNAS 1. DEFINICIÓN DE PROTEÍNAS Son moléculas orgánicas formadas por C, H, O, N, y en menor proporción por S y P. Son las moléculas que mayor número de funciones realizan en los seres vivos. Son las biomoléculas- después del agua más abundantes en los seres vivos, ya que si, eliminamos el agua, las proteinas constituyen el 50% del peso seco de un organismo. Las proteinas son polimeros lineales formadas por subunidades, los α- aminoácidos. La unión entre ellos se establece mediante un enlace típico, el enlace peptidico, liberando una molécula de agua y formando un peptido. En función del número de aminoácidos podemos tener: - Oligopéptidos (menos de 10 aminoácidos) - Polipéptidos (12-60 aminoácidos) - Proteínas (más de 60 aminoácidos) Las proteínas se pueden clasificar de la siguiente manera:
2 Las proteínas tienen gran diversidad debido al número y disposición que puedan adoptar los diferentes aminoácidos en la cadena de la proteína y que formaran la mayoría de los seres vivos. Una característica fundamental de las proteínas es su especificidad, lo cual quiere decir que cada organismo posee algunas proteínas exclusivas que marcan su identidad biológica 2. AMINOÁCIDOS a. ESTRUCTURA Los aminoácidos son las unidades básicas de las cadenas polipeptídicas. Se caracterizan por poseer un grupo carboxilo (-COOH); un grupo amino (-NH2); un atomo de H y un radical o cadena lateral unidos a un carbono central que ocupa la posición Los seres autótrofos pueden sintetizar todos los aminoácidos a partir de compuestos inorgánicos. Los heterótrofos solamente pueden sintetizar algunos aminoácidos a partir de otros compuestos orgánicos, el resto los tienen que tomar necesariamente formando parte de las proteínas de la dieta. A estos aminoácidos que no pueden sintetizar se les denomina aminoácidos esenciales. Son aminoácidos esenciales para el hombre: valina, leucina, isoleucina, metionina, fenilalanina, treonina, triptófano, lisina y en los niños además la histidina. A los aminoácidos se les suele designar de forma genérica por aa y de forma concreta con el nombre completo o mediante tres letras que suelen ser las tres primeras del nombre.
3 En la naturaleza existen unos 150 aminoácidos que no forman proteínas, pero que tienen funciones propias, como algunos neurotransmisores (acido γ-aminobutirico), ciertos precursores de vitaminas o moléculas que participan en determinadas reacciones químicas. Las proteínas se forman por la combinación de 20 aminoácidos distintos, llamados aminoácidos proteicos. Nuestro cuerpo fabrica sus propias proteínas a partir de esos 20 aminoácidos, por lo que no hay ninguna proteína que resulte esencial e imprescindible en la dieta; pero, en cambio, existen algunos aminoácidos que el organismo no puede sintetizar por si mismo, por lo que deben estar incluidos en la alimentación, se denominan aminoacidos esenciales y son los siguientes: Valina (val); Leucina (leu); Isoelucina (ile); Metionina (met); Fenilalanina ( phe); treonina (thr); triptofano (trp); Lisina (lys) y dos más durante la infancia (histidina y arginina) Cuando los aa se encuentran en agua estos se presentan ionizados, con su funcion carboxilo que ha perdido un ion hidrógeno y su función amino que ha ganado un ion hidrógeno, de tal manera que se encuentran en estado de ion híbrido, que se denominan formas zwitterionicas, a ph neutro el aa tiene carga neta cero (sin tener en cuenta R) b. ESTRUCTURA Dependiendo de la carga de la cadena lateral R, los aminoácidos se clasifican de la siguiente manera: 1. No polares o hidrofóbicos. La cadena R es una cadena hidrocarbonada, y por tanto, hidrófoba: Alanina (Ala), Valina (Val), Leucina (Leu), Isoleucina (Ile), Metionina (Met), Fenilalanina (Phe), Prolina (Pro), Triptófano: 2. Polares sin carga. La cadena lateral R puede formar puentes de hidrógeno con el agua. Glicina (Gly), Serina (Ser), Treonina (Thr), Cisteína (Cys), Asparagina (Asn), Glutamina (Gln), Tirosina (Tyr) 3. Polares con carga negativa, ácidos. El radical R tiene un grupo ácido carboxilo Aspártico (Asp) y Glutámico (Glu)
4 4. Polares con carga positiva, básicos. El radical R tiene un grupo básico, como un amino.: Lisina (Lys), Arginina (Arg) e Histidina (His)
5 c. PROPIEDADES AMINOÁCIDOS Los aminoácidos son compuestos orgánicos sencillos de bajo peso molecular, son sólidos, solubles en agua, cristalizables, incoloros, con un punto de fusión elevado (más de 200 ºC), presentan esteroisomería, actividad óptica y comportamiento anfótero. 1 Esteroisomería: Todos los aminoácidos excepto la glicina o glicocola poseen un carbono asimétrico, el C. Esto hace que presenten esteroisomería, cada aminoácido posee dos esteroisómeros según como sea la colocación del grupo NH2. Si el grupo NH2 se sitúa a la derecha tendrá configuración D, si se sitúa a la izquierda tendrá configuración L. Los aminoácidos que forman las proteínas son todos de configuración L.
6 H HOOC C NH2 R D - - aminoácido H 2HN - C COOH R L - - aminoácido 2.Actividad óptica: La presencia del carbono asimétrico, además les da actividad óptica, es decir en disolución son capaces de desviar el plano de polarización de la luz. Si lo desvían hacia la derecha (+) se llaman dextrógiros, si lo desvían hacia la izquierda (-) levógiros. 3.Comportamiento químico: Los aminoácidos son sustancias anfóteras, esto quiere decir que en disolución acuosa se pueden comportar como ácidos y como bases dependiendo del ph de la disolución, esto es debido la presencia del grupo carboxílico que tiene carácter ácido y del grupo amino que tiene carácter básico. Cuando están en disolución acuosa a ph próximo a la neutralidad los aminoácidos están ionizados formando iones dipolares o híbridos, esto es así porque el grupo carboxílico pierde un protón (actúa como ácido) y el grupo amino gana un protón (actúa como base). En algunos aminoácidos en las cadenas laterales existen otros grupos aminos y carboxílicos que también se ionizan. COO - COO - COOH ph>7 ph<7 H - C NH H - C NH H - C NH3 + H + H + R R R ph= 7 Si disminuye el ph, el medio se hace ácido, aumenta la concentración de H +. El aminoácido tiende a neutralizar la acidez captando H + y se carga positivamente, se comporta como base. Si aumenta el ph el medio se hace básico, disminuye la concentración H +. El aminoácido tiende a neutralizar la basicidad, libera protones y se carga negativamente, se comporta como un ácido. El ph en el cual el aminoácido tiene forma dipolar neutra, es decir esta ionizado pero tiene igual número de cargas + que -, se denomina punto isoeléctrico se representa por pi. Cuanto en el medio el ph > pi el aminoácido se carga negativamente. Cuando el ph < pi el aminoácido se carga positivamente 3. ENLACE PEPTÍDICO El enlace peptídico es el enlace que une entre sí a los aminoácidos para formar los péptidos y las proteínas. Se forma entre el grupo carboxílico de un aminoácido y el grupo amino del siguiente, liberándose en su formación una molécula de agua.
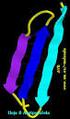
7 Las características del enlace peptídico son las siguientes : Es un enlace covalente tipo amida (CO-NH) Tiene carácter parcial de doble enlace, esto hace que sea rígido no permitiendo rotaciones entre los átomos que lo forman. Por ello el C y el N así como el O y el H (los átomos implicados en el enlace peptídico) se encuentran en un mismo plano. Los enlaces restantes - del C (CCcarboxilico y NC ) sí que pueden girar. 4. PEPTIDOS Y PROTEINAS Péptidos: Son compuestos que al igual que las proteínas están formados por aminoácidos que se unen mediante enlaces peptídicos. Se pueden obtener por hidrólisis parcial de las proteínas, aunque también existen péptidos naturales (insulina, oxitocina, etc) que desempeñan funciones importantes. Según el número de aminoácidos que los forman se dividen en dos grupos: Oligopéptidos están formados por entre 2 y 10 aminoácidos. A cada grupo se le nombra anteponiendo al término péptido un prefijo (di, tri, tetra, etc) que nos indica el número de aminoácidos que contienen. Polipéptido si contienen más de 10 aminoácidos. Proteínas: Son polipétidos en los que el peso molecular es mayor de u.m.a. Algunas proteínas están formadas por varias cadenas de polipéptidos. 5. ESTRUCTURA DE LAS PROTEINAS Las proteínas podemos definirlas como largas cadenas polipeptídicas (a veces una sola) que presentan una determinada configuración espacial denominada conformación nativa. La función que desempeñan depende de esta forma que adoptan en el espacio. La configuración espacial de las proteínas viene determinada por 4 niveles estructurales o estructuras: primaria, secundaria, terciaria, cuaternaria Estructura primaria Es la secuencia de aminoácidos de la proteína. Nos indica que aminoácidos componen la cadena y el orden en el que dichos aminoácidos se encuentran. Esta estructura viene determinada genéticamente y de ella dependen las demás estructuras. Cualquier cambio en la secuencia daría lugar a proteínas diferentes. La cadena peptídica posee un eje formado por: el carbono, el carbono carboxílico y el nitrógeno amino ( CH CO NH -) que se repiten un número variable de veces, este eje se dispone en zig-zag debido a la capacidad de rotación de los enlaces del carbono. Las cadenas laterales de los aminoácidos (R) salen de los C y se disponen alternativamente a uno y otro lado del eje. Todas las cadena llevan en un extremo un aminoácido con el grupo amino libre, a este extremo se le llama N-terminal y en el otro extremo un aminoácido con el grupo carboxílico libre, a este extremo se le llama C-terminal. Por convenio los aminoácidos se numeran desde el extremo N-terminal hacia el C-terminal Estructura secundaria Es la disposición espacial que presenta la cadena de aminoácidos (estructura primaria). Se produce gracias a la capacidad que tienen los enlaces del C para rotar. Existen principalmente dos tipos de estructura secundaria:
8 - - hélice o helicoidal - Lamina- ß o lámina plegada. -hélice: Se forma al enrollarse la cadena peptídica sobre sí misma siguiendo el sentido de las agujas del reloj (dextrógira) originando una hélice apretada (especie de tirabuzón). Cada vuelta de hélice comprende 3.6 aminoácidos, la distancia entre cada vuelta es de 5,4 A. En esta configuración las cadenas laterales de los aminoácidos se dirigen hacia el exterior de la hélice. Esta estructura se mantiene gracias a enlaces por puentes de hidrógeno que se establecen entre grupos NH y grupos CO de enlaces peptídicos diferentes que debido al enrollamiento se encuentran enfrentados. Puede presentarse tanto en proteínas globulares como fibrosas. Lámina- o lámina plegada. Esta estructura se produce cuando varios fragmentos polipeptídicos de la misma o de distintas cadenas se disponen paralelos o antiparalelos unos a otros en zig-zag (debido al plegamiento que ocurre a nivel del C ). El sentido de los fragmentos es paralelo si tienen el mismo sentido y antiparalelo si tienen distinto sentido. Esta estructura se mantiene gracias a enlaces por puentes de hidrógeno entre segmentos contiguos, que se establecen entre grupos NH y grupos CO de enlaces peptídicos distintos que quedan enfrentados. Como consecuencia se forma una lamina en zig-zag o lamina plegada. En ella los restos de los aminoácidos se disponen alternativamente a uno y otro lado de la misma. La lámina aparece en muchas regiones de proteínas globulares y también en proteínas estructurales como la fibroína de la seda Estructura terciaria Es la disposición que adopta por el plegamiento la estructura secundaria en el espacio, por consiguiente nos indica como es la configuración tridimensional de toda la molécula. A esta configuración tridimensional se la denomina conformación. La estructura terciaria se mantiene gracias a diferentes enlaces que se establecen principalmente entre los restos de los aminoácidos que forman la cadena peptídica. Los más importantes son: Puentes disulfuro. Es un enlace covalente que se da entre grupos SH pertenecientes a cadenas laterales del aminoácido cisteína Puentes de hidrógeno. Es un enlace débil se da entre grupos polares no iónicos (-OH, -NH, - CO), estos grupos pueden pertenecer a las cadenas laterales de los aminoácidos o a enlaces peptídicos distintos. Fuerzas electrostáticas. Es un enlace débil que se da entre grupos con carga opuesta que se encuentran en las cadenas laterales de los aminoácidos (-NH3 + -COO - ) Fuerzas de Van der Waals y enlaces hidrófobos. Son enlaces débiles que se dan entre grupos apolares hidrófobos (-CH3) de las cadenas laterales de los aminoácidos. Hay dos tipos de estructura terciaria -Conformación globular -Conformación filamentosa Conformación globular: La estructura secundaria se pliega y adopta una forma tridimensional compacta más o menos esférica de ahí su nombre. Estas proteínas son solubles en agua y en disoluciones salinas y desempeñan funciones dinámicas. Conformación filamentosa: Cuando la estructura secundaria no se repliega, por lo tanto la proteína tiene forma alargada. Estas proteínas son insolubles y desempeñan función estructural.
9 5.4. Estructura cuaternaria Sólo se presenta en aquellas proteínas que están formadas por más de una cadena polipeptídica. Esta estructura indica como se ensamblan entre sí las diferentes cadenas peptídicas para formar la proteína, a estas cadenas se las denomina subunidades o protómeros y pueden ser iguales o diferentes. A las proteína que tienen estructura cuaternaria se las denomina oligoméricas, y según el número de subunidades que las formen serán: dímeras, trímeras,... polímeras. Esta estructura se mantiene mediante enlaces similares a los que mantienen la estructura terciaria, estos enlaces se establecen entre las cadenas laterales de los aminoácidos pertenecientes a subunidades diferentes. 6. PROPIEDADES DE LAS PROTEINAS Las proteínas tienen una serie de propiedades que dependen principalmente de los restos de los aminoácidos que las forman, de su capacidad para reaccionar con otros radicales y con el medio que les rodea. Las principales propiedades son: 1Comportamiento químico Las proteínas al igual que los aminoácidos son anfóteras, es decir se pueden comportar como ácidos y como bases dependiendo del ph del medio, esto es debido a la presencia de aminoácidos con grupos ionizables, que pueden captar y ceder H +, como consecuencia pueden amortiguar las variaciones de ph. 2.Solubilidad La solubilidad depende de diversos factores como: ph, conformación, disposición de los restos, etc. Las proteínas que tienen conformación filamentosa son insolubles mientras, que las que tienen conformación globular son solubles en agua. Debido al elevado peso molecular que suelen tener forman dispersiones coloidales. La solubilidad se debe a los restos de los aminoácidos superficiales que forman la molécula de la proteína, que tienen grupos polares y grupos que se pueden ionizar, estos grupos establecen puentes de hidrógeno con el agua, formándose alrededor de la molécula de proteína una capa de moléculas de agua llamada capa de solvatación, que impide su unión con otras moléculas de proteínas. Si esta capa de solvatación se rompe, las moléculas de proteínas se unen entre sí formando un agregado insoluble y precipitan. Esto ocurre cuando se añaden iones (sales en disolución) que compiten con las cargas de los restos de los aminoácidos por unirse a las moléculas de agua de la capa de solvatación. 3.Especificidad Las proteínas que tienen los seres vivos son, en muchos casos, características de cada especie y diferentes a las de las demás especies, y aún dentro de una especie pueden variar de unos individuos a otros. Esto no ocurre con los lípidos y los glúcidos que son iguales en todos los seres vivos. La especificidad se debe a la ordenación de los aminoácidos. Las diferencias entre proteínas que realizan una misma función (homólogas) en individuos diferentes serán tanto mayores cuanto más alejados se encuentren esos individuos en la escala filogenética. Por lo tanto podemos decir que las proteínas son los compuestos que nos caracterizan a cada uno y nos diferencian de los demás.
10 La especificidad es importante, pues cuando una proteína de un organismo se introduce en otro, sin que haya existido digestión previa, actúa como un cuerpo extraño y el organismo que la recibe se defiende reaccionando contra ella. Esto es lo que ocurre en los rechazos de órganos. 4.Desnaturalización. Es el proceso mediante el cual las proteínas pierden su configuración espacial característica (conformación nativa) y como consecuencia pierden sus propiedades y dejan de realizar su función. Esto ocurre cuando la proteína se ve sometida a condiciones ambientales desfavorables tales como: variaciones de Tª, variaciones de ph, radiaciones U.V, etc ya que estos cambios producen la rotura de los enlaces: por puentes de hidrógeno, atracciones electrostáticas, puentes disulfuro etc, que mantienen las estructuras 2ª,3ª y 4ª mientras que los enlaces peptídicos no se ven afectados por consiguiente no se destruye la estructura 1ª. La desnaturalización provoca por lo general una disminución de la solubilidad y las proteínas precipitan, esto se debe a la perdida de la conformación globular que pasa a ser filamentosa. La desnaturalización puede ser: reversible o irreversible. a.reversible cuando las condiciones que la provocan son poco intensas o duran poco tiempo, en este caso cuando cesan, la proteína adopta de nuevo la configuración original. A este proceso se le denomina renaturalización. b.irreversible cuando los cambios que la producen son intensos y persistentes, en este caso cuando cesan, la proteína no recupera ya la configuración original. Ejemplos de desnaturalización: Formación del yogurt: acción de bacterias (fermentación láctica) Lactosa ácido láctico Variación ph Caseína de la leche se hace insoluble y precipita soluble desnaturalización formando el yogurt. 7. CLASIFICACION Las proteínas atendiendo a su composición se las divide en dos grupos: 1. Proteínas simples u holoproteínas: Son aquellas que están formadas únicamente por aminoácidos. 2. Proteínas conjugadas o heteroproteínas: Son aquellas que están formadas además de por aminoácidos, por otros compuestos no proteicos de distinta naturaleza que se denomina grupo prostético. Heteroproteína = parte proteica + grupo prostético
11 1.Proteínas simples u holoproteínas Se dividen en dos grupos según como sea su conformación. 1.1Proteínas globulares o esferoproteínas: Tienen conformación globular, son solubles en agua o en disoluciones polares, tienen gran actividad biológica. Dentro de este grupo tenemos: a.albúminas. Son solubles en agua y en disoluciones salinas. Tienen un peso molecular que oscila entre 30 y u.m.a. Intervienen en el transporte de otras moléculas: hormonas, ácidos grasos, cationes, etc, debido a la capacidad que tienen para unirse reversiblemente con ellas. Actúan como reserva de aminoácidos. Dentro de este grupo están: -Seroalbúmina: Se encuentra en el plasma sanguíneo, son las más abundantes de las proteínas plasmáticas. -Ovoalbúmina de la clara de huevo. -Lactoalbúmnia de la leche. b. Globulinas. Insolubles en agua pero solubles en disoluciones salinas. Tienen un peso molecular muy elevado de alrededor de Dentro este grupo están: -Seroglobulinas que se encuentran en la sangre como la -globulinas que forman parte de la hemoglobina, -globulinas forman parte de los anticuerpos. -Ovoglobulina que se encuentra en el huevo. -Lactoglobulina se encuentra en la leche. c.protaminas e histonas: Son proteínas básicas de bajo peso molecular. Se asocian a los ácidos nucleicos y forman parte de la cromatina. 1.2Proteínas filamentosa o escleroproteínas: Tienen conformación filamentosa, son insolubles en agua y muy resistentes a la acción de enzimas. Suelen tener función estructural. Las más importantes son: a. Colágenos: Están formadas por 3 cadenas polipeptídicas, ricas en prolina y glicina, que se enrollan helicoidalmente entre sí formando una triple hélice. Se encuentran en tejidos conjuntivos, cartilaginosos y óseos. Forman fibras muy resistentes a la tracción (tendones). b.elastinas: Están dotadas de elasticidad, por ello se encuentran en órganos sometidos a deformaciones reversibles tales como: paredes de vasos, pulmones etc. c. Queratinas: Son ricas en cisteína. Se encuentran en formaciones epidérmicas como pelos, uñas, plumas etc. d.actina y miosina que se encuentran en los músculos e intervienen en la contracción. e. Fibrina se obtiene a partir del fibrinógeno e interviene en la coagulación. 2. Proteínas conjugadas o heteroproteínas: Dentro de ellas atendiendo a la naturaleza del grupo prostético se pueden diferenciar varios tipos: 2.1 Cromoproteínas El grupo prostético es una molécula compleja coloreada debido a que posee dobles enlaces conjugados, por eso a estas proteínas se las denomina también pigmentos. Dentro de ellas se diferencian dos tipos atendiendo a la composición del grupo prostético. a. Porfirínicas: El grupo prostético es una metalporfirína, que es una molécula formada por un anillo tetrapirrólico o porfirina en cuyo interior existe un catión metálico. Dentro de este grupo destacan las siguientes: -Hemoglobina y mioglobina: En este caso a la metalporfirina se la denomina grupo hemo y lleva como catión metálico el ión Fe 2+, es de color rojo. La hemoglobina transporta el oxígeno en la sangre de los vertebrados y la mioglobina en los músculos.
12 -Citocromos: También contienen hierro que puede tomar o ceder electrones pasando de Fe 2+ a Fe 3+ y viceversa. Intervienen en las reacciones de oxido-reducción transportando electrones. b. No porfirínicas: El grupo prostético también es una molécula coloreada, tiene cationes metálicos pero no anillos pirrólicos. Destacan -Hemocianina: Es de color azul, contiene Cu 2+, es el pigmento respiratorio de moluscos y crustáceos. -Rodopsina: Esta presente en las células de la retina, necesaria para el proceso visual, ya que es la molécula que capta la luz. 2.2 Glucoproteínas: En este caso el grupo prostético es un glúcido. A este grupo pertenecen: -Gonadotropas: Hormonas producidas por la hipófisis que estimulan las gónadas. -Inmunoglobulinas o anticuerpos: Formadas por 4 cadenas polipeptídicas, 2 largas y 2 cortas que se unen con dos moléculas de glúcidos. -Mucoproteínas como las mucinas que tienen función lubricante y protectora. 2.3 Lipoproteínas: El grupo prostético es un lípido. Muchas forman parte de las membranas celulares; un grupo especial de lipoproteínas están presentes en el plasma y forman partículas hidrosolubles que se encargan de transportar lípidos insolubles (colesterol, triglicérido, etc) por el torrente sanguíneo, llevándolos desde el lugar de absorción el intestino hasta los tejidos de destino. Las lipoproteínas sanguíneas se clasifican en función de su densidad, que será tanto mayor cuanto menor es el contenido de lípidos, los principales grupos son -Quilomicrones: Se producen en las células del intestino a partir de los ácidos grasos y glicerina obtenidos en la digestión, transportan las grasas resultantes hasta el tejido adiposo y el hígado para almacenarse. -VLD (Lipoproteínas de muy baja densidad) transportan al tejido adiposo grasas formadas en el hígado. -LDL (Lipoproteína de baja densidad) se producen en el hígado. Transportan el colesterol, tanto el sintetizado en el hígado (endógeno) como el ingerido (exógeno) y gran parte de las grasas y fosfolípidos desde el hígado a los tejidos para que sea utilizado. Las LDL se fijan a receptores específicos de las membranas de las células diana y se engloban dentro de ellas por endocitosis, una vez dentro se destruyen dejando libre los lípidos. Si el colesterol se encuentra en grandes cantidades en las células se sintetizan menos receptores y como consecuencia no entra en las células y se deposita en la paredes arteriales internas formando placas denominadas ateromas que endurecen la pared arterial y reducen su luz, a esta enfermedad se la denomina arterioesclerosis. -HDL (Lipoproteínas de alta densidad) es el colesterol bueno. Se encarga de transportar el colesterol sobrante hasta el hígado para que allí sea metabolizado y excretado en la bilis. 2.4 Fosfoproteínas: El grupo prostético es el ácido ortofosfórico. A este grupo pertenece la caseína de la leche y la vitelina de la yema de huevo. 2.5 Nucleoproteínas: El grupo prostético son los ácidos nucleicos. Constituyen la cromatina y los cromosomas. 8. FUNCIONES DE LAS PROTEINAS Las proteínas desempeñan una gran variedad de funciones entre las cuales destacan las siguientes: 1.Función estructural. Las proteínas, sobre todo las filamentosas forman la mayoría de las estructuras tanto celulares como orgánicas. Así algunas glucoproteínas forman parte de las membranas celulares. Otras como tubulina, actina, etc forman los cilios, flagelos, citoesqueleto, etc. Las histonas forman parte de la cromatina y los cromosomas. El colágeno forma tendones,
13 cartílagos, huesos etc., la elastina forma parte paredes de ciertos órganos, la queratina constituye la mayoría de las formaciones epidérmicas como pelos, uñas plumas etc. 2.Función de reserva: Algunas proteínas como la ovoalbúmina de la clara de huevo, la caseína de la leche etc actúan como reserva de aminoácidos. 3.Función homeostática: Las proteínas contribuyen a mantener constantes las condiciones del medio interno. Intervienen en el mantenimiento del equilibrio osmótico y debido a su carácter anfótero actúan como sistemas amortiguadores de ph. 4.Función de transporte: Muchas proteínas se unen con otras moléculas e intervienen en su transporte. Así tenemos algunas proteínas de las membranas celulares (permeasas) que tienen como función transportar sustancias entre el exterior y el interior. Otras muchas proteínas extracelulares tienen como misión transportar diversas sustancias por el interior del organismo, así tenemos la hemoglobina que transporta el oxígeno en la sangre de los vertebrados, la hemocianina lo hace en algunos invertebrados, la mioglobina lo transporta en el músculo; los citocromos transportan electrones en la cadena respiratoria (mitocondrias) y en la fase luminosa de la fotosíntesis (cloroplastos); las lipoproteínas transportan colesterol, triglicéridos y otros lípidos; la seroalbúmina transporta ac.grasos, fármacos y otras sustancias en la sangre. 5.Función defensiva: Algunas proteínas realizan una función protectora para el organismo. Así tenemos la trombina y el fibrinógeno que intervienen en el proceso de coagulación impidiendo la perdida de sangre; las mucinas que tienen acción germicida y protectora de las mucosas. Pero la función defensiva más importante la realizan las inmunoglobulinas que constituyen los anticuerpos, estos se fabrican cuando en el organismo penetran sustancias extrañas (antígenos). Lo que hacen es reaccionar con ellos aglutinándolos y precipitándolos y como consecuencia los inactivan. 6.Función hormonal: Algunas hormonas son proteínas y actúan regulando diversos procesos metabólicos. Así tenemos la insulina y el glucagón regulan el metabolismo de los glúcidos; la parathormona regula metabolismo del Ca y del P; las hormonas producidas por la hipófisis etc. 7.Función contráctil: Los movimientos y la locomoción de los organismo tanto unicelulares como pluricelulares se deben a la acción de algunas proteínas. Así tenemos la actina y la miosina que forman las miofibrillas de los músculos y son las responsables de la contracción muscular; la dineína responsable del movimiento de cilios y flagelos, etc.. 8.Función catalítica: Algunas proteínas actúan catalizando (facilitando y acelerando) las reacciones que tienen lugar en los seres vivos, estas reacciones constituyen el metabolismo. Estas proteínas se denominan enzimas y constituyen el grupo más numeroso de proteínas y posiblemente el más importante.
Composición química de la materia viva. Componentes orgánicos. Proteínas
 Composición química de la materia viva. Componentes orgánicos. Proteínas Tema 1 parte 4 PROTEÍNAS: Concepto, clasificación (oligopéptidos, polipéptidos, holoproteínas, heteroproteínas). Aminoácidos: estructura
Composición química de la materia viva. Componentes orgánicos. Proteínas Tema 1 parte 4 PROTEÍNAS: Concepto, clasificación (oligopéptidos, polipéptidos, holoproteínas, heteroproteínas). Aminoácidos: estructura
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS. A.- Concepto de prótidos y clasificación B.-Los aminoácidos
 TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH)
 Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
TRABAJO SOBRE LAS PROTEÍNAS
 TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
Los monómeros de las proteínas
 Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
Proteínas. Características generales
 Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Holoproteínas (sólo contienen aa)
 TEMA 4: P ROTEÍNAS 1. Concepto y clasificación Las proteínas son biomoléculas orgánicas formadas por C, H, O, N y en menor medida P y S y otros elementos (Fe,Cu, Mg, ). Son polímeros no ramificados de
TEMA 4: P ROTEÍNAS 1. Concepto y clasificación Las proteínas son biomoléculas orgánicas formadas por C, H, O, N y en menor medida P y S y otros elementos (Fe,Cu, Mg, ). Son polímeros no ramificados de
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS
 EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
Tema 5: aminoácidos y proteínas
 1. Los aminoácidos 2. Propiedades de los aminoácidos 3. El enlace peptídico 4. Estructuras 1 aria y 2 aria de las proteínas 5. Estructuras 3 aria y 4 aria de las proteínas 6. Propiedades de las proteínas
1. Los aminoácidos 2. Propiedades de los aminoácidos 3. El enlace peptídico 4. Estructuras 1 aria y 2 aria de las proteínas 5. Estructuras 3 aria y 4 aria de las proteínas 6. Propiedades de las proteínas
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Proteínas.
 Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
CLASIFICACION POR LA CADENA LATERAL POR SU REQUERIMIENTO POR SU POLARIDAD. Esenciales No esenciales CADENA LATERAL CON GRUPO
 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
TEMA 2.- PROTEÍNAS. AMINOÁCIDOS
 TEMA 2.- PROTEÍNAS. AMINOÁCIDOS Diversidad estructural y funcional de las proteínas. Aminoácidos: características estructurales y clasificación. Aminoácidos estándares y derivados. Aminoácidos esenciales
TEMA 2.- PROTEÍNAS. AMINOÁCIDOS Diversidad estructural y funcional de las proteínas. Aminoácidos: características estructurales y clasificación. Aminoácidos estándares y derivados. Aminoácidos esenciales
Proteínas y Ácidos Nucleicos
 Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de
 Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
PROTEÍNAS. Las proteínas están constituidas por la unión de numerosas moléculas sencillas (monómeros) denominados aminoácidos.
 PROTEÍNAS 1. INTRODUCCIÓN Las proteínas son los constituyentes químicos fundamentales de la materia viva. Constituyen alrededor del 50% en peso seco del cuerpo. Los glúcidos y lípidos se encuentran en
PROTEÍNAS 1. INTRODUCCIÓN Las proteínas son los constituyentes químicos fundamentales de la materia viva. Constituyen alrededor del 50% en peso seco del cuerpo. Los glúcidos y lípidos se encuentran en
 Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
inactivación de materiales tóxicos o peligrosos, etc.).
 Proteínas Estructuras 1 Conceptos generales Las proteínas desempeñan papeles cruciales en prácticamente todos los procesos biológicos. El alcance de sus funciones es enorme, por un lado, forman parte de
Proteínas Estructuras 1 Conceptos generales Las proteínas desempeñan papeles cruciales en prácticamente todos los procesos biológicos. El alcance de sus funciones es enorme, por un lado, forman parte de
I) Biomoléculas 5) Proteínas I-5 PROTEÍNAS
 I-5 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
I-5 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
AMINOACIDOS Y PEPTIDOS. SEMANA 29 Licda. Lilian Judith Guzmán Melgar
 AMINOACIDOS Y PEPTIDOS SEMANA 29 Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los mas importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS SEMANA 29 Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los mas importantes en el mundo biológico son los α-aminoácidos,
5.1. CONCEPTO E IMPORTANCIA BIOLÓGICA DE LAS PROTEÍNAS
 5. PROTEINAS 5.1. CONCEPTO E IMPORTANCIA BIOLÓGICA DE LAS PROTEÍNAS Una proteína es un polipéptido formado por más de 50 aminoácidos. Los polipéptidos son polímeros de aminoácidos, unidos mediante enlaces
5. PROTEINAS 5.1. CONCEPTO E IMPORTANCIA BIOLÓGICA DE LAS PROTEÍNAS Una proteína es un polipéptido formado por más de 50 aminoácidos. Los polipéptidos son polímeros de aminoácidos, unidos mediante enlaces
Introducción al estudio de las proteínas
 Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
Conceptos básicos de biología molecular, I
 Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Tema 3. Tema 3. Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos. Péptidos
 Tema 3 Tema 3 Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos Enlace Peptídico Nomenclatura de péptidos Características estructurales del enlace peptídico Estéreoespecificidad
Tema 3 Tema 3 Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos Enlace Peptídico Nomenclatura de péptidos Características estructurales del enlace peptídico Estéreoespecificidad
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS
 PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
Estructura tridimensional de las proteínas
 Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo.
 1 OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo. 2 3 4 Son las moléculas que forman a los organismos o participan de su metabolismo. Orgánicas
1 OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo. 2 3 4 Son las moléculas que forman a los organismos o participan de su metabolismo. Orgánicas
Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas.
 Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica
 CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
Unidad 3: Organización molecular de la célula Proteínas
 Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Bloque I: Proteínas y enzimas
 Bloque I: Proteínas y enzimas 1. BASE FÍSICO-QUÍMICA DE LA VIDA PROTEÍNAS Y ENZIMAS CONTENIDOS 1.5. PROTEÍNAS 1.5.1. Concepto e importancia biológica. 1.5.2. Aminoácidos. Enlace peptídico. 1.5.3. Estructura
Bloque I: Proteínas y enzimas 1. BASE FÍSICO-QUÍMICA DE LA VIDA PROTEÍNAS Y ENZIMAS CONTENIDOS 1.5. PROTEÍNAS 1.5.1. Concepto e importancia biológica. 1.5.2. Aminoácidos. Enlace peptídico. 1.5.3. Estructura
Estructura y propiedades de las proteínas
 Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Clase 5. Los aminoácidos: Precursores de transmisores. Unidades de las proteínas. Las enzimas.
 Clase 5. Los aminoácidos: Precursores de transmisores. Unidades de las proteínas. Las enzimas. Los aminoácidos se clasifican en unas pocas categorías diferenciadas, basadas sobre todo en su solubilidad
Clase 5. Los aminoácidos: Precursores de transmisores. Unidades de las proteínas. Las enzimas. Los aminoácidos se clasifican en unas pocas categorías diferenciadas, basadas sobre todo en su solubilidad
Componentes químicos de
 Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA
 BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA Aminoácidos Es una molécula orgánica con un grupo amino (-NH 2 ) y un grupo carboxilo (- COOH). Los aminoácidos
BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA Aminoácidos Es una molécula orgánica con un grupo amino (-NH 2 ) y un grupo carboxilo (- COOH). Los aminoácidos
Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas.
 Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
TEORIA CELULAR. En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS
 TEORIA CELULAR En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS El nombre de célula significa celda, así las llamo Robert Hooke. En 1839 el zoólogo alemán Theodore Schwann
TEORIA CELULAR En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS El nombre de célula significa celda, así las llamo Robert Hooke. En 1839 el zoólogo alemán Theodore Schwann
Aminoácidos y péptidos
 Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
Profesor(a): C.D. María Isabel Pérez Aguilar
 Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
Composición química de los seres vivos
 Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Repaso: Química celular (biomoléculas)
 Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
Material elaborado por F. Agius, O. Borsani, P.Díaz, S. Gonnet, P. Irisarri, F. Milnitsky y J. Monza. Bioquímica. Facultad de Agronomía.
 AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS.
 REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS. PRESENTACIÓN Los animales incluyendo al hombre, recibimos pocas moléculas sencillas y una gran cantidad de macromoléculas, como almidones, proteínas
REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS. PRESENTACIÓN Los animales incluyendo al hombre, recibimos pocas moléculas sencillas y una gran cantidad de macromoléculas, como almidones, proteínas
Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares.
 Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares. Proteínas fibrosas Estructura y función de las queratinas Estructura y función del colágeno Triple hélice de
Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares. Proteínas fibrosas Estructura y función de las queratinas Estructura y función del colágeno Triple hélice de
Tema I: Biomoléculas
 República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. Colegio Santo Tomás de Villanueva Departamento de Ciencias Cátedra: Ciencias Biológicas 3 Año Tema I: Biomoléculas
República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. Colegio Santo Tomás de Villanueva Departamento de Ciencias Cátedra: Ciencias Biológicas 3 Año Tema I: Biomoléculas
L/O/G/O BIOQUÍMICA II
 L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
Agua, carbohidratos y Lípidos
 Agua, carbohidratos y Lípidos Biomoléculas Inorgánicas Características del agua El agua es el principal e imprescindible componente del cuerpo humano. Aproximadamente el 60 % de este agua se encuentra
Agua, carbohidratos y Lípidos Biomoléculas Inorgánicas Características del agua El agua es el principal e imprescindible componente del cuerpo humano. Aproximadamente el 60 % de este agua se encuentra
Clasificación de las proteinas según su conformación
 lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
Lehninger Principles of Biochemistry Fourth Edition
 David L. Nelson and Michael M. Cox Lehninger Principles of Biochemistry Fourth Edition Capítulo 3: Amino Acidos, Péptidos, y Proteínas Copyright 2004 by W. H. Freeman & Company Estereoquímica de Aminoácidos
David L. Nelson and Michael M. Cox Lehninger Principles of Biochemistry Fourth Edition Capítulo 3: Amino Acidos, Péptidos, y Proteínas Copyright 2004 by W. H. Freeman & Company Estereoquímica de Aminoácidos
Biomoléculas orgánicas: Proteínas y Ácidos nucleicos. Propiedad Intelectual Cpech
 Biología Biomoléculas orgánicas: Proteínas y Ácidos nucleicos Repaso Moléculas orgánicas Carbohidratos Lípidos 1. Monosacáridos: glucosa 2. Disacáridos: maltosa 3. Polisacáridos: glucógeno 1. Ácidos grasos.
Biología Biomoléculas orgánicas: Proteínas y Ácidos nucleicos Repaso Moléculas orgánicas Carbohidratos Lípidos 1. Monosacáridos: glucosa 2. Disacáridos: maltosa 3. Polisacáridos: glucógeno 1. Ácidos grasos.
Niveles de organización biológica. La composición de los seres vivos
 Niveles de organización biológica. La composición de los seres vivos Imagen de Fondo bajo licencia Creative Commons, autor: René Ehrtardt. Animación ADN de dominio público, fuente:wikipedia Con este tema
Niveles de organización biológica. La composición de los seres vivos Imagen de Fondo bajo licencia Creative Commons, autor: René Ehrtardt. Animación ADN de dominio público, fuente:wikipedia Con este tema
Aminoácidos y Proteínas
 Aminoácidos y Proteínas Un aminoácido es una pequeña molécula orgánica que contiene, al menos, un grupo amino (-NH 2), de naturaleza básica, y un grupo carboxilo (-COOH), de carácter ácido. Aunque los
Aminoácidos y Proteínas Un aminoácido es una pequeña molécula orgánica que contiene, al menos, un grupo amino (-NH 2), de naturaleza básica, y un grupo carboxilo (-COOH), de carácter ácido. Aunque los
AMINOÁCIDOS, PÉPTIDOS Y PROTEINAS. M.Sc. GABY MÓNICA FELIPE BRAVO
 AMINÁCIDS, PÉPTIDS Y PRTEINAS M.Sc. GABY MÓNICA FELIPE BRAV AMINÁCIDS C H 2 N C H R TDS LS AMINÁCIDS QUE FRMAN PARTE DE LAS PRTEÍNAS SN L-AMINÁCIDS CLASIFICACIÓN DE LS AMINÁCIDS ALIFÁTICS N PLARES ARMÁTICS
AMINÁCIDS, PÉPTIDS Y PRTEINAS M.Sc. GABY MÓNICA FELIPE BRAV AMINÁCIDS C H 2 N C H R TDS LS AMINÁCIDS QUE FRMAN PARTE DE LAS PRTEÍNAS SN L-AMINÁCIDS CLASIFICACIÓN DE LS AMINÁCIDS ALIFÁTICS N PLARES ARMÁTICS
PROTEÍNAS 1. PROTEÍNAS 2. ENZIMAS 1. PROTEÍNAS
 PROTEÍNAS 1. PROTEÍNAS Introducción Aminoácidos Estructura tridimensional de las proteínas Proteínas conjugadas Propiedades Funciones 2. ENZIMAS Introducción Estructura Clasificación Mecanismo de acción
PROTEÍNAS 1. PROTEÍNAS Introducción Aminoácidos Estructura tridimensional de las proteínas Proteínas conjugadas Propiedades Funciones 2. ENZIMAS Introducción Estructura Clasificación Mecanismo de acción
Niveles de Organización Conceptos, átomos y enlaces
 Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Biología General y Metodología de las Ciencias 2016 BIOMOLÉCULAS
 BIOMOLÉCULAS Objetivos: Reconocer los distintos niveles de organización de la materia. Diferenciar las propiedades constreñimiento, emergentes y colectivas. Identificar las principales Biomoléculas según
BIOMOLÉCULAS Objetivos: Reconocer los distintos niveles de organización de la materia. Diferenciar las propiedades constreñimiento, emergentes y colectivas. Identificar las principales Biomoléculas según
Tema 1: Los seres vivos: composición y función
 Tema 1: Los seres vivos: composición y función https://www.youtube.com/watch?v=-s28cydwauo El nivel atómico El nivel atómico Bioelementos: elementos que constituyen la materia viva Fundamentales: C, H,
Tema 1: Los seres vivos: composición y función https://www.youtube.com/watch?v=-s28cydwauo El nivel atómico El nivel atómico Bioelementos: elementos que constituyen la materia viva Fundamentales: C, H,
Guía de Biología I Medio Departamento de Ciencias Profesora NATALIA URQUIETA M.
 COLEGIO SAN CRISTOBAL Av. Diego Portales N 1.520. La Florida Guía de Biología I Medio Departamento de Ciencias Profesora NATALIA URQUIETA M. MOLÉCULAS ORGANICAS. Los componentes orgánicos de la materia
COLEGIO SAN CRISTOBAL Av. Diego Portales N 1.520. La Florida Guía de Biología I Medio Departamento de Ciencias Profesora NATALIA URQUIETA M. MOLÉCULAS ORGANICAS. Los componentes orgánicos de la materia
I) Biomoléculas 6) Proteínas I-6 PROTEÍNAS
 I-6 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
I-6 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
Universidad Nacional de la Patagonia San Juan Bosco Facultad de Ciencias Naturales Química Biológica Introducción
 Química Biológica TP 4 PROTEINAS,. Introducción Las proteínas son biomoléculas formados por 20 L-α-aminoácidos distintos, unidos linealmente entre sí por enlaces peptídicos, en un número que varía entre
Química Biológica TP 4 PROTEINAS,. Introducción Las proteínas son biomoléculas formados por 20 L-α-aminoácidos distintos, unidos linealmente entre sí por enlaces peptídicos, en un número que varía entre
Biomoléculas orgánicas: Carbohidratos y Lípidos. Propiedad Intelectual Cpech
 Biología Biomoléculas orgánicas: Carbohidratos y Lípidos Repaso Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan
Biología Biomoléculas orgánicas: Carbohidratos y Lípidos Repaso Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan
Metabolismo de AMINOÁCIDOS
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011 Metabolismo de AMINOÁCIDOS Dr. Mynor A. Leiva Enríquez Fuente:
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011 Metabolismo de AMINOÁCIDOS Dr. Mynor A. Leiva Enríquez Fuente:
Proteínas. Tabla 1: Funciones de las proteínas
 Colegio Lectura Hispano Complementaria Americano Depto. de Ciencias - Biología Nivel: 4to medio Unidad I Proteínas 1 En las células, son las proteínas las macromoléculas más abundantes y las que constituyen
Colegio Lectura Hispano Complementaria Americano Depto. de Ciencias - Biología Nivel: 4to medio Unidad I Proteínas 1 En las células, son las proteínas las macromoléculas más abundantes y las que constituyen
CLASIFICACIÓN SEGÚN SU POLARIDAD NO POLARES POLARES NEUTROS ACIDOS BASICOS
 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2015 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2015 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
Aminoácidos. Los aminoácidos se agrupan en la figura según las propiedades de sus cadenas
 Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
LA ORGANIZACIÓN DEL CUERPO HUMANO
 LA ORGANIZACIÓN DEL CUERPO HUMANO RICARDO, ALBERTO, PABLO Y JORGE 1º Los niveles de organización Todos los seres vivos estamos dotados de un conjunto de estructuras con sus funciones específicas. Ordenados
LA ORGANIZACIÓN DEL CUERPO HUMANO RICARDO, ALBERTO, PABLO Y JORGE 1º Los niveles de organización Todos los seres vivos estamos dotados de un conjunto de estructuras con sus funciones específicas. Ordenados
FISIOLOGÍA GENERAL Jesús Merino Pérez y María José Noriega Borge
 BIOMOLÉCULAS. PROTEÍNAS BIOMOLÉCULAS Los bioelementos se unen para formar biomoléculas, también denominadas principios inmediatos. En los seres vivos las moléculas se caracterizan por presentar una gran
BIOMOLÉCULAS. PROTEÍNAS BIOMOLÉCULAS Los bioelementos se unen para formar biomoléculas, también denominadas principios inmediatos. En los seres vivos las moléculas se caracterizan por presentar una gran
BIOMOLÉCULAS. Son moléculas fundamentales para la constitución y funcionamiento de todo ser vivo. Se clasifican en dos grupos:
 FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR
 INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno
 Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Estructura 3D de proteínas
 Estructura 3D de proteínas Aportaciones de la Bioinformática Structural Bioinformatics Laboratory Research Group on Biomedical Informatics (GRIB) Universitat Pompeu Fabra Sumario Conceptos básicos (I):
Estructura 3D de proteínas Aportaciones de la Bioinformática Structural Bioinformatics Laboratory Research Group on Biomedical Informatics (GRIB) Universitat Pompeu Fabra Sumario Conceptos básicos (I):
EL CONTROL DE LAS ACTIVIDADES CELULARES
 EL CONTROL DE LAS ACTIVIDADES CELULARES LAS REACCIONES CELULARES BÁSICAS Todas las células llevan a cabo funciones vitales: Ingestión de nutrientes Eliminación de desperdicios Crecimiento Reproducción
EL CONTROL DE LAS ACTIVIDADES CELULARES LAS REACCIONES CELULARES BÁSICAS Todas las células llevan a cabo funciones vitales: Ingestión de nutrientes Eliminación de desperdicios Crecimiento Reproducción
BIOQUIMICA Y FISIOLOGÍA MICROBIANA. Dra. Yenizey Merit Alvarez Cisneros
 BIOQUIMICA Y FISIOLOGÍA MICROBIANA Dra. Yenizey Merit Alvarez Cisneros Moléculas importantes para la vida Compuestos Orgánicos (contienen carbono e hidrógeno) y forma enlaces covalentes Azucares Aminoácidos
BIOQUIMICA Y FISIOLOGÍA MICROBIANA Dra. Yenizey Merit Alvarez Cisneros Moléculas importantes para la vida Compuestos Orgánicos (contienen carbono e hidrógeno) y forma enlaces covalentes Azucares Aminoácidos
Proteínas. José Seijo Ramil
 P.1. Aminoácidos: P.1.1. Concepto y fórmula general. P.1.2. Estereoisomería y actividad óptica P.1.3. Propiedades de los aminoácidos: Comportamiento anfótero. Punto isoeléctrico P.1.4 Clasificación P.2.
P.1. Aminoácidos: P.1.1. Concepto y fórmula general. P.1.2. Estereoisomería y actividad óptica P.1.3. Propiedades de los aminoácidos: Comportamiento anfótero. Punto isoeléctrico P.1.4 Clasificación P.2.
Se encuentra separado del citoplasma por la envoltura nuclear, que está formada por varias cisternas del retículo endoplasmático, que se mantienen uni
 Se encuentra separado del citoplasma por la envoltura nuclear, que está formada por varias cisternas del retículo endoplasmático, que se mantienen unidas gracias a una red de filamentos intermedios que
Se encuentra separado del citoplasma por la envoltura nuclear, que está formada por varias cisternas del retículo endoplasmático, que se mantienen unidas gracias a una red de filamentos intermedios que
Estructura tridimensional de proteínas
 Estructura tridimensional de proteínas 1. En solución acuosa, la conformación proteica esta determinada por dos factores prioritarios. Uno es la formación de un número máximo de enlaces de hidrógeno. El
Estructura tridimensional de proteínas 1. En solución acuosa, la conformación proteica esta determinada por dos factores prioritarios. Uno es la formación de un número máximo de enlaces de hidrógeno. El
Metodologías básicas del procesamiento de Proteinas
 Metodologías básicas del procesamiento de Proteinas Alejandra Kun Departamento de Proteínas y Ácidos Nucleicos-IIBCE Unidad Asociada Sección Bioquímica Facultad de Ciencias 13 de octubre 2014 Curso Introducción
Metodologías básicas del procesamiento de Proteinas Alejandra Kun Departamento de Proteínas y Ácidos Nucleicos-IIBCE Unidad Asociada Sección Bioquímica Facultad de Ciencias 13 de octubre 2014 Curso Introducción
Concepto de Lípido. Es un grupo de sustancias muy heterogéneas que sólo tienen en común estas dos características:
 Lípidos Sesión 01 Concepto de Lípido Los lípidos son biomoléculas orgánicas formadas básicamente por carbono e hidrógeno y generalmente también oxígeno; pero en porcentajes mucho más bajos. Además pueden
Lípidos Sesión 01 Concepto de Lípido Los lípidos son biomoléculas orgánicas formadas básicamente por carbono e hidrógeno y generalmente también oxígeno; pero en porcentajes mucho más bajos. Además pueden
1. TEORÍA CELULAR 2. ORGANIZACIÓN CELULAR PROCARIOTA 3. ORGANIZACIÓN CELULAR EUCARIOTA: ANIMAL Y VEGETAL
 LAS CÉLULAS INDICE: 1. TEORÍA CELULAR 2. ORGANIZACIÓN CELULAR PROCARIOTA 3. ORGANIZACIÓN CELULAR EUCARIOTA: ANIMAL Y VEGETAL 1º.- TEORÍA CELULAR Los principios básicos de la teoría celular son: La célula
LAS CÉLULAS INDICE: 1. TEORÍA CELULAR 2. ORGANIZACIÓN CELULAR PROCARIOTA 3. ORGANIZACIÓN CELULAR EUCARIOTA: ANIMAL Y VEGETAL 1º.- TEORÍA CELULAR Los principios básicos de la teoría celular son: La célula
Repaso Opción múltiple Macromoléculas Biológicas
 Repaso Opción múltiple Macromoléculas Biológicas 1. Por qué esta información sobre el carbono es tan importante para entender las moléculas de la vida? a. Es el esqueleto de las moléculas biológicas requeridas
Repaso Opción múltiple Macromoléculas Biológicas 1. Por qué esta información sobre el carbono es tan importante para entender las moléculas de la vida? a. Es el esqueleto de las moléculas biológicas requeridas
Clasificación de los lípidos
 LIPIDOS Concepto de Lípido Los lípidos son biomoléculas orgánicas formadas básicamente por carbono e hidrógeno y generalmente también oxígeno; pero en porcentajes mucho más bajos. Además pueden contener
LIPIDOS Concepto de Lípido Los lípidos son biomoléculas orgánicas formadas básicamente por carbono e hidrógeno y generalmente también oxígeno; pero en porcentajes mucho más bajos. Además pueden contener
La organización del cuerpo humano. Punto 1: Los niveles de organización.
 La organización del cuerpo humano Punto 1: Los niveles de organización. ATOMO MOLECULA Unidad constituyente más pequeña de la materia ordinaria. Conjunto de al menos dos átomos enlazados covalentes que
La organización del cuerpo humano Punto 1: Los niveles de organización. ATOMO MOLECULA Unidad constituyente más pequeña de la materia ordinaria. Conjunto de al menos dos átomos enlazados covalentes que
Polímero corto Monómero. síntesis. degradación
 Polímero corto Monómero síntesis degradación Hidratos de carbono. Glúcidos o azúcares. Monómeros Glúcidos. Dímeros. Glu+Glu= Maltosa (azúcar presente en la malta, un grano) Glu+Frc= Sacarosa (azúcar de
Polímero corto Monómero síntesis degradación Hidratos de carbono. Glúcidos o azúcares. Monómeros Glúcidos. Dímeros. Glu+Glu= Maltosa (azúcar presente en la malta, un grano) Glu+Frc= Sacarosa (azúcar de
AMINOÁCIDOS Y PÉPTIDOS
 TEMA 4 AMINOÁCIDOS Y PÉPTIDOS 1. Estructura y clasificación de los aminoácidos. 2. Propiedades ácido-base de los aminoácidos y péptidos 3. El enlace peptídico 4. Péptidos: hidrólisis y secuenciación 1.
TEMA 4 AMINOÁCIDOS Y PÉPTIDOS 1. Estructura y clasificación de los aminoácidos. 2. Propiedades ácido-base de los aminoácidos y péptidos 3. El enlace peptídico 4. Péptidos: hidrólisis y secuenciación 1.
TEMA 7: LA MEMBRANA PLASMÁTICA.
 TEMA 7: LA MEMBRANA PLASMÁTICA. 1.-La membrana plasmática como unidad estructural. 2.- Características de la membrana plasmática. 2.1. Estructura y composición. 2.2. Propiedades de la membrana plasmática.
TEMA 7: LA MEMBRANA PLASMÁTICA. 1.-La membrana plasmática como unidad estructural. 2.- Características de la membrana plasmática. 2.1. Estructura y composición. 2.2. Propiedades de la membrana plasmática.
Metabolismo y uso de Proteínas. Jorge Ml. Sánchez Centro de Inv. en Nutrición Animal Escuela de Zootecnia Universidad de Costa Rica
 Metabolismo y uso de Proteínas Jorge Ml. Sánchez Centro de Inv. en Nutrición Animal Escuela de Zootecnia Universidad de Costa Rica Metabolismo de las Proteínas Funciones en el organismo 1. Constituyen
Metabolismo y uso de Proteínas Jorge Ml. Sánchez Centro de Inv. en Nutrición Animal Escuela de Zootecnia Universidad de Costa Rica Metabolismo de las Proteínas Funciones en el organismo 1. Constituyen
HIDRATOS DE CARBONO Carbohidratos, sacáridos y glucidos
 1. Definición y clasificación HIDRATOS DE CARBONO Carbohidratos, sacáridos y glucidos Los carbohidratos o sacáridos (del griego: sakcharón, azúcar) Son compuestos esenciales de los organismos vivos y son
1. Definición y clasificación HIDRATOS DE CARBONO Carbohidratos, sacáridos y glucidos Los carbohidratos o sacáridos (del griego: sakcharón, azúcar) Son compuestos esenciales de los organismos vivos y son
COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO GUÍA REFORZAMIENTO 1 MEDIO
 COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO GUÍA REFORZAMIENTO 1 MEDIO NOMBRE: PJE. TOTAL: FECHA: CURSO: 1 MEDIO PJE. OBTENIDO: CALIFICACION: ASIGNATURA: BIOLOGIA UNIDAD: I - II OBJETIVO (S): CONTENIDO
COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO GUÍA REFORZAMIENTO 1 MEDIO NOMBRE: PJE. TOTAL: FECHA: CURSO: 1 MEDIO PJE. OBTENIDO: CALIFICACION: ASIGNATURA: BIOLOGIA UNIDAD: I - II OBJETIVO (S): CONTENIDO
Proteínas. Cual es la gracia? KEVLAR. polímeros biológicos es su versatilidad para formar una gran variedad estructuras con funciones especializadas.
 Estructura de Proteínas KEVLAR Dr. Mauricio Baez mauricio.baez@ciq.uchile.cl uchile cl Laboratorio de Bioquímica Facultad de Ciencias Químicas y Farmacéuticas Universidad de Chile Proteínas. Co-polímeros
Estructura de Proteínas KEVLAR Dr. Mauricio Baez mauricio.baez@ciq.uchile.cl uchile cl Laboratorio de Bioquímica Facultad de Ciencias Químicas y Farmacéuticas Universidad de Chile Proteínas. Co-polímeros
Química. Las proteínas o prótidos
 Química Las proteínas o prótidos Las proteínas, también denominadas prótidos, albuminoides o sustancias nitrogenadas, son las constituyentes de tejidos y líquidos orgánicos. Se desnaturalizan por la acción
Química Las proteínas o prótidos Las proteínas, también denominadas prótidos, albuminoides o sustancias nitrogenadas, son las constituyentes de tejidos y líquidos orgánicos. Se desnaturalizan por la acción
28 A 32. HOJA DE TRABAJO 5o. BLOQUE. Licda. Lilian Judith Guzmán Melgar
 HOJA DE TRABAJO 5o. BLOQUE Licda. Lilian Judith Guzmán Melgar 2016 28 A 32 1. En La siguiente estructura señale lo que se le solicita: a) Colina b) Glicerol c) Acido graso d) Enlace esterfosfato 2. Cuales
HOJA DE TRABAJO 5o. BLOQUE Licda. Lilian Judith Guzmán Melgar 2016 28 A 32 1. En La siguiente estructura señale lo que se le solicita: a) Colina b) Glicerol c) Acido graso d) Enlace esterfosfato 2. Cuales
METABOLISMO DE LIPIDOS
 METABOLISMO DE LIPIDOS Al igual que en el metabolismo de los carbohidratos, el metabolismo de lípidos consiste en: Digestión Transporte Almacenamiento Degradación Biosíntesis DIGESTIÓN DE LIPIDOS Los lípidos
METABOLISMO DE LIPIDOS Al igual que en el metabolismo de los carbohidratos, el metabolismo de lípidos consiste en: Digestión Transporte Almacenamiento Degradación Biosíntesis DIGESTIÓN DE LIPIDOS Los lípidos
XII SIMPOSIUM INTERNACIONAL DE LA UVA DE MESA - SIUVA
 Rol de los Aminoácidos en el Cultivo de Vid XII SIMPOSIUM INTERNACIONAL DE LA UVA DE MESA - SIUVA 2011 La Molina, 06 y 07 de Julio, 2011 Ing. M.Sc. Federico Ramírez D. Gerente Técnico Aminoácidos Las plantas
Rol de los Aminoácidos en el Cultivo de Vid XII SIMPOSIUM INTERNACIONAL DE LA UVA DE MESA - SIUVA 2011 La Molina, 06 y 07 de Julio, 2011 Ing. M.Sc. Federico Ramírez D. Gerente Técnico Aminoácidos Las plantas
1 Los niveles de organización
 1 La organización del ser humano 1 Los niveles de organización LOS NIVELES DE ORGANIZACIÓN DE LOS SERES VIVOS de menor a mayor complejidad, son Nivel atómico y molecular Los bioelementos, como el carbono,
1 La organización del ser humano 1 Los niveles de organización LOS NIVELES DE ORGANIZACIÓN DE LOS SERES VIVOS de menor a mayor complejidad, son Nivel atómico y molecular Los bioelementos, como el carbono,
4. El esquema adjunto representa la estructura de una molécula denominada lisozima.
 BLOQUE I : La base físico-química de la materia 1. a. Nombre y formule un monosacárido que contenga seis átomos de carbono. b. Indica esquemáticamente una diferencia estructural existente entre el almidón
BLOQUE I : La base físico-química de la materia 1. a. Nombre y formule un monosacárido que contenga seis átomos de carbono. b. Indica esquemáticamente una diferencia estructural existente entre el almidón
Carbohidratos. CLASIFICACIÓN DE LOS CARBOHIDRATOS ALIMENTICIOS y ejemplos
 Carbohidratos También llamados hidratos de carbono, son uno de los tres tipos de macronutrientes presentes en nuestra alimentación (los otros dos son las grasas y las proteínas). Existen en multitud de
Carbohidratos También llamados hidratos de carbono, son uno de los tres tipos de macronutrientes presentes en nuestra alimentación (los otros dos son las grasas y las proteínas). Existen en multitud de
PREGUNTAS PAU PROTEÍNAS
 PREGUNTAS PAU PROTEÍNAS EJERCICIO 1 a) Cuáles son las unidades estructurales de las proteínas? [0 2] b) Escriba su fórmula general [0 2]. c) Atendiendo a la variedad de radicales cite cuatro tipos de dichas
PREGUNTAS PAU PROTEÍNAS EJERCICIO 1 a) Cuáles son las unidades estructurales de las proteínas? [0 2] b) Escriba su fórmula general [0 2]. c) Atendiendo a la variedad de radicales cite cuatro tipos de dichas
Ácidos nucléicos. Los ácidos nucleicos fueron descubiertos por Freidrich Miescher en Mirel Nervenis
 Ácidos nucléicos Los ácidos nucleicos fueron descubiertos por Freidrich Miescher en 1869 La información genética o genoma, está contenida en unas moléculas llamadas ácidos nucleicos. Existen dos tipos
Ácidos nucléicos Los ácidos nucleicos fueron descubiertos por Freidrich Miescher en 1869 La información genética o genoma, está contenida en unas moléculas llamadas ácidos nucleicos. Existen dos tipos
UNIVERSIDAD DEL QUINDÍO UNIDAD 3: LÍPIDOS
 UNIVERSIDAD DEL QUINDÍO ASIGNATURA: Bioquímica DOCENTE: Edwin David Morales Álvarez Correo Electrónico: davidmorales@uniquindio.edu.co UNIDAD 3: LÍPIDOS Los lípidos son biomoléculas orgánicas formadas
UNIVERSIDAD DEL QUINDÍO ASIGNATURA: Bioquímica DOCENTE: Edwin David Morales Álvarez Correo Electrónico: davidmorales@uniquindio.edu.co UNIDAD 3: LÍPIDOS Los lípidos son biomoléculas orgánicas formadas
