TEMA PROTEINAS.
|
|
|
- Luis Salinas Quiroga
- hace 7 años
- Vistas:
Transcripción
1 TEMA PROTEINAS. Contenido: ü Niveles estructurales de las proteínas. ü Estructura primaria: Relación estructura función y evolución molecular. ü Estructura secundaria. ü Estructura terciaria: La molécula de mioglobina. ü Estructura cuaternaria: Hemoglobina y Cooperatividad. ü Comportamiento de las proteínas en disolución. Purificación y caracterización de proteínas.
2 Funciones biológicas Enzimas Actividad catalítica Transporte Hemoglobina Lipoproteínas Transportadores de membrana Nutrientes Caseína (leche) Ovoalbúmina (huevo) Contráctiles Actina Miosina Estructurales Colágeno Elastina Queratina Defensa Inmunoglobulinas Regulación Hormonas Proteínas G
3 Tamaño de las proteínas Numero medio de aminoácidos Numero de cadenas > 1 Masa molecular y 10 6 (PM/110 = nº aa)
4
5
6
7 1 secuencia única 1 proteína 1 estructura unica 1 función única Funciones diferentes Secuencia de aminoácidos diferente Funciones similares Secuencia de aminoácidos similares Cambio en secuencia Alteración en la función Cambios permitidos No alteran la función La secuencia de aminoácidos informa sobre: ü Estructura tridimensional ü Función ü Localización ü Evolución
8 Proteínas homologas Guardan relación evolutiva Misma función en especies diferentes Residuos invariables Residuos variables (evolución de las especies)
9 Secuencias de aminoácidos de la mioglobina de cachalote y humana
10 Árbol evolutivo del Citocromo C
11 Niveles de estructuras en las proteínas
12 Herrera
13 Enlace peptídico. Naturaleza de doble enlace
14 Enlaces peptídicos separados por carbono alfa
15
16 Ángulos de referencia (0º)
17 Representación de Ramachandran
18 Hélice alfa a) Hélice alfa dextrógira b) Enlaces de hidrogeno intracatenarios
19 Hélice alfa. Vista superior
20 Hélice alfa compacta
21 Hélice dextrógira y levógira
22 Estabilidad hélice alfa troponina C Arg 103 Asp 100 Esqueleto polipeptídico
23 Dipolos eléctricos en la hélice alfa
24 Hoja beta antiparalela
25 Hoja beta paralela
26 Giros beta
27 Giro beta
28
29 Alfa queratina
30 Sección transversal de un cabello
31 Microfibrilla de alfa queratina Protofibrilla de alfa queratina
32
33 Cadena alfa del colágeno Giro levógiro Gly-X-Pro Gly-X-Hyp
34 Modelo de esferas de la cadena alfa
35 Giro dextrógiro de tres cadenas levógiras
36 Superhélice de colageno (vista superior) Glicina
37
38 Estructura de las fibrillas de colágeno
39
40 Enlaces de hidrogeno y de entrecruzamiento del tropocolágeno
41 Biosíntesis y ensamblaje de una fibra de colágeno
42 Formación de la molécula de tropocolágeno
43 Elastina. Conformación al azar Unidad elemental: Tropoelastina PM Rica en Gly, Ala y Lys Hélice " rica en Gly Entrecruzamiento covalente: Desmosina
44 Estructura de la red de elastina
45 Entrecruzamiento de las cadenas polipeptídicas de elastina
46 Entrecruzamiento de tropoelastina
47 Fibroína de la seda
48
49 Estructura terciaria
50 Albumina sérica humana Kda, 585 aa
51 Estructura terciaria de la mioglobina PM aa; Hemo Almacenamiento O 2 Esqueleto polipeptídico y estructura secundaria
52 Estructura terciaria de la mioglobina Estructura de la superficie
53 Estructura terciaria de la mioglobina Imagen de contorno de la superficie
54 Estructura terciaria de la mioglobina Representación de cintas Aminoácidos hidrofóbicos
55 Grupo Hemo
56 Estructura tridimensional del citocromo C
57 Estructura tridimensional de la lisozima
58 Estructura tridimensional de la Ribonucleasa
59
60
61 Estructuras supersecundarias (Motivos o plegamientos) Patrón de plegamiento estable en proteínas
62 Patrón de plegamiento estable en proteínas
63 Patrón de plegamiento estable en proteínas
64 Patrón de plegamiento estable en proteínas
65 Patrón de plegamiento estable en proteínas
66 Patrón de plegamiento estable en proteínas
67 Patrón de plegamiento estable en proteínas
68 Patrón de plegamiento estable en proteínas
69 Construcción de macrodominios
70 Clasificación de proteínas según el banco de datos de la Strucutral Classification of Proteins (SCOP) Todo alfa
71 Todo beta
72 Alfa/Beta
73 Alfa + Beta
74 Desnaturalización de proteínas
75 Renaturalización
76 Ruta simulada de plegamiento Villina (36 aa) Plegamiento simulado 1 ms E. Coli Proteína activa100 aa 5 s 37ºC 1 aa 10 conformaciones Conformaciones posibles 1 conformación s Todas las conformaciones posibles 10 años 77
77 Termodinámica del plegamiento de una proteína
78 Chaperonas en plegamimento de proteínas
79 Chaperoninas en el plegamiento de proteínas
80 Complejo GroEL/GroES
81 Enzimas que catalizan reacciones de isomerización Proteína disulfuro isomerasa (PDI) Péptido prolil cis-trans isomerasa (PPI)
82 ESTRUCTURA CUATERNARIA
83 Estructura cuaternaria de la desoxihemoglobina Desoxihemoglobina 64,5 Kda; 4 subunidades (2 alfa 141 aa y 2 beta 146 aa)
84 Estructura cuaternaria de la desoxihemoglobina
85 Eritrocitos normales
86 Anemia falciforme
87 Hemoglobina normal y falciforme Cambio de Glu por Val
88 Formación de fibras insolubles
89 Anillo de protoporfirina IX
90 Representaciones del grupo Hemo
91 Enlaces de coordinación del hierro
92 Vista lateral del grupo Hemo
93 Estructura de la mioglobina
94 Unión de oxigeno a la mioglobina
95 Unión reversible del O 2 a la Mioglobina MbO 2 Mb + O 2 Kd Kd = [Mb][O 2 ] [MbO 2 ] = [Mb] po 2 [MbO 2 ] [MbO 2 ] = [Mb] po 2 Kd Fracción de saturación Y Y = [MbO 2] [MbO 2 ] + [Mb] Y = po 2 po 2 + Kd po 2 Y = 1 po 2 = Kd Y = 0,5 po 2 po 2 Y = po2 + Kd = po2 + P 50 Y 1-Y = po 2 P 50 lg Y 1-Y = lg po 2 lg P 50
96 Curva de unión sigmoidea del O 2 a la hemoglobina
97 Unión reversible del O 2 a la Hemoglobina Hb(O 2 ) 4 Hb + 4 O 2 Kd = [Hb][O 2 ] 4 [Hb(O 2 ) 4 ] [po 2 ] 4 Y = [po2 ] 4 + [P 50 ] 4 Y 1-Y = po 2 P 50 n lg Y 1-Y = n lg po 2 n lg P 50 n = Coeficiente de Hill n = 1 No existe cooperatividad n > 1 Cooperatividad positiva
98 Grafico de Hill para la unión del O 2 a la mioglobina y hemoglobina
99 Curva de unión sigmoidea del O 2 a la hemoglobina
100 Interacción del grupo hemo con los aminoácidos próximos
101 Interacciones dominantes entre las subunidades de la hemoglobina
102 Detalle de una molécula de desoxihemoglobina en estado T
103 Transición T a R
104 Cambios conformacionales en el entorno del grupo hemo por la unión de O 2
105 Modelos para la interconversión de formas activas e inactivas de proteínas con unión cooperativa a ligando
ESTRUCTURA DE PROTEÍNAS
 ESTRUCTURA DE PROTEÍNAS PROTEINAS Polipéptidos cuya secuencia aminoacídica está determinada genéticamente. Poseen entre 50 y mas de 20,000 residuos aa. (PM entre 5,500 y 220,000). Macromoléculas mas versátiles
ESTRUCTURA DE PROTEÍNAS PROTEINAS Polipéptidos cuya secuencia aminoacídica está determinada genéticamente. Poseen entre 50 y mas de 20,000 residuos aa. (PM entre 5,500 y 220,000). Macromoléculas mas versátiles
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS
 PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
Contenidos teóricos. Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente. Tema 3. Enzimas. Cinética y regulación.
 Contenidos teóricos Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente Tema 2. Principales biomoléculas presentes en los seres vivos y su relación estructura-función: proteínas,
Contenidos teóricos Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente Tema 2. Principales biomoléculas presentes en los seres vivos y su relación estructura-función: proteínas,
TEMA. Conformación tridimensional de proteínas Niveles estructurales Tipos de enlaces y fuerzas que estabilizan estas estructuras
 TEMA Conformación tridimensional de proteínas Niveles estructurales Tipos de enlaces y fuerzas que estabilizan estas estructuras Primaria Terciaria Cuaternaria Secundaria NIVELES ESTRUCTURALES DE LAS PROTEÍNAS
TEMA Conformación tridimensional de proteínas Niveles estructurales Tipos de enlaces y fuerzas que estabilizan estas estructuras Primaria Terciaria Cuaternaria Secundaria NIVELES ESTRUCTURALES DE LAS PROTEÍNAS
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 16-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 16-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupo: 07 Semestre: 17-I Este material es exclusivamente para uso educativo
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupo: 07 Semestre: 17-I Este material es exclusivamente para uso educativo
Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por
 PROTEÍNAS Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por C, H, O, N y S Por su naturaleza química
PROTEÍNAS Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por C, H, O, N y S Por su naturaleza química
PROTEÍNAS : ESTRUCTURA Y FUNCIÓN
 COLEGIO SAN FRANCISCO DEL ALBA DPTO BIOLOGÍA NIVEL: 4 MEDIO PROTEÍNAS : ESTRUCTURA Y FUNCIÓN PROFESORA: MARÍA JOSÉ ESCALONA. PROTEÍNAS (PROTEIOS= PRIMARIO) (C-H-O-N-S) Son biomoléculas esenciales para
COLEGIO SAN FRANCISCO DEL ALBA DPTO BIOLOGÍA NIVEL: 4 MEDIO PROTEÍNAS : ESTRUCTURA Y FUNCIÓN PROFESORA: MARÍA JOSÉ ESCALONA. PROTEÍNAS (PROTEIOS= PRIMARIO) (C-H-O-N-S) Son biomoléculas esenciales para
LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO
 LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO ESTRUCTURA Y FUNCION DE LAS PROTEINAS. Las proteínas son polímeros de aminoácidos unidos por uniones amida, llamadas uniones peptídicas. La cadena polipéptídica
LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO ESTRUCTURA Y FUNCION DE LAS PROTEINAS. Las proteínas son polímeros de aminoácidos unidos por uniones amida, llamadas uniones peptídicas. La cadena polipéptídica
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS. A.- Concepto de prótidos y clasificación B.-Los aminoácidos
 TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno
 Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares.
 Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares. Proteínas fibrosas Estructura y función de las queratinas Estructura y función del colágeno Triple hélice de
Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares. Proteínas fibrosas Estructura y función de las queratinas Estructura y función del colágeno Triple hélice de
AMINOÁCIDOS Y PROTEÍNAS
 4/6/15 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS Grupo carboxilo Grupo amino Carbono α Cadena Lateral Ión dipolar o zwitterión Las proteínas tienen L-aminoácidos
4/6/15 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS Grupo carboxilo Grupo amino Carbono α Cadena Lateral Ión dipolar o zwitterión Las proteínas tienen L-aminoácidos
CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS.
 MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
Actividades de las proteínas Tema 1
 Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
Estructura tridimensional de las proteínas
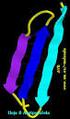 Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
PROTEÍNAS ESTRUCTURAS PRIMARIA, CUATERNARIA
 PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA PROTEÍNAS.- FUNCIONES BIOLÓGICAS a) Enzimas.- Actividad catalítica b) Hormonas c) Anticuerpos d) Receptores en membranas Reconocimiento
PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA PROTEÍNAS.- FUNCIONES BIOLÓGICAS a) Enzimas.- Actividad catalítica b) Hormonas c) Anticuerpos d) Receptores en membranas Reconocimiento
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH)
 Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
U. D. 4 LAS PROTEÍNAS
 U. D. 4 LAS PROTEÍNAS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
U. D. 4 LAS PROTEÍNAS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
Existen más de 150 aminoácidos, aunque tan sólo 20 son aminoácidos proteicos. Todos ellos α.
 UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
PROTEINAS. Clasificación. Propiedades químicas.
 PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
PROTEÍNAS. Del griego proteion, primero
 PROTEÍNAS Del griego proteion, primero Son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno (CHON). Pueden además contener azufre y en algunos tipos de proteínas, fósforo,
PROTEÍNAS Del griego proteion, primero Son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno (CHON). Pueden además contener azufre y en algunos tipos de proteínas, fósforo,
UT1. BIOMOLÉCULAS PRESENTES EN LOS SERES VIVOS. RELACIÓN ESTRUCTURA/FUNCIÓN
 UT1. BIOMOLÉCULAS PRESENTES EN LOS SERES VIVOS. RELACIÓN ESTRUCTURA/FUNCIÓN Tema 1: Introducción a la Bioquímica. Composición del cuerpo humano. Tema 2: Proteínas, Glúcidos, Lípidos y Ácidos Nucleicos.
UT1. BIOMOLÉCULAS PRESENTES EN LOS SERES VIVOS. RELACIÓN ESTRUCTURA/FUNCIÓN Tema 1: Introducción a la Bioquímica. Composición del cuerpo humano. Tema 2: Proteínas, Glúcidos, Lípidos y Ácidos Nucleicos.
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS INDICE 1. CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS 2. AMINOÁCIDOS 1. PROPIEDADES DE LOS AMINOÁCIDOS 2. CLASIFICACIÓN DE LOS AMINOÁCIDOS 3. EL ENLACE PEPTÍDICO 4. ESTRUCTURA DE LAS
TEMA 4: LAS PROTEÍNAS INDICE 1. CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS 2. AMINOÁCIDOS 1. PROPIEDADES DE LOS AMINOÁCIDOS 2. CLASIFICACIÓN DE LOS AMINOÁCIDOS 3. EL ENLACE PEPTÍDICO 4. ESTRUCTURA DE LAS
AMINOACIDOS. Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 12/04/2012
 AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
Formación del enlace peptídico por condensación de dos aminoácidos. Amida
 PÉPTIDOS Formación del enlace peptídico por condensación de dos aminoácidos. Amida Ejemplo de un pentapéptido Extremo amino-terminal Extremo carboxiterminal Ser Gly Tyr Ala Leu Ejemplo de un tetrapéptido
PÉPTIDOS Formación del enlace peptídico por condensación de dos aminoácidos. Amida Ejemplo de un pentapéptido Extremo amino-terminal Extremo carboxiterminal Ser Gly Tyr Ala Leu Ejemplo de un tetrapéptido
CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI
 CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI Materia de Articulación CEBI_A4 Química Biológica Docente a cargo:marta Blanca Mazzetti CEBI_A4_2B :Proteínas ESTRUCTURA SECUNDARIA Se
CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI Materia de Articulación CEBI_A4 Química Biológica Docente a cargo:marta Blanca Mazzetti CEBI_A4_2B :Proteínas ESTRUCTURA SECUNDARIA Se
Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería.
 Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería. Proteínas. Características Generales. Las proteínas son macromoléculas formadas por cadenas lineales de aminoácidos y compuestas por carbono (C),
Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería. Proteínas. Características Generales. Las proteínas son macromoléculas formadas por cadenas lineales de aminoácidos y compuestas por carbono (C),
Proteínas Polímeros de aminoácidos ( resíduos) PM aa aprox 110 PM prot
 Proteínas Polímeros de aminoácidos (50-2000 resíduos) PM aa aprox 110 PM prot 5000-200000 DiversasFunciones Estructurales (rígidas), Enzimas (más flexibles) Estructuras: primaria, secundaria, terciaria,
Proteínas Polímeros de aminoácidos (50-2000 resíduos) PM aa aprox 110 PM prot 5000-200000 DiversasFunciones Estructurales (rígidas), Enzimas (más flexibles) Estructuras: primaria, secundaria, terciaria,
PROTEÍNAS. Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas:
 PROTEÍNAS Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas: Tipos de Proteínas ESTRUCTURA DE LAS PROTEÍNAS Estructura
PROTEÍNAS Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas: Tipos de Proteínas ESTRUCTURA DE LAS PROTEÍNAS Estructura
Los monómeros de las proteínas
 Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
PROTEÍNAS ESTRUCTURAS PRIMARIA, CUATERNARIA
 PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA NIVELES DE ESTRUCTURACIÓN DE LAS PROTEÍNAS ESTRUCTURA PRIMARIA 1. Ordenamiento lineal de aminoácidos, en cadenas no ramificadas 2. Posición
PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA NIVELES DE ESTRUCTURACIÓN DE LAS PROTEÍNAS ESTRUCTURA PRIMARIA 1. Ordenamiento lineal de aminoácidos, en cadenas no ramificadas 2. Posición
Plegamiento y Estructura Terciaria
 Plegamiento y Estructura Terciaria Para el plegamiento apropiado y la formación correcta de los posibles enlaces disulfuro de una molécula proteica, no se requiere una mayor o especial información, que
Plegamiento y Estructura Terciaria Para el plegamiento apropiado y la formación correcta de los posibles enlaces disulfuro de una molécula proteica, no se requiere una mayor o especial información, que
PROTEÍNAS Y AMINOÁCIDOS
 PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
TRABAJO SOBRE LAS PROTEÍNAS
 TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
Composición: C, H, O, N, S (P, Fe, Cu, I, ).
 PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
AMINOÁCIDOS. Funciones:
 AMINOÁCIDOS Funciones: 1)Moléculas formadoras de las proteínas. 2)Precursores de vitaminas (β - alanina). 3)Intermediarios en las síntesis de otros aminoácidos. 4) Presentes en las paredes celulares de
AMINOÁCIDOS Funciones: 1)Moléculas formadoras de las proteínas. 2)Precursores de vitaminas (β - alanina). 3)Intermediarios en las síntesis de otros aminoácidos. 4) Presentes en las paredes celulares de
1º Bachillerato A Septiembre 2013
 1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS 1. Características químicas y clasificación 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las
TEMA 4: LAS PROTEÍNAS 1. Características químicas y clasificación 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las
Proteínas. Marijose Artolozaga Sustacha, MSc
 Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo α-carboxilo de aá 1 Grupo α-amino de aá 2 Se libera agua CO NH Carbono α Extremo
Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo α-carboxilo de aá 1 Grupo α-amino de aá 2 Se libera agua CO NH Carbono α Extremo
PROTEÍNAS. Lubert Stryer Jeremy M. Berg John L. Tymoczko Bioquimica (5. ed) Ed. Reverte. PROTEÍNAS generalidades
 PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
TEMA 5. LAS PROTEÍNAS.
 TEMA 5. LAS PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES. Son macromoléculas formadas por C, H, O y N. (en algunas ocasiones S). Son importantes porque son las biomoléculas más abundantes en peso seco (50%)
TEMA 5. LAS PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES. Son macromoléculas formadas por C, H, O y N. (en algunas ocasiones S). Son importantes porque son las biomoléculas más abundantes en peso seco (50%)
Clasificación de las proteinas según su conformación
 lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
puentes de hidrogeno enlaces covalentes Interacciones no-covalentes PUENTE DE HIDROGENO fuerte puente de hidrogeno menos fuerte puente de hidrogeno
 PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
HEMOGLOBINA Y MIOGLOBINA
 HEMOGLOBINA Y MIOGLOBINA 1 CARACTERÍSTICAS DE HIERRO Configuración electrónica [Ar] 3d 6 4s 2 Sus complejos mononucleares suelen ser octaédricos y de espín alto Sus momentos magnéticos son prácticamente
HEMOGLOBINA Y MIOGLOBINA 1 CARACTERÍSTICAS DE HIERRO Configuración electrónica [Ar] 3d 6 4s 2 Sus complejos mononucleares suelen ser octaédricos y de espín alto Sus momentos magnéticos son prácticamente
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4
 ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
Aminoácidos y péptidos
 Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
ESTRUCTURA DE LAS PROTEÍNAS. La conformación de las proteínas viene definida por cuatro estructuras: Enlaces sencillos de rotación libre
 ESTRUCTURA DE LAS PROTEÍNAS La existencia de enlaces en la cadena polipeptídica que permiten la libre rotación de sus átomos, posibilita que (en teoría ) cualquier proteína puede adoptar un elevado número
ESTRUCTURA DE LAS PROTEÍNAS La existencia de enlaces en la cadena polipeptídica que permiten la libre rotación de sus átomos, posibilita que (en teoría ) cualquier proteína puede adoptar un elevado número
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
Moléculas orgánicas. Proteínas y Lípidos
 Moléculas orgánicas Proteínas y Lípidos PROTEINAS: Son moléculas formadas por O, C, H, y N. La mayoría también contiene S. Son macromoléculas formadas por monómeros (unidades) llamados aminoácidos, ya
Moléculas orgánicas Proteínas y Lípidos PROTEINAS: Son moléculas formadas por O, C, H, y N. La mayoría también contiene S. Son macromoléculas formadas por monómeros (unidades) llamados aminoácidos, ya
QUÍMICA DE PROTEÍNAS
 QUÍMICA DE PROTEÍNAS ORGANIZACIÓN ESTRUCTURAL Se han descrito cuatro niveles en la estructura de las proteínas: 1. Primaria. Se refiere a la secuencia en que están unidos los aminoácidos, formando cadenas
QUÍMICA DE PROTEÍNAS ORGANIZACIÓN ESTRUCTURAL Se han descrito cuatro niveles en la estructura de las proteínas: 1. Primaria. Se refiere a la secuencia en que están unidos los aminoácidos, formando cadenas
Estructura secundaria de las proteínas
 Estructura secundaria de las proteínas Niveles de estructuración en las proteínas Se refiere a cualquier segmento de una cadena polipeptídica y describe el arreglo espacial local de los átomos de la cadena
Estructura secundaria de las proteínas Niveles de estructuración en las proteínas Se refiere a cualquier segmento de una cadena polipeptídica y describe el arreglo espacial local de los átomos de la cadena
PROTEÍNAS. Lubert Stryer Jeremy M. Berg John L. Tymoczko Bioquimica (5. ed) Ed. Reverte. PROTEÍNAS generalidades
 PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
Tema 4b Estructura tridimensional de las proteínas. Estructura supersecundaria y terciaria.
 Tema 4b Estructura tridimensional de las proteínas. Estructura supersecundaria y terciaria. Estructura supersecundaria Motivos Dominios Estructura terciaria Fuerzas que la estabilizan Plegamiento de proteínas
Tema 4b Estructura tridimensional de las proteínas. Estructura supersecundaria y terciaria. Estructura supersecundaria Motivos Dominios Estructura terciaria Fuerzas que la estabilizan Plegamiento de proteínas
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS 1. Características generales 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las proteínas 5.
TEMA 4: LAS PROTEÍNAS 1. Características generales 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las proteínas 5.
Tema 8. Biomoléculas: Proteínas y Ácidos Nucleicos
 Tema 8. Biomoléculas: Proteínas y Ácidos Nucleicos 1. Proteínas 1.1. Introducción 1.2. Aminoácidos, péptidos y proteínas 1.3. Estructura primaria: secuencia 1.4. Estructura secundaria 1.5. Estructura terciaria
Tema 8. Biomoléculas: Proteínas y Ácidos Nucleicos 1. Proteínas 1.1. Introducción 1.2. Aminoácidos, péptidos y proteínas 1.3. Estructura primaria: secuencia 1.4. Estructura secundaria 1.5. Estructura terciaria
Proteinas. Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia
 Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
QUÍMICA DE LAS BIOMOLÉCULAS
 QUÍMICA DE LAS BIMLÉCULAS AMINÁCIDS Y PRTEÍNAS Tema 11: Aminoácidos Tema 12: Proteínas A - Z Unidad 5: Aminoácidos y Proteínas Veterinaria AMINÁCIDS H 2 N CH C R H CLASIFICACIÓN: 1- AMINÁCIDS MNAMIN-MNCARBXÍLICS
QUÍMICA DE LAS BIMLÉCULAS AMINÁCIDS Y PRTEÍNAS Tema 11: Aminoácidos Tema 12: Proteínas A - Z Unidad 5: Aminoácidos y Proteínas Veterinaria AMINÁCIDS H 2 N CH C R H CLASIFICACIÓN: 1- AMINÁCIDS MNAMIN-MNCARBXÍLICS
TEMA 6: PROTEÍNAS. Definición de proteínas y aminoácidos
 TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
J. L. Sánchez Guillén. IES Pando - Oviedo Departamento de Biología y Geología
 J. L. Sánchez Guillén IES Pando - Oviedo Departamento de Biología y Geología 1-GENERALIDADES Concepto: Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos,
J. L. Sánchez Guillén IES Pando - Oviedo Departamento de Biología y Geología 1-GENERALIDADES Concepto: Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos,
FUNCIONES. Gran parte de la información genética de las células se expresa en forma de proteínas, las cuales desempeñan muy diversas funciones:
 Bioquímica CONCEPTO Son polímeros formados por monómeros llamados aminoácidos. Hay 20 aminoácidos en la naturaleza, que se combinan para formar miles de proteínas (muchos grupos funcionales: alcoholes,
Bioquímica CONCEPTO Son polímeros formados por monómeros llamados aminoácidos. Hay 20 aminoácidos en la naturaleza, que se combinan para formar miles de proteínas (muchos grupos funcionales: alcoholes,
Biomoléculas. Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos
 Biomoléculas Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos Aminoácidos, péptidos y proteínas Las proteínas cumplen importantes funciones biológicas:
Biomoléculas Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos Aminoácidos, péptidos y proteínas Las proteínas cumplen importantes funciones biológicas:
Tema 5 Estructura cuaternaria de proteínas
 Tema 5 Estructura cuaternaria de proteínas Estructura y función de la Hemoglobina Unión de la Hemoglobina a ligandos Curva unión O 2 a la Hemoglobina Efectores alostéricos Efecto del ph sobre la saturación
Tema 5 Estructura cuaternaria de proteínas Estructura y función de la Hemoglobina Unión de la Hemoglobina a ligandos Curva unión O 2 a la Hemoglobina Efectores alostéricos Efecto del ph sobre la saturación
Prof : Javier Cabello Schomburg, MS
 Prof : Javier Cabello Schomburg, MS Las enzimas son biocatalizadores, quienes permiten la producción de las reacciones metabólicas Son especificas para cada reacción Las hormonas son sustancias producidas
Prof : Javier Cabello Schomburg, MS Las enzimas son biocatalizadores, quienes permiten la producción de las reacciones metabólicas Son especificas para cada reacción Las hormonas son sustancias producidas
Unidad 3: Organización molecular de la célula Proteínas
 Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
estructura primaria estructura secundaria estructura terciaria La estructura cuaternaria
 La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
ACIDOS NUCLEICOS nucleotidos. PROTEINAS aminoácidos. POLISACARIDOS monosacáridos
 AIDOS NULEIOS nucleotidos PROTEINAS aminoácidos POLISAARIDOS monosacáridos ESTRUTURA DE PROTEÍNAS: POLÍMEROS DE AMINOÁIDOS PRIMARIA NIVELES ESTRUTURALES SEUNDARIA TERIARIA Formas de representación de proteínas
AIDOS NULEIOS nucleotidos PROTEINAS aminoácidos POLISAARIDOS monosacáridos ESTRUTURA DE PROTEÍNAS: POLÍMEROS DE AMINOÁIDOS PRIMARIA NIVELES ESTRUTURALES SEUNDARIA TERIARIA Formas de representación de proteínas
Biomoléculas orgánicas III. Las proteínas
 Biomoléculas orgánicas III Las proteínas Introducción Las proteínas son biomoléculas orgánicas formadas por Carbono, Hidrógeno, Oxígeno y Nitrógeno. En ocasiones aparecen Fósforo y Azufre. Su unidad básica
Biomoléculas orgánicas III Las proteínas Introducción Las proteínas son biomoléculas orgánicas formadas por Carbono, Hidrógeno, Oxígeno y Nitrógeno. En ocasiones aparecen Fósforo y Azufre. Su unidad básica
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
Estructura de proteínas
 Estructura de proteínas diversidad química de las cadenas laterales de los aa diversidad funcional Reconocimiento de ligandos catalisis Elementos estructurales Para que la cadena polipeptidica funcione
Estructura de proteínas diversidad química de las cadenas laterales de los aa diversidad funcional Reconocimiento de ligandos catalisis Elementos estructurales Para que la cadena polipeptidica funcione
estructura primaria estructura secundaria estructura terciaria La estructura cuaternaria
 La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
Estructura y función de proteínas
 Estructura y función de proteínas Luciferina y uciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo, escamas, cuernos, lana, uñas y plumas.
Estructura y función de proteínas Luciferina y uciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo, escamas, cuernos, lana, uñas y plumas.
Las proteínas. Dra. Nardy Diez García Investigadora
 Las proteínas Dra. Nardy Diez García Investigadora Son la clave de la vida Glicina o glicocola R=H Grupo Carboxilo Grupo Amino Es importante comprender estas propiedades porque son la clave de la estructura
Las proteínas Dra. Nardy Diez García Investigadora Son la clave de la vida Glicina o glicocola R=H Grupo Carboxilo Grupo Amino Es importante comprender estas propiedades porque son la clave de la estructura
Unidad IV. Sub-Unidad 4.3.
 República Bolivariana de Venezuela Universidad del Zulia Facultad de Medicina Escuela de Nutrición y Dietética Cátedra de Química General para Nutrición Unidad IV. Sub-Unidad 4.3. Prof. Alfonso R. Bravo
República Bolivariana de Venezuela Universidad del Zulia Facultad de Medicina Escuela de Nutrición y Dietética Cátedra de Química General para Nutrición Unidad IV. Sub-Unidad 4.3. Prof. Alfonso R. Bravo
Aminoácidos y Proteínas. Bioquímica Kinesiología UNLaM 2016
 Aminoácidos y Proteínas Bioquímica Kinesiología UNLaM 2016 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
Aminoácidos y Proteínas Bioquímica Kinesiología UNLaM 2016 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
IV electivo. Unidad 1: Integración célula organismo Genes, proteínas y enzimas
 IV electivo Unidad 1: Integración célula organismo Genes, proteínas y enzimas Objetivo Analizar la composición de un gen y la respectiva formación de proteínas Material genético Material genético Cromosoma
IV electivo Unidad 1: Integración célula organismo Genes, proteínas y enzimas Objetivo Analizar la composición de un gen y la respectiva formación de proteínas Material genético Material genético Cromosoma
Estructura tridimensional de proteínas
 Estructura tridimensional de proteínas 1. En solución acuosa, la conformación proteica esta determinada por dos factores prioritarios. Uno es la formación de un número máximo de enlaces de hidrógeno. El
Estructura tridimensional de proteínas 1. En solución acuosa, la conformación proteica esta determinada por dos factores prioritarios. Uno es la formación de un número máximo de enlaces de hidrógeno. El
NIVELES ESTRUCTURALES DE LAS PROTEÍNAS
 NIVELES ESTRUCTURALES DE LAS PROTEÍNAS 1 Péptidos y Polipéptidos: Se forman por uniones peptídicas de α-l-aminoácidos, siguiendo un orden diseñado por las enzimas que los unen, pero no tienen codificación
NIVELES ESTRUCTURALES DE LAS PROTEÍNAS 1 Péptidos y Polipéptidos: Se forman por uniones peptídicas de α-l-aminoácidos, siguiendo un orden diseñado por las enzimas que los unen, pero no tienen codificación
Proteínas. Cual es la gracia? KEVLAR. polímeros biológicos es su versatilidad para formar una gran variedad estructuras con funciones especializadas.
 Estructura de Proteínas KEVLAR Dr. Mauricio Baez [email protected] uchile cl Laboratorio de Bioquímica Facultad de Ciencias Químicas y Farmacéuticas Universidad de Chile Proteínas. Co-polímeros
Estructura de Proteínas KEVLAR Dr. Mauricio Baez [email protected] uchile cl Laboratorio de Bioquímica Facultad de Ciencias Químicas y Farmacéuticas Universidad de Chile Proteínas. Co-polímeros
Proteínas y Ácidos Nucleicos
 Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Biomoléculas PROTEÍNAS
 Biomoléculas PROTEÍNAS Las proteínas son biomoléculas orgánicas, formadas por unidades menores llamadas aminoácidos. Son polímeros sintetizados a partir de la unión de varios monómeros a través de un enlace
Biomoléculas PROTEÍNAS Las proteínas son biomoléculas orgánicas, formadas por unidades menores llamadas aminoácidos. Son polímeros sintetizados a partir de la unión de varios monómeros a través de un enlace
Estructura 3D de proteínas
 Estructura 3D de proteínas Aportaciones de la Bioinformática Structural Bioinformatics Laboratory Research Group on Biomedical Informatics (GRIB) Universitat Pompeu Fabra Sumario Conceptos básicos (I):
Estructura 3D de proteínas Aportaciones de la Bioinformática Structural Bioinformatics Laboratory Research Group on Biomedical Informatics (GRIB) Universitat Pompeu Fabra Sumario Conceptos básicos (I):
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Proteínas.
 Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
AMINOÁCIDOS: LOS MONÓMEROS DE LAS PROTEÍNAS
 AMINOÁCIDOS: LOS MONÓMEROS DE LAS PROTEÍNAS Los aminoácidos son moléculas sencillas, con una estructura general que presenta: 1- Una parte común, con un grupo carboxilo y un grupo amino unidos al mismo
AMINOÁCIDOS: LOS MONÓMEROS DE LAS PROTEÍNAS Los aminoácidos son moléculas sencillas, con una estructura general que presenta: 1- Una parte común, con un grupo carboxilo y un grupo amino unidos al mismo
Proteínas. Características generales
 Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
a) Aminoácidos b) Estructura primaria
 Estructura y función de proteínas a) Aminoácidos b) Estructura primaria Luciferina y luciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo,
Estructura y función de proteínas a) Aminoácidos b) Estructura primaria Luciferina y luciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo,
Es una estructura determinada por la cadena polipeptídica de la estructura primaria.
 Es una estructura determinada por la cadena polipeptídica de la estructura primaria. Se refiere a el plegamiento de los dominios y a la disposición final de los dominios en el polipéptido. Los dominios
Es una estructura determinada por la cadena polipeptídica de la estructura primaria. Se refiere a el plegamiento de los dominios y a la disposición final de los dominios en el polipéptido. Los dominios
Conceptos básicos de biología molecular, I
 Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Proteínas fibrosas. α-queratinas
 Hélices α entrecruzadas por puentes disulfuro Proteínas fibrosas α-queratinas Estructura Características Localización Estructuras resistentes e insolubles de dureza y flexibilidad variables Estructura
Hélices α entrecruzadas por puentes disulfuro Proteínas fibrosas α-queratinas Estructura Características Localización Estructuras resistentes e insolubles de dureza y flexibilidad variables Estructura
