Tema III: Ecuaciones de Estado
|
|
|
- Andrea Crespo Palma
- hace 5 años
- Vistas:
Transcripción
1 Tema III: Ecuaciones de Estado Contenido: 1. Introducción 2. Bases formales sobre las ecuaciones de estado 3. Sistema Hidrostático Gas ideal 4. Sistema: Alambres tensores 5. Sistema: Láminas superficiales (membranas) 6. Otros Sistemas: Lámina de Dieléctrico Varilla paramagnética.
2 Silabario: Termodinámica Clásica. García-Colín (GC). Capítulo 3. p Calor y Termodinámica. Zemansky-Dittman (ZD). Capítulo 2. Secciones 2.5 a 2.13, p Modern Thermodynamics. Kandepudi-Prigogine (KP). Sec. 1.3, p. 7-16
3 1. Introducción Una consecuencia importante de la Ley Cero de la Termodinámica abordada en el tema anterior fue la existencia de la ecuación de estado. 1, 2, 3, Coordenadas Termodinámicas Sistema Termodinámico φ( 1, 2, 3, ) = Ecuación de Estado Que también se puede escribir como: f (, 1, 2, 3, ) = 0 Para sistemas mas sencillos. Sean, y las coordenadas termodinámicas que lo caracterizan, escribimos la ecuación de estado como: φ(, ) =
4 La forma analítica de la ecuación de estado depende de la sustancia que constituye al sistema: es un agregado a la Termodinámica. Propuestas por rutas empíricas (ideadas para representar adecuadamente los valores medidos de las coordenadas termodinámicas) φ(, ) Propuestas por rutas teóricas (su deducción sustentada en un modelo molecular de la materia) La precisión de la ecuación de estado será reflejo de la precisión de los experimentos llevados a c a b o p a r a s u formulación La precisión de la ecuación de estado será reflejo de lo adecuado de los modelos de los potenciales de interacción entre las moléculas del sistema.
5 Algunos ejemplos de ecuaciones de estado: pv = nr p + N 2 V 2 p + an 2 V 2 M = c H V Nb ( ) = NR Π = a + b E ( ) I = k L L 0 V 2 V + Nb ( ) = NR ( 1 ε) Gas Ideal Van der Waals Beattie-Bridgman Curie Dieléctrico lineal Varilla elástica
6 2. Bases formales sobre las ecuaciones de estado Consideremos que por alguna razón NO conocemos la ecuación de estado de un sistema termodinámico, pero que SI sabemos cuales son las coordenadas termodinámicas que lo caracterizan:, Coordenadas Termodinámicas Sistema Termodinámico En virtud de la existencia de la ecuación de estado, de las tres coordenadas termodinámicas SOLAMENTE dos son independientes, entonces la tercera será una coordenada termodinámica dependiente de las dos primeras seleccionadas arbitrariamente como tales: = (,) = (,) = (, )
7 Cómo procedemos para conocer la relación entre las coordenadas termodinámicas del sistema? Analizando lo que sucede con ellas en cambios cuasiestáticos i i, i Estado Inicial d d d f f, f Estado Final Los cambios diferenciales de las coordenadas termodinámicas deberán ser tales que: suficientemente pequeños d << d << d << suficientemente grandes Para que no se vean afectados por la presencia de pocas moléculas
8 Ejemplo: cálculo sobre servilleta de papel. mmm en un litro de aire en condiciones normales.. mmm considerando que es un gas muy diluido. mmm cuál sería un cambio de volumen dv aceptable?... Veamos, para gases diluidos gas ideal : n pv R Estimando entonces, condiciones normales: p 1 atm 1x10 5 Pa V 1000 cm 3 1x10 3 m K Constante universal de los gases: R 8.31 J mol K Número de Avogadro: N A 6x10 23 partículas mol
9 Sustituyendo: n x x10 2 moles Entonces, haciendo uso de N A el número N de partículas en el recipiente de un litro es: N 2.4x10 22 partículas Ahora bien, la densidad de número o concentración (c) del gas en el recipiente, se define como: c N V luego entonces, la concentración del gas en el recipiente es: c 2.4x1022 1x x10 25 partículas m 3
10 Si conocemos la concentración de un sistema, es posible estimar el volumen por partícula (v) y también la distancia media (l) entre las partículas constituyentes del mismo, de la siguiente forma: [ c] partículas Volumen 1 [ c] Volumen partículas volumen por partícula v v = 1 c y como v 3 = 1 3 c En nuestro caso, la el volumen por partícula del sistema será: 1 v 24x x10 24 m 3 41nm 3 Entonces, un cambio de volumen dv aceptable en nuestro sistema deberá ser tal que: 41nm 3 << dv << 0.001m 3
11 Regresando a nuestro objetivo, como las coordenadas termodinámicas son coordenadas que nos permiten conocer inequívocamente el estado termodinámico del sistema, se les llama también coordenadas de estado (de estado termodinámico) y nos interesa practicar cambios diferenciales en ellas, entonces podemos escribir: = (,) = (,) = (, ) d = d = d = d + d + d + d d d (1) (2) (3) Es decir, la Termodinámica no nos indica cuales coordenadas termodinámicas considerar como variables independientes, por tanto, en general sería necesario tener conocimiento de los 6 coeficientes parciales para a partir de ellos asegurar la deducción de la ecuación de estado del sistema. Desde un contexto termodinámico, macroscópico, necesitaríamos disponer de mediciones experimentales que nos proporcionen dichos coeficientes. Siendo así, restaría un procedimiento de integración (analítica o numérica) para obtener: f (,,) = 0 Ecuación de Estado
12 Como veremos a continuación, será suficiente conocer solamente dos coeficientes parciales para conocer los cuatro restantes, es decir, solo dos coeficientes parciales son independientes. Teorema: Sean, y tres coordenadas termodinámicas relacionadas entre sí mediante la ecuación de estado. Entonces, como cualquiera par de ellas son independientes, se cumple que: = = = Relaciones Inversas = 1 Relación Cíclica
13 Sea: = (,) de la ec. (1), escribimos su diferencial como: d = d + d (1) Por otra parte de la ec. (2), escribimos el diferencial de como: d = d + d (2) Si sustituimos d de la ec. (2) en la (1), y desarrollamos, obtenemos: d 1 d = = = d d + Cómo dos coordenadas son independientes, y para todos los valores de sus diferenciales. d + + d + d d + d (4), la ec. (4) deberá cumplirse
14 - Sí: d = 0 de la ec. (4) se tiene que d 1 = 0 1 = 0 1 = (5) Relación Inversa - Sí: d = 0 de la ec. (4) se tiene que d + = 0 + = 0 = (5 ) La ec. (5) es una de las tres Relaciones Inversas y la ec. (5 ) es la base para obtener la Relación Cíclica, misma que reservamos para escribirla al final.
15 Para obtener las otras dos Relaciones Inversas, procedemos de forma similar a lo anterior. De la ec. (3), escribimos la diferencial de d = Lo que haremos ahora es sustituir nuevo para, obtener: d d +, como: d (3) de la ec. (3) en la (1), y desarrollamos de d 1 d = d = d + d + = d d + d + + d (6) d Ahora las coordenadas independientes, y, son tales que deberá cumplirse la ec. (6) independientemente de los valores de sus diferenciales.
16 - Sí: d = 0 de la ec. (6) se tiene que d 1 = 0 1 = 0 = 1 (7) Relación Inversa - Sí: d = 0 de la ec. (6) se tiene que d + = 0 + = 0 = (7 ) La ec. (7) es otra de las tres Relaciones Inversas y la ec. (7 ) es al igual que la (5 ) base para obtener la Relación Cíclica, misma que reservamos para escribirla al final.
17 De forma enteramente similar, si ahora sustituimos desarrollamos de nuevo, obtenemos: d = d 1 d + = d d de la ec. (3) en la ec. (2), y + d + d (8) - Sí: d = 0 de la ec. (8) se tiene que d 1 = 0 1 = 0 = 1 (9) Relación Inversa - Sí: d = 0 de la ec. (8) se tiene que d + = 0 + = 0 = (9 )
18 Las ecs. (5), (7) y (9) corresponden a las expresiones de las tres Relaciones Inversas del Teorema. Por otra parte, de la ec. (5) tenemos que: 1 = Sustituyendo esta relación inversa en la ec. (9 ): 1 = = 1 (10) Relación Cíclica Igualmente, la Relación Cíclica se puede obtener también sustituyendo la ec. (5) en la ec. (7 ); o también, sustituyendo la ec. (7) en la ec. (5 ). Conclusión: En virtud de las tres relaciones inversas y la relación cíclica (4 relaciones ) de los seis coeficientes parciales que aparecen en las ecs. (1)-(3), solamente dos son independientes, es decir, bastará medir o conocer solo dos de ellos para que los otros cuatros se conozcan también.
19 3. Sistema hidrostático
20 4. Sistema: Alambre tensores
21 5. Sistema: Láminas superficiales
22 6. Otros sistemas
Tema I: Introducción
 Tema I: Introducción Contenido: I.1 Ubicación y Objetivo de la Termodinámica I.2 Definiciones Generales I.3 Aspectos Formales Silabario: Termodinámica Clásica. García-Colín (GC). Capítulo 1. Generalidades,
Tema I: Introducción Contenido: I.1 Ubicación y Objetivo de la Termodinámica I.2 Definiciones Generales I.3 Aspectos Formales Silabario: Termodinámica Clásica. García-Colín (GC). Capítulo 1. Generalidades,
Tema IV: Trabajo Termodinámico
 Tema IV: Trabajo Termodinámico Contenido: 1. Introducción 2. Definición general de trabajo termodinámico 3. Sistema Hidrostático Procesos típicos Gas ideal 4. Trabajo termodinámico en otros sistemas Alambre
Tema IV: Trabajo Termodinámico Contenido: 1. Introducción 2. Definición general de trabajo termodinámico 3. Sistema Hidrostático Procesos típicos Gas ideal 4. Trabajo termodinámico en otros sistemas Alambre
Tema V: Primera Ley de la Termodinamica
 Tema V: Primera Ley de la Termodinamica Contenido: 1.Introducción fenomenológica.. 2. Primera Ley de la Termodinámica Energía Interna 3. Primera Ley de la Termodinámica. Generalización Conservación de
Tema V: Primera Ley de la Termodinamica Contenido: 1.Introducción fenomenológica.. 2. Primera Ley de la Termodinámica Energía Interna 3. Primera Ley de la Termodinámica. Generalización Conservación de
Termodinámica Clásica
 Termodinámica Clásica Conceptos fundamentales Física Estadística Maestría en Ciencias (Física) IFUAP Lilia Meza Montes Primavera 2016 Historia Mecánica Clásica (1833) Ecuaciones de (Lagrange) Hamilton
Termodinámica Clásica Conceptos fundamentales Física Estadística Maestría en Ciencias (Física) IFUAP Lilia Meza Montes Primavera 2016 Historia Mecánica Clásica (1833) Ecuaciones de (Lagrange) Hamilton
PROPIEDADES TÉRMICAS DE LA MATERIA. Fís. Carlos Adrián Jiménez Carballo Escuela de Física Instituto Tecnológico de Costa Rica
 PROPIEDADES TÉRMICAS DE LA MATERIA Fís. Carlos Adrián Jiménez Carballo Escuela de Física Instituto Tecnológico de Costa Rica 1 / 27 Objetivos Identificar un de gas ideal. Identificar algunas leyes de los
PROPIEDADES TÉRMICAS DE LA MATERIA Fís. Carlos Adrián Jiménez Carballo Escuela de Física Instituto Tecnológico de Costa Rica 1 / 27 Objetivos Identificar un de gas ideal. Identificar algunas leyes de los
TERMODINÁMICA y FÍSICA ESTADÍSTICA I
 TERMODINÁMICA y FÍSICA ESTADÍSTICA I Tema 1 - LA TEMPERATURA Y OTROS CONCEPTOS BÁSICOS DE LA TERMODINÁMICA Introducción: características generales y objetivos de la termodinámica. Comparación de los criterios
TERMODINÁMICA y FÍSICA ESTADÍSTICA I Tema 1 - LA TEMPERATURA Y OTROS CONCEPTOS BÁSICOS DE LA TERMODINÁMICA Introducción: características generales y objetivos de la termodinámica. Comparación de los criterios
GAS IDEAL SIMPLE : desde el punto de vista termodinámico un gas ideal está caracterizado por dos ecuaciones de estado:
 SISTEMAS EJEMPLO: GAS IDEAL SIMPLE : desde el punto de vista termodinámico un gas ideal está caracterizado por dos ecuaciones de estado: Ecuación de estado mecánica. Ecuación de estado térmica. donde c
SISTEMAS EJEMPLO: GAS IDEAL SIMPLE : desde el punto de vista termodinámico un gas ideal está caracterizado por dos ecuaciones de estado: Ecuación de estado mecánica. Ecuación de estado térmica. donde c
Termodinámica. Energía interna y Temperatura
 Termodinámica Energía interna y Temperatura 1.Conceptos fundamentales Termodinámica: Ciencia macroscópica Sistema Termodinámico: porción del unierso dentro de una superficie cerrada ( borde) que lo separa
Termodinámica Energía interna y Temperatura 1.Conceptos fundamentales Termodinámica: Ciencia macroscópica Sistema Termodinámico: porción del unierso dentro de una superficie cerrada ( borde) que lo separa
Introducción a la termodinámica
 Introducción a la termodinámica Prof. Jesús Hernández Trujillo Fac. Química, UNAM 31 de enero de 2017 Fisicoquímica La termodinámica es una rama de la Fisicoquímica Fisicoquímica: El estudio de los principios
Introducción a la termodinámica Prof. Jesús Hernández Trujillo Fac. Química, UNAM 31 de enero de 2017 Fisicoquímica La termodinámica es una rama de la Fisicoquímica Fisicoquímica: El estudio de los principios
FACULTAD INGENIERÍA OPTATIVA: TERMODINÁMICA. Ingeniería. Ingeniería en Tecnología de Procesos Optativa CI660
 DES: Ingeniería UNIVERSIDAD AUTÓNOMA DE CHIHUAHUA Clave: 08MSU007H Clave: 08USU4053W FACULTAD INGENIERÍA PROGRAMA DEL CURSO: OPTATIVA: TERMODINÁMICA Programa(s) Educativo(s): Tipo de materia: Clave de
DES: Ingeniería UNIVERSIDAD AUTÓNOMA DE CHIHUAHUA Clave: 08MSU007H Clave: 08USU4053W FACULTAD INGENIERÍA PROGRAMA DEL CURSO: OPTATIVA: TERMODINÁMICA Programa(s) Educativo(s): Tipo de materia: Clave de
Conceptos Básicos Termodinámica
 Conceptos Básicos Termodinámica Los sistemas físicos que encontramos en la Naturaleza consisten en un agregado de un número muy grande de átomos. La materia está en uno de los tres estados: sólido, líquido
Conceptos Básicos Termodinámica Los sistemas físicos que encontramos en la Naturaleza consisten en un agregado de un número muy grande de átomos. La materia está en uno de los tres estados: sólido, líquido
Existe una relación de dependencia entre las variables termodinámicas de un sistema que se denomina ecuación
 2.0- Ecuaciones de estado Supongamos que una masa constante de un cierto gas, de composición asimismo constante, se encuentra contenida en un recipiente de volumen variable, como por ejemplo, un cilindro
2.0- Ecuaciones de estado Supongamos que una masa constante de un cierto gas, de composición asimismo constante, se encuentra contenida en un recipiente de volumen variable, como por ejemplo, un cilindro
Tema 12. Gases. Química General e Inorgánica A ESTADOS DE AGREGACION DE LA MATERIA
 Tema 12 Gases Química General e Inorgánica A ESTADOS DE AGREGACION DE LA MATERIA 2.1 2.1 Variables que determinan el estado de agregación Tipo de material o materia Temperatura Presión 2.2 Elementos que
Tema 12 Gases Química General e Inorgánica A ESTADOS DE AGREGACION DE LA MATERIA 2.1 2.1 Variables que determinan el estado de agregación Tipo de material o materia Temperatura Presión 2.2 Elementos que
Electricidad y calor. Dr. Roberto Pedro Duarte Zamorano. Departamento de Física
 Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
mediante un punto en dicho diagrama. La temperatura de dicho estado se obtiene haciendo uso de la ecuación de estado.
 Función de estado Una función de estado es una propiedad de un sistema termodinámico que depende sólo del estado del sistema, y no de la forma en que el sistema llegó a dicho estado. Por ejemplo, la energía
Función de estado Una función de estado es una propiedad de un sistema termodinámico que depende sólo del estado del sistema, y no de la forma en que el sistema llegó a dicho estado. Por ejemplo, la energía
Módulo 1 Termodinámica
 Módulo 1 Termodinámica 1er cuatrimestre del 2012 Dra. Noelia Burgardt Termodinámica de equilibrio - Sistemas, paredes, procesos, función de estado - Repaso de gases ideales y reales - Trabajo y calor -
Módulo 1 Termodinámica 1er cuatrimestre del 2012 Dra. Noelia Burgardt Termodinámica de equilibrio - Sistemas, paredes, procesos, función de estado - Repaso de gases ideales y reales - Trabajo y calor -
LEY DE BOYLE. La presión (p) de un gas ideal varía inversamente a su volumen (V) si la temperatura (T) se mantiene constante.
 Gas un GAS IDEAL tiene las propiedades siguientes: está formado por partículas llamadas moléculas. Estas se mueven irregularmente y obedecen las leyes de Newton del movimiento. El número total de moléculas
Gas un GAS IDEAL tiene las propiedades siguientes: está formado por partículas llamadas moléculas. Estas se mueven irregularmente y obedecen las leyes de Newton del movimiento. El número total de moléculas
COORDINACION ACADEMICA UNIDAD QUERETARO. Problemas representativos para el examen de ingreso a doctorado. Termodinámica
 UNIDAD QUEREARO roblemas representativos para el examen de ingreso a doctorado ermodinámica Equilibrio térmico, ecuaciones de estado y trabajo 1.- Los sistemas 1 y son sales paramagnéticas con coordenadas
UNIDAD QUEREARO roblemas representativos para el examen de ingreso a doctorado ermodinámica Equilibrio térmico, ecuaciones de estado y trabajo 1.- Los sistemas 1 y son sales paramagnéticas con coordenadas
1 Separación de fases en el fluido de van der Waals
 1 Separación de fases en el fluido de van der Waals La energía libre de van der Waals está dada por [ ( ) ] V Nb F (N, V, ) = N ln + 1 an N Nλ 3 V. (1) donde λ = h/ πm es la longitud de onda de Broglie.
1 Separación de fases en el fluido de van der Waals La energía libre de van der Waals está dada por [ ( ) ] V Nb F (N, V, ) = N ln + 1 an N Nλ 3 V. (1) donde λ = h/ πm es la longitud de onda de Broglie.
RESUMEN TERMO 2A_1C 2016
 RESUMEN TERMO 2A_1C 2016 entorno o exterior sistema Universo sistema abierto cerrado aislado materia y energía energía nada Olla con agua sobre una hornalla Agua en un termo perfecto Persona o cualquier
RESUMEN TERMO 2A_1C 2016 entorno o exterior sistema Universo sistema abierto cerrado aislado materia y energía energía nada Olla con agua sobre una hornalla Agua en un termo perfecto Persona o cualquier
Introducción y conceptos básicos.
 Introducción y conceptos básicos. Introducción a la Física Ambiental. Tema 1. Tema 1 IFA (Prof. Ramos) 1 Tema 1.- " Introducción y conceptos básicos". Crítica al teorema de conservación de la energía mecánica:
Introducción y conceptos básicos. Introducción a la Física Ambiental. Tema 1. Tema 1 IFA (Prof. Ramos) 1 Tema 1.- " Introducción y conceptos básicos". Crítica al teorema de conservación de la energía mecánica:
El Problema de la Termodinámica y los Postulados.
 El Problema de la Termodinámica y los Postulados. Escala Temporal: Un sistema macroscópico contiene 10 +23 átomos (y coordenadas). Pero de todas ellas, sólo unas pocas son relevantes. Las medidas macroscópicas
El Problema de la Termodinámica y los Postulados. Escala Temporal: Un sistema macroscópico contiene 10 +23 átomos (y coordenadas). Pero de todas ellas, sólo unas pocas son relevantes. Las medidas macroscópicas
Cuando 2 y 3 están en equilibrio se tiene
 roblemario de ermodinámica Equilibrio térmico, ecuaciones de estado y trabajo Los sistemas y son sales paramagnéticas con coordenadas B,M y B M, respectivamente. El sistema 3 es un gas con coordenadas,
roblemario de ermodinámica Equilibrio térmico, ecuaciones de estado y trabajo Los sistemas y son sales paramagnéticas con coordenadas B,M y B M, respectivamente. El sistema 3 es un gas con coordenadas,
EVALUACIÓN FINAL DE QUÍMICA
 EVALUACIÓN FINAL DE QUÍMICA ESTADO LÍQUIDO En los líquidos las moléculas se mueven lentamente con respecto a los gases, las fuerzas de atracción moleculares son capaces de mantenerlas juntas dentro de
EVALUACIÓN FINAL DE QUÍMICA ESTADO LÍQUIDO En los líquidos las moléculas se mueven lentamente con respecto a los gases, las fuerzas de atracción moleculares son capaces de mantenerlas juntas dentro de
Puesto que ambas derivadas son iguales a cero en el punto crítico podemos escribir:
 Ecuaciones de estado Una ecuación de estado exacta, que es una representación analítica del comportamiento, frecuentemente es deseable desde un punto de vista computacional. Se han desarrollado muchas
Ecuaciones de estado Una ecuación de estado exacta, que es una representación analítica del comportamiento, frecuentemente es deseable desde un punto de vista computacional. Se han desarrollado muchas
Termodinámica. Calor y Temperatura
 Termodinámica Calor y Temperatura 1 Temas 3. GASES IDEALES Y ESTADOS TERMODINÁMICOS. 3.1 Concepto y características del gas ideal. 3.2 Ley de Boyle, Ley de Charles, Ley de Gay- Lussac e hipótesis de Avogadro.
Termodinámica Calor y Temperatura 1 Temas 3. GASES IDEALES Y ESTADOS TERMODINÁMICOS. 3.1 Concepto y características del gas ideal. 3.2 Ley de Boyle, Ley de Charles, Ley de Gay- Lussac e hipótesis de Avogadro.
El Equilibrio Termodinámico. Tipos de Equilibrios.
 TEMA 1.) CONCEPTOS BASICOS Sistema Termodinámico. Paredes. Tipos de Sistemas. Criterio de Signos. Estado Termodinámico. El Equilibrio Termodinámico. Tipos de Equilibrios. Variables Termodinámicas. Procesos
TEMA 1.) CONCEPTOS BASICOS Sistema Termodinámico. Paredes. Tipos de Sistemas. Criterio de Signos. Estado Termodinámico. El Equilibrio Termodinámico. Tipos de Equilibrios. Variables Termodinámicas. Procesos
Sustancia que se caracteriza porque sus moléculas. no tiene forma definida. adquiere la forma del recipiente que lo contiene.
 Qué es un gas? Sustancia que se caracteriza porque sus moléculas están en desorden. tienen gran energía. están muy separadas entre sí. prácticamente no se atraen entre sí. Una sustancia gaseosa no tiene
Qué es un gas? Sustancia que se caracteriza porque sus moléculas están en desorden. tienen gran energía. están muy separadas entre sí. prácticamente no se atraen entre sí. Una sustancia gaseosa no tiene
XIII Olimpiada Nacional de Física Burgos, de marzo de Dispositivo de Gay-Lussac para sus experiencias sobre la dilatación de los gases
 XIIIOlimpiada ESPAÑOLA DE FISICA XXXIII INERNACIONAL REAL SOCIEDAD ESPAñOLA DE FíSICA UNIVERSIDAD DE BURGOS XIII Olimpiada Nacional de Física Burgos, 21-24 de marzo de 22 Dispositivo de Gay-Lussac para
XIIIOlimpiada ESPAÑOLA DE FISICA XXXIII INERNACIONAL REAL SOCIEDAD ESPAñOLA DE FíSICA UNIVERSIDAD DE BURGOS XIII Olimpiada Nacional de Física Burgos, 21-24 de marzo de 22 Dispositivo de Gay-Lussac para
Termodinámica: Conceptos Fundamentales Parte 3
 Termodinámica: Conceptos Fundamentales Parte 3 Olivier Skurtys Departamento de Ingeniería Mecánica Universidad Técnica Federico Santa María Email: olivier.skurtys@usm.cl Santiago, 26 de abril de 2012 Presentación
Termodinámica: Conceptos Fundamentales Parte 3 Olivier Skurtys Departamento de Ingeniería Mecánica Universidad Técnica Federico Santa María Email: olivier.skurtys@usm.cl Santiago, 26 de abril de 2012 Presentación
PRINCIPIOS FISICOQUÍMICOS EN GEOFÍSICA I
 RINCIIOS FISICOQUÍMICOS EN GEOFÍSICA I Introducción Conceptos Básicos de Termodinámica ropiedades Físicas de los Gases Gases Ideales Ecuaciones de Estado INTRODUCCIÓN La fisicoquímica se divide en 4 áreas:
RINCIIOS FISICOQUÍMICOS EN GEOFÍSICA I Introducción Conceptos Básicos de Termodinámica ropiedades Físicas de los Gases Gases Ideales Ecuaciones de Estado INTRODUCCIÓN La fisicoquímica se divide en 4 áreas:
Olimpíada Argentina de Física
 Pruebas Preparatorias Segunda Prueba: Termodinámica Nombre:... D.N.I.:... Escuela:... - Antes de comenzar a resolver la prueba lea cuidadosamente TODO el enunciado de la misma. - Escriba su nombre y su
Pruebas Preparatorias Segunda Prueba: Termodinámica Nombre:... D.N.I.:... Escuela:... - Antes de comenzar a resolver la prueba lea cuidadosamente TODO el enunciado de la misma. - Escriba su nombre y su
Facultad de Ingeniería Civil. Curso Propedéutico de Física Diciembre de 2017 Día 13 Estática de Fluidos y Propiedades Térmicas de la Materia
 Facultad de Ingeniería Civil Curso Propedéutico de Física Diciembre de 2017 Día 13 Estática de Fluidos y Propiedades Térmicas de la Materia Principales teorías de la Física son: Mecánica clásica - Termodinámica
Facultad de Ingeniería Civil Curso Propedéutico de Física Diciembre de 2017 Día 13 Estática de Fluidos y Propiedades Térmicas de la Materia Principales teorías de la Física son: Mecánica clásica - Termodinámica
Relaciones esfuerzo deformación
 Capítulo Relaciones esfuerzo deformación En esta sección se emplea la primera ley de la termodinámica para derivar la relación esfuerzo deformación..1. Relaciones constitutivas Se llama modelo constitutivo
Capítulo Relaciones esfuerzo deformación En esta sección se emplea la primera ley de la termodinámica para derivar la relación esfuerzo deformación..1. Relaciones constitutivas Se llama modelo constitutivo
CAPITULO V TERMODINAMICA - 115 -
 CAPIULO V ERMODINAMICA - 5 - 5. EL GAS IDEAL Es el conjunto de un gran número de partículas diminutas o puntuales, de simetría esférica, del mismo tamaño y de igual volumen, todas del mismo material. Por
CAPIULO V ERMODINAMICA - 5 - 5. EL GAS IDEAL Es el conjunto de un gran número de partículas diminutas o puntuales, de simetría esférica, del mismo tamaño y de igual volumen, todas del mismo material. Por
Principios Cero y Primero
 Principios Cero y Primero Prof. Luis Conde Departamento de Física Aplicada Página personal: http://plasmalab.aero.upm.es/~lcl/ Procesos termodinámicos Un sistema termodinámico experimenta un cambio de
Principios Cero y Primero Prof. Luis Conde Departamento de Física Aplicada Página personal: http://plasmalab.aero.upm.es/~lcl/ Procesos termodinámicos Un sistema termodinámico experimenta un cambio de
Sistema homogéneo de composición constante (cerrados)
 Sistema homogéneo de composición constante (cerrados) Todas las propiedades tienen un valor uniforme en todo el sistema. Sea temperatura, presión y composición en un sentido macroscópico. n 1 n 2 T, P
Sistema homogéneo de composición constante (cerrados) Todas las propiedades tienen un valor uniforme en todo el sistema. Sea temperatura, presión y composición en un sentido macroscópico. n 1 n 2 T, P
Electricidad y calor
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temas 3. Gases ideales y estados termodinámicos. i. Concepto y características del gas ideal.
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temas 3. Gases ideales y estados termodinámicos. i. Concepto y características del gas ideal.
Capítulo 10. Efectos de superficie. Sistema respiratorio
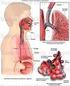 Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Resumen Cap. 8 - Felder Mercedes Beltramo 2 C 2015 Resumen Cap. 8
 Resumen Cap. 8 8.1 - Elementos de los cálculos de balance de energía 8.1a - Estados de referencia: repaso Es imposible conocer los valores absolutos de U y H para un especie en cierto estado. U (kj/mol)
Resumen Cap. 8 8.1 - Elementos de los cálculos de balance de energía 8.1a - Estados de referencia: repaso Es imposible conocer los valores absolutos de U y H para un especie en cierto estado. U (kj/mol)
Electricidad y calor. Dr. Roberto Pedro Duarte Zamorano. Departamento de Física 2011
 Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
El término teoría cinética hace referencia al modelo microscópico para un gas ideal Suposiciones: 1.- En los gases las moléculas son numerosas y la
 CAP 21 SERWAY El término teoría cinética hace referencia al modelo microscópico para un gas ideal Suposiciones: 1.- En los gases las moléculas son numerosas y la separación promedio entre ellas es grande
CAP 21 SERWAY El término teoría cinética hace referencia al modelo microscópico para un gas ideal Suposiciones: 1.- En los gases las moléculas son numerosas y la separación promedio entre ellas es grande
En el siglo XVIII la química estableció las medidas precisas de masa y volúmenes que llevaron a enunciar las llamadas leyes ponderales.
 1. LEYES PONDERALES En el siglo XVIII la química estableció las medidas precisas de masa y volúmenes que llevaron a enunciar las llamadas leyes ponderales. Ley de conservación de la masa de Lavoisier Lavosier
1. LEYES PONDERALES En el siglo XVIII la química estableció las medidas precisas de masa y volúmenes que llevaron a enunciar las llamadas leyes ponderales. Ley de conservación de la masa de Lavoisier Lavosier
Profesora: Teresa Esparza Araña ASPECTOS CUANTITATIVOS DE LA QUÍMICA. UNIDAD 2: Los gases ideales
 Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla ASPECTOS CUANTITATIVOS DE LA QUÍMICA UNIDAD 2: Los gases ideales ÍNDICE 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA
Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla ASPECTOS CUANTITATIVOS DE LA QUÍMICA UNIDAD 2: Los gases ideales ÍNDICE 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA
Electricidad y calor. Gases. Temas. 3. Gases ideales y estados termodinámicos. Webpage:
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temas 3. Gases ideales y estados termodinámicos. i. Concepto y características del gas ideal.
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temas 3. Gases ideales y estados termodinámicos. i. Concepto y características del gas ideal.
TEMA 2.- ESTADOS DE AGREGACIÓN DE LA MATERIA. GASES (I).
 TEMA 2.- ESTADOS DE AGREGACIÓN DE LA MATERIA. GASES (I). 1. Introducción. 2. Leyes de los gases ideales. Concepto de presión. Relación entre p y V de un gas. Ley de Boyle. Relación entre T y V de un gas.
TEMA 2.- ESTADOS DE AGREGACIÓN DE LA MATERIA. GASES (I). 1. Introducción. 2. Leyes de los gases ideales. Concepto de presión. Relación entre p y V de un gas. Ley de Boyle. Relación entre T y V de un gas.
Laboratorio de Física I, UNSAM- 2ndo. Cuatrimere 2002
 Experimento de Rüchardt Medición del cociente entre los calores específicos de un gas Maximiliano Gabriel De Napoli y Marina Alejandra Gonzálezmarugonza@hotmail.com Laboratorio de Física I, UNSAM- ndo.
Experimento de Rüchardt Medición del cociente entre los calores específicos de un gas Maximiliano Gabriel De Napoli y Marina Alejandra Gonzálezmarugonza@hotmail.com Laboratorio de Física I, UNSAM- ndo.
Electricidad y calor
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor. Webpage: Departamento de Física Universidad de Sonora
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
COEFICIENTE ADIABÁTICO DEL AIRE
 Prácticas de Termodinámica COEFICIENTE ADIABÁTICO DEL AIRE (21/09/2012) V-15-S1-M4 Macías Rodríguez, Javier Martín Ortiz, Cristina Medina Santano, Alejandro PRÁCTICA 2-a Determinación del coeficiente adiabático
Prácticas de Termodinámica COEFICIENTE ADIABÁTICO DEL AIRE (21/09/2012) V-15-S1-M4 Macías Rodríguez, Javier Martín Ortiz, Cristina Medina Santano, Alejandro PRÁCTICA 2-a Determinación del coeficiente adiabático
UNIVERSIDAD DE LEÓN. ESyTIA y EIIIIyA. Prof. Dr. Miguel Celemín Matachana. Dilatación térmica de los gases
 Cap. II: Termodinámica. Lección : Dilatación térmica de los gases Dilatación térmica de los gases La ecuación que proporciona la dilatación de un volumen no sirve para los gases si no se especifica la
Cap. II: Termodinámica. Lección : Dilatación térmica de los gases Dilatación térmica de los gases La ecuación que proporciona la dilatación de un volumen no sirve para los gases si no se especifica la
SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA
 I. CONTENIDOS: 1. Leyes de los gases. 2. Presión y temperatura. 3. Principio de Le Chatelier. 4. Constante de equilibrio. SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA II. OBJETIVOS: Al término de la Sesión,
I. CONTENIDOS: 1. Leyes de los gases. 2. Presión y temperatura. 3. Principio de Le Chatelier. 4. Constante de equilibrio. SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA II. OBJETIVOS: Al término de la Sesión,
Profesora: Teresa Esparza Araña LA CANTIDAD DE SUSTANCIA EN QUÍMICA. UNIDAD 6: Los gases ideales
 Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla LA CANTIDAD DE SUSTANCIA EN QUÍMICA UNIDAD 6: Los gases ideales 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA DE LA
Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla LA CANTIDAD DE SUSTANCIA EN QUÍMICA UNIDAD 6: Los gases ideales 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA DE LA
Lenguaje termodinámico. Práctica 1 Laboratorio de Termodinámica Ciclo
 Lenguaje termodinámico Práctica 1 Laboratorio de Termodinámica Ciclo 2013-1 1 Objetivo Que el alumno reflexione sobre la importancia de conocer, saber el significado, identificar, entender y aplicar adecuadamente
Lenguaje termodinámico Práctica 1 Laboratorio de Termodinámica Ciclo 2013-1 1 Objetivo Que el alumno reflexione sobre la importancia de conocer, saber el significado, identificar, entender y aplicar adecuadamente
CINETICA QUIMICA. ó M s s
 CINETICA QUIMICA La Cinética Química se encarga de estudiar las características de una reacción química, con respecto a su velocidad y a sus posibles mecanismos de explicación. La velocidad de una reacción
CINETICA QUIMICA La Cinética Química se encarga de estudiar las características de una reacción química, con respecto a su velocidad y a sus posibles mecanismos de explicación. La velocidad de una reacción
Los pasos que se dan son:
 Hasta ahora hemos admitido que podemos trabajar con la red de cores de nuestro sólido usando una aproximación clásica lo que nos ha permitido determinar los «modos normales de vibración» en el sentido
Hasta ahora hemos admitido que podemos trabajar con la red de cores de nuestro sólido usando una aproximación clásica lo que nos ha permitido determinar los «modos normales de vibración» en el sentido
TEMA 2: LEYES Y CONCEPTOS BÁSICOS EN QUÍMICA
 1. SUSTANCIAS PURAS Y MEZCLAS 2. LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS 2.1. LEY DE CONSERVACIÓN DE LA MATERIA Enunciada en 1783 por Lavoisier: La materia ni se crea ni se destruye, únicamente
1. SUSTANCIAS PURAS Y MEZCLAS 2. LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS 2.1. LEY DE CONSERVACIÓN DE LA MATERIA Enunciada en 1783 por Lavoisier: La materia ni se crea ni se destruye, únicamente
Reacciones Químicas. Homogéneas.
 Como se sabe, la materia está formada por partículas, dependiendo el comportamiento de esta (la materia) del estado físico en que se encuentran las partículas. Igualmente, sabemos que la materia no es
Como se sabe, la materia está formada por partículas, dependiendo el comportamiento de esta (la materia) del estado físico en que se encuentran las partículas. Igualmente, sabemos que la materia no es
UNIVERSIDAD TECNICA LUIS VARGAS TORRES" DE ESMERALDAS
 UNIVERSIDAD TECNICA LUIS VARGAS TORRES" DE ESMERALDAS FACULTAD DE INGENIERIAS Y TECNOLOGIAS ING. PAUL VISCAINO VALENCIA DOCENTE Esmeraldas, 06 de Julio del 2016 UNIVERSIDAD TECNICA "LUIS VARGAS TORRES"
UNIVERSIDAD TECNICA LUIS VARGAS TORRES" DE ESMERALDAS FACULTAD DE INGENIERIAS Y TECNOLOGIAS ING. PAUL VISCAINO VALENCIA DOCENTE Esmeraldas, 06 de Julio del 2016 UNIVERSIDAD TECNICA "LUIS VARGAS TORRES"
Los siguientes son elementos que pueden existir como gases a una temperatura de 25 C y 1 atm de presión
 Gases Los siguientes son elementos que pueden existir como gases a una temperatura de 25 C y 1 atm de presión Sustancias que existen como gases a una temperatura de 25 C y 1 atm de presión Características
Gases Los siguientes son elementos que pueden existir como gases a una temperatura de 25 C y 1 atm de presión Sustancias que existen como gases a una temperatura de 25 C y 1 atm de presión Características
( x) = a b, donde a y b son ciertas constantes
 Examen de Física-1 1 Ingeniería Química Segundo parcial. Enero de 01 Cuestiones (Un punto por cuestión). Cuestión 1: Una partícula de masa m se encuentra en un campo de energía potencial que solo depende
Examen de Física-1 1 Ingeniería Química Segundo parcial. Enero de 01 Cuestiones (Un punto por cuestión). Cuestión 1: Una partícula de masa m se encuentra en un campo de energía potencial que solo depende
Termodinámica. Calor y Temperatura
 Termodinámica Calor y Temperatura 1 Temas 4. PRIMERA LEY DE LA TERMODINÁMICA. 4.1 Concepto de Trabajo aplicado a gases. 4.2 Trabajo hecho por un gas ideal para los procesos: Isocóricos, isotérmicos, Isobáricos
Termodinámica Calor y Temperatura 1 Temas 4. PRIMERA LEY DE LA TERMODINÁMICA. 4.1 Concepto de Trabajo aplicado a gases. 4.2 Trabajo hecho por un gas ideal para los procesos: Isocóricos, isotérmicos, Isobáricos
FISICOQUIMICA UNQ Comisión C. Seminario 0 Conocimientos previos necesarios. Química
 FISICOQUIMICA UNQ Comisión C Seminario 0 Conocimientos previos necesarios Química a. Enuncie la ley de Coulomb. b. Qué es una molécula polar? Qué características debe presentar? c. En qué tipo de propiedades
FISICOQUIMICA UNQ Comisión C Seminario 0 Conocimientos previos necesarios Química a. Enuncie la ley de Coulomb. b. Qué es una molécula polar? Qué características debe presentar? c. En qué tipo de propiedades
Universidad Nacional Autónoma de México Facultad de Química
 Universidad Nacional Autónoma de México Facultad de Química Departamento de Fisicoquímica Laboratorio de Termodinámica DETERMINACIÓN DE LA CONSTANTE UNIVERSAL DE LOS GASES Profesores: Gerardo Omar Hernández
Universidad Nacional Autónoma de México Facultad de Química Departamento de Fisicoquímica Laboratorio de Termodinámica DETERMINACIÓN DE LA CONSTANTE UNIVERSAL DE LOS GASES Profesores: Gerardo Omar Hernández
Ecuaciones Diferenciales Homogéneas de Segundo Orden con Coeficientes Constantes.
 Ecuaciones Diferenciales Homogéneas de Segundo Orden con Coeficientes Constantes. La ecuación de segundo orden con coeficientes constantes se escribe como: d y d dy p q y f p y q son constantes d Si f
Ecuaciones Diferenciales Homogéneas de Segundo Orden con Coeficientes Constantes. La ecuación de segundo orden con coeficientes constantes se escribe como: d y d dy p q y f p y q son constantes d Si f
UD 6. Equilibrio químico
 UD 6. Equilibrio químico 1- Equilibrio químico. Constante de equilibrio. 2- Equilibrios gaseosos. 3- Factores que modifican el equilibrio. 4- Termodinámica y constante de equilibrio. 1- Equilibrio químico.
UD 6. Equilibrio químico 1- Equilibrio químico. Constante de equilibrio. 2- Equilibrios gaseosos. 3- Factores que modifican el equilibrio. 4- Termodinámica y constante de equilibrio. 1- Equilibrio químico.
Tema 5: Equilibrio químico
 Tema 5: Equilibrio químico. Concepto. Equilibrio y energía libre. Sistemas gaseosos. Ley de velocidad. Ley de acción de masas. Equilibrios heterogéneos. Aplicaciones de la constante de equilibrio. Cociente
Tema 5: Equilibrio químico. Concepto. Equilibrio y energía libre. Sistemas gaseosos. Ley de velocidad. Ley de acción de masas. Equilibrios heterogéneos. Aplicaciones de la constante de equilibrio. Cociente
Universidad Nacional Autónoma de México Departamento de Física
 Universidad Nacional Autónoma de México Departamento de Física Febrero de 2018 El alumno conocerá y manejará el concepto de presión. Mecánica clásica De los cuerpos rígidos Estática Dinámica Cinemática
Universidad Nacional Autónoma de México Departamento de Física Febrero de 2018 El alumno conocerá y manejará el concepto de presión. Mecánica clásica De los cuerpos rígidos Estática Dinámica Cinemática
ANTES: vamos a discutir primero solución general de Ec. Laplace en coordinadas cilíndricas (2D)
 PROBLEMA Calculo de distribución de potencial electroestático Anillo: con potencial exterior/interior conocido ANTES: vamos a discutir primero solución general de Ec. Laplace en coordinadas cilíndricas
PROBLEMA Calculo de distribución de potencial electroestático Anillo: con potencial exterior/interior conocido ANTES: vamos a discutir primero solución general de Ec. Laplace en coordinadas cilíndricas
Profesor: Joaquín Zueco Jordán Área de Máquinas y Motores Térmicos
 Comportamiento p-v-t en gases Profesor: Joaquín Zueco Jordán Área de Máquinas y Motores Térmicos _ P T v R Ecuación de estado en gases ideales _ lim P v J P 0 = R=8,3143 _ T mol k P v = R _ T PV = nrt
Comportamiento p-v-t en gases Profesor: Joaquín Zueco Jordán Área de Máquinas y Motores Térmicos _ P T v R Ecuación de estado en gases ideales _ lim P v J P 0 = R=8,3143 _ T mol k P v = R _ T PV = nrt
UD 6. Equilibrio químico
 UD 6. Equilibrio químico 1- Equilibrio químico. Constante de equilibrio. 2- Equilibrios gaseosos. 3- Factores que modifican el equilibrio. 4- Termodinámica y constante de equilibrio. 1- Equilibrio químico.
UD 6. Equilibrio químico 1- Equilibrio químico. Constante de equilibrio. 2- Equilibrios gaseosos. 3- Factores que modifican el equilibrio. 4- Termodinámica y constante de equilibrio. 1- Equilibrio químico.
Sistemas termodinámicos: Temperatura Temperatura: lo que medimos con un termómetro, Calor: energía que se transfiere por causa de una diferencia de
 Sistemas termodinámicos: Temperatura Temperatura: lo que medimos con un termómetro, Calor: energía que se transfiere por causa de una diferencia de temperatura. La descripción microscópica de una pequeña
Sistemas termodinámicos: Temperatura Temperatura: lo que medimos con un termómetro, Calor: energía que se transfiere por causa de una diferencia de temperatura. La descripción microscópica de una pequeña
Termodinámica. Calor y Temperatura
 Termodinámica Calor y Temperatura 1 Temas 1. TEMPERATURA Y LEY CERO. 1.1 Equilibrio Térmico y ley cero de la termodinámica. 1.2 Concepto de temperatura. 1.3 Tipos de termómetros. 1.4 Escalas de temperatura.
Termodinámica Calor y Temperatura 1 Temas 1. TEMPERATURA Y LEY CERO. 1.1 Equilibrio Térmico y ley cero de la termodinámica. 1.2 Concepto de temperatura. 1.3 Tipos de termómetros. 1.4 Escalas de temperatura.
Termodinámica. Calor y Temperatura. Gases. Temas
 Termodinámica Calor y Temperatura Temas 3. GSES IDELES Y ESTDOS TERMODINÁMICOS. 3. Concepto y características del gas ideal. 3. Ley de Boyle, Ley de Charles, Ley de Gay- Lussac e hipótesis de vogadro.
Termodinámica Calor y Temperatura Temas 3. GSES IDELES Y ESTDOS TERMODINÁMICOS. 3. Concepto y características del gas ideal. 3. Ley de Boyle, Ley de Charles, Ley de Gay- Lussac e hipótesis de vogadro.
A) NOMBRE DE CADA CURSO O ACTIVIDAD CURRICULAR: B) DATOS BÁSICOS DEL CURSO C) OBJETIVOS DEL CURSO TERMODINÁMICA Y TEORÍA CINÉTICA (OBLIGATORIA) Pág.
 A) NOMBRE DE CADA CURSO O ACTIVIDAD CURRICULAR: TERMODINÁMICA Y TEORÍA CINÉTICA (OBLIGATORIA) B) DATOS BÁSICOS DEL CURSO Semestre Horas de teoría Horas de práctica Horas trabajo adicional estudiante Créditos
A) NOMBRE DE CADA CURSO O ACTIVIDAD CURRICULAR: TERMODINÁMICA Y TEORÍA CINÉTICA (OBLIGATORIA) B) DATOS BÁSICOS DEL CURSO Semestre Horas de teoría Horas de práctica Horas trabajo adicional estudiante Créditos
Condiciones de Equilibrio.
 Condiciones de Equilibrio. Cuando eliminamos una ligadura interna nos planteamos encontrar el nuevo estado de equilibrio de entropía máxima. Nos preguntamos que propiedades comunes caracterizan estos estados
Condiciones de Equilibrio. Cuando eliminamos una ligadura interna nos planteamos encontrar el nuevo estado de equilibrio de entropía máxima. Nos preguntamos que propiedades comunes caracterizan estos estados
BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA
 BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA Unidad 2: Los gases ideales Teresa Esparza araña 1 Índice 1. Los estados de agregación de la materia a. Los estados de la materia b. Explicación según la teoría
BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA Unidad 2: Los gases ideales Teresa Esparza araña 1 Índice 1. Los estados de agregación de la materia a. Los estados de la materia b. Explicación según la teoría
EL ESTADO GASEOSO P R E S I Ó N
 EL ESTADO GASEOSO El aire está compuesto, principalmente, de los elementos oxígeno y nitrógeno. Otros elementos no metálicos existen en la naturaleza como gases en condiciones ordinarias como hidrógeno
EL ESTADO GASEOSO El aire está compuesto, principalmente, de los elementos oxígeno y nitrógeno. Otros elementos no metálicos existen en la naturaleza como gases en condiciones ordinarias como hidrógeno
Termodinámica. Calor y Temperatura
 Termodinámica Calor y Temperatura 1 Temas 1. TEMPERATURA Y LEY CERO. 1.1 Equilibrio Térmico y ley cero de la termodinámica. 1.2 Concepto de temperatura. 1.3 Tipos de termómetros. 1.4 Escalas de temperatura.
Termodinámica Calor y Temperatura 1 Temas 1. TEMPERATURA Y LEY CERO. 1.1 Equilibrio Térmico y ley cero de la termodinámica. 1.2 Concepto de temperatura. 1.3 Tipos de termómetros. 1.4 Escalas de temperatura.
Teorema de la Función Implícita (f : R R)
 Funciones de R n en R 1 Teorema de la Función Implícita f : R R) Teorema 1. Considere la función y = fx). Sea x 0, y 0 ) R 2 un punto tal que F x 0, y 0 ) = 0. Suponga que la función F tiene derivadas
Funciones de R n en R 1 Teorema de la Función Implícita f : R R) Teorema 1. Considere la función y = fx). Sea x 0, y 0 ) R 2 un punto tal que F x 0, y 0 ) = 0. Suponga que la función F tiene derivadas
Capítulo 3: La cantidad en química
 Capítulo 3: La cantidad en química ACTIVIDADES DE RECAPITULACIÓN 1. Las masas atómicas del hidrógeno y del helio son 1 y 4, respectivamente. Indica, razonadamente, si las siguientes afirmaciones son verdaderas
Capítulo 3: La cantidad en química ACTIVIDADES DE RECAPITULACIÓN 1. Las masas atómicas del hidrógeno y del helio son 1 y 4, respectivamente. Indica, razonadamente, si las siguientes afirmaciones son verdaderas
C a p í t u l o 1 TERMODINÁMICA IRREVERSIBLE LINEAL
 C a p í t u l o 1 ERMODINÁMICA IRREERSIBLE LINEAL En este capítulo se presentaran los conceptos preliminares sobre los cuales nos basaremos para describir termodinámicamente los fenómenos electrocinéticos
C a p í t u l o 1 ERMODINÁMICA IRREERSIBLE LINEAL En este capítulo se presentaran los conceptos preliminares sobre los cuales nos basaremos para describir termodinámicamente los fenómenos electrocinéticos
P V = n R T LEYES DE LOS GASES
 P V = n R T LEYES DE LOS GASES Estado gaseoso Medidas en gases Leyes de los gases Ley de Avogadro Leyes de los gases Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac
P V = n R T LEYES DE LOS GASES Estado gaseoso Medidas en gases Leyes de los gases Ley de Avogadro Leyes de los gases Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac
Tema II.1: Ley Cero y Temperatura
 Tema II.1: Ley Cero y Temperatura Contenido: II.1.1 Introducción General Objetivo de la Termodinámica II.1.2 Definiciones importantes Paredes y tipos Coordenadas de Estado Termodinámico II.1.3 Ley Cero
Tema II.1: Ley Cero y Temperatura Contenido: II.1.1 Introducción General Objetivo de la Termodinámica II.1.2 Definiciones importantes Paredes y tipos Coordenadas de Estado Termodinámico II.1.3 Ley Cero
DESCRIPCIÓN El método científico consiste en una serie de pasos ordenados que permiten encontrar el conocimiento con gran seguridad.
 UNIDAD 1: LA ACTIVIDAD CIENTÍFICA EL MÉTODO CIENTÍFICO DESCRIPCIÓN El método científico consiste en una serie de pasos ordenados que permiten encontrar el conocimiento con gran seguridad. OBSERVACIÓN Analizamos
UNIDAD 1: LA ACTIVIDAD CIENTÍFICA EL MÉTODO CIENTÍFICO DESCRIPCIÓN El método científico consiste en una serie de pasos ordenados que permiten encontrar el conocimiento con gran seguridad. OBSERVACIÓN Analizamos
INTRODUCCIÓN. Mecánica de Fluidos Avanzada UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA CIVIL DEPARTAMENTO DE HIDRÁULICA E HIDROLOGÍA
 INTRODUCCIÓN Mecánica de Fluidos Avanzada UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA CIVIL DEPARTAMENTO DE HIDRÁULICA E HIDROLOGÍA 1. DEFINICIÓN DE FLUIDO (1) 1. DEFINICIÓN DE FLUIDO (2)
INTRODUCCIÓN Mecánica de Fluidos Avanzada UNIVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE INGENIERÍA CIVIL DEPARTAMENTO DE HIDRÁULICA E HIDROLOGÍA 1. DEFINICIÓN DE FLUIDO (1) 1. DEFINICIÓN DE FLUIDO (2)
PRIMERA LEY DE LA TERMODINÁMICA. Fís. Carlos Adrián Jiménez Carballo Escuela de Física Instituto Tecnológico de Costa Rica
 PRIMERA LEY DE LA TERMODINÁMICA Fís. Carlos Adrián Jiménez Carballo Escuela de Física Instituto Tecnológico de Costa Rica 1 / 35 Objetivos El estudiante debe ser capaz de: Interpretar el concepto de sistema
PRIMERA LEY DE LA TERMODINÁMICA Fís. Carlos Adrián Jiménez Carballo Escuela de Física Instituto Tecnológico de Costa Rica 1 / 35 Objetivos El estudiante debe ser capaz de: Interpretar el concepto de sistema
1.- La rueda de una locomotora es r o =1 m a la temperatura de 0º Cuál es la diferencia entre el número de rotaciones de la rueda, a lo largo de un
 .- La rueda de una locomotora es r o m a la temperatura de 0º Cuál es la diferencia entre el número de rotaciones de la rueda, a lo largo de un recorrido de L000 km en verano con una temperatura de t 5ºC
.- La rueda de una locomotora es r o m a la temperatura de 0º Cuál es la diferencia entre el número de rotaciones de la rueda, a lo largo de un recorrido de L000 km en verano con una temperatura de t 5ºC
Unidad IV: Propiedades fundamentales de la materia.
 Unidad IV: Propiedades fundamentales de la materia. Facultad de Ingeniería 2012 UPV Unidad IV: Propiedades fundamentales de la materia: Masa y densidad Concepto de masa Relación entre masa y volumen Concepto
Unidad IV: Propiedades fundamentales de la materia. Facultad de Ingeniería 2012 UPV Unidad IV: Propiedades fundamentales de la materia: Masa y densidad Concepto de masa Relación entre masa y volumen Concepto
ANTES: vamos a discutir primero solución general de Ec. Laplace en coordinadas cilíndricas (2D)
 PROBLEMA 1 2 Calculo de distribución de potencial electroestático Anillo: con potencial exterior/interior conocido 1 ANTES: vamos a discutir primero solución general de Ec. Laplace en coordinadas cilíndricas
PROBLEMA 1 2 Calculo de distribución de potencial electroestático Anillo: con potencial exterior/interior conocido 1 ANTES: vamos a discutir primero solución general de Ec. Laplace en coordinadas cilíndricas
Principios y conceptos básicos de Química
 Principios y conceptos básicos de Química Se estudiarán durante las dos primeras quincenas, estos contenidos están en el tema 2 del libro de texto. Quincena 1ª - Repaso de conceptos estudiados en ESO (Densidad,
Principios y conceptos básicos de Química Se estudiarán durante las dos primeras quincenas, estos contenidos están en el tema 2 del libro de texto. Quincena 1ª - Repaso de conceptos estudiados en ESO (Densidad,
FÍSICA APLICADA Y FISICOQUÍMICA I. Tema 6. Termodinámica de las disoluciones
 aría del Pilar García Santos GRADO EN FARACIA FÍSICA APLICADA Y FISICOQUÍICA I Tema 6 Termodinámica de las disoluciones Esquema Tema 6.1 Propiedades generales de las disoluciones 6.2 Disolución líquida
aría del Pilar García Santos GRADO EN FARACIA FÍSICA APLICADA Y FISICOQUÍICA I Tema 6 Termodinámica de las disoluciones Esquema Tema 6.1 Propiedades generales de las disoluciones 6.2 Disolución líquida
INDICE Capitulo 1. Introducción: La Física y la Medición Capitulo 2. Vectores Capitulo 3. Movimiento de una Dimensión
 INDICE Capitulo 1. Introducción: La Física y la Medición 1 1.1. Estándares de longitud, masa tiempo 2 1.2. Densidad y masa atómica 5 1.3. Análisis dimensional 6 1.4. Conversión de unidades 8 1.5. Cálculos
INDICE Capitulo 1. Introducción: La Física y la Medición 1 1.1. Estándares de longitud, masa tiempo 2 1.2. Densidad y masa atómica 5 1.3. Análisis dimensional 6 1.4. Conversión de unidades 8 1.5. Cálculos
Ecuación de Estado de un Gas Real
 Clase 4 Ecuación de Estado de un Gas Real Hasta ahora hemos asumido gases ideales compuestos de partículas infinitesimales (p=0), y sin fuerzas de repulsión y atracción entre las partículas (F(r)=0). Bajo
Clase 4 Ecuación de Estado de un Gas Real Hasta ahora hemos asumido gases ideales compuestos de partículas infinitesimales (p=0), y sin fuerzas de repulsión y atracción entre las partículas (F(r)=0). Bajo
mecánica estadística Conjuntos Canónicos Generalizados Capítulo 3
 mecánica estadística Conuntos Canónicos Generalizados Capítulo 3 2014 Potenciales termodinámicos La energía interna U de un sistema cerrado se refiere a la energía de movimiento de las partículas que lo
mecánica estadística Conuntos Canónicos Generalizados Capítulo 3 2014 Potenciales termodinámicos La energía interna U de un sistema cerrado se refiere a la energía de movimiento de las partículas que lo
Determinación del Coeficiente Adiabático del Aire.
 Practica 2 Laboratorio Termodinámica: Determinación del Coeficiente Adiabático del Aire. Realizado por grupo V17S1M3: Oscar Rodríguez Sagundo. José Ignacio Ruipérez Conde. Carlos Serrano Jiménez. 1 Objetivo:
Practica 2 Laboratorio Termodinámica: Determinación del Coeficiente Adiabático del Aire. Realizado por grupo V17S1M3: Oscar Rodríguez Sagundo. José Ignacio Ruipérez Conde. Carlos Serrano Jiménez. 1 Objetivo:
Viscosímetros. Explicaciones complementarias/ Versión 0.0/ MODULO 2/ CÁTEDRA DE FÍSICA/ FFYB/ UBA/
 Viscosímetros, explicaciones complementarias 0.0/ M/ FISICA Viscosímetros Explicaciones complementarias/ Versión 0.0/ MODULO / CÁTEDRA DE FÍSICA/ FFYB/ UBA/ Cátedra de Física-FFYB-UBA [] Viscosímetros,
Viscosímetros, explicaciones complementarias 0.0/ M/ FISICA Viscosímetros Explicaciones complementarias/ Versión 0.0/ MODULO / CÁTEDRA DE FÍSICA/ FFYB/ UBA/ Cátedra de Física-FFYB-UBA [] Viscosímetros,
