Sesión 19. obtenemos el grupo funcional cetona,.
|
|
|
- Alberto Carrasco Gallego
- hace 8 años
- Vistas:
Transcripción
1 Sesión 19 Tema: ALDEHIDOS Y CETONAS. I. Objetivos de la sesión: Después de finaliz ar el estudio de es te capítulo U d. debería ser capaz de: 1) Escribir la fórmula es truc tural y el nombre de aldehídos y cetonas simples. 2) Distinguir entre aldehídos y cetonas. 3) C onocer las principales formas de obtención de los aldehídos y cetonas. 4) C onocer las principales reacciones en que pueden interv enir los aldehídos y cetonas. II. Temas Grupo carbonilo. Si se inserta un átomo de ox ígeno en la cadena de hidroc arburo, de modo que los dos enlaces del ox ígeno es tén unidos al mismo átomo de carbono, se forma el grupo funcional carbonilo,. (El tener un grupo carbonilo no le otorga al compuesto propiedades de ins aturación. El doble enlace para insaturación tiene que es tar entre dos átomos de c arbono). N uev amente tenemos dos posibilidades: podemos adicionar el átomo de ox ígeno a un carbono terminal o en el medio de la cadena. En cada cas o se deberán remov er dos átomos de hidrógeno. U bicando el grupo carbonilo al final de la molécula obtenemos el grupo funcional aldehído, obtenemos el grupo funcional cetona,. Aldehído, mientras que si lo ubic amos en la mitad de la c adena Cetona propanal propanona Se usa el sufijo al para designar a los aldehidos y el sufijo ona para las cetonas. ALDEHIDOS.- Nomenclatura: El sistema de nomenclatura corriente consiste en emplear el nombre del alcano correspondiente terminado en -al. Cuando el grupo CHO es sustituyente se utiliza el prefijo for mil-. También se utiliza el prefijo for mil- cuando hay tres o más funciones aldehídos sobre el mismo compuesto. En esos casos se puede utilizar otro sistema de nomenclatura que consiste en dar el nombre de carbaldehído a los grupos CHO (los carbonos de esos CHO no se numeran, se considera que no forman parte de la cadena). Este último sistema es el idóneo para compuestos con grupos -CHO unidos directamente a ciclos.
2 Propiedades físi cas. El aldehido más simple es el metanal, H -CH O, que tiene el nombre común formaldehido. Es gaseoso, mientras que los intermedios son líquidos y los superiores sólidos. Poseen olor desagradable y puntos de ebullic ión muy inferiores a los de los alc oholes de los que deriv an, y a que no pueden formar puentes de hidrógeno. Su solubilidad en agua disminuy e al aumentar el número de átomos de carbono de la cadena hidrocarbonada. CETONAS.- Nomenclatura: Para nombrar las cetonas tenemos dos alternativas: 1. El nombre del hidrocarburo del que procede terminado en -ona. Como sustituyente debe emplearse el prefijo oxo-. 2. Citar los dos radicales que están unidos al grupo carbonilo por orden alfabético y a continuación la palabra cetona. Propiedades físicas: los primeros términos son líquidos solubles en agua Preparación de aldehídos y cetonas. La oxidación suave de alcoholes primarios produce aldehídos
3 Se utiliza la Piridina (Py) para detener la reacción en el aldehído. Cr0 3 / H + se denomina reactivo de Jones La oxidación suave de alcoholes secundarios produce cetonas Ozonólisis de alquenos Tratamiento con KMnO 4 en caliente de alquenos. Este método sólo es válido para la preparación de cetonas. Hidratación de alquinos
4 Hidroboración-oxidación de alquinos Acilación de Fr iedel-cr afts del Benceno Preparación de acetona. La acetona se prepara calentando a no más de 300ºC el acetato de calcio Propiedades químicas. Reacciones La reacciones de los aldehídos y cetonas son esencialmente de tres tipos; adición nucleofílica, oxidación y reducción. Adición nucleofílica. Debido a la resonancia del grupo carbonilo la reacción más importante de aldehídos y cetonas es la reacción de adición nucleofílica cuyo mecanismo es el siguiente: Siguen este esquema la reacción con hidruros ( NaBH 4, LiAlH 4 ) donde Nu = H y la reacción con organometálicos (RMgI, RLi) donde Nu = R.
5 Con el reactivo de Grignard se obtienen alcoholes primarios (metanal), secundarios (otro aldehído) y terciarios (cetonas). 1.- Obtención de alcohol primario: R X MgCl 2 R Mg Cl O Mg Cl HOH R Mg Cl + H CH O H - C - H R - CH 2 OH + HO Mg Cl R compuesto aldehído compuesto alcohol primario de Grignard intermedio 2.- Obtención de alcohol secundario: O Mg Cl OH HOH R Mg Cl + R CH O R C H R CH R + HO Mg Cl compuesto aldehido R alcohol secundario de Grignard compuesto intermedio 3.- Obtención de alcohol Terciario. O Mg Cl OH HOH R Mg Cl + R CO R R C R R C R + H O Mg Cl compuesto cetona R R de Grignard compuesto intermedio alcohol terciario 4.- Adición nucleofílica de alcoholes, para formar acetales Con los alcoholes y en ausencioa de agua y ambiente ácido los aldehidos y cetonas forman hemiacetales en una primera instancia y acetales en una segunda. O OH O R HCl anhidro R -O-H / HCl R C H + R O H R C O R R C O R H H
6 5.- Adición de amina pr imar ia, para for mar iminas. 6.- Adición de Hidroxilamina, para formar oximas 7.- Adición de hidracinas, para formar hidrazonas 8.- Adición de Ácido Cianhídrico 9.- Adición de amoníaco a los aldehídos: Los aldehídos adicionan una molécula de amoníaco formando compuestos llamados aldehidatos de amonio: El metanal, en cambio, no adiciona amoníaco, sino que reacciona con él, con pérdida de agua, produciendo la hexametilentetramina o urotropina, un antiséptico urinario: Oxidación: Los oxidantes transforman en ácidos a los aldehídos. Esto quiere decir que los aldehídos son reductores, propiedad que se aprovecha para su reconocimiento
7 Las cetonas se rompen y cada radical se oxida separadamente: En el caso particular de la acetona, ésta se oxida para dar ácido acético y anhídrido carbónico Reducción: Los agentes reductores convierten en alcoholes primarios a los aldehídos y en alcoholes secundarios a las cetonas Acción de Hidruros: tetrahidroborato de Na o tetrahidroaluminato de Li Hidrogenación Reducción de Clemmensen Reacción de Wolff-Kishner Polimerización de aldehidos: Dos o más moléculas de un aldehído pueden unirse entre si. Por ejemplo, el metanal se puede convertir en un polímero cíclico llamado trioximetileno:
8 Este polímero, llamado comercialmente formalina, se descompone por el calor, regenerando el metanal, que posee acción antiséptica y desinfectante. Reconocimiento de aldehídos: Reacción de Schiff: Una solución diluida de fucsina, que presenta color rojo violáceo, se decolora con bisulfito sódico. En presencia de un aldehído, recupera su color rojo violáceo. Reacción de Tollens: Los aldehídos reducen una solución amoniacal de nitrato de plata, formando un depósito o espejo de plata en las paredes de un tubo de ensayo: R-CHO + Ag(NH 3 ) OH R-COO + NH H 2 O + 3 NH 3 + 2Ag Reacción de Fehling: Los aldehídos reducen también el reactivo de Fehing, que consta de dos soluciones: Solución A: sulfato cúprico (CuSO 4 ) Solución B: sal de Seignette (tartrato de Na y K) e hidróxido de sodio (NaOH) Estas dos soluciones se mantienen separadas y se mezclan en partes iguales al momento de usarlas. Al mezclar las soluciones no precipita el hidróxido cúprico, porque lo impide el ion tartrato presente, con el que se forma un complejo cupritartrato soluble de un color azul intenso, que calentado en presencia de un aldehído, produce un precipitado de color rojo ladrillo de óxido cuproso. La reacción puede explicarse por las siguientes ecuaciones: a) CuSO NaOH Cu(OH) 2 + Na 2 SO 4 b) COONa COONa CHOH CHO-Cu-OH + 2 HO-Cu-OH + 2H 2 O CHOH CHO-Cu-OH COOK COOK c) COONa C OONa CHO-Cu-OH CHOH + R-CHO + Cu 2 O + R-COOH CHO-Cu-OH CHOH COOK C OOK Las cetonas no reducen a los reactivos de Tollens ni de Fehling, ni dan la reacción de Schiff. Anión enolato Cuando los compuestos carbonílicos tienen hidrógenos en el C adyacente al grupo carbonilo estos H son ácidos, es decir, tienen tendencia a desprenderse propiciando la formación de un anión. El anión así formado recibe el nombre de anión enolato. Por ejemplo:
9 El anión enolato está estabilizado por resonancia: Si una vez obtenido el anión enolato efectuamos una hidrólisis: se genera un equilibrio entre la forma ceto y la forma enol, que se denomina tautomería ceto-enólica. Dicho equilibrio suele estar muy desplazado hacia la forma ceto.
10 Adición aldólica Consiste en una adición nucleofílica a un compuesto car bonílico donde el nucleófilo es un anión enolato. Por ejemplo: Si R = H, entonces: Condensación aldólica Consiste en una deshidratación (espontánea o por calentamiento) después de una adición aldólica. Caracter ísticas de los pr incipales aldehídos utilizados en la industria: a) Metanal o formaldehido: En la industria se le obtiene a partir del Metano, es un gas incoloro, muy irritante y de olor característico ataca las mucosas y es muy soluble en agua. La solución al 38% recibe el nombre de formalina, utilizado para la conservación de tejidos de origen animal por su propiedad de coagular albúminas y como antiséptico. Si la solución sobrepasa el 40%, se condensa como sólido blanco que unido al fenol forma resinas sintéticas, especialmente baquelita. Con la urea (CO (NH 2 ) 2 ) forma la melamina. b) Etanal: Líquido incoloro, que hierve a 20 ºc, muy soluble en agua, alcohol y éter, tiene olor a manzanas maduras, se obtiene por oxidación del alcohol etílico, también se obtiene a partir del acetileno. Una de sus principales aplicaciones es la obtención de ácido acético, se utiliza además en la obtención de acetatos, DDT (insecticida) y otros derivados orgánicos.
11 c) Benzaldehído: Al reaccionar con aminas aromáticas y fenoles, forma colorantes empleados en la industria, por su exquisito olor se emplea en la fabricación de perfumes y como aditivo de alimentos. Usos de algunas cetonas en la industria - Propanona o acetona: Se utiliza como disolvente y como base para sintetizar compuestos como el yodoformo, cloroformo y resinas sintéticas y en la fabricación de acetato de celulosa y de explosivos como el nitrato de celulosa. - Alcanfor: utilizado en la industria de jabones y cosméticos y como plastificante de la nitrocelulosa. - Antraquinona: Se utiliza en la industria de colorantes ya que se transforma en alizarina, un colorante amarillo - rojizo. - Hidroquinona: Actualmente utilizada en la industria de cosméticos y también en el revelado fotográfico. III. Actividad pr evia. Syllabus sesión 17 IV. Metodología de la sesión. Clase expositiva, de debate y con ejercicios prácticos V. Lectura post-sesión. Por definir Cuestionario. 1. Distinga entre un aldehido y una cetona 2. Escriba la fórmula molecular y la fórmula estructural para a. propanal b. p-ciclohexanodicarbaldehido c. 2-formil-4-metilpentanodial d. metilpropilcetona e. 2,5-ciclohexadienona 3. Escriba ecuaciones para las siguientes reacciones: a. Etanol y CrO 3 en ambiente ácido b. Etanol y CrO 3 en ambiente ácido en presencia de pyridina c. 2-propanol y permanganato de potasio d. etileno e hidruro de boro y agua oxigenada en ambiente alcalino. e. Acetona con permanganato de potasio en caliente y en ambiente ácido. f. Propino y ácido sulfúrico diluido en presencia de HgSO 4. g. Butino e hidruro de boro y agua oxigenada en ambiente alcalino. h. Benceno y cloruro de acetilo en presencia de AlCl 3. i. Calentamiento bajo los 300ºC de acetato de calcio. j. Acetaldehido y reactivo de Grignard. k. Formaldehido y reactivo de Grignard. l. Acetona y reactivo de Grignard. m. Acetona con exceso de etanol en ambiente ácido.
12 n. Propanona y 1,4-butanodiol. o. 3-pentanona y etilamina en ambiente ácido. p. acetona e hidroxilamina en ambiente ácido. q. butanona y metilhidrazina en ambiente ácido. r. Acetona y ácido cianhídrico. s. Propanal y amoníaco. t. Metanal y amoníaco. u. Acetaldehido y permanganato de potasio en ambiente ácido. v. 3-pentanona y permanganato de potasio en ambiente ácido. w. Propanona y permanganato de potasio en ambiente ácido. x. Acetona y tetrahidroaluminato de Li y acidificación. y. Acetona y Zn en ácido clorhídrico. z. Propanona e hidracina con posterior alcalinización y calentamiento. aa. Polimerización del formaldehido. 4. Indique tres formas de distinguir químicamente entre aldehidos y cetonas 5. Qué se entiende por ion enolato? 6. Describa en palabras y fórmulas lo que se entiende por adición aldólica. 7. Describa en palabras y fórmulas lo que se entiende por condensación aldólica.
Química orgánica. Cuarto Medio 25/06
 Química orgánica Cuarto Medio 25/06 CARBONO Es el elemento principal de las moléculas orgánicas. Debido a que este átomo, presenta una gran estabilidad. Dado que, tiene una baja tendencia a donar y quitar
Química orgánica Cuarto Medio 25/06 CARBONO Es el elemento principal de las moléculas orgánicas. Debido a que este átomo, presenta una gran estabilidad. Dado que, tiene una baja tendencia a donar y quitar
2.2- FENOLES. Como ya hemos indicado, se obtienen al sustituir uno o más átomos de hidrógeno del benceno por radicales OH.
 2.2- FENOLES Como ya hemos indicado, se obtienen al sustituir uno o más átomos de hidrógeno del benceno por radicales OH. Si se sustituye un solo átomo de hidrógeno, se obtienen los fenoles; si se sustituyen
2.2- FENOLES Como ya hemos indicado, se obtienen al sustituir uno o más átomos de hidrógeno del benceno por radicales OH. Si se sustituye un solo átomo de hidrógeno, se obtienen los fenoles; si se sustituyen
2ª Parte: Estructura y reactividad de
 2ª Parte: Estructura y reactividad de los compuestos CMPUESTS orgánicos. CARBNÍLICS 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos. - Hidrocarburos
2ª Parte: Estructura y reactividad de los compuestos CMPUESTS orgánicos. CARBNÍLICS 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos. - Hidrocarburos
CONDENSACIONES. Nucleofilo O. O Reactante que sufre adición OH - C H. Reactante que sufre sustitución H 2 O C O -
 NDENSAINES En química orgánica, se conoce como reacciones de condensación a aquellas que se llevan a cabo entre dos compuestos, los cuales tienen el grupo funcional carbonilo dentro de su estructura (
NDENSAINES En química orgánica, se conoce como reacciones de condensación a aquellas que se llevan a cabo entre dos compuestos, los cuales tienen el grupo funcional carbonilo dentro de su estructura (
Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento, conteste las siguientes preguntas.
 EXPERIMENTO 4 ALCOHOLES Y FENOLES Fecha: Sección de laboratorio: Nombre del estudiante: Grupo #: Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento, conteste las
EXPERIMENTO 4 ALCOHOLES Y FENOLES Fecha: Sección de laboratorio: Nombre del estudiante: Grupo #: Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento, conteste las
TEMA 2: COMPUESTOS OXIGENADOS
 TEMA 2: CMPUESTS XIGENADS Son compuestos constituidos por carbono, hidrógeno y oxígeno. Vamos a estudiar los compuestos oxigenados siguientes: alcoholes (y fenoles), éteres, aldehidos, cetonas, ácidos
TEMA 2: CMPUESTS XIGENADS Son compuestos constituidos por carbono, hidrógeno y oxígeno. Vamos a estudiar los compuestos oxigenados siguientes: alcoholes (y fenoles), éteres, aldehidos, cetonas, ácidos
QUÍMICA de 2º de BACHILLERATO QUÍMICA DEL CARBONO
 QUÍMICA de 2º de BACHILLERATO QUÍMICA DEL CARBONO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
QUÍMICA de 2º de BACHILLERATO QUÍMICA DEL CARBONO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
QUÍMICA - 2º DE BACHILLERATO EJERCICIOS DE SELECTIVIDAD UNIDADES 8 Y 9: QUÍMICA ORGÁNICA CUESTIONES 1
 CUESTIONES 1 HOJA 8-1 2002 modelo: Escribe el nombre de los compuestos que se indican a continuación: a) CH 3 -CH 2 COOCH 3 b) CH 3 -CH 2 CO CH 2 CH 3 c) CH 3 CHOH- CH 2 CH = CH 2 d) CH 3 -CH 2 NH 2 e)
CUESTIONES 1 HOJA 8-1 2002 modelo: Escribe el nombre de los compuestos que se indican a continuación: a) CH 3 -CH 2 COOCH 3 b) CH 3 -CH 2 CO CH 2 CH 3 c) CH 3 CHOH- CH 2 CH = CH 2 d) CH 3 -CH 2 NH 2 e)
Estructura del grupo carbonilo
 TEMA 19.- Compuestos carbonílicos. Clasificación y propiedades generales. Reacciones de adición. Características generales y factores con influencia en la velocidad de la adición. Adiciones de Michael.
TEMA 19.- Compuestos carbonílicos. Clasificación y propiedades generales. Reacciones de adición. Características generales y factores con influencia en la velocidad de la adición. Adiciones de Michael.
REACCIONES DE IONES METÁLICOS
 Actividad Experimental 4 REACCIONES DE IONES METÁLICOS Investigación previa -Investigar las medidas de seguridad para trabajar con amoniaco -Investigar las reglas de solubilidad de las sustancias químicas.
Actividad Experimental 4 REACCIONES DE IONES METÁLICOS Investigación previa -Investigar las medidas de seguridad para trabajar con amoniaco -Investigar las reglas de solubilidad de las sustancias químicas.
Susana Latorre Licenciada en Ciencias químicas
 Susana Latorre Licenciada en Ciencias químicas QUIMICA INORGANICA QUIMICA ORGANICA TIPOS DE ENLACES QUE ES UN ELEMENTO QUIMICO QUE ES UNA MOLECULA QUE ES UNA REACCION. COMO SE ESCRIBE ELEMENTO QUIMICO
Susana Latorre Licenciada en Ciencias químicas QUIMICA INORGANICA QUIMICA ORGANICA TIPOS DE ENLACES QUE ES UN ELEMENTO QUIMICO QUE ES UNA MOLECULA QUE ES UNA REACCION. COMO SE ESCRIBE ELEMENTO QUIMICO
Clase 11: Reacciones de condensación, formación del Ión Enolato y reacciones que de esto derivan
 Clase 11: Reacciones de condensación, formación del Ión Enolato y reacciones que de esto derivan Mario Manuel Rodas Morán Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad
Clase 11: Reacciones de condensación, formación del Ión Enolato y reacciones que de esto derivan Mario Manuel Rodas Morán Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad
Informe del trabajo práctico nº7
 Informe del trabajo práctico nº7 Profesora : Lic. Graciela. Lic. Mariana. Alumnas: Romina. María Luján. Graciela. Mariana. Curso: Química orgánica 63.14 turno 1 OBJETIVOS Mostrar las propiedades que presentan
Informe del trabajo práctico nº7 Profesora : Lic. Graciela. Lic. Mariana. Alumnas: Romina. María Luján. Graciela. Mariana. Curso: Química orgánica 63.14 turno 1 OBJETIVOS Mostrar las propiedades que presentan
FORMULACIÓN DE QUÍMICA ORGÁNICA 1- HIDROCARBUROS DE CADENA ABIERTA A) ALCANOS
 FORMULACIÓN DE QUÍMICA ORGÁNICA 1- HIDROCARBUROS DE CADENA ABIERTA A) ALCANOS Fórmula molecular C n H 2n+2 Sufijo ANO. Para los alcanos de cadena lineal, si tienen 1 C se utiliza el prefijo met-; 2 C et-;
FORMULACIÓN DE QUÍMICA ORGÁNICA 1- HIDROCARBUROS DE CADENA ABIERTA A) ALCANOS Fórmula molecular C n H 2n+2 Sufijo ANO. Para los alcanos de cadena lineal, si tienen 1 C se utiliza el prefijo met-; 2 C et-;
Química Orgánica. por átomos de carbono. A diferencia de otros
 Química Orgánica La definición moderna de la química orgánica es el estudio de los compuestos que se componen por átomos de carbono. A diferencia de otros elementos, el carbono crea enlaces muy fuertes
Química Orgánica La definición moderna de la química orgánica es el estudio de los compuestos que se componen por átomos de carbono. A diferencia de otros elementos, el carbono crea enlaces muy fuertes
IDENTIFICACIÓN DE GRUPOS FUNCIONALES ORGÁNICOS
 IDENTIFICACIÓN DE GRUPOS FUNCIONALES ORGÁNICOS Objetivo El alumno aprenderá a identificar los grupos funcionales que se encuentran en compuestos orgánicos de origen natural o sintético mediante pruebas
IDENTIFICACIÓN DE GRUPOS FUNCIONALES ORGÁNICOS Objetivo El alumno aprenderá a identificar los grupos funcionales que se encuentran en compuestos orgánicos de origen natural o sintético mediante pruebas
APÉNDICE II DESECACIÓN Y AGENTES DESECANTES DESECACIÓN
 259 APÉNDICE II DESECACIÓN Y AGENTES DESECANTES DESECACIÓN La desecación se emplea para extraer la humedad de los líquidos, soluciones y sustancias sólidas. El grado de desecación de una sustancia depende
259 APÉNDICE II DESECACIÓN Y AGENTES DESECANTES DESECACIÓN La desecación se emplea para extraer la humedad de los líquidos, soluciones y sustancias sólidas. El grado de desecación de una sustancia depende
Guía de Ejercicios N 1 Hidrocarburos alifáticos y aromáticos
 Guía de Ejercicios N 1 Hidrocarburos alifáticos y aromáticos I.-Hibridación, isomería y propiedades físicas 1.- En base a la siguiente estructura: HC C-CH=CHCH(CH 3 ) CH 2 CH 3 a) Cuantos carbonos sp 3
Guía de Ejercicios N 1 Hidrocarburos alifáticos y aromáticos I.-Hibridación, isomería y propiedades físicas 1.- En base a la siguiente estructura: HC C-CH=CHCH(CH 3 ) CH 2 CH 3 a) Cuantos carbonos sp 3
Tema 9.- Aldehídos y cetonas. El grupo carbonilo
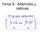 Tema 9.- Aldehídos y cetonas El grupo carbonilo Los aldehídos y cetonas son las funciones que vamos a estudiar en este Tema, probablemente uno de los más importantes de la asignatura. Nomenclatura propanal
Tema 9.- Aldehídos y cetonas El grupo carbonilo Los aldehídos y cetonas son las funciones que vamos a estudiar en este Tema, probablemente uno de los más importantes de la asignatura. Nomenclatura propanal
Las funciones orgánicas se clasifican de la siguiente manera:
 Página 1 APUNTES EJERCICIOS FORMULACIÓN ORGÁNICA Las sustancias orgánicas se clasifican en bloques que se caracterizan por tener un átomo o grupo atómico definido (grupo funcional) que le confiere a la
Página 1 APUNTES EJERCICIOS FORMULACIÓN ORGÁNICA Las sustancias orgánicas se clasifican en bloques que se caracterizan por tener un átomo o grupo atómico definido (grupo funcional) que le confiere a la
Aldehídos y Cetonas: Compuestos carbonílicos
 Aldehídos y etonas: ompuestos carbonílicos Grupo arbonilo: plano, 120 o, polar, hibridación sp 2 carga parcial negativa : : : : :.. : carga parcial positiva esonancia Aldehído arbonilo etona - - - = alquil.
Aldehídos y etonas: ompuestos carbonílicos Grupo arbonilo: plano, 120 o, polar, hibridación sp 2 carga parcial negativa : : : : :.. : carga parcial positiva esonancia Aldehído arbonilo etona - - - = alquil.
Resumen de la clase anterior
 Grupos Funcionales Resumen de la clase anterior sp 3 sp 2 sp Elemento de baja electronegatividad Capaz de hibridar electrones Carbono Hidrógeno Hidrocarburos Alifáticos Alicíclicos Aromáticos Alcanos Alquenos
Grupos Funcionales Resumen de la clase anterior sp 3 sp 2 sp Elemento de baja electronegatividad Capaz de hibridar electrones Carbono Hidrógeno Hidrocarburos Alifáticos Alicíclicos Aromáticos Alcanos Alquenos
OXIDACIÓN Y REDUCCIÓN DE COMPUESTOS ORGÁNICOS
 OXIDACIÓN Y REDUCCIÓN DE COMPUESTOS ORGÁNICOS O OXIDACIÓN: Aumento de átomos de oxígeno o pérdida de átomos de hidrógeno en un compuesto orgánico. O REDUCCIÓN: Aumento de átomos de hidrógeno o pérdida
OXIDACIÓN Y REDUCCIÓN DE COMPUESTOS ORGÁNICOS O OXIDACIÓN: Aumento de átomos de oxígeno o pérdida de átomos de hidrógeno en un compuesto orgánico. O REDUCCIÓN: Aumento de átomos de hidrógeno o pérdida
Singularidad del carbono
 Singularidad del carbono Su configuración electrónica y su tamaño determinan que sea el único elemento químico que puede: Formar enlaces covalentes sencillos, dobles o triples con otros átomos de carbono.
Singularidad del carbono Su configuración electrónica y su tamaño determinan que sea el único elemento químico que puede: Formar enlaces covalentes sencillos, dobles o triples con otros átomos de carbono.
La Química Orgánica es el estudio de los compuestos de carbono. El carbono puede formar más compuestos
 QUÍMICA ORGÁNICA La Química Orgánica es el estudio de los compuestos de carbono. El carbono puede formar más compuestos que ningún otro elemento, por tener la capacidad de unirse entre sí formando cadenas
QUÍMICA ORGÁNICA La Química Orgánica es el estudio de los compuestos de carbono. El carbono puede formar más compuestos que ningún otro elemento, por tener la capacidad de unirse entre sí formando cadenas
UNIVERSIDAD NACIONAL DEL CALLAO FACULTAD DE INGENIERIA QUIMICA AÑO 2009 AMINAS AROMATICAS
 AMINAS AROMATICAS I. OBJETIVOS Identificación de la anilina. Reconocimiento de la anilina con las diferentes pruebas. II. FUNDAMENTO TEORICO Amina, nombre que reciben los compuestos producidos a menudo
AMINAS AROMATICAS I. OBJETIVOS Identificación de la anilina. Reconocimiento de la anilina con las diferentes pruebas. II. FUNDAMENTO TEORICO Amina, nombre que reciben los compuestos producidos a menudo
04/11/2013 ALCOHOLES Y FENOLES
 ALCOHOLES Y FENOLES Pueden ser considerados como derivados del agua. Tienen en común, la presencia del grupo funcional OH, conocido como grupo hidroxilo ú oxhídrilo. ALCOHOLES: grupo OH-unido a radical
ALCOHOLES Y FENOLES Pueden ser considerados como derivados del agua. Tienen en común, la presencia del grupo funcional OH, conocido como grupo hidroxilo ú oxhídrilo. ALCOHOLES: grupo OH-unido a radical
UNIDAD IV ALCOHOLES. Alcoholes: Introducción y Nomenclatura. Pte. M. en C.Q. Macaria Hernández Chávez
 UNIDAD IV ALCOHOLES Alcoholes: Introducción y Nomenclatura Pte. M. en C.Q. Macaria Hernández Chávez ALCOHOLES Introducción. Los alcoholes son compuestos orgánicos que contienen grupos hidroxilo (-OH).
UNIDAD IV ALCOHOLES Alcoholes: Introducción y Nomenclatura Pte. M. en C.Q. Macaria Hernández Chávez ALCOHOLES Introducción. Los alcoholes son compuestos orgánicos que contienen grupos hidroxilo (-OH).
SEMANA 21 ALDEHÍDOS Y CETONAS Elaborado por: Licda. Lilian Judith Guzmán Melgar
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDÁCTICA QUÍMICA, PRIMER AÑO GUIAS DE ESTUDIO 2016 SEMANA 21 ALDEHÍDOS Y CETONAS Elaborado por: Licd Lilian Judith Guzmán
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDÁCTICA QUÍMICA, PRIMER AÑO GUIAS DE ESTUDIO 2016 SEMANA 21 ALDEHÍDOS Y CETONAS Elaborado por: Licd Lilian Judith Guzmán
18 Reacciones orgánicas
 Facultad de Farmacia. Universidad de Alcalá 181 18 Reacciones orgánicas 18.1 Reacciones de adición 18.2 Reacciones de eliminación 18.3 Reacciones de sustitución 18.4 Reacciones entre ácidos y bases 18.1
Facultad de Farmacia. Universidad de Alcalá 181 18 Reacciones orgánicas 18.1 Reacciones de adición 18.2 Reacciones de eliminación 18.3 Reacciones de sustitución 18.4 Reacciones entre ácidos y bases 18.1
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN
 FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2011/12 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2011/12 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
TEMA 4 ALCOHOLES, FENOLES, ETERES Y TIOLES
 4.1- INTRODUCCIÓN. - Alcoholes TEMA 4 ALCOLES, FENOLES, ETERES Y TIOLES Química Orgánica Biología - Cadena carbonada más larga que contenga el grupo. Cada nombre se deriva agregando al nombre del alcano
4.1- INTRODUCCIÓN. - Alcoholes TEMA 4 ALCOLES, FENOLES, ETERES Y TIOLES Química Orgánica Biología - Cadena carbonada más larga que contenga el grupo. Cada nombre se deriva agregando al nombre del alcano
Seminario de Química 2º Bachillerato LOGSE Unidad 0: Repaso Química 1º Bachillerato
 A) Composición Centesimal y Fórmulas químicas 1.- Determina la composición centesimal del Ca3(PO4)2. Datos: Masas atómicas (g/mol): Ca=40; P=31; O=16 S: Ca= 38,7%; P=20%; O=41,3% 2.- Determina la composición
A) Composición Centesimal y Fórmulas químicas 1.- Determina la composición centesimal del Ca3(PO4)2. Datos: Masas atómicas (g/mol): Ca=40; P=31; O=16 S: Ca= 38,7%; P=20%; O=41,3% 2.- Determina la composición
PRÁCTICA DE LABORATORIO N 3- AGRONOMÍA Y ZOOTECNIA ALDEHIDOS Y CETONAS
 PRÁCTICA DE LABRATRI 3- AGRMÍA Y ZTECIA ALDEIDS Y CETAS BJETIVS DEL PRACTIC DE ALDEIDS y CETAS: I. Realizar reacciones de caracterización de aldehídos y cetonas: 1. Reacciones del grupo carbonilo 2. Reacciones
PRÁCTICA DE LABRATRI 3- AGRMÍA Y ZTECIA ALDEIDS Y CETAS BJETIVS DEL PRACTIC DE ALDEIDS y CETAS: I. Realizar reacciones de caracterización de aldehídos y cetonas: 1. Reacciones del grupo carbonilo 2. Reacciones
Materiales recopilados por la Ponencia Provincial de Química para Selectividad TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano
TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano
Alcanos. Solo contienen carbono e hidrógeno Solo tienen enlaces sencillos. Todos poseen la formula: C n H 2n+2
 Alcanos Solo contienen carbono e hidrógeno Solo tienen enlaces sencillos Todos poseen la formula: C n H 2n+2 ALCANOS Ubique la cadena de átomos de carbono más larga, coloque la terminación ano Localizar
Alcanos Solo contienen carbono e hidrógeno Solo tienen enlaces sencillos Todos poseen la formula: C n H 2n+2 ALCANOS Ubique la cadena de átomos de carbono más larga, coloque la terminación ano Localizar
Tema 7.- Alcoholes, fenoles y tioles. RESVERATROL
 Tema 7.- Alcoholes, fenoles y tioles. RESVERATROL Nomenclatura de los alcoholes En el sistema de la IUPAC,los alcoholes se nombran añadiendo la terminación ol al hidrocarburo de referencia e, indicando
Tema 7.- Alcoholes, fenoles y tioles. RESVERATROL Nomenclatura de los alcoholes En el sistema de la IUPAC,los alcoholes se nombran añadiendo la terminación ol al hidrocarburo de referencia e, indicando
ALDEHIDOS Y CETONAS COMPUESTOS CON FUNCIÓN CARBONILO. SEMANA 21 Licda. Lilian Judith Guzmán Melgar
 ALDEHIDOS Y CETONAS COMPUESTOS CON FUNCIÓN CARBONILO SEMANA 21 Licda. Lilian Judith Guzmán Melgar GRUPO CARBONILO O - C - El grupo carbonilo consta de un doble enlace carbono oxigeno. Familias importantes
ALDEHIDOS Y CETONAS COMPUESTOS CON FUNCIÓN CARBONILO SEMANA 21 Licda. Lilian Judith Guzmán Melgar GRUPO CARBONILO O - C - El grupo carbonilo consta de un doble enlace carbono oxigeno. Familias importantes
http://www.youtube.com/watch?v=cibg6yv3iqw lauramarcelavalero.blogspot.com
 http://www.youtube.com/watch?v=cibg6yv3iqw lauramarcelavalero.blogspot.com El agua se congela a 0 C, lo que crea problemas para los carros en el invierno, lo que provocaría serios daños al bloque del motor.
http://www.youtube.com/watch?v=cibg6yv3iqw lauramarcelavalero.blogspot.com El agua se congela a 0 C, lo que crea problemas para los carros en el invierno, lo que provocaría serios daños al bloque del motor.
LOGRO: Identifica y nombra las diferentes funciones inorgánicas aplicando las reglas de la nomenclatura, común, stock y IUPAC.
 LOGRO: Identifica y nombra las diferentes funciones inorgánicas aplicando las reglas de la nomenclatura, común, stock y IUPAC. METODOLOGÍA DE TRABAJO: 1) Lea y repase la nomenclatura inorgánica. 2) Copie
LOGRO: Identifica y nombra las diferentes funciones inorgánicas aplicando las reglas de la nomenclatura, común, stock y IUPAC. METODOLOGÍA DE TRABAJO: 1) Lea y repase la nomenclatura inorgánica. 2) Copie
JULIO 2012. FASE ESPECÍFICA. QUÍMICA.
 JULIO 2012. FASE ESPECÍFICA. QUÍMICA. OPCIÓN A 1. (2,5 puntos) Se añaden 10 mg de carbonato de estroncio sólido, SrCO 3 (s), a 2 L de agua pura. Calcule la cantidad de SrCO 3 (s) que queda sin disolver.
JULIO 2012. FASE ESPECÍFICA. QUÍMICA. OPCIÓN A 1. (2,5 puntos) Se añaden 10 mg de carbonato de estroncio sólido, SrCO 3 (s), a 2 L de agua pura. Calcule la cantidad de SrCO 3 (s) que queda sin disolver.
TEMA I: REACCIONES Y ESTEQUIOMETRIA
 TEMA I: REACCIONES Y ESTEQUIOMETRIA 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano que quedan. c) Los gramos
TEMA I: REACCIONES Y ESTEQUIOMETRIA 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano que quedan. c) Los gramos
ELECTROQUIMICA CELDAS GALVANICAS, ELECTROLISIS Y ELECTROQUIMICA APLICADA
 ELECTROQUIMICA CELDAS GALVANICAS, ELECTROLISIS Y ELECTROQUIMICA APLICADA QUE ES LA ELECTROQUIMICA? Es la parte de la química que se encarga del estudio de las relaciones cualitativas y cuantitativas existentes
ELECTROQUIMICA CELDAS GALVANICAS, ELECTROLISIS Y ELECTROQUIMICA APLICADA QUE ES LA ELECTROQUIMICA? Es la parte de la química que se encarga del estudio de las relaciones cualitativas y cuantitativas existentes
UNIDAD: Química orgánica UNIDAD DE APRENDIZAJE: Nomenclatura Orgánica. Profesora: Gladys Rivera Jerez
 UNIDAD: Química orgánica UNIDAD DE APRENDIZAJE: Nomenclatura Orgánica Profesora: Gladys Rivera Jerez Las sencillas combinaciones del carbono con algunos pocos átomos han dado origen a más de 10 millones
UNIDAD: Química orgánica UNIDAD DE APRENDIZAJE: Nomenclatura Orgánica Profesora: Gladys Rivera Jerez Las sencillas combinaciones del carbono con algunos pocos átomos han dado origen a más de 10 millones
OPCIÓN A Pregunta A1.- Pregunta A2.-
 OPCIÓN A Pregunta A1.- Considere las cuatro configuraciones electrónicas siguientes: (A) 1s 2 2s 2 2p 7, (B) 1s 2 2s 3, (C) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5, y (D) 1s 2 2s 2 2p 6 3s 2. a) Razone cuál(es)
OPCIÓN A Pregunta A1.- Considere las cuatro configuraciones electrónicas siguientes: (A) 1s 2 2s 2 2p 7, (B) 1s 2 2s 3, (C) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5, y (D) 1s 2 2s 2 2p 6 3s 2. a) Razone cuál(es)
UANL UNIVERSIDAD AUTONOMA DE NUEVO LEON PREPARATORIA 23
 GUIA DE QUIMICA II 2 SEMESTRE 3ª OPORTUNIDAD ETAPA 1 Escritura y balanceo de ecuaciones químicas por el método de tanteo. Evidencias de cambios químicos Tipos de reacciones químicas (combinación, descomposición,
GUIA DE QUIMICA II 2 SEMESTRE 3ª OPORTUNIDAD ETAPA 1 Escritura y balanceo de ecuaciones químicas por el método de tanteo. Evidencias de cambios químicos Tipos de reacciones químicas (combinación, descomposición,
FORMULACIÓN BÁSICA QUÍMICA ORGÁNICA
 FORMULACIÓN BÁSICA QUÍMICA ORGÁNICA La fórmula empírica indica los elementos que forman la molécula y la proporción relativa de los mismos. CH (escasa información) La fórmula molecular indica el número
FORMULACIÓN BÁSICA QUÍMICA ORGÁNICA La fórmula empírica indica los elementos que forman la molécula y la proporción relativa de los mismos. CH (escasa información) La fórmula molecular indica el número
Unidad III 3.3.Enlaces simples carbonooxigeno, 3.4.carbono -azufre, 3.5. carbono- nitrógeno
 Unidad III 3.3.Enlaces simples carbonooxigeno, 3.4.carbono -azufre, 3.5. carbono- nitrógeno Química orgánica I Químicos Escuela de vacaciones junio 2016 Licda. Jaqueline Carrera. Propiedades de los éteres
Unidad III 3.3.Enlaces simples carbonooxigeno, 3.4.carbono -azufre, 3.5. carbono- nitrógeno Química orgánica I Químicos Escuela de vacaciones junio 2016 Licda. Jaqueline Carrera. Propiedades de los éteres
EJERCICIOS PARA EXAMEN U6 Química 2º Bachiller
 2010 Reacciones de intercambio de Protones EJERCICIOS PARA EXAMEN U6 Química 2º Bachiller Recopilación de ejercicios preguntados en exámenes de cursos anteriores Mª Teresa Gómez Ruiz IES Politécnico Cartagena.
2010 Reacciones de intercambio de Protones EJERCICIOS PARA EXAMEN U6 Química 2º Bachiller Recopilación de ejercicios preguntados en exámenes de cursos anteriores Mª Teresa Gómez Ruiz IES Politécnico Cartagena.
Pirólisis y Gasificación (alternativas a la incineración convencional)
 Pirólisis y Gasificación (alternativas a la incineración convencional) Ventajas y funciones atribuibles Proceso sencillo de bajo costo ajustable a bajas cantidades de residuos (10t/h) Recuperación de energía
Pirólisis y Gasificación (alternativas a la incineración convencional) Ventajas y funciones atribuibles Proceso sencillo de bajo costo ajustable a bajas cantidades de residuos (10t/h) Recuperación de energía
Plan de Estudios Licenciatura en Química
 Plan de Estudios CONTENIDOS 1) Presentación 5) Objetivos 2) Requisitos 6) Cursos Obligatorios 3) Plan de Estudios / Duración 7) Cursos Sugeridos 4) Tabla de Créditos 1) Presentación Su programa de Licenciatura
Plan de Estudios CONTENIDOS 1) Presentación 5) Objetivos 2) Requisitos 6) Cursos Obligatorios 3) Plan de Estudios / Duración 7) Cursos Sugeridos 4) Tabla de Créditos 1) Presentación Su programa de Licenciatura
Ác. Carboxílicos -COOH unido al número necesario de
 FORMULACIÓN Y NOMENCLATURA DE LOS COMPUESTOS ORGÁNICOS. Pág. Nº 1 CONTENIDOS 1.- Compuestos orgánicos. 2.- Compuestos hidrocarburos. 3.- Compuestos halogenados. 4.- Compuestos oxigenados. 5.- Compuestos
FORMULACIÓN Y NOMENCLATURA DE LOS COMPUESTOS ORGÁNICOS. Pág. Nº 1 CONTENIDOS 1.- Compuestos orgánicos. 2.- Compuestos hidrocarburos. 3.- Compuestos halogenados. 4.- Compuestos oxigenados. 5.- Compuestos
1.- La masa atómica de la plata es de 107'9 u. Cuántos gramos pesan 0'25 mol de plata?
 Unidad 6 1.- La masa atómica de la plata es de 107'9 u. Cuántos gramos pesan 0'25 mol de plata? Como la masa atómica de la plata es de 107'9 u, la masa de 1 mol de plata es de 107'9 g (la misma cifra pero
Unidad 6 1.- La masa atómica de la plata es de 107'9 u. Cuántos gramos pesan 0'25 mol de plata? Como la masa atómica de la plata es de 107'9 u, la masa de 1 mol de plata es de 107'9 g (la misma cifra pero
QUÍMICA DEL CARBONO. Una instauración es un enlace múltiple (doble o triple) entre dos carbonos.
 QUÍMICA DEL CARBONO Conceptos básicos Los carbonos, según la posición que ocupan en la cadena, pueden ser carbonos primarios (están unidos a un único átomo de carbono), carbonos secundarios (están unidos
QUÍMICA DEL CARBONO Conceptos básicos Los carbonos, según la posición que ocupan en la cadena, pueden ser carbonos primarios (están unidos a un único átomo de carbono), carbonos secundarios (están unidos
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual Química orgánica III: grupos funcionales SGUICES047CB33-A16V1 Ítem Alternativa Habilidad 1 E Aplicación 2 D ASE 3 D Comprensión 4 C Reconocimiento 5 C Reconocimiento 6
SOLUCIONARIO Guía Estándar Anual Química orgánica III: grupos funcionales SGUICES047CB33-A16V1 Ítem Alternativa Habilidad 1 E Aplicación 2 D ASE 3 D Comprensión 4 C Reconocimiento 5 C Reconocimiento 6
QUÍMICA. AgNO 3 (ac) Ag + (ac) + NO 3 - (ac) (0,25 puntos) 0,1 M 0,1 M 0,1 M. (0,25 puntos)
 OPCIÓN A QUÍMICA 1. (2,5 puntos) Se analiza una muestra de 10 ml de una disolución acuosa que contiene ión cloruro, Cl -, mediante la adición de una gota (0,2 ml) de disolución acuosa de nitrato de plata,
OPCIÓN A QUÍMICA 1. (2,5 puntos) Se analiza una muestra de 10 ml de una disolución acuosa que contiene ión cloruro, Cl -, mediante la adición de una gota (0,2 ml) de disolución acuosa de nitrato de plata,
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO. Modelo Curso 2010-2011
 UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO MATERIA: QUÍMICA Modelo Curso 010-011 MODELO INSTRUCCIONES Y CRITERIOS GENERALES DE
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO MATERIA: QUÍMICA Modelo Curso 010-011 MODELO INSTRUCCIONES Y CRITERIOS GENERALES DE
Algunas reacciones de sustitución, de adición y de eliminación. Reacciones de condensación e hidrlólisis Reacciones de Oxidación y reducción
 Algunas reacciones de sustitución, de adición y de eliminación. Reacciones de condensación e hidrlólisis Reacciones de Oxidación y reducción Sustituciones en derivados halogenados. Por reacciones de sustitución
Algunas reacciones de sustitución, de adición y de eliminación. Reacciones de condensación e hidrlólisis Reacciones de Oxidación y reducción Sustituciones en derivados halogenados. Por reacciones de sustitución
Dar a conocer la capacidad de disolución del agua frente a otras sustancias.
 MINISTERIO DE EDUCACION Actividad 1: Agua en la vida II. Laboratorio: Solubilidad del agua 1. Tema: AGUA DISOLVENTE UNIVERSAL 2. Objetivo: Dar a conocer la capacidad de disolución del agua frente a otras
MINISTERIO DE EDUCACION Actividad 1: Agua en la vida II. Laboratorio: Solubilidad del agua 1. Tema: AGUA DISOLVENTE UNIVERSAL 2. Objetivo: Dar a conocer la capacidad de disolución del agua frente a otras
TEMA 13. Compuestos orgánicos oxigenados
 TEMA 13. Compuestos orgánicos oxigenados ALCHLES. Grupo funcional hidroxilo. R-H FENLES. Grupo funcional Ar-H ÉTERES. Grupo funcional oxi. R--R Nomenclatura alcoholes: Cadena principal: la más larga conteniendo
TEMA 13. Compuestos orgánicos oxigenados ALCHLES. Grupo funcional hidroxilo. R-H FENLES. Grupo funcional Ar-H ÉTERES. Grupo funcional oxi. R--R Nomenclatura alcoholes: Cadena principal: la más larga conteniendo
TEMA 5: REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 5: REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97 1. a) Cuántos gramos de hidróxido de potasio se necesitan para preparar 250 ml de una disolución acuosa de ph = 13? b) Calcule
TEMA 5: REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97 1. a) Cuántos gramos de hidróxido de potasio se necesitan para preparar 250 ml de una disolución acuosa de ph = 13? b) Calcule
ÁCIDO BASE QCA 04 ANDALUCÍA
 ÁCIDO BASE QCA 4 ANDAUCÍA 1.- Un ácido monoprótico, HA, en disolución acuosa de concentración, se encuentra ionizado en un 5 %. Calcule: a) El ph de la disolución. b) a constante de ionización del ácido..-
ÁCIDO BASE QCA 4 ANDAUCÍA 1.- Un ácido monoprótico, HA, en disolución acuosa de concentración, se encuentra ionizado en un 5 %. Calcule: a) El ph de la disolución. b) a constante de ionización del ácido..-
TEMA 3. Grupos funcionales con enlaces múltiples.
 TEMA 3. Grupos funcionales con enlaces múltiples. Alquenos. Alquinos. Compuestos aromáticos. El grupo carbonilo. Aldehídos. Cetonas. Ácidos carboxílicos. Ésteres. Anhídridos. Amidas Tioésteres, Fosfoésteres,
TEMA 3. Grupos funcionales con enlaces múltiples. Alquenos. Alquinos. Compuestos aromáticos. El grupo carbonilo. Aldehídos. Cetonas. Ácidos carboxílicos. Ésteres. Anhídridos. Amidas Tioésteres, Fosfoésteres,
QUÍMICA 2º Bachillerato Apuntes: Química Orgánica
 1(7) 1. GRUPO FUNCIONAL Y SERIE HOMÓLOGA 2. REACCIONES EN QUÍMICA ORGÁNICA 3. ISOMERÍA 1. GRUPO FUNCIONAL Y SERIE HOMÓLOGA Los compuestos orgánicos más sencillos son los hidrocarburos, que están constituidos
1(7) 1. GRUPO FUNCIONAL Y SERIE HOMÓLOGA 2. REACCIONES EN QUÍMICA ORGÁNICA 3. ISOMERÍA 1. GRUPO FUNCIONAL Y SERIE HOMÓLOGA Los compuestos orgánicos más sencillos son los hidrocarburos, que están constituidos
ANIONES ENOLATO, CONDENSACIONES ALDÓLICAS Y OTRAS
 ALDEHÍDOS Y CETONAS II ANIONES ENOLATO, CONDENSACIONES ALDÓLICAS Y OTRAS REACCIONES DE ALDEHÍDOS Y CETONAS Enolización de aldehídos y cetonas. Como ya hemos mencionado a lo largo del curso,los hidrógenos
ALDEHÍDOS Y CETONAS II ANIONES ENOLATO, CONDENSACIONES ALDÓLICAS Y OTRAS REACCIONES DE ALDEHÍDOS Y CETONAS Enolización de aldehídos y cetonas. Como ya hemos mencionado a lo largo del curso,los hidrógenos
TEMA 0: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 0: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. Calcule: a) Los moles de metano que quedan. b) Las moléculas
TEMA 0: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. Calcule: a) Los moles de metano que quedan. b) Las moléculas
QUÍMICA ORGÁNICA I Curso Andrea S. Farré
 QUÍMICA ORGÁNICA I Curso 2012 Andrea S. Farré Oxidación de alcoholes primarios Ozonólisis de alquenos en presencia de un agente reductor Hidratación de alquinos terminales: Hidroboración-oxidación Ya lo
QUÍMICA ORGÁNICA I Curso 2012 Andrea S. Farré Oxidación de alcoholes primarios Ozonólisis de alquenos en presencia de un agente reductor Hidratación de alquinos terminales: Hidroboración-oxidación Ya lo
TEMA 2. CLASIFICACION Y NOMECLATURA DE LOS COMPUESTOS ORGANICOS.
 TEMA 2. LASIFIAIN Y NMELATURA DE LS MPUESTS RGANIS. 1. oncepto de radical y grupo funcional. Series homólogas. 2. Principales tipos de compuestos orgánicos. Formulación y nomenclatura. 2 Tema 2 TEMA 2.
TEMA 2. LASIFIAIN Y NMELATURA DE LS MPUESTS RGANIS. 1. oncepto de radical y grupo funcional. Series homólogas. 2. Principales tipos de compuestos orgánicos. Formulación y nomenclatura. 2 Tema 2 TEMA 2.
RESUMEN FORMULACIÓN DE QUÍMICA INORGÁNICA
 RESUMEN FORMULACIÓN DE QUÍMICA INORGÁNICA 1- SUSTANCIAS SIMPLES Las sustancias simples están constituidas por una clase única de átomos. En general, los elementos gaseosos suelen encontrarse en forma de
RESUMEN FORMULACIÓN DE QUÍMICA INORGÁNICA 1- SUSTANCIAS SIMPLES Las sustancias simples están constituidas por una clase única de átomos. En general, los elementos gaseosos suelen encontrarse en forma de
Informe del trabajo práctico nº8
 Informe del trabajo práctico nº8 Profesora : Lic. Graciela. Lic. Mariana. Alumnas: Romina. María Luján. Graciela. Mariana. Curso: Química orgánica 63.14 turno 1 Objetivos Verificar, en el laboratorio,
Informe del trabajo práctico nº8 Profesora : Lic. Graciela. Lic. Mariana. Alumnas: Romina. María Luján. Graciela. Mariana. Curso: Química orgánica 63.14 turno 1 Objetivos Verificar, en el laboratorio,
REACTIVOS Y SOLUCIONES
 REACTIVOS Y SOLUCIONES 1. Especificaciones de reactivos Se realizará la consulta al GE sobre la calidad de los reactivos a utilizar (ACS, HPLC, etc.) hay que definir. Almidón- El almidón separado de los
REACTIVOS Y SOLUCIONES 1. Especificaciones de reactivos Se realizará la consulta al GE sobre la calidad de los reactivos a utilizar (ACS, HPLC, etc.) hay que definir. Almidón- El almidón separado de los
6. Reacciones de precipitación
 6. Reacciones de precipitación Las reacciones de precipitación son aquellas en las que el producto es un sólido; se utilizan en los métodos gravimétricos de análisis y en las titulaciones por precipitación.
6. Reacciones de precipitación Las reacciones de precipitación son aquellas en las que el producto es un sólido; se utilizan en los métodos gravimétricos de análisis y en las titulaciones por precipitación.
UNIVERSIDAD AUTÓNOMA DE NUEVO LEÓN PREPARATORIA NO. 22. Portafolio Tercera y Quinta Oportunidad. Temas Selecto de Química
 UNIVERSIDAD AUTÓNOMA DE NUEVO LEÓN PREPARATORIA NO. 22 Portafolio Tercera y Quinta Oportunidad Temas Selecto de Química NOMBRE DEL ALUMNO: SEMESTRE: OPORTUNIDAD: PORTAFOLIO DE EVIDENCIAS DE TERCERA Y QUINTA
UNIVERSIDAD AUTÓNOMA DE NUEVO LEÓN PREPARATORIA NO. 22 Portafolio Tercera y Quinta Oportunidad Temas Selecto de Química NOMBRE DEL ALUMNO: SEMESTRE: OPORTUNIDAD: PORTAFOLIO DE EVIDENCIAS DE TERCERA Y QUINTA
TRABAJO DE RECUPERACIÓN DEL PRIMER PARCIAL 2012-2013
 TRABAJO DE RECUPERACIÓN DEL PRIMER PARCIAL 2012-2013 ÁREA: QUÍMICA CURSO: SEGUNDO DE BACHILLERATO NOMBRE: FECHA DE ENTREGA: Jueves, 22-11-2012 INDICACIONES GENERALES: El trabajo deberá ser entregado a
TRABAJO DE RECUPERACIÓN DEL PRIMER PARCIAL 2012-2013 ÁREA: QUÍMICA CURSO: SEGUNDO DE BACHILLERATO NOMBRE: FECHA DE ENTREGA: Jueves, 22-11-2012 INDICACIONES GENERALES: El trabajo deberá ser entregado a
Resultado: a) K ps = 6,81 10 11 M 4 ; b) No hay precipitado.
 PRUEBA GENERAL OPCIÓN A PROBLEMA.- La solubilidad del Cr(OH) 3 es 0,13 mg ml 1 : a) Determina la constante de solubilidad K ps del hidróxido de cromo (III). b) Se tiene una disolución de CrCl 3 de concentración
PRUEBA GENERAL OPCIÓN A PROBLEMA.- La solubilidad del Cr(OH) 3 es 0,13 mg ml 1 : a) Determina la constante de solubilidad K ps del hidróxido de cromo (III). b) Se tiene una disolución de CrCl 3 de concentración
U3 T5. Formulación y nomenclatura de los compuestos oxigenados y nitrogenados.
 U3 T5 Formulación y nomenclatura de los compuestos oxigenados y nitrogenados Tema Tema 5: Compuestos 1: Aquí pondríamos oxigenados el Título y nitrogenados del tema 1 Alcoholes, fenoles y éteres Los alcoholes
U3 T5 Formulación y nomenclatura de los compuestos oxigenados y nitrogenados Tema Tema 5: Compuestos 1: Aquí pondríamos oxigenados el Título y nitrogenados del tema 1 Alcoholes, fenoles y éteres Los alcoholes
EL ARCO IRIS DE LA REACTIVIDAD DE CATIONES
 EL ARC IRIS DE LA REACTIVIDAD DE CATINES RJ: REACTIVIDAD DEL HIERR CN EL SULFCIANUR El hierro, en estado de oxidación (+3), cuando está en disolución es incoloro. Este catión tiene la capacidad de combinarse
EL ARC IRIS DE LA REACTIVIDAD DE CATINES RJ: REACTIVIDAD DEL HIERR CN EL SULFCIANUR El hierro, en estado de oxidación (+3), cuando está en disolución es incoloro. Este catión tiene la capacidad de combinarse
www.fisicaeingenieria.es CARACTERÍSTICAS DE LOS ÁCIDOS Y LAS BASES
 CARACTERÍSTICAS DE LOS ÁCIDOS Y LAS BASES ÁCIDOS 1. Tienen sabor ácido como en el caso del ácido cítrico en la naranja. 2. Cambian el color del papel tornasol a rosado. 3. Son corrosivos. 4. Producen quemaduras
CARACTERÍSTICAS DE LOS ÁCIDOS Y LAS BASES ÁCIDOS 1. Tienen sabor ácido como en el caso del ácido cítrico en la naranja. 2. Cambian el color del papel tornasol a rosado. 3. Son corrosivos. 4. Producen quemaduras
Electrólisis. Electrólisis 12/02/2015
 Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
QUÍMICA ORGÁNICA. - Saturados o alcanos: todos los enlaces C-C son sencillos
 QUÍMICA ORGÁNICA Compuestos inorgánicos son los que forman la materia inerte (agua, sales minerales, rocas), aunque muchos de ellos también forman parte de los seres vivos; de hecho el agua, compuesto
QUÍMICA ORGÁNICA Compuestos inorgánicos son los que forman la materia inerte (agua, sales minerales, rocas), aunque muchos de ellos también forman parte de los seres vivos; de hecho el agua, compuesto
Ejemplos de algunas aminas biológicamente activas
 Ejemplos de algunas aminas biológicamente activas Alcaloides El amoniaco tiene una estructura tetraédrica algo distorsionada, con una de las posiciones del tetraedro ocupada por un par de electrones no
Ejemplos de algunas aminas biológicamente activas Alcaloides El amoniaco tiene una estructura tetraédrica algo distorsionada, con una de las posiciones del tetraedro ocupada por un par de electrones no
DISOLUCIONES Y ESTEQUIOMETRÍA
 DISOLUCIONES Y ESTEQUIOMETRÍA DISOLUCIONES 1.-/ Se disuelven 7 gramos de NaCl en 50 gramos de agua. Cuál es la concentración centesimal de la disolución? Sol: 12,28 % de NaCl 2.-/ En 20 ml de una disolución
DISOLUCIONES Y ESTEQUIOMETRÍA DISOLUCIONES 1.-/ Se disuelven 7 gramos de NaCl en 50 gramos de agua. Cuál es la concentración centesimal de la disolución? Sol: 12,28 % de NaCl 2.-/ En 20 ml de una disolución
SEPARACIÓN DE ALUMINIO A PARTIR DE MATERIAL DE DESECHO
 Actividad Experimental SEPARACIÓN DE ALUMINIO A PARTIR DE MATERIAL DE DESECHO Investigación previa 1.- Investigar las medidas de seguridad que hay que mantener al manipular KOH y H SO, incluyendo que acciones
Actividad Experimental SEPARACIÓN DE ALUMINIO A PARTIR DE MATERIAL DE DESECHO Investigación previa 1.- Investigar las medidas de seguridad que hay que mantener al manipular KOH y H SO, incluyendo que acciones
b) Para el último electrón del átomo de magnesio, los números cuánticos posibles son: n = 3; l = 1 ±.
 PRUEBA GENERAL OPCIÓN A CUESTIÓN 1.- Considerando el elemento alcalinotérreo del tercer período y el segundo elemento del grupo de los halógenos: a) Escribe sus configuraciones electrónicas. b) Escribe
PRUEBA GENERAL OPCIÓN A CUESTIÓN 1.- Considerando el elemento alcalinotérreo del tercer período y el segundo elemento del grupo de los halógenos: a) Escribe sus configuraciones electrónicas. b) Escribe
Reacciones Redox 26/06/2012 C 3 H 8 + 5O 2 3CO 2 + 4H 2 O. Academia de Química, Depto. Ciencia Básicas ITESM, campus qro. 1
 C 3 H 8 + 5O 2 3CO 2 + 4H 2 O Básicas ITESM, campus qro. 1 Reacciones donde hay transferencia de electrones. Cuando un átomo de carbono, en el reactivo orgánico, forma más enlaces con el O, C, N, halógenos
C 3 H 8 + 5O 2 3CO 2 + 4H 2 O Básicas ITESM, campus qro. 1 Reacciones donde hay transferencia de electrones. Cuando un átomo de carbono, en el reactivo orgánico, forma más enlaces con el O, C, N, halógenos
RESUMEN DE FORMULACIÓN DE QUÍMICA ORGÁNICA
 RESUMEN DE FRMULACIÓN DE QUÍMICA RGÁNICA 1. HIDRCARBURS SATURADS (ALCANS) a) Los cuatro primeros tienen por nombres: CH 4 metano; - etano; - CH 2 - propano; - CH 2 - CH 2 - butano. El resto se nombra mediante
RESUMEN DE FRMULACIÓN DE QUÍMICA RGÁNICA 1. HIDRCARBURS SATURADS (ALCANS) a) Los cuatro primeros tienen por nombres: CH 4 metano; - etano; - CH 2 - propano; - CH 2 - CH 2 - butano. El resto se nombra mediante
De cualquier manera, solo estudiaremos en esta unidad los compuestos inorgánicos.
 Unidad 3 Ácidos, Hidróxidos y Sales: óxidos básicos, óxidos ácidos, hidróxidos, hidrácidos o ácidos binarios, ácidos ternarios, sales binarias, ternarias y cuaternarias. Formación y nomenclatura. Enlaces
Unidad 3 Ácidos, Hidróxidos y Sales: óxidos básicos, óxidos ácidos, hidróxidos, hidrácidos o ácidos binarios, ácidos ternarios, sales binarias, ternarias y cuaternarias. Formación y nomenclatura. Enlaces
QUÍMICA ORGÁNICA.QUÍMICA DEL CARBONO
 QUÍMICA ORGÁNICA.QUÍMICA DEL CARBONO ENLACES DEL CARBONO ENLACE SIMPLE C-C ENLACE DOBLE C=C ENLACE TRIPLE C C TIPO DE ORBITAL sp 3 sp 2 sp Nº DE ORBITALES HÍBRIDOS ORBITALES P SIN HIBRIDAR GEOMETRÍA DE
QUÍMICA ORGÁNICA.QUÍMICA DEL CARBONO ENLACES DEL CARBONO ENLACE SIMPLE C-C ENLACE DOBLE C=C ENLACE TRIPLE C C TIPO DE ORBITAL sp 3 sp 2 sp Nº DE ORBITALES HÍBRIDOS ORBITALES P SIN HIBRIDAR GEOMETRÍA DE
Química orgánica: Grupos funcionales
 PPTCES042CB33-A16V1 Colegio Santo Domingo Química Electivo III Medio Clase Química orgánica: Grupos funcionales Ejercicio tipo PSU 1. Grupos funcionales oxigenados 1.1 Alcohol Constituido por radicales
PPTCES042CB33-A16V1 Colegio Santo Domingo Química Electivo III Medio Clase Química orgánica: Grupos funcionales Ejercicio tipo PSU 1. Grupos funcionales oxigenados 1.1 Alcohol Constituido por radicales
TUBERÍA POLIETILENO RETICULADO (PE-X)
 TUBERÍA POLIETILENO RETICULADO (PE-X) El tubo de Polietileno Reticulado PEX es un polímero de alta densidad al que el proceso de reticulación le confiere excelentes propiedades mecánicas ya que es este
TUBERÍA POLIETILENO RETICULADO (PE-X) El tubo de Polietileno Reticulado PEX es un polímero de alta densidad al que el proceso de reticulación le confiere excelentes propiedades mecánicas ya que es este
Especialista en Química Orgánica para Ciencias de la Salud
 Especialista en Química Orgánica para Ciencias de la Salud Titulación certificada por EUROINNOVA BUSINESS SCHOOL Especialista en Química Orgánica para Ciencias de la Salud Especialista en Química Orgánica
Especialista en Química Orgánica para Ciencias de la Salud Titulación certificada por EUROINNOVA BUSINESS SCHOOL Especialista en Química Orgánica para Ciencias de la Salud Especialista en Química Orgánica
PONTIFICIA UNIVERSIDAD JAVERIANA FAC. DE CIENCIAS - DPTO. DE QUIMICA FUNDAMENTOS DE BIOLOGIA I COMPUESTOS DEL CARBONO
 PNTIFICIA UNIVERSIDAD JAVERIANA FAC. DE CIENCIAS - DPT. DE QUIMICA FUNDAMENTS DE BILGIA I CMPUESTS DEL CARBN Julio A. Pedrozo Pérez 2002 FUNCINES RGANICAS 1. Funciones oxigenadas - Alcoholes, Fenoles y
PNTIFICIA UNIVERSIDAD JAVERIANA FAC. DE CIENCIAS - DPT. DE QUIMICA FUNDAMENTS DE BILGIA I CMPUESTS DEL CARBN Julio A. Pedrozo Pérez 2002 FUNCINES RGANICAS 1. Funciones oxigenadas - Alcoholes, Fenoles y
Números de Oxidación
 Iones Una buena proporción de toda la actividad química implica la transferencia de electrones entre elementos. Cuando un átomo gana o pierde un electrón se convierte en un ión. Un ión es un átomo o conjunto
Iones Una buena proporción de toda la actividad química implica la transferencia de electrones entre elementos. Cuando un átomo gana o pierde un electrón se convierte en un ión. Un ión es un átomo o conjunto
1. El 2-propanol y el etilmetiléter son dos compuestos isómeros con propiedades muy diferentes.
 QUÍMICA ORGÁNICA 1. El 2-propanol y el etilmetiléter son dos compuestos isómeros con propiedades muy diferentes. a) Formule dichos compuestos. b) Explique, en función de su estructura molecular, la razón
QUÍMICA ORGÁNICA 1. El 2-propanol y el etilmetiléter son dos compuestos isómeros con propiedades muy diferentes. a) Formule dichos compuestos. b) Explique, en función de su estructura molecular, la razón
SEGUNDO DE BACHILLERATO QUÍMICA. Simple C-C sp 3. Doble C=C sp 2. Triple C C
 TEMA 10. QUÍMICA ORGÁNICA PROPIEDADES GENERALES - Solubilidad: se disuelven generalmente en otros compuestos orgánicos, como éter, cloroformo o benceno - Estabilidad: suelen descomponerse a temperaturas
TEMA 10. QUÍMICA ORGÁNICA PROPIEDADES GENERALES - Solubilidad: se disuelven generalmente en otros compuestos orgánicos, como éter, cloroformo o benceno - Estabilidad: suelen descomponerse a temperaturas
REACCIONES DE TRANSFERENCIA DE ELECTRONES (electrolisis)
 REACCIONES DE TRANSFERENCIA DE ELECTRONES (electrolisis) 1 2 Electrólisis Aplicando una f.e.m. adecuada se puede conseguir que tenga lugar una reacción redox en el sentido que no es espontánea. En una
REACCIONES DE TRANSFERENCIA DE ELECTRONES (electrolisis) 1 2 Electrólisis Aplicando una f.e.m. adecuada se puede conseguir que tenga lugar una reacción redox en el sentido que no es espontánea. En una
UNIVERSIDAD DEL CAUCA FACULTAD DE CIENCIAS AGROPECUARIAS PROGRAMA INGENIERIA AGROINDUSTRIAL
 ASIGNATURA: QUÍMICA ORGÁNICA BÁSICA CÓDIGO: QCA142 CRÉDITOS: 4 MODALIDAD: Teórico-Práctica REQUISITOS: Química general INTENSIDAD: 5 horas semanales DIMENSIÓN: CIENTÍFICO - TECNOLÓGICA INTRODUCCIÓN La
ASIGNATURA: QUÍMICA ORGÁNICA BÁSICA CÓDIGO: QCA142 CRÉDITOS: 4 MODALIDAD: Teórico-Práctica REQUISITOS: Química general INTENSIDAD: 5 horas semanales DIMENSIÓN: CIENTÍFICO - TECNOLÓGICA INTRODUCCIÓN La
ANÁLISIS CUALITATIVO DE CATIONES Y ANIONES
 VII 1 PRÁCTICA 7 ANÁLISIS CUALITATIVO DE CATIONES Y ANIONES FORMACIÓN DE PRECIPITADOS Y DISOLUCIÓN DE LOS MISMOS POR FORMACIÓN DE COMPLEJOS FUNDAMENTO DE LA PRÁCTICA En esta práctica llevaremos a cabo
VII 1 PRÁCTICA 7 ANÁLISIS CUALITATIVO DE CATIONES Y ANIONES FORMACIÓN DE PRECIPITADOS Y DISOLUCIÓN DE LOS MISMOS POR FORMACIÓN DE COMPLEJOS FUNDAMENTO DE LA PRÁCTICA En esta práctica llevaremos a cabo
IES Real Instituto Jovellanos 1º BACHILLERATO. SERIE 17
 1.- Ajustar las siguientes reacciones: a) Propano + oxígeno === dióxido de carbono + agua b) Carbonato de sodio + ácido clorhídrico === cloruro de sodio + agua c) Tribromuro de fósforo + agua === ácido
1.- Ajustar las siguientes reacciones: a) Propano + oxígeno === dióxido de carbono + agua b) Carbonato de sodio + ácido clorhídrico === cloruro de sodio + agua c) Tribromuro de fósforo + agua === ácido
