Cada pulverización libera 27,5 microgramos de furoato de fluticasona.
|
|
|
- Bernardo Ramos Salazar
- hace 8 años
- Vistas:
Transcripción
1 1. NOMBRE DEL MEDICAMENTO Avamys 27,5 microgramos/pulverización, suspensión para pulverización nasal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada pulverización libera 27,5 microgramos de furoato de fluticasona. Para consultar la lista completa de excipientes, ver sección FORMA FARMACÉUTICA Suspensión para pulverización nasal. Suspensión de color blanco. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas Adultos, adolescentes (12 años y mayores) y niños (de 6 a 11 años) Avamys está indicado para el tratamiento de: los síntomas de la rinitis alérgica 4.2 Posología y forma de administración La suspensión para pulverización nasal de furoato de fluticasona debe administrarse únicamente por vía intranasal. Para obtener un beneficio terapéutico completo se recomienda seguir con regularidad la pauta posológica. El efecto terapéutico comienza a observarse 8 horas después de la administración inicial. Sin embargo, pueden ser necesarios varios días de tratamiento para conseguir el máximo beneficio, por lo que se debe informar al paciente de que sus síntomas mejorarán con el uso regular y continuado del medicamento (ver sección 5.1). La duración del tratamiento debe restringirse al período correspondiente a la exposición alergénica. Adultos y adolescentes (12 años y mayores) La dosis inicial recomendada es de dos pulverizaciones (27,5 microgramos de furoato de fluticasona por pulverización) en cada fosa nasal una vez al día (dosis diaria total, 110 microgramos). Una vez que se consiga un adecuado control de los síntomas, la reducción de la dosis a una sola pulverización en cada fosa nasal (dosis diaria total, 55 microgramos) puede ser efectiva para el mantenimiento. La dosis se debe ajustar a la dosis más baja con la que se mantenga un control eficaz de los síntomas. 2
2 Niños (de 6 a 11 años de edad) La dosis inicial recomendada es de una pulverización (27,5 microgramos de furoato de fluticasona por pulverización) en cada fosa nasal una vez al día (dosis diaria total, 55 microgramos). Los pacientes que no respondan adecuadamente a una pulverización diaria en cada fosa nasal (dosis diaria total, 55 microgramos), pueden utilizar dos pulverizaciones diarias en cada fosa nasal (dosis diaria total, 110 microgramos). Una vez que se consiga un adecuado control de los síntomas, se recomienda reducir la dosis a una sola pulverización en cada fosa nasal (dosis diaria total, 55 microgramos). Niños menores de 6 años: La experiencia en niños menores de 6 años es limitada (ver secciones 5.1 y 5.2). La seguridad y eficacia en este grupo no ha sido adecuadamente establecida. Pacientes de edad avanzada: No es necesario ajustar la dosis en esta población (ver sección 5.2). Pacientes con insuficiencia renal: No es necesario ajustar la dosis en esta población (ver sección 5.2). Pacientes con insuficiencia hepática: No es necesario ajustar la dosis en pacientes con insuficiencia hepática leve o moderada. No existen datos en pacientes con insuficiencia hepática grave (ver secciones 4.4 y 5.2). Se debe agitar el dispositivo intranasal antes de su uso. El dispositivo se prepara presionando el botón dosificador para emitir por lo menos seis pulverizaciones (hasta que se vea una fina niebla), mientras sujeta el dispositivo en posición vertical. Sólo es necesario volver a preparar el dispositivo intranasal (aproximadamente 6 pulverizaciones hasta que se vea una fina niebla) si ha quedado destapado durante 5 días o no se ha utilizado durante 30 días o más. Después de cada uso se debe limpiar el dispositivo y volver a colocar la tapa. 4.3 Contraindicaciones Hipersensibilidad al principio activo o a alguno de los excipientes de Avamys incluidos en la sección Advertencias y precauciones especiales de empleo El furoato de fluticasona experimenta un importante efecto de primer paso metabólico, por lo tanto es probable que aumente la exposición sistémica a furoato de fluticasona administrado por vía intranasal en pacientes con insuficiencia hepática grave. Esto puede producir un aumento en la frecuencia de efectos adversos sistémicos (ver secciones 4.2 y 5.2). Se debe tener precaución cuando se trate a este tipo de pacientes. Ritonavir No se recomienda la administración concomitante con ritonavir, debido al riesgo de que se produzca un aumento de la exposición sistémica a furoato de fluticasona (ver sección 4.5). Pueden aparecer efectos sistémicos con cualquier corticoide administrado por vía nasal, especialmente a dosis elevadas prescritas durante periodos prolongados. La probabilidad de que estos efectos aparezcan es mucho menor que con corticosteroides administrados por vía oral y puede variar en función del paciente y entre las diferentes preparaciones de corticosteroides. Los potenciales efectos sistémicos pueden incluir Síndrome de Cushing, aspecto Cushingoideo, supresión suprarrenal, retraso en el crecimiento de niños y adolescentes, cataratas, glaucoma y más raramente, una serie de efectos psicológicos o del comportamiento incluyendo hiperactividad psicomotora, trastornos del sueño, ansiedad, depresión o agresión (especialmente en niños). Se ha observado una disminución en la velocidad de crecimiento en los niños tratados con 110 microgramos de furoato de fluticasona diarios durante un año (ver secciones Reacciones adversas y Propiedades farmacodinámicas). Por lo tanto, se debe mantener a los niños con la 3
3 dosis mínima eficaz que permita un control adecuado de los síntomas (ver sección Posología y forma de administración). Al igual que con otros corticosteroides intranasales, los médicos deben estar alerta ante los posibles efectos sistémicos de los esteroides incluyendo cambios oculares (ver sección Propiedades farmacodinámicas). El tratamiento con dosis de corticosteroides nasales superiores a las recomendadas puede producir supresión de la función suprarrenal clínicamente relevante. Si hay evidencia de que se están empleando dosis superiores a las recomendadas, debe considerarse la posible necesidad de administrar corticosteroides sistémicos adicionales en períodos de estrés o en casos de cirugía programada. La administración de 110 microgramos de furoato de fluticasona una vez al día no se ha asociado con supresión del eje hipotálamo-hipófisis-suprarrenal (HPA) en adultos, adolescentes o pacientes pediátricos. Sin embargo, la dosis de furoato de fluticasona intranasal debe ser reducida hasta la mínima dosis posible con la que se consiga mantener un control efectivo de los síntomas de la rinitis. Al igual que con todos los corticosteroides intranasales, se debe considerar siempre la carga sistémica total de corticosteroides cuando se vayan a prescribir concomitantemente otras formas de tratamiento corticosteroide. Se han notificado casos de retraso en el crecimiento en niños tratados con corticosteroides nasales a las dosis autorizadas. Se recomienda vigilar regularmente el crecimiento de los niños que reciban un tratamiento prolongado con corticosteroides por vía nasal. Si se detecta un retraso en el crecimiento, deberá revisarse el tratamiento con objeto de, si es posible, reducir la dosis administrada a la mínima con la que se consiga un control efectivo de los síntomas. Además, se debe valorar la posibilidad de derivar al paciente a la consulta de su pediatra (ver sección 5.1). Si hubiera alguna razón para suponer que la función suprarrenal está alterada, se debe tener cuidado cuando los pacientes pasen de recibir un tratamiento con esteroides sistémicos a recibir furoato de fluticasona. El uso de corticosteroides nasales e inhalados pueden producir glaucoma y/o cataratas. Por tanto, se debe asegurar una estrecha vigilancia en pacientes que presenten cambios en la visión o con una historia de presión intraocular elevada, glaucoma y/o cataratas. Avamys contiene cloruro de benzalconio. Puede producir irritación de la mucosa nasal. 4.5 Interacción con otros medicamentos y otras formas de interacción El furoato de fluticasona sufre un rápido aclaramiento sistémico debido a un importante efecto de primer paso metabólico, producido por la isoenzima 3A4 del citocromo P450. Tomando como referencia los datos de otro glucocorticoide (propionato de fluticasona), que se metaboliza mediante la isoenzima CYP3A4, no se recomienda administrar furoato de fluticasona de forma conjunta con ritonavir debido al riesgo de aumento de exposición sistémica a furoato de fluticasona. Se recomienda precaución cuando se administren de forma conjunta furoato de fluticasona e inhibidores potentes de la isoenzima CYP3A4, ya que no se puede descartar un aumento en la exposición sistémica. En un estudio de interacción medicamentosa de furoato de fluticasona intranasal con ketoconazol, un potente inhibidor de la isoenzima CYP3A4, se observó un mayor número de sujetos con concentraciones medibles de furoato de fluticasona en el grupo de ketoconazol (6 de los 20 sujetos) comparado con placebo (1 de 20 sujetos). Este pequeño aumento en la exposición no tuvo como resultado una diferencia estadísticamente significativa entre los dos grupos en los niveles séricos de cortisol de 24 horas (ver sección 4.4). Los datos de inducción e inhibición enzimática sugieren que no hay una base teórica para anticipar interacciones metabólicas entre el furoato de fluticasona y otros compuestos cuyo metabolismo está 4
4 mediado por el citocromo P450 a dosis intranasales clínicamente relevantes. Por lo tanto, no se ha realizado ningún ensayo clínico para investigar las interacciones de furoato de fluticasona con otros medicamentos. 4.6 Fertilidad, embarazo y lactancia No existen datos adecuados acerca del uso de furoato de fluticasona en mujeres embarazadas. En estudios en animales se ha observado que los glucocorticodes inducen malformaciones, incluyendo paladar hendido y retraso en el crecimiento intra-uterino. Sin embargo no es probable que esto sea relevante en humanos a las dosis nasales recomendadas, ya que la exposición sistémica es mínima (ver sección 5.2). El furoato de fluticasona sólo debe ser utilizado durante el embarazo, si los beneficios para la madre superan los riesgos potenciales para el feto o el niño. Se desconoce si el furoato de fluticasona administrado por vía nasal se excreta en la leche materna. Sólo debe considerarse la administración de furoato de fluticasona en mujeres durante el periodo de lactancia, cuando el beneficio esperado para la madre supere cualquier posible riesgo para el niño. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas, ya que no se espera que el furoato de fluticasona afecte a esta capacidad. 4.8 Reacciones adversas Se han empleado los datos procedentes de ensayos clínicos de gran tamaño para determinar la frecuencia de las reacciones adversas. Las frecuencias se han definido de la siguiente forma: Muy frecuentes 1/10; Frecuentes 1/100 a <1/10; Poco frecuentes 1/1.000 a <1/100; Raras 1/ a <1/1.000; Muy raras <1/ Trastornos del sistema inmunológico Raras Reacciones de hipersensibilidad incluyendo anafilaxia, angioedema, erupción y urticaria. Trastornos del sistema nervioso Frecuentes Cefalea. Trastornos oculares Frecuencia no Cambios oculares transitorios (ver Experiencia clínica). conocida Trastornos respiratorios, torácicos y mediastínicos Muy frecuentes *Epistaxis. Frecuentes Úlceras nasales. Poco frecuentes Rinalgia, molestias nasales (incluyendo quemazón nasal, irritación nasal e inflamación nasal) y sequedad nasal. Trastornos musculoesqueléticos y del tejido conjuntivo (Niños) Frecuencia no **Retraso en el crecimiento (ver Experiencia clínica). conocida *La epistaxis fue generalmente de intensidad leve a moderada. En adultos y adolescentes, la incidencia de epistaxis fue más alta con el uso prolongado (más de 6 semanas) que con el uso a corto plazo (hasta 6 semanas). En ensayos clínicos en pacientes pediátricos de hasta 12 semanas de duración, la incidencia de epistaxis fue semejante entre los pacientes que recibieron furoato de fluticasona y los pacientes que recibieron placebo. 5
5 ** En un estudio clínico de un año de duración que evaluaba el crecimiento en niños pre-adolescentes que recibieron 110 microgramos de furoato de fluticasona una vez al día, se observó una diferencia media en la velocidad de crecimiento de 0,27 cm por año en los pacientes que recibieron tratamiento en comparación con placebo (ver Experiencia clínica). Pueden aparecer efectos sistémicos con el uso de corticosteroides nasales, especialmente cuando se prescriben a dosis elevadas durante largos periodos de tiempo (ver sección 4.4). Se han notificado casos de retraso en el crecimiento en niños tratados con corticosteroides nasales. 4.9 Sobredosis En un ensayo de biodisponibilidad, se administraron dosis intranasales diarias de hasta microgramos durante más de tres días, sin que se observara ningún efecto adverso sistémico (ver sección 5.2). Es improbable que la sobredosis aguda requiera algún tratamiento aparte de la observación. 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas Grupo farmacoterapéutico: Corticosteroides, código ATC: R01AD12 El furoato de fluticasona es un corticosteroide sintético trifluorado que posee una afinidad muy elevada por el receptor glucocorticoide y tiene una potente acción antiinflamatoria. Experiencia clínica: Rinitis alérgica estacional en adultos y adolescentes: Comparado con placebo, la administración de 110 microgramos de furoato de fluticasona en suspensión para pulverización nasal una vez al día mejoró significativamente los síntomas nasales (como son la rinorrea, congestión nasal, estornudos y prurito nasal) y los síntomas oculares (como son el prurito/ardor, lagrimeo y enrojecimiento de los ojos) en los cuatro ensayos. La eficacia se mantuvo durante el período de dosificación, de 24 horas, con una única administración diaria. El comienzo del beneficio terapéutico se observó a las 8 horas después de la administración inicial, observándose una mejoría adicional durante los días posteriores. La administración de furoato de fluticasona en suspensión para pulverización nasal mejoró significativamente la percepción de los pacientes en cuanto a la respuesta general al tratamiento, y la calidad de vida de los pacientes relacionada con la enfermedad (Cuestionario de Calidad de Vida de Rinoconjuntivitis RQLQ), en los cuatro ensayos. Rinitis alérgica perenne en adultos y adolescentes: La administración de 110 microgramos de furoato de fluticasona en suspensión para pulverización nasal una vez al día mejoró significativamente los síntomas nasales así como la percepción de los pacientes en cuanto a la respuesta general al tratamiento comparado con placebo en los tres ensayos. La administración de 110 microgramos de furoato de fluticasona en suspensión para pulverización nasal una vez al día mejoró significativamente los síntomas oculares, así como la calidad de vida de los pacientes relacionada con la enfermedad (RQLQ) en comparación con placebo, en un ensayo. La eficacia se mantuvo durante el período de dosificacion de 24 horas con una única administración diaria. En un estudio de dos años de duración diseñado para evaluar la seguridad ocular de furoato de fluticasona (110 microgramos una vez al día en suspensión para pulverización intranasal), los adultos y adolescentes con rinitis alérgica perenne recibieron bien furoato de fluticasona (n=367) o placebo (n=181). Los resultados de la variable primaria [tiempo hasta aumentar la opacidad subcapsular posterior ( 0,3 respecto 6
6 al valor basal en el Sistema de Clasificación de Opacidad Cristaliniana, Versión III (grado LOCS III) y tiempo hasta aumentar la presión intraocular (PIO; 7 mmhg respecto al valor basal)] no fueron estadísticamente significativos entre los dos grupos. Los aumentos en la opacidad subcapsular posterior ( 0,3 respecto al valor basal) fueron más frecuentes en los sujetos tratados con 110 microgramos de furoato de fluticasona [14 (4%)] frente a placebo [4 (2%)] y fueron de naturaleza transitoria para 10 sujetos en el grupo de furoato de fluticasona y 2 sujetos en el grupo placebo. Los aumentos en la PIO ( 7 mmhg respecto al valor basal) fueron más frecuentes en sujetos tratados con 110 microgramos de furoato de fluticasona: 7 (2%) para el grupo que recibió 110 microgramos de furoato de fluticasona una vez al día y 1 (<1%) para el grupo placebo. Estos acontecimientos fueron de naturaleza transitoria para 6 sujetos en el grupo de furoato de fluticasona y 1 sujeto en el grupo placebo. En las semanas 52 y 104, el 95% de los sujetos en ambos grupos de tratamiento tuvieron unos valores de opacidad subcapsular posterior dentro del ± 0,1 respecto a los valores basales para cada ojo y, en la semana 104, el 1% de los sujetos en ambos grupos de tratamiento tuvieron un aumento de 0,3 en la opacidad subcapsular posterior respecto al valor basal. En las semanas 52 y 104, la mayoría de los sujetos (>95%) tuvo valores de PIO dentro de ± 5mmHg respecto al valor basal. Los aumentos en la opacidad subcapsular posterior o en la PIO no fueron acompañados de ningún acontecimiento adverso de cataratas o glaucoma. Rinitis alérgica estacional y perenne en niños: La posología pediátrica se basa en la evaluación de los datos de eficacia en la población de niños con rinitis alérgica. En la rinitis alérgica estacional, la administración de 110 microgramos de furoato de fluticasona en suspensión para pulverización nasal una vez al día fue efectiva, pero no se observaron diferencias significativas entre la administración de 55 microgramos de furoato de fluticasona en suspensión para pulverización nasal una vez al día y placebo para ninguna de las variables. En la rinitis alérgica perenne, la administración de 55 microgramos de furoato de fluticasona en suspensión para pulverización nasal una vez al día mostró un perfil de eficacia más consistente que la administración de 110 microgramos de furoato de fluticasona en suspensión para pulverización nasal una vez al día durante 4 semanas de tratamiento. El análisis post-hoc a lo largo de 6 y 12 semanas en el mismo ensayo, así como el estudio de seguridad del eje HPA de 6 semanas de duración, apoyaron la eficacia de la administración de 110 microgramos de furoato de fluticasona en suspensión para pulverización nasal una vez al día. Un ensayo de 6 semanas de duración en el que se evaluó el efecto de la administración de 110 microgramos de furoato de fluticasona en suspensión para pulverización nasal una vez al día sobre la función suprarrenal en niños de 2 a 11 años, mostró que no se producía ningún efecto significativo en los niveles séricos de cortisol de 24 horas, en comparación con placebo. Un estudio clínico multicéntrico, aleatorizado, doble ciego de grupos paralelos, controlado con placebo de un año de duración sobre el crecimiento evaluó el efecto de 110 microgramos de furoato de fluticasona en suspensión para pulverización nasal una vez al día sobre la velocidad de crecimiento en 474 niños preadolescentes (niñas de 5 a 7,5 años de edad y niños de 5 a 8,5 años de edad) con estadimetría. La velocidad media de crecimiento durante las 52 semanas de tratamiento fue menor en los pacientes que recibieron furoato de fluticasona (5,19 cm/año) en comparación con placebo (5,46 cm/año). La diferencia media del tratamiento fue -0,27 cm por año [95% IC -0,48 a -0,06]. Rinitis alérgica estacional y perenne en niños (menores de 6 años): Los estudios de seguridad y eficacia fueron realizados en un total de 271 pacientes de entre 2 y 5 años tanto en ritinis alérgica estacional como perenne, de los cuales 176 fueron expuestos a furoato del fluticasona. La seguridad y eficacia en este grupo no ha sido bien establecida. 5.2 Propiedades farmacocinéticas Absorción: El furoato de fluticasona experimenta una absorción incompleta y un importante efecto de primer paso metabólico en el hígado y en el intestino, que tienen como resultado una exposición sistémica 7
7 insignificante. La administración intranasal de 110 microgramos una vez al día no suele dar lugar a concentraciones plasmáticas medibles (< 10 pg/ml). La biodisponibilidad absoluta de furoato de fluticasona administrado por vía intranasal es de 0,50 %, de modo que tras la administración de 110 microgramos, menos de 1 microgramo de furoato de fluticasona estaría disponible a nivel sistémico (ver sección 4.9). Distribución: La unión de furoato de fluticasona a proteínas plasmáticas es superior al 99 %. El furoato de fluticasona se distribuye ampliamente con un volumen de distribución medio en el estado estacionario de 608 l. Metabolismo: El furoato de fluticasona se elimina rápidamente de la circulación sistémica (aclaramiento plasmático total: 58,7 l/h), principalmente mediante metabolismo hepático por la isoenzima CYP3A4 del citocromo P450 dando lugar a un metabolito inactivo 17β-carboxílico (GW694301X). La principal ruta metabólica es la hidrólisis del grupo S-fluorometil carbotioato para dar lugar al metabolito ácido 17βcarboxílico. En los estudios in vivo no se ha observado la escisión del grupo furoato para formar fluticasona. Eliminación: La eliminación se produce principalmente por vía fecal tras la administración oral e intravenosa, lo que indica que furoato de fluticasona y sus metabolitos se excretan por vía biliar. Tras la administración intravenosa, la vida media de eliminación es 15,1 horas. La excreción urinaria tras la administración oral e intravenosa es de aproximadamente un 1 % y un 2 % de la dosis, respectivamente. Niños: En la mayoría de los pacientes, la concentración de furoato de fluticasona no es cuantificable (< 10 pg/ml) tras la administración intranasal de 110 microgramos una vez día. Se observaron niveles cuantificables en el 15,1 % de los pacientes pediátricos, tras la administración intranasal de 110 microgramos una vez día y sólo en un 6,8 % de los pacientes pediátricos tras la administración intranasal de 55 microgramos una vez día. No se observaron mayores niveles cuantificables de furoato de fluticasona en niños más pequeños (menores de 6 años de edad). La mediana de las concentraciones de furoato de fluticasona en sujetos con niveles cuantificables tras la administración de 55 microgramos fue 18,4 pg/ml y 18,9 pg/ml para 2-5 años y 6-11 años, respectivamente. Tras la administración de 110 microgramos, la mediana de las concentraciones en sujetos con niveles cuantificables fue 14,3 pg/ml y 14,4 pg/ml para 2-5 años y 6-11 años, respectivamente. Los valores son similares a los hallados en adultos (de más de 12 años) donde la mediana de las concentraciones en sujetos con niveles cuantificables fue 15,4 pg/ml y 21,8 pg/ml tras la administración de 55 microgramos y 110 microgramos, respectivamente. Pacientes de edad avanzada: Sólo de un pequeño número de pacientes de edad avanzada, ( 65 años, n=23/872; 2,6 %) se pudieron obtener datos farmacocinéticos. No se observó mayor incidencia de pacientes con concentraciones cuantificables de furoato de fluticasona entre las personas mayores en comparación con los pacientes más jóvenes. Insuficiencia renal: El furoato de fluticasona no es detectable en la orina de voluntarios sanos después de la administración intranasal. Menos del 1 % de la dosis se excreta por la orina y por lo tanto no se espera que la insuficiencia renal pueda afectar a la farmacocinética del furoato de fluticasona. Insuficiencia hepática: No existen datos relativos a la administración de furoato de fluticasona intranasal en pacientes con insuficiencia hepática. En un ensayo en el que se administró una sola dosis de 400 microgramos de furoato de fluticasona por vía oral inhalatoria a pacientes con insuficiencia hepática moderada se observó un incremento de la Cmax (42 %) y del AUC (0- ) (172 %) y una leve disminución en los niveles de cortisol (un 23 % de media) en pacientes en comparación con sujetos sanos. Teniendo en cuenta los resultados de 8
8 este ensayo no cabe esperar que se produzca una reducción en los niveles de cortisol en pacientes con insuficiencia hepática moderada tras la exposición a una media prevista de 110 microgramos de furoato de fluticasona intranasal. Por lo tanto no es previsible que la insuficiencia hepática moderada produzca un efecto clínicamente relevante tras la administración de la dosis habitual en adultos. No hay datos en pacientes con insuficiencia hepática grave. Es probable que la exposición a furoato de fluticasona se vea aumentada en dichos pacientes. 5.3 Datos preclínicos sobre seguridad Las conclusiones de los estudios generales de toxicología fueron semejantes a las observadas con otros glucocorticoides y se asocian con una actividad farmacológica exagerada. No es probable que estas conclusiones sean extrapolables a humanos, para las dosis nasales recomendadas, ya que la exposición sistémica esperada es mínima. No se ha observado ningún efecto genotóxico de furoato de fluticasona en las pruebas convencionales de genotoxicidad. Además, no se produjo un aumento en la incidencia de tumores relacionados con el tratamiento en estudios de inhalación de dos años de duración en ratas y ratones. 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes Glucosa anhidra Celulosa dispersable Polisorbato 80 Cloruro de benzalconio Edetato de disodio Agua purificada 6.2 Incompatibilidades No procede. 6.3 Periodo de validez 3 años. Tras la apertura: 2 meses. 6.4 Precauciones especiales de conservación No refrigerar o congelar. 6.5 Naturaleza y contenido del envase El dispositivo de Avamys suspensión para pulverización nasal es de plástico predominantemente blanquecino, con una ventana que permite ver el contenido del frasco. El botón dosificador lateral y la tapa protectora son de color azul claro. La cubierta de plástico contiene la suspensión para pulverización nasal dentro de un frasco de vidrio Tipo I de color ámbar, dotado con una bomba pulverizadora. El medicamento está disponible en tres tamaños de envase: 30, 60 y 120 pulverizaciones. Puede que solamente estén comercializados algunos tamaños de envases. 9
9 6.6 Precauciones especiales de eliminación y otras manipulaciones Ninguna especial para su eliminación. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Glaxo Group Ltd Greenford, Middlesex, UB6 0NN Reino Unido 8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN EU/1/07/434/001 EU/1/07/434/002 EU/1/07/434/ FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN 11/01/ FECHA DE LA REVISIÓN DEL TEXTO {Mes/año} La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos : 10
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Avamys 27,5 microgramos/pulverización, suspensión para pulverización nasal. 2. COMPOSICIÓN CUALITATIVA Y
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Avamys 27,5 microgramos/pulverización, suspensión para pulverización nasal. 2. COMPOSICIÓN CUALITATIVA Y
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
FICHA TÉCNICA. Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125 g Lisozima hidrocloruro...0,100 g Neomicina (sulfato)...
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH)
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH) 1 / 5 1. NOMBRE DEL MEDICAMENTO Lycopodium 12DH, glóbulos 2. COMPOSICIÓN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH) 1 / 5 1. NOMBRE DEL MEDICAMENTO Lycopodium 12DH, glóbulos 2. COMPOSICIÓN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Para consultar la lista completa de excipientes, ver sección 6.1.
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Desloratadina Kern Pharma 0,5 mg/ml solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Desloratadina Kern Pharma 0,5 mg/ml solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución
FICHA TÉCNICA. Se deberá respetar la dosis diaria recomendada independientemente de la extensión de la alopecia.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA Regaxidil 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA Regaxidil 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
FICHA TÉCNICA. Glucosamina Teva 1.500 mg polvo para solución oral EFG
 1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Avamys 27,5 microgramos/pulverización, suspensión para pulverización nasal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Avamys 27,5 microgramos/pulverización, suspensión para pulverización nasal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Plasimine está indicado para el tratamiento de las siguientes infecciones cutáneas causadas por microorganismos sensibles (ver sección 5.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Plasimine 20 mg/g pomada 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene; Mupirocina
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Plasimine 20 mg/g pomada 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene; Mupirocina
Equino: Alivio de la inflamación y el dolor en trastornos músculo-esqueléticos agudos y crónicos. Alivio del dolor asociado al cólico equino.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 0 1. NOMBRE DEL MEDICAMENTO VIRGAN 1,5 mg/g gel oftálmico 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 1g de gel contiene 1,5 mg de ganciclovir
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 0 1. NOMBRE DEL MEDICAMENTO VIRGAN 1,5 mg/g gel oftálmico 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 1g de gel contiene 1,5 mg de ganciclovir
FICHA TÉCNICA. Se deberá respetar la dosis diaria recomendada independientemente de la extensión de la alopecia.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA ALOXIDIL 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA ALOXIDIL 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA. 2. ANTES DE USAR Minoxidil Viñas 5% solución cutánea
 1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA Minoxidil Viñas 5% es una solución para uso cutáneo. La solución es transparente, incolora o muy débilmente amarillenta. Se presenta
1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA Minoxidil Viñas 5% es una solución para uso cutáneo. La solución es transparente, incolora o muy débilmente amarillenta. Se presenta
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
PROSPECTO: INFORMACIÓN PARA EL USUARIO Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada mililitro contiene 50 mg de carbocisteína. Para consultar la lista completa de excipientes,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada mililitro contiene 50 mg de carbocisteína. Para consultar la lista completa de excipientes,
Cada sobre de MOVICOL Pediátrico contiene los siguientes principios activos:
 agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO MOVICOL Pediátrico 6,9 g sobre, polvo para solución oral. 2. COMPOSICIÓN
agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO MOVICOL Pediátrico 6,9 g sobre, polvo para solución oral. 2. COMPOSICIÓN
FICHA TECNICA. Alivio local de los síntomas ocasionados por el herpes labial, tales como: picor, escozor u hormigueo.
 agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FormulaExpec 13,33 mg/ml jarabe sabor miel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Principio
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FormulaExpec 13,33 mg/ml jarabe sabor miel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Principio
FICHA TECNICA. Adultos y niños: Aplicar cinco veces al día aproximadamente cada cuatro horas omitiendo la aplicación de la noche.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
FICHA TÉCNICA. Carbocisteína 50 mg
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO cinfamucol carbocisteína 50 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Carbocisteína 50 mg Excipientes: maltitol líquido (E-965):
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO cinfamucol carbocisteína 50 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Carbocisteína 50 mg Excipientes: maltitol líquido (E-965):
Gel/Crema para uso cutáneo Gel homogéneo incoloro o de color amarillo pálido o ligeramente marrón. Crema blanca, brillante.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ROZEX 7,5 mg/g Gel tópico ROZEX 7,5 mg/g Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 gramo de gel/crema contiene 7,5 mg de metronidazol Para consultar la lista
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ROZEX 7,5 mg/g Gel tópico ROZEX 7,5 mg/g Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 gramo de gel/crema contiene 7,5 mg de metronidazol Para consultar la lista
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. 20 g/100 ml
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: CLORURO DE SODIO 20 % Forma farmacéutica: Solución concentrada para infusión IV Fortaleza: Presentación: Titular del Registro Sanitario,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: CLORURO DE SODIO 20 % Forma farmacéutica: Solución concentrada para infusión IV Fortaleza: Presentación: Titular del Registro Sanitario,
Lactofilus polvo oral
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Lactofilus polvo oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante,
PROSPECTO: INFORMACIÓN PARA EL USUARIO Lactofilus polvo oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante,
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ciclopirox olamina ISDIN 15 mg/g champú 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de champú contiene 15
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ciclopirox olamina ISDIN 15 mg/g champú 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de champú contiene 15
Se recomienda beber un vaso de agua después de cada dosis y abundante líquido durante el día.
 agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
FICHA TÉCNICA. Fluticasona Teva 50 microgramos suspensión para pulverización nasal
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fluticasona Teva 50 microgramos suspensión para pulverización nasal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Descripción general Fluticasona Teva 50 microgramos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fluticasona Teva 50 microgramos suspensión para pulverización nasal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Descripción general Fluticasona Teva 50 microgramos
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS LACTOVAC C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (5 ml): Sustancia/s activa/s Rotavirus bovino
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS LACTOVAC C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (5 ml): Sustancia/s activa/s Rotavirus bovino
Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos
 Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
4.2 Posología y forma de administración
 1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
Virus de la bronquitis infecciosa aviar (IBV) cepa variante 4-91 vivo atenuado: 3,6 log10 EID50 *.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
FICHA TÉCNICA. Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
FICHA TÉCNICA. Líquido oral. Líquido oleoso homogéneo, transparente, de color amarillo pálido
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO Ordelax 756,6 mg/ml líquido oral 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de líquido oral contiene: Parafina líquida...756,6 mg. Para consultar la lista
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO Ordelax 756,6 mg/ml líquido oral 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de líquido oral contiene: Parafina líquida...756,6 mg. Para consultar la lista
Indicaciones Asma bronquial, en pacientes que previamente no hayan respondido a terapia con broncodilatadores y/o antialérgicos.
 1 Pulmicort 0,5 mg/ml suspensión para nebulización budesonida Suspensión para nebulización Composición Cada dosis unitaria (2 ml) contiene: budesonida 1 mg. Excipientes: edetato de disodio, cloruro de
1 Pulmicort 0,5 mg/ml suspensión para nebulización budesonida Suspensión para nebulización Composición Cada dosis unitaria (2 ml) contiene: budesonida 1 mg. Excipientes: edetato de disodio, cloruro de
FICHA TÉCNICA. Las personas con infección sintomática o asintomática por VIH, deben ser vacunadas lo antes posible, una vez confirmado el diagnóstico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
Prospecto: información para el usuario. Utabon Niños 0,25 mg/ml gotas nasales en solución Oximetazolina hidrocloruro
 Prospecto: información para el usuario Utabon Niños 0,25 mg/ml gotas nasales en solución Oximetazolina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Utabon Niños 0,25 mg/ml gotas nasales en solución Oximetazolina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A AMEFIN
 INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. NOMBRE COMERCIAL: 2. NOMBRE GENÉRICO: 3. FORMA FARMACÉUTICA Y FORMULACIÓN: Tabletas Cada tableta contiene: Excipiente cbp 100 mg y 300 mg 1 tableta 4. INDICACIONES
INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. NOMBRE COMERCIAL: 2. NOMBRE GENÉRICO: 3. FORMA FARMACÉUTICA Y FORMULACIÓN: Tabletas Cada tableta contiene: Excipiente cbp 100 mg y 300 mg 1 tableta 4. INDICACIONES
1. NOMBRE DEL MEDICAMENTO. FAMOTIDINA MABO 20 mg COMPRIMIDOS EFG FAMOTIDINA MABO 40 mg COMPRIMIDOS EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO FAMOTIDINA MABO 20 mg COMPRIMIDOS EFG FAMOTIDINA MABO 40 mg COMPRIMIDOS EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de FAMOTIDINA MABO 20 mg COMPRIMIDOS contiene
1. NOMBRE DEL MEDICAMENTO FAMOTIDINA MABO 20 mg COMPRIMIDOS EFG FAMOTIDINA MABO 40 mg COMPRIMIDOS EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de FAMOTIDINA MABO 20 mg COMPRIMIDOS contiene
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. Denominación del medicamento ESTRUMATE 2. Composición cualitativa y cuantitativa Cloprostenol (sódico)...0,0250 g (principio activo)* Ácido cítrico anhidro...0,056
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. Denominación del medicamento ESTRUMATE 2. Composición cualitativa y cuantitativa Cloprostenol (sódico)...0,0250 g (principio activo)* Ácido cítrico anhidro...0,056
Prospecto: información para el usuario. Benzac 100 mg/g gel Peróxido de benzoilo
 Prospecto: información para el usuario Benzac 100 mg/g gel Peróxido de benzoilo Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para
Prospecto: información para el usuario Benzac 100 mg/g gel Peróxido de benzoilo Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para
Anexo II. Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA
 Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
Este medicamento debe ser usado exclusivamente bajo prescripción y vigilancia médica y no puede repetirse sin nueva receta médica.
 DORMID 15mg/3ml MIDAZOLAM5mg/ml Solucióninyectable IndustriaHolandesa Ventabajorecetaarchivada Estemedicamentodebeserusadoexclusivamentebajoprescripciónyvigilanciamédicaynopuederepetirsesin nuevarecetamédica.
DORMID 15mg/3ml MIDAZOLAM5mg/ml Solucióninyectable IndustriaHolandesa Ventabajorecetaarchivada Estemedicamentodebeserusadoexclusivamentebajoprescripciónyvigilanciamédicaynopuederepetirsesin nuevarecetamédica.
FICHA TÉCNICA. Solución estéril inyectable por vía intramuscular (preferiblemente) o subcutánea. Pneumo 23 es un líquido transparente e incoloro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Zelaika 150 mg/g gel. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Zelaika 150 mg/g gel. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 g de Zelaika gel contiene 150 mg de ácido azelaico Excipientes con efecto conocido: 1 mg ácido
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Zelaika 150 mg/g gel. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 g de Zelaika gel contiene 150 mg de ácido azelaico Excipientes con efecto conocido: 1 mg ácido
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO. EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml (que equivale aproximadamente a 25 gotas) contiene como principio activo: Picosulfato
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml (que equivale aproximadamente a 25 gotas) contiene como principio activo: Picosulfato
Prospecto: información para el usuario. Sorbenor 1g solución oral Aspartato de Arginina
 Prospecto: información para el usuario Sorbenor 1g solución oral Aspartato de Arginina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
Prospecto: información para el usuario Sorbenor 1g solución oral Aspartato de Arginina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
SINALERG Levocetirizina 2.5 mg / 5 ml Jarabe
 SINALERG Levocetirizina 2.5 mg / 5 ml Jarabe SINALERG (LEVOCETIRIZINA 2.5 mg/5 ml) Jarabe Antihistamínico COMPOSICIÓN Cada 100 ml contiene: Levocetirizina diclorhidrato... 0.05 g Excipientes c.s.p. INDICACIONES
SINALERG Levocetirizina 2.5 mg / 5 ml Jarabe SINALERG (LEVOCETIRIZINA 2.5 mg/5 ml) Jarabe Antihistamínico COMPOSICIÓN Cada 100 ml contiene: Levocetirizina diclorhidrato... 0.05 g Excipientes c.s.p. INDICACIONES
FICHA TÉCNICA. Cantidad: Los ingredientes activos en 1 ml de VITALIPID INFANTIL corresponden a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VITALIPID INFANTIL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de VITALIPID INFANTIL contiene: Principios activos: Retinolpalmitato (equivalente a Retinol 69
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VITALIPID INFANTIL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de VITALIPID INFANTIL contiene: Principios activos: Retinolpalmitato (equivalente a Retinol 69
Prospecto: información para el usuario. Cebión 500 mg granulado para solución oral. Ácido ascórbico (Vitamina C)
 Prospecto: información para el usuario Cebión 500 mg granulado para solución oral Ácido ascórbico (Vitamina C) Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el usuario Cebión 500 mg granulado para solución oral Ácido ascórbico (Vitamina C) Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
FICHA TÉCNICA. DOVIDA 30 mg cápsulas blandas: Cada cápsula blanda contiene 30 mg de sulodexida, equivalente en actividad in vitro a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DOVIDA 30 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA DOVIDA 30 mg cápsulas blandas: Cada cápsula blanda contiene 30 mg de sulodexida, equivalente
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DOVIDA 30 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA DOVIDA 30 mg cápsulas blandas: Cada cápsula blanda contiene 30 mg de sulodexida, equivalente
1. RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 1. RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO APIGUARD gel (25% timol) 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Timol
1. RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO APIGUARD gel (25% timol) 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Timol
FICHA TECNICA 1. DENOMINACIÓN DEL MEDICAMENTO
 agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. DENOMINACIÓN DEL MEDICAMENTO PULMICORT TURBUHALER 100 microgramos polvo para inhalación PULMICORT TURBUHALER 200 microgramos polvo
agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. DENOMINACIÓN DEL MEDICAMENTO PULMICORT TURBUHALER 100 microgramos polvo para inhalación PULMICORT TURBUHALER 200 microgramos polvo
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
Repafet. Rupatadina Tabletas. Rupatadina II.- DENOMINACIÓN GENÉRICA: III.- FORMA FARMACÉUTICA Y FORMULACIÓN:
 Repafet Rupatadina Tabletas II.- DENOMINACIÓN GENÉRICA: Rupatadina III.- FORMA FARMACÉUTICA Y FORMULACIÓN: Cada tableta contiene: Fumarato de Rupatadina equivalente a... 10 mg de Rupatadina Excipiente
Repafet Rupatadina Tabletas II.- DENOMINACIÓN GENÉRICA: Rupatadina III.- FORMA FARMACÉUTICA Y FORMULACIÓN: Cada tableta contiene: Fumarato de Rupatadina equivalente a... 10 mg de Rupatadina Excipiente
Cada gramo de pomada contiene 1 mg de furoato de mometasona y 50 mg de ácido salicílico.
 1. NOMBRE DEL MEDICAMENTO Elocom Plus 1 mg/g + 50 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 1 mg de furoato de mometasona y 50 mg de ácido salicílico. Excipiente(s)
1. NOMBRE DEL MEDICAMENTO Elocom Plus 1 mg/g + 50 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 1 mg de furoato de mometasona y 50 mg de ácido salicílico. Excipiente(s)
Prospecto: información para el usuario. INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína
 Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
La osmolaridad calculada de la solución es de 832 mosm/l y el ph de 3,5-5,5. El aporte teórico de calorías es de 600 kcal/l.
 1. NOMBRE DEL MEDICAMENTO Glucosada Grifols al 15% Solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml de solución contienen: Glucosa (D.C.I.) (como monohidrato), 15 g La osmolaridad
1. NOMBRE DEL MEDICAMENTO Glucosada Grifols al 15% Solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml de solución contienen: Glucosa (D.C.I.) (como monohidrato), 15 g La osmolaridad
OPTISPRING 0,5 mg/ml colirio en solución en envases unidosis
 1. NOMBRE DEL MEDICAMENTO OPTISPRING 0,5 mg/ml colirio en solución en envases unidosis 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada envase de 0,5 ml de colirio en solución contiene: Tetrizolina hidrocloruro.250
1. NOMBRE DEL MEDICAMENTO OPTISPRING 0,5 mg/ml colirio en solución en envases unidosis 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada envase de 0,5 ml de colirio en solución contiene: Tetrizolina hidrocloruro.250
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. 2.2. Composición cualitativa y cuantitativa
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Dymista 137 microgramos/50 microgramos /aplicación, suspensión para pulverización nasal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.2. Composición cualitativa y
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Dymista 137 microgramos/50 microgramos /aplicación, suspensión para pulverización nasal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.2. Composición cualitativa y
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RABDOMUN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cantidad por dosis (1
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RABDOMUN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cantidad por dosis (1
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
Champú Champú líquido viscoso, traslúcido, de incoloro a amarillo pálido, con olor a alcohol.
 agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO Clobex 500 microgramos/g champú 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de champú contiene 500 microgramos
agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO Clobex 500 microgramos/g champú 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de champú contiene 500 microgramos
Cada comprimido de Pramipexol Actavis 0,18 mg contiene 0,18 mg de pramipexol base (como 0,25 mg de dihidrocloruro de pramipexol monohidrato).
 1. NOMBRE DEL MEDICAMENTO Pramipexol Actavis 0,18 mg comprimidos EFG Pramipexol Actavis 0,7 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Pramipexol Actavis 0,18 mg contiene
1. NOMBRE DEL MEDICAMENTO Pramipexol Actavis 0,18 mg comprimidos EFG Pramipexol Actavis 0,7 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Pramipexol Actavis 0,18 mg contiene
FICHA TÉCNICA. STREPSILS pastillas para chupar sabor miel y limón
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor miel y limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor miel y limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
MUNTEL 5 mg comprimidos recubiertos con película Levocetirizina dihidrocloruro
 Prospecto: Información para el paciente MUNTEL 5 mg comprimidos recubiertos con película Levocetirizina dihidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque
Prospecto: Información para el paciente MUNTEL 5 mg comprimidos recubiertos con película Levocetirizina dihidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FOSFOEVAC 10,8g / 24,4g solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada frasco contiene: Fosfato disódico
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FOSFOEVAC 10,8g / 24,4g solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada frasco contiene: Fosfato disódico
FICHA TÉCNICA. Seretide Inhalador 25/50 microgramos/dosis de suspensión para inhalación en envase a presión.
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO Seretide Inhalador 25/50 microgramos/dosis de suspensión para inhalación en envase a presión. Seretide Inhalador 25/125 microgramos/dosis de suspensión para
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO Seretide Inhalador 25/50 microgramos/dosis de suspensión para inhalación en envase a presión. Seretide Inhalador 25/125 microgramos/dosis de suspensión para
La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares.
 Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
Hipersensibilidad al nedocromil sódico o a alguno de los excipientes.
 1. DENOMINACIÓN DEL MEDICAMENTO Tilad 2 mg suspensión para inhalación en envase a presión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Nedocromil sódico. Cada envase contiene 1,4085 % p/p de nedocromil sódico
1. DENOMINACIÓN DEL MEDICAMENTO Tilad 2 mg suspensión para inhalación en envase a presión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Nedocromil sódico. Cada envase contiene 1,4085 % p/p de nedocromil sódico
Avamys 27,5 microgramos/pulverización, suspensión para pulverización nasal. Cada pulverización libera 27,5 microgramos de furoato de fluticasona.
 1. NOMBRE DEL MEDICAMENTO Avamys 27,5 microgramos/pulverización, suspensión para pulverización nasal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada pulverización libera 27,5 microgramos de furoato de fluticasona.
1. NOMBRE DEL MEDICAMENTO Avamys 27,5 microgramos/pulverización, suspensión para pulverización nasal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada pulverización libera 27,5 microgramos de furoato de fluticasona.
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. DURAMUNE CACHORROS DP + C Liofilizado y disolvente para suspensión inyectable para perros
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
Cetirizina NORMON 10 mg comprimidos recubiertos con película EFG. Un comprimido recubierto con película contiene 10 mg de cetirizina dihidrocloruro.
 1. NOMBRE DEL MEDICAMENTO Cetirizina NORMON 10 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto con película contiene 10 mg de cetirizina dihidrocloruro.
1. NOMBRE DEL MEDICAMENTO Cetirizina NORMON 10 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto con película contiene 10 mg de cetirizina dihidrocloruro.
FICHA TÉCNICA. Pastillas circulares de color rosa con sabor a fresa y el icono de Strepsils grabado en ambos lados.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor fresa 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor fresa 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
en tratamiento con Toctino ... Nombre de la paciente (alitretinoína) Para el médico Soluciones pensando en ti
 (alitretinoína) Tarjeta Restaura de seguimiento desde el interiorde la Paciente en con Toctino... Nombre de la paciente Para el médico Soluciones pensando en ti www.almirall.es www.solucionesalmirall.com
(alitretinoína) Tarjeta Restaura de seguimiento desde el interiorde la Paciente en con Toctino... Nombre de la paciente Para el médico Soluciones pensando en ti www.almirall.es www.solucionesalmirall.com
Anexo II. Conclusiones científicas y motivos para la denegación presentados por la Agencia Europea de Medicamentos
 Anexo II Conclusiones científicas y motivos para la denegación presentados por la Agencia Europea de Medicamentos 5 Conclusiones científicas Resumen general de la evaluación científica de Etinilestradiol-Drospirenona
Anexo II Conclusiones científicas y motivos para la denegación presentados por la Agencia Europea de Medicamentos 5 Conclusiones científicas Resumen general de la evaluación científica de Etinilestradiol-Drospirenona
6. Tratamiento de la dependencia tabáquica en pacientes fumadores con diagnóstico de EPOC
 6. Tratamiento de la dependencia tabáquica en pacientes fumadores con diagnóstico de EPOC La dependencia tabáquica presenta determinadas características, que pueden hacer que se considere una enfermedad
6. Tratamiento de la dependencia tabáquica en pacientes fumadores con diagnóstico de EPOC La dependencia tabáquica presenta determinadas características, que pueden hacer que se considere una enfermedad
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. PRID DELTA 1,55 g SISTEMA DE LIBERACIÓN VAGINAL PARA BOVINO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PRID DELTA 1,55 g SISTEMA DE LIBERACIÓN VAGINAL PARA BOVINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sistema
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PRID DELTA 1,55 g SISTEMA DE LIBERACIÓN VAGINAL PARA BOVINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sistema
Prospecto: información para el usuario. Flixonase 50 microgramos/pulverización, suspensión para pulverización nasal Propionato de fluticasona
 Prospecto: información para el usuario Flixonase 50 microgramos/pulverización, suspensión para pulverización nasal Propionato de fluticasona Lea todo el prospecto detenidamente antes de empezar a usar
Prospecto: información para el usuario Flixonase 50 microgramos/pulverización, suspensión para pulverización nasal Propionato de fluticasona Lea todo el prospecto detenidamente antes de empezar a usar
Prospecto: Información para el usuario
 Prospecto: Información para el usuario Gaviscon suspensión oral sabor menta Alginato de sodio, bicarbonato (hidrógenocarbonato) de sodio y carbonato de calcio Lea todo el prospecto detenidamente antes
Prospecto: Información para el usuario Gaviscon suspensión oral sabor menta Alginato de sodio, bicarbonato (hidrógenocarbonato) de sodio y carbonato de calcio Lea todo el prospecto detenidamente antes
GLUCEMIX VILDAGLIPTINA / METFORMINA Comprimidos recubiertos
 GLUCEMIX VILDAGLIPTINA / METFORMINA Comprimidos recubiertos Industria Alemana EXPENDIO BAJO RECETA Nota importante: Antes de recetar este medicamento, consulte toda la información relativa a su prescripción.
GLUCEMIX VILDAGLIPTINA / METFORMINA Comprimidos recubiertos Industria Alemana EXPENDIO BAJO RECETA Nota importante: Antes de recetar este medicamento, consulte toda la información relativa a su prescripción.
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Para Daivobet pomada
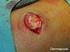 agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Para Daivobet pomada 1. DENOMINACIÓN DEL MEDICAMENTO Daivobet 50 microgramos/g + 0,5 mg/g pomada 2. COMPOSICIÓN
agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Para Daivobet pomada 1. DENOMINACIÓN DEL MEDICAMENTO Daivobet 50 microgramos/g + 0,5 mg/g pomada 2. COMPOSICIÓN
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO. 25 μg
 agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
VARICELA INTRODUCCIÓN INDICACIONES
 VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias
1. NOMBRE DE MEDICAMENTO ZENAVAN SPRAY 100 mg/ml solución para pulverizador cutáneo.
 1. NOMBRE DE MEDICAMENTO ZENAVAN SPRAY 100 mg/ml solución para pulverizador cutáneo. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución contiene etofenamato (D.O.E.) 100 mg. Para excipientes,
1. NOMBRE DE MEDICAMENTO ZENAVAN SPRAY 100 mg/ml solución para pulverizador cutáneo. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución contiene etofenamato (D.O.E.) 100 mg. Para excipientes,
AGENCIA NACIONAL DE MEDICAMENTOS INSTRUCTIVO SOBRE CONTENIDOS Y FORMATO DE FOLLETO DE INFORMACIÓN AL PACIENTE
 AGENCIA NACIONAL DE MEDICAMENTOS INSTRUCTIVO SOBRE CONTENIDOS Y FORMATO DE FOLLETO DE INFORMACIÓN AL PACIENTE 1.-ASPECTOS LEGALES El folleto de información al paciente debe cumplir con lo señalado en los
AGENCIA NACIONAL DE MEDICAMENTOS INSTRUCTIVO SOBRE CONTENIDOS Y FORMATO DE FOLLETO DE INFORMACIÓN AL PACIENTE 1.-ASPECTOS LEGALES El folleto de información al paciente debe cumplir con lo señalado en los
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. SPASMOBRONCHAL 0,03 mg/ml SOLUCIÓN INYECTABLE PARA EQUINO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SPASMOBRONCHAL 0,03 mg/ml SOLUCIÓN INYECTABLE PARA EQUINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SPASMOBRONCHAL 0,03 mg/ml SOLUCIÓN INYECTABLE PARA EQUINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
Virus de la bronquitis infecciosa aviar (IBV) cepa variante 4-91 vivo atenuado: 3,6 log10 EID50 *.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
Calf Notes.com Anotación sobre terneros nº 77 Métodos de suministro de agua
 Calf Notes.com Anotación sobre terneros nº 77 Métodos de suministro de agua Introducción. El agua es un factor muy importante para el adecuado desarrollo del rumen y para el correcto crecimiento de los
Calf Notes.com Anotación sobre terneros nº 77 Métodos de suministro de agua Introducción. El agua es un factor muy importante para el adecuado desarrollo del rumen y para el correcto crecimiento de los
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO. GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Cada cápsula dura contiene:
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene: Diacereína,
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene: Diacereína,
Prospecto: información par el usuario. SEBUMSELEN champú Sulfuro de selenio / Benzalconio cloruro
 Prospecto: información par el usuario SEBUMSELEN champú Sulfuro de selenio / Benzalconio cloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Prospecto: información par el usuario SEBUMSELEN champú Sulfuro de selenio / Benzalconio cloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
FICHA TÉCNICA O RESUMEN DE LAS CARCTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARCTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Clovate 0,5 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene 0,5 miligramos de propionato
FICHA TÉCNICA O RESUMEN DE LAS CARCTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Clovate 0,5 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene 0,5 miligramos de propionato
1. NOMBRE DEL MEDICAMENTO. ALOPEXY 50 mg/ml solución cutánea. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO ALOPEXY 50 mg/ml solución cutánea. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución contiene 50 mg de minoxidil. Excipiente con efecto conocido: 500 mg/ml de propilenglicol.
1. NOMBRE DEL MEDICAMENTO ALOPEXY 50 mg/ml solución cutánea. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución contiene 50 mg de minoxidil. Excipiente con efecto conocido: 500 mg/ml de propilenglicol.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. PRODELION 25-50 microgramos comprimidos. PRODELION 150 microgramos comprimidos
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRODELION 25-50 microgramos comprimidos PRODELION 75 microgramos comprimidos PRODELION 150 microgramos comprimidos
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRODELION 25-50 microgramos comprimidos PRODELION 75 microgramos comprimidos PRODELION 150 microgramos comprimidos
Prospecto: Información para el usuario. Levelina 10 mg/g crema Bifonazol
 Prospecto: Información para el usuario Levelina 10 mg/g crema Bifonazol Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
Prospecto: Información para el usuario Levelina 10 mg/g crema Bifonazol Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
FICHA TECNICA. Tratamiento sintomático de la rinoconjuntivitis alérgica (estacional y perenne) y de la urticaria.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Bilaxten 20 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 20 mg de bilastina. Para consultar la lista completa de excipientes
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Bilaxten 20 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 20 mg de bilastina. Para consultar la lista completa de excipientes
Se coloca dentro del útero para ofrecer protección anticonceptiva y tiene unos hilos guía para su localización y extracción.
 Qué es el DIU? El DIU (Dispositivo Intrauterino) es un objeto pequeño de plástico (polietileno) flexible que mide 4 cm aproximadamente. Existen varios tipos de DIU, los más comunes son: Los que contienen
Qué es el DIU? El DIU (Dispositivo Intrauterino) es un objeto pequeño de plástico (polietileno) flexible que mide 4 cm aproximadamente. Existen varios tipos de DIU, los más comunes son: Los que contienen
Agencia Española de Medicamentos y Productos Sanitarios AEMPS TRIMETAZIDINA (IDAPTAN, TRIMETAZIDINA EFG): RESTRICCIÓN DE INDICACIONES
 Nota informativa Productos Sanitarios AEMPS TRIMETAZIDINA (IDAPTAN, TRIMETAZIDINA EFG): RESTRICCIÓN DE INDICACIONES Fecha de publicación: 25 de junio de 2012 Categoría: MEDICAMENTOS USO HUMANO, SEGURIDAD.
Nota informativa Productos Sanitarios AEMPS TRIMETAZIDINA (IDAPTAN, TRIMETAZIDINA EFG): RESTRICCIÓN DE INDICACIONES Fecha de publicación: 25 de junio de 2012 Categoría: MEDICAMENTOS USO HUMANO, SEGURIDAD.
Tratamiento farmacológico de los trastornos mentales en la atención primaria de salud. Organización Mundial de la Salud
 Tratamiento farmacológico de los trastornos mentales en la atención primaria de salud Organización Mundial de la Salud Capítulo 1 Medicamentos esenciales para los trastornos mentales 1 1.1 El Informe sobre
Tratamiento farmacológico de los trastornos mentales en la atención primaria de salud Organización Mundial de la Salud Capítulo 1 Medicamentos esenciales para los trastornos mentales 1 1.1 El Informe sobre
1. DENOMINACIÓN DEL MEDICAMENTO BUDESONIDA ALDO-UNION 0,5 mg/ml suspensión para inhalación por nebulizador
 agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO BUDESONIDA ALDO-UNION 0,5 mg/ml suspensión para inhalación por nebulizador
agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO BUDESONIDA ALDO-UNION 0,5 mg/ml suspensión para inhalación por nebulizador
