Síntesis y Caracterización Estructural de los Materiales Ángel Carmelo Prieto Colorado
|
|
|
- Manuel Alvarado Miguélez
- hace 7 años
- Vistas:
Transcripción
1 Síntesis y Caracterización Estructural de los Materiales Ángel Carmelo Prieto Colorado Física de la Materia Condensada, Cristalografía y Mineralogía. Facultad de Ciencias. Universidad de Valladolid.
2 Estructura Estática y Dinámica de la Materia Tema 4 Materiales con estructuras de empaquetamiento: Metales, Aleaciones, Cristales iónicos, Cristales covalentes, Cristales moleculares Otros tipos de empaquetamiento: Empaquetamiento tetragonal Modelos poliédricos de empaquetamiento Estructuras típicas de empaquetamiento: NaCl, ZnS (esfalerita y wurzita), Na2O, NiAs, CsCl, y otras estructuras AX Estructuras tipo TiO2, CdI2, CdCl2 y Cs2O Espinelas y ferritas Estructura de los silicatos
3 Materiales con estructuras de empaquetamiento: Metales, Aleaciones, Cristales iónicos, Cristales covalentes, Cristales moleculares
4 Metales La mayoría de los metales cristalizan en estructura, ccp (F) y hcp (H). También cristalizan en una celda cúbica centrada en el interior, bcc (I), que estrictamente no es fruto de empaquetamiento compacto. Su distribución en estas estructuras es irregular y no bien definida, solo se observan tendencias. Se dan claros ejemplos de polimorfismo. Metal Estructura Rango de T Co H < 477 F Sn F (diamante) < 13 I F H Fe I < 911 F I Ti H < 882 I Zr H < 862 I R < 663 I U I I
5 Aleaciones Son fases intermetálicas o soluciones sólidas y, como es el caso de los metales puros, muchos tienen estructuras de empaquetamiento denso. Por ejemplo, Cu y Au tienen estructuras ccp, ambos elementos puros y cuando se mezcla para formar Cu-Au aleaciones. A altas temperaturas, se forma una soluciones sólidas completa entre Cu y Au. Los átomos de Cu y Au se distribuyen estadísticamente en los nudos de la red en una celda unidad de F y por lo tanto las capas ccp contienen una mezcla aleatoria de átomos de Cu y Au. El recocido de las composiciones AuCu y AuCu3 a temperaturas más bajas, produce un ordenamiento de los átomos de Au y Cu: se forman capas ccp pero la disposición atómica no es estadística. Estos fenómenos orden-desorden ocurren comúnmente en estructuras metálicas y estructuras iónicas.
6 Cristales iónicos Las estructuras de materiales como NaCl, Al2O3, Na2O y ZnO, en la que el anión es más grande que el catión, se construyen con empaquetados densos de aniones con secuencias de apilamiento hcp ó ccp y con los cationes colocados en los huecos intersticiales. La gran variedad estructuras iónicas se genera considerando unicamente las ecuencia de apilamiento de las capas de aniones, hcp ó ccp y el número y tipo de posiciones intersticiales que van a ocupar los cationes. A veces, los cationes son demasiado grandes para los huecos intersticiales y la estructura sólo se puede adaptar a ellos mediante la ampliación de distancia entre los aniones. En consecuencia, la disposición del anión es similar a los empaquetados densos, pero con la salvedad de que los aniones no están en contacto. Es lo que se denomina estructura eutactica. Además, considerar la geometría de los átomos como esferas rígidas de radio iónico fijo y conocido, es una simplificación, a veces no realista.
7 Cristales iónicos. Posiciones Intersticiales O T+ T- octaédricas O, coordinadas por tres aniones en cada capa están situadas a la mitad de la distancia entre las capas. tetraédricas T+ y T-, constituidas por tres aniones que forman la base de un tetraedro y pertenecen a una capa de empaquetamiento denso y situando el ápice del tetraedro en la capa por encima o por abajo, respectivamente. Están situadas a 1/4 de la distancia entre las dos capas y el centro de gravedad más próximo a la base, por eso + y -. Por cada anión hay tres huecos, dos tetraédricos (1T+ y 1T-) y uno octaédrico (1O).
8 Empaquetamiento X - T+ T- O Ejemplo 1 NaCl 1 ZnS, blenda ccp (F) 1/8 1/8 1/2 MgAl2O4 (espinela) 1/2 CdCl2 1/3 CrCl3 1 1 K2O, antifluorita 1 NiAs 1 ZnS, wurtzita hcp (H) 1/2 CdI2 1/2 TiO2, rutilo 2/3 Al2O3, corindón 1/8 1/8 1/2 Mg2SiO4, olivino ccp capas de BaO3 1/4 BaTiO3, pervskita
9 Es raro que todos los huecos intersticiales están ocupados; a menudo están parcialmente ocupados, lo que genera diversidad de estructuras: NaCl y NiAs tienen cationes (Na + y Ni +3 )en coordinación O y sólo se diferencian en la secuencia de apilamiento de Cl - y As -3. Lo mismo sucede con las estructuras de olivino (Mg2SiO4) y espinela (MgAl2O4), wurtzita y blenda (ZnS), CdI2 y CdCl2. Rutilo, TiO2 y CdI2 ambos tienen los aniones con empaquetado hcp (las capas son dobles en el rutilo). Los cationes ocupan solo 1/2 de los huecos octaédricos, pero difieren en la forma de ocupación. En cada capa de rutilo, la mitad de los sitios octaédricos están ocupados por Ti, y en CdI2, alternan las capas con huecos octaédricos ocupados y vacíos. En algunas estructuras es útil considerar los cationes como formadores del empaquetamiento compacto, como es el caso de la fluorita CaF2, y antifluorita K2O, con estructuras inversas.
10 El concepto de empaquetamiento denso puede incluir aquellas estructuras en las que las capas de máximo empaquetamiento estén constituidas por aniones y grandes cationes, como es el caso de la perovskita, BaTiO3. En ella las capas ccp estan ocupadas por BaO3, y 1/4 de los huecos octaédricos están ocupados por Ti, solamente aquellos en los que los seis aniones de los vértices del octaedro pueden ser O 2-. En algunas estructuras, como es el caso del ReO3, que puede considerarse como de máximo empaquetamiento, en las que la mitad de las posiciones de los O, están vacantes. Es análogo al caso de la perovskita, en el que se sustituyen los sitios ocupados por Ti, por Re y los ocupados por Ba, quedan vacantes. La estructura de la β-alúmina, con una estequiometria de fórmula NaAl11O17, contiene capas de óxido con empaquetados del tipo cúbico ccp, en el que cada cinco capas, una tiene 3/4 partes de las posiciones ocupadas por los iones O 2- vacantes.
11 Cristales iónicos. Tamaño de las posiciones Intersticiales En general, los huecos tetraédricos son más pequeños que los octaédricos, y estos, más pequeños que los poliedros de coordinación. Por tanto, en los cristales iónicos, los cationes M ocupan los poliedros e incluso pueden ocupar sitios que, a primera vista, parecen demasiado pequeños, empujando a los aniones y generando fuerzas expansivas (como en las estructuras eutacticas). Por el contrario, los cationes no tienden a ocupar posiciones demasiado grandes, a menos que la estructura puede comprimirse, por torsión o distorsionar la capa de aniones para reducir el tamaño del sitio; como sucede en estructuras perovskiticas distorsionadas en la que dos cationes pequeños pueden ocupar posiciones con coordinación 12, provocando un efecto tipo sonajero. Una situación intermedia ocurre en estructuras en las que el sitio de M es demasiado grande. El catión puede entonces someterse a pequeños desplazamientos fuera del centro de gravedad dando lugar a polarizabilidad, permisividad y fenómenos de ferroelectricidad.
12 Cristales iónicos. Longitud de enlace en huecos T+, T- y O Los sitios octaédricos son fáciles de localizar: están en el centro de las aristas (1,2 y 3) y en el centro del cubo (4) Si la celda unidad tiene una longitud, a, A-O para los sitios octaédricos es a/2. Para ver T+, T-, es conveniente dividir la celda unidad en ocho cubos, según las líneas de trazos, de modo que contengan 1 anión en una esquina. El centro de cada minicubo es un hueco tetraédrico, T+, ó T-, que distan A-T: 9 T- T+ 1
13 Cristales covalentes El diamante C y carburo de silicio SiC, que tienen enlaces muy fuertes, direccionales, covalentes, pueden ser descritos como estructuras compactas o estructuras eutácticas; muchos tienen las mismas estructuras que los compuestos iónicos. Por lo tanto, un polimorfo de SiC con estructura tipo wurtzita, es indiferente que el Si o el C sea tenga el empaquetado denso, ya que el resultado neto tridimensional de la distribución de vértices tetraédricos, es el mismo. Estructura tipo diamante se considera a una estructura de esfalerita en el que la mitad de los átomos de carbono forman un entorno ccp y la otra mitad ocupan posiciones T+, pero de nuevo los dos tipos de átomo son equivalentes. Clasificar esta estructura como eutáctica es útil ya que todos los átomos de C son del mismo tamaño y resulta poco realista distinguir entre átomos del poliedro de empaquetamiento e intersticiales. Muchas estructuras tienen enlace iónico-covalente mixto, por ejemplo, ZnS y CrCl3; Una de las ventajas de describir a los cristales covalentes como estructuras compactas, es que no se precisa describir el tipo de enlace dominante entre los átomos de la celdilla.
14 Estructuras moleculares Una molécula puede definirse como un grupo de átomos unidos entre sí por fuertes enlaces primarios. En este contexto, las muestras sólidas con sólo enlaces iónicos y metálicos se pueden considerar como una molécula simple. Sin embargo, este concepto no es válido para las substancias en las cuales predomina el enlace covalente, como moléculas elementales diatónicas (F2, O2, H2, etc.) y un sin fin de compuestos (H2O, CO2, HNO3, C6H6, CH4, etc.). En los estados sólido y líquido condensado, los enlaces entre moléculas son secundarios débiles. Por consiguiente, los materiales moleculares tienen temperaturas de fusión y de ebullición relativamente bajas. Muchos de ellos, los que están constituidos por pequeñas moléculas de pocos átomos, son gases a T y P ambiental. Por otro lado, muchos de los modernos polímeros, materiales moleculares compuestos de moléculas extremadamente grandes, existen como sólidos; algunas de sus propiedades dependen fuertemente de la presencia de enlaces secundarios de van te Waals y enlaces por puente de hidrógeno.
15 Dado que los empaquetados densos proporcionan un medio eficiente de enlazar átomos, muchos de estos compuestos moleculares cristalizan en estas estructuras a pesar de que las fuerzas de unión entre moléculas adyacentes sean fuerzas débiles de van der Waals. Si la molécula es más o menos esférica o se vuelven esférica porque pueden girar o ocupar diferentes orientaciones al azar, sus formas moleculares cristalizan en estructuras hcp o ccp, como es el caso de H2, CH4 y HCl. También moléculas no esféricas, especialmente con estructura tetraédrica y octaédrica, pueden pueden cristalizar como empaquetados densos. Por ejemplo, Al2Br6 es un dímero con dos tetraedros AlBr4 que comparten una arista común. Br Al
16 En Al2Br6, el Br forma un empaquetado hcp y el Al ocupa 1/6 de los huecos tetraédricos disponibles. Los átomos de Al ocupan un par de huecos intersticiales adyacentes T+ y T-, y dos átomos (3 y 5) de Br son comunes a ambos tetraedros y son los átomos de que unen ambos tetraedros adyacentes. Las moléculas Al2Br6 están dispuestas de modo que cada Br de la red hcp pertenece a una sola molécula.
17 Formas moleculares del C: Grafeno, grafito, fullerenos y nanotubos. En el grafito los átomos de C forman anillos hexagonales regulares, que se unen entre sí dando lugar a láminas planas. Cada una de estas láminas se denomina grafeno, el cual goza de una propiedades estructurales excepcionales. Cada átomo de C tiene tres vecinos cercanos con los que comparte 2 e - con cada uno de ellos, dispuestos en ángulos de 120º. El cuarto e - de valencia de cada C se encuentra también enlazado, pero de forma más débil y no localizada, dando lugar a estructuras de enlaces resonantes. Son estos electrones deslocalizados los que permiten la conducción eléctrica a lo largo de una lámina, y los responsables del color negro, con brillo metálico, característico del grafito. Las distintas láminas se mantienen unidas entre sí por fuerzas de Van der Waals. Estas fuerzas de atracción son sólo ligeramente superiores a las fuerzas de cohesión de los líquidos, de lo que resulta que la distancia entre lámina y lámina sea más del doble de la distancia de enlace entre átomos de carbono en la misma lámina.
18 3 capas de grafito (C) Estructura del grafito (C) Plano (001) de grafito (C) Imagenes SEM y M. de Fuerza Átomica de grafeno (C)
19 Los fullerenos son un conjunto de formas alotrópicas del C, diferentes del diamante y del grafito. Fueron descubiertos por primera vez en 1985 por los investigadores R. Curl, H. Kroto y R. Smalley, aunque su existencia ya fue predicha en Son moléculas con formas esferoidales que contienen desde 32 C hasta 960 C. Son sólidos moleculares, muy estables, ya que no poseen enlaces libres. El arquetipo de estas moléculas es la denominada buckminsterfullereno, buckybola o futboleno, de fórmula C60.
20 Otras moléculas esferoidales (pero no esferas perfectas) son la C32, la C40, C50, C58 y C70 y los fullerenos gigantes, C240, C540 y C960. El futboleno y el C70 con 20 y 25 hexagonos, respectivamente tienen ambos 12 pentágonos.
21 La importancia de los fullerenos radica en las propiedades de los materiales macroscópicos a que pueden dar lugar. El futboleno cristaliza según en una red tipo ccp denominada fullerita. Las fulleritas puras son aislantes, pero impurificadas con átomos de metales alcalinos se comportan como semiconductores y hasta como superconductores. Un ejemplo lo constituye el K3C60, que puede obtenerse disponiendo las moléculas de C60 en las posiciones propias de una red ccp y situando los átomos de K en huecos intersticiales T+, T- y O. El K puede ser reemplazado por Rb o Ta, y en ambos casos, el material es superconductor, a muy bajas temperaturas.
22 Para construir fullerenos esferoides son necesarias combinaciones de pentágonos y hexágonos. Si se prescinde de los pentágonos, se obtienen también moléculas estables en forma de cilindros huecos que se denominan nanotubos de carbono.
23 Otros tipos de empaquetamiento: Empaquetamiento tetragonal A partir del empaquetamiento ccp puede surgir un empaquetamiento tetragonal centrado en el interior, con celdilla del tipo I.
24 Modelos poliédricos de empaquetamiento número configuración / poliedro Ranión / Rcatión material 12 1 Cu CaF2; CsCl NaCl SiO CO BeCl2 Poliedros de coordinación básicos
25 El construir las estructuras mediante poliedros es un enfoque descriptivo que hace hincapié en el número de coordinación de los cationes Las estructuras son construidas por poliedros, formados por los cationes con sus vecinos inmediatos aniónicos, que se enlazan compartiendo esquinas, bordes o caras. En el NaCl cada Na + tiene seis Cl - dispuestos octaédricamente; por tanto, se representa por un octaedro con Cl - en las esquinas y Na + en el centro. Una visión 3D permite ver como una arista es compartida por dos octaedros. Otras estructuras, tipo perovskita, SrTiO3, TiO6, presentan octaedros que comparten un vértice. Na + Cl - En este tipo de representación de estructuras compactas, los aniones, al ser de mayor radio, ocupan los vértices del poliedro y el relleno interior indica la ubicación de los cationes en los huecos intersticiales.
26 Existen muchos ejemplos de materiales que sus estructuras comparten vértices y/o aristas, de los poliedros estructurales, principalmente tetraedros y octaedros. Ello da lugar a una amplia diversidad de estructuras. Estructura Ejemplo 12 aristas compartidos NaCl 6 vértices compartidos ReO3 octaédrica 3 aristas compartidos CrCl3, BiI3 2 aristas y vértices 6 compartidos TiO2 4 vértices compartidos KAlF4 4 vértices compartidos (entre 4 tetraedros) ZnS tetraédrica 4 vértices compartidos (entre 2 tetraedros) SiO2 1 vértices compartido (entre 2 tetraedros) Si2O7 6-2 vértices compartido (entre 2 tetraedros) (SiO3)n 2n- filas y ciclos
27 Los poliedros puede ser tetraedros, octaedros, prismas trigonales, etc. y pueden compartir con poliedros adyacentes, alguno o todos sus vértices, aristas y caras. Los vértices y aristas pueden ser comunes a dos o más poliedros, pero obviamente sólo dos poliedros puede compartir una cara común. Un enorme número de estructuras son factibles, al menos teóricamente, pero esta representación no tiene en cuenta las fuerzas de enlace entre átomos o iones. Dicha información debe obtenerse aparte. Tampoco, la descripción de estructuras mediante poliedros no implica necesariamente la existencia de tales entidades como especies separadas. Así, en el NaCl, el enlace es principalmente iónico, y físicamente no existen las unidades estructurales NaCl6. Los poliedros tienen existencia en estructuras como: a) materiales moleculares, Al2Br6 (comparten una arista 2 tetraedros) b) compuestos con iones complejos, [Pt(NH3)2Cl2]. c) estructuras con tetraedros SiO4 (toda la variedad de silicatos)
28 Para las estructuras poliédricas, debemos considerar la 3ª Regla de Pauling para cristales iónicos complejos: Las estructuras que poseen poliedros con aristas compartidas y, especialmente, con caras compartidas disminuyen su estabilidad, en particular para los cationes de alta valencia y número de coordinación pequeño. Es decir, para los poliedros pequeños, sobre todo tetraedros, que contiene cationes con carga alta. Cuando los poliedros comparten aristas y sobre todo caras, las distancias catión-catión (distancia entre centros de gravedad de los poliedros) decrecen y los cationes se repelen entre sí. Las imágenes ilustran como el compartir un vértice o un arista entre dos octaedros, modifica la distancia catión-catión.
29 Comparando la compartición de aristas entre octaedros y tetraedros, se observa como la distancia de catión-catión (M-M) (relativo a la distancia de enlace anión-catión M-X) es menor entre tetraedros que entre para los octaedros, porque los ángulos MXM entre iones son de 71º y 90º, respectivamente. 71º 90º
30 Estructuras típicas de empaquetamiento: NaCl, ZnS (esfalerita y wurzita), Na2O, NiAs, CsCl, y otras estructuras AX Se consideran estructuras derivadas de la estructura cúbica ccp (F). (NaCl) Halita Los iones Cl - y Na + ocupan las posiciones octaédricas O, (T+ y T-, están vacias). Se puede considerar dos redes interpenetradas en la diagonal principal (1/2,1/2,1/2) (ZnS) Blenda (Esfalerita) Los iones S = ocupan las posiciones tetraédricas T+ ó (T-) y son distintos a los de la posición (0,0,0) ocupados por Zn +2. Las posiciones O y T- ó (T+) están vacias.
31 (Ca2F) Fluorita Los aniones F - ocupan todas las posiciones tetraédricas (T+ y T-). Los Ca +2 forman una red cúbica F. Cada anión F - está rodeado por 8 cationes Ca +2 y cada catión Ca +2 esta rodeado de 4 F -. Na O (Na2O) Antifluorita Es identica a la estructura de la fluorita, pero intercambian las posiciones del F - por Na 2 y de Ca +2 por O -2. (C) Diamante Los átomos de C que ocupan las posiciones tetraédricas son idénticos a los de la posición (0,0,0), por tanto esta estructura es tipo blenda pero monoátomica. Es una estructura muy importante en los materiales semiconductores.
32 Se considera una estructura derivada de la hexagonal compacta hcp(h). S Zn (ZnS) Wurtzita Solo se ocupan la mitad de las posiciones de coordinación octaédrica, evitando la distorsión, y la estructura resulta equivalente a la tipo blenda. Los cationes Zn +2, solo ocupan las posiciones T+ ó (T-) Las posicionest- ó (T+) y O, están vacías. Zn S O T+ 4 8 T- Zn S
33 Se considera una estructura derivada de la hexagonal compacta hcp(h). (NiAs) Niquelina Solo se ocupan la mitad de las posiciones de coordinación octaédrica, evitando la distorsión, y la estructura resulta equivalente a la de la halita. Los cationes Ni +3, solo ocupan las posiciones O, las posiciones T- y T+, están vacías. As 3 Ni 1 2 T+ z=0 z=0.5 z=0.25 z=0.75 4
34 Se considera una de las estructuras de coordinación de tipo AX (CsCl) Los cationes (Cs + ) ocupan los vértices de un cubo y los aniones (Cl - ), se sitúan en el centro del cubo ó viceversa. La coordinación es 8, con distancias interatómicas de 0.866Å. No puede considerarse estrictamente una estructura de empaquetamiento compacto, dado que cada Cl - debería tener otros 12 Cl - como vecinos próximos, en vez de 6. Existe un vínculo con la estructura de la fluorita, pudiendo ser descrita como una celda cúbica primitiva de aniones con cationes en los centros de cubo alternativos. En realidad es una celda cúbicas de tipo I, dado que todos los centros del cubo están ocupados por iones Cs +. En este tipo de estructura cristalizan muchos haluros de grandes cationes monovalentes TlBr, TlCl, TlI, NH4Cl, NH4Br y compuestos intermetálicos, tipo AlNi, CuZn, AuMg, LiAg.
35 Aparte de las cinco estructura AX tipo NaCl, CsCl, NiAs, ZnS-blenda y ZnS-wurtzita, existen otras estructuras de coordinación de tipo AX que son variantes distorsionadas de ellas, por ejemplo: a) FeO a bajas temperaturas, <90 K, tiene una estructura NaCl distorsionada a un romboédro por pasar de un ángulo de 90º a 90.07º al tener una ligera compresión en (111). b) TlF tiene una estructura relacionada con el NaCl pero distorsionada a un red ortorrómbica centrada, al modificar los parámetros de red. c) NH4CN tiene una estructura tipo CsCl también distorsionada, en la que los iones CN - no tienen simetría esférica, la red pasa a ser tetragonal con aumento en el parámetro reticular c. d) Los compuestos de Pd y Pt (PdO, PtS, etc.), a menudo tienen una coordinación del catión plano cuadrada. Lo mismo sucede con el Cu en CuO. e) Los compuestos de átomos pesados, en sus estados de oxidación bajos (Tl +, Pb 2+, Bi 3+ ) pueden dar estructuras con poliedros distorsionados en los que el catión, M 2+ tiene cuatro O 2- cerrando una pirámide de base cuadrada.
36 Estructuras tipo TiO2, CdI2, CdCl2 y Cs2O Se consideran estructuras representativas del tipo AX2. O Ti (TiO2) Rutilo La coordinación del Ti es 6 y se sitúa en el centro de un octaedro con vértices ocupados por O. Da lugar a una red tetragonal, con dos tipos de O en posiciones no equivalentes. Se denominan estructuras 6:3 porque cada O esta rodeado de 3 Ti. Los huecos octaédricos donde se aloja el Ti, alternan posiciones llenas y vacías, en cada capa. Los oxígenos 1 y 2 forman un lado común a dos octaedros. 2 1
37 I Cd (CdI2) Yoduro de Cadmio Tiene una estructura similar a la de rutilo. La relación de radios iónicos de 0.53, predice que los cationes Cd +2 ocuparan los huecos octaédricos. Por razones estequiometrias, solo la mitad de los huecos octaédricos se ocuparán, alternando capas totalmente ocupadas con capas vacías. Luego la forma de ocupación de los sitios octaédricos es bastante diferente. En detalle, esta red muestra que las capas yoduro donde hay cationes Cd +2 ocupando huecos octaédricos, están más juntas que aquellas donde los huecos octaédricos están vacíos. Por tanto, los I - están empaquetados hexagonalmente y los huecos octaédricos ocupados por Cd +2, y ambos se disponen en capas, tipo sandwich, con iones Cd +2, entre capas de I -. Esta disposición del material en capas hace que sus propiedades sean muy diferentes a las del rutilo, mucho mas compacto tridimensionalmente.
38 Cd Cl (CdCl2) Cloruro de Cadmio Su estructura es muy similar a la del anterior halogenuro y solo se diferencian en el tipo de empaquetamiento del anión. Los iónes Cl - presentan una estructura ccp mientras que los I - presentaban una disposición hcp. Esta estructura representarse mediante una celda unidad hexagonal, aunque puede ser elegida una más pequeña romboédrica. La base celda hexagonal es de un tamaño y forma similar a la de CdI2 pero su parámetro reticular c, es tres veces mayor que en CdI2. Debido a ello, es por lo que las posiciones del Cd +2 y los octaedros CdCl6, se disponen de forma escalonada a lo largo del eje z y dar lugar a un apilamiento de 3 capas para el Cd +2 (CBA) y una repetición de 6 capas de Cl - (ABCABC).
39 (Cs2O) La estructura del óxido de cesio es más inusual, ya que es del tipo anti- CdCl2. Los iones Cs + forman capas ccp y los O 2- ocupan los huecos octaédricos entre pares alternos de capas Cs +. El Cs - no está rodeado de oxígenos, como se espera de una estructura iónica, y tan sólo tiene 3 O 2- vecinos, situados a un lado. La estructura se mantiene estable con enlaces entre Cs +, de capas adyacentes. Por tanto, la coordinación de Cs + y O 2- deben estar en una relación 1:2; como el ión Cs + es considerablemente más grande que O 2-, el número máximo de coordinación posible solo puede ser 6, lo que conduce a que solo 3 O 2- se coordinan con cada Cs +. Este deficit de oxigeno coordinado da lugar a que esta estructura no sea muy estable, lo que hace que se oxide fácilmente para dar peróxidos, Cd2O2 y superóxidos, CdO2, que contienen O Cs mas aniones.
40 Espinelas y ferritas (AB2O4 / MgAl2O4) Espinela Son óxidos dobles, cúbicos, representativos de estructuras de coordinación de compuestos ternarios ccp, en los que A es un metal divalente que ocupa posiciones tetraédricas y B un ión trivalente que por norma ocupa posiciones octaédricas. Mg Al O Cada O enlaza con 1A +2 y 3B +3. Por tanto, la estructura esta formada por tetraedros y octaedros de oxigeno de modo que cada O pertenece a 1 tetraedro y 3 octaedros. Normalmente Las posiciones pueden sufrir múltiples variantes según el catión y estado de oxidación, por ejemplo el Cr +3, es siempre octaédrico
41 La celda unidad de la espinela es un gran cubo, formado por 8 cubos centrados, Es como la estructura de la halita (ccp) con iones O 2- en las esquinas y los centros de la cara. Solo algunas posiciones octaédricas están ocupadas O, de modo que las posiciones colaterales, en cualquiera de las tres direcciones están vacías. La alternancia, vacía-ocupada de lo huecos O es patente. Los 8 huecos tetraédricos, están equidistantes iones O 2- y también de los sitio s octaédricos. Las repulsiones cation-catión no permiten que los sitios tetraédricos y octaédricos adyacentes se ocupen simultáneamente (seria compartir una cara común). Por tanto, los huecos tetraédricos (A), para ocuparse precisan que los cuatro huecos octaédricos vecinos están vacíos. La estructura en su conjunto, muestra los ocho octantes divididos en dos y dispuestos exactamente como en el NaCl, de modo alternativo en 3D.
42 Las imágenes muestran dos puntos de vista de la estructura de la espinela de MgAl2O4. Se observa una disposición de los octaedros AlO6 con los tetraedros MgO4 en los canales existentes entre las posiciones octaédricas.
43 (Fe +2 Fe +3 2O4)8 Ferritas La estructura tipo de las ferritas es similar a la de magnetita Fe3O4. La celda unitaria de magnetita tiene la fórmula Fe +2 Fe +3 2O -2 4, por tanto, similar a la espinela MgAl2O4. Si consideramos una macro estructura de 8 celdas cúbicas en cuyos centros se sitúan los huecos tetraédricos y octaédricos, los 32 iones O -2 se distribuyen en los vértices de las ocho celdas F. El número de huecos tetraédricos (T) y octaédricos (O) por celda es de 8 y 4, respectivamente. En total, 64 huecos tetraédricos y 32 huecos octaédricos, aunque sólo una parte de ellos están ocupados. Las ferritas mas comunes tienen 16 Fe +3 (8 T + 8 O) y 8 Fe +2 (8 O). Esta distribución se conoce como espinela inversa debido a que en la espinela los huecos T son ocupados por cationes A +2 y los O por B +3. A B X
44 Otras estructuras relevantes (ABX3 / SrTiO3) Perovskita Es una estructura idealizada de Coordinación de compuestos ternarios, en la que el Sr ocupa el centro de un cubo, los O se sitúan en el medio de las aristas y el Ti en los vértices. Se presenta en numerosos minerales. Ti Sr O Los iones A deben ser grandes y divalentes, y los B medianos y tetravalentes, incluso pueden ser ambos trivalentes. Las distorsiones octaédricas, producen descenso en la simetría del sistema cristalino.
45 Las distorsiones estructurales en muchas perovskitas son debidas a que los átomos A 2+ y B 3+ no tienen el tamaño adecuado para adaptarse a los huecos generados en la estructura. Se puede definir un factor ideal de tolerancia t, obtenido a partir de la relación del parámetro reticular a, con las distancias de enlace entre cationes y oxígenos, A-O y B-O: En la práctica, existe cierta flexibilidad para las longitudes de enlace y por lo general, en cristales cúbicos, las formas de perovskita son estables con valores comprendidos entre 0,9 y 1,0. Para t >> 1, el hueco B 3+ es más grande de lo necesario. Si sólo es ligeramente mayor que uno (t > 1) la estructura es de perovskita distorsionada (BaTiO3, t=1,06). Para los casos t = 1,0, el ion B 3+ exige un sitio más pequeño, de menor número de coordinación, y la posición cambia a coordinación tetraédrica, como en BaSiO3. Para factores de tolerancia más pequeños, 0,85 < t < 0.90, las distorsiones implican generalmente la inclinación y la rotación de los octaedros BO6, lo que produce un zig-zag en la linea de enlaces B-O-B-O-B que tiene el efecto de reducir el tamaño del hueco tetraédrico de los cationes A 2+.
46 Hay distorsiones estructurales y reducciones de los huecos tetragonales que consiguen mantener la simetría cúbica, como en la familia de fases (A A 3B4O12 / CaCu3Ti4O12), donde los octaedros TiO6 se someten a rotaciones acopladas a los tres ejes; consecuencia de ello es que tres cuartas partes de las posiciones tetraédricas se transforman en planas.
47 Otro sistema de distorsiones que producen un descenso en la simetria de la estructura que conduce a una celda unidad trigonal, son las fases, del tipo LaBO3 donde B puede ser: Co, Ni, Cu, Al y Ga. También puede darse deficiencia aniónica como en Ca2(Fe,Al)2O5, con coordinación 5, que produce una disposición laminar alternando octaédros y tetraédros La2Ni2O5 Brownmillerita, Ca2(Fe,Al)2O5
48 Re O ReO3, Trióxido de Renio La estructura es cúbica y está estrechamente relacionada con las perovskitas SrTiO3, pero sin los iónes Sr +2. La celda unidad tiene Re +6 en los 4 vertices de un cubo y O -2 en el medio de las aristas. Cada ión Re +6 está rodeado de 6O -2 en coordinación octaédrica. Los octaedros ReO6 alcanzan el límite de compartición de vértices y cada vértice es compartido con otro octaedro. Las grandes cavidades de la estructura ampliada, tipo perovskita, pueden ser ocupadas por cationes voluminosos, dando lugar a las estructuras denominadas bronce. Un ejemplo de ellas es la serie NaxWO3, donde Re +6 es sustituido por W 5+ y W 6+ en coordinación WO6 y por compensación de carga hace que entre Na + con estequiometría comprendida entre 0<x<1, y número de coordinación 12.
49 Se denominan bronces por la variedad y vistosidad de sus colores y sus propiedades eléctricas. Tienen de formula general: NaxW v xw vi 1-xO3. Existen muchas posibles diadoquías para el Na + (K +, Li +, Ba 2+ ), análogamente para el metal octaédrico (Ti, V, Nb, Ta, Mo, W, Re, Ru ó Pt), incluso con mezcla de sus estados de oxidación. En las posibles distorsiones y rotaciones estructurales, los canales ocupados por Na +, con nº de coordinación de 12, pueden pasar a 15 y 9, transformando los canales con estructura cuadrada-a a pentagonal-a y triangular-a. Serán ocupados según el riónico: A-Na +, A -(K +,Ba 2+ ) y A - Li + ). Tambien los octaedros tienen dos posiciones no equivalentes, B y B, que pueden ser ocupados por mezclas de metales.
50 (Mg,Fe) i m Si O (Mg,Fe)2SiO4 Olivinos Su estructura es el análogo hcp de la espinela. Los O 2- están en disposición hexagonal compacta y 1/8 de los huecos tetraédricos están ocupadas por Si, alternando sus oxígenos apicales de x a -x e y a -y. La mitad de huecos octaédricos se ocupan por Mg +2 o Fe +2, con dos posiciones cristalográficas diferentes, unos ocupan centros de inversión, M1 y otros planos de simetría, M2. Los extremos puros forsterita y fayalita, son el principal constituyente mineralógico de la litosfera. A altas presiones, muchos olivinos se transforman a espinela y probablemente sea el principal constituyente del manto inferior terrestre. Los cambios de volumen asociados con la transformación olivino-espinela pueden ser responsables de procesos geológicos fundamentales, como la orogénesis terrestre y de los terremotos.
51 A3B2(SiO4)3 o A3B2(SiO4)3-x(OH)4X, Granates Constituyen dos series minerales piralspita y ugrandita con amplias sustituciones de cationes divalentes (A: Mg +2, Ca +2, Fe 2+, Mn 2+ ) y trivalentes (B: Al 3+, Cr 3+, Fe 3+, Mn 3+, V +3, Si 4+, Ti 4+ ) y posibilidades de diadoquía de Si(Al 3+,Fe 3+ ). Mg Al Si O Su estructura esta constituida por octaedros y tetraedros. Cada octaedro se une a otros 6 octaedros a través de tetraedros que comparten vértices. Cada tetraedro Si comparte sus vértices con 4 octaedros. Los cationes divalentes (Mg +2 ), más voluminosos, ocupan huecos coordinados con 8 oxígenos dispuestos en un dodecaedro triangular, distorsionado. Los cationes trivalentes (Al 3+ ) están preferentemente en los huecos octaédricos. La red se puede considerar cúbica centrada en el interior I, con a 12.4 Å. Piralspita: Piropo, (SiO4)3 Mg3Al2; Almandino, (SiO4)3 Fe3Al2); Espesartina, (SiO4)3 Mn3Al2 Ugrandita: Grosularia, (SiO4)3Ca3Al2; Andradita, (SiO4)3 Ca3Fe2; Uvarovita, (SiO4)3 Ca3Cr2
52 Estructuras de Coordinación A2X3 (Al2O3) Corindón Cada Al se rodea de 6 Oxígenos equidistantes en coordinación octaédrica imperfecta. Es una estructura similar a la de wurtzita con solo dos de cada tres posiciones octaédricas ocupadas, para evitar las distorsiones. Al O
53 Estructuras de Coordinación A2X3 (FeTiO3) Ilmenita Cuando en una estructura tipo corindón, el metal se sustituye por dos cationes, surge esta nueva estructura romboédrica, pero en la cual se produce un descenso en la simetría espacial de R3c a R3 por tener octaedros no equivalentes Ti +4 Fe +2 Fe Ti O
54 Al B AlB2 La familia del diboruro de aluminio saltó a la fama en el año 2000 cuando se descubrió que su isoestructural MgB2 era un superconductor (Tc=39K). En su estructura cristalina los átomos de Al forman capas de empaquetados densos apiladas en una secuencia de AAA, que puede considerarse hexagonal primitivo, hp. Están separadas entre si por capas de B dispuesto como en el grafito. La coordinación del Al es 12, con anillos hexagonales de B por encima y por debajo. Cada ión B tiene a 3B próximos, en disposición plana trigonal y 6Mg vecinos dispuestos en forma de prisma trigonal. Está relacionada con la estructura de NiAs. En ambas los átomos de metal tienen una disposición hexagonal, pero en AlB2 los huecos prismáticas trigonales están todos ocupados por Al, en NiAs solo la mitad.
55 Estructuras derivadas de la estructura cúbica F (CuFeS2) Calcopirita Cu Surge de la modificación de la estructura tipo blenda, al efectuar diadoquías en posiciones tetraédricas a lo largo de una dirección, el cristal para a ser tetragonal. Esta sustitución se puede generalizar en otros sulfuros, dando lugar a estructuras cúbicas y tetragonales en las cuales cristalizan numerosos minerales sulfurados. Estructuras derivadas de la estructura hexagonal (H) Fe Fe S S (FeS) Pirrotina Todas las posiciones de coordinación octaédrica se ocupan por átomos iguales. Esta estructura es idéntica a la cúbica del NaCl dado que la coordinación es 6, pero aquí, se pierde y distorsiona la disposición octaédrica
56 Estructura de los silicatos Los minerales pertenecientes a esta clase juegan un papel importante en la corteza terrestre, ya que constituyen alrededor del 90% de la misma. Su número es aproximadamente de 500, lo cual significa una cuarta parte de todos los minerales conocidos. El elemento básico de la composición de los silicatos es el Si. Es muy abundante en la Litosfera, constituyendo el 27,59% de todas las rocas ígneas y el 0,83% del volumen total. Con excepción del SiC (Moisanita) de los meteoritos férreos, no se conoce en la naturaleza asociación del silicio que no aparezca oxígeno, con el que forma una combinación característica.
57 El silicio es invariablemente tetravalente con un riónico (Si +4 )=0,39Å, rodeándose por cuatro oxígenos. Los grupos SiO4 son básicos en las estructuras de los silicatos. Por tanto, la unidad estructural básica de los silicatos es el tetraedro (SiO4) -4, en el que las distancias Si-O son de 1.62Å y las O-O de 2.65Å y el ángulo de los enlaces O-Si-O de 109º º Å 2.65Å
58 Bajo condiciones magmáticas esta condensación corre paralela con el incremento gradual de SiO2 en el correspondiente magma durante la diferenciación, un exceso de Si da lugar a la formación de SiO2 libre (cuarzo), en él los grupos (SiO4) -4 están unidos por enlaces covalentes en las tres direcciones, del espacio. La variación de SiO2 en los principales tipos de rocas ígneas, sigue la misma correlación con el contenido en álcalis, siendo el comportamiento de ambos constituyentes paralelo, excepto en casos de ciertas rocas alcalinas con bajo contenido en sílice.
59 La cantidad de SiO2 libre en las rocas ígneas depende en gran medida de la posibilidad de combinar Si en otros componentes del magma, de forma que rocas con 50% de SiO2, sólo algunas veces presentan cuarzo, mientras que con un 65% siempre este presente este mineral, (cuarzo). La diversidad de composición de los silicatos bajo condiciones magmáticas se debe al reemplazamiento de parte del Si +4 tetraédrico (SiO4) = por Al +3. En coordinación tetraédrica el riónico(al +3 )=0.45Å, y permite diadoquías con Si, sobre todo a temperaturas elevadas. Tal diadoquía ocurre también entre Si y Be ri(be +2 )=0.34Å y entre Si y Ge ri(ge +4 )=0.44Å.
60 Se conocen tres isótopos estables del silicio: Si 28, Si 29 y Si 30. Sus abundancias respectivas son: 92.27%, 4.68% y 3.05%. La razón Si 28 /Si 30 en silicatos varía dentro de ciertos límites y se usa para diferenciar su origen. La relación Ge - Si es importante, no solo por la posibilidad de diadoquia en las estructuras silicatadas, sino también por el aumento gradual de contenido en Ge con el incremento en SiO2 en rocas ígneas. Las rocas básicas contienen 2ppm, mientras que las ácidas contienen hasta 5ppm de Ge. El Ge también puede presentarse en coordinación octaédrica ri(ge +4 )=0.64Å y como tal puede sustituir al Ti (ri(ti +4 )=0.64Å), como sucede en ciertas pegmatitas como el topacio, que alcanzar hasta 100 ppm de GeO2.
61 Contenido en SiO2 Tipo de Magma > 65 % Ácido % Neutro % Básico < 45 % Ultrabásico
62 Los grupos (SiO4)-4, poseen cuatro cargas negativas y si se encuentran como tales, aislados unos de otros, constituyen una subclase denominada NESOSILICATOS (Ortosilicatos). Su carácter mesodésmico, permite su polimerización, dando lugar a entramados más o menos complejos, que compartiendo exclusivamente vértices de su estructura, dan lugar a radicales más complejos finitos o infinitos y otras subclases de minerales. Entre los primeros, los más conocidos son: (Si2O7) 6-, (Si3O9) 6-, (Si4O12) 8-, (Si6O18) 12- y (Si12O30) 12-. Los minerales que presentan los grupos (Si2O7) 6- se denominan SOROSILICATOS o Diortosilicatos. En esta subclase el enlace Si-O-Si no siempre se presenta en linea recta, sino que puede ser angular.
63 Los grupos constituidos por 3, 4, 6 y 12 tetraedros (SiO4) se disponen en forma de anillo, por lo que los minerales que presentan estos grupos estructurales básicos se denominan CICLOSILICATOS. Cuando los tetraedros (SiO4) se unen en número infinito se pueden, disponer en forma de filas o cadenas, laminas u hojas y entramados tridimensionales. Las cadenas de tetraedros pueden ser simples o dobles originando la subclase de los INOSILICATOS. Si los tetraedros se disponen en forma laminar, los minerales de la subclase son denominados FILOSILICATOS. Y finalmente el entramado tridimensional de tetraedros origina la subclase de los TECTOSILICATOS.
64
65 NESOSILICATOS: Son silicatos en los que todos los oxígenos están unidos por cationes; no hay tetraedros compartiendo oxígenos Unidad estructural: (SiO4) -4 Fórmula general: XaXb(SiO4)n Xa cationes divalentes de gran tamaño (Ca 2+, Mg 2+, Fe 2+ y Mn 2+ ) Xb cationes trivalentes de pequeño tamaño (Fe 3+, Al 3+ y Cr 3+ ) Minerales: grupo de los olivinos, grupo de los granates, circón, topacio, distena, andalucita y silimanita.
66 SOROSILICATOS: Son silicatos en los que hay pares de tetraedros unidos entre sí compartiendo oxígenos; las uniones entre estos pares se realiza mediante cationes. Unidad estructural: (Si2O7) -6 Fórmula general: A3B2[(Si2O7)(SiO4)O(OH)] A cationes grandes y de poco carga (Ca 2+, Na + ) Xb cationes pequeños y de poca carga (Fe 3+, Al 3+, Mg 2+ y Mn 3+ ) Minerales: grupo de la epidota
67 CICLOSILICATOS: Son silicatos en los que todos los tetraedros de silicio están unidos entre sí formando un anillo cerrado de tres, cuatro o seis tetraedros Unidad estructural: (SiO3) -2 Fórmula general: A3B2(SixO3x) A cationes grandes y de poco carga (Ca 2+, Na + ) B cationes pequeños y de poca carga (Fe 3+, Al 3+, Mg 2+, Li + y Mn 3+ ) Minerales: Berilo y turmalina.
68 INOSILICATOS (PIROXENOS): Son silicatos en los que los tetraedros de silicio están unidos entre sí formando una cadena sencilla. La unión entre cadenas se realiza mediante cationes de diferente carga. Unidad estructural:(si2o6) -4 Fórmula general: AB(Si2O6) A, B cationes grandes o pequeños (Ca 2+, Na +, Fe 3+, Al 3+, Mg 2+ y Mn 3+ ) Minerales: Enstatita, hiperstena, diópsido y augita
69 INOSILICATOS (ANFIBOLES): Los tetraedros de silicio están unidos formando una cadena doble, resultado de la unión de dos cadenas sencillas mediante cationes balanceadores de las cargas negativas. Unidad estructural: (Si4O11) -6 Fórmula general: AaBb[(Si8O22)O(OH)2] A, B cationes grandes o pequeños (Ca 2+, Na +, Fe 3+, Al 3+, Mg 2+ y Mn 3+ ) Los grupos hidroxilos (OH), ocupan los huecos en las cadenas dobles Minerales: antofilita, tremolita y hornblenda
70 FILOSILICATOS: En los filosilicatos las cadenas de inosilicatos se unen entre sí compartiendo oxígenos (no mediante cationes) de manera que los tetraedros forman una hoja o lámina (siloxano) en la que todas las cargas de los oxígenos están satisfechas. Las láminas se unen entre sí mediante cationes. Unidad estructural: (Si2O5) -2
71 FILOSILICATOS: Sin embargo en los filosilicatos no todas las láminas están formadas por tetraedros de silicio (láminas de siloxano); en la estructura hay intercaladas láminas de octaedros formadas por 6 grupos de hidroxilos (OH) - y por cationes Al 3+ o Mg 2+. En el primer caso las láminas son dioctaédricos (gibsita), y en el segundo son trioctaédricas (brucita). U. E gibsitica Al2(OH)6 U. E brucitica Mg3(OH)6
72 FILOSILICATOS 1:1 Cada lámina de tetraedros (siloxano) se une a una lámina octaédrica con Al, gibsitica ó Mg brucitica. Unidad estructural: X[(Si2O5)(OH)4] X: 2Al ó 3Mg (para neutralizar la carga de los 6OH - Minerales: caolinita y serpentina o antigorita
73 FILOSILICATOS 2:1 Cada lámina de octaedros (de brucita o de gibsita) se une a dos láminas de tetraedros (siloxanos). Unidad estructural: X[(Si4O10)(OH)2] X: 2Al ó 3Mg (para neutralizar la carga de los 6OH - Minerales: Pirofilita y talco
74 FILOSILICATOS 2:1 En ocasiones pueden ocurrir sustituciones isomórficas de Si +4 por Al +3 ; el déficit de carga positiva implica la entrada en la estructura de otros cationes que aseguren un balance final neutro. Según el catión entrante, el mineral será uno del grupo de las micas. Unidad estructural: YX[(AlSi3O10)(OH)2] X: 2Al ó 3Mg; Y: K +, Na + y Ca +2 Minerales: moscovita, flogopita, paragonita, biotita, margarita y xantofilita
75 FILOSILICATOS 2:2 ó 2:1:1 Son grupos formados por 2 láminas de tetraedros (siloxanos), que conectan entre si mediante una capa octaedrica (filosilicatos de tipo 2:1) y a su vez se unen con otra lámina de tipo trioctaédrica (brucitica). Unidad estructural: X3[(Si4O10)(OH)2]Mg3(OH)6 X: Mg +2, Al +3, Fe +3 ó Fe 2+ Minerales: cloritas
76 FILOSILICATOS 2:2 ó 2:1:1 También pueden entrar moléculas de H2O en los huecos existentes entre los tetraedros, y sustituciones no regulares de cationes con o sin H2O, originando el grupo de las illitas (hidrómicas) y los filosilicatos expansibles vermiculitas y montmorillonitas (smectita).
77 TECTOSILICATOS En esta subclase las láminas de siloxano se unen entre sí compartiendo oxígenos, de manera que no hay cationes enlazando tetraedros. Todos los enlaces son de tipo oxígeno-silicio, los más estables de todos. Unidad estructural: (SiO2) Mineral: cuarzo Se pueden dar sustituciones isomórficas Si +4 (Al +3 ) y el déficit de carga permite la entrada en la estructura de algún otro catión balanceador. Según sea este resultará la formación de nuevos minerales: grupo de los feldespatos (K + ) y de las plagioclasas (Na + y/ó Ca +2 ).
78 Dos clasificaciones de silicatos con interes estructural son las de Liebau (1962) y Zoltai (1968). Liebau describe 6 variaciones de monocadena, según el nº de tetraedros que compongan la unidad repetitiva
79 Obviamente, 4 son las estructuras con dobles cadenas
80 Las variedades laminares o filosilicatos, estan constituidas por monocadenas, que dan lugar a tres tipos de estructuras (micas, oquenita y apofilita)
81 La 2 unidad laminar puede presentar alternancia en los oxígenos apicales de z y -z, dando lugar a estructuras T (atapulgita, sepiolita, etc) T T T T T T T T T T T T T T T T
82 La variedad de dobles laminas se debe a la compartición de los oxígenos cimeros ó apicales (milarita y polimorfos sintéticos Ca(Ba)Al2Si2O8. 60º
83 la clasificación de Zoltai (1968) es la que más incertidumbres resuelve. Plantea que la utilización exclusiva del Si/Al en los tetraedros no es suficiente para clasificar a los ciclo-, filo- y téctosilicatos. Sugiere que se consideren todas las posibles diadoquías Si (Z): B +3, Be +2, P +5, Ge +4, Fe +3, Zn +2 y Ti +4. Por tanto, los grupos ZO4, donde Z es el catión tetraédrico, son las piedras angulares de las subclases. Se define el coeficiente de Zoltai (Z) o de compartición que considera que como máximo dos tetraedros (SiO4) pueden compartir 1 solo vértice, pero si se consideran otros cationes, mas tetraedros pueden compartir un solo vértice.
84 Si n es un número positivo y entero que representa el número mínimo de tetraedros que comparten un vértice común, n+1 representará el número máximo de los que comparten un vértice común. Esto quiere decir que si en la estructura hay vértices no compartidos, estos vértices, comparten 1 solo tetraedro (n=1), y cualquiera de los restantes vértices de la estructura pueden ser compartidos entre (n+1) tetraedros, a lo sumo. Así pues, el el coeficiente de compartición de Zoltai, que representa el valor medio de vértices compartidos por (n+1) tetraedros, de modo general es: S = [x(n+1)+(4t-x)n]/4t) n: vertices compartidos x: vértices de tipo (n+1) S = n+(x/4t)
85 Veamos el ejemplo de la Tremolita Ca2Mg5Si8O22(OH)2 número de tetraedros T:8, (4T=32) vértices sin compartir n=12 vértices compartidos x=20 S = [(n*1)+(n+1)*2]/4t) S = [(12*1)+(20*2]/32) S = [12+40]/32 S = 1.65 S = 1+(20/32) = 1+0,65
86 Subclase Coficiente de Zoltai (Z) nesosilicatos 1.00 sorosilicatos Monociclos 3, 4 y 6 U ciclosilicatos? dobles ciclos varios ciclos inosilicatos filosilicatos tecosilicatos 1.50 monocadenas dobles cadenas 1.75 monocapas 2.00 dobles capas 2.00 [ZxO2x] 2.75 hemimorfita [Z2xO4x]
87 Ángel Carmelo Prieto Colorado Física de la Materia Condensada, Cristalografía y Mineralogía. Facultad de Ciencias. Universidad de Valladolid.
Estructura general de los silicatos
 Estructura general de los silicatos Apellidos, nombre Departamento Centro Ibáñez Asensio, Sara (sibanez@prv.upv.es) Moreno Ramón, Héctor (hecmora@prv.upv.es) Gisbert Blanquer, Juan Manuel (jgisbert@prv.upv.es)
Estructura general de los silicatos Apellidos, nombre Departamento Centro Ibáñez Asensio, Sara (sibanez@prv.upv.es) Moreno Ramón, Héctor (hecmora@prv.upv.es) Gisbert Blanquer, Juan Manuel (jgisbert@prv.upv.es)
Tema 4. Cristaloquímica. Descripción estructural y
 Tema 4. Cristaloquímica. Descripción estructural y estructuras tipos Qué objetivos tiene la Cristaloquímica? Las fases cristalinas son componentes esenciales de los materiales, y especificamente de los
Tema 4. Cristaloquímica. Descripción estructural y estructuras tipos Qué objetivos tiene la Cristaloquímica? Las fases cristalinas son componentes esenciales de los materiales, y especificamente de los
Estructura de sólidos
 Estructura de sólidos Química Inorgánica - 2006 Tipos de estructuras cristalinas cristal enlace características molecular covalente-baja energía cristales blandos, bajo p.f. red covalente covalente cristales
Estructura de sólidos Química Inorgánica - 2006 Tipos de estructuras cristalinas cristal enlace características molecular covalente-baja energía cristales blandos, bajo p.f. red covalente covalente cristales
TEMA 8: SÓLIDOS INORGÁNICOS. 2.- Redes bidimensionales y tridimensionales
 TEMA 8: SÓLIDOS INORGÁNICOS 1.- Tipos de sólidos 2.- Redes bidimensionales y tridimensionales 3.- Celda unidad y sus parámetros: - nº de átomos / celda - nº de coordinación (NC) - fracción de volumen ocupado
TEMA 8: SÓLIDOS INORGÁNICOS 1.- Tipos de sólidos 2.- Redes bidimensionales y tridimensionales 3.- Celda unidad y sus parámetros: - nº de átomos / celda - nº de coordinación (NC) - fracción de volumen ocupado
Síntesis y Caracterización Estructural de los Materiales Ángel Carmelo Prieto Colorado
 Síntesis y Caracterización Estructural de los Materiales Ángel Carmelo Prieto Colorado Física de la Materia Condensada, Cristalografía y Mineralogía. Facultad de Ciencias. Universidad de Valladolid. Estructura
Síntesis y Caracterización Estructural de los Materiales Ángel Carmelo Prieto Colorado Física de la Materia Condensada, Cristalografía y Mineralogía. Facultad de Ciencias. Universidad de Valladolid. Estructura
Sistemática de minerales. 2. Silicatos
 Sistemática de minerales 2. Silicatos Silicatos Enlace Si-O Geometría: tetraedros Estabilidad máxima Posibilidad polimerización Grupos de Silicatos Nesosilicatos [SiO4] -4 Grupos de Silicatos Sorosilicatos
Sistemática de minerales 2. Silicatos Silicatos Enlace Si-O Geometría: tetraedros Estabilidad máxima Posibilidad polimerización Grupos de Silicatos Nesosilicatos [SiO4] -4 Grupos de Silicatos Sorosilicatos
Tipos de estructuras. Introducción a la Ciencia de Materiales. M. Bizarro F. M. Sánchez
 Tipos de estructuras Empaquetamiento compacto Son estructuras formadas por átomos de igual tamaño que se unen mediante enlace metálico (esferas duras) A B A : A B C : FCC vs HCP El factor de empaquetamiento
Tipos de estructuras Empaquetamiento compacto Son estructuras formadas por átomos de igual tamaño que se unen mediante enlace metálico (esferas duras) A B A : A B C : FCC vs HCP El factor de empaquetamiento
Estructuras Cristalinas
 Estructuras Cristalinas Bibliografía: Solid State Chemistry: An introduction, L. Smart and E. Moore. 1992 Solid State Chemistry and its applications, A.R. West. 1984 1 Enlace en Cerámicos Iónico Mezcla
Estructuras Cristalinas Bibliografía: Solid State Chemistry: An introduction, L. Smart and E. Moore. 1992 Solid State Chemistry and its applications, A.R. West. 1984 1 Enlace en Cerámicos Iónico Mezcla
ESTRUCTURAS CARACTERÍSTICAS
 ESTRUCTURAS CARACTERÍSTICAS En este capítulo se describen algunas estructuras muy simples que permitirán analizar la disposición de los átomos de diversos compuestos característicos en los que el enlace
ESTRUCTURAS CARACTERÍSTICAS En este capítulo se describen algunas estructuras muy simples que permitirán analizar la disposición de los átomos de diversos compuestos característicos en los que el enlace
Los sólidos iónicos. Estructuras características de los sólidos iónicos
 Los sólidos iónicos Los compuestos iónicos suelen presentar una serie de características físicas que los distinguen de los covalentes. Así, los sólidos iónicos como el cloruro sódico y el nitrato de potasio
Los sólidos iónicos Los compuestos iónicos suelen presentar una serie de características físicas que los distinguen de los covalentes. Así, los sólidos iónicos como el cloruro sódico y el nitrato de potasio
Mineralogía Sistemática
 Mineralogía Sistemática Minerales Existen descritos más de 3500 especies minerales (sin incluir variedades) Sin embargo, solo unos cuantos son importantes en cuanto a su frecuencia Otros muchos son importantes
Mineralogía Sistemática Minerales Existen descritos más de 3500 especies minerales (sin incluir variedades) Sin embargo, solo unos cuantos son importantes en cuanto a su frecuencia Otros muchos son importantes
Ing. Fredy Velázquez Soto
 Ing. Fredy Velázquez Soto TIPOS DE SÓLIDOS Sólidos cristalinos Los átomos, iones o moléculas se empaquetan en un arreglo ordenado Sólidos covalentes ( diamante, cristales de cuarzo), sólidos metálicos,
Ing. Fredy Velázquez Soto TIPOS DE SÓLIDOS Sólidos cristalinos Los átomos, iones o moléculas se empaquetan en un arreglo ordenado Sólidos covalentes ( diamante, cristales de cuarzo), sólidos metálicos,
MATERIALES CERÁMICOS
 MATERIALES CERÁMICOS Son materiales inorgánicos no metálicos, constituidos por elementos metálicos y no metálicos enlazados principalmente mediante enlaces iónicos y/o covalentes. PROPIEDADES 1.En general,
MATERIALES CERÁMICOS Son materiales inorgánicos no metálicos, constituidos por elementos metálicos y no metálicos enlazados principalmente mediante enlaces iónicos y/o covalentes. PROPIEDADES 1.En general,
INO-1 PX Magdalena Rodas INOSILICATOS
 INO-1 PX Magdalena Rodas INOSILICATOS INOSILICATOS -Introducción: Rasgos estructurales básicos * Cadenas secillas: Piroxenos y piroxenoides. * Cadenas dobles: Anfíboles Silicatos con estructuras en cadenas
INO-1 PX Magdalena Rodas INOSILICATOS INOSILICATOS -Introducción: Rasgos estructurales básicos * Cadenas secillas: Piroxenos y piroxenoides. * Cadenas dobles: Anfíboles Silicatos con estructuras en cadenas
Consideraciones sobre estructuras representativas
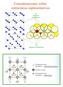 Consideraciones sobre estructuras representativas CONSIDERACIONES SOBRE ESTRUCTURAS REPRESENTATIVAS: En el empacamiento compacto hcp y ccp el número de coordinación es 12 Los elementos metálicos son los
Consideraciones sobre estructuras representativas CONSIDERACIONES SOBRE ESTRUCTURAS REPRESENTATIVAS: En el empacamiento compacto hcp y ccp el número de coordinación es 12 Los elementos metálicos son los
TECTOSILICATOS INTRODUCCIÓN GRUPO DE LA SILICE ESTRUCTURAS POLIMORFISMO. Magdalena Rodas
 TECTOSILICATOS INTRODUCCIÓN GRUPO DE LA SILICE ESTRUCTURAS POLIMORFISMO Magdalena Rodas TECTOSILICATOS Grupo de la sílice (SiO 2 ) Grupo de los feldespatos (Si 3 Al O 8 ) -1 Grupo de los feldespatóides
TECTOSILICATOS INTRODUCCIÓN GRUPO DE LA SILICE ESTRUCTURAS POLIMORFISMO Magdalena Rodas TECTOSILICATOS Grupo de la sílice (SiO 2 ) Grupo de los feldespatos (Si 3 Al O 8 ) -1 Grupo de los feldespatóides
NESOSILICATOS-2 GRANATES ESTAUROLITA TOPACIO. Magdalena Rodas
 NESOSILICATOS-2 GRANATES ESTAUROLITA TOPACIO Magdalena Rodas NESOSILICATOS: GRANATES Forman una solución sólida multicomponente, cuya fórmula general puede expresarse como: X 3 2+ Y 2 3+ Si 3 O 12, X =
NESOSILICATOS-2 GRANATES ESTAUROLITA TOPACIO Magdalena Rodas NESOSILICATOS: GRANATES Forman una solución sólida multicomponente, cuya fórmula general puede expresarse como: X 3 2+ Y 2 3+ Si 3 O 12, X =
Tema 8. Mineralogía Sistemática
 Tema 8 Mineralogía Sistemática Minerales Existen descritos más de 3500 especies minerales (sin incluir variedades) Sin embargo, solo unos cuantos son importantes en cuanto a su frecuencia Otros muchos
Tema 8 Mineralogía Sistemática Minerales Existen descritos más de 3500 especies minerales (sin incluir variedades) Sin embargo, solo unos cuantos son importantes en cuanto a su frecuencia Otros muchos
Bloque II: Silicatos BLOQUE III: CERAMICAS TRADICIONALES SILICATOS. Bibliografía Química Inorgánica, Enrique Gutierrez Rios
 BLOQUE III: CERAMICAS TRADICIONALES SILICATOS Bibliografía Química Inorgánica, Enrique Gutierrez Rios 1 Características generales Estructuras tridimensionales: XRD Эn sólo Estado Sólido Aplicación industriales
BLOQUE III: CERAMICAS TRADICIONALES SILICATOS Bibliografía Química Inorgánica, Enrique Gutierrez Rios 1 Características generales Estructuras tridimensionales: XRD Эn sólo Estado Sólido Aplicación industriales
Objetivo. Introducción. Palabras clave. Desarrollo. Química Unidad 8 Enlace químico. 1. Interacciones entre átomos
 Química Unidad 8 Enlace químico Objetivo Comprender los conceptos básicos de los modelos de enlace iónico, covalente y metálico. Introducción Los electrones cumplen un papel fundamental en la formación
Química Unidad 8 Enlace químico Objetivo Comprender los conceptos básicos de los modelos de enlace iónico, covalente y metálico. Introducción Los electrones cumplen un papel fundamental en la formación
NESOSILICATOS-1 OLIVINO
 NESOSILICATOS-1 OLIVINO M. Rodas Tomado de :www/usuarios.lycos.es GRUPO DEL OLIVINO NESOSILICATOS GRUPO DE LOS GRANATES GRUPO DE LOS NESOSILICATOS ALUMINICOS: Andalucita, Sillimanita, Distena o cianita
NESOSILICATOS-1 OLIVINO M. Rodas Tomado de :www/usuarios.lycos.es GRUPO DEL OLIVINO NESOSILICATOS GRUPO DE LOS GRANATES GRUPO DE LOS NESOSILICATOS ALUMINICOS: Andalucita, Sillimanita, Distena o cianita
TEMA 2. ENLACES QUIMICOS
 TEMA 2. ENLACES QUIMICOS En la naturaleza los átomos que constituyen la materia se encuentran unidos formando moléculas o agrupaciones más complejas. A pesar de ello existen una serie de elementos que
TEMA 2. ENLACES QUIMICOS En la naturaleza los átomos que constituyen la materia se encuentran unidos formando moléculas o agrupaciones más complejas. A pesar de ello existen una serie de elementos que
Filosilicatos : "Planos". Grupo estructural: [Si 2 O 5 ] 2 - Polimerización 3 Serpentina, micas.
![Filosilicatos : Planos. Grupo estructural: [Si 2 O 5 ] 2 - Polimerización 3 Serpentina, micas. Filosilicatos : Planos. Grupo estructural: [Si 2 O 5 ] 2 - Polimerización 3 Serpentina, micas.](/thumbs/56/38180282.jpg) Filosilicatos : "Planos". Grupo estructural: [Si 2 5 ] 2 - Polimerización 3 Serpentina, micas. Nombre derivado del griego, phyllon hoja. odos los miembros de este grupo tienen hábito hojoso o escamoso
Filosilicatos : "Planos". Grupo estructural: [Si 2 5 ] 2 - Polimerización 3 Serpentina, micas. Nombre derivado del griego, phyllon hoja. odos los miembros de este grupo tienen hábito hojoso o escamoso
4. Estructura atómica, enlaces y Ordenamiento atómico de los metales
 4. Estructura atómica, enlaces y Ordenamiento atómico de los metales Atomo Unidad estructural básica de todos los materiales. En nuestro modelo, los átomos están constituidos por tres partículas subatómicas
4. Estructura atómica, enlaces y Ordenamiento atómico de los metales Atomo Unidad estructural básica de todos los materiales. En nuestro modelo, los átomos están constituidos por tres partículas subatómicas
QUÉ ES LA MATERIA? Líquidos gases sólidos LOS MINERALES SON SÓLIDOS
 QUÉ ES LA MATERIA? Cualquier cosa que tenga masa y ocupe espacio es materia. Los estados o fases de la materia son: Líquidos gases sólidos LOS MINERALES SON SÓLIDOS ÁTOMOS Y ELEMENTOS La materia está formada
QUÉ ES LA MATERIA? Cualquier cosa que tenga masa y ocupe espacio es materia. Los estados o fases de la materia son: Líquidos gases sólidos LOS MINERALES SON SÓLIDOS ÁTOMOS Y ELEMENTOS La materia está formada
Materiales-G704/G742. Jesús Setién Marquínez Jose Antonio Casado del Prado Soraya Diego Cavia Carlos Thomas García
 Materiales-G704/G742 Lección 3. Estructura cristalina y amorfa Jesús Setién Marquínez Jose Antonio Casado del Prado Soraya Diego Cavia Carlos Thomas García Departamento de Ciencia e Ingeniería del Terreno
Materiales-G704/G742 Lección 3. Estructura cristalina y amorfa Jesús Setién Marquínez Jose Antonio Casado del Prado Soraya Diego Cavia Carlos Thomas García Departamento de Ciencia e Ingeniería del Terreno
Tema 2: Enlace y propiedades de los materiales
 En la mayoría de moléculas, los enlaces entre los átomos que las constituyen no es mediante la interacción coulombiana que hemos analizado en el caso del enlace iónico. Se necesita tener en cuenta el llamado
En la mayoría de moléculas, los enlaces entre los átomos que las constituyen no es mediante la interacción coulombiana que hemos analizado en el caso del enlace iónico. Se necesita tener en cuenta el llamado
Sólidos Iónicos El enlace Iónico (1)
 1 Sólidos Iónicos El enlace Iónico (1) 2 * Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4ª Ed., Harper Collins, 1993. Capítulo 4. * Douglas,
1 Sólidos Iónicos El enlace Iónico (1) 2 * Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4ª Ed., Harper Collins, 1993. Capítulo 4. * Douglas,
TECTO-3 FELDESPATOS. M.Rodas
 TECTO-3 FELDESPATOS M.Rodas FELDESPATOS 1.- Importancia 2.- Caracterización 3.- Clasificación 4.- Estructuras: -Sanidina - Microclina -Ortosa -Albita -Anortita - Miembros intermedios. 5.- Comportamiento
TECTO-3 FELDESPATOS M.Rodas FELDESPATOS 1.- Importancia 2.- Caracterización 3.- Clasificación 4.- Estructuras: -Sanidina - Microclina -Ortosa -Albita -Anortita - Miembros intermedios. 5.- Comportamiento
CAP. 1:ESTRUCTURAS CRISTALINAS
 CAP. 1:ESTRUCTURAS CRISTALINAS Sólidos cristalinos: amorfos: Disposiciones periódicas en el espacio Disposición al azar Situaciones intermedias: (no periódicas pero ordenadas) Estructuras moduladas Casicristales
CAP. 1:ESTRUCTURAS CRISTALINAS Sólidos cristalinos: amorfos: Disposiciones periódicas en el espacio Disposición al azar Situaciones intermedias: (no periódicas pero ordenadas) Estructuras moduladas Casicristales
TEMA 8 ESTRUCTURA CRISTALINA
 Tema 8. Estructura cristalina 1 TEMA 8 ESTRUCTURA CRISTALINA Los sólidos pueden clasificarse: 1.- Por su ordenación: 1a. Sólidos amorfos: tienen una estructura desordenada. Sus átomos o moléculas se colocan
Tema 8. Estructura cristalina 1 TEMA 8 ESTRUCTURA CRISTALINA Los sólidos pueden clasificarse: 1.- Por su ordenación: 1a. Sólidos amorfos: tienen una estructura desordenada. Sus átomos o moléculas se colocan
01 Minerales y estructuras
 01 Minerales y estructuras Año 2017 15/08/2017 1 Contenido Minerales metales Mena, ganga, ley mineral Tipo de minerales Estructura de los materiales Tipo de enlaces: iónico, covalente, metálico, van der
01 Minerales y estructuras Año 2017 15/08/2017 1 Contenido Minerales metales Mena, ganga, ley mineral Tipo de minerales Estructura de los materiales Tipo de enlaces: iónico, covalente, metálico, van der
ESTRU R C U T C UR U A R S A D E D LOS O MAT A ERI R AL A ES
 ESTRUCTURAS DE LOS MATERIALES Cristalina CRISTALINOS METALES COMPUESTOS IÓNICOS COMPUESTOS COMPLEJOS COV.-ION. SÓLIDOS COVALENTES COVALENTE PURO SÓLIDOS MOLECULARES NO CRISTALINOS (AMORFOS) VIDRIOS INORGÁNICOS
ESTRUCTURAS DE LOS MATERIALES Cristalina CRISTALINOS METALES COMPUESTOS IÓNICOS COMPUESTOS COMPLEJOS COV.-ION. SÓLIDOS COVALENTES COVALENTE PURO SÓLIDOS MOLECULARES NO CRISTALINOS (AMORFOS) VIDRIOS INORGÁNICOS
TEMA 5. Elementos y compuestos 1 CLASIFICACIÓN DE LOS ELEMENTOS
 TEMA 5 Elementos y compuestos 1 CLASIFICACIÓN DE LOS ELEMENTOS La primera clasificación de los elementos fue la que distinguió entre metales y no metales y se basaba en el aspecto que presentaban los elementos
TEMA 5 Elementos y compuestos 1 CLASIFICACIÓN DE LOS ELEMENTOS La primera clasificación de los elementos fue la que distinguió entre metales y no metales y se basaba en el aspecto que presentaban los elementos
CRISTALOGRAFIA. Es un sólido compuesto de átomos, iones o moléculas ordenados de una cierta forma y que se repite en tres dimensiones.
 CRISTALOGRAFIA CRISTAL SÓLIDO MONOCRISTALINO SÓLIDO POLICRISTALINO Es un sólido compuesto de átomos, iones o moléculas ordenados de una cierta forma y que se repite en tres dimensiones. Región donde el
CRISTALOGRAFIA CRISTAL SÓLIDO MONOCRISTALINO SÓLIDO POLICRISTALINO Es un sólido compuesto de átomos, iones o moléculas ordenados de una cierta forma y que se repite en tres dimensiones. Región donde el
24/02/2012 Ealboró Eefrén Giraldo 1
 24/02/2012 Ealboró Eefrén Giraldo 1 OBJETIVO Estudiar la relación intima entre la estructura y propiedades de los materiales. 24/02/2012 Ealboró Eefrén Giraldo 2 24/02/2012 Ealboró Eefrén Giraldo 3 ESTRUCTURA.
24/02/2012 Ealboró Eefrén Giraldo 1 OBJETIVO Estudiar la relación intima entre la estructura y propiedades de los materiales. 24/02/2012 Ealboró Eefrén Giraldo 2 24/02/2012 Ealboró Eefrén Giraldo 3 ESTRUCTURA.
Igual número de cationes y aniones. Ejemplos: cloruro de sodio (NaCl), cloruro de cesio (CsCl), blenda (ZnS), etc.
 6. MATERIALES CERÁMICOS 6.1 Estructura de los cerámicos Enlace atómico: parcial o totalmente iónico Iones metálicos: cationes (ceden sus electrones, +), aniones (aceptan electrones, - ). Estructuras cristalinas,
6. MATERIALES CERÁMICOS 6.1 Estructura de los cerámicos Enlace atómico: parcial o totalmente iónico Iones metálicos: cationes (ceden sus electrones, +), aniones (aceptan electrones, - ). Estructuras cristalinas,
MINERALOGÍA TEMA INOSILICATOS. ÍNDICE Piroxenos Anfíboles. Celia Marcos Pascual
 MINERALOGÍA TEMA 27 27-4 INOSILICATOS ÍNDICE 27.4.1 Piroxenos 27.4.2 Anfíboles Los inosilicatos constituyen alrededor del 16% del peso de la corteza terrestre y se caracterizan porque en ellos los tetraedros
MINERALOGÍA TEMA 27 27-4 INOSILICATOS ÍNDICE 27.4.1 Piroxenos 27.4.2 Anfíboles Los inosilicatos constituyen alrededor del 16% del peso de la corteza terrestre y se caracterizan porque en ellos los tetraedros
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto.
 OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
Estructura Interna de los Materiales
 TEMA III Estructura Interna de los Materiales LECCIÓN 3 Estructura Cristalina y Amorfa 1 3.1 ESTADOS DE LA MATERIA Ciencia y Tecnología de los Materiales La materia puede presentarse en tres estados: gaseoso,
TEMA III Estructura Interna de los Materiales LECCIÓN 3 Estructura Cristalina y Amorfa 1 3.1 ESTADOS DE LA MATERIA Ciencia y Tecnología de los Materiales La materia puede presentarse en tres estados: gaseoso,
Profesora: María Antonia Rojas Serrano
 Profesora: María Antonia Rojas Serrano CONCEPTO DE MINERAL Un mineral es un sólido, inorgánico, de origen natural, con estructura interna ordenada y composición química definida. Comprenderemos mejor el
Profesora: María Antonia Rojas Serrano CONCEPTO DE MINERAL Un mineral es un sólido, inorgánico, de origen natural, con estructura interna ordenada y composición química definida. Comprenderemos mejor el
Tema 9. SOLIDOS COVALENTES
 Tema 9. SOLIDOS COVALENTES Introducción Estructuras de no-metales Boro Carbono Fósforo Arsénico, Antimonio y Bismuto Selenio y Telurio Estructuras de óxidos Estructuras basadas en tetraedros Estructuras
Tema 9. SOLIDOS COVALENTES Introducción Estructuras de no-metales Boro Carbono Fósforo Arsénico, Antimonio y Bismuto Selenio y Telurio Estructuras de óxidos Estructuras basadas en tetraedros Estructuras
Sólidos Arreglos y celdas unitarias. Ramón L. Hernández Castillo Enero 2012
 Sólidos Arreglos y celdas unitarias Ramón L. Hernández Castillo Enero 2012 Importancia de estudiar los sólidos cristalinos La mayoría de los compuestos inorgánicos son sólidos Casi todos los elementos
Sólidos Arreglos y celdas unitarias Ramón L. Hernández Castillo Enero 2012 Importancia de estudiar los sólidos cristalinos La mayoría de los compuestos inorgánicos son sólidos Casi todos los elementos
MINERALOGÍA TEMA 27.3 CICLOSILICATOS. ÍNDICE 27.3 Ciclosilicatos. Celia Marcos Pascual
 MINERALOGÍA TEMA 27.3 CICLOSILICATOS ÍNDICE 27.3 Ciclosilicatos 1 Los ciclosilicatos están formados por anillos de tetraedros enlazados, con una relación Si:O = 1:3, pudiendo presentar tres posibles configuraciones
MINERALOGÍA TEMA 27.3 CICLOSILICATOS ÍNDICE 27.3 Ciclosilicatos 1 Los ciclosilicatos están formados por anillos de tetraedros enlazados, con una relación Si:O = 1:3, pudiendo presentar tres posibles configuraciones
Cl Electrones de valencia: Cl: 7 3 = 21 P: 5 Total 26 Tres enlaces sencillos: - 6 Electrones restantes: 20
 ESTRUCTURAS DE LEWIS PARA EL ENLACE COVALENTE.- Lewis sugirió que los átomos comparten electrones para alcanzar la configuración de gas noble y tener así una estructura más estable. Salvo en el caso de
ESTRUCTURAS DE LEWIS PARA EL ENLACE COVALENTE.- Lewis sugirió que los átomos comparten electrones para alcanzar la configuración de gas noble y tener así una estructura más estable. Salvo en el caso de
QUÍMICA. Tema 3. Enlace Químico
 Tema 3. Enlace Químico Índice - Tipos de enlace - Enlace iónico - Enlace covalente - Enlace metálico bjetivos específicos - Que el alumno conozca los principales tipos de enlaces químicos - Que el alumno
Tema 3. Enlace Químico Índice - Tipos de enlace - Enlace iónico - Enlace covalente - Enlace metálico bjetivos específicos - Que el alumno conozca los principales tipos de enlaces químicos - Que el alumno
MATERIALES DE LA CORTEZA TERRESTRE: MINERALES
 MATERIALES DE LA CORTEZA TERRESTRE: MINERALES CONTENIDO Minerales: componentes básicos b de las rocas. Composición n de los minerales. Estructura de los minerales. Propiedades físicas f de los minerales.
MATERIALES DE LA CORTEZA TERRESTRE: MINERALES CONTENIDO Minerales: componentes básicos b de las rocas. Composición n de los minerales. Estructura de los minerales. Propiedades físicas f de los minerales.
UNIDAD 1: LA MATERIA CRISTALINA
 UNIDAD 1: LA MATERIA CRISTALINA CONCEPTOS MATERIA CRISTALINA: Aquella cuyas partículas están perfectamente ordenadas en el espacio, ocupando posiciones fijas y a distancias regulares unas de otras, formando
UNIDAD 1: LA MATERIA CRISTALINA CONCEPTOS MATERIA CRISTALINA: Aquella cuyas partículas están perfectamente ordenadas en el espacio, ocupando posiciones fijas y a distancias regulares unas de otras, formando
Naturaleza del enlace químico Enlace iónico Enlace covalente Enlaces intermoleculares Enlace metálico
 Naturaleza del enlace químico Enlace iónico Enlace covalente Enlaces intermoleculares Enlace metálico Naturaleza del enlace químico Los átomos tienden a adquirir la máxima estabilidad y esto se consigue
Naturaleza del enlace químico Enlace iónico Enlace covalente Enlaces intermoleculares Enlace metálico Naturaleza del enlace químico Los átomos tienden a adquirir la máxima estabilidad y esto se consigue
EL ENLACE QUÍMICO. Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o iones.
 EL ENLACE QUÍMICO CONTENIDOS. 1.- El enlace químico. 1.1. Enlace iónico. Reacciones de ionización. 1.2. Enlace covalente. Modelo de Lewis. 2.- Justificación de la fórmula de los principales compuestos
EL ENLACE QUÍMICO CONTENIDOS. 1.- El enlace químico. 1.1. Enlace iónico. Reacciones de ionización. 1.2. Enlace covalente. Modelo de Lewis. 2.- Justificación de la fórmula de los principales compuestos
Geometría molecular. Solo moléculas covalentes. 1.La geometría molecular se refiere a la organización tridimensional de los átomos en las moléculas.
 Tema 1. Propiedades generales. Geometría molecular. Propiedades generales de los elementos no metálicos. Propiedades generales de los óxidos y de los haluros a lo largo del sistema periódico. Variación
Tema 1. Propiedades generales. Geometría molecular. Propiedades generales de los elementos no metálicos. Propiedades generales de los óxidos y de los haluros a lo largo del sistema periódico. Variación
TEMA 1: ESTRUCTURA INTERNA DE LOS MATERIALES
 PERIODO Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz TEMA 1: ESTRUCTURA INTERNA DE LOS MATERIALES El átomo: Toda la materia está compuesta por átomos y éstos por partículas
PERIODO Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz TEMA 1: ESTRUCTURA INTERNA DE LOS MATERIALES El átomo: Toda la materia está compuesta por átomos y éstos por partículas
Empaquetamiento compacto
 Empaquetamiento compacto Energía y empaquetamiento No denso, empaquetamiento aleatorio Energy Distancia del enlace energía de enlace Denso, empaquetamiento ordenado Energy distancia del enlace r Energía
Empaquetamiento compacto Energía y empaquetamiento No denso, empaquetamiento aleatorio Energy Distancia del enlace energía de enlace Denso, empaquetamiento ordenado Energy distancia del enlace r Energía
Suelos formados por viento (Loess)
 Suelos formados por viento (Loess) Procesos generales de formación de los suelos (continuación). Los elementos más facilmente lixiviables son las sales (carbonatos, cloruros, sulfatos, nitratos, bicarbonatos).
Suelos formados por viento (Loess) Procesos generales de formación de los suelos (continuación). Los elementos más facilmente lixiviables son las sales (carbonatos, cloruros, sulfatos, nitratos, bicarbonatos).
Estructura Cristalina de Sólidos
 Estructura Cristalina de Sólidos Relación entre estructura periódica y propiedades Bibliografía: 1. Solid State Physics. Ashcroft and Mermin. 2. Solid State Chemistry. West. 3. Química del Estado Sólido.
Estructura Cristalina de Sólidos Relación entre estructura periódica y propiedades Bibliografía: 1. Solid State Physics. Ashcroft and Mermin. 2. Solid State Chemistry. West. 3. Química del Estado Sólido.
Enlaces entre átomos:
 Enlaces entre átomos: 1. Enlace químico 2. Formación de enlaces moleculares 3. Orbitales híbridos 4. Fórmula de las moléculas 5. Forma de las moléculas 1 En la naturaleza, los átomos no se encuentran aislados
Enlaces entre átomos: 1. Enlace químico 2. Formación de enlaces moleculares 3. Orbitales híbridos 4. Fórmula de las moléculas 5. Forma de las moléculas 1 En la naturaleza, los átomos no se encuentran aislados
TEMA 2 MINERALES Y ROCAS
 1. CONCEPTOS MINERAL.- Asociación química de elementos inorgánicos. Ej: azufre (S), grafito ( C), calcita (Ca CO 3 ). ROCA.- Asociación de minerales. Ej: mármol (unidades de calcita), granito (cuarzo,
1. CONCEPTOS MINERAL.- Asociación química de elementos inorgánicos. Ej: azufre (S), grafito ( C), calcita (Ca CO 3 ). ROCA.- Asociación de minerales. Ej: mármol (unidades de calcita), granito (cuarzo,
ENLACE QUÍMICO UNIDADES ESTRUCTURALES DE LAS SUSTANCIAS IONES ÁTOMOS MOLÉCULAS ENLACE IÓNICO ENLACE METÁLICO ENLACE COVALENTE ENLACE COVALENTE
 ENLACE QUÍMICO Y TIPOS ENLACE QUÍMICO Enlace químico es la fuerza responsable de la unión entre las unidades estructurales ( iones, átomos o moléculas) que forman la materia. UNIDADES ESTRUCTURALES DE
ENLACE QUÍMICO Y TIPOS ENLACE QUÍMICO Enlace químico es la fuerza responsable de la unión entre las unidades estructurales ( iones, átomos o moléculas) que forman la materia. UNIDADES ESTRUCTURALES DE
Tipos de Enlaces Atómicos y Moleculares
 Tipos de Enlaces Atómicos y Moleculares Enlaces atómicos primarios Iónicos Covalentes Metálicos Enlaces atómicos secundarios y moleculares Dipolos permanentes Dipolos fluctuantes Enlaces Iónicos Grandes
Tipos de Enlaces Atómicos y Moleculares Enlaces atómicos primarios Iónicos Covalentes Metálicos Enlaces atómicos secundarios y moleculares Dipolos permanentes Dipolos fluctuantes Enlaces Iónicos Grandes
Ejercicios tabla periódica. Enlace 4º ESO
 1. a) Indica la configuración electrónica de los átomos de los elementos A, B y C cuyos números atómicos son respectivamente: 12, 17 y 19. b) Escribe la configuración electrónica del ion más estable de
1. a) Indica la configuración electrónica de los átomos de los elementos A, B y C cuyos números atómicos son respectivamente: 12, 17 y 19. b) Escribe la configuración electrónica del ion más estable de
UNIDAD 3. MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES
 UNIDAD 3. MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES 1. GENERALIDADES... Pág. 49 2. ESTRUCTURA INTERNA DE LOS METALES... Pág. 49 2.1. Estructuras cristalinas... Pág. 49 2.2. Estructura cristalina cúbica
UNIDAD 3. MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES 1. GENERALIDADES... Pág. 49 2. ESTRUCTURA INTERNA DE LOS METALES... Pág. 49 2.1. Estructuras cristalinas... Pág. 49 2.2. Estructura cristalina cúbica
Enlaces y Propiedades de Cristales con esos Enlaces
 Enlaces y Propiedades de Cristales con esos Enlaces Enlaces Enlaces Primarios, participan directamente los electrones de valencia. El rol de estos electrones (ser cedidos, compartidos o captados) depende
Enlaces y Propiedades de Cristales con esos Enlaces Enlaces Enlaces Primarios, participan directamente los electrones de valencia. El rol de estos electrones (ser cedidos, compartidos o captados) depende
Tema 1: Sólidos cristalinos Curso 2016/17
 Física del Estado Sólido I Tema 1: Sólidos cristalinos Curso 2016/17 Qué es un cristal? Un cristal ideal está formado por una distribución periódica tridimensional de átomos Desde hace siglos se observó
Física del Estado Sólido I Tema 1: Sólidos cristalinos Curso 2016/17 Qué es un cristal? Un cristal ideal está formado por una distribución periódica tridimensional de átomos Desde hace siglos se observó
UNIDAD 3: EL ENLACE QUÍMICO
 UNIDAD 3: EL ENLACE QUÍMICO 1.- REGLA DEL OCTETO Casi todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las fuerzas que mantienen unidos los átomos en las distintas
UNIDAD 3: EL ENLACE QUÍMICO 1.- REGLA DEL OCTETO Casi todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las fuerzas que mantienen unidos los átomos en las distintas
*GRUPO DE LOS NESOSILICATOS ALUMINICOS:
 NESOSILICATOS-4 *GRUPO DE LOS NESOSILICATOS ALUMINICOS: Andalucita, Sillimanita, Distena o Kianita *CLORITOIDE Magdalena Rodas Introducción De acuerdo a los esquemas de clasificaci n propuestos por ZOLTAI
NESOSILICATOS-4 *GRUPO DE LOS NESOSILICATOS ALUMINICOS: Andalucita, Sillimanita, Distena o Kianita *CLORITOIDE Magdalena Rodas Introducción De acuerdo a los esquemas de clasificaci n propuestos por ZOLTAI
Evaluación unidad 3 Enlace covalente
 CRITERIOS DE EVALUACIÓN 1. Utilizar el modelo de enlace correspondiente para explicar la formación de moléculas, de cristales y estructuras macroscópicas, y deducir sus propiedades. 2. Describir las características
CRITERIOS DE EVALUACIÓN 1. Utilizar el modelo de enlace correspondiente para explicar la formación de moléculas, de cristales y estructuras macroscópicas, y deducir sus propiedades. 2. Describir las características
M A T E R I A L E S ENLACES QUIMICOS
 M A T E R I A L E S ENLACES QUIMICOS I FUERZAS DE ATRACCIÓN Intramoleculares: entre átomos de una molécula Determinan tipo de sustancia y propiedades químicas. Intermoleculares: entre moléculas Determinan
M A T E R I A L E S ENLACES QUIMICOS I FUERZAS DE ATRACCIÓN Intramoleculares: entre átomos de una molécula Determinan tipo de sustancia y propiedades químicas. Intermoleculares: entre moléculas Determinan
QUÍMICA - 2º BACHILLERATO ENLACE QUÍMICO RESUMEN CONCEPTO DE ENLACE QUÍMICO
 Javier Robledano Arillo Química 2º Bachillerato Enlace Químico - 1 QUÍMICA - 2º BACHILLERATO ENLACE QUÍMICO RESUMEN CONCEPTO DE ENLACE QUÍMICO 1. Enlace químico: conjunto de fuerzas que mantienen unidos
Javier Robledano Arillo Química 2º Bachillerato Enlace Químico - 1 QUÍMICA - 2º BACHILLERATO ENLACE QUÍMICO RESUMEN CONCEPTO DE ENLACE QUÍMICO 1. Enlace químico: conjunto de fuerzas que mantienen unidos
Universidad Técnica Nacional
 Universidad Técnica Nacional Química I-CB005 Unidad II Átomos Moléculas e Iones Teoría atómica de Dalton Postulados de la teoría atómica de Dalton: Los elementos están formados por partículas extremadamente
Universidad Técnica Nacional Química I-CB005 Unidad II Átomos Moléculas e Iones Teoría atómica de Dalton Postulados de la teoría atómica de Dalton: Los elementos están formados por partículas extremadamente
Sólidos Covalentes. Tema 4: Estado Sólido. QUIMICA GENERAL Química Inorgánica Sólidos Covalentes
 Sólidos Covalentes Esta obra está licenciada bajo una Licencia Creative Commons Reconocimiento-NoComercial-SinObraDerivada 3.0 España Attribution-NonCommercial-NoDerivs 3.0 Unported CC BY-NC-ND 3.0 http://creativecommons.org/licenses/by-nc-nd/3.0/es/
Sólidos Covalentes Esta obra está licenciada bajo una Licencia Creative Commons Reconocimiento-NoComercial-SinObraDerivada 3.0 España Attribution-NonCommercial-NoDerivs 3.0 Unported CC BY-NC-ND 3.0 http://creativecommons.org/licenses/by-nc-nd/3.0/es/
Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o cristales que son más estables que los átomos por separados..
 ENLACE QUÍMICO Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o cristales que son más estables que los átomos por separados.. Son de tipo eléctrico. Al formarse un enlace
ENLACE QUÍMICO Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o cristales que son más estables que los átomos por separados.. Son de tipo eléctrico. Al formarse un enlace
GEOLOGÍA: TEMA 3. Dinámica del planeta Tierra: Procesos formadores de rocas. Clasificación n de los principales tipos de minerales y rocas.
 GEOLOGÍA: TEMA 3. Dinámica del planeta Tierra: ciclos endógeno y exógeno. Procesos formadores de rocas. Clasificación n de los principales tipos de minerales y rocas. Dinámica del Planeta Tierra Ciclos
GEOLOGÍA: TEMA 3. Dinámica del planeta Tierra: ciclos endógeno y exógeno. Procesos formadores de rocas. Clasificación n de los principales tipos de minerales y rocas. Dinámica del Planeta Tierra Ciclos
Unidad 1 (Parte III 1.1.2) Objetivo de la presentación: Repasar conceptos de Química General que son fundamentales para Química Orgánica
 Unidad 1 (Parte III 1.1.2) Objetivo de la presentación: Repasar conceptos de Química General que son fundamentales para Química Orgánica Lic. Walter de la Roca 1 Formas de los orbitales: Forma en el espacio
Unidad 1 (Parte III 1.1.2) Objetivo de la presentación: Repasar conceptos de Química General que son fundamentales para Química Orgánica Lic. Walter de la Roca 1 Formas de los orbitales: Forma en el espacio
TEMA 4: EL ENLACE QUÍMICO
 TEMA 4: EL ENLACE QUÍMICO 1. QUÉ ES EL ENLACE QUÍMICO? Todas las sustancias que existen en la naturaleza están formadas por átomos de elementos químicos. Generalmente estos átomos no se encuentran aislados,
TEMA 4: EL ENLACE QUÍMICO 1. QUÉ ES EL ENLACE QUÍMICO? Todas las sustancias que existen en la naturaleza están formadas por átomos de elementos químicos. Generalmente estos átomos no se encuentran aislados,
Tema 3. (Parte 1) Enlace químico y propiedades de las sustancias
 Tema 3. (Parte 1) Enlace químico y propiedades de las sustancias ÍNDICE 3.1. Enlace y estabilidad energética 3.2. Enlace iónico Energía de red Ciclo de Born-Haber Propiedades de las sustancias iónicas
Tema 3. (Parte 1) Enlace químico y propiedades de las sustancias ÍNDICE 3.1. Enlace y estabilidad energética 3.2. Enlace iónico Energía de red Ciclo de Born-Haber Propiedades de las sustancias iónicas
ENLACE QUÍMICO. NaCl. Grafito: láminas de átomos de carbono
 NaCl Grafito: láminas de átomos de carbono Se denomina enlace químico al conjunto de fuerzas que mantienen unidos los átomos cuando forman moléculas o cristales, así como las fuerzas que mantienen unidas
NaCl Grafito: láminas de átomos de carbono Se denomina enlace químico al conjunto de fuerzas que mantienen unidos los átomos cuando forman moléculas o cristales, así como las fuerzas que mantienen unidas
CONDICIONES DE VITRIFICACION
 CONDICIONES DE VITRIFICACION No todos les materiales presentan estructura vítrea y el efecto de transición vítrea! Aun enfriando rapidamente! - un vidrio requiere de una cantidad razonable de SiO2 y/o
CONDICIONES DE VITRIFICACION No todos les materiales presentan estructura vítrea y el efecto de transición vítrea! Aun enfriando rapidamente! - un vidrio requiere de una cantidad razonable de SiO2 y/o
Electrón: LAS PARTÍCULAS SUBATÓMICAS. Electrón: e - Carga eléctrica: 1,602x10-19 C Masa: 9,109x10-31 C
 ENLACE QUÍMICO 1. Repaso de los Conceptos Básicos: Las partículas del átomo: Electrón, Protón y neutrón Número atómico, número másico, Isótopos 2. Modelos atómicos: Repaso de los modelos atómicos Modelo
ENLACE QUÍMICO 1. Repaso de los Conceptos Básicos: Las partículas del átomo: Electrón, Protón y neutrón Número atómico, número másico, Isótopos 2. Modelos atómicos: Repaso de los modelos atómicos Modelo
ENLACES QUÍMICOS. Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos.
 1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
TECTOSILICATOS 5 FELDESPATOIDES. M. Rodas
 TECTOSILICATOS 5 FELDESPATOIDES M. Rodas Son un grupo de aluminosilicatos de Na, K y, menos frecuentemente, Ca, que aparecen en lugar de los feldespatos en magmas alcalinos subsaturados en sílice. Introducción:
TECTOSILICATOS 5 FELDESPATOIDES M. Rodas Son un grupo de aluminosilicatos de Na, K y, menos frecuentemente, Ca, que aparecen en lugar de los feldespatos en magmas alcalinos subsaturados en sílice. Introducción:
2. Teoría del enlace de valencia o teoría de deslocalización
 Los metales constituyen una extensa clase de sustancias que abarca cerca del ochenta por ciento de todos los elementos químicos conocidos. Tienen unas propiedades comunes que los caracterizan y que se
Los metales constituyen una extensa clase de sustancias que abarca cerca del ochenta por ciento de todos los elementos químicos conocidos. Tienen unas propiedades comunes que los caracterizan y que se
Unidad 3. Átomos y moléculas
 Unidad 3. Átomos y moléculas Índice de contenido 1. Elementos y compuestos...2 1.1. Teoría atómica de Dalton...2 2.-El átomo...3 3.-Número atómico y número másico...4 4.-Isótopos, unidad de masa atómica
Unidad 3. Átomos y moléculas Índice de contenido 1. Elementos y compuestos...2 1.1. Teoría atómica de Dalton...2 2.-El átomo...3 3.-Número atómico y número másico...4 4.-Isótopos, unidad de masa atómica
Estructuras Cristalinas. Julio Alberto Aguilar Schafer
 Estructuras Cristalinas Julio Alberto Aguilar Schafer Modelo del estado líquido los metales Modelo del paso del estado líquido al estado sólido de los metales Equilibrio líquido-vapor Presión de vapor
Estructuras Cristalinas Julio Alberto Aguilar Schafer Modelo del estado líquido los metales Modelo del paso del estado líquido al estado sólido de los metales Equilibrio líquido-vapor Presión de vapor
SOLUCIONARIO Guía Técnico Profesional
 SOLUCIONARIO Guía Técnico Profesional El enlace químico SGUICTC004TC33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 A Comprensión 4 A Comprensión 5 C Comprensión 6 D Aplicación 7
SOLUCIONARIO Guía Técnico Profesional El enlace químico SGUICTC004TC33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 A Comprensión 4 A Comprensión 5 C Comprensión 6 D Aplicación 7
Enlace Químico. Química General I 2012
 Enlace Químico Química General I 2012 Los electrones de valencia son los electrones del último orbital en un átomo, son los causantes de los enlaces químicos. Grupo e - configuración # de valencia 1A ns
Enlace Químico Química General I 2012 Los electrones de valencia son los electrones del último orbital en un átomo, son los causantes de los enlaces químicos. Grupo e - configuración # de valencia 1A ns
Los enlaces químicos son fuerzas que mantienen unidos a los átomos para formar compuestos moleculares o cristales.
 ENLACES Los enlaces químicos son fuerzas que mantienen unidos a los átomos para formar compuestos moleculares o cristales Enlaces Iónicos electrovalentes o polares Enlaces covalentes o no polar Enlace
ENLACES Los enlaces químicos son fuerzas que mantienen unidos a los átomos para formar compuestos moleculares o cristales Enlaces Iónicos electrovalentes o polares Enlaces covalentes o no polar Enlace
APLICA LO APRENDIDO. 1. Relaciona la columna de la izquierda con la derecha:
 APLICA LO APRENDIDO 1. Relaciona la columna de la izquierda con la derecha: a) Agrupo los elementos en triadas ( ) Lavoisier b) Clasificó los elementos en metales ( ) Dumas y no metales. c) Enunció la
APLICA LO APRENDIDO 1. Relaciona la columna de la izquierda con la derecha: a) Agrupo los elementos en triadas ( ) Lavoisier b) Clasificó los elementos en metales ( ) Dumas y no metales. c) Enunció la
Física Cuántica. Sólidos II. Requerimientos previos. José Manuel López y Luis Enrique González. Universidad de Valladolid. Curso p.
 Física Cuántica Sólidos II. Requerimientos previos. José Manuel López y Luis Enrique González Universidad de Valladolid Curso 2004-2005 p. 1/20 Red cristalina El primer dibujo de un cristal apareció en
Física Cuántica Sólidos II. Requerimientos previos. José Manuel López y Luis Enrique González Universidad de Valladolid Curso 2004-2005 p. 1/20 Red cristalina El primer dibujo de un cristal apareció en
Las especies químicas (átomos, moléculas, iones..) se unen para formar otras especies químicas con menor contenido energético, es decir más estables.
 TEMA 3. ENLACE QUÍMICO Las especies químicas (átomos, moléculas, iones..) se unen para formar otras especies químicas con menor contenido energético, es decir más estables. Para explicar el enlace químico,
TEMA 3. ENLACE QUÍMICO Las especies químicas (átomos, moléculas, iones..) se unen para formar otras especies químicas con menor contenido energético, es decir más estables. Para explicar el enlace químico,
EJERCICIOS RESUELTOS DE ENLACE QUIMICO
 EJERCICIOS RESUELTOS DE ENLACE QUIMICO 1. a) Qué tipo de enlace presenta el compuesto formado por F y Ca? b) Formule dicho compuesto a) Considerando los números atómicos del F (Z=9) y el Ca (Z=20) se desarrollan
EJERCICIOS RESUELTOS DE ENLACE QUIMICO 1. a) Qué tipo de enlace presenta el compuesto formado por F y Ca? b) Formule dicho compuesto a) Considerando los números atómicos del F (Z=9) y el Ca (Z=20) se desarrollan
Fisica de Celdas Fotovoltaicas. Parte I: Conceptos Previos
 Fisica de Celdas Fotovoltaicas Parte I: Conceptos Previos José L. Solis Universidad Nacional de Ingenieria Instituto Peruano de Energia Nuclear Materiales Semiconductores Los Semiconductores son un grupo
Fisica de Celdas Fotovoltaicas Parte I: Conceptos Previos José L. Solis Universidad Nacional de Ingenieria Instituto Peruano de Energia Nuclear Materiales Semiconductores Los Semiconductores son un grupo
Enlace químico Educación Secundaria Obligatoria Física y Química
 EL ENLACE QUÍMICO Hay tres maneras en que se unen los átomos: enlace iónico, enlace covalente y enlace metálico. Los enlaces entre átomos se producen porque éstos quieren cumplir la regla del octeto. La
EL ENLACE QUÍMICO Hay tres maneras en que se unen los átomos: enlace iónico, enlace covalente y enlace metálico. Los enlaces entre átomos se producen porque éstos quieren cumplir la regla del octeto. La
ENLACE COVALENTE. Z = 1 Hidrógeno H: 1s 1 Z = 6 Carbono C: 1s 2 2s 2 2p 2 Z = 7 Nitrógeno N: 1s 2 2s 2 2p 3 Z = 8 Oxígeno O: 1s 2 2s 2 2p 4 H H H 2
 ENLACE COVALENTE Si los átomos que se enfrentan son ambos electronegativos (no metales), ninguno de los dos cederá electrones. Una manera de adquirir la configuración de gas noble en su última capa es
ENLACE COVALENTE Si los átomos que se enfrentan son ambos electronegativos (no metales), ninguno de los dos cederá electrones. Una manera de adquirir la configuración de gas noble en su última capa es
10/11/2016 EL ENLACE QUÍMICO
 EL ENLACE QUÍMICO Por qué se unen los átomos? Los átomos, moléculas e iones y se unen entre sí porque al hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad
EL ENLACE QUÍMICO Por qué se unen los átomos? Los átomos, moléculas e iones y se unen entre sí porque al hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad
Coloides. Eduardo Martínez H
 Coloides Los coloides son dispersiones de pequeñas partículas de un material en otro de un diámetro aproximadamente igual o menor que 500 nm (aproximadamente la longitud de onda de la luz). Eduardo Martínez
Coloides Los coloides son dispersiones de pequeñas partículas de un material en otro de un diámetro aproximadamente igual o menor que 500 nm (aproximadamente la longitud de onda de la luz). Eduardo Martínez
Minerales. Joseline Tapia 1. Primavera Universidad de Antofagasta. 1 Departamento de Ingeniería de Minas
 Minerales Joseline Tapia 1 1 Departamento de Ingeniería de Minas Universidad de Antofagasta Primavera 2015 joseline.tapia@uantof.cl (UA) Minerales 02 2015 1 / 47 Resumen de la presentación 1 Introducción
Minerales Joseline Tapia 1 1 Departamento de Ingeniería de Minas Universidad de Antofagasta Primavera 2015 joseline.tapia@uantof.cl (UA) Minerales 02 2015 1 / 47 Resumen de la presentación 1 Introducción
Química Inorgánica Bloque d 1. BLOQUE d
 Química Inorgánica Bloque d 1 BLOQUE d Los elementos del bloque d están ubicados entre los grupos 2 y 13 de la tabla periódica y se los suele llamar metales de transición. elemento de transición: es un
Química Inorgánica Bloque d 1 BLOQUE d Los elementos del bloque d están ubicados entre los grupos 2 y 13 de la tabla periódica y se los suele llamar metales de transición. elemento de transición: es un
Enlaces. Parte 1. Enlaces Primarios. Enlace Metálico. Caso 1: Elemento E+ (Metal) Puro (Aleaciones: después) Enlace Metálico y Cristal Metálico
 Enlaces Parte 1. Enlaces Primarios Parte 2. Secundarios Parte 1. Enlaces Primarios Compuestos de algunos elementos en función de la electronegatividad. Na (Z=11): 0,9 Al (Z=13): 1,5 Cu (Z=29): 1,9 H (Z=1):
Enlaces Parte 1. Enlaces Primarios Parte 2. Secundarios Parte 1. Enlaces Primarios Compuestos de algunos elementos en función de la electronegatividad. Na (Z=11): 0,9 Al (Z=13): 1,5 Cu (Z=29): 1,9 H (Z=1):
FILOSILICATOS 4 Micas M. RODAS
 FILOSILICATOS 4 Micas M. RODAS MINERALES 2/1 1T+1 O + 1T = 7 Å carga eléctrica de la hoja 0 1T+1 O + 1T+ Esp. int.= 9 Å Pirofilita Talco carga eléctrica de la hoja: 0,2-0,6 0,6 1T+1 O+1T+ Esp. int.= 10
FILOSILICATOS 4 Micas M. RODAS MINERALES 2/1 1T+1 O + 1T = 7 Å carga eléctrica de la hoja 0 1T+1 O + 1T+ Esp. int.= 9 Å Pirofilita Talco carga eléctrica de la hoja: 0,2-0,6 0,6 1T+1 O+1T+ Esp. int.= 10
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
