MEDIDAS DE CONCENTRACIÓN
|
|
|
- Sebastián Coronel Ponce
- hace 7 años
- Vistas:
Transcripción
1 PROBLEMAS RESUELTOS MEDIDAS DE CONCENTRACIÓN FICHA 1 El ácido nítrico se vende en unas botellas de color topacio cuya etiqueta indica: HNO 3, 64 % de riqueza y densidad 1,45 g/ml. Calcula la concentración de este ácido nítrico expresada como molaridad, molalidad y fracción molar de soluto. Como la concentración es una magnitud intensiva, utilizaremos como base de cálculo una cantidad cualquiera del ácido nítrico comercial, por ejemplo, 1 L. Determinamos los moles de HNO 3 que hay en 1 L del producto comercial: m d = & m = d? V V La masa de 1 L del producto comercial: g m = 145,? 1000 ml = 1450 gdehno3 comercial ml 64 gdehno3 puro 1450 gdehno3 comercial? = 928 gdehno3 puro 100 gdehno comercial Expresamos esta cantidad en moles: M (HNO 3 ) = 1, , ,00 3 = 63,02 g/mol 928 gdehno 3 1 mol dehno 63, 02 gdehno = 14, 73 mol de HNO Ya hemos supuesto un volumen de V D = 1L: n 14,73mol de HNO3 M = = = 14,73 M V 1L D Obtenemos la masa de disolvente: m disolvente = 1450 g 928 g = 522 g & m = n 14,73 g = m (kg) disolvente 0,522 kg = Obtenemos los moles de disolvente: M (H 2 O) = 1, ,00 = 18,02 g/mol 3 28,21 m 1mol de HO 2 ns 14, 73 n = 522 gdeh2o? = 2897, mol de HO 2 & xs = = = 0,337 18, 02 gdeh O n + n 14, , 97 2 s d ACTIVIDADES 1 Qué cantidad de Na 2 SO 4 del 85 % se necesita para preparar 500 ml de disolución 1,25 M? Solución: 104,6 g 2 Qué cantidad de disolución 1,25 M en Na 2 SO 4 debemos coger para tener 0,15 g de ion sodio? Solución: 2,6 ml 3 Qué cantidad de H 2 SO 4 del 98 % de riqueza y 1,8 g/ml de densidad necesitamos para preparar 250 ml de disolución 0,8 M? Solución: 11,12 ml 4 Qué cantidad de disolución 2,5 M de HCl podremos preparar, como máximo, si tenemos 15 ml de HCl del 37 % de riqueza y 1,18 g/ml de densidad? Solución: 71 ml 5 La densidad del agua de mar es 1,03 g/ml. Calcula la riqueza en sal del agua de mar suponiendo que es una disolución de NaCl en agua y que al disolver NaCl en agua, el volumen no varía. Solución: 2,9 % 6 Aunque se considera que las espinacas son un alimento muy rico en hierro, solo tienen 4 mg de este elemento por cada 100 g de espinacas. Además, el organismo humano solo absorbe el 10 % del hierro que consume a través de este vegetal. La cantidad diaria recomendada (CDR) de hierro para un adulto es 14 mg. Calcula la cantidad de espinacas que debería tomar una persona adulta para tener todo el hierro que necesita, suponiendo que este es el único alimento que ingiere con hierro. Solución: 3500 g 103
2 PROBLEMAS RESUELTOS MEDIDAS DE CONCENTRACIÓN FICHA 2 Indica cuál será la concentración molar de la disolución que resulta de mezclar 10 ml de un ácido clorhídrico del 37 % de riqueza y 1,18 g/ml de densidad con 80 ml de disolución 1,5 M en ácido clorhídrico. Se supone que los volúmenes son aditivos. Necesitamos calcular los moles de HCl que proceden de las dos disoluciones que mezclamos: En 10 ml de un ácido clorhídrico del 37 % de riqueza y 1,18 g/ml de densidad: m g d = & m = d? V = 118,? 10 ml = 118, gdehcl comercial V ml 37 g de HCl puro 11, 8 gdehcl comercial? = 437, gdehcl puro 100 gde HClcomercial Expresamos esta cantidad en moles: M (HCl) = 1, ,45 = 36,46 g/mol n 1mol dehcl M = & n = 437gde, HCl? = 0,12 mol dehcl V 36,46 gde HCl En 80 ml de disolución 1,5 M en ácido clorhídrico: n M = & n = M? V = 1,5 mol/l 0,08 L = 0,12 mol de HCl V En la mezcla: n M = = V 0,12 mol+ 0,12 mol = 0,01 L+ 0,08 L 2,66 M ACTIVIDADES 1 En una experiencia se han mezclado 30 ml de una disolución Na 2 SO 4 0,5 M, con 60 ml de NaOH 2 M. Calcula la concentración de los iones sodio en la disolución. Dato: se supone que los volúmenes son aditivos. Solución: 1,67 M 2 Tenemos 500 g de una disolución de NaCl en agua al 10%. Qué cantidad tendremos que añadir, y de qué sustancia, para tener una disolución de NaCl al 20%? Solución: 62,5 g de NaCl 3 Tenemos 100 ml de una disolución al 40% de alcohol en agua. a) Cuál será la concentración si añadimos otros 100 ml de agua? b) Y si hubiésemos añadido otros 40 ml de alcohol? Dato: suponemos que los volúmenes son aditivos. Solución: a) 20 %; b) 57,14 % 4 Mezclamos 60 ml de una disolución 0,5 M de glucosa, C 6 H 12 O 6, en agua con 40 ml de disolución 1,5 M de sal, NaCl, en agua. Calcula la concentración de la glucosa y la sal en la mezcla. Suponemos que los volúmenes son aditivos. Solución: 0,3 M y 0,6 M 5 Tenemos 200 ml de una disolución de H 2 SO 4 1 M. Cuál será la concentración si le añadimos 100 ml de agua? Suponemos que los volúmenes son aditivos. Solución: 0,67 M 6 Tenemos 200 ml de una disolución de H 2 SO 4 1 M. Cuál será la concentración si le añadimos 5 ml de H 2 SO 4 comercial del 98 % de riqueza y 1,85 g/ml de densidad? Suponemos que los volúmenes son aditivos. Solución: 1,43 M 104
3 PROBLEMAS RESUELTOS PROPIEDADES COLIGATIVAS FICHA 3 La urea es una sustancia que se obtiene en la orina y en las heces como resultado del metabolismo de las proteínas. Es un sólido blanco y cristalino que también se fabrica artificialmente y es un producto de gran utilidad industrial con finalidades muy diversas que van desde fabricar fertilizantes hasta cola para madera. Cuando se prepara una disolución al 18,5 % de urea en agua a 25 C se obtiene una disolución cuya presión de vapor es 22,24 mm Hg. Calcula: a) La masa molar de la urea. b) La temperatura a la que congela la disolución. c) La presión osmótica de la disolución resultante. Datos: Presión de vapor del agua a 25 C, p 0 = 23,76 mm de Hg; K c agua = 1,86 C kg/mol; Densidad disolución = 1 g/ml. a) De acuerdo con la ley de Raoult: Dp = p? x & x = 0 s s Dp p 0 Puesto que la fracción molar es una magnitud intensiva, tomamos como base una determinada cantidad de disolución y hacemos los cálculos con relación a ella. Trabajamos con 100 g de disolución: Masa de agua = 100 g - 18,5 g = 81,5 g Para calcular el número de moles del agua: M (H 2 O) = 1, ,00 = 18,02 g/mol & 1mol deagua nd = 81, 5 gdeagua? 18, 02 gdeagua = 4,52 mol de agua D p = p - p = 23, 76 mm de Hg - 22, 24 mm de Hg = 152, mm de Hg 0 Dp 1,52 mm de Hg = = = 0,06397 p 23,76 mm de Hg x s 0 ns xs , = & ns =? nd =? 4,52 mol de agua = 0,3092mol de urea n + n 1 - x 0, x s d s Murea ( ) s ms 18,5 g de urea = = = n 0,3092mol de urea s g 59,84 mol n C? kg 0,31 mol b) D t = Kc? m = Kc? = 186,? = 7, 1 C -3 m (kg) disolvente mol 81,5? 10 kg La temperatura a la que congela la disolución es: t = t 0 - Dt = 0-7,1 C = -7,1 C.. g 60 mol n n n? d c) p = M? R? T =? R? T =? R? T =? R? T V m m d g 0,3092mol de urea? 1000 L atm? L p =? 0,082? ( ) K= 75,556 atm. 75,6 atm 100 g mol? K ACTIVIDADES 1 La presión osmótica del plasma sanguíneo es de unas 7,63 atmósferas. Indica cómo prepararás 3 L de suero glucosado que sea adecuado para administrar a un paciente. Datos: glucosa: C 6 H 12 O 6 ; temperatura de la habitación: 20 C. Solución: Disolver 171,58 g de glucosa en agua hasta tener 3 L. 2 La heparina es un anticoagulante que se aplica a los pacientes con riesgo de sufrir trombosis. Para determinar su masa molar se prepara una disolución de 8 g de heparina en 100 ml de alcohol isopropílico y se comprueba que, a 25 C, ejerce una presión osmótica de 75 mm de Hg. Cuánto vale su masa molar? Solución: M = g/mol. 105
4 MÁS PROBLEMAS COMPONENTES DE UNA DISOLUCIÓN FICHA 1 Generalmente las mezclas se pueden clasificar en homogéneas y heterogéneas; según sus componentes se puedan o no separar por métodos físicos (filtración o decantación) y distinguir a simple vista o con ayuda de un microscopio ordinario. Pero en realidad, no existe una división bien definida entre ambos tipos de mezcla. Existen sustancias materiales intermedias, como las mezclas coloidales y las suspensiones. Una forma de clasificar a las mezclas, es atenvdiendo a los diferentes tamaños de las partículas que las forman. Mezcla Mezcla homogénea Mezcla coloidal Suspensión Mezcla heterogénea Tamaño de sus partículas # 10-9 m 10-9 m 10-7 m m $ 10-7 m En la mezcla coloidal no se habla de soluto y disolvente, sino que se distingue el componente disperso (fase dispersa), que se encuentra en menor proporción, y el medio de dispersión, componente en el que se encuentran dispersos el resto de componentes de la mezcla. Las partículas de la fase dispersa son grandes agregados de moléculas llamados micelas. Por ejemplo, cada micela de azufre en estado coloidal está formada por unas 1000 moléculas de azufre. Constituyen un grupo importante de sustancias; Disolvente Disolución Disolución coloidal la mayoría de los tejidos y líquidos orgánicos son de naturaleza coloidal: leche, hemoglobina de la sangre, pinturas, nubes, humos. Los coloides se caracterizan porque dispersan la luz en todas direcciones (Efecto Tyndall); por eso su aspecto suele ser turbio. Si se hace pasar un rayo de luz a través de un coloide, el rayo es dispersado y su trayectoria se hace visible. No se observa dicha dispersión con las disoluciones comunes porque las partículas del soluto son demasiado pequeñas para interactuar con la luz visible y producir la dispersión (reflexión y refracción) de la luz. El término de suspensión se reserva para las mezclas en las que el componente disperso se encuentra dentro del medio de dispersión y se puede separar fácilmente por filtración o decantación. Existen ocho tipos distintos de mezclas coloidales basadas en el estado físico de sus componentes: Soluto Suspensión Medio de dispersión Fase dispersa Nombre Ejemplos Sólido Sólido Sol sólido Aleaciones como el acero Sólido Líquido Gel Gelatina, mantequilla Sólido Gas Espuma Espumas plásticas Líquido Sólido Sol Pinturas, tintas, cola, gomas Líquido Líquido Emulsión Mahonesa Líquido Gas Espuma Espuma, nata batida Gas Sólido Aerosol Humo, polvo en aire, smog Gas Líquido Aerosol Nieblas, nubes, brumas 106
5 MÁS PROBLEMAS COMPONENTES DE UNA DISOLUCIÓN FICHA 1 PROBLEMAS PROPUESTOS 1 Por qué en la clasificación de mezclas coloidales no aparece la combinación gas-gas? 2 Qué es una emulsión? Escribe algunos ejemplos. 3 Consulta los constituyentes existentes en la leche y basándote en ello clasifica a la leche como una disolución o como una emulsión. 4 En qué consiste el smog industrial? Indica si es una mezcla coloidal y, en caso afirmativo, cuál es el medio de dispersión y cuál el componente disperso. 5 Los coloides pueden parecer disoluciones, ya que también son mezclas homogéneas Cómo puede distinguirse una disolución de un coloide? 107
6 MÁS PROBLEMAS LA CONCENTRACIÓN DE LAS DISOLUCIONES FICHA 2 La unidad de concentración empleada para determinar la presencia de elementos en pequeñas cantidades (trazas) en una mezcla es la de ppm o partes por millón. Por ejemplo, se utiliza para expresar la concentración de contaminantes (plomo, cromo, cadmio, mercurio, nitratos, etc.) disueltos en agua. Se define como las partes de soluto contenidas en un millón de partes de disolución. Puede referirse tanto a masa, en el caso de sólidos, como en volumen, en el caso de líquidos o gases. Por ejemplo: g soluto/m 3 de disolución, mg soluto/l de disolución, g soluto/tonelada disolución. EJEMPLO Para preparar el remedio homeopático que denominan natrum muriaticum (conocida químicamente como cloruro de sodio y vulgarmente como sal común) se utiliza un proceso de dilución secuencial, por el que el principio activo es diluido centesimalmente (1:100) quince veces en agua como disolvente. Para ello se parte de una disolución al 10 % en peso, que se obtiene disolviendo 10 g de cloruro de sodio en 90 g de agua, como la masa molecular de la sal es 58,5 g/mol, contendrá 0,17 mol y moléculas de soluto. a) Es correcto hablar de moléculas de cloruro de sodio? Al ser un compuesto iónico que se disocia totalmente en agua, tendríamos que hablar más exactamente de cationes sodio Na 1+ y aniones cloruro Cl 1-. b) Si tomas con una pipeta, 1 ml de esta disolución inicial al 10 % en peso y añades 99 ml de agua (una dilución centesimal), cual será la nueva concentración? Cuántas moléculas de soluto se encontrarán en la disolución? La concentración resultante será de 10-3 g/ml (0,1 g de soluto en 100 ml de disolución), lo que es lo mismo un 0,1 % peso/volumen y una molaridad de 1, que corresponde con moléculas de soluto (realmente iones Na + y iones Cl - ). c) Las partes por millón indican las partes (g o ml) de soluto que se encuentran disueltas en 10 6 partes (g o ml ) de disolución. Cuál será la concentración de la disolución anterior en partes por millón? Un 1 % (1/100) equivale a ppm (10 4 /10 6 ). Como la disolución tiene una concentración de 0,1 %, expresada en partes por millón será de 1000 ppm. PROBLEMAS PROPUESTOS 6 Si repetimos el procedimiento descrito en el ejercicio anterior hasta realizar un total de quince diluciones centesimales consecutivas, cuál será la concentración y el número de moléculas en cada una de las diluciones sucesivas? a) Completa la tabla de concentraciones y número de moléculas (pares de iones) del principio activo (soluto). b) El límite de dilución se alcanza cuando solo queda una molécula de la supuesta medicina. En qué paso de la dilución se alcanza el límite de dilución? c) Realiza una gráfica representando el número de moléculas del soluto frente al número de diluciones. d) A la vista de tus resultados, crees que las teorías de la homeopatía están basadas en hechos científicos y de que sus preparados pueden considerarse medicamentos? e) Cómo explicar entonces los casos en que los preparados homeopáticos parecen ser eficaces? 108
7 MÁS PROBLEMAS LA CONCENTRACIÓN DE LAS DISOLUCIONES FICHA 2 a) Dilución Concentración (g /ml) % P/V (peso/volumen) Molaridad (mol/l) Moléculas principio activo (soluto) 1. a 2. a 3. a 4. a 5. a 6. a 7. a 8. a 9. a 10. a 11. a 12. a 13. a 14. a 15. a b) c) n. de moléculas n. de diluciones d) e) 109
8 MÁS PROBLEMAS LA SOLUBILIDAD FICHA 3 EJEMPLO En una experiencia de laboratorio se determina la máxima cantidad de nitrato de potasio que se puede disolver en 100 g de agua a diferentes temperaturas. Los resultados ordenados se indican en la tabla de datos: Masa KNO 3 (g ) Temperatura ( C ) a) Representa la gráfica de masa de nitrato de potasio frente a la temperatura. Qué relación existe entre ambas magnitudes? b) Deduce, utilizando la gráfica, la solubilidad del nitrato de potasio a 25 C y a 85 C c) Si añadimos 500 g de KNO 3 en agua hirviendo hasta saturación, cuántos gramos se podrán disolver? d) Si a continuación se deja enfriar la disolución hasta 30 C y se filtra para separar los cristales formados, qué cantidad de nitrato de potasio cristaliza? a) En este caso, al igual que en la mayoría de solutos sólidos, la solubilidad en líquidos aumenta con la temperatura, aunque no de manera proporcional ni de igual forma. Masa (g) T ( C) b) La solubilidad del nitrato a 25 C es, aproximadamente, de 39 g/100 g H 2 O; y a 85 C, de 180 g/100 g de H 2 O. c) A la temperatura de 100 C la máxima cantidad de nitrato que se puede disolver es de 246 g. El resto, 500 g g = 254 g, quedará sin disolver en el recipiente. d) Si la disolución contenía 246 g de nitrato de potasio a 100 C y se deja enfriar hasta 30 C, en que la solubilidad es de 46 g, la diferencia entre ambas cantidades cristaliza: 246 g - 46 g = 200 g. 110
9 MÁS PROBLEMAS LA SOLUBILIDAD FICHA 3 PROBLEMAS PROPUESTOS 7 La cristalización fraccionada es un método de separación de sustancias basado en la diferente solubilidad de los componentes que forman una mezcla. Para purificar una muestra de 90 g de nitrato de potasio contaminada con 10 g de cloruro de sodio, se disuelve la mezcla en 100 g de agua a 60 C y, a continuación, la disolución se enfría de manera gradual hasta 0 C. Consulta los datos de solubilidad del KNO3 y del NaCl y responde razonadamente. Datos de solubilidad del NaCl: (0 C, 34 g/100 g de H 2 O); (60 C, 38 g/100 g de H 2 O). a) Qué le ocurre al nitrato de potasio de la disolución? b) Qué cantidad de nitrato de potasio se separa de la disolución? c) Qué sucede con el cloruro de sodio? d) Qué porcentaje de la cantidad original de nitrato de potasio se puede obtener por este procedimiento? e) Muchos de los compuestos sólidos, inorgánicos y orgánicos, que se utilizan en el laboratorio se purifican mediante la cristalización fraccionada. Qué condiciones deben cumplir los compuestos que se quieren purificar mediante este sistema? a) b) c) d) e) 111
10 MÁS PROBLEMAS PROPIEDADES COLIGATIVAS FICHA 4 PROBLEMAS PROPUESTOS 8 Determina si cada una de las frases es verdadera o falsa. Justifica tu respuesta. a) La superficie libre de un líquido es una barrera infranqueable para las partículas que forman parte del líquido hasta que todas tengan energía suficiente para pasar a estado gaseoso. b) En el equilibrio del número de partículas en fase gaseosa que cambian a fase líquida es el mismo que el número de partículas que pasan de fase líquida a gaseosa. c) La presión de vapor es la presión que ejercen las partículas en fase gaseosa procedentes de un líquido. d) Al añadir un soluto no volatil aumenta la presión de vapor del disolvente. 9 La presión de vapor del benceno, C 6 H 6, es de 9,98 kpa a 25 C. Qué presión de vapor corresponderá a la disolución de 10 g de glucosa, C 6 H 12 O 6, en 50 g de benceno? 10 Determina si cada una de las frases es verdadera o falsa. Justifica tu respuesta. a) Al subir la temperatura de un líquido entonces aumenta la presión de vapor. b) En una disolución con soluto no volatil disminuye la presión de vapor entonces disminuye también la temperatura del punto de ebullición. c) Al congelarse las partículas del disolvente pasan a estado sólido, las partíclas del soluto presentes dificultan que encajen unas con otras por eso el punto de congelación disminuye. d) La variación de temperatura es directamente proporcional a la morlaridad de la disolución. 112
11 MÁS PROBLEMAS PROPIEDADES COLIGATIVAS FICHA 4 PROBLEMAS PROPUESTOS 11 Tenemos 10 g de alcohol etílico, C 2 H 6 O, disueltos en 500 g de agua. Qué temperatura de fusión y ebullición tendrá la disolución? Datos: T f = 0 C; T e = 100 C; K c = 1,86 C? kg/mol; K e = 0,51 C? kg/mol. 12 Determina si cada una de las frases es verdadera o falsa. Justifica tu respuesta. a) La ósmosis se produce cuando dos disoluciones de distinta concentración están separadas por una membrana impermeable. b) Las partículas de soluto, al chocar contra la membrana, ejercen una presión que no se da en la parte donde solo hay disolvente. Para equilibrar esta presión pasan partículas tanto del disolvente como del soluto a través de la membrana. c) En el cálculo de la presión osmótica se supone que las partículas del soluto se comportan en el seno del disolvente como las particulas de un gas ideal en el vacío. 13 El suero fisiológico tiene una presión osmótica de 7,7 atm a 37 C. Se puede inyectar a una persona un suero glucosado preparado añadiuendo 20 g de glucosa, C 6 H 12 O 6, en agua destilada hasta tener un volumen de 200 ml? Explica por qué. Dato: R = 0,082 (atm? L)/(mol? K). 113
12 MÁS PROBLEMAS (Soluciones) COMPONENTES DE UNA DISOLUCIÓN FICHA 1 Generalmente las mezclas se pueden clasificar en homogéneas y heterogéneas; según sus componentes se puedan o no separar por métodos físicos (filtración o decantación) y distinguir a simple vista o con ayuda de un microscopio ordinario. Pero en realidad, no existe una división bien definida entre ambos tipos de mezcla. Existen sustancias materiales intermedias, como las mezclas coloidales y las suspensiones. Una forma de clasificar a las mezclas, es atenvdiendo a los diferentes tamaños de las partículas que las forman. Mezcla Mezcla homogénea Mezcla coloidal Suspensión Mezcla heterogénea Tamaño de sus partículas # 10-9 m 10-9 m 10-7 m m $ 10-7 m En la mezcla coloidal no se habla de soluto y disolvente, sino que se distingue el componente disperso (fase dispersa), que se encuentra en menor proporción, y el medio de dispersión, componente en el que se encuentran dispersos el resto de componentes de la mezcla. Las partículas de la fase dispersa son grandes agregados de moléculas llamados micelas. Por ejemplo, cada micela de azufre en estado coloidal está formada por unas 1000 moléculas de azufre. Constituyen un grupo importante de sustancias; Disolvente Disolución Disolución coloidal la mayoría de los tejidos y líquidos orgánicos son de naturaleza coloidal: leche, hemoglobina de la sangre, pinturas, nubes, humos. Los coloides se caracterizan porque dispersan la luz en todas direcciones (Efecto Tyndall); por eso su aspecto suele ser turbio. Si se hace pasar un rayo de luz a través de un coloide, el rayo es dispersado y su trayectoria se hace visible. No se observa dicha dispersión con las disoluciones comunes porque las partículas del soluto son demasiado pequeñas para interactuar con la luz visible y producir la dispersión (reflexión y refracción) de la luz. El término de suspensión se reserva para las mezclas en las que el componente disperso se encuentra dentro del medio de dispersión y se puede separar fácilmente por filtración o decantación. Existen ocho tipos distintos de mezclas coloidales basadas en el estado físico de sus componentes: Soluto Suspensión Medio de dispersión Fase dispersa Nombre Ejemplos Sólido Sólido Sol sólido Aleaciones como el acero Sólido Líquido Gel Gelatina, mantequilla Sólido Gas Espuma Espumas plásticas Líquido Sólido Sol Pinturas, tintas, cola, gomas Líquido Líquido Emulsión Mahonesa Líquido Gas Espuma Espuma, nata batida Gas Sólido Aerosol Humo, polvo en aire, smog Gas Líquido Aerosol Nieblas, nubes, brumas 114
13 MÁS PROBLEMAS (Soluciones) COMPONENTES DE UNA DISOLUCIÓN FICHA 1 PROBLEMAS PROPUESTOS 1 Por qué en la clasificación de mezclas coloidales no aparece la combinación gas-gas? Porque por su propia naturaleza, las mezclas de gases son autenticas disoluciones. 2 Qué es una emulsión? Escribe algunos ejemplos. Una emulsión es una dispersión coloidal compuesta por dos líquidos inmiscibles. Se puede preparar una emulsión de aceite y agua añadiendo un agente emulsionante, como el jabón, que estabiliza el coloide. La mahonesa es una emulsión formada por aceite y vinagre (o limón), con yema de huevo como agente emulsionante. 3 Consulta los constituyentes existentes en la leche y basándote en ello clasifica a la leche como una disolución o como una emulsión. La leche es fundamentalmente una emulsión formada por gotitas de grasa dispersas en una disolución acuosa, aunque también existen partículas dispersas de proteínas y otros sólidos. La leche contiene casina como agente emulsionante. Cuando se agria y la caseína se coagula, se separa también la grasa en forma de grandes glóbulos. El proceso de desnatado consiste en separar las gotitas mayores, mientras que en el de la homogeneización estas gotitas se hacen más pequeñas. 4 En qué consiste el smog industrial? Indica si es una mezcla coloidal y, en caso afirmativo, cuál es el medio de dispersión y cuál el componente disperso. La palabra inglesa smog procede de la combinación de smoke (humo) y fog (niebla) se usa para designar la contaminación atmosférica como resultado de las condiciones climatológicas y algunos contaminantes (hollín, azufre) producidos por la combustión de carbón y petróleo. El smog es una mezcla coloidal en que el medio de dispersión es el aire (gas) y la fase dispersa (sólida) las moléculas de carbono y de azufre. 5 Los coloides pueden parecer disoluciones, ya que también son mezclas homogéneas Cómo puede distinguirse una disolución de un coloide? El mejor procedimiento para diferenciar mezclas coloidales de las disoluciones verdaderas es analizar su comportamiento frente a la luz. Haz de luz Disolución Disolución coloidal Al hacer pasar un haz luminoso, observando directamente en dirección perpendicular a su recorrido, el rayo se hace evidente cuando pasa a través de una mezcla coloidal, pero no es visible al pasar a través de la disolución. 115
14 MÁS PROBLEMAS (Soluciones) LA CONCENTRACIÓN DE LAS DISOLUCIONES FICHA 2 La unidad de concentración empleada para determinar la presencia de elementos en pequeñas cantidades (trazas) en una mezcla es la de ppm o partes por millón. Por ejemplo, se utiliza para expresar la concentración de contaminantes (plomo, cromo, cadmio, mercurio, nitratos, etc.) disueltos en agua. Se define como las partes de soluto contenidas en un millón de partes de disolución. Puede referirse tanto a masa, en el caso de sólidos, como en volumen, en el caso de líquidos o gases. Por ejemplo: g soluto/m 3 de disolución, mg soluto/l de disolución, g soluto/tonelada disolución. EJEMPLO Para preparar el remedio homeopático que denominan natrum muriaticum (conocida químicamente como cloruro de sodio y vulgarmente como sal común) se utiliza un proceso de dilución secuencial, por el que el principio activo es diluido centesimalmente (1:100) quince veces en agua como disolvente. Para ello se parte de una disolución al 10 % en peso, que se obtiene disolviendo 10 g de cloruro de sodio en 90 g de agua, como la masa molecular de la sal es 58,5 g/mol, contendrá 0,17 mol y moléculas de soluto. a) Es correcto hablar de moléculas de cloruro de sodio? Al ser un compuesto iónico que se disocia totalmente en agua, tendríamos que hablar más exactamente de cationes sodio Na 1+ y aniones cloruro Cl 1-. b) Si tomas con una pipeta, 1 ml de esta disolución inicial al 10 % en peso y añades 99 ml de agua (una dilución centesimal), cual será la nueva concentración? Cuántas moléculas de soluto se encontrarán en la disolución? La concentración resultante será de 10-3 g/ml (0,1 g de soluto en 100 ml de disolución), lo que es lo mismo un 0,1 % peso/volumen y una molaridad de 1, que corresponde con moléculas de soluto (realmente iones Na + y iones Cl - ). c) Las partes por millón indican las partes (g o ml) de soluto que se encuentran disueltas en 10 6 partes (g o ml ) de disolución. Cuál será la concentración de la disolución anterior en partes por millón? Un 1 % (1/100) equivale a ppm (10 4 /10 6 ). Como la disolución tiene una concentración de 0,1 %, expresada en partes por millón será de 1000 ppm. PROBLEMAS PROPUESTOS 6 Si repetimos el procedimiento descrito en el ejercicio anterior hasta realizar un total de quince diluciones centesimales consecutivas, cuál será la concentración y el número de moléculas en cada una de las diluciones sucesivas? a) Completa la tabla de concentraciones y número de moléculas (pares de iones) del principio activo (soluto). b) El límite de dilución se alcanza cuando solo queda una molécula de la supuesta medicina. En qué paso de la operación se alcanza el límite de dilución? c) Realiza una gráfica representando el número de moléculas del soluto frente al número de diluciones. d) A la vista de tus resultados, crees que las teorías de la homeopatía están basadas en hechos científicos y de que sus preparados pueden considerarse medicamentos? e) Cómo explicar entonces los casos en que los preparados homeopáticos parecen ser eficaces? 116
15 MÁS PROBLEMAS (Soluciones) 3 LA CONCENTRACIÓN DE LAS DISOLUCIONES FICHA 2 a) A cada dilución, la concentración se reduce 100 veces, por tanto, al final de quince diluciones resultará una concentración de g/ml. Para entenderlo mejor, si disolviéramos un terrón de azúcar en el agua que hay en todo el planeta, la concentración resultante sería incluso mayor que la presente en la mayoría de medicamentos homeopáticos. Dilución Concentración (g /ml) % P/V (peso/volumen) Molaridad (mol/l) Moléculas principio activo (soluto) 1. a , a , a , a , a , a , a , a , a , a , a , a , a , a , a , b) En la dilución número once se llega al límite de dilución, que es aquel donde solo se encuentra una sola molécula (al ser un compuesto iónico, un solo catión sodio y un solo anión cloruro), en las siguientes diluciones solo hay disolvente. c) n. de moléculas n. de diluciones d) En los preparados homeopáticos se realizan tantas disoluciones que según las leyes de la física la probabilidad de encontrar una sola molécula del principio activo inicial es prácticamente cero, por lo que los preparados homeopáticos difícilmente pueden producir efectos beneficiosos. Como conclusión y hasta la fecha, la homeopatía no es una teoría científica y no puede considerarse realmente como medicamento. e) Aunque muchos seguidores confirman los supuestos beneficios de esta medicina alternativa, esto no significa que esté basada en leyes ciertas, sino que hay que estar dispuesto a creer en sus postulados sin respaldo científico alguno. Estudios realizados por científicos de la Universidad de Berna (Suiza), muestran como resultado que, en ensayos con amplias muestras de población realizados con metodología de alta calidad mediante ensayos de doble ciego (aquellos en que ni los pacientes ni los investigadores saben lo que están tomando), los casos de curación están basados en la autosugestión del paciente (efecto placebo), en efectos sicológicos (fe en la curación) y en la evolución favorable que se produce espontáneamente en determinadas patologías funcionales. 117
16 MÁS PROBLEMAS (Soluciones) 3 LA SOLUBILIDAD FICHA 3 EJEMPLO En una experiencia de laboratorio se determina la máxima cantidad de nitrato de potasio que se puede disolver en 100 g de agua a diferentes temperaturas. Los resultados ordenados se indican en la tabla de datos: Masa KNO 3 (g ) Temperatura ( C ) a) Representa la gráfica de masa de nitrato de potasio frente a la temperatura. Qué relación existe entre ambas magnitudes? b) Deduce, utilizando la gráfica, la solubilidad del nitrato de potasio a 25 C y a 85 C c) Si añadimos 500 g de KNO 3 en agua hirviendo hasta saturación, cuántos gramos se podrán disolver? d) Si a continuación se deja enfriar la disolución hasta 30 C y se filtra para separar los cristales formados, qué cantidad de nitrato de potasio cristaliza? a) En este caso, al igual que en la mayoría de solutos sólidos, la solubilidad en líquidos aumenta con la temperatura, aunque no de manera proporcional ni de igual forma. Masa (g) T ( C) b) La solubilidad del nitrato a 25 C es, aproximadamente, de 39 g/100 g H 2 O; y a 85 C, de 180 g/100 g de H 2 O. c) A la temperatura de 100 C la máxima cantidad de nitrato que se puede disolver es de 246 g. El resto, 500 g g = 254 g, quedará sin disolver en el recipiente. d) Si la disolución contenía 246 g de nitrato de potasio a 100 C y se deja enfriar hasta 30 C, en que la solubilidad es de 46 g, la diferencia entre ambas cantidades cristaliza: 246 g - 46 g = 200 g. 118
17 MÁS PROBLEMAS (Soluciones) 3 LA SOLUBILIDAD FICHA 3 PROBLEMAS PROPUESTOS 7 La cristalización fraccionada es un método de separación de sustancias basado en la diferente solubilidad de los componentes que forman una mezcla. Para purificar una muestra de 90 g de nitrato de potasio contaminada con 10 g de cloruro de sodio, se disuelve la mezcla en 100 g de agua a 60 C y, a continuación, la disolución se enfría de manera gradual hasta 0 C. Consulta los datos de solubilidad del KNO3 y del NaCl y responde razonadamente. Datos de solubilidad del NaCl: (0 C, 34 g/100 g de H 2 O); (60 C, 38 g/100 g de H 2 O). a) Qué le ocurre al nitrato de potasio de la disolución? b) Qué cantidad de nitrato de potasio se separa de la disolución? c) Qué sucede con el cloruro de sodio? d) Qué porcentaje de la cantidad original de nitrato de potasio se puede obtener por este procedimiento? e) Muchos de los compuestos sólidos, inorgánicos y orgánicos, que se utilizan en el laboratorio se purifican mediante la cristalización fraccionada. Qué condiciones deben cumplir los compuestos que se quieren purificar mediante este sistema? a) La solubilidad depende de la temperatura. Si tenemos una disolución a una temperatura determinada y disminuimos su temperatura o eliminamos disolvente (evaporando), la disolución admite menos soluto y termina precipitando (solidificando) como consecuencia de que disminuye la solubilidad del soluto. Este fenómeno se conoce como cristalización. b) A la temperatura de 0 C la solubilidad del nitrato de potasio es de 12 g, precipitando la diferencia entre la cantidad inicial (90 g) y la cantidad final que queda en disolución (12 g ), esto es 78 g de nitrato, cristales que se pueden separar por filtración. c) Los 10 g de cloruro de sodio que contiene la mezcla se disuelve totalmente en los 100 g de agua a 60 C, por ser su solubilidad mayor que esa cantidad. Al enfriar la disolución hasta 0 C, la solubilidad del cloruro de sodio sigue siendo mayor que los 10 g de sal que contiene la mezcla, por lo que el cloruro de sodio no cristaliza y permanece totalmente en disolución. e) La cantidad inicial de nitrato es de 90 g, de los cuales 78 g se pueden separar finalmente. Masa nitrato cristalizada 78 g Rendimiento separación =? 100 =? 100 = 86,7% Masa nitrato mezclada 90 g De esta manera, se puede obtener alrededor del 90% de la cantidad original de nitrato de potasio en forma pura. e) El método funciona mejor si el compuesto que se va a purificar tiene una curva de solubilidad con una fuerte pendiente, es decir, si es mucho más soluble a altas temperaturas que a temperaturas bajas. De lo contrario, un alto porcentaje del compuesto permanecerá disuelto a media que se enfría la disolución. 119
UNIDAD EDUCATIVA COLEGIO SAN ANTONIO DEL TUY OCUMARE DEL TUY, ESTADO MIRANDA
 UNIDAD EDUCATIVA COLEGIO SAN ANTONIO DEL TUY OCUMARE DEL TUY, ESTADO MIRANDA CURSO: 4 TO AÑO PROFESOR: CARLOS M. LANDAETA H. GUÍA N 2: SOLUCIONES. UNIDADES DE CONCENTRACIÓN. LEY DE RAOULT Y PROPIEDADES
UNIDAD EDUCATIVA COLEGIO SAN ANTONIO DEL TUY OCUMARE DEL TUY, ESTADO MIRANDA CURSO: 4 TO AÑO PROFESOR: CARLOS M. LANDAETA H. GUÍA N 2: SOLUCIONES. UNIDADES DE CONCENTRACIÓN. LEY DE RAOULT Y PROPIEDADES
FyQ 1. IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química Unidad Didáctica 2
 Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 2015 2016 Unidad Didáctica 2 Rev 01 Las Disoluciones. Métodos Actuales para el Análisis de Sustancias
Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 2015 2016 Unidad Didáctica 2 Rev 01 Las Disoluciones. Métodos Actuales para el Análisis de Sustancias
MEZCLAS Y DISOLUCIONES - CUESTIONES Y EJERCICIOS
 MEZCLAS Y DISOLUCIONES - CUESTIONES Y EJERCICIOS Concentración de una disolución 1º.- Calcula la masa de nitrato de hierro (II), Fe(NO 3 ) 2, existente en 100 ml de disolución acuosa al 6 % en masa. Dato:
MEZCLAS Y DISOLUCIONES - CUESTIONES Y EJERCICIOS Concentración de una disolución 1º.- Calcula la masa de nitrato de hierro (II), Fe(NO 3 ) 2, existente en 100 ml de disolución acuosa al 6 % en masa. Dato:
SUSTANCIA QUÍMICA mercurio oxígeno
 ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
SOLUCIONES SOLIDA LIQUIDA GASEOSA. mezclas homogéneas de dos sustancias: SEGÚN EL ESTADO FISICO DEL SOLVENTE
 Soluciones SOLUCIONES mezclas homogéneas de dos sustancias: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA GASEOSA Cuando un sólido se disuelve en un líquido las partículas que lo
Soluciones SOLUCIONES mezclas homogéneas de dos sustancias: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA GASEOSA Cuando un sólido se disuelve en un líquido las partículas que lo
PROBLEMAS MEZCLAS Y DISOLUCIONES
 PROBLEMAS MEZCLAS Y DISOLUCIONES 1. Clasifica como homogéneos o heterogéneos los siguientes sistemas materiales: un trozo de cobre, agua salada, hierro oxidado, una ensalada. 2. Al mezclar dos sistemas
PROBLEMAS MEZCLAS Y DISOLUCIONES 1. Clasifica como homogéneos o heterogéneos los siguientes sistemas materiales: un trozo de cobre, agua salada, hierro oxidado, una ensalada. 2. Al mezclar dos sistemas
Disoluciones y cálculos de concentraciones
 Disoluciones y cálculos de concentraciones Disoluciones Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos o más sustancias en proporciones variables.
Disoluciones y cálculos de concentraciones Disoluciones Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos o más sustancias en proporciones variables.
Soluciones y unidades de concentración
 MATERIA Soluciones y unidades de concentración MEZCLAS SISTEMAS HETEROGÉNEOS Leche Arena Sal y azúcar SISTEMAS HOMOGÉNEOS Sal en agua Aire Acero COMPUESTOS Agua Etanol Benceno SUSTANCIAS PURAS ELEMENTOS
MATERIA Soluciones y unidades de concentración MEZCLAS SISTEMAS HETEROGÉNEOS Leche Arena Sal y azúcar SISTEMAS HOMOGÉNEOS Sal en agua Aire Acero COMPUESTOS Agua Etanol Benceno SUSTANCIAS PURAS ELEMENTOS
Soluciones y unidades de concentración
 Soluciones y unidades de concentración Dra. Dra. Patricia Patricia Satti, Satti, UNRN UNRN MATERIA MEZCLAS SUSTANCIAS PURAS SISTEMAS HETEROGÉNEOS Leche Arena Sal y azúcar SISTEMAS HOMOGÉNEOS Sal en agua
Soluciones y unidades de concentración Dra. Dra. Patricia Patricia Satti, Satti, UNRN UNRN MATERIA MEZCLAS SUSTANCIAS PURAS SISTEMAS HETEROGÉNEOS Leche Arena Sal y azúcar SISTEMAS HOMOGÉNEOS Sal en agua
Tema 7. Las mezclas. Introducción
 Tema 7. Las mezclas Introducción Ya sabes que los sistemas materiales se pueden clasificar según su composición en sustancias puras y mezclas. Las sustancias puras son los elementos y los compuestos que
Tema 7. Las mezclas Introducción Ya sabes que los sistemas materiales se pueden clasificar según su composición en sustancias puras y mezclas. Las sustancias puras son los elementos y los compuestos que
MEZCLAS Y DISOLUCIONES. Física y Química 3º de E.S.O. IES Isidra de Guzmán
 MEZCLAS Y DISOLUCIONES Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción Ya sabes que los sistemas materiales se pueden clasificar según su composición en sustancias puras y mezclas. Las
MEZCLAS Y DISOLUCIONES Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción Ya sabes que los sistemas materiales se pueden clasificar según su composición en sustancias puras y mezclas. Las
1. MATERIA Y SU ASPECTO
 1. MATERIA Y SU ASPECTO El aspecto de un sistema material puede variar según el método de observación. Algunos sistemas materiales como la leche, la sangre o la mantequilla a simple vista parecen uniformes,
1. MATERIA Y SU ASPECTO El aspecto de un sistema material puede variar según el método de observación. Algunos sistemas materiales como la leche, la sangre o la mantequilla a simple vista parecen uniformes,
DISOLUCIONES. Las disoluciones son mezclas homogéneas de dos o más sustancias (componentes) en proporciones variables.
 DISOLUCIONES Las disoluciones son mezclas homogéneas de dos o más sustancias (componentes) en proporciones variables. Soluto es la sustancia que se encuentra en menor proporción. Disolvente es la sustancia
DISOLUCIONES Las disoluciones son mezclas homogéneas de dos o más sustancias (componentes) en proporciones variables. Soluto es la sustancia que se encuentra en menor proporción. Disolvente es la sustancia
Para la solución de algunos de los ejercicios propuestos, se adjunta una parte del sistema periódico hasta el elemento Nº 20.
 Programa Estándar Anual Nº Guía práctica Disoluciones I: mezclas, disoluciones y unidades porcentuales de concentración Ejercicios PSU Para la solución de algunos de los ejercicios propuestos, se adjunta
Programa Estándar Anual Nº Guía práctica Disoluciones I: mezclas, disoluciones y unidades porcentuales de concentración Ejercicios PSU Para la solución de algunos de los ejercicios propuestos, se adjunta
TEMA 7. DISOLUCIONES Y PROPIEDADES COLIGATIVAS
 TEMA 7. DISOLUCIONES Y PROPIEDADES COLIGATIVAS 1. Una solución saturada A) Contiene más soluto que disolvente. B) Contiene más disolvente que soluto. C) Contiene el mismo número de moles de soluto que
TEMA 7. DISOLUCIONES Y PROPIEDADES COLIGATIVAS 1. Una solución saturada A) Contiene más soluto que disolvente. B) Contiene más disolvente que soluto. C) Contiene el mismo número de moles de soluto que
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
Repaso de Sistemas de concentración molar
 Repaso de Sistemas de concentración molar Prof. José A. Pérez Química Analítica 1 Unidades de Concentración molaridad, molalidad, % masa, % volumen, %masa/volumen, partes por mil (ppmil), partes por millón
Repaso de Sistemas de concentración molar Prof. José A. Pérez Química Analítica 1 Unidades de Concentración molaridad, molalidad, % masa, % volumen, %masa/volumen, partes por mil (ppmil), partes por millón
QUÉ SON LAS DISOLUCIONES?
 LICEO FEMENINO MERCEDES NARIÑO IED ÁREA CIENCIAS NATURALES Y ED. AMBIENTAL- QUÍMICA GRADO 11 DISOLUCIONES Prof. Juan Gabriel Perilla Jiménez Propósito General: Reconocer la presencia, comportamiento, importancia
LICEO FEMENINO MERCEDES NARIÑO IED ÁREA CIENCIAS NATURALES Y ED. AMBIENTAL- QUÍMICA GRADO 11 DISOLUCIONES Prof. Juan Gabriel Perilla Jiménez Propósito General: Reconocer la presencia, comportamiento, importancia
Tema 8: Disoluciones y sus propiedades
 Tema 8: Disoluciones y sus propiedades Francisco G. Calvo-Flores Contenidos 8-1 Disoluciones y tipos 8-2 Unidades de concentración 8-3 Disoluciones ideales y no ideales 8-4 Formación de disoluciones: equilibrio
Tema 8: Disoluciones y sus propiedades Francisco G. Calvo-Flores Contenidos 8-1 Disoluciones y tipos 8-2 Unidades de concentración 8-3 Disoluciones ideales y no ideales 8-4 Formación de disoluciones: equilibrio
HOJA DE PROBLEMAS 5: ENUNCIADOS
 Tema: SISTEMAS DISPERSOS HOJA DE PROBLEMAS 5: ENUNCIADOS 1. ( ) Calcule la molaridad de un disolución preparada disolviendo 23.4 g de sulfato de sodio hasta obtener 125 ml de disolución. 2. ( ) Cuantos
Tema: SISTEMAS DISPERSOS HOJA DE PROBLEMAS 5: ENUNCIADOS 1. ( ) Calcule la molaridad de un disolución preparada disolviendo 23.4 g de sulfato de sodio hasta obtener 125 ml de disolución. 2. ( ) Cuantos
EJERCICIOS RESUELTOS DISOLUCIONES
 EJERIIOS RESUELTOS DISOLUIONES 1.- Se disuelven 20 g de NaOH en 560 g de agua. alcula a) la concentración de la en % en masa y b) su molalidad. Ar(Na) 2. Ar(O)16. Ar(H)1. NaOH 20 a) % NaOH.100 % NaOH.100
EJERIIOS RESUELTOS DISOLUIONES 1.- Se disuelven 20 g de NaOH en 560 g de agua. alcula a) la concentración de la en % en masa y b) su molalidad. Ar(Na) 2. Ar(O)16. Ar(H)1. NaOH 20 a) % NaOH.100 % NaOH.100
1. La materia: sustancias puras y mezclas
 RESUMEN de la UNIDAD 3. DIVERSIDAD DE LA MATERIA 1. La materia: sustancias puras y mezclas La principal clasificación que se hace de la materia es en sustancias puras y mezclas. Las sustancias puras tienen
RESUMEN de la UNIDAD 3. DIVERSIDAD DE LA MATERIA 1. La materia: sustancias puras y mezclas La principal clasificación que se hace de la materia es en sustancias puras y mezclas. Las sustancias puras tienen
Sustituir fotografía. Sustituir texto
 Soluciones Sustituir fotografía Sustituir texto Tipos de soluciones. Hidrólisis. Solubilidad y el efecto de la temperatura. Unidades de concentración: Expresiones físicas de concentración (%m/m, %m/v,
Soluciones Sustituir fotografía Sustituir texto Tipos de soluciones. Hidrólisis. Solubilidad y el efecto de la temperatura. Unidades de concentración: Expresiones físicas de concentración (%m/m, %m/v,
Aprendizajes esperados
 Disoluciones II Aprendizajes esperados Identificar diluciones. Identificar los factores que afectan la solubilidad. Definir propiedades coligativas. Pregunta oficial PSU Al bajar gradualmente la temperatura,
Disoluciones II Aprendizajes esperados Identificar diluciones. Identificar los factores que afectan la solubilidad. Definir propiedades coligativas. Pregunta oficial PSU Al bajar gradualmente la temperatura,
SISTEMAS MATERIALES. Departamento de Física y Química 2º ESO
 SISTEMAS MATERIALES Departamento de Física y Química 2º ESO 0. Mapa conceptual MATERIA Sustancias puras Mezclas Heterogéneas Homogéneas Sistemas coloidales Técnicas de separación Disoluciones Soluto Disolvente
SISTEMAS MATERIALES Departamento de Física y Química 2º ESO 0. Mapa conceptual MATERIA Sustancias puras Mezclas Heterogéneas Homogéneas Sistemas coloidales Técnicas de separación Disoluciones Soluto Disolvente
Tema 2: Disoluciones. Tipos de disoluciones. Composición de las disoluciones: formas de expresión. Diluciones. Propiedades coligativas.
 Tema 2: Disoluciones Tipos de disoluciones. Composición de las disoluciones: formas de expresión. Diluciones. Propiedades coligativas. Presión de vapor. Presión osmótica. Aumento ebulloscópico y descenso
Tema 2: Disoluciones Tipos de disoluciones. Composición de las disoluciones: formas de expresión. Diluciones. Propiedades coligativas. Presión de vapor. Presión osmótica. Aumento ebulloscópico y descenso
03 DISOLUCIONES. 2 Observando la curva de solubilidad del clorato potásico, responder:
 03 DISOLUCIONES 1 Sabemos que cierta disolución tiene una concentración de c = 512 g/l. Si su densidad es1,43 g/l, expresa el valor de su concentración en tanto por ciento. 2 Observando la curva de solubilidad
03 DISOLUCIONES 1 Sabemos que cierta disolución tiene una concentración de c = 512 g/l. Si su densidad es1,43 g/l, expresa el valor de su concentración en tanto por ciento. 2 Observando la curva de solubilidad
Coloides y Suspensiones Osmosis y Diálisis. SEMANA 10 Licda. Lilian Judith Guzmán Melgar
 Coloides y Suspensiones Osmosis y Diálisis SEMANA 10 Licda. Lilian Judith Guzmán Melgar SUSPENSIONES Las suspensiones son mezclas heterogéneas formadas por una fase sólida (polvo o pequeñas partículas
Coloides y Suspensiones Osmosis y Diálisis SEMANA 10 Licda. Lilian Judith Guzmán Melgar SUSPENSIONES Las suspensiones son mezclas heterogéneas formadas por una fase sólida (polvo o pequeñas partículas
Materia y disoluciones
 Materia y disoluciones 1º.- Calcula la temperatura a la que habrá que someter 80 litros de un gas, para que ocupe un volumen de 15 litros a una presión de 18 atmósfera. S: 648,3 ºC 2º.- Un recipiente contiene
Materia y disoluciones 1º.- Calcula la temperatura a la que habrá que someter 80 litros de un gas, para que ocupe un volumen de 15 litros a una presión de 18 atmósfera. S: 648,3 ºC 2º.- Un recipiente contiene
Disoluciones Químicas
 Disoluciones Químicas Las disoluciones son mezclas homogéneas de dos o más sustancias, es decir, cuyos componentes no se pueden distinguir a simple vista. Siempre que se esta en presencia de una mezcla
Disoluciones Químicas Las disoluciones son mezclas homogéneas de dos o más sustancias, es decir, cuyos componentes no se pueden distinguir a simple vista. Siempre que se esta en presencia de una mezcla
Tema 6: Disoluciones. Propiedades coligativas
 Tema 6: Disoluciones. Propiedades coligativas 1-Una solución saturada A) Contiene más soluto que solvente. B) Contiene más solvente que soluto. C) Contiene el mismo número de moles de soluto que de solvente.
Tema 6: Disoluciones. Propiedades coligativas 1-Una solución saturada A) Contiene más soluto que solvente. B) Contiene más solvente que soluto. C) Contiene el mismo número de moles de soluto que de solvente.
TEMA 2: LA MATERIA: CÓMO SE PRESENTA?
 TEMA 2: LA MATERIA: CÓMO SE PRESENTA? 1.- La materia: sustancias puras y mezclas. 1.1.- Recordatorio. 1.2.- Sustancias puras. 1.3.- Mezclas. 1.4.- Cómo distinguir un coloide de una mezcla homogénea. 2.-
TEMA 2: LA MATERIA: CÓMO SE PRESENTA? 1.- La materia: sustancias puras y mezclas. 1.1.- Recordatorio. 1.2.- Sustancias puras. 1.3.- Mezclas. 1.4.- Cómo distinguir un coloide de una mezcla homogénea. 2.-
UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA LABORATORIO DE QUÍMICA GENERAL Profesor: Jaime O. Pérez DEYMER GÓMEZ CORREA:
 UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA LABORATORIO DE QUÍMICA GENERAL Profesor: Jaime O. Pérez Práctica: SOLUCIONES 1 Fecha: 9/Marzo/2010 DEYMER GÓMEZ CORREA: 1 042 091 432 OBJETIVOS
UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA LABORATORIO DE QUÍMICA GENERAL Profesor: Jaime O. Pérez Práctica: SOLUCIONES 1 Fecha: 9/Marzo/2010 DEYMER GÓMEZ CORREA: 1 042 091 432 OBJETIVOS
El aire de la atmósfera (78% N 2 ; 21% O 2 ; 1% Ar, He, CO 2 y vapor de agua) y el agua del mar son ejemplos de soluciones.
 SOLUCIONES la materia se presenta, con mayor frecuencia, en forma de mezcla de sustancias puras. dentro de éstas mezclas hay que distinguir las: I) mezclas propiamente dichas II) y las soluciones. El aire
SOLUCIONES la materia se presenta, con mayor frecuencia, en forma de mezcla de sustancias puras. dentro de éstas mezclas hay que distinguir las: I) mezclas propiamente dichas II) y las soluciones. El aire
EJERCICIOS TEMA 2. LA MATERIA Y SUS PROPIEDADES.
 EJERCICIOS TEMA 2. LA MATERIA Y SUS PROPIEDADES. 1. La materia puede presentarse en tres estados de agregación. Cuáles son? 2. Cómo son la forma y el volumen de un sólido? Y de un líquido? Y de un gas?
EJERCICIOS TEMA 2. LA MATERIA Y SUS PROPIEDADES. 1. La materia puede presentarse en tres estados de agregación. Cuáles son? 2. Cómo son la forma y el volumen de un sólido? Y de un líquido? Y de un gas?
ESPECIFICACIÓN DE LOS ÍTEMES DE PRUEBA
 Técnicas de Panadería Alimentación Química ESPECIFICACIÓN DE LOS ÍTEMES DE PRUEBA Aprendizaje Esperado Establecer relaciones cuantitativas en diversas reacciones químicas 1. Juan, debe diseñar un programa
Técnicas de Panadería Alimentación Química ESPECIFICACIÓN DE LOS ÍTEMES DE PRUEBA Aprendizaje Esperado Establecer relaciones cuantitativas en diversas reacciones químicas 1. Juan, debe diseñar un programa
Clasifica los siguientes sistemas materiales en elementos, compuestos o mezclas homogéneas o heterogéneas:
 TITULO (edite antes de imprimir) NOMBRE: CURSO: 1) Clasifica los siguientes sistemas materiales en elementos, compuestos o mezclas homogéneas o heterogéneas: Plomo ; acero ; mercurio ; óxido de hierro
TITULO (edite antes de imprimir) NOMBRE: CURSO: 1) Clasifica los siguientes sistemas materiales en elementos, compuestos o mezclas homogéneas o heterogéneas: Plomo ; acero ; mercurio ; óxido de hierro
EJERCIOS DE CONCENTRACIÓN DE SOLUCIONES
 Preuniversitario Liceo de Aplicación Química 4º 2010 Profesora Paola Lizama V. GUÍA 4: DISOLUCIONES EJERCIOS DE CONCENTRACIÓN DE SOLUCIONES 01.- Calcular la cantidad de sosa cáustica (NaOH) y de agua que
Preuniversitario Liceo de Aplicación Química 4º 2010 Profesora Paola Lizama V. GUÍA 4: DISOLUCIONES EJERCIOS DE CONCENTRACIÓN DE SOLUCIONES 01.- Calcular la cantidad de sosa cáustica (NaOH) y de agua que
TEMA 3 LAS DISOLUCIONES
 TEMA 3 LAS DISOLUCIONES 1.- DISOLUCIÓN: COMPONENTES Y TIPOS DE DISOLUCIONES 1.1- EL PROCESO DE DISOLUCIÓN - FACTORES QUE AFECTAN AL PROCESO DE DISOLUCIÓN 1.2-LA CONCENTRACIÓN - % EN MASA -% EN VOLUMEN
TEMA 3 LAS DISOLUCIONES 1.- DISOLUCIÓN: COMPONENTES Y TIPOS DE DISOLUCIONES 1.1- EL PROCESO DE DISOLUCIÓN - FACTORES QUE AFECTAN AL PROCESO DE DISOLUCIÓN 1.2-LA CONCENTRACIÓN - % EN MASA -% EN VOLUMEN
GUÍA DE EJERCICIOS DISOLUCIONES
 GUÍA DE EJERCICIOS DISOLUCIONES Área Química Resultados de aprendizaje Conocer el concepto de disolución y calcular la concentración de esta en ejercicios, de forma lógica. Contenidos 1. Definición de
GUÍA DE EJERCICIOS DISOLUCIONES Área Química Resultados de aprendizaje Conocer el concepto de disolución y calcular la concentración de esta en ejercicios, de forma lógica. Contenidos 1. Definición de
SUSTANCIAS PURAS (Repaso) MEZCLAS (Repaso)
 Física y Química 4 ESO DISOLUCIONES Pág. 1 SUSTANCIAS PURAS (Repaso) MEZCLAS (Repaso) Pág. 2 DISOLUCIONES Física y Química 4 ESO DISOLUCIONES CONCEPTO DE DISOLUCIÓN. COMPONENTES DE UNA DISOLUCIÓN. Una
Física y Química 4 ESO DISOLUCIONES Pág. 1 SUSTANCIAS PURAS (Repaso) MEZCLAS (Repaso) Pág. 2 DISOLUCIONES Física y Química 4 ESO DISOLUCIONES CONCEPTO DE DISOLUCIÓN. COMPONENTES DE UNA DISOLUCIÓN. Una
DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES. MSc. Marilú Cerda Lira
 DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES MSc. Marilú Cerda Lira DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES Introducción Definición Principales clases de soluciones Clasificación Modos de expresar las concentraciones
DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES MSc. Marilú Cerda Lira DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES Introducción Definición Principales clases de soluciones Clasificación Modos de expresar las concentraciones
HOJA DE PROBLEMAS 1: ENUNCIADOS
 Tema: DISOLUCIONES HOJA DE PROBLEMAS 1: ENUNCIADOS 1. ( ) Una disolución acuosa de AgNO 3 con una composición del 12 % en peso tiene una densidad de 1.1080 g/cm 3 a 20 C y 1 atm. Calcule la fracción molar,
Tema: DISOLUCIONES HOJA DE PROBLEMAS 1: ENUNCIADOS 1. ( ) Una disolución acuosa de AgNO 3 con una composición del 12 % en peso tiene una densidad de 1.1080 g/cm 3 a 20 C y 1 atm. Calcule la fracción molar,
2. MECANISMO DE DISOLUCIÓN Y DE HIDRATACIÓN DE IONES.
 1. QUÉ ES UNA DISOLUCIÓN? Disoluciones, en química, mezclas homogéneas de dos o más sustancias. El soluto es el componente que se encuentra en distinto estado físico que la disolución; y el disolvente
1. QUÉ ES UNA DISOLUCIÓN? Disoluciones, en química, mezclas homogéneas de dos o más sustancias. El soluto es el componente que se encuentra en distinto estado físico que la disolución; y el disolvente
1 Disponemos de un ácido nítrico comercial (HNO3) de densidad 1,15 g/cm 3 y riqueza 25,48% en masa.
 Relación de Problemas Unidades de Concentración 1 Disponemos de un ácido nítrico comercial (HNO3) de densidad 1,15 g/cm 3 y riqueza 25,48% en masa. a) Determina la molaridad del ácido nítrico comercial.
Relación de Problemas Unidades de Concentración 1 Disponemos de un ácido nítrico comercial (HNO3) de densidad 1,15 g/cm 3 y riqueza 25,48% en masa. a) Determina la molaridad del ácido nítrico comercial.
Materia: es aquello que ocupa un lugar en el espacio y cuyas propiedades percibimos por los sentidos. Es diversa y discontinua.
 Sistemas materiales Materia: es aquello que ocupa un lugar en el espacio y cuyas propiedades percibimos por los sentidos. Es diversa y discontinua. Mezcla Heterogénea: unión de dos o más sustancias de
Sistemas materiales Materia: es aquello que ocupa un lugar en el espacio y cuyas propiedades percibimos por los sentidos. Es diversa y discontinua. Mezcla Heterogénea: unión de dos o más sustancias de
QUÍMICA 2º BACHILLERATO
 DISOLUCIONES: CONCENTRACIÓN DE LAS MISMAS 1.-/ Se disuelven 7 g de cloruro de sodio en 43 g de agua. Determine la concentración centesimal de la disolución, así como la fracción molar de cada componente
DISOLUCIONES: CONCENTRACIÓN DE LAS MISMAS 1.-/ Se disuelven 7 g de cloruro de sodio en 43 g de agua. Determine la concentración centesimal de la disolución, así como la fracción molar de cada componente
M A T E R I A L E S SOLUCIONES
 M A T E R I A L E S SOLUCIONES I Componentes Mayor proporción solvente Menor proporción soluto Concentración: indica la cantidad de soluto presente en una dada cantidad de solvente o una dada cantidad
M A T E R I A L E S SOLUCIONES I Componentes Mayor proporción solvente Menor proporción soluto Concentración: indica la cantidad de soluto presente en una dada cantidad de solvente o una dada cantidad
Acuerdo 286. Química. Disoluciones. Recopiló: M.C. Macaria Hernández Chávez
 Acuerdo 286 Química Disoluciones Recopiló: M.C. Macaria Hernández Chávez Disolución: Es una mezcla homogénea de dos o más sustancias. La sustancia que se encuentra en mayor proporción se llama disolvente
Acuerdo 286 Química Disoluciones Recopiló: M.C. Macaria Hernández Chávez Disolución: Es una mezcla homogénea de dos o más sustancias. La sustancia que se encuentra en mayor proporción se llama disolvente
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual Disoluciones I: mezclas, disoluciones y unidades porcentuales de concentración SGUICES010CB33-A16V1 Ítem Alternativa Habilidad 1 D Reconocimiento 2 A Reconocimiento 3 C
SOLUCIONARIO Guía Estándar Anual Disoluciones I: mezclas, disoluciones y unidades porcentuales de concentración SGUICES010CB33-A16V1 Ítem Alternativa Habilidad 1 D Reconocimiento 2 A Reconocimiento 3 C
Problemas del Tema 1: Aspectos cuantitativos en Química
 Problemas del Tema 1: Aspectos cuantitativos en Química 1.- Se dispone de una botella de ácido sulfúrico cuya etiqueta aporta los siguientes datos: densidad 1 84 g/ml y riqueza en masa 96 %. Calcule: La
Problemas del Tema 1: Aspectos cuantitativos en Química 1.- Se dispone de una botella de ácido sulfúrico cuya etiqueta aporta los siguientes datos: densidad 1 84 g/ml y riqueza en masa 96 %. Calcule: La
DISOLUCIONES 1.- QUÉ ES UNA DISOLUCIÓN?
 DISOLUCIONES 1.- QUÉ ES UNA DISOLUCIÓN? Disoluciones, en química, mezclas homogéneas de dos o más sustancias. El soluto es el componente que se encuentra en distinto estado físico que la disolución; y
DISOLUCIONES 1.- QUÉ ES UNA DISOLUCIÓN? Disoluciones, en química, mezclas homogéneas de dos o más sustancias. El soluto es el componente que se encuentra en distinto estado físico que la disolución; y
QUÍMICA. Tema 4. Estados de Agregación de la Materia
 Tema 4. Estados de Agregación de la Materia Índice - Características de sólidos, líquidos y gases - Volumen molar de los gases - Ecuación de estado de los gases - Disoluciones Objetivos específicos - Que
Tema 4. Estados de Agregación de la Materia Índice - Características de sólidos, líquidos y gases - Volumen molar de los gases - Ecuación de estado de los gases - Disoluciones Objetivos específicos - Que
Tema 2: Dispersiones (1) Material preparado por VChan 1
 MATERIA: Cualquier cosa que ocupa espacio y tiene masa. Es todo lo que nos rodea. 2.1 Proceso de disolución Velocidad de disolución Material preparado por: Licda. Victoria Chan Escuela de Química/ ITCR
MATERIA: Cualquier cosa que ocupa espacio y tiene masa. Es todo lo que nos rodea. 2.1 Proceso de disolución Velocidad de disolución Material preparado por: Licda. Victoria Chan Escuela de Química/ ITCR
GUÍA DE EJERCICIOS DISOLUCIONES
 GUÍA DE EJERCICIOS DISOLUCIONES Área Química Resultados de aprendizaje Conocer el concepto de disolución y calcular la concentración de esta en ejercicios, de forma lógica. Contenidos 1. Definición de
GUÍA DE EJERCICIOS DISOLUCIONES Área Química Resultados de aprendizaje Conocer el concepto de disolución y calcular la concentración de esta en ejercicios, de forma lógica. Contenidos 1. Definición de
Materia es todo aquello que tiene masa y ocupa un lugar en el espacio (tiene volumen). La ciencia que estudia la materia es la Química.
 Alfonso García Materia es todo aquello que tiene masa y ocupa un lugar en el espacio (tiene volumen). La ciencia que estudia la materia es la Química. Un sistema material es una porción de materia. Ejemplos:
Alfonso García Materia es todo aquello que tiene masa y ocupa un lugar en el espacio (tiene volumen). La ciencia que estudia la materia es la Química. Un sistema material es una porción de materia. Ejemplos:
Disoluciones II: Unidades químicas de concentración y dilución
 Disoluciones II: Unidades químicas de concentración y dilución Resumen de la clase anterior Sustancias puras Elementos Compuestos MATERIA Heterogéneas Homogéneas Mezclas Suspensión Coloide Disolución Ø
Disoluciones II: Unidades químicas de concentración y dilución Resumen de la clase anterior Sustancias puras Elementos Compuestos MATERIA Heterogéneas Homogéneas Mezclas Suspensión Coloide Disolución Ø
CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS Nº6
 CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS Nº6 TEMA: PROPIEDADES COLIGATIVAS OBJETIVOS: Aplicar las propiedades coligativas para el cálculo de masas molares de solutos y de las propiedades físicas de las soluciones.
CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS Nº6 TEMA: PROPIEDADES COLIGATIVAS OBJETIVOS: Aplicar las propiedades coligativas para el cálculo de masas molares de solutos y de las propiedades físicas de las soluciones.
La unidad fundamental de la Química: el mol
 2 La unidad fundamental de la : el mol 1 Cita tres disoluciones coloidales y tres disoluciones verdaderas que conozcas. 2 Clasifica como disoluciones verdaderas, coloides o suspensiones las siguientes
2 La unidad fundamental de la : el mol 1 Cita tres disoluciones coloidales y tres disoluciones verdaderas que conozcas. 2 Clasifica como disoluciones verdaderas, coloides o suspensiones las siguientes
Tema 5: Disoluciones. (Químic General) Disoluciones 6 de noviembre de / 38
 Tema 5: Disoluciones Tipos de disoluciones. Concentración. Solubilidad de gases. Diagramas de fases de dos componentes. Propiedades coligativas: presión osmótica, disminución del punto de fusión y aumento
Tema 5: Disoluciones Tipos de disoluciones. Concentración. Solubilidad de gases. Diagramas de fases de dos componentes. Propiedades coligativas: presión osmótica, disminución del punto de fusión y aumento
FÍSICA Y QUÍMICA 2º ESO Tema 2: LA MATERIA Mezclas y Soluciones. Sustancias puras y mezclas
 Sustancias puras y mezclas La materia que nos rodea es, en la mayoría de los casos, una mezcla de sustancias. Los científicos han intentado clasificar las sustancias desde el principio de los tiempos.
Sustancias puras y mezclas La materia que nos rodea es, en la mayoría de los casos, una mezcla de sustancias. Los científicos han intentado clasificar las sustancias desde el principio de los tiempos.
FORMULAS PARA LAS CONCENTRACIONES CONCENTRACION DE A EXPRESADA EN: A % m/m = masa de A (g) x 100% masa total de la disolución (g)
 FORMULAS PARA LAS CONCENTRACIONES MASA DE LA DISOLUCION: MASA DEL SOLUTO + MASA DEL DISOLVENTE VOLUMEN DE LA DISOLUCION = MASA DE LA DISOLUCION DENSIDAD DE LA DISOLUCION PORCENTAJE MASA POR MASA: CONCENTRACION
FORMULAS PARA LAS CONCENTRACIONES MASA DE LA DISOLUCION: MASA DEL SOLUTO + MASA DEL DISOLVENTE VOLUMEN DE LA DISOLUCION = MASA DE LA DISOLUCION DENSIDAD DE LA DISOLUCION PORCENTAJE MASA POR MASA: CONCENTRACION
Teoría Disoluciones Fórmula empírica y molecular Física y Química. 1º bachiller DISOLUCIONES
 Teoría Disoluciones Fórmula empírica y molecular Física y Química. 1º bachiller 18-1-2015 CONCEPTO DE DISOLUCIÓN DISOLUCIONES Una disolución es una mezcla homogénea de sustancias en igual o distintos estados
Teoría Disoluciones Fórmula empírica y molecular Física y Química. 1º bachiller 18-1-2015 CONCEPTO DE DISOLUCIÓN DISOLUCIONES Una disolución es una mezcla homogénea de sustancias en igual o distintos estados
CAPITULO 6 : Soluciones
 CAPITULO 6 : Soluciones Gran parte de los líquidos que conocemos o que manejamos habitualmente son soluciones o disoluciones. El agua de mar, la saliva, la orina, la lavandina, el vinagre y al agua que
CAPITULO 6 : Soluciones Gran parte de los líquidos que conocemos o que manejamos habitualmente son soluciones o disoluciones. El agua de mar, la saliva, la orina, la lavandina, el vinagre y al agua que
PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES
 PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES Los estudios teóricos y experimentales han permitido establecer, que los líquidos poseen propiedades físicas características. Entre ellas cabe mencionar: la densidad,
PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES Los estudios teóricos y experimentales han permitido establecer, que los líquidos poseen propiedades físicas características. Entre ellas cabe mencionar: la densidad,
COMPARACIÓN MOLECULAR DE LOS ESTADOS DE LA MATERIA. 27/05/2014 Carlos Urzúa Stricker 1
 COMPARACIÓN MOLECULAR DE LOS ESTADOS DE LA MATERIA 27/05/2014 Carlos Urzúa Stricker 1 CARACTERISTICAS GENERALES DE LOS LÍQUIDOS Y DE SUS SOLUCIONES Aun cuando las partículas (átomos o moléculas)que constituyen
COMPARACIÓN MOLECULAR DE LOS ESTADOS DE LA MATERIA 27/05/2014 Carlos Urzúa Stricker 1 CARACTERISTICAS GENERALES DE LOS LÍQUIDOS Y DE SUS SOLUCIONES Aun cuando las partículas (átomos o moléculas)que constituyen
DISOLUCIONES DILUIDAS IDEALES. LEY DE HENRY. MODELO DE LA DISOLUCIÓN DILUIDA IDEAL
 DISOLUCIONES DILUIDAS IDEALES. LEY DE HENRY. Muchas disoluciones se desvían bastante del modelo de disolución ideal. or ello resulta útil definir otro modelo: MODELO DE LA DISOLUCIÓN DILUIDA IDEAL 1) Descripción
DISOLUCIONES DILUIDAS IDEALES. LEY DE HENRY. Muchas disoluciones se desvían bastante del modelo de disolución ideal. or ello resulta útil definir otro modelo: MODELO DE LA DISOLUCIÓN DILUIDA IDEAL 1) Descripción
La riqueza en peso nos dice que en 100 gramos de disolución hay 37 gramos de soluto, de modo que en 1180 gramos de disolución habrá:
 40.- Calcula la concentración en g/l de un ácido clorhídrico comercial de 37 % de riqueza en peso y densidad 1,18 g/ml. En primer lugar expresamos la densidad en g/l : 1180 g/l La riqueza en peso nos dice
40.- Calcula la concentración en g/l de un ácido clorhídrico comercial de 37 % de riqueza en peso y densidad 1,18 g/ml. En primer lugar expresamos la densidad en g/l : 1180 g/l La riqueza en peso nos dice
TEMA 6 MEZCLAS Y DISOLUCIONES
 TEMA 6 MEZCLAS Y DISOLUCIONES 1 Contenidos: 1. Tipos de disoluciones 2. El proceso de disolución 3. Formas de expresar la concentración. 4. Solubilidad. Factores que afectan a la solubilidad 5. Propiedades
TEMA 6 MEZCLAS Y DISOLUCIONES 1 Contenidos: 1. Tipos de disoluciones 2. El proceso de disolución 3. Formas de expresar la concentración. 4. Solubilidad. Factores que afectan a la solubilidad 5. Propiedades
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
Masas atómicas (g/mol): O = 16; S = 32; Zn = 65,4. Sol: a) 847 L; b) 710,9 g; c) 1,01 atm.
 1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES. MSc. Marilú Cerda Lira
 DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES MSc. Marilú Cerda Lira DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES Introducción Definición Métodos de separación de las soluciones Principales clases de soluciones
DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES MSc. Marilú Cerda Lira DISOLUCIONES Y CÀLCULO DE CONCENTRACIONES Introducción Definición Métodos de separación de las soluciones Principales clases de soluciones
Estequiometría de soluciones: Molaridad y Molalidad
 Estequiometría de soluciones: Molaridad y Molalidad Molaridad (M) de una solución Como ya sabemos, la composición de una solución formada por un determinado soluto en un solvente puede variar de acuerdo
Estequiometría de soluciones: Molaridad y Molalidad Molaridad (M) de una solución Como ya sabemos, la composición de una solución formada por un determinado soluto en un solvente puede variar de acuerdo
TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS
 TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS 1. LA MATERIA Y SU ASPECTO Los sistemas materiales, formados por una o varias sustancias, pueden clasificarse en: - Sistemas materiales heterogéneos: presentan
TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS 1. LA MATERIA Y SU ASPECTO Los sistemas materiales, formados por una o varias sustancias, pueden clasificarse en: - Sistemas materiales heterogéneos: presentan
FORMAS MÁS COMUNES DE EXPRESAR LA CONCENTRACIÓN:
 CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS Nº 4 TEMA: ESTEQUIOMETRÍA DE SOLUCIONES OBJETIVOS: Resolver problemas basados en la estequiometría de las soluciones, ampliando los conocimientos para ser aplicados criteriosamente
CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS Nº 4 TEMA: ESTEQUIOMETRÍA DE SOLUCIONES OBJETIVOS: Resolver problemas basados en la estequiometría de las soluciones, ampliando los conocimientos para ser aplicados criteriosamente
GUÍA DE EJERCICIOS DISOLUCIONES
 GUÍA DE EJERCICIOS DISOLUCIONES Área Química Resultados de aprendizaje Conocer el concepto de disolución y calcular la concentración de esta en ejercicios, de forma lógica. Contenidos 1. Definición de
GUÍA DE EJERCICIOS DISOLUCIONES Área Química Resultados de aprendizaje Conocer el concepto de disolución y calcular la concentración de esta en ejercicios, de forma lógica. Contenidos 1. Definición de
COLECCIÓN DE PROBLEMAS TEMA 0 QUÍMICA 2º BACHILLERATO. SANTILLANA. Dónde habrá mayor número de átomos, en 1 mol de metanol o en 1 mol
 COLECCIÓN DE PROBLEMAS TEMA 0 QUÍMICA 2º BACHILLERATO. SANTILLANA. Dónde habrá mayor número de átomos, en 1 mol de metanol o en 1 mol de ácido metanoico (ácido fórmico)? Si tenemos en cuenta las fórmulas
COLECCIÓN DE PROBLEMAS TEMA 0 QUÍMICA 2º BACHILLERATO. SANTILLANA. Dónde habrá mayor número de átomos, en 1 mol de metanol o en 1 mol de ácido metanoico (ácido fórmico)? Si tenemos en cuenta las fórmulas
Ejercicios tema 6: Teoría atómico-molecular de la materia
 Ejercicios tema 6: Teoría atómico-molecular de la materia 1. Tres muestras de carbono de masas 3,62; 5,91 y 7,07 g se queman en exceso de aire con lo que se produce dióxido de carbono en los tres casos
Ejercicios tema 6: Teoría atómico-molecular de la materia 1. Tres muestras de carbono de masas 3,62; 5,91 y 7,07 g se queman en exceso de aire con lo que se produce dióxido de carbono en los tres casos
La materia se puede definir como todo aquello que tiene masa y ocupa un volumen.
 Tema 2: LA MATERIA Que es la materia? La materia se puede definir como todo aquello que tiene masa y ocupa un volumen. Clasificación de la materia (criterio: separación) Mezclas Sustancias puras Composición
Tema 2: LA MATERIA Que es la materia? La materia se puede definir como todo aquello que tiene masa y ocupa un volumen. Clasificación de la materia (criterio: separación) Mezclas Sustancias puras Composición
ESTADOS DE AGREGACIÓN DE LA MATERIA
 LA MATERIA LA MATERIA Materia es todo aquello que ocupa un lugar en el espacio y tiene masa. La madera, el agua, el corcho, la sal,.. Son clases diferentes de materia. Las clases de materia que se utilizan
LA MATERIA LA MATERIA Materia es todo aquello que ocupa un lugar en el espacio y tiene masa. La madera, el agua, el corcho, la sal,.. Son clases diferentes de materia. Las clases de materia que se utilizan
FICHA 5: DISOLUCIONES %masa y % volumen
 FICHA 5: DISOLUCIONES %masa y % volumen 1. Calcula el % en masa de una disolución que contiene 30 g de soluto en 1 L de agua. Sol.: 2,9% 2. El vinagre es una disolución de ácido acético en agua al 3% en
FICHA 5: DISOLUCIONES %masa y % volumen 1. Calcula el % en masa de una disolución que contiene 30 g de soluto en 1 L de agua. Sol.: 2,9% 2. El vinagre es una disolución de ácido acético en agua al 3% en
Materia: FÍSICA Y QUÍMICA 3º E.S.O Curso
 ACTIVIDADES FÍSICA Y QUÍMICA 3º ESO PROGRAMA DE REFUERZO. PRIMERA PARTE 1.-Calcular el tanto por ciento en peso y en volumen de una disolución que se prepara al disolver 40 ml de ácido nítrico cuya densidad
ACTIVIDADES FÍSICA Y QUÍMICA 3º ESO PROGRAMA DE REFUERZO. PRIMERA PARTE 1.-Calcular el tanto por ciento en peso y en volumen de una disolución que se prepara al disolver 40 ml de ácido nítrico cuya densidad
So S l o u l c u i c o i n o e n s e
 Soluciones SOLUCIONES mezclas homogéneas de dos sustancias: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA GASEOSA Cuando un sólido se disuelve en un líquido las partículas que lo
Soluciones SOLUCIONES mezclas homogéneas de dos sustancias: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA GASEOSA Cuando un sólido se disuelve en un líquido las partículas que lo
LOS GASES Y LAS DISOLUCIONES. Departamento de Física y Química 3º ESO
 LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual Disoluciones III: solubilidad y propiedades coligativas SGUICES045CB33-A16V1 Ítem Alternativa Habilidad 1 D Comprensión 2 B Reconocimiento 3 E Reconocimiento 4 D Reconocimiento
SOLUCIONARIO Guía Estándar Anual Disoluciones III: solubilidad y propiedades coligativas SGUICES045CB33-A16V1 Ítem Alternativa Habilidad 1 D Comprensión 2 B Reconocimiento 3 E Reconocimiento 4 D Reconocimiento
Disoluciones. Tema 8. Una disolución es una mezcla homogénea de dos o más sustancias. disolución
 Disoluciones Tema 8 Química General e Inorgánica A Una disolución es una mezcla homogénea de dos o más sustancias disolución soluto disolvente El soluto es la sustancia que se encuentra en menor cantidad
Disoluciones Tema 8 Química General e Inorgánica A Una disolución es una mezcla homogénea de dos o más sustancias disolución soluto disolvente El soluto es la sustancia que se encuentra en menor cantidad
EJERCICIOS RESUELTOS DISOLUCIONES
 EJERCICIOS RESUELTOS DISOLUCIONES 1- Se disuelven 20 g de NaOH en 560 g de agua Calcula a) la concentración de la en % en masa b) su molalidad Ar(Na) 2 Ar(O)16 Ar(H)1 NaOH 20 a) % NaOH % NaOH % NaOH,45
EJERCICIOS RESUELTOS DISOLUCIONES 1- Se disuelven 20 g de NaOH en 560 g de agua Calcula a) la concentración de la en % en masa b) su molalidad Ar(Na) 2 Ar(O)16 Ar(H)1 NaOH 20 a) % NaOH % NaOH % NaOH,45
CLASIFICACIÓN DE LA MATERIA
 1. Clasificación de la materia por su aspecto CLASIFICACIÓN DE LA MATERIA La materia homogénea es la que presenta un aspecto uniforme, en la cual no se pueden distinguir a simple vista sus componentes.
1. Clasificación de la materia por su aspecto CLASIFICACIÓN DE LA MATERIA La materia homogénea es la que presenta un aspecto uniforme, en la cual no se pueden distinguir a simple vista sus componentes.
EJERCICIOS DE SELECTIVIDAD. Reacciones de transferencia de protones: Reacciones ácido-base
 EJERCICIOS DE SELECTIVIDAD Reacciones de transferencia de protones: Reacciones ácido-base CUESTIONES 1.- Razone la veracidad o falsedad de las siguientes afirmaciones: a) A igual molaridad, cuanto más
EJERCICIOS DE SELECTIVIDAD Reacciones de transferencia de protones: Reacciones ácido-base CUESTIONES 1.- Razone la veracidad o falsedad de las siguientes afirmaciones: a) A igual molaridad, cuanto más
LA MATERIA. - Masa - Volumen -Energía - Carga eléctrica. Propiedades generales
 TEMA 2 La Materia LA MATERIA Propiedades generales - Masa - Volumen -Energía - Carga eléctrica Propiedades características - Densidad - Punto de fusión - Punto de ebullición -Conductividad eléctrica -
TEMA 2 La Materia LA MATERIA Propiedades generales - Masa - Volumen -Energía - Carga eléctrica Propiedades características - Densidad - Punto de fusión - Punto de ebullición -Conductividad eléctrica -
U.D. 2 LA MATERIA. Para describir un cuerpo o un sistema material, necesitamos conocer sus propiedades. Así, distinguimos entre:
 U.D. 2 LA MATERIA 1. Propiedades de la materia La materia, o sistema material, es todo lo que posee una propiedad fundamental llamada masa, y que ocupa un espacio, es decir, un volumen. Para describir
U.D. 2 LA MATERIA 1. Propiedades de la materia La materia, o sistema material, es todo lo que posee una propiedad fundamental llamada masa, y que ocupa un espacio, es decir, un volumen. Para describir
SOLUCIONES. Coordinadora de Enseñanza de Bioquímica y Biología Molecular. Fac. de Medicina. UNAM
 SOLUCIONES M. en C. Alicia Cea Bonilla Coordinadora de Enseñanza de Bioquímica y Biología Molecular. Fac. de Medicina. UNAM 1 Qué es una solución? Es una mezcla homogénea de dos o más sustancias. La sustancia
SOLUCIONES M. en C. Alicia Cea Bonilla Coordinadora de Enseñanza de Bioquímica y Biología Molecular. Fac. de Medicina. UNAM 1 Qué es una solución? Es una mezcla homogénea de dos o más sustancias. La sustancia
Departamento Ciencias. Física y Química MATERIA. se clasifica en. SUSTANCIAS PURAS pueden ser. por métodos. físicos originan. Compuestos.
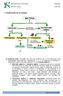 1. Clasificación de la materia MATERIA se clasifica en MEZCLAS pueden ser por métodos físicos originan SUSTANCIAS PURAS pueden ser Heterogéneas Homogéneas Compuestos como las Disoluciones formados por
1. Clasificación de la materia MATERIA se clasifica en MEZCLAS pueden ser por métodos físicos originan SUSTANCIAS PURAS pueden ser Heterogéneas Homogéneas Compuestos como las Disoluciones formados por
PSU MÓDULO COMÚN QUÍMICA PROPIEDADES COLIGATIVAS
 DEPARTAMENTO DE CIENCIAS PSU_MÓDULO COMÚN DE QUÍMICA PSU MÓDULO COMÚN QUÍMICA PROPIEDADES COLIGATIVAS Corresponden a las nuevas propiedades del solvente, debido que el soluto altera al solvente puro en
DEPARTAMENTO DE CIENCIAS PSU_MÓDULO COMÚN DE QUÍMICA PSU MÓDULO COMÚN QUÍMICA PROPIEDADES COLIGATIVAS Corresponden a las nuevas propiedades del solvente, debido que el soluto altera al solvente puro en
INSTITUCION EDUCATIVA LA PRESENTACION
 INSTITUCION EDUCATIVA LA PRESENTACION NOMBRE ALUMNA: AREA : CIENCIAS NATURALES Y EDUCACION AMBIENTAL ASIGNATURA: QUIMICA DOCENTE: OSCAR GIRALDO HERNANDEZ TIPO DE GUIA: CONCEPTUAL - EJERCITACION PERIODO
INSTITUCION EDUCATIVA LA PRESENTACION NOMBRE ALUMNA: AREA : CIENCIAS NATURALES Y EDUCACION AMBIENTAL ASIGNATURA: QUIMICA DOCENTE: OSCAR GIRALDO HERNANDEZ TIPO DE GUIA: CONCEPTUAL - EJERCITACION PERIODO
CLASIFICACIÓN DE LA MATERIA
 Separación de sustancias Elementos y compuestos Fernández Monroy, Mª Ernestina; Gutiérrez Múzquiz, Félix A. y Marco Viñes, José Manuel Física y Química: guía interactiva para la resolución de ejercicios
Separación de sustancias Elementos y compuestos Fernández Monroy, Mª Ernestina; Gutiérrez Múzquiz, Félix A. y Marco Viñes, José Manuel Física y Química: guía interactiva para la resolución de ejercicios
SOLUCIONES. Es la sustancia que se disuelve y siempre se encuentra en menor proporción, ya sea en peso o volumen.
 SOLUCIONES SOLUCIÓN (disoluciones): Son mezclas homogéneas(una FASE) que contiene dos tipos de sustancias denominadas SOLUTO y SOLVENTE; que se mezclan en proporciones variables; sin cambio alguno en su
SOLUCIONES SOLUCIÓN (disoluciones): Son mezclas homogéneas(una FASE) que contiene dos tipos de sustancias denominadas SOLUTO y SOLVENTE; que se mezclan en proporciones variables; sin cambio alguno en su
TEMA 2: DIVERSIDAD DE LA MATERIA
 TEMA 2: DIVERSIDAD DE LA MATERIA 1.- La materia: sustancias puras y mezclas. 1.1.- La materia. 1.1.1.- Estados de agregación de la materia. 1.1.2.- Propiedades generales y características de la materia.
TEMA 2: DIVERSIDAD DE LA MATERIA 1.- La materia: sustancias puras y mezclas. 1.1.- La materia. 1.1.1.- Estados de agregación de la materia. 1.1.2.- Propiedades generales y características de la materia.
Problemas resueltos de propiedades coligativas.
 Problemas resueltos de propiedades coligativas. Propiedades aditivas: las propiedades son aditivas cuando son iguales a la suma de los valores aislados de sus componentes Propiedades constitutivas: una
Problemas resueltos de propiedades coligativas. Propiedades aditivas: las propiedades son aditivas cuando son iguales a la suma de los valores aislados de sus componentes Propiedades constitutivas: una
