PROPIEDADES DEL GAS NATURAL
|
|
|
- Tomás Gutiérrez Ortiz de Zárate
- hace 6 años
- Vistas:
Transcripción
1 REPUBLICA BOLIVARIANA DE VENEZUELA INSTITUTO UNIVERSITARIO DE TECNOLOGIA DE ADMINISTRACION INDUSTRIAL EXTENSION PUERTO LA CRUZ CONVENIO MARCO DE COOPERACION INTERISTITUCIONAL UNERMB IUTA PROPIEDADES DEL GAS NATURAL Ing. MONICA MARTÍNEZ T.S.U Leislani Hernández Luis Donato Luis Ramón Ignacio Luis Cruz R. González
2 José G. Guzmán Abraham Caguana SECCION IG401I Puerto la cruz, octubre de 2014 ÍNDICE Pág Introducción Propiedades Físicas del gas natural...4 Gravedad específica..5 Densidad.pg Viscosidad. ug Factor volumétrico.bg Compresibidad.cg Factor de compresibilidad Conclusión...11 Bibliografía. 12
3 INTRODUCCIÓN El gas natural es una mezcla de gases hidrocarburos, principalmente metano, cantidades menores de etano, propano, butano y finalmente cantidades variables de otros gases no hidrocarburos (contaminantes), como nitrógeno (N2), dióxido de carbono (CO2), sulfuro de hidrógeno (H2S), helio (He),vapor de agua, etc. El gas natural puede obtenerse como tal en yacimientos de gas libre o asociado en yacimientos de petróleo y de condensado (porciones volátiles de petróleo). En general el petróleo y el gas son mezclas de hidrocarburos de una composición química compleja que se encuentran en un yacimiento a determinadas condiciones de presión y temperatura. En el presente trabajo de investigación se describirán algunas propiedades físicas del gas natural como (densidad, gravedad específica, viscosidad, comprensibilidad, factor de compresibilidad Z y factor volumétrico de formación Bg. El conocimiento de las propiedades físicas es indispensable para evaluar, en términos de volúmenes de líquido y gas, lo que produce una unidad de fluido del yacimiento y permite incrementar la eficiencia de los procesos y evitar daños operacionales.
4 PROPIEDADES DEL GAS NATURAL El gas en su forma más simple es un fluido homogéneo, generalmente de baja densidad y viscosidad, sin volumen definido que ocupa cualquier espacio en el cual se coloca. Las propiedades físicas del gas natural pueden estar en función o no de la presión y la temperatura, su conocimiento permite incrementar la eficiencia de los procesos y evitar daños operacionales. DENSIDAD Es el peso de un volumen de vapor o gas puro (sin aire presente) comparado con el peso de un volumen igual de aire seco a la misma temperatura y presión. Una densidad de vapor menor a 1 (uno) indica que el vapor es más ligero que el aire y que tenderá a elevarse. Una densidad de vapor mayor a 1 (uno) indica que el vapor es más pesado que el aire y tenderá a descender hacia el suelo. EJEMPLO Calcular la densidad, volumen específico y la densidad relativa de metano a 0 lpcm (14.7 lpca) y 60 F.
5 GRAVEDAD ESPECÍFICA La gravedad específica de un gas, se define como la relación entre su densidad y la densidad del aire. La gravedad específica del gas es proporcional a su peso molecular, PM, cuando éste se mide a bajas presiones donde el comportamiento del gas se aproxima a la idealidad. Una vez se obtiene el peso molecular, la gravedad del gas se determina dividiendo su peso molecular entre (peso molecular del aire). De esta podemos definir la gravedad específica de un gas como:
6 Definiendo como: ρ= densidad Mg= masa del gas. Ma= masa del aire (constante) R= constante para los gases su valor depende de las unidades empleadas de presión, volumen y temperatura. Uno de los principales factores de la gravedad específica de un gas en mayor medida que la densidad del gas es porque esta no varía con respecto a la presión y temperatura mientras que la densidad si ya que se ve afectada principalmente por estos dos factores, así que la gravedad especifica es independiente de estos factores siempre y cuando el gas siga la ley de los gases perfectos. Aplicación: Permite definir el peso del gas en relación al aire, lo cual lo podemos aplicar en casos de fugas de fluidos. Ejemplo: calcular la densidad y la gravedad específica del metano (C1) a (14.7 lpca) de presión y 60 F de temperatura. R= (460+ F) =520 ρ c 1= P.M R.T = (14.7) (16.043) = 0, 0423 lbs/pie3 (10.732) (520) γc 1= Mg Ma = = 0,5539
7 Se debe tomar en cuenta que el valor de γ no depende de la presion y la temperatura. En la tabla 8 podemos observar la composición típica del gas natural en diferentes áreas de Venezuela con su respectiva gravedad especifica. VISCOSIDAD DEL GAS ug Es la relación entre el esfuerzo cortante y la velocidad del esfuerzo cortante que se aplica a una porción del fluido para que adquiera movimiento. La viscosidad de los gases presenta el siguiente comportamiento: -A bajas presiones menor a 1500lpc un aumento de temperatura aumentara la viscosidad. -A cualquier temperatura si se aumenta la presión la viscosidad aumenta debido a la disminución de las distancias intermoleculares. -La viscosidad será mayor a medida que el gas posea componentes mas pesados debido a que sus moleculas seran mas grandes. FACTOR VOLUMETRICO DEL GAS Relaciona el volumen del gas en el yacimiento (a P y T) al volumen de la misma masa de gas en superficie a 14,7 lpca y 60 F. Es un factor adimensional. Se expresa en BY/PCN o PCY/PCN. Toma valores muy pequeños por expansibilidad del gas. Bg= 14,7 Zg T = 0,02829 Zg T PCY 520 p p PCN COMPRESIBILIDAD DEL GAS Cg Es la propiedad que presentan los gases de poder ser comprimidos. Según BOYLE el volumen del gas contenido en un recipiente se reduce si se aumenta la presión. P. V= Cte. A temperatura constante la presión y el volumen son magnitudes inversamente proporcionales. FACTOR DE COMPRESIBILIDAD Z
8 El factor de compresibilidad del gas Z, por definición es la razón del volumen que realmente ocupa un gas a determinada presión y temperatura, con respecto al volumen que ocuparía el mismo gas si se comportara como ideal así: Z =Va = volumen actual de n moles de gas a P y T Vi volumen ideal d n moles de gas a P y T El valor del factor de compresibilidad Z ha sido determinado experimentalmente para algunos gases puros (ver tabla de propiedades para sustancias puras). Este factor puede ser menor o mayor que la unidad dependiendo de la presión y la temperatura. A medida que la presión aumenta, Z disminuye pasando por un mínimo a determinada presión y para aumentos posteriores de presión, Z aumenta pasando por la unidad y sigue aumentando por este valor. El aprendizaje que debe tenerse es que para valores muy altos de presión, Z tiende a ser mayor que la unidad. (Ver grafica 1. Factor de compresibilidad de gases naturales con función de presión y temperatura seudoreducidas). El valor de Z para diferentes gases se determina con base en el teorema de los estados que dice: dos sistemas (mezclas de hidrocarburos) tienen propiedades similares en determinadas condiciones correspondientes con referencia a las condiciones críticas). Para el caso de los gases, se emplean como condiciones correspondientes la presión y temperatura seudoreducidas. Es decir; en las mismas condiciones de presión y temperatura seudoreducidas cualquier gas tiene el mismo factor de compresibilidad Z. En la práctica se disponen de varios métodos para la determinación del factor de compresibilidad de un gas. Entre los más comunes están: Método de Standing-Katz.
9 Método de refracción molecular de Eikman. Método de pitzer. Otros métodos utilizados con programas de computadora. Método de Standing-Katz: es el más popular para calcular el factor Z de gases dulces y que contengan pequeñas cantidades de gases no hidrocarburos. El método se basa en la grafica 1 donde Z está representado gráficamente en función de la presión y la temperatura seudoreducidas. esta grafica puede emplearse aproximadamente hasta lpca con desviaciones del 1%. Este método ha sido modificado por Whitchert y Aziz con el fin de aplicarlo para gases agrios (gases que contienen H2S y CO2)
10 Grafica 1Factor de compresibilidad de gases naturales con función de presión y temperatura seudorreducida.
11 Gráfica 4 comparación de los factores Z para diferentes gases.
12 . Factor de corrección Fsk R a la T seudocritica en la determinación de Z por el método de Standing-katz para gases agrios según Witchert y Aziz
13 CONCLUSIÓN El gas en su forma más simple es un fluido homogéneo, generalmente de baja densidad y viscosidad, sin volumen definido que ocupa cualquier espacio en el cual se coloca. Las propiedades físicas del gas natural pueden estar en función o no de la presión y la temperatura, su conocimiento permite incrementar la eficiencia de los procesos y evitar daños operacionales.
14 BIBLIOGRAFÍA YUNUS A. CENGEL, MICHAEL A. BOLES. TERMODINÁMICA Tomo 1. Segunda edición. RAMIRO PEREZ PALACIOS, MARCIAS J. MARTINEZ. INGENIERIA DEL GAS NATURAL J.M.SMITH. INTRODUCCION A LA TERMODINAMICA EN INGENIERÍA QUÍMICA
ESTIMACION DE LA PRESION DE CONVERGENCIA, CONSTANTE DE EQUILIBRIO Y FASES DEL GAS NATURAL
 República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación Superior Universidad Nacional Experimental Rafael María Baralt Programa: Ingeniería y Tecnología Proyecto: Ingeniería en
República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación Superior Universidad Nacional Experimental Rafael María Baralt Programa: Ingeniería y Tecnología Proyecto: Ingeniería en
TEMA 1 Cambios de fase
 TEMA 1 Cambios de fase 1.1. Introducción CLIMATIZACIÓN: crear y mantener un ambiente térmico en un espacio para desarrollar eficientemente una determinada actividad CONFORT O BIENESTAR: - Térmico - Lumínico
TEMA 1 Cambios de fase 1.1. Introducción CLIMATIZACIÓN: crear y mantener un ambiente térmico en un espacio para desarrollar eficientemente una determinada actividad CONFORT O BIENESTAR: - Térmico - Lumínico
INGENIERO. JOSMERY SÁNCHEZ
 UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA REALIZADO POR: INGENIERO.
UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA REALIZADO POR: INGENIERO.
TEMA 2: LEYES Y CONCEPTOS BÁSICOS EN QUÍMICA
 1. SUSTANCIAS PURAS Y MEZCLAS 2. LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS 2.1. LEY DE CONSERVACIÓN DE LA MATERIA Enunciada en 1783 por Lavoisier: La materia ni se crea ni se destruye, únicamente
1. SUSTANCIAS PURAS Y MEZCLAS 2. LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS 2.1. LEY DE CONSERVACIÓN DE LA MATERIA Enunciada en 1783 por Lavoisier: La materia ni se crea ni se destruye, únicamente
BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA
 BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA Unidad 2: Los gases ideales Teresa Esparza araña 1 Índice 1. Los estados de agregación de la materia a. Los estados de la materia b. Explicación según la teoría
BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA Unidad 2: Los gases ideales Teresa Esparza araña 1 Índice 1. Los estados de agregación de la materia a. Los estados de la materia b. Explicación según la teoría
LEYES DE LOS GASES. Leyes de los gases. Leyes de los gases
 LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
Física y Química 1º Bachillerato LOMCE
 Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 201 2016 Unidad Didáctica 1 Rev 01 Las Leyes Ponderales y Las Leyes de los Gases Ideales 1.1 Las
Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 201 2016 Unidad Didáctica 1 Rev 01 Las Leyes Ponderales y Las Leyes de los Gases Ideales 1.1 Las
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2012 Se disponen de tres recipientes que contienen en estado gaseoso 1 L de metano, 2 L de nitrógeno
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2012 Se disponen de tres recipientes que contienen en estado gaseoso 1 L de metano, 2 L de nitrógeno
C: GASES Y PRESIÓN DE VAPOR DEL AGUA
 hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2014 La fórmula empírica de un compuesto orgánico es C 4 H 8 S. Si su masa molecular es 88, determine:
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2014 La fórmula empírica de un compuesto orgánico es C 4 H 8 S. Si su masa molecular es 88, determine:
TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES
 TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES FUNDAMENTO TEÓRICO: La materia puede estar en tres estados: sólido, líquido y gaseoso. Los gases, no tienen forma ni volumen fijo, las fuerzas que mantienen
TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES FUNDAMENTO TEÓRICO: La materia puede estar en tres estados: sólido, líquido y gaseoso. Los gases, no tienen forma ni volumen fijo, las fuerzas que mantienen
5) En 20 g de Ni 2 (CO 3 ) 3 : a) Cuántos moles hay de dicha sal? b) Cuántos átomos hay de oxígeno? c) Cuántos moles hay de iones carbonato?
 QUÍMICA 2º BACH. SELECTIVIDAD: MOL-N A 1) Para un mol de agua, justifique la veracidad o falsedad de las siguientes afirmaciones: a) En condiciones normales de presión y temperatura, ocupa un volumen de
QUÍMICA 2º BACH. SELECTIVIDAD: MOL-N A 1) Para un mol de agua, justifique la veracidad o falsedad de las siguientes afirmaciones: a) En condiciones normales de presión y temperatura, ocupa un volumen de
TAREA 1. Nombre Núm. de lista Grupo Turno Núm. de Expediente Fecha
 TAREA 1 Nombre Núm. de lista Grupo Turno Núm. de Expediente Fecha INSTRUCCIONES: Investiga como es el puente de Hidrógeno en las estructuras del H 2 O, NH 3 y HF. Dibuja los modelos resaltando con color
TAREA 1 Nombre Núm. de lista Grupo Turno Núm. de Expediente Fecha INSTRUCCIONES: Investiga como es el puente de Hidrógeno en las estructuras del H 2 O, NH 3 y HF. Dibuja los modelos resaltando con color
Unidad 0 CÁLCULOS QUÍMICOS. Unidad 0. Cálculos químicos
 Unidad 0 CÁLCULOS QUÍMICOS Unidad 0. Cálculos químicos 1 0. Leyes ponderales Leyes que rigen las combinaciones químicas. Se basan en la experimentación y miden cuantitativamente la cantidad de materia
Unidad 0 CÁLCULOS QUÍMICOS Unidad 0. Cálculos químicos 1 0. Leyes ponderales Leyes que rigen las combinaciones químicas. Se basan en la experimentación y miden cuantitativamente la cantidad de materia
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas.
 LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
Masas atómicas (g/mol): O = 16; S = 32; Zn = 65,4. Sol: a) 847 L; b) 710,9 g; c) 1,01 atm.
 1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
Profesora: Teresa Esparza Araña LA CANTIDAD DE SUSTANCIA EN QUÍMICA. UNIDAD 6: Los gases ideales
 Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla LA CANTIDAD DE SUSTANCIA EN QUÍMICA UNIDAD 6: Los gases ideales 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA DE LA
Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla LA CANTIDAD DE SUSTANCIA EN QUÍMICA UNIDAD 6: Los gases ideales 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA DE LA
P V = n R T LEYES DE LOS GASES
 P V = n R T LEYES DE LOS GASES Estado gaseoso Medidas en gases Leyes de los gases Ley de Avogadro Leyes de los gases Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac
P V = n R T LEYES DE LOS GASES Estado gaseoso Medidas en gases Leyes de los gases Ley de Avogadro Leyes de los gases Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac
CANTIDAD DE SUSTANCIA. EL MOL. Física y Química 3º de E.S.O. IES Isidra de Guzmán
 CANTIDAD DE SUSTANCIA. EL MOL Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción Es fácil contar los garbanzos que hay en un puñado de esta legumbre. Hay que tener más paciencia para contar
CANTIDAD DE SUSTANCIA. EL MOL Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción Es fácil contar los garbanzos que hay en un puñado de esta legumbre. Hay que tener más paciencia para contar
PRÁCTICA 1 PRESIÓN. Laboratorio de Termodinámica
 PRÁCTICA 1 PRESIÓN Laboratorio de Termodinámica M del Carmen Maldonado Susano Enero 2015 Antecedentes Fluido Es aquella sustancia que debido a su poca cohesión intermolecular carece de forma propia y adopta
PRÁCTICA 1 PRESIÓN Laboratorio de Termodinámica M del Carmen Maldonado Susano Enero 2015 Antecedentes Fluido Es aquella sustancia que debido a su poca cohesión intermolecular carece de forma propia y adopta
Electricidad y calor. Dr. Roberto Pedro Duarte Zamorano. Departamento de Física
 Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
DIFERENCIA ENTRE FLUIDOS Y SÓLIDOS
 DIFERENCIA ENTRE FLUIDOS Y SÓLIDOS Se le llama fluido a toda aquella sustancia continua que puede fluir. Los fluidos pueden ser gaseosos y líquidos. Esta es la diferencia fundamental entre un sólido, cuya
DIFERENCIA ENTRE FLUIDOS Y SÓLIDOS Se le llama fluido a toda aquella sustancia continua que puede fluir. Los fluidos pueden ser gaseosos y líquidos. Esta es la diferencia fundamental entre un sólido, cuya
Física y Química 1º Bach.
 Física y Química 1º Bach. Leyes de los gases. Teoría cinético-molecular 05/11/10 DEPARTAMENTO FÍSICA E QUÍMICA Nombre: OPCIÓN 1 1. Observa el aparato de la Figura. Si la temperatura del aceite se eleva
Física y Química 1º Bach. Leyes de los gases. Teoría cinético-molecular 05/11/10 DEPARTAMENTO FÍSICA E QUÍMICA Nombre: OPCIÓN 1 1. Observa el aparato de la Figura. Si la temperatura del aceite se eleva
Oferta tecnológica: Método y equipo para medir la cantidad de gas o fluido supercrítico sorbido por una muestra
 Oferta tecnológica: Método y equipo para medir la cantidad de gas o fluido supercrítico sorbido por una muestra Oferta tecnológica: Método y equipo para medir la cantidad de gas o fluido supercrítico sorbido
Oferta tecnológica: Método y equipo para medir la cantidad de gas o fluido supercrítico sorbido por una muestra Oferta tecnológica: Método y equipo para medir la cantidad de gas o fluido supercrítico sorbido
Efecto de la Compresibilidad de los Gases durante el Control de una Surgencia. Ing. Hugo Mocchiutti Ing. Tomás Catzman Pan American Energy
 Efecto de la Compresibilidad de los Gases durante el Control de una Ing. Hugo Mocchiutti Ing. Tomás Catzman Pan American Energy Índice Comportamiento de los Gases Control de Pozo Evolución del Gas Ideal
Efecto de la Compresibilidad de los Gases durante el Control de una Ing. Hugo Mocchiutti Ing. Tomás Catzman Pan American Energy Índice Comportamiento de los Gases Control de Pozo Evolución del Gas Ideal
QUÍMICA. La MATERIA REPRESENTACIÓN. Observación Datos Ley Hipótesis Teoría DEFINICIONES BÁSICAS. Propiedades
 QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
Profesora: Teresa Esparza Araña ASPECTOS CUANTITATIVOS DE LA QUÍMICA. UNIDAD 2: Los gases ideales
 Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla ASPECTOS CUANTITATIVOS DE LA QUÍMICA UNIDAD 2: Los gases ideales ÍNDICE 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA
Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla ASPECTOS CUANTITATIVOS DE LA QUÍMICA UNIDAD 2: Los gases ideales ÍNDICE 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA
DISOLUCIONES. Las disoluciones son mezclas homogéneas de dos o más sustancias (componentes) en proporciones variables.
 DISOLUCIONES Las disoluciones son mezclas homogéneas de dos o más sustancias (componentes) en proporciones variables. Soluto es la sustancia que se encuentra en menor proporción. Disolvente es la sustancia
DISOLUCIONES Las disoluciones son mezclas homogéneas de dos o más sustancias (componentes) en proporciones variables. Soluto es la sustancia que se encuentra en menor proporción. Disolvente es la sustancia
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Química
 Gases RECUERDEN QUE: En los ejercicios de gases SIEMPRE deben trabajar con la temperatura en K ( C + 273). Además, por conveniencia, en esta unidad cuando hablemos de masa molar en gases, usaremos la sigla
Gases RECUERDEN QUE: En los ejercicios de gases SIEMPRE deben trabajar con la temperatura en K ( C + 273). Además, por conveniencia, en esta unidad cuando hablemos de masa molar en gases, usaremos la sigla
ANEXO 1: Tablas de las propiedades del aire a 1 atm de presión. ҪENGEL, Yunus A. y John M. CIMBALA, Mecánica de fluidos: Fundamentos y
 I ANEXO 1: Tablas de las propiedades del aire a 1 atm de presión ҪENGEL, Yunus A. y John M. CIMBALA, Mecánica de fluidos: Fundamentos y aplicaciones, 1ª edición, McGraw-Hill, 2006. Tabla A-9. II ANEXO
I ANEXO 1: Tablas de las propiedades del aire a 1 atm de presión ҪENGEL, Yunus A. y John M. CIMBALA, Mecánica de fluidos: Fundamentos y aplicaciones, 1ª edición, McGraw-Hill, 2006. Tabla A-9. II ANEXO
Parte I. Escoge la mejor contestación 1) Cuál es la unidad básica para medir cantidades de sustancias? a. Depende del tipo de sustancia que quieras
 Parte I. Escoge la mejor contestación 1) Cuál es la unidad básica para medir cantidades de sustancias? a. Depende del tipo de sustancia que quieras medir b. Litros c. Moles d. Kilogramos 2) Cuál es la
Parte I. Escoge la mejor contestación 1) Cuál es la unidad básica para medir cantidades de sustancias? a. Depende del tipo de sustancia que quieras medir b. Litros c. Moles d. Kilogramos 2) Cuál es la
EQUILIBRIO LÍQUIDO-VAPOR PRESIÓN DE VAPOR Y ENTALPÍA DE VAPORIZACIÓN DEL AGUA
 EQUILIBRIO LÍQUIDO-VAPOR PRESIÓN DE VAPOR Y ENTALPÍA DE VAPORIZACIÓN DEL AGUA I. OBJETIVO GENERAL Comprender e interpretar el significado de las variables termodinámicas involucradas en la ecuación de
EQUILIBRIO LÍQUIDO-VAPOR PRESIÓN DE VAPOR Y ENTALPÍA DE VAPORIZACIÓN DEL AGUA I. OBJETIVO GENERAL Comprender e interpretar el significado de las variables termodinámicas involucradas en la ecuación de
LOS GASES Y LAS DISOLUCIONES. Departamento de Física y Química 3º ESO
 LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
Los gases y la Teoría Cinética
 Para practicar Utiliza tu cuaderno y trata de resolver los siguientes ejercicios: 1.-En una tabla similar a la siguiente, introduce las propiedades características de un SÓLIDO, un LÍQUDO o un GAS, como
Para practicar Utiliza tu cuaderno y trata de resolver los siguientes ejercicios: 1.-En una tabla similar a la siguiente, introduce las propiedades características de un SÓLIDO, un LÍQUDO o un GAS, como
ESTADOS DE LA MATERIA
 ESTADOS DE LA MATERIA M en C Alicia Cea Bonilla 1 Existen tres estados de la materia: sólido, líquido y gaseoso, dependiendo de la distancia entre sus partículas, de las fuerzas de atracción entre éstas
ESTADOS DE LA MATERIA M en C Alicia Cea Bonilla 1 Existen tres estados de la materia: sólido, líquido y gaseoso, dependiendo de la distancia entre sus partículas, de las fuerzas de atracción entre éstas
PROCESOS ADIABÁTICOS
 PROCESOS ADIABÁTICOS AIRE GAS Leyes de los gases perfectos Masa Sujeto a la acción de las energías mecánica y calorífica Leyes de la termodinámica Ley de los gases p= δrt δ= densidad de gas R= constante
PROCESOS ADIABÁTICOS AIRE GAS Leyes de los gases perfectos Masa Sujeto a la acción de las energías mecánica y calorífica Leyes de la termodinámica Ley de los gases p= δrt δ= densidad de gas R= constante
Sustancias puras, procesos de cambios de fase, diagramas de fase. Estado 3 Estado 4 Estado 5. P =1 atm T= 100 o C. Estado 3 Estado 4.
 TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
XVII EXPOSICION INTERNACIONAL DEL GAS
 XVII EXPOSICION INTERNACIONAL DEL GAS EL GAS DE CAMPO Y SUS APLICACIONES EN MOTORES DE COMBUSTION INTERNA UNA BREVE INTRODUCCION Con el Crecimiento de la Demanda Energética Mundial, el hombre se ha visto
XVII EXPOSICION INTERNACIONAL DEL GAS EL GAS DE CAMPO Y SUS APLICACIONES EN MOTORES DE COMBUSTION INTERNA UNA BREVE INTRODUCCION Con el Crecimiento de la Demanda Energética Mundial, el hombre se ha visto
PRÁCTICA 3 PRESIÓN. Laboratorio de Principios de Termodinámica y Electromagnetismo
 PRÁCTICA 3 PRESIÓN Laboratorio de Principios de Termodinámica y Electromagnetismo M del Carmen Maldonado Susano 2015 Antecedentes Fluido Es aquella sustancia que debido a su poca cohesión intermolecular
PRÁCTICA 3 PRESIÓN Laboratorio de Principios de Termodinámica y Electromagnetismo M del Carmen Maldonado Susano 2015 Antecedentes Fluido Es aquella sustancia que debido a su poca cohesión intermolecular
Unidad 16: Temperatura y gases ideales
 Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
Carrera: MCT 0540. Participantes. Representantes de las academias de Ingeniería Mecánica de Institutos Tecnológicos. Academia de Ingeniería
 1.- DATOS DE LA ASIGNATURA Nombre de la asignatura: Carrera: Clave de la asignatura: Horas teoría-horas práctica-créditos Termodinámica Ingeniería Mecánica MCT 0540 2 3 7 2.- HISTORIA DEL PROGRAMA Lugar
1.- DATOS DE LA ASIGNATURA Nombre de la asignatura: Carrera: Clave de la asignatura: Horas teoría-horas práctica-créditos Termodinámica Ingeniería Mecánica MCT 0540 2 3 7 2.- HISTORIA DEL PROGRAMA Lugar
TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS
 TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS 1. LA MATERIA Y SU ASPECTO Los sistemas materiales, formados por una o varias sustancias, pueden clasificarse en: - Sistemas materiales heterogéneos: presentan
TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS 1. LA MATERIA Y SU ASPECTO Los sistemas materiales, formados por una o varias sustancias, pueden clasificarse en: - Sistemas materiales heterogéneos: presentan
GASES - PREGUNTAS DE TEST (2016) En la última página se ofrecen las soluciones
 GASES - PREGUNTAS DE TEST (2016) En la última página se ofrecen las soluciones Grupo A - CONCEPTOS GENERALES: CONCEPTO DE GAS Y VAPOR Grupo B - LEYES GENERALES DE LOS GASES IDEALES: Grupo C- LEY DE GRAHAM
GASES - PREGUNTAS DE TEST (2016) En la última página se ofrecen las soluciones Grupo A - CONCEPTOS GENERALES: CONCEPTO DE GAS Y VAPOR Grupo B - LEYES GENERALES DE LOS GASES IDEALES: Grupo C- LEY DE GRAHAM
Ecuación de estado del gas ideal
 Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
En el siglo XVIII la química estableció las medidas precisas de masa y volúmenes que llevaron a enunciar las llamadas leyes ponderales.
 1. LEYES PONDERALES En el siglo XVIII la química estableció las medidas precisas de masa y volúmenes que llevaron a enunciar las llamadas leyes ponderales. Ley de conservación de la masa de Lavoisier Lavosier
1. LEYES PONDERALES En el siglo XVIII la química estableció las medidas precisas de masa y volúmenes que llevaron a enunciar las llamadas leyes ponderales. Ley de conservación de la masa de Lavoisier Lavosier
de aire. Determinar la composicion de la mezcla resultante. Cuál es el porcentaje en exceso de aire, suponiendo conversion completa?
 C A P Í T U L O 2 Dada la importancia que tienen los procesos de combustión en la generación de contaminantes, en este capítulo se han incluido algunos ejercicios relacionados con la combustión estequiométrica.
C A P Í T U L O 2 Dada la importancia que tienen los procesos de combustión en la generación de contaminantes, en este capítulo se han incluido algunos ejercicios relacionados con la combustión estequiométrica.
Director de Curso Francisco J. Giraldo R.
 Director de Curso Francisco J. Giraldo R. EL AIRE El aire seco es una mezcla de gases: El 78% es Nitrógeno. El 21% es Oxígeno. El 1% es Argón. El Dioxido de carbono (CO 2 ), Helio (He), Neón (Ne), Kripton
Director de Curso Francisco J. Giraldo R. EL AIRE El aire seco es una mezcla de gases: El 78% es Nitrógeno. El 21% es Oxígeno. El 1% es Argón. El Dioxido de carbono (CO 2 ), Helio (He), Neón (Ne), Kripton
GUIA PRATICA TEMA: GASES IDEALES
 UNIDAD 3: GASES (TEMA 2: GASES IDEALES) UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSE DE SUCRE VICE RECTORADO PUERTO ORDAZ DEPARTAMENTO DE ESTUDIOS GENERALES SECCIÓN DE QUÍMICA Asignatura:
UNIDAD 3: GASES (TEMA 2: GASES IDEALES) UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSE DE SUCRE VICE RECTORADO PUERTO ORDAZ DEPARTAMENTO DE ESTUDIOS GENERALES SECCIÓN DE QUÍMICA Asignatura:
Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea.
 Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea. Mezcla de aceite y agua Mezcla de hielo y agua Las sustancias existen
Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea. Mezcla de aceite y agua Mezcla de hielo y agua Las sustancias existen
Bioquímica Tema 2: Soluciones. Unidades Año: 2013
 TEMA 2: SOLUCIONES Al estudio de las soluciones se le asigna gran importancia, teniendo en cuenta que la mayoría de las reacciones químicas ocurren entre soluciones, particularmente en medios acuosos.
TEMA 2: SOLUCIONES Al estudio de las soluciones se le asigna gran importancia, teniendo en cuenta que la mayoría de las reacciones químicas ocurren entre soluciones, particularmente en medios acuosos.
UNIVERSIDAD DE LEÓN. ESyTIA y EIIIIyA. Prof. Dr. Miguel Celemín Matachana. Dilatación térmica de los gases
 Cap. II: Termodinámica. Lección : Dilatación térmica de los gases Dilatación térmica de los gases La ecuación que proporciona la dilatación de un volumen no sirve para los gases si no se especifica la
Cap. II: Termodinámica. Lección : Dilatación térmica de los gases Dilatación térmica de los gases La ecuación que proporciona la dilatación de un volumen no sirve para los gases si no se especifica la
MODELOS DE SOLUCIÓN. Coeficientes de Actividad a partir de propiedades en exceso
 MODELOS DE SOLUCIÓN Coeficientes de Actividad a partir de propiedades en exceso MODELOS DE SOLUCIÓN Margules 2 sufijos MODELOS DE SOLUCIÓN Margules 3 sufijos MODELOS DE SOLUCIÓN Van Laar MODELOS DE SOLUCIÓN
MODELOS DE SOLUCIÓN Coeficientes de Actividad a partir de propiedades en exceso MODELOS DE SOLUCIÓN Margules 2 sufijos MODELOS DE SOLUCIÓN Margules 3 sufijos MODELOS DE SOLUCIÓN Van Laar MODELOS DE SOLUCIÓN
MAGNITUDES MOLARES COMPOSICIÓN DE LAS DISOLUCIONES. Actividad 7. Actividad 1. Actividad 8. Actividad 2. Actividad 9. Actividad 3.
 MAGNITUDES MOLARES {Respuesta: [a] 0, mol; [b] 0,82 mol; [c] 0,56 mol} Actividad [a] En qué se parecen y en qué se diferencian las siguientes magnitudes: masa molecular relativa y masa molar? [b] Calcula
MAGNITUDES MOLARES {Respuesta: [a] 0, mol; [b] 0,82 mol; [c] 0,56 mol} Actividad [a] En qué se parecen y en qué se diferencian las siguientes magnitudes: masa molecular relativa y masa molar? [b] Calcula
ECUACIONES DE ESTADO AUTOR
 ECUACIONES DE ESTADO AUTOR Fabio E Díaz-López Universidad Santo Tomás de Aquino, Bogotá Colombia e-mail: fabiodiaz@usantotomas.edu.co cel: 300 214 09 12 RESUMEN Se presentan ecuaciones de estado para gases
ECUACIONES DE ESTADO AUTOR Fabio E Díaz-López Universidad Santo Tomás de Aquino, Bogotá Colombia e-mail: fabiodiaz@usantotomas.edu.co cel: 300 214 09 12 RESUMEN Se presentan ecuaciones de estado para gases
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2013 La fórmula molecular del azúcar común o azúcar de mesa (sacarosa) es C12H22O11. Indique razonadamente
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2013 La fórmula molecular del azúcar común o azúcar de mesa (sacarosa) es C12H22O11. Indique razonadamente
DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4
 Universidad Tecnológica Nacional Facultad Regional La Plata DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4 Descenso crioscópico Objeto de la experiencia:
Universidad Tecnológica Nacional Facultad Regional La Plata DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4 Descenso crioscópico Objeto de la experiencia:
Ciencias III, énfasis en Química
 ASIGNATURA: GRADO: BLOQUE APRENDIZAJE ESPERADO CONTENIDO PROGRAMÁTICO Ciencias III, énfasis en Química Tercero I.- Las características de los materiales. Identifica las propiedades extensivas (masa y volumen)
ASIGNATURA: GRADO: BLOQUE APRENDIZAJE ESPERADO CONTENIDO PROGRAMÁTICO Ciencias III, énfasis en Química Tercero I.- Las características de los materiales. Identifica las propiedades extensivas (masa y volumen)
Carlos Martínez B. Ley de Boyle. Carlos Javier Bernal Avila. Viernes, 29 de enero de 2010
 ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS LABORATORIO DE FISICA B Profesor: Carlos Martínez B. Título de la práctica: Ley de Boyle Nombre: Carlos Javier Bernal Avila Grupo
ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS LABORATORIO DE FISICA B Profesor: Carlos Martínez B. Título de la práctica: Ley de Boyle Nombre: Carlos Javier Bernal Avila Grupo
Guía Teórica Experiencia Motor Stirling
 Universidad de Chile Escuela de Verano 2009 Curso de Energía Renovable Guía Teórica Experiencia Motor Stirling Escrito por: Diego Huarapil Enero 2009 Introducción El Motor Stirling es un motor térmico,
Universidad de Chile Escuela de Verano 2009 Curso de Energía Renovable Guía Teórica Experiencia Motor Stirling Escrito por: Diego Huarapil Enero 2009 Introducción El Motor Stirling es un motor térmico,
La uma, por ser una unidad de masa, tiene su equivalencia en gramos:
 UNIDAD 2 Magnitudes atómico-moleculares Introducción Teórica La masa de un átomo depende del átomo en cuestión, es decir del número de protones y neutrones que contenga su núcleo. Dicha magnitud es muy
UNIDAD 2 Magnitudes atómico-moleculares Introducción Teórica La masa de un átomo depende del átomo en cuestión, es decir del número de protones y neutrones que contenga su núcleo. Dicha magnitud es muy
A continuación se detallan cada una de las propiedades coligativas:
 PREGUNTA (Técnico Profesional) Se prepara una solución con 2 mol de agua y 0,5 mol de un electrolito no volátil. Al respecto, cuál es la presión de vapor a 25 ºC de esta solución, si la presión del agua
PREGUNTA (Técnico Profesional) Se prepara una solución con 2 mol de agua y 0,5 mol de un electrolito no volátil. Al respecto, cuál es la presión de vapor a 25 ºC de esta solución, si la presión del agua
Determinación de la Masa Molar del Magnesio
 Determinación de la Masa Molar del Magnesio Introducción teórica Como en muchas reacciones químicas, los reactivos o sus productos o ambos son gases, es más común medir éstos en función del volumen usando
Determinación de la Masa Molar del Magnesio Introducción teórica Como en muchas reacciones químicas, los reactivos o sus productos o ambos son gases, es más común medir éstos en función del volumen usando
UNIDAD 3 ESTADO GASEOSO
 UNIDAD DIDÁCTICA 3 UNIDAD 3 ESTADO GASEOSO En la naturaleza, las sustancias se puede presentar en tres diferentes estados de agregación: sólido, líquido y gaseoso, cada uno de los cuales se distingue por
UNIDAD DIDÁCTICA 3 UNIDAD 3 ESTADO GASEOSO En la naturaleza, las sustancias se puede presentar en tres diferentes estados de agregación: sólido, líquido y gaseoso, cada uno de los cuales se distingue por
Maestría en Ciencia y Tecnología Ambiental
 Maestría en Ciencia y Tecnología Ambiental Temario: Química Propósito general: Proporcionar y estandarizar el conocimiento básico de química a los candidatos para ingresar al programa de Maestría en Ciencia
Maestría en Ciencia y Tecnología Ambiental Temario: Química Propósito general: Proporcionar y estandarizar el conocimiento básico de química a los candidatos para ingresar al programa de Maestría en Ciencia
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
Equilibrio físico. Prof. Jesús Hernández Trujillo. Facultad de Química, UNAM. Equilibrio físico/j. Hdez. T p.
 Equilibrio físico/j. Hdez. T p. 1/34 Equilibrio físico Prof. Jesús Hernández Trujillo jesus.hernandezt@gmail.com Facultad de Química, UNAM Equilibrio físico/j. Hdez. T p. 2/34 Interacciones intermoleculares
Equilibrio físico/j. Hdez. T p. 1/34 Equilibrio físico Prof. Jesús Hernández Trujillo jesus.hernandezt@gmail.com Facultad de Química, UNAM Equilibrio físico/j. Hdez. T p. 2/34 Interacciones intermoleculares
Gases...1. Características: Volumen:...1. Temperatura:
 Índice de contenido Gases......1 Características:......1 Volumen:......1 Temperatura:......1 Presión:......2 Medición de presiones:......2 Ley de Boyle (relación presión volumen):......2 Ley de Charles
Índice de contenido Gases......1 Características:......1 Volumen:......1 Temperatura:......1 Presión:......2 Medición de presiones:......2 Ley de Boyle (relación presión volumen):......2 Ley de Charles
Caracterización Termodinámica de los Yacimientos
 CAPÍTULO 1 Caracterización Termodinámica de los Yacimientos I - 1 Fáctores físicos que controlan el comportamiento de fases Presión Temperatura Atracción Molecular Repulsión Molecular Presión Atracción
CAPÍTULO 1 Caracterización Termodinámica de los Yacimientos I - 1 Fáctores físicos que controlan el comportamiento de fases Presión Temperatura Atracción Molecular Repulsión Molecular Presión Atracción
Ley de Boyle. A temperatura constante, el volumen de una muestra dada de gas es inversamente proporcional a su presión
 LOS GASES Un gas es una porción de materia cuya forma y volumen son variables ya que se adaptan a la del recipiente que lo contiene, el cual ocupan totalmente. LEYES DE LOS GASES Ley de Boyle Robert Boyle,
LOS GASES Un gas es una porción de materia cuya forma y volumen son variables ya que se adaptan a la del recipiente que lo contiene, el cual ocupan totalmente. LEYES DE LOS GASES Ley de Boyle Robert Boyle,
MECÁNICA DE FLUIDOS. Docente: Ing. Alba Díaz Corrales
 MECÁNICA DE FLUIDOS Docente: Ing. Alba Díaz Corrales Fecha: 1 de septiembre 2010 Mecánica de Fluidos Tipo de asignatura: Básica Específica Total de horas semanales: 6 Total de horas semestrales: 84 Asignatura
MECÁNICA DE FLUIDOS Docente: Ing. Alba Díaz Corrales Fecha: 1 de septiembre 2010 Mecánica de Fluidos Tipo de asignatura: Básica Específica Total de horas semanales: 6 Total de horas semestrales: 84 Asignatura
- Leyes ponderales: Las leyes ponderales relacionan las masas de las sustancias que intervienen en una reacción química.
 FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
DIVISIÓN DE INGENIERIAS DEPARTAMENTO DE INGENIERÍA QUÍMICA PROGRAMA DE ASIGNATURA
 CENTRO UNIVERSITARIO DE CIENCIAS EXACTAS E INGENIERIAS DIVISIÓN DE INGENIERIAS DEPARTAMENTO DE INGENIERÍA QUÍMICA PROGRAMA DE ASIGNATURA NOMBRE DE MATERIA TERMODINÁMICA QUÍMICA CLAVE DE MATERIA DEPARTAMENTO
CENTRO UNIVERSITARIO DE CIENCIAS EXACTAS E INGENIERIAS DIVISIÓN DE INGENIERIAS DEPARTAMENTO DE INGENIERÍA QUÍMICA PROGRAMA DE ASIGNATURA NOMBRE DE MATERIA TERMODINÁMICA QUÍMICA CLAVE DE MATERIA DEPARTAMENTO
UNIDAD I. TEMA III. ESTEQUIOMETRÍA
 REPUBLICA BOLIVARIANA DE VENEZUELA UNIVERSIDAD EXPERIMENTAL SUR DEL LAGO Jesús María Semprúm PROGRAMA DE INGENIERIA DE ALIMENTOS UNIDAD CURRICULAR: QUIMICA GENERAL UNIDAD I. TEMA III. ESTEQUIOMETRÍA Prof.
REPUBLICA BOLIVARIANA DE VENEZUELA UNIVERSIDAD EXPERIMENTAL SUR DEL LAGO Jesús María Semprúm PROGRAMA DE INGENIERIA DE ALIMENTOS UNIDAD CURRICULAR: QUIMICA GENERAL UNIDAD I. TEMA III. ESTEQUIOMETRÍA Prof.
Concepto de mol. Concepto de mol. Número de Avogadro
 Concepto de mol Concepto de mol. Número de Avogadro La masa de los átomos es muy pequeña. Si se toma como ejemplo el átomo de calcio, cuyo radio es de 2.10-8 cm, para completar una distancia de un centímetro
Concepto de mol Concepto de mol. Número de Avogadro La masa de los átomos es muy pequeña. Si se toma como ejemplo el átomo de calcio, cuyo radio es de 2.10-8 cm, para completar una distancia de un centímetro
2. LA PRIMERA LEY DE LA TERMODINÁMICA
 1. CONCEPTOS BÁSICOS Y DEFINICIONES l. 1. Naturaleza de la Termodinámica 1.2. Dimensiones y unii2acles 1.3. Sistema, propiedad y estado 1.4. Densidad, volumen específico y densidad relativa 1.5. Presión
1. CONCEPTOS BÁSICOS Y DEFINICIONES l. 1. Naturaleza de la Termodinámica 1.2. Dimensiones y unii2acles 1.3. Sistema, propiedad y estado 1.4. Densidad, volumen específico y densidad relativa 1.5. Presión
Capítulo 10. Efectos de superficie. Sistema respiratorio
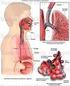 Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
QUIMICA UNIVERSIDAD DE BURGOS QUÍMICA GUÍA DOCENTE Denominación de la asignatura: QUIMICA. Titulación
 GUÍA DOCENTE 2012-2013 QUIMICA 1. Denominación de la asignatura: QUIMICA Titulación Ingeniería Electrónica Industrial y Automática Código 6400 2. Materia o módulo a la que pertenece la asignatura: Química
GUÍA DOCENTE 2012-2013 QUIMICA 1. Denominación de la asignatura: QUIMICA Titulación Ingeniería Electrónica Industrial y Automática Código 6400 2. Materia o módulo a la que pertenece la asignatura: Química
Reacciones Químicas. Homogéneas.
 Como se sabe, la materia está formada por partículas, dependiendo el comportamiento de esta (la materia) del estado físico en que se encuentran las partículas. Igualmente, sabemos que la materia no es
Como se sabe, la materia está formada por partículas, dependiendo el comportamiento de esta (la materia) del estado físico en que se encuentran las partículas. Igualmente, sabemos que la materia no es
El modelo cinético molecular para un gas ideal
 El modelo cinético ecular para un gas ideal En 166, Robert Boyle encontró que el volumen de un gas a temperatura constante es proporcional al inverso de la presión ley de Boyle 1 (1) P En 1787, Jacques
El modelo cinético ecular para un gas ideal En 166, Robert Boyle encontró que el volumen de un gas a temperatura constante es proporcional al inverso de la presión ley de Boyle 1 (1) P En 1787, Jacques
EJERCICIOS DE TERMOQUÍMICA
 EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
RESPONSABLE DE LA CÁTEDRA
 CÁTEDRA Q-TERMODINAMICA RESPONSABLE DE LA CÁTEDRA CAIVANO Jorge Omar CARRERA INGENIERÍA QUIMICA CARACTERÍSTICAS DE LA ASIGNATURA PLAN DE ESTUDIOS 2005 ORDENANZA CSU. Nº 1028 OBLIGATORIA ELECTIVA ANUAL
CÁTEDRA Q-TERMODINAMICA RESPONSABLE DE LA CÁTEDRA CAIVANO Jorge Omar CARRERA INGENIERÍA QUIMICA CARACTERÍSTICAS DE LA ASIGNATURA PLAN DE ESTUDIOS 2005 ORDENANZA CSU. Nº 1028 OBLIGATORIA ELECTIVA ANUAL
GUÍA ACUMULATIVA/ 8º MEDIO ( Desarrollo de Ejercicios: Leyes de los Gases) Nombre del Alumno: Curso: Fecha:
 Sector: Naturaleza Nivel: 8 Básico Nombre Profesora: Nancy Erazo Rosa Unidad V : Leyes de los gases GUÍA ACUMULATIVA/ 8º MEDIO ( Desarrollo de Ejercicios: Leyes de los Gases) Nombre del Alumno: Curso:
Sector: Naturaleza Nivel: 8 Básico Nombre Profesora: Nancy Erazo Rosa Unidad V : Leyes de los gases GUÍA ACUMULATIVA/ 8º MEDIO ( Desarrollo de Ejercicios: Leyes de los Gases) Nombre del Alumno: Curso:
Propiedades térmicas de la materia
 1 Propiedades térmicas de la materia Ahora que hemos comprendido los conceptos de calor y temperatura, procederemos a estudiar el comportamiento térmico de la materia. Para esto, nos interesan cuatro cantidades
1 Propiedades térmicas de la materia Ahora que hemos comprendido los conceptos de calor y temperatura, procederemos a estudiar el comportamiento térmico de la materia. Para esto, nos interesan cuatro cantidades
GASES IDEALES. P. V = n. R. T
 GASES IDEALES Lic. Lidia Iñigo A esta altura de tus estudios seguramente ya sabés que hay muchas sustancias formadas por moléculas, qué es una molécula, y que una sustancia determinada puede presentarse
GASES IDEALES Lic. Lidia Iñigo A esta altura de tus estudios seguramente ya sabés que hay muchas sustancias formadas por moléculas, qué es una molécula, y que una sustancia determinada puede presentarse
GASES. Contenidos. Leyes de los gases y su aplicación en la resolución de problemas numéricos.
 GASES Contenidos Postulados de la teoría cinética de los gases y su relación con las características (expansión, comprensión y difusión) y las propiedades ( presión, volumen y temperatura) que los definen.
GASES Contenidos Postulados de la teoría cinética de los gases y su relación con las características (expansión, comprensión y difusión) y las propiedades ( presión, volumen y temperatura) que los definen.
GUIA DE ESTUDIO Nº 7: Equilibrio Químico
 Página26 GUIA DE ESTUDIO Nº 7: Equilibrio Químico I.- Conceptos básicos: Equilibrio químico y constante de equilibrio. Concentraciones en el equilibrio y evolución de un sistema hacia el equilibrio. Principio
Página26 GUIA DE ESTUDIO Nº 7: Equilibrio Químico I.- Conceptos básicos: Equilibrio químico y constante de equilibrio. Concentraciones en el equilibrio y evolución de un sistema hacia el equilibrio. Principio
CLASIFICACIÓN DE LA MATERIA
 1. Clasificación de la materia por su aspecto CLASIFICACIÓN DE LA MATERIA La materia homogénea es la que presenta un aspecto uniforme, en la cual no se pueden distinguir a simple vista sus componentes.
1. Clasificación de la materia por su aspecto CLASIFICACIÓN DE LA MATERIA La materia homogénea es la que presenta un aspecto uniforme, en la cual no se pueden distinguir a simple vista sus componentes.
EQUILIBRIO ENTRE FASES
 UNCUYO FCULTD DE CIENCIS GRRIS Cát. de Química General e Inorgánica EQUILIRIO ENTRE FSES S I S T E M S D E D O S C O M O N E N T E S 2 da RTE INTRODUCCIÓN Efecto de las condiciones externas (,T) sobre
UNCUYO FCULTD DE CIENCIS GRRIS Cát. de Química General e Inorgánica EQUILIRIO ENTRE FSES S I S T E M S D E D O S C O M O N E N T E S 2 da RTE INTRODUCCIÓN Efecto de las condiciones externas (,T) sobre
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
Pv = nrt P T P T. Ing. Magno Cuba Atahua
 TEORI CINÉTIC DE LOS GSES Un gas ideal es un gas cuyas moléculas están tan separadas que raramente chocan unas con otras. uesto que éste es el caso para cualquier gas real a baja ideales a baja densidad
TEORI CINÉTIC DE LOS GSES Un gas ideal es un gas cuyas moléculas están tan separadas que raramente chocan unas con otras. uesto que éste es el caso para cualquier gas real a baja ideales a baja densidad
MEZCLAS NO REACTIVAS
 1 UNIVERSIDAD NACIONAL PEDRO RUIZ GALLO FACULTAD DE INGENIERÍA MECÁNICA ELÉCTRICA MEZCLAS NO REACTIVAS En los estudios previos en termodinámica se han centrado en sustancias constituidas por una sola especie
1 UNIVERSIDAD NACIONAL PEDRO RUIZ GALLO FACULTAD DE INGENIERÍA MECÁNICA ELÉCTRICA MEZCLAS NO REACTIVAS En los estudios previos en termodinámica se han centrado en sustancias constituidas por una sola especie
IES ALONSO QUESADA Física y Química 3º ESO Trabajo Científico. Estados de la materia. Clasificación de la materia.
 IES ALONSO QUESADA Física y Química 3º ESO Trabajo Científico. Estados de la materia. Clasificación de la materia. 1) Contesta las siguientes preguntas: a - Cuáles son los pasos del método científico?.
IES ALONSO QUESADA Física y Química 3º ESO Trabajo Científico. Estados de la materia. Clasificación de la materia. 1) Contesta las siguientes preguntas: a - Cuáles son los pasos del método científico?.
QUÉ ES EL GAS NATURAL?
 QUÉ ES EL GAS NATURAL? ES UNA MEZCLA DE HIDROCARBUROS SIMPLES QUE EXISTE EN ESTADO GASEOSO. SE ENCUENTRA GENERALMENTE EN DEPOSITOS SUBTERRANEOS PROFUNDOS FORMADOS POR ROCA POROSA, O EN LOS DOMOS DE LOS
QUÉ ES EL GAS NATURAL? ES UNA MEZCLA DE HIDROCARBUROS SIMPLES QUE EXISTE EN ESTADO GASEOSO. SE ENCUENTRA GENERALMENTE EN DEPOSITOS SUBTERRANEOS PROFUNDOS FORMADOS POR ROCA POROSA, O EN LOS DOMOS DE LOS
Propiedades de sustancias
 Propiedades de sustancias Objetivos Entender conceptos clave... como fase y sustancia pura, principio de estado para sistemas simples compresibles, superfice p-v-t, temperatura de saturación y presión
Propiedades de sustancias Objetivos Entender conceptos clave... como fase y sustancia pura, principio de estado para sistemas simples compresibles, superfice p-v-t, temperatura de saturación y presión
Unidad 5 Equilibrio. 1. Razone el efecto que provocará en la síntesis de amoniaco:
 Unidad 5 Equilibrio OPCIÓN A. Razone el efecto que provocará en la síntesis de amoniaco: N (g) + 3H (g) NH 3 (g) H º 9,4 kj a) Un aumento de la presión en el reactor. Un aumento de la presión origina que
Unidad 5 Equilibrio OPCIÓN A. Razone el efecto que provocará en la síntesis de amoniaco: N (g) + 3H (g) NH 3 (g) H º 9,4 kj a) Un aumento de la presión en el reactor. Un aumento de la presión origina que
Química 2º Bach. Recuperación 1ª Evaluación 13/01/05
 Química º Bach. Recuperación 1ª Evaluación 13/1/5 DEPARTAMENT DE FÍSIA E QUÍMIA Nombre: 1. alcula a partir de qué temperatura será espontánea la reacción de descomposición del tetraóxido de dinitrógeno
Química º Bach. Recuperación 1ª Evaluación 13/1/5 DEPARTAMENT DE FÍSIA E QUÍMIA Nombre: 1. alcula a partir de qué temperatura será espontánea la reacción de descomposición del tetraóxido de dinitrógeno
PRÁCTICA 10. TORRE DE REFRIGERACIÓN POR AGUA
 PRÁCTICA 10. TORRE DE REFRIGERACIÓN POR AGUA OBJETIVO GENERAL: Familiarizar al alumno con los sistemas de torres de refrigeración para evacuar el calor excedente del agua. OBJETIVOS ESPECÍFICOS: Investigar
PRÁCTICA 10. TORRE DE REFRIGERACIÓN POR AGUA OBJETIVO GENERAL: Familiarizar al alumno con los sistemas de torres de refrigeración para evacuar el calor excedente del agua. OBJETIVOS ESPECÍFICOS: Investigar
SEGUNDA PRACTICA DE QUÍMICA
 UNIVERSIDAD MAYOR DE SAN SIMÓN FACULTAD DE CIENCIAS Y TECNOLOGÍA DEPARTAMENTO DE QUÍMICA CURSO PROPEDÉUTICO ESTADO GASEOSO SEGUNDA PRACTICA DE QUÍMICA 1. El acetileno (C 2 H 2 ) es un combustible utilizado
UNIVERSIDAD MAYOR DE SAN SIMÓN FACULTAD DE CIENCIAS Y TECNOLOGÍA DEPARTAMENTO DE QUÍMICA CURSO PROPEDÉUTICO ESTADO GASEOSO SEGUNDA PRACTICA DE QUÍMICA 1. El acetileno (C 2 H 2 ) es un combustible utilizado
Cálculos de Estequiometría
 Cálculos de Estequiometría Relaciones entre moles en una ecuación química CH 4 + 2 O 2 2 H 2 O + CO 2 El coeficiente del metano es 1, el del oxígeno 2, el del dióxido de carbono 1 y el del agua 2 1 mol
Cálculos de Estequiometría Relaciones entre moles en una ecuación química CH 4 + 2 O 2 2 H 2 O + CO 2 El coeficiente del metano es 1, el del oxígeno 2, el del dióxido de carbono 1 y el del agua 2 1 mol
