Nº de catálogo K1497 Para uso con anticuerpos primarios de ratón
|
|
|
- Ana Belén Molina Rivas
- hace 6 años
- Vistas:
Transcripción
1 CSA II Biotin-free Tyramide Signal Amplification System Nº de catálogo K1497 Para uso con anticuerpos primarios de ratón Licencia de uso limitado Este sistema incorpora una tecnología desarrollada y otorgada por NEN Life Science Products, Inc. (Patente de EE.UU. nº 5,196,306). Este producto se distribuye y se vende al usuario final bajo licencia de NEN LIFE SCIENCE PRODUCTS, INC., para uso con el instrumental de Dako únicamente, para el procesamiento manual o automatizado de portaobjetos u otro material de soporte (aparte de micromatrices y biochips) con muestras de células o tejido para el examen de las mismas en el microscopio (incluyendo captura de imágenes automatizada y sistemas de análisis) con objeto de detectar ácidos nucleicos o proteínas. La compra de este producto no otorga ningún derecho a revenderlo o transferirlo, ni como producto independiente, ni como componente de otro. Queda terminantemente prohibido el uso de dicho producto para fines que no estén contemplados por la licencia, sin autorización explícita por escrito de NEN LIFE SCIENCE PRODUCTS, INC. Uso previsto Para uso en diagnóstico in vitro. Estas instrucciones corresponden al CSA II (nº de catálogo K1497). El CSA II es un sistema de amplificación de señales de tiramida sin biotina para inmunohistoquímica. Este sistema está diseñado para ser usado con anticuerpos primarios de ratón suministrados por el usuario para la identificación cualitativa de antígenos mediante microscopía óptica en tejidos normales y patológicos fijados con formol e incluidos en parafina. Este sistema puede utilizarse con procedimientos manuales y/o con instrumental de Dako. Consulte las General Instructions for Immunohistochemical Staining (Instrucciones generales para la tinción inmunohistoquímica) de los procedimientos IHQ para: (1) Principio del procedimiento, (2) Material necesario pero no suministrado, (3) Almacenamiento, (4) Preparación de la muestra, (5) Procedimiento de tinción, (6) Control de calidad, (7) Solución de problemas, (8) Interpretación de la tinción, (9) Limitaciones generales. Resumen y explicación Principios del procedimiento El CSA II System es un procedimiento de tinción inmunohistoquímica (IHQ) altamente sensible, que incorpora un método de amplificación de señales basado en la deposición catalizada con peroxidasa de un compuesto fenólico marcado con fluoresceína, seguido de una reacción secundaria con antifluoresceína conjugada con peroxidasa 1-5. En el procedimiento, se detecta en primer lugar un anticuerpo primario de ratón con un anticuerpo secundario conjugado con peroxidasa. En el siguiente paso se utiliza la peroxidasa ligada para catalizar la oxidación de un fenol conjugado con fluoresceína (fluorescil-tiramida) que luego se precipita en la muestra. El procedimiento continúa con la detección de la fluoresceína ligada mediante una antifluoresceína conjugada con peroxidasa. La tinción se completa con diaminobenzidina/peróxido de hidrógeno como cromógeno/sustrato, y puede ser observada con un microscopio óptico. En comparación con los métodos inmunohistoquímicos estándar, tales como la estreptavidina-biotina marcada (LSAB) o los complejos de avidina-biotina (ABC), se ha descrito que los métodos de amplificación de tiramida son varias veces más sensibles 3,4. El CSA II System es una versión simplificada del sumamente sensible Catalyzed Signal Amplification System (nº de catálogo K1500) que utiliza biotinil-tiramida. Este CSA II System, altamente sensible, permite la detección de cantidades muy pequeñas de proteína diana, así como el uso de anticuerpos de baja afinidad. Este sistema de reactivos utiliza fluorescil-tiramida en lugar de biotinil-tiramida, y no contiene reactivos de avidina/biotina con lo que se elimina una posible tinción de fondo causada por la reactividad con la biotina endógena 6,7. Las muestras se incuban primero con un inhibidor de peroxidasa durante cinco minutos, para reducir la actividad de peroxidasa endógena. Las muestras luego se incuban durante cinco minutos con un inhibidor proteínico para suprimir la unión inespecífica de reactivos posteriores, seguido de una incubación de 15 minutos con un anticuerpo primario de ratón apropiado, caracterizado y diluido, o con un reactivo de control negativo (suministrado por el usuario). Luego siguen incubaciones secuenciales de 15 minutos con inmunoglobulinas-hpr antirratón, peróxido de hidrógeno fluorescil-tiramida (reactivo de amplificación) y antifluoresceína-hrp. La tinción se completa con una incubación de cinco minutos con 3,3 -diaminobenzidina tetrahidrocloruro (DAB+)/peróxido de hidrógeno, que produce un precipitado marrón en la zona del antígeno. ( ) P04037ES_01/K1497/ p. 1/10
2 Reactivo suministrado Nº de catálogo K1497 En el kit se incluyen los siguientes materiales: Cantidad 1x15 ml Descripción Peroxidase Block Peróxido de hidrógeno al 3% en agua. 1x15 ml Protein Block Proteína libre de suero en tampón con 0,015 mol/l de azida de sodio. 1x15 ml Anti-Mouse Immunoglobulins-HRP Inmunoglobulinas antirratón conjugadas con peroxidasa de rábano en tampón con proteína estabilizante y antibiótico. 1x15 ml Amplification Reagent Fluorescil-tiramida y peróxido de hidrógeno en tampón con proteína estabilizante y un antibiótico. 1x15 ml Anti-Fluorescein-HRP Anticuerpo antifluoresceína conjugado con peroxidasa de rábano en tampón con proteína estabilizante y antibiótico. 1x18 ml Buffered Substrate Tampón con peróxido de hidrógeno y conservante. 1x1 ml Liquid DAB Chromogen Solución de cromógeno con 3,3'-diaminobenzidina. Material necesario pero no suministrado Diluyente de anticuerpos, como Antibody Diluent with Background Reducing Components (nº de catálogo S3022) Muestras de control positivo y negativo Contratinción, como Lillie s Modified Mayer s Hematoxylin (nº de catálogo S3301 para uso con el Dako Autostainer, o nº de catálogo S3302 para Manual Staining) Microscopio óptico Medios de montaje como Glycergel Mounting Medium (nº de catálogo C0563), Faramount, Aqueous Mounting Medium, Ready-to-use (nº de catálogo S3025), o medio de montaje permanente no acuoso, como Permanent Mounting Media (nº de catálogo S3026) Anticuerpos primarios de ratón y reactivos de control negativo. Tampón de lavado, como TBST (Tris Buffered Saline With Tween), 10x Concentrate (nº de catálogo S3306) Tinción automática Dako Autostainer (nº de catálogo S3400) o Autostainer Plus (nº de catálogo S3800). Consulte la Guía del usuario del Dako Autostainer para ver los componentes necesarios. Material opcional necesario pero no suministrado Consulte la hoja de especificaciones del anticuerpo primario Solución de recuperación diana tampón de citrato modificado (ph 6.1), como Target Retrieval Solution, Ready-to-use (nº de catálogo S1700) o 10x Concentrate (nº de catálogo S1699) Baño de agua (capaz de mantener una temperatura de ºC), vaporizador, olla a presión o autoclave, para la recuperación diana ( ) P04037ES_01/K1497/ p. 2/10
3 Precauciones Específicas del producto 1. Para usuarios profesionales. 2. Este producto contiene azida de sodio (NaN 3), un compuesto químico altamente tóxico en su forma pura. Aunque a las concentraciones del producto no está clasificado como peligroso, las acumulaciones de NaN 3 pueden reaccionar con cañerías de plomo y cobre formando azidas metálicas altamente explosivas. Luego de desecharlo, deje correr abundante cantidad de agua para evitar acumulaciones de azida en las cañerías 8, Minimice la contaminación microbiana de los reactivos, ya que es posible que se incrementen las tinciones inespecíficas. 4. Al igual que con cualquier producto derivado de fuentes biológicas, deberán aplicarse procedimientos adecuados de manejo. 5. Utilice el equipo de protección personal adecuado para evitar el contacto con los ojos y la piel. 6. La solución que no se utilice deberá desecharse de acuerdo a las normativas locales, estatales o federales. 7. Puede solicitar la hoja de datos de seguridad que se encuentra disponible para usuarios profesionales. Generales 1. No utilice los reactivos después de la fecha de caducidad. 2. No reemplace los reactivos por kits de otros fabricantes. 3. No almacene los componentes del sistema ni realice tinciones en presencia de luz intensa, como la luz solar directa. Nota: Los portaobjetos deben protegerse de la luz durante el paso de incubación del reactivo de amplificación. Atención Amplification Reagent: 10-30% Glicerol H320 Provoca irritación ocular. P280 Usar protección para los ojos o la cara. P264 Lavarse las manos cuidadosamente después de la manipulación. P305 + P351 + EN CASO DE CONTACTO CON LOS OJOS: Enjuagar con agua cuidadosamente P338 durante varios minutos. Quitar las lentes de contacto cuando estén presentes y pueda hacerse con facilidad. Proseguir con el lavado. P337 + P313 Si la irritación ocular persiste, consultar a un médico. Almacenamiento Peligro DAB Chromogen: 1-5% biphenyl-3,3',4,4'-tetrayltetraammonium tetrachloride H350 Puede provocar cáncer. H341 Se sospecha que provoca defectos genéticos. P201 Procurarse las instrucciones antes del uso. P202 No manipular antes de haber leído y comprendido todas las precauciones de seguridad. P281 Utilizar el equipo de protección individual obligatorio. P308 + P313 EN CASO DE exposición manifiesta o presunta: Consultar a un médico. P405 Guardar bajo llave. P501 Eliminar el contenido y el recipiente de acuerdo con las normativas locales, regionales, nacionales e internacionales. Almacenar los reactivos del CSA II System entre 2 y 8 ºC. No congelar. No utilizar después de la fecha de caducidad impresa en los viales del reactivo y en la etiqueta del kit. No existen signos evidentes que indiquen inestabilidad de estos productos. Por lo tanto, los controles positivo y negativo deberán realizarse de manera simultánea con muestras del paciente. Si observa una tinción inesperada que no puede explicarse por variaciones en los procedimientos del laboratorio y sospecha de la existencia de un problema con el equipo, póngase en contacto con el servicio técnico de Dako. Preparación de los reactivos Tampón de lavado Las investigaciones han demostrado que 0,05 mol/l de Tris-HCl, ph 7,6, que contenga 0,3 mol/l de NaCl y Tween 20 al 0,1%, sin azida de sodio, ayuda significativamente a minimizar la tinción de fondo con este sistema. Un tampón de lavado recomendado es TBST 10x (nº de catálogo S3306). Un tampón de lavado con azida de sodio inactiva la peroxidasa de rábano dando como resultado una tinción negativa. Almacene el tampón no utilizado a 2 8 ºC. Deseche el tampón si está turbio. Tinción automática El Automation Buffer, 10x (nº de catálogo S3006) puede utilizarse para los enjuagues generales con tampón de lavado en el Dako Autostainer para el protocolo automático CSA II, aunque deberá realizarse un baño auxiliar de 5 a 10 minutos de duración con TBST (nº de catálogo S3306) después del peróxido de hidrógeno, el anticuerpo primario y los reactivos antirratón-hrp. Puede utilizarse agua destilada o desionizada para el enjuague después de los pasos de sustrato-cromógeno y contratinción. ( ) P04037ES_01/K1497/ p. 3/10
4 Tinción manual Los cortes de tejido deben lavarse en uno, dos o tres baños de TBST nueva (nº de catálogo S3306) entre 3 y 5 minutos, entre cada uno de los pasos del protocolo CSA II. Preparación del sustrato-cromógeno DAB Un mililitro de sustrato-cromógeno es suficiente para diez cortes de tejido. PASO 1 PASO 2 Según el número de portaobjetos que deban teñirse, transfiera suficientes alícuotas de 1 ml de tampón, desde el frasco de sustrato tamponado a un tubo de ensayo. Para cada mililitro de sustrato tamponado, añada 1 gota (20 µl) del frasco de cromógeno líquido DAB. Mezcle inmediatamente. El sustrato-cromógeno preparado permanece estable durante aproximadamente 5 días cuando se almacena entre 2 y 8 C. Este reactivo debe mezclarse bien a ntes de su uso. Cualquier precipitado que se desarrolle en el reactivo no afecta a la calidad de la tinción. Dilución de anticuerpo primario concentrado y control negativo Diluya el anticuerpo primario utilizando un diluyente que contenga proteína estabilizante. Se recomienda encarecidamente el uso de Antibody Diluent with Background Reducing Components (nº de catálogo S3022). Un reactivo de control negativo adecuado es la inmunoglobulina de ratón del mismo isotipo que el anticuerpo primario, y debe estar diluido en la misma concentración de inmunoglobulina que el anticuerpo primario diluido. Preparación de las muestras Preparación de muestras incluidas en parafina Antes de la tinción IHQ, los tejidos deben fijarse y procesarse. La fijación evita la autólisis y putrefacción de los tejidos escindidos, preserva la antigenicidad, mejora el índice de refracción de los constituyentes tisulares y aumenta la resistencia de los elementos celulares al procesamiento de los tejidos. El procesamiento de los tejidos incluye deshidratación, eliminación de agentes deshidratantes, infiltración de medios de inclusión y corte de los tejidos. Los fijadores más comunes para preparados de tejidos IHQ se analizan en las General Instructions for Immunohistochemical Staining ( Instrucciones generales para la tinción inmunohistoquímica). Éstas son sólo pautas de trabajo. El usuario debe determinar y verificar los procedimientos óptimos. La supervivencia de los antígenos tisulares para la tinción inmunológica puede depender del tipo y concentración del fijador, del tiempo de fijación, y del tamaño de la muestra de tejido que va a fijarse Es importante mantener unas condiciones de fijación estándar óptimas siempre que sea posible, a fin de obtener resultados de tinción reproducibles. Siempre que sea posible, se recomienda utilizar muestras más delgadas junto con tiempos de fijación más cortos. Una exposición prolongada a los fijadores puede causar el enmascaramiento de los antígenos y reducir la tinción. Tras la fijación, los tejidos se deshidratan en alcoholes de grado, se aclaran con xileno o sustituto del xileno, y se les infiltra cera de parafina. Seguidamente, el tejido se incluye en cera de parafina en moldes o casetes para facilitar su corte. Para minimizar la desnaturalización de antígenos, no exponer los tejidos a temperaturas que excedan los 60 C durante el proceso. Los bloques de tejido pueden almacenarse o cortarse después de la inclusión. Los tejidos bien fijados e incluidos en parafina pueden guardarse indefinidamente si se almacenan en un sitio fresco (15 22 C). Montaje de los cortes de tejido Los tejidos cortados de bloques incluidos en parafina se recogen en portaobjetos de vidrio. Golpee los portaobjetos para eliminar tanta agua como sea posible. Las gotas de agua que quedan en el tejido durante el proceso de secado pueden afectar negativamente a la tinción del tejido. Séquelo en un horno entre una y dos horas a 60 C o menos, o deje que se seque a temper atura ambiente entre 15 y 24 horas. Para aumentar la adherencia de los cortes de tejido durante los procedimientos de tinción IHQ, se sugiere el uso de portaobjetos recubiertos con poli-l-lisina, portaobjetos cargados o Silanized Slides (nº de catálogo S3003). Se recomienda encarecidamente el uso de portaobjetos silanizados o cargados en cualquier procedimiento de tinción que requiera recuperación diana. Procedimiento de tinción automática y manual Notas sobre el procedimiento El usuario debe leer atentamente estas instrucciones y familiarizarse con el contenido del kit antes de utilizarlo. Todos los reactivos deben equilibrarse a temperatura ambiente (20 25 C) antes de la inmunotinción; de igual forma, todas las incubaciones deben realizarse a temperatura ambiente. Los reactivos y las instrucciones suministradas con este kit se han diseñado para obtener resultados óptimos. Una mayor dilución de los reactivos listos para usar puede producir resultados erróneos. Nota: En la tinción automática, la cubierta teñida del Dako Autostainer debe estar cerrada durante el paso de reactivo de amplificación para obtener un resultado de tinción óptimo. En la tinción manual, los portaobjetos deben protegerse de la luz durante el paso de incubación del reactivo de amplificación. No deje que los cortes de tejido se sequen durante el procedimiento de tinción. Los cortes de tejido secos pueden presentar una tinción inespecífica. Cubra los portaobjetos expuestos a corrientes de aire. Si se utilizan ( ) P04037ES_01/K1497/ p. 4/10
5 incubaciones prolongadas, coloque los portaobjetos en un ambiente húmedo. Para la reducción de la tinción inespecífica, se recomienda aclarar los cortes de tejido con TBST según las recomendaciones del tampón de lavado indicadas en la sección Preparación de los reactivos. Desparafinado de los cortes de tejido Antes de la tinción, los portaobjetos de tejido deben desparafinarse para eliminar el medio de inclusión y volverse a hidratar. Trate de no dejar restos de parafina. El medio residual de inclusión producirá un aumento de la tinción inespecífica. Digestión proteolítica y recuperación diana Se sabe que el formaldehído induce a cambios de conformación en las moléculas de antígeno, formando entrecruzamientos intermoleculares. Una fijación excesiva con formol puede enmascarar los lugares del antígeno y disminuir la tinción específica. En procedimientos IHQ estándar, estos lugares pueden verse con la digestión proteolítica de los tejidos antes de la inmunotinción. Nota: No se recomienda la digestión proteolítica ya que puede ocasionar un alto grado de tinción de fondo con el CSA II System. La recuperación diana con calor es la mejor alternativa a la digestión proteolítica, ya que ocasiona un ligero aumento de la tinción de fondo y un importante aumento de la tinción específica con muchos anticuerpos primarios. Para determinar si el tratamiento de recuperación diana de los tejidos está garantizada, consulte la hoja de especificaciones que acompaña al anticuerpo; en algunos anticuerpos este procedimiento es obligatorio. El procedimiento recomendado para la recuperación diana incluye la inmersión de los cortes de tejido montados en portaobjetos, en un tampón citrato modificado (ph 6,1), como Target Retrieval Solution, Ready-to-use (nº de catálogo S1700) o 10x Concentrate (nº de catálogo S1699); consulte el prospecto del envase para obtener instrucciones completas y conocer el grado de calor antes de proceder a la tinción IHQ. Aclare bien con solución de tampón de lavado y continúe con el procedimiento de tinción. Nota: No se recomienda el uso de una solución de recuperación diana con un ph alto (ph 10) con el CSA II System, ya que puede ocasionar un aumento de la tinción de fondo. Procedimiento de tinción automática PASO 1 Seleccione el programa automático de plantilla del protocolo PASO 2 Coloque los reactivos y el tampón en la gradilla de reactivos del Dako Autostainer PASO 3 Cargue los portaobjetos en el Dako Autostainer PASO 4 Comience el proceso PASO 5 Retire los portaobjetos del Dako Autostainer PASO 6 Proceda con el montaje Nota: La contratinción está incluida en la tabla de programación recomendada. Como opción alternativa, la contratinción puede realizarse manualmente en el banco del laboratorio. Procedimiento de tinción manual PASO 1 INHIBIDOR DE PEROXIDASA Elimine el exceso de líquido. Con un paño que no suelte pelusa, limpie cuidadosamente los alrededores de la muestra para eliminar los restos de líquido y mantener el reactivo dentro de la zona prescrita. Aplique suficiente peróxido de hidrógeno para cubrir la muestra. Incúbela durante 5 (±1) minutos. Enjuáguela cuidadosamente con agua destilada o solución de tampón de lavado de una botella de lavado (no apunte el chorro directamente sobre el tejido) y colóquela en un baño de tampón nuevo. PASO 2 PASO 3 INHIBIDOR PROTEÍNICO Elimine el exceso de líquido y limpie el portaobjetos como se indicó anteriormente. Aplique suficiente inhibidor proteínico para cubrir por completo la muestra. Incube durante 5 (±1) minutos. No elimine el inhibidor proteínico. ANTICUERPO PRIMARIO O REACTIVO DE CONTROL NEGATIVO Elimine el exceso de inhibidor proteínico y limpie el portaobjetos como se indicó anteriormente. Aplique suficiente anticuerpo primario preparado por el usuario o reactivo de control negativo para cubrir la muestra. Incube durante 15 (±1) minutos, a menos que se indique lo contrario en la hoja de especificaciones del anticuerpo primario. Enjuague cuidadosamente con solución de tampón de lavado procedente de una botella de lavado y colóquelo en un máximo de tres baños de tampón TBST nuevo, de 3 a 5 minutos cada uno. ( ) P04037ES_01/K1497/ p. 5/10
6 PASO 4 PASO 5 INMUNOGLOBULINAS ANTIRRATÓN-HRP Limpie el portaobjetos como se indicó anteriormente. Aplique suficiente inmunoglobulinas antirratón-hrp para cubrir la muestra. Incube durante 15 (±1) minutos. Enjuague el portaobjetos como se indicó en el paso 3. Colóquelo en un máximo de tres baños de tampón de lavado nuevo, de 3 a 5 minutos cada uno. REACTIVO DE AMPLIFICACIÓN Nota: Los portaobjetos deben protegerse de la luz durante este paso de incubación para obtener una tinción óptima. Limpie el portaobjetos como se indicó anteriormente. Aplique suficiente reactivo de amplificación para cubrir la muestra. Incube durante 15 (±1) minutos, protegiéndola de la luz. Enjuague el portaobjetos como se indicó anteriormente. Colóquelo en un máximo de tres baños de tampón de lavado nuevo, de 3 a 5 minutos cada uno. PASO 6 PASO 7 PASO 8 ANTIFLUORESCEÍNA-HRP Limpie el portaobjetos como se indicó anteriormente. Aplique suficiente Anti-Fluorescein-HRP para cubrir la muestra. Incube durante 15 (±1) minutos. Enjuague el portaobjetos como se indicó anteriormente. Colóquelo en un máximo de tres baños de tampón de lavado nuevo, de 3 a 5 minutos cada uno. SUSTRATO DAB LÍQUIDO-CROMÓGENO Limpie el portaobjetos como se indicó anteriormente. Aplique suficiente sustrato DAB líquido-cromógeno para cubrir la muestra. Incube durante 5 (±1) minutos. Enjuague cuidadosamente con agua destilada o desionizada. PROCEDA CON LA CONTRATINCIÓN Y EL MONTAJE Tabla de programación del Dako Autostainer para el CSA II La tabla de programación anterior es una plantilla del protocolo de Dako que contiene los elementos del protocolo necesarios para ejecutar el CSA II. Este ejemplo incluye los reactivos recomendados y los tiempos de incubación para un funcionamiento óptimo del CSA II en el Autostainer (nº de catálogo S3004) y Autostainer Plus (nº de catálogo S3800). Establezca una plantilla de protocolos y la programación automática con estos pasos recomendados y los tiempos de incubación. Se ha incluido el anticuerpo primario y el pretratamiento como ejemplo. La aplicación de la recuperación diana es específica del anticuerpo y puede que no sea necesaria. Control de calidad Las diferencias en el procesamiento de los tejidos y de los procedimientos técnicos del laboratorio del usuario pueden producir una importante variabilidad en los resultados, necesitándose un uso regular de los controles en cada laboratorio. Consulte las referencias 16 a 18 para obtener información adicional sobre control de calidad. Tejidos de control positivo Los controles positivos de tejido conocidos deben utilizarse sólo para monitorizar el correcto funcionamiento de los tejidos procesados y los reactivos de la prueba. Si los controles positivos de tejido no pueden demostrar una tinción positiva, los resultados de las muestras de la prueba deben considerarse como no válidos. ( ) P04037ES_01/K1497/ p. 6/10
7 Reactivo de control negativo Use un reactivo de control negativo en lugar del anticuerpo primario con un corte de cada muestra de prueba, para evaluar la tinción inespecífica y permitir una mejor interpretación de la tinción específica en la zona del antígeno. Si se utilizan paneles de anticuerpos en cortes de tejido en serie, las zonas de tinción negativa de un portaobjetos pueden servir como control de fondo de unión negativo/inespecífico para otros anticuerpos. Consulte las General Instructions for Immunohistochemical Staining ( Instrucciones generales para la tinción inmunohistoquímica ) para obtener más información acerca de los controles positivos y negativos. Interpretación de la tinción Las muestras de control positivo deben examinarse en primer lugar para asegurarse de que todos los reactivos funcionan correctamente. La presencia de un producto final de color marrón en el punto del antígeno diana, indica reactividad positiva. Si las muestras de control positivo no pueden demostrar una tinción positiva, los resultados de las muestras de la prueba deben considerarse como no válidos. Las muestras de control negativo deben ser examinadas para comprobar el marcado específico del antígeno diana por el anticuerpo primario. La ausencia de tinción específica en las muestras de control negativo confirmará la especificidad del anticuerpo primario. La tinción inespecífica, si ocurre, tendrá un aspecto punteado o difuso. La alta sensibilidad de este sistema se debe a su gran nivel de amplificación de señales; también se amplificará cualquier tinción de fondo inespecífica que se halle presente. Por esta razón, se recomienda el uso de reactivos de control negativo en un corte de cada control y muestra de prueba, como ayuda en la interpretación de los resultados de la tinción (consulte la sección Limitaciones para obtener más información sobre la tinción inespecífica). Se puede observar una tinción ligera y esporádica del tejido conectivo en cortes provenientes de tejidos fijados con exceso de formol. Utilice células intactas para interpretar los resultados de la tinción. Las células necróticas o degeneradas a menudo se tiñen de manera inespecífica. Pueden observarse resultados positivos falsos debido a la unión no inmunológica de reactivos a cortes de tejido. Limitaciones Para una intensidad de tinción óptima, los portaobjetos deben protegerse de la luz durante el paso de incubación del reactivo de amplificación (paso 5). No se recomienda la digestión proteolítica ya que puede ocasionar un alto grado de tinción de fondo con el CSA II System. Para la reducción de la tinción de fondo inespecífica, se recomienda enjuagar los cortes de tejido con tampón de lavado (consulte la sección Preparación de los reactivos) e incubarlos a temperatura ambiente en un máximo de tres baños de tampón de lavado nuevo, de 3 a 5 minutos cada uno, entre cada paso de reactivos en el protocolo del CSA II System. La inmunoglobulina endógena presente en las muestras de tejido humano, puede mostrar varios niveles de reactividad cruzada con los anticuerpos anti-inmunoglobulina secundarios. El anticuerpo secundario inmunoglobulina-hrp antirratón utilizado en este sistema ha sido absorbido con suero humano normal para reducir la reactividad cruzada. Sin embargo, debido a la alta sensibilidad de este sistema, incluso puede detectarse la reactividad cruzada frente a la inmunoglobulina endógena en algunas muestras. La tinción de fondo debida a la inmunoglobulina endógena se reconoce mejor como tinción en el control negativo alrededor de los vasos sanguíneos y linfáticos, en el tejido conectivo y en los espacios del tejido extravascular. Ciertos tipos de epitelio, especialmente aquellos asociados con el tracto digestivo, también pueden mostrar inmunoglobulina endógena. La tinción debida a la inmunoglobulina endógena también puede aumentarse utilizando métodos de recuperación diana. Por esta razón, es necesario el uso de reactivos y tejidos de control negativo apropiados para interpretar cualquier tinción positiva en aquellos casos en que se sospecha la presencia de inmunoglobulina endógena. La actividad de peroxidasa o pseudoperoxidasa endógena puede hallarse en hemoproteínas tales como hemoglobina, mioglobina, citocromo y catalasa, así como en determinados leucocitos 19,20. Dicha actividad puede inhibirse mediante la incubación de las muestras con Peroxidase Block durante 5 minutos (paso 1 del protocolo del CSA II System) antes de la aplicación del anticuerpo primario. Los tejidos que contengan el antígeno de superficie del virus de la hepatitis B (HBsAg) pueden mostrar tinción inespecífica con la peroxidasa de rábano 21. ( ) P04037ES_01/K1497/ p. 7/10
8 Solución de problemas automatizada Problema Causa probable Solución sugerida 1. Los portaobjetos no 1a. Error de programación. Los 1a. Revise la aplicación de los reactivos. se tiñen. reactivos no se han usado en 2. Los portaobjetos se tiñen débilmente. 3. Tinción excesiva de fondo de los 4. El tejido se desprende de los el orden correcto. 1b. Los viales de reactivos no estaban cargados en las posiciones correctas en las gradillas. 1c. No hay suficiente reactivo en el vial. 1d. Azida de sodio en el baño de tampón. 2a. Los portaobjetos no se incubaron el tiempo suficiente con los anticuerpos o el sustrato. 2b. El antígeno bajo investigación requiere recuperación diana. 2c. Las muestras han sido expuestas a la luz durante la incubación del reactivo de amplificación. 2d. La concentración del anticuerpo es demasiado baja. 3a. Las muestras presentan altos niveles de inmunoglobulina endógena. 3b. Las muestras presentan elevada actividad de peroxidasa endógena. 3c. No se eliminó completamente la parafina. 3d. No se enjuagaron bien los 3e. Los cortes se secaron durante la tinción. 3f. Los portaobjetos se secaron durante la carga en el Dako Autostainer. 3g. Unión inespecífica de los reactivos al corte de tejido. 3h. Unión inespecífica del anticuerpo primario a la muestra. 3i. El ph de la solución de recuperación diana utilizada para la recuperación de calor antes de la tinción era demasiado alto. 3j. Se usó digestión proteolítica antes de la tinción. 4a. Se utilizaron los portaobjetos incorrectos. 1b. Compruebe el mapa de reactivos para asegurarse de la ubicación correcta de los viales de reactivos. 1c. Asegúrese de que los viales tengan suficiente reactivo antes de empezar el proceso. Consulte los volúmenes necesarios en el mapa de reactivos. 1d. Utilice un tampón nuevo, libre de azida. 2a. Revise los tiempos de incubación recomendados. 2b. Realice la recuperación diana. 2c. Proteja las muestras de la luz durante la incubación del reactivo de amplificación. 2d. Vuelva a titular el anticuerpo. 3a. Compare el tejido de prueba con el tejido de control negativo para ver las diferencias. 3b. Incube el peróxido de hidrógeno durante más tiempo (paso 1). 3c. Utilice baños de xileno o de tolueno nuevos. Si varios portaobjetos se tiñen al mismo tiempo, el segundo baño de xileno debería contener xileno nuevo. 3d. Asegúrese de cebar bien el Dako Autostainer antes del proceso. Asegúrese de que haya suficiente solución tampón para todo el proceso. Incluya lavados auxiliares con TBST (nº de catálogo S3306), según se ha indicado. 3e. Asegúrese de aplicar el volumen correcto de reactivo a los Asegúrese de utilizar el Dako Autostainer con la tapa cerrada, y que no esté expuesto a fuentes de calor excesivo ni a corrientes de aire. 3f. Asegúrese de que los portaobjetos permanezcan húmedos con tampón durante la carga, y antes de empezar el proceso. 3g. Incube el inhibidor proteínico durante más tiempo (paso 2). 3h. Diluya el anticuerpo primario utilizando un diluyente que contenga proteína portadora. Antibody Diluent with Background Reducing Components (diluyente de anticuerpos con componentes reductores de fondo) (nº de catálogo S3022). 3i. Utilice un tampón de citrato modificado (ph 6,1) para la recuperación diana. 3j. Evite el uso de digestión proteolítica con este sistema de tinción. 4a. Utilice portaobjetos cargados (SuperFrost Plus) o silanizados como Silanized Slides de Dako (nº de catálogo S3003). ( ) P04037ES_01/K1497/ p. 8/10
9 Solución de problemas manual Problema Causa probable Solución sugerida 1. Los portaobjetos no 1a. Los reactivos no se han 1a. Revise la aplicación de los reactivos. se tiñen. usado en el orden correcto. 1b. Azida de sodio en el baño de 1b. Utilice un tampón nuevo, libre de azida. tampón. 2. Los portaobjetos se tiñen débilmente. 2a. Los cortes retienen demasiada solución después 2a. Elimine suavemente el exceso de solución antes de limpiar alrededor de los 3. Tinción excesiva de fondo de los 4. El tejido se desprende de los 5. Variación de la intensidad de la tinción entre procesos. del baño de lavado. 2b. Los portaobjetos no se incubaron el tiempo suficiente con los anticuerpos o el sustrato. 2c. El antígeno bajo investigación requiere recuperación diana. 2d. Las muestras han sido expuestas a la luz durante la incubación del reactivo de amplificación. 2e. La concentración del anticuerpo es demasiado baja. 3a. Las muestras presentan altos niveles de inmunoglobulina endógena. 3b. Las muestras presentan elevada actividad de peroxidasa endógena. 3c. No se eliminó completamente la parafina. 3d. No se enjuagaron bien los 3e. Reacción sustrato-cromógeno más rápida de lo normal debido a una temperatura ambiente demasiado alta. 3f. Los cortes se secaron durante el procedimiento de tinción. 3g. Unión inespecífica de los reactivos al corte de tejido. 3h. Unión inespecífica del anticuerpo primario a la muestra. 3i. El ph de la solución de recuperación diana utilizada para la recuperación de calor antes de la tinción era demasiado alto. 3j. Se usó digestión proteolítica antes de la tinción. 4a. Se utilizaron los portaobjetos incorrectos. 5a. Variaciones en la temperatura ambiente. 5b. Ligeras variaciones en el tiempo de incubación de los reactivos. 5c. Variaciones en el número y tiempos de incubación de los baños de tampón de lavado. 2b. Revise los tiempos de incubación recomendados. 2c. Realice la recuperación diana. 2d. Proteja las muestras de la luz durante la incubación del reactivo de amplificación. 2e. Vuelva a titular el anticuerpo. 3a. Compare el tejido de prueba con el tejido de control negativo para ver las diferencias. 3b. Incube el peróxido de hidrógeno durante más tiempo (paso 1). 3c. Utilice baños de xileno o de tolueno nuevos. Si varios portaobjetos se tiñen al mismo tiempo, el segundo baño de xileno debería contener xileno nuevo. 3d. Utilice soluciones nuevas en los baños de tampón y frascos de lavado. Se recomienda TBST. Incube los cortes en uno, dos o tres baños de TBST nueva, de 3 a 5 minutos cada uno, entre cada uno de los pasos del protocolo. 3e. Incube la solución sustrato-cromógeno durante menos tiempo. 3f. Utilice una cámara húmeda. Limpie sólo 3 o 4 portaobjetos a la vez antes de aplicar el reactivo. 3g. Incube el inhibidor proteínico durante más tiempo (paso 2). 3h. Diluya el anticuerpo primario utilizando un diluyente que contenga proteína estabilizante. Antibody Diluent with Background Reducing Components (nº de catálogo S3022). 3i. Utilice un tampón de citrato modificado (ph 6.1) para la recuperación diana. 3j. Evite el uso de digestión proteolítica con este sistema de tinción. 4a. Utilice portaobjetos cargados (SuperFrost Plus) o silanizados como Silanized Slides de Dako (nº de catálogo S3003). 5a. Regule la temperatura ambiente a un rango más estrecho. 5b. Programar los tiempos de incubación correctamente. 5c. Siga exactamente el mismo protocolo entre procesos. NOTA: Consulte la sección Solución de problemas en el Handbook Immunochemical Staining Methods, 3rd Edition 14, Atlas of Immunohistology 21 o Immunoperoxidase Techniques, A Practical Approach to Tumor Diagnosis 23. Póngase en contacto con el servicio técnico de Dako para comunicar una tinción poco habitual. ( ) P04037ES_01/K1497/ p. 9/10
10 Referencias 1. Bobrow MN, Harris TD, Shaughnessy KJ, Litt GJ. Catalyzed reporter deposition, a novel method of signal amplification. Application to immunoassays. J Immunol Methods 1989; 125: Bobrow MN, Shaughnessy KJ, Litt GJ. Catalyzed reporter deposition, a novel method of signal amplification. II. Application to membrane immunoassays. J Immunol Methods 1991; 137: Van Gijlswijk RPM, Zijlmans HJMAA, Wiegant J, Bobrow MN, Erickson TJ, Adler KE, Tanke HJ, Raap AK. Fluorochrome-labeled tyramides: use in immunocytochemistry and fluorescence in situ hybridization. J Histochem Cytochem 1997; 45(3): Von Wasielewski R, Mengel M, Gignac S, Wilkens L, Werner M, Georgii A. Tyramine amplification technique in routine immunohistochemistry. J Histochem Cytochem 1997; 45(11): Bobrow MN, Litt GJ, Shaughnessy KJ, Mayer PC, Conlon J. The use of catalyzed reporter deposition as a means of signal amplification in a variety of formats. J Immunol Methods 1992; 150: Wood GS and Warnke R. Suppression of endogenous avidin-biotin activity in tissues and its relevance to biotin-avidin detection systems. J Histochem Cytochem 1981; 29(10): Banerjee D and Pettit S. Endogenous avidin-binding activity in human lymphoid tissue. J Clin Pathol 1984; 37: Department of Health, Education and Welfare, National Institute for Occupational Safety and Health, Rockville, MD. Procedures for the decontamination of plumbing systems containing copper and/or lead azides. DHHS (NIOSH) Publ. No , Current 13. August 16, National Committee for Clinical Laboratory Standards. Protection of laboratory workers from instrument biohazards and infectious disease transmitted by blood, body fluids and tissue; approved guideline. Villanova, PA. 1997; Order Code M29-A 10. Kiernan JA. Histological and histochemical methods: Theory and practice. New York: Pergamon Press 1981; Boenisch T. In: Naish SJ, ed. Handbook immunochemical staining methods. Carpinteria: Dako Nadji M and Morales AR. Immunoperoxidase: I. The technique and its pitfalls. Lab Med 1983; 14: Banks PM. Diagnostic applications of an immunoperoxidase method in hematopathology. J Histochem Cytochem 1979; 27: Culling CFA, Reid PE, Sinnott NM. The effect of various fixatives and trypsin digestion upon the staining of routine paraffin-embedded sections by the peroxidase-antiperoxidase and immunofluorescent technique. J Histotech 1980; 3: Carson FL (ed). Histotechnology: A self-instructional text. Chicago: ASCP Press 1990: Elias JM, Gown AM, Nakamura RM, Wilbur DC, Herman GE, Jaffe ES, Battifora H, Brigati DJ. Special report: Quality control in immunohistochemistry. Amer J Clin Pathol 1989; 92: National Committee for Clinical Laboratory Standard. Internal quality control testing: principles and definitions; approved guideline. Villanova, PA 1991; Order code C24-A:4 18. Herman GE and Elfont EA. The taming of immunohistochemistry: The new era of quality control. Biotech & Histochem 1991; 66: Escribano LM, Gabriel LC, Villa E, Navarro JL. Endogenous peroxidase activity in human cutaneous and adenoidal mast cells. J Histochem Cytochem 1987; 35: Elias JM. Immunohistopathology: A practical approach to diagnosis. Chicago: Amer Soc Clin Pathol Press 1990; Omata M, Liew C-T, Ashcavai M, Peters RL. Nonimmunologic binding of horseradish peroxidase to hepatitis B surface antigen: A possible source of error in immunohistochemistry. Amer J Pathol 1980; 73: Tubbs RR, Gephardt GN, Petras RE. Atlas of immunohistology. Chicago: Amer Soc Clin Pathol Press Nadji M and Morales AR. Immunoperoxidase techniques, a practical approach to tumor diagnosis. Chicago: Amer Soc Clin Pathol Press Centers for Disease Control Manual Guide Safety Management, No. CDC-22, Atlanta, GA. Decontamination of laboratory sink drains to remove azide salts. April 30, 1976 Edition 07/15 ( ) P04037ES_01/K1497/ p. 10/10
Estas instrucciones se aplican a Dako EnVision+, Peroxidase (Dako EnVision+, HRP).
 Dako EnVision+ System- HRP Labelled Polymer Anti-ratón Nº de catálogo K4000 15 ml Nº de catálogo K4001 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican a Dako EnVision+,
Dako EnVision+ System- HRP Labelled Polymer Anti-ratón Nº de catálogo K4000 15 ml Nº de catálogo K4001 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican a Dako EnVision+,
Estas instrucciones corresponden a Dako EnVision+ Dual Link System-HRP (DAB+).
 Dako EnVision + Dual Link System-HRP (DAB+) Nº de catálogo K4065 Uso previsto Para uso en diagnóstico in vitro. Estas instrucciones corresponden a Dako EnVision+ Dual Link System-HRP (DAB+). Este kit está
Dako EnVision + Dual Link System-HRP (DAB+) Nº de catálogo K4065 Uso previsto Para uso en diagnóstico in vitro. Estas instrucciones corresponden a Dako EnVision+ Dual Link System-HRP (DAB+). Este kit está
Las técnicas de tinción inmunoenzimáticas/inmunhistoquímicas (IHQ) permiten la visualización de los antígenos en tejidos (células).
 Dako LSAB 2 System-AP Catálogo K0674 110 ml Catálogo K0676 15 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican al sistema Universal Dako LSAB 2 System, Alkaline Phosphatase
Dako LSAB 2 System-AP Catálogo K0674 110 ml Catálogo K0676 15 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican al sistema Universal Dako LSAB 2 System, Alkaline Phosphatase
Estreptavidina conjugada con peroxidasa de rábano en PBS que contiene proteína estabilizante y agentes antimicrobianos.
 Dako LSAB2 System-HRP Nº de catálogo K0672 15 ml Nº de catálogo K0673 15 ml Nº de catálogo K0675 110 ml Uso previsto Para uso en diagnóstico in vitro. Estas instrucciones se aplican al Dako Labelled Streptavidin-Biotin2
Dako LSAB2 System-HRP Nº de catálogo K0672 15 ml Nº de catálogo K0673 15 ml Nº de catálogo K0675 110 ml Uso previsto Para uso en diagnóstico in vitro. Estas instrucciones se aplican al Dako Labelled Streptavidin-Biotin2
Catalyzed Signal Amplification (CSA) System Para su uso con anticuerpos primarios de ratón
 Catalyzed Signal Amplification (CSA) System Para su uso con anticuerpos primarios de ratón Código K1500 15 ml Licencia de uso limitado Este producto se distribuye y vende al usuario final conforme con
Catalyzed Signal Amplification (CSA) System Para su uso con anticuerpos primarios de ratón Código K1500 15 ml Licencia de uso limitado Este producto se distribuye y vende al usuario final conforme con
Dako EnVision+ System- HRP Labelled Polymer Anti-Rabbit. Código K ml Código K ml. Indicaciones de uso. Para uso diagnóstico in vitro.
 Dako EnVision+ System- HRP Labelled Polymer Anti-Rabbit Código K4002 15 ml Código K4003 110 ml Indicaciones de uso Para uso diagnóstico in vitro. These instructions se aplican al sistema Dako EnVision
Dako EnVision+ System- HRP Labelled Polymer Anti-Rabbit Código K4002 15 ml Código K4003 110 ml Indicaciones de uso Para uso diagnóstico in vitro. These instructions se aplican al sistema Dako EnVision
EnVision FLEX+, Mouse, High ph, (Link)
 EnVision FLEX+, Mouse, High ph, (Link) Código K8002 5ª edición El kit contiene reactivos suficientes para 400 600 pruebas. Para instrumentos Autostainer Link. Reactivos opcionales: Código Nombre del producto
EnVision FLEX+, Mouse, High ph, (Link) Código K8002 5ª edición El kit contiene reactivos suficientes para 400 600 pruebas. Para instrumentos Autostainer Link. Reactivos opcionales: Código Nombre del producto
Dako EnVision+ System-HRP (DAB) Para su uso con anticuerpos primarios de conejo
 Dako EnVision+ System-HRP (DAB) Para su uso con anticuerpos primarios de conejo Código K4010 15 ml Código K4011 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican
Dako EnVision+ System-HRP (DAB) Para su uso con anticuerpos primarios de conejo Código K4010 15 ml Código K4011 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican
EnVision FLEX Mini Kit, High ph (Dako Omnis)
 EnVision FLEX Mini Kit, High ph (Dako Omnis) Nº de catálogo GV8232ª edición El kit contiene reactivos suficientes para 150 pruebas. Para instrumentos Dako Omnis. Reactivos opcionales: N.º de catálogo GV804
EnVision FLEX Mini Kit, High ph (Dako Omnis) Nº de catálogo GV8232ª edición El kit contiene reactivos suficientes para 150 pruebas. Para instrumentos Dako Omnis. Reactivos opcionales: N.º de catálogo GV804
Dako REAL Detection System, Peroxidase/DAB+, Rabbit/Mouse
 Dako REAL Detection System, Peroxidase/DAB+, Rabbit/Mouse Código K5001 6ª edición Para su uso con instrumentos de inmunotinción automatizada de Dako. El kit contiene reactivos suficientes para 500 pruebas.
Dako REAL Detection System, Peroxidase/DAB+, Rabbit/Mouse Código K5001 6ª edición Para su uso con instrumentos de inmunotinción automatizada de Dako. El kit contiene reactivos suficientes para 500 pruebas.
Dako EnVision+ System-HRP (DAB) Para su uso con anticuerpos primarios de ratón
 Dako EnVision+ System-HRP (DAB) Para su uso con anticuerpos primarios de ratón Código K4006 15 ml Código K4007 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican al
Dako EnVision+ System-HRP (DAB) Para su uso con anticuerpos primarios de ratón Código K4006 15 ml Código K4007 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones se aplican al
EnVision FLEX, High ph, (Dako Autostainer/Autostainer Plus)
 EnVision FLEX, High ph, (Dako Autostainer/Autostainer Plus) Código K8010 6ª edición El kit contiene reactivos suficientes para 400 600 pruebas. Para Dako Autostainer/Autostainer Plus. Reactivos opcionales:
EnVision FLEX, High ph, (Dako Autostainer/Autostainer Plus) Código K8010 6ª edición El kit contiene reactivos suficientes para 400 600 pruebas. Para Dako Autostainer/Autostainer Plus. Reactivos opcionales:
EnVision DuoFLEX Doublestain System, (Link)
 EnVision DuoFLEX Doublestain System, (Link) N.º de catálogo SK110 Edición 06/15 Este kit contiene reactivos suficientes para 100 150 pruebas. Para instrumentos Autostainer Link. (127843-001) P04070ES_01/SK110/2015.06
EnVision DuoFLEX Doublestain System, (Link) N.º de catálogo SK110 Edición 06/15 Este kit contiene reactivos suficientes para 100 150 pruebas. Para instrumentos Autostainer Link. (127843-001) P04070ES_01/SK110/2015.06
Dako EnVision+ System-HRP (AEC) For Use with Mouse Primary Antibodies. Nº de catálogo K ml Nº de catálogo K ml
 Dako EnVision+ System-HRP (AEC) For Use with Mouse Primary Antibodies Nº de catálogo K4004 115 ml Nº de catálogo K4005 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones son
Dako EnVision+ System-HRP (AEC) For Use with Mouse Primary Antibodies Nº de catálogo K4004 115 ml Nº de catálogo K4005 110 ml Indicaciones de uso Para uso diagnóstico in vitro. Estas instrucciones son
GenPoint utiliza tecnología desarrollada por y bajo licencia de PERKIN ELMER/NEN LIFE SCIENCE PRODUCTS, INC. (Patente estadounidense N ).
 Dako GenPoint TM Tyramide Signal Amplification System for Biotinylated Probes Nº de catálogo K0620 10 ml Licencia de uso limitado GenPoint utiliza tecnología desarrollada por y bajo licencia de PERKIN
Dako GenPoint TM Tyramide Signal Amplification System for Biotinylated Probes Nº de catálogo K0620 10 ml Licencia de uso limitado GenPoint utiliza tecnología desarrollada por y bajo licencia de PERKIN
PNA ISH Detection Kit N de código K5201
 PNA ISH Detection Kit N de código K5201 9a edición Para la hibridación in situ mediante sondas PNA conjugadas con fluoresceína. El kit contiene reactivos para un mínimo de 40 pruebas*. * Número de pruebas
PNA ISH Detection Kit N de código K5201 9a edición Para la hibridación in situ mediante sondas PNA conjugadas con fluoresceína. El kit contiene reactivos para un mínimo de 40 pruebas*. * Número de pruebas
HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS
 HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS INTERES CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS INTERES CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
HBsAg CONFIRMATORY TEST INTERÉS CLÍNICO
 HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS. INTERÉS CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS. INTERÉS CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
HercepTest for Automated Link Platforms
 HercepTest for Automated Link Platforms Nº de catálogo SK001 22ª edición (129282-001) P04456ES_01_SK00121-2/2016.05 p. 1/40 Índice Página/ Uso previsto...3 Resumen y explicación - Mama...4 Principio del
HercepTest for Automated Link Platforms Nº de catálogo SK001 22ª edición (129282-001) P04456ES_01_SK00121-2/2016.05 p. 1/40 Índice Página/ Uso previsto...3 Resumen y explicación - Mama...4 Principio del
INSTRUCCIONES DE USO PARASITE SUSPENSIONS. n Parasite Suspensions en formalina USO PREVISTO RESUMEN Y EXPLICACIÓN PRINCIPIOS COMPOSICIÓN
 INSTRUCCIONES DE USO n Parasite Suspensions en formalina USO PREVISTO Microbiologics Parasite Suspensions sirve de ayuda a los programas de control de calidad al utilizarse como muestras comparativas para
INSTRUCCIONES DE USO n Parasite Suspensions en formalina USO PREVISTO Microbiologics Parasite Suspensions sirve de ayuda a los programas de control de calidad al utilizarse como muestras comparativas para
INMUNOHISTOQUÍMICA. Métodos inmunoenzimáticos. Bioq. Gerardo Pisani
 INMUNOHISTOQUÍMICA Métodos inmunoenzimáticos Bioq. Gerardo Pisani Métodos inmunoenzimáticos Permite localizar moléculas en los tejidos mediante el empleo de anticuerpos. Utilizan reacciones enzima-sustrato.
INMUNOHISTOQUÍMICA Métodos inmunoenzimáticos Bioq. Gerardo Pisani Métodos inmunoenzimáticos Permite localizar moléculas en los tejidos mediante el empleo de anticuerpos. Utilizan reacciones enzima-sustrato.
TECNICA DE INMUNOHISTOQUIMICA *IHQ*
 Hospital General ISSS TECNICA DE INMUNOHISTOQUIMICA *IHQ* Tec. Delmy de Chávez Sep/2010 Estufa EQUIPO BASICO Baño de María EQUIPO BASICO Microscopio EQUIPO BASICO Medidor de ph. EQUIPO BASICO Refrigeradora
Hospital General ISSS TECNICA DE INMUNOHISTOQUIMICA *IHQ* Tec. Delmy de Chávez Sep/2010 Estufa EQUIPO BASICO Baño de María EQUIPO BASICO Microscopio EQUIPO BASICO Medidor de ph. EQUIPO BASICO Refrigeradora
INDICACIONES TRADOS. Orina. control hcg. Juego de. hcg Orina. etapas de embarazo. temprano. Cuando se. hcg Orina. tamponada con.
 Instrucciones para uso profesional INDICACIONES El Juego de control hcg Orina se utiliza con la prueba de QuickVue+ hcg Combo, prueba de QuickVue hcg Orina o Combo y prueba de RapidVue hcg. Estos controles
Instrucciones para uso profesional INDICACIONES El Juego de control hcg Orina se utiliza con la prueba de QuickVue+ hcg Combo, prueba de QuickVue hcg Orina o Combo y prueba de RapidVue hcg. Estos controles
HercepTest N de catálogo K5204
 HercepTest N de catálogo K5204 21ª edición Para tinción inmunocitoquímica. El kit es para 35 pruebas (70 portaobjetos). (129254-001) P04454ES_01_K520421-2/2016.05 p. 1/55 Índice Página Indicaciones de
HercepTest N de catálogo K5204 21ª edición Para tinción inmunocitoquímica. El kit es para 35 pruebas (70 portaobjetos). (129254-001) P04454ES_01_K520421-2/2016.05 p. 1/55 Índice Página Indicaciones de
Positive Control (ORG ) Negative Control (ORG ) Instrucciones para el uso 10/2009
 ORGENTEC Diagnostika GmbH Carl-Zeiss-Straße 49 55129 Mainz Tel.: 06131-9258-0 Fax: 06131-9258-58 Positive Control (ORG 310-24) Negative Control (ORG 311-24) Instrucciones para el uso 10/2009 1/7 alegria-control-0910-04-es
ORGENTEC Diagnostika GmbH Carl-Zeiss-Straße 49 55129 Mainz Tel.: 06131-9258-0 Fax: 06131-9258-58 Positive Control (ORG 310-24) Negative Control (ORG 311-24) Instrucciones para el uso 10/2009 1/7 alegria-control-0910-04-es
HercepTest for Dako Autostainer
 HercepTest for Dako Autostainer N de catálogo K5207 20ª edición Para tinción inmunocitoquímica. El kit es para 50 pruebas (100 portaobjetos). (129269-001) P04455ES_01_K520721-2/2016.05 p. 1/53 Índice Página
HercepTest for Dako Autostainer N de catálogo K5207 20ª edición Para tinción inmunocitoquímica. El kit es para 50 pruebas (100 portaobjetos). (129269-001) P04455ES_01_K520721-2/2016.05 p. 1/53 Índice Página
Inmunohistoquímica antígenos anticuerpos
 Inmunohistoquímica Inmunohistoquímica es toda técnica que permite detectar in situ componentes celulares y extracelulares (antígenos) mediante anticuerpos específicos. Metas Demostrar la presencia real
Inmunohistoquímica Inmunohistoquímica es toda técnica que permite detectar in situ componentes celulares y extracelulares (antígenos) mediante anticuerpos específicos. Metas Demostrar la presencia real
FluoroSpheres Code No. K0110
 FluoroSpheres Code No. K0110 6a edición Perlas de calibración para monitoreo diario del citómetro de flujo. Contiene reactivos para 40 calibraciones. (105798-004) SSK0110CE_02/ES/2015.12 p. 1/8 Contenidos
FluoroSpheres Code No. K0110 6a edición Perlas de calibración para monitoreo diario del citómetro de flujo. Contiene reactivos para 40 calibraciones. (105798-004) SSK0110CE_02/ES/2015.12 p. 1/8 Contenidos
EGFR pharmdx. Nº de catálogo K pruebas para uso en el Dako Autostainer Edición 05/2015. Uso previsto Para uso en diagnóstico in vitro.
 EGFR pharmdx Nº de catálogo K1494 50 pruebas para uso en el Dako Autostainer Edición 05/2015 Uso previsto Para uso en diagnóstico in vitro. El ensayo EGFR pharmdx es un kit inmunohistoquímico (IHQ) para
EGFR pharmdx Nº de catálogo K1494 50 pruebas para uso en el Dako Autostainer Edición 05/2015 Uso previsto Para uso en diagnóstico in vitro. El ensayo EGFR pharmdx es un kit inmunohistoquímico (IHQ) para
ÍNDICE 1. INTRODUCCIÓN 1 2. HIPÓTESIS OBJETIVOS OBJETIVO GENERAL OBJETIVOS ESPECÍFICOS REVISIÓN BIBLIOGRÁFICA...
 ÍNDICE 1. INTRODUCCIÓN 1 2. HIPÓTESIS... 4 3. OBJETIVOS... 5 3.1 OBJETIVO GENERAL... 5 3.2 OBJETIVOS ESPECÍFICOS... 6 4. REVISIÓN BIBLIOGRÁFICA... 7 4.1 ASPECTO GENERALES... 7 4.2 TUMOR ODONTOGÉNICO QUERATOQUÍSTICO..,...
ÍNDICE 1. INTRODUCCIÓN 1 2. HIPÓTESIS... 4 3. OBJETIVOS... 5 3.1 OBJETIVO GENERAL... 5 3.2 OBJETIVOS ESPECÍFICOS... 6 4. REVISIÓN BIBLIOGRÁFICA... 7 4.1 ASPECTO GENERALES... 7 4.2 TUMOR ODONTOGÉNICO QUERATOQUÍSTICO..,...
Carmín al 1% (laca de alumbre C.I ), cloruro de aluminio (anhídrido) al 1% y alcohol etílico al 50% en agua desionizada
 Artisan Mucicarmine Stain Kit Nº de catálogo AR168 Uso previsto Para uso en diagnóstico in vitro. Mucicarmine Stain Kit ha sido diseñado para su uso en laboratorio con objeto de identificar las mucinas
Artisan Mucicarmine Stain Kit Nº de catálogo AR168 Uso previsto Para uso en diagnóstico in vitro. Mucicarmine Stain Kit ha sido diseñado para su uso en laboratorio con objeto de identificar las mucinas
Laboratorio Nacional de Salud Pública
 1. Tinción de Gram 2. Objeto y campo de aplicación La técnica de tinción de Gram se utiliza para la tinción de bacterias, levaduras y actinomicetos aerobios. Este procedimiento operativo estándar es aplicable
1. Tinción de Gram 2. Objeto y campo de aplicación La técnica de tinción de Gram se utiliza para la tinción de bacterias, levaduras y actinomicetos aerobios. Este procedimiento operativo estándar es aplicable
c-kit pharmdx Código K para uso en el Dako Autostainer Uso previsto Para uso en diagnóstico in vitro.
 c-kit pharmdx Código K1907 35 para uso en el Dako Autostainer Uso previsto Para uso en diagnóstico in vitro. El ensayo c-kit pharmdx es un kit inmunohistoquímico (IHQ) cualitativo usado en el Dako Autostainer
c-kit pharmdx Código K1907 35 para uso en el Dako Autostainer Uso previsto Para uso en diagnóstico in vitro. El ensayo c-kit pharmdx es un kit inmunohistoquímico (IHQ) cualitativo usado en el Dako Autostainer
ZytoLight SPEC FGFR1/CEN 8 Dual Color Probe
 ZytoLight SPEC FGFR1/CEN 8 Dual Color Probe Z-2072-200 Z-2072-50 20 (0,2 ml) 5 (0,05 ml) Para la detección del gen humano FGFR1 y el satélite alfa del cromosoma 8 mediante hibridación in situ con fluorescencia
ZytoLight SPEC FGFR1/CEN 8 Dual Color Probe Z-2072-200 Z-2072-50 20 (0,2 ml) 5 (0,05 ml) Para la detección del gen humano FGFR1 y el satélite alfa del cromosoma 8 mediante hibridación in situ con fluorescencia
Instrucciones: Número de laboratorios participantes: Remitidos: 88 Contestados: 84 GCP (95.45 %) y 83(94.31%) Control Local
 SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología MÓDULO DE IHQ GENERAL RONDA 35 Antígeno probado: HMB45 Tejido probado: ü
SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología MÓDULO DE IHQ GENERAL RONDA 35 Antígeno probado: HMB45 Tejido probado: ü
Ensayo rápido cuantitativo microfluidico para la detección de Dimero - D. Uso Exclusivo para la Atencion Medica Profesional
 Ensayo rápido cuantitativo microfluidico para la detección de Dimero - D Uso Exclusivo para la Atencion Medica Profesional INTRODUCCIÓN Cuando la fibrina en un coágulo sanguíneo se rompe por las enzimas
Ensayo rápido cuantitativo microfluidico para la detección de Dimero - D Uso Exclusivo para la Atencion Medica Profesional INTRODUCCIÓN Cuando la fibrina en un coágulo sanguíneo se rompe por las enzimas
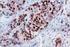
Inmunohistoquímica. Páncreas.
 Inmunohistoquímica Inmunohistoquímica es toda técnica que permite detectar in situ componentes celulares y extracelulares (antígenos) mediante anticuerpos específicos. Páncreas. Metas Demostrar la presencia
Inmunohistoquímica Inmunohistoquímica es toda técnica que permite detectar in situ componentes celulares y extracelulares (antígenos) mediante anticuerpos específicos. Páncreas. Metas Demostrar la presencia
ZytoLight SPEC RET Dual Color Break Apart Probe
 ZytoLight SPEC RET Dual Color Break Apart Probe Z-2148-200 Z-2148-50 20 (0,2 ml) 5 (0,05 ml) Para la detección de translocaciones que involucran al gen RET en 10q11.21 mediante hibridación in situ con
ZytoLight SPEC RET Dual Color Break Apart Probe Z-2148-200 Z-2148-50 20 (0,2 ml) 5 (0,05 ml) Para la detección de translocaciones que involucran al gen RET en 10q11.21 mediante hibridación in situ con
GUIA DE SOLUCIÓN DE ERRORES EN EL TAMIZAJE DE HEMOTRANSMISIBLES. Lic. TM. ANDRÉS LARA RODRÍGUEZ Hospital San Bartolomé
 GUIA DE SOLUCIÓN DE ERRORES EN EL TAMIZAJE DE HEMOTRANSMISIBLES Lic. TM. ANDRÉS LARA RODRÍGUEZ Hospital San Bartolomé Esquema de investigación en pruebas fallidas Revisar el procedimiento y determinar
GUIA DE SOLUCIÓN DE ERRORES EN EL TAMIZAJE DE HEMOTRANSMISIBLES Lic. TM. ANDRÉS LARA RODRÍGUEZ Hospital San Bartolomé Esquema de investigación en pruebas fallidas Revisar el procedimiento y determinar
Progensa PCA3 Urine Specimen Transport Kit
 Urine Specimen Transport Kit Instrucciones del médico Para uso de diagnóstico in vitro. Para exportación de EE.UU. únicamente. Instrucciones 1. Se recomienda que el paciente beba agua abundantemente (aproximadamente
Urine Specimen Transport Kit Instrucciones del médico Para uso de diagnóstico in vitro. Para exportación de EE.UU. únicamente. Instrucciones 1. Se recomienda que el paciente beba agua abundantemente (aproximadamente
50 kits de recolección de muestras con torunda multitest Aptima (N.º de catálogo PRD-03546) Cada kit contiene:
 Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
DANAGENE microspin DNA KIT
 Ref. 0607.1 50 extracciones Ref. 0607.2 250 extracciones 1.INTRODUCCION DANAGENE microspin DNA KIT Este kit permite una eficiente extracción de ADN genómico y mitocondrial a partir de muestras de pequeño
Ref. 0607.1 50 extracciones Ref. 0607.2 250 extracciones 1.INTRODUCCION DANAGENE microspin DNA KIT Este kit permite una eficiente extracción de ADN genómico y mitocondrial a partir de muestras de pequeño
Heat Shock Protein 27 (G3.1)
 Identificación del Producto N.º de ref. Descripción 46946 HSP27 0,1 M (G3.1) 46947 HSP27 1 M (G3.1) 46945 HSP27 RTU M (G3.1) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Identificación del Producto N.º de ref. Descripción 46946 HSP27 0,1 M (G3.1) 46947 HSP27 1 M (G3.1) 46945 HSP27 RTU M (G3.1) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
PROTOCOLO DE UTILIZACIÓN Hibridación para cortes de tejidos preservados en parafina
 PROTOCOLO DE UTILIZACIÓN Hibridación para cortes de tejidos preservados en parafina Materiales Provistos: ADN marcado con moléculas fluorescentes (sonda). Buffer de Hibridación Reactivos para preparar
PROTOCOLO DE UTILIZACIÓN Hibridación para cortes de tejidos preservados en parafina Materiales Provistos: ADN marcado con moléculas fluorescentes (sonda). Buffer de Hibridación Reactivos para preparar
Módulo de PATOLOGÍA QUIRÚRGICA GENERAL. Ronda nº 4
 SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº 4 Antígeno probado: CROMOGRANINA
SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº 4 Antígeno probado: CROMOGRANINA
TÉCNICAS DE IMAGEN EN BIOLOGÍA. Juan Luis Martínez (Ed.)
 TÉCNICAS DE IMAGEN EN BIOLOGÍA Juan Luis Martínez (Ed.) N. Anadón, A.M. Coto, J.M. Fraga, A. González, J.L. Martínez, A.M. Nistal, D. Tolivia Vicerrectorado de Postgrado y Títulos Propios. Universidad
TÉCNICAS DE IMAGEN EN BIOLOGÍA Juan Luis Martínez (Ed.) N. Anadón, A.M. Coto, J.M. Fraga, A. González, J.L. Martínez, A.M. Nistal, D. Tolivia Vicerrectorado de Postgrado y Títulos Propios. Universidad
INMUNOHISTOQUIMICA. Laboratorio de Inmunología Clínica Facultad de Ciencias Químicas - UNA
 INMUNOHISTOQUIMICA Laboratorio de Inmunología Clínica Facultad de Ciencias Químicas - UNA INMUNOHISTOQUIMICA Objetivo identificar Ag dentro de un corte tisular. Mediante la utilización de Anticuerpos monoclonales
INMUNOHISTOQUIMICA Laboratorio de Inmunología Clínica Facultad de Ciencias Químicas - UNA INMUNOHISTOQUIMICA Objetivo identificar Ag dentro de un corte tisular. Mediante la utilización de Anticuerpos monoclonales
Módulo de PATOLOGÍA QUIRÚRGICA GENERAL. Ronda nº 6
 SEAP Calle Ancora, 3, 2º B 284 MADRID Tfno. y Fax 91 39 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº 6 Antígeno probado: HMB4 Tejido
SEAP Calle Ancora, 3, 2º B 284 MADRID Tfno. y Fax 91 39 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº 6 Antígeno probado: HMB4 Tejido
Módulo de PATOLOGÍA LINFOIDE. Ronda nº 9
 SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA LINFOIDE Ronda nº 9 Antígeno probado: CD79a Tejido probado:
SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA LINFOIDE Ronda nº 9 Antígeno probado: CD79a Tejido probado:
PROTOCOLO OPCIONAL TITULACIÓN DE SALINIDAD
 PROTOCOLO OPCIONAL TITULACIÓN DE SALINIDAD Objetivo General Medir la salinidad del agua utilizando un kit de titulación. Visión General El alumnado usará un kit de titulación para medir la salinidad del
PROTOCOLO OPCIONAL TITULACIÓN DE SALINIDAD Objetivo General Medir la salinidad del agua utilizando un kit de titulación. Visión General El alumnado usará un kit de titulación para medir la salinidad del
EFECTIVIDAD DE ANTICUERPOS CADUCADOS EN TÉCNICAS DE INMUNOHISTOQUÍMICA.
 IV CONGRESO VIRTUAL HISPANO AMERICANO DE ANATOMÍA PATOLÓGICA CONTENIDO Abstract PDF Comentarios Título Resumen Introducción Material Resultados Discusión Conclusiones Referencias EFECTIVIDAD DE ANTICUERPOS
IV CONGRESO VIRTUAL HISPANO AMERICANO DE ANATOMÍA PATOLÓGICA CONTENIDO Abstract PDF Comentarios Título Resumen Introducción Material Resultados Discusión Conclusiones Referencias EFECTIVIDAD DE ANTICUERPOS
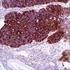
Inmunohistoquímica. Páncreas.
 Inmunohistoquímica Inmunohistoquímica es toda técnica que permite detectar in situ componentes celulares y extracelulares (antígenos) mediante anticuerpos específicos. Páncreas. Metas Demostrar la presencia
Inmunohistoquímica Inmunohistoquímica es toda técnica que permite detectar in situ componentes celulares y extracelulares (antígenos) mediante anticuerpos específicos. Páncreas. Metas Demostrar la presencia
LA DOBLE TINCIÓN EN INMUNOHISTOQUÍMICA
 LA DOBLE TINCIÓN EN INMUNOHISTOQUÍMICA (Zaragoza, Mayo 2011) Inés Martín-Lacave y José C Utrilla Alcolea Dptº de Citología e Histología Normal y Patológica Facultad de Medicina Universidad de Sevilla LA
LA DOBLE TINCIÓN EN INMUNOHISTOQUÍMICA (Zaragoza, Mayo 2011) Inés Martín-Lacave y José C Utrilla Alcolea Dptº de Citología e Histología Normal y Patológica Facultad de Medicina Universidad de Sevilla LA
Módulo de PATOLOGÍA LINFOIDE. Ronda nº 2
 SEAP Calle Ancora, 3, º B MADRID Tfno. y Fax 9 39 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Antígeno probado: bcl Tejido probado: Amígdala Módulo de PATOLOGÍA LINFOIDE Ronda nº Instrucciones:
SEAP Calle Ancora, 3, º B MADRID Tfno. y Fax 9 39 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Antígeno probado: bcl Tejido probado: Amígdala Módulo de PATOLOGÍA LINFOIDE Ronda nº Instrucciones:
PRUEBA DE OVULACIÓN CONTENIDO: INTRODUCCIÓN: CONSERVACIÓN Y ESTABILIDAD: Conservar por debajo de 30, no congelar. LIMITACIONES:
 PRUEBA DE OVULACIÓN INTRODUCCIÓN: La ovulación es la liberación de un óvulo del ovario. El óvulo entonces pasa a la trompa de Falopio donde está listo para ser fertilizado. Un bebé es concebido cuando
PRUEBA DE OVULACIÓN INTRODUCCIÓN: La ovulación es la liberación de un óvulo del ovario. El óvulo entonces pasa a la trompa de Falopio donde está listo para ser fertilizado. Un bebé es concebido cuando
Biología Celular e Histología. Prácticas de Biología Celular. Cultivos celulares y Procesamiento de tejidos.
 Biología Celular e Histología Prácticas de Biología Celular Cultivos celulares y Procesamiento de tejidos. Suspensiones celulares. Inmunodetección directa. Identificación celular tras cultivo. Manejo del
Biología Celular e Histología Prácticas de Biología Celular Cultivos celulares y Procesamiento de tejidos. Suspensiones celulares. Inmunodetección directa. Identificación celular tras cultivo. Manejo del
AUTOSTAINER PLUS DAKO PROCEDIMIENTO PARA LA UTILIZACIÓN DEL AUTOSTAINER PLUS DE DAKO
 Pag. 1 de PROCEDIMIENTO PARA LA UTILIZACIÓN DEL AUTOSTAINER PLUS DE DAKO DESCRIPCIÓN El Autostainer PLUS es un sistema automático que es compatible con las técnicas de IHQ, permitiendo un procesado automático
Pag. 1 de PROCEDIMIENTO PARA LA UTILIZACIÓN DEL AUTOSTAINER PLUS DE DAKO DESCRIPCIÓN El Autostainer PLUS es un sistema automático que es compatible con las técnicas de IHQ, permitiendo un procesado automático
Preparación de muestras para microscopía confocal
 Preparación de muestras para microscopía confocal Andrés Esteban Cantos y Covadonga Alonso Martí Laboratorio de Interacción virus-célula Departamento de Biotecnología del INIA Preparación de muestras La
Preparación de muestras para microscopía confocal Andrés Esteban Cantos y Covadonga Alonso Martí Laboratorio de Interacción virus-célula Departamento de Biotecnología del INIA Preparación de muestras La
FICHA TECNICA DE PRODUCTOS Y EQUIPOS
 1 de 5 NOMBRE DEL PRODUCTO: GENTAMICINA REFERENCIA: 6801711 MARCA: JOHNSON & JOHNSON GENERALIDADES 1. Aplicación Para uso diagnóstico in vitro. El VITROS Chemistry Products GENT Reagent se usa para determinar
1 de 5 NOMBRE DEL PRODUCTO: GENTAMICINA REFERENCIA: 6801711 MARCA: JOHNSON & JOHNSON GENERALIDADES 1. Aplicación Para uso diagnóstico in vitro. El VITROS Chemistry Products GENT Reagent se usa para determinar
TÉCNICA DEL FISH. Mª Dolores Durán HGU de Alicante
 TÉCNICA DEL FISH Mª Dolores Durán HGU de Alicante HIS : hibridación in situ Capacidad que poseen los ácidos nucléicos para hibridarse entre sí. Permite detectar secuencias específicas de ácidos nucléicos
TÉCNICA DEL FISH Mª Dolores Durán HGU de Alicante HIS : hibridación in situ Capacidad que poseen los ácidos nucléicos para hibridarse entre sí. Permite detectar secuencias específicas de ácidos nucléicos
Cytokeratin 20 (Ks20.8)
 Identificación del Producto N.º de ref. Descripción 44559 Cytokeratin 20 0,1 M (Ks20.8) 44560 Cytokeratin 20 1 M (Ks20.8) 44269 Cytokeratin 20 RTU M (Ks20.8) Definiciones De Los Símbolos P C A E S DIL
Identificación del Producto N.º de ref. Descripción 44559 Cytokeratin 20 0,1 M (Ks20.8) 44560 Cytokeratin 20 1 M (Ks20.8) 44269 Cytokeratin 20 RTU M (Ks20.8) Definiciones De Los Símbolos P C A E S DIL
QUANTA Chek ANA Panel
 QUANTA Chek ANA Panel 708111 Uso previsto El QUANTA Chek TM ANA Panel se utiliza como control de calidad de los procedimientos IFA y ELISA para anticuerpos antinucleares. Cada suero sirve como control
QUANTA Chek ANA Panel 708111 Uso previsto El QUANTA Chek TM ANA Panel se utiliza como control de calidad de los procedimientos IFA y ELISA para anticuerpos antinucleares. Cada suero sirve como control
FICHA DE DATOS DE SEGURIDAD (MSDS) KIT CLART HPV2
 1. Identificación de la sustancia y proveedor Nombre comercial CLART HPV2 Referencias: Extracción-Purificación y Amplificación 48 determinaciones Ref.: AT-1104-48-MT 96 determinaciones Ref.: AS-0108-96-PL
1. Identificación de la sustancia y proveedor Nombre comercial CLART HPV2 Referencias: Extracción-Purificación y Amplificación 48 determinaciones Ref.: AT-1104-48-MT 96 determinaciones Ref.: AS-0108-96-PL
Artisan Jones Basement Membrane Stain Kit. Nº de catálogo AR180. Uso previsto Para uso en diagnóstico in vitro.
 Artisan Jones Basement Membrane Stain Kit Nº de catálogo AR180 Uso previsto Para uso en diagnóstico in vitro. El Jones Basement Membrane Stain Kit ha sido diseñado para su uso en laboratorio con objeto
Artisan Jones Basement Membrane Stain Kit Nº de catálogo AR180 Uso previsto Para uso en diagnóstico in vitro. El Jones Basement Membrane Stain Kit ha sido diseñado para su uso en laboratorio con objeto
Cytology FISH Accessory Kit Nº de catálogo K 5499
 Cytology FISH Accessory Kit Nº de catálogo K 5499 2ª edición Para hibridación in situ fluorescente (FISH, por sus siglas en inglés) con muestras de citología. El kit contiene reactivos suficientes para
Cytology FISH Accessory Kit Nº de catálogo K 5499 2ª edición Para hibridación in situ fluorescente (FISH, por sus siglas en inglés) con muestras de citología. El kit contiene reactivos suficientes para
Herpes Simplex Virus II (Polyclonal)
 Identificación del Producto N.º de ref. Descripción 44640 Herpes simplex virus II 0,1 R (Poly) 44641 Herpes simplex virus II 1 R (Poly) 44309 Herpes simplex virus II RTU R (Poly) Definiciones De Los Símbolos
Identificación del Producto N.º de ref. Descripción 44640 Herpes simplex virus II 0,1 R (Poly) 44641 Herpes simplex virus II 1 R (Poly) 44309 Herpes simplex virus II RTU R (Poly) Definiciones De Los Símbolos
CD138/syndecan-1 (B-A38)
 Identificación del Producto N.º de ref. Descripción 44463 CD138 0,1 M (B-A38) 44464 CD138 1 M (B-A38) 44220 CD138 RTU M (B-A38) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Identificación del Producto N.º de ref. Descripción 44463 CD138 0,1 M (B-A38) 44464 CD138 1 M (B-A38) 44220 CD138 RTU M (B-A38) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Cytokeratin 20 (Ks20.8)
 Identificación del Producto N.º de ref. Descripción 45139 IMPATH Cytokeratin 20 RTU M (Ks20.8) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número
Identificación del Producto N.º de ref. Descripción 45139 IMPATH Cytokeratin 20 RTU M (Ks20.8) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 44437 BCL6 0,1 M (GI191E/A8) 44438 BCL6 1 M (GI191E/A8) 44206 BCL6 RTU M (GI191E/A8) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
Identificación del Producto N.º de ref. Descripción 44437 BCL6 0,1 M (GI191E/A8) 44438 BCL6 1 M (GI191E/A8) 44206 BCL6 RTU M (GI191E/A8) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
Experimentos típicos. Modo de funcionamiento
 Sensor de ph DT016A El sensor de ph puede ser conectado a los recolectores de datos ITP-C, MultiLogPRO o TriLink. El sensor de ph es capaz de medir en el rango de ph entre 0 y 14, y es utilizado en varios
Sensor de ph DT016A El sensor de ph puede ser conectado a los recolectores de datos ITP-C, MultiLogPRO o TriLink. El sensor de ph es capaz de medir en el rango de ph entre 0 y 14, y es utilizado en varios
FICHA DE DATOS DE SEGURIDAD (MSDS) KIT CLART STIs B
 1. Identificación de la sustancia y proveedor Nombre comercial CLART STIs B Referencias: Extracción y purificación 16 determinaciones Ref.: CS-1113-16 48 determinaciones Ref.: CS-1113-48 Amplificación
1. Identificación de la sustancia y proveedor Nombre comercial CLART STIs B Referencias: Extracción y purificación 16 determinaciones Ref.: CS-1113-16 48 determinaciones Ref.: CS-1113-48 Amplificación
Presentación: 1 LITRO, 2 LITROS, 3 LITROS, 4 LITROS, 10 LITROS Y 20 LITROS.
 LIMPIAVIDRIOS MAGNUS USO INDUSTRIAL Presentación: 1 LITRO, 2 LITROS, 3 LITROS, 4 LITROS, 10 LITROS Y 20 LITROS. CARACTERÍSTICAS Formulado para limpiar eficazmente las superficies de vidrio, incluso ventanas,
LIMPIAVIDRIOS MAGNUS USO INDUSTRIAL Presentación: 1 LITRO, 2 LITROS, 3 LITROS, 4 LITROS, 10 LITROS Y 20 LITROS. CARACTERÍSTICAS Formulado para limpiar eficazmente las superficies de vidrio, incluso ventanas,
INTRODUCCIÓN AL ELISA
 INTRODUCCIÓN AL ELISA 10 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es aportar a los estudiantes el conocimiento y metodología de la técnica del ELISA 2. COMPONENTES
INTRODUCCIÓN AL ELISA 10 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es aportar a los estudiantes el conocimiento y metodología de la técnica del ELISA 2. COMPONENTES
Instrucciones para el uso 10/2009. ORGENTEC Diagnostika GmbH Carl-Zeiss-Straße Mainz Tel.: Fax:
 ORGENTEC Diagnostika GmbH Carl-Zeiss-Straße 49 55129 Mainz Tel.: 06131-9258-0 Fax: 06131-9258-58 Instrucciones para el uso 10/2009 1/8 alegria-0910-04-e ÍNDICE DESCRIPCIÓN BREVE... 3 METODOLOGÍA... 3 INDICACIONES
ORGENTEC Diagnostika GmbH Carl-Zeiss-Straße 49 55129 Mainz Tel.: 06131-9258-0 Fax: 06131-9258-58 Instrucciones para el uso 10/2009 1/8 alegria-0910-04-e ÍNDICE DESCRIPCIÓN BREVE... 3 METODOLOGÍA... 3 INDICACIONES
Histology FISH Accessory Kit N.º de catálogo K5799
 Histology FISH Accessory Kit N.º de catálogo K5799 6ª edición Para hibridación in situ fluorescente (FISH) con cortes de tejidos fijados con formol e incluidos en parafina. El kit contiene reactivos suficientes
Histology FISH Accessory Kit N.º de catálogo K5799 6ª edición Para hibridación in situ fluorescente (FISH) con cortes de tejidos fijados con formol e incluidos en parafina. El kit contiene reactivos suficientes
11. MÉTODOS PARA LA DETECCIÓN DEL ROTAVIRUS. Actualmente existen diversos métodos en el mercado que pueden utilizarse
 11. MÉTODOS PARA LA DETECCIÓN DEL ROTAVIRUS Actualmente existen diversos métodos en el mercado que pueden utilizarse para el diagnóstico de rotavirus, las cuales pueden realizarse directamente a partir
11. MÉTODOS PARA LA DETECCIÓN DEL ROTAVIRUS Actualmente existen diversos métodos en el mercado que pueden utilizarse para el diagnóstico de rotavirus, las cuales pueden realizarse directamente a partir
Módulo de Patología de Mama. Ronda 6ª. Tejido probado: Adenocarcinoma ductal infiltrante de mama
 SEAP Calle Ancora, 3, 2º B 284 MADRID Tfno. y Fax 91 39 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de Patología de Mama Ronda 6ª Antígeno probado: Receptores de Estrógenos
SEAP Calle Ancora, 3, 2º B 284 MADRID Tfno. y Fax 91 39 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de Patología de Mama Ronda 6ª Antígeno probado: Receptores de Estrógenos
Guía de evaluación: Cada uno de los asesores calificó la muestra con una puntación de 0-5 (valor máximo de 20 puntos).
 SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología MÓDULO DE MAMA Ronda n 19 Antígeno probado: Receptor de Progesterona Tejido
SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología MÓDULO DE MAMA Ronda n 19 Antígeno probado: Receptor de Progesterona Tejido
Albúmina 22 % I.- Introducción. II.- Características. III.- Presentación
 Albúmina 22 % I.- Introducción En 1945 Cameron y Diamond establecieron que ciertos sueros anti-d(anti-rh) podían aglutinar glóbulos rojos Rho positivos en presencia de albúmina de bovino pero no aglutinaban
Albúmina 22 % I.- Introducción En 1945 Cameron y Diamond establecieron que ciertos sueros anti-d(anti-rh) podían aglutinar glóbulos rojos Rho positivos en presencia de albúmina de bovino pero no aglutinaban
50 kits de recolección de muestras con torunda multitest Aptima (N.º de catálogo PRD-03546) Cada kit contiene:
 Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
Adenovirus (20/11 & 2/6)
 Identificación del Producto N.º de ref. Descripción 45606 Adenovirus 0,1 M (20/11 & 2/6) 45607 Adenovirus 1 M (20/11 & 2/6) 45631 Adenovirus RTU M (20/11 & 2/6) Definiciones De Los Símbolos P C A E S DIL
Identificación del Producto N.º de ref. Descripción 45606 Adenovirus 0,1 M (20/11 & 2/6) 45607 Adenovirus 1 M (20/11 & 2/6) 45631 Adenovirus RTU M (20/11 & 2/6) Definiciones De Los Símbolos P C A E S DIL
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 45608 Cadherin-17 0,1 R (SP183) 45609 Cadherin-17 1 R (SP183) 45632 Cadherin-17 RTU R (SP183) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo
Identificación del Producto N.º de ref. Descripción 45608 Cadherin-17 0,1 R (SP183) 45609 Cadherin-17 1 R (SP183) 45632 Cadherin-17 RTU R (SP183) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 44837 Vimentin 0,1 M (V9) 44838 Vimentin 1 M (V9) 44409 Vimentin RTU M (V9) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
Identificación del Producto N.º de ref. Descripción 44837 Vimentin 0,1 M (V9) 44838 Vimentin 1 M (V9) 44409 Vimentin RTU M (V9) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar concentrado
PRINACID 20 Versión: 3 Fecha: Diciembre, 2008 Código: FOS004-1
 Sección 1 Identificación del Producto y del Proveedor Nombre del producto Código del producto 119000110670 Proveedor PRINAL S.A. Teléfono 56-2-8707200 Sección 2 Composición / Ingredientes Alquildimetilbenzilamoniocloruro
Sección 1 Identificación del Producto y del Proveedor Nombre del producto Código del producto 119000110670 Proveedor PRINAL S.A. Teléfono 56-2-8707200 Sección 2 Composición / Ingredientes Alquildimetilbenzilamoniocloruro
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 46949 Langerin 0,1 M (12D6) 46950 Langerin 1 M (12D6) 46948 Langerin RTU M (12D6) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
Identificación del Producto N.º de ref. Descripción 46949 Langerin 0,1 M (12D6) 46950 Langerin 1 M (12D6) 46948 Langerin RTU M (12D6) Definiciones De Los Símbolos P C A E S DIL DOC# DIS listo para usar
El equipo de tinción elástica está compuesto por cuatro paquetes dispensadores listos para su uso, contiene:
 Artisan Elastic Stain Kit Código AR163 Uso previsto Para uso diagnóstico in vitro. El equipo de tinción elástica está previsto para su uso en laboratorio para la identificación, por microscopía óptica,
Artisan Elastic Stain Kit Código AR163 Uso previsto Para uso diagnóstico in vitro. El equipo de tinción elástica está previsto para su uso en laboratorio para la identificación, por microscopía óptica,
Módulo de PATOLOGÍA LINFOIDE. Ronda nº 7
 SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA LINFOIDE Ronda nº 7 Antígeno probado: CD4 Tejido probado:
SEAP Calle Ancora, 3, 2º B 28045 MADRID Tfno. y Fax 91 539 86 28 MAIL: SEAP@SEAP.ES Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA LINFOIDE Ronda nº 7 Antígeno probado: CD4 Tejido probado:
Módulo de PATOLOGÍA QUIRÚRGICA GENERAL. Ronda nº 6. Antígeno probado: BhCG (Gonadotrofina coriónica, subunidad beta).
 SEAP Calle Ancora,, 2º B 284 MADRID Tfno. y Fax 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº 6 Antígeno probado: BhCG (Gonadotrofina
SEAP Calle Ancora,, 2º B 284 MADRID Tfno. y Fax 86 28 Mail: seap@seap.es Programa de Garantía de Calidad en Patología Módulo de PATOLOGÍA QUIRÚRGICA GENERAL Ronda nº 6 Antígeno probado: BhCG (Gonadotrofina
Principios Y Procedimientos
 Identificación del Producto N.º de ref. Descripción 45311 IMPATH HGAL RTU M (MRQ-49) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número distribuido
Identificación del Producto N.º de ref. Descripción 45311 IMPATH HGAL RTU M (MRQ-49) Definiciones De Los Símbolos P A E S DOC# DIS listo para usar ascitis suero sobrenadante documento número distribuido
Gelatina Ácido ascórbico Carbón
 Instrucciones de uso n Epower USO PREVISTO Los microorganismos Epower son preparaciones cuantitativas liofilizadas de microorganismos destinadas al uso en laboratorios industriales para fines de control
Instrucciones de uso n Epower USO PREVISTO Los microorganismos Epower son preparaciones cuantitativas liofilizadas de microorganismos destinadas al uso en laboratorios industriales para fines de control
Reactivos suministrados El Reticulin-No Counterstain Kit está compuesto por siete cartuchos de dispensador listos para su uso, cada uno con:
 Artisan Reticulin-No Counterstain Kit Nº de catálogo AR182 Uso previsto Para uso en diagnóstico in vitro. Reticulin-No Counterstain Kit ha sido diseñado para su uso en laboratorio con objeto de identificar,
Artisan Reticulin-No Counterstain Kit Nº de catálogo AR182 Uso previsto Para uso en diagnóstico in vitro. Reticulin-No Counterstain Kit ha sido diseñado para su uso en laboratorio con objeto de identificar,
BALLERINA JABON LIQUIDO ALGAS MARINAS HOJA SEGURIDAD
 SECCIÓN 1 IDENTIFICACIÓN DE PRODUCTO Producto Fabricante Presentación BALLERINA JABON LIQUIDO ALGAS MARINAS LABACH ENVASE FLEXIBLE 1000 ML ENVASE FLEXIBLE 340 ML FRASCO 350 ML BIDON 5 L Fono emergencia
SECCIÓN 1 IDENTIFICACIÓN DE PRODUCTO Producto Fabricante Presentación BALLERINA JABON LIQUIDO ALGAS MARINAS LABACH ENVASE FLEXIBLE 1000 ML ENVASE FLEXIBLE 340 ML FRASCO 350 ML BIDON 5 L Fono emergencia
