Proteínas María de la Luz Velázquez Monroy & Miguel Ángel Ordorica Vargas
|
|
|
- María Antonia Cabrera Herrero
- hace 8 años
- Vistas:
Transcripción
1 Introducción Proteínas María de la Luz Velázquez Monroy & Miguel Ángel rdorica Vargas El nombre Proteína fue propuesto en 1838 por el químico sueco Jons Jakob Berzelius (Figura 1) para designar a las substancias complejas y ricas en itrógeno que se encuentran en las células de todas las plantas y animales. La palabra deriva del griego proteios que significa "de primera importancia", lo cual es indicativo de la importancia biológica que desde entonces se reconocía para estas substancias. Por definición, las proteínas se consideran como: Macromoléculas formadas por cadenas lineales de aminoácidos, unidos por enlaces peptídicos, sin orden aparente. Figura 1. Jons Jakob Berzelius Funciones En este caso, preferimos usar cadena, en lugar del término polímero, porque los polímeros reales están formados por unidades iguales, mientras que las proteínas pueden tener 20 o más aminoácidos diferentes. Esta definición deja mucho que desear en cuanto a la comprensión de la versatilidad de las proteínas, que se refleja en la variedad de sus funciones, como se enlista a continuación. Estructurales. Dan forma y constituyen el soporte de las estructuras de células y tejidos. Entre las más importantes de este grupo se encuentran el olágeno, que es la proteína más abundante del organismo (30% de la proteína total, 15% del peso seco), Elastina, Queratina, Tubulina, etc. Transporte y Almacenamiento. Gran cantidad de sustancias se transportan a través del organismo, y/o se almacenan, unidas a proteínas como emoglobina y Mioglobina ( 2 ), Transferrina, Ferritina y Siderofilina (Fe), Lipoproteínas (lípidos), Albúmina (ác. grasos y fármacos). atálisis. Es el grupo con más variedad; incluye todas las enzimas que se estudian en el curso, como la Anhidrasa arbónica que participa en el transporte de 2, Renina que participa en la regulación de la presión sanguínea, y Glutaminasa que participa en la regulación del p en el Riñón. Movimiento. Las principales proteínas contráctiles son Actina y Miosina del músculo y la Tubulina del citoesqueleto. Protección y Defensa. Los Anticuerpos son las proteínas más conocidas de este grupo que también incluye los Interferones, el Sistema del omplemento y la Fibrina del sistema de coagulación de la sangre. ormonas. Las hormonas peptídicas son muy abundantes e incluyen sustancias como Insulina, Glucagon, xitocina, AD (Vasopresina), Factores de recimiento y Liberación, etc. maov/mlvm/febrero de 2012
2 Identificación. Las propiedades antigénicas de las proteínas, como las de grupo sanguíneo o de histocompatibilidad, sirven para que el organismo pueda reconocer las estructuras propias, distinguirlas de las extrañas y actuar en correspondencia. Regulación. La diferenciación y el control de las funciones celulares, dependen de la regulación de la expresión de la información genética que llevan a cabo los factores nucleares de naturaleza proteica. omunicación. La generación de impulsos y la traducción de los mismos dependen de proteínas de membrana, denominadas Receptores, que transducen las señales físicas o químicas que reciben, en cambios bioquímicos dentro de las células. Podemos mencionar los receptores de hormonas, neurotransmisores, presión, tonicidad y luz, como la Rodopsina. Esta lista de categorías podría hacerse más extensa ya que todas las actividades celulares dependen en forma directa o indirecta, de la acción de una o más proteínas. lasificación Las proteínas se pueden clasificar usando varios criterios: Según la función. Las proteínas se pueden clasificar con base en la función que realizan, como en la lista anterior. En la clasificación funcional una misma proteína puede pertenecer a más de un grupo por ejemplo la Albúmina es un componente estructural de la sangre, pero también cumple funciones de transporte. Algo similar sucede con la Miosina que junto con su función de contracción, también forma parte de la estructura del músculo y además presenta actividad enzimática. omposición química. Las proteínas que están constituidas únicamente por aminoácidos, se denominan simples, como ejemplo tenemos la Albúmina y la enzima Ribonucleasa. Las proteínas que en su estructura además de aminoácidos, tienen otros grupos no proteicos, se conocen como complejas o conjugadas, como la emoglobina, los itocromos de la cadena respiratoria, y casi todas las enzimas que estudiaremos. La parte proteica de las proteínas conjugadas se conoce como apoproteína y la parte no proteica se conoce como grupo conjugado. A su vez, las proteínas conjugadas se pueden clasificar según la naturaleza del grupo conjugado como se describe en la Tabla 1. Tabla 1. lasificación de proteínas según su composición química PRTEÍA GRUP JUGAD ucleoproteínas Ácido nucleico, en cromosomas y ribosomas. Glicoproteínas o mucoproteínas arbohidratos y derivados de carbohidratos, incluyen a los anticuerpos y varias proteínas de membrana.. Lipoproteínas Lípidos Fosfoproteínas Esteres de fosfato en residuos de serina o Treonina romoproteínas: Grupos pigmentados, Flavinas, emoglobina, itocomos Flavoproteínas Dinucleótido de flavina-adenina, cono la succinato deshidrogenasa emoproteínas Grupos de porfirina-hierro (hemo), como hemoglobina, citocromos, catalasa y mioglobina. Metaloproteínas Iones metálicos, como el zinc de la anhidrasa carbónica mlvm/maov/2
3 Forma. Según su forma las proteínas pueden ser fibrosas como Queratina, olágeno y Fibrina que son largas en proporción a su diámetro, o globulares como la Albúmina, Enzimas, emoglobina, Anticuerpos y Proteínas de Membrana, que son más simétricas. Estas categorías representan los extremos de la clasificación, pueden existir proteínas que tengan partes globulares y partes fibrosas, como la Miosina. Solubilidad. Está clasificación es útil durante la purificación, porque divide a las proteínas según los solventes con los que se pueden extraer, como se describe en la Tabla 2. PRTEÍA Albúminas Globulinas Escleroproteínas Prolaminas Glutelinas istonas Protaminas Queratinas Tabla 2. lasificación de proteínas según su solubilidad SLUBILIDAD Solubles en agua y soluciones salinas diluidas; precipitan por saturación completa con sulfato de amonio, coagulan con calor. Albúmina sérica Solubles en solución salina diluida, insolubles en agua y en soluciones salinas concentradas, coagulan con calor. Anticuerpos Insolubles en soluciones acuosas neutras y en ácidos o bases diluidos. olágeno, Gelatina. También se conocen como albuminoides. Solubles en agua:etanol al 70%, pero insolubles en agua o en etanol absoluto, y solventes neutros. Proteínas vegetales, Zeina del maíz Insolubles en agua, etanol y sus mezclas; solubles en ácidos o álcalis diluidos, coagulan con calor. Proteínas vegetales, Glutelina del trigo Solubles en agua, forman soluciones alcalinas débiles, también en ácidos diluidos, coagulan con calor. Generalmente conjugadas, como nucleoproteínas (istonas del núcleo) y cromoproteínas en estado nativo Solubles en agua formando soluciones alcalinas; contienen proporciones elevadas de Arginina. Son de peso molecular pequeño; no coagulan por el calor. De los espermatozoides de peces; conjugadas con ácido nucleico en estado nativo Insolubles Tamaño. En base el tamaño de las cadenas, las proteínas se dividen en: (1) oligopéptidos, que tiene de 2 a 10 aminoácidos en la cadena; por ejemplo xitocina, Angiotensinas, Encefalinas, Vasopresina; (2) polipéptidos, con 11 a 100 aminoácidos, Glucágon e Insulina, y (3) proteínas, con mas de 100 aminoácidos. En esta clasificación, algunos autores consideran polipéptido a cualquier cadena sencilla de aminoácidos sin importar su tamaño, y proteína sólo a la molécula formada por dos o más cadenas de aminoácidos. Estructura. Las proteínas son monoméricas cuando están formadas por una sola cadena de aminoácidos como Albúmina, Mioglobina, Ribonucleasa; oligoméricas cuando tienen mas de una de cadena, como emoglobina, Lactato Deshidrogenasa, Anticuerpos y la mayoría de las enzimas de células eucarióticas; y complejos, cuando están formadas por varias cadenas que realizan distintas actividades como los complejos de la adena Respiratoria y el de la Piruvato Deshidrogenasa. Sin importar el tipo de clasificación aplicada o el grupo al que pertenece una proteína, sus propiedades y funciones se originan en la composición de aminoácidos que la constituyen, de ahí mlvm/maov/3
4 que para comprender cabalmente las proteínas, sea necesario estudiar primero los aminoácidos. Aminoácidos Los aminoácidos son moléculas que contienen un grupo amino y un ácido. Los aminoácidos de las células se dividen en dos grupos, los proteicos o proteínicos, que se encuentran en la estructura de las proteínas, y los no proteicos o no proteínicos que no lo están, pero cumplen otras funciones. En los aminoácidos proteínicos el grupo ácido es siempre un carboxilo y en todos ellos los grupos amino y carboxilo, están unidos al mismo carbono, el llamado carbono alfa ( ), por esta razón se dice que los aminoácidos proteínicos son -aminoácidos. onsiderando por separado la fuerza que como ácido y base tiene los grupos carboxilo y amino respectivamente, la estructura general de estos aminoácidos debía ser como la que se presenta en el Esquema 1.A. 2 R A 3 Esquema 1 Si fuera así, los aminoácidos de las proteínas serían líquidos, volátiles, solubles en solventes no polares y poco solubles en agua. Sin embargo, resulta que en realidad son sólidos cristalinos, con puntos de fusión elevados, solubles en agua, insolubles en solventes no polares, y producen soluciones electrolíticas. Todas estas propiedades corresponden a compuestos iónicos. En los aminoácidos proteínicos, carboxilo y amino se encuentran ionizados porque al estar próximos, actúan como ácidos y bases más fuertes que en forma individual. omo resultado de este efecto, los aminoácidos proteínicos existen como iones dobles o zwitteriones, con la fórmula general que se muestra en el Esquema 1.B. En los esquemas anteriores, la R representa la cadena lateral del aminoácido, también conocida como Resto, Residuo o Radical del aminoácido, que al ser la parte variable, confiere a cada aminoácido sus propiedades características. uando R es diferente de, las cuatro valencias del carbono están ocupadas por sustituyentes diferentes y se dice que es quiral (del griego keiros = mano) Los sustituyentes unidos a los carbonos quirales se pueden ordenar en dos formas diferentes alrededor del carbono central; el orden que tienen los sustituyentes alrededor de un carbono quiral se llama configuración. Las dos configuraciones que puede tener el carbono quiral guardan entre sí la misma relación que nuestras manos derecha e izquierda, esto es, la de un objeto y su imagen en el espejo, por eso se dice que son enantiómeros (del griego enantios = espejo). Existen dos formas de designar las configuraciones de los compuestos quirales. La más usada en Bioquímica es la configuración relativa en la cual se toma como patrón la molécula de Gliceraldehído que puede existir en las dos formas que se muestran en el Esquema 2, porque el carbono 2 es quiral. R B mlvm/maov/4
5 R R D-Gliceraldehído L-Gliceraldehído D-Aminoácido L-Aminoácido Esquema 2 Estas estructuras fueron designadas como D y L por Emil Fischer (Figura 2) basándose en su actividad óptica, como se describe más adelante en las propiedades de los aminoácidos. Todos los aminoácidos quirales de las proteínas tiene la configuración relativa L, con excepción de la Glicina que no tiene carbono quiral. La otra forma de designar la configuración de los carbonos quirales es aplicando la Regla de la Secuencia para determinar la configuración absoluta. En forma breve, la regla de la secuencia consiste en asignar un grado de importancia o precedencia de los radicales unidos al carbono quiral, aplicando una serie de criterios que podemos resumir en los puntos siguientes. 1. La importancia de los átomos aumenta con el número atómico. 2. uando los números atómicos son iguales, se usa como criterio de importancia la masa atómica, los isótopos más pesados son más importantes. 3. Sí los átomos son iguales en número y masa atómicas, se aplican los mismos criterios a los átomos unidos a ellos, el átomo con mayor precedencia es el que tiene unido átomos de más importancia. Figura 2. Emil Fischer 4. La importancia de los radicales se determina tomando en cuenta los átomos uno a la vez, comenzando con el que está unido directamente al carbono quiral y alejándose un enlace cada vez. 5. Los enlaces dobles o triples se cuentan como dos o tres enlaces sencillos a átomos del mismo tipo, y el átomo con más precedencia es el que está unido a un mayor número de átomos importantes. Una vez asignada la precedencia de los sustituyentes, se dibuja la molécula de forma que los tres más importantes queden hacia el observador y el de menor importancia hacia atrás, alejándose del observador. La configuración absoluta es R (del latín rectus = derecho), si la precedencia de los grupos disminuye en la dirección de las manecillas del reloj, y es S (del latín sinister = izquierdo), cuando disminuye en sentido contrario (Esquema 3). La configuración relativa L/D se aplica una vez a toda una estructura, sin importar que la molécula tenga más de un centro quiral, basta especificar que carbono se usa para determinar la semejanza con el Gliceraldehído. Por su parte, la configuración absoluta R/S se debe especificar para cada átomo quiral presente en la estructura de una molécula. La configuración relativa L del carbono alfa de los aminoácidos de las proteínas equivale a la configuración absoluta S, excepto en la isterna, en la que el Azufre de la cadena lateral tiene mayor importancia que los xígenos del arbono carboxílico, por lo que el carbono alfa de este aminoácido tiene configuración absoluta mlvm/maov/5
6 S. De lo anterior resulta que los aminoácidos proteínicos se pueden designar como L- aminoácidos, o 2-S-aminoácidos R-Gliceraldehído S-Gliceraldehído Esquema 3 Estructura y nomenclatura de los aminoácidos proteínicos codificables Los aminoácidos proteínicos se dividen en dos grupos, los que se incluyen en la estructura de las proteínas al momento de la síntesis que se llaman codificables, porque su posición está determinada por la información genética que codifica para la proteína en cuestión, y los no codificables, que se derivan de los codificables, mediante reacciones catalizadas por enzimas específicas, que se llevan a cabo después de la síntesis. Las estructuras, nombres aceptados y símbolos internacionales de los 20 aminoácidos proteínicos codificables se presentan, en orden alfabético en la Tabla 3; y en la Tabla de propiedades fisicoquímicas de aminoácidos, se presentan los nombres sistemáticos y algunas propiedades fisicoquímicas importantes. lasificación de los aminoácidos proteínicos codificables En la clasificación de los aminoácidos proteínicos codificables se pueden aplicar varios criterios: Estructura química de las cadenas laterales. Según este criterio los aminoácidos pueden clasificarse como: Alifáticos. Son aquellos cuyas cadenas están formadas sólo por arbono e idrógeno, unidos por enlaces sencillos: Glicina, Alanina, Valina, Leucina, Isoleucina y Prolina. Aromáticos. Los restos de estos aminoácidos tienen anillos aromáticos, tipo Benceno: Triptofano, Fenilalanina y Tirosina. idroxilados. Las cadenas laterales de estos aminoácidos tienen grupos : Serina, Treonina. Azufrados. adenas con Azufre, ya sea en forma de mercapto (-S) o tioeter (-S-): isteína y Metionina. Ácidos. Las cadenas de estos aminoácidos tienen radicales carboxilo: Aspartato y Glutamato. Amidas. Son las amidas de los aminoácidos del grupo anterior: Asparagina y Glutamina Básicos. Estos aminoácidos tienen radicales que aceptan protones: Arginina, Lisina e istidina. Existen variantes de esta forma de clasificar los aminoácidos. Algunos autores prefieren colocar a mlvm/maov/6
7 la Tirosina como aminoácido hidroxilado, en nuestra opinión las propiedades aromáticas del anillo fenólico son más importantes. tros autores añaden un grupo de cadenas con heterocíclos, formado por Triptofano, Prolina e istidina, pero las propiedades de estas cadenas son muy distintas como para considerarlas en un mismo grupo. Por último la muy extendida separación de la Prolina como un iminoácido no es correcta y obedece a una nomenclatura obsoleta, que ya no se aplica a las aminas secundarias. Tabla 3. Estructura y omenclatura de los Aminoácidos proteínicos codificables 3 ombre R Símbolo ombre R Símbolo Alanina 3 Ala A Arginina 2 Arg R R Asparagina 2 Asn Aspartato isteína S ys Fenilalanina 2 Asp D Phe F Glicina Gly G Glutamato Glutamina Glu Gln Q istidina is E Isoleucina S Ile I Leucina 3 Leu L Lisina 3 Lys K Metionina S 3 Met M Prolina Pro P Serina Ser S Tirosina 2 3 Tyr Y Treonina R 3 Thr T Triptofano Trp W Valina 3 Val V 3 mlvm/maov/7
8 omportamiento a p fisiológico. Según este criterio, los aminoácidos se dividen en: o polares. on restos que no son solubles en agua y por ello, tratan de colocarse en el interior de las proteínas, ellos son: Alanina, Valina, Leucina, Isoleucina, Prolina, Fenilalanina, Triptofano y Metionina. Polares sin carga. Sus cadenas pueden interactuar con el agua por lo que es posible encontrarlos en la superficie de las proteínas, pero también se pueden colocar en el interior si encuentran otra cadena polar para formar puentes de hidrógeno, los aminoácidos de este grupo son Serina, Treonina, Tirosina, isteína, Asparagina y Glutamina. Iónicos. adenas con radicales cargados a p fisiológico que por ello deben colocarse casi exclusivamente en la superficie de la proteína, incluyen los ácidos Aspártico y Glutámico, de carga negativa, y las bases Lisina, Arginina e istidina, con carga positiva. En esta clasificación también se acostumbra separar los aminoácidos iónicos en atiónicos (Lys, is y Arg) y Aniónicos (Glu y Asp). En esta clasificación la Glicina no se puede asignar a un grupo especial ya que su comportamiento depende de los aminoácidos que la rodean. Síntesis biológica. Este criterio toma en cuenta la necesidad de cada aminoácido que tiene el organismo Existe un grupo de aminoácidos cuya ausencia en la dieta provoca que el balance de nitrógeno se vuelva negativo, porque no se pueden sintetizar las proteínas y por lo tanto, se elimina más nitrógeno del que se ingiere. La razón de esta condición es que dichos aminoácidos no se pueden sintetizar en el organismo y por ello se denominan esenciales, en el hombre son ocho: Valina, Leucina, Isoleucina y Treonina que son aminoácidos alifáticos ramificados; Triptofano y Fenilalanina, aromáticos; Lisina de cadena larga, y Metionina que tiene un átomo de azufre a mitad de la cadena. tros aminoácidos aunque no son esenciales según el criterio antes mencionado, representan casos especiales. La falta de istidina no provoca que el balance de nitrógeno se vuelva negativo en el corto plazo, sin embargo se requiere en la dieta de los individuos en desarrollo, probablemente porque la velocidad de su síntesis no basta para llenar las necesidades durante el crecimiento. Por otro lado, la síntesis de isteína y Tirosina, depende de que la dieta contenga una cantidad suficiente de los aminoácidos esenciales Metionina y Fenilalanina respectivamente, por eso cuando faltan estos, los primeros no se pueden sintetizar y es necesario ingerirlos en la dieta. Por último, la Tirosina es esencial para quienes padecen de Fenilcetonuria. Destino metabólico. Tomando en cuenta las vías de degradación que siguen sus esqueletos de carbono, los aminoácidos se dividen en: Glucogénicos puros. Siguen un metabolismo de tipo glúcido o pueden servir como precursores de Glucosa, son la mayoría Glicina, Valina, Prolina, Metionina, Serina, Treonina, isteína, Asparagina, Glutamina, Arginina, istidina, Aspartato y Glutamato. mlvm/maov/8
9 etogénicos puros. El metabolismo es de tipo lipídico o no pueden producir glucosa, como Leucina y Lisina. Mixtos. Una parte de la molécula sigue un tipo de metabolismo y el resto el otro, como sucede con Isoleucina, Triptofano, Fenilalanina y Tirosina. Las diversas formas de clasificación se resumen en la Tabla 4, marcando con X las categorías a que pertenece cada aminoácido. Tabla 4. Esquemas de clasificación de los aminoácidos proteínicos codificables A D E F G I K L M P Q R S T V W Y Aminoácido Ala ys Asp Glu Phe Gly is Ile Lys Leu Met Asn Pro Gln Arg Ser Thr Val Trp Tyr lasificación según su estructura química Alifáticos Aromáticos eterocíclicos Azufrados Acidos Amidas Básicos idroxilados lasificación según su comportamiento a p = 7 o Polares Polares sin arga Aniónicos atiónicos lasificación según su requerimiento Esenciales o esenciales lasificación según su destino metabólico Glucogénicos etogénicos ( ) Pueden ser indispensables para los individuos en desarrollo o durante el embarazo. ( ) La síntesis de isteína y Tirosina dependen de la presencia de Metionina y Fenilalanina respectivamente, por lo tanto en ausencia de estos, aquellos se vuelven indispensables. En los fenilcetonúricos la Tirosina es esencial. Aminoácidos proteínicos no codificables omo son derivados de los proteínicos, los aminoácidos proteínicos no codificables son todos L- -aminoácidos. La mayoría de ellos son específicos de las proteínas en que se encuentran y normalmente sólo se forman en pequeñas cantidades. El aminoácido no codificable más abundante es la 4-idroxiprolina que se encuentra exclusivamente en el olágeno; se forma después de la síntesis por acción de la enzima Prolina idroxilasa que requiere ácido ascórbico (vitamina ) para efectuar la reacción. La deficiencia de vitamina provoca la enfermedad llamada Escorbuto, que se caracteriza por la fragilidad de los tejidos, provocada por la inestabilidad de las molé- mlvm/maov/9
10 culas de colágeno debido a la falta de idroxiprolina. tros aminoácidos que también se encuentran en el colágeno, pero en menor proporción que la idroxiprolina, son la 5-idroxilisina y la Alisina, derivados de Lisina. De los aminoácidos proteínicos no codificables la istína es el que está más ampliamente distribuido en las proteínas. Se forma por la condensación de dos moléculas de isteína a través de los grupos tiol. La oxidación de los grupos tiol forma la estructura conocida como el Puente Disulfuro. Los puentes disulfuro participan en forma importante en la estabilización de la estructura tridimensional de las proteínas, cuando se forman entre dos regiones de una misma proteína, y en la asociación cuando se forman entre dos cadenas distintas. En general, las proteínas son más estables cuando tienen más puentes disulfuro, las proteínas de las bacterias termófilas, que viven en los manantiales de aguas termales tiene muchos puentes disulfuro. En la Tiroglobulina de la glándula tiroides se encuentra el aminoácido Tiroxina (3,5,3,5 - Tetrayodotironina) derivada de Tirosina. Este aminoácido se forma cuando la tiroides capta el Yodo, y se libera por hidrólisis de la proteína. En el organismo actúa como una de las hormonas de la glándula tiroides, responsables del mantenimiento del metabolismo basal de las células. Las estructuras y algunas propiedades de estos aminoácidos, se presentan en la Tabla 5. Tabla 5. Restos de aminoácidos proteínicos no codificables pka ombre y Símbolo R PM 1 pka 2 pka 3 2 R 4-idroxiprolina. yp 5- idroxilisina Alisina 3 istina S S I I Tiroxina T I I L- -Aminoácidos no proteínicos Los aminoácidos no proteínicos pueden ser L- -aminoácidos o no, porque no se encuentran en las proteínas, sino cumpliendo diversas funciones. mlvm/maov/10
11 Tres L- -aminoácidos no proteínicos son necesarios para la conversión del amoniaco en urea, rnitina, itrulina, y Arginosuccinato, son intermediarios de la vía metabólica conocida como iclo de la Urea. Además, la rnitina también es precursor de las poliaminas, compuestos que participan en la regulación del ciclo celular. tro aminoácido de este tipo que también es intermediario metabólico es la omocisteína, que se forma cuando se usa la Metionina como donador de grupos metilo. En el metabolismo de la isteína se forma el isteinilsulfinato, un aminoácido con un grupo sulfónico en su cadena lateral. La omoserina es intermediario del metabolismo de Treonina, Aspartato y Metionina. La Penicilamina forma parte de la estructura de la Penicilina. tro aminoácido importante es la L-3,4-Dihidroxifenilalanina o L-DPA, que es precursor de las catecolaminas neurotransmisoras Dopamina, orepinefrina y Epinefrina, y también del pigmento cutáneo Melanina. Un último aminoácido de tipo L- que no es proteínico es la hormona 3,5,3 - Triyodotironina o T 3. Esta es la forma más activa de las hormonas tiroideas, se forma en los tejidos por eliminación del átomo de yodo en 5 de la Tiroxina liberada por la glándula tiroides. En la Tabla 6 se presentan las estructuras de estos aminoácidos. S omocisteína S 3 3 Penicilamina Tabla 6. Restos de algunos L- -aminoácidos no proteínicos R 2 Arginosuccinato Aminoácidos no proteínicos de otro tipo omoserina L-3,4-Dihidroxifenilalanina (L-DPA) I I I 3,5,3 -Triyodotironina (T 3 ) S isteínsulfinato 3 rnitina 2 itrulina Este es el grupo más numeroso de aminoácidos, en él se encuentran muchos aminoácidos con funciones importantes, en la Figura 3, se presentan las estructuras de algunos de estos aminoácidos. La Taurina es un -aminoácido con ácido sulfónico, se forma por descarboxilación y oxidación de la isteína. La taurina se conjuga con los ácidos biliares para formar las sales biliares que sir- mlvm/maov/11
12 ven para la emulsificación las grasas durante la digestión. tro aminoácido que se obtiene por descarboxilación es la -Alanina derivada del ácido aspártico. Es componente de la vitamina Pantotenato que se encuentra en la oenzima A, cofactor necesario en el metabolismo de Glúcidos, Lípidos y aminoácidos. 3 3 S Taurina -Aminobutirato (GABA) Alanina arnitina Aminoisobutirato reatina Figura 3. Aminoácidos no proteínicos, que no son -amino. El Ácido -Aminobutírico o GABA, es un neurotransmisor inhibidor, derivado por descarboxilación del Ácido Glutámico. La deficiencia de GABA se asocia con los problemas epilépticos de tipo convulsivo. El aminoácido reatina sirve como almacén de energía en músculo. En reposo, aceptar un fosfato del ATP y se transforma en Fosfocreatina, que es un compuesto de alta energía de hidrólisis. uando el músculo entra en actividad, la fosfocreatina, dona el fosfato para regenerar el ATP. Por último, la arnitina es un aminoácido que sirve para transportar los ácidos grasos, a través de la membrana mitocondrial interna, a la matriz mitocondrial para su oxidación. Propiedades de los aminoácidos omo se mencionó antes, los aminoácidos proteínicos son compuestos quirales, que pueden existir en dos configuraciones diferentes, las propiedades físicas de ambas configuraciones son prácticamente idénticas, con excepción de la forma de sus cristales y la actividad óptica. La actividad óptica es la capacidad que tienen las soluciones de substancias quirales, de desviar el plano de vibración de la luz polarizada, cuando esta pasa a través de ellas. La luz polarizada es la luz cuyas ondas vibran todas en planos paralelos. La desviación se mide en grados usando un polarímetro (Figura 4) y la dirección se representa con un signo. Las substancias que desvían el plano en el sentido de las manecillas del reloj se dice que son dextrógiras (del latín dexter = derecha) y a su rotación se le da signo positivo; las que lo desvían en sentido contrario, son levógiras (del latín laevus = izquierda) y su rotación tiene signo negativo. Las substancias con la misma fórmula desarrollada pero diferente actividad óptica se llaman isómeros ópticos. Los enantiómeros son isómeros ópticos cuya actividad tiene el mismo valor absoluto pero signo contrario. La designación D y L que se da a los enantiómeros del gliceraldehido mlvm/maov/12
13 usados como patrón para asignar la configuración relativa, originalmente se baso en su actividad óptica, el isómero D es dextrógiro y el L es levógiro (ver Esquema 3). Esta equivalencia se abandonó porque la relación entre la configuración y la actividad óptica no es simple; existen compuestos que se clasifican como D y son levógiros y otros dextrógiros que son semejantes al L- gliceralehído. Por ello además de describir la configuración del compuesto, también se debe incluir en el nombre, el signo de la actividad óptica. Figura 4. Medición de la actividad óptica En Farmacología, es común el empleo de la simbología antigua para representar la rotación óptica, la cual consiste en usar las letras minúsculas cursivas d y l, para indicar la actividad óptica de los isómeros dextrógiros y levógiros respectivamente. También es costumbre usar los prefijos levo- o dextro- en los nombres de los fármacos, cuando se sabe cual de los enantiómeros es el que se administra por ejemplo, la Levodopa. Todos los aminoácidos proteínicos quirales son L- -aminoácidos, pero a pesar de que todos tienen la misma configuración, algunos son levógiros y otros dextrógiros, como puede verse en la tabla de propiedades fisicoquímicas de los aminoácidos. En la Treonina y la Isoleucina además del carbono también el carbono es quiral, de modo que existen isómeros -R y -S de estos aminoácidos, de los cuales sólo uno se encuentra en las proteínas. Para la Isoleucina es el 3S, y para la Treonina es el 3R Propiedades ácido - básicas Ya sabemos que todos los aminoácidos proteínicos tienen en su molécula un radical -carboxilo y otro -amino, y por ello son anfóteros. Estos radicales son ácidos y bases débiles y su ionización cambia con el p del medio, como se muestra en el Esquema 4 para la Valina Esquema 4 La fuerza de los grupos está determinada por el pka de los radicales, que es característico de cada aminoácido, como puede verse en la tabla de propiedades fisicoquímicas de los aminoácidos. Al variar la ionización de los radicales con el p, la carga total de los aminoácidos también cambia. mlvm/maov/13
14 Para todos los aminoácidos existen formas catiónicas, con carga neta positiva; aniónicas, con carga neta negativa, y una forma isoeléctrica, en la cual la cantidad de carga positiva es igual a la negativa, y la carga neta es cero. El p al cual predomina la forma isoeléctrica de un aminoácido se conoce como p isoeléctrico o Punto Isoeléctrico (pi) del aminoácido. El pi se puede calcular como el promedio de los dos pka que limitan la forma isoeléctrica. Tomando como ejemplo la Valina, que sólo tiene dos grupos ionizables, y con los valores de la tabla de propiedades fisicoquímicas de los aminoácidos, tenemos que: pi pka 1 pka donde el pka 1 corresponde al grupo -carboxilo y el pka 2 al -amino, esta forma de nomenclatura es la usada en Bioquímica. La situación es un poco más compleja cuando la cadena lateral tiene un grupo ionizable como los casos del ácido Aspártico y la Lisina que se presentan en los Esquemas 5 y 6 respectivamente Esquema En el caso del aspartato, la forma isoeléctrica está determinada por la ionización de los dos grupos carboxilo y el punto isoeléctrico se calcularía como: pi pka 1 pka mientras que, para la lisina las formas de ionización son: Esquema Ahora la forma isoeléctrica se encuentra limitada por la ionización de los dos grupos amino y su valor se calcula como: pi pka pka mlvm/maov/14
15 En los dos casos anteriores, y para todos los aminoácidos, el pka 3, corresponde al radical ácido o básico de la cadena lateral, en estos casos, el -carboxilo del aspartato y el -amino de lisina. A partir de los tres casos presentados, es posible elaborar algunas generalizaciones útiles: 1. A p bajo los aminoácidos presentan carga positiva mientras que a p alto tiene carga negativa. 2. Los aminoácidos con grupos ácidos en su cadena lateral adquieren su forma isoeléctrica del lado ácido, y su pi se calcula usando los dos pka menores. 3. La forma isoeléctrica de los aminoácidos básicos está del lado alcalino y su pi se calculan con los dos pka mayores. 4. En solución, los aminoácidos no pueden existir sin tener al menos un radical disociado. 5. Para los aminoácidos no polares, o polares sin carga, la forma isoeléctrica es la misma que la del ión dipolar y es neutra. 6. En los aminoácidos básicos la forma de ión dipolar es positiva y para los aminoácidos ácidos es neutra o negativa. tras propiedades físicas importantes de los aminoácidos como el tamaño y la solubilidad se enlistan en la tabla de propiedades fisicoquímicas que ya debes tener. Propiedades Químicas de los Aminoácidos La forma más sencilla de sistematizar el estudio de las propiedades químicas de los aminoácidos es analizando cada radical por separado, -carboxilo, -amino y cadena lateral. 1. Propiedades del carboxilo. Este grupo puede esterificarse, clorarse, reducirse o participar en cualquiera de las reacciones químicas comunes del grupo carboxilo, pero dos son las reacciones de importancia en la Bioquímica de proteínas. 1.1.Formación del enlace peptídico. Un enlace peptídico se forma cuando el grupo -carboxilo de un aminoácido reacciona con el grupo -amino de otro (Esquema 7). R1 3 R2 3 Esquema 7 R1 3 R2 Desde el punto de vista químico, el enlace peptídico es un enlace amida, con varias características importantes. El xígeno tiene electronegatividad alta y atrae el par de electrones del doble enlace, provocando un desbalance de cargas que es revertido por el itrógeno, que también es muy electronegativo. omo resultado de estos corrimientos de electrones, el enlace peptídico presenta las dos formas de resonancia que se muestran en 60% 40% Esquema 8 mlvm/maov/15
16 el Esquema 8. Proteínas Los tres átomos involucrados en la resonancia, carboxílico, carbonílico y amínico, tienen hibridación sp 2 y el enlace es parcialmente doble, como se puede ver por la geometría del enlace descrita en la Figura 5.A. (A) (B) Figura 5. (A) Ángulos y distancias del enlace peptídico en grados y Ángstrom (Å). (B) Definición de los ángulos de rotación El carácter doble del enlace hace que sea plano y rígido, los seis átomos que se presentan en el esquema 8, están en un sólo plano y únicamente hay rotación en los enlaces (ángulo psi, ) y (ángulo fi, ); el enlace (ángulo omega, ) generalmente tiene conformación anti, como se describe en la Figura 5.B. Esta propiedad tiene implicaciones importantes para la estructura de las proteínas. omo se estudia más adelante, los valores de rotación de estos ángulos definen la forma en que se pliegan las cadenas de aminoácidos de las proteínas. La misma deslocalización de electrones, crea cargas parciales negativa ( -) en el xígeno y positiva ( ) en el itrógeno, lo cual aunado a su electronegatividad, favorece la participación de ambos átomos en la formación de puentes de idrógeno, que también son importantes en la estructura de las proteínas. La molécula que resulta de la formación del enlace peptídico, se llama péptido y tiene dos extremos diferentes; en un lado se encuentra el grupo -amino que no reaccionó, este es el llamado extremo amino terminal; del otro lado está el extremo carboxilo terminal donde se encuentra el grupo -carboxilo sin reaccionar. Por convención, la estructura de los péptidos se escribe de izquierda a derecha comenzando en el extremo amino terminal, ya sea que se usen fórmulas o símbolos. 1.2.Descarboxilación. Esta reacción consiste en la pérdida del carboxilo- de los aminoácidos (Esquema 9). Es catalizada por las enzimas Aminoácido Descarboxilasas que dependen de la coenzima Fosfato de Piridoxal. R 3 - R 3 2 Aminoácido Amina Biógena Esquema 9 Los productos de descarboxilación de los aminoácidos son llamados Aminas Biógenas, compuestos que poseen actividades biológicas importantes. La descarboxilación del ácido glutámico pro- mlvm/maov/16
17 duce el neurotransmisor inhibidor GABA. Del ácido aspártico se forma la -alanina que se encuentra en la estructura de la oenzima A. La descarboxilación de L-DPA produce Dopamina, neurotransmisor y a la vez precursor de las catecolaminas orepinefrina y Epinefrina, que tienen funciones como hormonas y neurotransmisores. El autacoide istamina se produce por descarboxilación de la istidina. En la síntesis de Serotonina a partir de Triptofano, también hay una reacción de descarboxilación. Algunas de estas aminas biógenas se muestran en la Figura 3, el resto de las mencionadas se encuentran en la Figura Dopamina orepinefrina Epinefrina istamina Serotonina Figura 6. Algunas Aminas Biógenas derivadas por descarboxilación de aminoácidos. 2. Propiedades del amino. Además de la formación del enlace peptídico, el grupo -amino de los aminoácidos participa en cuatro reacciones de interés en Bioquímica. 2.1.Formación de bases de Schiff (Esquema 10). Desde el punto de vista metabólico, esta es la reacción más importante del grupo -amino. Las bases de Schiff son iminas que se forman cuando los aldehídos reaccionan con aminas. En la Bioquímica de los aminoácidos, el aldehído más importante es el Piridoxal, que en forma de fosfato de Piridoxal (PLP) es coenzima de muchas enzimas del metabolismo de aminoácidos. Las bases de Schiff formadas entre los aminoácidos y el PLP, son intermediarios en muchas reacciones como Transmaminación, Racemización, Deshidratación, y Descarboxilación. R 3 Aminoácido 3 Piridoxal Esquema 10 R Base de Schiff 2.2.Reacción de Sanger (Esquema 11). Esta es una reacción importante desde el punto de vista histórico ya que fue utilizada por Frederick Sanger para determinar, por primera vez en la historia, la secuencia de aminoácidos de una proteína, la Insulina bovina. Por este trabajo, recibió el premio obel de Química en mlvm/maov/17
18 La reacción consiste en combinar los aminoácidos con el 2,4 - dinitrofluorobenceno o reactivo de Sanger; los dinitrofenil derivados de aminoácidos son compuestos de intenso color amarillo, fáciles de detectar e identificar. R 3 2 F 2 R 2 Aminoácido 2,4-dinitrofluorobenceno Esquema 11 2 Dinitrofenilaminoácido 2.3. Reacción de Edman (Esquema 12). En esta reacción se condensa el grupo amino con el Fenilisotiocianato o Reactivo de Edman, formando un feniltiocarbamil - aminoácido, que ciclisa en medio ácido y forma una fenilhidantoína distinta para cada aminoácido. R 1 S R 1 R S 1 R 2 R 2 R 2 S Fenilisotiocianato Péptido(n) Peptidil-feniltiocambanida Aminoácil- Feniltioidantoína Péptido(n-1) Esquema 12 uando el aminoácido forma parte de una cadena peptídica, la ciclisación provoca el rompimiento del enlace peptídico, con lo que se libera un nuevo grupo amino. Repitiendo la reacción varias veces seguidas, es posible degradar péptidos, aminoácido por aminoácido a partir del extremo aminoterminal, y determinar así su secuencia Reacción de la inhidrina. La inhidrina (idrato de Tricetohidrindeno) es el reactivo más empleado en la detección y cuantificación de aminoácidos. Durante la reacción, se consumen dos equivalentes de inhidrina por cada aminoácido. En el primer paso de la reacción (Esquema 13) el aminoácido se oxida, descarboxilándose y liberando amoniaco, mientras que uno de los equivalentes de inhidrina se reduce a idrindantina. R - Aminoácido 3 2 R inhidrina idrindantina Esquema 13 En el segundo paso (Esquema 14) la idrindantina formada y otro equivalente de inhidrina, reaccionan con el amoniaco formando un complejo de color púrpura (Púrpura de Ruhemann). La mlvm/maov/18
19 Prolina produce un compuesto color amarillo. 3 inhidrina idrindantina Esquema 14 Púrpura de Ruhemann 3. Propiedades del Grupo R. Los grupos funcionales de la cadena lateral, mantienen sus propiedades químicas normales y por lo tanto se pueden usar para identificar aminoácidos específicos. Aunque los analizadores automáticos han reducido la aplicación de estas pruebas, varias de ellas aún se utilizan en casos específicos, las más importantes se presentan a continuación Xantoprotéica. Algunos aminoácidos como Fenilalanina, Tirosina y Triptofano, tienen anillo aromáticos derivados de benceno y por ello tiene las propiedades químicas del benceno y sus derivados. Una de estas propiedades es la reacción de nitración del anillo bencénico con ácido ítrico concentrado. Los anillos Benceno de Tirosina y Triptofano están activados y reaccionan fácilmente, mientras que el benceno de la Fenilalanina no tiene sustituyentes que lo activan y reacciona con más dificultad El nombre de la reacción se deriva del griego xantos, que significa amarillo, que es el color característico de la reacción positiva. El color amarillo se intensifica en medio alcalino. Esta reacción es la que provoca el color amarillo cuando se salpica la piel con ácido ítrico concentrado, las proteínas de la piel tienen Tirosina y Triptófano, los cuales al nitrarse, le dan a la piel un color amarillo característico Millon. Es específica para el grupo fenólico por lo tanto, la dan positiva todas las sustancias que poseen esta función, como la Tirosina y todas las proteínas que contengan Tirosina. El primer paso de la reacción de Millon consiste en la nitración del anillo fenólico de la Tirosina, por el ácido ítrico del reactivo. La Tirosina nitrada forma complejos con los iones Mercurioso g(i) y Mercúrico g(ii) del reactivo produciendo un precipitado rojo o una solución roja, ambos resultados positivos. mlvm/maov/19
20 Proteínas g 3 g( 3 ) Algunas proteínas pueden formar el precipitado rojo desde el inicio, mientras que otras primero forman un precipitado blanco, que se debe calentar para dar el color rojo indicativo de la presencia de Tirosina. ualquier sustancia con un grupo fenólico dará positiva la reacción de Millon y puede interferir con la detección de Tirosina opkins ole. Es específica del grupo indol característico del Triptófano. El anillo del indol se hace reaccionar con ácido Glioxálico en presencia de ácido Sulfúrico concentrado para formar un compuesto violeta que se forma en la interfase entre la solución de proteína y el ácido sulfúrico. La estructura exacta del compuesto violeta no se conoce, pero parece estar relacionado con el producto de condensación del aldehído del ácido Glioxálico con los nitrógenos de dos anillos indólicos, como se muestra en la reacción, ya que también se pueden formar complejos con otros aldehídos. 3 2 S La reacción de opkins ole es positiva sólo para las proteínas que contienen Triptófano. Se supone que el ácido concentrado hidroliza las proteínas en la interfase liberando el Triptófano para dar el producto violeta. Sin embargo, el Triptófano puro en solución no da positiva la reacción, a menos que se agreguen agentes oxidantes, por lo que es de suponer que el Triptófano de las proteínas no se libera como tal, por lo cual la reacción presentada es sólo parcialmente correcta Aminoácidos Azufrados. Esta reacción detecta la isterna y proteínas que la contengan. En medio fuertemente alcalino el radical mercapto de la isterna se desprenden como ácido sulfhídrico que se pone en evidencia añadiendo sales de plomo para que se forme de un precipitado negro de sulfuro de plomo. mlvm/maov/20
21 S 3 a 2 S 3 (3)2Pb 2 S 2 3 PbS El ácido sulfhídrico se puede reconocer por su olor desagradable característico. En la Tabla 7, se enlistan otras de las reacciones empleadas en identificación de aminoácidos específicos. Tabla 7. Reacciones de las cadenas laterales de aminoácidos ombre Reactivos Aminoácido(s) olor Ehrlich p-dimetilaminobenzaldehido en l concentrado Trp Azul Sakaguchi -aftol en hipoclorito de sodio Arg Rojo itroprusido itrato de sodio en 3 diluido ys Rojo Sullivan Sodio-1,2-naftoquinona-4-sulfonato e hidrosulfito de sodio ys Rojo Pauli Ácido sulfanilico diazotizado en solución alcalina is, Tyr Rojo Folin ioclateu Ácido fosfomolibdotúngstico Tyr Azul ligopéptidos Los oligopéptidos son cadenas de aminoácidos con 10 o menos residuos (algunos autores consideran hasta 25). A pesar del tamaño pequeño, son importantes porque existe muchos oligopéptidos naturales que tienen funciones biológicas importantes. Para formar el nombre químico de un oligopéptido, se empieza en el extremo amino terminal, que por convención se escribe y dibuja del lado izquierdo. La terminación del nombre de los aminoácidos que forman la cadena se cambia por -il, porque cada aminoácido se considera radical sustituyente del grupo amino del aminoácido que le sigue a la derecha, el nombre del aminoácido del extremo derecho no se cambia. Por ejemplo, el péptido de la Figura 7 tendría como nombre químico: Tirosil-glicil-glicil-fenilalanil-leucina Figura 7. Estructura de la Leucina-encefalina ombres como estos se vuelven imposibles de usar, por ello para los oligopéptidos, es costumbre emplear nombres comunes, el del péptido de la Figura 7 es Leucina-encefalina. En la Tabla 8 se presentan nombre, secuencia y actividades de algunos oligopéptidos de interés médico. mlvm/maov/21
22 Tabla 8. Algunos oligopéptidos de interés ombre Secuencia aracterísticas Glutation (G-S) -Glu-ys-Gly Mantiene la integridad estructural de las proteínas Met- y Leu- Encefalinas Tyr-Gly-Gly-Phe-Met Tyr-Gly-Gly-Phe-Leu eurotransmisores con acción analgésica de tipo morfina, inhiben el dolor. Angiotensina I Asp-Arg-Val-Tyr-Ile-is-Pro-Phe-is-Leu Sustancia presora producida por acción de la enzima Renina sobre el precursor plasmático Angiotensinógeno, en respuesta a la baja de presión en la arteria eferente del riñón. Precursor de la Angiotensina II Angiotensina II Asp-Arg-Val-Tyr-Ile-is-Pro-Phe Sustancia con alta potencia presora. Producida a partir de la Angiotensina I por acción de la Enzima onvertidora de Angiotensina (EA) Bradicinina Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg Péptido vasodilatador producido por hidrólisis de proteínas específicas del plasma con la enzima Tripsina. alidina Lys-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg Péptido vasodilatador producido por hidrólisis de proteínas específicas del plasma (alidinógeno) Vasopresina ys-tyr-phe-gln-asn-ys-pro-arg-gly( 2 ) S S xitocina ys-tyr-ile-gln-asn-ys-pro-leu-gly( 2 ) S S ormona antidiurética (AD) secretada por la neurohipófisis. Provoca la retención renal de agua y es ligeramente vasopresora. ormona que provoca la contracción del músculo liso del útero durante el parto y en la glándula mamaria durante la lactancia. Secretada por la neurohipófisis Substancia P Arg-Pro-Lys-Pro-Gln-Phe-Phe-Gly-Leu-Met( 2 ) eurotransmisor involucrado en las vías de dolor Gramicidina S (-L-Val-L-rn-L-Leu-D-Phe-L-Pro-) 2 Antibiótico con estructura cíclica aislado de la bacteria Bacillus brevis Tirocidina L-Val-L-rn-L-Leu-D-Phe-L-Pro Antibiótico aislado de la bacteria Bacillus brevis L-Tyr-L-Gln-L-Asn-D-Phe-L-Phe Valinomicina (-L-Lactato-L-Val-D--Val-D-Val-) 3 Antibiótico de estructura cíclica con actividad ionofórica para Potasio. Algunas de estas moléculas merecen atención especial. Las Encefalinas tienen actividad semejante a la Morfina y se cree que son los agentes analgésicos endógenos, bloqueando la transmisión de los impulsos nerviosos provenientes de los receptores de dolor. La xitocina y la Vasopresina son hormonas producidas por la glándula pituitaria. La xitocina estimula la contracción del músculo liso del útero durante el trabajo de parto, y de los músculos de la glándula mamaria durante la lactancia. La Vasopresina u ormona Antidiurética (AD) estimula la retención de agua en el riñón e incrementa la presión sanguínea para facilitar el flujo sanguíneo en el riñón. Aunque la secuencia de ambas hormonas es casi idéntica, su estructura secundaria es muy diferente y esto explica la diferencia en actividad. En la xcitocina el resto de Tyr 2 forma un puente de idrógeno con Asn 4, y la hormona adquiere una forma tridimensional compacta. En cambio, la Vasopresina tiene una forma alargada porque mlvm/maov/22
23 la Phe 3, impide la formación del puente de idrógeno entre Tirosina y Asparagina. El Glutatión cumple una función vital al evitar la oxidación permanente de la emoglobina y otras proteínas celulares. El grupo tiol (-S) del Glutatión provee el poder reductor para mantener las proteínas en el estado de oxidación correcto. Dos moléculas de G-S forman un dímero unido por un puente disulfuro (Esquema 16) y liberan equivalentes reductores en forma de idrógenos. En las células humanas la relación entre el Glutatión reducido y el oxidado es de 500:1, gracias a la acción de la enzima Gluatión peroxidasa (Esquema 15). G-S G-S 1/2 2 G-S-S-G 2 Glutatión Glutatión reducido oxidado Esquema 15 El Glutatión también participa en la prevención del efecto oxidante de fármacos y sustancias químicas contaminantes. La exposición prolongada a sobredosis de agentes oxidantes provoca una disminución en la concentración de Glutatión reducido y puede constituir un peligro porque muchas proteínas pueden oxidarse en forma irreversible y perder su actividad. Propiedades Químicas de ligopéptidos Además de las propiedades químicas de los aminoácidos que los forman, la reacción del Biuret permite detectar los oligopéptidos de tres y más aminoácidos. La prueba consiste en la formación de un complejo entre al menos dos enlaces peptídicos consecutivos con un ión cúprico u(ii) en medio alcalino. El complejo es de color violeta y la intensidad depende del número de enlaces presentes. R R u 2 a u 2 R El obre(ii) se añade en forma de Sulfato de obre. Dado que las soluciones de Sulfato de obre tiene color azul, la cantidad de reactivo añadida debe ser controlada para evitar positivos falsos. El nombre se proviene del compuesto Biurea ( ) el cual da positiva la prueba. Mediante esta reacción es posible seguir el proceso de hidrólisis proteica, la reacción será negativa cuando la hidrólisis sea completa. Estructura de Proteínas omo resultado de la formación de los enlaces peptídicos las cadenas de aminoácidos están formadas por dos secciones distintas una constante llamada esqueleto, que está formada por los ar- mlvm/maov/23
 Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de
 Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas.
 Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
QUÍMICA DE ALIMENTOS I Tarea 10: Las Proteínas en los alimentos. Agua (o humedad, si se conoce)*
 QUÍMICA DE ALIMENTOS I Tarea 10: Las Proteínas en los alimentos. Entregar el 21 de Mayo. Selecciona un alimento, de preferencia de los que consumes con regularidad, que contenga proteínas. 1. De acuerdo
QUÍMICA DE ALIMENTOS I Tarea 10: Las Proteínas en los alimentos. Entregar el 21 de Mayo. Selecciona un alimento, de preferencia de los que consumes con regularidad, que contenga proteínas. 1. De acuerdo
Biomoléculas. Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos
 Biomoléculas Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos Aminoácidos, péptidos y proteínas Las proteínas cumplen importantes funciones biológicas:
Biomoléculas Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos Aminoácidos, péptidos y proteínas Las proteínas cumplen importantes funciones biológicas:
Proteínas. Características generales
 Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas.
 Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
Estructura y propiedades de las proteínas
 Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
PROTEÍNAS. Las proteínas están constituidas por la unión de numerosas moléculas sencillas (monómeros) denominados aminoácidos.
 PROTEÍNAS 1. INTRODUCCIÓN Las proteínas son los constituyentes químicos fundamentales de la materia viva. Constituyen alrededor del 50% en peso seco del cuerpo. Los glúcidos y lípidos se encuentran en
PROTEÍNAS 1. INTRODUCCIÓN Las proteínas son los constituyentes químicos fundamentales de la materia viva. Constituyen alrededor del 50% en peso seco del cuerpo. Los glúcidos y lípidos se encuentran en
ácidos orgánicos con un grupo amino en posición alfa
 AMINOÁIDOS ASPETOS GENERALES Desde el punto de vista químico, los aminoácidos (AA) son ácidos orgánicos con un grupo amino en posición alfa. Según esta definición, los cuatro sustituyentes del carbono
AMINOÁIDOS ASPETOS GENERALES Desde el punto de vista químico, los aminoácidos (AA) son ácidos orgánicos con un grupo amino en posición alfa. Según esta definición, los cuatro sustituyentes del carbono
Isomería estructural o constitucional
 TEMA 7.- Estereoisomería. Isomería: constitucional y estereoisomería. Isomería óptica. Quiralidad y enantiomería. Configuraciones absoluta y relativa. Moléculas con dos o más estereocentros: diastereoisomería
TEMA 7.- Estereoisomería. Isomería: constitucional y estereoisomería. Isomería óptica. Quiralidad y enantiomería. Configuraciones absoluta y relativa. Moléculas con dos o más estereocentros: diastereoisomería
TEMA 5. LAS PROTEÍNAS.
 TEMA 5. LAS PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES. Son macromoléculas formadas por C, H, O y N. (en algunas ocasiones S). Son importantes porque son las biomoléculas más abundantes en peso seco (50%)
TEMA 5. LAS PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES. Son macromoléculas formadas por C, H, O y N. (en algunas ocasiones S). Son importantes porque son las biomoléculas más abundantes en peso seco (50%)
METABOLISMO DEL NITRÓGENO
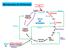 METABLISM DEL NITRÓGEN Descomposición por microorganismos Compuesto rgánicos Nitrogenados ANIMALES Desechos orgánicos Amonificación CICL DEL NITRÓGEN N 3 Nitrificación Nitrosomonas Nitrosación N 2 Nitratación
METABLISM DEL NITRÓGEN Descomposición por microorganismos Compuesto rgánicos Nitrogenados ANIMALES Desechos orgánicos Amonificación CICL DEL NITRÓGEN N 3 Nitrificación Nitrosomonas Nitrosación N 2 Nitratación
Presentación organizada por José Antonio Pascual Trillo
 Presentación organizada por José Antonio Pascual Trillo La fotosíntesis es un proceso que se desarrolla en dos etapas: Reacciones lumínicas: es un proceso dependiente de la luz (etapa clara), requiere
Presentación organizada por José Antonio Pascual Trillo La fotosíntesis es un proceso que se desarrolla en dos etapas: Reacciones lumínicas: es un proceso dependiente de la luz (etapa clara), requiere
Capítulo 5: BIOMOLÉCULAS
 Capítulo 5: BIOMOLÉCULAS De qué están hechas las células? Al analizar los átomos y moléculas presentes en las células, se observa que todas ellas se asemejan: una gran proporción es agua; el resto es un
Capítulo 5: BIOMOLÉCULAS De qué están hechas las células? Al analizar los átomos y moléculas presentes en las células, se observa que todas ellas se asemejan: una gran proporción es agua; el resto es un
ESTRUCTURA GENERAL DE LOS AMINOACIDOS A ph FISIOLOGICO
 ESTRUCTURA GENERAL DE LOS AMINOACIDOS A ph FISIOLOGICO Todos los aminoácidos tienen, como mínimo, dos grupos titulables o ionizables, cada uno con un pka característico y, por tanto, con dos zonas tampón
ESTRUCTURA GENERAL DE LOS AMINOACIDOS A ph FISIOLOGICO Todos los aminoácidos tienen, como mínimo, dos grupos titulables o ionizables, cada uno con un pka característico y, por tanto, con dos zonas tampón
XII SIMPOSIUM INTERNACIONAL DE LA UVA DE MESA - SIUVA
 Rol de los Aminoácidos en el Cultivo de Vid XII SIMPOSIUM INTERNACIONAL DE LA UVA DE MESA - SIUVA 2011 La Molina, 06 y 07 de Julio, 2011 Ing. M.Sc. Federico Ramírez D. Gerente Técnico Aminoácidos Las plantas
Rol de los Aminoácidos en el Cultivo de Vid XII SIMPOSIUM INTERNACIONAL DE LA UVA DE MESA - SIUVA 2011 La Molina, 06 y 07 de Julio, 2011 Ing. M.Sc. Federico Ramírez D. Gerente Técnico Aminoácidos Las plantas
De cualquier manera, solo estudiaremos en esta unidad los compuestos inorgánicos.
 Unidad 3 Ácidos, Hidróxidos y Sales: óxidos básicos, óxidos ácidos, hidróxidos, hidrácidos o ácidos binarios, ácidos ternarios, sales binarias, ternarias y cuaternarias. Formación y nomenclatura. Enlaces
Unidad 3 Ácidos, Hidróxidos y Sales: óxidos básicos, óxidos ácidos, hidróxidos, hidrácidos o ácidos binarios, ácidos ternarios, sales binarias, ternarias y cuaternarias. Formación y nomenclatura. Enlaces
Aminoácidos, péptidos y proteinas
 Aminoácidos, péptidos y proteinas Generalidades sobre los aminoácidos Compuestos que contienen un grupo -NH 2 y un grupo -CO 2 H esos grupos en realidad están presentes como -NH 3+ and -CO 2 respectivamente.
Aminoácidos, péptidos y proteinas Generalidades sobre los aminoácidos Compuestos que contienen un grupo -NH 2 y un grupo -CO 2 H esos grupos en realidad están presentes como -NH 3+ and -CO 2 respectivamente.
hidratos de carbono lípidos, proteínas, vitaminas sales minerales y agua principios inmediatos aminoácidos ácidos grasos esenciales
 A pesar de la diversidad en su composición, los análisis químicos revelan que todos los alimentos presentan seis grupos de sustancias comunes, denominadas nutritivas, en distinta proporción: hidratos de
A pesar de la diversidad en su composición, los análisis químicos revelan que todos los alimentos presentan seis grupos de sustancias comunes, denominadas nutritivas, en distinta proporción: hidratos de
Todo lo que los padres deben saber para que su hijo se alimente bien y crezca sano
 http://www.librosaguilar.com/es/ Empieza a leer... Primeros capítulos ANA Mª REQUEJO ROSA Mª ORTEGA Todo lo que los padres deben saber para que su hijo se alimente bien y crezca sano NUTRIENTES Clasificación,
http://www.librosaguilar.com/es/ Empieza a leer... Primeros capítulos ANA Mª REQUEJO ROSA Mª ORTEGA Todo lo que los padres deben saber para que su hijo se alimente bien y crezca sano NUTRIENTES Clasificación,
TABLA DE DECISION. Consideremos la siguiente tabla, expresada en forma genérica, como ejemplo y establezcamos la manera en que debe leerse.
 TABLA DE DECISION La tabla de decisión es una herramienta que sintetiza procesos en los cuales se dan un conjunto de condiciones y un conjunto de acciones a tomar según el valor que toman las condiciones.
TABLA DE DECISION La tabla de decisión es una herramienta que sintetiza procesos en los cuales se dan un conjunto de condiciones y un conjunto de acciones a tomar según el valor que toman las condiciones.
ESTRUCTURA Y PROPIEDADES DE AMINOÁCIDOS Y PÉPTIDOS AMINOÁCIDOS
 ESTRUCTURA Y PROPIEDADES DE AMINOÁCIDOS Y PÉPTIDOS Fabián Rodríguez Julio 2011 AMINOÁCIDOS Un aminoácido es una molécula orgánica que en su estructura contiene un grupo amino (NH 2 ) y un grupo carboxilo
ESTRUCTURA Y PROPIEDADES DE AMINOÁCIDOS Y PÉPTIDOS Fabián Rodríguez Julio 2011 AMINOÁCIDOS Un aminoácido es una molécula orgánica que en su estructura contiene un grupo amino (NH 2 ) y un grupo carboxilo
LA INSULINA DE ACCION EN EL HIPERTIROIDISMO: UN ENFOQUE EN LOS MUSCULOS Y TEJIDO ADIPOSO.
 LA INSULINA DE ACCION EN EL HIPERTIROIDISMO: UN ENFOQUE EN LOS MUSCULOS Y TEJIDO ADIPOSO. INTRODUCCION Las hormonas tiroideas pueden influir en un número de procesos en el cuerpo. Los cambios en sus niveles
LA INSULINA DE ACCION EN EL HIPERTIROIDISMO: UN ENFOQUE EN LOS MUSCULOS Y TEJIDO ADIPOSO. INTRODUCCION Las hormonas tiroideas pueden influir en un número de procesos en el cuerpo. Los cambios en sus niveles
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS. A.- Concepto de prótidos y clasificación B.-Los aminoácidos
 TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
Ruta de las pentosas fosfato
 Ruta de las pentosas fosfato La ruta predominante del catabolismo de la glucosa es la glucólisis para dar piruvato, seguida por la oxidación a CO 2 en el ciclo del ácido cítrico. Un proceso alternativo,
Ruta de las pentosas fosfato La ruta predominante del catabolismo de la glucosa es la glucólisis para dar piruvato, seguida por la oxidación a CO 2 en el ciclo del ácido cítrico. Un proceso alternativo,
AMINOÁCIDOS Y PÉPTIDOS
 TEMA 4 AMINOÁCIDOS Y PÉPTIDOS 1. Estructura y clasificación de los aminoácidos. 2. Propiedades ácido-base de los aminoácidos y péptidos 3. El enlace peptídico 4. Péptidos: hidrólisis y secuenciación 1.
TEMA 4 AMINOÁCIDOS Y PÉPTIDOS 1. Estructura y clasificación de los aminoácidos. 2. Propiedades ácido-base de los aminoácidos y péptidos 3. El enlace peptídico 4. Péptidos: hidrólisis y secuenciación 1.
AMINOÁCIDOS, PÉPTIDOS Y PROTEINAS. M.Sc. GABY MÓNICA FELIPE BRAVO
 AMINÁCIDS, PÉPTIDS Y PRTEINAS M.Sc. GABY MÓNICA FELIPE BRAV AMINÁCIDS C H 2 N C H R TDS LS AMINÁCIDS QUE FRMAN PARTE DE LAS PRTEÍNAS SN L-AMINÁCIDS CLASIFICACIÓN DE LS AMINÁCIDS ALIFÁTICS N PLARES ARMÁTICS
AMINÁCIDS, PÉPTIDS Y PRTEINAS M.Sc. GABY MÓNICA FELIPE BRAV AMINÁCIDS C H 2 N C H R TDS LS AMINÁCIDS QUE FRMAN PARTE DE LAS PRTEÍNAS SN L-AMINÁCIDS CLASIFICACIÓN DE LS AMINÁCIDS ALIFÁTICS N PLARES ARMÁTICS
7.012 Serie de ejercicios 1
 ombre Grupo 7.01 Serie de ejercicios 1 Pregunta 1 a) uáles son los 4 tipos principales de moléculas biológicas mencionadas en clase? ite una función importante de cada tipo de molécula biológica celular.
ombre Grupo 7.01 Serie de ejercicios 1 Pregunta 1 a) uáles son los 4 tipos principales de moléculas biológicas mencionadas en clase? ite una función importante de cada tipo de molécula biológica celular.
La Absorción del Agua
 La Absorción del Agua Importancia del Agua en las Plantas Es el cons5tuyente principal del protoplasma celular, en ocasiones representa hasta el 95% del peso total de la planta. Es el solvente en el que
La Absorción del Agua Importancia del Agua en las Plantas Es el cons5tuyente principal del protoplasma celular, en ocasiones representa hasta el 95% del peso total de la planta. Es el solvente en el que
AMINOÁCIDOS, PEPTIDOS Y PROTEÍNAS. Profesor Carlos Urzúa Stricker
 AMINÁIDS, PEPTIDS Y PRTEÍNAS Profesor arlos Urzúa Stricker H 3 N AMIN AIDS: BLQUES DE NSTRUIÓN DE LAS PRTEÍNAS Químicamente los aminoácidos son ácidos carboxílicos que poseen un grupo amino. H R H 3 N
AMINÁIDS, PEPTIDS Y PRTEÍNAS Profesor arlos Urzúa Stricker H 3 N AMIN AIDS: BLQUES DE NSTRUIÓN DE LAS PRTEÍNAS Químicamente los aminoácidos son ácidos carboxílicos que poseen un grupo amino. H R H 3 N
BIOQUÍMICA GENERAL. MSc. Dania Martín
 BIOQUÍMICA GENERAL MSc. Dania Martín UNIDAD # 3: PROTEÍNAS Clase #7 OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto de Diferenciar el objeto de Ser consciente de la 1.
BIOQUÍMICA GENERAL MSc. Dania Martín UNIDAD # 3: PROTEÍNAS Clase #7 OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto de Diferenciar el objeto de Ser consciente de la 1.
Clasificación de los AA en familias, según su biosíntesis
 Tema 15: : Aspectos generales de la biosíntesis de aminoácidos. Fijación n del nitrógeno a cadenas carbonadas. Algunos ejemplos de interés s biológico. T 15 síntesis AA Los AA se clasifican en esenciales
Tema 15: : Aspectos generales de la biosíntesis de aminoácidos. Fijación n del nitrógeno a cadenas carbonadas. Algunos ejemplos de interés s biológico. T 15 síntesis AA Los AA se clasifican en esenciales
Aminoácidos Pi Primera Parte
 Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
Holoproteínas (sólo contienen aa)
 TEMA 4: P ROTEÍNAS 1. Concepto y clasificación Las proteínas son biomoléculas orgánicas formadas por C, H, O, N y en menor medida P y S y otros elementos (Fe,Cu, Mg, ). Son polímeros no ramificados de
TEMA 4: P ROTEÍNAS 1. Concepto y clasificación Las proteínas son biomoléculas orgánicas formadas por C, H, O, N y en menor medida P y S y otros elementos (Fe,Cu, Mg, ). Son polímeros no ramificados de
2.2- FENOLES. Como ya hemos indicado, se obtienen al sustituir uno o más átomos de hidrógeno del benceno por radicales OH.
 2.2- FENOLES Como ya hemos indicado, se obtienen al sustituir uno o más átomos de hidrógeno del benceno por radicales OH. Si se sustituye un solo átomo de hidrógeno, se obtienen los fenoles; si se sustituyen
2.2- FENOLES Como ya hemos indicado, se obtienen al sustituir uno o más átomos de hidrógeno del benceno por radicales OH. Si se sustituye un solo átomo de hidrógeno, se obtienen los fenoles; si se sustituyen
REPASANDO CONCEPTOS : LAS PROTEÍNAS
 REPASANDO CONCEPTOS : LAS PROTEÍNAS Drqf. Manuel Fontboté A. Consultor en Ciencias Cosméticas CHILE El uso de materias activas de naturaleza proteica en los cosméticos no es un hecho reciente, antes bien,
REPASANDO CONCEPTOS : LAS PROTEÍNAS Drqf. Manuel Fontboté A. Consultor en Ciencias Cosméticas CHILE El uso de materias activas de naturaleza proteica en los cosméticos no es un hecho reciente, antes bien,
constituye aproximadamente el 60% de la reserva de aminoácidos del músculo esquelético.
 Qué es la glutamina? La glutamina es el más abundante aminoácido libre en el cuerpo humano, y constituye aproximadamente el 60% de la reserva de aminoácidos del músculo esquelético. La glutamina es un
Qué es la glutamina? La glutamina es el más abundante aminoácido libre en el cuerpo humano, y constituye aproximadamente el 60% de la reserva de aminoácidos del músculo esquelético. La glutamina es un
Química orgánica. Cuarto Medio 25/06
 Química orgánica Cuarto Medio 25/06 CARBONO Es el elemento principal de las moléculas orgánicas. Debido a que este átomo, presenta una gran estabilidad. Dado que, tiene una baja tendencia a donar y quitar
Química orgánica Cuarto Medio 25/06 CARBONO Es el elemento principal de las moléculas orgánicas. Debido a que este átomo, presenta una gran estabilidad. Dado que, tiene una baja tendencia a donar y quitar
Proteínas: Leche y caseína
 Proteínas: Leche y caseína El papel de la leche en la naturaleza es para alimentar y proporcionar una protección inmunológica para los mamíferos jóvenes. La leche ha sido una fuente de alimento para los
Proteínas: Leche y caseína El papel de la leche en la naturaleza es para alimentar y proporcionar una protección inmunológica para los mamíferos jóvenes. La leche ha sido una fuente de alimento para los
CARACTERIZACIÓN DE ISÓMEROS ÓPTICOS POR POLARIMETRÍA
 CARACTERIZACIÓN DE ISÓMEROS ÓPTICOS POR POLARIMETRÍA OBJETIVO Caracterizar los diastereoisómeros puros del complejo [Co(en) 3 ]. 3 I 3 previamente sintetizado por medio de la medición de su actividad óptica
CARACTERIZACIÓN DE ISÓMEROS ÓPTICOS POR POLARIMETRÍA OBJETIVO Caracterizar los diastereoisómeros puros del complejo [Co(en) 3 ]. 3 I 3 previamente sintetizado por medio de la medición de su actividad óptica
Solubilidad. y se representa por.
 Solubilidad Solubilidad. La solubilidad mide la cantidad máxima de soluto capaz de disolverse en una cantidad definida de disolvente, a una temperatura determinada, y formar un sistema estable que se denomina
Solubilidad Solubilidad. La solubilidad mide la cantidad máxima de soluto capaz de disolverse en una cantidad definida de disolvente, a una temperatura determinada, y formar un sistema estable que se denomina
Informe del trabajo práctico nº7
 Informe del trabajo práctico nº7 Profesora : Lic. Graciela. Lic. Mariana. Alumnas: Romina. María Luján. Graciela. Mariana. Curso: Química orgánica 63.14 turno 1 OBJETIVOS Mostrar las propiedades que presentan
Informe del trabajo práctico nº7 Profesora : Lic. Graciela. Lic. Mariana. Alumnas: Romina. María Luján. Graciela. Mariana. Curso: Química orgánica 63.14 turno 1 OBJETIVOS Mostrar las propiedades que presentan
El agua como disolvente
 hidrofobicas El agua como disolvente El elevado momento dipolar del agua y su facilidad para formar puentes de hidrógeno hacen que el agua sea un excelente disolvente. Una molécula o ión es soluble en
hidrofobicas El agua como disolvente El elevado momento dipolar del agua y su facilidad para formar puentes de hidrógeno hacen que el agua sea un excelente disolvente. Una molécula o ión es soluble en
AMINOÁCIDOS SE PUEDEN UNIR POR ENLACES PEPTÍDICOS
 Tema 4. Proteínas: funciones biológicas y estructura primaria. Enlace peptídico. Péptidos y proteínas. Diversidad de funciones biológicas. Niveles de organización estructural de las proteínas. Separación
Tema 4. Proteínas: funciones biológicas y estructura primaria. Enlace peptídico. Péptidos y proteínas. Diversidad de funciones biológicas. Niveles de organización estructural de las proteínas. Separación
En el APOENZIMA se distinguen tres tipos de aminoácidos:
 1. Concepto de biocatalizador. Son sustancias que consiguen que las reacciones se realicen a gran velocidad a bajas temperaturas, ya que disminuyen la energía de activación de los reactivos. Pueden ser:
1. Concepto de biocatalizador. Son sustancias que consiguen que las reacciones se realicen a gran velocidad a bajas temperaturas, ya que disminuyen la energía de activación de los reactivos. Pueden ser:
METABOLISMO CELULAR. Es el conjunto de reacciones químicas a través de las cuales el organismo intercambia materia y energía con el medio
 METABOLISMO CELULAR Es el conjunto de reacciones químicas a través de las cuales el organismo intercambia materia y energía con el medio Reacciones Celulares Básicas. Los sistemas vivos convierten la energía
METABOLISMO CELULAR Es el conjunto de reacciones químicas a través de las cuales el organismo intercambia materia y energía con el medio Reacciones Celulares Básicas. Los sistemas vivos convierten la energía
CLASIFICACION POR LA CADENA LATERAL POR SU REQUERIMIENTO POR SU POLARIDAD. Esenciales No esenciales CADENA LATERAL CON GRUPO
 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
NIVEL QUÍMICO DE ORGANIZACIÓN DEL CUERPO HUMANO
 NIVEL QUÍMICO DE ORGANIZACIÓN DEL CUERPO HUMANO 10. Defina macromolécula utilizando los términos polímero y monómero. Cite ejemplos. 11. Qué elementos químicos poseen los glúcidos y por qué reciben el
NIVEL QUÍMICO DE ORGANIZACIÓN DEL CUERPO HUMANO 10. Defina macromolécula utilizando los términos polímero y monómero. Cite ejemplos. 11. Qué elementos químicos poseen los glúcidos y por qué reciben el
CONTROL DE LA ACTIVIDAD CELULAR
 CONTROL DE LA ACTIVIDAD CELULAR Sumario Las Moléculas de los Seres Vivos Control de la actividad celular 1. Las reacciones celulares básicas 2. El control de las reacciones celulares 3. Los modelos de
CONTROL DE LA ACTIVIDAD CELULAR Sumario Las Moléculas de los Seres Vivos Control de la actividad celular 1. Las reacciones celulares básicas 2. El control de las reacciones celulares 3. Los modelos de
Ablandamiento de agua mediante el uso de resinas de intercambio iónico.
 Ablandamiento de agua por intercambio iónica página 1 Ablandamiento de agua mediante el uso de resinas de intercambio iónico. (Fuentes varias) Algunos conceptos previos: sales, iones y solubilidad. Que
Ablandamiento de agua por intercambio iónica página 1 Ablandamiento de agua mediante el uso de resinas de intercambio iónico. (Fuentes varias) Algunos conceptos previos: sales, iones y solubilidad. Que
La radiación es el transporte o la propagación de energía en forma de partículas u
 La radiación es el transporte o la propagación de energía en forma de partículas u ondas. Si la radiación es debida a fuerzas eléctricas o magnéticas se llama radiación electromagnética. Pero la materia
La radiación es el transporte o la propagación de energía en forma de partículas u ondas. Si la radiación es debida a fuerzas eléctricas o magnéticas se llama radiación electromagnética. Pero la materia
Clase No.11: Estereoquímica, Isomería óptica y Rotación específica
 Clase No.11: Estereoquímica, Isomería óptica y Rotación específica Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad de San Carlos de Guatemala Quiralidad Porqué no
Clase No.11: Estereoquímica, Isomería óptica y Rotación específica Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad de San Carlos de Guatemala Quiralidad Porqué no
Actividad: Cuál es la diferencia entre una reacción nuclear y una reacción química?
 Cuál es la diferencia entre una reacción nuclear y una reacción química? Nivel: 4º medio Subsector: Ciencias químicas Unidad temática: Actividad: Cuál es la diferencia entre una reacción nuclear y una
Cuál es la diferencia entre una reacción nuclear y una reacción química? Nivel: 4º medio Subsector: Ciencias químicas Unidad temática: Actividad: Cuál es la diferencia entre una reacción nuclear y una
FUNDAMENTOS BIOLÓGICOS DEL APRENDIZAJE Y LA MEMORIA
 Departamento de Biología a Ambiental y Salud PúblicaP FUNDAMENTOS BIOLÓGICOS DEL APRENDIZAJE Y LA MEMORIA La base celular y físico-química del impulso y transmisión de la señal nerviosa. La neurona. Potencial
Departamento de Biología a Ambiental y Salud PúblicaP FUNDAMENTOS BIOLÓGICOS DEL APRENDIZAJE Y LA MEMORIA La base celular y físico-química del impulso y transmisión de la señal nerviosa. La neurona. Potencial
PROTEÍNAS. Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas:
 PROTEÍNAS Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas: Tipos de Proteínas ESTRUCTURA DE LAS PROTEÍNAS Estructura
PROTEÍNAS Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas: Tipos de Proteínas ESTRUCTURA DE LAS PROTEÍNAS Estructura
Área Académica de: Química. Programa Educativo: Licenciatura de Química en Alimentos. Nombre de la Asignatura: Biología celular
 Área Académica de: Química Línea de Investigación Programa Educativo: Licenciatura de Química en Alimentos Nombre de la Asignatura: Biología celular Tema: Introducción Ciclo: Agosto-Diciembre 2011 Profesor(a):
Área Académica de: Química Línea de Investigación Programa Educativo: Licenciatura de Química en Alimentos Nombre de la Asignatura: Biología celular Tema: Introducción Ciclo: Agosto-Diciembre 2011 Profesor(a):
MANUAL PRACTICO DE NUTRICIÒN
 www.nutrimedperu.com MANUAL PRACTICO DE NUTRICIÒN Lic. Nutricionista: Castrejón Miguel ángel Portocarrero No de Colegiatura: CNP: 3904 Email: mpc2804@nutrimedperu.com Web: www.nutrimedperu.com Introducción
www.nutrimedperu.com MANUAL PRACTICO DE NUTRICIÒN Lic. Nutricionista: Castrejón Miguel ángel Portocarrero No de Colegiatura: CNP: 3904 Email: mpc2804@nutrimedperu.com Web: www.nutrimedperu.com Introducción
Electrólisis. Electrólisis 12/02/2015
 Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
10.8. Balances de carga y materia
 10.8. Balances de carga y materia La determinación de la concentración de todas las especies en equilibrio de la disolución acuosa diluida de ácidos y bases se resume a un problema de N ecuaciones no lineales
10.8. Balances de carga y materia La determinación de la concentración de todas las especies en equilibrio de la disolución acuosa diluida de ácidos y bases se resume a un problema de N ecuaciones no lineales
TEMA 2: Representación de la Información en las computadoras
 TEMA 2: Representación de la Información en las computadoras Introducción Una computadora es una máquina que procesa información y ejecuta programas. Para que la computadora ejecute un programa, es necesario
TEMA 2: Representación de la Información en las computadoras Introducción Una computadora es una máquina que procesa información y ejecuta programas. Para que la computadora ejecute un programa, es necesario
CLASIFICACION POR LA CADENA LATERAL POR SU REQUERIMIENTO POR SU POLARIDAD. Esenciales No esenciales CADENA LATERAL CON GRUPO
 29 2018 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
29 2018 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
TEMA 2.- PROTEÍNAS. AMINOÁCIDOS
 TEMA 2.- PROTEÍNAS. AMINOÁCIDOS Diversidad estructural y funcional de las proteínas. Aminoácidos: características estructurales y clasificación. Aminoácidos estándares y derivados. Aminoácidos esenciales
TEMA 2.- PROTEÍNAS. AMINOÁCIDOS Diversidad estructural y funcional de las proteínas. Aminoácidos: características estructurales y clasificación. Aminoácidos estándares y derivados. Aminoácidos esenciales
Ambientación Universitaria BIOLOGÍA. Guía de Actividades 2014
 1 Ambientación Universitaria BIOLOGÍA Guía de Actividades 2014 2 I.- INTRODUCCIÓN- CONCEPTO DE CIENCIA Y VIDA 1) Lea el siguiente texto. Mencione ejemplos de lo que considere investigación en ciencias
1 Ambientación Universitaria BIOLOGÍA Guía de Actividades 2014 2 I.- INTRODUCCIÓN- CONCEPTO DE CIENCIA Y VIDA 1) Lea el siguiente texto. Mencione ejemplos de lo que considere investigación en ciencias
CÓDIGO GENÉTICO Y SÍNTESIS DE PROTEÍNAS
 CÓDIGO GENÉTICO Y SÍNTESIS DE PROTEÍNAS Sumario Mitosis y meiosis Código genético y síntesis de proteínas: 1. Concepto de gen 2. Estructura del ADN 3. La replicación del ADN 4. La transcripción 5. La traducción
CÓDIGO GENÉTICO Y SÍNTESIS DE PROTEÍNAS Sumario Mitosis y meiosis Código genético y síntesis de proteínas: 1. Concepto de gen 2. Estructura del ADN 3. La replicación del ADN 4. La transcripción 5. La traducción
Proteínas. Tabla 1: Funciones de las proteínas
 Colegio Lectura Hispano Complementaria Americano Depto. de Ciencias - Biología Nivel: 4to medio Unidad I Proteínas 1 En las células, son las proteínas las macromoléculas más abundantes y las que constituyen
Colegio Lectura Hispano Complementaria Americano Depto. de Ciencias - Biología Nivel: 4to medio Unidad I Proteínas 1 En las células, son las proteínas las macromoléculas más abundantes y las que constituyen
QUÍMICA DE LAS BIOMOLÉCULAS
 QUÍMICA DE LAS BIMLÉCULAS AMINÁCIDS Y PRTEÍNAS Tema 11: Aminoácidos Tema 12: Proteínas A - Z Unidad 5: Aminoácidos y Proteínas Veterinaria AMINÁCIDS H 2 N CH C R H CLASIFICACIÓN: 1- AMINÁCIDS MNAMIN-MNCARBXÍLICS
QUÍMICA DE LAS BIMLÉCULAS AMINÁCIDS Y PRTEÍNAS Tema 11: Aminoácidos Tema 12: Proteínas A - Z Unidad 5: Aminoácidos y Proteínas Veterinaria AMINÁCIDS H 2 N CH C R H CLASIFICACIÓN: 1- AMINÁCIDS MNAMIN-MNCARBXÍLICS
SEMANA 29 AMINOACIDOS Y PÉPTIDOS Elaborado por: Lic. Fernando Andrade
 +UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO GUIA DE ESTUDIO 2016 SEMANA 29 AMINOACIDOS Y PÉPTIDOS Elaborado por: Lic. Fernando Andrade Lea
+UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO GUIA DE ESTUDIO 2016 SEMANA 29 AMINOACIDOS Y PÉPTIDOS Elaborado por: Lic. Fernando Andrade Lea
BLOQUE I. CUÁL ES LA COMPOSICIÓN DE LOS SERES VIVOS? LAS MOLÉCULAS DE LA VIDA
 I.E.S. Flavio Irnitano El Saucejo (Sevilla) Curso 2.015 2.016 Departamento de Biología y Geología NIVEL: 2º Bachillerato MATERIA: BIOLOGÍA 6.1. Concepto y estructura. BLOQUE I. CUÁL ES LA COMPOSICIÓN DE
I.E.S. Flavio Irnitano El Saucejo (Sevilla) Curso 2.015 2.016 Departamento de Biología y Geología NIVEL: 2º Bachillerato MATERIA: BIOLOGÍA 6.1. Concepto y estructura. BLOQUE I. CUÁL ES LA COMPOSICIÓN DE
TECNOLOGIA RESUMEN DEL TEMA 3 (NOCIONES DE ELECTRICIDAD Y MAGNETISMO)
 TECNOLOGIA RESUMEN DEL TEMA 3 (NOCIONES DE ELECTRICIDAD Y MAGNETISMO) Existen 2 clases de electrización, la positiva (que se representa con + ), y la negativa (que se representa con - ). Hay una partícula
TECNOLOGIA RESUMEN DEL TEMA 3 (NOCIONES DE ELECTRICIDAD Y MAGNETISMO) Existen 2 clases de electrización, la positiva (que se representa con + ), y la negativa (que se representa con - ). Hay una partícula
Unidad I. 1.1 Sistemas numéricos (Binario, Octal, Decimal, Hexadecimal)
 Unidad I Sistemas numéricos 1.1 Sistemas numéricos (Binario, Octal, Decimal, Hexadecimal) Los computadores manipulan y almacenan los datos usando interruptores electrónicos que están ENCENDIDOS o APAGADOS.
Unidad I Sistemas numéricos 1.1 Sistemas numéricos (Binario, Octal, Decimal, Hexadecimal) Los computadores manipulan y almacenan los datos usando interruptores electrónicos que están ENCENDIDOS o APAGADOS.
TEMA 13. EL METABOLISMO CELULAR 5. PROCESOS DE OXIDO-REDUCCIO E EL METABOLISMO
 TEMA 13. EL METABOLISMO CELULAR 1. METABOLISMO CELULAR: GE ERALIDADES. 2. RUTAS METABÓLICAS. 3. TIPOS DE PROCESOS METABÓLICOS. 4. TIPOS METABOLICOS DE SERES VIVOS. 5. PROCESOS DE OXIDO-REDUCCIO E EL METABOLISMO
TEMA 13. EL METABOLISMO CELULAR 1. METABOLISMO CELULAR: GE ERALIDADES. 2. RUTAS METABÓLICAS. 3. TIPOS DE PROCESOS METABÓLICOS. 4. TIPOS METABOLICOS DE SERES VIVOS. 5. PROCESOS DE OXIDO-REDUCCIO E EL METABOLISMO
www.elesapiens.com GLOSARIO DE QUÍMICA ABONO: Es cualquier sustancia orgánica o inorgánica que mejora la calidad de la tierra.
 GLOSARIO DE QUÍMICA ABONO: Es cualquier sustancia orgánica o inorgánica que mejora la calidad de la tierra. ANTIBIÓTICO: Es una sustancia química que mata o impide el crecimiento de ciertas clases de microorganismos
GLOSARIO DE QUÍMICA ABONO: Es cualquier sustancia orgánica o inorgánica que mejora la calidad de la tierra. ANTIBIÓTICO: Es una sustancia química que mata o impide el crecimiento de ciertas clases de microorganismos
Objetivos de Aprendizaje:
 Objetivos de Aprendizaje: Resultados de Aprendizaje: METABOLISMO El metabolismo es el conjunto de reacciones y procesos físico-químicos que ocurren en una célula, necesarios para su supervivencia. Estos
Objetivos de Aprendizaje: Resultados de Aprendizaje: METABOLISMO El metabolismo es el conjunto de reacciones y procesos físico-químicos que ocurren en una célula, necesarios para su supervivencia. Estos
3. AMINOACIDOS. PROPIEDADES ACIDO-BASE
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 3. AMINOACIDOS. PROPIEDADES ACIDO-BASE ESQUEMA - Aminoácidos. Definición, funciones y clasificación - Tipos de aminoácidos: aminoácidos
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 3. AMINOACIDOS. PROPIEDADES ACIDO-BASE ESQUEMA - Aminoácidos. Definición, funciones y clasificación - Tipos de aminoácidos: aminoácidos
ÁREA DE BIOLOGÍA CELULAR DEPARTAMENTO DE BIOLOGÍA AMBIENTAL Y SALUD PÚBLICA FACULTAD DE CIENCIAS EXPERIMENTALES UNIVERSIDAD DE HUELVA ESTRÉS OXIDATIVO
 ÁREA DE BIOLOGÍA CELULAR DEPARTAMENTO DE BIOLOGÍA AMBIENTAL Y SALUD PÚBLICA FACULTAD DE CIENCIAS EXPERIMENTALES UNIVERSIDAD DE HUELVA ESTRÉS OXIDATIVO Concepto de estrés oxidativo. Formación de especies
ÁREA DE BIOLOGÍA CELULAR DEPARTAMENTO DE BIOLOGÍA AMBIENTAL Y SALUD PÚBLICA FACULTAD DE CIENCIAS EXPERIMENTALES UNIVERSIDAD DE HUELVA ESTRÉS OXIDATIVO Concepto de estrés oxidativo. Formación de especies
18 Reacciones orgánicas
 Facultad de Farmacia. Universidad de Alcalá 181 18 Reacciones orgánicas 18.1 Reacciones de adición 18.2 Reacciones de eliminación 18.3 Reacciones de sustitución 18.4 Reacciones entre ácidos y bases 18.1
Facultad de Farmacia. Universidad de Alcalá 181 18 Reacciones orgánicas 18.1 Reacciones de adición 18.2 Reacciones de eliminación 18.3 Reacciones de sustitución 18.4 Reacciones entre ácidos y bases 18.1
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
TEMA 5: INTRODUCCIÓN A LA SIMETRÍA MOLECULAR
 Tema 5 Simetría Molecular 1 TEMA 5: INTRODUCCIÓN A LA SIMETRÍA MOLECULAR La simetría de una molécula determina muchas de sus propiedades e incluso determina cómo se producen algunas reacciones. El estudio
Tema 5 Simetría Molecular 1 TEMA 5: INTRODUCCIÓN A LA SIMETRÍA MOLECULAR La simetría de una molécula determina muchas de sus propiedades e incluso determina cómo se producen algunas reacciones. El estudio
 LA CELULA MEMBRANA PLASMATICA La unidad estructural,histologica y anatomica de los seres vivos es la celula y cada una de ellas se organiza en tejidos, organos y aparatos, orientados a una funcion especifica.
LA CELULA MEMBRANA PLASMATICA La unidad estructural,histologica y anatomica de los seres vivos es la celula y cada una de ellas se organiza en tejidos, organos y aparatos, orientados a una funcion especifica.
Química Orgánica. por átomos de carbono. A diferencia de otros
 Química Orgánica La definición moderna de la química orgánica es el estudio de los compuestos que se componen por átomos de carbono. A diferencia de otros elementos, el carbono crea enlaces muy fuertes
Química Orgánica La definición moderna de la química orgánica es el estudio de los compuestos que se componen por átomos de carbono. A diferencia de otros elementos, el carbono crea enlaces muy fuertes
Base de datos en Excel
 Base de datos en Excel Una base datos es un conjunto de información que ha sido organizado bajo un mismo contexto y se encuentra almacenada y lista para ser utilizada en cualquier momento. Las bases de
Base de datos en Excel Una base datos es un conjunto de información que ha sido organizado bajo un mismo contexto y se encuentra almacenada y lista para ser utilizada en cualquier momento. Las bases de
04/11/2013 ALCOHOLES Y FENOLES
 ALCOHOLES Y FENOLES Pueden ser considerados como derivados del agua. Tienen en común, la presencia del grupo funcional OH, conocido como grupo hidroxilo ú oxhídrilo. ALCOHOLES: grupo OH-unido a radical
ALCOHOLES Y FENOLES Pueden ser considerados como derivados del agua. Tienen en común, la presencia del grupo funcional OH, conocido como grupo hidroxilo ú oxhídrilo. ALCOHOLES: grupo OH-unido a radical
La tabla periódica de los elementos
 La tabla periódica de los elementos 4 año secundario Vamos a iniciar este tema realizando un vistazo a la tabla periódica de los elementos. Aquí les doy varios sitios a los que pueden acudir para conocerla.
La tabla periódica de los elementos 4 año secundario Vamos a iniciar este tema realizando un vistazo a la tabla periódica de los elementos. Aquí les doy varios sitios a los que pueden acudir para conocerla.
DESARROLLO DE HABILIDADES DEL PENSAMIENTO LÓGICO
 I. SISTEMAS NUMÉRICOS DESARROLLO DE HABILIDADES DEL PENSAMIENTO LÓGICO LIC. LEYDY ROXANA ZEPEDA RUIZ SEPTIEMBRE DICIEMBRE 2011 Ocosingo, Chis. 1.1Sistemas numéricos. Los números son los mismos en todos
I. SISTEMAS NUMÉRICOS DESARROLLO DE HABILIDADES DEL PENSAMIENTO LÓGICO LIC. LEYDY ROXANA ZEPEDA RUIZ SEPTIEMBRE DICIEMBRE 2011 Ocosingo, Chis. 1.1Sistemas numéricos. Los números son los mismos en todos
PROPIEDADES FUNCIONALES DE LAS PROTEÍNAS
 PROPIEDADES FUNCIONALES DE LAS PROTEÍNAS Que es una Propiedad Funcional? Propiedades físicas y químicas que derivan del comportamiento de proteínas en sistemas alimenticios durante procesado, almacenamiento,
PROPIEDADES FUNCIONALES DE LAS PROTEÍNAS Que es una Propiedad Funcional? Propiedades físicas y químicas que derivan del comportamiento de proteínas en sistemas alimenticios durante procesado, almacenamiento,
Vias alternativas de oxidación de Glucosa: Ruta de las pentosas fosfato
 Vias alternativas de oxidación de Glucosa: Ruta de las pentosas fosfato Ruta alternativa de oxidación de glucosa: Ruta de las Pentosas Fosfato Productos primarios: NADPH: agente reductor en biosíntesis.
Vias alternativas de oxidación de Glucosa: Ruta de las pentosas fosfato Ruta alternativa de oxidación de glucosa: Ruta de las Pentosas Fosfato Productos primarios: NADPH: agente reductor en biosíntesis.
Singularidad del carbono
 Singularidad del carbono Su configuración electrónica y su tamaño determinan que sea el único elemento químico que puede: Formar enlaces covalentes sencillos, dobles o triples con otros átomos de carbono.
Singularidad del carbono Su configuración electrónica y su tamaño determinan que sea el único elemento químico que puede: Formar enlaces covalentes sencillos, dobles o triples con otros átomos de carbono.
ESCUELA SUPERIOR POLITECNICA DEL LITORAL OFICINA DE ADMISIONES CURSO DE NIVELACION DE CARRERA SEGUNDO PARCIAL DE QUIMICA Marzo de 2014
 ESCUELA SUPERIOR POLITECNICA DEL LITORAL OFICINA DE ADMISIONES CURSO DE NIVELACION DE CARRERA SEGUNDO PARCIAL DE QUIMICA Marzo de 2014 NOMBRE: PARALELO: FECHA: El presente examen ha sido elaborado para
ESCUELA SUPERIOR POLITECNICA DEL LITORAL OFICINA DE ADMISIONES CURSO DE NIVELACION DE CARRERA SEGUNDO PARCIAL DE QUIMICA Marzo de 2014 NOMBRE: PARALELO: FECHA: El presente examen ha sido elaborado para
CUPES L. Ciencias experimentales. Configuración Electrónica. Recopiló: M.C. Macaria Hernández Chávez
 CUPES L Ciencias experimentales Configuración Electrónica Recopiló: M.C. Macaria Hernández Chávez 1. Existen 7 niveles de energía o capas donde pueden situarse los electrones, numerados del 1, el más interno,
CUPES L Ciencias experimentales Configuración Electrónica Recopiló: M.C. Macaria Hernández Chávez 1. Existen 7 niveles de energía o capas donde pueden situarse los electrones, numerados del 1, el más interno,
REACCIONES DE IONES METÁLICOS
 Actividad Experimental 4 REACCIONES DE IONES METÁLICOS Investigación previa -Investigar las medidas de seguridad para trabajar con amoniaco -Investigar las reglas de solubilidad de las sustancias químicas.
Actividad Experimental 4 REACCIONES DE IONES METÁLICOS Investigación previa -Investigar las medidas de seguridad para trabajar con amoniaco -Investigar las reglas de solubilidad de las sustancias químicas.
AMINOACIDOS Y PEPTIDOS. SEMANA 29 Licda. Lilian Judith Guzmán Melgar
 AMINOACIDOS Y PEPTIDOS SEMANA 29 Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los mas importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS SEMANA 29 Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los mas importantes en el mundo biológico son los α-aminoácidos,
1.4.1.2. Resumen... 1.4.2. ÁREA DE FACTURACIÓN::INFORMES::Pedidos...27 1.4.2.1. Detalle... 1.4.2.2. Resumen... 1.4.3. ÁREA DE
 MANUAL DE USUARIO DE ABANQ 1 Índice de contenido 1 ÁREA DE FACTURACIÓN......4 1.1 ÁREA DE FACTURACIÓN::PRINCIPAL...4 1.1.1. ÁREA DE FACTURACIÓN::PRINCIPAL::EMPRESA...4 1.1.1.1. ÁREA DE FACTURACIÓN::PRINCIPAL::EMPRESA::General...4
MANUAL DE USUARIO DE ABANQ 1 Índice de contenido 1 ÁREA DE FACTURACIÓN......4 1.1 ÁREA DE FACTURACIÓN::PRINCIPAL...4 1.1.1. ÁREA DE FACTURACIÓN::PRINCIPAL::EMPRESA...4 1.1.1.1. ÁREA DE FACTURACIÓN::PRINCIPAL::EMPRESA::General...4
Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento, conteste las siguientes preguntas.
 EXPERIMENTO 4 ALCOHOLES Y FENOLES Fecha: Sección de laboratorio: Nombre del estudiante: Grupo #: Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento, conteste las
EXPERIMENTO 4 ALCOHOLES Y FENOLES Fecha: Sección de laboratorio: Nombre del estudiante: Grupo #: Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento, conteste las
ALIMENTACIÓN Y DEPORTE
 CURSO NIVEL III Entrenador Nacional de Fútbol y Fútbol Sala Técnico deportivo Superior. ALIMENTACIÓN Y DEPORTE Apuntes del curso de entrenadores de fútbol y fútbol sala Nivel 3, impartido por la Escuela
CURSO NIVEL III Entrenador Nacional de Fútbol y Fútbol Sala Técnico deportivo Superior. ALIMENTACIÓN Y DEPORTE Apuntes del curso de entrenadores de fútbol y fútbol sala Nivel 3, impartido por la Escuela
Conceptos básicos de biología molecular, I
 Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Materia: Informática. Nota de Clases Sistemas de Numeración
 Nota de Clases Sistemas de Numeración Conversión Entre Sistemas de Numeración 1. EL SISTEMA DE NUMERACIÓN 1.1. DEFINICIÓN DE UN SISTEMA DE NUMERACIÓN Un sistema de numeración es un conjunto finito de símbolos
Nota de Clases Sistemas de Numeración Conversión Entre Sistemas de Numeración 1. EL SISTEMA DE NUMERACIÓN 1.1. DEFINICIÓN DE UN SISTEMA DE NUMERACIÓN Un sistema de numeración es un conjunto finito de símbolos
Hibridación de orbitales.
 Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
FARMACODINAMIA CONCEPTOS GENERALES
 FARMACODINAMIA CONCEPTOS GENERALES 1 DEFINICIÓN La Farmacodinamia comprende el estudio de los mecanismos de acción de las drogas y de los efectos bioquímicos, fisiológicos o directamente farmacológicos
FARMACODINAMIA CONCEPTOS GENERALES 1 DEFINICIÓN La Farmacodinamia comprende el estudio de los mecanismos de acción de las drogas y de los efectos bioquímicos, fisiológicos o directamente farmacológicos
