CÁLCULOS URINARIOS. Introducción:
|
|
|
- Inés Lucero Peralta
- hace 7 años
- Vistas:
Transcripción
1 CÁLCULOS URINARIOS Introducción: Los cálculos urinarios son estructuras compactas producidas por la precipitación de sustancias cristaloides normalmente disueltas en la orina, sobre una matriz o núcleo amorfo. Se producen en el tracto urinario (pelvis renal, uréter, vejiga, uretra), vías biliares, próstata y ocasionalmente en otra zona como en las glándulas salivales. Generalmente suelen ser el resultado de un desequilibrio entre la excreción de agua por un lado y materiales de baja solubilidad por otro, también se han asociado factores predisponentes que conllevarían a la formación de los mismos, como: gota cistinuria hiperparatiroidismo deshidratación isohidriuria hepatopatías factores geneticos, etc... Los cálculos urinarios están compuestos por elementos normalmente excretados en la orina, junto con proteínas, incluyendo las de la sangre. Rara vez por elementos extraños. Pueden Clasificarse según: Composición en: 1. Cálculos Simples : Solo presenta un compuesto urinario. 2. Cálculos mixtos : Estos contienen 2 o más componentes. 3. Cálculos formados por cuerpos extraños: Debido a cuerpos extraños en el organismo. Según su estructura en: 1. Concresionarios: Si alrededor del núcleo existen laminaciones concéntricas. 2. Sedimentarias : Si poseen varios núcleos unidos en forma 1
2 desordenada. Composición: Dentro de las sustancias que con mayor frecuencia se detectan en su composición estan : Cálculos de Calcio % Cálculos de estruvita % Cálculos de Acido Urico 5 8 % Cálculos de Cistina 0 1 % Calculos de calcio: Son mas frecuentes en hombres, edad media de inicio es la tercera decada de vida, la mayoria de estas personas con cálculo de calcio aislado termina por formar otro y los intervalos entre sucesivos cálculos se acortan o permanecen constantes. La cifra media entre formación de un cálculo y otro es cada 2 ó 3 años, generalmente este tipo de cálculo es familiar. Hay cristales de oxalato cálcico monohidratado y dihidratado. Los primeros suelen crecer como óvalos bicóncavos muy parecidos a un glóbulo rojo en cuanto a su forma y tamaño, pudiendo llegar a un tamaño mayor y en forma de Pesa que al exponerlos a luz polarizada y con fondo oscuro son brillantes, su intensidad dependerá de su orientación (Este efecto es llamado refringencia). Los segundos son bipiramidales y solo débilmente birrefringentes. Calculos de estruvita (MgNH4PO4): Son frecuentes y potencialmente muy peligrosos, formados principalmente en las mujeres, resultado de una infección urinaria por bacterias productoras de ureasa (enzima que actúa sobre la urea transformándola en amonio), generalmente Proteus. Pueden llegar a un gran tamaño y llenar la pelvis y los cálices renales hasta dar un aspecto de asta de venado. Son radiopacos con densidad interna variable. En la orina los cristales de estruvita son Prismas rectangulares que han sido comparado con tapas de ataúd. Calculo de acido urico: Estos son más frecuentes en hombres, son radiolúcidos, la mitad de estos pacientes tienen Gota, enfermedad asociada a un grupo de trastornos heterogéneos que se presentan aislados o de forma combinada, tales como Hiperuricemia, ataques de artritis inflamatoria monoarticular aguda, urolitiasis, etc... La litiasis por ácido úrico suele ser familiar, haya o no gota. En la orina, los cristales de ácido úrico son de color rojo anaranjado debido a que absorben el pigmento uricina. El ácido úrico anhidro produce cristales pequeños, que parecen amorfos al microscopio óptico. Son indistinguibles los cristales de apatita, excepto por su birrefringencia. El dihidrato de ácido úrico tiende a formar cristales en forma de gota y planchas planas y cuadradas. Ambos son fuertemente birrefringentes. La arenilla de ácido úrico parece polvo rojo y ocasionalmente los cálculos son anaranjados o rojos. 2
3 Calculos de cistina: Son infrecuentes, presentan un color amarillo limón brillante. Son radiopacos porque contienen azufre. Los cristales de cistína aparecen en orina como planchas planas y hexagonales. El cálculo se lava con agua destilada para eliminar cualquier resto de sangre, moco, coágulos, soluciones conservantes, etc. Se deja secar y se guarda en un recipiente seco y limpio para su posterior uso. Se deben hacer dos tipos de exámenes en el laboratorio: Exámen físico. Exámen químico. EXÁMEN FÍSICO Se deben medir las dimensiones del cálculo. Los cálculos pequeños generalmente se ubican en el riñón o pelvis renal y los grandes en la vejiga. Se debe observar el color, forma, aspecto, peso y consistencia. Los cálculos de oxalato son: duros, irregulares, cristalinos o labrados en parte. Los cálculos de ácido úrico son: duros, y de color amarillo o rojo parduzco. Los cálculos de fosfato son: blandos y cereos al tacto. Romper el cálculo y buscar un cuerpo extraño que haya servido para su formación Pulverizar finamente el cálculo. Una porción se calienta sobre una punta de una espátula de niquel o en asa de platino. Los cálculos orgánicos puros se queman completamente, sin producir llama: ácido úrico y uratos. Cistina: llama azul pálido. Si no se quema y deja un residuo blanco o grisáceo puede ser un cálculo de carbonato, oxalato o fosfato. EXÁMEN QUÍMICO. Este exámen esta orientado a descubrir el o los compuestos que forman el cálculo urinario, básicamente es un estudio de tipo cualitativo, ya que carece de detección de compuestos totales, quedando tras ello compuestos no investigados. Detección de Carbonato. Fundamento: Los ácidos minerales (HCL), descomponen los carbonatos desprendiendo el dióxido de carbono (CO2), el que es visualizado por la efervescencia que produce. Reacción: CO HCL CO2 + H2O + 2Cl= Se debe colocar una porción del polvo y añadir 8 a 10 gotas de HCl al 10 % v/v. La producción de CO2 evidencia carbonatos. Detección de Uratos. Fundamento: El ácido es oxidado a alantoína y dióxido de carbono por el ácido fosfotungstánico en solución 3
4 alcalina. El ácido fosfotungstánico es reducido a azul de tungstato. Concentraciones altas de glutatión, cistina y glucosa reducen el ácido fosfotungstánico y provoca la aparición del color azul. Ox. Reacción: Ac. Úrico + Ac. Fosfotungstánico Alantoína + CO2 + Azul de tungstato Red. Se coloca una porción del polvo en un tubo khan, agregar una gota de carbonato de sodio anhidro al 20% y una gota de reactivo de Folín Denis. Un color azul intenso, indica reacción positiva, un color celeste reacción negativa. Detección de Fosfato. Fundamento: Para separar el fosfato de las sustancias que puedan interferir, se precipita éste como fosfomolibdato de amonio en soluciones de ácido nítrico a unos 40 C. En esta reacción pueden interferir el arsénico, vanadio, sílice y cantidades excesivas de sales de amonio. Recién precipitado se admite que el precipitado de fosfomolibdato de amonio, de color amarillo, tiene agua y ácido úrico de cristalización. Puede acelerarse la reacción agregando nitrato de amonio. Reacción: PO4= + 3NH4 + 12MoO4H2 PO4(NH4)312MoO3 + 12H2O. Colocar en un tubo Kahn una porción del polvo, agregar cristales de molibdato de amonio, luego agregar 1 ml de ácido nítrico diluido 1/3. Calentar, si se produce un color amarillo o un precipitado indica reacción positiva. Detección de Oxalato. Fundamento: El oxalato precipita como oxalato de calcio, debido a la acidificación con HCL y posterior calentamiento. Finalmente se neutraliza con aceteato de sodio, obteniendo un anillo en la interfase. Reacción: Oxalato + HCL(1/3) + calor + Acetato de Na saturado Oxalato de calcio Poner en un tubo khan una porción de polvo, agregar 1 ml de HCl diluido 1/3. Agitar y calentar, una vez frio, agregar solución saturada de acetato de sodio lentamente por las paredes. Un anillo (amarillo) blanco en la interfase evidencia el oxalato. Detección de Calcio. Fundamento: El calcio precipita como oxalato de calcio, en una solución caliente, previamente acidificada con HCL, y neutralizando lentamente con solución de NaOH. El efecto de precipitación es por consecuencia de un desplazamiento de la solución de un medio estable a un medio disociado, que luego vuelve a estar estable gracias a cambios de ph. Reacción: Ca + HCL + NaOH Oxalato de calcio + H2O. 4
5 Acidificar una porción de polvo con HCl 1/3 o al 10% en un tubo Khan, agitarlo, luego sacar de este extracto ácido una gota u depositarla en otro tubo, al que se le agregaran 2 a 3 gotas de NaOH al 20 25%. Se formara un fino precipitado blanco si es oxalato de calcio y un precipitado denso si es fosfato de calcio. Detección de Magnesio. Fundamento: El extracto ácido es convertido a alcalino por el NaOH y se forma el Mg(OH)2. El colorante azo es absorvido por el Mg(OH)2 en solución alcalina. La sensibilidad depende en gran medida de la concentración de iones OH y de cantidades grandes de NH4+ que impiden la precipitación del Mg(OH)2. Pequeñas cantidades de amonio no interfieren, siempre que se añadan cantidades suficientes de NaOH. Gran cantidad de calcio crea una coloración parecida, pero más clara. Reacción: Ext. Ácido + NaOH + p nitrobenceno azo resorcinol Mg(OH)2. Detección de Amonio. Fundamento: La determinación es por el reactivo de Nessler (solución alcalina de tetraiodomercuriato de potasio). Se produce un precipitado marrón o coloración marrón o amarilla de acuerdo con la cantidad de amoníaco o de iones de amonio presentes. El precipitado es un amino ioduro básico de mercurio. Reacción: NH4+ + 2[Hg I4]2= + 4OH HgO Hg(NH2) I + 7I + 3H2O Al extracto ácido o al polvo agregar 2 a 3 gotas de NaOH 25% y 2 a 3 gotas de reactivo de Nessler, obteniéndose como reacción positiva un precipitado naranja. RESULTADO DE LOS ANALISIS FORMA PROBABLE a) Amoniaco y oxalato Oxalato de amonio b) Ca, y CO2 Carbonato de calcio c) Ca, Oxalto y Amoniaco Oxalato de calcio y amonio d) Ca y Fosfato Oxalato de calcio e) Ca y Fosfato Fosfato de calcio f) Ca, Fósforo y oxalato Fosfato y oxalato de Calcio g) Ca, Fósforo y ácido úrico Fosfato de calcio y ácido úrico h) Ca, P, ácido úrico y amoniaco Fosfato de calcio y urato de amonio i) Fósforo y amoniaco, Ca y Mg Fosfato triple 5
6 j) Ac. Úrico sin amoniaco Acido úrico CÁLCULOS URINARIOS Gota Cistinuria Hiperparatiroidismo Deshidratación Isohidriuria Hepatopatías Factores geneticos, etc... Composición en: 1. Cálculos Simples : Solo presenta un compuesto urinario. 2. Cálculos mixtos : Estos contienen 2 o más componentes. 3. Cálculos formados por cuerpos extraños: Debido a cuerpos extraños en el organismo. Según su estructura en: 1. Concresionarios: Si alrededor del núcleo existen laminaciones concéntricas. 2. Sedimentarias : Si poseen varios núcleos unidos en forma desordenada. Cálculos de Calcio % Cálculos de estruvita % Cálculos de Acido Urico 5 8 % Cálculos de Cistina 0 1 % EXÁMEN FÍSICO 1. Se deben medir las dimensiones del cálculo. Los cálculos pequeños generalmente se ubican en el riñón o pelvis renal y los grandes en la vejiga. Se debe observar el color, forma, aspecto, peso y consistencia. Los cálculos de oxalato son: duros, irregulares, cristalinos o labrados en parte. Los cálculos de ácido úrico son: duros, y de color amarillo o rojo parduzco. Los cálculos de fosfato son: blandos y cereos al tacto. Romper el cálculo y buscar un cuerpo extraño que haya servido para su formación 6
7 Pulverizar finamente el cálculo. Una porción se calienta sobre una punta de una espátula de niquel o en asa de platino. Los cálculos orgánicos puros se queman completamente, sin producir llama: ácido úrico y uratos. Cistina: llama azul pálido. Si no se quema y deja un residuo blanco o grisáceo puede ser un cálculo de carbonato, oxalato o fosfato. EXÁMEN QUÍMICO. Detección de Carbonato Reacción: CO HCL CO2 + H2O + 2Cl= Detección de Uratos. Ox. Reacción: Ac. Úrico + Ac. Fosfotungstánico Alantoína + CO2 + Azul de tungstato Red. Detección de Fosfato. Reacción: PO4= + 3NH4 + 12MoO4H2 PO4(NH4)312MoO3 + 12H2O. Detección de Oxalato Reacción: Oxalato + HCL(1/3) + calor + Acetato de Na saturado Oxalato de calcio Detección de Calcio. Reacción: Ca + HCL + NaOH Oxalato de calcio + H2O. Detección de Magnesio. Reacción: Ext. Ácido + NaOH + p nitrobenceno azo resorcinol Mg(OH)2. Detección de Amonio. Reacción: NH4+ + 2[Hg I4]2= + 4OH HgO Hg(NH2) I + 7I + 3H2O RESULTADO DE LOS ANALISIS FORMA PROBABLE a) Amoniaco y oxalato Oxalato de amonio b) Ca, y CO2 Carbonato de calcio c) Ca, Oxalto y Amoniaco Oxalato de calcio y amonio d) Ca y Fosfato Oxalato de calcio e) Ca y Fosfato Fosfato de calcio 7
8 f) Ca, Fósforo y oxalato Fosfato y oxalato de Calcio g) Ca, Fósforo y ácido úrico Fosfato de calcio y ácido úrico h) Ca, P, ácido úrico y amoniaco Fosfato de calcio y urato de amonio i) Fósforo y amoniaco, Ca y Mg Fosfato triple j) Ac. Úrico sin amoniaco Acido úrico Difracción de Rayos X. Espectrofotometría Infraroja. DIFRACCIÓN DE RAYOS X La difracción de rayos X identifica constituyentes de un calculo por medio de patrones únicos en su genero, son como sus "huellas digitales", las que son generadas gracias a el bombardeo monocromatico de rayos X sobre el material cristalino. Los rayos X cuando viajan distancias intramoleculares, son difractados o reflejados, dando patrones característicos que dependeran de la estructura de los cristales. Las rayos X reflejados pueden usarse para producir un difractograma el que estara compuesto de picos o "máximos" registrados según vaya rotando el muestreo en una sucesión de ángulos. Esto permite identificar en forma definitiva una sustancia cristalina desconocida. La ventaja más importante de la difracción de rayos X es que permite identificar absolutamente casi todos los materiales y mezclas cristalinas. Cuando sustancias amorfas y cristalinas se mezclan, los otros métodos pueden confundir estos dos (como en el caso de cálculos de fosfátos) ; la difracción de rayos X identifica selectivamente los componentes cristalinos. Los componentes cristalinos comunes en calculos urinarios son todos fácilmente identificables y potencialmente medibles por este método. Cristales de apatita pueden ser identificadas pero comúnmente la difracción de rayos X es pobre en su detección, debido a que estos están en un estado microcristalino y dan débiles bandas anchas de difracción. La desventaja principal de difracción de rayos X es que es muy pobre su capacidad para identificar algunos metabolitos o materiales constituyentes amorfos presentes en cantidades únicas y mínimas. ESPECTROFOTOMETRIA INFRAROJA La espctrofotometria Infraroja es específica, rápida, y versátil, puede usarse con especímenes de diverso tamaño. usa como instrumento un espectrofotómetro el cual expone las moléculas de muestreo a la luz infrarroja. En la región infrarroja del espectro electromagnético la luz es absorbida como una onda vibratoria, la cual es desviada por los enlaces de grupos covalentes en los átomos, esto dependerá de la excitación de los mismos mediante longitudes de ondas determinadas. La mayoría de los sólidos orgánicos e inorgánicos tienen patrones de absorción que incluyen varios picos de absorbancia característicos a determinadas longitudes de onda, la que dependerá de los grupos funcionales particulares que constituyan la molécula. La correlación que se realiza entre los picos de absorbancia observados en las muestra problema con nuestros espectros de referencia son los que nos permiten identificar positivamente la(s) sustancia(s) en la muestra. La espectrofotometria infrarroja es bastante útil en la identificación de materiales no cristalinos y sustancias amorfas. Esto da una ventaja sobre la difracción de rayos X, que es útil primariamente para analizar compuestos cristalinos. Los compuestos como carbonatos de apatita o hidroxi apatita las que pueden dar líneas difusas, o un patrón muy débil cuando se emplea difracción de rayos X, este problema es superado al usarse espectrofotometría infrarroja, ya que pueden ser medidas e identificadas sin mayor problema. 8
9 Una aplicación bastante particular de este método es su uso en la identificación de drogas y metabolitos de los mismos en los cálculos urinarios por medio de susu picos de absorción característicos. Las drogas que se metabolizan parcialmente pueden ser identificadas positivamente, pero esto va a depender de los estudios analiticos, los antecedentes de drogadicción del paciente y la información farmacocinética de la droga que se posea. La espectrofotometría infrarroja resulta bastante útil en la identificación de muchos artefactos que aparecen en los cálculosi. Comúnmente, el análisis infrarrojo dará a conocer la naturaleza cierta de estos artefactos. Los otros artefactos que son fácilmente identificables por medio de la espectrofotometría infrarroja son cuarzo y Kaolin, ambos tienen un espectro muy característico. 9
XVII JORNADA DE FORMACIÓN INTERHOSPITALARIA DEL LABORATORIO CLÍNICO MÉTODOS DE IDENTIFICACIÓN DE LOS CÁLCULOS.
 XVII JORNADA DE FORMACIÓN INTERHOSPITALARIA DEL LABORATORIO CLÍNICO MÉTODOS DE IDENTIFICACIÓN DE LOS CÁLCULOS. C 20 de mayo de 2009 PABLO ARGÜELLES MENÉNDEZ NDEZ SERVICIO DE BIOQUÍMICA CLÍNICA HOSPITAL
XVII JORNADA DE FORMACIÓN INTERHOSPITALARIA DEL LABORATORIO CLÍNICO MÉTODOS DE IDENTIFICACIÓN DE LOS CÁLCULOS. C 20 de mayo de 2009 PABLO ARGÜELLES MENÉNDEZ NDEZ SERVICIO DE BIOQUÍMICA CLÍNICA HOSPITAL
REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDAR DE PROTEÍNA
 REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDAR DE PROTEÍNA OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo de micropipetas
REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDAR DE PROTEÍNA OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo de micropipetas
2º de Bachillerato EQUILIBRIOS DE SOLUBILIDAD
 º de Bachillerato EQUILIBRIOS DE SOLUBILIDAD Indice 1. Equilibrios heterogéneos.. Solubilidad. Reglas de solubilidad. 3. Reacciones de precipitación. 4. Producto de solubilidad. 5. Factores que modifican
º de Bachillerato EQUILIBRIOS DE SOLUBILIDAD Indice 1. Equilibrios heterogéneos.. Solubilidad. Reglas de solubilidad. 3. Reacciones de precipitación. 4. Producto de solubilidad. 5. Factores que modifican
El examen de orina efectuado en forma correcta brinda información sobre:
 El examen de orina efectuado en forma correcta brinda información sobre: Si la enfermedad renal existe o no. Si esta existe, puede aproximarse el diagnóstico acerca de la naturaleza de la misma. Permite
El examen de orina efectuado en forma correcta brinda información sobre: Si la enfermedad renal existe o no. Si esta existe, puede aproximarse el diagnóstico acerca de la naturaleza de la misma. Permite
LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO.
 LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO. Prácticamente todos los elementos conocidos, metales y no metales, reaccionan o son oxidados por el oxígeno formando
LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO. Prácticamente todos los elementos conocidos, metales y no metales, reaccionan o son oxidados por el oxígeno formando
PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO
 PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO COLECCIÓN PRIMERA. 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono,
PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO COLECCIÓN PRIMERA. 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono,
Química. Equilibrio ácido-base Nombre:
 Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
OBJETIVO: -Identificar aminoácidos y proteínas por medio de métodos basados en reacciones químicas.
 Química Biológica I TP : PROTEINAS Generalidades OBJETIVO: -Identificar aminoácidos y proteínas por medio de métodos basados en reacciones químicas. FUNDAMENTOS: Caracterización de las proteínas La caracterización
Química Biológica I TP : PROTEINAS Generalidades OBJETIVO: -Identificar aminoácidos y proteínas por medio de métodos basados en reacciones químicas. FUNDAMENTOS: Caracterización de las proteínas La caracterización
UROLITIASIS EN PERROS Y GATOS
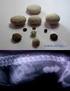 UROLITIASIS EN PERROS Y GATOS UROLITO Concreciones policristalinas que se componen principalmente de cristaloides orgánicos e inorgánicos (95%) y una matriz orgánica (5-10%) Núcleo central con laminaciones
UROLITIASIS EN PERROS Y GATOS UROLITO Concreciones policristalinas que se componen principalmente de cristaloides orgánicos e inorgánicos (95%) y una matriz orgánica (5-10%) Núcleo central con laminaciones
LABORATORIO GRUPO 16
 Química Inorgánica Laboratorio Grupo 16 1 LABORATORIO GRUPO 16 A) DESCOMPOSICIÓN DEL AGUA OXIGENADA Materiales: balanza granataria, tubos de ensayos,... Reactivos: agua oxigenada de 10 vol, dióxido de
Química Inorgánica Laboratorio Grupo 16 1 LABORATORIO GRUPO 16 A) DESCOMPOSICIÓN DEL AGUA OXIGENADA Materiales: balanza granataria, tubos de ensayos,... Reactivos: agua oxigenada de 10 vol, dióxido de
INTRODUCCIÓN: Las proteínas son precipitadas de sus soluciones por ciertos ácidos tales como Zn +++, Hg ++, Fe ++, Cu ++ y Pb ++.
 INTRODUCCIÓN: Las proteínas pueden formar soluciones estables debido a las cargas de hidratación de las moléculas de proteína y a las cargas eléctricas que ellas poseen. Las proteínas ligan agua por formación
INTRODUCCIÓN: Las proteínas pueden formar soluciones estables debido a las cargas de hidratación de las moléculas de proteína y a las cargas eléctricas que ellas poseen. Las proteínas ligan agua por formación
PRACTICA N 4 REACCIONES QUÍMICAS
 PRACTICA N 4 REACCIONES QUÍMICAS I. OBJETIVO GENERAL Adquirir las destrezas necesaria en la realización de reacciones químicas sencillas. II. OBJETIVOS ESPECÍFICOS Al finalizar la práctica el estudiante
PRACTICA N 4 REACCIONES QUÍMICAS I. OBJETIVO GENERAL Adquirir las destrezas necesaria en la realización de reacciones químicas sencillas. II. OBJETIVOS ESPECÍFICOS Al finalizar la práctica el estudiante
Ejercicios 2 (Estequiometría) 3) Calcule la masa, en gramos, de 0,433 mol de nitrato de calcio. R: 71,1 g Ca(NO 3 ) 2
 Profesor Bernardo Leal Química El Mol y número de Avogadro: Ejercicios 2 (Estequiometría) 1) Calcule el número de moles de glucosa (C 6 H 12 O 6 ) que hay en 5,38 g de esta sustancia R: 0,03 mol C 6 H
Profesor Bernardo Leal Química El Mol y número de Avogadro: Ejercicios 2 (Estequiometría) 1) Calcule el número de moles de glucosa (C 6 H 12 O 6 ) que hay en 5,38 g de esta sustancia R: 0,03 mol C 6 H
PRÁCTICA Nº 1. Determinación Volumétrica de Ácidos Mono y Polifuncionales Fuertes y Débiles. Nombre y apellido del alumno:
 PRÁCTICA Nº 1 Determinación Volumétrica de Ácidos Mono y Polifuncionales Fuertes y Débiles Nombre y apellido del alumno: Fecha: Grupo de práctica: Estandarización de la solución de NaOH Solución Concentración
PRÁCTICA Nº 1 Determinación Volumétrica de Ácidos Mono y Polifuncionales Fuertes y Débiles Nombre y apellido del alumno: Fecha: Grupo de práctica: Estandarización de la solución de NaOH Solución Concentración
Práctica 11 Equilibrios de Solubilidad
 UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA LABORATORIO DE QUÍMICA GENERAL II Grupo: Equipo: Nombre: Nombre: Nombre: Nombre: Nombre: 1 PROBLEMAS: Práctica 11 Equilibrios de Solubilidad
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA LABORATORIO DE QUÍMICA GENERAL II Grupo: Equipo: Nombre: Nombre: Nombre: Nombre: Nombre: 1 PROBLEMAS: Práctica 11 Equilibrios de Solubilidad
SAPONIFICACIÓN: SÍNTESIS DE JABÓN
 SAPONIFICACIÓN: SÍNTESIS DE JABÓN Objetivos: 1. Preparar jabón a partir de aceite vegetal 2. Observar las propiedades del jabón al someterlo a distintas pruebas. Introducción: Las propiedades de las grasas
SAPONIFICACIÓN: SÍNTESIS DE JABÓN Objetivos: 1. Preparar jabón a partir de aceite vegetal 2. Observar las propiedades del jabón al someterlo a distintas pruebas. Introducción: Las propiedades de las grasas
1. Se dispone de una disolución acuosa de ácido sulfúrico del 98% de riqueza en masa y densidad 1,84 g/ml.
 ESTEQUIOMETRÍA,DISOLUCIONES: ACTIVIDADES DE SELECTIVIDAD. 1. Se dispone de una disolución acuosa de ácido sulfúrico del 98% de riqueza en masa y densidad 1,84 g/ml. a) Qué volumen de esta disolución se
ESTEQUIOMETRÍA,DISOLUCIONES: ACTIVIDADES DE SELECTIVIDAD. 1. Se dispone de una disolución acuosa de ácido sulfúrico del 98% de riqueza en masa y densidad 1,84 g/ml. a) Qué volumen de esta disolución se
LEYES PONDERALES Y ESTEQUIOMETRIA- ESTEQUIOMETRIA (ejercicios)
 LEYES PONDERALES Y ESTEQUIOMETRIA- ESTEQUIOMETRIA (ejercicios) ESTEQUIOMETRIA DE REACCIONES Indicadores de Evaluación: Representan reacciones químicas en una ecuación de reactantes y productos. Formulan
LEYES PONDERALES Y ESTEQUIOMETRIA- ESTEQUIOMETRIA (ejercicios) ESTEQUIOMETRIA DE REACCIONES Indicadores de Evaluación: Representan reacciones químicas en una ecuación de reactantes y productos. Formulan
TRABAJO PRÁCTICO N 7 EQUILIBRIO QUÍMICO
 TRABAJO PRÁCTICO N 7 EQUILIBRIO QUÍMICO Algunos conceptos teóricos: Reacciones reversibles: Es probable que todas las reacciones químicas puedan producirse en ambos sentidos, pero en muchos casos la magnitud
TRABAJO PRÁCTICO N 7 EQUILIBRIO QUÍMICO Algunos conceptos teóricos: Reacciones reversibles: Es probable que todas las reacciones químicas puedan producirse en ambos sentidos, pero en muchos casos la magnitud
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
Materia: FÍSICA Y QUÍMICA 3º E.S.O Curso
 ACTIVIDADES FÍSICA Y QUÍMICA 3º ESO PROGRAMA DE REFUERZO. PRIMERA PARTE 1.-Calcular el tanto por ciento en peso y en volumen de una disolución que se prepara al disolver 40 ml de ácido nítrico cuya densidad
ACTIVIDADES FÍSICA Y QUÍMICA 3º ESO PROGRAMA DE REFUERZO. PRIMERA PARTE 1.-Calcular el tanto por ciento en peso y en volumen de una disolución que se prepara al disolver 40 ml de ácido nítrico cuya densidad
COLOR EN COMPUESTOS ORGÁNICOS: SÍNTESIS DE TINTES
 359 COLOR EN COMPUESTOS ORGÁNICOS: SÍNTESIS DE TINTES NH 3 - SO 3 1. Na 2 CO 3 (aq) 2. HCl / NaNO 2 Cl - N 2 SO 3 - Ph-NMe 2 Na - O 3 S N N NMe 2 4-[4-(Dimetilamino)fenilazo]benzene sulfonic acid, sodium
359 COLOR EN COMPUESTOS ORGÁNICOS: SÍNTESIS DE TINTES NH 3 - SO 3 1. Na 2 CO 3 (aq) 2. HCl / NaNO 2 Cl - N 2 SO 3 - Ph-NMe 2 Na - O 3 S N N NMe 2 4-[4-(Dimetilamino)fenilazo]benzene sulfonic acid, sodium
PRACTICA # 1 DETERMINACION DE FOSFORO OLSEL Y BRAY P-1
 PRACTICA # 1 DETERMINACION DE FOSFORO OLSEL Y BRAY P-1 INTRODUCCIÓN El fósforo es un elemento esencial para la vida. Las plantas lo necesitan para crecer y desarrollar su potencial genético. Lamentablemente,
PRACTICA # 1 DETERMINACION DE FOSFORO OLSEL Y BRAY P-1 INTRODUCCIÓN El fósforo es un elemento esencial para la vida. Las plantas lo necesitan para crecer y desarrollar su potencial genético. Lamentablemente,
SECRETARIA DE COMERCIO FOMENTO INDUSTRIAL NORMA MEXICANA NMX-F-320-S-1978 DETERMINACION DE FOSFATOS EN EMBUTIDOS
 SECRETARIA DE COMERCIO Y FOMENTO INDUSTRIAL NORMA MEXICANA NMX-F-320-S-1978 DETERMINACION DE FOSFATOS EN EMBUTIDOS DETERMINATION OF PHOSPHORUS IN SAUSAGES DIRECCION GENERAL DE NORMAS PREFACIO En la elaboración
SECRETARIA DE COMERCIO Y FOMENTO INDUSTRIAL NORMA MEXICANA NMX-F-320-S-1978 DETERMINACION DE FOSFATOS EN EMBUTIDOS DETERMINATION OF PHOSPHORUS IN SAUSAGES DIRECCION GENERAL DE NORMAS PREFACIO En la elaboración
Licenciatura en Ciencias Biológicas LABORATORIO Nº 3. Proteínas
 LABORATORIO Nº 3 OBJETIVOS * Reconocer los que tipos de aminoácidos están presentes en una proteína mediante reacciones específicas. * Comprobar los distintos factores que pueden desnaturalizar a una proteína.
LABORATORIO Nº 3 OBJETIVOS * Reconocer los que tipos de aminoácidos están presentes en una proteína mediante reacciones específicas. * Comprobar los distintos factores que pueden desnaturalizar a una proteína.
FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA BIORGÁNICA
 FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA BIORGÁNICA PRÁCTICA 3: PRUEBAS GENERALES PARA AMINOÁCIDOS Los aminoácidos constituyentes de las proteínas, contienen además
FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA BIORGÁNICA PRÁCTICA 3: PRUEBAS GENERALES PARA AMINOÁCIDOS Los aminoácidos constituyentes de las proteínas, contienen además
OBJETIVO: -Identificar aminoácidos y proteínas por medio de métodos basados en reacciones químicas.
 Trabajo Práctico 4: PROTEINAS: Generalidades OBJETIVO: -Identificar aminoácidos y proteínas por medio de métodos basados en reacciones químicas. FUNDAMENTOS: Caracterización de las proteínas La caracterización
Trabajo Práctico 4: PROTEINAS: Generalidades OBJETIVO: -Identificar aminoácidos y proteínas por medio de métodos basados en reacciones químicas. FUNDAMENTOS: Caracterización de las proteínas La caracterización
PRÁCTICAS DE EQUILIBRIO QUÍMICO
 PRÁCTICAS DE EQUILIBRIO QUÍMICO Le Chatelier PAU RESUELTOS Julio FG 2012 Para estudiar experimentalmente el equilibrio en disolución: Fe 3+ (ac) + 6 SCN - (ac) [Fe(SCN) 6 ] 3- (ac), se prepara una disolución
PRÁCTICAS DE EQUILIBRIO QUÍMICO Le Chatelier PAU RESUELTOS Julio FG 2012 Para estudiar experimentalmente el equilibrio en disolución: Fe 3+ (ac) + 6 SCN - (ac) [Fe(SCN) 6 ] 3- (ac), se prepara una disolución
OBJETIVOS. b) Comprender las caracterizaciones de una mezcla compleja de iones en solución
 OBJETIVOS a) Comprender las marchas analíticas b) Comprender las caracterizaciones de una mezcla compleja de iones en solución c) Saber como tratar las muestras con reactivos que separen los iones en grupos,
OBJETIVOS a) Comprender las marchas analíticas b) Comprender las caracterizaciones de una mezcla compleja de iones en solución c) Saber como tratar las muestras con reactivos que separen los iones en grupos,
PRACTICA DE LABORATORIO SEMANA 19 y 20 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES Elaborado por: Licda. Lilian Judith Guzmán Melgar
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MEDICAS-CUM UNIDAD DIDACTICA QUIMICA, PRIMER AÑO PRACTICA DE LABORATORIO 2016 SEMANA 19 y 20 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MEDICAS-CUM UNIDAD DIDACTICA QUIMICA, PRIMER AÑO PRACTICA DE LABORATORIO 2016 SEMANA 19 y 20 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES
Trabajo Práctico N 3. Reconocimiento de sustancias ácidas, básicas y neutras. mediante el empleo de indicadores químicos.
 Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
ESPECTROSCOPIA UV-VISIBLE
 ESPECTROSCOPIA UV-VISIBLE FUNDAMENTOS INSTRUMENTACION FUNCIONAMIENTO APLICACIONES FUNDAMENTOS La espectroscopia UV-Vis está basada en el proceso de absorción de la radiación ultravioleta-visible (radiación
ESPECTROSCOPIA UV-VISIBLE FUNDAMENTOS INSTRUMENTACION FUNCIONAMIENTO APLICACIONES FUNDAMENTOS La espectroscopia UV-Vis está basada en el proceso de absorción de la radiación ultravioleta-visible (radiación
Lo que hay que saber sobre la urolitiasis canina
 24.nutrición Lo que hay que saber sobre la urolitiasis canina Mª Elena Fernández Comunicación Científica Royal Canin Ibérica, S.A. El AV muchas veces tiene que responder múltiples cuestiones que le plantea
24.nutrición Lo que hay que saber sobre la urolitiasis canina Mª Elena Fernández Comunicación Científica Royal Canin Ibérica, S.A. El AV muchas veces tiene que responder múltiples cuestiones que le plantea
8/12/2014. Examinar y clasificar una serie de reacciones como: Precipitación Neutralización {ácido-base} Oxidación-reducción Complejación.
 Cambios Químicos Química General Laboratorio I QUIM 3003 Ileana Nieves Martínez http://quimicacem.blogspot.com/2009/04/los-cambiosquimicos-y-fisicos.html Objetivos Examinar y clasificar una serie de reacciones
Cambios Químicos Química General Laboratorio I QUIM 3003 Ileana Nieves Martínez http://quimicacem.blogspot.com/2009/04/los-cambiosquimicos-y-fisicos.html Objetivos Examinar y clasificar una serie de reacciones
Determinación de Dureza Total en aguas naturales y residuales
 QUÍMICA ANALITICA APLICADA INORGÁNICA QMC 613 Determinación de Dureza Total en aguas naturales y residuales Procedimiento Operativo Estándar Lic. Luis Fernando Cáceres Choque 29/09/2013 Método Titulométrico
QUÍMICA ANALITICA APLICADA INORGÁNICA QMC 613 Determinación de Dureza Total en aguas naturales y residuales Procedimiento Operativo Estándar Lic. Luis Fernando Cáceres Choque 29/09/2013 Método Titulométrico
ÁCIDO BASE. Julio 2017; Opción B; Cuestión 3 a.- b.- c.- d.- Datos.- Julio 2017; Opción A; Problema 4 a M b % Datos.
 ÁCIDO BASE. Julio 2017; Opción B; Cuestión 3 Justifique si las siguientes afirmaciones son verdaderas o falsas: a.- La mezcla de 10 ml de HCl 0,1 M con 20 ml de NaOH 0,1 M será una disolución neutra. F
ÁCIDO BASE. Julio 2017; Opción B; Cuestión 3 Justifique si las siguientes afirmaciones son verdaderas o falsas: a.- La mezcla de 10 ml de HCl 0,1 M con 20 ml de NaOH 0,1 M será una disolución neutra. F
Página 1
 TEMA 5. CINÉTICA QUÍMICA Y EQUILIBRIO QUÍMICO 6.2) A una hipotética reacción química A + B C le corresponde la siguiente ecuación de velocidad: v = k [A] [B]. Indique: a) El orden de la reacción respecto
TEMA 5. CINÉTICA QUÍMICA Y EQUILIBRIO QUÍMICO 6.2) A una hipotética reacción química A + B C le corresponde la siguiente ecuación de velocidad: v = k [A] [B]. Indique: a) El orden de la reacción respecto
DETERMINACIONES ESPECTROFOTOMETRICAS EN ALIMENTOS. Carotenoides totales y nitritos.
 1 PRACTICA Nº 5 DETERMINACIONES ESPECTROFOTOMETRICAS EN ALIMENTOS. Carotenoides totales y nitritos. I. INTRODUCCIÓN: En espectrofotometría se usa como fuente luminosa la luz blanca natural o artificial
1 PRACTICA Nº 5 DETERMINACIONES ESPECTROFOTOMETRICAS EN ALIMENTOS. Carotenoides totales y nitritos. I. INTRODUCCIÓN: En espectrofotometría se usa como fuente luminosa la luz blanca natural o artificial
ALIMENTO ORGANICA SOLUBLE EN DISOLVENTES ORGANICOS (GRASA O LIPIDOS) CON NITROGENO (PROTEINAS) NO GRASO SIN NITROGENO (CARBOHIDRATOS)
 ALIMENTO VOLATIL POR SECADO (HUMEDAD) MATERIA SECA ORGANICA INORGANICA (CENIZAS) SOLUBLE EN DISOLVENTES ORGANICOS (GRASA O LIPIDOS) CON NITROGENO (PROTEINAS) NO GRASO SIN NITROGENO (CARBOHIDRATOS) DIGERIBLES
ALIMENTO VOLATIL POR SECADO (HUMEDAD) MATERIA SECA ORGANICA INORGANICA (CENIZAS) SOLUBLE EN DISOLVENTES ORGANICOS (GRASA O LIPIDOS) CON NITROGENO (PROTEINAS) NO GRASO SIN NITROGENO (CARBOHIDRATOS) DIGERIBLES
Cómo y por qué se forman los cálculos
 Conocer el problema 9 Se llama litiasis renal a la presencia de cálculos (también denominados litos) en alguna parte de la vía urinaria. Los cálculos son pequeñas piedras formadas por diferentes sustancias,
Conocer el problema 9 Se llama litiasis renal a la presencia de cálculos (también denominados litos) en alguna parte de la vía urinaria. Los cálculos son pequeñas piedras formadas por diferentes sustancias,
SECRETARIA DE COMERCIO FOMENTO INDUSTRIAL NORMA MEXICANA NMX-K DETERMINACION DE ORTOFOSFATOS EN AGUAS PARA CALDERAS
 SECRETARIA DE COMERCIO Y FOMENTO INDUSTRIAL NORMA MEXICANA NMX-K-450-1978 DETERMINACION DE ORTOFOSFATOS EN AGUAS PARA CALDERAS WATER FOR BOILERS DETERMINATION OF ARTHO PHOSPHATES DIRECCION GENERAL DE NORMAS
SECRETARIA DE COMERCIO Y FOMENTO INDUSTRIAL NORMA MEXICANA NMX-K-450-1978 DETERMINACION DE ORTOFOSFATOS EN AGUAS PARA CALDERAS WATER FOR BOILERS DETERMINATION OF ARTHO PHOSPHATES DIRECCION GENERAL DE NORMAS
HCl. NaCl + CO. AgCl + NaNO. Al SO + H H SO. CaO + CO. Na2CO. ZnSO. Hg + CuCl. MgO ZnCl. REACCIONES QUíMICAS
 Dadas las siguientes reacciones químicas, contesta: Qué sustancias son reactivos? Cuáles son productos?. Ajústalas a) H + Cl HCl b) CH5OH + O c) HCl + NaHCO NaCl + CO d) NaCl + AgNO AgCl + NaNO e) CO +
Dadas las siguientes reacciones químicas, contesta: Qué sustancias son reactivos? Cuáles son productos?. Ajústalas a) H + Cl HCl b) CH5OH + O c) HCl + NaHCO NaCl + CO d) NaCl + AgNO AgCl + NaNO e) CO +
UNIVERSIDAD NACIONAL DE COLOMBIA QUÍMICA BÁSICA TALLER 2
 UNIVERSIDAD NACIONAL DE COLOMBIA QUÍMICA BÁSICA TALLER 2 1. Cuando el benceno (C 6 H 6 ) reacciona con bromo (Br 2 ), se obtiene bromobenceno (C 6 H 5 Br): C 6 H 6 + Br 2 C 6 H 5 Br + HBr El rendimiento
UNIVERSIDAD NACIONAL DE COLOMBIA QUÍMICA BÁSICA TALLER 2 1. Cuando el benceno (C 6 H 6 ) reacciona con bromo (Br 2 ), se obtiene bromobenceno (C 6 H 5 Br): C 6 H 6 + Br 2 C 6 H 5 Br + HBr El rendimiento
COMPOSICIÓN DE LOS SERES VIVOS
 COMPOSICIÓN DE LOS SERES VIVOS SERES VIVOS: Un ser vivo es un organismo que nace, crece, se reproduce y muere. CONSTITUIDOS POR BIOELEMENTOS BIOMOLECULAS PRIMARIOS SECUNDARIOS ORGANICOS INORGANICOS CARBONO
COMPOSICIÓN DE LOS SERES VIVOS SERES VIVOS: Un ser vivo es un organismo que nace, crece, se reproduce y muere. CONSTITUIDOS POR BIOELEMENTOS BIOMOLECULAS PRIMARIOS SECUNDARIOS ORGANICOS INORGANICOS CARBONO
Reacciones de precipitación
 Reacciones de precipitación Criterios de evaluación Aplicar el concepto de equilibrio químico para predecir la evolución de un sistema y resolver problemas de equilibrios homogéneos, en particular en reacciones
Reacciones de precipitación Criterios de evaluación Aplicar el concepto de equilibrio químico para predecir la evolución de un sistema y resolver problemas de equilibrios homogéneos, en particular en reacciones
ANÁLISIS CUALITATIVO DE CATIONES Y ANIONES
 VII 1 PRÁCTICA 7 ANÁLISIS CUALITATIVO DE CATIONES Y ANIONES FORMACIÓN DE PRECIPITADOS Y DISOLUCIÓN DE LOS MISMOS POR FORMACIÓN DE COMPLEJOS FUNDAMENTO DE LA PRÁCTICA En esta práctica llevaremos a cabo
VII 1 PRÁCTICA 7 ANÁLISIS CUALITATIVO DE CATIONES Y ANIONES FORMACIÓN DE PRECIPITADOS Y DISOLUCIÓN DE LOS MISMOS POR FORMACIÓN DE COMPLEJOS FUNDAMENTO DE LA PRÁCTICA En esta práctica llevaremos a cabo
Clase 3. Composición química de la célula
 Clase 3. Composición química de la célula 1. Introducción: Los seres vivos siguen las mismas leyes físicas y químicas que el resto de la naturaleza. 2. Del átomo a la célula: Elementos de la célula 3.
Clase 3. Composición química de la célula 1. Introducción: Los seres vivos siguen las mismas leyes físicas y químicas que el resto de la naturaleza. 2. Del átomo a la célula: Elementos de la célula 3.
PRÁCTICA No. 5 BASE QUIMICA DE LA VIDA
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA ESCUELA DE FORMACION DE PROFESORES DE ENSEÑANZA MEDIA-EFPEM- CURSO: BIOLOGÍA I I. INTRODUCCIÓN PRÁCTICA No. 5 BASE QUIMICA DE LA VIDA Los organismos vivos estamos
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA ESCUELA DE FORMACION DE PROFESORES DE ENSEÑANZA MEDIA-EFPEM- CURSO: BIOLOGÍA I I. INTRODUCCIÓN PRÁCTICA No. 5 BASE QUIMICA DE LA VIDA Los organismos vivos estamos
REACCIONES DE QUÍMICA INORGÁNICA. RENDIMIENTO Y RIQUEZA.
 PROBLEMAS ESTEQUIOMETRÍA 1º BACH. REACCIONES DE QUÍMICA INORGÁNICA. RENDIMIENTO Y RIQUEZA. 1. El cloruro amónico con hidróxido de calcio produce al reaccionar cloruro de calcio, amoníaco y agua. Si el
PROBLEMAS ESTEQUIOMETRÍA 1º BACH. REACCIONES DE QUÍMICA INORGÁNICA. RENDIMIENTO Y RIQUEZA. 1. El cloruro amónico con hidróxido de calcio produce al reaccionar cloruro de calcio, amoníaco y agua. Si el
Revista de Química. Vol. VII. Nº 2. Diciembre de 1993 OBTENCION DEL OXIDO DE MAGNESIO A PARTIR DE LA DOLOMITA RESUMEN
 Revista de Química. Vol. VII. Nº 2. Diciembre de 1993 OBTENCION DEL OXIDO DE MAGNESIO A PARTIR DE LA DOLOMITA Juan Huamayalli L. y Rómulo Ochoa L.* RESUMEN El presente trabajo de investigación muestra
Revista de Química. Vol. VII. Nº 2. Diciembre de 1993 OBTENCION DEL OXIDO DE MAGNESIO A PARTIR DE LA DOLOMITA Juan Huamayalli L. y Rómulo Ochoa L.* RESUMEN El presente trabajo de investigación muestra
Práctica 13. Equilibrios de solubilidad
 Práctica 13. Equilibrios de solubilidad ELABORADO POR: LAURA GASQUE SILVA ENUNCIADO A RESPONDER AL FINAL DE LA PRÁCTICA En sales poco solubles cuando el valor de (K ps /pk ps ), se (incrementa/disminuye),
Práctica 13. Equilibrios de solubilidad ELABORADO POR: LAURA GASQUE SILVA ENUNCIADO A RESPONDER AL FINAL DE LA PRÁCTICA En sales poco solubles cuando el valor de (K ps /pk ps ), se (incrementa/disminuye),
LABORATORIO QUÍMICA GENERAL GUIA 8-1. Equilibrio iónico y PH. FeSCN +2
 LABORATORIO QUÍMICA GENERAL 502501 GUIA 8-1. Equilibrio iónico y PH I. El Problema: - Estudiar el efecto de la temperatura sobre el equilibrio químico del siguiente sistema 2+ Co(H 2 O) 6 (ac) + 4Cl (ac)
LABORATORIO QUÍMICA GENERAL 502501 GUIA 8-1. Equilibrio iónico y PH I. El Problema: - Estudiar el efecto de la temperatura sobre el equilibrio químico del siguiente sistema 2+ Co(H 2 O) 6 (ac) + 4Cl (ac)
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 4, Opción
JUNIO FASE GENERAL QUÍMICA. OPCIÓN A
 JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
TEMA 5. Elementos y compuestos 1 CLASIFICACIÓN DE LOS ELEMENTOS
 TEMA 5 Elementos y compuestos 1 CLASIFICACIÓN DE LOS ELEMENTOS La primera clasificación de los elementos fue la que distinguió entre metales y no metales y se basaba en el aspecto que presentaban los elementos
TEMA 5 Elementos y compuestos 1 CLASIFICACIÓN DE LOS ELEMENTOS La primera clasificación de los elementos fue la que distinguió entre metales y no metales y se basaba en el aspecto que presentaban los elementos
EQUILIBRIO QUÍMICO. Cynthia Fernandez
 EQUILIBRIO QUÍMICO Cynthia Fernandez cyntuche@hotmail.com PRIMERA PARTE Experiencia 1 La solución de K 2Cr 2O 4 es de color amarillo. Al agregar unas gotas de H 2SO 4, la solución se tornó de color naranja.
EQUILIBRIO QUÍMICO Cynthia Fernandez cyntuche@hotmail.com PRIMERA PARTE Experiencia 1 La solución de K 2Cr 2O 4 es de color amarillo. Al agregar unas gotas de H 2SO 4, la solución se tornó de color naranja.
SOLUCIONES BUFFERS. pk = valor de ph en el cual las concentraciones del ácido y la sal son iguales
 SOLUCIONES BUFFERS Constituidas por un ácido débil y su base conjugada (sal) permite la adición de ácido o base sin variar considerablemente el ph. La capacidad búffer es máximo una unidad por encima y
SOLUCIONES BUFFERS Constituidas por un ácido débil y su base conjugada (sal) permite la adición de ácido o base sin variar considerablemente el ph. La capacidad búffer es máximo una unidad por encima y
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 4, Opción
Urolitiasis y su manejo nutricional en el perro
 20.nutrición Urolitiasis y su manejo nutricional en el perro Gemma Baciero Comunicación Científica Royal Canin Ibérica, S.A. Las urolitiasis o cálculos urinarios constituyen un motivo de visita al veterinario
20.nutrición Urolitiasis y su manejo nutricional en el perro Gemma Baciero Comunicación Científica Royal Canin Ibérica, S.A. Las urolitiasis o cálculos urinarios constituyen un motivo de visita al veterinario
Un equilibrio heterogéneo muy especial: Equilibrio de Precipitación
 Un equilibrio heterogéneo muy especial: Equilibrio de Precipitación Los equilibrios heterogéneos son aquellos en los cuales los reactivos y productos se presentan en distintos estados de agregación (sólido,
Un equilibrio heterogéneo muy especial: Equilibrio de Precipitación Los equilibrios heterogéneos son aquellos en los cuales los reactivos y productos se presentan en distintos estados de agregación (sólido,
Universidad Central de Venezuela Facultad de Ciencias Escuela de Química Unidad Docente de Principios de Química Principios de Química I
 Tema II: Átomos, iones y moléculas. 1) Complete la siguiente tabla: Universidad Central de Venezuela Facultad de Ciencias Escuela de Química Unidad Docente de Principios de Química Principios de Química
Tema II: Átomos, iones y moléculas. 1) Complete la siguiente tabla: Universidad Central de Venezuela Facultad de Ciencias Escuela de Química Unidad Docente de Principios de Química Principios de Química
INTRODUCCION AL EQUILIBRIO PRECIPITACIÓN - SOLUBILIZACIÓN
 INTRODUCCION AL EQUILIBRIO PRECIPITACIÓN - SOLUBILIZACIÓN Lo básico que debes saber de Química General 14-1 LA SOLUBILIDAD DE ELECTROLITOS FUERTES POCO SOLUBLES Compuesto Solubilidad Electrolito NaCl BaSO
INTRODUCCION AL EQUILIBRIO PRECIPITACIÓN - SOLUBILIZACIÓN Lo básico que debes saber de Química General 14-1 LA SOLUBILIDAD DE ELECTROLITOS FUERTES POCO SOLUBLES Compuesto Solubilidad Electrolito NaCl BaSO
Trabajo Práctico Nº 1 Ensayos a la llama
 Trabajo Práctico Nº 1 Ensayos a la llama Introducción En el ensayo a la llama se somete una muestra a la acción del calor y se observa principalmente los diferentes colores obtenidos, que dependen de los
Trabajo Práctico Nº 1 Ensayos a la llama Introducción En el ensayo a la llama se somete una muestra a la acción del calor y se observa principalmente los diferentes colores obtenidos, que dependen de los
Problemas del Tema 1. Estequiometria
 Problemas del Tema 1. Estequiometria Esta guía práctica es un material didáctico en construcción, destinada para estudiantes de la asignatura de Química General de la Facultad de Farmacia y Bioanálisis.
Problemas del Tema 1. Estequiometria Esta guía práctica es un material didáctico en construcción, destinada para estudiantes de la asignatura de Química General de la Facultad de Farmacia y Bioanálisis.
Contenidos. 1. Repaso 2. Reacciones de hidrólisis de sales (estudio cualitativo).
 Ácido-Base II 1 2 Contenidos 1. Repaso 2. Reacciones de hidrólisis de sales (estudio cualitativo). a) Sales procedentes de ácido fuerte y base débil. b) Sales procedentes de ácido débil y base fuerte.
Ácido-Base II 1 2 Contenidos 1. Repaso 2. Reacciones de hidrólisis de sales (estudio cualitativo). a) Sales procedentes de ácido fuerte y base débil. b) Sales procedentes de ácido débil y base fuerte.
Práctica 4 y 5: Propiedades periódicas
 Equipo: Nombre: Nombre: Nombre: Práctica 4 y 5: Propiedades periódicas Problema 1 Qué comportamiento ácido-base presentan en disolución acuosa los óxidos de litio, sodio, potasio, magnesio, calcio, silicio,
Equipo: Nombre: Nombre: Nombre: Práctica 4 y 5: Propiedades periódicas Problema 1 Qué comportamiento ácido-base presentan en disolución acuosa los óxidos de litio, sodio, potasio, magnesio, calcio, silicio,
Equilibrios de solubilidad. 2 Fe (ac) 3 CO (ac) Fe CO (s)
 IES a Magdalena. Avilés. Asturias Se dice que aparece un precipitado cuando en una disolución acuosa, y como consecuencia de una reacción química, se forma un compuesto sólido insoluble. En la imagen de
IES a Magdalena. Avilés. Asturias Se dice que aparece un precipitado cuando en una disolución acuosa, y como consecuencia de una reacción química, se forma un compuesto sólido insoluble. En la imagen de
Equilibrios de solubilidad. 2 Fe (ac) 3 CO (ac) Fe CO (s)
 IES a Magdalena. Avilés. Asturias Se dice que aparece un precipitado cuando en una disolución acuosa, y como consecuencia de una reacción química, se forma un compuesto sólido insoluble. En la imagen de
IES a Magdalena. Avilés. Asturias Se dice que aparece un precipitado cuando en una disolución acuosa, y como consecuencia de una reacción química, se forma un compuesto sólido insoluble. En la imagen de
REACCIONES REDOX CON DICROMATO POTÁSICO
 REACCIONES REDOX CON DICROMATO POTÁSICO Se han comenzado los trabajos de Química a la gota con las reacciones redox del permanganato potásico, un oxidante característico y visualmente muy interesante por
REACCIONES REDOX CON DICROMATO POTÁSICO Se han comenzado los trabajos de Química a la gota con las reacciones redox del permanganato potásico, un oxidante característico y visualmente muy interesante por
Práctica 7. La reacción química (Parte I)
 Práctica 7. La reacción química (Parte I) PREGUNTAS A RESPONDER AL FINAL DE LA SESIÓN Revisaron: M. en C. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar QFB. Fabiola González Olguín Define
Práctica 7. La reacción química (Parte I) PREGUNTAS A RESPONDER AL FINAL DE LA SESIÓN Revisaron: M. en C. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar QFB. Fabiola González Olguín Define
MANUAL VETERINARIO - SUIZA VET
 43 Prueba Tipo de Muestra Vol. Rango de Normalidad / Interpretación URIANALISIS COMPLETO ORINA RECIENTE Refrig. 3-6º C FO 10 ml. DETERMINACION DE ELEMENTOS ANORMALES: DENSIDAD: PH: Perro: Gato: Carnívoros:
43 Prueba Tipo de Muestra Vol. Rango de Normalidad / Interpretación URIANALISIS COMPLETO ORINA RECIENTE Refrig. 3-6º C FO 10 ml. DETERMINACION DE ELEMENTOS ANORMALES: DENSIDAD: PH: Perro: Gato: Carnívoros:
COLECCIÓN DE PROBLEMAS TEMA 0 QUÍMICA 2º BACHILLERATO. SANTILLANA. Dónde habrá mayor número de átomos, en 1 mol de metanol o en 1 mol
 COLECCIÓN DE PROBLEMAS TEMA 0 QUÍMICA 2º BACHILLERATO. SANTILLANA. Dónde habrá mayor número de átomos, en 1 mol de metanol o en 1 mol de ácido metanoico (ácido fórmico)? Si tenemos en cuenta las fórmulas
COLECCIÓN DE PROBLEMAS TEMA 0 QUÍMICA 2º BACHILLERATO. SANTILLANA. Dónde habrá mayor número de átomos, en 1 mol de metanol o en 1 mol de ácido metanoico (ácido fórmico)? Si tenemos en cuenta las fórmulas
Complejos del Co (continuación)
 Complejos del Co (continuación) Los compuestos de coordinación del cobalto(iii), que fueron los primeros estudiados, son difíciles de obtener, puesto que son menos estables que los de Co(II) vistos con
Complejos del Co (continuación) Los compuestos de coordinación del cobalto(iii), que fueron los primeros estudiados, son difíciles de obtener, puesto que son menos estables que los de Co(II) vistos con
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
PRÁCTICA Nº 6 EQUILIBRIO QUÍMICO
 PRÁCTICA Nº 6 EQUILIBRIO QUÍMICO OBJETIVOS Comprobar la perturbación en un sistema en equilibrio de complejos de cobalto (II), cuando se modifican la concentración de las sustancias implicadas y la temperatura.
PRÁCTICA Nº 6 EQUILIBRIO QUÍMICO OBJETIVOS Comprobar la perturbación en un sistema en equilibrio de complejos de cobalto (II), cuando se modifican la concentración de las sustancias implicadas y la temperatura.
1- Calcula la masa de los siguientes átomos: Al; Mg; Ca; N y F. 4 - Expresa en moles: 4,5 g de agua; 0,3 g de hidrógeno; 440 g de dióxido de carbono
 ÁTOMOS, MOLÉCULAS Y MOLES 1- Calcula la masa de los siguientes átomos: Al; Mg; Ca; N y F 2- Calcula la masa de las siguientes moléculas: HNO 3 ; PH 3 ; Cl 2 O; N 2 O 5 y CCl 4 3 - Cuantos moles de oxígeno
ÁTOMOS, MOLÉCULAS Y MOLES 1- Calcula la masa de los siguientes átomos: Al; Mg; Ca; N y F 2- Calcula la masa de las siguientes moléculas: HNO 3 ; PH 3 ; Cl 2 O; N 2 O 5 y CCl 4 3 - Cuantos moles de oxígeno
Dr. José R. Chirinos C. Centro de Química Analítica
 Análisis Gravimétrico Dr. José R. Chirinos C. Centro de Química Analítica Análisis gravimétrico Conceptos importantes Análisis gravimétrico: Implica la determinación del peso de una sustancia producida
Análisis Gravimétrico Dr. José R. Chirinos C. Centro de Química Analítica Análisis gravimétrico Conceptos importantes Análisis gravimétrico: Implica la determinación del peso de una sustancia producida
Práctica 4. Propiedades de algunos elementos y sus óxidos (Parte I)
 Práctica 4. Propiedades de algunos elementos y sus óxidos (Parte I) Revisaron: M. en C. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA De
Práctica 4. Propiedades de algunos elementos y sus óxidos (Parte I) Revisaron: M. en C. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA De
montagepages.fuselabs.com
 Las reacciones o cambios químicos que sufren las materiales ocurren en la vida diaria o pueden provocarse en el laboratorio; como la fermentación, la oxidación, las combustiones espontáneas, son ejemplos
Las reacciones o cambios químicos que sufren las materiales ocurren en la vida diaria o pueden provocarse en el laboratorio; como la fermentación, la oxidación, las combustiones espontáneas, son ejemplos
MARCHAS ANALÍTICAS 1 INTRODUCCIÓN 2 CONCEPTOS FUNDAMENTALES
 MARCHAS ANALÍTICAS 1 INTRODUCCIÓN Se puede definir la Química Analítica como una ciencia de medición basada en un conjunto de ideas y métodos útiles en todos los campos de la ciencia. La Química Analítica
MARCHAS ANALÍTICAS 1 INTRODUCCIÓN Se puede definir la Química Analítica como una ciencia de medición basada en un conjunto de ideas y métodos útiles en todos los campos de la ciencia. La Química Analítica
PRÁCTICA 18 EQUILIBRIOS DE SOLUBILIDAD. ESTIMACIÓN DEL PRODUCTO DE SOLUBILIDAD DEL HIDRÓXIDO DE ZINC.
 PRÁCTICA 18 EQUILIBRIOS DE SOLUBILIDAD. ESTIMACIÓN DEL PRODUCTO DE SOLUBILIDAD DEL HIDRÓXIDO DE ZINC. OBJETIVOS Determinar experimentalmente si se forma o no un determinado compuesto insoluble. Determinar
PRÁCTICA 18 EQUILIBRIOS DE SOLUBILIDAD. ESTIMACIÓN DEL PRODUCTO DE SOLUBILIDAD DEL HIDRÓXIDO DE ZINC. OBJETIVOS Determinar experimentalmente si se forma o no un determinado compuesto insoluble. Determinar
1.1 Acción del ácido TricloroAcético a baja temperatura
 LABORATORIO N 7 IDENTIFICACION DE CARBOHIDRATOS, LIPIDOS Y PROTEINAS EN ALGUNOS TEJIDOS ANIMALES Fraccionamiento de tejidos en sus principales constituyentes Carbohidratos, Lípidos y proteínas OBJETIVOS
LABORATORIO N 7 IDENTIFICACION DE CARBOHIDRATOS, LIPIDOS Y PROTEINAS EN ALGUNOS TEJIDOS ANIMALES Fraccionamiento de tejidos en sus principales constituyentes Carbohidratos, Lípidos y proteínas OBJETIVOS
Conceptos básicos en estequiometría
 Conceptos básicos en estequiometría Tomado de: http://www.eis.uva.es/~qgintro/esteq/tutorial-01.html El Mol Un mol se define como la cantidad de materia que tiene tantos objetos como el número de átomos
Conceptos básicos en estequiometría Tomado de: http://www.eis.uva.es/~qgintro/esteq/tutorial-01.html El Mol Un mol se define como la cantidad de materia que tiene tantos objetos como el número de átomos
Manual de Laboratorio de Química Analítica
 PRÁCTICA 3: IDENTIFICACIÓN DE UNA MUESTRA SÓLIDA DESCONOCIDA La muestra consistirá en una sal, en estado sólido, formada por un catión y un anión. Es necesario identificar ambos iones para reportar la
PRÁCTICA 3: IDENTIFICACIÓN DE UNA MUESTRA SÓLIDA DESCONOCIDA La muestra consistirá en una sal, en estado sólido, formada por un catión y un anión. Es necesario identificar ambos iones para reportar la
Fenilbutazona. Este principio activo se encuentra en las siguientes formas farmacéuticas comerciales:
 Fenilbutazona Nombre Químico: 4-Butil-1,2-difenil-3,5-pirazolidinadiona La fenilbutazona es una de las drogas antiinflamatorias no esteroideas (AINE) más antiguas después del ácido acetil salicilico, comenzó
Fenilbutazona Nombre Químico: 4-Butil-1,2-difenil-3,5-pirazolidinadiona La fenilbutazona es una de las drogas antiinflamatorias no esteroideas (AINE) más antiguas después del ácido acetil salicilico, comenzó
OBTENCIÓN DE NaHCO 3 (P 4)
 OBTENCIÓN DE NaHCO 3 (P 4) Objetivos - Estudio descriptivo del NaHCO 3, y de sus usos industriales - Adquisición de conocimiento básicos sobre generación química de gases en el laboratorio - Realización
OBTENCIÓN DE NaHCO 3 (P 4) Objetivos - Estudio descriptivo del NaHCO 3, y de sus usos industriales - Adquisición de conocimiento básicos sobre generación química de gases en el laboratorio - Realización
Enlace químico Educación Secundaria Obligatoria Física y Química
 EL ENLACE QUÍMICO Hay tres maneras en que se unen los átomos: enlace iónico, enlace covalente y enlace metálico. Los enlaces entre átomos se producen porque éstos quieren cumplir la regla del octeto. La
EL ENLACE QUÍMICO Hay tres maneras en que se unen los átomos: enlace iónico, enlace covalente y enlace metálico. Los enlaces entre átomos se producen porque éstos quieren cumplir la regla del octeto. La
Practica No7 La reacción química (primera parte)
 Practica No7 La reacción química (primera parte) Objetivo Identificar los productos de las reacciones involucradas. Escribir de manera correcta un proceso que involucra una reacción química. Clasificar
Practica No7 La reacción química (primera parte) Objetivo Identificar los productos de las reacciones involucradas. Escribir de manera correcta un proceso que involucra una reacción química. Clasificar
DIFERENCIA ENTRE COMPUESTOS ORGÁNICOS E INORGÁNICOS
 DIFERENCIA ENTRE COMPUESTOS ORGÁNICOS E INORGÁNICOS 1. Objetivos Demostrar experimentalmente algunas de las diferencias entre los compuestos orgánicos e inorgánicos. 2. Fundamento teórico Entre las diferencias
DIFERENCIA ENTRE COMPUESTOS ORGÁNICOS E INORGÁNICOS 1. Objetivos Demostrar experimentalmente algunas de las diferencias entre los compuestos orgánicos e inorgánicos. 2. Fundamento teórico Entre las diferencias
Estudia un día en la U.M.H.
 Estudia un día en la U.M.H. Buscando respuestas, resolviendo enigmas cuáles son las leyes que rigen los cambios de la Naturaleza? La Química en acción II Acerca del calor y del color: cambios que acompañan
Estudia un día en la U.M.H. Buscando respuestas, resolviendo enigmas cuáles son las leyes que rigen los cambios de la Naturaleza? La Química en acción II Acerca del calor y del color: cambios que acompañan
Práctica 4 y 5: Propiedades periódicas
 Equipo: Nombre: Nombre: Nombre: Práctica 4 y 5: Propiedades periódicas PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA Clasificar los elementos utilizados durante la práctica. Cuáles son metales y cuáles
Equipo: Nombre: Nombre: Nombre: Práctica 4 y 5: Propiedades periódicas PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA Clasificar los elementos utilizados durante la práctica. Cuáles son metales y cuáles
FACULTAD DE CIENCIAS NATURALES Y MATEMATICAS DEPARTAMENTO DE CIENCIAS QUIMICAS Y AMBIENTALES PRIMER EXAMEN DE TRATAMIENTO DE AGUAS
 FACULTAD DE CIENCIAS NATURALES Y MATEMATICAS DEPARTAMENTO DE CIENCIAS QUIMICAS Y AMBIENTALES PRIMER EXAMEN DE TRATAMIENTO DE AGUAS Nombre y apellido: Fecha: Junio 30 de 2014 1. (10 puntos) Con los datos
FACULTAD DE CIENCIAS NATURALES Y MATEMATICAS DEPARTAMENTO DE CIENCIAS QUIMICAS Y AMBIENTALES PRIMER EXAMEN DE TRATAMIENTO DE AGUAS Nombre y apellido: Fecha: Junio 30 de 2014 1. (10 puntos) Con los datos
GUÍA DE EJERCICOS. CONTENIDOS Simbología Química. El Mol y las Ecuaciones Químicas. Estequiometría. Alejandra Escobar Gomes
 CONTENIDOS Simbología Química. El Mol y las Ecuaciones Químicas. Estequiometría Alejandra Escobar Gomes GUÍA DE EJERCICOS Química 3er año ALEJANDRA ESCOBAR GOMES 0 GUÍA DE EJERCICIOS 6 24 23 1. Para los
CONTENIDOS Simbología Química. El Mol y las Ecuaciones Químicas. Estequiometría Alejandra Escobar Gomes GUÍA DE EJERCICOS Química 3er año ALEJANDRA ESCOBAR GOMES 0 GUÍA DE EJERCICIOS 6 24 23 1. Para los
Materiales recopilados por la Ponencia Provincial de Química para Selectividad TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano
TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano
PRACTICA No.9 REACCIONES QUIMICAS I
 PRACTICA No.9 REACCIONES QUIMICAS I INTRODUCCION: Las transformaciones de la materia se conocen como REACCIONES QUIMICAS. En ellas se opera un cambio en la estructura íntima de las sustancias reaccionantes
PRACTICA No.9 REACCIONES QUIMICAS I INTRODUCCION: Las transformaciones de la materia se conocen como REACCIONES QUIMICAS. En ellas se opera un cambio en la estructura íntima de las sustancias reaccionantes
PROBLEMAS. los conocimientos adquiridos y
 PROBLEMAS Ahora con los temas que has aprendido contesta los siguientes ejercicios para poner en práctica los conocimientos adquiridos y aplicarlos a situaciones reales. 1) Entre las suspensiones que son
PROBLEMAS Ahora con los temas que has aprendido contesta los siguientes ejercicios para poner en práctica los conocimientos adquiridos y aplicarlos a situaciones reales. 1) Entre las suspensiones que son
Universidad Gran Mariscal de Ayacucho Carreras de Ambiente, Civil, Computación y Mantenimiento Asignatura: Química I TEMA 1. LEYES PONDERALES.
 Universidad Gran Mariscal de Ayacucho Carreras de Ambiente, Civil, Computación y Mantenimiento Asignatura: Química I TEMA 1. LEYES PONDERALES. 1) Determine la cantidad de óxido de magnesio que se formara
Universidad Gran Mariscal de Ayacucho Carreras de Ambiente, Civil, Computación y Mantenimiento Asignatura: Química I TEMA 1. LEYES PONDERALES. 1) Determine la cantidad de óxido de magnesio que se formara
TEMA I: REACCIONES Y ESTEQUIOMETRIA
 TEMA I: REACCIONES Y ESTEQUIOMETRIA 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano que quedan. c) Los gramos
TEMA I: REACCIONES Y ESTEQUIOMETRIA 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano que quedan. c) Los gramos
CISTINURIA. Elisa del Valle
 CISTINURIA Elisa del Valle CISTINURIA La cistinuria es un desorden autosómico recesivo (en el que pocos casos muestran una herencia dominante) Afecta el transporte de membrana de cistina y AA dibásicos
CISTINURIA Elisa del Valle CISTINURIA La cistinuria es un desorden autosómico recesivo (en el que pocos casos muestran una herencia dominante) Afecta el transporte de membrana de cistina y AA dibásicos
Equilibrios ácido-base y equilibrios de solubilidad
 Equilibrios ácido-base y equilibrios de solubilidad Capítulo 16 El efecto del ión común es el cambio en equilibrio causado por el añadir un compuesto que tiene un ión común con la sustancia disuelta. La
Equilibrios ácido-base y equilibrios de solubilidad Capítulo 16 El efecto del ión común es el cambio en equilibrio causado por el añadir un compuesto que tiene un ión común con la sustancia disuelta. La
