ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
|
|
|
- Mario Domínguez Villanueva
- hace 8 años
- Vistas:
Transcripción
1 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1
2 1. NOMBRE DEL MEDICAMENTO Siklos 100 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 100 mg de hidroxicarbamida. Para consultar la lista completa de excipientes, ver sección FORMA FARMACÉUTICA Comprimido recubierto con película (comprimido). Comprimidos recubiertos con película, redondos, de color blanquecino y grabado 100 en una cara. 4. DATOS CLÍNICOS 4.1. Indicaciones terapéuticas Siklos está indicado en la prevención de las crisis de oclusión de vasos dolorosas y recurrentes, como el síndrome torácico agudo en adultos, adolescentes y niños mayores de 2 años que padecen anemia drepanocítica sintomática (ver sección 5.1) Posología y forma de administración El tratamiento con Siklos debe ser iniciado por un médico que tenga experiencia en el tratamiento de la anemia drepanocítica. Posología En adultos, adolescentes y niños mayores de 2 años de edad: La posología debe basarse en el peso corporal del paciente (pc). La dosis inicial de hidroxicarbamida es de 15 mg/kg de peso corporal, y la dosis habitual es de 15 a 30 mg/kg de peso corporal/día. Mientras el paciente responda al tratamiento, ya sea desde el punto de vista clínico o hematológico (p. ej., elevación de la hemoglobina F (HbF), volumen corpuscular medio (VCM), recuento de neutrófilos), se mantendrá la dosis de Siklos. Si no hay respuesta (reaparición de las crisis o mantenimiento de la frecuencia de éstas) se puede aumentar la dosis en incrementos de 2,5 a 5 mg/kg de peso corporal/día utilizando la concentración más apropiada. En circunstancias excepcionales se puede justificar una dosis máxima de 35 mg/kg/ de peso corporal/día bajo control hematológico estricto (ver sección 4.4). Si un paciente sigue sin responder a pesar de recibir la dosis máxima de hidroxicarbamida (35 mg/kg p.c./día) durante tres a seis meses, se considerará la posibilidad de suspender definitivamente la administración de Siklos. Si las cifras de los hemogramas se encuentran dentro de los límites de toxicidad, se suspenderá temporalmente la administración de Siklos hasta que dichas cifras vuelvan a la normalidad. La recuperación hematológica suele ocurrir en el plazo de dos semanas. Cuando esto se produzca, se puede reanudar el tratamiento con dosis reducidas. Posteriormente se puede volver a aumentar bajo estricto control hematológico. Si una dosis produce toxicidad hematológica, no debe probarse más de dos veces. El intervalo tóxico se caracteriza por los siguientes resultados de los análisis de sangre: 2
3 Neutrófilos < 2.000/mm 3 Plaquetas < /mm 3 Hemoglobina < 4,5 g/dl Reticulocitos < /mm 3 si la concentración de hemoglobina es < 9 g/dl Hay datos a largo plazo sobre el uso continuado de hidroxicarbamida en niños y adolescentes con anemia drepanocítica, con un seguimiento de 12 años en niños y adolescentes y de más de 13 años en adultos. En la actualidad se ignora cuánto debe durar el tratamiento con Siklos. La duración del tratamiento es responsabilidad del médico, y dependerá de la situación clínica y hematológica de cada paciente. Población pediátrica Niños menores de 2 años Los datos existentes sobre el tratamiento con hidroxicarbamida en niños menores de 2 años de edad son tan escasos que no se han establecido pautas de administración y, por tanto, no se recomienda el tratamiento con hidroxicarbamida de esta población. Niños y adolescentes (2 a 18 años) En niños y adolescentes con anemia drepanocítica, la exposición sistémica a la hidroxicarbamida es similar a la que se observa en pacientes adultos. Por consiguiente, no es necesario ajustar la dosis en pacientes jóvenes. Insuficiencia renal En pacientes con insuficiencia renal hay que considerar la posibilidad de reducir la dosis de Siklos, puesto que ésta es una vía de eliminación importante. Si el aclaramiento de creatinina es 60 ml/min, la dosis inicial de Siklos debe reducirse en un 50 %. En estos pacientes se aconseja vigilar estrechamente los parámetros sanguíneos. Siklos no debe administrarse a pacientes con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min) (ver secciones 4.3, 4.4 y 5.2). Insuficiencia hepática No hay datos concretos que respalden ajustes de la dosis en pacientes con insuficiencia hepática. En estos pacientes se aconseja vigilar estrechamente los parámetros sanguíneos. Por razones de seguridad, Siklos está contraindicado en pacientes con insuficiencia hepática grave (ver secciones 4.3 y 4.4). Método de administración Dependiendo de la dosis individual, el comprimido deberá tomarse una vez al día, preferiblemente por la mañana antes del desayuno y, cuando sea necesario, con un vaso de agua o una cantidad muy pequeña de alimentos. Si el paciente no puede tragar los comprimidos, podrán disolverse inmediatamente antes de su uso en una pequeña cantidad de agua utilizando una cucharilla. Para ocultar su sabor amargo se puede añadir una gota de sirope o mezclar el contenido con comida Contraindicaciones Hipersensibilidad al principio activo o a alguno de los excipientes. Insuficiencia hepática (clasificación C de Child-Pugh) o insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min). Los intervalos tóxicos de mielosupresión se recogen en la sección 4.2. Lactancia (ver sección 4.6). 3
4 4.4. Advertencias y precauciones especiales de empleo El tratamiento con Siklos requiere un control clínico estricto. Antes de iniciarlo se determinará la situación hematológica del paciente y las funciones renal y hepática; estas determinaciones se repetirán durante el tratamiento. Durante el tratamiento con Siklos se obtendrán recuentos hemáticos cada 2 semanas al inicio del tratamiento (es decir, los dos primeros meses) y si la dosis diaria de hidroxicarbamida es de hasta 35 mg/kg p.c. Los pacientes que se estabilicen con dosis inferiores serán controlados cada 2 meses. Si se observa una depresión acusada de la función de la médula ósea, se suspenderá el tratamiento con Siklos. Normalmente la primera y más frecuente manifestación de supresión hematológica es la neutropenia. La trombocitopenia y la anemia son menos frecuentes, y es raro que no vayan precedidas por neutropenia. La mielosupresión se suele recuperar pronto si se suspende el tratamiento. El tratamiento con Siklos se puede reanudar con una dosis un poco más baja (ver sección 4.2). Siklos debe utilizarse con precaución en pacientes con insuficiencia renal de leve a moderada (ver sección 4.2). No se dispone de datos en pacientes con insuficiencia hepática entre leve y moderada, por lo que Siklos debe utilizarse con precaución. También debe utilizarse con precaución en pacientes que presenten úlceras en las piernas. Éstas son una complicación frecuente de la anemia drepanocítica, pero también se han notificado en pacientes tratados con hidroxicarbamida. En pacientes con trastornos mieloproliferativos tratados con hidroxicarbamida se ha observado toxicidad en los vasos cutáneos, como ulceraciones vasculíticas y gangrena. Este tipo de toxicidad se dio casi siempre en pacientes que habían recibido tratamiento con interferón o que lo estaban recibiendo. Como quiera que los trastornos clínicos derivados de las úlceras vasculares cutáneas notificadas en pacientes con enfermedades mieloproliferativas pueden ser graves, en caso de que aparezcan se suspenderá el tratamiento con hidroxicarbamida o se reducirá la dosis. En raras ocasiones las úlceras se deben a vasculitis leucocitoclásticas. Se recomienda hacer un seguimiento continuado del crecimiento de los niños en tratamiento. La hidroxicarbamida causa macrocitosis, que puede enmascarar la aparición fortuita de déficit de ácido fólico y vitamina B 12. Se recomienda la administración preventiva de ácido fólico. Los pacientes y los padres o tutores deben ser capaces de seguir las instrucciones de administración de este medicamento, de su control y su cuidado. La hidroxicarbamida es inequívocamente genotóxica en gran variedad de pruebas. Se supone que es carcinógena para varias especies. En pacientes tratados con hidroxicarbamida a largo plazo por trastornos mieloproliferativos, se ha notificado leucemia secundaria. Se ignora si este efecto leucemogénico es secundario a la hidroxicarbamida o se asocia a la enfermedad subyacente del paciente. También se ha notificado cáncer de piel en pacientes tratados con hidroxicarbamida a largo plazo Interacción con otros medicamentos y otras formas de interacción No se han realizado estudios de interacciones específicos con hidroxicarbamida. En pacientes infectados por el VIH y tratados con hidroxicarbamida combinada con medicamentos antirretrovirales, sobre todo didanosina más estavudina, se han notificado pancreatitis potencialmente mortal, toxicidad hepática y neuropatía periférica grave. La mediana de la reducción de los linfocitos CD4 en pacientes tratados con hidroxicarbamida combinada con didanosina, estavudina e indinavir fue de 100/mm 3 aproximadamente. 4
5 El uso simultáneo de hidroxicarbamida y otros medicamentos mielosupresores o radioterapia puede aumentar la depresión medular, los trastornos digestivos o la mucositis. Un eritema causado por la radiación puede empeorar por la hidroxicarbamida. El uso simultáneo de hidroxicarbamida con una vacuna con virus vivos puede potenciar la replicación del virus de la vacuna y/o aumentar la reacción adversa al virus de la vacuna, porque puede que los mecanismos de defensa normales estén suprimidos por la hidroxicarbamida. La administración de una vacuna con virus vivos a un paciente en tratamiento con hidroxicarbamida puede desencadenar una infección grave. En general, puede disminuir la respuesta de los anticuerpos del paciente a la vacuna. Sólo se administrará Siklos a la vez que vacunas con virus vivos si las ventajas superan claramente a los riesgos potenciales Fertilidad, embarazo y lactancia Mujeres en edad fértil / Anticoncepción en hombres y mujeres Se debe aconsejar a las mujeres en edad fértil que durante el tratamiento con hidroxicarbamida no se queden embarazadas y que informen a su médico de inmediato en caso de embarazo. Es muy importante que las mujeres en edad fértil utilicen anticonceptivos eficaces. Los pacientes en tratamiento con hidroxicarbamida quienes deseen concebir un hijo, deben interrumpir el tratamiento entre 3 y 6 meses antes del embarazo, si es posible. La evaluación de la relación riesgo/beneficio debe hacerse caso por caso, sopesando el riesgo del tratamiento con hidroxicarbamida frente al cambio a un programa de transfusiones de sangre. Embarazo En un análisis retrospectivo de un estudio de cohorte de 123 pacientes adultos tratados con hidroxicarbamida se notificaron veintitrés embarazos en 15 mujeres tratadas con hidroxicarbamida y en las parejas de tres varones tratados con hidroxicarbamida. En la mayor parte de los casos (61 %) el resultado fue normal en cuanto a la fecha del parto y al transcurso del mismo. En los demás casos con evolución conocida fue necesario interrumpir el embarazo, por voluntad de la paciente o por consejo médico. Por eso los datos de unos pocos embarazos con exposición al fármaco indican que no tiene efectos adversos sobre el embarazo ni sobre la salud del feto/ recién nacido. Los estudios en animales han mostrado toxicidad para la reproducción (ver sección 5.3). ). Los pacientes en tratamiento con hidroxicarbamida deben ser avisados de los riesgos teóricos en el feto. Teniendo en cuenta la escasa información disponible, en caso de exposición a la hidroxicarbamida de pacientes embarazadas o parejas embarazadas de pacientes tratados con hidroxicarbamida, es preciso considerar el seguimiento meticuloso, con exámenes clínicos, biológicos y ecográficos suficientes. Lactancia La hidroxicarbamida se excreta en la leche materna. Debido a las posibles reacciones adversas graves en los lactantes, el periodo de lactancia se suspenderá durante el tratamiento con Siklos. Fertilidad La fertilidad en hombres puede verse afectada por el tratamiento. Casos oligospermia o azoospermia reversibles muy frecuentes se han observado en los seres humanos, aunque estos trastornos también se asocian a la enfermedad subyacente. En ratas macho se ha observado alteración de la fertilidad(ver sección 5.3) Efectos sobre la capacidad para conducir y utilizar máquinas No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. No obstante, se informará a los pacientes de que en la bibliografía aparecen casos de mareos, aunque no son frecuentes. Se aconsejará a los pacientes que no conduzcan ni manejen máquinas si se marean durante el tratamiento con Siklos. 5
6 4.8. Reacciones adversas Se ha realizado un análisis retrospectivo específico de la seguridad de la hidroxicarbamida en un estudio de cohortes de 123 adultos durante 13 años y 352 niños mayores de 2 años y adolescentes hasta 12 años de edad durante 12 años. La reacción adversa notificada con más frecuencia es la mielosupresión, siendo la neutropenia su manifestación más frecuente. La depresión medular es el efecto tóxico limitante de la dosis de hidroxicarbamida. Cuando no se alcanza la dosis máxima tolerada suele producirse mielotoxicidad transitoria en menos del 10 % de los pacientes, pero si se alcanza dicha dosis, más del 50 % de los pacientes pueden experimentar supresión medular reversible. Estas reacciones adversas son previsibles debido a la farmacología de la hidroxicarbamida. Si se aumenta la dosis de forma gradual, estos efectos pueden ser menos intensos (ver sección 4.2). A continuación se enumeran las reacciones adversas ordenadas según su clasificación por órganos y sistemas y por frecuencias absolutas. Las frecuencia se definen así: muy frecuentes ( 1/10); frecuentes ( 1/100, < 1/10); poco frecuentes ( 1/1.000, < 1/100); raras ( 1/10.000, < 1/1.000); muy raras (< 1/10.000), desconocidos (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia. Infecciones e infestaciones: Desconocidos: Infección por parvovirus B19 Neoplasias benignas, malignas y no especificadas: Desconocidos: Leucemia y, en pacientes ancianos, cáncer de piel Trastornos de la sangre y del sistema linfático: Muy frecuentes: Depresión medular 1, incluida neutropenia (< 2,0 x 10 9 /l), reticulocitopenia (< 80 x 10 9 /l), macrocitosis 2 Frecuentes: Trombocitopenia (< 80 x 10 9 /l), anemia (hemoglobina < 4,5 g/dl) 3 Trastornos del sistema nervioso: Frecuentes: Dolor de cabeza Poco frecuentes: Mareos Trastornos vasculares Desconocidos: Hemorragia Trastornos gastrointestinales: Poco frecuentes: Náuseas Desconocidos: Trastornos gastrointestinales, vómitos, úlcera gastrointestinal, hipomagnesemia grave Trastornos hepatobiliares Raros: Elevación de las enzimas hepáticas Trastornos de la piel y del tejido subcutáneo: Frecuentes Reacciones cutáneas (por ejemplo, pigmentación oral, ungueal y cutánea) y mucositis oral. Poco frecuentes: Exantema, melanoniquia, alopecia. Raros: Úlceras en las piernas Desconocidos: Sequedad cutánea Trastornos del aparato reproductor y de la mama: Muy frecuentes : oligospermia,azoospermia 4 Desconocidos: Amenorrea Trastornos generales y alteraciones en el lugar de administración Desconocidos: Fiebre Exploraciones complementarias: Desconocidos: Aumento de peso 5 1 La recuperación hematológica suele producirse en las dos semanas siguientes a la retirada de la hidroxicarbamida. 6
7 2 La macrocitosis causada por la hidroxicarbamida no tiene relación con el déficit de vitamina B 12 o de ácido fólico. 3 Debido principalmente a infección por parvovirus o a secuestro esplénico. 4 La oligospermia y la azoospermia suelen ser reversibles, pero hay que tenerlas en cuenta si se desea tener hijos (ver sección 5.3). Estos trastornos también se asocian a la enfermedad subyacente. 5 Que puede ser un efecto de la mejora del estado general. Los datos clínicos obtenidos en pacientes con anemia drepanocítica no han aportado pruebas de que la hidroxicarbamida produzca reacciones adversas para las funciones hepática y renal. Notificación de sospechas de reacciones adversas Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V Sobredosis Se han notificado casos de toxicidad mucocutánea aguda en pacientes tratados con hidroxicarbamida en dosis varias veces superiores a la terapéutica. Se ha observado hipersensibilidad, eritema violeta, edema en palmas y plantas seguido por descamación de manos y pies, hiperpigmentación generalizada grave de la piel y estomatitis. En pacientes con anemia drepanocítica se ha notificado neutropenia en casos aislados de sobredosis de hidroxicarbamida (1,43 y 8,57 veces la dosis máxima recomendada de 35 mg/kg p.c./día). Se recomienda controlar el hemograma durante varias semanas después de una sobredosis, porque la recuperación puede tardar. El tratamiento de la sobredosis consiste en lavado gástrico seguido de tratamiento sintomático y control de la función de la médula ósea. 5. PROPIEDADES FARMACOLÓGICAS 5.1. Propiedades farmacodinámicas Grupo farmacoterapéutico: Agentes antineoplásicos, otros antineoplásicos, código ATC: L01XX05. En casi todos los ensayos clínicos realizados sobre anemia drepanocítica, la hidroxicarbamida redujo la frecuencia de episodios de oclusión vascular en niños y en adultos entre un 66% y un 80%. En los grupos tratados se observó la misma reducción en el número de ingresos hospitalarios y en el número de días de hospitalización. En varios estudios también disminuyó la frecuencia anual del síndrome torácico agudo entre un 25% y un 33%. Ésta es una complicación frecuente de la anemia drepanocítica que pone en peligro la vida del paciente, y se caracteriza por dolor torácico o fiebre o disnea con infiltrado reciente en la radiografía. Se demostró un beneficio sostenido para los pacientes que continuaron el tratamiento con hidroxicarbamida durante 8 años. No se conoce completamente el mecanismo de acción concreto de la hidroxicarbamida. Uno de los mecanismos por los que actúa es la elevación de las concentraciones de hemoglobina fetal (HbF) en los pacientes con anemia drepanocítica. La HbF interfiere en la polimerización de la hemoglobina S (HbS), lo que impide la deformación de los glóbulos rojos. En todos los ensayos clínicos se ha observado un aumento significativo de la HbF con respecto al valor basal después del tratamiento con hidroxicarbamida. Recientemente se ha demostrado que la hidroxicarbamida se asocia a la generación de óxido nítrico, que estimula la producción de monofosfato de guanosina cíclico (GMPc), lo que a su vez activa una proteína cinasa y aumenta la producción de HbF. Otros efectos farmacológicos conocidos de 7
8 hidroxicarbamida que pueden contribuir a sus efectos beneficiosos en la anemia drepanocítica son la reducción del número de neutrófilos, el aumento del contenido de agua de los eritrocitos, el aumento de la deformabilidad de las células drepanocíticas y la alteración de la adhesión de los eritrocitos al endotelio. Además la hidroxicarbamida produce una inhibición inmediata de la síntesis de ADN actuando como inhibidor de la ribonucleótido reductasa, sin interferir en la síntesis del ácido ribonucleico ni de las proteínas. Además de la correlación inconstante entre la reducción de la tasa de crisis y el aumento de la HbF, el efecto citorreductor de hidroxicarbamida, sobre todo el descenso del número de neutrófilos, fue el factor más estrechamente relacionado con la reducción de la tasa de crisis Propiedades farmacocinéticas Absorción Tras la administración oral de 20 mg/kg de hidroxicarbamida se observa una absorción rápida: la concentración plasmática máxima, de 30 mg/l aproximadamente, se alcanza al cabo de 0,75 horas en niños y de 1,2 horas en adultos con anemia drepanocítica. La exposición total en las 24 horas siguientes a la administración es de 124 mg*h/l en niños y adolescentes y de 135 mg*h/l en pacientes adultos. La biodisponibilidad oral de la hidroxicarbamida es casi completa a juzgar por lo observado en otras indicaciones distintas de la anemia drepanocítica. Distribución La hidroxicarbamida se distribuye rápidamente en el cuerpo humano, entra en el líquido cefalorraquídeo, aparece en el líquido peritoneal y en el ascítico, y se concentra en leucocitos y eritrocitos. El volumen de distribución estimado de hidroxicarbamida es aproximadamente igual que el de agua total del organismo. El volumen de distribución en estado de equilibrio ajustado en función de la biodisponibilidad es de 0,57 l/kg en pacientes con anemia drepanocítica (lo que supone aproximadamente 72 l en niños y 90 l en adultos). Se desconoce el grado de unión de la hidroxicarbamida a las proteínas. Biotransformación: No se conocen bien las vías de biotransformación ni los metabolitos. La urea es uno de ellos. La hidroxicarbamida en concentraciones de 30, 100 y 300 µm no es metabolizada in vitro por el sistema del citocromo P450 de los microsomas hepáticos humanos. En concentraciones de 10 a 300 µm, la hidroxicarbamida no estimula in vitro la actividad ATPasa de la glucoproteína P (GPP) recombinante humana, lo que indica que la hidroxicarbamida no es sustrato de la GPP. Por consiguiente, no es de esperar que se produzcan interacciones si se administra junto con sustratos de los citocromos P450 o de la GPP. Eliminación En un estudio sobre la administración de dosis reiteradas a pacientes adultos con anemia drepanocítica, se detectó aproximadamente el 60 % de la dosis de hidroxicarbamida en orina en estado de equilibrio. En adultos, el aclaramiento total ajustado en función de la biodisponibilidad fue de 9,89 l/h (0,16 l/h/kg); 5,64 l/h correspondieron al aclaramiento renal y 4,25 l/h al no renal. Los valores respectivos del aclaramiento total en niños fueron de 7,25 l/h (0,20 l/h/kg), 2,91 por vía renal y 4,34 l/h por otras vías. En adultos con anemia drepanocítica, la excreción acumulada media de hidroxicarbamida por orina fue del 62 % de la dosis administrada a las 8 horas, y por lo tanto superior a la observada en pacientes con cáncer (35 % 40 %). En pacientes con anemia drepanocítica, la hidroxicarbamida fue eliminada con una semivida de seis a siete horas, superior a lo notificado en otras indicaciones. Edad, raza, sexo No se dispone de información sobre diferencias farmacocinéticas debidas a la edad (excepto en niños), al sexo o a la raza. 8
9 Niños En pacientes pediátricos y adultos con anemia drepanocítica, la exposición sistémica a la hidroxicarbamida en estado de equilibrio fue similar en lo que respecta al área bajo la curva. Las concentraciones plasmáticas máximas y el volumen aparente de distribución con respecto al peso corporal fueron muy parecidos en todos los grupos de edad. El tiempo necesario para alcanzar la concentración plasmática máxima y el porcentaje de dosis eliminado por la orina fueron superiores en niños que en adultos. En niños, la semivida y el aclaramiento total en función del peso corporal fueron ligeramente superiores que en pacientes adultos (ver sección 4.2). Insuficiencia renal Como la excreción renal es una de las vías de eliminación, hay que considerar la posibilidad de reducir la dosis de Siklos en pacientes con insuficiencia renal. En un estudio abierto sobre la administración de una sola dosis a pacientes adultos con anemia drepanocítica (Yan JH y cols., 2005), se evaluó la influencia de la función renal en la farmacocinética de la hidroxicarbamida. Pacientes con función renal normal (aclaramiento de creatinina CrCl > 80 ml/min), y con insuficiencia renal leve (CrCl ml/min), moderada (CrCl 30 - < 60 ml/min) o grave (< 30 ml/min) recibieron una sola dosis de 15 mg/kg p.c. de hidroxicarbamida en cápsulas de 200 mg, 300 mg o 400 mg. En pacientes con CrCl inferior a 60 ml/min o en pacientes con nefropatía terminal, la exposición a la hidroxicarbamida fue aproximadamente un 64 % superior que en pacientes con función renal normal. Según se observó en otro estudio, en pacientes con CrCl < 60 ml/min, el área bajo la curva fue aproximadamente un 51 % mayor que en pacientes con CrCl 60 ml/min, lo que indica que en pacientes con CrCl 60 ml/min puede convenir reducir la dosis de hidroxicarbamida en un 50 %. La hemodiálisis redujo la exposición a la hidroxicarbamida en un 33 % (ver secciones 4.2 y 4.4). En estos pacientes se aconseja vigilar estrechamente los parámetros sanguíneos. Insuficiencia hepática No hay datos que permitan proponer instrucciones concretas para ajustar la dosis en pacientes con insuficiencia hepática pero, por seguridad, Siklos está contraindicado en pacientes con insuficiencia hepática grave (ver sección 4.3). En estos pacientes se aconseja vigilar estrechamente los parámetros sanguíneos Datos preclínicos sobre seguridad En los estudios no clínicos sobre toxicidad los efectos más frecuentes fueron depresión medular, atrofia linfoide y cambios degenerativos en el epitelio de los intestinos delgado y grueso. En algunas especies se observaron efectos cardiovasculares y alteraciones hematológicas. En ratas también se produjo atrofia testicular con reducción de la espermatogénesis, mientras que en perros se observó una detención reversible de la espermatogénesis. La hidroxicarbamida es inequívocamente genotóxica en gran variedad de pruebas. No se han realizado estudios convencionales a largo plazo sobre el poder carcinógeno de hidroxicarbamida. No obstante, se supone que es carcinógena para varias especies. La hidroxicarbamida atraviesa la barrera placentaria y se ha demostrado que, en la dosis terapéutica para seres humanos o en otras inferiores, tiene efectos teratógenos y embriotóxicos potentes en gran variedad de modelos con animales. El poder teratógeno se caracterizó por osificación parcial de los huesos del cráneo, ausencia de las cuencas oculares, hidrocefalia, esternebras bífidas, ausencia de vértebras lumbares. La embriotoxicidad se caracterizó por reducción de la viabilidad fetal, reducción del tamaño de las camadas vivas y retrasos del desarrollo. La administración de 60 mg/kg p.c./día de hidroxicarbamida a ratas macho (aproximadamente el doble de la dosis máxima recomendada en seres humanos) les produjo atrofia testicular, reducción de la espermatogénesis y reducción acusada de la capacidad de preñar a las hembras. 9
10 6. DATOS FARMACÉUTICOS 6.1. Lista de excipientes Estearil fumarato de sodio Celulosa microcristalina con sílice Copolímero de metacrilato butilado básico 6.2. Incompatibilidades No procede Periodo de validez 3 años Precauciones especiales de conservación Conservar por debajo de 30 C Naturaleza y contenido del envase Frasco de polietileno de alta densidad (HDPE) con cierre de rosca de polipropileno a prueba de niños con una unidad desecante, conteniendo 60, 90 o 120 comprimidos recubiertos con película.. Puede que solamente estén comercializados algunos tamaños de envase Precauciones especiales de eliminación y otras manipulaciones Siklos es un medicamento que debe manipularse con cuidado. Las personas que no toman Siklos (sobre todo las mujeres embarazadas) deben evitar el contacto con la hidroxicarbamida.. Lávese las manos antes y después de tocar los comprimidos. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN París Francia Tel.: Fax: Correo electrónico: contact@addmedica.com 8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN EU/1/07/397/002 EU/1/07/397/003 EU/1/07/397/ FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN Fecha de la primera autorización: 29/06/
11 Fecha de la última renovación: 28/06/ FECHA DE LA REVISIÓN DEL TEXTO La información detallada de este medicamento está disponible en la página web de la Agencia Europea del Medicamento: 11
12 1. NOMBRE DEL MEDICAMENTO Siklos 1000 mg comprimidos recubiertos con pelicula. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene mg de hidroxicarbamida. Para consultar la lista completa de excipientes, ver sección FORMA FARMACÉUTICA Comprimido casi blanco, con forma de cápsula y recubierto con película, con tres ranuras a cada lado. El comprimido se puede dividir en cuatro partes iguales. 4. DATOS CLÍNICOS 4.1. Indicaciones terapéuticas Siklos está indicado en la prevención de las crisis de oclusión de vasos dolorosas y recurrentes, como el síndrome torácico agudo en adultos, adolescentes y niños mayores de 2 años que padecen anemia drepanocítica sintomática (ver sección 5.1) Posología y forma de administración El tratamiento con Siklos debe ser iniciado por un médico que tenga experiencia en el tratamiento de la anemia drepanocítica. Posología En adultos, adolescentes y niños mayores de 2 años de edad: La posología debe basarse en el peso corporal del paciente (pc). La dosis inicial de hidroxicarbamida es de 15 mg/kg de peso corporal, y la dosis habitual es de 15 a 30 mg/kg de peso corporal/día. Mientras el paciente responda al tratamiento, ya sea desde el punto de vista clínico o hematológico (p. ej., elevación de la hemoglobina F (HbF), volumen corpuscular medio (VCM), recuento de neutrófilos), se mantendrá la dosis de Siklos. Si no hay respuesta (reaparición de las crisis o mantenimiento de la frecuencia de éstas) se puede aumentar la dosis en incrementos de 2,5 a 5 mg/kg de peso corporal/día utilizando la concentración más apropiada. En circunstancias excepcionales se puede justificar una dosis máxima de 35 mg/kg/ de peso corporal/día bajo control hematológico estricto (ver sección 4.4). Si un paciente sigue sin responder a pesar de recibir la dosis máxima de hidroxicarbamida (35 mg/kg p.c./día) durante tres a seis meses, se considerará la posibilidad de suspender definitivamente la administración de Siklos. Si las cifras de los hemogramas se encuentran dentro de los límites de toxicidad, se suspenderá temporalmente la administración de Siklos hasta que dichas cifras vuelvan a la normalidad. La recuperación hematológica suele ocurrir en el plazo de dos semanas. Cuando esto se produzca, se puede reanudar el tratamiento con dosis reducidas. Posteriormente se puede volver a aumentar bajo estricto control hematológico. Si una dosis produce toxicidad hematológica, no debe probarse más de dos veces. El intervalo tóxico se caracteriza por los siguientes resultados de los análisis de sangre: 12
13 Neutrófilos < 2.000/mm 3 Plaquetas < /mm 3 Hemoglobina < 4,5 g/dl Reticulocitos < /mm 3 si la concentración de hemoglobina es < 9 g/dl Hay datos a largo plazo sobre el uso continuado de hidroxicarbamida en niños y adolescentes con anemia drepanocítica, con un seguimiento de 12 años en niños y adolescentes y de más de 13 años en adultos. En la actualidad se ignora cuánto debe durar el tratamiento con Siklos. La duración del tratamiento es responsabilidad del médico, y dependerá de la situación clínica y hematológica de cada paciente. Población pediátrica Niños menores de 2 años Los datos existentes sobre el tratamiento con hidroxicarbamida en niños menores de 2 años de edad son tan escasos que no se han establecido pautas de administración y, por tanto, no se recomienda el tratamiento con hidroxicarbamida de esta población. Niños y adolescentes (2 a 18 años) En niños y adolescentes con anemia drepanocítica, la exposición sistémica a la hidroxicarbamida es similar a la que se observa en pacientes adultos. Por consiguiente, no es necesario ajustar la dosis en pacientes jóvenes. Insuficiencia renal En pacientes con insuficiencia renal hay que considerar la posibilidad de reducir la dosis de Siklos, puesto que ésta es una vía de eliminación importante. Si el aclaramiento de creatinina es 60 ml/min, la dosis inicial de Siklos debe reducirse en un 50 %. En estos pacientes se aconseja vigilar estrechamente los parámetros sanguíneos. Siklos no debe administrarse a pacientes con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min) (ver secciones 4.3, 4.4 y 5.2). Insuficiencia hepática No hay datos concretos que respalden ajustes de la dosis en pacientes con insuficiencia hepática. En estos pacientes se aconseja vigilar estrechamente los parámetros sanguíneos. Por razones de seguridad, Siklos está contraindicado en pacientes con insuficiencia hepática grave (ver secciones 4.3 y 4.4). Método de administración Dependiendo de la dosis individual, el comprimido entero, partido por la mitad o en cuartos, deberá tomarse una vez al día, preferiblemente por la mañana antes del desayuno y, cuando sea necesario, con un vaso de agua o una pequeña cantidad de alimentos. Si el paciente no puede tragar los comprimidos, podrán disolverse inmediatamente antes de su uso en una pequeña cantidad de agua utilizando una cucharilla. Para ocultar su sabor amargo se puede añadir una gota de sirope o mezclar el contenido con comida Contraindicaciones Hipersensibilidad al principio activo o a alguno de los excipientes. Insuficiencia hepática (clasificación C de Child-Pugh) o insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min). Los intervalos tóxicos de mielosupresión se recogen en la sección 4.2. Lactancia (ver sección 4.6). 13
14 4.4. Advertencias y precauciones especiales de empleo El tratamiento con Siklos requiere un control clínico estricto. Antes de iniciarlo se determinará la situación hematológica del paciente y las funciones renal y hepática; estas determinaciones se repetirán durante el tratamiento. Durante el tratamiento con Siklos se obtendrán recuentos hemáticos cada 2 semanas al inicio del tratamiento (es decir, los dos primeros meses) y si la dosis diaria de hidroxicarbamida es de hasta 35 mg/kg p.c. Los pacientes que se estabilicen con dosis inferiores serán controlados cada 2 meses. Si se observa una depresión acusada de la función de la médula ósea, se suspenderá el tratamiento con Siklos. Normalmente la primera y más frecuente manifestación de supresión hematológica es la neutropenia. La trombocitopenia y la anemia son menos frecuentes, y es raro que no vayan precedidas por neutropenia. La mielosupresión se suele recuperar pronto si se suspende el tratamiento. El tratamiento con Siklos se puede reanudar con una dosis un poco más baja (ver sección 4.2). Siklos debe utilizarse con precaución en pacientes con insuficiencia renal entre leve y moderada (ver sección 4.2). No se dispone de datos en pacientes con insuficiencia hepática de leve a moderada, por lo que Siklos debe utilizarse con precaución. También debe utilizarse con precaución en pacientes que presenten úlceras en las piernas. Éstas son una complicación frecuente de la anemia drepanocítica, pero también se han notificado en pacientes tratados con hidroxicarbamida. En pacientes con trastornos mieloproliferativos tratados con hidroxicarbamida se ha observado toxicidad en los vasos cutáneos, como ulceraciones vasculíticas y gangrena. Este tipo de toxicidad se dio casi siempre en pacientes que habían recibido tratamiento con interferón o que lo estaban recibiendo. Como quiera que los trastornos clínicos derivados de las úlceras vasculares cutáneas notificadas en pacientes con enfermedades mieloproliferativas pueden ser graves, en caso de que aparezcan se suspenderá el tratamiento con hidroxicarbamida o se reducirá la dosis. En raras ocasiones las úlceras se deben a vasculitis leucocitoclásticas. Se recomienda hacer un seguimiento continuado del crecimiento de los niños en tratamiento. La hidroxicarbamida causa macrocitosis, que puede enmascarar la aparición fortuita de déficit de ácido fólico y vitamina B 12. Se recomienda la administración preventiva de ácido fólico. Los pacientes y los padres o tutores deben ser capaces de seguir las instrucciones de administración de este medicamento, de su control y su cuidado. La hidroxicarbamida es inequívocamente genotóxica en gran variedad de pruebas. Se supone que es carcinógena para varias especies. En pacientes tratados con hidroxicarbamida a largo plazo por trastornos mieloproliferativos, se ha notificado leucemia secundaria. Se ignora si este efecto leucemogénico es secundario a la hidroxicarbamida o se asocia a la enfermedad subyacente del paciente. También se ha notificado cáncer de piel en pacientes tratados con hidroxicarbamida a largo plazo Interacción con otros medicamentos y otras formas de interacción No se han realizado estudios de interacciones específicos con hidroxicarbamida. En pacientes infectados por el VIH y tratados con hidroxicarbamida combinada con medicamentos antirretrovirales, sobre todo didanosina más estavudina, se han notificado pancreatitis potencialmente mortal, toxicidad hepática y neuropatía periférica grave. La mediana de la reducción de los linfocitos CD4 en pacientes tratados con hidroxicarbamida combinada con didanosina, estavudina e indinavir fue de 100/mm 3 aproximadamente. 14
15 El uso simultáneo de hidroxicarbamida y otros medicamentos mielosupresores o radioterapia puede aumentar la depresión medular, los trastornos digestivos o la mucositis. Un eritema causado por la radiación puede empeorar por la hidroxicarbamida. El uso simultáneo de hidroxicarbamida con una vacuna con virus vivos puede potenciar la replicación del virus de la vacuna y/o aumentar la reacción adversa al virus de la vacuna, porque puede que los mecanismos de defensa normales estén suprimidos por la hidroxicarbamida. La administración de una vacuna con virus vivo a un paciente en tratamiento con hidroxicarbamida puede desencadenar una infección grave. En general, puede disminuir la respuesta de los anticuerpos del paciente a la vacuna. Sólo se administrará Siklos a la vez que vacunas con virus vivos si las ventajas superan claramente a los riesgos potenciales Fertilidad, embarazo y lactancia Mujeres en edad fértil / Anticoncepción en hombres y mujeres Se debe aconsejar a las mujeres en edad fértil que durante el tratamiento con hidroxicarbamida no se queden embarazadas y que informen a su médico de inmediato en caso de embarazo. Es muy importante las mujeres en edad fértil que utilicen anticonceptivos eficaces Los pacientes en tratamiento con hidroxicarbamida; quienes deseen concebir un hijo, deben interrumpir el tratamiento entre 3 y 6 meses antes del embarazo, si es posible. La evaluación de la relación riesgo/beneficio debe hacerse caso por caso, sopesando el riesgo del tratamiento con hidroxicarbamida frente al cambio a un programa de transfusiones de sangre. Embarazo En un análisis retrospectivo de un estudio de cohorte de 123 pacientes adultos tratados con hidroxicarbamida se notificaron veintitrés embarazos en 15 mujeres tratadas con hidroxicarbamida y en las parejas de tres varones tratados con hidroxicarbamida. En la mayor parte de los casos (61 %) el resultado fue normal en cuanto a la fecha del parto y al transcurso del mismo. En los demás casos con evolución conocida fue necesario interrumpir el embarazo, por voluntad de la paciente o por consejo médico. Por eso los datos de unos pocos embarazos con exposición al fármaco indican que no tiene efectos adversos sobre el embarazo ni sobre la salud del feto recién nacido. Los estudios en animales han mostrado toxicidad para la reproducción (ver sección 5.3). ). Los pacientes en tratamiento con hidroxicarbamida deben ser avisados de los riesgos teóricos en el feto. Teniendo en cuenta la escasa información disponible, en caso de exposición a la hidroxicarbamida de pacientes embarazadas o parejas embarazadas de pacientes tratados con hidroxicarbamida, durante el embarazo es preciso considerar el seguimiento meticuloso, con exámenes clínicos, biológicos y ecográficos suficientes. Lactancia La hidroxicarbamida se excreta en la leche materna. Debido a las posibles reacciones adversas graves en los lactantes, el periodo de lactancia se suspenderá durante el tratamiento con Siklos. Fertilidad La fertilidad en hombres puede verse afectada por el tratamiento. Casos oligospermia o azoospermia reversibles muy frecuentes se han observado en los seres humanos, aunque estos trastornos también se asocian a la enfermedad subyacente. En ratas macho se ha observado alteración de la fertilidad (ver sección 5.3) Efectos sobre la capacidad para conducir y utilizar máquinas No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. No obstante, se informará a los pacientes de que en la bibliografía aparecen casos de mareos, aunque no son frecuentes. Se aconsejará a los pacientes que no conduzcan ni manejen máquinas si se marean durante el tratamiento con Siklos. 15
16 4.8. Reacciones adversas Se ha realizado un análisis retrospectivo específico de la seguridad de la hidroxicarbamida en un estudio de cohortes de 123 adultos durante 13 años y 352 niños mayores de 2 años y adolescentes hasta 12 años de edad durante 12 años. La reacción adversa notificada con más frecuencia es la mielosupresión, siendo la neutropenia su manifestación más frecuente. La depresión medular es el efecto tóxico limitante de la dosis de hidroxicarbamida. Cuando no se alcanza la dosis máxima tolerada suele producirse mielotoxicidad transitoria en menos del 10 % de los pacientes, pero si se alcanza dicha dosis, más del 50 % de los pacientes pueden experimentar supresión medular reversible. Estas reacciones adversas son previsibles debido a la farmacología de la hidroxicarbamida. Si se aumenta la dosis de forma gradual, estos efectos pueden ser menos intensos (ver sección 4.2). A continuación se enumeran las reacciones adversas ordenadas según su clasificación por órganos y sistemas y por frecuencias absolutas. Las frecuencia se definen así: muy frecuentes ( 1/10); frecuentes ( 1/100, < 1/10); poco frecuentes ( 1/1.000, < 1/100); raras ( 1/10.000, < 1/1.000); muy raras (< 1/10.000), desconocidos (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia. Infecciones e infestaciones: Desconocidos: Infección por parvovirus B19 Neoplasias benignas, malignas y no especificadas: Desconocidos: Leucemia y, en pacientes ancianos, cáncer de piel Trastornos de la sangre y del sistema linfático: Muy frecuentes: Depresión medular 1, incluida neutropenia (< 2,0 x 10 9 /l), reticulocitopenia (< 80 x 10 9 /l), macrocitosis 2 Frecuentes: Trombocitopenia (< 80 x 10 9 /l), anemia (hemoglobina < 4,5 g/dl) 3 Trastornos del sistema nervioso: Frecuentes: Dolor de cabeza Poco frecuentes: Mareos Trastornos vasculares Desconocidos: Hemorragia Trastornos gastrointestinales: Poco frecuentes: Náuseas Desconocidos: Trastornos gastrointestinales, vómitos, úlcera gastrointestinal, hipomagnesemia grave Trastornos hepatobiliares Raros: Elevación de las enzimas hepáticas Trastornos de la piel y del tejido subcutáneo: Frecuentes Reacciones cutáneas (por ejemplo, pigmentación oral, ungueal y cutánea) y mucositis oral. Poco frecuentes: Exantema, melanoniquia, alopecia. Raros: Úlceras en las piernas Desconocidos: Sequedad cutánea Trastornos del aparato reproductor y de la mama: Muy frecuentes : Oligospermia,azoospermia 4 Desconocidos: Amenorrea Trastornos generales y alteraciones en el lugar de administración Desconocidos: Fiebre Exploraciones complementarias: Desconocidos: Aumento de peso 5 1 La recuperación hematológica suele producirse en las dos semanas siguientes a la retirada de la hidroxicarbamida. 16
17 2 La macrocitosis causada por la hidroxicarbamida no tiene relación con el déficit de vitamina B 12 o de ácido fólico. 3 Debido principalmente a infección por parvovirus o a secuestro esplénico. 4 La oligospermia y la azoospermia suelen ser reversibles, pero hay que tenerlas en cuenta si se desea tener hijos (ver sección 5.3). Estos trastornos también se asocian a la enfermedad subyacente. 5 Que puede ser un efecto de la mejora del estado general. Los datos clínicos obtenidos en pacientes con anemia drepanocítica no han aportado pruebas de que la hidroxicarbamida produzca reacciones adversas para las funciones hepática y renal. Notificación de sospechas de reacciones adversas Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V Sobredosis Se han notificado casos de toxicidad mucocutánea aguda en pacientes tratados con hidroxicarbamida en dosis varias veces superiores a la terapéutica. Se ha observado hipersensibilidad, eritema violeta, edema en palmas y plantas seguido por descamación de manos y pies, hiperpigmentación generalizada grave de la piel y estomatitis. En pacientes con anemia drepanocítica se ha notificado neutropenia en casos aislados de sobredosis de hidroxicarbamida (1,43 y 8,57 veces la dosis máxima recomendada de 35 mg/kg p.c./día). Se recomienda controlar el hemograma durante varias semanas después de una sobredosis, porque la recuperación puede tardar. El tratamiento de la sobredosis consiste en lavado gástrico seguido de tratamiento sintomático y control de la función de la médula ósea. 5. PROPIEDADES FARMACOLÓGICAS 5.1. Propiedades farmacodinámicas Grupo farmacoterapéutico: Agentes antineoplásicos, otros antineoplásicos, código ATC: L01XX05. En casi todos los ensayos clínicos realizados sobre anemia drepanocítica, la hidroxicarbamida redujo la frecuencia de episodios de oclusión vascular en niños y en adultos entre un 66% y un 80%. En los grupos tratados se observó la misma reducción en el número de ingresos hospitalarios y en el número de días de hospitalización. En varios estudios también disminuyó la frecuencia anual del síndrome torácico agudo entre un 25% y un 33%. Ésta es una complicación frecuente de la anemia drepanocítica que pone en peligro la vida del paciente, y se caracteriza por dolor torácico o fiebre o disnea con infiltrado reciente en la radiografía. Se demostró un beneficio sostenido para los pacientes que continuaron el tratamiento con hidroxicarbamida durante 8 años. No se conoce completamente el mecanismo de acción concreto de la hidroxicarbamida. Uno de los mecanismos por los que actúa es la elevación de las concentraciones de hemoglobina fetal (HbF) en los pacientes con anemia drepanocítica. La HbF interfiere en la polimerización de la hemoglobina S (HbS), lo que impide la deformación de los glóbulos rojos. En todos los ensayos clínicos se ha observado un aumento significativo de la HbF con respecto al valor basal después del tratamiento con hidroxicarbamida. Recientemente se ha demostrado que la hidroxicarbamida se asocia a la generación de óxido nítrico, que estimula la producción de monofosfato de guanosina cíclico (GMPc), lo que a su vez activa una proteína cinasa y aumenta la producción de HbF. Otros efectos farmacológicos conocidos de 17
18 hidroxicarbamida que pueden contribuir a sus efectos beneficiosos en la anemia drepanocítica son la reducción del número de neutrófilos, el aumento del contenido de agua de los eritrocitos, el aumento de la deformabilidad de las células drepanocíticas y la alteración de la adhesión de los eritrocitos al endotelio. Además la hidroxicarbamida produce una inhibición inmediata de la síntesis de ADN actuando como inhibidor de la ribonucleótido reductasa, sin interferir en la síntesis del ácido ribonucleico ni de las proteínas. Además de la correlación inconstante entre la reducción de la tasa de crisis y el aumento de la HbF, el efecto citorreductor de hidroxicarbamida, sobre todo el descenso del número de neutrófilos, fue el factor más estrechamente relacionado con la reducción de la tasa de crisis Propiedades farmacocinéticas Absorción Tras la administración oral de 20 mg/kg de hidroxicarbamida se observa una absorción rápida: la concentración plasmática máxima, de 30 mg/l aproximadamente, se alcanza al cabo de 0,75 horas en niños y de 1,2 horas en adultos con anemia drepanocítica. La exposición total en las 24 horas siguientes a la administración es de 124 mg*h/l en niños y adolescentes y de 135 mg*h/l en pacientes adultos. La biodisponibilidad oral de la hidroxicarbamida es casi completa a juzgar por lo observado en otras indicaciones distintas de la anemia drepanocítica. Distribución La hidroxicarbamida se distribuye rápidamente en el cuerpo humano, entra en el líquido cefalorraquídeo, aparece en el líquido peritoneal y en el ascítico, y se concentra en leucocitos y eritrocitos. El volumen de distribución estimado de hidroxicarbamida es aproximadamente igual que el de agua total del organismo. El volumen de distribución en estado de equilibrio ajustado en función de la biodisponibilidad es de 0,57 l/kg en pacientes con anemia drepanocítica (lo que supone aproximadamente 72 l en niños y 90 l en adultos). Se desconoce el grado de unión de la hidroxicarbamida a las proteínas. Biotransformación No se conocen bien las vías de biotransformación ni los metabolitos. La urea es uno de ellos. La hidroxicarbamida en concentraciones de 30, 100 y 300 µm no es metabolizada in vitro por el sistema del citocromo P450 de los microsomas hepáticos humanos. En concentraciones de 10 a 300 µm, la hidroxicarbamida no estimula in vitro la actividad ATPasa de la glucoproteína P (GPP) recombinante humana, lo que indica que la hidroxicarbamida no es sustrato de la GPP. Por consiguiente, no es de esperar que se produzcan interacciones si se administra junto con sustratos de los citocromos P450 o de la GPP. Eliminación En un estudio sobre la administración de dosis reiteradas a pacientes adultos con anemia drepanocítica, se detectó aproximadamente el 60 % de la dosis de hidroxicarbamida en orina en estado de equilibrio. En adultos, el aclaramiento total ajustado en función de la biodisponibilidad fue de 9,89 l/h (0,16 l/h/kg); 5,64 l/h correspondieron al aclaramiento renal y 4,25 l/h al no renal. Los valores respectivos del aclaramiento total en niños fueron de 7,25 l/h (0,20 l/h/kg), 2,91 por vía renal y 4,34 l/h por otras vías. En adultos con anemia drepanocítica, la excreción acumulada media de hidroxicarbamida por orina fue del 62 % de la dosis administrada a las 8 horas, y por lo tanto superior a la observada en pacientes con cáncer (35 % 40 %). En pacientes con anemia drepanocítica, la hidroxicarbamida fue eliminada con una semivida de seis a siete horas, superior a lo notificado en otras indicaciones. Edad, raza, sexo No se dispone de información sobre diferencias farmacocinéticas debidas a la edad (excepto en niños), al sexo o a la raza. 18
19 Niños En pacientes pediátricos y adultos con anemia drepanocítica, la exposición sistémica a la hidroxicarbamida en estado de equilibrio fue similar en lo que respecta al área bajo la curva. Las concentraciones plasmáticas máximas y el volumen aparente de distribución con respecto al peso corporal fueron muy parecidos en todos los grupos de edad. El tiempo necesario para alcanzar la concentración plasmática máxima y el porcentaje de dosis eliminado por la orina fueron superiores en niños que en adultos. En niños, la semivida y el aclaramiento total en función del peso corporal fueron ligeramente superiores que en pacientes adultos (ver sección 4.2). Insuficiencia renal Como la excreción renal es una de las vías de eliminación, hay que considerar la posibilidad de reducir la dosis de Siklos en pacientes con insuficiencia renal. En un estudio abierto sobre la administración de una sola dosis a pacientes adultos con anemia drepanocítica (Yan JH y cols., 2005), se evaluó la influencia de la función renal en la farmacocinética de la hidroxicarbamida. Pacientes con función renal normal (aclaramiento de creatinina CrCl > 80 ml/min), y con insuficiencia renal leve (CrCl ml/min), moderada (CrCl 30 - < 60 ml/min) o grave (< 30 ml/min) recibieron una sola dosis de 15 mg/kg p.c. de hidroxicarbamida en cápsulas de 200 mg, 300 mg o 400 mg. En pacientes con CrCl inferior a 60 ml/min o en pacientes con nefropatía terminal, la exposición a la hidroxicarbamida fue aproximadamente un 64 % superior que en pacientes con función renal normal. Según se observó en otro estudio, en pacientes con CrCl < 60 ml/min, el área bajo la curva fue aproximadamente un 51 % mayor que en pacientes con CrCl 60 ml/min, lo que indica que en pacientes con CrCl 60 ml/min puede convenir reducir la dosis de hidroxicarbamida en un 50 %. La hemodiálisis redujo la exposición a la hidroxicarbamida en un 33 % (ver secciones 4.2 y 4.4). En estos pacientes se aconseja vigilar estrechamente los parámetros sanguíneos. Insuficiencia hepática No hay datos que permitan proponer instrucciones concretas para ajustar la dosis en pacientes con insuficiencia hepática pero, por seguridad, Siklos está contraindicado en pacientes con insuficiencia hepática grave (ver sección 4.3). En estos pacientes se aconseja vigilar estrechamente los parámetros sanguíneos Datos preclínicos sobre seguridad En los estudios no clínicos sobre toxicidad los efectos más frecuentes fueron depresión medular, atrofia linfoide y cambios degenerativos en el epitelio de los intestinos delgado y grueso. En algunas especies se observaron efectos cardiovasculares y alteraciones hematológicas. En ratas también se produjo atrofia testicular con reducción de la espermatogénesis, mientras que en perros se observó una detención reversible de la espermatogénesis. La hidroxicarbamida es inequívocamente genotóxica en gran variedad de pruebas. No se han realizado estudios convencionales a largo plazo sobre el poder carcinógeno de hidroxicarbamida. No obstante, se supone que es carcinógena para varias especies. La hidroxicarbamida atraviesa la barrera placentaria y se ha demostrado que, en la dosis terapéutica para seres humanos o en otras inferiores, tiene efectos teratógenos y embriotóxicos potentes en gran variedad de modelos con animales. El poder teratógeno se caracterizó por osificación parcial de los huesos del cráneo, ausencia de las cuencas oculares, hidrocefalia, esternebras bífidas, ausencia de vértebras lumbares. La embriotoxicidad se caracterizó por reducción de la viabilidad fetal, reducción del tamaño de las camadas vivas y retrasos del desarrollo. La administración de 60 mg/kg p.c./día de hidroxicarbamida a ratas macho (aproximadamente el doble de la dosis máxima recomendada en seres humanos) les produjo atrofia testicular, reducción de la espermatogénesis y reducción acusada de la capacidad de preñar a las hembras. 19
20 6. DATOS FARMACÉUTICOS 6.1. Lista de excipientes Estearil fumarato de sodio Celulosa microcristalina con sílice Copolímero de metacrilato butilado básico 6.2. Incompatibilidades No procede Periodo de validez 3 años. Periodo de validez en uso: los comprimidos rotos de Siklos mg sin usar deben introducirse de nuevo en el frasco y usarse en tres meses Precauciones especiales de conservación Conservar por debajo de 30 C. Consulte la sección 6.3 para ver la forma de guardar los comprimidos rotos sin usar Naturaleza y contenido del envase Frasco de polietileno de alta densidad (HDPE) con cierre de rosca de polipropileno) a prueba de niños con una unidad desecante. Tamaño de envase: 30 comprimidos recubiertos con película Precauciones especiales de eliminación y otras manipulaciones Siklos es un medicamento que debe manipularse con cuidado. Las personas que no toman Siklos (sobre todo las mujeres embarazadas) deben evitar el contacto con la hidroxicarbamida. Si para lograr la dosis necesaria tiene que partir el comprimido en dos o cuatro partes, debe hacerlo lejos de donde haya alimentos. Limpie con una toallita húmeda desechable el polvo que pudiera caer al romper el comprimido y tírela.. Siempre que se manipule Siklos, lávese las manos antes y después de tocar los comprimidos. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN París Francia Tel.: Fax: Correo electrónico: contact@addmedica.com 8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN EU/1/07/397/001 20
FICHA TÉCNICA. Pastillas circulares de color rosa con sabor a fresa y el icono de Strepsils grabado en ambos lados.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor fresa 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor fresa 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
FICHA TÉCNICA. STREPSILS pastillas para chupar sabor miel y limón
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor miel y limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor miel y limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
FICHA TÉCNICA. Excipientes con efecto conocido: 1,38 g de sacarosa y 1,10 g de glucosa.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor ciruela 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor ciruela 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
FICHA TÉCNICA. Cada comprimido contiene 10 mg de Cetirizina (DOE) dihidrocloruro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Coulergin 10 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de Cetirizina (DOE) dihidrocloruro.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Coulergin 10 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de Cetirizina (DOE) dihidrocloruro.
FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL
 FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Analgésico y antipirético (antitérmico, que reduce la fiebre). 1.2 Cómo actúa este fármaco: Inhibe un enzima que
FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Analgésico y antipirético (antitérmico, que reduce la fiebre). 1.2 Cómo actúa este fármaco: Inhibe un enzima que
Cada comprimido contiene 625 mg de glucosamina (en forma de hidrocloruro de glucosamina)
 1. DENOMINACIÓN DEL MEDICAMENTO Glucomed 625 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 625 mg de glucosamina (en forma de hidrocloruro de glucosamina) Para la lista
1. DENOMINACIÓN DEL MEDICAMENTO Glucomed 625 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 625 mg de glucosamina (en forma de hidrocloruro de glucosamina) Para la lista
FICHA TÉCNICA. Glucosa
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA NOMBRE DEL MEDICAMENTO Sueroral Hiposódico. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada sobre contiene: COMPONENTES CANTIDADES mmol/l
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA NOMBRE DEL MEDICAMENTO Sueroral Hiposódico. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada sobre contiene: COMPONENTES CANTIDADES mmol/l
FICHA TECNICA. Adultos y niños: Aplicar cinco veces al día aproximadamente cada cuatro horas omitiendo la aplicación de la noche.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
Tratamiento tópico de la psoriasis en placas de leve a moderadamente grave (psoriasis vulgar) con hasta un 35% de la superficie corporal afectada.
 agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO Silkis 3 microgramos/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 3 microgramos de
agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO Silkis 3 microgramos/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 3 microgramos de
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 0 1. NOMBRE DEL MEDICAMENTO VIRGAN 1,5 mg/g gel oftálmico 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 1g de gel contiene 1,5 mg de ganciclovir
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 0 1. NOMBRE DEL MEDICAMENTO VIRGAN 1,5 mg/g gel oftálmico 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 1g de gel contiene 1,5 mg de ganciclovir
FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO EchinaMed gotas orales en solución 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 1 ml [= 0.905g] contiene: 860 mg de extracto (como tintura) de la parte aérea fresca
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO EchinaMed gotas orales en solución 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 1 ml [= 0.905g] contiene: 860 mg de extracto (como tintura) de la parte aérea fresca
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH)
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH) 1 / 5 1. NOMBRE DEL MEDICAMENTO Lycopodium 12DH, glóbulos 2. COMPOSICIÓN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH) 1 / 5 1. NOMBRE DEL MEDICAMENTO Lycopodium 12DH, glóbulos 2. COMPOSICIÓN
FICHA TÉCNICA. Cada cápsula contiene: Metilcelulosa... 500 mg. Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Muciplazma 500 mg cápsulas duras FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Metilcelulosa... 500 mg Para consultar la lista completa de excipientes
1. NOMBRE DEL MEDICAMENTO Muciplazma 500 mg cápsulas duras FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Metilcelulosa... 500 mg Para consultar la lista completa de excipientes
GUÍA PARA EL PACIENTE. Información importante acerca de su tratamiento o el de su hijo. Disponible en la web de la AEMPS www.aemps.gob.
 GUÍA PARA EL PACIENTE Información importante acerca de su tratamiento o el de su hijo Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos autorizada por la Agencia
GUÍA PARA EL PACIENTE Información importante acerca de su tratamiento o el de su hijo Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos autorizada por la Agencia
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ácidos Omega 3 ratiopharm 1000 mg cápsulas blandas EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula blanda contiene 1.000
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ácidos Omega 3 ratiopharm 1000 mg cápsulas blandas EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula blanda contiene 1.000
FICHA TECNICA. Alivio local de los síntomas ocasionados por el herpes labial, tales como: picor, escozor u hormigueo.
 agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
Tratamiento con Hidroxiurea contra la Enfermedad de Células Falciformes
 Tratamiento con Hidroxiurea contra la Enfermedad de Células Falciformes antes de hidroxiurea después de hidroxiurea Tratamiento con Hidroxiurea contra la Enfermedad de Células Falciformes 1 Este documento
Tratamiento con Hidroxiurea contra la Enfermedad de Células Falciformes antes de hidroxiurea después de hidroxiurea Tratamiento con Hidroxiurea contra la Enfermedad de Células Falciformes 1 Este documento
Advertencias y precauciones especiales de empleo
 1 - NOMBRE DEL MEDICAMENTO GINKGO MADAUS Extracto de Ginkgo biloba 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Una medida de 1,5 ml contiene: Extracto estandarizado seco de hojas de Ginkgo biloba, obtenido
1 - NOMBRE DEL MEDICAMENTO GINKGO MADAUS Extracto de Ginkgo biloba 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Una medida de 1,5 ml contiene: Extracto estandarizado seco de hojas de Ginkgo biloba, obtenido
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO. EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml (que equivale aproximadamente a 25 gotas) contiene como principio activo: Picosulfato
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml (que equivale aproximadamente a 25 gotas) contiene como principio activo: Picosulfato
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 Anexo III Modificaciones a incluir en las secciones relevantes de la ficha técnica o resumen de las características del producto, etiquetado y prospecto 20 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS
Anexo III Modificaciones a incluir en las secciones relevantes de la ficha técnica o resumen de las características del producto, etiquetado y prospecto 20 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS
Qué es la tarjeta amarilla?
 Qué es la tarjeta amarilla? Es el formulario de recogida de sospechas de reacciones adversas, editada en color amarillo, y distribuida por el Centro Autonómico de Farmacovigilancia del Principado de Asturias
Qué es la tarjeta amarilla? Es el formulario de recogida de sospechas de reacciones adversas, editada en color amarillo, y distribuida por el Centro Autonómico de Farmacovigilancia del Principado de Asturias
Cada sobre de MOVICOL Pediátrico contiene los siguientes principios activos:
 agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO MOVICOL Pediátrico 6,9 g sobre, polvo para solución oral. 2. COMPOSICIÓN
agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO MOVICOL Pediátrico 6,9 g sobre, polvo para solución oral. 2. COMPOSICIÓN
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Zulex 333 mg Comprimidos recubiertos Acamprosato
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Zulex 333 mg Comprimidos recubiertos Acamprosato Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya que puede
PROSPECTO: INFORMACIÓN PARA EL USUARIO Zulex 333 mg Comprimidos recubiertos Acamprosato Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya que puede
Se administrarán de 120 a 240 mg de extracto al día repartidos en tres tomas, la duración del tratamiento será de 6-8 semanas.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO GINKGO BILOBA BESCANSA. Solución oral Extracto estandarizado seco de Ginkgo biloba L. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Por ml: 40 mg de extracto estandarizado
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO GINKGO BILOBA BESCANSA. Solución oral Extracto estandarizado seco de Ginkgo biloba L. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Por ml: 40 mg de extracto estandarizado
Anexo III. Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto
 Anexo III Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto Nota: Esta Ficha Técnica o Resumen de las Características del producto y prospecto son
Anexo III Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto Nota: Esta Ficha Técnica o Resumen de las Características del producto y prospecto son
Ensayos Clínicos en Oncología
 Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
GLUCOSAMINA NORMON 1500 mg Polvo para solución oral EFG.
 1. NOMBRE DEL MEDICAMENTO GLUCOSAMINA NORMON 1500 mg Polvo para solución oral EFG. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada sobre contiene 1.500 mg de glucosamina sulfato como 1.884 mg de glucosamina
1. NOMBRE DEL MEDICAMENTO GLUCOSAMINA NORMON 1500 mg Polvo para solución oral EFG. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada sobre contiene 1.500 mg de glucosamina sulfato como 1.884 mg de glucosamina
Calcitonina Almirall 100 UI Solución inyectable Calcitonina sintética de salmón
 Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Plasimine está indicado para el tratamiento de las siguientes infecciones cutáneas causadas por microorganismos sensibles (ver sección 5.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Plasimine 20 mg/g pomada 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene; Mupirocina
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Plasimine 20 mg/g pomada 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene; Mupirocina
2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO HERPIAL 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (D.O.E.)... 50 mg Excipientes: propilenglicol..400 mg Para la lista completa de
1. NOMBRE DEL MEDICAMENTO HERPIAL 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (D.O.E.)... 50 mg Excipientes: propilenglicol..400 mg Para la lista completa de
Debe utilizarse la dosis eficaz mínima durante el periodo más corto posible a fin de reducir las reacciones adversas.
 ANEXO III 1 ENMIENDAS A INCLUIR EN LAS SECCIONES RELEVANTES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTIENEN NIMESULIDA (FORMULACIONES SISTÉMICAS) El texto añadido aparece
ANEXO III 1 ENMIENDAS A INCLUIR EN LAS SECCIONES RELEVANTES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTIENEN NIMESULIDA (FORMULACIONES SISTÉMICAS) El texto añadido aparece
FICHA TÉCNICA. Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTOS FICHA TÉCNICA Loratadina NORMON 10 mg Comprimidos EFG. Loratadina NORMON 1 mg/ml Jarabe EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina.
1. NOMBRE DEL MEDICAMENTOS FICHA TÉCNICA Loratadina NORMON 10 mg Comprimidos EFG. Loratadina NORMON 1 mg/ml Jarabe EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina.
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. 20 g/100 ml
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: CLORURO DE SODIO 20 % Forma farmacéutica: Solución concentrada para infusión IV Fortaleza: Presentación: Titular del Registro Sanitario,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: CLORURO DE SODIO 20 % Forma farmacéutica: Solución concentrada para infusión IV Fortaleza: Presentación: Titular del Registro Sanitario,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ACICLOVIR NORMON 200 mg Comprimidos EFG. ACICLOVIR NORMON 800 mg Comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ACICLOVIR NORMON 200 mg Comprimidos EFG
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ACICLOVIR NORMON 200 mg Comprimidos EFG. ACICLOVIR NORMON 800 mg Comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ACICLOVIR NORMON 200 mg Comprimidos EFG
FICHA TÉCNICA. Se deberá respetar la dosis diaria recomendada independientemente de la extensión de la alopecia.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA Regaxidil 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA Regaxidil 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
4.2 Posología y forma de administración
 1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
Se recomienda beber un vaso de agua después de cada dosis y abundante líquido durante el día.
 agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 1. NOMBRE DEL MEDICAMENTO POSTINOR 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Excipientes en el apartado 6.1. Comprimidos. Los comprimidos son
1. NOMBRE DEL MEDICAMENTO POSTINOR 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Excipientes en el apartado 6.1. Comprimidos. Los comprimidos son
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FormulaExpec 13,33 mg/ml jarabe sabor miel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Principio
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FormulaExpec 13,33 mg/ml jarabe sabor miel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Principio
ANEXO CONDICIONES O RESTRICCIONES RESPECTO AL USO SEGURO Y EFICAZ DEL MEDICAMENTO A APLICAR POR LOS ESTADOS MIEMBROS
 ANEXO CONDICIONES O RESTRICCIONES RESPECTO AL USO SEGURO Y EFICAZ DEL MEDICAMENTO A APLICAR POR LOS ESTADOS MIEMBROS 1 Los Estados Miembros se tienen que asegurar de que se apliquen todas las condiciones
ANEXO CONDICIONES O RESTRICCIONES RESPECTO AL USO SEGURO Y EFICAZ DEL MEDICAMENTO A APLICAR POR LOS ESTADOS MIEMBROS 1 Los Estados Miembros se tienen que asegurar de que se apliquen todas las condiciones
1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA. 2. ANTES DE USAR Minoxidil Viñas 5% solución cutánea
 1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA Minoxidil Viñas 5% es una solución para uso cutáneo. La solución es transparente, incolora o muy débilmente amarillenta. Se presenta
1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA Minoxidil Viñas 5% es una solución para uso cutáneo. La solución es transparente, incolora o muy débilmente amarillenta. Se presenta
FICHA TÉCNICA. Carbocisteína 50 mg
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO cinfamucol carbocisteína 50 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Carbocisteína 50 mg Excipientes: maltitol líquido (E-965):
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO cinfamucol carbocisteína 50 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Carbocisteína 50 mg Excipientes: maltitol líquido (E-965):
ETOPOSIDO 100mg/5mL. 1. Identificación del Medicamento. Nombre Comercial. Etoposido 100mg/5mL Solución Inyectable. Nombre Genérico.
 ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Clarityne 10 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina.
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Clarityne 10 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada mililitro contiene 50 mg de carbocisteína. Para consultar la lista completa de excipientes,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada mililitro contiene 50 mg de carbocisteína. Para consultar la lista completa de excipientes,
SIM EXPRESS Información dirigida a los profesionales de la salud Teriflunomida
 COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos 23/04/2015 SIM EXPRESS Información dirigida
COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos 23/04/2015 SIM EXPRESS Información dirigida
Anticoncepción oral sin estrógenos Qué debes saber?
 Anticoncepción oral sin estrógenos Qué debes saber? Anticoncepción oral sin estrógenos Qué debes saber? Qué es la píldora sin estrógenos? Cómo funciona? Cuándo iniciar el tratamiento con la píldora sin
Anticoncepción oral sin estrógenos Qué debes saber? Anticoncepción oral sin estrógenos Qué debes saber? Qué es la píldora sin estrógenos? Cómo funciona? Cuándo iniciar el tratamiento con la píldora sin
-Usar el preservativo, que evita el contagio de otras enfermedades de transmisión sexual.
 Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO normoginkgo 70 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película de normoginkgo contiene: 70 mg de Extracto
1. NOMBRE DEL MEDICAMENTO normoginkgo 70 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película de normoginkgo contiene: 70 mg de Extracto
El sobrepeso puede reducir seriamente la calidad de vida de su perro.
 El sobrepeso puede reducir seriamente la calidad de vida de su perro. Un perro con sobrepeso puede no sentirse tan bien como realmente podría. De hecho, si su perro Tiene problemas a la hora de levantarse
El sobrepeso puede reducir seriamente la calidad de vida de su perro. Un perro con sobrepeso puede no sentirse tan bien como realmente podría. De hecho, si su perro Tiene problemas a la hora de levantarse
Menalgil B 6 Comprimidos
 agencia española de medicamentos y productos sanitarios Menalgil B 6 Comprimidos 1. NOMBRE DEL MEDICAMENTO MENALGIL B 6 Comprimidos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA MENALGIL B 6 Comprimidos Cada
agencia española de medicamentos y productos sanitarios Menalgil B 6 Comprimidos 1. NOMBRE DEL MEDICAMENTO MENALGIL B 6 Comprimidos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA MENALGIL B 6 Comprimidos Cada
MIELOMA MULTIPLE. Se manifiesta en estos pacientes, debilidad, fatiga, y hemorragias como consecuencia de una medula ósea insuficiente.
 MIELOMA MULTIPLE 1. Qué es el mieloma múltiple? Es un cáncer de unas células llamadas plasmáticas, que nacen de nuestro sistema de defensa llamado también inmunológico, éstas células que producen a las
MIELOMA MULTIPLE 1. Qué es el mieloma múltiple? Es un cáncer de unas células llamadas plasmáticas, que nacen de nuestro sistema de defensa llamado también inmunológico, éstas células que producen a las
VARICELA INTRODUCCIÓN INDICACIONES
 VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
Estudios Pre-clínicos y Clínicos
 Estudios Pre-clínicos y Clínicos Rocío Ramírez Herrera Dictaminadoras Especializadas Norma Edith Soto Ruíz DIRECCIÓN EJECUTIVA DE AUTORIZACIÓN DE PRODUCTOS Y ESTABLECIMIENTOS 1 ESTUDIOS PRECLÍNICOS Conjunto
Estudios Pre-clínicos y Clínicos Rocío Ramírez Herrera Dictaminadoras Especializadas Norma Edith Soto Ruíz DIRECCIÓN EJECUTIVA DE AUTORIZACIÓN DE PRODUCTOS Y ESTABLECIMIENTOS 1 ESTUDIOS PRECLÍNICOS Conjunto
Qué medicamentos debo tomar en diálisis?
 Qué medicamentos debo tomar en diálisis? Ahora que empiezo diálisis, qué medicamentos debo o puedo tomar? La diálisis sustituye algunas funciones del riñon sano, pero no todas; por este motivo, será necesario
Qué medicamentos debo tomar en diálisis? Ahora que empiezo diálisis, qué medicamentos debo o puedo tomar? La diálisis sustituye algunas funciones del riñon sano, pero no todas; por este motivo, será necesario
PREGUNTAS FRECUENTES SOBRE VPH.
 PREGUNTAS FRECUENTES SOBRE VPH. Qué es el VPH? El Virus del Papiloma Humano VPH es una familia de virus que afecta muy frecuentemente a los seres humanos. Existen alrededor de 100 tipos de VPH, de los
PREGUNTAS FRECUENTES SOBRE VPH. Qué es el VPH? El Virus del Papiloma Humano VPH es una familia de virus que afecta muy frecuentemente a los seres humanos. Existen alrededor de 100 tipos de VPH, de los
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO (08/03/2012)
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO (08/03/2012) 1. NOMBRE DEL MEDICAMENTO Lizipadol 20 mg pastillas para chupar 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una pastilla para
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO (08/03/2012) 1. NOMBRE DEL MEDICAMENTO Lizipadol 20 mg pastillas para chupar 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una pastilla para
FICHA TÉCNICA. Este medicamento contiene 0.00064 mg de dióxido de azufre por sobre.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Casenlax 4 g polvo para solución oral en sobre 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 4 g de macrogol 4000. Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Casenlax 4 g polvo para solución oral en sobre 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 4 g de macrogol 4000. Excipientes con efecto conocido:
FICHA TÉCNICA. Líquido oral. Líquido oleoso homogéneo, transparente, de color amarillo pálido
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO Ordelax 756,6 mg/ml líquido oral 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de líquido oral contiene: Parafina líquida...756,6 mg. Para consultar la lista
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO Ordelax 756,6 mg/ml líquido oral 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de líquido oral contiene: Parafina líquida...756,6 mg. Para consultar la lista
FICHA TÉCNICA. Glucosamina Teva 1.500 mg polvo para solución oral EFG
 1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
Prospecto: Información para el usuario. Aciclovir STADA 200 mg comprimidos EFG
 Prospecto: Información para el usuario Aciclovir STADA 200 mg comprimidos EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
Prospecto: Información para el usuario Aciclovir STADA 200 mg comprimidos EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CETIRIZINA 10 mg COMPRIMIDOS RECUBIERTOS ANTIHISTAMINICO Página 1 CETIRIZINA 10 mg Comprimidos Recubiertos Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CETIRIZINA 10 mg COMPRIMIDOS RECUBIERTOS ANTIHISTAMINICO Página 1 CETIRIZINA 10 mg Comprimidos Recubiertos Principio
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS VICTRELIS (BOCEPREVIR): INTERACCIÓN CON LOS INHIBIDORES DE LA PROTEASA DEL VIH ATAZANAVIR, DARUNAVIR Y LOPINAVIR Fecha de
Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS VICTRELIS (BOCEPREVIR): INTERACCIÓN CON LOS INHIBIDORES DE LA PROTEASA DEL VIH ATAZANAVIR, DARUNAVIR Y LOPINAVIR Fecha de
APRENDIENDO CON NEFRON SUPERHEROE
 APRENDIENDO CON NEFRON SUPERHEROE DIABETES - UN FACTOR DE RIESGO PARA LA ENFERMEDAD RENAL La Diabetes mellitus, generalmente conocida como diabetes, es una enfermedad en la que su cuerpo no produce suficiente
APRENDIENDO CON NEFRON SUPERHEROE DIABETES - UN FACTOR DE RIESGO PARA LA ENFERMEDAD RENAL La Diabetes mellitus, generalmente conocida como diabetes, es una enfermedad en la que su cuerpo no produce suficiente
Introducción. Nuevos anticoagulantes orales
 Progresos en la prevención del ACV asociado a la fibrilación auricular Dabigatrán, rivaroxabán y apixabán son anticoagulantes orales nuevos que pueden ser una alternativa a la warfarina en el tratamiento
Progresos en la prevención del ACV asociado a la fibrilación auricular Dabigatrán, rivaroxabán y apixabán son anticoagulantes orales nuevos que pueden ser una alternativa a la warfarina en el tratamiento
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mucosan 30 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 30 mg de ambroxol hidrocloruro.
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mucosan 30 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 30 mg de ambroxol hidrocloruro.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Miclast10mg/ml solución cutánea EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Miclast10mg/ml solución cutánea EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución cutánea contiene 10 mg de ciclopirox olamina. Descripción general
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Miclast10mg/ml solución cutánea EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución cutánea contiene 10 mg de ciclopirox olamina. Descripción general
Anticoncepcion de Emergencia
 Anticoncepcion de Emergencia La anticoncepción de emergencia o anticoncepción postcoital se refiere a las píldoras anticonceptivas que tomadas después del acto sexual pueden prevenir el embarazo La anticoncepción
Anticoncepcion de Emergencia La anticoncepción de emergencia o anticoncepción postcoital se refiere a las píldoras anticonceptivas que tomadas después del acto sexual pueden prevenir el embarazo La anticoncepción
Prospecto: información para el usuario. Angileptol comprimidos para chupar sabor miel-limón Clorhexidina/Benzocaína/Enoxolona
 Prospecto: información para el usuario Angileptol comprimidos para chupar sabor miel-limón Clorhexidina/Benzocaína/Enoxolona Lea todo el prospecto detenidamente porque contiene información importante para
Prospecto: información para el usuario Angileptol comprimidos para chupar sabor miel-limón Clorhexidina/Benzocaína/Enoxolona Lea todo el prospecto detenidamente porque contiene información importante para
Repafet. Rupatadina Tabletas. Rupatadina II.- DENOMINACIÓN GENÉRICA: III.- FORMA FARMACÉUTICA Y FORMULACIÓN:
 Repafet Rupatadina Tabletas II.- DENOMINACIÓN GENÉRICA: Rupatadina III.- FORMA FARMACÉUTICA Y FORMULACIÓN: Cada tableta contiene: Fumarato de Rupatadina equivalente a... 10 mg de Rupatadina Excipiente
Repafet Rupatadina Tabletas II.- DENOMINACIÓN GENÉRICA: Rupatadina III.- FORMA FARMACÉUTICA Y FORMULACIÓN: Cada tableta contiene: Fumarato de Rupatadina equivalente a... 10 mg de Rupatadina Excipiente
MÁS QUE UN ESTORNUDO. Preguntas más frecuentes. Con la colaboración de: + que un estornud. www.masqueunestornudo.es. www.portalfarma.
 MÁS QUE UN ESTORNUDO Preguntas más frecuentes Con la colaboración de: www.masqueunestornudo.es www.portalfarma.com Preguntas más frecuentes en la oficina de farmacia A continuación se detallan las preguntas
MÁS QUE UN ESTORNUDO Preguntas más frecuentes Con la colaboración de: www.masqueunestornudo.es www.portalfarma.com Preguntas más frecuentes en la oficina de farmacia A continuación se detallan las preguntas
Prospecto: información para el usuario. Atosiban Genfarma 6,75 mg/0,9 ml solución inyectable EFG. Atosiban
 Prospecto: información para el usuario Atosiban Genfarma 6,75 mg/0,9 ml solución inyectable EFG Atosiban Lea todo el prospecto detenidamente antes de que le administren el medicamento, porque contiene
Prospecto: información para el usuario Atosiban Genfarma 6,75 mg/0,9 ml solución inyectable EFG Atosiban Lea todo el prospecto detenidamente antes de que le administren el medicamento, porque contiene
ALBENDAZOL 100 mg / 5 ml Suspensión
 ALBENDAZOL 100 mg / 5 ml Suspensión ALBENDAZOL 100 mg / 5 ml Suspensión COMPOSICIÓN: Cada 100 ml contiene: Albendazol 2 mg Excipientes c.s.p INDICACIONES: Indicado en el tratamiento de Hidatidosis; Neurocisticercosis;
ALBENDAZOL 100 mg / 5 ml Suspensión ALBENDAZOL 100 mg / 5 ml Suspensión COMPOSICIÓN: Cada 100 ml contiene: Albendazol 2 mg Excipientes c.s.p INDICACIONES: Indicado en el tratamiento de Hidatidosis; Neurocisticercosis;
FICHA TÉCNICA. Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125 g Lisozima hidrocloruro...0,100 g Neomicina (sulfato)...
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
EchinaMed Junior, comprimidos
 EchinaMed Junior, comprimidos PROSPECTO: información para el usuario Lea todo el prospecto detenidamente porque tiene información importante para Ud. Este medicamento puede obtenerse sin receta, para el
EchinaMed Junior, comprimidos PROSPECTO: información para el usuario Lea todo el prospecto detenidamente porque tiene información importante para Ud. Este medicamento puede obtenerse sin receta, para el
Gel/Crema para uso cutáneo Gel homogéneo incoloro o de color amarillo pálido o ligeramente marrón. Crema blanca, brillante.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ROZEX 7,5 mg/g Gel tópico ROZEX 7,5 mg/g Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 gramo de gel/crema contiene 7,5 mg de metronidazol Para consultar la lista
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ROZEX 7,5 mg/g Gel tópico ROZEX 7,5 mg/g Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 gramo de gel/crema contiene 7,5 mg de metronidazol Para consultar la lista
FICHA TECNICA. Un comprimido con cubierta pelicular contiene 8,42 mg de cetirizina como cetirizina diclorhidrato 10 mg. Para excipientes Ver 6.1.
 agencia española de medicamentos y productos sanitarios FICHA TECNICA DENOMINACIÓN DEL MEDICAMENTO CETIRIZINA BEXAL 10 mg comprimidos con cubierta pelicular EFG. COMPOSICION CUALITATIVA Y CUANTITATIVA
agencia española de medicamentos y productos sanitarios FICHA TECNICA DENOMINACIÓN DEL MEDICAMENTO CETIRIZINA BEXAL 10 mg comprimidos con cubierta pelicular EFG. COMPOSICION CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ciclopirox olamina ISDIN 15 mg/g champú 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de champú contiene 15
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ciclopirox olamina ISDIN 15 mg/g champú 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de champú contiene 15
Peroxiben está indicado para el tratamiento local sintomático del acné vulgar moderado.
 1. NOMBRE DEL MEDICAMENTO Peroxiben 100 mg/g gel Peroxiben 50 mg/g gel Peroxiben 25 mg/g gel FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Peroxiben 100 mg/g gel Cada gramo contiene: Principio
1. NOMBRE DEL MEDICAMENTO Peroxiben 100 mg/g gel Peroxiben 50 mg/g gel Peroxiben 25 mg/g gel FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Peroxiben 100 mg/g gel Cada gramo contiene: Principio
Comprimidos recubiertos con película, redondos, de color blanquecino y grabado 100 en una cara.
 1. NOMBRE DEL MEDICAMENTO Siklos 100 mg comprimidos recubiertos con película.. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Siklos 100 mg comprimidos recubiertos con película Cada comprimido contiene 100
1. NOMBRE DEL MEDICAMENTO Siklos 100 mg comprimidos recubiertos con película.. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Siklos 100 mg comprimidos recubiertos con película Cada comprimido contiene 100
FICHA TÉCNICA. Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
Maleato de acepromacina: 17 mg (equivalente a 12,5 mg de acepromacina base) Excipiente c.s. para 1 comprimido
 agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO VETERINARIO CALMIVET COMPRIMIDOS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Maleato
agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO VETERINARIO CALMIVET COMPRIMIDOS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Maleato
Qué es? Los Antimaláricos en Reumatología
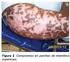 30 Qué es? Los Antimaláricos en Reumatología 30 Qué es? Los Antimaláricos en Reumatología Son un grupo de medicamentos (también llamados antipalúdicos) que se han usado clásicamente para tratar el paludismo
30 Qué es? Los Antimaláricos en Reumatología 30 Qué es? Los Antimaláricos en Reumatología Son un grupo de medicamentos (también llamados antipalúdicos) que se han usado clásicamente para tratar el paludismo
Comprimidos recubiertos redondos, blancos marcados con 333 en una cara.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO CAMPRAL 333 mg comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Acamprosato, 333 mg Para consultar la lista completa de excipientes, ver sección
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO CAMPRAL 333 mg comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Acamprosato, 333 mg Para consultar la lista completa de excipientes, ver sección
Este medicamento debe ser usado exclusivamente bajo prescripción y vigilancia médica y no puede repetirse sin nueva receta médica.
 DORMID 15mg/3ml MIDAZOLAM5mg/ml Solucióninyectable IndustriaHolandesa Ventabajorecetaarchivada Estemedicamentodebeserusadoexclusivamentebajoprescripciónyvigilanciamédicaynopuederepetirsesin nuevarecetamédica.
DORMID 15mg/3ml MIDAZOLAM5mg/ml Solucióninyectable IndustriaHolandesa Ventabajorecetaarchivada Estemedicamentodebeserusadoexclusivamentebajoprescripciónyvigilanciamédicaynopuederepetirsesin nuevarecetamédica.
Alivio temporal de los síntomas de la conjuntivitis alérgica tales como: picor de ojos, lagrimeo y enrojecimiento.
 V 3.0 1. NOMBRE DEL MEDICAMENTO REACTINE Levocabastina 0,5mg/ml colirio en suspensión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Levocabastina (como hidrocloruro) equivalente a 0,5 mg
V 3.0 1. NOMBRE DEL MEDICAMENTO REACTINE Levocabastina 0,5mg/ml colirio en suspensión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Levocabastina (como hidrocloruro) equivalente a 0,5 mg
ALERGIA A MEDICAMENTOS
 ALERGIA A MEDICAMENTOS 1 QUE REACCIONES ADVERSAS PUEDEN CAUSAR LOS MEDICAMENTOS? Los medicamentos tienen como función curar enfermedades pero sin embargo en ocasiones pueden causar problemas. Dentro de
ALERGIA A MEDICAMENTOS 1 QUE REACCIONES ADVERSAS PUEDEN CAUSAR LOS MEDICAMENTOS? Los medicamentos tienen como función curar enfermedades pero sin embargo en ocasiones pueden causar problemas. Dentro de
FICHA TÉCNICA. Alivio local sintomático de las infecciones leves de boca y garganta que cursan con dolor y sin fiebre.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO STREPSILS CON LIDOCAINA pastillas para chupar. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla: Amilmetacresol hidrocloruro... 0,6mg Alcohol 2,4- diclorobencílico.......1,2mg
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO STREPSILS CON LIDOCAINA pastillas para chupar. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla: Amilmetacresol hidrocloruro... 0,6mg Alcohol 2,4- diclorobencílico.......1,2mg
ACICLOVIR STADA COMPRIMIDOS EFG
 1. NOMBRE DEL MEDICAMENTO ACICLOVIR STADA 200 mg COMPRIMIDOS ACICLOVIR STADA 800 mg COMPRIMIDOS ACICLOVIR STADA COMPRIMIDOS EFG 2. COMPOSICIÓN CUALITITATIVA Y CUANTITATIVA ACICLOVIR STADA 200 mg COMPRIMIDOS,
1. NOMBRE DEL MEDICAMENTO ACICLOVIR STADA 200 mg COMPRIMIDOS ACICLOVIR STADA 800 mg COMPRIMIDOS ACICLOVIR STADA COMPRIMIDOS EFG 2. COMPOSICIÓN CUALITITATIVA Y CUANTITATIVA ACICLOVIR STADA 200 mg COMPRIMIDOS,
Prospecto: información para el usuario. Cebión 500 mg granulado para solución oral. Ácido ascórbico (Vitamina C)
 Prospecto: información para el usuario Cebión 500 mg granulado para solución oral Ácido ascórbico (Vitamina C) Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el usuario Cebión 500 mg granulado para solución oral Ácido ascórbico (Vitamina C) Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Cada comprimido de Pramipexol Actavis 0,18 mg contiene 0,18 mg de pramipexol base (como 0,25 mg de dihidrocloruro de pramipexol monohidrato).
 1. NOMBRE DEL MEDICAMENTO Pramipexol Actavis 0,18 mg comprimidos EFG Pramipexol Actavis 0,7 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Pramipexol Actavis 0,18 mg contiene
1. NOMBRE DEL MEDICAMENTO Pramipexol Actavis 0,18 mg comprimidos EFG Pramipexol Actavis 0,7 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Pramipexol Actavis 0,18 mg contiene
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO. GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Cada cápsula dura contiene:
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene: Diacereína,
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene: Diacereína,
INFORMACIÓN GENERAL SOBRE LA ENFERMEDAD POR VIRUS ÉBOLA Y EL ACTUAL BROTE EN ÁFRICA OCCIDENTAL GUINEA, LIBERIA, SIERRA LEONA Y NIGERIA
 INFORMACIÓN GENERAL SOBRE LA ENFERMEDAD POR VIRUS ÉBOLA Y EL ACTUAL BROTE EN ÁFRICA OCCIDENTAL GUINEA, LIBERIA, SIERRA LEONA Y NIGERIA QUÉ ES LA ENFERMEDAD DEL ÉBOLA? La enfermedad del Ébola es una enfermedad
INFORMACIÓN GENERAL SOBRE LA ENFERMEDAD POR VIRUS ÉBOLA Y EL ACTUAL BROTE EN ÁFRICA OCCIDENTAL GUINEA, LIBERIA, SIERRA LEONA Y NIGERIA QUÉ ES LA ENFERMEDAD DEL ÉBOLA? La enfermedad del Ébola es una enfermedad
Virus del Ébola ÉBOLA. Durante un brote, quienes mayor riesgo de infección corren son:
 ÉBOLA Lo que se debemos saber. 1. Qué es la enfermedad provocada por el virus del Ébola? Denominada anteriormente Fiebre hemorrágica del Ébola, es una enfermedad grave y con frecuencia letal, cuya tasa
ÉBOLA Lo que se debemos saber. 1. Qué es la enfermedad provocada por el virus del Ébola? Denominada anteriormente Fiebre hemorrágica del Ébola, es una enfermedad grave y con frecuencia letal, cuya tasa
1.3.1 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO, ETIQUETADO Y PROSPECTO
 agencia española de medicamentos y productos sanitarios 1.3.1 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO, ETIQUETADO Y PROSPECTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PENTASA 2 g granulado de liberación
agencia española de medicamentos y productos sanitarios 1.3.1 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO, ETIQUETADO Y PROSPECTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PENTASA 2 g granulado de liberación
Importancia de la investigación clínica EN ONCOLOGÍA. ONCOvida. oncovida_20.indd 1 10/10/11 12:53
 Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FOSFOEVAC 10,8g / 24,4g solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada frasco contiene: Fosfato disódico
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FOSFOEVAC 10,8g / 24,4g solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada frasco contiene: Fosfato disódico
FICHA TÉCNICA. Solución estéril inyectable por vía intramuscular (preferiblemente) o subcutánea. Pneumo 23 es un líquido transparente e incoloro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
