Vacuna de virus vivo contra el herpes zóster (Oka/Merck), MSD.
|
|
|
- José Ángel Padilla Moreno
- hace 6 años
- Vistas:
Transcripción
1 I. NOMBRE COMERCIAL II. NOMBRE GENÉRICO Vacuna de virus vivo contra el herpes zóster (Oka/Merck), MSD. III. FÓRMULA Y FORMA FARMACÉUTICA En un frasco, polvo para reconstituir y, en otro frasco, diluente para constituir la suspensión inyectable. ZOSTAVAX es un preparado liofilizado de la cepa Oka/Merck del virus de la varicela/zóster vivo atenuado. Ingredientes activos Cuando se reconstituye como se indica, ZOSTAVAX es un preparado estéril para administración subcutánea. Una vez reconstituido y mantenido a la temperatura ambiente hasta durante 30 minutos, cada dosis de 0.65 ml contiene un mínimo de 19,400 unidades formadoras de placas del virus Oka/Merck de varicela-zóster. Ingredientes inactivos Cada dosis de 0.65 ml contiene mg de sacarosa, mg de gelatina hidrolizada porcina, 8.55 mg de urea, 5.25 mg de cloruro de sodio, 0.82 mg de L-glutamato monosódico, 0.75 mg de fosfato dibásico de sodio, 0.13 mg de fosfato monobásico de potasio, 0.13 mg de cloruro de potasio, componentes residuales de células MRC-5 (incluyendo ADN y proteína), y trazas de neomicina y de suero de ternero. El producto no contiene ningún conservador. IV. INDICACIONES TERAPÉUTICAS ZOSTAVAX está indicado para: prevenir el herpes zóster prevenir la neuralgia posherpética disminuir el dolor asociado con el herpes zóster agudo o crónico. ZOSTAVAX está indicado para inmunizar a personas mayores de 50 años. Marca registrada de Merck Sharp & Dohme Corp., una subsidiaria de Merck & Co., Inc., Whitehouse Station, NJ, Estados Unidos. D.R Merck Sharp & Dohme Corp., una subsidiaria de MERCK & CO., Inc., Whitehouse Station, NJ, Estados Unidos. Reservados todos los derechos. 1
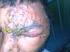
2 ZOSTAVAX se puede administrar concomitantemente con la vacuna inactivada contra influenza (véase XIII DOSIS Y VÍA DE ADMINISTRACIÓN y Estudios Clínicos en V. FARMACOCINÉTICA Y FARMACODINAMIA EN HUMANOS). V. FARMACOCINÉTICA Y FARMACODINAMIA EN HUMANOS Herpes zóster El herpes zóster (HZ, llamado también simplemente zóster, o zona) es una manifestación de la reactivación del virus de varicela-zóster, que como infección primaria produce la varicela. Tras la infección inicial el virus permanece latente en los ganglios de las raíces posteriores o de los nervios craneales sensitivos, hasta que se reactiva y causa el HZ. Usualmente éste se caracteriza por una erupción cutánea vesicular, unilateral, dolorosa, que se distribuye en el dermatoma correspondiente. Aunque la erupción vesicular es la característica más distintiva del zóster, el síntoma que con más frecuencia afecta al paciente es el dolor, que puede ocurrir durante la fase prodrómica, la fase de erupción aguda y la fase posherpética de la infección. Se ha reportado que durante la fase eruptiva aguda hasta 90% de los pacientes inmunocompetentes presentan dolor local. Cualquier persona que se haya infectado con el virus de varicela-zóster, incluso las que no tienen historia clínica de varicela, está en riesgo de padecer HZ, que se considera debido a la disminución progresiva de la inmunidad al virus. En Estados Unidos casi todos los adultos (~98%) son susceptibles al zóster, se calcula que ocurren un millón de casos al año, y se prevé que ese número aumentará a medida que aumenta el promedio de edad de la población. La incidencia y la intensidad del HZ y de sus complicaciones aumentan considerablemente con la edad; dos tercios de los casos ocurren en personas mayores de 50 años. En estudios recientes se ha estimado que el riesgo de padecerlo es de hasta 30% en la población general, y se calcula que 50% de las personas de 85 años habrán experimentado un episodio de HZ. De 70 a 80% de las hospitalizaciones por zóster ocurren en personas inmunocompetentes. En Estados Unidos, cada año hay 50,000 a 60,000 hospitalizaciones relacionadas con el HZ, y éste es el diagnóstico primario en 12,000 a 19,000 de ellas. El HZ puede tener complicaciones importantes, como neuralgia posherpética, cicatrices, sobreinfección bacteriana, parálisis de neuronas motoras, neumonía, encefalitis, síndrome de Ramsay Hunt, deterioro visual, hipoacusia, y muerte. El dolor y el malestar asociados con el HZ pueden ser prolongados y discapacitantes y disminuir la calidad de vida y la capacidad funcional en grado similar al ocasionado por enfermedades debilitantes como la insuficiencia cardiaca congestiva, el infarto del miocardio, la diabetes mellitus de tipo II y la depresión intensa. Neuralgia posherpética La neuralgia posherpética es la complicación importante y la causa más frecuentes de morbilidad asociada con el HZ en los pacientes inmunocompetentes. En la literatura 2
3 publicada se calcula que en la población de Estados Unidos hay 500,000 a 1,000,000 de casos. Su frecuencia y su intensidad aumentan con la edad, y puede complicar 25 a 50% de los casos de zóster en pacientes mayores de 50 años. La neuralgia posherpética se ha descrito como hiperestesia o dolor agudo ardoroso, pulsátil, lancinante y/o penetrante, que puede persistir durante meses o hasta años y puede ocasionar estrés emocional. Por lo menos 90% de los pacientes con neuralgia posherpética presentan alodinia (dolor producido por un estímulo inocuo), que es descrita típicamente como uno de los tipos de dolor más estresantes y debilitantes. En la comunidad médica se usan ampliamente varias definiciones de la neuralgia posherpética, incluyendo la de un dolor que persiste por más de 90 días después del inicio de la erupción cutánea. Mecanismo de acción El riesgo de padecer HZ tiene una relación causal con una disminución de la inmunidad específica contra el virus de varicela-zóster. Se mostró que ZOSTAVAX refuerza esa inmunidad, y se considera que ese es el mecanismo por el que protege contra el zóster y sus complicaciones. (Véase más adelante Inmunogenicidad.) ESTUDIOS CLÍNICOS Evaluación de la eficacia clínica de ZOSTAVAX Estudio de Eficacia y Seguridad de ZOSTAVAX (ZEST) en sujetos de 50 a 59 años de edad El estudio de eficacia y seguridad de ZOSTAVAX (ZEST, por sus siglas en inglés) realizado en pacientes de 50 a 59 años de edad, un estudio clínico doble ciego y controlado con placebo, que incluyó a sujetos de 50 a 59 años de edad, asignados al azar para recibir una dosis única de ZOSTAVAX (n = 11,211) o placebo (n = 11,228). Con seguimiento para el desarrollo de HZ durante un promedio de 1,3 años (rango de 0 a 2 años). Todos los casos sospechosos de HZ fueron revisados por un comité de evaluación clínica. La determinación final de los casos de zoster se hizo mediante la reacción en cadena de polimerasa (PCR,por sus siglas en inglés) [86%], o en la ausencia de detección de virus, fue determinado por el comité de evaluación clínica [14%]. ZOSTAVAX redujo significativamente la incidencia de HZ comparado con placebo (30 casos [2.0/1000 personas-año] frente a 99 casos [6.6/1000 personas-año], respectivamente, p <0,001). La eficacia protectora de ZOSTAVAX contra el HZ fue del 69,8% (95% CI: [54,1 a 80,6%]). Estudio sobre la Prevención de Herpes Zóster (SPS por sus siglas en inglés) en sujetos de 60 años de edad y mayores. En el estudio sobre la prevención del herpes zóster (SPS), un estudio clínico de ZOSTAVAX doble ciego comparado con un placebo, se distribuyó al azar a 38,546 personas mayores de 60 años para recibir una sola dosis de ZOSTAVAX (n=19,720) o de placebo (n=19,726) y se vigiló la aparición de HZ durante un promedio de 3.1 años (rango, desde un día hasta 4.9 años). La distribución al azar se estratificó según la edad (grupo de 60 a 70 años y grupo de mayores de 70 años). Un comité de evaluación clínica calificó todos los casos sospechosos de zóster. El diagnóstico final de los casos de zóster se hizo por reacción en cadena de la polimerasa, por cultivo local, o por decisión del comité de evaluación clínica, en ese orden. En ambos grupos (el que recibió ZOSTAVAX y el que recibió el placebo), a las personas que 3
4 presentaron HZ se les administró famciclovir y, si era necesario, analgésicos. La intensidad del "peor dolor" se evaluó en una escala de puntuación de 0 a 10 usando el Zoster Brief Pain Inventory (ZBPI), que es un cuestionario validado. Se consideró clínicamente significativa una puntuación de 3 o más, porque se correlaciona con una interferencia importante de las actividades cotidianas. En comparación con el placebo, ZOSTAVAX disminuyó significativamente el riesgo de presentar HZ o neuralgia posherpética. Además, disminuyó significativamente el dolor agudo o crónico asociado con el zóster en la puntuación de la "carga del dolor" (tabla 1). Tabla 1 Eficacia de ZOSTAVAX en comparación con el placebo en el Estudio sobre la Prevención del Herpes Zóster Punto final Eficacia de la vacuna IC 95% Incidencia de zóster Incidencia de neuralgia posherpética* "Carga del dolor"** 51% 67% 61% 44 a 58% 48 a 79% 51 a 69% IC 95% = Intervalo de confianza de 95%. *Dolor clínicamente significativo asociado con el zóster, persistente o que empezó por lo menos 90 días después de aparecer la erupción. **La puntuación de la "carga del dolor" es una puntuación compuesta que incluye la incidencia, la intensidad y la duración del dolor asociado con el zóster en un periodo de seguimiento de seis meses. ZOSTAVAX disminuyó significativamente la incidencia de zóster (315 casos [5.4/1,000 personas-años]) en comparación con el placebo (642 casos [11.1/1,000 personas-años]) (p<0.001). La eficacia protectora de ZOSTAVAX contra el HZ fue de 51% (intervalo de confianza de 95%, 44 a 58%), y disminuyó su incidencia 64% (intervalo de confianza de 95%, 56 a 71%) en las personas de 60 a 70 años y 38% (intervalo de confianza de 95%, 25 a 48%) en las mayores de 70 años. También disminuyó significativamente la incidencia acumulativa del zóster al paso del tiempo en las personas vacunadas (p<0.001) (figura 1). 4
5 Figura 1 Gráfica de Kaplan-Meier de la incidencia acumulativa del zóster al paso del tiempo* en el Estudio sobre la Prevención del Herpes Zóster 6.0 Porcentaje de personas con zóster ZOSTAVAX Placebo 1.0 p< Tiempo desde el inicio del seguimiento (en años) *En un número limitado de personas el seguimiento fue mayor de cuatro años. ZOSTAVAX disminuyó la incidencia de la neuralgia posherpética (27 casos [0.5/1,000 personas-años]) en comparación con el placebo (80 casos [1.4/1,000 personas-años]) (p<0.001). En este ensayo la neuralgia posherpética se definió como el dolor clínicamente significativo asociado con el zóster, persistente o que empezó por lo menos 90 días después de aparecer la erupción. La eficacia protectora de ZOSTAVAX contra la neuralgia posherpética fue de 67% (intervalo de confianza de 95%, 48 a 79%), y la disminución fue similar en los dos grupos de edad (60-70 años y mayores de 70 años). Además, la eficacia de ZOSTAVAX no cambió apreciablemente cuando la neuralgia posherpética se definió con otros tiempos de duración del dolor (30, 60, 120 ó 182 días). En comparación con el placebo, ZOSTAVAX disminuyó significativamente la incidencia acumulativa de la neuralgia posherpética al paso del tiempo (p<0.001) (figura 2). 5
6 Figura 2 Gráfica de Kaplan-Meier de la incidencia acumulativa de la neuralgia posherpética al paso del tiempo* en el Estudio sobre la Prevención del Herpes Zóster Porcentaje de personas con neuralgia posherpética ZOSTAVAX Placebo p< Tiempo desde el inicio del seguimiento (en años) *En un número limitado de personas el seguimiento fue mayor de cuatro años. ZOSTAVAX disminuyó la calificación de la "carga del dolor" 61% aproximadamente (intervalo de confianza de 95%, 51 a 69%) en comparación con el placebo, y en grado similar en los dos grupos de edad (60-69 años y mayores de 70 años). La puntuación de la "carga del dolor" es una puntuación compuesta que incluye la incidencia, la intensidad y la duración del dolor agudo y crónico asociado con el zóster en un periodo de seguimiento de seis meses. En comparación con el placebo, ZOSTAVAX disminuyó 73% (intervalo de confianza de 95%, 46 a 87%) la incidencia del dolor intenso y persistente asociado con el zóster (puntuación intensidad x duración, mayor de 600). Tuvieron esa puntuación mayor de 600 once de las personas vacunadas con ZOSTAVAX y 40 de las que recibieron el placebo (figura 3). En las personas vacunadas que presentaron zóster, ZOSTAVAX disminuyó significativamente el dolor en comparación con el placebo. Durante el periodo de seguimiento de seis meses, la puntuación intensidad x duración disminuyó 22% con ZOSTAVAX (promedio de la puntuación, 141 con ZOSTAVAX y 181 con el placebo; p=0.008). 6
7 Figura 3 Puntuación intensidad x duración del dolor asociado con el zóster al paso del tiempo en el Estudio sobre la Prevención del Herpes Zóster* ZOSTAVAX Placebo Número de personas con zóster Puntuación intensidad x duración del dolor asociado con el zóster *La gráfica pequeña presenta el número de personas con puntuación intensidad x duración >600. Por ejemplo, un "peor dolor" diario con puntuación máxima de 10 durante más de 60 días daría una puntuación intensidad x duración mayor de 600. En las personas vacunadas que presentaron neuralgia posherpética, ZOSTAVAX disminuyó significativamente el dolor en comparación con el placebo. En el periodo transcurrido desde 90 días después de la aparición de la erupción hasta el final del seguimiento, ZOSTAVAX disminuyó 57% la puntuación intensidad x duración (promedio de la puntuación, 347 con ZOSTAVAX y 805 con el placebo; p=0.016). Para evaluar el efecto de ZOSTAVAX sobre la interferencia de las actividades cotidianas por el zóster, se calculó para cada persona una puntuación combinada basada en la interferencia de la actividad general, del humor, de la capacidad de andar, del trabajo normal, de las relaciones con otras personas, del sueño y del disfrute de la vida. Cada uno de esos elementos se midió en una escala de 0 a 10, donde 0 indicaba ninguna interferencia y 10 interferencia máxima. En comparación con el placebo, ZOSTAVAX causó una 7
8 disminución favorable, pero no estadísticamente significativa (8%) en el riesgo de sufrir una interferencia considerable de las actividades cotidianas (puntuación de la interferencia combinada 2 durante siete días o más), aparte de la eficacia de la vacuna contra el zóster. Entre las personas tratadas que presentaron zóster, ZOSTAVAX disminuyó significativamente la interferencia de las actividades cotidianas en comparación con el placebo. Durante el periodo de seguimiento de seis meses, la puntuación intensidad x duración de la interferencia combinada de las actividades cotidianas disminuyó 31% con ZOSTAVAX (promedio de la puntuación, 57 con ZOSTAVAX y 83 con el placebo; p=0.002). El uso de medicamentos antivirales en las 72 horas siguientes a la aparición de la erupción del zóster no tuvo un efecto significativo sobre la eficacia de ZOSTAVAX contra el dolor o la incidencia de la neuralgia posherpética. La proporción de pacientes que utilizaron analgésicos fue similar en los dos grupos. Por lo tanto, no fue probable que los analgésicos hayan contribuido a disminuir el dolor herpético o la incidencia de la neuralgia posherpética. Las personas que recibieron ZOSTAVAX reportaron menos complicaciones que las que recibieron el placebo. La tabla 2 muestra el número de personas que tuvieron complicaciones específicas reportadas en el Estudio sobre la Prevención del Herpes Zóster con una frecuencia de 1% o más. Tabla 2 Número de personas con complicaciones específicas del zóster* reportadas en el Estudio sobre la Prevención del Herpes Zóster ZOSTAVAX (N=19,270) (n = 321) Placebo (N=19,276) (n = 659) Complicación Alodinia Sobreinfección bacteriana 3 7 Diseminación 5 11 Deterioro de la visión** 2 9 Parálisis de nervios motores periféricos 5 12 Ptosis palpebral** 2 9 Cicatrices Hipoestesia 7 12 N=Número de pacientes distribuidos al azar. n=número de casos de zóster, incluyendo los que ocurrieron en los 30 días siguientes a la vacunación, con estos datos disponibles. *Complicaciones reportadas en las personas con zóster con una frecuencia 1% en uno o ambos grupos. **El zóster oftálmico ocurrió en 35 personas vacunadas con ZOSTAVAX y en 69 de las que recibieron el placebo. Se reportaron complicaciones viscerales como neumonía, hepatitis y meningoencefalitis en menos de 1% de los pacientes con zóster (tres casos de neumonía y uno de hepatitis en el grupo del placebo, y un caso de meningoencefalitis en el grupo de ZOSTAVAX). 8
9 Inmunogenicidad de ZOSTAVAX En el estudio clínico de eficacia y seguridad de ZOSTAVAX (ZEST por sus siglas en inglés), las respuestas inmunes a la vacunación fueron evaluadas en una subcohorte con distribución al azar del 10% (n=1,136 para ZOSTAVAX y n= 1,133 para placebo) de los sujetos enlistados en el ZEST. ZOSTAVAX provocó mayores respuestas immunes específicas al virus de varicela zóster (VVZ), 6 semanas después de la vacunación en comparación con placebo. El aumento en el nivel de anticuerpos frente a VVZ, se demostró por el ensayo inmunoenzimático de adsorción de glicoproteínas (gpelisa) (2.3 veces la diferencia (95% IC [2,2, 2,4]), la media geométrica de los títulos [GMT] de 664 frente a 288 unidades gpelisa / ml, p <0,001). En el Estudio sobre la Prevención del Herpes Zóster (SPS) se evaluaron las respuestas inmunes a la vacunación en un subgrupo de las personas que ingresaron al estudio (N=1,395). A las seis semanas después de la administración, ZOSTAVAX indujo mayores respuestas inmunes específicas contra el virus de varicela-zóster que el placebo. Se demostraron aumentos tanto en la concentración de anticuerpos contra el virus de varicelazóster, medida por la prueba de ensayo inmunoenzimático de adsorción de glicoproteínas (gpelisa) (diferencia de 1.7 veces más, promedio geométrico de título de 479 contra 288 unidades gpelisa/ml, p<0.001) y por la actividad de células T, medida por la prueba ImmunoSpot ligada a enzima del interferón-gamma del virus de varicela-zóster (IFN-γ ELISPOT) (diferencia de 2.2 veces más, promedio geométrico de título de 70 contra 32 células formadoras de manchas por millón de células mononucleares, p<0.001). En un análisis integrado de dos estudios clínicos que evaluaron la respuesta inmune a ZOSTAVAX cuatro semanas después de la vacunación, las respuestas generalmente fueron similares en sujetos de 50 a 59 años de edad (n=389) en comparación con los sujetos de 60 años de edad o mayores (n=731) (promedio geométrico de título de 668 vs. 614 unidades gpelisa/ml, respectivamente). El aumento promedio geométrico del título de la respuesta inmune tras la vacunación, medido por gpelisa, fue 2.6 (IC 95%: [2.4 a 2.9] en los sujetos de años de edad y 2.3 (IC 95%: [2.1 a 2.4] en los sujetos de 60 años de edad o mayores. Inmunogenicidad Después de la Administración Concomitante En un estudio doble ciego, controlado, 762 adultos de 50 años de edad o mayores fueron distribuidos al azar a recibir una dosis de ZOSTAVAX administrada concomitantemente (n= 382) o no concomitantemente (n= 380) con la vacuna inactivada contra influenza. Los sujetos del concomitante recibieron ZOSTAVAX y la vacuna inactivada contra influenza en el Día 1 y placebo en la semana 4. Los sujetos del grupo no concomitante recibieron la vacuna inactivada contra influenza y placebo en el Día 1 y ZOSTAVAX en la semana 4. Cuatro semanas después de la vacunación, las respuestas de anticuerpos para ambas vacunas fueron similares, independientemente de que se administraran concomitantemente o no. 9
10 En un estudio clínico controlado, doble ciego, con 473 adultos de 60 años de edad o más, fueron asignados al azar para recibir ZOSTAVAX y PULMOVAX concomitantemente (N = 237), o sólo PULMOVAX y 4 semanas más tarde la administración de ZOSTAVAX (N = 236). A las cuatro semanas posteriores a la vacunación, los niveles de anticuerpos VVZ (virus de varicela zóster) con el uso concomitante fueron significativamente más bajos que los niveles de anticuerpos VVZ después de la administración no concomitante (GMT de 338 contra 484 unidades gpelisa/ml, respectivamente; relación GMT = 0.70 (IC del 95%: [0.61, 0.80 ])). Los niveles de anticuerpos VVZ 4 semanas después de la vacunación se incrementaron 1.9 veces (95% IC: [1.7, 2.1]; cumplen el criterio de aceptación previamente especificado) en el grupo concomitante vs. 3.1 veces (95% IC: [2,8, 3,5]) en el grupo no concomitante. Las GMTs para los antígenos de PULMOVAX fueron comparables entre los dos grupos. El uso concomitante de ZOSTAVAX y PULMOVAX demostró un perfil de seguridad que fue generalmente similar al de las dos vacunas administradas de forma no concomitante. Inmunogenicidad en sujetos con antecedentes de herpes zóster antes de la vacunación En un estudio doble ciego, con distribución al azar, controlado con placebo, se administró ZOSTAVAX a 100 sujetos de 50 años de edad o mayores con antecedentes de HZ antes de la vacunación para evaluar la inmunogenicidad de ZOSTAVAX. A las 4 semanas después de la vacunación, ZOSTAVAX indujo significativamente mayores respuestas inmunes específicas contra el virus de varicela-zóster según mediciones con gpelisa en comparación con placebo (diferencia de 2.1 veces (95% IC: [1.5 a 2.9], p<0.001, promedio geométrico de título de 812 vs. 393 unidades gpelisa /ml). Las respuestas de anticuerpos contra el virus de varicela-zóster generalmente fueron similares en los sujetos de 50 a 59 años comparado con los sujetos de 60 años de edad o mayores. Inmunogenicidad en sujetos que toman corticosteroides sistémicos crónicos/mantenimiento En un estudio clínico con distribución al azar, doble ciego, controlado con placebo, ZOSTAVAX fue administrado a 206 sujetos de 60 años de edad o más que estaban recibiendo terapia crónica/mantenimiento con corticosteroides sistémicos a dosis equivalentes diarias de 5 a 20 mg de prednisona durante al menos 2 semanas antes de inicio, y 6 o más después de la vacunación para evaluar la inmunogenicidad y perfil de seguridad de ZOSTAVAX. En comparación con placebo, ZOSTAVAX indujo una mayor VVZ específica gpelisa anticuerpos GMT a las 6 semanas posteriores a la vacunación (GMT vs de unidades gpelisa / ml, respectivamente). La media geométrica de las veces en que aumentó el anticuerpo VVZ, medida por gpelisa, antes y después de la vacunación era de 2,3 (95% CI: [2,0 a 2,7]) en el grupo de ZOSTAVAX en comparación con 1,1 (95% CI: [1,0 a 1,2 ]) en el grupo placebo (véase VI CONTRAINDICACIONES). Estudio SPS subestudio de persistencia a corto plazo (STPS por sus siglas en ingles) El STPS se inicio para acumular información sobre la persistencia de la eficacia de la vacuna y para preservar un subconjunto de temas para el subestudio persistencia a largo plazo (LTPS por sus siglas en inglés). EL STPS incluyó a 7,320 sujetos vacunados previamente con ZOSTAVAX y 6,950 vacunados previamente con placebo en el SPS. La 10
11 edad media al momento de inscribirse en el STPS era de 73.3 años. Durante el curso del STPS, a los sujetos que recibieron placebo se les ofreció ZOSTAVAX, en ese momento se consideró que habían completado el STPS. Los análisis de eficacia de la vacuna para el STPS se basaron en datos recolectados primordialmente de 4 a 7 años posteriores a la vacunación en el SPS. La mediana de seguimiento en el STPS era 1.2 (el intervalos es de 1 día a 2.2 años). En el STPS, había 84 casos evaluables de HZ en el grupo de ZOSTAVAX y 95 casos evaluables en el grupo placebo. La eficacia estimada de la vacuna para la incidencia de HZ durante el periodo de seguimiento del STPS fue del 39.6% (18.2%, 55.5%). La eficacia estimada de la vacuna para la incidencia de la neuralgia posherpética fue del 60.1% (-9.8%, 86.7%). La eficacia estimada de la vacuna para la "carga del dolor" del HZ fue del 50.1% (14.1%, 71.0%). No hubo experiencias adversas serias reportadas en el STPS relacionadas con la vacuna. Estudio SPS subestudio de persistencia a largo plazo (LPTS) Tras la finalización del STPS, el estudio abierto LPTS evaluó la duración de la protección contral el HZ, neuralgia posherpética y "carga del dolor" del HZ de ZOSTAVAX en sujetos vacunados en el SPS. Participaron en el LPTS un total de 6,687 sujetos previamente vacunados con ZOSTAVAX en el SPS. La edad promedio al momento de inscribirse al LPTS fue de 74.5 años. Debido a que a los sujetos tratados con placebo se les ofreció previamente la vacuna durante el STPS, un grupo control con placebo concurrente no estaba disponible para el cálculo de la eficacia de la vacuna para el LTPS. Por lo tanto, los receptores de placebo anteriores se utilizaron como grupo de referencia para el cálculo de eficacia de la vacuna en el LTPS. Los análisis del LTPS para la eficacia de la vacuna basados en los datos recolectados primordialmente del año 7 al 10 posteriores a la vacunación en el SPS. La mediana de seguimiento durante el LTPS fue de 3.9 años (el rango es de una semanas a 4.75 años). Hubo 263 casos evaluables de HZ durante el periodo de seguimientos del LTPS. La eficacia estimada de la vacuna para la incidencia durante el periodo de seguimiento del LTPS fue de 21.1% (10.9%, 30.4%). La eficacia estimada de la vacuna para la incidencia de neuralgia posherpética fue del 35.4 % (8.8%, 55.8%). La eficacia estimada para la vacuna para la "carga del dolor" del HZ fue del 37.3% (26.7%, 46.4%). La Eficacia observada de la vacuna en el LTPS es generalmente consistente con la eficacia de la vacuna para el HZ observada durante el SPS en el grupo de 70 años de edad y es consistente con la edad actual del grupo de cohorte No hubo experiencias adversas serias reportadas en el LTPS relacionadas con la vacuna. 11
12 VI. CONTRAINDICACIONES Antecedentes de hipersensibilidad a cualquiera de los componentes de la vacuna, incluyendo la gelatina. Antecedentes de reacción anafiláctica o anafilactoide a la neomicina (cada dosis de la vacuna reconstituida contiene trazas de neomicina). Generalmente, la alergia a la neomicina se manifiesta como una dermatitis de contacto. Sin embargo, un antecedente de dermatitis de contacto debida a la neomicina no es una contraindicación para recibir vacunas de virus vivos. Estados de inmunodeficiencia primaria o adquirida debidos a trastornos como leucemias agudas o crónicas, linfoma, otras alteraciones que afectan la médula ósea o el sistema linfático, inmunosupresión por VIH/SIDA, o deficiencias inmunitarias celulares. Tratamientos inmunosupresores (incluyendo las dosis altas de corticosteroides); sin embargo, ZOSTAVAX no está contraindicado en las personas que están recibiendo corticosteroides tópicos o inhalados, corticosteroides sistémicos a dosis bajas, o como tratamiento de reemplazo (por ejemplo, en la insuficiencia suprarrenal). Tuberculosis activa no tratada. Embarazo (véase Embarazo en VIII PRECAUCIONES O RESTRICCIONES DE USO DURANTE EL EMBARAZO O LA LACTANCIA). VII. PRECAUCIONES GENERALES El profesional de la salud debe preguntar al paciente si ha tenido alguna reacción a una dosis anterior de cualquier vacuna que contenga virus de varicela-zóster (véase VI CONTRAINDICACIONES). Como con cualquier vacuna, se deben tener los medios terapéuticos adecuados, incluyendo epinefrina inyectable (al 1:1,000), para usarlos inmediatamente si ocurre una reacción anafiláctica o anafilactoide. Se debe considerar posponer la vacunación si el paciente tiene fiebre de más de 38.5 C. No se han determinado la seguridad y la eficacia de ZOSTAVAX en adultos infectados con el virus de la inmunodeficiencia humana (VIH) con o sin signos de inmunodeficiencia (véase VI CONTRAINDICACIONES). Como ocurre con cualquier vacuna, es posible que la vacunación con ZOSTAVAX no proteja a todos los que la reciben. Transmisión En los ensayos clínicos con ZOSTAVAX no se ha reportado la transmisión del virus de la vacuna. Sin embargo, la experiencia obtenida después de la salida al mercado sugiere que 12
13 en raros casos los vacunados que presentan una erupción semejante a la varicela pueden transmitir el virus de la vacuna a los contactos susceptibles. También se ha reportado, pero no se ha confirmado, la transmisión del virus de la vacuna por personas que recibieron la vacuna contra la varicela y no presentaron dicha erupción; ese es un riego teórico de la vacunación con ZOSTAVAX. Se debe comparar el riesgo de transmitir el virus atenuado de la vacuna a las personas susceptibles con el de presentar el HZ natural y transmitirlo a esas personas. Empleo en niños No se recomienda administrar ZOSTAVAX a niños. Empleo en personas de edad avanzada El promedio de edad de las personas incluidas en el estudio clínico más extenso de ZOSTAVAX (n=38,546) fue 69 años (rango, 59 a 99 años). De las 19,270 personas que recibieron ZOSTAVAX, 10,378 tenían 60 a 69 años, 7,629 tenían 70 a 79 años, y 1,263 eran mayores de 80 años. Se demostró que ZOSTAVAX fue generalmente seguro y eficaz en esos pacientes. VIII. PRECAUCIONES O RESTRICCIONES DE USO DURANTE EL EMBARAZO O LA LACTANCIA Embarazo No se han hecho estudios de reproducción en animales con ZOSTAVAX. No se sabe si ZOSTAVAX puede causar daños al feto o afectar la capacidad reproductora si se administra a una mujer embarazada. Sin embargo, se sabe que la infección con el virus de varicelazóster natural puede causar daño fetal. Por lo tanto, no se debe administrar ZOSTAVAX a una mujer embarazada, y se debe evitar el embarazo durante los tres meses siguientes a la vacunación (véase VI CONTRAINDICACIONES). Madres lactantes No se sabe si el virus de la varicela-zóster es excretado con la leche humana. Por lo tanto, debido a que algunos virus sí son excretados con la leche, se debe tener precaución si se administra ZOSTAVAX a una mujer que está amamantando. IX. REACCIONES SECUNDARIAS Y ADVERSAS En los ensayos clínicos se ha evaluado la seguridad de ZOSTAVAX en más de 32,000 personas mayores de 50 años, y fue generalmente bien tolerado. Estudio clínico de eficacia y seguridad de ZOSTAVAX (ZEST) en sujetos de 50 a 59 años de edad En el estudio ZEST, los sujetos recibieron una dosis única, ya fuera de ZOSTAVAX (n= 11,184) o placebo (n=11,212) y se monitorizó la seguridad general a través del estudio. Durante el estudio un sujeto vacunado reportó una reacción adversa seria con ZOSTAVAX (reacción anafiláctica). 13
14 Todos los sujetos que recibieron una tarjeta de registro de vacunación (VCR pór sus siglas en inglés) para registrar los eventos adversos que ocurrieran del dia 1 al 42 posteriores a la vacunación, además de someterse a un monitoreo de seguridad de rutina durante todo el estudio. Las siguientes experiencias adversas comunes ( 1/100, <1/10) y muy comunes ( 1/10) relacionadas con el sitio de inyección de la vacuna, fueron reportadas en el estudio ZEST. Varias experiencias adversas fueron solicitadas (días 1 a 5 posteriores a la vacunación) y se designan con el símbolo *. Trastornos del sistema nervioso Común: cefalea Trastornos generales y alteraciones en el lugar de administración Muy comunes: eritema,* dolor* hinchazón*, prurito Comunes: hematoma, calor, induración Trastornos musculoesqueléticos y del tejido conectivo Comunes: dolor en las extremidades La incidencia global de eventos adversos relacionados con el lugar de inyección de la vacuna fue significativamente mayor en sujetos vacunados con ZOSTAVAX vs. los que recibieron placebo (63.9% para ZOSTAVAX y 14.4% para placebo). En el periodo de reporte de 42 días posterior a la vacunación en el estudio ZEST, erupciones de varicela fueron reportados por 34 sujetos en lugares diferentes al de inyección (19 para ZOSTAVAX y 36 para placebo). De las 24 muestras que fueron adecuadas para la reacción en cadena de polimerasa (PCR por sus siglas en inglés), se detectó VVZ de tipo salvaje en 10 (3 para ZOSTAVAX y 7 para placebo) de éstos especímenes. La cepa Oka/ Merck del VVZ no se detectó en ninguna de éstas muestras. Dentro de esos mismos 42 días posteriores a la vacunación en el período de reporte del estudio ZEST, 124 sujetos reportaron erupciones parecidas a varicela (69 para ZOSTAVAX y 55 para placebo). De 23 especimenes que estaban disponibles y adecuadas para la prueba de PCR, VVZ se detectó en uno de estos especímenes del drupo de sujetos que recibieron ZOSTAVAX; sin embargo, la cepa del virus (cepa Oka/Merck tipo salvaje) no se pudo determinar. Shingles Prevention Study (SPS), (estudio de prevención de herpes sóster) en sujetos de 60 años y mayores En el más extenso de esos ensayos, el Estudio sobre la Prevención del Herpes Zóster (SPS, por sus siglas en inglés), 38,546 personas recibieron una sola dosis de ZOSTAVAX (n=19,270) o de un placebo (n=19,276) y se evaluó la seguridad durante todo el estudio. Se reportaron reacciones adversas importantes en dos de las que recibieron ZOSTAVAX (exacerbación del asma y polimialgia reumática) y en tres de las que recibieron el placebo (síndrome de Goodpasture, reacción anafiláctica y polimialgia reumática). 14
15 En el Subestudio de Vigilancia de las Reacciones Adversas se entregaron tarjetas de reporte a un subgrupo de personas del estudio SPS (3,345 de las que recibieron ZOSTAVAX y 3,271 de las que recibieron el placebo), para que anotaran las reacciones adversas que ocurrieran en los días 0 a 42 después de la vacunación, además de la vigilancia usual de la seguridad durante todo el estudio. Las siguientes experiencias adversas comunes ( 1/100, <1/10) y muy comunes ( 1/10) relacionadas con el sitio de inyección de la vacuna, fueron reportadas en el Adverse Event Monitoring Substudy (subestudio de monitoreo de eventos adversos). La mayoría de estas experiencias adversas fueron reportadas como de intensidad media. Varias experiencias adversas fueron frecuentes (0-4 días posteriores a la vacunación). Y son designadas con el el simbolo *. Trastornos del sistema nervioso Común: cefalea Trastornos generales y condiciones del sitio de administración Muy comunes: eritema,* dolor/hiperestesia,* hinchazón* Comúnes: hematoma, prurito, calor La incidencia general de las reacciones adversas en el sitio de la inyección relacionadas con la vacuna fue significativamente mayor con ZOSTAVAX (48%) que con el placebo (17%). En los demás pacientes del estudio SPS se hizo la vigilancia usual de la seguridad, pero no se les dieron tarjetas de reporte. Los tipos de reacciones que se reportaron en ellos fueron generalmente similares a los observados en el subgrupo del Subestudio de Vigilancia de las Reacciones Adversas. Dentro del periodo de reporte de 42 días del estudio SPS, el número total de pacientes que tuvieron erupciones zosteriformes fue pequeño (17 con ZOSTAVAX, 36 con el placebo; p=0.009). De 41 de esas 53 personas se obtuvieron muestras adecuadas para la prueba de reacción en cadena de la polimerasa, y se detectó el virus de varicela-zóster natural en 25 de ellos (cinco de los que recibieron ZOSTAVAX y 20 de los que recibieron el placebo). En ninguna de las muestras se detectó la cepa Oka/Merck del virus. Dentro de ese mismo periodo de 42 días después de la vacunación en el estudio SPS, el número de pacientes con erupciones similares a la varicela también fue pequeño. Se obtuvieron diez muestras adecuadas para la prueba de reacción en cadena de la polimerasa, y en ninguna de ellas se detectó el virus de varicela-zóster. En los demás ensayos clínicos que apoyaron la licencia inicial de la formulación congelada de ZOSTAVAX las incidencias reportadas de erupciones zosteriformes y similares a la varicela fuera del sitio de la inyección en los 42 días siguientes a la vacunación también fueron bajas, tanto en las personas que recibieron la vacuna como en las que recibieron el placebo. De los 17 casos reportados de esas erupciones, en diez se obtuvieron muestras adecuadas para la prueba de reacción en cadena de la polimerasa. Se identificó la cepa 15
16 Oka/Merck del virus en las muestras de las lesiones de sólo dos de las personas con erupción similar a la varicela (que se inició los Días 8 y 17, respectivamente). En los estudios clínicos con ZOSTAVAX en personas mayores de 50 años, incluyendo el estudio de administración concomitante con la vacuna inactivada contra la influenza, el perfil de seguridad fue generalmente similar al observado en el Subestudio de Vigilancia de las Reacciones Adversas del SPS. Sin embargo, en esos estudios, la incidencia reportada de reacciones adversas leves a moderadas en el sitio de la inyección fue mayor en las de 50 a 59 años que en las mayores de 60 años. En un estudio doble ciego, controlado con placebo, ensayo clínico aleatorizado, ZOSTAVAX fue administrado a 100 sujetos de 50 años de edad o mayores con antecedentes de HZ antes de la vacunación para evaluar la inmunogenicidad de ZOSTAVAX y el perfil de seguridad. En este ensayo clínico, el perfil de seguridad fue generalmente similar a la observada en el subestudio de monitorización de eventos adversos del estudio SPS. Para resolver dudas sobre las personas de las que no se sabía si ya habían sido vacunadas antes con ZOSTAVAX, se evaluaron la seguridad y la tolerabilidad de una segunda dosis de ZOSTAVAX. En un estudio doble ciego comparativo con un placebo, 98 personas mayores de 60 años recibieron una segunda dosis de ZOSTAVAX 42 días después de la primera dosis; la vacuna fue generalmente bien tolerada. La frecuencia de las reacciones adversas relacionadas con la vacuna después de esa segunda dosis fue generalmente similar a la observada después de la primera dosis. Experiencia después de la comercialización Las siguientes reacciones adversas adicionales han sido identificadas durante la comercialización de ZOSTAVAX. Debido a que estas reacciones han sido reportadas voluntariamente por una población de tamaño incierto, en general no es posible estimar con certeza su frecuencia o establecer alguna relación causal con la vacuna. Trastornos gastrointestinales: nausea Trastornos de la piel y tejido subcutáneo: erupción Trastornos musculoesqueléticos y tejido conectivo: artralgia; mialgia Trastornos generales y en el sitio de administración: erupción en el sitio de la inyección; urticaria en el sitio de inyección; pirexia; linfadenopatía transitoria en el sitio de la inyección Trastornos del sistema inmune: reacciones de hipersensibilidad, incluyendo reacciones anafilácticas X. INTERACCIONES MEDICAMENTOSAS No se debe mezclar ZOSTAVAX con ningún otro medicamento en la misma jeringa. Otros medicamentos inyectables se deben administrar por separado en otros lugares del cuerpo. No se ha evaluado la administración concomitante de ZOSTAVAX y medicamentos antivirales eficaces contra el virus de varicela-zóster. 16
17 ZOSTAVAX y PULMOVAX no deben administrarse concomitantemente ya que su uso concomitante resultó en una reducción en la inmunogenicidad de ZOSTAVAX (véase V FARMACOCINÉTICA Y FARMACODINAMIA EN HUMANOS). XI. ANÁLISIS DE LAS PRUEBAS DE LABORATORIO Evaluaciones de rutina de laboratorio no fueron hechas durante los estudios clínicos; por ello no se han reportado alteraciones en las pruebas de laboratorio. XII. PRECAUCIONES O EFECTOS RELACIONADOS CON CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y DESARROLLO No se ha evaluado el potencial carcinogénico, mutagénico o de alteración de la fertilidad de ZOSTAVAX. XIII. DOSIS Y VÍA DE ADMINISTRACIÓN PARA ADMINISTRACIÓN SUBCUTÁNEA. No se inyecte por vía intravenosa. Se debe administrar una sola dosis. No se sabe cuánto dura la protección después de la vacunación con ZOSTAVAX. En el Estudio sobre la Prevención del Herpes Zóster (SPS, por sus siglas en inglés) se demostró la protección durante cuatro años de seguimiento. Aún no se ha determinado si es necesaria la revacunación. ZOSTAVAX no es un tratamiento del zóster ni de la neuralgia posherpética. ZOSTAVAX se puede administrar concomitantemente con la vacuna inactivada contra influenza utilizando jeringas diferentes. Reconstitúyase inmediatamente después de sacarlo del refrigerador. Para reconstituir la vacuna úsese únicamente el diluente que se proporciona con ella, que no contiene conservadores u otras sustancias antivirales que podrían inactivar el virus de la vacuna. Frasco de diluyente: Para reconstituir la vacuna, aspírese con una jeringa todo el contenido del frasco del diluente, inyéctese en el frasco de vacuna liofilizada, y mézclese bien agitando el frasco suavemente. Aspírese todo el contenido con una jeringa e inyéctese por vía subcutánea el volumen total de la vacuna reconstituida, de preferencia en la cara externa del brazo (región deltoidea). 17
18 Jeringas prellenadas con diluyente Para reconstituir la vacuna, inyecte todo el diluyente de la jeringa prellenada en el frasco de la vacuna liofilizada, y mézclese bien agitando el frasco suavemente. Aspírese todo el contenido en la jeringa e inyéctese por vía subcutánea el volumen total de la vacuna reconstituida, de preferencia en la cara externa del brazo (región deltoidea). SE RECOMIENDA ADMINISTRAR LA VACUNA INMEDIATAMENTE DESPUÉS DE RECONSTITUIRLA, PARA MINIMIZAR LA PÉRDIDA DE POTENCIA. DESÉCHESE LA VACUNA RECONSTITUIDA QUE NO SE HAYA ADMINISTRADO EN LOS 30 MINUTOS SIGUIENTES A SU RECONSTITUCIÓN. No se congele la vacuna reconstituida. PRECAUCIÓN: Para cada inyección y/o reconstitución de ZOSTAVAX se debe usar una jeringa estéril y libre de conservadores, antisépticos y detergentes, porque estas sustancias podrían inactivar el virus de la vacuna. Es importante usar una jeringa y una aguja estériles distintas para cada paciente, para evitar la transmisión de agentes infecciosos de una persona a otra. Las agujas se deben desechar apropiadamente sin volver a ponerles su funda. Si las características de la solución y del envase lo permiten, los medicamentos parenterales se deben examinar visualmente antes de administrarlos, en busca de partículas o cambios de coloración. Una vez reconstituido, ZOSTAVAX es un líquido semi opaco a translúcido, incoloro a amarillo claro. XIV. SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL (ANTÍDOTOS) No hay datos acerca de la sobredosificación. XV. PRESENTACIÓN Caja con 1 ó 10 frascos ámpula de 0.65 ml de dosis única y caja con 1 ó 10 frascos o jeringas prellenadas con diluente estéril. XVI. RECOMENDACIONES PARA EL ALMACENAMIENTO Para asegurar que no ocurra ninguna pérdida de potencia, durante su transporte la vacuna se debe mantener a una temperatura de 8 C (46 F) o menor. ZOSTAVAX SE DEBE MANTENER REFRIGERADO a una temperatura media de 2 a 8 C (36-46 F) o menor hasta que sea reconstituido para inyectarlo (véase XIII DOSIS Y VÍA DE ADMINISTRACIÓN). El diluente se debe conservar por separado a la temperatura ambiente (20 a 25 C) o en el refrigerador (a 2-8 C). 18
19 Antes de la reconstitución, protéjase la vacuna de la luz. DESÉCHESE LA VACUNA RECONSTITUIDA QUE NO SE HAYA INYECTADO EN LOS 30 MINUTOS SIGUIENTES A LA RECONSTITUCIÓN. NO SE CONGELE LA VACUNA RECONSTITUIDA. XVII. LEYENDAS DE PROTECCIÓN Su venta requiere receta médica. Literatura exclusiva para médicos. No se deje al alcance de los niños. WPC-V211-ZST-R-I ZOSTAVAX es marca registrada de Merck Sharp & Dohme Corp., una subsidiaria de MERCK & CO., Inc., Whitehouse Station, N.J., U.S.A. XVIII. NOMBRE DEL LABORATORIO Y DIRECCIÓN Merck Sharp & Dohme de Mexico, S.A. de C.V. Av. San Jerónimo # 369 piso 8, Col. La Otra Banda, México D.F. Tel XIX. NÚMERO DE REGISTRO Y DE IPP Reg. No. 1236M2009 SSA IPP No. ooo 19
FICHA TÉCNICA ZOSTAVAX. prevenir el herpes zóster prevenir la neuralgia posherpética disminuir el dolor asociado con el herpes zóster agudo o crónico.
 1. Denominación distintiva FICHA TÉCNICA 2. Denominación genérica Vacuna antivaricela atenuada 3. Composición cualitativa y cuantitativa Cuando se reconstituye como se indica, es un preparado estéril para
1. Denominación distintiva FICHA TÉCNICA 2. Denominación genérica Vacuna antivaricela atenuada 3. Composición cualitativa y cuantitativa Cuando se reconstituye como se indica, es un preparado estéril para
INFORMACIÓN PARA PRESCRIBIR AMPLIA ZOSTAVAX vacuna de virus vivo contra el herpes zóster (Oka/Merck), MSD Refrigerado
 I. DENOMINACIÓN DISTINTIVA. II. DENOMINACIÓN GENÉRICA. Vacuna antivaricela atenuada III. FORMULA FARMACÉUTICA Y FORMULACIÓN. En un frasco, polvo para reconstituir y, en otro frasco, diluyente para reconstituir
I. DENOMINACIÓN DISTINTIVA. II. DENOMINACIÓN GENÉRICA. Vacuna antivaricela atenuada III. FORMULA FARMACÉUTICA Y FORMULACIÓN. En un frasco, polvo para reconstituir y, en otro frasco, diluyente para reconstituir
Información para Prescribir Amplia ZOSTAVAX
 I. Denominación distintiva ZOSTAVAX II. Denominación genérica Vacuna antivaricela atenuada. III. Forma Farmacéutica y Formulación Forma Farmacéutica: Suspensión. Consideración de uso: Inyectable. ZOSTAVAX
I. Denominación distintiva ZOSTAVAX II. Denominación genérica Vacuna antivaricela atenuada. III. Forma Farmacéutica y Formulación Forma Farmacéutica: Suspensión. Consideración de uso: Inyectable. ZOSTAVAX
ZOSTAVAX es un preparado liofilizado de la cepa Oka / Merck de, virus de la varicela-zoster vivo atenuado (VZV).
 WPC-V211-R-I-032016-VENEZUELA ZOSTAVAX VACUNA DE VIRUS VIVOS ATENUADOS CONTRA HERPES ZÓSTER. POLVO LIOFILIZADO PARA SUSPENSIÓN INYECTABLE. (Vacuna de virus vivos atenuados contra Herpes Zóster) I. CLASE
WPC-V211-R-I-032016-VENEZUELA ZOSTAVAX VACUNA DE VIRUS VIVOS ATENUADOS CONTRA HERPES ZÓSTER. POLVO LIOFILIZADO PARA SUSPENSIÓN INYECTABLE. (Vacuna de virus vivos atenuados contra Herpes Zóster) I. CLASE
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN
Comentarios sobre la vacuna contra el herpes zóster
 Comentarios sobre la vacuna contra el herpes zóster Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid El Advisory Committee
Comentarios sobre la vacuna contra el herpes zóster Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid El Advisory Committee
INFORMACION PARA PRESCRIBIR AMPLIA MEXICO VARIVAX III (vacuna de virus vivo contra la varicela [Oka/Merck], MSD) 1 de 12
![INFORMACION PARA PRESCRIBIR AMPLIA MEXICO VARIVAX III (vacuna de virus vivo contra la varicela [Oka/Merck], MSD) 1 de 12 INFORMACION PARA PRESCRIBIR AMPLIA MEXICO VARIVAX III (vacuna de virus vivo contra la varicela [Oka/Merck], MSD) 1 de 12](/thumbs/66/56079413.jpg) (vacuna de virus vivo contra la varicela [Oka/Merck], MSD) 1 de 12 I. NOMBRE COMERCIAL VARIVAX * III 2. NOMBRE GENÉRICO Vacuna de virus vivo contra la varicela (Oka/Merck), MSD 3. FORMA FARMACÉUTICA Y
(vacuna de virus vivo contra la varicela [Oka/Merck], MSD) 1 de 12 I. NOMBRE COMERCIAL VARIVAX * III 2. NOMBRE GENÉRICO Vacuna de virus vivo contra la varicela (Oka/Merck), MSD 3. FORMA FARMACÉUTICA Y
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Anatoxal Tedi, suspensión inyectable, jeringa precargada Vacuna contra la difteria y el tétanos (adsorbida, contenido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Anatoxal Tedi, suspensión inyectable, jeringa precargada Vacuna contra la difteria y el tétanos (adsorbida, contenido
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA
 La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
FICHA TÉCNICA VACUNA ANTIPOLIOMIELÍTICA BIVALENTE ORAL
 1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Vacuna Antipoliomielítica Bivalente Oral 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0.1 ml contiene Virus de Poliomielitis Tipo 1 1,000,000
1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Vacuna Antipoliomielítica Bivalente Oral 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0.1 ml contiene Virus de Poliomielitis Tipo 1 1,000,000
PRINCIPIO ACTIVO. Virus de la parotiditis TCID 50
 PROSPECTO VACUNA MSD ANTI PAROTIDITIS COMPOSICIÓN VIAL DE POLVO LIOFILIZADO PRINCIPIO ACTIVO. Virus de la parotiditis...20.000 TCID 50 EXCIPIENTES Neomicina 25,0 mcg Albúmina humana 0,3 mg Sacarosa 2,3
PROSPECTO VACUNA MSD ANTI PAROTIDITIS COMPOSICIÓN VIAL DE POLVO LIOFILIZADO PRINCIPIO ACTIVO. Virus de la parotiditis...20.000 TCID 50 EXCIPIENTES Neomicina 25,0 mcg Albúmina humana 0,3 mg Sacarosa 2,3
FICHA TECNICA. Adultos en prediálisis o en diálisis: 1 dosis (40 µg) de 1 ml en cada inyección.
 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
ZOSTAVAX VACUNA CON VIRUS VIVOS ATENUADOS (OKA/ MERCK) DEL HERPES ZOSTER. Inyectable para administración subcutánea
 ZOSTAVAX VACUNA CON VIRUS VIVOS ATENUADOS (OKA/ MERCK) DEL HERPES ZOSTER Inyectable para administración subcutánea INDUSTRIA NORTEAMERICANA VENTA BAJO RECETA FORMULA CUALI-CUANTITATIVA: ZOSTAVAX es una
ZOSTAVAX VACUNA CON VIRUS VIVOS ATENUADOS (OKA/ MERCK) DEL HERPES ZOSTER Inyectable para administración subcutánea INDUSTRIA NORTEAMERICANA VENTA BAJO RECETA FORMULA CUALI-CUANTITATIVA: ZOSTAVAX es una
El reservorio es humano y el modo de transmisión es por vía aérea a través de las secreciones nasofaríngeas de la persona infectada.
 Información general Rubéola La rubéola es una infección vírica que es leve en los niños, pero tiene consecuencias graves en las embarazadas porque puede causar muerte fetal o defectos congénitos en el
Información general Rubéola La rubéola es una infección vírica que es leve en los niños, pero tiene consecuencias graves en las embarazadas porque puede causar muerte fetal o defectos congénitos en el
FICHA TÉCNICA VARIVAX III
 1. Denominación distintiva 2. Denominación genérica Vacuna antivaricela atenuada 3. Composición cualitativa y cuantitativa 1350 UFP 4. Forma farmacéutica Suspensión 4. Datos clínicos 5.1 Indicaciones terapéuticas
1. Denominación distintiva 2. Denominación genérica Vacuna antivaricela atenuada 3. Composición cualitativa y cuantitativa 1350 UFP 4. Forma farmacéutica Suspensión 4. Datos clínicos 5.1 Indicaciones terapéuticas
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN
FICHA TÉCNICA TOXOIDES TETÁNICO Y DIFTÉRICO (TD)
 1. DENOMINACIÓN DISTINTIVA. 2. DENOMINACIÓN GENÉRICA. Toxoides tetánico y diftérico 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Toxoide diftérico Toxoide tetánico Vehículo cbp 3 5 Lf 10 20 Lf 0.5 ml 4.
1. DENOMINACIÓN DISTINTIVA. 2. DENOMINACIÓN GENÉRICA. Toxoides tetánico y diftérico 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Toxoide diftérico Toxoide tetánico Vehículo cbp 3 5 Lf 10 20 Lf 0.5 ml 4.
FICHA TÉCNICA HIBERIX
 1. Denominación distintiva 2. Denominación genérica Vacuna conjugada de Haemophilus influenzae tipo b 3. Composición cualitativa y cuantitativa El frasco ámpula con liofilizado para 1 dosis de 0.5 ml contiene:
1. Denominación distintiva 2. Denominación genérica Vacuna conjugada de Haemophilus influenzae tipo b 3. Composición cualitativa y cuantitativa El frasco ámpula con liofilizado para 1 dosis de 0.5 ml contiene:
FICHA TÉCNICA. Polisacárido Vi de Salmonella typhi (cepa Ty2)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Typherix, solución inyectable en jeringa precargada Vacuna de polisacárido antitifoideo. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml de la vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Typherix, solución inyectable en jeringa precargada Vacuna de polisacárido antitifoideo. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml de la vacuna
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable ZOSTAVAX polvo y disolvente para suspensión inyectable
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable ZOSTAVAX polvo y disolvente para suspensión inyectable
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRABOVIS-4 Liofilizado y disolvente para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRABOVIS-4 Liofilizado y disolvente para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA. MENCEVAX AC es una preparación liofilizada de polisacáridos purificados de Neisseria meningitidis (meningococo) de los grupos A y C.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MENCEVAX AC Vacuna de polisacáridos meningocócicos, grupos A y C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. MENCEVAX AC es una preparación liofilizada de polisacáridos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MENCEVAX AC Vacuna de polisacáridos meningocócicos, grupos A y C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. MENCEVAX AC es una preparación liofilizada de polisacáridos
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable ZOSTAVAX polvo y disolvente para suspensión inyectable
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable ZOSTAVAX polvo y disolvente para suspensión inyectable
Virus del sarampión TCID 50
 PROSPECTO AMUNOVAX Vacuna antisarampión COMPOSICION VIAL DE POLVO LIOFILIZADO PRINCIPIO ACTIVO. Virus del sarampión... 1.000 TCID 50 EXCIPIENTES Neomicina 25,0 mcg Albúmina humana 0,3 mg Sacarosa 2,3 mg
PROSPECTO AMUNOVAX Vacuna antisarampión COMPOSICION VIAL DE POLVO LIOFILIZADO PRINCIPIO ACTIVO. Virus del sarampión... 1.000 TCID 50 EXCIPIENTES Neomicina 25,0 mcg Albúmina humana 0,3 mg Sacarosa 2,3 mg
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVALTO Respi 3 suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVALTO Respi 3 suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis
Tratamiento del herpes genital inicial y recurrente, herpes labial y de infecciones mucocutáneas localizadas, producidas por virus de herpes simple
 1. NOMBRE DEL MEDICAMENTO ACICLOVIR DEXTER Crema E.F.G. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA ACICLOVIR DEXTER Crema E.F.G. Cada gramo contiene: Aciclovir (DCI)... 50 mg Excipientes, c.s. 3. FORMA
1. NOMBRE DEL MEDICAMENTO ACICLOVIR DEXTER Crema E.F.G. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA ACICLOVIR DEXTER Crema E.F.G. Cada gramo contiene: Aciclovir (DCI)... 50 mg Excipientes, c.s. 3. FORMA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. RECOMBIVAX HB 5 mg Vacuna recombinante antihepatitis B. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 5 mg Vacuna recombinante antihepatitis B. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 5 microgramos/ 0,5 ml, suspensión inyectable
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 5 mg Vacuna recombinante antihepatitis B. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 5 microgramos/ 0,5 ml, suspensión inyectable
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. RECOMBIVAX HB 10 mg jeringa precargada Vacuna recombinante antihepatitis B.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 10 mg jeringa precargada Vacuna recombinante antihepatitis B. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 10 microgramos /
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 10 mg jeringa precargada Vacuna recombinante antihepatitis B. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 10 microgramos /
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. COLOMBOVAC PMV/POX Liofilizado y suspensión para suspensión inyectable para palomas
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO COLOMBOVAC PMV/POX Liofilizado y suspensión para suspensión inyectable
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO COLOMBOVAC PMV/POX Liofilizado y suspensión para suspensión inyectable
FICHA TÉCNICA. VACUNA ANTIRRABICA MERIEUX Vacuna antirrábica inactivada cultivada en células diploides humanas
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIRRABICA MERIEUX Vacuna antirrábica inactivada cultivada en células diploides humanas 2. COMPOSICION CUALITATIVA Y CUANTITATIVA De una dosis de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIRRABICA MERIEUX Vacuna antirrábica inactivada cultivada en células diploides humanas 2. COMPOSICION CUALITATIVA Y CUANTITATIVA De una dosis de vacuna
K:\Jenner_Public\QSS\VACCINE QUALITY & REGULATION GROUP\Inserts\Spanish\esp_Insert measles rubella Vd2-rev.doc
 MODELO DE PROSPECTO VACUNA COMBINADA CONTRA EL SARAMPIÓN Y LA RUBÉOLA (MR) DESCRIPCIÓN La vacuna MR es un polvo liofilizado que contiene dos antígenos, el del sarampión y el de la rubéola. Debe reconstituirse
MODELO DE PROSPECTO VACUNA COMBINADA CONTRA EL SARAMPIÓN Y LA RUBÉOLA (MR) DESCRIPCIÓN La vacuna MR es un polvo liofilizado que contiene dos antígenos, el del sarampión y el de la rubéola. Debe reconstituirse
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker inac, suspensión inyectable
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker inac, suspensión inyectable
FICHA TÉCNICA. La vacuna MSD Antirrubéola cumple los requisitos de la OMS para productos biológicos y vacunas Antirrubéola.
 1. NOMBRE DEL MEDICAMENTO VACUNA MSD ANTIRRUBEOLA FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Vacuna MSD Antirrubéola (vacuna con virus de la rubéola vivos) es una vacuna de virus vivos para
1. NOMBRE DEL MEDICAMENTO VACUNA MSD ANTIRRUBEOLA FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Vacuna MSD Antirrubéola (vacuna con virus de la rubéola vivos) es una vacuna de virus vivos para
FICHA TÉCNICA VACUNA VIVA ATENUADA CONTRA EL SARAMPION Y RUBEOLA (MR) LIOFILIZADA
 FICHA TÉCNICA VACUNA VIVA ATENUADA CONTRA EL SARAMPION Y RUBEOLA (MR) LIOFILIZADA PRESENTACION DEL PRODUCTO (Resumen) La vacuna se prepara a partir de las cepas vivas, atenuadas del virus de sarampión
FICHA TÉCNICA VACUNA VIVA ATENUADA CONTRA EL SARAMPION Y RUBEOLA (MR) LIOFILIZADA PRESENTACION DEL PRODUCTO (Resumen) La vacuna se prepara a partir de las cepas vivas, atenuadas del virus de sarampión
Los reservorios del virus de la rabia son fundamentalmente animales salvajes, como murciélagos y zorros y animales domésticos, como perros y gatos.
 Información general Rabia La rabia es una zoonosis viral. Es decir, una enfermedad propia de animales, causada por un virus y transmitida ocasionalmente al hombre por diversas especies animales. Se trata
Información general Rabia La rabia es una zoonosis viral. Es decir, una enfermedad propia de animales, causada por un virus y transmitida ocasionalmente al hombre por diversas especies animales. Se trata
El sarampión puede producir epidemias que causan muchas muertes y meningoencefalitis, que puede dejar secuelas de retraso mental.
 Información general El sarampión El sarampión es una enfermedad muy contagiosa y grave causada por un virus. El único reservorio del mismo es humano, por lo que reúne todas las condiciones para ser eliminado
Información general El sarampión El sarampión es una enfermedad muy contagiosa y grave causada por un virus. El único reservorio del mismo es humano, por lo que reúne todas las condiciones para ser eliminado
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO CORREO ELECTRÓNICO Sugerencias_ft@aemps.es C/ CAMPEZO, 1 EDIFICIO 8 28022 MADRID 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO CORREO ELECTRÓNICO Sugerencias_ft@aemps.es C/ CAMPEZO, 1 EDIFICIO 8 28022 MADRID 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en
FICHA TÉCNICA STAMARIL
 1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Vacuna antiamarílica atenuada 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Suspensión inyectable Fórmula: El frasco ámpula con liofilizado para una dosis
1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Vacuna antiamarílica atenuada 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Suspensión inyectable Fórmula: El frasco ámpula con liofilizado para una dosis
FLUBLOK Hemaglutininas recombinantes para la cepa viral de Influenza H1N1, H3N2 y B Solución Inyectable
 Información para prescribir Reducida FLUBLOK Hemaglutininas recombinantes para la cepa viral de Influenza H1N1, H3N2 y B Solución Inyectable FÓRMULA Cada dosis de 0.5 ml contiene: rha H1 A/California/07/2009
Información para prescribir Reducida FLUBLOK Hemaglutininas recombinantes para la cepa viral de Influenza H1N1, H3N2 y B Solución Inyectable FÓRMULA Cada dosis de 0.5 ml contiene: rha H1 A/California/07/2009
FICHA TÉCNICA AGRIPPAL S1
 1. Denominación distintiva 2. Denominación genérica Vacuna anti-influenza trivalente tipo A y B 3. Composición cualitativa y cuantitativa. A/California/7/2009 (H1N1)pdm09 15.000 mcg HA A/Perth/16/2009
1. Denominación distintiva 2. Denominación genérica Vacuna anti-influenza trivalente tipo A y B 3. Composición cualitativa y cuantitativa. A/California/7/2009 (H1N1)pdm09 15.000 mcg HA A/Perth/16/2009
FICHA TÉCNICA. * La vacuna cumple con la recomendación de la OMS (hemisferio Norte) y con la decisión de la Unión Europea para la campaña 2000/2001.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL PASTEUR Vacuna antigripal inactivada (virus fraccionados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe cultivados en huevos, fraccionados
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL PASTEUR Vacuna antigripal inactivada (virus fraccionados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe cultivados en huevos, fraccionados
FICHA TÉCNICA. DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Por cada unidad de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Por cada unidad de vacuna
FICHA TÉCNICA. Virus de la gripe fraccionados*, inactivados, que contienen antígenos equivalentes a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ZULVAC 1 Bovis suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ZULVAC 1 Bovis suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Brucella melitensis, viva atenuada, cepa Rev-1 (fase lisa) x 10 9 ufc* *ufc: Unidades formadoras de colonias
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CZV Rev-1 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis (1 ml) de
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CZV Rev-1 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis (1 ml) de
FICHA TÉCNICA FLUVIRENE
 1. Denominación distintiva 2. Denominación genérica Vacuna antiinfluenza trivalente tipo A y B 3. Composición cualitativa y cuantitativa. A/California/7/2009 (H1N1)pdm09 A/Victoria/361/2011 (H3N2) B/Wisconsin/1/2010
1. Denominación distintiva 2. Denominación genérica Vacuna antiinfluenza trivalente tipo A y B 3. Composición cualitativa y cuantitativa. A/California/7/2009 (H1N1)pdm09 A/Victoria/361/2011 (H3N2) B/Wisconsin/1/2010
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker viva, liofilizado y disolvente
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker viva, liofilizado y disolvente
MODELO DE PROSPECTO Vacuna recombinante contra la hepatitis B (HepB)
 MODELO DE PROSPECTO Vacuna recombinante contra la hepatitis B (HepB) DESCRIPCIÓN Esta vacuna liquida contiene partículas muy purificadas y no infecciosas del antígeno de superficie del virus de la hepatitis
MODELO DE PROSPECTO Vacuna recombinante contra la hepatitis B (HepB) DESCRIPCIÓN Esta vacuna liquida contiene partículas muy purificadas y no infecciosas del antígeno de superficie del virus de la hepatitis
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis BVD Suspensión inyectable para bovino. DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis BVD Suspensión inyectable para bovino. DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Influvac suspensión inyectable jeringa precargada (vacuna antigripal inactivada de antígenos de superficie). Campaña 2014/2015. 2.
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Influvac suspensión inyectable jeringa precargada (vacuna antigripal inactivada de antígenos de superficie). Campaña 2014/2015. 2.
FICHA TÉCNICA. VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable
 FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
Nobivac Myxo-RHD liofilizado y disolvente para suspensión inyectable para conejos.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobivac Myxo-RHD liofilizado y disolvente para suspensión inyectable para conejos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna reconstituida
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobivac Myxo-RHD liofilizado y disolvente para suspensión inyectable para conejos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna reconstituida
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS IBR MARKER VIVA Liofilizado y disolvente para suspensión para bovino
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS IBR MARKER VIVA Liofilizado y disolvente para suspensión para bovino
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
FICHA TÉCNICA INFLUVAC
 1. Denominación distintiva: 2. Denominación genérica: Vacuna antiinfiuenza trivalente tipo A y B 3. Composición cualitativa y cuantitativa: Cada dosis de 0,5 ml contiene: A/California/7/2009 (H1N1) pdm09
1. Denominación distintiva: 2. Denominación genérica: Vacuna antiinfiuenza trivalente tipo A y B 3. Composición cualitativa y cuantitativa: Cada dosis de 0,5 ml contiene: A/California/7/2009 (H1N1) pdm09
El propósito de esta carta es comunicarle la información actualizada para. CELESTONE 4mg / ml SOLUCIÓN INYECTABLE (Betametasona)
 Abril, 2017 Para: Profesionales de la Salud Asunto: Información Actualizada sobre la Seguridad y términos de uso del producto CELESTONE 4mg / ml SOLUCIÓN INYECTABLE (Betametasona) Estimado Profesional
Abril, 2017 Para: Profesionales de la Salud Asunto: Información Actualizada sobre la Seguridad y términos de uso del producto CELESTONE 4mg / ml SOLUCIÓN INYECTABLE (Betametasona) Estimado Profesional
Instrucción Vacunación frente Hepatitis A
 Instrucción Vacunación frente Hepatitis A 1. Situación epidemiológica de la hepatitis A en España Desde finales del año 2016 se ha observado un aumento de casos de hepatitis A en nuestra región, en España
Instrucción Vacunación frente Hepatitis A 1. Situación epidemiológica de la hepatitis A en España Desde finales del año 2016 se ha observado un aumento de casos de hepatitis A en nuestra región, en España
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACION DEL MEDICAMENTO VETERINARIO DERCUNIMIX 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACION DEL MEDICAMENTO VETERINARIO DERCUNIMIX 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis
agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACION DEL MEDICAMENTO VETERINARIO DERCUNIMIX 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis
Egnor pqste_uf VAXIGRIP ADULTO 2OO9 FICHA TECNICA. Virus de la influenzax, fraccionado, inactivado, conteniendo antígenos análogos a:
 Egnor pqste_uf ------ La división vacunas del Gruoo sanofi-aventis FICHA TECNICA VAXIGRIP ADULTO 2OO9 Vacuna anti-influenza inactivada suspensión inyectable 1. DEMONIMACIóN DEL MEDICAMENTO VAXIGRIP, suspensión
Egnor pqste_uf ------ La división vacunas del Gruoo sanofi-aventis FICHA TECNICA VAXIGRIP ADULTO 2OO9 Vacuna anti-influenza inactivada suspensión inyectable 1. DEMONIMACIóN DEL MEDICAMENTO VAXIGRIP, suspensión
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RISPOVAL BRSV PI3 BVD Liofilizado y suspensión
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RISPOVAL BRSV PI3 BVD Liofilizado y suspensión
4.2. Indicaciones de uso, especificando las especies de destino
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO FILAVAC VHD K C+V suspensión inyectable para conejos. 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO FILAVAC VHD K C+V suspensión inyectable para conejos. 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA O RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Ingelvac MycoFLEX suspensión inyectable para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Mycoplasma
FICHA TÉCNICA O RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Ingelvac MycoFLEX suspensión inyectable para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Mycoplasma
PROSPECTO: INFORMACIÓN PARA EL USUARIO
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Gamma Anti-Tétanos Grifols 500 UI solución inyectable en jeringa precargada Inmunoglobulina humana antitetánica Lea todo el prospecto detenidamente antes de empezar
PROSPECTO: INFORMACIÓN PARA EL USUARIO Gamma Anti-Tétanos Grifols 500 UI solución inyectable en jeringa precargada Inmunoglobulina humana antitetánica Lea todo el prospecto detenidamente antes de empezar
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
PROSPECTO PARA: Ingelvac MycoFLEX suspensión inyectable para cerdos
 PROSPECTO PARA: Ingelvac MycoFLEX suspensión inyectable para cerdos 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Y DEL FABRICANTE RESPONSABLE DE
PROSPECTO PARA: Ingelvac MycoFLEX suspensión inyectable para cerdos 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Y DEL FABRICANTE RESPONSABLE DE
VACUNAS COMBINADAS. Introducción. Administración y pautas de vacunación
 VACUNAS COMBINADAS 19 Introducción La aparición de un número cada vez mayor de vacunas cuya administración está indicada en la edad infantil implica un número creciente de inyecciones parenterales, con
VACUNAS COMBINADAS 19 Introducción La aparición de un número cada vez mayor de vacunas cuya administración está indicada en la edad infantil implica un número creciente de inyecciones parenterales, con
Información para Prescribir PULMOVAX
 I. Denominación distintiva II. Denominación genérica Vacuna antineumocóccica de 23 Serotipos III. Forma Farmacéutica y Formulación Suspensión inyectable. PULMOVAX se prepara por métodos desarrollados por
I. Denominación distintiva II. Denominación genérica Vacuna antineumocóccica de 23 Serotipos III. Forma Farmacéutica y Formulación Suspensión inyectable. PULMOVAX se prepara por métodos desarrollados por
Secretaría de Salud Programa Ampliado de Inmunizaciones. Conceptos y principios generales de inmunización
 Secretaría de Salud Programa Ampliado de Inmunizaciones Conceptos y principios generales de inmunización Siguatepeque 27 de junio al 01 de julio de 2011 Contenido Conceptos básicos Principios generales
Secretaría de Salud Programa Ampliado de Inmunizaciones Conceptos y principios generales de inmunización Siguatepeque 27 de junio al 01 de julio de 2011 Contenido Conceptos básicos Principios generales
Inmunizaciones. Vacunas Infantiles. Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Objetivo:
 Inmunizaciones Vacunas Infantiles Objetivo: Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Definición: n: Administración n de microorganismos o sus toxinas previamente
Inmunizaciones Vacunas Infantiles Objetivo: Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Definición: n: Administración n de microorganismos o sus toxinas previamente
Virus de la parotiditis TCID 50. VIAL DE DISOLVENTE. Agua para inyección...0,5 ml
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO VACUNA MSD ANTIPAROTIDITIS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA VACUNA MSD ANTIPAROTIDITIS (vacuna con virus de la parotiditis vivos) es una vacuna de virus
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO VACUNA MSD ANTIPAROTIDITIS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA VACUNA MSD ANTIPAROTIDITIS (vacuna con virus de la parotiditis vivos) es una vacuna de virus
Prospecto: información para el usuario. PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos
 Prospecto: información para el usuario PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos Lea todo el prospecto detenidamente antes de que usted o su hijo sean
Prospecto: información para el usuario PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos Lea todo el prospecto detenidamente antes de que usted o su hijo sean
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS IB+ND 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis (0,5
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS IB+ND 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis (0,5
Vacuna combinada de virus de moquillo canino (vivo), liofilizado; parvovirus canino (vivo) liofilizado, y coronavirus canino (inactivado).
 agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DURAMUNE CACHORROS DP+C COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DURAMUNE CACHORROS DP+C COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRABOVIS BALANCE liofilizado y suspensión para preparación de suspensión inyectable para bovino
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRABOVIS BALANCE liofilizado y suspensión para preparación de suspensión inyectable para bovino
Influenza. Dr. Fernando Arrieta
 Influenza Dr. Fernando Arrieta Dpto. InmunizacionesCHLA EP Virus Influenza Tipos antigénicos: iéi A, B y C Tipo A: circulan entre humanos y animales Tipo B: circula entre humanos Tipo C: circula entre
Influenza Dr. Fernando Arrieta Dpto. InmunizacionesCHLA EP Virus Influenza Tipos antigénicos: iéi A, B y C Tipo A: circulan entre humanos y animales Tipo B: circula entre humanos Tipo C: circula entre
IM cara anterolateral del muslo en los lactantes o el músculo deltoides de la parte superior del brazo en los niños.
 ESQUEMA CON VACUNAS ESPECIALES VACUNACION NO CUBIERTA POR EL PAN OBLIGATORIO DE SALUD Hepatitis B Anti hepatitis B A partir de los 5 º dosis en la fecha elegida. ª un mes después de la primera dosis. ª
ESQUEMA CON VACUNAS ESPECIALES VACUNACION NO CUBIERTA POR EL PAN OBLIGATORIO DE SALUD Hepatitis B Anti hepatitis B A partir de los 5 º dosis en la fecha elegida. ª un mes después de la primera dosis. ª
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)_Agosto_2016
 KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
FÓRMULA CUALI CUANTITATIVA:
 VACUNAANTIGRIPAL VENTABAJORECETA FORMAFARMACÉUTICA: Suspensióninyectableporvíaintramuscular(jeringaprellenadade0,5ml) FÓRMULACUALI CUANTITATIVA: Cadajeringaprellenadade0,5mlcontiene: Antigenosdehemoaglutininayneuraminidasasdelassiguientescepasdevirusinfluenza:
VACUNAANTIGRIPAL VENTABAJORECETA FORMAFARMACÉUTICA: Suspensióninyectableporvíaintramuscular(jeringaprellenadade0,5ml) FÓRMULACUALI CUANTITATIVA: Cadajeringaprellenadade0,5mlcontiene: Antigenosdehemoaglutininayneuraminidasasdelassiguientescepasdevirusinfluenza:
VARIVAX es una vacuna contra la varicela de virus vivos atenuados (una preparación liofilizada de la cepa de varicela Oka/Merck).
 VARIVAX VACUNA CONTRA LA VARICELA DE VIRUS VIVOS ATENUADOS 1350 PFU/0,5 ml, POLVO LIOFILIZADO PARA SOLUCIÓN INYECTABLE Vacuna contra la Varicela de virus vivos atenuados I. CLASE TERAPEUTICA VARIVAX es
VARIVAX VACUNA CONTRA LA VARICELA DE VIRUS VIVOS ATENUADOS 1350 PFU/0,5 ml, POLVO LIOFILIZADO PARA SOLUCIÓN INYECTABLE Vacuna contra la Varicela de virus vivos atenuados I. CLASE TERAPEUTICA VARIVAX es
FICHA TECNICA. Adyuvante de la vacuna de antihepatitis A inactivada Hidróxido de aluminio...0,3 miligramos Al 3+
 FICHA TECNICA 1. DENOMINACIÓN DEL MEDICAMENTO TYAVAX suspensión inyectable Vacuna combinada contra la fiebre tifoidea de polisacárido Vi purificado y antihepatitis A inactivada. 2. COMPOSICIÓN CUALITATIVA
FICHA TECNICA 1. DENOMINACIÓN DEL MEDICAMENTO TYAVAX suspensión inyectable Vacuna combinada contra la fiebre tifoidea de polisacárido Vi purificado y antihepatitis A inactivada. 2. COMPOSICIÓN CUALITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PORCILIS GLÄSSER SUSPENSION INYECTABLE PARA CERDOS 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PORCILIS GLÄSSER SUSPENSION INYECTABLE PARA CERDOS 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO STAMARIL PASTEUR Polvo y disolvente para suspensión inyectable. Vacuna atenuada contra la fiebre amarilla 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO STAMARIL PASTEUR Polvo y disolvente para suspensión inyectable. Vacuna atenuada contra la fiebre amarilla 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis
INSTRUCCIÓN DE 16 DE FEBRERO DE 2015 DE LA DIRECCIÓN GENERAL DE SALUD PÚBLICA
 INSTRUCCIÓN DE 16 DE FEBRERO DE 2015 DE LA DIRECCIÓN GENERAL DE SALUD PÚBLICA PROGRAMA PILOTO DE VACUNACIÓN FRENTE A HERPES ZÓSTER EN GRUPOS DE RIESGO. El herpes zóster es una enfermedad causada por el
INSTRUCCIÓN DE 16 DE FEBRERO DE 2015 DE LA DIRECCIÓN GENERAL DE SALUD PÚBLICA PROGRAMA PILOTO DE VACUNACIÓN FRENTE A HERPES ZÓSTER EN GRUPOS DE RIESGO. El herpes zóster es una enfermedad causada por el
NORMATIVA VACUNAS HEPATITIS B. Departamento de Vacunas e Inmunizaciones Ministerio de Salud
 NORMATIVA VACUNAS HEPATITIS B Departamento de Vacunas e Inmunizaciones Ministerio de Salud Nuevas incorporaciones en trámite 2015 (Sujetos a modificaciones y aprobación por el Departamento de Asesoría
NORMATIVA VACUNAS HEPATITIS B Departamento de Vacunas e Inmunizaciones Ministerio de Salud Nuevas incorporaciones en trámite 2015 (Sujetos a modificaciones y aprobación por el Departamento de Asesoría
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBI-VAC PARVO-C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (1
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBI-VAC PARVO-C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (1
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VERSIFEL FeLV Suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 1 ml contiene:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VERSIFEL FeLV Suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 1 ml contiene:
Vacuna frente a Haemophilus influenzae tipo b
 Vacuna frente a Haemophilus influenzae tipo b Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Previo al empleo sistemático
Vacuna frente a Haemophilus influenzae tipo b Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Previo al empleo sistemático
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS IB+ND+EDS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS IB+ND+EDS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO. Equilis Prequenza Te, suspensión inyectable, para caballos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Equilis Prequenza Te, suspensión inyectable, para caballos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias activas: Virus de la influenza
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Equilis Prequenza Te, suspensión inyectable, para caballos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias activas: Virus de la influenza
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TÉCNICA. VACUNA ANTINEUMOCÓCICA DE POLISACÁRIDOS AVENTIS PASTEUR MSD, Jeringa precargada
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VACUNA ANTINEUMOCÓCICA DE POLISACÁRIDOS AVENTIS PASTEUR MSD, Jeringa precargada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VACUNA ANTINEUMOCÓCICA DE POLISACÁRIDOS AVENTIS PASTEUR MSD, Jeringa precargada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Ditanrix Adulto suspensión inyectable Vacuna Antitétanos-difteria (Td)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ditanrix Adulto suspensión inyectable Vacuna Antitétanos-difteria (Td) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Ditanrix Adulto contiene los toxoides de tétanos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ditanrix Adulto suspensión inyectable Vacuna Antitétanos-difteria (Td) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Ditanrix Adulto contiene los toxoides de tétanos
FICHA TÉCNICA DENGVAXIA
 1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Vacuna tetravalente de virus vivos atenuados contra el dengue. 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Polvo liofilizado y diluyente para suspensión
1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Vacuna tetravalente de virus vivos atenuados contra el dengue. 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Polvo liofilizado y diluyente para suspensión
FICHA TÉCNICA. Para más información sobre el adyuvante, ver sección 5.1. Para consultar la lista completa de excipientes, ver sección 6.1.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Epaxal suspensión para inyección en jeringa precargada. Vacuna contra la hepatitis A (inactivada, virosoma) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis de
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Epaxal suspensión para inyección en jeringa precargada. Vacuna contra la hepatitis A (inactivada, virosoma) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis de
