ZOSTAVAX es un preparado liofilizado de la cepa Oka / Merck de, virus de la varicela-zoster vivo atenuado (VZV).
|
|
|
- Milagros Rojo Valenzuela
- hace 7 años
- Vistas:
Transcripción
1 WPC-V211-R-I VENEZUELA ZOSTAVAX VACUNA DE VIRUS VIVOS ATENUADOS CONTRA HERPES ZÓSTER. POLVO LIOFILIZADO PARA SUSPENSIÓN INYECTABLE. (Vacuna de virus vivos atenuados contra Herpes Zóster) I. CLASE TERAPÉUTICA ZOSTAVAX es un preparado liofilizado de la cepa Oka / Merck de, virus de la varicela-zoster vivo atenuado (VZV). COMPOSICIÓN ZOSTAVAX es un preparado liofilizado de la cepa Oka / Merck de, virus de la varicela-zoster vivo atenuado (VZV). El virus se obtuvo inicialmente a partir de un niño con varicela de origen natural, a continuación, fue introducido en cultivos de células de pulmón de embrión humano, adaptada y propagadas en cultivos de células de cerdo de guinea embrionario y finalmente propagadas en cultivos de células diploides humanas (WI 38). Además el paso del virus se realizó en Merck Research Laboratories (MRL) en cultivos de células diploides humanas (MRC 5) que estaban libres de agentes extraños. Esta vacuna zoster vivo atenuado es una preparación liofilizada que contiene sacarosa, fosfato, glutamato, y la gelatina procesada como estabilizadores. INGREDIENTES ACTIVOS: Cuando se reconstituye como se indica, ZOSTAVAX es un preparado estéril para administración subcutánea. Una vez reconstituido y mantenido a temperatura ambiente hasta durante 30 minutos, cada dosis de 0,65 ml contiene un mínimo de unidades formadoras de placas del virus de varicela-zóster. INGREDIENTES INACTIVOS: Cada dosis 0,65 ml contiene: sacarosa 41,05 mg, gelatina porcina hidrolizada 20,53 mg, urea 8,55mg, cloruro de sodio 5,25 mg, L-glutamato monosódico 0,82 mg, fosfato dibásico de sodio 0,75 mg, fosfato monobásico de potasio 0,13 mg, cloruro de potasio 0,13 mg; los componentes residuales de las células MRC-5 incluyendo ADN y proteína; y cantidades traza de neomicina y componentes séricos bovinos. El producto no contiene preservante. II. INDICACIONES ZOSTAVAX está indicado para: Prevenir el herpes zóster. Prevenir la neuralgia post-herpética (NPH), causada por la infección y reactivación del virus varicela zóster. Disminuir el dolor asociado con el herpes zoster agudo o crónico. ZOSTAVAX está indicado para inmunizar a personas mayores de 50 años. ZOSTAVAX puede ser administrado concomitantemente con la vacuna inactivada de la influenza (véase POSOLOGÍA Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA). III. POSOLOGÍA Y ADMINISTRACIÓN
2 PARA ADMINISTRACIÓN SUBCUTÁNEA No se inyecte por vía intravenosa. Adultos mayores de 50 años: una dosis única de 0,65 ml vía subcutánea en la región deltoidea. Se debe administrar una sola dosis. No se ha determinado cuánto dura la protección después de la vacunación con ZOSTAVAX. En el Estudio sobre la Prevención del Herpes Zóster (SPS, por sus siglas en inglés) se demostró la protección durante cuatro años de seguimiento. Aún no se ha determinado si es necesaria la revacunación. ZOSTAVAX no es un tratamiento para el herpes zóster ni de la neuralgia post-herpética. ZOSTAVAX puede ser administrado de forma concomitante con la vacuna inactivada de la influenza usando jeringas separadas. Reconstitúyase inmediatamente después de sacarlo del refrigerador. Para reconstituir la vacuna úsese únicamente el diluente que se proporciona con ella, que no contiene conservantes u otras sustancias antivirales que podrían inactivar el virus de la vacuna. Frasco de diluente: Para reconstituir la vacuna, aspírese con una jeringa todo el contenido del frasco del diluente, inyéctese en el frasco de vacuna liofilizada, y mézclese bien agitando el frasco suavemente. Aspírese todo el contenido con una jeringa e inyéctese por vía subcutánea el volumen total de la vacuna reconstituida, de preferencia en la cara externa del brazo (región deltoidea). Jeringa prellenada de diluente: Para reconstituir la vacuna, inyecte todo el contenido del frasco del diluente en el frasco de vacuna liofilizada, y mézclese bien agitando el frasco suavemente. Aspírese todo el contenido con una jeringa e inyéctese por vía subcutánea el volumen total de la vacuna reconstituida, de preferencia en la cara externa del brazo (región deltoidea). SE RECOMIENDA ADMINISTRAR LA VACUNA INMEDIATAMENTE DESPUÉS DE RECONSTITUIRLA, PARA MINIMIZAR LA PÉRDIDA DE POTENCIA. DESÉCHESE LA VACUNA RECONSTITUIDA QUE NO SE HAYA ADMINISTRADO EN LOS 30 MINUTOS SIGUIENTES A SU RECONSTITUCIÓN. No se congele la vacuna reconstituida. PRECAUCIÓN: Para cada inyección y/o reconstitución de ZOSTAVAX se debe usar una jeringa estéril y libre de conservantes, antisépticos y detergentes, porque estas sustancias podrían inactivar el virus de la vacuna. Es importante usar una jeringa y una aguja estériles distintas para cada paciente, para evitar la transmisión de agentes infecciosos de una persona a otra. Las agujas se deben desechar apropiadamente sin volver a ponerles su cubierta.
3 Si las características de la solución y del envase lo permiten, los medicamentos parenterales se deben examinar visualmente antes de administrarlos, en busca de partículas o cambios de coloración. Una vez reconstituido, ZOSTAVAX es un líquido semi-opaco a translúcido, incoloro a amarillo claro. IV. CONTRAINDICACIONES Antecedentes de hipersensibilidad a cualquiera de los componentes de la vacuna, incluyendo la gelatina. Antecedentes de reacción anafiláctica o anafilactoide a la neomicina (cada dosis de la vacuna reconstituida contiene trazas de neomicina). Generalmente, la alergia a la neomicina se manifiesta como una dermatitis de contacto. Sin embargo, un antecedente de dermatitis de contacto debido a la neomicina no es una contraindicación para recibir vacunas de virus vivos. ZOSTAVAX es una vacuna virus vivos y atenuados de varicela-zóster, su administración puede resultar en una enfermedad diseminada en individuos que están inmunosuprimidos o inmunodeficientes. Estados de inmunodeficiencia primaria y adquirida debidos a trastornos como leucemia aguda o crónica, linfoma, otras alteraciones que afectan la médula ósea o el sistema linfático, inmunosupresión por VIH/SIDA (ver FARMACOLOGÍA CLÍNICA y EFECTOS ADVERSOS); o deficiencias inmunitarias celulares. Tratamientos inmunosupresores (incluyendo las dosis altas de corticosteroides) (ver EFECTOS ADVERSOS); sin embargo, ZOSTAVAX no está contraindicado en las personas que están recibiendo corticosteroides tópicos o inhalados, corticosteroides sistémicos a dosis bajas, o como tratamiento de reemplazo, por ejemplo, en la insuficiencia suprarrenal. Tuberculosis activa no tratada. Mujeres embarazadas (ver EMBARAZO). V. PRECAUCIONES Y ADVERTENCIAS El profesional de la salud debe preguntar al paciente si ha tenido alguna reacción a una dosis anterior de cualquier vacuna que contenga virus de varicela-zóster (ver CONTRAINDICACIONES). Precaución en pacientes con trombocitopenia o trastornos de la coagulación. Como con cualquier vacuna, se deben tener los medios terapéuticos adecuados, incluyendo epinefrina inyectable (al 1:1000), para usarlos inmediatamente si ocurre una reacción anafiláctica o anafilactoide. Se debe considerar posponer la vacunación si el paciente tiene fiebre de más de 38.5 C (> F). No se han determinado la seguridad y la eficacia de ZOSTAVAX en adultos infectados con el virus de la inmunodeficiencia humana (VIH) con o sin signos de inmunodeficiencia. Un estudio de seguridad e inmunogenicidad de fase II en adultos infectados por VIH con la función inmune conservada ha sido completado (ver FARMACOLOGÍA CLÍNICA y EFECTOS ADVERSOS). Como ocurre con cualquier vacuna, es posible que la vacunación con ZOSTAVAX no proteja a todos los que son vacunados.
4 Transmisión En los ensayos clínicos con ZOSTAVAX no se ha reportado la transmisión del virus de la vacuna. Sin embargo, la experiencia obtenida después de la salida al mercado sugiere que en raros casos los vacunados que presentan una erupción semejante a la varicela pueden transmitir el virus de la vacuna a los contactos susceptibles. La transmisión del virus de la vacuna de varicela de los vacunados sin erupción tipo VZV también ha sido reportada. Este es un riesgo teórico para la vacunación con ZOSTAVAX. Se debe comparar el riesgo de transmitir el virus atenuado de la vacuna a las personas susceptibles con el de presentar el herpes zóster natural y transmitirlo a esas personas. No se administre en pacientes con enfermedades febriles, infecciones agudas y en pacientes que hayan recibido recientemente agentes inmunosupresores. VI. EMBARAZO No se han hecho estudios de reproducción en animales con ZOSTAVAX. No se sabe si ZOSTAVAX puede causar daños al feto si se administra a una mujer embarazada o afectar la capacidad reproductora. Sin embargo, se sabe que la infección natural con el virus de varicela-zóster natural puede causar daño fetal. Por lo tanto, no se debe administrar ZOSTAVAX a una mujer embarazada, y se debe evitar el embarazo durante los tres meses siguientes a la vacunación (ver CONTRAINDICACIONES). VII. LACTANCIA No sé ha determinado si el virus de la varicela-zóster es excretado con la leche humana. Por lo tanto, debido a que algunos virus sí son excretados con la leche. No se debe administrar durante la lactancia. VIII. USO PEDIÁTRICO No se recomienda administrar ZOSTAVAX a niños en este grupo etario. IX. USO EN PACIENTES DE EDAD AVANZADA El promedio de edad de las personas incluidas en el estudio clínico más extenso de ZOSTAVAX (n = ) fue 69 años (rango 59 a 99 años). De las personas que recibieron ZOSTAVAX, tenían 60 a 69 años, tenían 70 a 79 años, y eran mayores de 80 años. Se demostró que ZOSTAVAX fue generalmente seguro y eficaz en esos pacientes. X. INTERACCIONES No se debe mezclar ZOSTAVAX con ningún otro medicamento en la misma jeringa. Otros medicamentos inyectables se deben administrar por separado en otros lugares del cuerpo. No se ha evaluado la administración concomitante de ZOSTAVAX y medicamentos antivirales eficaces contra el virus de varicela-zóster. ZOSTAVAX y PNEUMOVAX 23 no deberían ser administrados concomitantemente, debido a que su uso concomitante resultó en reducción de la inmunogenicidad de ZOSTAVAX. Considerar la administración de las dos vacunas separadas por al menos 4 semanas.
5 XI. EFECTOS ADVERSOS En los ensayos clínicos se ha evaluado la seguridad de ZOSTAVAX en más de personas mayores de 50 años, y fue generalmente bien tolerado. Estudio de la Eficacia y de la Seguridad del ZOSTAVAX (ZEST) en Pacientes de 50 a 59 Años de Edad. En el estudio ZEST, los pacientes recibieron una dosis única de ZOSTAVAX (N=11.184) o placebo (N=11.212) y se les monitoreó la seguridad durante el estudio. Durante el estudio, se reportó una experiencia seria relacionada con la vacuna para 1 paciente vacunado con ZOSTAVAX (reacción anafiláctica). Todos los pacientes recibieron una tarjeta de reporte de vacunas (VRC) para registrar los eventos adversos que ocurren desde los Días 1 a 42 después de la aplicación de la vacuna además de enfrentar un monitoreo rutinario de seguridad durante todo el estudio. En el estudio ZEST se reportaron las siguientes experiencias adversas muy comunes ( 1/10) y comunes ( 1/100, <1/10) relacionadas con la vacuna en el sitio de inyección y sistémicas. Varias experiencias adversas fueron solicitadas (Días 1-5 postvacuna) y están marcadas con el símbolo *. Trastornos del sistema nervioso Comunes: cefalea Trastornos generales y condiciones del sitio de administración Muy comunes: eritema*, dolor*, hinchazón*, prurito Comunes: hematoma, calor, endurecimiento Trastornos músculoesqueléticos y del tejido conectivo Comunes: dolor en las extremidades La incidencia general de las experiencias adversas relacionada con la vacuna en el sitio de inyección fue significantemente mayor para los pacientes vacunados con ZOSTAVAX versus los pacientes que recibieron placebo (63.9% para ZOSTAVAX y 14.4% para el placebo). Dentro del período de reporte postvacuna de 42 días en el ZEST, se reportaron para 34 pacientes sarpullidos zosteriformes en sitios distintos al sitio de inyección (19 para el ZOSTAVAX y 15 para el placebo). De 24 muestras que resultaron adecuadas para la prueba de la Reacción de la Polimerasa en Cadena (PCR), se detectó VZV de tipo silvestre en 10 (3 para ZOSTAVAX, 7 para el placebo) de esas muestras. La cepa de VZV no fue detectada en ninguna de esas muestras. Dentro del mismo período de reporte postvacunación de 42 días en el ZEST, se reportaron sarpullidos tipo varicella en 124 pacientes (69 para ZOSTAVAX y 55 para el placebo). De 23 muestras que estaban disponibles y adecuadas para la prueba PCR se detectó VZV en una de esas muestras del grupo de pacientes que recibieron ZOSTAVAX; sin embargo, no se pudo determinar la cepa del virus (silvestre o cepa). Estudio de Prevención de la Culebrilla (SPS) en Pacientes de 60 años de edad o más En el más amplio de estos estudios, el Estudio de Prevención de la Culebrilla (SPS), pacientes recibieron una dosis única de ZOSTAVAX (N=19.270) o de placebo (N=19.276) y se les monitoreó la seguridad durante el estudio. Durante el estudio en 2 pacientes vacunados con ZOSTAVAX fueron reportadas experiencias adversas serias relacionadas con la vacuna (exacerbación del asma y polimialgia reumática) y en 3 pacientes que recibieron placebo (síndrome de Goodpasture, reacción anafiláctica y polimialgia reumática). En el Subestudio de Monitoreo de los Eventos Adversos, a un subgrupo de pacientes derivados del SPS (N=3.345 que recibieron ZOSTAVAX y N=3.271 que recibieron placebo) se les suministró una tarjeta de reporte de la vacuna para registrar los eventos adversos que ocurrieron desde el día 0 al día 42 postvacuna además de ser sometidos a un monitoreo de seguridad rutinario durante el estudio. Las siguientes experiencias adversas relacionadas con la vacuna en el sitio de inyección y sistémicas muy comunes ( 1/10) y comunes ( 1/100, <1/10) fueron reportadas en el Subestudio de Monitoreo de los Eventos Adversos. La mayoría de estas experiencias adversas fueron reportadas de intensidad leve. Varias experiencias adversas fueron solicitadas (Días 0-4 postvacuna) y se indican con el símbolo *. Trastornos del sistema nervioso Comunes: cefalea
6 Trastornos generales y condiciones del sitio de administración Muy comunes: eritema *, dolor / sensibilidad *, inflamación * Comunes: hematoma, prurito, calor La incidencia general de experiencias adversas relacionadas con la vacuna en el sitio de inyección fue significativamente mayor para los pacientes vacunados con ZOSTAVAX versus los pacientes que recibieron placebo (48% para ZOSTAVAX y 17% para el placebo). El resto de los pacientes en el SPS recibieron monitoreo de seguridad rutinario, pero no se les suministró la tarjeta de reporte. Los tipos de eventos reportados en esos pacientes fueron generalmente similares al subgrupo de pacientes en el Subestudio de Monitoreo de los Eventos Adversos. Dentro del período de reporte de 42 días postvacuna en el SPS, el número de rash zosteriformes reportado entre todos los pacientes fue pequeño (17 para ZOSTAVAX, 36 para el placebo; p=0.009). De estos 53 rash zosteriformes, 41 tuvieron muestras disponibles y adecuadas para la prueba del PCR. Se detectó VZV tipo salvaje en 25 (5 para ZOSTAVAX, 20 para el placebo) de esas muestras. La cepa de VZV no se detectó en ninguna de esas muestras. Dentro del mismo período de reporte de 42 días postvacuna en el SPS, el número (N=59) de rash tipo varicela reportados fue también pequeño. De estos rash tipo varicela, 10 tuvieron muestras disponibles y adecuadas para la prueba PCR. El VZV no fue detectado en ninguna de esas muestras. Otros Estudios En otros estudios clínicos que apoyan la licencia inicial de la fórmula congelada de ZOSTAVAX, la frecuencia de reporte de rash zosteriformes y tipo varicela en sitios distintos al sitio de inyección dentro de los 42 días postvacuna fue también baja en los receptores de la vacuna zóster y del placebo. De 17 rash tipo varicela reportados y rash tipo zóster en sitios distintos al sitio de inyección, se dispuso de 10 muestras adecuadas para la prueba del PCR y a 2 pacientes se les confirmó varicela (surgimiento el día 8 y 17) con la cepa. En estudios clínicos que evaluaron el ZOSTAVAX en pacientes de 50 años de edad en adelante, incluyendo un estudio de vacuna inactivada de influenza administrada concomitantemente, el perfil de seguridad fue generalmente similar a aquél observado en el Subestudio de Monitoreo de Eventos Adversos del SPS. Sin embargo, en esos estudios, entre los pacientes de años de edad comparados con los pacientes 60 años de edad, se reportó una mayor incidencia de experiencias adversas de intensidad leve a moderada. En un estudio clínico doble ciego, controlado con placebo, aleatorio, el ZOSTAVAX fue administrado a 100 pacientes de 50 años de edad o más con antecedentes de herpes zoster (HZ) antes de la vacuna, para evaluar la inmunogenicidad del ZOSTAVAX y el perfil de seguridad. En este estudio clínico, el perfil de seguridad fue generalmente similar a aquél observado en el Subestudio de Monitoreo de Eventos Adversos del SPS. Para solucionar los problemas para los pacientes con antecedentes desconocidos de aplicación de vacuna con ZOSTAVAX, se evaluó la seguridad y la tolerabilidad de una segunda dosis de ZOSTAVAX. En un estudio controlado con placebo, doble ciego, 98 adultos de 60 años de edad o más recibieron una segunda dosis de ZOSTAVAX 42 días después de la dosis inicial; la vacuna fue generalmente bien tolerada. La frecuencia de experiencias adversas relacionadas con la vacuna después de la segunda dosis de ZOSTAVAX fue generalmente similar a aquella observada con la primera dosis. Experiencia Postcomercialización Durante el uso postcomercialización de ZOSTAVAX se identificaron las siguientes reacciones adversas. Debido a que estas reacciones son reportadas voluntariamente por una población de tamaño incierto, generalmente no es posible calcular con certeza su frecuencia o establecer una relación causal con la vacuna. Trastornos gastrointestinales: náusea, vómito, diarrea. Infecciones e infestaciones: herpes zóster (cepa de la vacuna) Trastornos de la piel y del tejido subcutáneo: rash. Trastornos músculoesqueléticos y del tejido conectivo: artralgia; mialgia. Trastornos generales y condiciones del sitio de administración: rash en el sitio de inyección; urticaria en el sitio de inyección; pirexia; linfoadenopatía transitoria en el sitio de inyección, fiebre, somnolencia hiporexia, malestar general, irritabilidad, mareos. Trastornos del sistema inmune: reacciones de hipersensibilidad incluyendo reacciones anafilácticas
7 Trastornos oculares: retinitis necrotizante (pacientes con terapia inmunosupresora). XII. SOBREDOSIS No existen datos acerca de la toxicidad. XIII. FARMACOLOGÍA CLÍNICA Herpes Zoster Herpes zoster (HZ), comúnmente conocido como herpes o simplemente "zoster", es una manifestación de la reactivación de VZV, que, como una infección primaria, produce varicela. Luego de la infección inicial, el virus permanece latente en la raíz dorsal o en los ganglios sensitivos craneales hasta que se reactiva, produciendo zoster. Zoster se caracteriza usualmente por una erupción cutánea vesicular, dolorosa, unilateral, con una distribución dermatómica. A pesar de que la formación del sarpullido es la característica más distintiva del zoster, el síntoma debilitante más frecuente es el dolor, que puede ocurrir durante el pródromo, la fase eruptiva aguda, y la fase post-herpética de la infección. Durante la fase eruptiva aguda, el dolor local se ha reportado que ocurre en hasta el 90% de los individuos inmunocompetentes. Cualquiera que ha estado infectado con el VZV, incluyendo aquéllos sin una historia clínica de varicela, se encuentra en riesgo de desarrollar zoster; se considera que se debe a una disminución de la inmunidad al VZV. Casi todos los adultos (~98%) en los EE.UU. son susceptibles al zoster, donde se estima que 1 millón de casos ocurren anualmente. Se espera que este número aumente a medida que la edad media de la población aumente. La incidencia y la severidad del zoster, como así también la frecuencia y la severidad de sus complicaciones, aumentan marcadamente con la edad, con dos tercios de los casos ocurriendo en individuos mayores a los 50 años de edad. En estudios recientes, se estimó que el riesgo de por vida de tener zoster es tan alto como un 30% en la población general. Se estima que para los 85 años de edad, el 50% de los individuos habrán tenido un episodio de zoster. Entre 60% a 80% de hospitalizaciones por zoster ocurren entre los individuos inmunocompetentes. En los EE.UU., aproximadamente a hospitalizaciones asociadas al zoster, incluyendo de a en los cuales el diagnóstico principal es zoster, ocurren cada año. El zoster puede estar asociado con complicaciones serias, tales como neuralgia postherpética (NPH), cicatrices, superinfección bacteriana, parálisis neuromotora, neumonía, encefalitis, Síndrome de Ramsay-Hunt, trastornos visuales, pérdida de la audición, y muerte. El dolor y malestar asociado a zoster se puede prolongar y puede inhabilitar, y puede disminuir la calidad de vida y la capacidad funcional a un grado comparable como el de las enfermedades debilitantes tales como la insuficiencia cardíaca congestiva, infarto de miocardio, diabetes mellitus tipo II, y depresión grave. Neuralgia Post-herpética La Neuralgia Post-herpética (NPH), constituye la complicación grave más común y la causa de morbilidad asociada a zoster en las personas inmunocompetentes. Literatura publicada estima que la prevalencia del NPH en la población de EE.UU. es de a de casos. La frecuencia y la severidad del NPH aumentan con la edad, y podría complicar del 25 al 50% de los casos de zoster entre los pacientes por encima de los 50 años de edad. NPH ha sido descrita como un dolor ardiente, marcado, apuñalante, súbito y/o agudo que persiste por meses y hasta años y puede también conducir a agotamiento emocional. La allodynia (dolor de un estímulo inocuo) se encuentra presente en al menos 90% de los pacientes
8 con NPH y es típicamente descrita como uno de los tipos de dolores más agotadores y debilitantes. Varias definiciones de NPH han sido ampliamente usadas en la comunidad médica, incluyendo el dolor que persiste por más de 90 días luego de la aparición de la erupción. Mecanismo de acción El riesgo de desarrollar herpes zoster parece estar relacionado causalmente con una disminución de la inmunidad específica para el VZV. ZOSTAVAX demostró potenciar la inmunidad específica para el VZV, la cual se considera constituye el mecanismo que protege contra el herpes zoster y sus complicaciones. (Ver Inmunogenicidad). Estudios Clínicos Evaluación de la eficacia clínica suministrada por ZOSTAVAX Ensayo de Seguridad y Eficacia de Zostavax (ZEST) en Sujetos de 50 a 59 años de edad En el ensayo de Seguridad y Eficacia de ZOSTAVAX (ZEST), un ensayo clínico doble ciego, controlado por placebo, sujetos de 50 a 59 años de edad fueron randomizados para recibir una dosis simple de ya sea ZOSTAVAX (n=11.211) o placebo (n=11.228) y fueron monitoreados para detectar el desarrollo de zoster por una mediana de 1,3 años (rango de 0 a 2 años). Todos los casos sospechosos de zoster fueron adjudicados por un comité de evaluación clínica. La determinación final de los casos de zoster fue hecha a través de la Reacción en Cadena de la Polimerasa (PCR) [86%], o en la ausencia de detección del virus, según lo determinaba el comité de evaluación clínica [14%]. ZOSTAVAX redujo significativamente la incidencia de zoster comparado a placebo (30 casos [2,0/1000 años-persona] vs. 99 casos [6,6/1000 años-persona], respectivamente; p< 0.001). La eficacia protectora de ZOSTAVAX contra de zoster fue del 69,8% (IC al 95%: [54,1 80,6%]). Estudio de Prevención de Herpes (SPS) en Sujetos de 60 años de edad o mayores En el Estudio de Prevención del Herpes Zoster (SPS), un ensayo clínico de ZOSTAVAX controlado por placebo, y doble ciego, sujetos de 60 años y mayores fueron distribuidos aleatoriamente para recibir una dosis única de ZOSTAVAX (n=19.270) o placebo (n= ) y su seguimiento para verificar el desarrollo de herpes zoster se realizó durante un promedio de 3,1 años (rango 1 día a 4,9 años). La distribución aleatoria se estratificó por edad, 60 a 69 años y 70 años. Todos los supuestos casos de herpes zoster fueron adjudicados por un comité de evaluación clínica. La determinación definitiva de los casos de herpes zoster se realizó por PCR, cultivo local, o por decisión del comité de evaluación clínica, en dicho orden. En ambos grupos de vacunación (ZOSTAVAX y placebo), a los sujetos que desarrollaron el herpes zoster se les administró famciclovir, y según necesidad, medicaciones contra el dolor. La severidad del dolor fue evaluada según la puntuación del peor dolor en una escala de 0 a 10, utilizando el Inventario del Dolor por Herpes Zoster (ZBPI, según sus siglas en inglés), un cuestionario validado. Una puntuación de 3 o superior se consideró clínicamente significativa, ya que se correlacionaba con interferencias significativas con las Actividades de la Vida Diaria (ADL). ZOSTAVAX redujo significativamente el riesgo de desarrollo de herpes zoster y de neuralgia post-herpética respecto a placebo. Además, ZOSTAVAX redujo el dolor agudo y crónico asociado con el herpes zoster, según mediciones de la puntuación de Carga de la Enfermedad (BOI, según sus siglas en inglés) del dolor por el herpes zoster (ver Tabla 1).
9 Porcentaje Percent of de Subjects Sujetos con With zoster Zoster Tabla 1: Eficacia de ZOSTAVAX respecto a placebo en el Estudio de Prevención del Herpes Zoster Punto Final Eficacia de la vacuna IC al 95% Incidencia del Herpes Zoster 51% 44 a 58% Incidencia de NPH* 67% 48 a 79% Dolor por Herpes Zoster según la carga de enfermedad** 61% 51 a 69% *Dolor clínicamente significativo persistente o con aparición al menos 90 días después del inicio del rash, asociado con el herpes zoster **La puntuación de la BOI del dolor por herpes zoster es una puntuación compuesta que incorpora la incidencia, severidad, y duración del dolor agudo y crónico asociado con el herpes zoster durante un período de seguimiento de 6 meses. ZOSTAVAX disminuyó significativamente la incidencia de herpes zoster respecto a placebo (315 casos [5,4/ años persona] respecto a 642 casos [11,1/ años persona], respectivamente, p< 0,001). La eficacia protectora de ZOSTAVAX contra el herpes zoster fue de 51% (IC al 95%: [44-58%]). ZOSTAVAX redujo la incidencia de zoster en 64% (IC al 95%: [56-71%] en personas de 60 a 69 años, y en 38% (IC al 95%: [25-48%]) en personas 70 años. La incidencia acumulativa de herpes zoster a través del tiempo entre los receptores de la vacuna también se vio significativamente reducida (p< 0,001; Figura 1). Figura 1 Curva Kaplan-Meier de la Incidencia Acumulada de Zoster en el Tiempo* en el Estudio de Prevención del Herpes Zoster ZOSTAVAX Placebo p< Time Since the Start of Follow-Up (in Years) Tiempo desde el inicio del seguimiento (en años) * Un limitado número de sujetos fueron seguidos más allá de 4 años
10 Porcentaje Percent of de Subjects Sujetos With con PHN NPH ZOSTAVAX disminuyó la incidencia de neuralgia post-herpética (NPH) respecto a placebo [(27 casos [0,5/ años persona] vs. 80 casos [1,4/ años persona], respectivamente; p 0,001). En este ensayo, la definición de NPH fue dolor clínicamente significativo persistente o con aparición al menos 90 días después del inicio del rash, asociado con el herpes zoster. La eficacia protectora de ZOSTAVAX contra la neuralgia post-herpética fue de 67% (IC al 95%: [48-79%]), y la reducción resultó similar para los dos grupos etarios (60 a 69 y 70años). Además, la eficacia de ZOSTAVAX no cambió en forma apreciable cuando se definió la NPH utilizando tiempos de corte alternativos (30, 60, 120 o 182 días) por la duración del dolor. ZOSTAVAX redujo significativamente la incidencia acumulada de NPH a través del tiempo comparada con placebo (p> 0,001; Figura 2). Figura 2 Curva Kaplan-Meier de la Incidencia Acumulada de NPH en el Tiempo* en el Estudio de Prevención del Herpes Zoster ZOSTAVAX Placebo p< Tiempo Time Since desde the el inicio Start del of Follow-Up seguimiento (in (en Years) años) *Un limitado número de sujetos fueron seguidos más allá de 4 años ZOSTAVAX redujo la puntuación de Carga de la Enfermedad de dolor por el herpes zoster en aproximadamente 61% (IC al 95%: [51-69%]), respecto a placebo. ZOSTAVAX redujo la puntuación de Carga de la Enfermedad de dolor por el herpes zoster en un nivel similar para los dos grupos etarios (60 a 69 años y 70 años). La puntuación de la BOI del dolor por herpes zoster es una puntuación compuesta que incorpora la incidencia, severidad, y duración del dolor agudo y crónico asociado con el herpes zoster durante un período de seguimiento de 6 meses. ZOSTAVAX redujo en 73% (IC al 95% [46-87%]) la incidencia de herpes zoster con dolor severo y de larga duración (puntuación de severidad por duración > 600), respecto a placebo. Once sujetos vacunados con ZOSTAVAX presentaron puntuaciones de severidad por duración > 600 comparados con 40 sujetos que recibieron placebo (ver Figura 3).
11 Número de personas con Zoster Number of Subjects with Zoster Entre las personas vacunadas que desarrollaron herpes zoster, ZOSTAVAX redujo significativamente el dolor asociado con el herpes zoster respecto a placebo. Durante el período de seguimiento de 6 meses hubo una reducción de 22% en la puntuación de severidad por duración (puntuaciones promedio de 141 para ZOSTAVAX y 181 para placebo, p= 0,008). Figura 3 Severidad del Dolor asociado con Zoster por Puntuación de Dolor en el Tiempo en el Estudio de Prevención del Herpes Zoster* ZOSTAVAX Placebo Zoster-associated Pain Severity-by-Duration Score Severidad del Dolor asociado a Zoster- Escala de duración *El gráfico anterior presenta el número de sujetos con una puntuación de severidad por duración>600. Por ejemplo, un dolor diario peor clasificado en la máxima puntuación de 10 para >60 días resultaría en una puntuación de severidad por duración de >600 Entre las personas vacunadas que desarrollaron neuralgia post-herpética, ZOSTAVAX redujo en forma significativa el dolor asociado con la neuralgia post-herpética respecto a placebo. En el período desde los 90 días posteriores al inicio del rash hasta la finalización del seguimiento, hubo una reducción de 57% en la puntuación de la severidad por duración (puntuaciones promedio de 347 para ZOSTAVAX y de 805 para placebo; p= 0,016). Para evaluar el impacto de ZOSTAVAX sobre la interferencia asociada con el herpes zoster en las actividades de la vida diaria, se calculó una puntuación combinada para cada sujeto sobre la base de la interferencia con la actividad, estado de ánimo, capacidad para caminar, trabajo normal, relaciones con terceros, sueño, y goce de la vida generales. Cada ítem se midió según una escala de 0 a 10 (0 sin interferencia y 10 interferencia máxima). Respecto a placebo, ZOSTAVAX condujo a una reducción (8%) favorable pero no estadísticamente significativa en el riesgo de una interferencia sustancial con las actividades de la vida diaria (definida como con una puntuación de interferencia combinada en las actividades de la vida diaria 2 durante 7 días) además de la eficacia de la vacuna para el zoster. Entre las personas vacunadas que
12 desarrollaron herpes zoster, ZOSTAVAX redujo significativamente la interferencia con las actividades de la vida diaria respecto a placebo. Durante el período de seguimiento de 6 meses, hubo una reducción de 31% en la puntuación de severidad por duración para la interferencia en las actividades de la vida diaria combinada (puntuaciones promedio de 57 para ZOSTAVAX y de 83 para placebo; p= 0,002). La utilización de medicaciones antivirales dentro de las 72 horas de inicio del rash por herpes zoster no tuvo un efecto significativo sobre la eficacia de ZOSTAVAX para el dolor por zoster o la incidencia de neuralgia post-herpética. La proporción de sujetos que utilizaron medicaciones con efectos analgésicos se encontró equilibrada entre los grupos de vacunación. Por lo tanto, el uso de dichas medicaciones es improbable que haya contribuido a la reducción del dolor por el herpes zoster o la incidencia de neuralgia post-herpética. Menos complicaciones fueron reportadas por sujetos que recibieron ZOSTAVAX comparado a sujetos que recibieron placebo. El número de sujetos con complicaciones específicas de zoster que fueron reportados en el SPS con una frecuencia de 1% se muestra en la tabla 2. Tabla 2: Número de Sujetos con Complicaciones* Específicas de Zoster que fueron Reportadas en el Estudio de Prevención de Herpes Zoster Complicación ZOSTAVAX (N = 19,270) (n = 321) Placebo (N = 19,276) (n = 659) Alodinia Sobreinfección bacteriana 3 7 Diseminación 5 11 Problemas de Visión 2 9 Parálisis de los nervios periféricos (motores) 5 12 Ptosis ** 2 9 Cicatrización Pérdida sensorial 7 12 N = Número de sujetos randomizados n = número de casos de zoster, incluyendo aquellos casos que ocurrieron en el transcurso de los 30 días postvacunación, con esos datos disponibles. * Complicaciones reportadas a una frecuencia de 1% en al menos un grupo de vacunación entre sujetos con zoster. ** Zoster oftálmico ocurrió en 35 sujetos vacunados con ZOSTAVAX vs. 69 sujetos que recibieron placebo. Las complicaciones viscerales tales como neumonitis, hepatitis y meningoencefalitis fueron reportadas por menos de 1% de los sujetos con zoster (3 casos de neumonitis y 1 caso de hepatitis en el grupo placebo; 1 caso de meningoencefalitis en el grupo de vacuna). Inmunogenicidad de ZOSTAVAX En el Estudio de Prevención del Herpes Zoster (SPS) se evaluaron las respuestas inmunes a la vacunación en un subgrupo de los sujetos incorporados (N= 1395). ZOSTAVAX generó respuestas inmunes específicas mayores para el VZV a las 6 semanas post-vacunación respecto a placebo. Se demostraron aumentos en el nivel tanto de anticuerpos de VZV, según medición realizada por ensayo de glicoproteínas inmunoabsorbentes ligadas a enzimas (gpelisa) (diferencia de 1,7 veces,
13 título promedio geométrico [GMT] de 479 vs. 288 unidades gpelisa/ml, p< 0,001) y de actividad de los linfocitos T, medida por ensayo de titulación inmunoenzimática con formación de manchas de las células productoras de interferón gamma del VZV (IFN- ELISPOT) (diferencia de 2,2 veces, recuento promedio geométrico [GMC] de 70 vs. 32 de células formadoras de manchas por millón de células mononucleares de sangre periférica [SFC/ 106 PBMCs], p< 0,001). En un análisis integrado de dos ensayos clínicos en los cuales se evaluó la respuesta inmune a ZOSTAVAX a las 4 semanas post-vacunación, las respuestas resultaron generalmente similares en sujetos de 50 a 59 años (N= 389) respecto a los sujetos 60 años (N=731) (GMT de 668 vs. 614 unidades gpelisa/ ml, respectivamente). El incremento del promedio geométrico de la respuesta inmune luego de la vacunación medida por gpelisa fue de 2,6 veces (IC al 95%: [2,4-2,9]) en sujetos de 50 a 59 años, y de 2,3 veces (IC al 95%: [2,1-2,4]) en sujetos 60 años. Estudio SPS sub-estudio de persistencia a corto plazo (STPS) El STPS se inició para acumular información sobre la persistencia de la eficacia de la vacuna y para preservar un subconjunto de temas para el sub-estudio persistencia a largo plazo (LTPS por sus siglas en inglés). EL STPS incluyó a sujetos vacunados previamente con ZOSTAVAX y vacunados previamente con placebo en el SPS. La edad media al momento de inscribirse en el STPS era de 73,3 años. Durante el curso del STPS, a los sujetos que recibieron placebo se les ofreció ZOSTAVAX, en ese momento se consideró que habían completado el STPS. Los análisis de eficacia de la vacuna para el STPS se basaron en datos recolectados primordialmente de 4 a 7 años posteriores a la vacunación en el SPS. La mediana de seguimiento en el STPS era ~1,2 (el intervalos es de 1 día a 2,2 años). En el STPS, había 84 casos evaluables de HZ en el grupo de ZOSTAVAX y 95 casos evaluables en el grupo placebo. La eficacia estimada de la vacuna para la incidencia de HZ durante el periodo de seguimiento del STPS fue del 39,6% (18,2%, 55,5%). La eficacia estimada de la vacuna para la incidencia de la neuralgia post-herpética fue del 60.1% (- 9,8%, 86,7%). La eficacia estimada de la vacuna para la carga del dolor del HZ fue del 50,1% (14,1%, 71,0%). No hubo experiencias adversas serias reportadas en el STPS relacionadas con la vacuna. Estudio SPS sub-estudio de persistencia a largo plazo (LPTS) Tras la finalización del STPS, el estudio abierto LPTS evaluó la duración de la protección contral el HZ, neuralgia posherpética y carga del dolor del HZ de ZOSTAVAX en sujetos vacunados en el SPS. Participaron en el LPTS un total de sujetos previamente vacunados con ZOSTAVAX en el SPS. La edad promedio al momento de inscribirse al LPTS fue de 74,5 años. Debido a que a los sujetos tratados con placebo se les ofreció previamente la vacuna durante el STPS, un grupo control con placebo concurrente no estaba disponible para el cálculo de la eficacia de la vacuna para el LTPS. Por lo tanto, los receptores de placebo anteriores se utilizaron como grupo de referencia para el cálculo de eficacia de la vacuna en el LTPS. Los análisis del LTPS para la eficacia de la vacuna basados en los datos recolectados primordialmente del año 7 al 10 posteriores a la vacunación en el SPS. La mediana de seguimiento durante el LTPS fue de ~3,9 años (el rango es de una semanas a 4,75 años). Hubo 263 casos evaluables de HZ durante el período de seguimientos del LTPS. La eficacia estimada de la vacuna para la incidencia durante el período de seguimiento del LTPS fue de 21,1% (10,9%, 30,4%). La eficacia estimada de la vacuna para la incidencia de neuralgia posherpética fue del 35,4 % (8,8%, 55,8%). La eficacia estimada para la vacuna para la carga del dolor del HZ fue del 37,3% (26,7%, 46,4%). La Eficacia observada de la vacuna en el LTPS es generalmente consistente con la eficacia de la vacuna para el HZ observada durante el SPS en el grupo de 70 años de edad y es consistente con la edad actual del grupo de cohorte.
14 No hubo experiencias adversas serias reportadas en el LTPS relacionadas con la vacuna. Inmunogenicidad luego de la administración concomitante En un ensayo clínico doble ciego y controlado por placebo, 762 adultos de 50 años y mayores fueron distribuidos aleatoriamente para recibir una dosis única de ZOSTAVAX administrada en forma concomitante (N= 382) o no (n= 380) con la vacuna inactivada contra la gripe. Los sujetos enlistados en el grupo concomitante recibieron ZOSTAVAX y la vacuna contra la gripe en el Día 1 y placebo en la Semana 4. Los sujetos enlistados en el grupo no concomitante recibieron la vacuna contra la gripe y placebo en el Día 1 y ZOSTAVAX en la Semana 4. Las respuestas de anticuerpos a ambas vacunas a las 4 semanas posvacunación fueron similares, administradas ya sea en forma concomitante o no. En un ensayo clínico controlado, doble ciego, 473 adultos, de 60 años de edad o mayores, fueron aleatorizados para recibir ZOSTAVAX y PNEUMOVAX 23 concomitantemente (N=237), o PNEUMOVAX 23 sola seguido de 4 semanas después por ZOSTAVAX sola (N=236). A las 4 semanas post-vacunación, los niveles de anticuerpos VZV luego del uso concomitante fueron significativamente más bajos que los niveles de anticuerpos VZV luego de la administración no concomitante (GMTs de 338 vs. 484 unidades gpelisa/ml, respectivamente; relación GMT = 0.70 (IC al 95%: [0,61 0,80])). Los niveles de anticuerpos VZV 4 semanas post-vacunación aumentaron 1,9 veces (IC al 95%: [1,7 2,1]; cumpliendo los criterios de aceptación pre-especificados) en el grupo concomitante vs. 3,1 veces (IC al 95%: [2,8 3,5]) en el grupo no concomitante. El uso concomitante de ZOSTAVAX y PNEUMOVAX 23 demostró un perfil de seguridad que generalmente fue similar al de las dos vacunas administradas no concomitantemente. Inmunogenecidad en sujetos con antecedentes de herpes zoster antes de la vacunación En un ensayo clínico aleatorio, doble ciego, placebo controlado, ZOSTAVAX fue administrado a 100 sujetos de 50 años de edad o mayores, con antecedentes de herpes zoster antes de la vacunación, para ensayar la inmunogenecidad de ZOSTAVAX. ZOSTAVAX indujo una respuesta inmune VZV-específica mayor, medida por el ensayo gpelisa a las 4 semanas post-vacunación, comparada con placebo (diferencia de 2,1 veces (IC al 95% [1,5 2,9], p<0,001, GMT de 812 vs. 393 unidades gpelisa /ml). Las respuestas de anticuerpos contra el virus de varicela-zóster generalmente fueron similares en los sujetos de 50 a 59 años comparado con los sujetos de 60 años de edad o mayores. Inmunogenicidad en sujetos que toman corticosteroides sistémicos crónicos/ mantenimiento En un estudio clínico con distribución al azar, doble ciego, controlado con placebo, ZOSTAVAX fue administrado a 206 sujetos de 60 años de edad o más que estaban recibiendo terapia crónica/mantenimiento con corticosteroides sistémicos a dosis equivalentes diarias de 5 a 20 mg de prednisona durante al menos 2 semanas antes de inicio, y 6 o más después de la vacunación para evaluar la inmunogenicidad y perfil de seguridad de ZOSTAVAX. En comparación con placebo, ZOSTAVAX indujo una mayor VVZ específica gpelisa anticuerpos GMT a las 6 semanas posteriores a la vacunación (GMT 531,1 vs 224,3 de unidades gpelisa / ml, respectivamente). La media geométrica de las veces en que aumentó el anticuerpo VVZ, medida por gpelisa, antes y después de la vacunación era de 2,3 (IC al 95%: [2,0-2,7]) en el grupo de ZOSTAVAX en comparación con 1,1 (IC al 95%: [1,0-1,2]) en el grupo placebo (véase CONTRAINDICACIONES referente a corticosteroides). Inmunogenicidad en sujetos con infección por VIH En un ensayo clínico aleatorizado, doble ciego, controlado con placebo, se administró ZOSTAVAX bajo dos regímenes de dosis a adultos infectados por VIH (18 años de edad o mayores) bajo potente tratamiento antirretroviral de combinación con la función inmune inalterada (Recuento de células T CD células/µl). Aunque en este estudio se utilizó un régimen
15 de 2 dosis, ZOSTAVAX es administrado como un régimen de una única dosis (ver POSOLOGÍA Y ADMINISTRACIÓN). En este estudio, un total de 295 sujetos recibieron 1 dosis y 286 sujetos recibieron 2 dosis. En comparación con el placebo, ZOSTAVAX indujo un GMT de anticuerpos gpelisa específica de VZV superior en la semana 6 (6 semanas después de la dosis 1) y en la semana 12 (6 semanas después de la dosis 2) (GMT de 534,4 y 263,7 vs. 530,3 y 250,3 unidades gpelisa / ml, respectivamente). La media geométrica del aumento de veces de la respuesta de anticuerpos VZV, medida por gpelisa, desde el inicio hasta la semana 6 y en la semana 12 fueron de 1,78 (IC del 95%: [1,64-1,92]) y 1,80 (IC al 95%: [1,66 1,95] ), respectivamente, en receptores de la vacuna y 1,05 (IC al 95%: [0,98-1,12]) y 1,04 (IC al 95%: [0,96-1,13]), respectivamente, en los receptores de placebo. (Ver CONTRAINDICACIONES con respecto a inmunosupresión debido a VIH / SIDA.) XIV. CONDICIONES DE ALMACENAMIENTO Almacenamiento Durante el envío, para asegurar que no haya pérdida de potencia, la vacuna debe mantenerse a una temperatura de 8 C (46 F) o más frío, pero que no exceda de temperaturas inferiores a 50 C (58 F). El uso de hielo seco puede someter ZOSTAVAX a temperaturas inferiores a 50 C (58 F). ZOSTAVAX SE DEBE ALMACENAR REFRIGERADA a una temperatura de 2 a 8 C (36 a 46 F) o menor hasta que se reconstituye para inyección (véase DOSIS Y ADMINISTRACIÓN). El diluente se debe almacenar por separado a temperatura ambiente (20 a 25 C, 68 a 77 F) o en el refrigerador (2 a 8 C, 36 a 46 F). Antes de la reconstitución, proteja de la luz. DESECHAR SI LA VACUNA RECONSTITUIDA NO SE USA EN 30 MINUTOS. NO CONGELAR LA VACUNA RECONSTITUIDA. XIV. NOMBRE Y DIRECCIÓN DE LOS FABRICANTES DEL PRODUCTO TERMINADO Fabricado por: MERCK SHARP & DOHME CORP., USA. Dirección: 770 Sumneytown Pike. West Point, PA USA. Envasado por: MERCK SHARP & DOHME B.V., HOLANDA. Dirección: Waardeweg 39, 2031 BN Haarlem, Netherlands. XIV. INFORMACIÓN LOCAL ZOSTAVAX Vacuna de virus vivos atenuados contra herpes Zóster. Polvo Liofilizado para Suspensión inyectable P.B /15 RIF. J
ZOSTAVAX VACUNA CON VIRUS VIVOS ATENUADOS (OKA/ MERCK) DEL HERPES ZOSTER. Inyectable para administración subcutánea
 ZOSTAVAX VACUNA CON VIRUS VIVOS ATENUADOS (OKA/ MERCK) DEL HERPES ZOSTER Inyectable para administración subcutánea INDUSTRIA NORTEAMERICANA VENTA BAJO RECETA FORMULA CUALI-CUANTITATIVA: ZOSTAVAX es una
ZOSTAVAX VACUNA CON VIRUS VIVOS ATENUADOS (OKA/ MERCK) DEL HERPES ZOSTER Inyectable para administración subcutánea INDUSTRIA NORTEAMERICANA VENTA BAJO RECETA FORMULA CUALI-CUANTITATIVA: ZOSTAVAX es una
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA
 La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
IM cara anterolateral del muslo en los lactantes o el músculo deltoides de la parte superior del brazo en los niños.
 ESQUEMA CON VACUNAS ESPECIALES VACUNACION NO CUBIERTA POR EL PAN OBLIGATORIO DE SALUD Hepatitis B Anti hepatitis B A partir de los 5 º dosis en la fecha elegida. ª un mes después de la primera dosis. ª
ESQUEMA CON VACUNAS ESPECIALES VACUNACION NO CUBIERTA POR EL PAN OBLIGATORIO DE SALUD Hepatitis B Anti hepatitis B A partir de los 5 º dosis en la fecha elegida. ª un mes después de la primera dosis. ª
K:\Jenner_Public\QSS\VACCINE QUALITY & REGULATION GROUP\Inserts\Spanish\esp_Insert measles rubella Vd2-rev.doc
 MODELO DE PROSPECTO VACUNA COMBINADA CONTRA EL SARAMPIÓN Y LA RUBÉOLA (MR) DESCRIPCIÓN La vacuna MR es un polvo liofilizado que contiene dos antígenos, el del sarampión y el de la rubéola. Debe reconstituirse
MODELO DE PROSPECTO VACUNA COMBINADA CONTRA EL SARAMPIÓN Y LA RUBÉOLA (MR) DESCRIPCIÓN La vacuna MR es un polvo liofilizado que contiene dos antígenos, el del sarampión y el de la rubéola. Debe reconstituirse
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)_Agosto_2016
 KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
FICHA TÉCNICA. La vacuna MSD Antirrubéola cumple los requisitos de la OMS para productos biológicos y vacunas Antirrubéola.
 1. NOMBRE DEL MEDICAMENTO VACUNA MSD ANTIRRUBEOLA FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Vacuna MSD Antirrubéola (vacuna con virus de la rubéola vivos) es una vacuna de virus vivos para
1. NOMBRE DEL MEDICAMENTO VACUNA MSD ANTIRRUBEOLA FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Vacuna MSD Antirrubéola (vacuna con virus de la rubéola vivos) es una vacuna de virus vivos para
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA. Gotas Óticas. Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g.
 DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FORMULARIO DE INVESTIGACIÓN DE EAV Sólo para Eventos Adversos Serios Atribuidos a la Vacunación
 Página 1 de 9 Sólo para Eventos Adversos Serios Atribuidos a la ción SECCIÓN A DETALLES BÁSICOS Estado Distrito ID Lugar de la vacunación Centro de salud pública Centro de salud privado Otro (Especificar)
Página 1 de 9 Sólo para Eventos Adversos Serios Atribuidos a la ción SECCIÓN A DETALLES BÁSICOS Estado Distrito ID Lugar de la vacunación Centro de salud pública Centro de salud privado Otro (Especificar)
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
Vacuna contra la poliomielitis. (Comentarios a las fichas técnicas)
 Vacuna contra la poliomielitis (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Composición
Vacuna contra la poliomielitis (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Composición
FICHA TÉCNICA. VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable
 FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela
 Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
FICHA TÉCNICA. Las personas con infección sintomática o asintomática por VIH, deben ser vacunadas lo antes posible, una vez confirmado el diagnóstico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
Anexo III. Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos
 Anexo III Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos 44 Modificaciones que se incluyen en las secciones pertinentes de la ficha técnica para las vacunas monovalentes
Anexo III Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos 44 Modificaciones que se incluyen en las secciones pertinentes de la ficha técnica para las vacunas monovalentes
FICHA TÉCNICA. Solución estéril inyectable por vía intramuscular (preferiblemente) o subcutánea. Pneumo 23 es un líquido transparente e incoloro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox
 TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Oncept IL-2 liofilizado y disolvente para suspensión inyectable para gatos. 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Oncept IL-2 liofilizado y disolvente para suspensión inyectable para gatos. 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Prospecto: información para el usuario
 Prospecto: información para el usuario ZOSTAVAX Polvo y disolvente para suspensión inyectable en jeringa precargada Vacuna frente a herpes zóster (virus vivos) Lea todo el prospecto detenidamente antes
Prospecto: información para el usuario ZOSTAVAX Polvo y disolvente para suspensión inyectable en jeringa precargada Vacuna frente a herpes zóster (virus vivos) Lea todo el prospecto detenidamente antes
Inmunizaciones. Vacunas Infantiles. Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Objetivo:
 Inmunizaciones Vacunas Infantiles Objetivo: Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Definición: n: Administración n de microorganismos o sus toxinas previamente
Inmunizaciones Vacunas Infantiles Objetivo: Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Definición: n: Administración n de microorganismos o sus toxinas previamente
Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014 2. COMPOSICIÓN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
Vacuna frente a Haemophilus influenzae tipo b
 Vacuna frente a Haemophilus influenzae tipo b Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Previo al empleo sistemático
Vacuna frente a Haemophilus influenzae tipo b Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Previo al empleo sistemático
Boletín Herpes. La pieza clave para fortalecer el sistema inmunológico
 Hoy en día, el Factor de Transferencia se ofrece como un complemento de los tratamientos convencionales, ya que al ser un inmunomodulador, es capaz de enseñar al sistema inmunológico a reaccionar de una
Hoy en día, el Factor de Transferencia se ofrece como un complemento de los tratamientos convencionales, ya que al ser un inmunomodulador, es capaz de enseñar al sistema inmunológico a reaccionar de una
VARICELA INTRODUCCIÓN INDICACIONES
 VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
PROSPECTO: INFORMACIÓN PARA EL USUARIO. PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos
 PROSPECTO: INFORMACIÓN PARA EL USUARIO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos Lea todo el prospecto detenidamente antes de que usted o su hijo sean
PROSPECTO: INFORMACIÓN PARA EL USUARIO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos Lea todo el prospecto detenidamente antes de que usted o su hijo sean
PANENZA suspensión inyectable en vial multidosis Vacuna antigripal pandémica (H1N1) (virus fraccionado inactivado)
 1. NOMBRE DEL MEDICAMENTO PANENZA suspensión inyectable en vial multidosis Vacuna antigripal pandémica (H1N1) (virus fraccionado inactivado) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe*
1. NOMBRE DEL MEDICAMENTO PANENZA suspensión inyectable en vial multidosis Vacuna antigripal pandémica (H1N1) (virus fraccionado inactivado) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe*
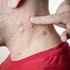
Herpes zóster. Este sumario le enseñará sobre el herpes zoster, sus causas, síntomas, complicaciones, diagnóstico, y tratamiento.
 Herpes zóster Introducción El herpes zóster es una enfermedad que causa dolor y ampollas graves en la cara o el cuerpo. Millones de personas se ven afectadas cada año por el herpes zóster. El herpes zoster
Herpes zóster Introducción El herpes zóster es una enfermedad que causa dolor y ampollas graves en la cara o el cuerpo. Millones de personas se ven afectadas cada año por el herpes zóster. El herpes zoster
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
Nadia Isabel Hornquist Hurtarte Química Bióloga Clínica de Enfermedades Infecciosas Hospital Roosevelt
 Nadia Isabel Hornquist Hurtarte Química Bióloga Clínica de Enfermedades Infecciosas Hospital Roosevelt Fase aguda: Entre el 40% a 90% sintomáticos (similar mononucleosis) Fase crónica: asintomaticos El
Nadia Isabel Hornquist Hurtarte Química Bióloga Clínica de Enfermedades Infecciosas Hospital Roosevelt Fase aguda: Entre el 40% a 90% sintomáticos (similar mononucleosis) Fase crónica: asintomaticos El
Es preciso vacunar del herpes zóster a los mayores de 50 años?
 Es preciso vacunar del herpes zóster a los mayores de 50 años? Magda Campins Martí Servicio de Medicina Preventiva y Epidemiología XII Jornadas sobre Vacunas en Atención Primaria Valencia, octubre 2011
Es preciso vacunar del herpes zóster a los mayores de 50 años? Magda Campins Martí Servicio de Medicina Preventiva y Epidemiología XII Jornadas sobre Vacunas en Atención Primaria Valencia, octubre 2011
GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE
 FOLLETO DE INFORMACIÓN AL PROFESIONAL GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE 1. INDICACIONES Y USO 1.1 Niñas y Mujeres GARDASIL 9 es una vacuna
FOLLETO DE INFORMACIÓN AL PROFESIONAL GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE 1. INDICACIONES Y USO 1.1 Niñas y Mujeres GARDASIL 9 es una vacuna
Es frecuente la infección crónica por el virus de hepatitis B (VHB)?
 HEPATITIS B Qué es la hepatitis B y tipos? La hepatitis B es una enfermedad producida por la infección de un virus de tipo ADN, que infecta e inflama el hígado. Puede producir un cuadro agudo (hepatitis
HEPATITIS B Qué es la hepatitis B y tipos? La hepatitis B es una enfermedad producida por la infección de un virus de tipo ADN, que infecta e inflama el hígado. Puede producir un cuadro agudo (hepatitis
Vacunas Tosferina. Quién debe recibir la vacuna?
 Vacunas Tosferina Dos vacunas nuevas que contienen la vacuna acelular contra la tosferina fueron aprobadas en el 2005 por la FDA para uso en personas mayores. Estas vacunas son abreviadas Tdap. Una es
Vacunas Tosferina Dos vacunas nuevas que contienen la vacuna acelular contra la tosferina fueron aprobadas en el 2005 por la FDA para uso en personas mayores. Estas vacunas son abreviadas Tdap. Una es
AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública
 Fiebre Amarilla AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública La fiebre amarilla es una infección aguda causada por un Arbovirus del género flavivirus, transmitida por la picadura
Fiebre Amarilla AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública La fiebre amarilla es una infección aguda causada por un Arbovirus del género flavivirus, transmitida por la picadura
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Fevaxyn Pentofel, suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Fevaxyn Pentofel, suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Varicela 1. Agente inmunizante 2. Conservación
 Varicela 1. Agente inmunizante Es una vacuna viral atenuada, desarrollada en Japón en 1974; se utiliza el virus varicela-zoster cepa OKA atenuada (aceptada por OMS) obtenida en cultivos de células diploides
Varicela 1. Agente inmunizante Es una vacuna viral atenuada, desarrollada en Japón en 1974; se utiliza el virus varicela-zoster cepa OKA atenuada (aceptada por OMS) obtenida en cultivos de células diploides
Patología Médica Facultad de Medicina de Granada. Prof. Juan Jiménez Alonso Curso académico
 TOXOPLASMOSIS Patología Médica Facultad de Medicina de Granada. Prof. Juan Jiménez Alonso Curso académico 2002-2003 TOXOPLASMOSIS * Infección producida por T. Gondii, que es un protozoo intracelular que
TOXOPLASMOSIS Patología Médica Facultad de Medicina de Granada. Prof. Juan Jiménez Alonso Curso académico 2002-2003 TOXOPLASMOSIS * Infección producida por T. Gondii, que es un protozoo intracelular que
FICHA TÉCNICA. Polisacárido capsular Vi purificado de Salmonella typhi (cepa Ty2)...25 microgramos
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TYPHIM Vi, solución inyectable Vacuna antitifoidea de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene: Polisacárido capsular
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TYPHIM Vi, solución inyectable Vacuna antitifoidea de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene: Polisacárido capsular
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. RISPOVAL IBR-MARKER VIVUM Liofilizado y disolvente para suspensión inyectable para bovino
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RISPOVAL IBR-MARKER VIVUM Liofilizado y disolvente para suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RISPOVAL IBR-MARKER VIVUM Liofilizado y disolvente para suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Vacuna contra el Sarampión, Parotiditis y Rubéola. 2.0. DENOMINACIÓN GENÉRICA Vacuna contra el Sarampión,
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Vacuna contra el Sarampión, Parotiditis y Rubéola. 2.0. DENOMINACIÓN GENÉRICA Vacuna contra el Sarampión,
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO Gardasil suspensión inyectable. Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] (Recombinante, adsorbida).
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO Gardasil suspensión inyectable. Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] (Recombinante, adsorbida).
Guía de infecciones de transmisión sexual (ITS) seleccionadas
 Clamidia Una bacteria que puede infectar el cuello uterino y el útero de la mujer, así como la uretra, la garganta o el ano de hombres y mujeres. La infección por clamidia sin tratar puede ocasionar infertilidad
Clamidia Una bacteria que puede infectar el cuello uterino y el útero de la mujer, así como la uretra, la garganta o el ano de hombres y mujeres. La infección por clamidia sin tratar puede ocasionar infertilidad
FICHA TÉCNICA. * cultivados en huevos de gallina embrionados procedentes de pollos sanos ** hemaglutinina
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MUTAGRIP, suspensión inyectable en jeringa precargada. Vacuna antigripal (virus fraccionados, inactivados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MUTAGRIP, suspensión inyectable en jeringa precargada. Vacuna antigripal (virus fraccionados, inactivados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la
FICHA TÉCNICA. Nota: La utilización de Priorix debe realizarse de acuerdo a las recomendaciones oficiales.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRIORIX polvo y disolvente en jeringa precargada con aguja para solución inyectable PRIORIX polvo y disolvente
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRIORIX polvo y disolvente en jeringa precargada con aguja para solución inyectable PRIORIX polvo y disolvente
El sistema inmune y las vacunas
 SESIÓN DE INFORMACIÓN SOBRE VACUNAS, Santiago, Chile 7 de mayo 9 mayo, 2014 El sistema inmune y las vacunas Dra. Juanita Zamorano R Pediatra- Infectóloga jzamorano@uandes.cl 1 Jenner: En 1796 inicia la
SESIÓN DE INFORMACIÓN SOBRE VACUNAS, Santiago, Chile 7 de mayo 9 mayo, 2014 El sistema inmune y las vacunas Dra. Juanita Zamorano R Pediatra- Infectóloga jzamorano@uandes.cl 1 Jenner: En 1796 inicia la
FICHA TÉCNICA. No se han establecido la seguridad y efectividad en niños menores de 12 meses.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vaqta 25 Unidades/0,5 ml suspensión inyectable en jeringa precargada. Vacuna antihepatitis A, inactivada, adsorbida. Para niños y adolescentes. 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vaqta 25 Unidades/0,5 ml suspensión inyectable en jeringa precargada. Vacuna antihepatitis A, inactivada, adsorbida. Para niños y adolescentes. 2. COMPOSICIÓN CUALITATIVA
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
INFORME CÓDIGOS OMI AP. ARAGÓN S70. HERPES ZÓSTER - Informe año 2015 INTRODUCCIÓN METODOLOGÍA OBJETIVOS
 INFORME CÓDIGOS OMI AP. ARAGÓN S70. HERPES ZÓSTER - Informe año 2015 INTRODUCCIÓN El herpes zóster es una manifestación local que aparece al reactivarse una infección latente por virus de la varicela en
INFORME CÓDIGOS OMI AP. ARAGÓN S70. HERPES ZÓSTER - Informe año 2015 INTRODUCCIÓN El herpes zóster es una manifestación local que aparece al reactivarse una infección latente por virus de la varicela en
FICHA TÉCNICA. Esta vacuna puede contener una cantidad residual de neomicina (ver secciones 4.3 y 4.4).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Varivax polvo y disolvente para suspensión inyectable [Vacuna antivaricela (virus vivos)] 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Después de su reconstitución,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Varivax polvo y disolvente para suspensión inyectable [Vacuna antivaricela (virus vivos)] 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Después de su reconstitución,
LLD Abreviado de Zoloft. Todo medicamento debe conservarse fuera del alcance de los niños.
 LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2011/2012 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2011/2012 2. COMPOSICIÓN
FICHA TÉCNICA. Adsorbido en hidróxido de aluminio hidratado Total: 0,50 mg Al 3+ Una dosis (0,5 ml) de Havrix 720 contiene: 720 Unidades ELISA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Havrix 1440 suspensión inyectable en jeringa precargada Havrix 720 suspensión inyectable en jeringa precargada Vacuna antihepatitis A (inactivada, adsorbida) 2.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Havrix 1440 suspensión inyectable en jeringa precargada Havrix 720 suspensión inyectable en jeringa precargada Vacuna antihepatitis A (inactivada, adsorbida) 2.
Proyecto: uso racional de analgésicos y antiinflamatorios
 Proyecto: uso racional de analgésicos y antiinflamatorios OBJETIVO -Concientizar a la población sobre el uso responsable de los medicamentos, en este caso AINES. -Revalorizar el rol del farmacéutico en
Proyecto: uso racional de analgésicos y antiinflamatorios OBJETIVO -Concientizar a la población sobre el uso responsable de los medicamentos, en este caso AINES. -Revalorizar el rol del farmacéutico en
Prospecto: Información para el usuario. PNEUMOVAX 23 Solución Inyectable en vial. Vacuna antineumocócica de polisacáridos
 Prospecto: Información para el usuario PNEUMOVAX 23 Solución Inyectable en vial Vacuna antineumocócica de polisacáridos PARA ADULTOS Y NIÑOS A PARTIR DE DOS AÑOS. Lea todo el prospecto detenidamente antes
Prospecto: Información para el usuario PNEUMOVAX 23 Solución Inyectable en vial Vacuna antineumocócica de polisacáridos PARA ADULTOS Y NIÑOS A PARTIR DE DOS AÑOS. Lea todo el prospecto detenidamente antes
1. QUÉ ES VACUNA ANTIGRIPAL POLIVALENTE LETI, VIRUS FRACCIONADOS Y PARA QUÉ SE UTILIZA
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Vacuna Antigripal Polivalente LETI, Virus Fraccionados Suspensión Inyectable en Jeringa Precargada Vacuna antigripal (virus fraccionados, inactivados) Lea todo el
PROSPECTO: INFORMACIÓN PARA EL USUARIO Vacuna Antigripal Polivalente LETI, Virus Fraccionados Suspensión Inyectable en Jeringa Precargada Vacuna antigripal (virus fraccionados, inactivados) Lea todo el
SUPERINTENDENCIA DE SERVICIOS DE SALUD
 SUPERINTENDENCIA DE SERVICIOS DE SALUD VACUNACIÓN ANTIGRIPAL 2016 VACUNACIÓN ANTIGRIPAL 2016 La gripe o influenza es una enfermedad viral respiratoria que se presenta habitualmente en los meses más fríos
SUPERINTENDENCIA DE SERVICIOS DE SALUD VACUNACIÓN ANTIGRIPAL 2016 VACUNACIÓN ANTIGRIPAL 2016 La gripe o influenza es una enfermedad viral respiratoria que se presenta habitualmente en los meses más fríos
INFORME CÓDIGOS OMI AP. ARAGÓN S70. HERPES ZÓSTER - Informe año 2012 INTRODUCCIÓN METODOLOGÍA OBJETIVOS
 INFORME CÓDIGOS OMI AP. ARAGÓN S7. HERPES ZÓSTER - Informe año 12 INTRODUCCIÓN El herpes zóster es una manifestación local que aparece al reactivarse una infección latente por virus de la varicela en los
INFORME CÓDIGOS OMI AP. ARAGÓN S7. HERPES ZÓSTER - Informe año 12 INTRODUCCIÓN El herpes zóster es una manifestación local que aparece al reactivarse una infección latente por virus de la varicela en los
2. La Influenza A/H1N1
 2. La Influenza A/H1N1 Haemagglutinin (HA) Influenza Virus Neuraminidase (NA) El gráfico representa una partícula viral completa del virus (virión) de influenza. El virus posee una envoltura externa que
2. La Influenza A/H1N1 Haemagglutinin (HA) Influenza Virus Neuraminidase (NA) El gráfico representa una partícula viral completa del virus (virión) de influenza. El virus posee una envoltura externa que
CENTROS DE VACUNACIÓN
 Vacunación Infantil INTRODUCCIÓN a vacunación constituye una de las medidas más eficaces de la moderna salud pública para la prevención de importantes enfermedades que afectan a todos los ciudadanos, pero
Vacunación Infantil INTRODUCCIÓN a vacunación constituye una de las medidas más eficaces de la moderna salud pública para la prevención de importantes enfermedades que afectan a todos los ciudadanos, pero
VACUNACIÓN ANTIGRIPAL EN NIÑOS
 Servicio Canario de la Salud DIRECCIÓN GENERAL DE SALUD PÚBLICA VACUNACIÓN ANTIGRIPAL EN NIÑOS PROGRAMA DE VACUNAS SERVICIO DE EPIDEMIOLOGÍA Y PREVENCIÓN DIRECCIÓN GENERAL DE SALUD PÚBLICA OCTUBRE / DICIEMBRE-2008
Servicio Canario de la Salud DIRECCIÓN GENERAL DE SALUD PÚBLICA VACUNACIÓN ANTIGRIPAL EN NIÑOS PROGRAMA DE VACUNAS SERVICIO DE EPIDEMIOLOGÍA Y PREVENCIÓN DIRECCIÓN GENERAL DE SALUD PÚBLICA OCTUBRE / DICIEMBRE-2008
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
Actualización de temas GINA Dra. Patricia Arizmendi Agosto 2014
 Actualización de temas GINA 2014 Dra. Patricia Arizmendi Agosto 2014 Definición Enfermedad caracterizada por la inflamación crónica de la vía aérea. Definida por la presencia de síntomas de la esfera respiratoria
Actualización de temas GINA 2014 Dra. Patricia Arizmendi Agosto 2014 Definición Enfermedad caracterizada por la inflamación crónica de la vía aérea. Definida por la presencia de síntomas de la esfera respiratoria
DIAGNÓSTICO MOLECULAR CMV Y EBV
 DIAGNÓSTICO MOLECULAR CMV Y EBV DIAGNÓSTICO MOLECULAR REACCIÓN EN CADENA DE LA POLIMERASA (PCR) ALTA SENSIBILIDAD Y ESPECIFICIDAD DIAGNÓSTICO MOLECULAR REACCIÓN EN CADENA DE LA POLIMERASA (PCR) PCR PUNTO
DIAGNÓSTICO MOLECULAR CMV Y EBV DIAGNÓSTICO MOLECULAR REACCIÓN EN CADENA DE LA POLIMERASA (PCR) ALTA SENSIBILIDAD Y ESPECIFICIDAD DIAGNÓSTICO MOLECULAR REACCIÓN EN CADENA DE LA POLIMERASA (PCR) PCR PUNTO
INFORME CÓDIGOS OMI AP. ARAGÓN S70. HERPES ZÓSTER - Informe año 2014 INTRODUCCIÓN METODOLOGÍA OBJETIVOS
 INFORME CÓDIGOS OMI AP. ARAGÓN S7. HERPES ZÓSTER - Informe año 14 INTRODUCCIÓN El herpes zóster es una manifestación local que aparece al reactivarse una infección latente por virus de la varicela en los
INFORME CÓDIGOS OMI AP. ARAGÓN S7. HERPES ZÓSTER - Informe año 14 INTRODUCCIÓN El herpes zóster es una manifestación local que aparece al reactivarse una infección latente por virus de la varicela en los
Terapia de reposición en adultos y niños en síndromes de inmunodeficiencia primaria tales como:
 1. NOMBRE DEL MEDICAMENTO IGAMPLIA 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 320 mg/2 ml 800 mg/5 ml Inmunoglobulina humana normal (Proteínas humanas (Proporción
1. NOMBRE DEL MEDICAMENTO IGAMPLIA 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 320 mg/2 ml 800 mg/5 ml Inmunoglobulina humana normal (Proteínas humanas (Proporción
Procedimiento para la administración de la vacuna frente al Virus del Papiloma Humano (VPH) en la Comunidad Valenciana
 Procedimiento para la administración de la vacuna frente al Virus del Papiloma Humano (VPH) en la Comunidad Valenciana Desde la aparición de dos casos de adolescentes que experimentaron una posible reacción
Procedimiento para la administración de la vacuna frente al Virus del Papiloma Humano (VPH) en la Comunidad Valenciana Desde la aparición de dos casos de adolescentes que experimentaron una posible reacción
Corrección de calendario vacunal abril María Rosa Albañil Pediatra CS Cuzco GPI- AEPap
 Corrección de calendario vacunal abril 2016 María Rosa Albañil Pediatra CS Cuzco GPI- AEPap Niño de 2 años y 3 meses Nacido en Londres, donde ha residido hasta ahora Sano, no patología previa, no recibe
Corrección de calendario vacunal abril 2016 María Rosa Albañil Pediatra CS Cuzco GPI- AEPap Niño de 2 años y 3 meses Nacido en Londres, donde ha residido hasta ahora Sano, no patología previa, no recibe
Herpes zoster: epidemiología a y prevención. Valencia 2007
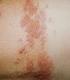 Herpes zoster: epidemiología a y prevención. Valencia 2007 PREVENCIÓN DE HERPES ZOSTER A mediados de 2006, ha sido aprobada en Estados Unidos por la FDA, una vacuna frente al herpes zóster, que contiene
Herpes zoster: epidemiología a y prevención. Valencia 2007 PREVENCIÓN DE HERPES ZOSTER A mediados de 2006, ha sido aprobada en Estados Unidos por la FDA, una vacuna frente al herpes zóster, que contiene
ACTUALIZACION DE VARICELA A LA SE 23 DE 2012
 ACTUALIZACION DE VARICELA A LA SE 23 DE 2012 Montevideo, 25 de junio de 2012 La varicela es la principal infección causada por el virus de la varicela zoster (VZV). Es una enfermedad viral aguda generalizada,
ACTUALIZACION DE VARICELA A LA SE 23 DE 2012 Montevideo, 25 de junio de 2012 La varicela es la principal infección causada por el virus de la varicela zoster (VZV). Es una enfermedad viral aguda generalizada,
Dolor en el anciano. Dr. Alberto José Mimenza Alvarado. Departamento de Geriatría, Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán
 Dolor en el anciano Dr. Alberto José Mimenza Alvarado Departamento de Geriatría, Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán F Qué entendemos por dolor? El dolor es una experiencia
Dolor en el anciano Dr. Alberto José Mimenza Alvarado Departamento de Geriatría, Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán F Qué entendemos por dolor? El dolor es una experiencia
Vacuna y Antivirales contra Influenza en embarazadas. Jeannette Dabanch Sociedad Chilena de Infectología Minsal 2012
 Vacuna y Antivirales contra Influenza en embarazadas Jeannette Dabanch Sociedad Chilena de Infectología Minsal 2012 Contenidos Impacto de la influenza en la embarazada y feto Rol de antivirales Eficacia
Vacuna y Antivirales contra Influenza en embarazadas Jeannette Dabanch Sociedad Chilena de Infectología Minsal 2012 Contenidos Impacto de la influenza en la embarazada y feto Rol de antivirales Eficacia
3. Defunciones y tasas de la mortalidad neonatal según causa y periodo, por sexo. Casos y tasas por nacidos vivos.
 2005-2013 2005-2007 2008-2010 Casos Tasa Casos Tasa Casos Tasa 01-54. Todas las causas 240 2,9 97 3,5 68 2,4 I. 01-05. Enfermedades infecciosas y parasitarias 1. Enfermedades infecciosas intestinales 2.
2005-2013 2005-2007 2008-2010 Casos Tasa Casos Tasa Casos Tasa 01-54. Todas las causas 240 2,9 97 3,5 68 2,4 I. 01-05. Enfermedades infecciosas y parasitarias 1. Enfermedades infecciosas intestinales 2.
PRIMERA REUNION NACIONAL DE HEPATITIS B y C. Marcela Avendaño V. Enfermera Departamento de Vacunas e Inmunizaciones Ministerio de Salud
 PRIMERA REUNION NACIONAL DE HEPATITIS B y C Marcela Avendaño V. Enfermera Departamento de Vacunas e Inmunizaciones Ministerio de Salud Misión: Protección de la población chilena frente a enfermedades inmunoprevenibles
PRIMERA REUNION NACIONAL DE HEPATITIS B y C Marcela Avendaño V. Enfermera Departamento de Vacunas e Inmunizaciones Ministerio de Salud Misión: Protección de la población chilena frente a enfermedades inmunoprevenibles
NILGRIP. VACUNA ANTIGRIPAL INACTIVADA (SPLIT VIRION) Suspensión para inyección subcutánea profunda o intramuscular
 NILGRIP VACUNA ANTIGRIPAL INACTIVADA (SPLIT VIRION) Suspensión para inyección subcutánea profunda o intramuscular Industria Australiana Venta bajo receta ADVERTENCIA: En esta temporada la vacuna está indicada
NILGRIP VACUNA ANTIGRIPAL INACTIVADA (SPLIT VIRION) Suspensión para inyección subcutánea profunda o intramuscular Industria Australiana Venta bajo receta ADVERTENCIA: En esta temporada la vacuna está indicada
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
- Como disolvente de medicamentos en polvo o liofilizados, previamente a su administración. - Como diluyente de soluciones y/o medicamentos.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables SERRACLINICS. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen agua para preparaciones inyectables. ph: 5,0-7,0
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables SERRACLINICS. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen agua para preparaciones inyectables. ph: 5,0-7,0
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Poulvac Marek CVI Suspensión y disolvente para suspensión inyectable para
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Poulvac Marek CVI Suspensión y disolvente para suspensión inyectable para
Vacuna triple vírica (sarampión, rubeola, parotiditis)
 Vacuna triple vírica (sarampión, rubeola, parotiditis) (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad
Vacuna triple vírica (sarampión, rubeola, parotiditis) (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
Nombre: Lincomicina Condición de venta: con receta médica Clasificación: antibiotico Disponible en: Nombres de marca:
 Nombre: Lincomicina Condición de venta: con receta médica Clasificación: antibiotico Disponible en: Nombres de marca: Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene
Nombre: Lincomicina Condición de venta: con receta médica Clasificación: antibiotico Disponible en: Nombres de marca: Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene
PROGRAMA DE VACUNACIONES VACUNACIÓN FRENTE A VARICELA A LOS 11 AÑOS
 PROGRAMA DE VACUNACIONES VACUNACIÓN FRENTE A VARICELA A LOS 11 AÑOS Revisión noviembre 2012 El Calendario Oficial de Vacunaciones de Castilla y León incluye desde 2005 la vacuna frente a la varicela a
PROGRAMA DE VACUNACIONES VACUNACIÓN FRENTE A VARICELA A LOS 11 AÑOS Revisión noviembre 2012 El Calendario Oficial de Vacunaciones de Castilla y León incluye desde 2005 la vacuna frente a la varicela a
VACUNACIÓN FRENTE A LA ENFERMEDAD NEUMOCÓCICA EN MAYORES EN CASTILLA-LA MANCHA
 VACUNACIÓN FRENTE A LA ENFERMEDAD NEUMOCÓCICA EN MAYORES EN CASTILLA-LA MANCHA JUSTIFICACION El neumococo (Streptococcus Pneumoniae) es el responsable de enfermedades invasoras, entre las que destacan
VACUNACIÓN FRENTE A LA ENFERMEDAD NEUMOCÓCICA EN MAYORES EN CASTILLA-LA MANCHA JUSTIFICACION El neumococo (Streptococcus Pneumoniae) es el responsable de enfermedades invasoras, entre las que destacan
Vacunación. Infantil
 Vacunación Infantil E N C A S T I L L A - L A M A N C H A Edición Dirección General de Salud Pública y Consumo Consejería de Sanidad Junta de Comunidades de Castilla-La Mancha Actualizado Febrero 2016
Vacunación Infantil E N C A S T I L L A - L A M A N C H A Edición Dirección General de Salud Pública y Consumo Consejería de Sanidad Junta de Comunidades de Castilla-La Mancha Actualizado Febrero 2016
La severidad de la hemofilia depende del nivel plasmático del FVIII (hemofilia A) / FIX (hemofilia B): <1% de factor Entre el 1% al 5% >5% de factor
 La hemofilia es un desorden hemorrágico hereditario y congénito, originado por mutaciones en el cromosoma X y que se caracteriza por la disminución o ausencia de actividad funcional de los factores de
La hemofilia es un desorden hemorrágico hereditario y congénito, originado por mutaciones en el cromosoma X y que se caracteriza por la disminución o ausencia de actividad funcional de los factores de
Vacuna conjugada frente al neumococo. Javier Díez Domingo, III Jornadas sobre Vacunas en Atención primaria
 Vacuna conjugada frente al neumococo Javier Díez Domingo, III Jornadas sobre Vacunas en Atención primaria Edad Tasa de incidencia por 100.000 niños y año < 2 años < 5 años < 15 años 16,8 10,5 4,6 Díez
Vacuna conjugada frente al neumococo Javier Díez Domingo, III Jornadas sobre Vacunas en Atención primaria Edad Tasa de incidencia por 100.000 niños y año < 2 años < 5 años < 15 años 16,8 10,5 4,6 Díez
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Rabipur Polvo y disolvente para solución inyectable Vacuna antirrábica inactivada
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Rabipur Polvo y disolvente para solución inyectable Vacuna antirrábica inactivada Lea todo el prospecto detenidamente antes de que usted o su hijo reciban Rabipur.
PROSPECTO: INFORMACIÓN PARA EL USUARIO Rabipur Polvo y disolvente para solución inyectable Vacuna antirrábica inactivada Lea todo el prospecto detenidamente antes de que usted o su hijo reciban Rabipur.
VARIANTES EN EL DISEÑO DE LOS ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA. Sandra Flores Moreno. AETSA 21 de Diciembre de 2006
 VARIANTES EN EL DISEÑO DE LOS ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA Sandra Flores Moreno. AETSA 21 de Diciembre de 2006 VARIANTES EN EL DISEÑO DE ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA *INTRODUCCIÓN
VARIANTES EN EL DISEÑO DE LOS ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA Sandra Flores Moreno. AETSA 21 de Diciembre de 2006 VARIANTES EN EL DISEÑO DE ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA *INTRODUCCIÓN
INFLUENZA HUMANA A- H1N1
 INFLUENZA HUMANA A- H1N1 INFLUENZA ESTACIONAL QUÉ ES? Infección aguda que resulta de la infección con el virus de influenza. Nos afecta todos los años en otoño e invierno. Existen grupos de personas más
INFLUENZA HUMANA A- H1N1 INFLUENZA ESTACIONAL QUÉ ES? Infección aguda que resulta de la infección con el virus de influenza. Nos afecta todos los años en otoño e invierno. Existen grupos de personas más
AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública
 Fiebre tifoidea AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública Es una infección bacteriana aguda causada por una bacteria que recibe el nombre de Salmonella tiphi. La enfermedad que
Fiebre tifoidea AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública Es una infección bacteriana aguda causada por una bacteria que recibe el nombre de Salmonella tiphi. La enfermedad que
QUÉ ES LA PSORIASIS EN PLACAS?
 QUÉ ES LA PSORIASIS EN PLACAS? La psoriasis en placa es la forma más común de la psoriasis. Puede aparecer en cualquier parte del cuerpo, pero se encuentra más comúnmente en los codos, rodillas, cuero
QUÉ ES LA PSORIASIS EN PLACAS? La psoriasis en placa es la forma más común de la psoriasis. Puede aparecer en cualquier parte del cuerpo, pero se encuentra más comúnmente en los codos, rodillas, cuero
FICHA TÉCNICA. STAMARIL, polvo y disolvente para suspensión inyectable en jeringa precargada.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO STAMARIL, polvo y disolvente para suspensión inyectable en jeringa precargada. Vacuna (viva) frente a la fiebre amarilla. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO STAMARIL, polvo y disolvente para suspensión inyectable en jeringa precargada. Vacuna (viva) frente a la fiebre amarilla. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
PÍLDORA DEL DÍA DESPUÉS
 Programa Nacional de Salud Sexual y Procreación Responsable PÍLDORA DEL DÍA DESPUÉS Anticoncepción Hormonal de Emergencia AHE Guía de Usuarias MÉTODOS ANTICONCEPTIVOS La salud sexual y reproductiva es
Programa Nacional de Salud Sexual y Procreación Responsable PÍLDORA DEL DÍA DESPUÉS Anticoncepción Hormonal de Emergencia AHE Guía de Usuarias MÉTODOS ANTICONCEPTIVOS La salud sexual y reproductiva es
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
Administración de fármacos por vía subcutánea en cuidados paliativos
 Administración de fármacos por vía subcutánea en cuidados paliativos Dña. Mª Trinidad Llopis Llorens D. Francisco Enrique Moltó Abad Enfermer@s UHD. Hospital Virgen de los Lirios. Alcoi 1 Origenes. 1817-1884
Administración de fármacos por vía subcutánea en cuidados paliativos Dña. Mª Trinidad Llopis Llorens D. Francisco Enrique Moltó Abad Enfermer@s UHD. Hospital Virgen de los Lirios. Alcoi 1 Origenes. 1817-1884
Buenas Prácticas en Cadena de Frío
 Comisión Honoraria para la Lucha Antituberculosa y Enfermedades Prevalentes Laboratorio Albert Calmette Dra. Beatriz Lemes QF. Marina Monteiro Son todas aquellas actividades necesarias para garantizar
Comisión Honoraria para la Lucha Antituberculosa y Enfermedades Prevalentes Laboratorio Albert Calmette Dra. Beatriz Lemes QF. Marina Monteiro Son todas aquellas actividades necesarias para garantizar
POSITON CREMA POSITON UNGÜENTO
 POSITON CREMA POSITON UNGÜENTO POSITON CREMA COMPOSICION Cada 100 gramos contienen: Acetónido de Triamcinolona Neomicina (sulfato) Nistatina 100 mg 250 mg 10.000.000 U.I Excipientes: Estearato de polioxila
POSITON CREMA POSITON UNGÜENTO POSITON CREMA COMPOSICION Cada 100 gramos contienen: Acetónido de Triamcinolona Neomicina (sulfato) Nistatina 100 mg 250 mg 10.000.000 U.I Excipientes: Estearato de polioxila
