GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE
|
|
|
- María Soledad Saavedra del Río
- hace 8 años
- Vistas:
Transcripción
1 FOLLETO DE INFORMACIÓN AL PROFESIONAL GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE 1. INDICACIONES Y USO 1.1 Niñas y Mujeres GARDASIL 9 es una vacuna indicada en niñas y mujeres de 9 a 26 años de edad para la prevención de las siguientes enfermedades: Cáncer cervical, vulvar, vaginal y anal causado por el Virus del Papiloma Humano (VPH) tipos 16, 18, 31, 33, 45, 52 y 58. Verrugas genitales (condiloma acuminado) causadas por VPH tipos 6 y 11 Y las siguientes lesiones precancerosas o displásicas causadas por VPH tipos 6, 11, 16, 18, 31, 33, 45, 52 y 58: Neoplasia intraepitelial cervical (NIC) de grado 2/3 y adenocarcinoma cervical in situ (AIS) Neoplasia intraepitelial cervical (NIC) de grado 1 Neoplasia intraepitelial vulvar (NIV) de grado 2 y 3 Neoplasia intraepitelial vaginal (NIVa) de grado 2 y 3 Neoplasia intraepitelial anal (NIA) de grado 1, 2 y Niños GARDASIL 9 está indicada en niños de 9 a 15 años de edad para la prevención de las siguientes enfermedades: Cáncer anal causado por VPH tipos 16, 18, 31, 33, 45, 52 y 58 Verrugas genitales (condiloma acuminado) causadas por VPH tipos 6 y 11 Y las siguientes lesiones precancerosas o displásicas causadas por VPH tipos 6, 11, 16, 18, 31, 33, 45, 52 y 58: Neoplasia intraepitelial anal (NIA) de grado 1, 2 y DOSIS Y ADMINISTRACIÓN 2.1 General Dosis Se debe administrar GARDASIL 9 de forma intramuscular en 3 dosis separadas de 0,5 ml de acuerdo con el siguiente esquema: Primera dosis: en la fecha elegida Segunda dosis: 2 meses después de la primera dosis Tercera dosis: 6 meses después de la primera dosis
2 Se alienta a que las personas sigan el esquema de vacunación de 0, 2 y 6 meses. No obstante, en estudios clínicos, se ha demostrado la eficacia en individuos que han recibido las 3 dosis dentro del término de 1 año. Si fuera necesario un esquema alternativo de vacunación, la segunda dosis se debe administrar al menos 1 mes después de la primera dosis y la tercera dosis se debe administrar al menos 3 meses después de la segunda dosis. Método de administración GARDASIL 9 se debe administrar de forma intramuscular en la región deltoidea del brazo o en la zona antero lateral superior del muslo. No se debe inyectar GARDASIL 9 de forma intravascular. No se han realizado estudios sobre la administración subcutánea ni intradérmica. No se recomiendan dichos métodos de administración. 2.2 Administración de GARDASIL 9 en personas que ya han sido vacunadas con GARDASIL previamente. Datos de seguridad e inmunogenicidad de GARDASIL 9 fueron evaluados en individuos que previamente completaron una serie de vacunación de tres dosis con GARDASIL. No se han realizado estudios utilizando un régimen mixto (intercambiabilidad) de vacunas contra el VPH para GARDASIL INSTRUCCIONES DE USO La vacuna debe utilizarse como se provee; no es necesario diluirla ni reconstituirla. Se debe utilizar la dosis total recomendada de la vacuna. Agitar bien antes de usar. Es necesario agitar bien inmediatamente antes de administrarla para mantener la suspensión de la vacuna. Después de agitar bien, GARDASIL 9 es un líquido blanco opaco. Antes de la administración, se deben inspeccionar visualmente los productos farmacológicos parenterales para verificar que no haya partículas ni decoloración. Desechar el producto si se observan partículas o si parece descolorido. Uso de vial de dosis única En el caso de viales de dosis única, se deberá utilizar una jeringa y una aguja estériles separadas para cada individuo. Extraer la dosis de 0,5 ml de vacuna del vial de dosis única por medio de una jeringa y una aguja estériles sin conservantes, antisépticos ni detergentes. Una vez que el vial de dosis única haya sido penetrado, la vacuna extraída debe utilizarse de inmediato y se debe desechar el vial. Uso de jeringa pre-llenada
3 La jeringa pre-llenada es para uso único y no debe utilizarse para más de una persona. Inyectar todo el contenido de la jeringa. 4. CONTRAINDICACIONES GARDASIL 9 está contraindicada en pacientes con hipersensibilidad, incluyendo reacciones alérgicas severas a componentes de GARDASIL 9 o GARDASIL Los individuos que desarrollan síntomas indicadores de hipersensibilidad luego de recibir una dosis de GARDASIL 9 o GARDASIL no deben recibir más dosis de GARDASIL ADVERTENCIAS Y PRECAUCIONES Como sucede con todas las vacunas, la vacunación con GARDASIL 9 puede no proteger a todas las personas vacunadas. Esta vacuna no debe ser usada en el tratamiento de lesiones genitales externas activas, cáncer cervical, vulvar, vaginal o anal o bien NIC, NIV, NIVa o NIA. Esta vacuna no protege contra enfermedades que no sean causadas por el VPH. Como ocurre con todas las vacunas inyectables, debe haber a disposición un tratamiento médico adecuado en caso de reacciones anafilácticas poco frecuentes luego de la administración de la vacuna. Luego de cualquier vacunación, puede haber síncopes (desmayos), especialmente en adolescentes y jóvenes. Ha habido casos de síncopes, a veces asociados con caídas, luego de la vacunación contra el VPH. Por lo tanto, se debe observar cuidadosamente a las personas vacunadas durante aproximadamente 15 minutos luego de la administración de GARDASIL 9. La decisión de administrar o retrasar la vacunación debido a una enfermedad febril reciente o actual depende, en gran medida, de la gravedad de los síntomas y su etiología. La fiebre baja en sí misma y las infecciones leves de las vías respiratorias superiores normalmente no son contraindicaciones para la vacunación. Los individuos con respuesta inmunológica deteriorada, ya sea por el uso de terapia inmunosupresora, defecto genético, infección por virus de inmunodeficiencia humana (VIH) u otras causas, pueden tener una respuesta reducida de los anticuerpos a la inmunización activa. [Ver 6 INTERACCIONES FARMACOLÓGICAS Y OTRAS FORMAS DE INTERACCIONES, 6.3 Uso con esteroides y 7 USO EN POBLACIONES ESPECÍFICAS, 7.5 Individuos inmunocomprometidos.]
4 Esta vacuna debe administrarse con precaución en individuos con trombocitopenia o trastorno de la coagulación ya que puede haber hemorragia luego de la administración intramuscular en dichos individuos. 6. INTERACCIONES FARMACOLÓGICAS Y OTRAS FORMAS DE INTERACCIONES 6.1 Uso con otras vacunas Los resultados de los estudios clínicos indican que GARDASIL 9 puede administrarse de forma concomitante (en lugares de inyección separados) con Menactra [vacuna antimeningocócica de polisacárido conjugado con toxoide diftérico (Grupos A, C, Y y W-135)], Adacel [vacuna de toxoide tetánico y diftérico adsorbidos y tos ferina acelular (Tdap)] y Repevax [vacuna contra difteria, tétano, tos ferina (componente, acelular) y poliomielitis (inactivada), contenido antígeno reducido adsorbido] (dtap-ipv). 6.2 Uso con anticonceptivos hormonales En mujeres (de 16 a 26 años), el 60,2 utilizó anticonceptivos hormonales durante el período de vacunación de los estudios clínicos. El uso de anticonceptivos hormonales no pareció afectar el tipo de respuestas inmunes específicas para GARDASIL Uso con esteroides Las terapias inmunosupresoras, incluso la irradiación, los antimetabolíticos, los agentes alquilantes, los fármacos citotóxicos y los corticoides (usados en dosis superiores a las dosis fisiológicas) pueden reducir las respuestas inmunológicas a las vacunas. [Ver 7 USO EN POBLACIONES ESPECÍFICAS, 7.5 Individuos inmunocomprometidos.] 7. USO EN POBLACIONES ESPECÍFICAS 7.1 Embarazo Estudios en ratas hembras Se realizaron estudios reproductivos en ratas hembras en una dosis alrededor de 240 veces superior a la dosis humana (base mg/kg) y no revelaron evidencia de fertilidad femenina deteriorada ni daño al feto debido a GARDASIL 9. En estudios con ratas, se llevó a cabo una evaluación de los efectos de GARDASIL 9 en el desarrollo embrio-fetal antes y después del destete. No se observaron efectos adversos en el apareamiento, la fertilidad, la gestación, el parto, la lactancia y el desarrollo embrio-fetal antes y después del destete. No se observaron malformaciones u otras evidencias de teratogenia relacionados con la vacuna. Además, no hubo efectos relacionados con el tratamiento en los signos de desarrollo, el comportamiento, el desempeño reproductivo ni la fertilidad de la cría. GARDASIL 9 indujo una respuesta de anticuerpos específicos contra los tipos de VPH 6, 11, 16, 18, 31, 33, 45, 52 y 58 en
5 ratas preñadas luego de inyecciones intramusculares múltiples o únicas. Se transfirieron anticuerpos contra los 9 tipos de VPH a la cría durante la gestación y posiblemente durante la lactancia. Estudios clínicos en humanos No existen estudios suficientes ni bien controlados en mujeres embarazadas. Debido a que los estudios sobre reproducción animal no siempre permiten predecir la respuesta humana, se debe evitar el embarazo durante el régimen de vacunación con GARDASIL 9. En estudios clínicos, se sometió a las mujeres a pruebas de embarazo en sangre u orina antes de la administración de GARDASIL 9. Las mujeres que estaban embarazadas antes de finalizar el régimen de 3 dosis de GARDASIL 9 recibieron instrucciones de postergar su régimen de vacunación hasta la finalización del embarazo. La proporción total de embarazos que ocurrieron en cualquier momento durante los estudios y que presentaron un resultado adverso definido como la cantidad combinada de abortos espontáneos, muerte fetal tardía y casos de anomalía congénita, de la cantidad total de embarazos de los que se conoció el resultado (sin incluir la interrupción voluntaria) fue del 14,1 (145/1.028) en mujeres que recibieron GARDASIL 9 y 17,0 (168/991) en mujeres que recibieron GARDASIL. Las proporciones de los resultados adversos observados fueron consistentes con los resultados de los embarazos observados en la población general. Se llevaron a cabo más sub-análisis para evaluar los embarazos con inicio estimado dentro de los 30 días o más de 30 días desde la administración de una dosis de GARDASIL 9 o GARDASIL. En el caso de embarazos con inicio estimado dentro de los 30 días de la vacunación, no se observaron casos de anomalías congénitas en mujeres que habían recibido GARDASIL 9 o GARDASIL. En el caso de embarazos con inicio estimado luego de más de 30 días de la vacunación, se observaron 20 y 21 casos de anomalías congénitas en mujeres que habían recibido GARDASIL 9 y GARDASIL, respectivamente. Los tipos de anomalías observados fueron consistentes con los que se observan en los embarazos de la población general (al margen de cuándo ocurrió el embarazo en relación con la vacunación). Por ende, no hay evidencia que indique que la administración de GARDASIL 9 afecte adversamente los resultados relativos a la fertilidad, al embarazo o a los infantes. 7.2 Lactancia GARDASIL 9 puede ser administrado a mujeres lactantes. No se sabe si los anticuerpos o los antígenos de la vacuna inducidos por la vacuna son excretados en la leche materna. Durante el período de vacunación de los estudios clínicos de GARDASIL 9, un total de 86 mujeres estaban amamantando. En dichos estudios, la inmunogenicidad de la vacuna fue comparable entre las mujeres lactantes y las mujeres no lactantes. Además, el perfil de experiencias adversas para las mujeres lactantes fue comparable al de las mujeres en la población de seguridad general. No se
6 informaron experiencias adversas graves en infantes que tomaban leche materna durante el período de vacunación. 7.3 Uso pediátrico No se evaluó la seguridad y la eficacia de GARDASIL 9 en niños menores de 9 años. 7.4 Uso geriátrico No se evaluó la seguridad y la eficacia de GARDASIL 9 en individuos de 65 años o más. 7.5 Individuos inmunocomprometidos La respuesta inmunológica a GARDASIL 9 puede verse disminuida en los individuos inmunocomprometidos [ver 6 INTERACCIONES FARMACOLÓGICAS Y OTRAS FORMAS DE INTERACCIONES, 6.3 Uso con esteroides]. 8. REACCIONES ADVERSAS 8.1 Experiencia en ensayos clínicos Experiencia en ensayos clínicos con GARDASIL 9 y GARDASIL Se evaluó la seguridad de GARDASIL 9 en 6 estudios clínicos (Protocolos 001, 002, 005, 006, 007, 009) que incluyeron individuos que recibieron al menos una dosis de GARDASIL 9 y fueron sometidos a un seguimiento de seguridad. El Protocolo 001 y el Protocolo 009 incluyeron individuos que recibieron al menos una dosis de GARDASIL y fueron sometidos a un seguimiento de seguridad. Las vacunas se administraron el día de la inscripción, y las dosis subsiguientes se administraron aproximadamente 2 y 6 meses después. Se evaluó la seguridad por medio de vigilancia en base a la tarjeta de informe de vacunación (VRC, vaccination report card) durante 14 días luego de cada inyección de GARDASIL 9 o GARDASIL. Los individuos que fueron monitoreados por medio de la VRC incluyeron mujeres de 16 a 26 años y mujeres y varones de 9 a 15 años (3.481 mujeres y varones) en la inscripción y recibieron GARDASIL 9, y mujeres de 16 a 26 años y 300 mujeres de 9 a 15 años en la inscripción y recibieron GARDASIL. Reacciones adversas sistémicas y en el lugar de la inyección en ensayos clínicos de GARDASIL 9. Las experiencias adversas relacionadas con la vacuna que se observaron entre los vacunados con GARDASIL 9 o GARDASIL a una frecuencia de al menos 1 se muestran en las Tablas 1 y 2. Pocos individuos interrumpieron el uso (GARDASIL 9 = 0,1 y GARDASIL <0,1 ) debido a experiencias adversas luego de recibir alguna de las dos vacunas. El perfil de seguridad fue similar entre GARDASIL 9 y GARDASIL en mujeres y varones.
7 Tabla 1: Reacciones adversas sistémicas y en el lugar de la inyección informadas a una frecuencia de 1 en individuos que recibieron GARDASIL 9 en todos los estudios clínicos* Mujeres Reacción Adversa 16 a 26 años GARDASIL 9 (N=8027) Reacciones adversas en el lugar de la inyección (1 a 5 días posteriores a la vacunación) Dolor 89,6 78,8 Inflamación 40,2 33,8 Eritema 34,3 28,0 Prurito 5,6 2,6 Equimosis 1,7 0,0 Hematomas 1,3 2,0 Masa 1,2 0,2 Hemorragia 0,9 1,0 Endurecimiento 0,7 1,1 Reacciones adversas sistémicas (1 a 15 días posteriores a la vacunación) Dolor de cabeza 14,7 12,7 Pirexia 5,1 8,9 Náuseas 4,2 2,2 Mareos 2,9 1,6 Fatiga 2,3 1,3 Diarrea 1,2 0,5 Dolor orofaríngeo 1,0 0,8 Dolor abdominal superior 0,7 1,3 *Datos de los Protocolos 001,002, 005, 006, 007, 009 Designa una reacción adversa solicitada N=cantidad de sujetos vacunados Mujeres y varones 9 a 15 años GARDASIL 9 (N=5280) Tabla 2: Reacciones adversas sistémicas y en el lugar de la inyección informadas a una frecuencia de 1 para GARDASIL 9 en comparación con GARDASIL en dos estudios clínicos* Reacción Adversa Mujeres 16 a 26 años Niñas 9 a 15 años GARDASIL 9 (N=7071) GARDASIL (N=7078) GARDASIL 9 (N=299) GARDASIL (N=300) Reacciones adversas en el lugar de la inyección (1 a 5 días posteriores a la vacunación) Dolor 89,9 83,5 89,3 88,3 Inflamación 40,0 28,8 47,8 36,0 Eritema 34,0 25,6 34,1 29,3 Prurito 5,5 4,0 4,0 2,7 Equimosis 1,9 1,9 Masa 1,3 0,6 Hemorragia 1,0 0,7 1,0 2,0 Hematomas 0,9 0,6 3,7 4,7 Calor 0,8 0,5 0,7 1,7 Endurecimiento 0,8 0,2 2,0 1,0 Reacción 0,6 0,6 0,3 1,0 Reacciones adversas sistémicas (1 a 15 días posteriores a la vacunación) Dolor de cabeza 14,6 13,7 11,4 11,3 Pirexia 5,0 4,3 5,0 2,7 Náuseas 4,4 3,7 3,0 3,7 Mareos 3,0 2,8 0,7 0,7 Fatiga 2,3 2,1 0,0 2,7 Diarrea 1,2 1,0 0,3 0,0
8 Mialgia 1,0 0,7 0,7 0,7 Dolor orofaríngeo 1,0 0,6 2,7 0,7 Dolor abdominal superior 0,7 0,8 1,7 1,3 Infección del tracto respiratorio superior 0,1 0,1 0,3 1,0 *Los datos de las mujeres son del Protocolo 001 y los datos de las niñas son del Protocolo 009. Designa una reacción adversa solicitada No se informa equimosis ni masa en el lugar de la inyección en el caso de las niñas. N=cantidad de sujetos vacunados Reacciones adversas sistémicas y en el lugar de la inyección en ensayos clínicos con GARDASIL 9 La temperatura, el eritema, la inflamación y el dolor en el lugar de la inyección se solicitaron en la vigilancia con la tarjeta VRC por 5 días luego de cada inyección de GARDASIL 9 durante los estudios clínicos. La incidencia y la gravedad de las reacciones adversas solicitadas que ocurrieron 5 días luego de cada dosis de GARDASIL 9 se muestran en la Tabla 3. Tabla 3: Evaluación post-dosis de las reacciones adversas sistémicas solicitadas y en el lugar de la inyección según incidencia y gravedad en todos los estudios clínicos* (1 a 5 días posteriores a la vacunación) Reacción adversa sistémica solicitada Temperatura Reacción adversa solicitada en el lugar de la inyección Gravedad Dosis 1 N= Dosis 2 N= Dosis 3 N= Cualquier dosis N= < 37,8 C (100,0 F) 96,9 97,3 96,7 92,0 37,8 C (100,0 F) < 38,9 C (102,0 F) 2,7 2,3 2,7 6,6 38,9 C (102,0 F) < 39,9 C (103,8 F) 0,4 0,3 0,5 1,2 39,9 C (103,8 F) < 40,9 C (105,6 F) 0,1 0,1 0,1 0,2 40,9 C (105,6 F) 0,0 0,0 0,0 0,0 Gravedad Dosis 1 N= Dosis 2 N= Dosis 3 N= Cualquier dosis N= Leve 53,5 47,6 45,3 51,1 Dolor Moderada 11,5 16,3 17,8 30,3 Severa 0,7 1,6 2,3 3,9 Leve 9,6 15,3 18,5 25,4 Inflamación Moderada 1,8 3,9 4,9 7,8 Severa 0,8 1,7 2,7 4,3 Leve 8,6 14,0 16,6 25,3 Eritema Moderado 0,9 2,0 2,7 4,6 Severo 0,2 0,5 1,2 1,7 *Datos de los Protocolos 001, 002, 005, 006, 007, 009 La intensidad de la inflamación y del eritema se midió según el tamaño (pulgadas): Leve = 0 a 1; Moderado = >1 a 2; Severo = >2. N=Cantidad de individuos con seguimiento Experiencia en ensayos clínicos con GARDASIL 9 en individuos que ya habían sido vacunados con GARDASIL previamente
9 Un estudio clínico (Protocolo 006) evaluó la seguridad de GARDASIL 9 en mujeres de 12 a 26 años que habían sido vacunadas previamente con 3 dosis de GARDASIL. El intervalo entre la última inyección de GARDASIL y la primera inyección de GARDASIL 9 osciló entre los 12 y los 36 meses aproximadamente. A los individuos se les administró GARDASIL 9 o un placebo salino, y se evaluó la seguridad con vigilancia en base a la tarjeta VRC durante 14 días luego de cada inyección de GARDASIL 9 o del placebo salino aplicada a dichos individuos. Los individuos que se monitorearon incluyeron 608 sujetos que recibieron GARDASIL 9 y 305 sujetos que recibieron placebo salino. Pocos individuos (0,5 ) que recibieron GARDASIL 9 interrumpieron la administración debido a reacciones adversas. Las experiencias adversas relacionadas con la vacuna que se observaron entre las personas vacunadas con GARDASIL 9 a una frecuencia de al menos 1,0 y también a una frecuencia mayor que la observada entre las personas vacunadas con placebo salino se muestran en la Tabla 4. En general, el perfil de seguridad fue similar entre los individuos vacunados con GARDASIL 9 que antes habían sido vacunados con GARDASIL y que nunca habían recibido vacunación contra el VPH. Tabla 4: Reacciones adversas sistémicas relacionadas con la vacuna y en el lugar de la inyección informadas a una frecuencia 1 y mayor que la del placebo salino para GARDASIL 9 en mujeres de 12 a 26 años que habían sido previamente vacunadas con GARDASIL* Reacción Adversa GARDASIL 9 (N=608) PLACEBO SALINO (N=305) Reacciones adversas en el lugar de la inyección (1 a 5 días posteriores a la vacunación) Dolor 90,3 38,0 Inflamación 49,0 5,9 Eritema 42,3 8,5 Prurito 7,7 1,3 Hematomas 4,8 2,3 Reacción 1,3 0,3 Masa 1,2 0,7 Reacciones adversas sistémicas (1 a 15 días posteriores a la vacunación) Dolor de cabeza 19,6 18,0 Pirexia 5,1 1,6 Náuseas 3,9 2,0 Mareos 3,0 1,6 Dolor abdominal superior 1,5 0,7 Gripe 1,2 1,0 *Los datos sobre GARDASIL 9 y placebo son del Protocolo 006. Designa una reacción adversa solicitada N=cantidad de sujetos vacunados Experiencia en ensayos clínicos de administración concomitante de GARDASIL 9 con otras vacunas En estudios clínicos, se evaluó la seguridad de GARDASIL 9 cuando se administra de forma concomitante con otras vacunas. Se informó un aumento de la inflamación en el lugar de la inyección en el caso de GARDASIL 9 cuando esta se administró de forma concomitante con la vacuna contra la difteria, el tétano, la tos ferina (acelular) y la poliomielitis (inactivada) (adsorbida, contenido reducido de antígenos) (dtap- IPV) o con la vacuna con toxoide tetánico, toxoide diftérico reducido y tos ferina acelular, vacuna
10 meningocócica de polisacárido conjugado con toxoide diftérico adsorbida (dtap) (Grupos A, C, Y y W-135) en comparación con la vacunación no concomitante. Se informó que la mayor parte de las inflamaciones observadas en el lugar de la inyección con administración concomitante con otras vacunas fue de intensidad leve a moderada. 8.2 Experiencia posterior a la comercialización Se informaron espontáneamente las siguientes experiencias adversas durante el uso posterior a la aprobación de GARDASIL y también pueden verse en la experiencia posterior a la comercialización de GARDASIL 9. La experiencia de seguridad posterior a la comercialización de GARDASIL es relevante para GARDASIL 9 ya que las vacunas tienen una composición similar y ambas contienen proteínas L1 del VPH de 4 de los mismos tipos del VPH. Debido a que estas experiencias la informa voluntariamente una población de tamaño incierto, no es posible estimar con certeza su frecuencia o establecer una relación causal con la exposición a la vacuna. Infecciones e infestaciones: celulitis Trastornos sanguíneos y del sistema linfático: púrpura trombocitopénica inmunológica, linfoadenopatía. Trastornos del sistema nervioso: encefalomielitis aguda diseminada, mareos, síndrome de Guillain- Barré, dolor de cabeza, síncope a veces acompañado de movimientos tónicos clónicos. Trastornos gastrointestinales: náuseas, vómitos. Trastornos musculoesqueléticos y del tejido conjuntivo: artralgia, mialgia. Trastornos generales y condiciones del lugar de la administración: astenia, escalofríos, fatiga, malestar. Trastornos del sistema inmunológico: reacciones por hipersensibilidad, incluso reacciones anafilácticas/anafilactoides, broncoespasmo y urticaria. 9. SOBREDOSIS No ha habido reportes de administración de dosis de GARDASIL 9 más altas que las recomendadas. 10. FORMA FARMACÉUTICA GARDASIL 9 es una suspensión para administración intramuscular disponible en viales y jeringas pre-llenadas de dosis única de 0,5 ml. 11. DETALLES FARMACÉUTICOS 11.1 Composición
11 Principio activo GARDASIL 9 es una preparación estéril de administración intramuscular. Cada dosis de 0,5 ml contiene proteína L1 de VPH 6, proteína L1 de VPH 11, proteína L1 de VPH 16, proteína L1 de VPH 18, proteína L1 de VPH 31, proteína L1 de VPH 33, proteína L1 de VPH 45, proteína L1 de VPH 52 y proteína L1 de VPH 58. Ingredientes inactivos (lista de excipientes) Incluir listado cualitativo de excipientes según la fórmula aprobada en el registro sanitario. Antes de agitarse, GARDASIL 9 puede parecer un líquido transparente con un precipitado blanco. Después de agitarla bien, GARDASIL 9 es un líquido blanco opaco Almacenamiento Precauciones especiales de almacenamiento Indicar condiciones de almacenamiento según lo autorizado en el registro sanitario. Desechar el producto si está congelado, se observan partículas o parece descolorido. S-CCDS-V503-I
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO. 25 μg
 agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
FICHA TÉCNICA. Solución estéril inyectable por vía intramuscular (preferiblemente) o subcutánea. Pneumo 23 es un líquido transparente e incoloro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
-Usar el preservativo, que evita el contagio de otras enfermedades de transmisión sexual.
 Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
GARDASIL [Vacuna cuadrivalente contra el virus del papiloma humano (tipos 6, 11, 16 y 18), recombinante] SP9883616
![GARDASIL [Vacuna cuadrivalente contra el virus del papiloma humano (tipos 6, 11, 16 y 18), recombinante] SP9883616 GARDASIL [Vacuna cuadrivalente contra el virus del papiloma humano (tipos 6, 11, 16 y 18), recombinante] SP9883616](/thumbs/34/13114587.jpg) USPPI Información para el paciente sobre GARDASIL Nombre genérico: [vacuna cuadrivalente contra el virus del papiloma humano (tipos 6, 11, 16 y 18), recombinante] Lea esta información con atención antes
USPPI Información para el paciente sobre GARDASIL Nombre genérico: [vacuna cuadrivalente contra el virus del papiloma humano (tipos 6, 11, 16 y 18), recombinante] Lea esta información con atención antes
FICHA TECNICA. ACT-HIB Vacuna de polisacárido de Haemophilus influenzae tipo b conjugado a proteína del tétanos
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO. ACT-HIB Vacuna de polisacárido de Haemophilus influenzae tipo b conjugado a proteína del tétanos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA. Liofilizado (para una
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO. ACT-HIB Vacuna de polisacárido de Haemophilus influenzae tipo b conjugado a proteína del tétanos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA. Liofilizado (para una
FICHA TÉCNICA. Las personas con infección sintomática o asintomática por VIH, deben ser vacunadas lo antes posible, una vez confirmado el diagnóstico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
PROSPECTO: INFORMACIÓN PARA EL USUARIO. PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos
 PROSPECTO: INFORMACIÓN PARA EL USUARIO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos Lea todo el prospecto detenidamente antes de que usted o su hijo sean
PROSPECTO: INFORMACIÓN PARA EL USUARIO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos Lea todo el prospecto detenidamente antes de que usted o su hijo sean
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. TRIAXIS, suspensión inyectable.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TRIAXIS, suspensión inyectable. Vacuna de difteria, tétanos, tos ferina (componente acelular) (adsorbida, contenido de antígenos reducido). 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TRIAXIS, suspensión inyectable. Vacuna de difteria, tétanos, tos ferina (componente acelular) (adsorbida, contenido de antígenos reducido). 2. COMPOSICIÓN CUALITATIVA
PI-GRD-I-082008-COLOMBIA GARDASIL
 1. NOMBRE DEL PRODUCTO Y DENOMINACIÓN COMÚN INTERNACIONAL DEL PRINCIPIO ACTIVO GARDASIL * [Vacuna Recombinante Tetravalente contra el Virus de Papiloma Humano (Tipos 6, 11, 16, 18)] 2. FORMA FARMACEUTICA
1. NOMBRE DEL PRODUCTO Y DENOMINACIÓN COMÚN INTERNACIONAL DEL PRINCIPIO ACTIVO GARDASIL * [Vacuna Recombinante Tetravalente contra el Virus de Papiloma Humano (Tipos 6, 11, 16, 18)] 2. FORMA FARMACEUTICA
GUÍA DE PRÁCTICA CLÍNICA. Vacunas contra HPV. Dra. Laura Fleider
 Dra. Laura Fleider Año 2011 - Revisión: 0 Página 1 de 6 Introducción Entre las afecciones atribuidas al virus del papiloma humano (HPV) que pueden prevenirse por medio de la vacunación se destacan: cáncer
Dra. Laura Fleider Año 2011 - Revisión: 0 Página 1 de 6 Introducción Entre las afecciones atribuidas al virus del papiloma humano (HPV) que pueden prevenirse por medio de la vacunación se destacan: cáncer
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA INGREDIENTES ACTIVOS Cada dosis de 0,5 ml de vacuna reconstituida contiene:
 1. NOMBRE DEL MEDICAMENTO PENTAVAC Vacuna de difteria, tétanos, tosferina acelular y poliomielitis inactivada, adsorbida y Vacuna de Haemophilus influenzae tipo b conjugada. 2. COMPOSICIÓN CUALITATIVA
1. NOMBRE DEL MEDICAMENTO PENTAVAC Vacuna de difteria, tétanos, tosferina acelular y poliomielitis inactivada, adsorbida y Vacuna de Haemophilus influenzae tipo b conjugada. 2. COMPOSICIÓN CUALITATIVA
VARICELA INTRODUCCIÓN INDICACIONES
 VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
FICHA TÉCNICA. * cultivados en huevos de gallina embrionados procedentes de pollos sanos ** hemaglutinina
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MUTAGRIP, suspensión inyectable en jeringa precargada. Vacuna antigripal (virus fraccionados, inactivados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MUTAGRIP, suspensión inyectable en jeringa precargada. Vacuna antigripal (virus fraccionados, inactivados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la
ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO
 ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO 1.1. Plan de gestión de riesgos para la prevención del embarazo 1.1.1. Plan de gestión de riesgos para la prevención del embarazo con
ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO 1.1. Plan de gestión de riesgos para la prevención del embarazo 1.1.1. Plan de gestión de riesgos para la prevención del embarazo con
PANENZA suspensión inyectable en vial multidosis Vacuna antigripal pandémica (H1N1) (virus fraccionado inactivado)
 1. NOMBRE DEL MEDICAMENTO PANENZA suspensión inyectable en vial multidosis Vacuna antigripal pandémica (H1N1) (virus fraccionado inactivado) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe*
1. NOMBRE DEL MEDICAMENTO PANENZA suspensión inyectable en vial multidosis Vacuna antigripal pandémica (H1N1) (virus fraccionado inactivado) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe*
EVALUACIÓN CRÍTICA BASADA EN LA EVIDENCIA Sandra Convers-Páez EPIDEMIOLOGÍA CLÍNICA II
 EVALUACIÓN CRÍTICA BASADA EN LA EVIDENCIA Sandra Convers-Páez EPIDEMIOLOGÍA CLÍNICA II MBE Cáncer de cuello uterino y VPH CA de cérvix: Segundo tipo de CA en las mujeres. Principal causa de muerte por
EVALUACIÓN CRÍTICA BASADA EN LA EVIDENCIA Sandra Convers-Páez EPIDEMIOLOGÍA CLÍNICA II MBE Cáncer de cuello uterino y VPH CA de cérvix: Segundo tipo de CA en las mujeres. Principal causa de muerte por
POLIOMIELITIS INTRODUCCIÓN INDICACIONES
 POLIOMIELITIS 3 INTRODUCCIÓN Es una enfermedad vírica aguda, a menudo identificada por la parálisis flácida aguda, pero con una amplia diversidad de presentaciones clínicas. El agente infeccioso es el
POLIOMIELITIS 3 INTRODUCCIÓN Es una enfermedad vírica aguda, a menudo identificada por la parálisis flácida aguda, pero con una amplia diversidad de presentaciones clínicas. El agente infeccioso es el
Vacunaciones en grupos de riesgo
 Actividades: 1. Niño con inmunodeficiencia. 2. Niño con diatesis hemorrágica. 3. Niño prematuro. 4. Niño con infección VIH. 5. Niño viajero. 6. Niño con otras condiciones, enfermedades o riesgos. Actividad
Actividades: 1. Niño con inmunodeficiencia. 2. Niño con diatesis hemorrágica. 3. Niño prematuro. 4. Niño con infección VIH. 5. Niño viajero. 6. Niño con otras condiciones, enfermedades o riesgos. Actividad
INFORMACIÓN ADICIONAL
 DE: DIRECCIÓN GENERAL DE SALUD PÚBLICA 01/12/2015 VACUNACIÓN FRENTE A TOS FERINA EN EL TERCER TRIMESTRE ASUNTO: DEL EMBARAZO INFORMACIÓN ADICIONAL Referencia: mmd VACUNA A EMPLEAR Hasta nueva indicación
DE: DIRECCIÓN GENERAL DE SALUD PÚBLICA 01/12/2015 VACUNACIÓN FRENTE A TOS FERINA EN EL TERCER TRIMESTRE ASUNTO: DEL EMBARAZO INFORMACIÓN ADICIONAL Referencia: mmd VACUNA A EMPLEAR Hasta nueva indicación
Vacunas Varicela- Herpes Zoster. Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC
 Vacunas Varicela- Herpes Zoster Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC 1 Vacunas de la varicela 2 3 Posibles complicaciones de la varicela: Sobreinfecciones bacterianas
Vacunas Varicela- Herpes Zoster Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC 1 Vacunas de la varicela 2 3 Posibles complicaciones de la varicela: Sobreinfecciones bacterianas
en tratamiento con Toctino ... Nombre de la paciente (alitretinoína) Para el médico Soluciones pensando en ti
 (alitretinoína) Tarjeta Restaura de seguimiento desde el interiorde la Paciente en con Toctino... Nombre de la paciente Para el médico Soluciones pensando en ti www.almirall.es www.solucionesalmirall.com
(alitretinoína) Tarjeta Restaura de seguimiento desde el interiorde la Paciente en con Toctino... Nombre de la paciente Para el médico Soluciones pensando en ti www.almirall.es www.solucionesalmirall.com
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela
 Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
INFORMACIÓN PARA LA PACIENTE CONIZACIÓN CERVICAL
 INFORMACIÓN PARA LA PACIENTE CONIZACIÓN CERVICAL 1 Vas a ser sometida a una CONIZACIÓN CERVICAL. Se trata de un procedimiento quirúrgico para extirpar una parte del cuello del útero. PROCEDIMIENTO El término
INFORMACIÓN PARA LA PACIENTE CONIZACIÓN CERVICAL 1 Vas a ser sometida a una CONIZACIÓN CERVICAL. Se trata de un procedimiento quirúrgico para extirpar una parte del cuello del útero. PROCEDIMIENTO El término
Esquema nacional de vacunación 2015
 Esquema nacional de vacunación 2015 Definiciones en el PAI Susceptible Cualquier persona o animal que supuestamente no posee suficiente resistencia contra un agente patógeno determinado, que le proteja
Esquema nacional de vacunación 2015 Definiciones en el PAI Susceptible Cualquier persona o animal que supuestamente no posee suficiente resistencia contra un agente patógeno determinado, que le proteja
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. Denominación del medicamento ESTRUMATE 2. Composición cualitativa y cuantitativa Cloprostenol (sódico)...0,0250 g (principio activo)* Ácido cítrico anhidro...0,056
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. Denominación del medicamento ESTRUMATE 2. Composición cualitativa y cuantitativa Cloprostenol (sódico)...0,0250 g (principio activo)* Ácido cítrico anhidro...0,056
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RABDOMUN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cantidad por dosis (1
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RABDOMUN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cantidad por dosis (1
Vacunación Infantil. www.madrid.org
 Vacunación Infantil www.madrid.org INTRODUCCIÓN a vacunación constituye una de las medidas más eficaces de la moderna salud pública para la prevención de importantes enfermedades que afectan a todos los
Vacunación Infantil www.madrid.org INTRODUCCIÓN a vacunación constituye una de las medidas más eficaces de la moderna salud pública para la prevención de importantes enfermedades que afectan a todos los
INFORMACIÓN SOBRE VIRUS PAPILOMA HUMANO (VPH) DIRIGIDO A POBLACIÓN GENERAL
 INFORMACIÓN SOBRE VIRUS PAPILOMA HUMANO (VPH) DIRIGIDO A POBLACIÓN GENERAL Desde la perspectiva de Salud Pública, disminuir la incidencia y/o prevenir enfermedades como el cáncer de cuello de útero, producido
INFORMACIÓN SOBRE VIRUS PAPILOMA HUMANO (VPH) DIRIGIDO A POBLACIÓN GENERAL Desde la perspectiva de Salud Pública, disminuir la incidencia y/o prevenir enfermedades como el cáncer de cuello de útero, producido
FICHA TECNICA. Adultos y niños: Aplicar cinco veces al día aproximadamente cada cuatro horas omitiendo la aplicación de la noche.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
Cáncer de cuello uterino PREVENCIÓN. Dra Alicia Aleman Prof Ag. Departamento de Medicina Preventiva y Social Facultad de Medicina- UdelaR
 Cáncer de cuello uterino PREVENCIÓN Dra Alicia Aleman Prof Ag. Departamento de Medicina Preventiva y Social Facultad de Medicina- UdelaR Montevideo, julio 2012 De que hablaremos Algunos aspectos anatómicos
Cáncer de cuello uterino PREVENCIÓN Dra Alicia Aleman Prof Ag. Departamento de Medicina Preventiva y Social Facultad de Medicina- UdelaR Montevideo, julio 2012 De que hablaremos Algunos aspectos anatómicos
QUÉ ES LA HEPATITIS C? CÓMO SE CONTAGIA?
 QUÉ ES LA HEPATITIS C? La hepatitis C es una inflamación del hígado producida por la infección del virus de la hepatitis C. La inflamación puede causar que el hígado no funcione adecuadamente. Se estima
QUÉ ES LA HEPATITIS C? La hepatitis C es una inflamación del hígado producida por la infección del virus de la hepatitis C. La inflamación puede causar que el hígado no funcione adecuadamente. Se estima
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 2 ml de vacuna reconstituida:
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 2 ml de vacuna reconstituida:
SIM EXPRESS Información dirigida a los profesionales de la salud Teriflunomida
 COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos 23/04/2015 SIM EXPRESS Información dirigida
COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos 23/04/2015 SIM EXPRESS Información dirigida
15 Respuestas Acerca de La Influenza (la gripe)
 15 Respuestas Acerca de La Influenza (la gripe) (Todo lo que necesita saber para participar en la discusión) Compromiso Público Acerca de la Influenza Influenza (la gripe) 1. Qué es la influenza (la gripe)?
15 Respuestas Acerca de La Influenza (la gripe) (Todo lo que necesita saber para participar en la discusión) Compromiso Público Acerca de la Influenza Influenza (la gripe) 1. Qué es la influenza (la gripe)?
INFORMACIÓN DE PRESCRIPCIÓN COMPLETA: CONTENIDO* 1 INDICACIONES Y USO 2 DOSIFICACIÓN Y ADMINISTRACIÓN
 202-1269601 VERSIÓN MAESTRA EN ESPAÑOL Revisado: 06/2013 (Leuprolide acetate para suspensión depot) Lupron Depot-PED 7.5 mg Lupron Depot-PED 11.25 mg Uno y tres meses Lupron Depot-PED 15 mg Lupron Depot-PED
202-1269601 VERSIÓN MAESTRA EN ESPAÑOL Revisado: 06/2013 (Leuprolide acetate para suspensión depot) Lupron Depot-PED 7.5 mg Lupron Depot-PED 11.25 mg Uno y tres meses Lupron Depot-PED 15 mg Lupron Depot-PED
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS LACTOVAC C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (5 ml): Sustancia/s activa/s Rotavirus bovino
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS LACTOVAC C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (5 ml): Sustancia/s activa/s Rotavirus bovino
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Vivotif cápsulas duras gastrorresistentes (Vacuna viva antitífica oral) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA.
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Vivotif cápsulas duras gastrorresistentes (Vacuna viva antitífica oral) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA.
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. GENESTRAN 75 microgramos/ml SOLUCION INYECTABLE PARA VACUNO EQUINO Y PORCINO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO GENESTRAN 75 microgramos/ml SOLUCION INYECTABLE PARA VACUNO EQUINO Y PORCINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO GENESTRAN 75 microgramos/ml SOLUCION INYECTABLE PARA VACUNO EQUINO Y PORCINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Vacunación Anti Influenza 2009. Mientras Antes se Vacune, Mejor
 Vacunación Anti Influenza 2009 Mientras Antes se Vacune, Mejor Qué es la Influenza? Es una enfermedad viral altamente contagiosa que afecta el sistema respiratorio. Es una de las enfermedades más severas
Vacunación Anti Influenza 2009 Mientras Antes se Vacune, Mejor Qué es la Influenza? Es una enfermedad viral altamente contagiosa que afecta el sistema respiratorio. Es una de las enfermedades más severas
Equino: Alivio de la inflamación y el dolor en trastornos músculo-esqueléticos agudos y crónicos. Alivio del dolor asociado al cólico equino.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
Transfusión de sangre
 Transfusión de sangre Blood Transfusion - Spanish Información para pacientes sobre los beneficios, riesgos y alternativas UHN Cuáles son los beneficios de una transfusión de sangre? Las transfusiones de
Transfusión de sangre Blood Transfusion - Spanish Información para pacientes sobre los beneficios, riesgos y alternativas UHN Cuáles son los beneficios de una transfusión de sangre? Las transfusiones de
La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares.
 Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
Preguntas y respuestas sobre el cambio del calendario común de vacunación infantil: Razones para la implantación de un nuevo esquema de vacunación
 Preguntas y respuestas sobre el cambio del calendario común de vacunación infantil: Razones para la implantación de un nuevo esquema Contenido del documento: 1. Qué es el calendario común 2. Cuál es el
Preguntas y respuestas sobre el cambio del calendario común de vacunación infantil: Razones para la implantación de un nuevo esquema Contenido del documento: 1. Qué es el calendario común 2. Cuál es el
FICHA TÉCNICA. Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. DURAMUNE CACHORROS DP + C Liofilizado y disolvente para suspensión inyectable para perros
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
LO QUE TODA MUJER NECESITA SABER SOBRE LA. Prevención del cáncer de cuello de útero
 LO QUE TODA MUJER NECESITA SABER SOBRE LA Prevención del cáncer de cuello de útero Qué es el cáncer de cuello de útero? ES EL CÁNCER QUE AFECTA A UNA ZONA GENITAL FEMENINA: el cuello del útero, es decir,
LO QUE TODA MUJER NECESITA SABER SOBRE LA Prevención del cáncer de cuello de útero Qué es el cáncer de cuello de útero? ES EL CÁNCER QUE AFECTA A UNA ZONA GENITAL FEMENINA: el cuello del útero, es decir,
Vacunación n contra Neumococo
 Vacunación n contra Neumococo Comisión Honoraria para la Lucha Antituberculosa y Enfermedades Prevalentes (CHLA-EP) Departamento de Inmunizaciones Dr. Fernando Arrieta Interrogantes Qué es el neumococo?
Vacunación n contra Neumococo Comisión Honoraria para la Lucha Antituberculosa y Enfermedades Prevalentes (CHLA-EP) Departamento de Inmunizaciones Dr. Fernando Arrieta Interrogantes Qué es el neumococo?
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada mililitro contiene 50 mg de carbocisteína. Para consultar la lista completa de excipientes,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada mililitro contiene 50 mg de carbocisteína. Para consultar la lista completa de excipientes,
La vacuna pentavalente oral contra rotavirus puede ser tolerable
 La vacuna pentavalente oral contra rotavirus puede ser tolerable Para los lactantes atendidos en los centros médicos donde se realizó el estudio, la información clínica con respecto a los episodios de
La vacuna pentavalente oral contra rotavirus puede ser tolerable Para los lactantes atendidos en los centros médicos donde se realizó el estudio, la información clínica con respecto a los episodios de
Virus de la bronquitis infecciosa aviar (IBV) cepa variante 4-91 vivo atenuado: 3,6 log10 EID50 *.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
Condiciones Generales
 CAMPAÑA DE VACUNACIÓN ANTIGRIPAL y antineumocócica PAMI 2011 NORMATIVA GENERAL Condiciones Generales 1. LAS VACUNAS ANTIGRIPALES y LAS VACUNAS ANTINEUMOCÓCIAS SON PROPIEDAD DE PAMI, SOLO SE PODRÁ VACUNAR
CAMPAÑA DE VACUNACIÓN ANTIGRIPAL y antineumocócica PAMI 2011 NORMATIVA GENERAL Condiciones Generales 1. LAS VACUNAS ANTIGRIPALES y LAS VACUNAS ANTINEUMOCÓCIAS SON PROPIEDAD DE PAMI, SOLO SE PODRÁ VACUNAR
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. PRID DELTA 1,55 g SISTEMA DE LIBERACIÓN VAGINAL PARA BOVINO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PRID DELTA 1,55 g SISTEMA DE LIBERACIÓN VAGINAL PARA BOVINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sistema
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PRID DELTA 1,55 g SISTEMA DE LIBERACIÓN VAGINAL PARA BOVINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sistema
Prospecto: información para el usuario. DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral)
 Prospecto: información para el usuario DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral) Lea todo el prospecto detenidamente antes de empezar a usar
Prospecto: información para el usuario DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral) Lea todo el prospecto detenidamente antes de empezar a usar
FICHA TÉCNICA. STAMARIL, polvo y disolvente para suspensión inyectable en jeringa precargada.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO STAMARIL, polvo y disolvente para suspensión inyectable en jeringa precargada. Vacuna (viva) frente a la fiebre amarilla. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO STAMARIL, polvo y disolvente para suspensión inyectable en jeringa precargada. Vacuna (viva) frente a la fiebre amarilla. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
GLUCEMIX VILDAGLIPTINA / METFORMINA Comprimidos recubiertos
 GLUCEMIX VILDAGLIPTINA / METFORMINA Comprimidos recubiertos Industria Alemana EXPENDIO BAJO RECETA Nota importante: Antes de recetar este medicamento, consulte toda la información relativa a su prescripción.
GLUCEMIX VILDAGLIPTINA / METFORMINA Comprimidos recubiertos Industria Alemana EXPENDIO BAJO RECETA Nota importante: Antes de recetar este medicamento, consulte toda la información relativa a su prescripción.
Qué son las vacunas y cómo actúan?
 Qué son las vacunas y cómo actúan? Cuando se sufre una infección, el organismo reacciona produciendo unas sustancias llamadas anticuerpos, que nos defienden de la enfermedad y protegen frente a futuras
Qué son las vacunas y cómo actúan? Cuando se sufre una infección, el organismo reacciona produciendo unas sustancias llamadas anticuerpos, que nos defienden de la enfermedad y protegen frente a futuras
VIRUS DEL PAPILOMA HUMANO
 Vacunación contra el VIRUS DEL PAPILOMA HUMANO MANUAL PARA PROFESOR/A Chile Previene el Cáncer de Cuello de Útero Juntos por ELLAS Ministerio de Educación PRESENTACIÓN En conjunto con el Ministerio de
Vacunación contra el VIRUS DEL PAPILOMA HUMANO MANUAL PARA PROFESOR/A Chile Previene el Cáncer de Cuello de Útero Juntos por ELLAS Ministerio de Educación PRESENTACIÓN En conjunto con el Ministerio de
EchinaMed Junior, comprimidos
 EchinaMed Junior, comprimidos PROSPECTO: información para el usuario Lea todo el prospecto detenidamente porque tiene información importante para Ud. Este medicamento puede obtenerse sin receta, para el
EchinaMed Junior, comprimidos PROSPECTO: información para el usuario Lea todo el prospecto detenidamente porque tiene información importante para Ud. Este medicamento puede obtenerse sin receta, para el
SINALERG Levocetirizina 2.5 mg / 5 ml Jarabe
 SINALERG Levocetirizina 2.5 mg / 5 ml Jarabe SINALERG (LEVOCETIRIZINA 2.5 mg/5 ml) Jarabe Antihistamínico COMPOSICIÓN Cada 100 ml contiene: Levocetirizina diclorhidrato... 0.05 g Excipientes c.s.p. INDICACIONES
SINALERG Levocetirizina 2.5 mg / 5 ml Jarabe SINALERG (LEVOCETIRIZINA 2.5 mg/5 ml) Jarabe Antihistamínico COMPOSICIÓN Cada 100 ml contiene: Levocetirizina diclorhidrato... 0.05 g Excipientes c.s.p. INDICACIONES
FICHA TECNICA. Alivio local de los síntomas ocasionados por el herpes labial, tales como: picor, escozor u hormigueo.
 agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
FICHA TÉCNICA. No se han establecido la seguridad y efectividad en niños menores de 12 meses.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vaqta 25 Unidades/0,5 ml suspensión inyectable en jeringa precargada. Vacuna antihepatitis A, inactivada, adsorbida. Para niños y adolescentes. 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vaqta 25 Unidades/0,5 ml suspensión inyectable en jeringa precargada. Vacuna antihepatitis A, inactivada, adsorbida. Para niños y adolescentes. 2. COMPOSICIÓN CUALITATIVA
REMICADE es un anticuerpo monoclonal quimérico que suprime la actividad inflamatoria
 TERAPIA BIOLÓGICA REMICADE es un anticuerpo monoclonal quimérico que suprime la actividad inflamatoria INDICACIONES ARTRITIS REUMATOIDE ESPONDILITIS ANQUILOSANTE ENFERMEDAD DE CROHN Y COLITIS ULCEROSA
TERAPIA BIOLÓGICA REMICADE es un anticuerpo monoclonal quimérico que suprime la actividad inflamatoria INDICACIONES ARTRITIS REUMATOIDE ESPONDILITIS ANQUILOSANTE ENFERMEDAD DE CROHN Y COLITIS ULCEROSA
VACUNACIÓN EN HUESPEDES ESPECIALES
 VACUNACIÓN EN HUESPEDES ESPECIALES E N F E R M E R A V A N E S A A R G Ü E L L O INMUNIDAD BACTERIANAS VIRALES VIVAS ATENUADAS BCG Sarampión Paperas Rubéola Varicela OPV Fiebre Amarilla Rotavirus INACTIVADAS
VACUNACIÓN EN HUESPEDES ESPECIALES E N F E R M E R A V A N E S A A R G Ü E L L O INMUNIDAD BACTERIANAS VIRALES VIVAS ATENUADAS BCG Sarampión Paperas Rubéola Varicela OPV Fiebre Amarilla Rotavirus INACTIVADAS
El Virus del Papiloma Humano y la vacuna para prevenir el cáncer cérvico uterino: descripción y prevención de la enfermedad
 El Virus del Papiloma Humano y la vacuna para prevenir el cáncer cérvico uterino: descripción y prevención de la enfermedad No. DE AUTORIZACION: 093300201B1730 SSA El cáncer cérvico uterino P1 Dónde se
El Virus del Papiloma Humano y la vacuna para prevenir el cáncer cérvico uterino: descripción y prevención de la enfermedad No. DE AUTORIZACION: 093300201B1730 SSA El cáncer cérvico uterino P1 Dónde se
CANCER DE VULVA. Usted puede encontrar más información acerca de esto mirando en el folleto para el paciente Vulva Normal".
 CANCER DE VULVA Dónde está la vulva? La vulva es la porción externa de los órganos genitales femeninos. Se compone de los labios mayores (dos labios grandes y carnosos), los labios menores (por dentro
CANCER DE VULVA Dónde está la vulva? La vulva es la porción externa de los órganos genitales femeninos. Se compone de los labios mayores (dos labios grandes y carnosos), los labios menores (por dentro
Se recomienda beber un vaso de agua después de cada dosis y abundante líquido durante el día.
 agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
Terapia de reposición en adultos y niños en síndromes de inmunodeficiencia primaria tales como:
 1. NOMBRE DEL MEDICAMENTO IGAMPLIA 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 320 mg/2 ml 800 mg/5 ml Inmunoglobulina humana normal (Proteínas humanas (Proporción
1. NOMBRE DEL MEDICAMENTO IGAMPLIA 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 320 mg/2 ml 800 mg/5 ml Inmunoglobulina humana normal (Proteínas humanas (Proporción
Resumen de los principales conceptos
 Resumen de los principales conceptos Documento de posición de la OMS sobre las vacunas contra el virus del papiloma humano (VPH) 9 de abril de 2009 1 ocumento de posición de la OMS sobre las vacunas contra
Resumen de los principales conceptos Documento de posición de la OMS sobre las vacunas contra el virus del papiloma humano (VPH) 9 de abril de 2009 1 ocumento de posición de la OMS sobre las vacunas contra
La forma clínica de presentación más frecuente de la enfermedad
 C a p í t u l o 1 4 Aspectos ginecológicos Gloria Gálvez Bueno La forma clínica de presentación más frecuente de la enfermedad celíaca suele ser en el niño entre los 2 y 5 años de edad con síntomas gastrointestinales,
C a p í t u l o 1 4 Aspectos ginecológicos Gloria Gálvez Bueno La forma clínica de presentación más frecuente de la enfermedad celíaca suele ser en el niño entre los 2 y 5 años de edad con síntomas gastrointestinales,
PIÉNSALO Quién tiene relaciones sexuales?
 PIÉNSALO Quién tiene relaciones sexuales? La verdadera mayoría: Sabías que más de la mitad de los adolescentes NO tienen relaciones sexuales? Únete al montón: Qué dirías si supieras que más de la mitad
PIÉNSALO Quién tiene relaciones sexuales? La verdadera mayoría: Sabías que más de la mitad de los adolescentes NO tienen relaciones sexuales? Únete al montón: Qué dirías si supieras que más de la mitad
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FormulaExpec 13,33 mg/ml jarabe sabor miel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Principio
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FormulaExpec 13,33 mg/ml jarabe sabor miel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Principio
UNICEF/97-0627/Lemoyne
 UNICEF/97-0627/Lemoyne Por qué es importante actuar y compartir información sobre LA INMUNIZACIÓN La inmunización Más de 1,7 millones de niños de corta edad mueren todos los años como consecuencia de enfermedades
UNICEF/97-0627/Lemoyne Por qué es importante actuar y compartir información sobre LA INMUNIZACIÓN La inmunización Más de 1,7 millones de niños de corta edad mueren todos los años como consecuencia de enfermedades
Aunque estos cambios no son cáncer, pueden llevar a que se presente cáncer del cuello uterino si no se tratan.
 La displasia cervical se refiere a cambios anormales en las células de la superficie del cuello uterino que se observan bajo un microscopio. El cuello uterino es la parte inferior del útero (matriz) que
La displasia cervical se refiere a cambios anormales en las células de la superficie del cuello uterino que se observan bajo un microscopio. El cuello uterino es la parte inferior del útero (matriz) que
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento.
 Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Vacunación frente al neumococo (estudio piloto) Instrucción
 Vacunación frente al neumococo (estudio piloto) Instrucción Esta instrucción puede ser consultada en la página web de laa Dirección Xeral de Innovación e Xestión da Saúde Pública: http://dxsp.sergas.es
Vacunación frente al neumococo (estudio piloto) Instrucción Esta instrucción puede ser consultada en la página web de laa Dirección Xeral de Innovación e Xestión da Saúde Pública: http://dxsp.sergas.es
La influenza: una guía para padres de niños o adolescentes con enfermedades crónicas.
 La influenza: una guía para padres de niños o adolescentes con enfermedades crónicas. Qué es la influenza? La influenza (gripe) es una infección de la nariz, la garganta y los pulmones causada por los
La influenza: una guía para padres de niños o adolescentes con enfermedades crónicas. Qué es la influenza? La influenza (gripe) es una infección de la nariz, la garganta y los pulmones causada por los
ETOPOSIDO 100mg/5mL. 1. Identificación del Medicamento. Nombre Comercial. Etoposido 100mg/5mL Solución Inyectable. Nombre Genérico.
 ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
Prospecto: información para el usuario. INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína
 Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
BOLETÍN EPIDEMIOLÓGICO DE CASTILLA-LA MANCHA DICIEMBRE 2002/ Vol.14 /No 50 PREVENCIÓN Y CONTROL DE LA GRIPE (II)*
 BOLETÍN EPIDEMIOLÓGICO DE CASTILLA-LA MANCHA DICIEMBRE 2002/ Vol.14 /No 50 PREVENCIÓN Y CONTROL DE LA GRIPE (II)* RECOMENDACIONES DEL COMITÉ ASESOR DE ESTRATEGIAS DE INMUNIZACIÓN RECOMENDACIONES PARA EL
BOLETÍN EPIDEMIOLÓGICO DE CASTILLA-LA MANCHA DICIEMBRE 2002/ Vol.14 /No 50 PREVENCIÓN Y CONTROL DE LA GRIPE (II)* RECOMENDACIONES DEL COMITÉ ASESOR DE ESTRATEGIAS DE INMUNIZACIÓN RECOMENDACIONES PARA EL
Que es la rubéola? Todas las personas que se contagian con el virus de la rubéola tienen los síntomas de la enfermedad?
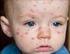 Que es la rubéola? Es una enfermedad causad por un virus. Se caracteriza por fiebre, ganglios agrandados (principalmente en el cuello y detrás de las orejas) y erupción en la piel que dura de 3 a 5 días,
Que es la rubéola? Es una enfermedad causad por un virus. Se caracteriza por fiebre, ganglios agrandados (principalmente en el cuello y detrás de las orejas) y erupción en la piel que dura de 3 a 5 días,
1. RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 1. RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO APIGUARD gel (25% timol) 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Timol
1. RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO APIGUARD gel (25% timol) 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Timol
PUNTOS DESTACADOS DE LA INFORMACIÓN PARA LA FORMULACIONES Y CONCENTRACIONES PRESCRIPCIÓN
 PUNTOS DESTACADOS DE LA INFORMACIÓN PARA LA PRESCRIPCIÓN Estos puntos destacados no incluyen toda la información necesaria para el uso seguro y efectivo de PREVNAR 13. Véase la información completa para
PUNTOS DESTACADOS DE LA INFORMACIÓN PARA LA PRESCRIPCIÓN Estos puntos destacados no incluyen toda la información necesaria para el uso seguro y efectivo de PREVNAR 13. Véase la información completa para
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Gardasil, suspensión inyectable. Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] (Recombinante,
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Gardasil, suspensión inyectable. Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] (Recombinante,
Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos
 Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/21
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/21 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Purevax RCPCh FeLV 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio(s) activo(s) Por dosis de 1 ml:
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/21 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Purevax RCPCh FeLV 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio(s) activo(s) Por dosis de 1 ml:
FICHA TÉCNICA. Se deberá respetar la dosis diaria recomendada independientemente de la extensión de la alopecia.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA Regaxidil 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA Regaxidil 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
INFLUENZA PORCINA (H1N1)
 INFLUENZA PORCINA (H1N1) La gripe porcina (influenza porcina A H1N1) es un tipo de gripe que generalmente afecta al cerdo y no al humano, raramente se produce un caso de contagio hacia las personas que
INFLUENZA PORCINA (H1N1) La gripe porcina (influenza porcina A H1N1) es un tipo de gripe que generalmente afecta al cerdo y no al humano, raramente se produce un caso de contagio hacia las personas que
Lactofilus polvo oral
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Lactofilus polvo oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante,
PROSPECTO: INFORMACIÓN PARA EL USUARIO Lactofilus polvo oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante,
DISTRIBUIDO POR: FABRICADO POR: Esófago de Barrett
 DISTRIBUIDO POR: FABRICADO POR: Esófago de Barrett Qué es el esófago de Barrett? El esófago de Barrett es un estado precanceroso que afecta al revestimiento del esófago, el tubo que, al tragar, transporta
DISTRIBUIDO POR: FABRICADO POR: Esófago de Barrett Qué es el esófago de Barrett? El esófago de Barrett es un estado precanceroso que afecta al revestimiento del esófago, el tubo que, al tragar, transporta
DUDAS FRECUENTES SOBRE
 DUDAS FRECUENTES SOBRE EL EMBARAZO Y LA LACTANCIA EN PACIENTES CON ENFERMEDAD DE CROHN 15 María Chaparro y Javier P. Gisbert Hospital Universitario de La Princesa. Instituto de Investigación Sanitaria
DUDAS FRECUENTES SOBRE EL EMBARAZO Y LA LACTANCIA EN PACIENTES CON ENFERMEDAD DE CROHN 15 María Chaparro y Javier P. Gisbert Hospital Universitario de La Princesa. Instituto de Investigación Sanitaria
PREGUNTAS FRECUENTES SOBRE VPH.
 PREGUNTAS FRECUENTES SOBRE VPH. Qué es el VPH? El Virus del Papiloma Humano VPH es una familia de virus que afecta muy frecuentemente a los seres humanos. Existen alrededor de 100 tipos de VPH, de los
PREGUNTAS FRECUENTES SOBRE VPH. Qué es el VPH? El Virus del Papiloma Humano VPH es una familia de virus que afecta muy frecuentemente a los seres humanos. Existen alrededor de 100 tipos de VPH, de los
LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Vacuna Antipoliomielítica Trivalente Oral. 2.0. DENOMINACIÓN GENÉRICA Vacuna Antipoliomielítica Trivalente
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Vacuna Antipoliomielítica Trivalente Oral. 2.0. DENOMINACIÓN GENÉRICA Vacuna Antipoliomielítica Trivalente
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
4.2 Posología y forma de administración
 1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
Prevención y control de enfermedades
 Nutrición Durante el control del sobrepeso y la obesidad, se recomienda pesarse y medir la cintura cada quince días para valorar la evolución. Acuda con su médico familiar para recibir indicaciones del
Nutrición Durante el control del sobrepeso y la obesidad, se recomienda pesarse y medir la cintura cada quince días para valorar la evolución. Acuda con su médico familiar para recibir indicaciones del
PORQUE VACUNAR A NUESTROS NIÑOS?
 PORQUE VACUNAR A NUESTROS NIÑOS? A diario en todo el mundo se indican y se insiste con la necesidad de vacunar a los niños, ya que es la única forma de prevenir enfermedades infecciosas endémicas, causantes
PORQUE VACUNAR A NUESTROS NIÑOS? A diario en todo el mundo se indican y se insiste con la necesidad de vacunar a los niños, ya que es la única forma de prevenir enfermedades infecciosas endémicas, causantes
