FICHA TÉCNICA ZOSTAVAX. prevenir el herpes zóster prevenir la neuralgia posherpética disminuir el dolor asociado con el herpes zóster agudo o crónico.
|
|
|
- Blanca Serrano Ojeda
- hace 7 años
- Vistas:
Transcripción
1 1. Denominación distintiva FICHA TÉCNICA 2. Denominación genérica Vacuna antivaricela atenuada 3. Composición cualitativa y cuantitativa Cuando se reconstituye como se indica, es un preparado estéril para administración subcutánea. Una vez reconstituido y mantenido a la temperatura ambiente hasta durante 30 minutos, cada dosis de 0.65 ml contiene un mínimo de 19,400 unidades formadoras de placa del virus Oka/Merck de varicelazóster. 4. Forma farmacéutica Suspensión 5. Datos clínicos 5.1 Indicaciones terapéuticas está indicado para: prevenir el herpes zóster prevenir la neuralgia posherpética disminuir el dolor asociado con el herpes zóster agudo o crónico. está indicado para inmunizar a personas mayores de 50 años. 5.2 Posología y vía de administración PARA ADMINISTRACIÓN SUBCUTÁNEA. No se inyecte por vía intravenosa. Se debe administrar una sola dosis. No se sabe cuánto dura la protección después de la vacunación con. En el Estudio sobre la Prevención del Herpes Zóster (SPS, por sus siglas en inglés) se demostró la protección durante cuatro años de seguimiento. Aún no se ha determinado si es necesaria la revacunación. no es un tratamiento del zóster ni de la neuralgia posherpética. Página 1 de 12
2 se puede administrar concomitantemente con la vacuna inactivada contra influenza utilizando jeringas diferentes. Reconstitúyase inmediatamente después de sacarlo del refrigerador. Para reconstituir la vacuna úsese únicamente el diluente que se proporciona con ella, que no contiene conservadores u otras sustancias antivirales que podrían inactivar el virus de la vacuna. Frasco de diluyente: Para reconstituir la vacuna, aspírese con una jeringa todo el contenido del frasco del diluente, inyéctese en el frasco de vacuna liofilizada, y mézclese bien agitando el frasco suavemente. Aspírese todo el contenido con una jeringa e inyéctese por vía subcutánea el volumen total de la vacuna reconstituida, de preferencia en la cara externa del brazo (región deltoidea). Jeringas prellenadas con diluyente Para reconstituir la vacuna, inyecte todo el diluyente de la jeringa prellenada en el frasco de la vacuna liofilizada, y mézclese bien agitando el frasco suavemente. Aspírese todo el contenido en la jeringa e inyéctese por vía subcutánea el volumen total de la vacuna reconstituida, de preferencia en la cara externa del brazo (región deltoidea). SE RECOMIENDA ADMINISTRAR LA VACUNA INMEDIATAMENTE DESPUÉS DE RECONSTITUIRLA, PARA MINIMIZAR LA PÉRDIDA DE POTENCIA. DESÉCHESE LA VACUNA RECONSTITUIDA QUE NO SE HAYA ADMINISTRADO EN LOS 30 MINUTOS SIGUIENTES A SU RECONSTITUCIÓN. No se congele la vacuna reconstituida. PRECAUCIÓN: Para cada inyección y/o reconstitución de se debe usar una jeringa estéril y libre de conservadores, antisépticos y detergentes, porque estas sustancias podrían inactivar el virus de la vacuna. Es importante usar una jeringa y una aguja estériles distintas para cada paciente, para evitar la transmisión de agentes infecciosos de una persona a otra. Las agujas se deben desechar apropiadamente sin volver a ponerles su funda. Página 2 de 12
3 Si las características de la solución y del envase lo permiten, los medicamentos parenterales se deben examinar visualmente antes de administrarlos, en busca de partículas o cambios de coloración. Una vez reconstituido, es un líquido semi opaco a translúcido, incoloro a amarillo claro. 5.3 Contraindicaciones Antecedentes de hipersensibilidad a cualquiera de los componentes de la vacuna, incluyendo la gelatina. Antecedentes de reacción anafiláctica o anafilactoide a la neomicina (cada dosis de la vacuna reconstituida contiene trazas de neomicina). Generalmente, la alergia a la neomicina se manifiesta como una dermatitis de contacto. Sin embargo, un antecedente de dermatitis de contacto debida a la neomicina no es una contraindicación para recibir vacunas de virus vivos. Estados de inmunodeficiencia primaria o adquirida debidos a trastornos como leucemias agudas o crónicas, linfoma, otras alteraciones que afectan la médula ósea o el sistema linfático, inmunosupresión por VIH/SIDA, o deficiencias inmunitarias celulares. Tratamientos inmunosupresores (incluyendo las dosis altas de corticosteroides); sin embargo, no está contraindicado en las personas que están recibiendo corticosteroides tópicos o inhalados, corticosteroides sistémicos a dosis bajas, o como tratamiento de reemplazo (por ejemplo, en la insuficiencia suprarrenal). Tuberculosis activa no tratada. Embarazo. 5.4 Advertencias y precauciones especiales de uso El profesional de la salud debe preguntar al paciente si ha tenido alguna reacción a una dosis anterior de cualquier vacuna que contenga virus de varicela-zóster. Como con cualquier vacuna, se deben tener los medios terapéuticos adecuados, incluyendo epinefrina inyectable (al 1:1,000), para usarlos inmediatamente si ocurre una reacción anafiláctica o anafilactoide. Se debe considerar posponer la vacunación si el paciente tiene fiebre de más de 38.5 C. No se han determinado la seguridad y la eficacia de en adultos infectados con el virus de la inmunodeficiencia humana (VIH) con o sin signos de inmunodeficiencia. Página 3 de 12
4 Como ocurre con cualquier vacuna, es posible que la vacunación con no proteja a todos los que la recibe. Transmisión En los ensayos clínicos con no se ha reportado la transmisión del virus de la vacuna. Sin embargo, la experiencia obtenida después de la salida al mercado sugiere que en raros casos los vacunados que presentan una erupción semejante a la varicela pueden transmitir el virus de la vacuna a los contactos susceptibles. También se ha reportado, pero no se ha confirmado, la transmisión del virus de la vacuna por personas que recibieron la vacuna contra la varicela y no presentaron dicha erupción; ese es un riego teórico de la vacunación con. Se debe comparar el riesgo de transmitir el virus atenuado de la vacuna a las personas susceptibles con el de presentar el HZ natural y transmitirlo a esas personas. Empleo en niños No se recomienda administrar a niños. Empleo en personas de edad avanzada El promedio de edad de las personas incluidas en el estudio clínico más extenso de (n=38,546) fue 69 años (rango, 59 a 99 años). De las 19,270 personas que recibieron, 10,378 tenían 60 a 69 años, 7,629 tenían 70 a 79 años, y 1,263 eran mayores de 80 años. Se demostró que fue generalmente seguro y eficaz en esos pacientes. 5.5 Interacciones medicamentosas y de otro género No se debe mezclar con ningún otro medicamento en la misma jeringa. Otros medicamentos inyectables se deben administrar por separado en otros lugares del cuerpo. No se ha evaluado la administración concomitante de y medicamentos antivirales eficaces contra el virus de varicela-zóster. y PULMOVAX no deben administrarse concomitantemente ya que su uso concomitante resultó en una reducción en la inmunogenicidad de. 5.6 Manifestaciones y manejo de la sobredosis o ingesta accidental No hay datos acerca de la sobredosificación. 5.7 Restricciones de uso durante el embarazo y la lactancia Página 4 de 12
5 Embarazo No se han hecho estudios de reproducción en animales con. No se sabe si puede causar daños al feto o afectar la capacidad reproductora si se administra a una mujer embarazada. Sin embargo, se sabe que la infección con el virus de varicela-zóster natural puede causar daño fetal. Por lo tanto, no se debe administrar a una mujer embarazada, y se debe evitar el embarazo durante los tres meses siguientes a la vacunación. Madres lactantes No se sabe si el virus de la varicela-zóster es excretado con la leche humana. Por lo tanto, debido a que algunos virus sí son excretados con la leche, se debe tener precaución si se administra a una mujer que está amamantando. 5.8 Efectos sobre la capacidad de conducir y utilizar máquinas No se reporta información 5.9 Reacciones secundarias y adversas En los ensayos clínicos se ha evaluado la seguridad de en más de 32,000 personas mayores de 50 años, y fue generalmente bien tolerado. Estudio clínico de eficacia y seguridad de (ZEST) en sujetos de 50 a 59 años de edad En el estudio ZEST, los sujetos recibieron una dosis única, ya fuera de (n= 11,184) o placebo (n=11,212) y se monitorizó la seguridad general a través del estudio. Durante el estudio un sujeto vacunado reportó una reacción adversa seria con (reacción anafiláctica). Todos los sujetos que recibieron una tarjeta de registro de vacunación (VCR pór sus siglas en inglés) para registrar los eventos adversos que ocurrieran del dia 1 al 42 posteriores a la vacunación, además de someterse a un monitoreo de seguridad de rutina durante todo el estudio. Las siguientes experiencias adversas comunes ( 1/100, <1/10) y muy comunes ( 1/10) relacionadas con el sitio de inyección de la vacuna, fueron reportadas en el estudio ZEST. Varias experiencias adversas fueron solicitadas (días 1 a 5 posteriores a la vacunación) y se designan con el símbolo *. Trastornos del sistema nervioso Común: cefalea Página 5 de 12
6 Trastornos generales y alteraciones en el lugar de administración Muy comunes: eritema,* dolor* hinchazón*, prurito Comunes: hematoma, calor, induración Trastornos musculoesqueléticos y del tejido conectivo Comunes: dolor en las extremidades La incidencia global de eventos adversos relacionados con el lugar de inyección de la vacuna fue significativamente mayor en sujetos vacunados con vs. los que recibieron placebo (63.9% para y 14.4% para placebo). En el periodo de reporte de 42 días posterior a la vacunación en el estudio ZEST, erupciones de varicela fueron reportados por 34 sujetos en lugares diferentes al de inyección (19 para y 36 para placebo). De las 24 muestras que fueron adecuadas para la reacción en cadena de polimerasa (PCR por sus siglas en inglés), se detectó VVZ de tipo salvaje en 10 (3 para y 7 para placebo) de éstos especímenes. La cepa Oka/ Merck del VVZ no se detectó en ninguna de éstas muestras. Dentro de esos mismos 42 días posteriores a la vacunación en el período de reporte del estudio ZEST, 124 sujetos reportaron erupciones parecidas a varicela (69 para y 55 para placebo). De 23 especimenes que estaban disponibles y adecuadas para la prueba de PCR, VVZ se detectó en uno de estos especímenes del drupo de sujetos que recibieron ; sin embargo, la cepa del virus (cepa Oka/Merck tipo salvaje) no se pudo determinar. Shingles Prevention Study (SPS), (estudio de prevención de herpes sóster) en sujetos de 60 años y mayores En el más extenso de esos ensayos, el Estudio sobre la Prevención del Herpes Zóster (SPS, por sus siglas en inglés), 38,546 personas recibieron una sola dosis de (n=19,270) o de un placebo (n=19,276) y se evaluó la seguridad durante todo el estudio. Se reportaron reacciones adversas importantes en dos de las que recibieron (exacerbación del asma y polimialgia reumática) y en tres de las que recibieron el placebo (síndrome de Goodpasture, reacción anafiláctica y polimialgia reumática). En el Subestudio de Vigilancia de las Reacciones Adversas se entregaron tarjetas de reporte a un subgrupo de personas del estudio SPS (3,345 de las que recibieron y 3,271 de las que recibieron el placebo), para que anotaran las reacciones adversas que ocurrieran en los días 0 a 42 después de la vacunación, además de la vigilancia usual de la seguridad durante todo el estudio. Página 6 de 12
7 Las siguientes experiencias adversas comunes ( 1/100, <1/10) y muy comunes ( 1/10) relacionadas con el sitio de inyección de la vacuna, fueron reportadas en el Adverse Event Monitoring Substudy (subestudio de monitoreo de eventos adversos). La mayoría de estas experiencias adversas fueron reportadas como de intensidad media. Varias experiencias adversas fueron frecuentes (0-4 días posteriores a la vacunación). Y son designadas con el el simbolo *. Trastornos del sistema nervioso Común: cefalea Trastornos generales y condiciones del sitio de administración Muy comunes: eritema,* dolor/hiperestesia,* hinchazón* Comúnes: hematoma, prurito, calor La incidencia general de las reacciones adversas en el sitio de la inyección relacionadas con la vacuna fue significativamente mayor con (48%) que con el placebo (17%). En los demás pacientes del estudio SPS se hizo la vigilancia usual de la seguridad, pero no se les dieron tarjetas de reporte. Los tipos de reacciones que se reportaron en ellos fueron generalmente similares a los observados en el subgrupo del Subestudio de Vigilancia de las Reacciones Adversas. Dentro del periodo de reporte de 42 días del estudio SPS, el número total de pacientes que tuvieron erupciones zosteriformes fue pequeño (17 con, 36 con el placebo; p=0.009). De 41 de esas 53 personas se obtuvieron muestras adecuadas para la prueba de reacción en cadena de la polimerasa, y se detectó el virus de varicela-zóster natural en 25 de ellos (cinco de los que recibieron y 20 de los que recibieron el placebo). En ninguna de las muestras se detectó la cepa Oka/Merck del virus. Dentro de ese mismo periodo de 42 días después de la vacunación en el estudio SPS, el número de pacientes con erupciones similares a la varicela también fue pequeño. Se obtuvieron diez muestras adecuadas para la prueba de reacción en cadena de la polimerasa, y en ninguna de ellas se detectó el virus de varicela-zóster. En los demás ensayos clínicos que apoyaron la licencia inicial de la formulación congelada de las incidencias reportadas de erupciones zosteriformes y similares a la varicela fuera del sitio de la inyección en los 42 días siguientes a la vacunación también fueron bajas, tanto en las personas que recibieron la vacuna como en las que recibieron el placebo. De los 17 casos reportados de esas erupciones, en diez se obtuvieron muestras adecuadas para la prueba de reacción en cadena de la polimerasa. Se identificó la Página 7 de 12
8 cepa Oka/Merck del virus en las muestras de las lesiones de sólo dos de las personas con erupción similar a la varicela (que se inició los Días 8 y 17, respectivamente). En los estudios clínicos con en personas mayores de 50 años, incluyendo el estudio de administración concomitante con la vacuna inactivada contra la influenza, el perfil de seguridad fue generalmente similar al observado en el Subestudio de Vigilancia de las Reacciones Adversas del SPS. Sin embargo, en esos estudios, la incidencia reportada de reacciones adversas leves a moderadas en el sitio de la inyección fue mayor en las de 50 a 59 años que en las mayores de 60 años. En un estudio doble ciego, controlado con placebo, ensayo clínico aleatorizado, fue administrado a 100 sujetos de 50 años de edad o mayores con antecedentes de HZ antes de la vacunación para evaluar la inmunogenicidad de y el perfil de seguridad. En este ensayo clínico, el perfil de seguridad fue generalmente similar a la observada en el subestudio de monitorización de eventos adversos del estudio SPS. Para resolver dudas sobre las personas de las que no se sabía si ya habían sido vacunadas antes con, se evaluaron la seguridad y la tolerabilidad de una segunda dosis de. En un estudio doble ciego comparativo con un placebo, 98 personas mayores de 60 años recibieron una segunda dosis de 42 días después de la primera dosis; la vacuna fue generalmente bien tolerada. La frecuencia de las reacciones adversas relacionadas con la vacuna después de esa segunda dosis fue generalmente similar a la observada después de la primera dosis. Experiencia después de la comercialización Las siguientes reacciones adversas adicionales han sido identificadas durante la comercialización de. Debido a que estas reacciones han sido reportadas voluntariamente por una población de tamaño incierto, en general no es posible estimar con certeza su frecuencia o establecer alguna relación causal con la vacuna. Trastornos gastrointestinales: nausea Trastornos de la piel y tejido subcutáneo: erupción Trastornos musculoesqueléticos y tejido conectivo: artralgia; mialgia Trastornos generales y en el sitio de administración: erupción en el sitio de la inyección; urticaria en el sitio de inyección; pirexia; linfadenopatía transitoria en el sitio de la inyección Trastornos del sistema inmune: reacciones de hipersensibilidad, incluyendo reacciones anafilácticas Página 8 de 12
9 6. Propiedades farmacológicas FICHA TÉCNICA 6.1 Propiedades farmacodinámicas Inmunogenicidad de En el estudio clínico de eficacia y seguridad de (ZEST por sus siglas en inglés), las respuestas inmunes a la vacunación fueron evaluadas en una subcohorte con distribución al azar del 10% (n=1,136 para y n= 1,133 para placebo) de los sujetos enlistados en el ZEST. provocó mayores respuestas immunes específicas al virus de varicela zóster (VVZ), 6 semanas después de la vacunación en comparación con placebo. El aumento en el nivel de anticuerpos frente a VVZ, se demostró por el ensayo inmunoenzimático de adsorción de glicoproteínas (gpelisa) (2.3 veces la diferencia (95% IC [2,2, 2,4]), la media geométrica de los títulos [GMT] de 664 frente a 288 unidades gpelisa / ml, p <0,001). En el Estudio sobre la Prevención del Herpes Zóster (SPS) se evaluaron las respuestas inmunes a la vacunación en un subgrupo de las personas que ingresaron al estudio (N=1,395). A las seis semanas después de la administración, indujo mayores respuestas inmunes específicas contra el virus de varicela-zóster que el placebo. Se demostraron aumentos tanto en la concentración de anticuerpos contra el virus de varicela-zóster, medida por la prueba de ensayo inmunoenzimático de adsorción de glicoproteínas (gpelisa) (diferencia de 1.7 veces más, promedio geométrico de título de 479 contra 288 unidades gpelisa/ml, p<0.001) y por la actividad de células T, medida por la prueba ImmunoSpot ligada a enzima del interferón-gamma del virus de varicela-zóster (IFN-γ ELISPOT) (diferencia de 2.2 veces más, promedio geométrico de título de 70 contra 32 células formadoras de manchas por millón de células mononucleares, p<0.001). En un análisis integrado de dos estudios clínicos que evaluaron la respuesta inmune a cuatro semanas después de la vacunación, las respuestas generalmente fueron similares en sujetos de 50 a 59 años de edad (n=389) en comparación con los sujetos de 60 años de edad o mayores (n=731) (promedio geométrico de título de 668 vs. 614 unidades gpelisa/ml, respectivamente). El aumento promedio geométrico del título de la respuesta inmune tras la vacunación, medido por gpelisa, fue 2.6 (IC 95%: [2.4 a 2.9] en los sujetos de años de edad y 2.3 (IC 95%: [2.1 a 2.4] en los sujetos de 60 años de edad o mayores. Inmunogenicidad Después de la Administración Concomitante En un estudio doble ciego, controlado, 762 adultos de 50 años de edad o mayores fueron distribuidos al azar a recibir una dosis de administrada concomitantemente (n= 382) o no concomitantemente (n= 380) con la vacuna inactivada contra influenza. Los sujetos del concomitante recibieron y la vacuna inactivada contra influenza en el Día 1 y placebo en la semana 4. Los sujetos del grupo no concomitante recibieron la vacuna inactivada contra influenza y placebo en el Día 1 y en la Página 9 de 12
10 semana 4. Cuatro semanas después de la vacunación, las respuestas de anticuerpos para ambas vacunas fueron similares, independientemente de que se administraran concomitantemente o no. En un estudio clínico controlado, doble ciego, con 473 adultos de 60 años de edad o más, fueron asignados al azar para recibir y PULMOVAX concomitantemente (N = 237), o sólo PULMOVAX y 4 semanas más tarde la administración de (N = 236 ). A las cuatro semanas posteriores a la vacunación, los niveles de anticuerpos VVZ (virus de varicela zóster) con el uso concomitante fueron significativamente más bajos que los niveles de anticuerpos VVZ después de la administración no concomitante (GMT de 338 contra 484 unidades gpelisa/ml, respectivamente; relación GMT = 0.70 (IC del 95%: [0.61, 0.80 ])). Los niveles de anticuerpos VVZ 4 semanas después de la vacunación se incrementaron 1.9 veces (95% IC: [1.7, 2.1]; cumplen el criterio de aceptación previamente especificado) en el grupo concomitante vs. 3.1 veces (95% IC: [2,8, 3,5]) en el grupo no concomitante. Las GMTs para los antígenos de PULMOVAX fueron comparables entre los dos grupos. El uso concomitante de y PULMOVAX demostró un perfil de seguridad que fue generalmente similar al de las dos vacunas administradas de forma no concomitante. Inmunogenicidad en sujetos con antecedentes de herpes zóster antes de la vacunación En un estudio doble ciego, con distribución al azar, controlado con placebo, se administró a 100 sujetos de 50 años de edad o mayores con antecedentes de HZ antes de la vacunación para evaluar la inmunogenicidad de. A las 4 semanas después de la vacunación, indujo significativamente mayores respuestas inmunes específicas contra el virus de varicela-zóster según mediciones con gpelisa en comparación con placebo (diferencia de 2.1 veces (95% IC: [1.5 a 2.9], p<0.001, promedio geométrico de título de 812 vs. 393 unidades gpelisa /ml). Las respuestas de anticuerpos contra el virus de varicela-zóster generalmente fueron similares en los sujetos de 50 a 59 años comparado con los sujetos de 60 años de edad o mayores. 6.2 Propiedades farmacocinéticas El riesgo de padecer HZ tiene una relación causal con una disminución de la inmunidad específica contra el virus de varicela-zóster. Se mostró que refuerza esa inmunidad, y se considera que ese es el mecanismo por el que protege contra el zóster y sus complicaciones. 6.3 Datos preclínicos sobre seguridad No se reportan datos. 7. Datos farmacéuticos. Página 10 de 12
11 7.1 Lista de aditivos Cada dosis de 0.65 ml contiene sacarosa, gelatina, urea, cloruro de sodio, L-glutamato monosódico, fosfato dibásico de sodio, fosfato monobásico de potasio, cloruro de potasio. El producto no contiene ningún conservador. 7.2 Incompatibilidades No se reportan datos. 7.3 Plazo de caducidad 18 meses, debiendo expresar el año con número y el mes con letra. 7.4 Condiciones de conservación y almacenaje Para asegurar que no ocurra ninguna pérdida de potencia, durante su transporte la vacuna se debe mantener a una temperatura de 8 o menor. SE DEBE MANTENER REFRIGERADO a una temperatura media de 2 a 8 C o menor hasta que sea reconstituido para inyectarlo. El diluente se debe conservar por separado a la temperatura ambiente (20 a 25 C) o en el refrigerador (a 2-8 C). Antes de la reconstitución, protéjase la vacuna de la luz. DESÉCHESE LA VACUNA RECONSTITUIDA QUE NO SE HAYA INYECTADO EN LOS 30 MINUTOS SIGUIENTES A LA RECONSTITUCIÓN. NO SE CONGELE LA VACUNA RECONSTITUIDA. 7.5 Presentaciones Caja con 1 ó 10 frascos ámpula de 0.65 ml de dosis única y caja con 1 ó 10 frascos o jeringas prellenadas con diluente estéril. 7.6 Leyendas de advertencia y precautorias Su venta requiere receta médica. No se deje al alcance de los niños. No se use en el embarazo ni en la lactancia. Reporte las sospechas de reacción adversa al correo: farmacovigilancia@cofepris.gob.mx. Página 11 de 12
12 Literatura exclusiva para médicos. FICHA TÉCNICA 8. Razón social y domicilio del titular del registro Schering-Plough, S.A. de C.V. Av. 16 de Septiembre No. 301, Col. Xaltocan, C.P , Deleg. Xochimilco, Ciudad de México, México. 9. Razón social y domicilio del fabricante del medicamento Merck Sharp & Dohme Corp. 770 Sumneytown Pike, West Point, PA 19486, EUA. 10. Razón social y domicilio del acondicionador Merck Sharp & Dohme B.V. Waarderweg 39, 2031 BN Haarlem, Países Bajos. 11. Razón social y domicilio del distribuidor Merck Sharp & Dohme Comercializadora, S. de R.L. de C.V. Carretera México- Querétaro Km 34.5, Nave 6, interior 13, Col. Rancho San Isidro, C.P , Cuautitlán Izcalli, Estado de México, México. 12. Número de registro 123M2009 SSA 13. Fecha de vigencia 27 de septiembre del Fecha de la última actualización. 11 de abril del Número de trámite asociado a dicha actualización X0035 Página 12 de 12
FICHA TÉCNICA VACUNA ANTIPOLIOMIELÍTICA BIVALENTE ORAL
 1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Vacuna Antipoliomielítica Bivalente Oral 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0.1 ml contiene Virus de Poliomielitis Tipo 1 1,000,000
1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Vacuna Antipoliomielítica Bivalente Oral 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0.1 ml contiene Virus de Poliomielitis Tipo 1 1,000,000
INFORMACIÓN PARA PRESCRIBIR AMPLIA ZOSTAVAX vacuna de virus vivo contra el herpes zóster (Oka/Merck), MSD Refrigerado
 I. DENOMINACIÓN DISTINTIVA. II. DENOMINACIÓN GENÉRICA. Vacuna antivaricela atenuada III. FORMULA FARMACÉUTICA Y FORMULACIÓN. En un frasco, polvo para reconstituir y, en otro frasco, diluyente para reconstituir
I. DENOMINACIÓN DISTINTIVA. II. DENOMINACIÓN GENÉRICA. Vacuna antivaricela atenuada III. FORMULA FARMACÉUTICA Y FORMULACIÓN. En un frasco, polvo para reconstituir y, en otro frasco, diluyente para reconstituir
Información para Prescribir Amplia ZOSTAVAX
 I. Denominación distintiva ZOSTAVAX II. Denominación genérica Vacuna antivaricela atenuada. III. Forma Farmacéutica y Formulación Forma Farmacéutica: Suspensión. Consideración de uso: Inyectable. ZOSTAVAX
I. Denominación distintiva ZOSTAVAX II. Denominación genérica Vacuna antivaricela atenuada. III. Forma Farmacéutica y Formulación Forma Farmacéutica: Suspensión. Consideración de uso: Inyectable. ZOSTAVAX
FICHA TÉCNICA TOXOIDES TETÁNICO Y DIFTÉRICO (TD)
 1. DENOMINACIÓN DISTINTIVA. 2. DENOMINACIÓN GENÉRICA. Toxoides tetánico y diftérico 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Toxoide diftérico Toxoide tetánico Vehículo cbp 3 5 Lf 10 20 Lf 0.5 ml 4.
1. DENOMINACIÓN DISTINTIVA. 2. DENOMINACIÓN GENÉRICA. Toxoides tetánico y diftérico 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Toxoide diftérico Toxoide tetánico Vehículo cbp 3 5 Lf 10 20 Lf 0.5 ml 4.
FICHA TÉCNICA HIBERIX
 1. Denominación distintiva 2. Denominación genérica Vacuna conjugada de Haemophilus influenzae tipo b 3. Composición cualitativa y cuantitativa El frasco ámpula con liofilizado para 1 dosis de 0.5 ml contiene:
1. Denominación distintiva 2. Denominación genérica Vacuna conjugada de Haemophilus influenzae tipo b 3. Composición cualitativa y cuantitativa El frasco ámpula con liofilizado para 1 dosis de 0.5 ml contiene:
ZOSTAVAX es un preparado liofilizado de la cepa Oka / Merck de, virus de la varicela-zoster vivo atenuado (VZV).
 WPC-V211-R-I-032016-VENEZUELA ZOSTAVAX VACUNA DE VIRUS VIVOS ATENUADOS CONTRA HERPES ZÓSTER. POLVO LIOFILIZADO PARA SUSPENSIÓN INYECTABLE. (Vacuna de virus vivos atenuados contra Herpes Zóster) I. CLASE
WPC-V211-R-I-032016-VENEZUELA ZOSTAVAX VACUNA DE VIRUS VIVOS ATENUADOS CONTRA HERPES ZÓSTER. POLVO LIOFILIZADO PARA SUSPENSIÓN INYECTABLE. (Vacuna de virus vivos atenuados contra Herpes Zóster) I. CLASE
FICHA TÉCNICA. MENCEVAX AC es una preparación liofilizada de polisacáridos purificados de Neisseria meningitidis (meningococo) de los grupos A y C.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MENCEVAX AC Vacuna de polisacáridos meningocócicos, grupos A y C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. MENCEVAX AC es una preparación liofilizada de polisacáridos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MENCEVAX AC Vacuna de polisacáridos meningocócicos, grupos A y C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. MENCEVAX AC es una preparación liofilizada de polisacáridos
FICHA TÉCNICA VARIVAX III
 1. Denominación distintiva 2. Denominación genérica Vacuna antivaricela atenuada 3. Composición cualitativa y cuantitativa 1350 UFP 4. Forma farmacéutica Suspensión 4. Datos clínicos 5.1 Indicaciones terapéuticas
1. Denominación distintiva 2. Denominación genérica Vacuna antivaricela atenuada 3. Composición cualitativa y cuantitativa 1350 UFP 4. Forma farmacéutica Suspensión 4. Datos clínicos 5.1 Indicaciones terapéuticas
FICHA TÉCNICA AGRIPPAL S1
 1. Denominación distintiva 2. Denominación genérica Vacuna anti-influenza trivalente tipo A y B 3. Composición cualitativa y cuantitativa. A/California/7/2009 (H1N1)pdm09 15.000 mcg HA A/Perth/16/2009
1. Denominación distintiva 2. Denominación genérica Vacuna anti-influenza trivalente tipo A y B 3. Composición cualitativa y cuantitativa. A/California/7/2009 (H1N1)pdm09 15.000 mcg HA A/Perth/16/2009
FICHA TÉCNICA STAMARIL
 1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Vacuna antiamarílica atenuada 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Suspensión inyectable Fórmula: El frasco ámpula con liofilizado para una dosis
1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Vacuna antiamarílica atenuada 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Suspensión inyectable Fórmula: El frasco ámpula con liofilizado para una dosis
PRINCIPIO ACTIVO. Virus de la parotiditis TCID 50
 PROSPECTO VACUNA MSD ANTI PAROTIDITIS COMPOSICIÓN VIAL DE POLVO LIOFILIZADO PRINCIPIO ACTIVO. Virus de la parotiditis...20.000 TCID 50 EXCIPIENTES Neomicina 25,0 mcg Albúmina humana 0,3 mg Sacarosa 2,3
PROSPECTO VACUNA MSD ANTI PAROTIDITIS COMPOSICIÓN VIAL DE POLVO LIOFILIZADO PRINCIPIO ACTIVO. Virus de la parotiditis...20.000 TCID 50 EXCIPIENTES Neomicina 25,0 mcg Albúmina humana 0,3 mg Sacarosa 2,3
FICHA TÉCNICA. Polisacárido Vi de Salmonella typhi (cepa Ty2)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Typherix, solución inyectable en jeringa precargada Vacuna de polisacárido antitifoideo. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml de la vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Typherix, solución inyectable en jeringa precargada Vacuna de polisacárido antitifoideo. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml de la vacuna
Comentarios sobre la vacuna contra el herpes zóster
 Comentarios sobre la vacuna contra el herpes zóster Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid El Advisory Committee
Comentarios sobre la vacuna contra el herpes zóster Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid El Advisory Committee
INFORMACION PARA PRESCRIBIR AMPLIA MEXICO VARIVAX III (vacuna de virus vivo contra la varicela [Oka/Merck], MSD) 1 de 12
![INFORMACION PARA PRESCRIBIR AMPLIA MEXICO VARIVAX III (vacuna de virus vivo contra la varicela [Oka/Merck], MSD) 1 de 12 INFORMACION PARA PRESCRIBIR AMPLIA MEXICO VARIVAX III (vacuna de virus vivo contra la varicela [Oka/Merck], MSD) 1 de 12](/thumbs/66/56079413.jpg) (vacuna de virus vivo contra la varicela [Oka/Merck], MSD) 1 de 12 I. NOMBRE COMERCIAL VARIVAX * III 2. NOMBRE GENÉRICO Vacuna de virus vivo contra la varicela (Oka/Merck), MSD 3. FORMA FARMACÉUTICA Y
(vacuna de virus vivo contra la varicela [Oka/Merck], MSD) 1 de 12 I. NOMBRE COMERCIAL VARIVAX * III 2. NOMBRE GENÉRICO Vacuna de virus vivo contra la varicela (Oka/Merck), MSD 3. FORMA FARMACÉUTICA Y
FICHA TÉCNICA. VACUNA ANTIRRABICA MERIEUX Vacuna antirrábica inactivada cultivada en células diploides humanas
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIRRABICA MERIEUX Vacuna antirrábica inactivada cultivada en células diploides humanas 2. COMPOSICION CUALITATIVA Y CUANTITATIVA De una dosis de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIRRABICA MERIEUX Vacuna antirrábica inactivada cultivada en células diploides humanas 2. COMPOSICION CUALITATIVA Y CUANTITATIVA De una dosis de vacuna
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVALTO Respi 3 suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVALTO Respi 3 suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis
Virus del sarampión TCID 50
 PROSPECTO AMUNOVAX Vacuna antisarampión COMPOSICION VIAL DE POLVO LIOFILIZADO PRINCIPIO ACTIVO. Virus del sarampión... 1.000 TCID 50 EXCIPIENTES Neomicina 25,0 mcg Albúmina humana 0,3 mg Sacarosa 2,3 mg
PROSPECTO AMUNOVAX Vacuna antisarampión COMPOSICION VIAL DE POLVO LIOFILIZADO PRINCIPIO ACTIVO. Virus del sarampión... 1.000 TCID 50 EXCIPIENTES Neomicina 25,0 mcg Albúmina humana 0,3 mg Sacarosa 2,3 mg
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
FICHA TÉCNICA. Virus de la gripe fraccionados*, inactivados, que contienen antígenos equivalentes a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. COLOMBOVAC PMV/POX Liofilizado y suspensión para suspensión inyectable para palomas
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO COLOMBOVAC PMV/POX Liofilizado y suspensión para suspensión inyectable
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO COLOMBOVAC PMV/POX Liofilizado y suspensión para suspensión inyectable
FICHA TÉCNICA VAQTA. 1. Denominación distintiva VAQTA. 2. Denominación genérica Vacuna antihepatitis A inactivada
 1. Denominación distintiva 2. Denominación genérica Vacuna antihepatitis A inactivada 3. Composición cualitativa y cuantitativa Un mililitro de la vacuna contiene aproximadamente: 50 unidades (U) de antígeno
1. Denominación distintiva 2. Denominación genérica Vacuna antihepatitis A inactivada 3. Composición cualitativa y cuantitativa Un mililitro de la vacuna contiene aproximadamente: 50 unidades (U) de antígeno
PROSPECTO PARA: Ingelvac MycoFLEX suspensión inyectable para cerdos
 PROSPECTO PARA: Ingelvac MycoFLEX suspensión inyectable para cerdos 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Y DEL FABRICANTE RESPONSABLE DE
PROSPECTO PARA: Ingelvac MycoFLEX suspensión inyectable para cerdos 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Y DEL FABRICANTE RESPONSABLE DE
FICHA TÉCNICA. Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones inyectables 1 g por
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones inyectables 1 g por
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRABOVIS-4 Liofilizado y disolvente para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRABOVIS-4 Liofilizado y disolvente para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA. * La vacuna cumple con la recomendación de la OMS (hemisferio Norte) y con la decisión de la Unión Europea para la campaña 2000/2001.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL PASTEUR Vacuna antigripal inactivada (virus fraccionados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe cultivados en huevos, fraccionados
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL PASTEUR Vacuna antigripal inactivada (virus fraccionados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe cultivados en huevos, fraccionados
FICHA TECNICA. Adultos en prediálisis o en diálisis: 1 dosis (40 µg) de 1 ml en cada inyección.
 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
FICHA TÉCNICA VACUNA CONTRA SARAMPIÓN Y RUBÉOLA
 1. DENOMINACIÓN DISTINTIVA Vacuna contra Sarampión y Rubéola 2. DENOMINACIÓN GENÉRICA Vacuna contra sarampión y rubéola FICHA TÉCNICA 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Componentes Dosis Cada: 0.5
1. DENOMINACIÓN DISTINTIVA Vacuna contra Sarampión y Rubéola 2. DENOMINACIÓN GENÉRICA Vacuna contra sarampión y rubéola FICHA TÉCNICA 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Componentes Dosis Cada: 0.5
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea
 FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
FICHA TÉCNICA. La vacuna MSD Antirrubéola cumple los requisitos de la OMS para productos biológicos y vacunas Antirrubéola.
 1. NOMBRE DEL MEDICAMENTO VACUNA MSD ANTIRRUBEOLA FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Vacuna MSD Antirrubéola (vacuna con virus de la rubéola vivos) es una vacuna de virus vivos para
1. NOMBRE DEL MEDICAMENTO VACUNA MSD ANTIRRUBEOLA FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Vacuna MSD Antirrubéola (vacuna con virus de la rubéola vivos) es una vacuna de virus vivos para
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO CORREO ELECTRÓNICO Sugerencias_ft@aemps.es C/ CAMPEZO, 1 EDIFICIO 8 28022 MADRID 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO CORREO ELECTRÓNICO Sugerencias_ft@aemps.es C/ CAMPEZO, 1 EDIFICIO 8 28022 MADRID 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ZULVAC 1 Bovis suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ZULVAC 1 Bovis suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
3.0. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Antígeno del virus de la hepatitis A
 1.0. DENOMINACIÓN DISTINTIVA. Virohep A 2.0. DENOMINACIÓN GENÉRICA Vacuna Antihepatitis A 3.0. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Antígeno del virus de la hepatitis A 12 UI 4.0. FORMA FARMACÉUTICA.
1.0. DENOMINACIÓN DISTINTIVA. Virohep A 2.0. DENOMINACIÓN GENÉRICA Vacuna Antihepatitis A 3.0. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Antígeno del virus de la hepatitis A 12 UI 4.0. FORMA FARMACÉUTICA.
FICHA TÉCNICA. VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable
 FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN
Egnor pqste_uf VAXIGRIP ADULTO 2OO9 FICHA TECNICA. Virus de la influenzax, fraccionado, inactivado, conteniendo antígenos análogos a:
 Egnor pqste_uf ------ La división vacunas del Gruoo sanofi-aventis FICHA TECNICA VAXIGRIP ADULTO 2OO9 Vacuna anti-influenza inactivada suspensión inyectable 1. DEMONIMACIóN DEL MEDICAMENTO VAXIGRIP, suspensión
Egnor pqste_uf ------ La división vacunas del Gruoo sanofi-aventis FICHA TECNICA VAXIGRIP ADULTO 2OO9 Vacuna anti-influenza inactivada suspensión inyectable 1. DEMONIMACIóN DEL MEDICAMENTO VAXIGRIP, suspensión
Nobivac Myxo-RHD liofilizado y disolvente para suspensión inyectable para conejos.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobivac Myxo-RHD liofilizado y disolvente para suspensión inyectable para conejos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna reconstituida
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobivac Myxo-RHD liofilizado y disolvente para suspensión inyectable para conejos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna reconstituida
FICHA TÉCNICA O RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Ingelvac MycoFLEX suspensión inyectable para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Mycoplasma
FICHA TÉCNICA O RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Ingelvac MycoFLEX suspensión inyectable para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Mycoplasma
FICHA TÉCNICA VACUNA ADSORBIDA ANTIDIFTÉRICA, ANTITETÁNICA Y CONTRA LA TOS FERINA
 1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Toxoide Diftérico / Toxoide Tetánica / Vacuna Pertussis 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Componentes Cada: Toxoide Diftérico Corynebacterium
1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Toxoide Diftérico / Toxoide Tetánica / Vacuna Pertussis 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Componentes Cada: Toxoide Diftérico Corynebacterium
FICHA TÉCNICA FLUVACSIN SV
 1. DENOMINACIÓN DISTINTIVA. 2. DENOMINACIÓN GENÉRICA. Vacuna Anti-Influenza Trivalente Tipos A y B 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Cada dosis de vacuna contiene virus (inactivados, fraccionados)
1. DENOMINACIÓN DISTINTIVA. 2. DENOMINACIÓN GENÉRICA. Vacuna Anti-Influenza Trivalente Tipos A y B 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Cada dosis de vacuna contiene virus (inactivados, fraccionados)
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACION DEL MEDICAMENTO VETERINARIO DERCUNIMIX 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACION DEL MEDICAMENTO VETERINARIO DERCUNIMIX 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis
agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACION DEL MEDICAMENTO VETERINARIO DERCUNIMIX 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Medicinal product no longer authorised
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobivac Piro liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobivac Piro liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
4.2. Indicaciones de uso, especificando las especies de destino
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO FILAVAC VHD K C+V suspensión inyectable para conejos. 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO FILAVAC VHD K C+V suspensión inyectable para conejos. 2. COMPOSICIÓN CUALITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis BVD Suspensión inyectable para bovino. DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis BVD Suspensión inyectable para bovino. DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS IBR MARKER VIVA Liofilizado y disolvente para suspensión para bovino
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS IBR MARKER VIVA Liofilizado y disolvente para suspensión para bovino
ZOSTAVAX VACUNA CON VIRUS VIVOS ATENUADOS (OKA/ MERCK) DEL HERPES ZOSTER. Inyectable para administración subcutánea
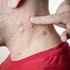 ZOSTAVAX VACUNA CON VIRUS VIVOS ATENUADOS (OKA/ MERCK) DEL HERPES ZOSTER Inyectable para administración subcutánea INDUSTRIA NORTEAMERICANA VENTA BAJO RECETA FORMULA CUALI-CUANTITATIVA: ZOSTAVAX es una
ZOSTAVAX VACUNA CON VIRUS VIVOS ATENUADOS (OKA/ MERCK) DEL HERPES ZOSTER Inyectable para administración subcutánea INDUSTRIA NORTEAMERICANA VENTA BAJO RECETA FORMULA CUALI-CUANTITATIVA: ZOSTAVAX es una
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. RECOMBIVAX HB 10 mg jeringa precargada Vacuna recombinante antihepatitis B.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 10 mg jeringa precargada Vacuna recombinante antihepatitis B. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 10 microgramos /
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 10 mg jeringa precargada Vacuna recombinante antihepatitis B. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 10 microgramos /
Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol.
 1. NOMBRE DEL MEDICAMENTO TROSID 280 mg/ml barniz de uñas medicamentoso 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol. Para consultar la
1. NOMBRE DEL MEDICAMENTO TROSID 280 mg/ml barniz de uñas medicamentoso 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol. Para consultar la
Virus de la parotiditis TCID 50. VIAL DE DISOLVENTE. Agua para inyección...0,5 ml
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO VACUNA MSD ANTIPAROTIDITIS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA VACUNA MSD ANTIPAROTIDITIS (vacuna con virus de la parotiditis vivos) es una vacuna de virus
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO VACUNA MSD ANTIPAROTIDITIS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA VACUNA MSD ANTIPAROTIDITIS (vacuna con virus de la parotiditis vivos) es una vacuna de virus
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable ZOSTAVAX polvo y disolvente para suspensión inyectable
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable ZOSTAVAX polvo y disolvente para suspensión inyectable
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker viva, liofilizado y disolvente
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker viva, liofilizado y disolvente
FICHA TÉCNICA TYPHIM Vi
 1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Vacuna antitifoídica capsular Polisacárido Vi 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis de 0.5 ml contiene: Polisacárido capsular Vi purificado
1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Vacuna antitifoídica capsular Polisacárido Vi 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis de 0.5 ml contiene: Polisacárido capsular Vi purificado
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. RECOMBIVAX HB 5 mg Vacuna recombinante antihepatitis B. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 5 mg Vacuna recombinante antihepatitis B. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 5 microgramos/ 0,5 ml, suspensión inyectable
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 5 mg Vacuna recombinante antihepatitis B. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 5 microgramos/ 0,5 ml, suspensión inyectable
FICHA TÉCNICA. DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Por cada unidad de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Por cada unidad de vacuna
K:\Jenner_Public\QSS\VACCINE QUALITY & REGULATION GROUP\Inserts\Spanish\esp_Insert measles rubella Vd2-rev.doc
 MODELO DE PROSPECTO VACUNA COMBINADA CONTRA EL SARAMPIÓN Y LA RUBÉOLA (MR) DESCRIPCIÓN La vacuna MR es un polvo liofilizado que contiene dos antígenos, el del sarampión y el de la rubéola. Debe reconstituirse
MODELO DE PROSPECTO VACUNA COMBINADA CONTRA EL SARAMPIÓN Y LA RUBÉOLA (MR) DESCRIPCIÓN La vacuna MR es un polvo liofilizado que contiene dos antígenos, el del sarampión y el de la rubéola. Debe reconstituirse
Cepa derivada de A/California/7/2009 (H1N1)pdm09: (NYMC X-181) 15 microgramos HA** Cepa derivada de A/Victoria/361/2011 (H3N2): (IVR-165)
 1. NOMBRE DEL MEDICAMENTO CHIROFLU, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Antígenos
1. NOMBRE DEL MEDICAMENTO CHIROFLU, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Antígenos
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
VARIVAX es una vacuna contra la varicela de virus vivos atenuados (una preparación liofilizada de la cepa de varicela Oka/Merck).
 VARIVAX VACUNA CONTRA LA VARICELA DE VIRUS VIVOS ATENUADOS 1350 PFU/0,5 ml, POLVO LIOFILIZADO PARA SOLUCIÓN INYECTABLE Vacuna contra la Varicela de virus vivos atenuados I. CLASE TERAPEUTICA VARIVAX es
VARIVAX VACUNA CONTRA LA VARICELA DE VIRUS VIVOS ATENUADOS 1350 PFU/0,5 ml, POLVO LIOFILIZADO PARA SOLUCIÓN INYECTABLE Vacuna contra la Varicela de virus vivos atenuados I. CLASE TERAPEUTICA VARIVAX es
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Ditanrix Adulto suspensión inyectable Vacuna Antitétanos-difteria (Td)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ditanrix Adulto suspensión inyectable Vacuna Antitétanos-difteria (Td) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Ditanrix Adulto contiene los toxoides de tétanos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ditanrix Adulto suspensión inyectable Vacuna Antitétanos-difteria (Td) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Ditanrix Adulto contiene los toxoides de tétanos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA VACUNA VIVA ATENUADA CONTRA EL SARAMPION Y RUBEOLA (MR) LIOFILIZADA
 FICHA TÉCNICA VACUNA VIVA ATENUADA CONTRA EL SARAMPION Y RUBEOLA (MR) LIOFILIZADA PRESENTACION DEL PRODUCTO (Resumen) La vacuna se prepara a partir de las cepas vivas, atenuadas del virus de sarampión
FICHA TÉCNICA VACUNA VIVA ATENUADA CONTRA EL SARAMPION Y RUBEOLA (MR) LIOFILIZADA PRESENTACION DEL PRODUCTO (Resumen) La vacuna se prepara a partir de las cepas vivas, atenuadas del virus de sarampión
FICHA TECNICA. Adyuvante de la vacuna de antihepatitis A inactivada Hidróxido de aluminio...0,3 miligramos Al 3+
 FICHA TECNICA 1. DENOMINACIÓN DEL MEDICAMENTO TYAVAX suspensión inyectable Vacuna combinada contra la fiebre tifoidea de polisacárido Vi purificado y antihepatitis A inactivada. 2. COMPOSICIÓN CUALITATIVA
FICHA TECNICA 1. DENOMINACIÓN DEL MEDICAMENTO TYAVAX suspensión inyectable Vacuna combinada contra la fiebre tifoidea de polisacárido Vi purificado y antihepatitis A inactivada. 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA. Para más información sobre el adyuvante, ver sección 5.1. Para consultar la lista completa de excipientes, ver sección 6.1.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Epaxal suspensión para inyección en jeringa precargada. Vacuna contra la hepatitis A (inactivada, virosoma) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis de
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Epaxal suspensión para inyección en jeringa precargada. Vacuna contra la hepatitis A (inactivada, virosoma) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis de
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA
 La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
FICHA TÉCNICA. Una dosis (0,5 ml) de Havrix 720 contiene: 720 Unidades ELISA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Havrix 1440 suspensión inyectable en jeringa precargada Havrix 720 suspensión inyectable en jeringa precargada Vacuna antihepatitis A (inactivada, adsorbida) 2.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Havrix 1440 suspensión inyectable en jeringa precargada Havrix 720 suspensión inyectable en jeringa precargada Vacuna antihepatitis A (inactivada, adsorbida) 2.
FICHA TÉCNICA. VACUNA ANTINEUMOCÓCICA DE POLISACÁRIDOS AVENTIS PASTEUR MSD, Jeringa precargada
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VACUNA ANTINEUMOCÓCICA DE POLISACÁRIDOS AVENTIS PASTEUR MSD, Jeringa precargada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VACUNA ANTINEUMOCÓCICA DE POLISACÁRIDOS AVENTIS PASTEUR MSD, Jeringa precargada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014 2. COMPOSICIÓN
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VERSIFEL FeLV Suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 1 ml contiene:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VERSIFEL FeLV Suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 1 ml contiene:
Rifamicina 1% colirio
 Rifamicina 1% colirio RESUMEN DE CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO RIFAMICINA Colirio FICHA TECNICA IPC-RFM-OS-0987 Tracer Nº RFM-E-17820 04/00 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Rifamicina 1% colirio RESUMEN DE CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO RIFAMICINA Colirio FICHA TECNICA IPC-RFM-OS-0987 Tracer Nº RFM-E-17820 04/00 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO STAMARIL PASTEUR Polvo y disolvente para suspensión inyectable. Vacuna atenuada contra la fiebre amarilla 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO STAMARIL PASTEUR Polvo y disolvente para suspensión inyectable. Vacuna atenuada contra la fiebre amarilla 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis
FICHA TÉCNICA M-M-R II
 1. Denominación distintiva FICHA TÉCNICA 2. Denominación genérica Vacuna de virus contra sarampión, parotiditis y rubéola 3. Composición cualitativa y cuantitativa Virus de Sarampión 1,000 DICC50 (1) Virus
1. Denominación distintiva FICHA TÉCNICA 2. Denominación genérica Vacuna de virus contra sarampión, parotiditis y rubéola 3. Composición cualitativa y cuantitativa Virus de Sarampión 1,000 DICC50 (1) Virus
PROSPECTO PARA: Versican Plus DP liofilizado y disolvente para suspensión inyectable para perros
 PROSPECTO PARA: Versican Plus DP liofilizado y disolvente para suspensión inyectable para perros 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Y
PROSPECTO PARA: Versican Plus DP liofilizado y disolvente para suspensión inyectable para perros 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Y
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Fevaxyn Pentofel, suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Fevaxyn Pentofel, suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Influvac suspensión inyectable jeringa precargada (vacuna antigripal inactivada de antígenos de superficie). Campaña 2017/2018.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Influvac suspensión inyectable jeringa precargada (vacuna antigripal inactivada de antígenos de superficie). Campaña 2017/2018. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Influvac suspensión inyectable jeringa precargada (vacuna antigripal inactivada de antígenos de superficie). Campaña 2017/2018. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA HAVRIX
 1. Denominación distintiva 2. Denominación genérica Vacuna antihepatitis A inactivada. 3. Composición cualitativa y cuantitativa El frasco ámpula o la jeringa prellenada con 1 dosis contiene: PEDIATRICA
1. Denominación distintiva 2. Denominación genérica Vacuna antihepatitis A inactivada. 3. Composición cualitativa y cuantitativa El frasco ámpula o la jeringa prellenada con 1 dosis contiene: PEDIATRICA
Ficha técnica Página 1
 1. NOMBRE DEL MEDICAMENTO: Difur 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada cápsula contiene 120 mg de extracto seco de rizoma de Polypodium leucotomos L. (DER nativo 4-6:1)
1. NOMBRE DEL MEDICAMENTO: Difur 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada cápsula contiene 120 mg de extracto seco de rizoma de Polypodium leucotomos L. (DER nativo 4-6:1)
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO. Equilis Prequenza Te, suspensión inyectable, para caballos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Equilis Prequenza Te, suspensión inyectable, para caballos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias activas: Virus de la influenza
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Equilis Prequenza Te, suspensión inyectable, para caballos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias activas: Virus de la influenza
Prospecto: información para el usuario. PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos
 Prospecto: información para el usuario PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos Lea todo el prospecto detenidamente antes de que usted o su hijo sean
Prospecto: información para el usuario PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos Lea todo el prospecto detenidamente antes de que usted o su hijo sean
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS IB+ND+EDS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS IB+ND+EDS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis
PROSPECTO PARA EL FABRICANTE LIBERADOR DEL LOTE ZOETIS MANUFACTURING & RESEARCH SPAIN, S.L. PROSPECTO PARA:
 PROSPECTO PARA EL FABRICANTE LIBERADOR DEL LOTE ZOETIS MANUFACTURING & RESEARCH SPAIN, S.L. PROSPECTO PARA: POULVAC MAREK CVI suspensión y disolvente para suspensión inyectable para aves. 1. NOMBRE O RAZÓN
PROSPECTO PARA EL FABRICANTE LIBERADOR DEL LOTE ZOETIS MANUFACTURING & RESEARCH SPAIN, S.L. PROSPECTO PARA: POULVAC MAREK CVI suspensión y disolvente para suspensión inyectable para aves. 1. NOMBRE O RAZÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. BRONCHI-SHIELD Liofilizado y disolvente para suspensión para gotas nasales para perros
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BRONCHI-SHIELD Liofilizado y disolvente para suspensión para gotas nasales
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BRONCHI-SHIELD Liofilizado y disolvente para suspensión para gotas nasales
FICHA TÉCNICA. Excipientes con efecto conocido: 0,458 g de maltitol líquido (E965) y 1,830 g de isomalta (E953).
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
MODELO DE PROSPECTO Vacuna recombinante contra la hepatitis B (HepB)
 MODELO DE PROSPECTO Vacuna recombinante contra la hepatitis B (HepB) DESCRIPCIÓN Esta vacuna liquida contiene partículas muy purificadas y no infecciosas del antígeno de superficie del virus de la hepatitis
MODELO DE PROSPECTO Vacuna recombinante contra la hepatitis B (HepB) DESCRIPCIÓN Esta vacuna liquida contiene partículas muy purificadas y no infecciosas del antígeno de superficie del virus de la hepatitis
Fluarix Tetra. Vacuna antigripal tetravalente (virión fraccionado inactivado) suspensión inyectable
 Fluarix Tetra Vacuna antigripal tetravalente (virión fraccionado inactivado) suspensión inyectable COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Fluarix Tetra es una vacuna antigripal inactivada (virión fraccionado),
Fluarix Tetra Vacuna antigripal tetravalente (virión fraccionado inactivado) suspensión inyectable COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Fluarix Tetra es una vacuna antigripal inactivada (virión fraccionado),
FICHA TÉCNICA DIPERTIX 1. Denominación distintiva. DIPERTIX
 1. Denominación distintiva. 2. Denominación genérica. Vacuna antipertussis con toxoides diftérico y tetánico adsorbidos (DTP) 3. Composición cualitativa y cuantitativa. Cada dosis de 0.5 ml contiene: Toxoide
1. Denominación distintiva. 2. Denominación genérica. Vacuna antipertussis con toxoides diftérico y tetánico adsorbidos (DTP) 3. Composición cualitativa y cuantitativa. Cada dosis de 0.5 ml contiene: Toxoide
Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1.
 1. NOMBRE DEL MEDICAMENTO CHIROMAS, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA
1. NOMBRE DEL MEDICAMENTO CHIROMAS, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA
PROSPECTO: INFORMACIÓN PARA EL USUARIO
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Gamma Anti-Tétanos Grifols 500 UI solución inyectable en jeringa precargada Inmunoglobulina humana antitetánica Lea todo el prospecto detenidamente antes de empezar
PROSPECTO: INFORMACIÓN PARA EL USUARIO Gamma Anti-Tétanos Grifols 500 UI solución inyectable en jeringa precargada Inmunoglobulina humana antitetánica Lea todo el prospecto detenidamente antes de empezar
FICHA TÉCNICA, ETIQUETADO Y PROSPECTO FICHA TÉCNICA
 1.3.1. FICHA TÉCNICA, ETIQUETADO Y PROSPECTO FICHA TÉCNICA MÓDULO 1. AGUA INYECCION GRIFOLS 1 1. NOMBRE DEL MEDICAMENTO Agua para Inyección Grifols 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones
1.3.1. FICHA TÉCNICA, ETIQUETADO Y PROSPECTO FICHA TÉCNICA MÓDULO 1. AGUA INYECCION GRIFOLS 1 1. NOMBRE DEL MEDICAMENTO Agua para Inyección Grifols 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones
FICHA TÉCNICA. Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Oculotect 50 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 50 mg de povidona K25. Para consultar la lista
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Oculotect 50 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 50 mg de povidona K25. Para consultar la lista
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS AE+POX Liofilizado y disolvente para suspensión inyectable 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS AE+POX Liofilizado y disolvente para suspensión inyectable 2. COMPOSICIÓN
NORMATIVA VACUNAS HEPATITIS B. Departamento de Vacunas e Inmunizaciones Ministerio de Salud
 NORMATIVA VACUNAS HEPATITIS B Departamento de Vacunas e Inmunizaciones Ministerio de Salud Nuevas incorporaciones en trámite 2015 (Sujetos a modificaciones y aprobación por el Departamento de Asesoría
NORMATIVA VACUNAS HEPATITIS B Departamento de Vacunas e Inmunizaciones Ministerio de Salud Nuevas incorporaciones en trámite 2015 (Sujetos a modificaciones y aprobación por el Departamento de Asesoría
La vacuna no es eficaz para la prevención de la otitis media aguda, sinusitis y otras infecciones comunes del tracto respiratorio superior.
 1. NOMBRE DEL MEDICAMENTO Pneumovax 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna contiene 25 microgramos
1. NOMBRE DEL MEDICAMENTO Pneumovax 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna contiene 25 microgramos
600 U.I. 480 mg 95% Ig. 67,5 mg 9,0 mg 3 ml. Solución inyectable con inmunoglobulinas, principalmente inmunoglobulina G (IgG).
 1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-HEPATITIS B GRIFOLS 600 U.I. GAMMA ANTI-HEPATITIS B GRIFOLS 1000 U.I. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 600 U.I. 1000 U.I. Inmunoglobulina
1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-HEPATITIS B GRIFOLS 600 U.I. GAMMA ANTI-HEPATITIS B GRIFOLS 1000 U.I. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 600 U.I. 1000 U.I. Inmunoglobulina
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. 2.1 Descripción general
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Las cápsulas son ovales, con el cuerpo y la tapa de color blanco.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Las cápsulas son ovales, con el cuerpo y la tapa de color blanco.
FICHA TÉCNICA VACUNA CONTRA SARAMPIÓN, PAROTIDITIS Y RUBÉOLA.
 1. DENOMINACIÓN DISTINTIVA Vacuna contra Sarampión, Parotiditis y Rubéola. 2. DENOMINACIÓN GENÉRICA Vacuna antisarampión, antiparotiditis y antirrubéola. 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Componentes
1. DENOMINACIÓN DISTINTIVA Vacuna contra Sarampión, Parotiditis y Rubéola. 2. DENOMINACIÓN GENÉRICA Vacuna antisarampión, antiparotiditis y antirrubéola. 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Componentes
