1. NOMBRE DEL MEDICAMENTO
|
|
|
- Aurora Fidalgo Villalba
- hace 8 años
- Vistas:
Transcripción
1 1. NOMBRE DEL MEDICAMENTO Miflonide 200 microgramos polvo para inhalación (cápsula dura) Miflonide 400 microgramos polvo para inhalación (cápsula dura) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula de 200 microgramos contiene 230 microgramos de budesonida y libera 200 microgramos de budesonida por la boquilla del dispositivo cuando se utiliza con el Aerolizer (nombre del dispositivo inhalador). Cada cápsula de 400 microgramos contiene 460 microgramos de budesonida y libera 400 microgramos de budesonida por la boquilla del dispositivo cuando se utiliza con el Aerolizer (nombre del dispositivo inhalador). Excipientes: Lactosa monohidrato: mg por cápsula de 200 microgramos y 24,54 mg por cápsula de 400 microgramos. Para consultar la lista completa de excipientes, ver sección FORMA FARMACÉUTICA Polvo para inhalación (cápsula dura). La cápsula de 200 microgramos posee una tapa opaca de color rosa pálido y un cuerpo transparente incoloro y lleva impreso el logotipo BUDE 200. La cápsula de 400 microgramos posee una tapa opaca de color rosa y un cuerpo transparente incoloro y lleva impreso el logotipo BUDE DATOS CLÍNICOS 4.1 Indicaciones terapéuticas Miflonide está indicado en pacientes asmáticos para el control antiinflamatorio a largo plazo del asma persistente, incluyendo profilaxis de las exacerbaciones agudas del asma. 4.2 Posología y forma de administración La dosificación deberá ajustarse individualmente a la dosis eficaz menor requerida para el control de los síntomas del asma. Al pasar un paciente desde un dispositivo de inhalación a otro debe reajustarse individualmente la dosis. Se recomienda después de cada administración de una dosis, enjuagar completamente la boca con agua y posteriormente escupir el agua del enjuague con el fin de prevenir ronquera, irritación de la garganta e infección por candida en la boca y la garganta, así como para reducir posiblemente el riesgo de efectos sistémicos. Los pacientes deben ser informados de que las cápsulas son sólo para uso por inhalación y no para ser tragadas (ver sección 4.4). El contenido de la cápsula se inhala mediante un dispositivo inhalador denominado Aerolizer. La dosis más baja en una sola cápsula es de 200 microgramos. Si se requiere una dosis única inferior a 200 microgramos, no puede utilizarse este producto. Miflonide está contraindicado en niños menores de 6 años de edad (ver sección 4.3). Adultos: El tratamiento de adultos con asma leve puede iniciarse con la dosis mínima efectiva de 200 microgramos una vez al día.
2 La dosis recomendada habitualmente es de microgramos al día repartidos en dos dosis. La dosis de mantenimiento deberá ajustarse a la dosis menor a la que se mantiene el control eficaz del asma. Se deberá instruir a los pacientes sobre el empleo adecuado del Aerolizer de acuerdo con las instrucciones de uso para el paciente, a fin de asegurar que el fármaco alcanza las zonas del pulmón deseadas. Poblaciones especiales Población pediátrica (a partir de 6 años): Debido a la ausencia de experiencia clínica en niños menores de 6 años de edad, Miflonide no debe utilizarse en este grupo de edad. El tratamiento de niños con asma leve debe iniciarse con 200 microgramos una vez al día. La dosis recomendada habitualmente es de microgramos al día dividida en dos dosis. En casos graves de asma pueden ser necesarios hasta 800 microgramos al día en dosis divididas. La dosis de mantenimiento deberá ajustarse a la dosis menor a la que se mantiene el control eficaz del asma. Pacientes mantenidos con glucocorticosteroides orales Miflonide puede permitir la sustitución o reducción significativa de la dosis de glucocorticosteroides manteniendo el control del asma. En el momento del paso desde esteroides orales a Miflonide, el paciente deberá encontrarse en una fase relativamente estable. Se deberá administrar una dosis alta de budesonida en combinación con el esteroide oral previamente empleado durante aprox. 10 días. Posteriormente, la dosis oral deberá reducirse de manera gradual (por ejemplo en 2,5 mg de prednisolona o el equivalente cada mes) al nivel más bajo posible. En muchos casos, es posible sustituir completamente los esteroides orales con Miflonide. Para más información sobre la retirada de los corticosteroides, ver sección 4.4. Pacientes con insuficiencia renal: No se dispone de datos que sugieran un ajuste de dosis en pacientes con insuficiencia renal. En base a los datos farmacocinéticos con budesonida oral es improbable que la exposición sistémica del fármaco pueda verse alterada a un nivel clínicamente significativo en dichos pacientes (ver sección 5). Pacientes con insuficiencia hepática: No se dispone de datos que sugieran un ajuste de dosis en pacientes con insuficiencia hepática. Sin embargo, debido a que la budesonida se elimina predominantemente por metabolismo hepático, se deberá tener precaución con el uso de Miflonide en pacientes con insuficiencia hepática grave. En base a los datos farmacocinéticos con budesonida oral, es improbable que los pacientes con insuficiencia hepática de leve a moderada muestren una alteración clínicamente significativa en la exposición al fármaco (ver sección 5). Pacientes de edad avanzada (mayores de 65 años): No existe evidencia que sugiera que los pacientes mayores de 65 años requieran una dosis diferente de la utilizada en pacientes adultos más jóvenes. 4.3 Contraindicaciones No deberá utilizarse en niños menores de 6 años. Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1. Está contraindicado el uso en pacientes con tuberculosis pulmonar activa. 4.4 Advertencias y precauciones especiales de empleo
3 Naturaleza profiláctica del tratamiento Debe advertirse a los pacientes de la naturaleza profiláctica del tratamiento con budesonida por inhalación y que debe tomarse de manera regular cada día, incluso en los pacientes asintomáticos, para obtener un control óptimo del asma. Budesonida no alivia un broncospasmo agudo, y tampoco es apropiada para el tratamiento primario del status asmático ni otros episodios asmáticos agudos. Condiciones concomitantes Se requiere especial precaución en pacientes con tuberculosis pulmonar quiescente y en pacientes con infecciones fúngicas o virales en las vías respiratorias. Estos pacientes deben ser controlados cuando se traten con Miflonide como tratamiento de mantenimiento en asma. Es necesario tener especial precaución en el tratamiento de pacientes con trastornos pulmonares como bronquiectasias y neumoconiosis debido a la posibilidad de infecciones fúngicas. Exacerbaciones asmáticas Las exacerbaciones agudas del asma pueden necesitar un aumento de la dosis de budesonida o un tratamiento adicional con una tanda corta de corticosteroides orales y/o un antibiótico, si existe infección. Budesonida no está destinada para un alivio rápido de los episodios agudos del asma donde se requiere un broncodilatador inhalado de corta duración. Broncoespasmo paradójico Al igual que con otros tratamientos por inhalación, en raras ocasiones se puede producir broncoespasmo paradójico con un aumento inmediato en las sibilancias. Si esto se produce, deberá interrumpirse inmediatamente el tratamiento con budesonida inhalada, se evaluará al paciente y se le instaurará un tratamiento alternativo si es necesario. Se aconsejará a los pacientes que contacten con su médico si el asma empeora (mayor frecuencia de tratamiento con broncodilatador inhalado de corta duración o síntomas respiratorios persistentes), se deberá reevaluar al paciente así como la necesidad de aumentar la terapia antiinflamatoria, asimismo debe considerarse un aumento de la dosis de corticosteriode inhalado u oral. Efectos sistémicos En particular, cuando se prescriben dosis elevadas durante periodos prolongados de tiempo, pueden presentarse los efectos sistémicos de los corticosteroides inhalados. Sin embargo, es menos probable que aparezcan estos efectos con tratamiento vía inhalatoria que cuando se administran corticosteroides orales. Los posibles efectos sistémicos incluyen, hiperadrenocorticismo/síndrome de Cushing, características cushingoides, supresión adrenal, retraso del crecimiento en niños y adolescentes, disminución de la densidad mineral ósea, cataratas, glaucoma y mas raramente, una serie de efectos psicológicos o del comportamiento, incluyendo hiperactividad psicomotora, alteraciones del sueño, ansiedad, depresión o agresión (principalmente en niños). Por lo tanto, es importante que la dosis de corticosteroides inhalados se fije a la dosis menor a la que se mantiene el control eficaz del asma. La función hepática reducida afecta a la eliminación de los corticosteroides, causando una menor proporción de eliminación y una exposición sistémica más elevada. Se debe prestar atención a los posibles efectos secundarios sistémicos. Efecto sobre el crecimiento Se recomienda controlar regularmente la estatura de los niños que reciben tratamiento prolongado con corticosteroides inhalados. Si se retrasa el crecimiento, deberá reevaluarse el tratamiento con el objetivo de reducir la dosis de corticosteroide inhalado, si es posible, hasta la dosis menor a la que se mantiene el control eficaz del asma. Se deben sopesar cuidadosamente los beneficios del tratamiento con corticosteroides y los posibles riesgos de retraso del crecimiento. Además, se debe considerar
4 remitir al paciente a un especialista respiratorio pediátrico. Se desconocen los efectos a largo plazo de esta disminución en la velocidad de crecimiento asociada con corticoides inhalados, incluyendo el impacto sobre la estatura final en la edad adulta. No se ha estudiado adecuadamente el potencial para alcanzar el crecimiento esperado al interrumpir el tratamiento con corticoides inhalados vía oral. Medicaciones concomitantes Deberá evitarse el tratamiento concomitante con itraconazol, ketoconazol, ritonavir u otros inhibidores potentes del CYP3A4 (p.ej. algunos antimicóticos azoles, inhibidores de la proteasa del VIH y antibióticos macrólidos) (ver sección 4.5). El tratamiento prolongado con dosis elevadas de corticosteroides inhalados, particularmente superiores a la dosis recomendada, puede dar lugar a una supresión adrenal clínicamente significativa. Estos pacientes pueden presentar signos y síntomas de insuficiencia adrenal cuando se exponen a estrés severo. Se deberá considerar una cobertura adicional con corticosteroides sistémicos durante periodos de stress o de cirugía electiva. Deberá controlarse regularmente la función adrenal al reducir la dosis de esteroide sistémico cuando se pasan pacientes desde corticosteroides sistémicos a corticosteroides inhalados y en aquellos pacientes en los que las dosis elevadas se utilizan durante periodos prolongados. Las cápsulas de 200 microgramos contienen 24,77 mg de lactosa monohidrato y las cápsulas de 400 microgramos contienen 24,54 mg de lactosa monohidrato. Estas cantidades no provocan reacciones de intolerancia a la lactosa. Puede provocar reacciones alérgicas en pacientes con alergia a la proteína de la leche de vaca. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp (insuficiencia observada en ciertas poblaciones de Laponia) o malabsorción de glucosa o galactosa no deben usar este medicamento. Puede producirse candidiasis oral durante el tratamiento con corticosteroides inhalados. Esta infección puede necesitar tratamiento con terapia antifúngica adecuada y en algunos pacientes puede ser necesaria la interrupción del tratamiento (ver también sección 4.2). Precauciones especiales: Pacientes que inician tratamiento con esteroides Habitualmente se alcanza un efecto terapéutico en 10 días. En pacientes con secreción excesiva de moco en los bronquios, se puede administrar inicialmente un régimen corto adicional de corticosteroides orales (aprox. 2 semanas). Pacientes corticodependientes En el momento del paso desde esteroides orales a Miflonide, el paciente deberá encontrarse en una fase relativamente estable. Se deberá administrar una dosis alta de budesonida en combinación con el esteroide oral previamente empleado durante aprox. 10 días. Posteriormente, la dosis oral deberá reducirse de manera gradual (por ejemplo en 2,5 mg de prednisolona o el equivalente cada mes) al nivel más bajo posible. En muchos casos, es posible sustituir completamente los esteroides orales con Miflonide. Durante el paso del tratamiento con esteroides orales a Miflonide ciertos pacientes experimentarán un efecto esteroideo general reducido. Los síntomas alérgicos previos como rinitis y eczema pueden volver a aparecer y los pacientes pueden verse alterados con letargia, dolor muscular o articular y, a veces, náuseas y vómitos. En estos casos, puede ser necesario un apoyo médico activo con el fin de animar a los pacientes a continuar el tratamiento con Miflonide y continuar la retirada de los esteroides orales, a menos que no esté justificado médicamente. Las alergias deberán tratarse con antihistamínicos y/o preparados tópicos, incluyendo corticosteroides tópicos. Un aumento temporal de la dosis de esteroide oral también puede estar justificado. El
5 tratamiento con corticosteroides sistémicos suplementarios o budesonida no debe interrumpirse bruscamente. Debe tenerse especial precaución durante los primeros meses de cambio desde corticosteroides sistémicos a budesonida, con el fin de asegurar que la reserva adrenocortical del paciente es adecuada para situaciones de crisis específicas como son traumatismos, cirugía o infecciones graves. Vía de administración incorrecta Existen informes de pacientes que han ingerido cápsulas de Miflonide por error, en lugar de colocarlas en el dispositivo para inhalación Aerolizer. La mayoría de estas ingestiones no estuvieron asociadas con efectos adversos. Los profesionales sanitarios deben informar a los pacientes sobre el uso correcto de Miflonide (ver sección 4.2). Si el paciente en tratamiento con Miflonide no presenta mejoría en la respiración, el profesional sanitario debe preguntar al paciente como está usando Miflonide. 4.5 Interacción con otros medicamentos y otras formas de interacción Agentes que actúan en la inhibición de la CYP3A4 La principal vía del metabolismo de budesonida y también la causa de un metabolismo de primer paso importante es la catalización por el CYP3A4. La administración concomitante de los inhibidores conocidos del CYP3A4 (p.ej. itraconazol, ketoconazol, ritonavir, saquinavir, nelfinavir, amiodarona, claritromicina, telitromicina y eritromicina) puede incrementar de forma importante la exposición sistémica a budesonida (ver sección 4.4). Deberá evitarse el uso concomitante de inhibidores potentes del CYP3A4. Si esto no es posible, el intervalo de tiempo entre las administraciones de los fármacos que interaccionan deberá ser tan largo como sea posible y deberá controlarse la función corticoadrenal. También puede considerarse una reducción de la dosis de budesonida. Los datos limitados existentes sobre esta interacción para dosis elevadas de budesonida inhalada indican que pueden producirse aumentos importantes en los niveles plásmaticos (un promedio de 4 veces) si se administra el itraconazol, 200 mg una vez al día, concomitantemente con budesonida inhalada (dosis única de 1000 µg). Agentes que actúan en la inducción de la CYP3A4 La administración concomitante de inductores potentes del CYP3A4 (p.ej. rifampicina) incrementa el metabolismo de budesonida y disminuye su exposición sistémica (ver sección 5.2). Se desconoce si la exposición pulmonar está afectada. Se ha observado aumento de las concentraciones plasmáticas y del efecto de los corticosteroides en mujeres también tratadas con estrógenos y anticonceptivos esteroideos, sin embargo no se ha observado efecto con budesonida y la ingesta concomitante de la combinación de anticonceptivos orales de dosis bajas. Debido a que la función adrenal puede estar suprimida, una prueba de estimulación con ACTH para el diagnóstico de insuficiencia hipofisaria puede mostrar falsos resultados (valores bajos). 4.6 Embarazo y lactancia Embarazo Los datos de aproximadamente embarazos expuestos indicaron que no había un mayor riesgo teratogénico asociado con el uso de budesonida inhalada. Los glucocorticoides demostraron en estudios en animales que inducen malformaciones (ver sección 5.3). No es probable que esto sea relevante para humanos teniendo en cuenta las dosis de inhalación recomendadas. Los estudios en animales han identificado asimismo, una participación del exceso de glucocorticoides prenatal en el mayor riesgo de retraso en el crecimiento intrauterino, enfermedad cardiovascular en el adulto y cambios permanentes en la densidad del receptor de glucocorticoides, recambio de neurotransmisores y comportamiento a exposiciones por debajo del intervalo de dosis teratogénica.
6 Deberá evitarse la administración durante el embarazo a menos que el beneficio esperado supere el riesgo potencial. Si el tratamiento con glucocorticosteroides durante el embarazo es inevitable, son de elección los corticosteroides inhalados debido a su menor efecto sistémico en comparación con dosis equipotentes antiasmáticas de glucocorticosteroides orales. Deberá utilizarse la dosis mínima efectiva de budesonida necesaria para mantener un control adecuado del asma. Lactancia La budesonida se excreta en la lecha materna. Sin embargo, a las dosis terapéuticas de budesonida no se prevén efectos sobre el lactante. La budesonida puede utilizarse durante la lactancia. El tratamiento de mantenimiento con budesonida inhalada (200 ó 400 microgramos dos veces al día) en mujeres asmáticas en periodo de lactancia dió como resultado una exposición sistémica insignificante a budesonida en niños lactantes. En un estudio farmacocinético, la dosis diaria estimada en lactantes fue del 0,3% de la dosis diaria materna para ambos niveles de dosis, y la concentración plasmática media en lactantes se estimó en el 0,17% de las concentraciones observadas en el plasma materno, asumiendo una biodisponibilidad oral completa en lactantes. Las concentraciones de budesonida en las muestras de plasma de lactantes fueron todas inferiores al límite de cuantificación. En base a los datos de budesonida inhalada y al hecho de que la budesonida exhibe propiedades farmacocinéticas lineales en los intervalos de dosis terapéutica después de la administración nasal, inhalada, oral y rectal, se espera que la exposición a lactantes, a dosis terapéuticas de budesonida, sea baja. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. Se considera poco probable que se presente un efecto de este tipo. 4.8 Reacciones adversas Las reacciones adversas están agrupadas de acuerdo con la frecuencia, que se define como: muy frecuente ( 1/10), frecuente ( 1/100 a 1/10), poco frecuente ( 1/1.000 a 1/100), rara ( 1/ a <1/1.000), muy rara (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles). La tabla 1 contiene las reacciones adversas comunicadas de pacientes tratados con budesonida, agrupadas de acuerdo con las clases de órganos estándar de meddra. Infecciones e infestaciones Frecuente Candidiasis orofaríngea Trastornos del sistema inmunológico Reacciones de hipersensibilidad inmediata y retardada incluyendo erupción cutánea, dermatitis de contacto, urticaria, angioedema, prurito y reacción anafiláctica Trastornos endocrinos Signos y síntomas de efectos corticosteroideos sistémicos, incluyendo supresión adrenal, retraso del crecimiento*, hipoadrenocorticismo, hiperadrenocorticismo, síndrome de Cushing Trastornos psiquiátricos Frecuencia no conocida Trastornos oculares Agitación, nerviosismo, depresión, cambios en el comportamiento (principalmente en niños) Alteraciones del sueño, ansiedad, hiperactividad psicomotora, agresión Glaucoma, cataratas
7 Trastornos respiratorios, torácicos y mediastínicos Frecuente Disfonía, tos, ronquera, irritación de garganta Broncospasmo, incluyendo broncoespasmo paradójico Trastornos de la piel y del tejido subcutáneo Hematomas Trastornos musculoesqueléticos y del tejido conjuntivo Disminución de la densidad mineral ósea *ver población pediátrica a continuación Existe un riesgo incrementado de neumonía en pacientes con tratamiento de inicio con corticosteroides inhalados para EPOC diagnosticada recientemente. Sin embargo, una evaluación ponderada de 8 ensayos clínicos agrupados incluyendo pacientes con EPOC tratados con budesonida y pacientes randomizados a tratamientos no corticosteroideos inhalados, no demostró un mayor riesgo de neumonía. Los resultados de los 7 primeros de los 8 ensayos se han publicado como un metaanálisis. Población pediátrica Debido al riesgo de retraso en el crecimiento en la población pediátrica, debe controlarse el crecimiento tal y como se describe en la sección 4.4. Ronquera e irritación de la garganta que es reversible y desaparece al interrumpir el tratamiento o al reducir la dosis y/o descansar la voz. Si se produce infección por candida en la orofaringe, se aconseja a los pacientes que se enjuaguen la boca con agua o que se cepillen los dientes tras cada administración. En la mayoría de los casos, esta condición responde a una terapia antifúngica tópica sin interrumpir el tratamiento con Budesonida. Al igual que con otros tratamientos administrados por inhalación, es posible la aparición de un broncospamo paradójico. Si se presentara, se deberá interrumpir inmediatamente el tratamiento con budesonida e instituir una terapia alternativa, si es necesario, y debe administrarse inmediatamente tratamiento con un broncodilatador inhalado de acción rápida. Notificación de sospechas de reacciones adversas Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: Sobredosis La toxicidad aguda de budesonida es baja. La inhalación de dosis elevadas del fármaco durante un corto periodo de tiempo puede llevar a la supresión de la función hipotalámico-hipófiso-suprarrenal (HPA). No es necesario tomar ninguna acción especial de emergencia. El tratamiento con budesonida debe continuarse a la dosis menor a la que se mantiene el control eficaz del asma. 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas Grupo farmacoterapéutico: Otros medicamentos para alteraciones obstructivas de las vías respiratorias, inhalatorios; Glucocorticoides. Código ATC: R 03 BA 02
8 Budesonida es un corticosteroide con acción tópica. Al igual que con otros glucocorticoides por inhalación, la budesonida ejerce su efecto farmacológico a través de la interacción con receptores de glucocorticoides intracelulares. Se inhibe la producción de diferentes citocinas, quimiocinas, enzimas y moléculas de adhesión celular. El máximo beneficio del tratamiento con budesonida polvo para inhalación se alcanza en aproximadamente 10 días tras el inicio del tratamiento. El uso regular de la budesonida reduce la inflamación crónica de los pulmones asmáticos. Por lo tanto, la budesonida mejora la función pulmonar y los síntomas del asma, reduce la hiperreactividad bronquial y previene las exacerbaciones del asma. Población pediátrica Si bien no hay datos específicos disponibles para Miflonide, los datos de budesonida inhalada liberada a través de diferentes tipos de inhaladores en 157 niños de 5-16 años no se asoció con una mayor incidencia de catarata subcapsular posterior. Influencia sobre la concentración de cortisol en plasma Los estudios realizados en voluntarios sanos con budesonida han mostrado efectos relacionados con la dosis en plasma y cortisol urinario. A la dosis recomendada, los datos de otros productos con budesonida inhalada demostraron, de forma significativa, menos efecto sobre la función adrenal que prednisona 10 mg, como se demostró por la prueba de ACTH. 5.2 Propiedades farmacocinéticas Absorción La cantidad de budesonida depositada en los pulmones se absorbe rápida y completamente. Tras la administración se alcanza la concentración máxima en 5-10 minutos. Aproximadamente el 25-30% de una dosis única se deposita en los pulmones. Únicamente del 10 al 13% de la fracción tragada de una dosis inhalada es biodisponible debido al metabolismo presistémico significativo en el hígado. Distribución La unión de budesonida a proteínas plasmáticas es del 85 al 90% por encima del intervalo de concentración de 1 a 100 nmol. La budesonida se distribuye ampliamente en los tejidos y su volumen de distribución en el estado estacionario es de 183 a 301 l aproximadamente. La budesonida pasa a la leche materna, con una proporción de concentración de la leche al plasma de 0,46 aproximadamente. La dosis diaria estimada en lactantes es del 0,3% de la dosis diaria materna, y la concentración plasmática media en lactantes se estimó en 1/600avo de las concentraciones observadas en el plasma materno, asumiendo una biodisponibilidad oral completa en lactantes. Biotransformación La budesonida no se metaboliza en los pulmones. Tras la absorción, la budesonida se metaboliza extensamente en el hígado y se convierte en metabolitos (incluyendo 6ß- hidroxibudesonida y 16 hidroxiprednisolona) con baja actividad de glucocorticoide. La principal vía de metabolismo de budesonida es vía CYP3A4 y puede estar afectada por inhibidores conocidos o inductores de esta enzima (ver sección 4.5). Eliminación En voluntarios humanos que inhalaron budesonida radiomarcada (mediante un inhalador contador de dosis), el 32% aproximadamente de la dosis liberada se recuperó en la orina y el 15% en las heces. Tras la inhalación, no se detectó budesonida en la orina donde se detectó como 16 - hidroxiprednisolona. La budesonida muestra un aclaramiento plasmático elevado (84 l/h) tras la dosis intravenosa. La semivida de eliminación de budesonida fue de 2,8 a 5 h aproximadamente.
9 Poblaciones especiales Pacientes de edad avanzada No se ha estudiado la farmacocinética de budesonida cuando se administra como Miflonide en pacientes de edad avanzada. Sin embargo, en base a los datos limitados en pacientes mayores de 65 años, sugieren que no hay diferencia significativa en la farmacocinética en pacientes de edad avanzada comparado con adultos más jóvenes, después de la administración oral e intravenosa de budesonida. Población pediátrica No se ha estudiado la farmacocinética de budesonida cuando se administra como Miflonide en la población pediátrica. Sin embargo, los datos con otros medicamentos de budesonida inhalada sugieren que el aclaramiento normalizado por el peso corporal en niños mayores de 3 años es aproximadamemnte el 50% más elevado comparado con adultos. Pacientes con insuficiencia hepática No se ha estudiado la farmacocinética de budesonida inhalada en pacientes con insuficiencia hepática. Sin embargo, se notificó que la biodisponibilidad sistémica de budesonida era 2,5 veces más elevada después de la administración oral en pacientes con cirrosis comparado con controles sanos. Se notificó que la insuficiencia hepática leve tiene un ligero efecto sobre la exposición sistémica de budesonida oral. 5.3 Datos preclínicos sobre seguridad Los datos preclínicos obtenidos de los estudios de toxicidad de dosis repetida, así como de los estudios de sensibilización de la piel, mutagenicidad y carcinogenicidad con budesonida no revelaron riesgo específico para humanos a la dosis terapéutica establecida. Los glucocorticoides, incluido budesonida, producen efectos teratogénicos en animales, incluyendo fisura palatina y anormalidades en el esqueleto. Se considera improbable que se produzcan efectos similares en humanos a la dosis terapéutica. 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes Lactosa monohidrato (que contiene pequeñas cantidades de proteínas de la leche) 6.2 Incompatibilidades No aplicable. 6.3 Período de validez 3 años 6.4 Precauciones especiales de conservación No almacenar por encima de 25ºC. 6.5 Naturaleza y contenido del envase Tiras de blister de PVC/PVDC/Aluminio de 1x, 2x, 3x, 5x, 6x, 10x, 12x, 18x, 20x ó 50x10 cápsulas con o sin inhalador.
10 Tiras de blister de PVC/PVDC/Aluminio de 1x, 2x, 3x, 4x, 6x, 8x, 10x, 12x ó 20x14 cápsulas con o sin inhalador. Envases de PP con cierre de PE con 60 ó 120 cápsulas. Puede que no se comercialicen todos los envases. 6.6 Precauciones especiales de eliminación y otras manipulaciones Es importante que el paciente comprenda que la cápsula de gelatina puede, muy ocasionalmente, romperse en pequeños trozos de gelatina que llegan a la boca o a la garganta tras la inhalación. Puede asegurarse al paciente que la gelatina se ablandará en la boca y que puede tragarse. La tendencia de rotura de la cápsula se minimiza si no se perfora la cápsula más de una vez. Solamente deberá extraerse la cápsula del blister inmediatamente antes de su uso. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Novartis Farmacéutica, S.A. Gran Via de les Corts Catalanes, Barcelona 8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN Miflonide 200 microgramos: Miflonide 400 microgramos: FECHA DE LA PRIMERA AUTORIZACIÓN/REVALIDACIÓN DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Fecha de la primera autorización: 21/Abril/1999 Fecha de la última revalidación: Junio FECHA DE LA REVISIÓN DEL TEXTO Septiembre 2014
FICHA TÉCNICA. STREPSILS pastillas para chupar sabor miel y limón
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor miel y limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor miel y limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO BECLOASMA (Dipropionato de beclometasona) Aerosol 50 mcg/cada inhalación
 Nombre del producto: RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO BECLOASMA (Dipropionato de beclometasona) Forma farmacéutica: Fortaleza: Presentación: Aerosol 50 mcg/cada inhalación Estuche por un frasco
Nombre del producto: RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO BECLOASMA (Dipropionato de beclometasona) Forma farmacéutica: Fortaleza: Presentación: Aerosol 50 mcg/cada inhalación Estuche por un frasco
FICHA TÉCNICA. Pastillas circulares de color rosa con sabor a fresa y el icono de Strepsils grabado en ambos lados.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor fresa 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor fresa 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
FICHA TÉCNICA. Excipientes con efecto conocido: 1,38 g de sacarosa y 1,10 g de glucosa.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor ciruela 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor ciruela 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO, ETIQUETADO Y PROSPECTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO, ETIQUETADO Y PROSPECTO 1 20110719r FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 2 20110719r 1. NOMBRE DEL MEDICAMENTO Alvesco
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO, ETIQUETADO Y PROSPECTO 1 20110719r FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 2 20110719r 1. NOMBRE DEL MEDICAMENTO Alvesco
FICHA TÉCNICA. Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTOS FICHA TÉCNICA Loratadina NORMON 10 mg Comprimidos EFG. Loratadina NORMON 1 mg/ml Jarabe EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina.
1. NOMBRE DEL MEDICAMENTOS FICHA TÉCNICA Loratadina NORMON 10 mg Comprimidos EFG. Loratadina NORMON 1 mg/ml Jarabe EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina.
Indicaciones Asma bronquial, en pacientes que previamente no hayan respondido a terapia con broncodilatadores y/o antialérgicos.
 1 Pulmicort 0,5 mg/ml suspensión para nebulización budesonida Suspensión para nebulización Composición Cada dosis unitaria (2 ml) contiene: budesonida 1 mg. Excipientes: edetato de disodio, cloruro de
1 Pulmicort 0,5 mg/ml suspensión para nebulización budesonida Suspensión para nebulización Composición Cada dosis unitaria (2 ml) contiene: budesonida 1 mg. Excipientes: edetato de disodio, cloruro de
Cuida. y previene el asma INSPIRA PROGRAMA DE SALUD COMPLETO Y GRATUITO ESPACIOINSPIRA ESPACIO. Pregunta a tu farmacéutico e inscríbete
 a Novartis company ESPACIO INSPIRA PROGRAMA DE SALUD COMPLETO Y GRATUITO Impartido por un enfermero ESPACIOINSPIRA Respirar. Innovar. Respirar. Innovar. Pregunta a tu farmacéutico e inscríbete TU FARMACIA
a Novartis company ESPACIO INSPIRA PROGRAMA DE SALUD COMPLETO Y GRATUITO Impartido por un enfermero ESPACIOINSPIRA Respirar. Innovar. Respirar. Innovar. Pregunta a tu farmacéutico e inscríbete TU FARMACIA
FICHA TECNICA 1. DENOMINACIÓN DEL MEDICAMENTO
 agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. DENOMINACIÓN DEL MEDICAMENTO PULMICORT TURBUHALER 100 microgramos polvo para inhalación PULMICORT TURBUHALER 200 microgramos polvo
agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. DENOMINACIÓN DEL MEDICAMENTO PULMICORT TURBUHALER 100 microgramos polvo para inhalación PULMICORT TURBUHALER 200 microgramos polvo
FICHA TÉCNICA. Cada comprimido contiene 10 mg de Cetirizina (DOE) dihidrocloruro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Coulergin 10 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de Cetirizina (DOE) dihidrocloruro.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Coulergin 10 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de Cetirizina (DOE) dihidrocloruro.
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mucosan 30 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 30 mg de ambroxol hidrocloruro.
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mucosan 30 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 30 mg de ambroxol hidrocloruro.
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO (08/03/2012)
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO (08/03/2012) 1. NOMBRE DEL MEDICAMENTO Lizipadol 20 mg pastillas para chupar 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una pastilla para
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO (08/03/2012) 1. NOMBRE DEL MEDICAMENTO Lizipadol 20 mg pastillas para chupar 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una pastilla para
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 1. NOMBRE DEL MEDICAMENTO POSTINOR 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Excipientes en el apartado 6.1. Comprimidos. Los comprimidos son
1. NOMBRE DEL MEDICAMENTO POSTINOR 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Excipientes en el apartado 6.1. Comprimidos. Los comprimidos son
LLD Abreviado de XANAX
 LLD Abreviado de XANAX Versión: 8.0 Fecha: 12 Diciembre de 2013 Aprobación ARCSA: 3 de Mayo de 2014 1. Presentación: Cada tableta de liberación inmediata contiene XANAX 0.25 mg tabletas: Reg.San. 29637-02-11
LLD Abreviado de XANAX Versión: 8.0 Fecha: 12 Diciembre de 2013 Aprobación ARCSA: 3 de Mayo de 2014 1. Presentación: Cada tableta de liberación inmediata contiene XANAX 0.25 mg tabletas: Reg.San. 29637-02-11
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
Cada comprimido contiene 625 mg de glucosamina (en forma de hidrocloruro de glucosamina)
 1. DENOMINACIÓN DEL MEDICAMENTO Glucomed 625 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 625 mg de glucosamina (en forma de hidrocloruro de glucosamina) Para la lista
1. DENOMINACIÓN DEL MEDICAMENTO Glucomed 625 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 625 mg de glucosamina (en forma de hidrocloruro de glucosamina) Para la lista
FICHA TÉCNICA. Cada cápsula contiene: Metilcelulosa... 500 mg. Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Muciplazma 500 mg cápsulas duras FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Metilcelulosa... 500 mg Para consultar la lista completa de excipientes
1. NOMBRE DEL MEDICAMENTO Muciplazma 500 mg cápsulas duras FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Metilcelulosa... 500 mg Para consultar la lista completa de excipientes
FICHA TÉCNICA. Carbocisteína 50 mg
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO cinfamucol carbocisteína 50 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Carbocisteína 50 mg Excipientes: maltitol líquido (E-965):
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO cinfamucol carbocisteína 50 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Carbocisteína 50 mg Excipientes: maltitol líquido (E-965):
FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL
 FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Analgésico y antipirético (antitérmico, que reduce la fiebre). 1.2 Cómo actúa este fármaco: Inhibe un enzima que
FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Analgésico y antipirético (antitérmico, que reduce la fiebre). 1.2 Cómo actúa este fármaco: Inhibe un enzima que
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Clarityne 10 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina.
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Clarityne 10 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina.
FICHA TÉCNICA. Fluticasona Teva 50 microgramos suspensión para pulverización nasal
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fluticasona Teva 50 microgramos suspensión para pulverización nasal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Descripción general Fluticasona Teva 50 microgramos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fluticasona Teva 50 microgramos suspensión para pulverización nasal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Descripción general Fluticasona Teva 50 microgramos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada mililitro contiene 50 mg de carbocisteína. Para consultar la lista completa de excipientes,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada mililitro contiene 50 mg de carbocisteína. Para consultar la lista completa de excipientes,
4.2 Posología y forma de administración
 1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
Repafet. Rupatadina Tabletas. Rupatadina II.- DENOMINACIÓN GENÉRICA: III.- FORMA FARMACÉUTICA Y FORMULACIÓN:
 Repafet Rupatadina Tabletas II.- DENOMINACIÓN GENÉRICA: Rupatadina III.- FORMA FARMACÉUTICA Y FORMULACIÓN: Cada tableta contiene: Fumarato de Rupatadina equivalente a... 10 mg de Rupatadina Excipiente
Repafet Rupatadina Tabletas II.- DENOMINACIÓN GENÉRICA: Rupatadina III.- FORMA FARMACÉUTICA Y FORMULACIÓN: Cada tableta contiene: Fumarato de Rupatadina equivalente a... 10 mg de Rupatadina Excipiente
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aerosona 125 microgramos/inhalación suspensión para inhalación en envase a presión Aerosona 250 microgramos/inhalación suspensión para inhalación en envase a presión
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aerosona 125 microgramos/inhalación suspensión para inhalación en envase a presión Aerosona 250 microgramos/inhalación suspensión para inhalación en envase a presión
FICHA TÉCNICA. Glucosa
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA NOMBRE DEL MEDICAMENTO Sueroral Hiposódico. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada sobre contiene: COMPONENTES CANTIDADES mmol/l
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA NOMBRE DEL MEDICAMENTO Sueroral Hiposódico. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada sobre contiene: COMPONENTES CANTIDADES mmol/l
Tratamiento tópico de la psoriasis en placas de leve a moderadamente grave (psoriasis vulgar) con hasta un 35% de la superficie corporal afectada.
 agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO Silkis 3 microgramos/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 3 microgramos de
agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO Silkis 3 microgramos/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 3 microgramos de
FICHA TÉCNICA. Glucosamina Teva 1.500 mg polvo para solución oral EFG
 1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
GLUCOSAMINA NORMON 1500 mg Polvo para solución oral EFG.
 1. NOMBRE DEL MEDICAMENTO GLUCOSAMINA NORMON 1500 mg Polvo para solución oral EFG. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada sobre contiene 1.500 mg de glucosamina sulfato como 1.884 mg de glucosamina
1. NOMBRE DEL MEDICAMENTO GLUCOSAMINA NORMON 1500 mg Polvo para solución oral EFG. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada sobre contiene 1.500 mg de glucosamina sulfato como 1.884 mg de glucosamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CETIRIZINA 10 mg COMPRIMIDOS RECUBIERTOS ANTIHISTAMINICO Página 1 CETIRIZINA 10 mg Comprimidos Recubiertos Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CETIRIZINA 10 mg COMPRIMIDOS RECUBIERTOS ANTIHISTAMINICO Página 1 CETIRIZINA 10 mg Comprimidos Recubiertos Principio
ALERGIA A MEDICAMENTOS
 ALERGIA A MEDICAMENTOS 1 QUE REACCIONES ADVERSAS PUEDEN CAUSAR LOS MEDICAMENTOS? Los medicamentos tienen como función curar enfermedades pero sin embargo en ocasiones pueden causar problemas. Dentro de
ALERGIA A MEDICAMENTOS 1 QUE REACCIONES ADVERSAS PUEDEN CAUSAR LOS MEDICAMENTOS? Los medicamentos tienen como función curar enfermedades pero sin embargo en ocasiones pueden causar problemas. Dentro de
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Miclast10mg/ml solución cutánea EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Miclast10mg/ml solución cutánea EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución cutánea contiene 10 mg de ciclopirox olamina. Descripción general
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Miclast10mg/ml solución cutánea EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución cutánea contiene 10 mg de ciclopirox olamina. Descripción general
FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO EchinaMed gotas orales en solución 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 1 ml [= 0.905g] contiene: 860 mg de extracto (como tintura) de la parte aérea fresca
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO EchinaMed gotas orales en solución 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 1 ml [= 0.905g] contiene: 860 mg de extracto (como tintura) de la parte aérea fresca
Se recomienda beber un vaso de agua después de cada dosis y abundante líquido durante el día.
 agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FormulaExpec 13,33 mg/ml jarabe sabor miel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Principio
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FormulaExpec 13,33 mg/ml jarabe sabor miel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Principio
FICHA TECNICA. Adultos y niños: Aplicar cinco veces al día aproximadamente cada cuatro horas omitiendo la aplicación de la noche.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
Equino: Alivio de la inflamación y el dolor en trastornos músculo-esqueléticos agudos y crónicos. Alivio del dolor asociado al cólico equino.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
Anticoncepción oral sin estrógenos Qué debes saber?
 Anticoncepción oral sin estrógenos Qué debes saber? Anticoncepción oral sin estrógenos Qué debes saber? Qué es la píldora sin estrógenos? Cómo funciona? Cuándo iniciar el tratamiento con la píldora sin
Anticoncepción oral sin estrógenos Qué debes saber? Anticoncepción oral sin estrógenos Qué debes saber? Qué es la píldora sin estrógenos? Cómo funciona? Cuándo iniciar el tratamiento con la píldora sin
Cada pulverización libera 27,5 microgramos de furoato de fluticasona.
 1. NOMBRE DEL MEDICAMENTO Avamys 27,5 microgramos/pulverización, suspensión para pulverización nasal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada pulverización libera 27,5 microgramos de furoato de fluticasona.
1. NOMBRE DEL MEDICAMENTO Avamys 27,5 microgramos/pulverización, suspensión para pulverización nasal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada pulverización libera 27,5 microgramos de furoato de fluticasona.
Debe utilizarse la dosis eficaz mínima durante el periodo más corto posible a fin de reducir las reacciones adversas.
 ANEXO III 1 ENMIENDAS A INCLUIR EN LAS SECCIONES RELEVANTES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTIENEN NIMESULIDA (FORMULACIONES SISTÉMICAS) El texto añadido aparece
ANEXO III 1 ENMIENDAS A INCLUIR EN LAS SECCIONES RELEVANTES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTIENEN NIMESULIDA (FORMULACIONES SISTÉMICAS) El texto añadido aparece
3. Los medicamentos en el organismo
 3. Los medicamentos en el organismo Un medicamento es una sustancia que se administra con el objeto de provocar algún cambio en el organismo. Después de haber entrado y hasta que salga del cuerpo, el medicamento
3. Los medicamentos en el organismo Un medicamento es una sustancia que se administra con el objeto de provocar algún cambio en el organismo. Después de haber entrado y hasta que salga del cuerpo, el medicamento
Hipersensibilidad al nedocromil sódico o a alguno de los excipientes.
 1. DENOMINACIÓN DEL MEDICAMENTO Tilad 2 mg suspensión para inhalación en envase a presión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Nedocromil sódico. Cada envase contiene 1,4085 % p/p de nedocromil sódico
1. DENOMINACIÓN DEL MEDICAMENTO Tilad 2 mg suspensión para inhalación en envase a presión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Nedocromil sódico. Cada envase contiene 1,4085 % p/p de nedocromil sódico
FICHA TÉCNICA. Emovate crema está indicado para el tratamiento de eczema y dermatitis de todos los tipos, incluyendo:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Emovate crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición por 100 g: Clobetasona, 17-butirato... 0,05 g (0,5 mg/g) Excipientes y agua purificada c.s.p....
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Emovate crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición por 100 g: Clobetasona, 17-butirato... 0,05 g (0,5 mg/g) Excipientes y agua purificada c.s.p....
FICHA TÉCNICA. Budesonida Aldo-Unión 0,25 mg/ml y 0,5 mg/ml suspensión para inhalación por nebulizador
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Budesonida Aldo-Unión 0,25 mg/ml y 0,5 mg/ml suspensión para inhalación por nebulizador 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un mililitro de suspensión contiene
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Budesonida Aldo-Unión 0,25 mg/ml y 0,5 mg/ml suspensión para inhalación por nebulizador 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un mililitro de suspensión contiene
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH)
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH) 1 / 5 1. NOMBRE DEL MEDICAMENTO Lycopodium 12DH, glóbulos 2. COMPOSICIÓN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH) 1 / 5 1. NOMBRE DEL MEDICAMENTO Lycopodium 12DH, glóbulos 2. COMPOSICIÓN
FICHA TÉCNICA. Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125 g Lisozima hidrocloruro...0,100 g Neomicina (sulfato)...
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
FICHA TÉCNICA. Se deberá respetar la dosis diaria recomendada independientemente de la extensión de la alopecia.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA Regaxidil 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA Regaxidil 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
FICHA TÉCNICA. Symbicort Turbuhaler 80 microgramos/4,5 microgramos/inhalación polvo para inhalación
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Symbicort Turbuhaler 80 microgramos/4,5 microgramos/inhalación polvo para inhalación 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis liberada (dosis liberada
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Symbicort Turbuhaler 80 microgramos/4,5 microgramos/inhalación polvo para inhalación 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis liberada (dosis liberada
Cada dosis liberada contiene 400 microgramos de mometasona furoato.
 1. NOMBRE DEL MEDICAMENTO Asmanex Twisthaler 400 microgramos polvo para inhalación 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis liberada contiene 400 microgramos de mometasona furoato. Excipientes
1. NOMBRE DEL MEDICAMENTO Asmanex Twisthaler 400 microgramos polvo para inhalación 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis liberada contiene 400 microgramos de mometasona furoato. Excipientes
Advertencias y precauciones especiales de empleo
 1 - NOMBRE DEL MEDICAMENTO GINKGO MADAUS Extracto de Ginkgo biloba 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Una medida de 1,5 ml contiene: Extracto estandarizado seco de hojas de Ginkgo biloba, obtenido
1 - NOMBRE DEL MEDICAMENTO GINKGO MADAUS Extracto de Ginkgo biloba 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Una medida de 1,5 ml contiene: Extracto estandarizado seco de hojas de Ginkgo biloba, obtenido
FICHA TÉCNICA. Seretide Inhalador 25/50 microgramos/dosis de suspensión para inhalación en envase a presión.
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO Seretide Inhalador 25/50 microgramos/dosis de suspensión para inhalación en envase a presión. Seretide Inhalador 25/125 microgramos/dosis de suspensión para
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO Seretide Inhalador 25/50 microgramos/dosis de suspensión para inhalación en envase a presión. Seretide Inhalador 25/125 microgramos/dosis de suspensión para
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe de Evaluación
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe de Evaluación
1. DENOMINACIÓN DEL MEDICAMENTO BUDESONIDA ALDO-UNION 0,5 mg/ml suspensión para inhalación por nebulizador
 agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO BUDESONIDA ALDO-UNION 0,5 mg/ml suspensión para inhalación por nebulizador
agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO BUDESONIDA ALDO-UNION 0,5 mg/ml suspensión para inhalación por nebulizador
FICHA TÉCNICA. El comprimido es redondo, blanco y marcado con el código NL 1.5 en una cara.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO NorLevo 1500 microgramos comprimido. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 1500 microgramos de levonorgestrel. Excipientes: Lactosa
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO NorLevo 1500 microgramos comprimido. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 1500 microgramos de levonorgestrel. Excipientes: Lactosa
Distraneurine es un hipnótico y sedante de acción breve con efectos anticonvulsivos.
 Distraneurine cápsulas clometiazol Cápsulas Distraneurine es un hipnótico y sedante de acción breve con efectos anticonvulsivos. Composición Cada cápsula de color marrón grisáceo contiene: 192 mg de clometiazol
Distraneurine cápsulas clometiazol Cápsulas Distraneurine es un hipnótico y sedante de acción breve con efectos anticonvulsivos. Composición Cada cápsula de color marrón grisáceo contiene: 192 mg de clometiazol
MÁS QUE UN ESTORNUDO. Preguntas más frecuentes. Con la colaboración de: + que un estornud. www.masqueunestornudo.es. www.portalfarma.
 MÁS QUE UN ESTORNUDO Preguntas más frecuentes Con la colaboración de: www.masqueunestornudo.es www.portalfarma.com Preguntas más frecuentes en la oficina de farmacia A continuación se detallan las preguntas
MÁS QUE UN ESTORNUDO Preguntas más frecuentes Con la colaboración de: www.masqueunestornudo.es www.portalfarma.com Preguntas más frecuentes en la oficina de farmacia A continuación se detallan las preguntas
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO. EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml (que equivale aproximadamente a 25 gotas) contiene como principio activo: Picosulfato
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml (que equivale aproximadamente a 25 gotas) contiene como principio activo: Picosulfato
Calcitonina Almirall 100 UI Solución inyectable Calcitonina sintética de salmón
 Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Prospecto: información para el usuario. INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína
 Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
FICHA TÉCNICA. Cantidad: Los ingredientes activos en 1 ml de VITALIPID INFANTIL corresponden a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VITALIPID INFANTIL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de VITALIPID INFANTIL contiene: Principios activos: Retinolpalmitato (equivalente a Retinol 69
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VITALIPID INFANTIL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de VITALIPID INFANTIL contiene: Principios activos: Retinolpalmitato (equivalente a Retinol 69
FICHA TÉCNICA. Ebastina Kern Pharma 10 mg comprimidos recubiertos con película EFG Ebastina Kern Pharma 20 mg comprimidos recubiertos con película EFG
 1. DENOMINACIÓN DEL MEDICAMENTO FICHA TÉCNICA Ebastina Kern Pharma 10 mg comprimidos recubiertos con película EFG Ebastina Kern Pharma 20 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA
1. DENOMINACIÓN DEL MEDICAMENTO FICHA TÉCNICA Ebastina Kern Pharma 10 mg comprimidos recubiertos con película EFG Ebastina Kern Pharma 20 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA
Anexo III. Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto
 Anexo III Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto Nota: Esta Ficha Técnica o Resumen de las Características del producto y prospecto son
Anexo III Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto Nota: Esta Ficha Técnica o Resumen de las Características del producto y prospecto son
SINALERG Levocetirizina 2.5 mg / 5 ml Jarabe
 SINALERG Levocetirizina 2.5 mg / 5 ml Jarabe SINALERG (LEVOCETIRIZINA 2.5 mg/5 ml) Jarabe Antihistamínico COMPOSICIÓN Cada 100 ml contiene: Levocetirizina diclorhidrato... 0.05 g Excipientes c.s.p. INDICACIONES
SINALERG Levocetirizina 2.5 mg / 5 ml Jarabe SINALERG (LEVOCETIRIZINA 2.5 mg/5 ml) Jarabe Antihistamínico COMPOSICIÓN Cada 100 ml contiene: Levocetirizina diclorhidrato... 0.05 g Excipientes c.s.p. INDICACIONES
FICHA TÉCNICA. Este medicamento contiene 0.00064 mg de dióxido de azufre por sobre.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Casenlax 4 g polvo para solución oral en sobre 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 4 g de macrogol 4000. Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Casenlax 4 g polvo para solución oral en sobre 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 4 g de macrogol 4000. Excipientes con efecto conocido:
Plasimine está indicado para el tratamiento de las siguientes infecciones cutáneas causadas por microorganismos sensibles (ver sección 5.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Plasimine 20 mg/g pomada 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene; Mupirocina
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Plasimine 20 mg/g pomada 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene; Mupirocina
EFECTOS ADVERSOS: POSOLOGIA
 POSOLOGIA NILOTINIB se administra por vía oral. La dosis recomendada es según prescripción médica. CÓMO se debe TOMAR Nilotinib? Debe tomarlo sin alimentos, es decir, 1 hora antes o dos horas después de
POSOLOGIA NILOTINIB se administra por vía oral. La dosis recomendada es según prescripción médica. CÓMO se debe TOMAR Nilotinib? Debe tomarlo sin alimentos, es decir, 1 hora antes o dos horas después de
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. CARPROSAN 50 mg/ml SOLUCIÓN INYECTABLE PARA BOVINO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CARPROSAN 50 mg/ml SOLUCIÓN INYECTABLE PARA BOVINO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada ml contiene: Sustancia
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CARPROSAN 50 mg/ml SOLUCIÓN INYECTABLE PARA BOVINO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada ml contiene: Sustancia
Que son "inyecciones para la alergia"?
 Que son "inyecciones para la alergia"? Este folleto está diseñado para responder las preguntas básicas de quién, qué, cuándo, dónde, cómo y por qué que pueda tener con respecto a la inmunoterapia alergénica,
Que son "inyecciones para la alergia"? Este folleto está diseñado para responder las preguntas básicas de quién, qué, cuándo, dónde, cómo y por qué que pueda tener con respecto a la inmunoterapia alergénica,
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Tratamiento sintomático de procesos alérgicos tales como: Rinitis o conjuntivitis alérgica, urticaria crónica, dermatitis alérgica.
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO ASTEMIZOL RATIOPHARM 10 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Astemizol (D.C.I.)... 10 mg Excipientes: véase
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO ASTEMIZOL RATIOPHARM 10 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Astemizol (D.C.I.)... 10 mg Excipientes: véase
FICHA TÉCNICA. Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
Cada sobre de MOVICOL Pediátrico contiene los siguientes principios activos:
 agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO MOVICOL Pediátrico 6,9 g sobre, polvo para solución oral. 2. COMPOSICIÓN
agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO MOVICOL Pediátrico 6,9 g sobre, polvo para solución oral. 2. COMPOSICIÓN
FICHA TECNICA. Alivio local de los síntomas ocasionados por el herpes labial, tales como: picor, escozor u hormigueo.
 agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Zulex 333 mg Comprimidos recubiertos Acamprosato
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Zulex 333 mg Comprimidos recubiertos Acamprosato Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya que puede
PROSPECTO: INFORMACIÓN PARA EL USUARIO Zulex 333 mg Comprimidos recubiertos Acamprosato Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya que puede
FICHA TÉCNICA. Líquido oral. Líquido oleoso homogéneo, transparente, de color amarillo pálido
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO Ordelax 756,6 mg/ml líquido oral 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de líquido oral contiene: Parafina líquida...756,6 mg. Para consultar la lista
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO Ordelax 756,6 mg/ml líquido oral 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de líquido oral contiene: Parafina líquida...756,6 mg. Para consultar la lista
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Para Daivobet pomada
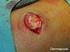 agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Para Daivobet pomada 1. DENOMINACIÓN DEL MEDICAMENTO Daivobet 50 microgramos/g + 0,5 mg/g pomada 2. COMPOSICIÓN
agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Para Daivobet pomada 1. DENOMINACIÓN DEL MEDICAMENTO Daivobet 50 microgramos/g + 0,5 mg/g pomada 2. COMPOSICIÓN
Alivio temporal de los síntomas de la conjuntivitis alérgica tales como: picor de ojos, lagrimeo y enrojecimiento.
 V 3.0 1. NOMBRE DEL MEDICAMENTO REACTINE Levocabastina 0,5mg/ml colirio en suspensión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Levocabastina (como hidrocloruro) equivalente a 0,5 mg
V 3.0 1. NOMBRE DEL MEDICAMENTO REACTINE Levocabastina 0,5mg/ml colirio en suspensión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Levocabastina (como hidrocloruro) equivalente a 0,5 mg
FICHA TECNICA. Un comprimido con cubierta pelicular contiene 8,42 mg de cetirizina como cetirizina diclorhidrato 10 mg. Para excipientes Ver 6.1.
 agencia española de medicamentos y productos sanitarios FICHA TECNICA DENOMINACIÓN DEL MEDICAMENTO CETIRIZINA BEXAL 10 mg comprimidos con cubierta pelicular EFG. COMPOSICION CUALITATIVA Y CUANTITATIVA
agencia española de medicamentos y productos sanitarios FICHA TECNICA DENOMINACIÓN DEL MEDICAMENTO CETIRIZINA BEXAL 10 mg comprimidos con cubierta pelicular EFG. COMPOSICION CUALITATIVA Y CUANTITATIVA
PROSPECTO: INFORMACIÓN PARA EL USUARIO. ACIDOS OMEGA-3 CINFA 1000 mg CAPSULAS BLANDAS EFG Esteres etílicos de ácidos grasos omega-3 al 90%
 PROSPECTO: INFORMACIÓN PARA EL USUARIO ACIDOS OMEGA-3 CINFA 1000 mg CAPSULAS BLANDAS EFG Esteres etílicos de ácidos grasos omega-3 al 90% Lea todo el prospecto detenidamente antes de empezar a tomar el
PROSPECTO: INFORMACIÓN PARA EL USUARIO ACIDOS OMEGA-3 CINFA 1000 mg CAPSULAS BLANDAS EFG Esteres etílicos de ácidos grasos omega-3 al 90% Lea todo el prospecto detenidamente antes de empezar a tomar el
FICHA TÉCNICA. Alivio local sintomático de las infecciones leves de boca y garganta que cursan con dolor y sin fiebre.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO STREPSILS CON LIDOCAINA pastillas para chupar. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla: Amilmetacresol hidrocloruro... 0,6mg Alcohol 2,4- diclorobencílico.......1,2mg
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO STREPSILS CON LIDOCAINA pastillas para chupar. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla: Amilmetacresol hidrocloruro... 0,6mg Alcohol 2,4- diclorobencílico.......1,2mg
BUCOMAX Pastillas para chupar sabor menta
 BUCOMAX Pastillas para chupar sabor menta PROSPECTO Bucomax pastillas para chupar sabor menta Amilmetacresol / alcohol 2,4- diclorobencílico Lea todo el prospecto detenidamente antes de empezar a tomar
BUCOMAX Pastillas para chupar sabor menta PROSPECTO Bucomax pastillas para chupar sabor menta Amilmetacresol / alcohol 2,4- diclorobencílico Lea todo el prospecto detenidamente antes de empezar a tomar
FICHA TÉCNICA FERROPROTINA NUEVA FÓRMULA
 agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA FERROPROTINA NUEVA FÓRMULA FERROPROTINA 20 mg, Solución oral FERROPROTINA 40 mg, Granulado para solución
agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA FERROPROTINA NUEVA FÓRMULA FERROPROTINA 20 mg, Solución oral FERROPROTINA 40 mg, Granulado para solución
Cada comprimido de Pramipexol Actavis 0,18 mg contiene 0,18 mg de pramipexol base (como 0,25 mg de dihidrocloruro de pramipexol monohidrato).
 1. NOMBRE DEL MEDICAMENTO Pramipexol Actavis 0,18 mg comprimidos EFG Pramipexol Actavis 0,7 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Pramipexol Actavis 0,18 mg contiene
1. NOMBRE DEL MEDICAMENTO Pramipexol Actavis 0,18 mg comprimidos EFG Pramipexol Actavis 0,7 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Pramipexol Actavis 0,18 mg contiene
1. DENOMINACIÓN DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 3. FORMA FARMACÉUTICA
 POSTINOR 750 microgramos comprimidos. 1. DENOMINACIÓN DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Para los excipientes, véase en
POSTINOR 750 microgramos comprimidos. 1. DENOMINACIÓN DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Para los excipientes, véase en
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO DuoResp Spiromax 160 microgramos/4,5 microgramos polvo para inhalación 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO DuoResp Spiromax 160 microgramos/4,5 microgramos polvo para inhalación 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO HERPIAL 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (D.O.E.)... 50 mg Excipientes: propilenglicol..400 mg Para la lista completa de
1. NOMBRE DEL MEDICAMENTO HERPIAL 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (D.O.E.)... 50 mg Excipientes: propilenglicol..400 mg Para la lista completa de
Gel/Crema para uso cutáneo Gel homogéneo incoloro o de color amarillo pálido o ligeramente marrón. Crema blanca, brillante.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ROZEX 7,5 mg/g Gel tópico ROZEX 7,5 mg/g Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 gramo de gel/crema contiene 7,5 mg de metronidazol Para consultar la lista
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ROZEX 7,5 mg/g Gel tópico ROZEX 7,5 mg/g Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 gramo de gel/crema contiene 7,5 mg de metronidazol Para consultar la lista
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. PULMICORT 0,25 mg/ml suspensión para inhalación por nebulizador 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PULMICORT 0,25 mg/ml suspensión para inhalación por nebulizador 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PULMICORT 0,25 mg/ml suspensión para inhalación por nebulizador 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
PROSPECTO: INFORMACIÓN PARA EL USUARIO. PLURALAIS 10 mg comprimidos recubiertos con película EFG (Montelukast)
 PROSPECTO: INFORMACIÓN PARA EL USUARIO PLURALAIS 10 mg comprimidos recubiertos con película EFG (Montelukast) Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este
PROSPECTO: INFORMACIÓN PARA EL USUARIO PLURALAIS 10 mg comprimidos recubiertos con película EFG (Montelukast) Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. 20 g/100 ml
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: CLORURO DE SODIO 20 % Forma farmacéutica: Solución concentrada para infusión IV Fortaleza: Presentación: Titular del Registro Sanitario,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: CLORURO DE SODIO 20 % Forma farmacéutica: Solución concentrada para infusión IV Fortaleza: Presentación: Titular del Registro Sanitario,
Se administrarán de 120 a 240 mg de extracto al día repartidos en tres tomas, la duración del tratamiento será de 6-8 semanas.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO GINKGO BILOBA BESCANSA. Solución oral Extracto estandarizado seco de Ginkgo biloba L. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Por ml: 40 mg de extracto estandarizado
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO GINKGO BILOBA BESCANSA. Solución oral Extracto estandarizado seco de Ginkgo biloba L. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Por ml: 40 mg de extracto estandarizado
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 Anexo III Modificaciones a incluir en las secciones relevantes de la ficha técnica o resumen de las características del producto, etiquetado y prospecto 20 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS
Anexo III Modificaciones a incluir en las secciones relevantes de la ficha técnica o resumen de las características del producto, etiquetado y prospecto 20 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ciclopirox olamina ISDIN 15 mg/g champú 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de champú contiene 15
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ciclopirox olamina ISDIN 15 mg/g champú 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de champú contiene 15
MEDICACIONES PARA EL ASMA: INFORMACION PARA NIÑOS Y FAMILIAS = ASTHMA MEDICATIONS: INFORMATION FOR CHILDREN AND FAMILIES
 Page 1 of 8 PED-ALL-007-2004 MEDICACIONES PARA EL ASMA: INFORMACION PARA NIÑOS Y FAMILIAS = ASTHMA MEDICATIONS: INFORMATION FOR CHILDREN AND FAMILIES Lo que usted debe saber sobre las medicinas para Asma
Page 1 of 8 PED-ALL-007-2004 MEDICACIONES PARA EL ASMA: INFORMACION PARA NIÑOS Y FAMILIAS = ASTHMA MEDICATIONS: INFORMATION FOR CHILDREN AND FAMILIES Lo que usted debe saber sobre las medicinas para Asma
Comprimidos recubiertos redondos, blancos marcados con 333 en una cara.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO CAMPRAL 333 mg comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Acamprosato, 333 mg Para consultar la lista completa de excipientes, ver sección
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO CAMPRAL 333 mg comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Acamprosato, 333 mg Para consultar la lista completa de excipientes, ver sección
Anticoncepcion de Emergencia
 Anticoncepcion de Emergencia La anticoncepción de emergencia o anticoncepción postcoital se refiere a las píldoras anticonceptivas que tomadas después del acto sexual pueden prevenir el embarazo La anticoncepción
Anticoncepcion de Emergencia La anticoncepción de emergencia o anticoncepción postcoital se refiere a las píldoras anticonceptivas que tomadas después del acto sexual pueden prevenir el embarazo La anticoncepción
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Falcol Difucrem 15 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Falcol Difucrem 15 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene 15 mg de aceclofenaco. Excipientes con efecto conocido: alcohol
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Falcol Difucrem 15 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene 15 mg de aceclofenaco. Excipientes con efecto conocido: alcohol
Clasificación de problemas relacionados con medicamentos
 Clasificación de problemas relacionados con medicamentos (revisado 14-01-2010 vm) 2003-2010 Pharmaceutical Care Network Europe Foundation Esta clasificación puede ser utilizada libremente para la investigación
Clasificación de problemas relacionados con medicamentos (revisado 14-01-2010 vm) 2003-2010 Pharmaceutical Care Network Europe Foundation Esta clasificación puede ser utilizada libremente para la investigación
FICHA TÉCNICA. Se deberá respetar la dosis diaria recomendada independientemente de la extensión de la alopecia.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA ALOXIDIL 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA ALOXIDIL 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
