UNIVERSIDAD SIMÓN BOLÍVAR
|
|
|
- María Rodríguez Quintero
- hace 5 años
- Vistas:
Transcripción
1 UNIVERSIDAD SIMÓN BOLÍVAR DECANATO DE ESTUDIOS PROFESIONALES COORDINACIÓN DE LICENCIATURA EN BIOLOGÍA VALIDACIÓN DEL MÉTODO DE RECUENTO MICROBIANO Y DE DETERMINACIÓN DE MICROORGANISMOS ESPECÍFICOS EN PRODUCTOS FARMACÉUTICOS NO ESTÉRILES Por: Jessica Elena Vivas Véliz INFORME DE PASANTÍA Presentado ante la Ilustre Universidad Simón Bolívar como requisito parcial para optar al título de Licenciado en Biología Sartenejas, Marzo de 2015
2 UNIVERSIDAD SIMÓN BOLÍVAR DECANATO DE ESTUDIOS PROFESIONALES COORDINACIÓN DE LICENCIATURA EN BIOLOGÍA VALIDACIÓN DEL MÉTODO DE RECUENTO MICROBIANO Y DE DETERMINACIÓN DE MICROORGANISMOS ESPECÍFICOS EN PRODUCTOS FARMACÉUTICOS NO ESTÉRILES Por: Jessica Elena Vivas Véliz Realizado con la asesoría de: Tutor Académico: Prof. Elisabetta Lucci. Tutor Industrial: Lic. Piroska Domonkos. INFORME DE PASANTÍA Presentado ante la Ilustre Universidad Simón Bolívar como requisito parcial para optar al título de Licenciado en Biología Sartenejas, Marzo de 2015
3
4 RESUMEN Los productos farmacéuticos son utilizados para tratar enfermedades, sin embargo, pueden contaminarse con diversos microorganismos durante su producción y consumo, representando una problemática por el riesgo potencial que conllevan a la salud del consumidor. Existen medicamentos que no requieren ser estériles, pero deben cumplir con los límites de carga microbiana establecidos para garantizar su calidad, seguridad y eficacia. Para esto, se llevan a cabo análisis de recuento microbiano y de determinación de microorganismos específicos en base a los estándares establecidos por la Farmacopea de los Estados Unidos (USP, por sus siglas en inglés). Estos procedimientos deben ser validados por las empresas farmacéuticas para garantizar que los resultados obtenidos al analizar sus productos y materias primas sean confiables. El presente trabajo consistió en validar estas dos metodologías de análisis en dos tipos de productos no estériles elaborados por la empresa farmacéutica Biotech Laboratorios C.A. Previo al ensayo, se determinó el recuento microbiano inicial de cada producto obteniéndose resultados de conformidad ( 10 UFC/ml). Para la validación del método de recuento microbiano se utilizaron suspensiones estandarizadas de los microorganismos de prueba: Escherichia coli (ATCC 8739), Staphylococcus aureus (ATCC 6538), Candida albicans (ATCC 10231), Bacillus spizizenii (ATCC 6633), Pseudomonas aeruginosa (ATCC9027) y Aspergillus brasiliensis (ATCC 16404),obteniendo que C. albicans presentó un recuento promedio más cercano al esperado (100 UFC) para ambos productos. Los resultados fueron comparados con el factor de dos de sus respectivos controles, obteniendo que los recuentos promedios se hallaron dentro de sus intervalos respectivos y con porcentajes de recuperación 90%, comprobando que la metodología permite la recuperación de microorganismos presentes en una muestra. Se comprobó además la aptitud del método para detectar microorganismos patógenos específicos en cada muestra, recuperándose en los medios selectivos utilizados los microorganismos inoculados, C. albicans, S. aureus y P. aeruginosa en el producto 1 y E. coli y P. aeruginosa en el producto 2, validándose el método ya que fue posible la detección de estos microorganismos. Palabras clave: validación, recuento microbiano, microorganismos específicos, productos farmacéuticos no estériles. iii
5 ÍNDICE GENERAL INTRODUCCIÓN 1 CAPÍTULO I: DESCRIPCIÓN DE LA EMPRESA 4 CAPÍTULO II: FUNDAMENTOS TEÓRICOS Microorganismos Medios de Cultivo Validación de Métodos Productos Farmacéuticos No Estériles Parámetros Establecidos por la USP Procedimiento General en la Determinación de Aptitud del Método de Recuento Microbiano Procedimiento General en la Determinación de Aptitud de Pruebas de Microorganismos Específicos 12 CAPÍTULO III: MATERIALES Y MÉTODOS Materiales Equipos Reactivos Misceláneos Material biológico Muestras Farmacéuticas Preparación de Materiales y Medios de Cultivo Preparación de Materiales Preparación de los Medios de Cultivo Preparación de las Suspensiones Estandarizadas de los Microorganismos de Prueba Preparación de la Suspensión Madre de E. coli, S. aureus, P. aeruginosa, B. spizizenii y C. albicans Preparación de la Suspensión de A. brasiliensis Determinación de las Unidades Formadoras de Colonias (UFC) por ml de la Suspensión Madre Realización de Diluciones Seriadas Método de Recuento en Placas 17 iv
6 Cálculo de las UFC/ml de los Microorganismos utilizados Validación del Método de Recuento Microbiano Control Negativo del Producto Determinación de ph de las Muestras Preparación de las Muestras Cálculo del Volumen de Suspensión a Inocular Para E. coli, S. aureus, P. aeruginosa, B. spizizenii y C. albicans Para A. brasiliensis Prueba de Aptitud del Método de Recuento Microbiano Validación del Método de Determinación de Microorganismos Específicos Para el Producto Para el Producto 2 21 CAPÍTULO IV: RESULTADOS Y DISCUSIÓN Recuento en Placa y Densidad de Microorganismos en las Suspensiones Madre Validación del Método de Recuento Microbiano Control Negativo del Producto Determinación de ph de las Muestras Prueba de Aptitud del Método de Recuento Microbiano Validación del Método de Determinación de Microorganismos Específicos 31 CONCLUSIONES Y RECOMENDACIONES 37 REFERENCIAS BIBLIOGRÁFICAS 39 APÉNDICE A. CARACTERÍSTICAS DE LAS COLONIAS OBTENIDAS DE LOS MICROORGANISMOS DE PRUEBA EN EL RECUENTO EN PLACA 43 APÉNDICE B. PORCENTAJES DE RECUPERACIÓN OBTENIDOS EN LA PRUEBA DE APTITUD DE RECUENTO MICROBIANO 44 v
7 ÍNDICE DE TABLAS Tabla 2.1. Condiciones de la prueba de aptitud de método de recuento para cada microorganismo. Tabla 2.2. Condiciones de la prueba de determinación de microorganismos específicos para cada microorganismo de estudio. Tabla 3.1. Medios de cultivo y condiciones de incubación para cada microorganismo de estudio. Tabla 3.2. Características típicas de las colonias de los microorganismos de ensayo en los medios de cultivo utilizados. Tabla 4.1. Densidad aproximada de las suspensiones madre de los microorganismos (UFC/ml o esp/ml) obtenida a partir del método de recuento en placa. Tabla 4.2. Resultados del control negativo para ambos productos en estudio. Tabla 4.3. ph de las muestras en el medio de enriquecimiento. Tabla 4.4. Valores promedio obtenidos de la prueba de aptitud del método de recuento para el control y los tres lotes del producto 1. Tabla 4.5. Valores promedio obtenidos de la prueba de aptitud del método de recuento para el control y los tres lotes del producto 2. vi
8 ÍNDICE DE FIGURAS Figura 1.1. Organigrama resumido de la empresa Biotech Laboratorios C.A. Figura 3.1. Método de siembra en placa por estriado. Figura 3.2. Método de diluciones seriadas. Figura 4.1. Resultados obtenidos de la siembra del producto 1 inoculado con S. aureus en Agar Manitol Salado. Figura 4.2. Resultados obtenidos de la siembra del producto 1 inoculado con C. albicans en Agar Sabouraud Dextrosa. Figura 4.3. Resultados obtenidos de la siembra del producto inoculado con P. aeruginosa en Agar Cetrimide. a) Resultados para el producto 1. b) Resultados para el producto 2. Figura 4.4. Resultados obtenidos de la siembra del producto 2 inoculado con E. coli en Agar MacConkey. vii
9 ÍNDICE DE ECUACIONES Ecuación 3.1. Cálculo del número de UFC de microorganismos por ml de suspensión. Ecuación 3.2. Cálculo del volumen de suspensión a inocular. viii
10 LISTA DE ABREVIATURAS USP United States Pharmacopeia (Farmacopea de los Estados Unidos). USP-NF United States Pharmacopeia. The National Formulary (Farmacopea de los Estados Unidos. Formulario Nacional). C.A. Compañía Anónima. B.P.M. Buenas Prácticas de Manufactura. GPL Good Practices of Laboratory (Buenas Prácticas de Laboratorio). ICH International Conference of Harmonization (Conferencia Internacional de Armonización). gr Gramos. ml Mililitros. UFC Unidades Formadoras de Colonias. N/A No aplica. mm Milímetros. lts Litros. µl Micro litros. esp Esporas. FDA Food and Drugs Administration (Administración de Drogas y Alimentos). ASC Agar Soya-Caseína. ASD Agar Sabouraud Dextrosa. ix
11 1 INTRODUCCIÓN Las bacterias, hongos y levaduras son microorganismos que se encuentran ampliamente distribuidos en todos los ambientes, incluyendo ambientes considerados extremos por presentar condiciones inhabitables para otros seres vivos. La microbiología es la ciencia que estudia estos microorganismos, organismos demasiado pequeños para ser percibidos a simple vista por el ojo humano (Stanier y col., 1996). Su estudio data de épocas relativamente recientes, a pesar de que estos organismos existen en la Tierra desde el principio de los tiempos (Tortora y col., 2007). La gran mayoría de los microorganismos no son dañinos para los seres humanos, algunos son beneficiosos y unos pocos son patógenos, los cuales representan un problema a considerar en industrias como la de alimentos y farmacéuticas. Cualquier producto farmacéutico tiene, por tanto, el potencial de contaminarse con microorganismos, ya sean bacterias, levaduras u hongos, debido a que, en su mayoría presentan características como ph, actividad de agua y nutrientes que son favorables para el crecimiento y desarrollo de los mismos. Esta contaminación puede provenir de las materias primas, ocurrir durante el proceso de producción o durante su almacenamiento y uso, y representa un peligro potencial por dos razones: primero, puede causar el deterioro del producto afectando sus propiedades terapeuticas; y segundo, puede poner en peligro la salud del paciente, dependiendo del tipo y número de organismos presentes (Bloomfield, 2012). Los productos farmacéuticos son utilizados de diversas formas en la prevención, tratamiento y diagnóstico de enfermedades (Mugoyela y Mwambete, 2010), por lo que no deben representar un peligro para el consumidor. Sin embargo, para algunos tipos de medicamentos se considera que no es necesaria la condición de esterilidad, por lo que existe la necesidad de establecer niveles aceptables de microorganismos para la garantía de la calidad de estos productos (Bloomfield, 2012). Debido a esto, en los últimos años, la industria farmacéutica ha mejorado la calidad de los medicamentos no estériles hasta obtener productos que contengan sólo una mínima carga microbiana (Mugoyela y Mwambete, 2010). Es de gran preocupación en la industria cuando los contaminantes microbianos exceden los límites aceptables (Mugoyela y Mwambete, 2010), por tanto, la producción de medicamentos requiere de una política de calidad cuyo objetivo es garantizar los intereses de los consumidores (Formoso y col., 2013). Las buenas prácticas de fabricación y muchos otros documentos
12 2 complementarios deben formar parte esencial del sistema de gestión de la calidad, que es necesario establecer para obtener medicamentos con la adecuada calidad, seguridad y eficacia (Formoso y col., 2013). Uno de los documentos más importantes en los cuales se basa la industria farmacéutica para el control y la garantía de la calidad es la Farmacopea de los Estados Unidos (USP por sus siglas en inglés). Su primera publicación se llevó a cabo en el año 1820 con revisiones periódicas cada 10 años, alcanzando el reconocimiento legal de varios países latinoamericanos y siendo utilizada por la mayoría de los laboratorios farmacéuticos multinacionales (Folch y Fernández, 1935; Arias y León, 1999). Una Farmacopea es equivalente a una ley en cuanto a preparación, ensayo y valoración de los medicamentos (Folch y Fernández, 1935). Surge por la necesidad de establecer estándares de referencia como indicativos de la calidad de los productos, para asegurar su inocuidad y efectividad (Schifter y col., 2009). La USP ha marcado pauta en lo que se refiere a técnicas instrumentales, métodos de identificación y su aplicación para determinar la calidad y potencia de simples, compuestos y preparaciones farmacéuticas terminadas (Schifter y col., 2009). Todas las normas farmacopeicas para fármacos, formas farmacéuticas, preparaciones magistrales, excipientes, dispositivos médicos, plantas medicinales y suplementos dietéticos se encuentran contenidas en los compendios de la Farmacopea de los Estados Unidos - Formulario Nacional (USP-NF), así como también los procedimientos y especificaciones estándar para la validación de los métodos de análisis en un laboratorio de control de calidad (USP, 2014). En este sentido, todas las empresas farmacéuticas deben cumplir con las normativas creadas para garantizar la calidad de sus productos y asegurarse de validar los procedimientos de laboratorio que son llevados a cabo para el análisis físico-químico y microbiológico de sus materias primas y productos. El objetivo general del presente trabajo es validar el método de recuento microbiano y el método de determinación de microorganismos específicos para dos productos farmacéuticos no estériles elaborados por la empresa Biotech Laboratorios C.A.
13 3 Los objetivos específicos planteados para esto son los siguientes: - Validar el método de recuento microbiano para tres muestras provenientes de distintos lotes de preparación de dos productos farmacéuticos no estériles. - Validar el método de determinación de microorganismos específicos para tres muestras provenientes de distintos lotes de preparación de dos productos farmacéuticos no estériles.
14 CAPÍTULO I DESCRIPCIÓN DE LA EMPRESA Biotech Laboratorios C.A. es una empresa con una larga trayectoria en el país, dedicada a la fabricación, mercadeo y comercialización de productos farmacéuticos, naturales y de consumo masivo. Su misión es la de proveer productos y servicios para el cuidado de la salud, orientados a mejorar la calidad de vida de los venezolanos, elaborados bajo las normas y principios más exigentes y con la mejor relación precio-valor. La empresa ha estado presente en el mercado venezolano desde el año 1907, cuando Don Giuseppe Palenzona funda Palenzona & Cia., C.A. en el centro de Caracas, con el fin de comercializar víveres. Luego de finalizada la Primera Guerra Mundial, su fundador se traslada a Italia donde crea Palenzona & Compagnia, encargada de la exportación e importación de bienes de Venezuela a través de la empresa establecida años antes en este país. En el año 1932, Armando Palenzona, hijo mayor de Don Giuseppe, regresa a Venezuela para tomar las riendas de la empresa y un par de años más tarde, tras la muerte de su padre, Rodolfo Palenzona, el segundo hijo de Giuseppe Palenzona, se une a su hermano y comienzan a expandir la empresa comercializando artículos de ferretería y quincalla. Es apenas a finales de la década de los años 30 cuando inician la comercialización de productos farmacéuticos, la mayoría de ellos importados desde Italia. En el año 1942 comienza la fabricación local de los primeros productos y, debido al éxito obtenido, los hermanos fundan una planta farmacéutica que llevó por nombre Laboratorio Palenzona C.A.I., ubicada en la Avenida Andrés Bello de San Bernardino. Con miras hacia la expansión, en el año 1961 la empresa se traslada a instalaciones más modernas ubicadas en la Zona Industrial de La Trinidad, donde su dedicación en la fabricación de productos de calidad le permitió alcanzar un lugar importante entre las industrias farmacéuticas presentes en el país.
15 5 Luego del fallecimiento de los hermanos Palenzona, la empresa pasa a manos de inversionistas suizos quienes deciden cambiar el nombre de Laboratorios Palenzona C.A.I. a Biotech Laboratorios C.A. pero sin modificar de fondo la estructura y funcionamiento de la empresa. De forma general, la planta de Biotech Laboratorios C.A. presenta una estructura organizacional formada por tres áreas principales (ver Figura 1.1): 1) el área administrativa, que engloba la parte legal, administrativa, financiera y de mercadeo de la empresa; 2) el área de producción, que incluye todos los departamentos encargados de la fabricación de los productos, validación y buenas prácticas de manufactura (B.P.M.); y 3) el área de control de calidad, que incluye los laboratorios encargados de comprobar que los productos fabricados siguen las especificaciones indicadas para garantizar así su calidad y su seguridad para el consumo. Figura 1.1. Organigrama resumido de la empresa Biotech Laboratorios C.A.
16 6 El área de producción está a su vez dividida en varios departamentos, cada uno encargado de la fabricación independiente de un tipo de producto específico. Estos departamentos son: sólidos, confección sólidos, semi-sólidos, líquidos, confección líquidos e inyectables líquidos. Por su parte, el área de control de calidad incluye los laboratorios de control físico-químico y control microbiológico. Este último se encarga de realizar las pruebas microbiológicas necesarias a productos, materias primas, envases, soluciones sanitizantes y diversos factores ambientales (agua, aire, áreas y superficies de trabajo y personal), para garantizar el cumplimiento de los parámetros establecidos por la USP (Farmacopea de los Estados Unidos) y así asegurar la calidad y seguridad de los productos que son comercializados.
17 CAPÍTULO II FUNDAMENTOS TEÓRICOS 2.1 Microorganismos Los microorganismos son organismos microscópicos constituidos por una o varias células (Madigan y col., 2009). En la actualidad es sabido que los microorganismos se encuentran presentes casi en todas partes, por consiguiente, durante toda nuestra vida nos encontramos en contacto con ellos (Montoya, 2008), sin embargo, existe aún la tendencia a relacionar estos organismos sólo con la transmisión de enfermedades, cuando realmente sólo unos pocos de ellos son patógenos (Tortora y col., 2007). Estos organismos engloban diversos grupos, como son: las bacterias, los hongos (levaduras y mohos), los protozoarios, las algas microscópicas y los virus (entidades no celulares) (Tortora y col., 2007). Los microorganismos habitan la Tierra desde miles de millones de años antes que las plantas y los animales, y de no existir ellos, las formas de vida superiores no hubieran podido surgir y mantenerse hasta la actualidad (Madigan y col., 2009), ya que la mayoría realiza importantes contribuciones al bienestar de los habitantes del planeta al ayudar a mantener el equilibrio de los organismos vivos y las sustancias químicas en el ambiente; algunos de ellos presentan además muchas aplicaciones comerciales (Tortora y col. 2007). Existen diversos factores que influyen en el crecimiento de los microorganismos. Para que éste ocurra de forma exitosa es necesario que se cumplan dos factores determinantes: condiciones ambientales favorables y medio de cultivo apropiado. En general, los factores físicos o ambientales presentan un valor óptimo al cual los microorganismos tienen su mayor desarrollo, además presentan un valor máximo y uno mínimo por encima y por debajo de los cuales no es posible su reproducción, respectivamente. Entre los principales factores ambientales influyentes se encuentran: temperatura, presión, ph, humedad y oxígeno. Por su parte, un medio de cultivo
18 8 adecuado es aquel en el cual los microorganismos sean capaces de obtener los nutrientes necesarios para su crecimiento y desarrollo (Barreiro y Sandoval, 2006; Montoya, 2008). 2.2 Medios de Cultivo Los medios de cultivo son aquellas soluciones nutritivas preparadas y utilizadas en el laboratorio para el cultivo de los microorganismos (Tortora y col., 2007; Madigan y col., 2009). Los medios de cultivo deben ser estériles y deben además contener los elementos nutritivos necesarios para favorecer la multiplicación de los microorganismos, por lo que hay que tener en cuenta que diferentes microorganismos pueden tener diferentes requerimientos nutricionales (Prats, 2006; Tortora y col., 2007). Algunos microorganismos pueden crecer bien en casi todos los medios de cultivo, otros requieren medios con características especiales y existen incluso otros que son incapaces de crecer en alguno de los medios existentes (Tortora y col., 2007). Los medios de cultivo deben cumplir ciertos criterios principales para favorecer el crecimiento: contener los nutrientes adecuados para el microorganismo específico a cultivar, contener suficiente humedad, un ph ajustado y una concentración de oxígeno apropiada (Tortora y col., 2007). Entre líquidos y sólidos, existe una gran variedad de medios de cultivo para el crecimiento de microorganismos en el laboratorio, siendo algunos capaces de aislar o incluso diferenciar unos microorganismos de otros (Prats, 2006). Los medios selectivos son aquellos que permiten aislar específicamente un tipo de microorganismo favoreciendo su crecimiento e inhibiendo el desarrollo de los microorganismos no deseados, mientras que los medios diferenciales son aquellos que permiten diferenciar más fácilmente las colonias de los microorganismos deseados de otras (Prats, 2006; Tortora y col., 2007). 2.3 Validación de Métodos En los laboratorios de control de calidad donde son realizados análisis en general sobre materias primas, control de procesos, productos terminados o condiciones de almacenamiento, es necesario conocer si se cumplen los parámetros establecidos nacional e internacionalmente (garantía de la calidad), para ello es recomendado la utilización de métodos de análisis rápidos, altamente eficientes, no contaminantes y de bajo costo (Clavijo, 2002).
19 9 El uso de un método analítico está justificado únicamente una vez que se haya comprobado que es válido (Gennaro, 2003). Diferentes organismos internacionales relacionados con las Buenas Prácticas de Laboratorio (GPL, por sus siglas en inglés) recomiendan que los métodos de análisis deben ser sometidos a validación con el objetivo de demostrar que los datos obtenidos a partir de éstos son aceptables para el fin que se busca (Gómez y col., 2009). En este sentido, la validación de un método se refiere a la evaluación y demostración experimental, por medio de estudios de laboratorio convenientemente documentados, de que el método analítico cumple con las especificaciones para su aplicación, siendo aceptable para el fin que se pretende lograr y produciendo los resultados previstos bajo condiciones definidas (Harris, 2007; Pérez y col., 2007; Soledad, 2009). Para métodos analíticos aplicados a muestras farmacéuticas, la Farmacopea de los Estados Unidos (USP por sus siglas en inglés) establece guías de validación y describe los parámetros de rendimiento analítico que deben seguirse para validar un procedimiento. Entre estos parámetros se cuentan: precisión, exactitud, selectividad, linealidad, rango, robustez, límite de detección y límite de cuantificación (Gennaro, 2003; Harris, 2007; Gómez y col., 2009; Soledad, 2009). En documentos de la Conferencia Internacional de Armonización (ICH, por sus siglas en inglés) se presenta una guía sobre la necesidad de revalidación de los métodos en caso de que ocurra lo siguiente: cambios en la síntesis de la sustancia o del principio activo, cambios en la composición del producto y cambios en el procedimiento analítico (Soledad, 2009). 2.4 Productos Farmacéuticos No Estériles En términos microbiológicos, los productos farmacéuticos pueden dividirse en dos grupos: estériles y no estériles. Los medicamentos no estériles son aquellos que, independientemente de su dosificación y vía de administración, no requieren estar completamente libres de la presencia microorganismos (Ratajczak y col., 2014). La incidencia de microorganismos en preparaciones no estériles generalmente está influenciada por la naturaleza de los componentes (naturales o sintéticos), la calidad del proceso y el cuidado y aptitud del personal involucrado en el manejo de las mismas (Gad y col., 2011).
20 10 Los medicamentos no estériles deben satisfacer los criterios y especificaciones apropiados de pureza microbiológica incluidos en las monografías farmacopeicas, los cuales se establecen específicamente con el fin de asegurar que el producto sea terapéuticamente efectivo y seguro para los pacientes (Ratajczak y col., 2014). Los análisis, realizados tanto a las materias primas como a los productos terminados, incluyen pruebas para determinar el recuento total de aerobios y el recuento total de hongos y levaduras, existiendo límites definidos de aceptación para la presencia de cada uno de estos en las muestras analizadas (Gad y col., 2011; Ratajczak y col., 2014). Para disminuir el riesgo de contaminación y eliminar niveles bajos de contaminantes microbianos que pueden aparecer durante el almacenamiento o por el uso repetido de productos multi-dosis, es posible incluir sustancias antimicrobianas o preservativos en la formulación de estos productos para garantizar que se mantengan satisfactoriamente (Gad y col., 2011). 2.5 Parámetros Establecidos por la USP Procedimiento General en la Determinación de Aptitud del Método de Recuento Microbiano En el capítulo 61 de la USP (2014), Examen Microbiológico de Productos No Estériles: Pruebas de Recuento Microbiano, se describen las pruebas que permiten demostrar la aptitud del recuento cuantitativo de bacterias y hongos en productos farmacéuticos no estériles, lo que se lleva a cabo para determinar si una preparación cumple con las especificaciones establecidas de calidad microbiológica. Se deben utilizar suspensiones estandarizadas en solución de cloruro de sodio de cada uno de los microorganismos de prueba por separado, que correspondan a sub-cultivos de no más de cinco repiques con respecto a la cepa original. Las suspensiones se deben utilizar dentro de las dos horas siguientes a su preparación o dentro de las siguientes 24 horas si se conservan a una temperatura entre 2 y 8 C (USP 37, 2014). Para la preparación de la muestra, en el caso de productos solubles en agua, se toman 10 gr o ml del producto y se disuelven en 90 ml de Caldo Soya-Caseína para obtener una dilución 1 en 10. El ph de esta preparación debe tener un valor entre 6 y 8. Se realiza además un control positivo que contenga únicamente el medio de cultivo líquido sin el producto. Para productos que
21 11 presenten sustancias inhibitorias del crecimiento o preservativos que no se inhiban por medio de la dilución, es necesario utilizar algún tipo de agente neutralizante. En estos casos se sustituye el Caldo Soya-Caseína por Caldo Letheen que contiene lecitina y polisorbato que actúan como neutralizantes de algunos preservativos (USP 37, 2014). Las muestras y el control positivo se deben inocular con un volumen de suspensión que permita obtener no más de 100 UFC en el recuento en el caso de los aerobios y no más de 50 UFC en el caso de hongos y levaduras. Se preparará una muestra y un control positivo por cada microorganismo de prueba. El volumen de suspensión a inocular no debe ser mayor al 1% del volumen del producto diluido (USP 37, 2014). Para la recuperación de microorganismos en presencia del producto se utiliza principalmente el método de recuento en placa. Se lleva a cabo la siembra por profundidad de 1ml de cada muestra preparada e inoculada en ml de Agar Soya-Caseína o Agar Sabouraud Dextrosa y se incuba a las condiciones especificadas en la Tabla 2.1. En el caso de los aerobios estrictos se utiliza el método de extensión en superficie, donde se agregan entre 15 y 20 ml de Agar Soya-Caseína a una placa, se deja solidificar y luego se esparce un volumen de 0,1 ml de la muestra, colocando en incubación las placas bajo las condiciones indicadas. En ambos casos se debe realizar un mínimo de dos réplicas por muestra (USP 37, 2014). Tabla 2.1. Condiciones de la prueba de aptitud de método de recuento para cada microorganismo (USP 37, 2014). Microorganismos Pseudomonas aeruginosa ATCC 9027 Staphylococcus aureus ATCC 6538 Bacillus spizizenii ATCC 6633 Escherichia coli ATCC 8739 Candida albicans ATCC Aspergillus brasiliensis ATCC Aptitud del Método de Recuento en Presencia del Producto Recuento Total de Recuento Total de Hongos Aerobios Filamentosos y Levaduras Agar Soya-Caseína 100 UFC C 3 días Agar Soya-Caseína 50 UFC C 5 días N/A Agar Sabouraud Dextrosa 50 UFC C 5 días
22 Procedimiento General en la Determinación de Aptitud de Pruebas de Microorganismos Específicos En el capítulo 62 de la USP (2014), Examen Microbiológico de Productos No Estériles: Pruebas de Microorganismos Específicos, se describen las pruebas que permiten demostrar la aptitud de la determinación de ausencia o presencia limitada de microorganismos específicos que pueden ser detectados en condiciones definidas, lo que es de gran importancia, ya que, aunque los productos farmacéuticos no estériles pueden presentar una cierta carga microbiana, existen microorganismos que pueden ser patógenos para los humanos y que por tanto no deben estar presentes bajo ninguna circunstancia en dichos productos. Para estas pruebas se utilizan las mismas muestras preparadas e inoculadas utilizadas en la determinación de aptitud del método de recuento. A partir de dichas muestras se preparan diluciones 1:100 en Caldo Soya-Caseína para E. coli ATCC 8739, P. aeruginosa ATCC 9027 y S. aureus ATCC 6538 y se incuban a una temperatura de C durante un período de horas. En el caso de C. albicans ATCC se prepara una dilución 1:100 en Caldo Sabouraud Dextrosa y se incuba a una temperatura de C durante un período de 3 a 5 días. La utilización de distintos microorganismos dependerá del tipo de muestra farmacéutica que se analice (USP 37, 2014). Luego de incubarse las muestras, se realizan sub-cultivos en placas para cada uno de los microorganismos utilizando los medios de cultivo y las condiciones de incubación especificadas en la Tabla 2.2. Tabla 2.2. Condiciones de la prueba de determinación de microorganismos específicos para cada microorganismo de estudio (USP 37, 2014). Microorganismo Medio de Cultivo Condiciones de Incubación E. coli Agar MacConkey C horas P. aeruginosa Agar Cetrimide S. aureus Agar Manitol Salado C. albicans Agar Sabouraud Dextrosa C horas
23 El crecimiento de colonias indica la posible presencia de cada microorganismo, confirmada según las características típicas y los cambios ocurridos en el medio de cultivo. 13
24 CAPÍTULO III MATERIALES Y MÉTODOS 3.1 Materiales Equipos Los equipos utilizados en la realización del presente trabajo fueron: Vortex Mixer VM-300, microscopio Optima XSZ-287, medidor de ph portátil Thermo RLO60P, balanza analítica Mettler Basball, mechero Bunsen, nevera ejecutiva General Electric, nevera NBS-50 GamLab, planchas de agitación Corning PC-420D, incubadora National Appliance, Autoclave F de Lama, estufa de secado Heraeus y microondas Whirlpool Reactivos En el trabajo realizado fueron utilizados los siguientes medios de cultivo: Agar Soya-Caseína, Agar Sabouraud Dextrosa, Agar Cetrimide, Caldo Soya-Caseína, Caldo Sabouraud Dextrosa y Caldo Letheen de la marca Merck, y Agar Manitol Salado y Agar MacConkey de la casa comercial Oxoid; además se utilizó solución salina 0,9%, agua purificada y alcohol 70% Misceláneos Adicional a lo antes mencionado, también se utilizaron: placas de Petri VWR International 100x15mm, tubos de ensayo estériles, frascos de vidrio Ilmabor de 100 y 400 ml, balones de vidrio de 6 lts, pipetas estériles de 5 y 10 ml, micropipetas Biopette P-200 y P-1000, puntas estériles Rainin de 250 y 1000 µl, jeringas KX Medical de 10 ml, asa de inoculación de platino, espátula de Drigalski y perlas de vidrio estériles.
25 Material Biológico Los microorganismos utilizados en la realización del presente ensayo fueron: Staphylococcus aureus (ATCC 6538), Pseudomonas aeruginosa (ATCC 9027), Aspergillus brasiliensis (ATCC 16404), Candida albicans (ATCC 10231), Bacillus subtilis subs. spizizenii (ATCC 6633) y Escherichia coli (ATCC 8739) Muestras Farmacéuticas Para el estudio fueron utilizados dos tipos de productos farmacéuticos no estériles: una ducha vaginal (producto 1) y un jarabe (producto 2). De cada uno de los productos fueron utilizadas tres muestras provenientes de diferentes lotes de producción que serán denominados en el presente trabajo como A, B y C en ambos casos. 3.2 Preparación de Materiales y Medios de Cultivo Preparación de Materiales El material utilizado se acondicionó para su uso según los procedimientos establecidos en la empresa. Se lavó debidamente y se esterilizó en autoclave a una temperatura de 121 C y 15 psi de presión durante 35 minutos Preparación de los Medios de Cultivo Los medios de cultivo utilizados fueron preparados siguiendo las especificaciones del fabricante impresas en el empaque y se esterilizaron en autoclave a una temperatura de 121 C y 15 psi de presión durante 15 minutos. 3.3 Preparación de las Suspensiones Estandarizadas de los Microorganismos de Prueba Preparación de la Suspensión Madre de E. coli, S. aureus, P. aeruginosa, B. spizizenii y C. albicans Para preparar la suspensión de estos microorganismos, inicialmente se realizó una siembra de refrescamiento y verificación de pureza en placas con Agar Soya-Caseína de cada una de las cepas. Para ello, fue tomada una asada de los subcultivos de microorganismos en tubos con agar
26 16 en bisel y se sembró en las placas como lo muestra la Figura 3.1. Estas cepas utilizadas no debían provenir de subcultivos con más de 5 repiques a partir del cultivo original liofilizado. Figura 3.1. Método de siembra en placa por estriado (Tomado de Las placas fueron incubadas por un tiempo de horas a una temperatura de C y, una vez finalizada la incubación, se tomaron las colonias aisladas con un asa de platino y se inocularon en un tubo con 10 ml de solución salina 0,9% hasta obtener una suspensión turbia homogénea luego de ser agitada con el vortex Preparación de las Suspensión de A. brasiliensis Para realizar la suspensión A. brasiliensis se utilizó un subcultivo en tubo con agar en bisel que no tuviera más de 5 repiques a partir del cultivo original liofilizado. Para ello, se agregaron al tubo 15 ml de solución salina 0,9% y perlas de vidrio estériles, se agitó para arrastrar las esporas presentes y se trasvasó la solución a un tubo de vidrio estéril con tapa y protegido de la luz Determinación de las Unidades Formadoras de Colonias (UFC) por ml de la Suspensión Madre Realización de Diluciones Seriadas A partir de la suspensión madre de cada microorganismo se realizaron diluciones seriadas para reducir la concentración y luego proceder a estandarizar dichas suspensiones. Para ello, con una
27 17 micropipeta se tomó 0,1 ml de la suspensión madre y se agregó a un tubo con 9,9 ml de solución salina 0,9% para obtener una dilución 1/100 (10-2 ), como lo refleja la Figura 3.2; se procedió de la misma manera para obtener una dilución A partir de allí, para obtener las diluciones de orden 10-5, 10-6 y 10-7, se tomó con la micropipeta 1 ml de la suspensión anterior inmediata y se agregó a un tubo con 9 ml de solución salina 0,9%. Figura 3.2. Método de diluciones seriadas Método de Recuento en Placas A partir de las diluciones seriadas se llevó a cabo el recuento en placas utilizando las diluciones 10-4, 10-5 y 10-6, o 10-5, 10-6 y 10-7 dependiendo del microorganismo. Se realizó por triplicado la siembra de estas diluciones agregando 1 ml a cada placa para la siembra por profundidad en agar blando de E. coli, S. aureus, B. spizizenni, C. albicans y A. brasiliensis, y 0,1 ml para la siembra por superficie de P. aeruginosa. Las placas fueron incubadas a una temperatura de C por un período de 24 horas para las bacterias y 48 horas para C. albicans. En el caso de A. brasiliensis, la incubación se realizó a temperatura ambiente (20-25 C) por un período de horas Cálculo de las UFC/ml de los Microorganismos utilizados Luego de la incubación se procedió a contar las colonias visibles en las placas y para calcular las UFC/ml de las suspensiones se tomó en cada caso aquella dilución en cuyas placas fue posible
28 18 contar entre 25 y 250 colonias en el caso de las bacterias y de C. albicans, y entre 8 y 80 colonias en el caso de A. brasiliensis, y se aplicó la siguiente fórmula: Ecuación 3.1. Cálculo del número de UFC de microorganismos por ml de suspensión. donde X es el promedio del número de colonias contadas en las tres réplicas de placas de la dilución seleccionada. 3.4 Validación del Método de Recuento Microbiano Control Negativo del Producto Se realizó el recuento microbiano de los productos utilizando frascos de vidrio con 90 ml de Caldo Letheen a los cuales se le agregó 10 ml de la muestra sin inocular. Se agitaron bien los frascos para homogeneizar la solución y con una pipeta se transfirió 1 ml de la solución a 6 placas de Petri por cada uno de los lotes en estudio: a 3 de ellas se le agregarían entre 15 y 20 ml de Agar Soya-Caseína fundido y enfriado a 45 C y a las 3 restantes se les agregó Agar Sabouraud Dextrosa en las mismas condiciones. Las placas fueron agitadas suavemente para que la muestra se mezclara completamente con el medio y, una vez que éste se solidificó, las placas se colocaron en incubación entre 30 y 35 C durante un tiempo 72 horas para el caso de las que contenían Agar Soya-Caseína, y entre 20 y 25 C durante un período 5 días para las placas que contenían Agar Sabouraud Dextrosa. Culminada la incubación, se procedió a contar las colonias presentes en las placas, esperando obtener un recuento de 10 UFC/ml de acuerdo con lo establecido en el protocolo de la empresa Determinación de ph de las Muestras Se tomó un frasco de vidrio con 90 ml de Caldo Letheen y se agregaron 10 ml de la muestra para obtener una dilución 1:10 de la misma y se procedió a determinar su ph, el cual debía presentar un valor entre 6 y 8. Esto se realizó una vez por cada uno de los lotes de los dos productos utilizados.
29 Preparación de las Muestras Para la preparación de las muestras se usaron frascos de vidrio con 90 ml de Caldo Letheen a los que se añadieron 10 ml del producto para obtener una dilución 1:10. Esto se realizó una vez por cada uno de los tres lotes de los dos productos utilizados y por separado para cada microorganismo de prueba. Además se realizó un control positivo para cada lote de producto con cada microorganismo, para lo cual se tomaron frascos de vidrio con 100 ml de Caldo Letheen y no se les agregó muestra Cálculo del Volumen de Suspensión a Inocular Para E. coli, S. aureus, P. aeruginosa, B. spizizenii y C. albicans El volumen del inóculo a utilizar no debe ser mayor al 1% de la muestra diluida, que en este caso es 1 ml, y debe contener una cantidad menor o igual a diez mil UFC ( 10000) de los microorganismos de estudio. Para ello, a partir de la suspensión madre de los microorganismos se realizaron diluciones seriadas hasta obtener una dilución que tuviera una densidad de orden Luego de allí fue posible proceder de dos maneras: Caso 1: se calculó el volumen total de solución, la cual, al agregar 1 ml de la dilución de orden 10 4, se tendría una densidad de UFC/ml. Para esto se utilizó la siguiente fórmula: donde: Di = densidad inicial de la suspensión de orden Df = densidad final deseada = UFC/ml = 1*10 4 UFC/ml. X = volumen total de la solución que contendría 1*10 4 UFC/ml. Ecuación 3.2. Cálculo del volumen de suspensión a inocular. A partir de esta solución obtenida con densidad 1*10 4 UFC/ml, el volumen a utilizar para inocular la muestra sería de 1 ml.
30 20 Caso 2: por medio de una regla de tres simple, se calculó directamente el volumen a tomar de la dilución de orden 10 4 que contuviera UFC para inocular la muestra, siempre que éste no fuera mayor a 1 ml Para A. brasiliensis En este caso, al igual que el anterior, el volumen del inóculo a utilizar no debe ser mayor al 1% de la muestra diluida (1 ml), pero debe contener una cantidad menor o igual a cinco mil UFC ( 5000) de los microorganismos. Para esto, a partir de la suspensión madre de los microorganismos se realizaron diluciones seriadas hasta obtener una dilución que tuviera una densidad de orden Luego de allí fue posible proceder de cualquiera de las dos maneras antes explicadas para determinar el volumen de suspensión que contuviera 5000 UFC (5*10 3 UFC) a utilizar para inocular la muestra Prueba de Aptitud del Método de Recuento Microbiano Se inocularon los frascos de la muestra y de control positivo con el volumen de la suspensión de microorganismo calculado agitando para homogeneizar la solución. De allí se transfirieron alícuotas de 1 ml a placas de Petri por triplicado y se agregó entre 15 y 20 ml del medio de cultivo correspondiente (ver Tabla 3.1) fundido y enfriado a 45 C, agitando suavemente para que el inóculo se mezclara completamente con el agar. Una vez solidificado el agar, las placas se colocaron en incubación bajo las condiciones correspondientes señaladas en la Tabla 3.1. Tabla 3.1. Medios de cultivo y condiciones de incubación para cada microorganismo de estudio (USP 37, 2014). Microorganismo P. aeruginosa S. aureus B. spizizenii E. coli C. albicans Medios de Cultivo y Condiciones de Incubación Hongos Filamentosos y Total de Aerobios Levaduras Agar Soya-Caseína C, 72 horas Agar Soya-Caseína C, 5 días A. brasiliensis N/A N/A Agar Sabouraud Dextrosa C, 5 días Agar Sabouraud Dextrosa C, 5 días
31 21 Una vez finalizado el período de incubación, se contaron las colonias observadas en las placas de prueba y en las placas control y se determinó el promedio de recuento de las tres réplicas realizadas. Se calculó el factor de dos (50% - 200%) del recuento promedio del grupo control y se determinó si la recuperación de los microorganismos de los grupos prueba no diferían en un factor mayor de dos con respecto al grupo control. 3.5 Validación del Método de Determinación de Microorganismos Específicos Las muestras preparadas en el punto y que fueron inoculadas con los microorganismos, se dejaron en incubación durante dos horas a temperatura ambiente (20-25 C) para luego ser utilizadas en la determinación de microorganismos específicos Para el Producto 1 A partir de la dilución 1:10 se preparó una dilución 1:100 en Caldo Soya-Caseína por separado para S. aureus y P. aeruginosa y una dilución 1:100 en Caldo Sabouraud Dextrosa para C. albicans. Los frascos con estas diluciones fueron incubados a una temperatura de C por 18 horas para el caso de S. aureus y P. aeruginosa y por 24 horas para C. albicans. Al finalizar la incubación, mediante el uso de un asa de inoculación se transfirió una porción del cultivo de S. aureus a una placa con Agar Manitol Salado, una porción del cultivo de P. aeruginosa a una placa con Agar Cetrimide y una porción del cultivo de C. albicans a una placa con Agar Sabouraud Dextrosa. Las placas fueron incubadas bajo las mismas condiciones descritas anteriormente para cada microorganismo. Una vez culminado el tiempo de incubación, se observaron las colonias presentes y se compararon con las características indicadas en la Tabla Para el Producto 2 A partir de la dilución 1:10 se preparó una dilución 1:100 en Caldo Soya-Caseína por separado para E. coli y P. aeruginosa. Los frascos con estas diluciones fueron incubados a una temperatura de C por un período de 18 horas. Luego de la incubación, con el uso de un asa de inoculación se transfirió una porción del cultivo de E. coli a una placa con Agar MacConkey y una porción del cultivo de P. aeruginosa a una placa con Agar Cetrimide. Las placas fueron incubadas bajo las mismas condiciones descritas anteriormente para los caldos y, una vez
32 22 finalizado el tiempo de incubación, se observaron las colonias presentes y se compararon con las características indicadas en la Tabla 3.2. Tabla 3.2. Características típicas de las colonias de los microorganismos de ensayo en los medios de cultivo utilizados (Allen, 2008). Microorganismo S. aureus Agar Manitol Salado Colonias redondas, pequeñas y amarillas; cambio de color del medio de rojo a amarillo. P. aeruginosa N/A Agar Cetrimide Agar Sabouraud Dextrosa Agar MacConkey N/A N/A N/A Colonias redondas, blancas muy pequeñas con pigmento verde que difunde en el medio. C. albicans N/A N/A N/A Colonias blancas grandes, con bordes lisos, filamentosas en algunos casos. No produce cambios en el medio. E. coli N/A N/A N/A N/A N/A Colonias grandes con bordes irregulares de color rosa, rojo o violeta, con un halo rosa alrededor de las colonias.
33 CAPÍTULO IV RESULTADOS Y DISCUSIÓN Los productos farmacéuticos son altamente susceptibles a la contaminación con microorganismos durante su producción y consumo, es por esta razón que las empresas farmacéuticas presentan estrictos controles de calidad microbiológica para sus productos, ya que productos contaminados representan un riesgo para la salud de los consumidores. Entre los principales controles que se realizan a los productos farmacéuticos no estériles se encuentran el recuento microbiano y la determinación de microorganismos patógenos, para determinar si éstos cumplen las especificaciones básicas y son aptos para la comercialización y consumo. 4.1 Recuento en Placa y Densidad de Microorganismos en las Suspensiones Madre Para la realización de los ensayos era necesaria la preparación de suspensiones estandarizadas de los microorganismos de prueba. El método más comúnmente utilizado para esto es el de recuento en placa, donde se siembran distintas diluciones de una suspensión microbiana para luego calcular el número de células viables presentes en la misma al contar el número de colonias que se desarrollan luego de la incubación, multiplicarlo por el factor de dilución y luego dividirlo entre el volumen inoculado en las placas (Stanier y col., 1996). La densidad de microorganismos presente en cada una de las suspensiones madre utilizadas se refleja en la Tabla 4.1. Tabla 4.1. Densidad aproximada de las suspensiones madre de los microorganismos (UFC/ml o esp/ml) obtenida a partir del método de recuento en placa. Microorganismos UFC/ml o esp/ml Producto 1 Producto 2 S. aureus 3,2 x ,6 x 10 8 P. aeruginosa 6,3 x ,7 x 10 8 B. spizizenii 5,2 x ,9 x 10 7 C. albicans 2,7 x ,3 x 10 7 A. brasiliensis 8,7 x ,8 x 10 7 E. coli N/A 2,6 x 10 8
34 24 Se realizaron suspensiones estandarizadas una vez para cada microorganismo y para cada producto por separado, y éstas fueron utilizadas para todos los lotes de producción en cada caso, evitando así que existieran posibles variaciones en los resultados para los distintos lotes que fueran de un mismo producto. A partir del recuento se tomó aquella dilución en la cual el promedio de las réplicas dio un valor entre 25 y 250 colonias, límites convenidos por la Food and Drugs Administration (FDA) de Estados Unidos para evitar inexactitudes en el recuento por la aglomeración y dificultad de desarrollo de las células y, por tanto, de su cuantificación, cuando están presentes demasiadas colonias en las placas (Tortora y col., 2007). En base a esto se obtuvieron los valores reflejados en la Tabla 4.1, en donde es posible observar que la densidad microbiana de las suspensiones varía entre los distintos microorganismos, presentando incluso distintos órdenes de magnitud, lo cual se debe al hecho de que, al momento de la preparación de las suspensiones, no se tomó un grado específico de turbidez para la comparación de las mismas que permitiera que todas las suspensiones presentaran una densidad de microorganismos aproximadamente igual, como por ejemplo, una turbidez de grado 1 en la escala de McFarland que equivale aproximadamente a 3*10 8 células/ml (Cobas y col., 2007). Otra forma en la que puede estandarizarse una suspensión es mediante el uso de un espectrofotómetro, sin embargo, en este caso no se disponía de uno al momento de llevar a cabo el presente trabajo. Es importante la utilización de suspensiones estandarizadas en este tipo de ensayos, ya que permiten al analista saber la concentración real en que se encuentran los microorganismos en dicha suspensión para así predecir los resultados teóricos y una vez realizado el ensayo poder determinar si los resultados obtenidos son correctos y aceptables. En el caso del producto 2 se incluyó en el ensayo Escherichia coli como microorganismo de prueba de acuerdo con los protocolos desarrollados por la empresa. Ésta es una bacteria que normalmente se encuentra en el tracto intestinal de los humanos, por lo que es utilizada como indicador de contaminación fecal (Hayhurst, 2004). La contaminación de productos con E. coli es muy común si no se mantiene una higiene adecuada y puede ocurrir por parte del personal durante su producción o por parte de los consumidores. Debido a que el producto 2 consistía en un jarabe, es decir, un producto de administración oral, se incluyó este microorganismo en el ensayo ya que, aunque la mayoría de las cepas que existen no son patógenas, las que sí lo son,
35 25 producen afecciones del sistema digestivo (Hayhurst, 2004), por lo cual, no es aceptable que los productos farmacéuticos no estériles puedan presentar contaminación por esta bacteria. 4.2 Validación del Método de Recuento Microbiano Control Negativo del Producto Como control negativo se realizó el recuento microbiano de los productos sin inocular, obteniendo como resultado los valores reflejados en la Tabla 4.2. Es posible observar que para cada lote de ambos productos el recuento de microorganismos viables fue de 10 UFC/ml, lo cual se considera una carga microbiana aceptable para productos no estériles como los evaluados y, por tanto, un resultado conforme. La prueba no detectó contaminación, lo que indica que los productos cumplen con el control básico de calidad para su comercialización y consumo. Sin embargo, se puede considerar una desventaja de este método la realización de diluciones de la muestra durante su preparación, lo que resulta en una cantidad muy pequeña a ser examinada, produciéndose una reducción en la sensibilidad de la prueba a la detección microbiana (Millar, 2003). Tabla 4.2. Resultados del control negativo del recuento microbiano para ambos productos en estudio. Producto Lote Recuento A 1 B C 10 UFC/ml A 2 B C 10 UFC/ml Determinación de ph de las Muestras Se midió el ph de las muestras preparadas sin inocular, una vez para cada lote, obteniendo los resultados presentados en la Tabla 4.3. Para todos los lotes del producto 1 se obtuvieron valores ligeramente por encima de la neutralidad, entre 7,17 y 7,22, mientras que para los tres lotes del producto 2 se obtuvieron valores alrededor de 6,40. En ambos casos se consideran resultados
36 26 conformes, ya que la USP (2014) establece que para estas pruebas los productos deben presentar valores de ph entre 6,0 y 8,0. Tabla 4.3. ph de las muestras en el medio de enriquecimiento. Producto Lote ph A 7,17 1 B 7,22 C 7,18 A 6,40 2 B 6,45 C 6,44 Es sabido que el intervalo de ph óptimo de crecimiento para la mayoría de las bacterias oscila entre 6,5 y 8,0, mientras que para los hongos se encuentra en un intervalo que tiende hacia la acidez (Nuevas-Paz y col., 2012). Específicamente para las bacterias utilizadas en este estudio, los rangos de ph óptimos para el crecimiento son los siguientes: para S. aureus entre 5,5 y 7,5 (Matiz y col., 2012; Rayo, 2012); para P. aeruginosa entre 6,6 y 7,0 (Durazo, 2006); para E. coli entre 4,3 y 9,5 (Durazo, 2006); y para B subtilis se encuentra en un intervalo muy similar a E. coli, entre 4,3 y 9,3 (Wilks y col., 2009; Pérez, 2012). Para los hongos el intervalo de ph óptimo de crecimiento oscila entre 2,0 y 7,0, mientras que para levaduras se encuentra entre 2,5 y 8,0 (Durazo, 2006). Es debido a esto que el rango de ph en el que se deben encontrar las muestras a analizar sea entre 6,0 y 8,0 según la USP, para garantizar que ocurra un desarrollo y recuperación adecuados de estos microorganismos de estudio Prueba de Aptitud del Método de Recuento Microbiano A pesar de que los laboratorios farmacéuticos tienen la libertad de seleccionar los procedimientos específicos de análisis de una determinada muestra, basados o no en los parámetros presentados por las farmacopeas, las autoridades reguladoras siempre esperan de los laboratorios la generación de datos de validación que soporten la aplicación de las pruebas y demuestren que ni las muestras, ni los reactivos, ni ningún aspecto del procedimiento afectan de alguna forma los resultados (Millar, 2003). La validación normalmente consiste en introducir en la muestra un nivel bajo conocido de microorganismos, seleccionados por ser generalmente representativos de aquellos encontrados en
37 27 el ambiente o durante su uso. Se mide la recuperación microbiana en presencia y ausencia del producto y se compara para determinar la capacidad de la prueba para recuperar los microorganismos de la muestra (Millar, 2003). En el presente estudio, para la validación del método de recuento microbiano de productos no estériles, se realizaron tres réplicas por cada uno de los lotes de los productos en estudio y del control positivo y los promedios de recuento de viables obtenidos de cada uno de estos y para cada microorganismo se reflejan en las Tablas 4.4 y 4.5. En todos los casos se inoculó un volumen de suspensión de microorganismos que contuviera UFC, excepto para A. brasiliensis, del cual se inocularon 5000 UFC, para obtener un recuento 100 y 50 UFC, respectivamente. El ensayo se llevó a cabo para todos los lotes de producto y su respectivo control positivo en un mismo día y utilizando la misma suspensión de cada microorganismo en todos los casos para evitar errores o variaciones que pudieran presentarse entre los resultados de realizarse en momentos diferentes o con diferentes suspensiones de un mismo microorganismo. Para el producto 1 es posible observar que el microorganismo que presentó los valores de recuento de viables más cercanos a 100 UFC tanto para el control como para los tres lotes de producción fue C. albicans en los dos medios de cultivo utilizados, Agar Soya-Caseína (ASC) y Agar Sabouraud Dextrosa (ASD) (ver Tabla 4.4). A. brasiliensis también presentó valores promedios de recuento bastante cercanos a las 50 UFC esperadas. En este caso, S. aureus fue el microorganismo del cual se obtuvieron los valores más bajos en el recuento de viables, tanto para el control como para los tres lotes del producto analizados. En la mencionada tabla es posible además observar el factor de 2 calculado para cada microorganismo a partir del promedio de los controles positivos respectivos, el cual representa el rango de valores dentro del cual se deben encontrar los promedios de colonias obtenidas para cada muestra analizada; en este sentido, se aceptan los resultados obtenidos por microorganismo para cada uno de los lotes del producto 1, ya que cada uno de ellos se encuentra dentro del intervalo respectivo calculado.
38 28 Tabla 4.4. Valores promedio obtenidos de la prueba de aptitud del método de recuento para el control y los tres lotes del producto 1. Microorganismo Recuento Promedio (UFC/ml o esp/ml) Medio de Factor de Control Cultivo Lote A Lote B Lote C 2 (+) S. aureus ASC 89,6 89,3 90,7 88,7 44,8-179,2 P. aeruginosa ASC 98 91,3 97,3 88, B. spizizenii ASC 91,3 96,6 88, ,7-182,6 C. albicans ASC 97, , ,7-194,6 C. albicans ASD 94, ,3 47,3-189,2 A. brasiliensis ASD 53,6 49, ,3 26,8-107,2 En el caso del producto 2, los microorganismos que presentaron un recuento más cercano a 100 UFC tanto en el control positivo como en cada lote estudiado fueron P. aeruginosa y C. albicans, al igual que en el caso anterior, para ambos medios de cultivo utilizados (ver Tabla 4.5). El recuento promedio obtenido para E. coli fue muy bajo tomando en consideración que se esperaba una recuperación de alrededor de 100 UFC. En la Tabla 4.5 también se refleja el factor de 2 calculado para cada microorganismo a partir del recuento de los controles positivos respectivos, en base a lo cual, se considerarían aceptables todos los resultados obtenidos para cada lote de producto por cada microorganismo, ya que los valores promedio de viables obtenidos en todos los casos se encuentran dentro de los rangos respectivos. Tabla 4.5. Valores promedio obtenidos de la prueba de aptitud del método de recuento para el control y los tres lotes del producto 2. Microorganismo Recuento Promedio (UFC/ml o esp/ml) Medio de Factor de Control Cultivo Lote A Lote B Lote C 2 (+) E. coli ASC 77 75,3 87,3 77,6 38,5-154 S. aureus ASC 91, ,3 45,9-183,4 P. aeruginosa ASC ,7 95, B. spizizenii ASC 85, ,3 84,3 42,9-171,4 C. albicans ASC 93, , ,7-186,6 C. albicans ASD 99 92, ,3 49,5-198 A. brasiliensis ASD 44, , ,2-88,6 Las diferencias claramente observables entre los resultados de los distintos microorganismos en ambos productos podría deberse a errores de cálculo al momento de realizar las diluciones
39 29 necesarias y de determinar el volumen de suspensión a inocular que se supone deba contener 100 o 50 UFC dependiendo del caso. Para corroborar los resultados obtenidos a partir del recuento de viables, se calculó para cada microorganismo y cada lote de los dos productos evaluados el porcentaje de recuperación microbiana. Sin importar las variaciones observables entre microorganismos, entre lotes de un mismo producto o entre productos, en todos los casos se obtuvo un porcentaje de recuperación igual o mayor a 90%, cumpliendo con lo establecido por la USP, en donde se establece como aceptable un porcentaje mínimo de recuperación del 70%, lo que permite comprobar que la metodología posee la capacidad de detectar una cantidad considerable y una gama de distintos microorganismos presentes en las muestras, como en el caso del estudio realizado por Arias y colaboradores (2013). En dicho estudio se comprueba mediante estos porcentajes que todos los microorganismos de prueba son capaces de crecer sin inconvenientes en presencia de productos preservados debido a la acción inactivante del Caldo Letheen, lo que es aplicable también en el presente trabajo, permitiendo descartar la acción de los preservativos de las muestras analizadas como posible fuente de errores en los resultados. De forma general, la prueba permite detectar diversos tipos de microorganismos que pueden estar presentes en productos farmacéuticos no estériles, con un alto porcentaje de recuperación para la cantidad de microorganismos inoculada, lo que indica que se puede aceptar este método para la evaluación de la inocuidad de materias primas y productos en la empresa. Con la validación se pueden determinar las posibles variaciones que se presentan en diferentes números de ensayos y de esta manera disminuir las posibilidades de error dentro de la técnica relacionados con el personal, el instrumental, los suministros y la metodología analítica utilizada, errores que generarían graves consecuencias para la empresa al no proporcionar un alto grado de confianza en los resultados obtenidos (Elles y col., 2010). Por tanto, cuando se llevan a cabo análisis de laboratorio, es necesario tomar en cuenta que existen diversos factores y variables que pueden afectar los resultados y que deben ser reducidos al mínimo para que éstos puedan ser confiables. Para pruebas de este tipo, la USP recomienda utilizar las suspensiones bacterianas y de levaduras dentro de las primeras 24 horas desde que son preparadas y las de hongos hasta 7 días almacenadas bajo refrigeración (USP 37, 2014). Sin embargo, en las pruebas realizadas, las
40 30 suspensiones madre de los distintos microorganismos fueron almacenadas bajo refrigeración durante el tiempo de incubación de las placas y hasta realizarse el recuento para determinación de la concentración de dichas suspensiones, lo que podría ser un inconveniente en el caso de los microorganismos que tengan un crecimiento más lento y cuyo recuento se realice pasadas las 24 horas. Esto puede representar una desventaja, ya que puede ocurrir la pérdida de células viables en la suspensión si éstas entran en fase de muerte, aunque intente retardarse este proceso manteniéndolas a bajas temperaturas (2-8 C aproximadamente). Otra posible fuente de error que podría representar una disminución en el número de colonias en el recuento, es la muerte de algunas células viables a causa del calor del agar fundido si éste se agrega a las placas estando muy caliente. El analista debe considerar que el agar fundido excesivamente caliente puede ocasionar la muerte de microorganismos presentes en la muestra y, por tanto, una reducción artificial del contaje detectado. Se toma como regla general que el frasco que contiene el agar no debe estar tan caliente que no sea posible sostenerlo en la mano (Millar, 2003). Existen además diversos factores que pueden considerarse respecto al muestreo para un recuento total de viables, como son, la forma en que es tomada la muestra, el tamaño de ésta y el momento en el que es tomada; la manipulación de la muestra puede influenciar la población microbiana de la misma; el tiempo que transcurre desde que la muestra es tomada hasta el momento de su análisis, así como las condiciones de almacenamiento bajo las cuales se mantiene, puede ocasionar cambios en los niveles de carga microbiana; además, es posible que las cepas de estudio utilizadas presenten cierto deterioro por diversas causas, siendo necesario un tratamiento previo para que pueda tener lugar su crecimiento durante el ensayo; es necesario también tener cuidado con la interpretación de los datos numéricos, sobre todo en aquellos ensayos que presentan limites de aceptación estrictos (Baird y Bloomfield, 1996). El error asociado a los analistas es otro factor a considerar, ya que está presente a pesar del cuidado que se tenga durante el procedimiento, lo que se evidencia cuando un mismo método es aplicado por varios analistas y se pueden observar variaciones en los resultados, aunque éstas puedan ser pequeñas.
41 Validación del Método de Determinación de Microorganismos Específicos Por separado, ni el recuento total de viables ni las pruebas específicas son totalmente satisfactorios, por esto, los laboratorios llevan a cabo ambas pruebas en conjunto para evaluar sus productos y materias primas y determinar si cumplen o no con las especificaciones de calidad. De acuerdo con la USP, existen microorganismos específicos que no deben estar presentes en las muestras que se analizan dependiendo del tipo de forma farmacéutica que sean éstas. Para las duchas vaginales no es permitida la presencia de S. aureus, P. aeruginosa y C. albicans, por lo tanto se realizan los análisis en los medios selectivos correspondientes para descartar su presencia en productos de este tipo, como es el caso del producto 1 utilizado en el presente trabajo. En el caso de jarabes se lleva a cabo el mismo procedimiento pero utilizando un medio selectivo que descarte la presencia de E. coli y de P. aeruginosa; este es el caso del producto 2 utilizado. Mediante el uso de Agar Manitol Salado, se evaluaron las muestras del producto 1 que fueron inoculadas con S. aureus para determinar si mediante este procedimiento es posible detectar la presencia de ese microorganismo en una muestra farmacéutica no estéril. Una vez transcurrido el tiempo de incubación, las placas fueron observadas para determinar las características que presentaban las colonias presentes y compararlas con las características especificadas en la Tabla 3.2 para así aceptar o no que el microorganismo presente era S. aureus. De la prueba realizada se obtuvieron colonias pequeñas, redondas con bordes regulares y con una coloración amarilla (ver Figura 4.1), además de esto se observó un cambio de color en el medio de cultivo de rojo a amarillo, tanto para el control positivo como para los tres lotes del producto 1. En base a esto se acepta que el método utilizado permite la detección e identificación de la bacteria S. aureus en caso de encontrarse presente en una muestra. El género Staphylococcus sp. se caracteriza por estar presente en la mucosa y en la piel de los humanos, sin embargo hay especies que se asocian aún más a la producción de enfermedades infecciosas como lo es caso de Staphylococcus aureus, la bacteria más virulenta y más reconocida de este género, un coco Gram positivo, ampliamente distribuido en la naturaleza (Rayo, 2012). Debido a esto, no es aceptable su presencia en ningún tipo de forma farmacéutica no estéril.
42 32 Control (+) Lote A Lote B Lote C Figura 4.1. Resultados obtenidos de la siembra del producto 1 inoculado con S. aureus en Agar Manitol Salado. De acuerdo con distintos manuales de medios de cultivo, el Agar Manitol Salado se emplea para el aislamiento selectivo de estafilococos patógenos en productos alimenticios, farmacéuticos y cosméticos. Staphylococcus aureus es un microorganismo capaz de tolerar concentraciones elevadas de cloruro de sodio a diferencia de la mayoría de las bacterias restantes, además, es capaz de fermentar el hidrato de carbono manitol. Por esta razón, el Agar Manitol Salado presenta una concentración de sal de 7,5% que inhibe el crecimiento de otros microorganismos favoreciendo a S. aureus, y presenta como indicador de ph al rojo de fenol, el cual, al fermentarse el manitol, vira de color rojo a amarillo debido a la producción de ácido (Panreac Química S.A., 2003; Tortora y col., 2007). Para los productos de aplicación vaginal no es aceptable la presencia de Candida albicans por ser la causa más frecuente de candidiasis humana, la cual puede presentar manifestaciones clínicas de tres tipos: mucocutáneas, cutáneas y sistémicas. La candidiasis de las mucosas afecta principalmente la cavidad bucal y el conducto vaginal, y es considerada de forma general como una de las principales enfermedades nosocomiales (Dinakaran, 2008).
43 33 Por tratarse de una ducha vaginal, al producto 1 se le realizó la prueba para la detección de C. albicans. Las muestras que habían sido inoculadas con este microorganismo fueron sembradas en Agar Sabouraud Dextrosa para determinar si a través de este método es posible su detección, obteniendo el crecimiento observado en la Figura 4.2. Tanto en el control positivo como para los tres lotes del producto se obtuvo crecimiento de colonias redondas, grandes, con bordes lisos y de color blanco, sin cambios observables en el medio de cultivo, lo cual cumple con las características típicas de las colonias de este microorganismo en este medio, comprobando así la capacidad del método para su detección en caso de encontrarse presente en algún producto farmacéutico. Control (+) Lote A Lote B Lote C Figura 4.2. Resultados obtenidos de la siembra del producto 1 inoculado con C. albicans en Agar Sabouraud Dextrosa. El Agar Sabouraud Dextrosa es uno de los medios de cultivo más antiguos y más comúnmente utilizados para el aislamiento y crecimiento de hongos y levaduras. Es un medio selectivo formulado para permitir el crecimiento de hongos e inhibir el crecimiento de bacterias, debido a que es un medio ácido (ph 5,6) y en ocasiones contiene antibióticos o sustancias antimicrobianas. Es efectivo para aislar selectivamente hongos de muestras ambientales, como de aire y suelo, permitiendo distinguir e identificar diferentes especies (Hare, 2013). Puede ser utilizado además
44 34 para el aislamiento de hongos de muestras cutáneas o levaduras de cultivos vaginales. Este agar es muy útil para aumentar la esporulación típica y proporcionar la morfología más característica de las colonias (Allen, 2008). Las Pseudomonas son organismos muy bien adaptados y con una amplia distribución en el ambiente y en el área hospitalaria, presentando una gran versatilidad nutricional que les permite sobrevivir a diversas condiciones. Dentro de este grupo, la especie que presenta una patogenicidad importante para los seres humanos es Pseudomonas aeruginosa (Fick, 1992). Este microorganismo puede causar enfermedades letales, infecciones locales que no amenacen la vida del individuo o pueden sólo colonizar las vías aéreas, piel o tracto urinario de forma asintomática (Stryjewski y Sexton, 2003). Debido a las áreas del cuerpo que pueden verse afectadas por esta bacteria, son diversos los tipos de productos farmacéuticos no estériles que son analizados para descartar su presencia. En el caso del presente estudio, se aplicó el método de detección de P. aeruginosa a ambos productos para comprobar que éste sea capaz de arrojar resultados positivos en caso de que dicho microorganismo se encuentre presente en una muestra. Tanto para el producto 1 (ver Figura 4.3a) como para el producto 2 (ver Figura 4.3b) se obtuvieron colonias circulares pequeñas, de color blancuzco, con aspecto viscoso y se observó una coloración verde fluorescente que difunde en el medio de cultivo, tanto en el caso de los controles positivos como en cada uno de los tres lotes de cada producto, comprobándose que el método permite determinar la presencia de este microorganismo en una muestra farmacéutica, ya que las características obtenidas se corresponden con las esperadas. a Control (+) Lote A Lote B Lote C
45 35 b Control (+) Lote A Lote B Lote C Figura 4.3. Resultados obtenidos de la siembra del producto inoculado con P. aeruginosa en Agar Cetrimide. a) Resultados para el producto 1. b) Resultados para el producto 2. De acuerdo con varios manuales de medios de cultivo, el Agar Cetrimide es un medio selectivo para el crecimiento de P. aeruginosa, ampliamente utilizado en la evaluación de muestras cosméticas, farmacéuticas y clínicas. Su formulación favorece la producción de pigmentos como piocianina y fluoresceína por parte de P. aeruginosa que dan el color característico al medio de cultivo cuando ésta está presente, debido al contenido de cloruro de magnesio y sulfato de potasio en su composición. La adición de cetrimida al medio actúa como agente inhibidor del crecimiento de una amplia variedad de microorganismos, incluidas otras especies de Pseudomonas diferentes de P. aeruginosa (Panreac Química S.A., 2003). Por ser medicamentos de administración oral, los jarabes no deben tener presencia de E. coli, por tanto se les aplica la prueba de microorganismos específicos para descartar que éste se encuentre presente. Por esta razón, para el producto 2 se evaluó el método para determinar su capacidad de detectar E. coli. Las muestras inoculadas con esta bacteria fueron sembradas en placas con Agar MacConkey obteniendo los resultados reflejados en la Figura 4.4. Tanto en el caso del control positivo como para los tres lotes analizados se obtuvieron colonias grandes con bordes irregulares y de color rosa intenso, casi rojo, con un halo de coloración similar alrededor de éstas que difunde en el medio de cultivo, lo que es concordante con las características típicas
46 36 esperadas, permitiendo aceptarse el método por su capacidad de detectar la presencia de Escherichia coli en la muestra. Control (+) Lote A Lote B Lote C Figura 4.4. Resultados obtenidos de la siembra del producto 2 inoculado con E. coli en Agar MacConkey. El Agar MacConkey es un medio de cultivo utilizado para el aislamiento de bacilos entéricos Gram negativos. En su fórmula presenta sales biliares y cristal violeta que inhiben el crecimiento de bacterias Gram positivas. Por la presencia de la lactosa, aquellas bacterias capaces de fermentarla acidifican el medio, cambiando el color del indicador rojo neutro presente en su composición, y formando colonias rojas o rosadas con un halo turbio alrededor que corresponde a la precipitación de las sales biliares a ph muy ácido. Las bacterias que no son capaces de fermentar la lactosa dan colonias incoloras en este medio, lo que permite su diferenciación de las que sí fermentan la lactosa (Panreac Química S.A., 2003; Prats, 2006). La prueba para la determinación de microorganismos patógenos específicos ha sido validada en el caso de los productos farmacéuticos analizados por ser capaz de arrojar los resultados esperados en cada caso para los microorganismos de prueba en los medios de cultivo selectivos para éstos, lo que presenta gran relevancia, ya que, dependiendo de la vía de administración de los distintos medicamentos no estériles, existen microorganismos cuya presencia no es aceptable bajo ninguna circunstancia por significar un riesgo para la salud de los consumidores.
47 37 CONCLUSIONES Y RECOMENDACIONES De la prueba de aptitud del método de recuento microbiano para el producto 1 se obtuvo que el microorganismo con el recuento promedio más cercano al esperado fue C. albicans para los dos medios de cultivo en los que se sembró, sin embargo, se aceptan los resultados obtenidos para todos los microorganismos de prueba, ya que sus valores de recuento promedio se hayan dentro de los intervalos respectivos definidos por el factor de dos, con porcentajes de recuperación 90%. Estos resultados se pueden considerar conformes, tomando como válida la metodología implementada. De la prueba de aptitud del método de recuento microbiano para el producto 2 se obtuvo que el microorganismo con el recuento promedio más cercano al esperado fue también C. albicans para los dos medios de cultivo en los que se sembró. En base al factor de dos y a los porcentajes de recuperación obtenidos ( 90%), se aceptan también los resultados obtenidos para los demás microorganismos de prueba, sin embargo, los valores de recuento promedio que se obtuvieron para E. coli son bajos en relación a los demás, por lo que se recomienda hacer una revisión de los posibles factores que pudieron influir en estos resultados. Se evaluó la aptitud del método de determinación de microorganismos específicos con S. aureus, C. albicans y P. aeruginosa para el producto 1 obteniendo crecimiento en todos los casos con las características típicas de estos microorganismos para los medios selectivos utilizados. Se acepta este procedimiento como válido, ya que de estar presente alguno de estos microorganismos en una muestra, sería posible su detección. Para el producto 2 también se evaluó la aptitud del método de determinación de microorganismos específicos, en este caso con E. coli y P. aeruginosa, obteniendo en todos los casos crecimiento con las características esperadas para los medios selectivos utilizados. Se corrobora la validez del procedimiento también en el caso de este producto, ya que mediante la metodología fue posible detectar los microorganismos de prueba utilizados. Se recomienda la utilización de un estándar de turbidez aproximada conocida para la comparación de las suspensiones preparadas para la realización de los análisis para eliminar un posible error en los resultados y crear más uniformidad entre todas las suspensiones realizadas.
48 38 Tomando en cuenta que, según lo establecido en los protocolos de la empresa, el límite de aceptación de microorganismos presentes en una muestra no estéril es de apenas 10 UFC, se recomienda llevar a cabo la metodología de validación inoculando una población menor de microorganismos para determinar si el método es lo suficientemente sensible para detectar densidades más bajas de microorganismos que las utilizadas en el presente trabajo. Se considera que en la realización de una dilución más de las muestras para llevar a cabo el análisis de microorganismos específicos podrían perderse microorganismos cuya presencia podría ser importante detectar, por tanto, se recomienda realizar este método utilizando las muestras originales sin llevar a cabo la dilución 1:100.
49 39 REFERENCIAS BIBLIOGRÁFICAS - Allen, S Koneman. Diagnóstico Microbiológico. 6ª edición. Ed. Médica Panamericana. Buenos Aires, Argentina pp. - Arias, T. D. y J. León Glosario de Medicamentos: Desarrollo, Evaluación y Uso. 1ª edición. Pan American Health Org. Washington D.C., Estados Unidos. 312 pp. - Arias, J.; D. S. Ortiz y A. González. Validación e Implementación de una Metodología para el Análisis Microbiológico de un Producto Líquido Preservado, Elaborado en una Industria Farmacéutica. Revista Cubana de Farmacia. 2013;47(2): Baird, R. y S. F. Bloomfield Microbial Quality Assurance in Pharmaceuticals, Cosmetics, and Toiletries. 2ª edición. CRC Press. Gran Bretaña, Reino Unido. 272 pp. - Barreiro, J. A. y A. J. Sandoval Operaciones de Conservación de Alimentos por Bajas Temperaturas. 1ª edición. Equinoccio. Caracas, Venezuela. 365 pp. - Bloomfield, S. F Guide to Microbiological Control in Pharmaceuticals and Medical Devices. 2ª edición. CRC Press. Florida, Estados Unidos. 504 pp. - Clavijo Díaz, A Fundamentos de Química Analítica. Equilibrio Iónico y Análisis Químico. 1ª edición. Univ. Nacional de Colombia. Bogotá, Colombia pp. - Cobas, H.; S. Pavoni, A. Zayas, F. Rodríguez, E. Álvarez y R. Contreras Aplicación de la Voltametría en el Análisis del Crecimiento Microbiológico. Sociedad Cubana de Bioingeniería. La Habana, Cuba. 4 pp. - Dinakaran, H Characteristics of Candida albicans Biofilm Formation in Synthetic Urine Medium. ProQuest. Texas, Estados Unidos. 41 pp. - Durazo, E Aprovechamiento de los Productos Pesqueros. 1ª edición. UABC. Baja California, México. 231 pp.
50 40 - Elles, E.; M. Salcedo, M. Muñoz y R. Mendoza. Validación de la Técnica de Recuento de Coliformes Totales y E. coli por el Método Filtración de Membrana en el Laboratorio de Control de Calidad de Aguas de Cartagena S.A E.S.P. Ciencia y Salud Virtual. 2010;2(1): Fick, R. B Pseudomonas aeruginosa the Opportunist. 1ª edición. CRC Press. Florida, Estados Unidos. 272 pp. - Folch, R. y O. Fernández Criterios que nos Muestran Algunas Farmacopeas Vigentes. Real Academia Nac. Medicina. Toledo, España. 123 pp. - Formoso, A.; D. Guillama, M. Castro y M. Mieres. La Gestión de la Calidad en un Centro de Investigación Científica Productor de Medicamentos y Servicios. La Habana, Cuba. Ingeniería Industrial. 2013;31: Gad, G. F.; R. A. Ibrahem y M. S. El-din. Microbial Evaluation of Some Non-sterile Pharmaceutical Preparations Commonly Used in the Egyptian Market. Tropical Journal of Pharmaceutical Research. 2011;10(4): Gennaro, A. R Remington Farmacia Vol ª edición. Ed. Médica Panamericana. Buenos Aires, Argentina pp. - Gómez, S.; M. I. Sierra, D. Pérez y S. Morante Análisis Instrumental Vol. 1. 1ª edición. Netbiblo. La Coruña, España. 256 pp. - Hare, J. M. Sabouraud Agar for Fungal Growth. Fungal Biology. 2013; Harris, D. C Análisis Químico Cuantitativo. 3ª edición. Reverte. Barcelona, España. 924 pp. - Hayhurst, C E. coli. 1ª edición. The Rosen Publishing Group. New York, Estados Unidos. 64 pp. - Madigan, M.; J. Martinko y J. Parker Biología de los Microorganismos. 12ª edición. Pearson Educación. Iberia, España pp.
51 41 - Matiz, G.; M. R. Osorio, F. Camacho, M. Atencia y J. Herazo. Diseño y Evaluación in vivo de Fórmulas para Acné basadas en Aceites Esenciales de Naranja (Citrus sinensis), Albahaca (Ocimum basilicum L) y Ácido Acético. Biomédica. 2012;32(1): Millar, R Handbook of Microbiological Quality Control in Pharmaceuticals and Medical Devices. 1ª edición. CRC Press. Florida, Estados Unidos. 280 pp. - Montoya, H. H Microbiología Básica para el Área de la Salud y Afines. 2ª edición. Editorial Universidad de Antioquía. Medellín, Colombia. 255 pp. - Mugoyela, V. y K. D. Mwambete. Microbial Contamination of Nonsterile Pharmaceuticals in Public Hospital Settings. Therapeutics and Clinical Risk Management. 2010;6: Nuevas-Paz, L.; J. C. Álvarez, A. Suárez-Torras, L. Sordo-Martínez, L. González-Hernández y C. J. Acosta-Esquijarosa. Estabilidad Físico-química y Microbiológica de la Corteza Fresca de Mangifera indica L. Revista Cubana de Plantas Medicinales. 2012;17(2): Panreac Química S.A Manual Básico de Microbiología. Cultimed. 4ª edición. 545 pp. - Pérez, M.; G. Ramírez, M. Pérez y P. Restrepo. Validación del Método Analítico para la Determinación de Valsartán en Plasma Humano por HPLC/UV con Adición de Estándar empleando Losartán como Estándar Interno. Colombia Médica. 2007;38(1): Pérez, I. Bacillus cereus y su Papel en las Intoxicaciones Alimentarias. Revista Cubana de Salud Pública. 2012;38(1): Prats, G Microbiología Clínica. 1ª edición. Ed. Médica Panamericana. Madrid, España. 366 pp. - Ratajczak, M.; M. M. Kubicka, D. Kaminska, P. Sawicka y J. Dlugaszewska. Microbiological Quality of Non-sterile Pharmaceutical Products. Saudi Pharmaceutical Journal. 2014;22: Rayo, L. X Colonización por Staphylococcus aureus en una Cohorte de Pacientes que asisten a Programa VIH. Pontificia Universidad Javeriana. Bogotá, Colombia. 29 pp.
52 42 - Schifter, L.; J. Puerto y P. Aceves. Las Farmacopeas de México y Estados Unidos en el Nuevo Milenio: Paralelismos y Divergencias. Anales de la Real Academia Nacional de Farmacia 2009;75(4): Soledad, B. E La Validación en la Industria. 1ª edición. 69 pp. - Stanier, R. Y.; J. L. Ingraham, M. L. Wheelis y P. R. Painter Microbiología. 5ª edición. Reverté. Barcelona, España. 768 pp. - Stryjewski, M. E. y D. J. Sexton Severe Infections Caused by Pseudomonas aeruginosa. 1ª edición. Springer Science and Business Media. New York, Estados Unidos. 236 pp. - Tortora, G. J.; B. R. Funke y C. L. Case Introducción a la Microbiología. 9ª edición. Ed. Médica Panamericana. Buenos Aires, Argentina. 959 pp. - USP <61> Examen Microbiológico de Productos No Estériles: Pruebas de Recuento Microbiano. Vol. 1. Maryland, Estados Unidos. - USP <62> Examen Microbiológico de Productos No Estériles: Pruebas de Microorganismos Específicos. Vol. 1. Maryland, Estados Unidos. - Wilks, J. C.; R. D. Kitko, S. H. Cleeton, G. E. Lee, C. S. Ugwu, B. D. Jones, S. S. BonDurant y J. L. Slonczewski. Acid and Base Stress and Transcriptomic Responses in Bacillus subtilis. Applied and Environmental Microbiology. 2009;75(4):
53 43 APÉNDICE A CARACTERÍSTICAS DE LAS COLONIAS OBTENIDAS DE LOS MICROORGANISMOS DE PRUEBA EN EL RECUENTO EN PLACA a b c d e f a) E. coli en ASC; b) S. aureus en ASC; c) P. aeruginosa en ASC; d) C. albicans en ASC; e) B. spizizenii en ASC; f) A. brasiliensis en ASD.
PROCEDIMIENTO DETECCIÓN Y ENUMERACIÓN POR NUMERO MAS PROBABLE (NMP) CON ETAPA DE PRE- ENRIQUECIMIENTO DE ENTEROBACTERIACEAE EN ALIMENTOS
 Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
ENUMERACIÓN DE ENTEROBACTERIACEAE EN ALIMENTOS SIN RESUSCITACIÓN. TÉCNICA RECUENTO EN PLACA
 PRT-712.03-040 Página 1 de 6 1. OBJETIVO Determinar el número de Enterobactereaceae presentes en un alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos
PRT-712.03-040 Página 1 de 6 1. OBJETIVO Determinar el número de Enterobactereaceae presentes en un alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos
USP FEUM ÍFICO CIENT Límites microbianos ENCUENTRO MEMORIAS
 Límites microbianos Origen de técnicas de cultivo en medios sólidos En 1881 dentro del Congreso Médico Internacional en Londres, Robert Koch describió un método de cultivo de microorganismos empleando
Límites microbianos Origen de técnicas de cultivo en medios sólidos En 1881 dentro del Congreso Médico Internacional en Londres, Robert Koch describió un método de cultivo de microorganismos empleando
ADIESTRAMIENTO EN LAS TÉCNICAS DE ANÁLISIS RUTINARIAS DEL LABORATORIO DE CONTROL DE CALIDAD DE LA EMPRESA LABORATORIOS ELMOR S.A.
 Universidad de Carabobo Facultad Experimental de Ciencia y Tecnología Departamento de Química Informe de Pasantías ADIESTRAMIENTO EN LAS TÉCNICAS DE ANÁLISIS RUTINARIAS DEL LABORATORIO DE CONTROL DE CALIDAD
Universidad de Carabobo Facultad Experimental de Ciencia y Tecnología Departamento de Química Informe de Pasantías ADIESTRAMIENTO EN LAS TÉCNICAS DE ANÁLISIS RUTINARIAS DEL LABORATORIO DE CONTROL DE CALIDAD
Revista Cubana de Plantas Medicinales. 2013;47(2):
 ARTÍCULO ORIGINAL Validación e implementación de una metodología para el análisis microbiológico de un producto líquido preservado, elaborado en una industria farmacéutica Validation and implementation
ARTÍCULO ORIGINAL Validación e implementación de una metodología para el análisis microbiológico de un producto líquido preservado, elaborado en una industria farmacéutica Validation and implementation
PRACTICAS ADECUADAS EN EL LABORATORIO DE MICROBIOLOGIA CAPITULO 1117, 1051 (USP 40) Farmacopea Nacional de los Estados Unidos Mexicanos (FEUM)
 PRACTICAS ADECUADAS EN EL LABORATORIO DE MICROBIOLOGIA CAPITULO 1117, 1051 (USP 40) Farmacopea Nacional de los Estados Unidos Mexicanos (FEUM) Norma Oficial Mexicana NOM-059-SSA1-2015 INSTALACIONES Áreas
PRACTICAS ADECUADAS EN EL LABORATORIO DE MICROBIOLOGIA CAPITULO 1117, 1051 (USP 40) Farmacopea Nacional de los Estados Unidos Mexicanos (FEUM) Norma Oficial Mexicana NOM-059-SSA1-2015 INSTALACIONES Áreas
2. Examen microbiológico de productos no estériles: pruebas de microorganismos específicos
 PROGRAMA CURSO VALIDACIONES MICROBIOLÓGICAS: FARMACOPÉICAS Y NO FARMACOPÉICAS CÓD. SENCE: 1237975004 OBJETIVOS DEL CURSO: Entregar conceptos que permitirán definir los parámetros para la validación de
PROGRAMA CURSO VALIDACIONES MICROBIOLÓGICAS: FARMACOPÉICAS Y NO FARMACOPÉICAS CÓD. SENCE: 1237975004 OBJETIVOS DEL CURSO: Entregar conceptos que permitirán definir los parámetros para la validación de
Verificación de la carga microbiana en los Culti-Loops
 Verificación de la carga microbiana en los Culti-Loops Mario Morote 1,*, Lourdes Zegarra 1, Carla Bernal 2 1 Planta de Producción de Radioisótopos, Instituto Peruano de Energía Nuclear, Av. Canadá 1470,
Verificación de la carga microbiana en los Culti-Loops Mario Morote 1,*, Lourdes Zegarra 1, Carla Bernal 2 1 Planta de Producción de Radioisótopos, Instituto Peruano de Energía Nuclear, Av. Canadá 1470,
Trabajo Práctico Nº 2
 Introducción Objetivo Fundamento Trabajo Práctico Nº 2 MÉTODO DE LA MEMBRANA FILTRANTE PARA EL ANÁLISIS MICROBIOLÓGICO DEL AGUA Materiales Procedimiento Resultados Conclusiones Actividades Adicionales
Introducción Objetivo Fundamento Trabajo Práctico Nº 2 MÉTODO DE LA MEMBRANA FILTRANTE PARA EL ANÁLISIS MICROBIOLÓGICO DEL AGUA Materiales Procedimiento Resultados Conclusiones Actividades Adicionales
NMX-BB-040-SCFI-1999 MÉTODOS GENERALES DE ANÁLISIS - DETERMINACIÓN DE LA ACTIVIDAD ANTIMICROBIANA EN PRODUCTOS GERMICIDAS
 MÉTODOS GENERALES DE ANÁLISIS - DETERMINACIÓN DE LA ACTIVIDAD ANTIMICROBIANA EN PRODUCTOS GERMICIDAS GENERAL METHODS FOR ANALYSIS - ANTIMICROBIAL ACTIVITY DETERMINATION TO GERMICIDAL PRODUCTS PREFACIO
MÉTODOS GENERALES DE ANÁLISIS - DETERMINACIÓN DE LA ACTIVIDAD ANTIMICROBIANA EN PRODUCTOS GERMICIDAS GENERAL METHODS FOR ANALYSIS - ANTIMICROBIAL ACTIVITY DETERMINATION TO GERMICIDAL PRODUCTS PREFACIO
9 MATERIALES Y MÉTODOS.
 9 MATERIALES Y MÉTODOS. Se evaluó la inactivación de Escherichia coli ATCC 25922 en agua destilada utilizando Dióxido de Titanio dopado con Nitrógeno, a diferentes condiciones de ph y de radiación solar
9 MATERIALES Y MÉTODOS. Se evaluó la inactivación de Escherichia coli ATCC 25922 en agua destilada utilizando Dióxido de Titanio dopado con Nitrógeno, a diferentes condiciones de ph y de radiación solar
PRACTICA Núm. 18 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN AGUA RESIDUAL
 I. OBJETIVO PRACTICA Núm. 18 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN AGUA RESIDUAL Determinar la presencia de coliformes totales y fecales en agua residual por el método del Número Más Probable,
I. OBJETIVO PRACTICA Núm. 18 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN AGUA RESIDUAL Determinar la presencia de coliformes totales y fecales en agua residual por el método del Número Más Probable,
LABORATORIO CONTROL MICROBIOLÓGICO SL.
 VALORACIÓN DE LA VIABILIDAD Y FUNGICA EN PLACA DE ESCAYOLA PARA FALSOS TECHOS REGISTRABLES INFORME DE ENSAYO Nº 200915 (Hoja 1 de 7) a) Laboratorio de ensayo... Control Microbiológico S.L. b) Cliente...
VALORACIÓN DE LA VIABILIDAD Y FUNGICA EN PLACA DE ESCAYOLA PARA FALSOS TECHOS REGISTRABLES INFORME DE ENSAYO Nº 200915 (Hoja 1 de 7) a) Laboratorio de ensayo... Control Microbiológico S.L. b) Cliente...
PARTE EXPERIMENTAL 1 MATERIALES, EQUIPOS Y REACTIVOS 1.1 MATERIAL Y EQUIPOS
 II PARTE EXPERIMENTAL El presente trabajo se realizó en el laboratorio del Centro Latino Americano de Enseñanza e Investigación de Bacteriología Alimentaria (CLEIBA), con sede en la Facultad de Farmacia
II PARTE EXPERIMENTAL El presente trabajo se realizó en el laboratorio del Centro Latino Americano de Enseñanza e Investigación de Bacteriología Alimentaria (CLEIBA), con sede en la Facultad de Farmacia
INFORME DE EVALUACIÓN DE DESINFECTANTES
 Página1., EL LÍDER MUNDIAL EN CERTIFICACIÓN, INSPECCIÓN Y CONTROL DE CALIDAD INFORME DE EVALUACIÓN DE DESINFECTANTES WellHome Ltda OL:268806 RUT : 77.760.020-6 ATENCIÓN A : Andrea Prenzlau DIRECCIÓN :
Página1., EL LÍDER MUNDIAL EN CERTIFICACIÓN, INSPECCIÓN Y CONTROL DE CALIDAD INFORME DE EVALUACIÓN DE DESINFECTANTES WellHome Ltda OL:268806 RUT : 77.760.020-6 ATENCIÓN A : Andrea Prenzlau DIRECCIÓN :
CULTIVO DE MICROORGANISMOS MEDIOS DE CULTIVO
 CULTIVO DE MICROORGANISMOS MEDIOS DE CULTIVO CULTIVO DE MICROORGANISMOS fuente de energía exógena nutrientes esenciales: agua, carbón, nitrógeno, minerales condiciones ambientales apropiadas: ph, temperatura,
CULTIVO DE MICROORGANISMOS MEDIOS DE CULTIVO CULTIVO DE MICROORGANISMOS fuente de energía exógena nutrientes esenciales: agua, carbón, nitrógeno, minerales condiciones ambientales apropiadas: ph, temperatura,
OZOSYSTEMS-MODELO ESTERILIZADOR DE INSTRUMENTAL CONSIDERACIONES TÉCNICAS
 OZOSYSTEMS-MODELO ESTERILIZADOR DE INSTRUMENTAL CONSIDERACIONES TÉCNICAS El generador de ozono modelo OZOSYSTEMS Esterilizador de Instrumental es un armario destinado a la esterilización de instrumental
OZOSYSTEMS-MODELO ESTERILIZADOR DE INSTRUMENTAL CONSIDERACIONES TÉCNICAS El generador de ozono modelo OZOSYSTEMS Esterilizador de Instrumental es un armario destinado a la esterilización de instrumental
Quito Ecuador EXTRACTO COSMÉTICOS. MICROBIOLOGÍA. DETECCIÓN DE CANDIDA ALBICANS (ISO 18416:2007, IDT)
 Quito Ecuador NORMA TÉCNICA ECUATORIANA NTE INEN-ISO 18416 Primera edición 2014-01 COSMÉTICOS. MICROBIOLOGÍA. DETECCIÓN DE CANDIDA ALBICANS (ISO 18416:2007, IDT) COSMETICS. MICROBIOLOGY. DETECTION OF CANDIDA
Quito Ecuador NORMA TÉCNICA ECUATORIANA NTE INEN-ISO 18416 Primera edición 2014-01 COSMÉTICOS. MICROBIOLOGÍA. DETECCIÓN DE CANDIDA ALBICANS (ISO 18416:2007, IDT) COSMETICS. MICROBIOLOGY. DETECTION OF CANDIDA
Últimas novedades en filtración
 Servicios Artículo Seguridad Alimentaria 01 Últimas novedades en filtración Comparación de las unidades de filtración para evaluar la recuperación microbiológica Tommaso Ronconi Director mundial de producto
Servicios Artículo Seguridad Alimentaria 01 Últimas novedades en filtración Comparación de las unidades de filtración para evaluar la recuperación microbiológica Tommaso Ronconi Director mundial de producto
PRACTICA Núm. 19 DETERMINACION DE ESTREPTOCOCOS FECALES EN AGUA
 PRACTICA Núm. 19 DETERMINACION DE ESTREPTOCOCOS FECALES EN AGUA I. OBJETIVO Investigar la presencia de Estreptococos fecales en una muestra de agua mediante la técnica del Número Más Probable (NMP) usando
PRACTICA Núm. 19 DETERMINACION DE ESTREPTOCOCOS FECALES EN AGUA I. OBJETIVO Investigar la presencia de Estreptococos fecales en una muestra de agua mediante la técnica del Número Más Probable (NMP) usando
NMP PARA LA DETERMINACION DE COLIFORMESY COLIFORMES FECALES EN AGUAS
 PRT-712.03-005 Página 1 de 6 1. OBJETIVO Este método es utilizado para estimar la densidad de bacterias del grupo coliformes y conocer la calidad sanitaria en aguas crudas 2. CAMPO DE APLICACIÓN Y ALCANCE
PRT-712.03-005 Página 1 de 6 1. OBJETIVO Este método es utilizado para estimar la densidad de bacterias del grupo coliformes y conocer la calidad sanitaria en aguas crudas 2. CAMPO DE APLICACIÓN Y ALCANCE
Validación de métodos en microbiología industrial y ambiental a la luz de la ISO 17025
 Validación de métodos en microbiología industrial y ambiental a la luz de la ISO 17025 Dios mío nos llego la auditoría!! 2 5.4.5 VALIDACIÓN DE LOS MÉTODOS La validación es la confirmación, a través del
Validación de métodos en microbiología industrial y ambiental a la luz de la ISO 17025 Dios mío nos llego la auditoría!! 2 5.4.5 VALIDACIÓN DE LOS MÉTODOS La validación es la confirmación, a través del
DESCRIPCION DE BIOCOUNTER
 DESCRIPCION DE BIOCOUNTER BIOCOUNTER es un Laminocultivo para Control Microbiológico Industrial utilizado ampliamente en el campo alimentario y áreas relacionadas. El análisis microbiológico realizado
DESCRIPCION DE BIOCOUNTER BIOCOUNTER es un Laminocultivo para Control Microbiológico Industrial utilizado ampliamente en el campo alimentario y áreas relacionadas. El análisis microbiológico realizado
BPM - CONTROL DE CALIDAD EN LA INDUSTRIA FARMACÉUTICA
 Dirección General de Medicamentos, Insumos y Drogas BPM - CONTROL DE CALIDAD EN LA INDUSTRIA FARMACÉUTICA Q.F. BETTY DANY LLANA GAGLIUFFI DIRECCIÓN DE CONTROL Y VIGILANCIA SANITARIA EQUIPO DE CONTROL Y
Dirección General de Medicamentos, Insumos y Drogas BPM - CONTROL DE CALIDAD EN LA INDUSTRIA FARMACÉUTICA Q.F. BETTY DANY LLANA GAGLIUFFI DIRECCIÓN DE CONTROL Y VIGILANCIA SANITARIA EQUIPO DE CONTROL Y
MISIÓN DE UN SERVICIO DE MICROBIOLOGÍA Información necesaria para tomar una decisión clínica o industrial, y adopción de medidas preventivas. Normas d
 DIAGNÓSTICO MICROBIOLÓGICO 1 MISIÓN DE UN SERVICIO DE MICROBIOLOGÍA Información necesaria para tomar una decisión clínica o industrial, y adopción de medidas preventivas. Normas de obtención de muestras
DIAGNÓSTICO MICROBIOLÓGICO 1 MISIÓN DE UN SERVICIO DE MICROBIOLOGÍA Información necesaria para tomar una decisión clínica o industrial, y adopción de medidas preventivas. Normas de obtención de muestras
PROCEDIMIENTO TECNICA NMP STAPHYLOCOCCUS AUREUS EN ALIMENTOS. BAM ONLINE 2001
 PRT-712.02-025 Página 1 de 9 1. OBJETIVO Estimar la densidad de bacterias S. aureus en matrices de alimento o agua como indicador sanitario 2. CAMPO DE APLICACIÓN Y ALCANCE El método de NMP es recomendado
PRT-712.02-025 Página 1 de 9 1. OBJETIVO Estimar la densidad de bacterias S. aureus en matrices de alimento o agua como indicador sanitario 2. CAMPO DE APLICACIÓN Y ALCANCE El método de NMP es recomendado
1. Introducción y antecedentes Glosario Alcance Aspectos a considerar... 3 Referencia... 7
 Anexo 4 Guía general para los estudios de los tiempos de espera 1. Introducción y antecedentes... 2 2. Glosario... 2 3. Alcance... 2 4. Aspectos a considerar... 3 Referencia... 7 1. Introducción y antecedentes
Anexo 4 Guía general para los estudios de los tiempos de espera 1. Introducción y antecedentes... 2 2. Glosario... 2 3. Alcance... 2 4. Aspectos a considerar... 3 Referencia... 7 1. Introducción y antecedentes
INFORME DE RESULTADOS
 INFORME DE RESULTADOS Los análisis realizados al producto con Aloe vera, se desarrollaron de acuerdo a lo establecido en CCAYAC-P-062, para determinar la dilución correspondiente con las 3 cepas analizadas
INFORME DE RESULTADOS Los análisis realizados al producto con Aloe vera, se desarrollaron de acuerdo a lo establecido en CCAYAC-P-062, para determinar la dilución correspondiente con las 3 cepas analizadas
Procedimiento de Muestreo [25] Recipientes de muestreo: Los recipientes de muestro utilizados fueron de
![Procedimiento de Muestreo [25] Recipientes de muestreo: Los recipientes de muestro utilizados fueron de Procedimiento de Muestreo [25] Recipientes de muestreo: Los recipientes de muestro utilizados fueron de](/thumbs/81/84303382.jpg) Apéndice A Procedimiento de Muestreo [25] Recipientes de muestreo: Los recipientes de muestro utilizados fueron de plástico y de vidrio, adecuados para el manejo durante el trabajo de campo y durante el
Apéndice A Procedimiento de Muestreo [25] Recipientes de muestreo: Los recipientes de muestro utilizados fueron de plástico y de vidrio, adecuados para el manejo durante el trabajo de campo y durante el
SÍNTESIS DE LA PROGRAMACIÓN
 www.iesanctipetri.com Modelo MD7501PR05 Rev.: 1 Página 1 de 6 CURSO ACADÉMICO GRUPO MÓDULO PROFESOR/A 2017/2018 2ºLCB- A y B Microbiología clínica D. Manuel Prado Fernández D. José Nacente Aleu RESULTADOS
www.iesanctipetri.com Modelo MD7501PR05 Rev.: 1 Página 1 de 6 CURSO ACADÉMICO GRUPO MÓDULO PROFESOR/A 2017/2018 2ºLCB- A y B Microbiología clínica D. Manuel Prado Fernández D. José Nacente Aleu RESULTADOS
PRACTICA N 02: PROCESOS FERMENTATIVOS: PRODUCCION DE PROTEÍNA UNICELULAR O BIOMASA
 PRACTICA N 02: PROCESOS FERMENTATIVOS: PRODUCCION DE PROTEÍNA UNICELULAR O BIOMASA Capacidades a lograr: 1. Conoce y aplica técnicas de siembra, cultivo y cuantificación del proceso fermentativo para producción
PRACTICA N 02: PROCESOS FERMENTATIVOS: PRODUCCION DE PROTEÍNA UNICELULAR O BIOMASA Capacidades a lograr: 1. Conoce y aplica técnicas de siembra, cultivo y cuantificación del proceso fermentativo para producción
CONTROLES MICROBIOLÓGICOS
 CONTROLES MICROBIOLÓGICOS Pilar Gomis Muñoz Farmacéutica adjunta HGU Doce de Octubre. Madrid Grupo de Nutrición de la SEFH pilar.gomis@salud.madrid.org Mª Sagrario Pernía López Farmacéutica adjunta HGU
CONTROLES MICROBIOLÓGICOS Pilar Gomis Muñoz Farmacéutica adjunta HGU Doce de Octubre. Madrid Grupo de Nutrición de la SEFH pilar.gomis@salud.madrid.org Mª Sagrario Pernía López Farmacéutica adjunta HGU
Aplicación a escala de laboratorio
 Aplicación a escala de laboratorio Índice de contenidos Velcorin Aplicación a escala de laboratorio págs. 3 5 Introducción pág. 3 Medidas de precaución pág. 3 Método de trabajo (sensorial) pág. 4 Método
Aplicación a escala de laboratorio Índice de contenidos Velcorin Aplicación a escala de laboratorio págs. 3 5 Introducción pág. 3 Medidas de precaución pág. 3 Método de trabajo (sensorial) pág. 4 Método
Impurezas Análisis de Medicamentos Facultad de Química
 Impurezas Análisis de Medicamentos Facultad de Química M. en I. PEDRO VALADEZ ESLAVA psve1@yahoo.com.mx Generalidades sobre impurezas Impurezas provenientes del ingrediente activo (1) Las sustancias relacionadas
Impurezas Análisis de Medicamentos Facultad de Química M. en I. PEDRO VALADEZ ESLAVA psve1@yahoo.com.mx Generalidades sobre impurezas Impurezas provenientes del ingrediente activo (1) Las sustancias relacionadas
RepublicofEcuador EDICTOFGOVERNMENT±
 RepublicofEcuador EDICTOFGOVERNMENT± Inordertopromotepubliceducationandpublicsafety,equaljusticeforal, abeterinformedcitizenry,theruleoflaw,worldtradeandworldpeace, thislegaldocumentisherebymadeavailableonanoncommercialbasis,asit
RepublicofEcuador EDICTOFGOVERNMENT± Inordertopromotepubliceducationandpublicsafety,equaljusticeforal, abeterinformedcitizenry,theruleoflaw,worldtradeandworldpeace, thislegaldocumentisherebymadeavailableonanoncommercialbasis,asit
COMO ABORDAR Y RESOLVER ASPECTOS PRÁCTICOS DE MICROBIOLOGÍA
 COMO ABORDAR Y RESOLVER ASPECTOS PRÁCTICOS DE MICROBIOLOGÍA PROPUESTA DE EJERCICIOS Inés Arana, Maite Orruño e Isabel Barcina Departamento Inmunología, Microbiología y Parasitología Universidad del País
COMO ABORDAR Y RESOLVER ASPECTOS PRÁCTICOS DE MICROBIOLOGÍA PROPUESTA DE EJERCICIOS Inés Arana, Maite Orruño e Isabel Barcina Departamento Inmunología, Microbiología y Parasitología Universidad del País
BIORREACTRES. Estudios básicos y aplicados sobre procesos de fermentación
 BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
MICROBIOLOGÍA AGRÍCOLA
 MICROBIOLOGÍA AGRÍCOLA CONTROL DE LA CALIDAD DE ALIMENTOS Año 2015 TRABAJO PRÁCTICO N 9 PRÁCTICO N 9 CONTROL DE LA CALIDAD DE ALIMENTOS Objetivos: Conocer posibles contaminantes en alimentos. Conocer la
MICROBIOLOGÍA AGRÍCOLA CONTROL DE LA CALIDAD DE ALIMENTOS Año 2015 TRABAJO PRÁCTICO N 9 PRÁCTICO N 9 CONTROL DE LA CALIDAD DE ALIMENTOS Objetivos: Conocer posibles contaminantes en alimentos. Conocer la
Unidad 5. Técnicas de aislamiento de microorganismos Práctica 6. Técnicas de aislamiento de microorganismos.
 Unidad 5. Técnicas de aislamiento de microorganismos Práctica 6. Técnicas de aislamiento de microorganismos. Objetivos Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación
Unidad 5. Técnicas de aislamiento de microorganismos Práctica 6. Técnicas de aislamiento de microorganismos. Objetivos Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación
Medición del crecimiento Microbiano
 Medición del crecimiento Microbiano Determinación del número de microorganismos en una muestra. Determinación de la actividad metabólica, biomasa y proteínas. Métodos para el conteo de microorganismos
Medición del crecimiento Microbiano Determinación del número de microorganismos en una muestra. Determinación de la actividad metabólica, biomasa y proteínas. Métodos para el conteo de microorganismos
CRITERIOS TÉCNICOS DE EVALUACIÓN DE UN DOSSIER DE ESPECIALIDADES FARMACEUTICAS DIRECTIVA SANITARIA N 001-MINSA/DIGEMID V.01
 CRITERIOS TÉCNICOS DE EVALUACIÓN DE UN DOSSIER DE ESPECIALIDADES FARMACEUTICAS EQUIPO DE REGISTRO DE PRODUCTOS FARMACÉUTICOS DIRECCIÓN DE AUTORIZACIONES SANITARIAS VALIDACIÓN DE UN PROCEDIMIENTO ANALÍTICO
CRITERIOS TÉCNICOS DE EVALUACIÓN DE UN DOSSIER DE ESPECIALIDADES FARMACEUTICAS EQUIPO DE REGISTRO DE PRODUCTOS FARMACÉUTICOS DIRECCIÓN DE AUTORIZACIONES SANITARIAS VALIDACIÓN DE UN PROCEDIMIENTO ANALÍTICO
1 MATERIALES Y MÉTODOS
 1 MATERIALES Y MÉTODOS 1.1 ESQUEMA DE TRABAJO Toma de muestras mesofílicos aerobios por cuenta en placa (UFC*). coniformes fecales mediante NMP * Vibrio cholerae O1 Salmonella Staphyloccoccus aureus *NMP,
1 MATERIALES Y MÉTODOS 1.1 ESQUEMA DE TRABAJO Toma de muestras mesofílicos aerobios por cuenta en placa (UFC*). coniformes fecales mediante NMP * Vibrio cholerae O1 Salmonella Staphyloccoccus aureus *NMP,
Clostridium perfringens
 Clostridium perfringens Introducción Cuando se lanza un producto alimentario al mercado se deben tener en cuenta varios parámetros que le otorgan calidad al producto, uno de ellos es la inocuidad. Los
Clostridium perfringens Introducción Cuando se lanza un producto alimentario al mercado se deben tener en cuenta varios parámetros que le otorgan calidad al producto, uno de ellos es la inocuidad. Los
Coordinación Técnica de Regulación Sanitaria Dirección Técnica de Riesgos Sanitarios
 Coordinación Técnica de Regulación Sanitaria Dirección Técnica de Riesgos Sanitarios Abril, 2018 Página 3 de 10 CONTROL DE CAMBIOS Versión Descripción Fecha de Actualización 1 Emisión de Original Abril/2018
Coordinación Técnica de Regulación Sanitaria Dirección Técnica de Riesgos Sanitarios Abril, 2018 Página 3 de 10 CONTROL DE CAMBIOS Versión Descripción Fecha de Actualización 1 Emisión de Original Abril/2018
PREPARACIÓN DE MEDIOS DE CULTIVO
 Introducción Clasificación de los medios de cultivo Almacenamiento de los medios de cultivo Trabajo Práctico Nº 6 PREPARACIÓN DE MEDIOS DE CULTIVO Objetivo Fundamento Procedimiento Resultados Bibliografía
Introducción Clasificación de los medios de cultivo Almacenamiento de los medios de cultivo Trabajo Práctico Nº 6 PREPARACIÓN DE MEDIOS DE CULTIVO Objetivo Fundamento Procedimiento Resultados Bibliografía
PRUEBAS DE SENSIBILIDAD A AGENTES ANTIMICROBIANOS
 PRACTICA Nº2 DE MALALTIES INFECCIOSES I PRUEBAS DE SENSIBILIDAD A AGENTES ANTIMICROBIANOS Introducción La determinación de la sensibilidad a los agentes antimicrobianos es una de las principales funciones
PRACTICA Nº2 DE MALALTIES INFECCIOSES I PRUEBAS DE SENSIBILIDAD A AGENTES ANTIMICROBIANOS Introducción La determinación de la sensibilidad a los agentes antimicrobianos es una de las principales funciones
PRÁCTICO N 4. Análisis de fertilidad del suelo
 PRÁCTICO N 4 Análisis de fertilidad del suelo OBJETIVOS Conocer las técnicas actuales de recuento de microorganismos. Conocer la importancia del monitoreo de abundancia, actividad y diversidad de los microorganismos
PRÁCTICO N 4 Análisis de fertilidad del suelo OBJETIVOS Conocer las técnicas actuales de recuento de microorganismos. Conocer la importancia del monitoreo de abundancia, actividad y diversidad de los microorganismos
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO )
 PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUANTITATIVO DE ORINA ANÁLISIS CUALITATIVO DE ORINA M-1 M-2 M-3 M-4 Lectura de la placa de Agar CLED Identificación presuntiva
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUANTITATIVO DE ORINA ANÁLISIS CUALITATIVO DE ORINA M-1 M-2 M-3 M-4 Lectura de la placa de Agar CLED Identificación presuntiva
CAPÍTULO 5 CONSTRUCCIÓN Y PROCEDIMIENTOS PARA LA CARACTERIZACIÓN DEL REACTOR DE COLIMACIÓN.
 CAPÍTULO 5 CONSTRUCCIÓN Y PROCEDIMIENTOS PARA LA CARACTERIZACIÓN DEL REACTOR DE COLIMACIÓN. 5.1 Construcción del reactor. Para la construcción del reactor se adquirieron lámparas con una potencia de 15
CAPÍTULO 5 CONSTRUCCIÓN Y PROCEDIMIENTOS PARA LA CARACTERIZACIÓN DEL REACTOR DE COLIMACIÓN. 5.1 Construcción del reactor. Para la construcción del reactor se adquirieron lámparas con una potencia de 15
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA
 PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
AISLAMIENTO DE MICROORGANISMOS
 PRÁCTICA5 AISLAMIENTO DE MICROORGANISMOS Introducción En la naturaleza, la mayoría de los microorganismos no se encuentran aislados, sino integrados en poblaciones mixtas. Para llevar a cabo el estudio
PRÁCTICA5 AISLAMIENTO DE MICROORGANISMOS Introducción En la naturaleza, la mayoría de los microorganismos no se encuentran aislados, sino integrados en poblaciones mixtas. Para llevar a cabo el estudio
Gelatina Ácido ascórbico Carbón
 Instrucciones de uso n Epower USO PREVISTO Los microorganismos Epower son preparaciones cuantitativas liofilizadas de microorganismos destinadas al uso en laboratorios industriales para fines de control
Instrucciones de uso n Epower USO PREVISTO Los microorganismos Epower son preparaciones cuantitativas liofilizadas de microorganismos destinadas al uso en laboratorios industriales para fines de control
Cultivo Puro. Técnicas de aislamiento Mantenimiento y preservación de cultivos puros Morfología macroscópica Morfología microscópica
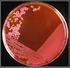 Cultivo Puro Técnicas de aislamiento Mantenimiento y preservación de cultivos puros Morfología macroscópica Morfología microscópica Definición El cultivo puro representa las condiciones artificiales para
Cultivo Puro Técnicas de aislamiento Mantenimiento y preservación de cultivos puros Morfología macroscópica Morfología microscópica Definición El cultivo puro representa las condiciones artificiales para
INGENIERÍA EN PROCESOS BIOALIMENTARIOS EN COMPETENCIAS PROFESIONALES ASIGNATURA DE CONTROL MICROBIOLÓGICO DE PROCESOS ALIMENTARIOS
 INGENIERÍA EN PROCESOS BIOALIMENTARIOS EN COMPETENCIAS PROFESIONALES ASIGNATURA DE CONTROL MICROBIOLÓGICO DE PROCESOS ALIMENTARIOS UNIDADES DE APRENDIZAJE 1. Competencias Administrar los recursos y procesos
INGENIERÍA EN PROCESOS BIOALIMENTARIOS EN COMPETENCIAS PROFESIONALES ASIGNATURA DE CONTROL MICROBIOLÓGICO DE PROCESOS ALIMENTARIOS UNIDADES DE APRENDIZAJE 1. Competencias Administrar los recursos y procesos
Bioquirama SAS PROCEDIMIENTO PRUEBA DE ANTAGONISMO
 OBJETIVO Determinar el nivel de Antagonismo de varios Microorganismos con características biofungicidas, Hongos y Bacterias benéficas empleadas en la elaboración de algunos insumos Biológicos, con el patógeno
OBJETIVO Determinar el nivel de Antagonismo de varios Microorganismos con características biofungicidas, Hongos y Bacterias benéficas empleadas en la elaboración de algunos insumos Biológicos, con el patógeno
REGLAMENTO NSO RTCA : 06 TÉCNICO CENTROAMERICANO
 REGLAMENTO NSO RTCA 11.01.35: 06 TÉCNICO CENTROAMERICANO PRODUCTOS FARMACÉUTICOS. VALIDACIÓN DE MÉTODOS ANALÍTICOS PARA LA EVALUACIÓN DE LA CALIDAD DE LOS MEDICAMENTOS Correspondencia: No hay correspondencia
REGLAMENTO NSO RTCA 11.01.35: 06 TÉCNICO CENTROAMERICANO PRODUCTOS FARMACÉUTICOS. VALIDACIÓN DE MÉTODOS ANALÍTICOS PARA LA EVALUACIÓN DE LA CALIDAD DE LOS MEDICAMENTOS Correspondencia: No hay correspondencia
INGENIERÍA EN PROCESOS BIOALIMENTARIOS
 HOJA DE ASIGNATURA CON DESGLOSE DE UNIDADES TEMÁTICAS 1. Nombre de la asignatura Control microbiológico de procesos alimentarios 2. Competencias Administrar los recursos y procesos alimentarios a través
HOJA DE ASIGNATURA CON DESGLOSE DE UNIDADES TEMÁTICAS 1. Nombre de la asignatura Control microbiológico de procesos alimentarios 2. Competencias Administrar los recursos y procesos alimentarios a través
Ensayo de Uniformidad de Unidades de Dosificación- UUD
 Ensayo de Uniformidad de Unidades de Dosificación- UUD Objetivo: verificar que cada unidad de dosificación de un lote en estudio, contenga una cantidad de principio activo dentro de un intervalo estrecho
Ensayo de Uniformidad de Unidades de Dosificación- UUD Objetivo: verificar que cada unidad de dosificación de un lote en estudio, contenga una cantidad de principio activo dentro de un intervalo estrecho
RECOPILADO POR: EL PROGRAMA UNIVERSITARIO DE ALIMENTOS
 NMX-F-187-1978. DETERMINACIÓN DEL NÚMERO MÁS PROBABLE DE GÉRMENES. METHOD OF TEST FOR GERMS MOST PROBABLE NUMBER. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. PREFACIO En la elaboración de esta Norma
NMX-F-187-1978. DETERMINACIÓN DEL NÚMERO MÁS PROBABLE DE GÉRMENES. METHOD OF TEST FOR GERMS MOST PROBABLE NUMBER. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. PREFACIO En la elaboración de esta Norma
MANUAL DE NORMAS Y PROCEDIMIENTOS PROCEDIMIENTO: CONTROL DE CALIDAD INTERNO
 UNIDAD DE LABORATORIO 1 DE 8 I. INTRODUCCIÓN La Garantía de calidad es un conjunto de procedimientos utilizados para asegurar la calidad de los resultados finales, cubriendo con ello todas las fases del
UNIDAD DE LABORATORIO 1 DE 8 I. INTRODUCCIÓN La Garantía de calidad es un conjunto de procedimientos utilizados para asegurar la calidad de los resultados finales, cubriendo con ello todas las fases del
Técnicas de monitoreo para la detección de microorganismos en el medio ambiente
 Técnicas de monitoreo para la detección de microorganismos en el medio ambiente Gloria Alicia Figueroa Aguilar Condiciones Ambientales REQUISITO: El laboratorio debe asegurarse que las condiciones ambientales,
Técnicas de monitoreo para la detección de microorganismos en el medio ambiente Gloria Alicia Figueroa Aguilar Condiciones Ambientales REQUISITO: El laboratorio debe asegurarse que las condiciones ambientales,
PROCEDIMIENTO RECUENTO MOHOS Y LEVADURAS EN ALIMENTOS NORMA ISO 7954
 PRT- 712.02-031 Página 1 de 9 1. OBJETIVO Conocer el número de Mohos y Levaduras que contiene un alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Este procedimiento se aplica a todos los alimentos de consumos
PRT- 712.02-031 Página 1 de 9 1. OBJETIVO Conocer el número de Mohos y Levaduras que contiene un alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Este procedimiento se aplica a todos los alimentos de consumos
TRAMADOL CLORHIDRATO SI
 Página 1 de 5 FICHA TECNICA TRAMADOL 100 MG / 2 ML CASA MATRIZ Información General: Vigente $%&&Diana Carolina Lara Gonzalez - () ' %$ Diego Andres Peralta L - (Director Tecnico Vitalis Colombia) (&Interno
Página 1 de 5 FICHA TECNICA TRAMADOL 100 MG / 2 ML CASA MATRIZ Información General: Vigente $%&&Diana Carolina Lara Gonzalez - () ' %$ Diego Andres Peralta L - (Director Tecnico Vitalis Colombia) (&Interno
Carrera: Químico Farmacobiólogo. Asignatura: ANÁLISIS FARMACEUTICOS Área del Conocimiento: QUÍMICA. Licenciatura Químico Farmacobiólogo
 Carrera: Químico Farmacobiólogo Asignatura: ANÁLISIS FARMACEUTICOS Área del Conocimiento: QUÍMICA Generales de la Asignatura: Nombre de la Asignatura: Clave Asignatura: Nivel: Carrera: Frecuencia (h/semana)
Carrera: Químico Farmacobiólogo Asignatura: ANÁLISIS FARMACEUTICOS Área del Conocimiento: QUÍMICA Generales de la Asignatura: Nombre de la Asignatura: Clave Asignatura: Nivel: Carrera: Frecuencia (h/semana)
VALIDACIÓN DE LOS PROCEDIMIENTOS ANALÍTICOS EMPLEADOS EN EL EXAMEN DE LOS MATERIALES FARMACÉUTICOS
 INFORME 32 ANEXO 5 VALIDACIÓN DE LOS PROCEDIMIENTOS ANALÍTICOS EMPLEADOS EN EL EXAMEN DE LOS MATERIALES FARMACÉUTICOS 1. En qué consiste la validación analítica? El control analítico de un producto farmacéutico,
INFORME 32 ANEXO 5 VALIDACIÓN DE LOS PROCEDIMIENTOS ANALÍTICOS EMPLEADOS EN EL EXAMEN DE LOS MATERIALES FARMACÉUTICOS 1. En qué consiste la validación analítica? El control analítico de un producto farmacéutico,
PRACTICA Núm. 12 AISLAMIENTO DE 2 MICROORGANISMOS Y OBTENCION DE UN CULTIVO AXENICO
 PRACTICA Núm. 12 AISLAMIENTO DE 2 MICROORGANISMOS Y OBTENCION DE UN CULTIVO AXENICO I. OBJETIVO Aislar dos microorganismos por la técnica de siembra de dilución por estría en placa de agar y obtener un
PRACTICA Núm. 12 AISLAMIENTO DE 2 MICROORGANISMOS Y OBTENCION DE UN CULTIVO AXENICO I. OBJETIVO Aislar dos microorganismos por la técnica de siembra de dilución por estría en placa de agar y obtener un
Trabajo Práctico Nº4: Análisis Bacteriológico del Agua. Lic Soria José
 Trabajo Práctico Nº4: Análisis Bacteriológico del Agua Lic Soria José Las fuentes del Agua Se considera agua potable de suministro público y agua potable de uso domiciliario la que es apta para la alimentación
Trabajo Práctico Nº4: Análisis Bacteriológico del Agua Lic Soria José Las fuentes del Agua Se considera agua potable de suministro público y agua potable de uso domiciliario la que es apta para la alimentación
PRODUCTO TRAMADOLCLORHIDRATO 50Mg/mL
 Página 1 de 7 FICHA TECNICA TRAMADOL 50 MG / 1ML CASA MATRIZ Información General: Vigente $%&&Diana Carolina Lara Gonzalez - () ' %$ Diego Andres Peralta L - (Director Tecnico Vitalis Colombia) (&Interno
Página 1 de 7 FICHA TECNICA TRAMADOL 50 MG / 1ML CASA MATRIZ Información General: Vigente $%&&Diana Carolina Lara Gonzalez - () ' %$ Diego Andres Peralta L - (Director Tecnico Vitalis Colombia) (&Interno
VALIDACIÓN DE MÉTODOS MICROBIOLÓGICOS Y BIOLÓGICOS
 VALIDACIÓN DE MÉTODOS MICROBIOLÓGICOS Y BIOLÓGICOS Referencia USP 29, Farmacopea Mexicana Validación de métodos analíticos AEFI 1de 21 Ensayos biológicos Los métodos biológicos se emplean para determinar
VALIDACIÓN DE MÉTODOS MICROBIOLÓGICOS Y BIOLÓGICOS Referencia USP 29, Farmacopea Mexicana Validación de métodos analíticos AEFI 1de 21 Ensayos biológicos Los métodos biológicos se emplean para determinar
PRACTICA Núm. 20 DETERMINACION DE CLOSTRIDIOS SULFITO REDUCTORES EN AGUA
 PRACTICA Núm. 20 DETERMINACION DE CLOSTRIDIOS SULFITO REDUCTORES EN AGUA I. OBJETIVO Determinar la presencia de Clostridios sulfito reductores en agua por el método de recuento en tubo. II. INTRODUCCION
PRACTICA Núm. 20 DETERMINACION DE CLOSTRIDIOS SULFITO REDUCTORES EN AGUA I. OBJETIVO Determinar la presencia de Clostridios sulfito reductores en agua por el método de recuento en tubo. II. INTRODUCCION
PROCEDIMIENTO RECUENTO DE AREOBIOS MESOFILOS EN LECHE UHT
 PRT-712.02-078 Página 1 de 8 1. OBJETIVO Conocer la calidad microbiológica de la leche sometida a ultra alta temperatura de acuerdo a lo establecido en el Reglamento Sanitario de los Alimentos. 2. CAMPO
PRT-712.02-078 Página 1 de 8 1. OBJETIVO Conocer la calidad microbiológica de la leche sometida a ultra alta temperatura de acuerdo a lo establecido en el Reglamento Sanitario de los Alimentos. 2. CAMPO
Informe Público de Evaluación
 REF. PTE. AUTORIZACIÓN Informe Público de Evaluación SULFATO DE MAGNESIO GENFARMA 150 mg/ml Solución inyectable y para perfusión Este documento resume cómo ha evaluado la Productos Sanitarios (AEMPS) los
REF. PTE. AUTORIZACIÓN Informe Público de Evaluación SULFATO DE MAGNESIO GENFARMA 150 mg/ml Solución inyectable y para perfusión Este documento resume cómo ha evaluado la Productos Sanitarios (AEMPS) los
1. FUNDAMENTOS TEÓRICOS
 DETERMINACIÓN DE LA MASA DE UNA SUSTANCIA 1. FUNDAMENTOS TEÓRICOS CLASIFICACIÓN DE LAS SUSTANCIAS Reactivos: La pureza de los reactivos es de fundamental importancia para la exactitud de los resultados
DETERMINACIÓN DE LA MASA DE UNA SUSTANCIA 1. FUNDAMENTOS TEÓRICOS CLASIFICACIÓN DE LAS SUSTANCIAS Reactivos: La pureza de los reactivos es de fundamental importancia para la exactitud de los resultados
3M Petrifilm Simplemente rápidas, precisas y productivas
 3M Petrifilm Simplemente rápidas, precisas y productivas Simplemente revolucionario El pequeño punto rojo que cambió la microbiología Las Placas 3M Petrifilm comenzaron con la curiosidad de un microbiólogo
3M Petrifilm Simplemente rápidas, precisas y productivas Simplemente revolucionario El pequeño punto rojo que cambió la microbiología Las Placas 3M Petrifilm comenzaron con la curiosidad de un microbiólogo
PROCEDIMIENTO RECUENTO DE AREOBIOS MESOFILOS EN LECHE UHT
 PRT- 712.02-078 Página 1 de 9 1. OBJETIVO Conocer la calidad microbiológica de la leche sometida a ultra alta temperatura de acuerdo a lo establecido en el Reglamento Sanitario de los Alimentos. 2. CAMPO
PRT- 712.02-078 Página 1 de 9 1. OBJETIVO Conocer la calidad microbiológica de la leche sometida a ultra alta temperatura de acuerdo a lo establecido en el Reglamento Sanitario de los Alimentos. 2. CAMPO
RECOPILADO POR: EL PROGRAMA UNIVERSITARIO DE ALIMENTOS
 NMX-F-308-1992. ALIMENTOS - CUENTA DE ORGANISMOS COLIFORMES FECALES. FOODS - FECALS COLIFORM ORGANISMS COUNT. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. PREFACIO En la elaboración de está Norma participaron
NMX-F-308-1992. ALIMENTOS - CUENTA DE ORGANISMOS COLIFORMES FECALES. FOODS - FECALS COLIFORM ORGANISMS COUNT. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. PREFACIO En la elaboración de está Norma participaron
Autor: Egdo. Jorge O. Muñoz P. Director: Ing. M.Sc. Iván Flores M.
 EVALUACIÓN DE LA CALIDAD MICROBIOLÓGICA EN 4 MARCAS DE YOGURT DISTRIBUIDO EN LA PROVINCIA DE CHIMBORAZO UTILIZANDO PLACAS PETRIFILM Autor: Egdo. Jorge O. Muñoz P. Director: Ing. M.Sc. Iván Flores M. INTRODUCCION
EVALUACIÓN DE LA CALIDAD MICROBIOLÓGICA EN 4 MARCAS DE YOGURT DISTRIBUIDO EN LA PROVINCIA DE CHIMBORAZO UTILIZANDO PLACAS PETRIFILM Autor: Egdo. Jorge O. Muñoz P. Director: Ing. M.Sc. Iván Flores M. INTRODUCCION
NORMA VENEZOLANA ALIMENTOS. PRINCIPIOS GENERALES PARA EL ESTABLECIMIENTO DE CRITERIOS MICROBIOLOGICOS
 NORMA VENEZOLANA ALIMENTOS. PRINCIPIOS GENERALES PARA EL ESTABLECIMIENTO DE CRITERIOS MICROBIOLOGICOS Proyecto de Norma Venezolana COVENIN 409:2016 2 da Revisión 1. Objetivo Esta norma venezolana COVENIN
NORMA VENEZOLANA ALIMENTOS. PRINCIPIOS GENERALES PARA EL ESTABLECIMIENTO DE CRITERIOS MICROBIOLOGICOS Proyecto de Norma Venezolana COVENIN 409:2016 2 da Revisión 1. Objetivo Esta norma venezolana COVENIN
UNIVERSIDAD NACIONAL MAYOR DE SAN MARCOS FACULTAD DE MEDICINA VETERINARIA LABORATORIO DE PATOLOGIA CLINICA
 INFORME DE EVALUACIÓN ANTIBIOTICA N DE REGISTRO DEL ANÁLISIS: 318-08 SOLICITANTE: REFERENTE: AGROVET MARKET S.A. Umberto Calderón Ojeda IDENTIFICACION DE PRODUCTO Nombre Comercial: Principio Activo: CEFA-MILK
INFORME DE EVALUACIÓN ANTIBIOTICA N DE REGISTRO DEL ANÁLISIS: 318-08 SOLICITANTE: REFERENTE: AGROVET MARKET S.A. Umberto Calderón Ojeda IDENTIFICACION DE PRODUCTO Nombre Comercial: Principio Activo: CEFA-MILK
5.2 Preparación del inóculo
 Américas, Puebla, las cuales se mantuvieron en agar papa dextrosa (Merck, Merck México) y se resembraron periódicamente cada 20 días (López-Malo, 1995). 5.2 Preparación del inóculo Se preparó el inóculo,
Américas, Puebla, las cuales se mantuvieron en agar papa dextrosa (Merck, Merck México) y se resembraron periódicamente cada 20 días (López-Malo, 1995). 5.2 Preparación del inóculo Se preparó el inóculo,
Laboratorio Nacional de Salud Pública
 1. Tinción de Gram 2. Objeto y campo de aplicación La técnica de tinción de Gram se utiliza para la tinción de bacterias, levaduras y actinomicetos aerobios. Este procedimiento operativo estándar es aplicable
1. Tinción de Gram 2. Objeto y campo de aplicación La técnica de tinción de Gram se utiliza para la tinción de bacterias, levaduras y actinomicetos aerobios. Este procedimiento operativo estándar es aplicable
GARANTÍA DE CALIDAD: Conjunto de actividades dirigidas a asegurar la calidad de los resultados analíticos.
 3 GARANTÍA DE CALIDAD: Conjunto de actividades dirigidas a asegurar la calidad de los resultados analíticos. CONTROL DE CALIDAD: CALIDAD TOTAL Niveles de Actuación: Dirección del laboratorio (relación
3 GARANTÍA DE CALIDAD: Conjunto de actividades dirigidas a asegurar la calidad de los resultados analíticos. CONTROL DE CALIDAD: CALIDAD TOTAL Niveles de Actuación: Dirección del laboratorio (relación
RTCA :09 Productos Naturales Medicinales para uso humano. Verificación de Calidad.
 RTCA 11.03.56:09 Productos Naturales Medicinales para uso humano. Verificación de Calidad. Objetivo del Reglamento Técnico: Establecer las pruebas analíticas que deben ser realizadas para verificar la
RTCA 11.03.56:09 Productos Naturales Medicinales para uso humano. Verificación de Calidad. Objetivo del Reglamento Técnico: Establecer las pruebas analíticas que deben ser realizadas para verificar la
ING. IRMA CASTILLO CARMONA CLISERIA RENDON DORANTES TECNICAS DE CULTIVOS VEGETALES FECHA: 19 DE MARZO DE 2013
 ING. IRMA CASTILLO CARMONA CLISERIA RENDON DORANTES TECNICAS DE CULTIVOS VEGETALES FECHA: 19 DE MARZO DE 2013 GENERALIDADES Solución Formulación MEDIO DE CULTIVO Los medios de cultivo constituyen un elemento
ING. IRMA CASTILLO CARMONA CLISERIA RENDON DORANTES TECNICAS DE CULTIVOS VEGETALES FECHA: 19 DE MARZO DE 2013 GENERALIDADES Solución Formulación MEDIO DE CULTIVO Los medios de cultivo constituyen un elemento
Trabajo Práctico Nº 5
 Introducción Objetivo Procedimiento Resultados Trabajo Práctico Nº 5 INFLUENCIA DE LAS CONDICIONES AM- BIENTALES EN EL CRECIMIENTO MICRO- BIANO Conclusiones Bibliografía INTRODUCCIÓN Las diferentes especies
Introducción Objetivo Procedimiento Resultados Trabajo Práctico Nº 5 INFLUENCIA DE LAS CONDICIONES AM- BIENTALES EN EL CRECIMIENTO MICRO- BIANO Conclusiones Bibliografía INTRODUCCIÓN Las diferentes especies
3M Seguridad Alimentaria Placas 3M TM Petrifilm TM y Lector de Placas 3M TM Petrifilm TM. Consistencia y Productividad maximizadas
 3M Seguridad Alimentaria Placas 3M Petrifilm y Lector de Placas 3M Petrifilm Consistencia y Productividad maximizadas Placas 3M Petrifilm... Funciones y características. de aerobios Recuento de la flora
3M Seguridad Alimentaria Placas 3M Petrifilm y Lector de Placas 3M Petrifilm Consistencia y Productividad maximizadas Placas 3M Petrifilm... Funciones y características. de aerobios Recuento de la flora
CONTROL DE CALIDAD DE MEDIOS DE CULTIVO. Maricela Esteban Méndez, Manuel Quintos Escalante, Alicia Herrera Benavides
 CONTROL DE CALIDAD DE MEDIOS DE CULTIVO Maricela Esteban Méndez, Manuel Quintos Escalante, Alicia Herrera Benavides Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional Unidad
CONTROL DE CALIDAD DE MEDIOS DE CULTIVO Maricela Esteban Méndez, Manuel Quintos Escalante, Alicia Herrera Benavides Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional Unidad
PROYECTO DE REGLAMENTO TÉCNICO ANDINO DE ESPECIFICACIONES TÉCNICAS MÍNIMAS PARA PRODUCTOS DE HIGIENE DOMESTICA CON PROPIEDAD DESINFECTANTE
 PROYECTO DE REGLAMENTO TÉCNICO ANDINO DE ESPECIFICACIONES TÉCNICAS MÍNIMAS PARA PRODUCTOS DE HIGIENE DOMESTICA CON PROPIEDAD DESINFECTANTE CAPÍTULO I OBJETO Y CAMPO DE APLICACIÓN Artículo 1.- El presente
PROYECTO DE REGLAMENTO TÉCNICO ANDINO DE ESPECIFICACIONES TÉCNICAS MÍNIMAS PARA PRODUCTOS DE HIGIENE DOMESTICA CON PROPIEDAD DESINFECTANTE CAPÍTULO I OBJETO Y CAMPO DE APLICACIÓN Artículo 1.- El presente
PROCEDIMIENTO TECNICA DE COAGULASA EN TUBO PRT
 Página 1 de 7 1. OBJETIVO Comprobar la facultad de las unidades formadoras de colonias de S. aureus presentes en una muestra de alimento, de coagular el plasma de conejo por acción de la enzima coagulasa
Página 1 de 7 1. OBJETIVO Comprobar la facultad de las unidades formadoras de colonias de S. aureus presentes en una muestra de alimento, de coagular el plasma de conejo por acción de la enzima coagulasa
APLICACION DEL SISTEMA BACTRAC IMPEDANCIA ELECTRICA EN ALIMENTACION
 APLICACION DEL SISTEMA BACTRAC IMPEDANCIA ELECTRICA EN ALIMENTACION Calidad microbiológica en la industria de alimentación CONTAMINACION DE LOS ALIMENTOS Multiplicación Alimentos alterados Alimentos peligrosos
APLICACION DEL SISTEMA BACTRAC IMPEDANCIA ELECTRICA EN ALIMENTACION Calidad microbiológica en la industria de alimentación CONTAMINACION DE LOS ALIMENTOS Multiplicación Alimentos alterados Alimentos peligrosos
Dice Debe decir Justificación* CAPÍTULO DE GENERALIDADES
 COMENTARIOS Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del 1º de agosto y hasta el 30
COMENTARIOS Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del 1º de agosto y hasta el 30
MGA LÍMITES MICROBIANOS
 EL TEXTO EN COLOR ROJO HA SIDO MODIFICADO Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del
EL TEXTO EN COLOR ROJO HA SIDO MODIFICADO Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del
Biplaca que se utiliza para evaluar la contaminación microbiológica de las superficies (Paredes, Techos, Equipos, Pisos, etc.) o Líquidos.
 BIPLACA HYCHECK Biplaca que se utiliza para evaluar la contaminación microbiológica de las superficies (Paredes, Techos, Equipos, Pisos, etc.) o Líquidos. Son estadísticamente comparables a una Torunda
BIPLACA HYCHECK Biplaca que se utiliza para evaluar la contaminación microbiológica de las superficies (Paredes, Techos, Equipos, Pisos, etc.) o Líquidos. Son estadísticamente comparables a una Torunda
Objetivos. S Determinar la presencia de bacterias coliformes en una muestra de agua
 Análisis del agua S Objetivos S Determinar la presencia de bacterias coliformes en una muestra de agua Introducción S Las tres pruebas básicas para determinar la presencia de bacterias coliformes (asociada
Análisis del agua S Objetivos S Determinar la presencia de bacterias coliformes en una muestra de agua Introducción S Las tres pruebas básicas para determinar la presencia de bacterias coliformes (asociada
PROCEDIMIENTO CONTROL ESTERILIDAD DE SANGRE Y HEMODERIVADOS PROCEDENTES DEL BIOTERIO
 PRT-712.02-096 Página 1 de 5 1. OBJETIVO Determinar la exclusión de contaminación microbiológica en muestras de hemoderivados procedentes de la Sección de Bioterios del Instituto de Salud Pública de Chile.
PRT-712.02-096 Página 1 de 5 1. OBJETIVO Determinar la exclusión de contaminación microbiológica en muestras de hemoderivados procedentes de la Sección de Bioterios del Instituto de Salud Pública de Chile.
ÍNDICE DE CONTENIDOS. ÍNDICE DE TABLAS. vi. ÍNDICE DE FIGURAS... vii. ÍNDICE DE APÉNDICES... xi. RESUMEN.. xii. ABREVIACIONES Y NOMENCLATURAS xiv
 ÍNDICE DE CONTENIDOS ÍNDICE DE TABLAS. vi ÍNDICE DE FIGURAS... vii ÍNDICE DE APÉNDICES... xi RESUMEN.. xii ABREVIACIONES Y NOMENCLATURAS xiv CAPÍTULO 1. INTRODUCCIÓN 1 1.1 Situación del Agua en el Mundo.
ÍNDICE DE CONTENIDOS ÍNDICE DE TABLAS. vi ÍNDICE DE FIGURAS... vii ÍNDICE DE APÉNDICES... xi RESUMEN.. xii ABREVIACIONES Y NOMENCLATURAS xiv CAPÍTULO 1. INTRODUCCIÓN 1 1.1 Situación del Agua en el Mundo.
INSTRUCCIONES DE USO. Microorganismos EZ-CFU USO PREVISTO COMPONENTES DE LA FÓRMULA
 INSTRUCCIONES DE USO Microorganismos EZ-CFU USO PREVISTO Los microorganismos EZ-CFU son preparaciones enumeradas liofilizadas de microorganismos para realizar controles de calidad en laboratorios industriales.
INSTRUCCIONES DE USO Microorganismos EZ-CFU USO PREVISTO Los microorganismos EZ-CFU son preparaciones enumeradas liofilizadas de microorganismos para realizar controles de calidad en laboratorios industriales.
Visto el artículo 2 párrafo 2 iv del Acuerdo del 3 de abril de 2001 por el cual se creó la Organización Internacional de la Viña y el Vino,
 RESOLUCIÓN OIV/OENO 329/2009 CODEX - LEVADURAS SECAS ACTIVAS - Modificación LA ASAMBLEA GENERAL, Visto el artículo 2 párrafo 2 iv del Acuerdo del 3 de abril de 2001 por el cual se creó la Organización
RESOLUCIÓN OIV/OENO 329/2009 CODEX - LEVADURAS SECAS ACTIVAS - Modificación LA ASAMBLEA GENERAL, Visto el artículo 2 párrafo 2 iv del Acuerdo del 3 de abril de 2001 por el cual se creó la Organización
