PRÁCTICA 1: Obtención de una Muestra de Sangre Endovenosa.
|
|
|
- Carla Aguilar Romero
- hace 7 años
- Vistas:
Transcripción
1 PRÁCTICA 1: Obtención de una Muestra de Sangre Endovenosa. Materiales: Bata. Jeringa. Aguja endovenosa. Vacutainer con EDTA. Cinta Elástica. Alcohol de 70º. Gasa estéril. Contenedor para residuos biológicos. Guantes. Esparadrapo. Procedimiento: 1. Pedir al paciente que se siente y que apoye el brazo extendido y en supinación sobre la mesa. Intentaremos que se encuentre lo más cómodo y relajado posible. 2. A continuación tendremos que localizar sobre el brazo una de las venas de la superficiales del codo donde se realizará la extracción. Estas venas podrán ser la cefálica, mediana, basílica. No es obligatorio ir a las venas del codo, pues en algunos pacientes se visualizan mejor ramas de la cefálica en el antebrazo. Para una mejor visualización el paciente puede cerrar y abrir el puño con fuerza. Además podemos ayudarnos con una cinta elástica que colocaríamos en el tercio medio del brazo (10-15 cm por encima del codo) para evitar un poco el retorno venoso.
2 3. Nos ponemos los guantes y limpiamos la zona de extracción con una gasa estéril con alcohol de 70º. 4. Preparamos la jeringa: la quitamos de su envoltorio, retiramos el plástico de la aguja y la colocamos sobre la jeringa. Quitamos el capuchón de la jeringa. Nos aseguramos que el émbolo está abajo del todo. Normalmente las jeringuillas ya vienen preparadas para esto, es decir, vienen haciendo vacío, con el émbolo abajo del todo. 5. Cogemos la jeringa de manera que el orificio de la aguja quede orientado hacia arriba y la introducimos con un ángulo de aproximadamente 45º en la vena previamente palpada y siguiendo su trayectoria. Al meter la aguja hay que hacerlo de una vez, sin dudas, firmes pero sin fuerza bruta.
3 6. Retiramos la cinta elástica del brazo. 7. Sostenemos bien la jeringa con una mano mientras que con la otra tiramos suavemente hacia atrás del émbolo y con cuidado de que al hacerlo no retiremos la aguja hasta que la jeringa recoja el volumen necesario para nuestro análisis. 8. Una vez finalizada la extracción, retiramos cuidadosamente la aguja del brazo. Esto se hace de forma limpia, de una vez pero con suavidad. 9. Inmediatamente después, tapamos la zona de la zona con una gasa y la fijamos con esparadrapo. Pedimos al paciente que presione, que flexione el codo un poco durante los primero minutos.
4 10. Pasamos el volumen de sangre recogido en la jeringa a un vacutainer que contiene el anticoagulante EDTA (el empleado en esta práctica y el más habitual). Cuando vertemos sangre en el vacutainer debemos empujarlo suavemente con el émbolo e ir derramando poco a poco sobre la pared del recipiente, ya que si no provocaríamos la lisis celular. Tras esto tapamos el vacutainer y ya tendremos lista la preparación para su análisis. El Ácido Etileno Diamino Tetracético (EDTA) tiene la particularidad de atrapar en su molécula iones de minerales y metales bivalentes que se encuentran en la circulación, en las paredes de las arterias o en las articulaciones, pero no puede afectar el calcio del hueso. Esta sustancia, que es un aminoácido, al captar el calcio depositado, devuelve su elasticidad a las arterias. De esa manera se promueve una mejor nutrición de las células y se vuelven a poner en acción diversos sistemas enzimáticos antes reprimidos. También impide la hemostasia, pues el calcio es un factor clave en ella. 11. Para finalizar depositamos la aguja en el contenedor de residuos biológicos con cuidado de no tocar la punta, así como los guantes y el resto de fómites usados.
5 PRÁCTICA 2: Obtención de un Frotis Sanguíneo. Materiales: Bata. Portaobjetos (x2). Lanceta. Cubreobjetos. Bandeja (cubeta). Pipeta Pasteur. Tubo de ensayo. Alcohol de 70º. Gasita estéril. Colorante Giemsa. Tampón PBS. Tampón de Inmersión. Agua Destilada. Guantes. Contenedor de residuos biológicos. Tirita. Microscopio óptico. Procedimiento: 1. Nos colocamos los guantes y desinfectamos la yema del dedo donde se realizará la extracción con una gasa estéril con alcohol de 70º. (Generalmente dedo índice o corazón). 2. Retiramos el envoltorio de la lanceta y, una vez evaporado el alcohol, procedemos a pinchar en un lateral de la yema (menos terminaciones nerviosas) del dedo con un movimiento rápido, pero nunca con demasiada fuerza. 3. A continuación, colocamos bajo el dedo el portaobjetos y presionamos suevamente la yema del dedo para que fluya más sangre hacia el exterior. Dejaremos que unas cuantas gotitas en el extremo del porta. (Generalmente la primera gota suele descartarse). 4. Cubrimos la herida con la tirita y depositamos la lanceta en el contenedor de residuos biológicos. 5. Cogemos el segundo portaobjetos mientras que con la otra mano sujetamos aquel en el que hemos depositado la muestra. Intentaremos poco a poco deslizar el portaobjetos siguiendo un movimiento primero retrógrado hasta tocar el borde donde se encuentra la sangre y posteriormente lo deslizamos hacia adelante para extender la gota. El portaobjetos que utilizamos para extender el frotis debemos colocarlo con una inclinación aproximada de 45 º.
6 Como se indica en el dibujo, obtendremos un frotis en el que distinguiremos 3 partes: la cabeza, donde existe mayor acumulo de la muestra de sangre, y por lo tanto donde veremos gran cantidad de eritrocitos que nos harán difícil visualizar bien los leucocitos; el cuerpo, que es la zona media donde ya no encontraremos tantos eritrocitos acumulados; Cola donde apenas encontramos ya eritrocitos.
7 Cabeza Cuerpo Cola 6. Dejamos secar y procedemos a fijar la muestra haciendo uso de alcohol: colocamos sobre la bandeja el portaobjetos y vertemos sobre él alcohol de 70 º utilizando una pipeta Pasteur. Comenzamos poniendo el alcohol por la cabeza y terminamos por la cola, teniendo siempre cuidado de no hacerlo con demasiada presión. 7. Esperamos 3 minutos. 8. Situamos el portaobjetos inclinado, apoyándolo en el borde de la cubeta para retirar el alcohol. 9. Después, preparamos la disolución Giemsa y PBS. Esta disolución suele prepararse con la proporción 1:9, por lo tanto pondremos en el tubo de ensayo 9 ml de PBS por cada ml de colorante Giemsa. 10. Volvemos a poner el porta sobre la base de la bandeja y vertemos con una pipeta Pasteur el colorante. Poco a poco vamos vertiendo generosamente y cubriendo toda la superficie, pero nunca con presión. Comprobaremos que el colorante aparece con cierto volumen sobre el portaobjetos (esto es gracias al fenómeno de tensión superficial del líquido).
8 11. Dejamos reposar la preparación unos minutos. 12. Para finalizar de preparar la muestra, apoyamos la cabeza del portaobjetos sobre uno de los bordes de la bandeja y procedemos a lavar el frotis con la pipeta Pasteur cargada de agua destilada. Iremos derramando el agua suavemente sobre la preparación desde la zona superior para quitar el exceso de colorante. 13. Ponemos el portaobjetos sobre el microscopio y observamos cual es la mejor zona de visualización de los diferentes tipos celulares en el frotis. 14. Una vez que elegida la zona cogemos el portaobjetos y añadimos una gotitas de fijador en ella para taparlo con un cubreobjetos.
9 15. Dejamos secar el portaobjetos y ya tenemos lista la preparación para observar al microscopio.
10 PRÁCTICA 3: Recuento Celular Sanguíneo. Materiales: Bata. Guantes. Lanceta. Eppendorf (x2). Líquido de Tulkarem. PBS. Cámara de Neubauer (Cámara cuentaglóbulos). Micropipeta. Gasa estéril. Alcohol de 70º. Tirita. Microscopio óptico. Contenedor de residuos biológicos. Procedimiento: 1. Nos ponemos los guantes y desinfectamos la yema del dedo con una gasita estéril empapada en alcohol de 70º. 2. Retiramos el envoltorio que contiene la lanceta y pinchamos en uno de los laterales de la yema del dedo (ver práctica 2). 3. Tiramos la lanceta al contenedor de residuos biológicos e inmediatamente después situamos la punta de la pipeta (con el tope bajado) sobre la sangre de la herida, mientras otra persona nos ayuda presionando el dedo para que salga más. Intentamos absorber poco a poco la sangre soltando lentamente el émbolo de la pipeta.
11 4. Vamos trasladando la sangre a los 2 Eppendorf. En cada uno de los Eppendorf pondremos un volumen de 0,5 µl. A la hora de ponerlo solo presionaremos hasta el primer tope de la pipeta, a diferencia de cuando recogíamos la sangre del dedo, en donde podíamos apretar hasta el 2º. 5. Ponemos una tirita en el lugar de la punción tras haber recogido la sangre. 6. En cada Eppendorf pondremos una disolución diferente. En uno se hará una para el recuento de glóbulos rojos, mientras que en el otro se hará para el recuento de leucocitos. 1º Eppendorf: Añadimos con la pipeta un volumen de 1000 µl de PBS. Cogemos el Eppendorf con dos dedos mientras que con otro dedo le damos golpecitos para permitir que se mezclen suavemente sin dañar la preparación. Este Eppendorf será el que utilizaremos para el recuento de eritrocitos. 2º Eppendorf: Añadimos 100 µl de líquido de Tulkarem. Mezclamos suavemente como con el anterior. Esta disolución será la que emplearemos para el recuento de leucocitos. El líquido de Tull contiene azul de metileno, un compuesto básico que tiñe muy bien todos aquellas moléculas ácidas como son el ADN y el ARN celular. De este modo sólo aparecerán marcados los núcleos. Este líquido también contiene Ácido acético, un compuesto que provoca la lisis de los eritrocitos. Así, cuando visualicemos nuestra preparación solo se apreciarán los núcleos de los leucocitos. 7. Recuento de leucocitos: Con una pipeta cogemos la solución con líquido de Tull y la vamos depositando en la zona central de la cámara de Neubauer. Repetimos esta operación hasta que el portaobjetos quede lleno.
12 8. Colocamos un cubreobjetos sobre la cámara de Neubauer. Podremos apreciar cómo las gotitas se expanden hacia las rejillas por capilaridad. 9. Situamos la cámara de Neubauer bajo la lente del microscopio. Podremos apreciar la presencia de una cuadrícula. Para el recuento de leucocitos contaremos los núcleos que apreciamos en cada uno de los 16 cuadritos de una de las esquinas del cuadro. Iremos contando de izquierda a derecha, como si estuviéramos leyendo. Cuando hayamos hecho el recuento del número de leucocitos de una de las áreas del cuadro (los leucocitos de los 16 cuadritos) aplicaremos la siguiente fórmula:
13 10. En nuestro caso realizamos un recuento de 26 leucocitos en una de las áreas (en 16 cuadraditos), de manera a que para hacer una estimación aproximada del número de leucocitos en sangre aplicamos la fórmula. El valor de leucocitos varía según la edad: Adultos / niños > 2 años Niños < 2 años Recién nacidos /mm /mm /mm3 El valor fisiológico de leucocitos en sangre está entre y por mm 3. Nuestro recuento ha sido de 5.200, así que puede considerarse que es un estado normal.
14 PRÁCTICA 4: Visualización de Leucocitos. Durante la Práctica de Visualización de Frotis sanguíneo se pudieron observar dos frotis sanguíneos cada uno con una tinción distinta: A. Visualización de leucocitos sobre un frotis sanguíneo teñido previamente mediante tinción Giemsa. (procedimiento en práctica 2). B. Extracción de sangre capilar, y tras extender el frotis se tiñó mediante la tinción de Wright. A) Visualización del frotis sanguíneo con tinción Giemsa, empleando aceite de inmersión y x100 aumentos): La tinción Giemsa nos permitió observar una gran variedad de células de la serie blanca. Las células más abundantes fueron los neutrófilos. La identificación de cada uno de los tipos de leucocitos se facilitó aún más, ya que se utilizó una lente de x100 aumentos con aceite de inmersión. B) Realización de la tinción de Wright: Tinción de Wright: Compuesta por azul de metileno y eosina. Esta técnica, al igual que la de Giemsa, es muy común para la visualización de frotis en el microscopio. Sin embargo, con la tinción de Wright se realiza una tinción más completa, ya que permite visualizar distintas coloraciones citoplasmáticas (pueden quedar reflejadas las granulaciones). Materiales: Lanceta. Alcohol. Gasa y Tirita. Cubeta. Tinte de Giemsa. Tinte de Wright. PBS. Pipeta Pasteur. Agua destilada. Microscopio. Bata. Procedimiento: 1. Obtener una muestra de sangre capilar. Para ello, primero nos pondremos los guantes y desinfectaremos con una gasa empapada en alcohol la yema del dedo, que a continuación pincharemos con la lanceta. (Más información en práctica 2) 2. Procedemos a extender la muestra y obtener así un frotis. (Véase práctica 2).
15 3. Dejar secar el frotis unos minutos. 4. Tinción de Wright: 4.1. Sumergimos el frotis en una solución de Giemsa: dejamos el portaobjetos sobre la cubeta y con la pipeta Pasteur tomaremos un volumen Giemsa repetidas veces y lo iremos añadiendo sobre el frotis hasta dejarlo totalmente cubierto por el tinte. Tras esto, dejamos secar un minuto y después procedemos a quitar el exceso de Giemsa antes de lavarlo, ayudándonos de un papel absorbente Pipeteamos agua destilada y la vamos añadiendo suavemente sin que ésta ejerza presión sobre el frotis. Para facilitar el lavado, apoyaremos uno de los extremos del frotis sobre uno de los bordes de la cubeta. Así, iremos poco a poco lavando la preparación hasta eliminar el exceso de Giemsa Prepararemos la tinción de Wright: Se debe tomar 1 volumen de líquido de Wright por cada 2 volúmenes de PBS. Una vez hayamos obtenido la mezcla, succionamos con una pipeta Pasteur y vamos añadiendo colorante sobre la muestra que reposa sobre la base de la cubeta. Tendremos que asegurarnos que la muestra queda totalmente cubierta por líquido de tinción.
16 4.4. Dejamos Reposar durante 10 minutos Lavaremos de nuevo el frotis con agua destilada y al igual que antes, no debemos ejercer presión al expulsar el agua desde la pipeta Dejaremos secar la tinción unos minutos. 5. Colocamos el cubreobjetos en la zona más interesante para observar en el microscopio con la ayuda del fijador. 6. Esperamos a que seque y visualizamos el portaobjetos en el microscopio óptico. En este caso, se utilizó aceite inmersión y un objetivo de x100 aumentos.
17 PRÁCTICA 5: Hematocrito. Objetivos: A. Entender los conceptos de: hematocrito, Volumen Corpuscular Medio y Hemoglobina Corpuscular Media. B. Comprender los cálculos que relacionan el hematocrito y el número de hematíes para obtener el volumen corpuscular y el volumen de hemoglobina corpuscular media. C. Conocer las técnicas para la obtención del hematocrito. D. Realizar el hematocrito con muestras de nuestra propia sangre. El índice de hematocrito: Porcentaje de glóbulos rojos que se encuentran en toda la sangre con respecto a la proporción de plasma sanguíneo. Nos da una idea de la cantidad de hematíes que la persona presenta en sangre (se hace en%). Los valores normales del hematocrito varían según el sexo, la edad, la condición física del sujeto o el laboratorio donde se haga la prueba: Varones adultos 42-52% Mujeres adultas 37-47% Lactantes - niños 30-43% Recién nacidos 44-64% En situaciones patológicas los valores pueden verse modificados, de ahí que este índice pueda ser de ayuda a la hora de elaborar un diagnóstico: Hematocrito disminuido: En situaciones patológicas como anemia, hemorragias, cáncer de colon, leucemia, desnutrición o deficiencia vitamínica en la dieta, mieloma múltiple o artritis reumatoide. Hematocrito elevado: En situaciones de deshidratación, quemaduras, diarrea, eritrocitosis, bajos niveles de O ₂ en sangre (hipoxia), policitemia vera (tipo de leucemia donde la serie eritroide es la que se ve afectada). Se debe obtener una muestra de sangre venosa (ya que el volumen de sangre que se obtendría de una muestra capilar sería insuficiente para realizar la medición). Una vez se tenga la muestra en un capilar se debe centrifugar. Al centrifugar el capilar, se podrán distinguir claramente 2 regiones. La parte superior y más diluida corresponde a la fracción plasmática, mientras que la parte inferior, más densa, corresponde a los elementos formes que componen la sangre. Lo más abundante en esta última son los hematíes y, esto es a lo que le llamamos hematocrito. Cabe recordar que el HC en venas es > HC en arterias, que es > HC en capilares (para más información ver a continuación el procedimiento de obtención de hematocrito con una muestra de sangre propia). A continuación procederemos a calcular el valor del hematocrito. Para la lectura del hematocrito se pueden emplear dos procedimientos distintos: Una regla, midiendo siempre en mm (el método empleado por nosotros), o un lector de hematocrito (utilizado en laboratorios).
18 CAPILAR En nuestro caso no se puedo llevar a cabo la medición del hematocrito, pues la centrifugadora no estaba calibrada y se convirtió en una trituradora, que rompió todos los capilares. Aún así, por ejemplo, si la fracción de elemento formes hubiera sido de 30 mm y nuestra fracción plasmática de 65 mm, tendríamos que hacer lo siguiente: Este valor estaría dentro del rango normal en un varón adulto. Cálculo del número de Hematíes a partir del hematocrito: A partir del índice del hematocrito se puede deducir la cifra de hematíes. Si los hematíes tienen una forma y un tamaño normal y un contenido en hemoglobina normal o poco alterado, la relación ente el número de hematíes (heme) y el índice de hematocrito (Ht) es una constante. Por lo tanto, el porcentaje de hematocrito multiplicado por una constante nos proporcionan el número de hematíes por mm 3. Los valores de nº de hematíes varían también con el sexo y la edad: Varones adultos Mujeres adultas Recién nacidos 4,7-6,1 millones/mm3 4,2-5,4 millones/mm3 4,8-7,1 millones/mm3
19 Volumen Corpuscular Medio: El Volumen Corpuscular Medio nos da idea del tamaño de los hematíes. Este parámetro es útil para el diagnóstico de anemias macrocíticas, producida, por ejemplo, por la falta de vit. B12; o anemias microcíticas producidas, por ejemplo, por deficiencia de hierro. El VCM varía con la edad: Adultos/niños/as Recién nacidos Concentración de Hemoglobina Corpuscular Media: Concentración de hemoglobina por unidad de volumen de eritrocitos. Este valor varía según la edad y sexo: Varones adultos Mujeres adultas Lactantes - niños Recién nacidos g/dl g/dl g/dl g/dl Realización de un hematocrito con nuestra propia sangre: Materiales Bata. Jeringa. Aguja endovenosa. Gasa estéril y tirita. Alcohol. Cinta elástica. Vacutainer con EDTA. Guantes. Contenedor de residuos Biológicos. Tubito Capilar (de 75mm de largo y 2 mm de diámetro interior y heparina de secado). Plastilina. Regla milimetrada. Centrifugadora de alta velocidad ( rpm).
20 Procedimiento 1. Procedemos a obtener una muestra sanguínea endovenosa. Para ello desinfectaremos la zona con una gasa empapada en alcohol y procederemos a la extracción. La sangre deberá incluirse en un vacutainer con el anticoagulante EDTA. (Para más información véase práctica 1). 2. A continuación traspasaremos un volumen de sangre que tenemos en el vacutainer el capilar. Para ello tapamos un extremo del capilar con la yema del dedo e introducimos el otro extremo del capilar en el vacutainer con sangre. Mantenemos el vacutainer con cierta inclinación y tras esto, desplazamos la yema del dedo del orificio del capilar. Así, al haber creado un vacío la sangre tenderá a ascender por el capilar con mayor facilidad. Poco a poco descender y ascender el capilar hasta que quede totalmente lleno. 3. Cuando el capilar esté lleno taparemos ambos extremos del capilar con plastilina para evitar que la sangre pueda perderse. 4. DEPOSITAMOS el capilar en el platillo de la centrifugadora y la Programamos 5 minutos a rpm. (Poner siempre un contrapeso). 5. Tras el centrifugado sacamos el capilar y podremos observar como la sangre del capilar aparece dividida en 2 fracciones: La fracción superior más diluida y sin apenas coloración (plasma) y la fracción inferior más densa y rojiza (elementos formes), compuesta principalmente por eritrocitos.
21 6. Para calcular el hematocrito tan sólo tendremos que medir con una regla milimetrada la longitud del capilar ocupada por cada fracción. Siendo: Y = Longitud de la fracción de células plasmáticas en el capilar. X = Longitud de la fracción de plasma sanguíneo en el capilar.
22 PRÁCTICA 6: Velocidad de Sedimentación Globular (VSG). Velocidad de sedimentación globular (VSG): Prueba de diagnóstico complementaria que mide la velocidad con la que los eritrocitos precipitan en el fondo del tubo de ensayo. Consiste en dejar en reposo durante un período de tiempo determinado (1-2 horas), la sangre total sin coagular (sangre no coagulada con citrato sódico al 3,8% durante una hora), produciéndose la separación de los hematíes de la concentración plasmática, de modo que sedimentan en el fondo del recipiente formando acúmulos en forma de pilas de monedas por la atracción de la superficie de los eritrocitos. La velocidad con la que se da el descenso de estos hematíes sedimentados es lo que define a la prueba de la velocidad de sedimentación globular (VSG). Este parámetro va a estar determinado por: La concentración y tamaño de los hematíes. La diferencia de densidad del plasma y hematíes. La viscosidad del plasma. La temperatura ambiente. La velocidad de sedimentación globular es muy sensible ante cualquier variación fisiológica o fisiopatológicos que pueda tener lugar. Por esta razón este parámetro no puede emplearse como prueba de diagnóstico, ya que existen múltiples variables con las que se puede ver afectada. Sin embargo, si puede utilizarse como prueba complementaria, como una prueba más que pueda ofrecer información hacia un diagnóstico. Etapas de sedimentación Globular:
23 Etapas de la Sedimentación Globular: 1. Hemaglutinación: tendencia a formar "pilas de monedas". 2. Sedimentación de los hematíes hacia el fondo del recipiente. 3. Acumulación de los hematíes en el fondo del recipiente. De estas 3 etapas la más importante es la primera etapa ya que de ella va a depender la velocidad con la que se dé el resto del proceso. Los eritrocitos van formando agregados, por ello, cuantos más agregados, más rápidamente van descendiendo. Mientras que si existen pocos agregados, la velocidad de sedimentación será mayor. En un individuo normal la VSG se mantiene gracias a un equilibrio entre la albúmina y el resto de las proteínas plasmáticas. A pesar de que sea una prueba tan inespecífica y cuyo uso sea siempre complementario, como ya hemos comentado es muy sensible, y su aumento es siempre signo de enfermedad (proceso inflamatorio, neoplásico o infeccioso). La VSG también se relaciona con la actividad de la enfermedad y puede ser útil para el seguimiento de ciertas afecciones como procesos inflamatorios crónicos (artritis reumatoide, tuberculosis...). Se sabe que el aumento de las globulinas sobre la albumina produce un incremento de la V.S.G., así como el aumento del fibrinógeno plasmático, aunque esto no indica ninguna patología concreta. El método más utilizado es el de Westergren, en el que la velocidad de sedimentación de los hematíes o eritrocitos son medidos en mm/hora. Los valores normales ronda dependiendo de la edad y el sexo los: Hombres Mujeres Niños Neonatos 0-15 mm / h 0-20 mm / h 0-10 mm / h 0-2 mm / h Alteraciones de la VSG: Aumento de la VSG: Puede ser producido por el envejecimiento, embarazo, menstruación, anemias, infarto agudo de miocardio, insuficiencia renal, neoplasias o tumores, hemorragias, gammapatías monoclonales como mielomas o incluso por un aumento de la fracción de inmunoglobulinas. En condiciones patológicas el aumento de proteínas plasmáticas sobretodo IgM propias de procesos de agudos, enfermedades reumáticas y la presencia de paraproteínas provocan un aumento de la hemaglutinación, ya que estas proteínas se asocian al agua y la densidad plasmática global cambia y por lo tanto, esto termina por aumentar la VSG. Disminución de la VSG: Puede venir dada por policitemias (aumento de la cantidad de eritrocitos, por ejemplo, por aumento de EPO), alteraciones eritrocitarias (en cuanto a su forma o volumen), disminución de fibrinógeno plasmático (hipofibrinogenenemia), etc.
24 Realización de una lectura de VSG en una muestra de sangre en una hora: Materiales: Bata. Jeringa. Aguja endovenosa. Gasa estéril. Alcohol 70º. Tirita. Guantes. Tubo con solución anticoagulante de citrato. Pipeta de Eritrosedimentación o de Westergreen (longitud 300mm y calibre 2,5 mm). Soporte inmovilizador milimetrado de la pipeta en posición vertical. Cronómetro. Procedimiento: 1. Extraer una muestra de sangre venosa, para ello desinfectaremos previamente la zona aplicando una gasa con alcohol, colocamos la cinta elástica y tras ello efectuaremos la extracción (véase práctica 1). La sangre debe quedar contenida en un tubo con citrato sódico en 109 mmol / L. Es importante haber llenar todo el tubo para asegurarnos así de que la proporción de citrato y de sangre es la adecuada: 1 volumen de anticoagulante de citrato: 4 volúmenes de sangre 2. Llenamos la pipeta Westergreen con nuestra muestra de sangre con una propipeta y enrasamos a los 0 mm. 3. Una vez llena ponemos la pipeta de Westergreen el soporte inmovilizador milimetrado, sobre el cual nuestra pipeta quedará en posición vertical. Debemos fijarnos en los mm que nos muestra el soporte nada más ponerlo, ya que se irá produciendo la sedimentación globular, de modo que la altura reflejada en el soporte será distinta al cabo de una hora. 4. Nosotros realizaremos la lectura 1 hora después de su extracción. De esta forma habrá tenido lugar una lenta separación entre los eritrocitos (zona inferior) y el
25 plasma sanguíneo (zona superior). Los eritrocitos habrán ido precipitando y sedimentándose en el fondo de la pipeta quedando apilados unos sobre otros como columnas de monedas. Cuanto más rápido se produzca la sedimentación de los eritrocitos, mayor será la VSG. Nos fijamos en la superficie del menisco de la columna de eritrocitos actual, no del plasma, con respecto a la parte superior de la columna donde se reflejaba 0 mm. La altura correspondiente en mm será el valor de la VSG para nuestra muestra de sangre.
26 PRÁCTICA 7: Tiempo de Protrombina o tiempo de Quick. En esta práctica aprenderemos a calcular el tiempo de protrombina o tiempo de Quick, que es el tiempo necesario para la coagulación de un plasma recalcificado en presencia de un exceso de tromboplastina hística. Materiales: Bata. Jeringa. Aguja endovenosa. Gasa estéril. Alcohol 70º. Cinta elástica. Vacutainer. Plasma pobre en plaquetas gracias a que la sangre se recoge con citrato sódico, 0,1 mol / L en proporción 1 volumen de citrato por cada 9 volúmenes de sangre. Pipeta. Suspensión de tromboplastina hística. Aparato de incubación hoyo 1 A. Imán activador del coágulo. Pocillos especiales para colocar muestra de incubación. Guantes. Contenedor de residuos biológicos. Procedimiento: 1. Obtenemos una muestra de sangre endovenosa (ver práctica 1). La muestra de sangre tendrá que quedar incluida en anticoagulante (citrato sódico).
27 2. Centrifugamos nuestra muestra de sangre con el anticoagulante durante 10 minutos. Cuando la centrifugación haya finalizado, en nuestra muestra se habrá fraccionado, distinguiéndose así, una región inferior compuesta por hematíes, una región compuesta por leucocitos y plaquetas y una región superior, la cual contiene plasma y es muy pobre en plaquetas. (Esta región pobre en plaquetas es la que buscamos, ya que queremos determinar el tiempo de coagulación sin que interfieran las plaquetas). 3. Pipeteamos 100 landas de plasma (la fracción superior) de la muestra centrifugada y lo introducimos en un pocillo. A continuación depositaremos el pocillo en el aparato de incubación y lo programaremos a 37ºC durante 10 minutos. De esta manera estaremos simulando las condiciones fisiológicas del cuerpo.
28 4. Una vez transcurridos los 10 minutos, depositamos en el pocillo un imán y a continuación colocamos nuestro pocillo ahora ya sobre el rotor y lo reprogramamos a 0,0. 5. Extraemos un volumen de 200 landas de tromboplastina y lo vertemos en el pocillo.
29 6. Pondremos en marcha el rotor. 7. A continuación calcularemos el tiempo de coagulación, el cual se corresponderá con el tiempo que se haya necesitado para que el imán deje de rotar. Cuando introducimos la tromboplastina estaremos activando la formación del coágulo, y mientras este se forme el imán girará. Un vez el imán se detenga querrá decir que se ha formado el coágulo y este impide que gire. El valor marcado en ese momento corresponderá al tiempo de coagulación. Si la tromboplasmina es la adecuada, el valor debe encontrarse entre los 12 y los 14 segundos.
30 PRÁCTICA 8: Determinación de los Grupos Sanguíneos. Los grupos sanguíneos AB0 son glucolípidos y proteínas que forman parte de la membrana de los hematíes y se diferencian por su diferente capacidad antigénica. Tales glucoproteínas se encuentran unidas a diferentes azúcares que son los que les proporcionan la especificidad de grupo: Grupo A: Contiene en la membrana la Galactosaminil-N-acetiltransferasa (sustancia A). Tendrá anticuerpos anti-b. Grupo B: Contiene en la membrana la Galactosiltransferasa (sustancia B). tendrá anticuerpos anti-a. Grupo AB: Contiene tanto los tipos de transferasa del A como de B. No da lugar a ningún anticuerpo. Grupo 0: No contiene ninguna transferasa (sustancia H). Da lugar a lo anticuerpos anti-a y anti-b. Normalmente la población sigue estos porcentajes en lo que se refiere a su grupo sanguíneo: El grupo antigénico no eritrocitario HLA (antígenos leucocitarios humanos) es un grupo antigénico presente en todas las células (incluidos en los glóbulos blancos) y su determinación es de gran importancia para poder evitar así el rechazo de trasplantes de órganos. El Sistema Rh es un sistema complejo basado en distintos antígenos eritrocitarios como Ag: D, C, E, c y e. De todos estos antígenos, el que presenta mayor capacidad antigénica es el D, por ello, en la determinación rutinaria del Rh sólo se investiga el Ag D: Rh+ si presenta el antígeno D (85% de la raza caucásica).
31 Rh- si no presenta antígeno anti D (15% de la raza caucásica). Durante esta práctica se pretende: 1. Determinar el grupo sanguíneo y sistema Rh para Ag D de nuestra muestra de sangre. 2. Entender las compatibilidades transfusionales de los grupos AB0 y Rh. Materiales: Bata. Jeringas. Agujas endovenosas. Tubo colector con EDTA. Alcohol. Gasas estériles. Guantes. Cinta elástica. Suero anti-a. Suero anti-b. Suero Anti-D. 3 Pipetas Pasteur. 3 Portaobjetos. 3 Puntas de micropipetas estériles para mezclar y agilizar así la aglutinación si es el caso. Rotulador permanente para marcar los portaobjetos. Procedimiento: 1. Obtenemos una muestra de sangre endovenosa (véase práctica 1) con una tubo colector con EDTA. La muestra puede proceder de punción capilar, pero esto implicaría depositar rápidamente gotas de sangre sobre los portaobjetos y, además se necesita una cantidad de sangre mayor de la que seguramente se obtendría con esta punción. 2. Cogemos los tres portaobjetos y con el rotulador marcamos en cada uno con el nombre del suero que depositaremos posteriormente. De manera que al final tendremos un portaobjetos rotulado como A, otro como B y otro como D. 3. A continuación añadiremos en el centro de cada portaobjetos su suero correspondiente. En el portaobjetos A añadiremos suero Anti-A, en el portaobjetos B añadiremos suero Anti-B y en el portaobjetos D añadiremos suero Anti-D. 4. Una vez tengamos preparados los portaobjetos, destaparemos el tubo colector con EDTA donde está contenida la muestra y con una de las pipetas Pasteur succionaremos un poco de sangre del tubo. A continuación depositaremos una ó dos gotitas de sangre sobre el suero del portaobjetos A. 5. Desechamos la pipeta Pasteur y ayudándonos de una de las puntas estériles procederemos mezclar suavemente pero sin detenerse, el suero con las gotitas de sangre siguiendo un movimiento circular. Lo haremos durante 2 minutos o hasta que vemos
32 que la mezcla se haya aglutinado. En caso de que se produzca aglutinación nos estará indicando que existe unión antígeno-anticuerpo y por ello la muestra de sangre contiene tal antígeno. 6. Repetiremos los pasos 4 y 5 pero esta vez con el portaobjetos B. 7. Para terminar terminaremos repitiendo los pasos 4 y 5, pero esta vez con el portaobjetos D para determinar así si el individuo es Rh+ o Rh-. En este portaobjetos tendremos que continuar el movimiento de la mezcla durante unos 3 minutos o algo más para poder determinar verdaderamente si se produce aglutinación o no, porque tarda más. Tipo O Rh+ No aglutinación en A y B Aglutinación en D Interpretación de los Resultados: Grupo Sanguíneo: Si la mezcla sólo se aglutina en el portaobjetos A: el grupo sanguíneo es A. Si la mezcla sólo se aglutina en el portaobjetos B: el grupo sanguíneo es B. Si la mezcla se aglutina en el portaobjetos A y también se aglutina en el portaobjetos B: el grupo sanguíneo es AB. Si la mezcla no se aglutina ni en el portaobjetos A ni en el portaobjetos B: el grupo sanguíneo es 0.
33 Sistema Rh para antígeno D: Si la mezcla se aglutina en el portaobjetos D: el individuo es Rh+. Si la mezcla no se aglutina en el portaobjetos D: el individuo es Rh-. Compatibilidades transfusionales del grupo AB0: El grupo O puede recibir solo de otro O; pero puede donar a todos, es el dador universal. El grupo A solo puede recibir de otro A o del O. El B solo puede recibir de otro B o del O. Y, por último, el AB puede recibir de todos los grupos sanguíneos (receptor universal), pero solo puede dar a otro AB. Compatibilidades transfusionales del sistema Rh: Un individuo del grupo Rh + no presenta anticuerpos Anti D por ello, es receptor de sangre del grupo Rh+ (sangre con Ag D) y del grupo Rh- (sangre sin Ag D). En cambio, un individuo del grupo Rh- presenta anticuerpos anti-d, por lo tanto sólo podrá recibir transfusiones de sangre que sean del grupo Rh- (aquellas que no contengan Ag D) y nunca podrá ser receptor de sangre de grupo Rh + (las cuales contienen antígeno D). A la hora de realizar la transfusión hay que tener en cuenta ambos sistemas (ABO y Rh), pues de pendiendo de cómo sean ambos la transfusión será posible o no: R E C E P T O R O- O+ A- A+ B- B+ AB- AB+ DONANTE O- O+ A- A+ B- B+ AB- AB+
Prácticas fisiología sangre y sistema inmunitario.
 Prácticas fisiología sangre y sistema inmunitario. Práctica 1: extracción de sangre Material Jeringuilla Agujas endovenosas Tubos de vacío o Vacutainer Algodón Cinta elástica Gasas Alcohol etílico 70%
Prácticas fisiología sangre y sistema inmunitario. Práctica 1: extracción de sangre Material Jeringuilla Agujas endovenosas Tubos de vacío o Vacutainer Algodón Cinta elástica Gasas Alcohol etílico 70%
Práctica 1. Obtención de una muestra sanguínea
 Práctica 1. Obtención de una muestra sanguínea Punción venosa Jeringas y agujas endovenosas de todas las medidas. Tubos de vacio o Vacutainer ( Con EDTA). Torundas de algodón Alcohol etílico al 70 % Ligadura
Práctica 1. Obtención de una muestra sanguínea Punción venosa Jeringas y agujas endovenosas de todas las medidas. Tubos de vacio o Vacutainer ( Con EDTA). Torundas de algodón Alcohol etílico al 70 % Ligadura
TEMA 3. RECOGIDA Y MANIPULACIÓN N DE MUESTRAS. COLORANTES EN HEMATOLOGÍA
 TEMA 3. RECOGIDA Y MANIPULACIÓN N DE MUESTRAS. COLORANTES EN HEMATOLOGÍA NORMAS PARA CORRECTA EXTRACCIÓN SANGUÍNEA #Punción venosa Región antecubital, yugular o femoral en RN, dorso de la mano y pie en
TEMA 3. RECOGIDA Y MANIPULACIÓN N DE MUESTRAS. COLORANTES EN HEMATOLOGÍA NORMAS PARA CORRECTA EXTRACCIÓN SANGUÍNEA #Punción venosa Región antecubital, yugular o femoral en RN, dorso de la mano y pie en
P08.- DETERMINACIÓN DE LOS GRUPOS SANGUÍNEOS
 P08.- DETERMINACIÓN DE LOS GRUPOS SANGUÍNEOS Objetivos de la práctica Comprender el concepto de grupo sanguíneo y conocer los tipos sanguíneos más importantes. Conocer la importancia de determinar el grupo
P08.- DETERMINACIÓN DE LOS GRUPOS SANGUÍNEOS Objetivos de la práctica Comprender el concepto de grupo sanguíneo y conocer los tipos sanguíneos más importantes. Conocer la importancia de determinar el grupo
Se tiene que preparar el frotis con anticipación y debes enfocar con el menor aumento y asi
 Frotis sanguíneo Material Porta objetos Microscopio Lanceta Placa excava de porcelana Tècnica Se limpia el dedo con alcohol y se hace una punción en el mismo hasta que caiga la gota de sangre que es necesaria
Frotis sanguíneo Material Porta objetos Microscopio Lanceta Placa excava de porcelana Tècnica Se limpia el dedo con alcohol y se hace una punción en el mismo hasta que caiga la gota de sangre que es necesaria
I Determinación de la velocidad de sedimentación eritrocitaria (VSE o VSG).
 I Determinación de la velocidad de sedimentación eritrocitaria (VSE o VSG). Técnica. 1 Extraiga sangre del tubo o frasco con una pipeta Pasteur. 2 Transfiérala a un tubo de Wintrobe y llénelo hasta la
I Determinación de la velocidad de sedimentación eritrocitaria (VSE o VSG). Técnica. 1 Extraiga sangre del tubo o frasco con una pipeta Pasteur. 2 Transfiérala a un tubo de Wintrobe y llénelo hasta la
P07 FISIOLOGÍA DE LA HEMOSTASIA
 P07 FISIOLOGÍA DE LA HEMOSTASIA Objetivos de la práctica Conocer las pruebas para el estudio de las diferentes vías coagulación y su significado clínico. Adquirir los conceptos de tiempo de sangría, tiempo
P07 FISIOLOGÍA DE LA HEMOSTASIA Objetivos de la práctica Conocer las pruebas para el estudio de las diferentes vías coagulación y su significado clínico. Adquirir los conceptos de tiempo de sangría, tiempo
TEMA 8: HEMATOLOGÍA. Hematíes: < Anemia, > Policitemia Leucocitos:<Leucopenia,>Leucocitosis Plaquetas: <Trombocitopenia, > Trombocitosis
 b) Métodos automáticos: basados en variaciones en la conductividad o resistencia, basados en la difracción Células: TEMA 8: HEMATOLOGÍA Hematíes: < Anemia, > Policitemia Leucocitos:Leucocitosis
b) Métodos automáticos: basados en variaciones en la conductividad o resistencia, basados en la difracción Células: TEMA 8: HEMATOLOGÍA Hematíes: < Anemia, > Policitemia Leucocitos:Leucocitosis
Procesado de muestras de sangre
 6 6.Prevención de la salud Procesado de muestras de sangre Los análisis de sangre son una herramienta diagnóstica muy útil en la Clínica Veterinaria. La fiabilidad de un análisis y su interpretación dependen
6 6.Prevención de la salud Procesado de muestras de sangre Los análisis de sangre son una herramienta diagnóstica muy útil en la Clínica Veterinaria. La fiabilidad de un análisis y su interpretación dependen
Fisiología del Tejido Sanguíneo Volemia y Glóbulos Rojos
 Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Programa de Enfermería Departamento de Ciencias Funcionales Sección de Fisiología Fisiología del Tejido Sanguíneo Volemia
Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Programa de Enfermería Departamento de Ciencias Funcionales Sección de Fisiología Fisiología del Tejido Sanguíneo Volemia
Programa Formativo. Objetivos. Código: Curso: Hematología y Hemoterapia. Duración: 70h.
 Código: 40657 Curso: Hematología y Hemoterapia Modalidad: ONLINE Duración: 70h. Objetivos La sangre es un tejido líquido que circula permanentemente por el sistema vascular y está formado por vasos sanguíneos
Código: 40657 Curso: Hematología y Hemoterapia Modalidad: ONLINE Duración: 70h. Objetivos La sangre es un tejido líquido que circula permanentemente por el sistema vascular y está formado por vasos sanguíneos
Técnico en Hematología y Hemoterapia. Sanidad, Dietética y Nutrición
 Técnico en Hematología y Hemoterapia Sanidad, Dietética y Nutrición Ficha Técnica Categoría Sanidad, Dietética y Nutrición Referencia 166762-1501 Precio 50.36 Euros Sinopsis La sangre es la especialidad
Técnico en Hematología y Hemoterapia Sanidad, Dietética y Nutrición Ficha Técnica Categoría Sanidad, Dietética y Nutrición Referencia 166762-1501 Precio 50.36 Euros Sinopsis La sangre es la especialidad
Volemia y Glóbulos Rojos
 UNIVERSIDAD CENTROCCIDENTAL LISANDRO ALVARADO DECANATO DE CIENCIAS DE LA SALUD DEPARTAMENTO DE FISIOLOGIA ENFERMERIA Volemia y Glóbulos Rojos Lic. Ana López-Fonseca ana.lopez@.ucla.edu.ve CONTENIDO.-Sangre
UNIVERSIDAD CENTROCCIDENTAL LISANDRO ALVARADO DECANATO DE CIENCIAS DE LA SALUD DEPARTAMENTO DE FISIOLOGIA ENFERMERIA Volemia y Glóbulos Rojos Lic. Ana López-Fonseca ana.lopez@.ucla.edu.ve CONTENIDO.-Sangre
QUE ES? Es la búsqueda de anticuerpos preformados contra los linfocitos de un posible donante en el suero de un paciente.
 CROSS MATCH QUE ES? Es la búsqueda de anticuerpos preformados contra los linfocitos de un posible donante en el suero de un paciente. Pueden estar específicamente dirigidos contra los antígenos HLA o contra
CROSS MATCH QUE ES? Es la búsqueda de anticuerpos preformados contra los linfocitos de un posible donante en el suero de un paciente. Pueden estar específicamente dirigidos contra los antígenos HLA o contra
Extracción de Sangre Venosa Periférica
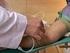 Extracción de Sangre Venosa Periférica Introducción La extracción venosa de sangre es un proceso muy acequiado en el análisis biológico dado que es posible detectar diversas enfermedades o condiciones
Extracción de Sangre Venosa Periférica Introducción La extracción venosa de sangre es un proceso muy acequiado en el análisis biológico dado que es posible detectar diversas enfermedades o condiciones
Técnicas de aglutinación En estas técnicas se hacen visibles los complejos Ag-Ac por la aglutinación que producen los anticuerpos cuando el Ag forma
 Técnicas de aglutinación En estas técnicas se hacen visibles los complejos Ag-Ac por la aglutinación que producen los anticuerpos cuando el Ag forma parte, o se ha unido artificialmente, a la superficie
Técnicas de aglutinación En estas técnicas se hacen visibles los complejos Ag-Ac por la aglutinación que producen los anticuerpos cuando el Ag forma parte, o se ha unido artificialmente, a la superficie
Sangre. Como parte del tejido conectivo esta formada por células y substancia intercelular llamada plasma
 Sangre Sangre Como parte del tejido conectivo esta formada por células y substancia intercelular llamada plasma Las células sanguíneas se dividen en: 1. Glóbulos rojos 2. Glóbulos blancos 3. Plaquetas
Sangre Sangre Como parte del tejido conectivo esta formada por células y substancia intercelular llamada plasma Las células sanguíneas se dividen en: 1. Glóbulos rojos 2. Glóbulos blancos 3. Plaquetas
TEÓRICO PRÁCTICO 2 HEMOGLOBINA HEMATOCRITO - ÍNDICES HEMATIMÉTRICOS VELOCIDAD DE SEDIMENTACIÓN GLOBULAR ALTERACIONES MORFOLÓGICAS DE LOS ERITROCITOS
 TEÓRICO PRÁCTICO 2 HEMOGLOBINA HEMATOCRITO - ÍNDICES HEMATIMÉTRICOS VELOCIDAD DE SEDIMENTACIÓN GLOBULAR ALTERACIONES MORFOLÓGICAS DE LOS ERITROCITOS 2017 Dra. Ana Cecilia Haro HEMOGLOBINA Molécula de la
TEÓRICO PRÁCTICO 2 HEMOGLOBINA HEMATOCRITO - ÍNDICES HEMATIMÉTRICOS VELOCIDAD DE SEDIMENTACIÓN GLOBULAR ALTERACIONES MORFOLÓGICAS DE LOS ERITROCITOS 2017 Dra. Ana Cecilia Haro HEMOGLOBINA Molécula de la
TOMA DE MUESTRA SANGUINEA
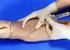 DEFINICIÓN: TOMA DE MUESTRA Procedimiento que permite acceder al torrente sanguíneo para extraer una pequeña muestra de sangre, que será utilizada en diversas pruebas. Dr. Eddie Alonzo RIII Medicina Interna
DEFINICIÓN: TOMA DE MUESTRA Procedimiento que permite acceder al torrente sanguíneo para extraer una pequeña muestra de sangre, que será utilizada en diversas pruebas. Dr. Eddie Alonzo RIII Medicina Interna
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS
 PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
Inmunohematología. Dra. Ana Cecilia Haro
 Inmunohematología 2016 Dra. Ana Cecilia Haro Sensibilización Aglutinación Ag + Ac Ag-Ac Enzimas LISS SAGH PEG Polibrene Albúmina Potencial zeta Tipo de Ac Densidad antigénica Tiempo de incubación Fuerza
Inmunohematología 2016 Dra. Ana Cecilia Haro Sensibilización Aglutinación Ag + Ac Ag-Ac Enzimas LISS SAGH PEG Polibrene Albúmina Potencial zeta Tipo de Ac Densidad antigénica Tiempo de incubación Fuerza
Fase inicial de agregación Fase de sedimentación rápida Fase final de concentración
 1.- Introducción: La membrana de los glóbulos rojos tiene una membrana electrostática negativa que da lugar a fuerzas de repulsión entre los hematíes que hacen que los eritrocitos tiendan a permanecer
1.- Introducción: La membrana de los glóbulos rojos tiene una membrana electrostática negativa que da lugar a fuerzas de repulsión entre los hematíes que hacen que los eritrocitos tiendan a permanecer
Inmunohematología 2017
 Inmunohematología 2017 REACCIONES DE HEMAGLUTINACIÓN 1-Sensibilización 2-Aglutinación Ag + Ac Ag-Ac FACTORES QUE AFECTAN LA HEMAGLUTINACIÓN Enzimas LISS SAGH PEG Polibrene Albúmina Potencial zeta Tipo
Inmunohematología 2017 REACCIONES DE HEMAGLUTINACIÓN 1-Sensibilización 2-Aglutinación Ag + Ac Ag-Ac FACTORES QUE AFECTAN LA HEMAGLUTINACIÓN Enzimas LISS SAGH PEG Polibrene Albúmina Potencial zeta Tipo
PRACTICA Núm. 6 TINCION DE FLAGELOS BACTERIANOS POR EL METODO DE LEIFSON
 PRACTICA Núm. 6 TINCION DE FLAGELOS BACTERIANOS POR EL METODO DE LEIFSON I. OBJETIVO Demostrar la presencia de flagelos mediante tinción y observar la movilidad que presentan algunas bacterias diferenciándola
PRACTICA Núm. 6 TINCION DE FLAGELOS BACTERIANOS POR EL METODO DE LEIFSON I. OBJETIVO Demostrar la presencia de flagelos mediante tinción y observar la movilidad que presentan algunas bacterias diferenciándola
Componentes de la sangre: Elementos celulares (glóbulos rojos, glóbulos blancos y plaquetas) Elemento líquido o plasma.
 Componentes de la sangre: Elementos celulares (glóbulos rojos, glóbulos blancos y plaquetas) Elemento líquido o plasma. Hematopoyesis: Proceso de formación de células sanguíneas (glóbulos rojos glóbulos
Componentes de la sangre: Elementos celulares (glóbulos rojos, glóbulos blancos y plaquetas) Elemento líquido o plasma. Hematopoyesis: Proceso de formación de células sanguíneas (glóbulos rojos glóbulos
3. MATERIALES Y MÉTODOS
 3. MATERIALES Y MÉTODOS En este trabajo se realizó un estudio experimental en muestras de sangre periférica de individuos del sexo masculino aparentemente sanos de Hermosillo, Sonora, México. Se empleo
3. MATERIALES Y MÉTODOS En este trabajo se realizó un estudio experimental en muestras de sangre periférica de individuos del sexo masculino aparentemente sanos de Hermosillo, Sonora, México. Se empleo
Sistema Circulatorio
 Universidad Metropolitana Centro Universitario de Aguadilla Laboratorio de Anatomía Preparado por: Flordeliz Méndez Técnica de laboratorio Introducción: Sistema Circulatorio Laboratorio # 7 El Aparato
Universidad Metropolitana Centro Universitario de Aguadilla Laboratorio de Anatomía Preparado por: Flordeliz Méndez Técnica de laboratorio Introducción: Sistema Circulatorio Laboratorio # 7 El Aparato
UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL
 UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL PROTOCOLO PARA OBTENCIÓN DE EMBRIONES DE POLLO EN LABORATORIO
UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL PROTOCOLO PARA OBTENCIÓN DE EMBRIONES DE POLLO EN LABORATORIO
TITULO DEL PROCEDIMIENTO RECUENTO DE LEUCOCITOS EN SANGRE TOTAL
 PAGINA: 1 de n RECUENTO DE LEUCOCITOS EN SANGRE TOTAL OBJETO Establecer el procedimiento para realizar el recuento de leucocitos o glóbulos blancos en el laboratorio CALIDAD. CAMPO DE APLICACIÓN Este procedimiento
PAGINA: 1 de n RECUENTO DE LEUCOCITOS EN SANGRE TOTAL OBJETO Establecer el procedimiento para realizar el recuento de leucocitos o glóbulos blancos en el laboratorio CALIDAD. CAMPO DE APLICACIÓN Este procedimiento
TEÓRICO PRÁCTICO 2 HEMOGLOBINA HEMATÓCRITO ÍNDICES HEMATIMÉTRICOS VELOCIDAD DE SEDIMENTACIÓN GLOBULAR ALTERACIONES MORFOLÓGICAS DE LOS ERITROCITOS
 TEÓRICO PRÁCTICO 2 HEMOGLOBINA HEMATÓCRITO ÍNDICES HEMATIMÉTRICOS VELOCIDAD DE SEDIMENTACIÓN GLOBULAR ALTERACIONES MORFOLÓGICAS DE LOS ERITROCITOS BIOQUÍMICA CLÍNICA I. INSTITUTO DE BIOQUÍMICA APLICADA.
TEÓRICO PRÁCTICO 2 HEMOGLOBINA HEMATÓCRITO ÍNDICES HEMATIMÉTRICOS VELOCIDAD DE SEDIMENTACIÓN GLOBULAR ALTERACIONES MORFOLÓGICAS DE LOS ERITROCITOS BIOQUÍMICA CLÍNICA I. INSTITUTO DE BIOQUÍMICA APLICADA.
BANCO DE SANGRE (FUNCIONES)
 BANCO DE SANGRE (FUNCIONES) CONCEPTO Es el departamento encargado del mantenimiento de las reservas adecuadas de sangre y componentes sanguíneos de calidad, para cubrir las necesidades de la totalidad
BANCO DE SANGRE (FUNCIONES) CONCEPTO Es el departamento encargado del mantenimiento de las reservas adecuadas de sangre y componentes sanguíneos de calidad, para cubrir las necesidades de la totalidad
DANAGENE BLOOD DNA KIT
 Ref. 0601 100 ml Ref. 0602 200 ml DANAGENE BLOOD DNA KIT 1.INTRODUCCION DANAGENE BLOOD DNA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de sangre total o médula ósea.
Ref. 0601 100 ml Ref. 0602 200 ml DANAGENE BLOOD DNA KIT 1.INTRODUCCION DANAGENE BLOOD DNA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de sangre total o médula ósea.
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR
 ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
TECHNOLOGY. CROSSMATCH TEST canino. primer test inmunocromatografico para reaccion cruzada con antiglobulina canina especifica.
 CROSSMATCH TEST canino primer test inmunocromatografico para reaccion cruzada con antiglobulina canina especifica 20 minutos TECHNOLOGY - ahorra tiempo - facil manipulacion - resultados fiables - facil
CROSSMATCH TEST canino primer test inmunocromatografico para reaccion cruzada con antiglobulina canina especifica 20 minutos TECHNOLOGY - ahorra tiempo - facil manipulacion - resultados fiables - facil
INSTRUCCIONES DE USO
 1/4 INSTRUCCIONES DE USO (IMPROMINI TUBOS PARA LA RECOLECCION DE SANGRE CAPILAR PARA UN UNICO USO) Fabricante Guangzhou Improve Medical Instruments Co., Ltd Nombre del Producto Capillary Blood Collection
1/4 INSTRUCCIONES DE USO (IMPROMINI TUBOS PARA LA RECOLECCION DE SANGRE CAPILAR PARA UN UNICO USO) Fabricante Guangzhou Improve Medical Instruments Co., Ltd Nombre del Producto Capillary Blood Collection
MATERIA DE HEMATOLOGIA UNIDAD 3: VOLUMEN DE LA SANGRE
 MATERIA DE HEMATOLOGIA UNIDAD 3: VOLUMEN DE LA SANGRE TITULAR DE LA MATERIA: DRA EN C. CONSUELO CHANG RUEDA CICLO: ENERO - DICIEMBRE 2015 DRA EN C. CONSUELO CHANG RUEDA 8 UNIDAD III.- VOLUMEN SANGUÍNEO
MATERIA DE HEMATOLOGIA UNIDAD 3: VOLUMEN DE LA SANGRE TITULAR DE LA MATERIA: DRA EN C. CONSUELO CHANG RUEDA CICLO: ENERO - DICIEMBRE 2015 DRA EN C. CONSUELO CHANG RUEDA 8 UNIDAD III.- VOLUMEN SANGUÍNEO
1- Contenidos del módulo
 IES Francesc de B. Moll SAN306P0 4 Información para el alumnado matriculado como libres en el módulo de Fundamentos y técnicas de análisis hematológicos y citológicos C.F.G.S. DE LABORATORIO DE DIAGNÓSTICO
IES Francesc de B. Moll SAN306P0 4 Información para el alumnado matriculado como libres en el módulo de Fundamentos y técnicas de análisis hematológicos y citológicos C.F.G.S. DE LABORATORIO DE DIAGNÓSTICO
Circulación Sanguínea. Klgo. Francisco Cerda
 Circulación Sanguínea Klgo. Francisco Cerda Circulación Arterias Tubos que parten del corazón y se ramifican Tienen paredes gruesas y resistentes formadas por tres capas: Interna o endotelial, Media con
Circulación Sanguínea Klgo. Francisco Cerda Circulación Arterias Tubos que parten del corazón y se ramifican Tienen paredes gruesas y resistentes formadas por tres capas: Interna o endotelial, Media con
Nutrición: Aparato circulatorio
 Nutrición: Aparato circulatorio Transporte de sustancias Nutrientes O 2 Productos de desecho del metabolismo CO 2 APARATO CIRCULATORIO. Sistema de transporte que mueve el medio interno para hacer llegar
Nutrición: Aparato circulatorio Transporte de sustancias Nutrientes O 2 Productos de desecho del metabolismo CO 2 APARATO CIRCULATORIO. Sistema de transporte que mueve el medio interno para hacer llegar
Anemias en Pediatría Diagnóstico, interpretación del hemograma
 Anemias en Pediatría Diagnóstico, interpretación del hemograma Dra. Marcela Gutiérrez Médica Pediatra Hematóloga Hospital de Niños Ricardo Gutiérrez Buenos Aires Técnica de recolección: recursos para su
Anemias en Pediatría Diagnóstico, interpretación del hemograma Dra. Marcela Gutiérrez Médica Pediatra Hematóloga Hospital de Niños Ricardo Gutiérrez Buenos Aires Técnica de recolección: recursos para su
Protocolo de toma de muestra arterial MANUAL DE CALIDAD LABORATORIO CLÍNICO. PRO 08 D Ed 01 Protocolo extracción arterial
 MANUAL DE CALIDAD LABORATORIO CLÍNICO Protocolo de toma de muestra arterial Código Fecha emisión/última revisión Revisado Aprobado PRO 08 D Ed 01 18/11/09 Spsor. Rafael Infantes Viano Dr. Vidal Pérez Valero.
MANUAL DE CALIDAD LABORATORIO CLÍNICO Protocolo de toma de muestra arterial Código Fecha emisión/última revisión Revisado Aprobado PRO 08 D Ed 01 18/11/09 Spsor. Rafael Infantes Viano Dr. Vidal Pérez Valero.
Albúmina 22 % I.- Introducción. II.- Características. III.- Presentación
 Albúmina 22 % I.- Introducción En 1945 Cameron y Diamond establecieron que ciertos sueros anti-d(anti-rh) podían aglutinar glóbulos rojos Rho positivos en presencia de albúmina de bovino pero no aglutinaban
Albúmina 22 % I.- Introducción En 1945 Cameron y Diamond establecieron que ciertos sueros anti-d(anti-rh) podían aglutinar glóbulos rojos Rho positivos en presencia de albúmina de bovino pero no aglutinaban
09/11/2017. Hematología Curso 2017/2018
 El Hemograma Hematología Curso 2017/2018 El Hemograma es una determinación analítica básica mediante la que se estudian elementos formes de la sangre desde el punto de vista cuantitativo y cualitativo.
El Hemograma Hematología Curso 2017/2018 El Hemograma es una determinación analítica básica mediante la que se estudian elementos formes de la sangre desde el punto de vista cuantitativo y cualitativo.
Sangre LA SANGRE. Blgo. Yury Cruzado Torres
 LA SANGRE Blgo. Yury Cruzado Torres Qué es la sangre? La SANGRE, es un tejido circulatorio conectivo especializado, compuesto por plasma sanguíneo y células. Las FUNCIONES de la sangre son: proveer nutrientes
LA SANGRE Blgo. Yury Cruzado Torres Qué es la sangre? La SANGRE, es un tejido circulatorio conectivo especializado, compuesto por plasma sanguíneo y células. Las FUNCIONES de la sangre son: proveer nutrientes
RECUENTOS CELULARES.
 RECUENTOS CELULARES. Los recuentos celulares son una serie de procedimientos que tienen por objeto determinar el número de cada uno de los tipos celulares que están comprendidos en una unidad de volumen
RECUENTOS CELULARES. Los recuentos celulares son una serie de procedimientos que tienen por objeto determinar el número de cada uno de los tipos celulares que están comprendidos en una unidad de volumen
PROTOCOLO DE EXTRACCIÓN SANGUÍNEA VENOSA Y ARTERIAL
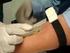 ÍNDICE 1) Objeto. 2 2) Profesionales implicados. 2 3) Población diana. 2 4) Desarrollo. 2 5) Indicadores de evaluación. 5 6) Control de cambio de protocolo. 5 ELABORADO POR: REVISADO POR: APROBADO POR:
ÍNDICE 1) Objeto. 2 2) Profesionales implicados. 2 3) Población diana. 2 4) Desarrollo. 2 5) Indicadores de evaluación. 5 6) Control de cambio de protocolo. 5 ELABORADO POR: REVISADO POR: APROBADO POR:
EXTRACCIÓN DE SANGRE DE VENA PERIFÉRICA
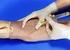 Página 1 de 7 EXTRACCIÓN DE SANGRE DE VENA PERIFÉRICA 1.-OBJETIVO Proporcionar los conocimientos necesarios para obtener muestras de sangre venosa del paciente para determinaciones diagnósticas. 2.-DEFINICIÓN
Página 1 de 7 EXTRACCIÓN DE SANGRE DE VENA PERIFÉRICA 1.-OBJETIVO Proporcionar los conocimientos necesarios para obtener muestras de sangre venosa del paciente para determinaciones diagnósticas. 2.-DEFINICIÓN
Conferencia Invitada:
 IV CONGRESO VIRTUAL HISPANOAMERICANO DE ANATOMÍA PATOLÓGICA Presentación Volver al Indice Volver al Inicio Conferencia Invitada: "ELIMINACIÓN DEL MOCO EN BRONCOASPIRADOS POCO CELULARES. Descripción de
IV CONGRESO VIRTUAL HISPANOAMERICANO DE ANATOMÍA PATOLÓGICA Presentación Volver al Indice Volver al Inicio Conferencia Invitada: "ELIMINACIÓN DEL MOCO EN BRONCOASPIRADOS POCO CELULARES. Descripción de
1ª PRÁCTICA DE MICROBIOLOGÍA:
 1ª PRÁCTICA DE MICROBIOLOGÍA: INTRODUCCIÓN A LAS TÉCNICAS DE CULTIVO EN MICROBIOLOGÍA (O COMO HACER VISIBLES ORGANISMOS INVISIBLES) INTRODUCCIÓN El objetivo de esta práctica es aislar y observar algunos
1ª PRÁCTICA DE MICROBIOLOGÍA: INTRODUCCIÓN A LAS TÉCNICAS DE CULTIVO EN MICROBIOLOGÍA (O COMO HACER VISIBLES ORGANISMOS INVISIBLES) INTRODUCCIÓN El objetivo de esta práctica es aislar y observar algunos
Tipificación de Grupos Sanguineos e Isohemaglutininas
 Tipificación de Grupos Sanguineos e Isohemaglutininas Introducción Los eritrocitos expresan antígenos de membrana. Dichos antígenos se encuentran determinados genéticamente y pueden ser identificados mediante
Tipificación de Grupos Sanguineos e Isohemaglutininas Introducción Los eritrocitos expresan antígenos de membrana. Dichos antígenos se encuentran determinados genéticamente y pueden ser identificados mediante
Propiedades fisicoquímicas y funcionales de los alimentos 2015
 TRABAJO PRÁCTICO N 2: EMULSIONES DETERMINACIÓN DE LA ESTABILIDAD DE EMULSIONES POR CONDUCTIMETRÍA, MICROSCOPÍA Y TURBIDIMETRÍA. OBJETIVOS: 1. Determinar la estabilidad de emulsiones por conductimetría,
TRABAJO PRÁCTICO N 2: EMULSIONES DETERMINACIÓN DE LA ESTABILIDAD DE EMULSIONES POR CONDUCTIMETRÍA, MICROSCOPÍA Y TURBIDIMETRÍA. OBJETIVOS: 1. Determinar la estabilidad de emulsiones por conductimetría,
Biología 3º E.S.O. 2015/16
 Biología 3º E.S.O. 2015/16 TEMA 3: Aparato circulatorio sanguíneo Ficha número 7 1.- Por qué es necesario el aparato circulatorio? 2.- Cuáles son los componentes del aparato circulatorio? 3.- Completa:
Biología 3º E.S.O. 2015/16 TEMA 3: Aparato circulatorio sanguíneo Ficha número 7 1.- Por qué es necesario el aparato circulatorio? 2.- Cuáles son los componentes del aparato circulatorio? 3.- Completa:
TOMA DE MUESTRAS SANGUINEAS Q.F.B. ADRIANA O. PASTRANA ARROYO
 TOMA DE MUESTRAS SANGUINEAS Q.F.B. ADRIANA O. PASTRANA ARROYO Los resultados de los procedimientos bioanalíticos que se realizan en el laboratorio deben ser confiables y de calidad Qué espera el médico
TOMA DE MUESTRAS SANGUINEAS Q.F.B. ADRIANA O. PASTRANA ARROYO Los resultados de los procedimientos bioanalíticos que se realizan en el laboratorio deben ser confiables y de calidad Qué espera el médico
TRANSFUSIÓN DE SANGRE Y COMPONENTES
 TRANSFUSIÓN DE SANGRE Y COMPONENTES Autores Servicio Dr.Adalberto Ballester Santovenia Dr. Jesús Diego de la Campa Lic. Mayra Pérez Pérez Téc. Bárbara Hourrutinier Banco de Sangre OBJETIVO Garantizar mediante
TRANSFUSIÓN DE SANGRE Y COMPONENTES Autores Servicio Dr.Adalberto Ballester Santovenia Dr. Jesús Diego de la Campa Lic. Mayra Pérez Pérez Téc. Bárbara Hourrutinier Banco de Sangre OBJETIVO Garantizar mediante
MÓDULO 1 TRABAJO PRÁCTICO N 1
 MÓDULO 1 TRABAJO PRÁCTICO N 1 Estructura y función celular. La organización tisular. Los compartimientos orgánicos. Generalidades del sistema sanguíneo. El alumno deberá conocer antes del trabajo práctico
MÓDULO 1 TRABAJO PRÁCTICO N 1 Estructura y función celular. La organización tisular. Los compartimientos orgánicos. Generalidades del sistema sanguíneo. El alumno deberá conocer antes del trabajo práctico
MANUAL DE OPERACIONES. DIRECCIÓN DE INVESTIGACIÓN Fecha: JUN 15 SUBDIRECCIÓN DE INVESTIGACIÓN BIOMÉDICA MANUAL DE TINCIONES
 A Hoja: de 0 MANUAL DE TINCIONES Elaboró: Autorizó: Puesto QUÍMICO JEFE DE LABORATORIO Firma Hoja: 2 de 0. Propósito Establecer las técnicas y condiciones para la realización de tinciones utilizadas en
A Hoja: de 0 MANUAL DE TINCIONES Elaboró: Autorizó: Puesto QUÍMICO JEFE DE LABORATORIO Firma Hoja: 2 de 0. Propósito Establecer las técnicas y condiciones para la realización de tinciones utilizadas en
PROCEDIMIENTO PARA LA DETERMINACIÓN DE HEMOGLOBINA MEDIANTE HEMOGLOBINOMETROS PORTATILES
 PROCEDIMIENTO PARA LA DETERMINACIÓN DE HEMOGLOBINA MEDIANTE HEMOGLOBINOMETROS PORTATILES 1 El procedimiento agrupa tres etapas: 1. Procedimiento previo a la punción capilar. 2. Procedimiento de la punción
PROCEDIMIENTO PARA LA DETERMINACIÓN DE HEMOGLOBINA MEDIANTE HEMOGLOBINOMETROS PORTATILES 1 El procedimiento agrupa tres etapas: 1. Procedimiento previo a la punción capilar. 2. Procedimiento de la punción
PRÁCTICA 2. PREPARACIONES MICROSCOPICAS 1. CÉLULA EUCARIOTA VEGETAL: EPIDERMIS DE CEBOLLA.
 AMPLIACIÓN BIOLOGÍA 4º ESO Taller Biología 4º E.S.O. BLOQUE 2. MICROSCOPÍA Y CITOLOGÍA PRÁCTICA 2. PREPARACIONES MICROSCOPICAS 1. CÉLULA EUCARIOTA VEGETAL: EPIDERMIS DE CEBOLLA. OBJETIVOS o Adquirir práctica
AMPLIACIÓN BIOLOGÍA 4º ESO Taller Biología 4º E.S.O. BLOQUE 2. MICROSCOPÍA Y CITOLOGÍA PRÁCTICA 2. PREPARACIONES MICROSCOPICAS 1. CÉLULA EUCARIOTA VEGETAL: EPIDERMIS DE CEBOLLA. OBJETIVOS o Adquirir práctica
PRACTICA No. 3 EL ESTADO GASEOSO
 PRACTICA No. 3 EL ESTADO GASEOSO INTRODUCCION: Las sustancias en Estado Gaseoso tienen propiedades físicas y químicas que las hacen diferentes de otras que se encuentran en un estado físico distinto. A
PRACTICA No. 3 EL ESTADO GASEOSO INTRODUCCION: Las sustancias en Estado Gaseoso tienen propiedades físicas y químicas que las hacen diferentes de otras que se encuentran en un estado físico distinto. A
SISTEMA CIRCULATORIO FUNCIONES MÁS IMPORTANTES:
 SISTEMA CIRCULATORIO FUNCIONES MÁS IMPORTANTES: Transporte de O 2 de los pulmones a los tejidos y de CO 2 de los tejidos hacia los pulmones. Distribución de los nutrientes desde el sistema digestivo hacia
SISTEMA CIRCULATORIO FUNCIONES MÁS IMPORTANTES: Transporte de O 2 de los pulmones a los tejidos y de CO 2 de los tejidos hacia los pulmones. Distribución de los nutrientes desde el sistema digestivo hacia
INSTRUCCIÓN TÉCNICA DISTRIBUCIÓN: Jefe de la Unidad de Calidad SUMARIO DE MODIFICACIONES
 Investigación de crioaglutininas Página 1 de 5 DISTRIBUCIÓN: DEPARTAMENTO Dirección Hematología Enfermería RESPONSABLE Jefe de la Unidad de Calidad Jefe de la Unidad de Hematología Coordinadora de Enfermería
Investigación de crioaglutininas Página 1 de 5 DISTRIBUCIÓN: DEPARTAMENTO Dirección Hematología Enfermería RESPONSABLE Jefe de la Unidad de Calidad Jefe de la Unidad de Hematología Coordinadora de Enfermería
El término de tejido sanguíneo es un tejido conectivo altamente especializado, cuya matriz extracelular es liquida y se denomina plasma
 Trabajo Práctico N o 10: Tejido sanguíneo Nombre... Comisión... Objetivos 1. Identificar en microscopio óptico los elementos del tejido sanguíneo 2. Observar cristales de hemoglobina 3. Comprender los
Trabajo Práctico N o 10: Tejido sanguíneo Nombre... Comisión... Objetivos 1. Identificar en microscopio óptico los elementos del tejido sanguíneo 2. Observar cristales de hemoglobina 3. Comprender los
ACTIVIDAD PRÁCTICA No. 6 REACCIONES DE HIPERSENSIBILIDAD
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA CENTRO UNIVERSITARIO METROPOLITANO FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA DE INMUNOLOGÍA Y MICROBIOLOGÍA MÉDICA TERCER AÑO ACTIVIDAD PRÁCTICA No. 6 REACCIONES
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA CENTRO UNIVERSITARIO METROPOLITANO FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA DE INMUNOLOGÍA Y MICROBIOLOGÍA MÉDICA TERCER AÑO ACTIVIDAD PRÁCTICA No. 6 REACCIONES
Prácticas: Configuración de los seres vivos. Curso académico Práctica 2. Preparación de extensiones celulares.
 Prácticas: Configuración de los seres vivos. Curso académico 2009-2010 16 Práctica 2. Preparación de extensiones celulares Introducción Se entiende por extensión o frotis celular, a la formación de una
Prácticas: Configuración de los seres vivos. Curso académico 2009-2010 16 Práctica 2. Preparación de extensiones celulares Introducción Se entiende por extensión o frotis celular, a la formación de una
Presencia de algas en agua de consumo
 Presencia de algas en agua de consumo Provoca: Deterioro de la calidad Aparición de olores y sabores Consumo del cloro residual Favoreciendo desarrollo de bacterias SECUENCIA PARA EL ANALISIS DEL FITOPLANCTON
Presencia de algas en agua de consumo Provoca: Deterioro de la calidad Aparición de olores y sabores Consumo del cloro residual Favoreciendo desarrollo de bacterias SECUENCIA PARA EL ANALISIS DEL FITOPLANCTON
ANEJO 1: Instrumental de laboratorio utilizado en la práctica
 Prácticas de Materiales de Construcción I.T. Obras Públicas PRÁCTICA Nº 6 EQUIVALENTE DE ARENA. DESGASTE DE LOS ÁNGELES. FORMA DE LOS ÁRIDOS. Contenido: 1.1 Introducción 1.2 Equivalente de arena. 1.3 Coeficiente
Prácticas de Materiales de Construcción I.T. Obras Públicas PRÁCTICA Nº 6 EQUIVALENTE DE ARENA. DESGASTE DE LOS ÁNGELES. FORMA DE LOS ÁRIDOS. Contenido: 1.1 Introducción 1.2 Equivalente de arena. 1.3 Coeficiente
Calidad de muestras. Bioquímica Lucrecia Drago Bioquímica María Fernanda Pontoriero
 Calidad de muestras Bioquímica Lucrecia Drago Bioquímica María Fernanda Pontoriero Calidad de muestras Factores intervinientes: Obtención de muestra Contenedores Anticoagulantes Manipulación Preparación
Calidad de muestras Bioquímica Lucrecia Drago Bioquímica María Fernanda Pontoriero Calidad de muestras Factores intervinientes: Obtención de muestra Contenedores Anticoagulantes Manipulación Preparación
CONTROL DE CAMBIOS Y MEJORAS
 Página: 1 de 5 CONTROL DE CAMBIOS Y MEJORAS NIVEL DE REVISIÓN SECCIÓN Y/O PÁGINA DESCRIPCIÓN DE LA MODIFICACIÓN Y MEJORA FECHA DE MODIFICACIÓN 01 Políticas Descripción de las actividades Se cambio el horario
Página: 1 de 5 CONTROL DE CAMBIOS Y MEJORAS NIVEL DE REVISIÓN SECCIÓN Y/O PÁGINA DESCRIPCIÓN DE LA MODIFICACIÓN Y MEJORA FECHA DE MODIFICACIÓN 01 Políticas Descripción de las actividades Se cambio el horario
LA DECANTACIÓN 4º ESO. Introducción
 LA DECANTACIÓN 4º ESO Introducción Este trabajo teórico trata sobre la utilización de una de las técnicas de separación de mezclas mas utilizada, la decantación, este método sirve para separar una mezcla
LA DECANTACIÓN 4º ESO Introducción Este trabajo teórico trata sobre la utilización de una de las técnicas de separación de mezclas mas utilizada, la decantación, este método sirve para separar una mezcla
INSTRUCTIVO DETERMINACIÓN DE GRUPOS A,B,O Y RH-D
 1. OBJETIVO: Desarrollar la clasificación de Grupo y Rh a los usuarios del Hospital Regional de Arica Dr. Juan Noé Crevani, de acuerdo con los antígenos y anticuerpos presentes en la sangre, esto con el
1. OBJETIVO: Desarrollar la clasificación de Grupo y Rh a los usuarios del Hospital Regional de Arica Dr. Juan Noé Crevani, de acuerdo con los antígenos y anticuerpos presentes en la sangre, esto con el
KITS EDUCATIVOS DE BIOLOGÍA MOLECULAR
 KITS EDUCATIVOS DE BIOLOGÍA MOLECULAR Índice General Aula GENYCA. Flujo de trabajo. 3 Kits Educativos de Técnicas Básicas 5 P1-A. Extracción de ADN de Sangre 6 P1-B. Extracción de ADN en Columna 7 P2.
KITS EDUCATIVOS DE BIOLOGÍA MOLECULAR Índice General Aula GENYCA. Flujo de trabajo. 3 Kits Educativos de Técnicas Básicas 5 P1-A. Extracción de ADN de Sangre 6 P1-B. Extracción de ADN en Columna 7 P2.
PMD: CARLOS ANDRES SAMBONI
 PMD: CARLOS ANDRES SAMBONI El sistema o aparato circulatorio, se ocupa justamente de la circulación o transporte de todas las sustancias (ej.: hormonas, desechos, minerales, nutrientes y gases) que componen
PMD: CARLOS ANDRES SAMBONI El sistema o aparato circulatorio, se ocupa justamente de la circulación o transporte de todas las sustancias (ej.: hormonas, desechos, minerales, nutrientes y gases) que componen
Orientación diagnóstica de las anemias en Urgencias. Hematología Clínica Rotger 2016
 Orientación diagnóstica de las anemias en Urgencias Definición Disminución de la hemoglobina por debajo de los valores normales Definición La hemoglobina es el parámetro más correcto para valorar una anemia
Orientación diagnóstica de las anemias en Urgencias Definición Disminución de la hemoglobina por debajo de los valores normales Definición La hemoglobina es el parámetro más correcto para valorar una anemia
Laboratorio De Química TRABAJO PRÁCTICO Nº 3 SISTEMAS MATERIALES
 TRABAJO PRÁCTICO Nº 3 SISTEMAS MATERIALES - Materia Es todo lo que posee masa, y ocupa un lugar en el espacio. - Sistema Materi al Porción de materia que se aisla para su estudio. - Sistema Homogéneo Es
TRABAJO PRÁCTICO Nº 3 SISTEMAS MATERIALES - Materia Es todo lo que posee masa, y ocupa un lugar en el espacio. - Sistema Materi al Porción de materia que se aisla para su estudio. - Sistema Homogéneo Es
Fase preanalítica. Porcentaje de participacion de cada una de las fases en el flujo de trabajo
 Fase preanalítica Porcentaje de participacion de cada una de las fases en el flujo de trabajo Variaciones preanalíticas Cualquier factor fisiológico, técnico o de procedimiento que puede afectar la concentración
Fase preanalítica Porcentaje de participacion de cada una de las fases en el flujo de trabajo Variaciones preanalíticas Cualquier factor fisiológico, técnico o de procedimiento que puede afectar la concentración
PARA EL ESTUDIO DE LOS ERITROCITOS
 OTROS MÉTODOS M PARA EL ESTUDIO DE LOS ERITROCITOS HEMOGRAMA Parámetros cualitativos Morfología celular Fórmula leucocitaria Parámetros cuantitativos Hemoglobina Hematocrito Recuentos celulares Índices
OTROS MÉTODOS M PARA EL ESTUDIO DE LOS ERITROCITOS HEMOGRAMA Parámetros cualitativos Morfología celular Fórmula leucocitaria Parámetros cuantitativos Hemoglobina Hematocrito Recuentos celulares Índices
PREPARACIÓN DE DISOLUCIONES
 PREPARACIÓN DE DISOLUCIONES Objetivo El alumno debe ser capaz de preparar una disolución de concentración determinada a partir de sus componentes, soluto y disolvente. Aquí se van a preparar las disoluciones
PREPARACIÓN DE DISOLUCIONES Objetivo El alumno debe ser capaz de preparar una disolución de concentración determinada a partir de sus componentes, soluto y disolvente. Aquí se van a preparar las disoluciones
WITNESS RELAXIN (plasma, serum) RLX RLX u d 9 n n ersio V X RLX L R -W IO B S
 WITNESS RELAXIN (plasma, serum) SBIO-W Version n 9 du 28.07.2010 WITNESS RELAXIN WITNESS RELAXIN GENERALIDADES El kit WITNESS RELAXIN permite diagnosticar la gestación en la perra y en la gata, y permite
WITNESS RELAXIN (plasma, serum) SBIO-W Version n 9 du 28.07.2010 WITNESS RELAXIN WITNESS RELAXIN GENERALIDADES El kit WITNESS RELAXIN permite diagnosticar la gestación en la perra y en la gata, y permite
PRÁCTICA 1: MÉTODOS DE RUPTURA CELULAR
 PRÁCTICA 1: MÉTODOS DE RUPTURA CELULAR FUNDAMENTO TEÓRICO Para estudiar la estructura y/o las funciones metabólicas de los distintos compartimentos celulares hay que aislarlos del resto de los orgánulos.
PRÁCTICA 1: MÉTODOS DE RUPTURA CELULAR FUNDAMENTO TEÓRICO Para estudiar la estructura y/o las funciones metabólicas de los distintos compartimentos celulares hay que aislarlos del resto de los orgánulos.
PRACTICA No. 3 EL ESTADO GASEOSO
 ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II PRACTICA No. 3 EL ESTADO GASEOSO 1. INTRODUCCION: Las sustancias en Estado Gaseoso tienen propiedades físicas y químicas que las hacen
ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II PRACTICA No. 3 EL ESTADO GASEOSO 1. INTRODUCCION: Las sustancias en Estado Gaseoso tienen propiedades físicas y químicas que las hacen
Sistema sanguíneo Corazón Circulación de la sangre Vasos sanguíneos La sangre. Sistema linfático Vasos linfáticos Ganglios linfáticos La linfa
 Sistema sanguíneo Corazón Circulación de la sangre Vasos sanguíneos La sangre Sistema linfático Vasos linfáticos Ganglios linfáticos La linfa CORAZÓN El corazón es un órgano hueco, del tamaño del puño
Sistema sanguíneo Corazón Circulación de la sangre Vasos sanguíneos La sangre Sistema linfático Vasos linfáticos Ganglios linfáticos La linfa CORAZÓN El corazón es un órgano hueco, del tamaño del puño
INSTRUCCIÓN TÉCNICA. Escrutinio de anticuerpos Irregulares o Coombs Indirecto DISTRIBUCIÓN: Jefe de la Unidad de Calidad SUMARIO DE MODIFICACIONES
 Página 1 de 6 DISTRIBUCIÓN: DEPARTAMENTO Dirección Hematología Enfermería RESPONSABLE Jefe de la Unidad de Calidad Jefe de la Unidad de Hematología Coordinadora de Enfermería REVISIÓN FECHA DESCRIPCIÓN
Página 1 de 6 DISTRIBUCIÓN: DEPARTAMENTO Dirección Hematología Enfermería RESPONSABLE Jefe de la Unidad de Calidad Jefe de la Unidad de Hematología Coordinadora de Enfermería REVISIÓN FECHA DESCRIPCIÓN
MANUAL DE NORMAS Y PROCEDIMIENTOS PROCEDIMIENTO: OPERATIVOS DE ORINAS
 SERVICIO DE LABORATORIO 1 DE 5 1. OBJETIVO El objetivo del presente documento es describir el procedimiento para determinar las características físicas, química y microscópicas de muestras de orinas. 2.
SERVICIO DE LABORATORIO 1 DE 5 1. OBJETIVO El objetivo del presente documento es describir el procedimiento para determinar las características físicas, química y microscópicas de muestras de orinas. 2.
DANAGENE SALIVA KIT. Ref Extracciones / Ref Extracciones
 DANAGENE SALIVA KIT Ref.0603.4 50 Extracciones / Ref.0603.41 160 Extracciones 1.INTRODUCCION Este kit provee un método para la extracción de ADN genómico de alta calidad a partir de muestras de saliva
DANAGENE SALIVA KIT Ref.0603.4 50 Extracciones / Ref.0603.41 160 Extracciones 1.INTRODUCCION Este kit provee un método para la extracción de ADN genómico de alta calidad a partir de muestras de saliva
PRÁCTICA Nº 1: MEDIDA EXPERIMENTAL DE DENSIDADES
 PRÁCTICA Nº 1: MEDIDA EXPERIMENTAL DE DENSIDADES INTRODUCCIÓN: Las magnitudes son propiedades de los cuerpos que se pueden medir. Existen magnitudes fundamentales, como la MASA, el TIEMPO y la LONGITUD,
PRÁCTICA Nº 1: MEDIDA EXPERIMENTAL DE DENSIDADES INTRODUCCIÓN: Las magnitudes son propiedades de los cuerpos que se pueden medir. Existen magnitudes fundamentales, como la MASA, el TIEMPO y la LONGITUD,
Conceptos del Manejo de Factores de Crecimiento en sus distintas Aplicaciones
 Conceptos del Manejo de Factores de Crecimiento en sus distintas Aplicaciones Por: Dr. Carlos Eduardo Rojas Martínez Dr José Fernando García Jaramillo Índice 1. 2. 3. 4. 5 Concepto de la medicina regenerativa.
Conceptos del Manejo de Factores de Crecimiento en sus distintas Aplicaciones Por: Dr. Carlos Eduardo Rojas Martínez Dr José Fernando García Jaramillo Índice 1. 2. 3. 4. 5 Concepto de la medicina regenerativa.
Transportando sustancias
 Transportando sustancias Encargado de distribuir los nutrientes y el oxígeno a todas las partes del cuerpo, al mismo tiempo que recoge las sustancias de desecho y las lleva hasta los órganos encargados
Transportando sustancias Encargado de distribuir los nutrientes y el oxígeno a todas las partes del cuerpo, al mismo tiempo que recoge las sustancias de desecho y las lleva hasta los órganos encargados
PRÁCTICA 5 FASES DE LA MITOSIS. ESTIMACIÓN DE LOS ÍNDICES MITÓTICO Y DE FASE
 PRÁCTICA 5 FASES DE LA MITOSIS. ESTIMACIÓN DE LOS ÍNDICES MITÓTICO Y DE FASE INTRODUCCIÓN La mitosis es la división nuclear asociada a las células somáticas (las células de un organismo eucariótico que
PRÁCTICA 5 FASES DE LA MITOSIS. ESTIMACIÓN DE LOS ÍNDICES MITÓTICO Y DE FASE INTRODUCCIÓN La mitosis es la división nuclear asociada a las células somáticas (las células de un organismo eucariótico que
TRABAJO PRÁCTICO Nº 3 PROPIEDADES DE LA SANGRE DETERMINACIÓN DE GRUPOS SANGUÍNEOS INTERPRETACIÓN FISIOLÓGICA DE LAS PRUEBAS
 TRABAJO PRÁCTICO Nº 3 PROPIEDADES DE LA SANGRE DETERMINACIÓN DE GRUPOS SANGUÍNEOS INTERPRETACIÓN FISIOLÓGICA DE LAS PRUEBAS 1. OBJETIVOS Que, a partir de los conocimientos teóricos, los alumnos logren:
TRABAJO PRÁCTICO Nº 3 PROPIEDADES DE LA SANGRE DETERMINACIÓN DE GRUPOS SANGUÍNEOS INTERPRETACIÓN FISIOLÓGICA DE LAS PRUEBAS 1. OBJETIVOS Que, a partir de los conocimientos teóricos, los alumnos logren:
PRÁCTICAS TÉCNICAS DE SEPARACIÓN Y PREPARACIÓN DE DISOLUCIONES FÍSICA Y QUÍMICA 2º
 PRÁCTICAS TÉCNICAS DE SEPARACIÓN Y PREPARACIÓN DE DISOLUCIONES FÍSICA Y QUÍMICA 2º CURSO: NOMBRE: COMPAÑEROS QUE FORMAN TU GRUPO: 1 FILTRACIÓN DE AGUA Y ARENA La filtración es la separación de las partículas
PRÁCTICAS TÉCNICAS DE SEPARACIÓN Y PREPARACIÓN DE DISOLUCIONES FÍSICA Y QUÍMICA 2º CURSO: NOMBRE: COMPAÑEROS QUE FORMAN TU GRUPO: 1 FILTRACIÓN DE AGUA Y ARENA La filtración es la separación de las partículas
Instrucciones para preparar y administrar una inyección subcutánea de ORENCIA:
 Instrucciones para preparar y administrar una inyección subcutánea de ORENCIA: Lea cuidadosamente estas instrucciones y sígalas paso a paso. Recibirá instrucciones de su médico o enfermera acerca de cómo
Instrucciones para preparar y administrar una inyección subcutánea de ORENCIA: Lea cuidadosamente estas instrucciones y sígalas paso a paso. Recibirá instrucciones de su médico o enfermera acerca de cómo
SISTEMA CIRCULATORIO:
 SISTEMA CIRCULATORIO: Sistema Circulatorio Integrantes:Martina,Valentina,Tiziano,Lola y Abril. Curso:5to B. SISTEMA CIRCULATORIO: 1- El sistema circulatorio Es el sistema corporal encargado de transportar
SISTEMA CIRCULATORIO: Sistema Circulatorio Integrantes:Martina,Valentina,Tiziano,Lola y Abril. Curso:5to B. SISTEMA CIRCULATORIO: 1- El sistema circulatorio Es el sistema corporal encargado de transportar
Biología y Geología 3º ESO
 1/ El sistema circulatorio Biología y Geología 3º ESO TEMA 4: EL TRANSPORTE Y LA ELIMINACIÓN DE DESECHOS 1-1/ Función del sistema circulatorio Recoger en el intestino los nutrientes obtenidos en el proceso
1/ El sistema circulatorio Biología y Geología 3º ESO TEMA 4: EL TRANSPORTE Y LA ELIMINACIÓN DE DESECHOS 1-1/ Función del sistema circulatorio Recoger en el intestino los nutrientes obtenidos en el proceso
Actividades del tema 6
 Actividades del tema 6 1) Qué necesitan las células para realizar sus funciones? Aporte de nutrientes y oxígeno. 2) Cómo llegan las sustancias necesarias hasta cada una de las células del organismo? A
Actividades del tema 6 1) Qué necesitan las células para realizar sus funciones? Aporte de nutrientes y oxígeno. 2) Cómo llegan las sustancias necesarias hasta cada una de las células del organismo? A
Antígenos Anticuerpo Aglutinógeno Aglutinina Es la clasificación de la sangre de acuerdo a los antígenos presentes en la membrana de los glóbulos rojo
 Grupos Sanguíneos neos Antígenos Anticuerpo Aglutinógeno Aglutinina Es la clasificación de la sangre de acuerdo a los antígenos presentes en la membrana de los glóbulos rojos y a los anticuerpos presentes
Grupos Sanguíneos neos Antígenos Anticuerpo Aglutinógeno Aglutinina Es la clasificación de la sangre de acuerdo a los antígenos presentes en la membrana de los glóbulos rojos y a los anticuerpos presentes
4.2.- MÉTODO. la preparación de los reactivos que se van a utilizar, la obtención de los diferentes tipos de muestras en soportes
 4.2.- MÉTODO En la descripción de los métodos que aplicamos, existen algunos puntos comunes como son: la preparación de los reactivos que se van a utilizar, la obtención de los diferentes tipos de muestras
4.2.- MÉTODO En la descripción de los métodos que aplicamos, existen algunos puntos comunes como son: la preparación de los reactivos que se van a utilizar, la obtención de los diferentes tipos de muestras
