Alteraciones del Estado Acido-Base (traducido de Raoul Nelson) ASPECTOS GENERALES DE LAS ALTERACIONES ACIDO-BASE
|
|
|
- Emilia Esther Molina Paz
- hace 7 años
- Vistas:
Transcripción
1 Alteraciones del Estado Acido-Base (traducido de Raoul Nelson) TERMINOLOGIA BASICA Acidemia: está presente cuando el ph en sangre es < 7,35. Alcalemia: está presente cuando el ph en sangre es > 7,45. Acidosis: es un proceso que conduce a la acidemia si no se lo contrarresta. Alcalosis: es un proceso que conduce a la alcalemia si no se lo contrarresta. Metabólico: refiere al desorden que se produce por una alteración primaria en la [H + ] o [HCO3 - ]. Respiratorio: es un desorden que se produce por una alteración primaria en la pco2 debido a una alteración en la eliminación de CO2. ASPECTOS GENERALES DE LAS ALTERACIONES ACIDO-BASE Una alteración primaria en la [H + ],[HCO3 - ] o pco2 que produce un ph anormal El organismo posee diversos mecanismos para corregir el ph al rango normal. - en la fase aguda (minutos a horas) los sistemas buffers extra- e intracelulares (el más importante es el sistema bicarbonato) minimizan los cambios en el ph - en la fase crónicas (horas a días), la compensación renal o respiratoria restaura parcial o completamente el ph hacia el valor normal. Hay límites para ambos tipos de compensaciones La compensación no produce sobre-corrección del ph. DATOS REQUERIDOS PARA EL DIAGNOSTICO DE ALTERACIONES DEL ESTADO ACDO BASE Los gases en sangre arterial muestran el ph, pco2 y [HCO3 - ] sanguíneo El panel químico muestra [CO2total], [Cl - ], [Na + ], [K + ], glucosa, urea y creatinina La [CO2total] es la suma de la [CO2] y [HCO3-]. De esta manera, la [HCO3-] del gas arterial y la [CO2total] del panel de electrolitos tienen 2 meq/l de diferencia. De otra forma, las mediciones son erróneas o fueron tomadas en diferentes momentos. CALCULOS ACIDO-BASE Uno debe estar familiarizado con las ecuaciones que describen la relación entre el ph, la pco2 y la [HCO3 - ]. Dados dos parámetros cualesquiera, uno podría calcular el tercero. Asimismo, dados los tres parámetros, uno debería ser capaz de reconocer errores. Ecuación de Henderson-Hasselbach ph= 6,1 + log10 [HCO3 - ]/ (0,03 x pco2) Ecuación de Henderson [H + ]= 24 x pco2/[hco3 - ] La ecuación de Henderson es más fácil de usar, pero sólo se aplica entre ph 7,2 y 7,6. Para esta ecuación, uno debe calcular la [H + ] a partir del ph. [H + ]= 40 neq/l cuando el ph es 7,40. La [H + ] Aumenta 10 neq/l por cada 0,1 unidades de caída del ph.
2 VALORES NORMALES DE LABORATORIO Gases sangre arterial ph 7,35-7,45 [H + ] nmoles/l o neq/l pco mm Hg [HCO3 - ] mmoles/l o meq/l Electrolitos plasmáticos [Na + ] meq/l [K + ] 3,5-5,0 meq/l [Cl - ] meq/l [CO2total] meq/l ALTERACIONES ACIDO-BASE SIMPLES Las alteraciones ácido-base simples tiene una sola anormalidad primaria. Las cuatro alteraciones primarias son: acidosis respiratoria, alcalosis respiratoria, acidosis metabólica y alcalosis metabólica. Las alteraciones ácido-base mixtas tienen más de una anormalidad. Dos o tres alteraciones primarias se pueden combinar juntas para producir una alteración mixta. ACIDOSIS RESPIRATORIA La acidosis respiratoria es una alteración con alta pco2 causada por la reducción en la eliminación de CO2 (o hipoventilación). Si no es contrarrestada produce acidemia. CO2 + H2O H2CO3 H + + HCO3 - [H + ]= 24 x pco2/[hco3 - ] En la acidosis respiratoria aguda, el aumento de pco2 produce la conversión de CO2 a H2CO3 y la subsecuente disociación a H + y HCO3 -. De esta manera, hay un aumento en la [HCO3 - ], un aumento en la [H + ] y una disminución en el ph. En la acidosis respiratoria crónica, el aumento en la pco2 dispara la compensación renal. Hay un aumento en la excreción de H + por orina y un aumento en la generación de nuevo HCO3 - la sangre por el riñón. Como resultado de esta compensación, hay un aumento en la [HCO3 - ], una disminución en la [H + ], y un aumento en el ph hacia el valor normal. La compensación renal comienza dentro de las 24 horas y se completa a los 5 días. A pesar de la compensación, el ph permanece en el rango menor del normal. ALCALOSIS RESPIRATORIA La alcalosis respiratoria es una alteración con baja pco2 causada por aumento en la eliminación de CO2 (hiperventilación). Si no es contrarrestada, resulta en alcalemia. CO2 + H2O H2CO3 H + + HCO3 - [H + ]= 24 x pco2/[hco3 - ]
3 En la alcalosis respiratoria aguda, la disminución de la pco2 conduce a la conversión de H2CO3 a pco2, y a la asociación de HCO3 - y H + para formar H2CO3. El resultado es una disminución en la [HCO3 - ], una disminución en la [H + ] y un aumento en el ph. En la alcalosis respiratoria crónica, la disminución en la pco2 dispara la compensación renal. Hay una disminución en la secreción de H + a la orina y una disminución en la generación de HCO3 - por el riñón. Como resultado de la compensación, hay una disminución en la [HCO3 - ], un aumento en la [H + ] y una disminución del ph hacia el rango normal. La compensación renal comienza en horas y se completa a los 3 días. El ph generalmente puede ser restaurado a valores normales. ACIDOSIS METABOLICA La acidosis metabólica es una alteración con baja [HCO3 - ] causada por una ganancia neta de H + o la pérdida de HCO3 -. Si no es contrarrestada resulta en acidemia. Por ganancia neta de H+ CO2 + H2O H2CO3 H + + HCO3 - [H + ]= 24 x pco2/[ HCO3 - ] Si hay una ganancia neta de [H + ], disminuye el ph y se produce la conversión de H2CO3 a CO2. De esta manera la [HCO3-] disminuye. Por pérdida de HCO3- CO2 + H2O H2CO3 H + + HCO3 - [H + ]= 24 x pco2/[hco3 - ] Si hay una disminución en la [HCO3 - ], se produce la conversión de H2CO3 en HCO3 - y H + y la conversión de CO2 en H2CO3. Por lo tanto hay un aumento de la [H + ] y una disminución del ph. En acidosis metabólica, la acidemia dispara la respuesta compensatoria respiratoria, aumentando la ventilación alveolar que resulta en el aumento de la eliminación de CO2 y en una disminución de la pco2. La disminución de la pco2 lleva a la conversión de H2CO3 a CO2, y la conversión de H + y HCO3 - a H2CO3. Esto resulta en una disminución de la [H + ] y un aumento del ph hacia la normalidad. La compensación respiratoria empieza durante la primera hora y se completa a las horas. Sin embargo, aún con máxima compensación respiratoria la acidemia persiste. ALCALOSIS METABOLICA La alcalosis metabólica es una alteración con alta [HCO3 - ] plasmático causada por la ganancia neta de HCO3 - o la pérdida de H+. Si no es contrarrestada resulta en alcalemia. Por pérdida de H+ CO2 + H2O H2CO3 H + + HCO3 - [H + ]= 24 x pco2/[hco3 - ] La pérdida de H+ aumenta el ph y lleva a la conversión de H2CO3 a HCO3 -. De esta manera la [HCO3 - ] aumenta. Por ganancia neta de HCO3 -
4 CO2 + H2O H2CO3 H + + HCO3 - [H + ]= 24 x pco2/[hco3 - ] La ganancia neta de HCO3 - produce un aumento en la [HCO3 - ], que lleva al consumo de H + y al aumento del ph. Con una ganancia neta de HCO3 - o la pérdida de H +, disminuye la [H + ] y aumenta el ph. La alcalemia dispara la respuesta compensatoria respiratoria, disminuyendo la ventilación alveolar que resulta en la disminución de la eliminación de CO2 y un aumento en la pco2. El aumento de la pco2 conduce a la conversión de CO2 a H2CO3 y a la disociación de H2CO3 a HCO3 - y H+. Esto resulta en un aumento de la [HCO3 - ] y un aumento de la [H + ] y la disminución del ph hacia la normalidad. La alcalemia también aumenta la glucólisis y la producción de ácido láctico. Esto también ayuda a aumentar la [H + ] y a disminuir el ph hacia el normal. La compensación respiratoria comienza dentro de la primera hora y se completa entre las 12 a 24 horas. RESUMEN DE ALTERACIONES ACIDO-BASE SIMPLES Y COMPENSACION Defecto primario Efecto en ph Respuesta compensatoria Compensación esperada Límites de compensación Acidosis Metabólica Pérdida de HCO 3 - o ganancia de H + ( [HCO 3 - ]) ventilación ( pco 2) pco 2 = 1.5 [HCO 3 - ] + 8 ± 2 pco 2= mmhg Alcalosis Metabólica Ganancia de HCO 3 - o pérdida de H + ( [HCO 3 - ]) ventilación ( pco 2) pco 2 aumenta 0,6 mm Hg por cada 1 meq/l [HCO 3 - ] pco 2= 55 mm Hg Acidosis Hipoventilación Respiratoria Aguda pco 2 - Generación de HCO 3 [HCO - 3 ] [HCO - 3 ] aumenta 1 meq/l por cada 10 mm Hg de pco 2 Crónica pco 2 [HCO - 3 ] [HCO - 3 ] aumenta 4 meq por cada 10 mm Hg de pco 2 Alcalosis Hiperventilación Respiratoria Aguda pco 2 - Consumo de HCO 3 [HCO - 3 ] disminuye 2 meq/l [HCO - 3 ] por cada 10 mm Hg de pco 2 Crónica pco 2 [HCO 3- ] [HCO 3- ]disminuye 5 meq/l por cada 10 mm Hg de pco 2 [HCO 3 - ]= 45 meq/l [HCO 3- ]= meq/l ALTERACIONES ACIDO-BASE MIXTAS ACIDOSIS RESPIRATORIA La acidosis respiratoria es causada por desórdenes que resultan en hipoventilación alveolar. La hipoventilación puede deberse a enfermedad pulmonar (obstrucción aguda de vías aéreas, enfermedad pulmonar parenquimatosa, enfermedad pulmonar obstructiva crónica, ventilación restringida) o reducción del impulso respiratorio (depresión del SNC, desórdenes neuromusculares).
5 ALCALOSIS RESPIRATORIA La alcalosis respiratoria es causada por desórdenes que resultan en hiperventilación pulmonar. La hiperventilación es debida a un aumento del impulso respiratorio causado por hipoxemia (enfermedad pulmonar intrínseca), toxinas (septicemia, shock, falla hepática), drogas (salicilatos), fiebre o ansiedad. ACIDOSIS METABOLICA Las causas de acidosis metabólica son comprendidas más fácilmente cuando se las divide en aquellas con anión gap aumentado o normal. PRUEBAS DE LABORATORIO CALCULO DEL ANION GAP El anión gap es un valor aparente que se calcula como sigue: ANION GAP (AG)= [Na + ] ([Cl - ] + [HCO3 - ]= 10±2 meq/l Algunos aniones y cationes pueden medirse fácilmente (Na +, Cl - y HCO3 - ). Normalmente la [Na + ] está en exceso de la sumatoria de la [Cl - ] y [HCO3 - ]. Esto es debido a la presencia de aniones no medidos. Los aniones no medidos incluyen a los ácidos inorgánicos (sulfatos y fosfatos) y aniones orgánicos (lactato, β-hidroxibutirato y salicilato), y aniones proteicos. En ciertos tipos de ACIDOSIS METABOLICAS, la concentración de los aniones no medidos aumenta, resultando en un aumento del anión gap. Suponiendo que la acidosis metabólica es debida a la ganancia neta de H + A -, donde A - es algún anión no medido, el HCO3 - se combina con H + para formar H2CO3; el H2CO3 se convierte en CO2, y el CO2 es perdido por ventilación alveolar. El resultado neto es que el HCO3 - es reemplazado por A -. En otras palabras, la [HCO3 - ] plasmático cae y [A - ] aumenta. Como [Na + ] y [Cl - ] se mantienen constantes, al anión gap aumenta. CALCULO DEL GAP OSMOLAR El gap osmolar es una medida de las moléculas del plasma que son osmóticamente activas, pero que no son medidas por los paneles químicos sanguíneos estándar. Algunas de estas moléculas pueden conducir a acidosis metabólica con elevado anión gap, así como a toxicidad severa. La osmolalidad plasmática (Osm p) puede ser medida directamente por la depresión del punto de congelación. La osmolalidad plasmática puede ser calculada usando las concentraciones plasmáticas de sodio (meq/l), glucosa (mg/dl) y urea o nitrógeno ureico (mg/dl). Osm p calculada= (2 x [Na+] + [glucosa]/18 + [urea]/6 o [N ureico]/2,8) El gap osmolar se calcula: Gap osmolar= Osm p medida Osm p calculada. Gap osmolar >25 mosm/kg agua indica que hay una concentración significativa de una molécula osmóticamente activa.
6 ACIDOSIS METABOLICA CON ANION GAP ELEVADO Y GAP OSMOLAR AUMENTADO Ingestión de etilenglicol: alcohólicos, niños o pacientes suicidas pueden ingerir soluciones conteniendo etilenglicol. A dosis típicamente tóxicas para el sistema nervioso, el etilenglicol aumenta la osmolalidad plasmática. El etilenglicol es rápidamente metabolizado por la alcohol deshidrogenasa a ácido oxálico (oxalato). Esto resulta en una severa acidosis metabólica, así como también, en insuficiencia renal aguda secundaria al depósito de oxalato en los túbulos renales. En la presencia de una acidosis metabólica severa con anión gap y gap osmolar aumentados, y sospecha clínica, se deben medir los niveles de etilenglicol. Ingestión de metanol: alcohólicos, niños o pacientes suicidas pueden ingerir soluciones conteniendo metanol. A dosis tóxicas de metanol, el metanol aumenta la osmolalidad plasmática. El metanol también es metabolizado rápidamente a formaldehído, que es muy tóxico para el sistema nervioso central (SNC), y ácido fórmico, resultando en una profunda acidosis metabólica. En la presencia de una acidosis metabólica severa con anión gap y gap osmolar aumentados, y sospecha clínica, se deben medir los niveles de metanol. Cetoacidosis alcohólica: la combinación de la ingestión de alcohol y el ayuno, estimulan la lipólisis y la producción de cetoácidos. Esto conduce a un aumento del anión gap. A diferencia de la diabetes, la concentración de glucosa sanguínea generalmente es baja o normal. Los niveles aumentados de etanol en sangre producen un gap osmolar elevado. ACIDOSIS METABOLICA CON ANION GAP ELEVADO Y GAP OSMOLAR NORMAL Cetoacidosis diabética: Tipo 1. La deficiencia de insulina conduce a hiperglucemia, así como también a lipólisis y sobreproducción de cetoácidos (β-hidroxibutirato y acetoacetato) y cetonas (acetona). Los cetoácidos producen acidosis metabólica con anión gap aumentado. Este diagnóstico se hace frente a hiperglucemia, acidosis metabólica con anión gap aumentado, y la presencia de cetonas en sangre y orina confirma este diagnóstico. Acidosis láctica: Muchos tejidos pueden metabolizar glucosa anaeróbicamente, pero sólo el hígado y el riñón utilizan ácido láctico para sintetizar glucosa. La acidosis láctica resulta en la sobreproducción y/o subutilización de ácido láctico. Las causas incluyen: 1) hipoperfusión tisular, 2) hipoxia aguda, 3) errores congénitos del metabolismo en niños que resultan de un bloqueo en la gluconeogénesis o la inhibición del metabolismo oxidativo del piruvato, 4) monóxido de carbono-inhibición del transporte de oxígeno por la hemoglobina, 5) inhibición por cianuro del transporte de electrones al oxígeno (puede ocurrir en el tratamiento de hipertensión con nitroprusiato). Los niveles aumentados de ácido láctico producen acidosis metabólica con anión gap aumentado. Los niveles de piruvato y ácido láctico pueden ser medidos rápidamente para confirmar la acidosis láctica. D-acidosis láctica: El crecimiento excesivo de microorganismos en el intestino delgado produce la conversión de carbohidratos en D-ácido láctico. El D-ácido láctico es reabsorbido a la sangre. El D-ácido láctico no puede ser metabolizado por el hombre. El D-ácido láctico se acumula en sangre, causando así acidosis con anión gap aumentado. El test usual de laboratorio no mide la forma D-ácido láctico.
7 Ingestión de salicilatos: La ingestión de altas dosis de salicilatos (aspirina) puede producir acidosis metabólica con anión gap aumentado y alcalosis respiratoria. La acidosis metabólica se debe al salicilato perse así como a los cetoácidos endógenos y al ácido láctico producido debido al efecto tóxico del salicilato. Los niveles de salicilatos deben se medidos. Exposición a tolueno: La exposición a tolueno por aspiración de pegamentos puede causar acidosis metabólica severa debido a la conversión del tolueno a ácido benzoico y ácido hipúrico. Normalmente el riñón es capaz de excretar rápidamente el hipurato. Sin embargo, el anión se acumula si la función renal es insuficiente. Insuficiencia renal (severa): La insuficiencia renal severa se define cuando la velocidad de filtrado glomerular es aprox 10 ml/min/1.73m 2. Hay una reducción marcada del número de nefronas funcionantes. A pesar de que las nefronas funcionantes restantes aumentan la excreción neta de ácidos, hay una reducción en la excreción neta de ácidos en general, debido a la reducción del número de nefronas funcionantes. De esta manera, la [H + ] aumenta y el ph disminuye. Además, hay una disminución en la excreción de ácidos orgánicos e inorgánicos que resulta en un aumento del anión gap. Una marcada elevación de creatinina y urea establece el diagnóstico de IR severa. ACIDOSIS METABOLICA CON ANION GAP NORMAL ph URINARIO MINIMO: La acidemia puede estar presente espontáneamente o puede ser causada por tratamiento con ácidos (NH4Cl). La acidemia está reflejada por una disminución de la [HCO3 - ] en plasma. La acidemia causa que el riñón aumente la excreción de H +, conduciendo a la disminución del ph urinario. El mínimo ph urinario es el menor ph que una persona puede generar cuando está acidémica. El mínimo ph urinario debería caer por debajo de 5,5 debido a una excreción máxima de H + en el túbulo distal. El mínimo ph urinario puede no caer por debajo de 5,5 en algunas enfermedades renales. CARGA NETA URINARIA: La acidemia estimula la excreción neta de ácidos aumentando la excreción de la acidez titulable y el NH4 +. Es difícil medir directamente la Acidez titulable o el NH4 + en orina. Sin embargo, el NH4 + puede ser estimado indirectamente por el cálculo de la carga neta urinaria (CNU). CNU= ([Na + ] urinario + [K + ] urinario [Cl - ] urinario) Cuando la CNU es negativa (CNU<0), hay un exceso de Cl - (Cl - > Na + + K + ). Esto implica que hay secreción de NH4 no medido. Cuando la CUN es positiva, no hay un exceso de Cl - respecto a Na + K. Esto implica que hay un deterioro en la excreción de NH4 +. La excreción de NH4 + puede estar deteriorada en ciertas enfermedades renales. EXCRECION DE BICARBONATO: En un paciente con bajo bicarbonato plasmático debido a una acidosis metabólica. El HCO3 - plasmático puede ser aumentado administrándole NaHCO3. Se puede medir la [HCO3 - ] en plasma y orina, y la de creatinina en plasma y orina. Se pueden calcular el bicarbonato filtrado, reabsorbido y excretado. El HCO3 - excretado puede ser expresado como la fracción de bicarbonato filtrado que es excretado. Al aumentar el HCO3 - plasmático, aumenta el HCO3 - filtrado. En una persona normal, la excreción fraccional de bicarbonato es muy baja cuando la concentración plasmática de bicarbonato es normal. La excreción fraccional de HCO3 - está aumentada en ciertas enfermedades del túbulo proximal del riñón.
8 CAUSAS DE ACIDOSIS METABOLICA CON ANION GAP NORMAL CAUSAS RENALES Acidosis tubular renal tipo I o acidosis tubular renal distal: Este desorden se caracteriza por una reducción en la excreción neta de ácidos por el conducto colector en el riñón. A pesar de la acidosis, el ph urinario no cae por debajo de 5,5 (el ph urinario mínimo está aumentado). El NH3 urinario no es atrapado en el lumen tubular, entonces la excreción urinaria de NH4 + no aumenta con la acidosis. De esta manera, la excreción neta de ácidos está reducida. El bicarbonato filtrado es reabsorbido normalmente en el túbulo proximal. La [K + ] en plasma es normal o baja. Hay formas hereditarias de la enfermedad, autosómica dominante o recesiva, que resultan de mutaciones en genes involucrados en la excreción de H + y la reabsorción de HCO3 - en conducto colector (ej. genes del intercambiador Cl - /HCO3 - o H + -ATPasa). También existen formas adquiridas del desorden que se producen por daño del tubo colector distal causado por enfermedades autoinmunes (Sindrome de Sjögren y artritis reumatoidea), toxicidad por drogas, exposición a toxinas (tolueno) y depósitos de calcio (hipercalciuria idiopática). Hay consecuencias de la ATR distal. En niños, hay alteraciones en el crecimiento. En adultos y niños, el calcio esquelético se disuelve como resultado de la acidosis metabólica crónica y hay un aumento en la excreción de calcio por orina. Esto conduce a osteopenia (disminución del calcio en el hueso), nefrolitiasis (cálculos renales de calcio) y nefrocalcinosis (depósitos de calcio en riñón). Acidosis tubular renal tipo II o acidosis tubular renal proximal: Este desorden se caracteriza por una disminución en la reabsorción del HCO 3 - filtrado en túbulo proximal. Cuando la [HCO3 - ] en plasma es baja, sólo una pequeña cantidad del HCO3 - filtrado no es reabsorbida en el túbulo proximal. El conducto colector puede excretar cantidades suficientes de H + para neutralizar y reabsorber esa pequeña cantidad de HCO3 - y así reducir el ph urinario por debajo de 5,5. De esta manera, el ph urinario mínimo es <5,5. Cuando la [HCO3 + ] en plasma aumenta hacia niveles normales por administración de NaHCO3, una gran cantidad del HCO3 - filtrado alcanza el tubo colector. El tubo colector no puede excretar suficiente cantidad de H + como para neutralizar y reabsorber la gran cantidad de HCO3 -. De esta manera, grandes cantidades de HCO3 - son excretadas por la orina y el ph urinario es > 5,5. La ATR proximal puede ser un desorden aislado o asociarse con otros defectos del TP. La ATR proximal aislada puede ser genética (deficiencia de anhidrasa carbónica) o adquirida (inhibición de la anhidrasa carbónica por acetazolamida). Más comunmente, la ATR proximal está asociada a otros defectos en la reabsorción de glucosa filtrada, aminoácidos, fosfato, agua, Na y K en el túbulo proximal, que resultan en glucosuria, aminoaciduria, fosfaturia y poliuria. Esto se llama Síndrome de Fanconi. Este síndrome puede ser debido a los efectos tóxicos de proteínas normales (mieloma múltiple), drogas o metabolitos sobreproducidos en enfermedades transmitidas genéticamente (cistinosis, tirosinemia, galactosemia, intolerancia hereditaria a la fructosa). Acidosis tubular renal tipo IV o disfunción generalizada de la nefrona distal. Esto es debido a la falta de efecto de la aldosterona en el riñón. La falta de efecto de aldosterona en riñón resulta en una reducción en la excreción de K +. La reducida excreción de K + resulta en hiperkalemia (aumento de K+ en sangre). La hiperkalemia resultante inhibe la excreción urinaria de amonio (inhibe amoniogénesis). A pesar de que el conducto colector puede disminuir el ph urinario por debajo de 5,5, la capacidad de excreción neta de ácidos está reducida debido a la disminución en la excreción de amonio. Esto significa que el ph urinario mínimo es <5,5, pero la carga neta urinaria es positiva. La falta de efecto de aldosterona en riñón puede deberse a una deficiencia de
9 aldosterona o resistencia tubular a la aldosterona. La deficiencia de aldosterona puede ser causada por hiporreninismo hipoaldosteronémico (producción reducida de renina en diabetes y nefritis intersticial) o deficiencia primaria de mineralocorticoides (enfermedad autoinmune de glándula adrenal, defectos congénitos enzimáticos). La resistencia a la aldosterona puede deberse a trastornos genéticos (pseudohipoaldosteronismo, receptor mineralocorticoide y defectos en canales de sodio), drogas (espironolactona, triamterene, amiloride) o nefropatía obstructiva. Insuficiencia renal leve: La IR leve es definida por una VFG de ml/min/1,73 m2 Hay una leve reducción en el número de nefronas funcionantes. Las nefronas individuales remanentes son capaces de aumentar la excreción neta de ácidos generando un ph urinario mínimo de 5,5 y aumentando la excreción de amonio. Sin embargo, la excreción neta de ácidos total está reducida debido al menor número de nefronas. La IR leve se diagnostica por la presencia de leve aumento de creatinina. El grado de IR puede ser estimado por el aumento de creatinina. Con IR leve la excreción de aniones está preservada. Por lo tanto, el anión gap es normal. (En contraste con la IR severa donde la excreción de aniones está reducida y el anión gap aumentado). CAUSAS NO RENALES Los mecanismos renales de reabsorción del HCO3 - filtrado y aumento de la excreción neta de ácidos alcanzando el ph urinario mínimo y aumentando la excreción de amonio están intactos, pero pueden ser insuficientes para compensar totalmente. Esto significa que no hay excreción urinaria de HCO3 -, la carga neta urinaria es negativa y el ph urinario mínimo es < 5,5. Pérdidas gastrointestinales de HCO3 -. El HCO3 - es perdido por diarrea, drenaje pancreático externo (trasplante o pancreatitis) o drenaje de intestino delgado (ileostomía). Nutrición parenteral total: contiene ArgCl y LysCl. Administración de estos por vía endovenosa es equivalente a dar H +. Acidosis dilucional. La expansión del LEC con una solución que contiene Cl - pero no HCO3 -, produce la dilución del HCO3- extracelular. Esto va a conducir a la disociación del H2CO3 a HCO3 - y H +. El HCO3- va a restaurar parcialmente la [HCO3 - ] y el H + va a reducir el ph. Acidosis Metab. AG Normal Excreción - HCO 3 urinario ph urinario mínimo Carga neta urinaria K+ plasmático ATR Tipo I normal >5,5 Positiva Normal o ATR Tipo II aumentada < 5,5 Negativa Normal o ATR Tipo IV normal < 5,5 Positiva aumentado IR leve normal < 5,5 Negativa Normal No renal normal < 5,5 Negativa normal ALCALOSIS METABOLICA La alcalosis metabólica puede dividirse en desórdenes de origen renal y no renal.
10 PRUEBAS DE LABORATORIO Ciertos trastornos renales pueden producir disminución en la reabsorción del Cl - filtrado, así como también de Na + y/o K. E + n este caso, la [Cl - ] en orina es inapropiadamente elevada (>10 meq/l) En alteraciones no renales generalmente la reabsorción del Cl - filtrado es normal. En este caso, la [Cl - ] en orina no está elevada (<10 meq/l) CAUSAS RENALES [Cl - ] en orina es alto (>10 meq/l) Diuréticos. Los diuréticos del asa bloquean al co-transportador Na-K2Cl en la rama ascendente gruesa del asa de Henle, y de esta forma, bloquean la reabsorción de estos iones. Los diuréticos tiazidas bloquean al co-transportador NaCl en el túbulo distal, y así bloquean la reabsorción de Na + y Cl -. Los diuréticos del asa y las tiazidas aumentan la excreción de Na + (natriuresis) y Cl -, y así producen contracción del volumen del LEC. El aumento de la [HCO3 - ] lleva a la conversión de HCO3 - a H2CO3. La [H + ] en plasma se reduce y el ph aumenta (alcalosis). La contracción del LEC resultante conduce a un aumento en la secreción de renina por el aparato yuxtaglomerular renal. El aumento en la renina estimula la secreción de aldosterona por la glándula adrenal. Los altos niveles de aldosterona estimulan la secreción de H + y la generación de HCO3 - por el conducto colector. Esto resulta en la disminución de la [H + ] y el aumento del ph y del [HCO3 - ] o alcalosis metabólica. Notar que ambos diuréticos causan un aumento en la excreción de K + en orina (kaliuresis) y de esta manera conducen a la disminución de la [K + ] en sangre (hipokalemia). Síndrome de Bartter. Los pacientes con Síndrome de Bartter se comportan fisiológicamente como si hubieran sido tratados con diuréticos del asa. Muchos pacientes muestran un defecto genético en el co-transportados NKCC2 que es blanco de los diuréticos del asa. Otros defectos genéticos similares ocurren también. Es de notar que también hay un aumento en la excreción de calcio en orina (hipercalciuria). Esto puedo producir luego, depósitos de calcio en el riñón (nefrocalcinosis). No hay aumento en la excreción de Mg por orina. Síndrome de Gitelman. El Síndrome de Gitelman se comporta como el tratamiento con diuréticos tiazidas. Se ha visto que muchos pacientes presentan un defecto genético en el co-transportador NaCl (NCCT), que es el blanco de los diuréticos tiazidas en el túbulo distal. Es de notar que no hay un aumento en la excreción urinaria de calcio pero sí en la de Mg (hipermagnesiuria). Esto conduce a la reducción del Mg en sangre (hipomagnesemia) CAUSAS NO RENALES [Cl - ] en orina es bajo (<10 meq/l) Pérdida de H + gastrointestinales. Vómitos o succión nasogástrica resultan en la pérdida de HCl (H + ) en secreciones gástricas, produciendo alcalosis metabólica. Debido a que se pierde NaCl y KCl en las secreciones gástricas, también se produce contracción del volumen extracelular. La depleción de volumen estimula la producción de renina por el riñón. El aumento en la renina estimula la secreción de aldosterona por la glándula adrenal. Los altos niveles de aldosterona estimulan la secreción de H + y la generación de HCO3 - por el conducto colector. Esto resulta en la disminución de la [H + ] y el aumento del ph y del [HCO3 - ]. Es de notar que los vómitos pueden ser autoinducidos, como en la anorexia nerviosa y la bulimia.
11 Alcalosis por contracción. Pérdida de fluidos que contienen bicarbonato libre o cloruro de fuente extrarrenal. Esta puede deberse a excesiva secreción gástrica en aclorhidria, excesiva sudoración en fibrosis quística, o formas raras de diarrea secretoria (adenoma velloso, abuso de laxantes o clorhidrea congénita) El aumento de bicarbonato lleva a la conversión de HCO3 - a H2CO3. La [H + ] en plasma se reduce y el ph aumenta (alcalosis). La contracción de volumen también causa alcalosis por el mecanismo renina-aldosterona. Alcalosis posthipercápnica: Disminución rápida de la pco2 por ventilación mecánica del paciente con acidosis respiratoria que resulta en alcalosis. Toma tiempo para el riñón compensar la alcalosis. CONSECUENCIAS DE ACIDEMIA SEVERA (ph< 7,20) Cardiovascular: deterioro del volumen minuto y perfusión, arritmias cardiacas Cerebral: estado mental alterado Respiratorio: hiperventilación desarrolla falla respiratoria por fatiga de músculos respiratorios Metabólico: hiperkalemia puede conducir a arritmia cardiaca letal (más probable con acidosis metabólica que respiratoria.
EDUCATIVO. Alteraciones del. - Departamento de Fisiopatología - Facultad de Medicina 2011MATERIAL. Dr MSc José Boggia
 - Departamento de Fisiopatología - Facultad de Medicina Alteraciones del equilibrio i ácido-base 2011 Dr MSc José Boggia PANORAMICA GLOBAL I. Recordatorio de la fisiología ácido-base II. Diagnóstico de
- Departamento de Fisiopatología - Facultad de Medicina Alteraciones del equilibrio i ácido-base 2011 Dr MSc José Boggia PANORAMICA GLOBAL I. Recordatorio de la fisiología ácido-base II. Diagnóstico de
Fisiopatología del Equilibrio Ácido-Base ACIDOSIS
 Fisiopatología del Equilibrio Ácido-Base ACIDOSIS Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiologia Universidad Austral de Chile ALTERACIONES DEL EQUILIBRIO ACIDO BASE: I. ACIDOSIS:
Fisiopatología del Equilibrio Ácido-Base ACIDOSIS Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiologia Universidad Austral de Chile ALTERACIONES DEL EQUILIBRIO ACIDO BASE: I. ACIDOSIS:
BALANCE ÁCIDO-BASE Y REGULACIÓN DEL ph
 BALANCE ÁCIDO-BASE Y REGULACIÓN DEL ph INTRODUCCION Importancia del mantenimiento del ph [H + ] afecta: Conformación de proteínas Reacciones donde el H + es producto o reactivo Liberación de O 2 de la
BALANCE ÁCIDO-BASE Y REGULACIÓN DEL ph INTRODUCCION Importancia del mantenimiento del ph [H + ] afecta: Conformación de proteínas Reacciones donde el H + es producto o reactivo Liberación de O 2 de la
REGULACIÓN DEL EQUILIBRIO ÁCIDO-BASE. Bqca. Sofía Langton Fisiología Humana Junio 2014
 REGULACIÓN DEL EQUILIBRIO ÁCIDOBASE Bqca. Sofía Langton Fisiología Humana Junio 2014 Objetivos 1. Estudiar la importancia del balance ácidobase en el organismo. 2. Comprender los tres sistemas (amortiguadores,
REGULACIÓN DEL EQUILIBRIO ÁCIDOBASE Bqca. Sofía Langton Fisiología Humana Junio 2014 Objetivos 1. Estudiar la importancia del balance ácidobase en el organismo. 2. Comprender los tres sistemas (amortiguadores,
Equilibrio Ácido - Base
 Equilibrio Ácido - Base OBJETIVOS Comprender la importancia de mantener los valores de ph dentro del rango normal Analizar los diferentes mecanismos de regulación que permiten mantener el equilibrio ácido-base
Equilibrio Ácido - Base OBJETIVOS Comprender la importancia de mantener los valores de ph dentro del rango normal Analizar los diferentes mecanismos de regulación que permiten mantener el equilibrio ácido-base
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA CICLO ACADÉMICO 2,009
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,009 Equilibrio AcidoAcido-Base Dr. Mynor A. Leiva Enríquez Las moléculas
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,009 Equilibrio AcidoAcido-Base Dr. Mynor A. Leiva Enríquez Las moléculas
lunes 27 de febrero de 12 Desequilibrio Acido-Base
 Desequilibrio Acido-Base Equilibrio Ácido-Base H + es un anión con muy baja concentración en el cuerpo humano. Na + 3.5 millones de veces mas que H + Escala de ph: mide el grado de acidez de una solución.
Desequilibrio Acido-Base Equilibrio Ácido-Base H + es un anión con muy baja concentración en el cuerpo humano. Na + 3.5 millones de veces mas que H + Escala de ph: mide el grado de acidez de una solución.
TRASTORNOS METABOLICOS DEL ESTADO ACIDO-BASE
 TRASTORNOS METABOLICOS DEL ESTADO ACIDO-BASE ALTERACIONES ACIDO-BASE Los ácidos son producidos en forma continua, durante el metabolismo normal La concentración de hidrógeno en el LEC se mantiene en un
TRASTORNOS METABOLICOS DEL ESTADO ACIDO-BASE ALTERACIONES ACIDO-BASE Los ácidos son producidos en forma continua, durante el metabolismo normal La concentración de hidrógeno en el LEC se mantiene en un
EQUILIBRIO ACIDO - BASE
 EQUILIBRIO ACIDO - BASE Carrera de Médicos Especialistas Universitarios en Medicina Crítica y Terapia Intensiva. Universidad de Buenos Aires CONCEPTOS GENERALES EQUILIBRIO ACIDO-BASE EN FORMA ESTEQUIOMÉTRICA
EQUILIBRIO ACIDO - BASE Carrera de Médicos Especialistas Universitarios en Medicina Crítica y Terapia Intensiva. Universidad de Buenos Aires CONCEPTOS GENERALES EQUILIBRIO ACIDO-BASE EN FORMA ESTEQUIOMÉTRICA
EQUILIBRIO ÁCIDO-BASE
 EQUILIBRIO ÁCIDO-BASE - Departamento de Fisiopatología - Facultad de Medicina Br. Inés Lujambio CONCEPTOS BÁSICOS. Ácido: toda sustancias capaz de ceder protones de hidrógeno (H + ). HCl H + + Cl - Base:
EQUILIBRIO ÁCIDO-BASE - Departamento de Fisiopatología - Facultad de Medicina Br. Inés Lujambio CONCEPTOS BÁSICOS. Ácido: toda sustancias capaz de ceder protones de hidrógeno (H + ). HCl H + + Cl - Base:
GASES EN SANGRE. modifican el ph sanguineo.
 GASES EN SANGRE ESTADO ACIDO-BASE ESTADO DE OXIGENACION Detectar o confirmar alteraciones metabolicas y/o respiratorias que modifican el ph sanguineo. Determinar si la oxigenacion tisular es la adecuada.
GASES EN SANGRE ESTADO ACIDO-BASE ESTADO DE OXIGENACION Detectar o confirmar alteraciones metabolicas y/o respiratorias que modifican el ph sanguineo. Determinar si la oxigenacion tisular es la adecuada.
ALTERACIONES DEL EQUILIBRIO ÁCIDO BASE. Prof. Dra. Liliana G. Bianciotti
 ALTERACIONES DEL EQUILIBRIO ÁCIDO BASE Prof. Dra. Liliana G. Bianciotti lbianc@ffyb.uba.ar 2016 ALTERACIONES DEL EQUILIBIO ACIDO-BASE ph 7.35-7.45 Metabolismo de Ca 2+ y K + Solubilidad de sales óseas
ALTERACIONES DEL EQUILIBRIO ÁCIDO BASE Prof. Dra. Liliana G. Bianciotti lbianc@ffyb.uba.ar 2016 ALTERACIONES DEL EQUILIBIO ACIDO-BASE ph 7.35-7.45 Metabolismo de Ca 2+ y K + Solubilidad de sales óseas
ESTADO ACIDO-BASE CONCEPTOS TEORICO-PRACTICOS FUNDAMENTALES
 ESTADO ACIDOBASE CONCEPTOS TEORICOPRACTICOS FUNDAMENTALES Estado ácidobase: (EAB) Los trastornos del EAB se observan frecuentemente en la práctica diaria, sobre todo en pacientes agudos, algunos son simples
ESTADO ACIDOBASE CONCEPTOS TEORICOPRACTICOS FUNDAMENTALES Estado ácidobase: (EAB) Los trastornos del EAB se observan frecuentemente en la práctica diaria, sobre todo en pacientes agudos, algunos son simples
HOSPITAL NACIONAL PROF. A. POSADAS SERVICIO DE PEDIATRÍA
 HOSPITAL NACIONAL PROF. A. POSADAS SERVICIO DE PEDIATRÍA EQUILIBRIO ÁCIDO-BASE DESDE LA FISIOLOGÍA SERVICIO DE PEDIATRÍA HOSP. NAC. PROF. A. POSADAS Dept. Pediatría Fac. Medicina - UBA Horacio A. Repetto
HOSPITAL NACIONAL PROF. A. POSADAS SERVICIO DE PEDIATRÍA EQUILIBRIO ÁCIDO-BASE DESDE LA FISIOLOGÍA SERVICIO DE PEDIATRÍA HOSP. NAC. PROF. A. POSADAS Dept. Pediatría Fac. Medicina - UBA Horacio A. Repetto
Día 1 ANANMESIS Paciente masculino de 57 años llega a la guardia con fatiga y es internado para su evaluación.
 CASO CLINICO 8 Día 1 ANANMESIS Paciente masculino de 57 años llega a la guardia con fatiga y es internado para su evaluación. ANTECEDENTES Trabajador de la construcción, fumador desde su juventud. Refiere
CASO CLINICO 8 Día 1 ANANMESIS Paciente masculino de 57 años llega a la guardia con fatiga y es internado para su evaluación. ANTECEDENTES Trabajador de la construcción, fumador desde su juventud. Refiere
REGULACIÓN DEL BALANCE ÁCIDO-BÁSICO:
 REGULACIÓN DEL BALANCE ÁCIDO-BÁSICO: - FISIOLOGÍA DE ÁCIDOS Y BASES - EXCRECIÓN RENAL DE H + Miryam Romero R. MSc. PhD. Profesora de Fisiología Departamento de Ciencias Fisiológicas Universidad del Valle
REGULACIÓN DEL BALANCE ÁCIDO-BÁSICO: - FISIOLOGÍA DE ÁCIDOS Y BASES - EXCRECIÓN RENAL DE H + Miryam Romero R. MSc. PhD. Profesora de Fisiología Departamento de Ciencias Fisiológicas Universidad del Valle
Equilibrio Acido-Base. Dr Jorge Brenes Dittel. Nefrología.
 Equilibrio Acido-Base Dr Jorge Brenes Dittel. Nefrología. Equilibrio Acido-base. Fisiología ph es el logaritmo de la concentracíon del ión hidrogenion expresada en milimoles por litro. [H+] en sangre es
Equilibrio Acido-Base Dr Jorge Brenes Dittel. Nefrología. Equilibrio Acido-base. Fisiología ph es el logaritmo de la concentracíon del ión hidrogenion expresada en milimoles por litro. [H+] en sangre es
Equilibrio Acido-Base
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,008 Equilibrio Acido-Base Dr. Mynor A. Leiva Enríquez Las moléculas
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,008 Equilibrio Acido-Base Dr. Mynor A. Leiva Enríquez Las moléculas
Equilibrio Acido-Base
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 Equilibrio Acido-Base Dr. Mynor A. Leiva Enríquez Conceptos
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 Equilibrio Acido-Base Dr. Mynor A. Leiva Enríquez Conceptos
ESTADO ACIDO BASE ACIDOSIS METABOLICA. ETIOLOGÍA DE LA ACIDOSIS METABÓLICA Inhabilidad Para Secretar La Carga Acida De La Dieta +
 ESTADO ACIDO BASE Los siguientes pasos son usados para evaluar los desordenes acidobase: 1.Determinar la anormalidad de base acidosis metabólica y/o alcalosis metabólica. 2.Determinar los factores contribuyentes
ESTADO ACIDO BASE Los siguientes pasos son usados para evaluar los desordenes acidobase: 1.Determinar la anormalidad de base acidosis metabólica y/o alcalosis metabólica. 2.Determinar los factores contribuyentes
Diuréticos 19/11/2011. Mecanismos de acción, farmacocinética y reacciones adversas
 UNIVERSIDAD DE CHILE FACULTAD DE MEDICINA Diuréticos Mecanismos de acción, farmacocinética y reacciones adversas DIURÉTICOS Clasificación Diuréticos de Asa: Furosemida Tiazidas: Hidroclorotiazida Ahorradores
UNIVERSIDAD DE CHILE FACULTAD DE MEDICINA Diuréticos Mecanismos de acción, farmacocinética y reacciones adversas DIURÉTICOS Clasificación Diuréticos de Asa: Furosemida Tiazidas: Hidroclorotiazida Ahorradores
Control del Equilibrio ácido-base
 Control del Equilibrio ácido-base Escala de ph ph Concentración de H + en Eq/L 1 0.1 2 0.01 3 0.001 4 0.0001 5 0.00001 6 0.000001 7 0.0000001 7.4 0.0000004 8 0.00000001 9 0.000000001 ÁLCALI: sustancia
Control del Equilibrio ácido-base Escala de ph ph Concentración de H + en Eq/L 1 0.1 2 0.01 3 0.001 4 0.0001 5 0.00001 6 0.000001 7 0.0000001 7.4 0.0000004 8 0.00000001 9 0.000000001 ÁLCALI: sustancia
Fisiopatología Del Equilibrio Ácido-Base Alcalosis
 Fisiopatología Del Equilibrio Ácido-Base Alcalosis Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiologia Universidad Austral de Chile ALTERACIONES DEL EQUILIBRIO ACIDO BASE: II. ALCALOSIS
Fisiopatología Del Equilibrio Ácido-Base Alcalosis Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiologia Universidad Austral de Chile ALTERACIONES DEL EQUILIBRIO ACIDO BASE: II. ALCALOSIS
Interpretación Rápida de los Gases Arteriales
 Artículo de Revisión Concisa Interpretación Rápida de los Gases Arteriales Dr. Juan Ignacio Padilla Cuadra (Decano, Facultad de Medicina, Universidad de Iberoamérica) Introducción: Los gases arteriales
Artículo de Revisión Concisa Interpretación Rápida de los Gases Arteriales Dr. Juan Ignacio Padilla Cuadra (Decano, Facultad de Medicina, Universidad de Iberoamérica) Introducción: Los gases arteriales
Lic. Cintia Mendez Vedia Lic. en Nutrición Univesidad de Buenos Aires
 ÁCIDOS Y BASES Lic. Cintia Mendez Vedia Lic. en Nutrición Univesidad de Buenos Aires OBJETIVOS: - Reconocer ácidos, bases y sales, determinar sus disociaciones en agua, según sean electrolitos fuertes
ÁCIDOS Y BASES Lic. Cintia Mendez Vedia Lic. en Nutrición Univesidad de Buenos Aires OBJETIVOS: - Reconocer ácidos, bases y sales, determinar sus disociaciones en agua, según sean electrolitos fuertes
PAGINA FUNCION BASICA DEL RIÑON
 PAGINA 1 www.clases83.jimdo.com 096437814 FUNCION BASICA DEL RIÑON PAGINA 2 www.clases83.jimdo.com 096437814 PAGINA 3 www.clases83.jimdo.com 096437814 FILTRACION PAGINA 4 www.clases83.jimdo.com 096437814
PAGINA 1 www.clases83.jimdo.com 096437814 FUNCION BASICA DEL RIÑON PAGINA 2 www.clases83.jimdo.com 096437814 PAGINA 3 www.clases83.jimdo.com 096437814 FILTRACION PAGINA 4 www.clases83.jimdo.com 096437814
Escala de ph. Concentración de H + en Eq/L
 Escala de ph ph Concentración de H + en Eq/L 1 0.1 2 0.01 3 0.001 4 0.0001 5 0.00001 6 0.000001 7 0.0000001 7.4 0.0000004 8 0.00000001 9 0.000000001 ÁLCALI: sustancia capaz de aceptar un H + ÁCIDO: sustancia
Escala de ph ph Concentración de H + en Eq/L 1 0.1 2 0.01 3 0.001 4 0.0001 5 0.00001 6 0.000001 7 0.0000001 7.4 0.0000004 8 0.00000001 9 0.000000001 ÁLCALI: sustancia capaz de aceptar un H + ÁCIDO: sustancia
Actualización en Medio Interno Conceptos básicos
 Actualización en Medio Interno Conceptos básicos Bioquímica Lucrecia Drago Bioquímica M. Fernanda Pontoriero Ácidos Moléculas capaces de liberar H + HCl H + + Cl H 2 CO 3 H + + HCO 3 Bases Moléculas capaces
Actualización en Medio Interno Conceptos básicos Bioquímica Lucrecia Drago Bioquímica M. Fernanda Pontoriero Ácidos Moléculas capaces de liberar H + HCl H + + Cl H 2 CO 3 H + + HCO 3 Bases Moléculas capaces
Agua, electrolitos, balance acido-base. Dra. Luz E. Cuevas-Molina NURS 1231
 Agua, electrolitos, balance acido-base Dra. Luz E. Cuevas-Molina NURS 1231 1 Introducción Para mantener la homoestasis debe haber un balance entre las cantidades de fluido y electrolitos Los electrolitos
Agua, electrolitos, balance acido-base Dra. Luz E. Cuevas-Molina NURS 1231 1 Introducción Para mantener la homoestasis debe haber un balance entre las cantidades de fluido y electrolitos Los electrolitos
TALLER DE MEDIO INTERNO. Fernando Tortosa - Luis Aramayo
 TALLER DE MEDIO INTERNO Fernando Tortosa Luis Aramayo Interpretación del EAB La interpretación del EAB se inicia con el conocimiento de los antecedentes del paciente y su estado clínico actual Datos necesarios
TALLER DE MEDIO INTERNO Fernando Tortosa Luis Aramayo Interpretación del EAB La interpretación del EAB se inicia con el conocimiento de los antecedentes del paciente y su estado clínico actual Datos necesarios
TEMA 3. FUNCIÓN TUBULAR (II). EQUILIBRIO DEL AGUA. EQUILIBRIO ÁCIDO- BÁSICO
 TEMA 3. FUNCIÓN TUBULAR (II). EQUILIBRIO DEL AGUA. EQUILIBRIO ÁCIDO- BÁSICO Equilibrio del agua. Resorción de agua en túbulo proximal y en asa de Henle. Mecanismos de concentración y de dilución de la
TEMA 3. FUNCIÓN TUBULAR (II). EQUILIBRIO DEL AGUA. EQUILIBRIO ÁCIDO- BÁSICO Equilibrio del agua. Resorción de agua en túbulo proximal y en asa de Henle. Mecanismos de concentración y de dilución de la
PROPÓSITO DE MEDIR LOS GASES ARTERIALES
 FISIOLOGÍA DE GASES ARTERIALES La primera parte de este módulo comprende elementos básicos sobre la fisiología de los gases arteriales. Este módulo ayudará a los profesionales de la enfermería y cardiorrespiratorios
FISIOLOGÍA DE GASES ARTERIALES La primera parte de este módulo comprende elementos básicos sobre la fisiología de los gases arteriales. Este módulo ayudará a los profesionales de la enfermería y cardiorrespiratorios
Amortiguadores o Buffer. SEMANA 13 Licda. Lilian Judith Guzman melgar
 Amortiguadores o Buffer SEMANA 13 Licda. Lilian Judith Guzman melgar Soluciones amortiguadoras También llamadas soluciones: Buffer Reguladoras Tampón Solución Buffer Es una solución de un ácido débil y
Amortiguadores o Buffer SEMANA 13 Licda. Lilian Judith Guzman melgar Soluciones amortiguadoras También llamadas soluciones: Buffer Reguladoras Tampón Solución Buffer Es una solución de un ácido débil y
1. Líquidos corporales. 2. Anatomía y función renal. 3. Hormonas ADH y aldosterona
 1. Líquidos corporales 2. Anatomía y función renal 3. Hormonas ADH y aldosterona Propiedades de la Homeostasis 1. Importancia tanto del sistema nervioso como del endocrino. 2. Controles antagónicos. 3.
1. Líquidos corporales 2. Anatomía y función renal 3. Hormonas ADH y aldosterona Propiedades de la Homeostasis 1. Importancia tanto del sistema nervioso como del endocrino. 2. Controles antagónicos. 3.
Fisiopatología Equilibrio Hidrosalino. Potasio
 Fisiopatología Equilibrio Hidrosalino Potasio Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiología Universidad Austral de Chile Valdivia- Chile FISIOPATOLOGIA DEL EQUILIBRIO DEL K+:
Fisiopatología Equilibrio Hidrosalino Potasio Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiología Universidad Austral de Chile Valdivia- Chile FISIOPATOLOGIA DEL EQUILIBRIO DEL K+:
METABOLISMO ACIDO / BASE
 METABOLISMO ACIDO / BASE Dr Sergio Octavio GRANADOS TINAJERO Hospital Angeles de Villahermosa, Villahermosa, Tabasco, México. Course : 3 Year : 2003 Language : Spanish Country : Mexico City : Baja California
METABOLISMO ACIDO / BASE Dr Sergio Octavio GRANADOS TINAJERO Hospital Angeles de Villahermosa, Villahermosa, Tabasco, México. Course : 3 Year : 2003 Language : Spanish Country : Mexico City : Baja California
Revista de Actualización Clínica Volumen
 ACIDOSIS METABOLICA Vargas Flores Tatiana 1 Colaboración: Condori Canaza Claudia 2 RESUMEN El ph responsable del equilibrio ácidobase a nivel del líquido extracelular tiene un valor de 7,35 a 7,40; el
ACIDOSIS METABOLICA Vargas Flores Tatiana 1 Colaboración: Condori Canaza Claudia 2 RESUMEN El ph responsable del equilibrio ácidobase a nivel del líquido extracelular tiene un valor de 7,35 a 7,40; el
DIURÉTICOS. Prof. Maribel Bravo Mata Farmacología Veterinaria Febrero 2016
 UNIVERSIDAD CENTROCCIDENTAL LISANDRO ALVARADO DECANATO DE CIENCIAS VETERINARIAS DEPARTAMENTO DE CIENCIAS BÁSICAS FARMACOLOGÍA VETERINARIA UCLA DIURÉTICOS 3 de Febrero de 1964 Prof. Maribel Bravo Mata Farmacología
UNIVERSIDAD CENTROCCIDENTAL LISANDRO ALVARADO DECANATO DE CIENCIAS VETERINARIAS DEPARTAMENTO DE CIENCIAS BÁSICAS FARMACOLOGÍA VETERINARIA UCLA DIURÉTICOS 3 de Febrero de 1964 Prof. Maribel Bravo Mata Farmacología
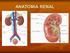
UNIDAD RENAL. Anatomía y fisiología del aparato urinario. LEI. JAVIER CESPEDES MATA ME.
 UNIDAD RENAL Anatomía y fisiología del aparato urinario. LEI. JAVIER CESPEDES MATA ME. Funciones de la nefrona Filtración glomerular. Reabsorción glomerular. Secreción tubular. Excresion Tasa de filtración
UNIDAD RENAL Anatomía y fisiología del aparato urinario. LEI. JAVIER CESPEDES MATA ME. Funciones de la nefrona Filtración glomerular. Reabsorción glomerular. Secreción tubular. Excresion Tasa de filtración
EQUILIBRIO ÁCIDO-BASE MANTENIMIENTO DE LA HOMEOSTASIS
 EQUILIBRIO ÁCIDO-BASE MANTENIMIENTO DE LA HOMEOSTASIS EQUILÍBRIO ÁCIDO-BASE La regulación de ph a nivel celular, es necesaria para la supervivencia. Los ácidos y bases entran continuamente en la sangre
EQUILIBRIO ÁCIDO-BASE MANTENIMIENTO DE LA HOMEOSTASIS EQUILÍBRIO ÁCIDO-BASE La regulación de ph a nivel celular, es necesaria para la supervivencia. Los ácidos y bases entran continuamente en la sangre
Dra. Mélida Bermúdez, Dr. Manuel Velasco, Dra. Caroline González
 GUÍA DE SEMINARIO UNIDAD IV DIURÉTICOS Dra. Mélida Bermúdez, Dr. Manuel Velasco, Dra. Caroline González Revise los mecanismos- fisiológicos de reabsorción de agua y electrolitos a lo largo del nefrón:
GUÍA DE SEMINARIO UNIDAD IV DIURÉTICOS Dra. Mélida Bermúdez, Dr. Manuel Velasco, Dra. Caroline González Revise los mecanismos- fisiológicos de reabsorción de agua y electrolitos a lo largo del nefrón:
Índice. Sección I. 1. Química y amortiguamiento acidobásicos Homeostasis acidobásica intracelular... 35
 Índice Prefacio... V Prólogo... VII Indice... IX Colaboradores... XVII Sección I 1. Química y amortiguamiento acidobásicos... 21 - John H. Galla Introducción... 21 Amortiguamiento... 24 El papel de los
Índice Prefacio... V Prólogo... VII Indice... IX Colaboradores... XVII Sección I 1. Química y amortiguamiento acidobásicos... 21 - John H. Galla Introducción... 21 Amortiguamiento... 24 El papel de los
DIURETICOS. Profa. Almudena Albillos Martínez Departamento de Farmacología y Terapéutica Facultad de Medicina Universidad Autónoma de Madrid
 DIURETICOS Profa. Almudena Albillos Martínez Departamento de Farmacología y Terapéutica Facultad de Medicina Universidad Autónoma de Madrid Fisiología renal FUNCION DEL RIÑON - LA NEFRONA Función del riñón:
DIURETICOS Profa. Almudena Albillos Martínez Departamento de Farmacología y Terapéutica Facultad de Medicina Universidad Autónoma de Madrid Fisiología renal FUNCION DEL RIÑON - LA NEFRONA Función del riñón:
FISIOPATOLOGIA. Concentración normal H+: 40 nmoles/l. -PH : 6.8-7.35 < -( H+) : 16-160 nmoles/l -PCO2: 36-44 mmhg -BE: -3 a 3
 FISIOPATOLOGIA Concentración normal H+: 40 nmoles/l -PH : 6.8-7.35 < -( H+) : 16-160 nmoles/l -PCO2: 36-44 mmhg -BE: -3 a 3 FISIOPATOLOGIA ACIDO-BASE ACIDO: sustancia capaz de ceder protones BASE: sustancia
FISIOPATOLOGIA Concentración normal H+: 40 nmoles/l -PH : 6.8-7.35 < -( H+) : 16-160 nmoles/l -PCO2: 36-44 mmhg -BE: -3 a 3 FISIOPATOLOGIA ACIDO-BASE ACIDO: sustancia capaz de ceder protones BASE: sustancia
Trabajo Práctico N o 2 BUFFERS BIOLÓGICOS
 1 Trabajo Práctico N o 2 BUFFERS BIOLÓGICOS OBJETIVOS A partir de la ecuación de HendersonHasselbach calcular la concentración de (H + ),(Aceptor de H + ) o (Dador de H + ). Conocer cómo se mantiene el
1 Trabajo Práctico N o 2 BUFFERS BIOLÓGICOS OBJETIVOS A partir de la ecuación de HendersonHasselbach calcular la concentración de (H + ),(Aceptor de H + ) o (Dador de H + ). Conocer cómo se mantiene el
b. Base es la sustancia que en disolución acuosa se disocia, liberando aniones de hidroxilo (OH ) según la ecuación general:
 ACIDOS y BASES Teorías ácido - base Los ácidos y las bases fueron definidos por primera vez por el científico sueco Svante Arrhenius en 1887 en su teoría disociación iónica, en la que establecía que hay
ACIDOS y BASES Teorías ácido - base Los ácidos y las bases fueron definidos por primera vez por el científico sueco Svante Arrhenius en 1887 en su teoría disociación iónica, en la que establecía que hay
ALTERACIONES DEL EQUILIBRIO ACIDOBÁSICO
 ALTERACIONES DEL EQUILIBRIO ACIDOBÁSICO RAQUEL YAGÜE ZAPICO R1 MEDICINA INTENSIVA Servicio de Medicina Interna 2012 GENERALIDADES DIARIAMENTE: -Hidrogeniones ( ácidos no volátiles): 70 a 100 mmol en dieta
ALTERACIONES DEL EQUILIBRIO ACIDOBÁSICO RAQUEL YAGÜE ZAPICO R1 MEDICINA INTENSIVA Servicio de Medicina Interna 2012 GENERALIDADES DIARIAMENTE: -Hidrogeniones ( ácidos no volátiles): 70 a 100 mmol en dieta
Tema 34 Fisiología del sistema excretor. Filtración glomerular. Presiones y permeabilidad. Aclaramiento renal.
 Tema 34 Fisiología del sistema excretor. Filtración glomerular. Presiones y permeabilidad. Aclaramiento renal. 1. Funciones generales del sistema excretor. 2. Anatomía del sistema excretor. 3. La nefrona.
Tema 34 Fisiología del sistema excretor. Filtración glomerular. Presiones y permeabilidad. Aclaramiento renal. 1. Funciones generales del sistema excretor. 2. Anatomía del sistema excretor. 3. La nefrona.
Tema 9: Interpretación de una gasometría
 Tema 9: Interpretación de una gasometría Concepto de gasometría Gasometría en muestras de sangre (arterial, capilar, venosa) Valores normales Hipoxemia Hipercapnia e hipocapnia Acidosis y alcalosis: Introducción
Tema 9: Interpretación de una gasometría Concepto de gasometría Gasometría en muestras de sangre (arterial, capilar, venosa) Valores normales Hipoxemia Hipercapnia e hipocapnia Acidosis y alcalosis: Introducción
Fundación H.A. Barceló Facultad de Medicina
 Fundación H.A. Barceló Facultad de Medicina LICENCIATURA EN NUTRICION PRIMER AÑO FISIOLOGIA MODULO 16 LECCIONES 1 Y 2 1 MODULO 16: Equilibrio Electrolítico y Control de ph OBJETIVOS - Conocer las vías
Fundación H.A. Barceló Facultad de Medicina LICENCIATURA EN NUTRICION PRIMER AÑO FISIOLOGIA MODULO 16 LECCIONES 1 Y 2 1 MODULO 16: Equilibrio Electrolítico y Control de ph OBJETIVOS - Conocer las vías
[A-] Citrato 3- ph = pka + log. 7 = log [AH] Citrato 2- 7 = log = = x x
![[A-] Citrato 3- ph = pka + log. 7 = log [AH] Citrato 2- 7 = log = = x x [A-] Citrato 3- ph = pka + log. 7 = log [AH] Citrato 2- 7 = log = = x x](/thumbs/55/35730009.jpg) Una reacción enzimática transcurre en 10 ml de una disolución cuya concentración total de citrato es 120 mm y su ph inicial es de 7. Durante la reacción se producen 0.2 miliequivalentes de un ácido. Calcular
Una reacción enzimática transcurre en 10 ml de una disolución cuya concentración total de citrato es 120 mm y su ph inicial es de 7. Durante la reacción se producen 0.2 miliequivalentes de un ácido. Calcular
BIOQUIMICA CLINICA II
 Universidad Autónoma de Chiapas Facultad de Ciencias Químicas Campus IV BIOQUIMICA CLINICA II UNIDAD 5 EQUILIBRIO ACIDO-BASE TITULAR DEL CURSO : M.C. CONSUELO CHANG RUEDA CICLO ENERO - DICIEMBRE - 2015
Universidad Autónoma de Chiapas Facultad de Ciencias Químicas Campus IV BIOQUIMICA CLINICA II UNIDAD 5 EQUILIBRIO ACIDO-BASE TITULAR DEL CURSO : M.C. CONSUELO CHANG RUEDA CICLO ENERO - DICIEMBRE - 2015
MEDIO INTERNO ACIDOSIS METABÓLICA DRA. STELLA MARIS DIEGUEZ HTAL. GRAL DE AGUDOS DR. T. ÁLVAREZ
 MEDIO INTERNO ACIDOSIS METABÓLICA DRA. STELLA MARIS DIEGUEZ HTAL. GRAL DE AGUDOS DR. T. ÁLVAREZ 1-Historia clínica G D Varón de 1 año y 5 meses MOTIVO DE CONSULTA retraso del crecimiento ANTECEDENTES RNTPAEG
MEDIO INTERNO ACIDOSIS METABÓLICA DRA. STELLA MARIS DIEGUEZ HTAL. GRAL DE AGUDOS DR. T. ÁLVAREZ 1-Historia clínica G D Varón de 1 año y 5 meses MOTIVO DE CONSULTA retraso del crecimiento ANTECEDENTES RNTPAEG
K + Tema 29: Alteraciones del potasio: hiperpotasemia e hipopotasemia. (sinónimos: hiper- e hipokalemia [o kaliemia]; Lat. kalium)
![K + Tema 29: Alteraciones del potasio: hiperpotasemia e hipopotasemia. (sinónimos: hiper- e hipokalemia [o kaliemia]; Lat. kalium) K + Tema 29: Alteraciones del potasio: hiperpotasemia e hipopotasemia. (sinónimos: hiper- e hipokalemia [o kaliemia]; Lat. kalium)](/thumbs/55/36263077.jpg) Tema 29: Alteraciones del potasio: hiperpotasemia e hipopotasemia (sinónimos: hiper- e hipokalemia [o kaliemia]; Lat. kalium) Generalidades Hiperpotasemia Manifestaciones clínicas Hipopotasemia Manifestaciones
Tema 29: Alteraciones del potasio: hiperpotasemia e hipopotasemia (sinónimos: hiper- e hipokalemia [o kaliemia]; Lat. kalium) Generalidades Hiperpotasemia Manifestaciones clínicas Hipopotasemia Manifestaciones
Acidosis y Alcalosis Metabolica.
 Acidosis y Alcalosis Metabolica. Acidosis metabólica Se caracteriza por: ph arterial bajo (concentración alta de hidrogeniones) Reducción en la concentración plasmática de HCO3. Hiperventilación compensatoria.
Acidosis y Alcalosis Metabolica. Acidosis metabólica Se caracteriza por: ph arterial bajo (concentración alta de hidrogeniones) Reducción en la concentración plasmática de HCO3. Hiperventilación compensatoria.
El CO2, en presencia de anhidrasa carbónica (AC), se hidrata de la siguiente forma: CO2 + H2O <------> CO3H2 < > H+ + HCO3-
 Equilibro Acido Base El equilibrio ácido-base requiere la integración de tres sistemas orgánicos, el hígado, los pulmones y el riñón. En resumen, el hígado metaboliza las proteínas produciendo iones hidrógeno
Equilibro Acido Base El equilibrio ácido-base requiere la integración de tres sistemas orgánicos, el hígado, los pulmones y el riñón. En resumen, el hígado metaboliza las proteínas produciendo iones hidrógeno
Fisiología y envejecimiento Aparato urinario
 Tema 11 Funciones generales. Anatomía Nefrona Filtración glomerular Reabsorción tubular Secreción tubular Micción Envejecimiento 1 Funciones generales * Mantenimiento de la homeostasis hídrica y electrolítica.
Tema 11 Funciones generales. Anatomía Nefrona Filtración glomerular Reabsorción tubular Secreción tubular Micción Envejecimiento 1 Funciones generales * Mantenimiento de la homeostasis hídrica y electrolítica.
Organización Funcional y el Medio Interno
 Organización Funcional y el Medio Interno Aproximadamente el 50 % del cuerpo humano es líquido y la mayor parte es intracelular, la tercera parte es extracelular, la misma que se encuentra en movimiento
Organización Funcional y el Medio Interno Aproximadamente el 50 % del cuerpo humano es líquido y la mayor parte es intracelular, la tercera parte es extracelular, la misma que se encuentra en movimiento
Fisiología y envejecimiento Aparato urinario. Tema 11
 Tema 11 Funciones generales. Anatomía Nefrona Filtración glomerular Reabsorción tubular Secreción tubular Micción Envejecimiento Funciones generales * Mantenimiento de la homeostasis hídrica y electrolítica.
Tema 11 Funciones generales. Anatomía Nefrona Filtración glomerular Reabsorción tubular Secreción tubular Micción Envejecimiento Funciones generales * Mantenimiento de la homeostasis hídrica y electrolítica.
MECANISMOS DE TRANSPORTE RENAL: REABSORCIÓN DE NaCl Y AGUA
 MECANISMOS DE TRANSPORTE RENAL: REABSORCIÓN DE NaCl Y AGUA Miryam Romero, MSc., PhD. Profesora de Fisiología Departamento de Ciencias Fisiológicas UNIVERSIDAD DEL VALLE 1 Magnitud de los recambios renales
MECANISMOS DE TRANSPORTE RENAL: REABSORCIÓN DE NaCl Y AGUA Miryam Romero, MSc., PhD. Profesora de Fisiología Departamento de Ciencias Fisiológicas UNIVERSIDAD DEL VALLE 1 Magnitud de los recambios renales
Alteraciones de los Fluidos Corporales, Electrolitos
 Alteraciones de los Fluidos Corporales, Electrolitos Introducción Abner J. Gutiérrez Chávez, MVZ, MC. Facultad de Medicina Veterinaria y Zootecnia, UNAM. Dpto. Producción Animal: Rumiantes Existen diversas
Alteraciones de los Fluidos Corporales, Electrolitos Introducción Abner J. Gutiérrez Chávez, MVZ, MC. Facultad de Medicina Veterinaria y Zootecnia, UNAM. Dpto. Producción Animal: Rumiantes Existen diversas
En general es un parámetro que indica la función renal, aunque puede estar alterado en otras enfermedades o en casos de deshidratación.
 UREA La urea es el resultado final del metabolismo de las proteínas y se elimina por la orina. Si el riñón no funciona bien la urea se acumula en la sangre y se eleva su concentración. En general es un
UREA La urea es el resultado final del metabolismo de las proteínas y se elimina por la orina. Si el riñón no funciona bien la urea se acumula en la sangre y se eleva su concentración. En general es un
FISIOPATOLOGÍA DE LA INSUFICIENCIA RENAL AGUDA
 UNIVERSIDAD DE CHILE Facultad de Medicina Escuela de Tecnología Médica FISIOPATOLOGÍA DE LA INSUFICIENCIA RENAL AGUDA Dr. Ramón Rodrigo 2008 ESTUDIO DE LAS ENFERMEDADES RENALES 1. Antecedentes de la historia
UNIVERSIDAD DE CHILE Facultad de Medicina Escuela de Tecnología Médica FISIOPATOLOGÍA DE LA INSUFICIENCIA RENAL AGUDA Dr. Ramón Rodrigo 2008 ESTUDIO DE LAS ENFERMEDADES RENALES 1. Antecedentes de la historia
Revisión NEJM: F. JOHN GENNARI, M.D.
 Revisión NEJM: F. JOHN GENNARI, M.D. Baja de K+ sérico es la anomalía electrolítica mas frecuente en la practica clínica. Se define como
Revisión NEJM: F. JOHN GENNARI, M.D. Baja de K+ sérico es la anomalía electrolítica mas frecuente en la practica clínica. Se define como
SOLUCIONES BUFFERS. pk = valor de ph en el cual las concentraciones del ácido y la sal son iguales
 SOLUCIONES BUFFERS Constituidas por un ácido débil y su base conjugada (sal) permite la adición de ácido o base sin variar considerablemente el ph. La capacidad búffer es máximo una unidad por encima y
SOLUCIONES BUFFERS Constituidas por un ácido débil y su base conjugada (sal) permite la adición de ácido o base sin variar considerablemente el ph. La capacidad búffer es máximo una unidad por encima y
Programa 3º Curso. Curso (Prof. M García-Caballero)
 Programa 3º Curso Departamento de Cirugía Curso 2008-09 Equilibrio i hidroelectrolítico lí i y ácido-base (Prof. M García-Caballero) http://www.cirugiadelaobesidad.net/ CAMBIOS DE FLUIDOS Y ELECTROLITOS
Programa 3º Curso Departamento de Cirugía Curso 2008-09 Equilibrio i hidroelectrolítico lí i y ácido-base (Prof. M García-Caballero) http://www.cirugiadelaobesidad.net/ CAMBIOS DE FLUIDOS Y ELECTROLITOS
8. CASOS PRACTICOS DE ALTERACIONES DEL EQUILIBRIO ACIDO BASE
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 8. CASOS PRACTICOS DE ALTERACIONES DEL EQUILIBRIO ACIDO BASE A continuación se presentan una serie de casos prácticos resueltos,
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 8. CASOS PRACTICOS DE ALTERACIONES DEL EQUILIBRIO ACIDO BASE A continuación se presentan una serie de casos prácticos resueltos,
Objetivos
 CONTENIDO CAPITULO I Transporte a travbs de membranas y epitelios... 1-1 Objetivos... 1-1.. Introduccion... 1-3 Movimientos de solutos... 1-4 Flujo de disolvente... 1-7 Intercambio ionicos a través de
CONTENIDO CAPITULO I Transporte a travbs de membranas y epitelios... 1-1 Objetivos... 1-1.. Introduccion... 1-3 Movimientos de solutos... 1-4 Flujo de disolvente... 1-7 Intercambio ionicos a través de
VARIACIONES SANGUÍNEAS: - pco2 - EL ph ESTIMULO C.R.B., NO COMPENSA DISNEA - po2 - NaHCO3 5 mmol/l
 Fisiopatología Del Equilibrio Ácido-Base: Acidosis PH debe ser menor a 7.35. a) Acidosis Respiratorias b) Acidosis Metabólicas También se habla de acidosis compensadas y no compensadas. Una acidosis puede
Fisiopatología Del Equilibrio Ácido-Base: Acidosis PH debe ser menor a 7.35. a) Acidosis Respiratorias b) Acidosis Metabólicas También se habla de acidosis compensadas y no compensadas. Una acidosis puede
TALLER ALTERACIONES DEL EQUILIBRIO ACIDO - BASE
 TALLER ALTERACIONES DEL EQUILIBRIO ACIDO - BASE 1. GENERALIDADES EQUILIBRIO ÁCIDO - BASE 1.1 Valor Normal Gasometría Arterial: PaCO 2 PaO 2 HCO - 3 Sat 35-45 mm Hg > 85 mm Hg 22-26 meq/lt > 95% 1.2 Mecanismos
TALLER ALTERACIONES DEL EQUILIBRIO ACIDO - BASE 1. GENERALIDADES EQUILIBRIO ÁCIDO - BASE 1.1 Valor Normal Gasometría Arterial: PaCO 2 PaO 2 HCO - 3 Sat 35-45 mm Hg > 85 mm Hg 22-26 meq/lt > 95% 1.2 Mecanismos
 Minino de Cheshire, podrías decirme, por favor, qué camino debo seguir para salir de aquí? Esto depende en gran parte del si>o al que quieras llegar - dijo el Gato. - - No me importa mucho el si>o... -
Minino de Cheshire, podrías decirme, por favor, qué camino debo seguir para salir de aquí? Esto depende en gran parte del si>o al que quieras llegar - dijo el Gato. - - No me importa mucho el si>o... -
DESORDEN ACIDO BASICO
 DESORDEN ACIDO BASICO Cuando se habla de regulacion del equilibrio acido base, se habla en realidad de la Regulacion de la concentracion de iones hidrogenos en los liquidos corporales 1 Como la concentracion
DESORDEN ACIDO BASICO Cuando se habla de regulacion del equilibrio acido base, se habla en realidad de la Regulacion de la concentracion de iones hidrogenos en los liquidos corporales 1 Como la concentracion
Conclusiones. Siempre antes del análisis, esta la Clínica o que espero yo en mi paciente
 Gases en Sepsis Conclusiones Siempre antes del análisis, esta la Clínica o que espero yo en mi paciente El análisis de los gases no debe retrasar tomar el Lactato e iniciar EGDT No tratamos solo números
Gases en Sepsis Conclusiones Siempre antes del análisis, esta la Clínica o que espero yo en mi paciente El análisis de los gases no debe retrasar tomar el Lactato e iniciar EGDT No tratamos solo números
Regulación de (H+) Equilibrio ácido-básico
 Regulación de (H+) Equilibrio ácido-básico Introducción v CO2 es generado dentro de las células à Forma H2CO3 (ácido carbónico) al disolverse en agua Introducción ácidos no volátiles v Ácidos no volátiles:
Regulación de (H+) Equilibrio ácido-básico Introducción v CO2 es generado dentro de las células à Forma H2CO3 (ácido carbónico) al disolverse en agua Introducción ácidos no volátiles v Ácidos no volátiles:
Fisiología renal Rafael Porcile. Universidad Abierta Interamericana
 Fisiología renal Rafael Porcile rafael.porcile@vaneduc.edu.ar D E P A R T A M E N T O D E C A R D I O L O G I A C A T E D R A D E F I S I O L O G Í A Universidad Abierta Interamericana rafael.porcile@vaneduc.edu.ar
Fisiología renal Rafael Porcile rafael.porcile@vaneduc.edu.ar D E P A R T A M E N T O D E C A R D I O L O G I A C A T E D R A D E F I S I O L O G Í A Universidad Abierta Interamericana rafael.porcile@vaneduc.edu.ar
INTERPRETACION DE LOS GASES ARTERIALES
 INTERPRETACION DE LOS GASES ARTERIALES ph PaO2 PaCO2 HCO3 BE Hb SaO2 Bloque 6 Modulo 2 Dr Erick Valencia Anestesiologo Intensivista. Que son los Gases Arteriales? Una muestra de sangre anticoagulada que
INTERPRETACION DE LOS GASES ARTERIALES ph PaO2 PaCO2 HCO3 BE Hb SaO2 Bloque 6 Modulo 2 Dr Erick Valencia Anestesiologo Intensivista. Que son los Gases Arteriales? Una muestra de sangre anticoagulada que
Uso de soluciones enterales y parenterales. Objetivos. Distribución del agua corporal 14/02/15
 Uso de soluciones enterales y parenterales Dr. Chih Hao Chen Ku Farmacología clínica Hospital San Juan de Dios Objetivos del agua corporal n Requerimientos mínimos diarios de agua y electrolitos n Soluciones
Uso de soluciones enterales y parenterales Dr. Chih Hao Chen Ku Farmacología clínica Hospital San Juan de Dios Objetivos del agua corporal n Requerimientos mínimos diarios de agua y electrolitos n Soluciones
Nefrología Cuestionario 1
 Nefrología Cuestionario 1 Cuestionario Nefro 1.1 Pregunta 1 de 32 Mujer de 30 años, sometida a colecistectomía. En el posoperatorio tuvo nausea, vómitos y dolor intenso del área quirúrgica. Permanece en
Nefrología Cuestionario 1 Cuestionario Nefro 1.1 Pregunta 1 de 32 Mujer de 30 años, sometida a colecistectomía. En el posoperatorio tuvo nausea, vómitos y dolor intenso del área quirúrgica. Permanece en
TALLER DE ANALISIS DE GASES ARTERIALES
 TALLER DE ANALISIS DE GASES ARTERIALES Dr. Menfil A Orellana-Barrios Medicina Interna Cursos Precongreso Congreso de Residentes 2012 HGSJDD www.drmenfilorellana.wordpress.com Para qué se utilizan los Gases
TALLER DE ANALISIS DE GASES ARTERIALES Dr. Menfil A Orellana-Barrios Medicina Interna Cursos Precongreso Congreso de Residentes 2012 HGSJDD www.drmenfilorellana.wordpress.com Para qué se utilizan los Gases
Líquidos corporales Compartimiento Equilibrio de líquidos. Q.F. Adriana Cordero
 Líquidos corporales Compartimiento Equilibrio de líquidos Q.F. Adriana Cordero INTRODUCCIÒN El agua y los solutos disueltos en cada uno de los compartimentos corporales de fluidos constituyen los líquidos
Líquidos corporales Compartimiento Equilibrio de líquidos Q.F. Adriana Cordero INTRODUCCIÒN El agua y los solutos disueltos en cada uno de los compartimentos corporales de fluidos constituyen los líquidos
La Composición del medio que rodea a las células debe permanecer constante: (HOMEOSTASIS) y entre límites compatibles con las reacciones vitales
 pulmones Tracto Gastrointestinal FLUIDOS INTRA- Y EXTRA-CELULARES Al pasar por los pulmones el CO2 sale y entra O2 a la sangre nutrientes Nutrientes y O2 entran a cls Deshechos y CO2 salen de las cls Los
pulmones Tracto Gastrointestinal FLUIDOS INTRA- Y EXTRA-CELULARES Al pasar por los pulmones el CO2 sale y entra O2 a la sangre nutrientes Nutrientes y O2 entran a cls Deshechos y CO2 salen de las cls Los
POLIURIA. La homeostasis del sodio es más compleja, su excreción está regulada por el riñón mediante mecanismos neuro-hormonales e intrarrenales.
 POLIURIA DEFINICION: Etimológicamente poliuria significa mucha diuresis. No hay un consenso sobre su definición, sin embargo, se tiende a definir como un volumen urinario inapropiadamente alto para el
POLIURIA DEFINICION: Etimológicamente poliuria significa mucha diuresis. No hay un consenso sobre su definición, sin embargo, se tiende a definir como un volumen urinario inapropiadamente alto para el
1.-EQUILIBRIOS IÓNICOS EN DISOLUCIONES ACUOSAS.
 TEMA 5 EQUILIBRIOS IÓNICOS y SISTEMAS TAMPÓN. GUIÓN. ( 2 sesiones). 1.- EQUILIBRIOS IÓNICOS EN DISOLUCIÓN ACUOSA 2.- CONCEPTO DE SISTEMA TAMPÓN. 3.- IMPORTANCIA DE LA REGULACIÓN DEL PH FISIOLÓGICO. 4.-
TEMA 5 EQUILIBRIOS IÓNICOS y SISTEMAS TAMPÓN. GUIÓN. ( 2 sesiones). 1.- EQUILIBRIOS IÓNICOS EN DISOLUCIÓN ACUOSA 2.- CONCEPTO DE SISTEMA TAMPÓN. 3.- IMPORTANCIA DE LA REGULACIÓN DEL PH FISIOLÓGICO. 4.-
FISIOPATOLOGÍA DE LA INSUFICIENCIA RENAL CRÓNICA
 UNIVERSIDAD DE CHILE Facultad de Medicina Escuela de Tecnología Médica FISIOPATOLOGÍA DE LA INSUFICIENCIA RENAL CRÓNICA Dr. Ramón Rodrigo 2007 Insuficiencia renal crónica Trastorno que involucra un deterioro
UNIVERSIDAD DE CHILE Facultad de Medicina Escuela de Tecnología Médica FISIOPATOLOGÍA DE LA INSUFICIENCIA RENAL CRÓNICA Dr. Ramón Rodrigo 2007 Insuficiencia renal crónica Trastorno que involucra un deterioro
Fisiología y Fisiopatología Del Equilibrio Hidrosalino
 Fisiología y Fisiopatología Del Equilibrio Hidrosalino Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiología Universidad Austral de Chile FISIOLOGÍA DEL EQUILIBRIO HIDROSALINO: 1. IMPORTANCIA
Fisiología y Fisiopatología Del Equilibrio Hidrosalino Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiología Universidad Austral de Chile FISIOLOGÍA DEL EQUILIBRIO HIDROSALINO: 1. IMPORTANCIA
TALLER DE GASES ARTERIALES
 TALLER DE GASES ARTERIALES MOP 24 de Agosto 2010 Objetivos Aprender a reconocer los trastornos del equilibrio ácido-base: Acidosis metabólica y respiratoria, alcalosis metabólica y respiratoria. Familiarizarse
TALLER DE GASES ARTERIALES MOP 24 de Agosto 2010 Objetivos Aprender a reconocer los trastornos del equilibrio ácido-base: Acidosis metabólica y respiratoria, alcalosis metabólica y respiratoria. Familiarizarse
ALTERACIONES DEL EQUILIBRIO ACIDO-BASE
 ALTERACIONES DEL EQUILIBRIO ACIDO-BASE El equilibrio ácido-base puede alterarse por dos tipos de mecanismos fundamentales. a) Cambios en la función respiratoria, con aumento o disminución de la P a CO
ALTERACIONES DEL EQUILIBRIO ACIDO-BASE El equilibrio ácido-base puede alterarse por dos tipos de mecanismos fundamentales. a) Cambios en la función respiratoria, con aumento o disminución de la P a CO
Trastornos del equilibrio ácido-base
 NOTA DELS COMISSIONARIS: hi ha aclaracions i correccions importants al document Fe d errades, és important que us el mireu de cara a l examen!! Trastornos del equilibrio ácidobase INTRODUCCIÓN CONCEPTOS
NOTA DELS COMISSIONARIS: hi ha aclaracions i correccions importants al document Fe d errades, és important que us el mireu de cara a l examen!! Trastornos del equilibrio ácidobase INTRODUCCIÓN CONCEPTOS
La acidosis metabólica es un trastorno ácido-base que tiende a producir acidemia (descenso en el ph) por cambios primarios en la
 Fecha actualización: 27/09/16 Algoritmos diagnósticos: Equilibrio ácido base Use CTRL+F para buscar en este artículo Roberto Alcazar Arroyo Elena Corchete Prats Servicio de Nefrología Hospital Infanta
Fecha actualización: 27/09/16 Algoritmos diagnósticos: Equilibrio ácido base Use CTRL+F para buscar en este artículo Roberto Alcazar Arroyo Elena Corchete Prats Servicio de Nefrología Hospital Infanta
ANÁLISIS DUPLICIDAD TERAPÉUTICA SUBGRUPO C03-DIURÉTICOS
 ANÁLISIS DUPLICIDAD TERAPÉUTICA SUBGRUPO C03-DIURÉTICOS C03-. DIURÉTICOS Clasificación ATC C03A-. DIURÉTICOS DE BAJO TECHO, TIAZIDAS C03AA.Tiazidas solas C03AX.Tiazidas asociadas a otras sustancias concentrado
ANÁLISIS DUPLICIDAD TERAPÉUTICA SUBGRUPO C03-DIURÉTICOS C03-. DIURÉTICOS Clasificación ATC C03A-. DIURÉTICOS DE BAJO TECHO, TIAZIDAS C03AA.Tiazidas solas C03AX.Tiazidas asociadas a otras sustancias concentrado
Funciones renales. Excretora Homeostática Endocrina Regulación de la PA
 FISIOLOGIA RENAL I Funciones renales Excretora Homeostática Endocrina Regulación de la PA Nefrón Pelvis renal Uréter Depósitos grasos Corteza Médula Estructura del nefrón Componente vascular ó Glomerulo
FISIOLOGIA RENAL I Funciones renales Excretora Homeostática Endocrina Regulación de la PA Nefrón Pelvis renal Uréter Depósitos grasos Corteza Médula Estructura del nefrón Componente vascular ó Glomerulo
MECANISMOS RENALES PARA LA CONCENTRACIÓN Y LA DILUCIÓN DE LA ORINA
 MECANISMOS RENALES PARA LA CONCENTRACIÓN Y LA DILUCIÓN DE LA ORINA Miryam Romero, MSc., PhD. Profesora de Fisiología Departamento de Ciencias Fisiológicas UNIVERSIDAD DEL VALLE 1 En circunstancias normales,
MECANISMOS RENALES PARA LA CONCENTRACIÓN Y LA DILUCIÓN DE LA ORINA Miryam Romero, MSc., PhD. Profesora de Fisiología Departamento de Ciencias Fisiológicas UNIVERSIDAD DEL VALLE 1 En circunstancias normales,
Agua en el cuerpo: líquido intracelular y extracelular
 KILO POR KILO, EL CUERPO contiene más agua que cualquier otro componente. Después del oxígeno, el agua es el ingrediente más importante para la vida; sin ella, los procesos biológicos, y la vida, cesan
KILO POR KILO, EL CUERPO contiene más agua que cualquier otro componente. Después del oxígeno, el agua es el ingrediente más importante para la vida; sin ella, los procesos biológicos, y la vida, cesan
Fisiopatología del aparato respiratorio II _ Pruebas complementarias
 Fisiopatología del aparato respiratorio II _ Pruebas complementarias Gasometría arterial (GSA) Gasometría arterial: Punción de una arteria periférica Determina el equilibrio ácido-base: - ph - Las concentraciones
Fisiopatología del aparato respiratorio II _ Pruebas complementarias Gasometría arterial (GSA) Gasometría arterial: Punción de una arteria periférica Determina el equilibrio ácido-base: - ph - Las concentraciones
Trastornos Del Potasio. Hipopotasemia
 Trastornos Del Potasio Hipopotasemia Hipopotasemia Es uno de los trastornos hidroelectrolíticos más frecuentes en la UTI. Se considera hipopotasemia cuando la concentración plasmática de potasio cae por
Trastornos Del Potasio Hipopotasemia Hipopotasemia Es uno de los trastornos hidroelectrolíticos más frecuentes en la UTI. Se considera hipopotasemia cuando la concentración plasmática de potasio cae por
Trascripción clase de acidosis
 Trascripción clase de acidosis En las clases hemos visto como se produce el equilibrio ácido base y como el organismo trata de mantener el equilibrio ácido base. Al salirse del equilibrio acido_base se
Trascripción clase de acidosis En las clases hemos visto como se produce el equilibrio ácido base y como el organismo trata de mantener el equilibrio ácido base. Al salirse del equilibrio acido_base se
Capítulo 18 FUNCION RENAL EN EL ADULTO MAYOR
 Capítulo 18 FUNCION RENAL EN EL ADULTO MAYOR La filtración glomerular (FG) en el recién nacido es 30% menos que en el adulto y al año es igual a la del adulto normal. En el adulto normal, la FG es de 90
Capítulo 18 FUNCION RENAL EN EL ADULTO MAYOR La filtración glomerular (FG) en el recién nacido es 30% menos que en el adulto y al año es igual a la del adulto normal. En el adulto normal, la FG es de 90
Dr. M. Quintana Profesor Facultad de Medicina, UAM Especialista en Cuidados Críticos Coordinador de Urgencias HULP
 Dr. M. Quintana Profesor Facultad de Medicina, UAM Especialista en Cuidados Críticos Coordinador de Urgencias HULP concepto definición fisiopatología monitorización tipos manejo puntos clave Concepto CONCEPTO
Dr. M. Quintana Profesor Facultad de Medicina, UAM Especialista en Cuidados Críticos Coordinador de Urgencias HULP concepto definición fisiopatología monitorización tipos manejo puntos clave Concepto CONCEPTO
