Conclusiones científicas
|
|
|
- Ana María Esther Luna Crespo
- hace 6 años
- Vistas:
Transcripción
1 Anexo II Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización o suspensión de las autorizaciones de comercialización, según corresponda, teniendo en consideración las indicaciones aprobadas para cada producto 9
2 Conclusiones científicas Resumen general de la evaluación científica de medicamentos que contienen dihidroergotamina (ver el Anexo I) El 18 de enero de 2012, Francia inició un procedimiento de arbitraje, de conformidad con el Artículo 31 de la Directiva 2001/83/CE, para los siguientes medicamentos que contienen derivados ergóticos: dihidroergocriptina/cafeína, dihidroergocristina, dihidroergotamina, dihidroergotoxina y nicergolina. Consiguientemente a una revisión nacional de farmacovigilancia, realizada en 2011, las nuevas notificaciones espontáneas notificadas sobre varios de estos productos detectaron casos graves de fibrosis y ergotismo, y Francia consideró que las escasas pruebas de eficacia no compensaban esta reserva en relación con la seguridad. En consecuencia, se solicitó al CHMP que formulase un dictamen respecto a si las autorizaciones de comercialización para los medicamentos que contienen derivados ergóticos debían mantenerse, modificarse, suspenderse o retirarse en relación con las indicaciones mencionadas a continuación: Tratamiento sintomático del deterioro cognitivo y neurosensorial patológico crónico en ancianos (excepto en la enfermedad de Alzheimer y otras demencias) Tratamiento complementario de la claudicación intermitente en la enfermedad arterial oclusiva periférica sintomática (EAOP estadio II) Tratamiento complementario del síndrome de Raynaud Tratamiento complementario del deterioro de la agudeza visual y alteraciones del campo visual, presumiblemente de origen vascular Retinopatías agudas de origen vascular Profilaxis de la cefalea migrañosa Hipotensión ortostática Tratamiento sintomático de la insuficiencia venolinfática La dihidroergotamina mesilato (dihidroergotamina - DHE) es un derivado semisintético de la ergotamina. Se ha empleado desde hace mucho tiempo en el tratamiento de la migraña debido a su actividad vasoconstrictora, más mitigada que la de la ergotamina. En el tratamiento preventivo de la migraña, la dihidroergotamina se administra por vía oral y a largo plazo. En el tratamiento de las crisis de migraña agudas, se administra por vía parenteral o por pulverización nasal debido a la baja biodisponibilidad del medicamento no modificado por vía oral. La eficacia de la dihidroergotamina en el tratamiento de las crisis de migraña aguda no es objeto de este procedimiento de arbitraje y no será analizada. De manera análoga, la eficacia de la dihidroergotamina administrada mediante inyección subcutánea, intramuscular o intravenosa, o mediante pulverización nasal tampoco es objeto de este procedimiento de arbitraje y tampoco será analizada. A partir de las indicaciones aprobadas de los medicamentos que contienen dihidroergotamina, las que son objeto de este procedimiento de arbitraje y están aprobadas en al menos un Estado miembro son las siguientes (el texto específico de la indicación puede variar de un producto a otro): Profilaxis de la cefalea migrañosa Hipotensión ortostática Tratamiento sintomático de la insuficiencia venolinfática Los titulares de las autorizaciones de comercialización (TAC) presentaron todos los datos disponibles sobre la eficacia procedentes de ensayos clínicos y estudios de observación, en particular los datos obtenidos con posterioridad a la concesión de la autorización de comercialización inicial. Los TAC también presentaron sus propias revisiones y resúmenes críticos de todos los informes espontáneos sobre reacciones fibróticas (cardíacas, con o sin hipertensión arterial pulmonar, pulmonar, pleural, peritoneal, retroperitoneal, etc.) y ergotismo relativos a los medicamentos bajo su titularidad que contienen derivados ergóticos. Cuando fue posible, se presentó una revisión del resto de los datos disponibles (es decir, datos bibliográficos, datos preclínicos y otros datos clínicos, incluidos los estudios epidemiológicos) relevantes para evaluar el riesgo de fibrosis. El CHMP ha examinado la totalidad de los datos disponibles sobre la seguridad y la eficacia de la dihidroergotamina. 10
3 Eficacia clínica En lo que respecta a su eficacia para la indicación «profilaxis de la cefalea migrañosa», los datos proceden de diversos estudios aleatorizados, doble ciego, controlados con placebo; o de estudios doble ciego, no controlados con placebo o abiertos, la mayoría realizados después de la concesión de la autorización de comercialización inicial. Los estudios doble ciego, aleatorizados, controlados con placebo eran antiguos y por lo general no se habían practicado con la metodología actualizada. El número de pacientes fue limitado y la duración del tratamiento, demasiado breve, y los parámetros de eficacia clínica empleados no se ajustan a las Directrices europeas sobre investigación clínica de los medicamentos para el tratamiento de la migraña. En el único estudio reciente y exhaustivo, con un diseño adecuado (estudio doble ciego, controlado con placebo, de 5 meses de tratamiento) (estudio PROMISE) publicado con posterioridad a la concesión de la autorización de comercialización inicial, no se han obtenido pruebas de la eficacia de la dihidroergotamina para la prevención de la migraña, ya que no se encontró una diferencia estadísticamente significativa entre la dihidroergotamina y un placebo. Se trató a un total de 363 pacientes con dihidroergotamina o placebo durante un periodo de 4 meses, tras un periodo de preinclusión de 1 mes con placebo. La frecuencia de las crisis de migraña (el principal criterio de eficacia) no fue estadísticamente significativa (grupo de dihidroergotamina (-1,84 ± 1,55) frente al grupo de placebo (-1,67 ± 1,49) (p = 0,220)). En cuanto al porcentaje de pacientes que respondieron al tratamiento (61,1 % en el grupo de dihidroergotamina frente al 55,9 % en el grupo de placebo), la diferencia no fue estadísticamente significativa. Se llevó a cabo un análisis post-hoc en el subgrupo de pacientes (n = 288) con discapacidad funcional y empeoramiento de la calidad de vida (CdV) (definida mediante el instrumento Calidad de vida específica para la migraña, MSQ < 80). Al cabo de 4 meses de tratamiento, la frecuencia de las crisis disminuyó un 2,0 ± 1,6 ( 60,0 %) con dihidroergotamina, frente a 1,7 ± 1,5 ( 48,8 %) con placebo (p = 0,014 para las variaciones relativas). No se apreció mejora significativa frente a placebo en el subgrupo de pacientes sin afección de la CdV. En este estudio, no se ha demostrado la eficacia de la dihidroergotamina en la prevención de la migraña, ya que no se detectó una diferencia estadísticamente significativa entre la dihidroergotamina y placebo en términos de reducción de la frecuencia de las crisis de migraña (el principal criterio de eficacia) en la población general. Los datos bibliográficos indican una posible eficacia de la dihidroergotamina oral en la profilaxis de la migraña, pero las pruebas científica definitivas siguen sin ser concluyentes. Son escasas las pruebas aportadas por ensayos clínicos doble ciego, controlados con placebo, y los resultados que ofrecen estos estudios en relación con la eficacia de la ergotamina oral frente al placebo u otras sustancias para la prevención de la migraña no es uniforme, ya que dichos resultados fueron tanto positivos como negativos. En conclusión: los estudios presentados por el TAC no se habían practicado con una metodología actualizada. El número de pacientes que participó en los estudios fue muy escaso y la duración del tratamiento, excesivamente reducida. En el único estudio exhaustivo y reciente adecuadamente concebido (estudio PROMISE), no se apreciaron diferencias estadísticamente significativas entre la dihidroergotamina y el placebo por lo que a la reducción de la frecuencia de las crisis de migraña se refiere (el principal criterio de la eficacia) dentro de la población en general. Además, a instancias del CHMP se convocó a un grupo científico consultivo (SAG) en diciembre de 2012 y los expertos que lo integraban debatieron, basándose en su experiencia clínica, si esta sustancia juega un papel en la profilaxis de la cefalea migrañosa. De acuerdo con la experiencia clínica, el grupo consideró que no existe ninguna población especial que pueda beneficiarse del tratamiento con este principio activo en la profilaxis de la cefalea migrañosa. En consecuencia, el grupo consideró que no existe ninguna población claramente definida que responda insatisfactoriamente al tratamiento profiláctico de referencia de la migraña que presente necesidad de este principio activo como tratamiento alternativo o de última línea. Para la indicación «Hipotensión ortostática», el CHMP consideró que la calidad metodológica de los estudios presentados era inadecuada: se trataba fundamentalmente de ensayos no controlados, con 1 único estudio doble ciego, pero con un número de pacientes limitado. Algunos evaluaban la vía inyectable o dosis superiores a las recomendadas (de hasta 42 mg al día, en lugar de 10 mg al día). La población de pacientes o bien era heterogénea, o bien los pacientes padecían hipotensión inducida por el tratamiento con fármacos psicotrópicos. En estos estudios, la dihidroergotamina solo parece presentar cierta eficacia cuando se inyecta o bien en dosis superiores a la autorizada. Las dosis orales 11
4 autorizadas parecen presentar una eficacia reducida o nula debido a la escasa biodisponibilidad del fármaco. Solo un estudio, el Thulesius (1986), demostró una reducción significativa del descenso inmediato de la tensión arterial después de bipedestación con 10 mg al día de dihidroergotamina frente a placebo en pacientes con hipotensión inducida por el tratamiento con fármacos psicotrópicos y fue posible disponer de los datos inmediatamente después de la concesión de la autorización de comercialización inicial. El CHMP consideró aceptable el diseño de este estudio (es decir, controlado, aleatorizado, doble ciego), pero el tamaño del estudio se consideró pequeño (n = 58). Además, se incluyó a pacientes que presentaban una reducción de la tensión arterial sistólica superior a 10 mmhg, lo que incumple la definición aceptada de hipotensión ortostática (al menos 20 mmhg inferior al nivel inicial). La tensión arterial sistólica de los grupos de placebo y de dihidroergotamina era ya distinta inicialmente. La eficacia se evaluó comparando las mediciones de la tensión arterial absoluta después del tratamiento en lugar de comparando las diferencias entre las posiciones de decúbito supino y bipedestación) lo que no se consideró aceptable. El CHMP también indicó que la población del estudio, formada únicamente por los pacientes con hipotensión ortostática inducida por fármacos, no es lo suficientemente representativa como para concluir la eficacia de la dihidroergotamina en la población global de pacientes con hipotensión ortostática. El CHMP también consideró la opinión de varios TAC en el sentido de que no existen pruebas suficientes que respalden la indicación de la dihidroergotamina oral en la hipotensión ortostática. Además, se convocó un grupo científico consultivo (SAG) en diciembre de 2012 por solicitud del CHMP y los expertos que lo integraron debatieron, basándose en su experiencia clínica, si esta sustancia desempeña una función en el tratamiento de la hipotensión ortostática. Según la experiencia clínica, el grupo consideró que la dihidroergotamina solo se ha empleado en raras ocasiones para el tratamiento de la hipotensión ortostática sin beneficios claros para los pacientes. Además, se empleaba la formulación IV del producto y no la formulación oral, que es la que se contempla en este procedimiento de arbitraje. Por tanto, el grupo consideró que, basándose en los datos disponibles, no existe ninguna necesidad de este principio activo, ya que no hay ningún subgrupo claro de pacientes que pueda beneficiarse de ella. Para la indicación «tratamiento sintomático de la insuficiencia venolinfática», se han realizado muy pocos estudios. El estudio abierto (Wenzel-E et al, 1989), que se publicó después de la concesión de la autorización de comercialización inicial, trata sobre el uso de la dihidroergotamina en la insuficiencia venosa. Se trató a doce pacientes que padecían insuficiencia venosa periférica, en primer lugar con dihidroergotamina intravenosa y, a continuación, con dihidroergotamina oral durante una semana. Aunque se demostró una reducción significativa de la capacidad venosa, el flujo capilar de eritrocitos y el flujo máximo de la hiperemia reactiva, debido a que el grupo del estudio era muy pequeño, al diseño no controlado y otras limitaciones metodológicas, el CHMP no pudo extraer ninguna conclusión sobre la eficacia de la dihidroergotamina. Los estudios presentados son antiguos y su calidad metodológica presenta deficiencias: diseño abierto, no controlado, con un pequeño número de pacientes (n = 12 en Wenzel (1989), el estudio más reciente). En algunos casos se llevaron a cabo con la administración intravenosa no contemplada en el marco del presente procedimiento de arbitraje para la dihidroergotamina. La enfermedad de los pacientes y los parámetros de eficacia no están bien definidos. La relevancia de las variables clínicas es cuestionable. El CHMP tuvo en cuenta el hecho de que, según varios TAC, no existen pruebas suficientes que respalden la indicación de la dihidroergotamina oral en el tratamiento sintomático de la insuficiencia venolinfática y consideró que no es posible extraer ninguna conclusión científica sobre la eficacia de la dihidroergotamina a partir de los resultados de estos estudios. Seguridad clínica Está reconocida la capacidad de los derivados ergóticos para inducir fibrosis, en particular fibrosis de las válvulas cardíacas. La relación entre la fibrosis y la activación de los receptores serotoninérgicos, en particular de los receptores 5-HT 2B por los derivados ergóticos, ha sido exhaustivamente descrita en la bibliografía. El agonismo de los receptores 5-HT 2B induce una respuesta proliferativa y capacidad mitogénica de las células que expresan este receptor, lo que desencadena fibrogénesis. En general, la diferente afinidad de los distintos derivados ergóticos por los receptores serotoninérgicos y las dosis terapéuticas utilizadas pueden explicar las diferencias observadas en las tasas de notificación de las reacciones fibróticas. Por tanto, incluso aunque sea farmacológicamente muy verosímil que los derivados ergóticos que actúan como agonistas de los receptores 5-HT 2B puedan inducir valvulopatías «serotoninérgicas» similares a las inducidas por los tumores carcinoides o las lesiones fibróticas de 12
5 otros tejidos, debe recordarse que algunos derivados ergóticos no son agonistas de los receptores 5- HT 2B. Por tanto, no pueden excluirse otros mecanismos inductores de fibrosis, lo que indica que existe una relación causal entre la fibrosis y el agonismo de los receptores 5-HT 2A y 5-HT 1B y también un probable efecto sobre el transportador de la serotonina. Con respecto a los casos notificados, el CHMP observó el problema de infranotificación de este producto, teniendo en cuenta el tiempo que lleva en el mercado. Las razones para sospechar la infranotificación son: La notificación de reacciones adversas con una sustancia que lleva mucho tiempo en el mercado es por lo general menos frecuente. La fibrosis se menciona en varios Resúmenes de características del producto (RCP) europeos actuales y, con frecuencia, las reacciones previstas se comunican con menor frecuencia. Además, la fibrosis es una reacción insidiosa que se produce al cabo de un largo periodo de tratamiento y, por ello, el diagnóstico a menudo es tardío. Por otra parte, los datos sobre seguridad que presentaron algunos TAC están incompletos (faltan datos entre el periodo de la revisión y el periodo de comercialización del producto) y no puede excluirse que falte la notificación de casos con sus productos. En total, se consideró que 8 casos de reacciones adversas fibróticas provenientes de un sondeo francés realizado en 2011 y 50 de los 75 casos indicados por el TAC se han considerado potencialmente relacionados con la dihidroergotamina, entre los que se incluyen 24 sin factores de confusión. Un caso presentaba confusión por los antecedentes médicos y en 25 casos se notificaron otros fármacos sospechosos de uso simultáneo: benfluorex (4 casos), dexflenfuramina (4 casos), pergolida (1 caso), betabloqueantes β (9 casos), fenofibrato (2 casos) y derivado ergótico (8 casos). Los medicamentos notificados también como sospechosos son conocidos inductores de la fibrosis. Sin embargo, el CHMP indicó que los bloqueantes β por lo general no son reconocidos como causa de la fibrosis. En algunas publicaciones, se consideran factores etiológicos de la fibrosis retroperitoneal (P. Meier et al, La fibrose rétropéritonéale, une maladie inflammatoire méconnue. Observations cliniques et revue de la littérature. Néphrologie Vol. 24 n , pp ). En los casos notificados, la dihidroergotamina estaba principalmente indicada en general para la migraña o la cefalea (30 pacientes) y se usaba con la dosis diaria recomendada. Como era de esperar, la fibrosis se presentó principalmente en mujeres (68 %) después de un tratamiento prolongado con dihidroergotamina (9,1 años de media) y el tipo de reacción fibrótica notificada con mayor frecuencia fue la retroperitoneal (36 %), seguida de la cardíaca (30 %) y la pleural (18 %). Casi todos los casos fueron graves (el 93 % de los casos en los que se indicó la gravedad) y el tratamiento con dihidroergotamina se interrumpió en el 91 % de los casos (de los que se dispone de información) y, en el 57 % de estos casos, se notificó mejoría o recuperación. No obstante, el CHMP indicó que, en la mayoría de estos pacientes, la mejoría o la recuperación se había observado después del tratamiento con corticosteroides o de una intervención quirúrgica (sustitución de válvulas) y, en la mayoría de los casos, la mejoría se determinó a partir de los síntomas clínicos (sin escáner). En conclusión, dados los casos notificados para una reacción de difícil diagnóstico temprano (síntomas retrasados) y probablemente infranotificados, el uso del fármaco a una dosis aprobada, añadido a un perfil farmacológico plausible, hace que la dihidroergotamina se considere estrechamente asociada al riesgo de reacciones fibróticas. Además, dado que la fibrosis es una reacción grave potencialmente mortal observada después del tratamiento prolongado con dihidroergotamina (un fármaco utilizado en indicaciones que requieren un tratamiento prolongado), lo que afecta a la relación riesgo/beneficio de los productos. Además, las 8 nuevas notificaciones espontáneas registradas durante el sondeo francés realizado en 2011 demuestran que las medidas de minimización del riesgo que están aplicándose en la actualidad no bastan para evitar el riesgo de reacciones fibróticas. Por lo que se refiere al riesgo de ergotismo, el análisis de los casos aportados por los TAC no era exhaustivo y la metodología empleada para localizar recuperar los casos de ergotismo era poco clara en el caso de la mayoría de los TAC. Algunos síntomas relacionados con el ergotismo pueden confundirse con los síntomas de la migraña y, por ello, no ser notificados como reacción adversa. No obstante, los TAC han notificado un total de 134 casos de ergotismo o de síntomas potencialmente relacionados con el ergotismo. El ergotismo es una reacción grave que, en casos raros, provoca secuelas importantes como, por ejemplo, amputación o resección del colon. Esta reacción tuvo lugar en pacientes jóvenes (edad media 13
6 de los casos notificados: 41 años) y se inició poco tiempo después de comenzar el tratamiento con dihidroergotamina (menos de 2 meses, promedio: 2 días). Se subraya la gravedad de estas reacciones adversas y su posible desenlace mortal. Los síntomas del ergotismo se recogen en las secciones 4.8 y 4.9 de todos los RCP y el ergotismo se identifica en la sección 4.4 como consecuencia del uso prolongado o de dosis altas de dihidroergotamina. Para todos los productos, está contraindicado el uso concomitante de inhibidores del CYP3A y la dihidroergotamina (sección 4.5) y, para otros, también está contraindicado el uso concomitante de fármacos vasoconstrictores. Sin embargo, más de la mitad de los casos de ergotismo notificados se han descrito fuera de un contexto de sobredosis o sin el uso de un medicamento contraindicado. Además, el número de casos notificados con un fármaco contraindicado concomitante revela que la información del RCP no es suficiente para evitar la exposición del paciente al grave riesgo de ergotismo. En conclusión, el ergotismo es una reacción adversa de los derivados ergóticos bien conocido en un contexto de sobredosis o de interacción. No obstante, dado el número de casos notificados con la dihidroergotamina, con síntomas relacionados con el ergotismo (a pesar de que probablemente falten casos), incluso cuando la dihidroergotamina se emplea tal y como se recomienda (sin sobredosis ni medicamentos contraindicados y durante un tiempo breve), la alta plausibilidad farmacológica y la cronología indicativa en la mayoría de los casos, se considera que los pacientes están expuestos a un alto riesgo de ergotismo cuando se tratan con dihidroergotamina. Por otra parte, dada la gravedad del ergotismo y sus consecuencias (secuelas, necesidad de intervención quirúrgica, amputación), la juventud de los pacientes con síntomas de ergotismo y el breve tiempo hasta el inicio de la reacción, el perfil de seguridad de la dihidroergotamina es muy cuestionable. El CHMP consideró las medidas de minimización de los riesgos propuestas por los TAC y que incluían restringir las indicaciones terapéuticas, recomendar una estrecha vigilancia de los pacientes y la distribución de una DHPC. Si bien varias de las medidas propuestas podrían ayudar a la identificación precoz de los pacientes con fibrosis, podría ser demasiado tarde, ya que en ciertas ocasiones estas reacciones son irreversibles. El Comité, en consecuencia, subrayó que las medidas propuestas son insuficientes para evitar que algunos pacientes desarrollen fibrosis y ergotismo durante el tratamiento. En conjunto, el CHMP consideró que ninguna situación justificaba la exposición de un paciente al riesgo de fibrosis y ergotismo teniendo en cuenta la escasez de datos sobre eficacia. Relación riesgo/beneficio El Comité concluyó que la relación riesgo/beneficio de los productos que contienen dihidroergotamina para uso oral no es favorable, de conformidad con el Artículo 116 de la Directiva 2001/83/CE, para la profilaxis de la migraña, la hipotensión ortostática y el tratamiento sintomático de la insuficiencia venolinfática. Motivos para la suspensión/modificación de las condiciones de la autorización de comercialización Considerando que El Comité consideró el procedimiento de conformidad con el Artículo 31 de la Directiva 2001/83/CE para los medicamentos que contienen derivados ergóticos en las indicaciones afectadas. El Comité consideró todos los datos presentados por los TAC y la conclusión del grupo asesor científico. El Comité consideró que no es posible excluir una posible asociación causal entre las reacciones fibróticas o el ergotismo y la dihidroergotamina por vía oral. De hecho, los datos disponibles son indicativos de que existe dicha relación causal. Se subraya la gravedad de estas reacciones adversas y su posible desenlace mortal. El Comité considera que las pruebas de la eficacia clínicamente significativa de la dihidroergotamina oral en las indicaciones actualmente evaluadas son muy escasas y, por tanto, los riesgos 14
7 identificados anteriormente son mayores que el posible beneficio para los pacientes en estas indicaciones. El Comité consideró que la relación riesgo/beneficio de los productos orales que contienen dihidroergotamina: No es favorable para la profilaxis de la cefalea migrañosa. No es favorable para la hipotensión ortostática. No es favorable para el tratamiento sintomático de la insuficiencia venolinfática. Por tanto, de conformidad con el Artículo 116 de la Directiva 2001/83/CE, el CHMP recomienda: La modificación de las condiciones de la autorización de comercialización para los medicamentos que contienen dihidroergotamina incluidos en el Anexo I con el fin de eliminar las siguientes indicaciones de la información sobre el producto (el texto específico de la indicación puede variar de un producto a otro y de un país a otro), así como cualquier referencia relativa a estas indicaciones incluida en la información sobre el producto, cuando existan otras indicaciones terapéuticas aprobadas como parte de su autorización de comercialización: Profilaxis de la cefalea migrañosa. Hipotensión ortostática. Tratamiento sintomático de la insuficiencia venolinfática. La suspensión de la autorización de comercialización para los medicamentos que contienen dihidroergotamina incluidos en el Anexo I en el caso de que no exista ninguna otra indicación aprobada como parte de su autorización de comercialización. Para el levantamiento de la suspensión, los TAC deben identificar una población especial de pacientes en la que los beneficios del producto superen el riesgo. 15
Conclusiones científicas
 Anexo II Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización o suspensión de las autorizaciones de comercialización, según corresponda, teniendo
Anexo II Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización o suspensión de las autorizaciones de comercialización, según corresponda, teniendo
Anexo I. Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Anexo IV. Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización
 Anexo IV Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización 267 Conclusiones científicas El CHMP estudió la siguiente recomendación del
Anexo IV Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización 267 Conclusiones científicas El CHMP estudió la siguiente recomendación del
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 42 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN CABERGOLINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 42 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN CABERGOLINA 4.2 Posología y forma
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
Anexo II Tratamiento farmacológico de las cefaleas primarias y algias faciales (Grupo de Estudio de Cefaleas, S.E.N.)
 Anexo II Tratamiento farmacológico de las cefaleas primarias y algias faciales (Grupo de Estudio de Cefaleas, S.E.N.) Las dosis recomendadas son para pacientes adultos. Estas recomendaciones no deberían
Anexo II Tratamiento farmacológico de las cefaleas primarias y algias faciales (Grupo de Estudio de Cefaleas, S.E.N.) Las dosis recomendadas son para pacientes adultos. Estas recomendaciones no deberían
CONTROVERSIAS HIPERTENSION PULMONAR
 CONTROVERSIAS HIPERTENSION PULMONAR Mª Carmen Torreiro Penas Hospital Xeral-Calde Lugo Eficacia/precio de los fármacos f aprobados? Es necesario evaluar los fármacos f aprobados? TRATAMIENTO Importantes
CONTROVERSIAS HIPERTENSION PULMONAR Mª Carmen Torreiro Penas Hospital Xeral-Calde Lugo Eficacia/precio de los fármacos f aprobados? Es necesario evaluar los fármacos f aprobados? TRATAMIENTO Importantes
INN Nombre inventado Concentración Forma farmacéutica. Caustinerf Arsenical
 Estado Miembro (en EEA) Autorización de Comercialización Titular INN Nombre inventado Concentración Forma farmacéutica Vía de administración Lituania Septodont 58, rue du Pont de Creteil clorhidrato de
Estado Miembro (en EEA) Autorización de Comercialización Titular INN Nombre inventado Concentración Forma farmacéutica Vía de administración Lituania Septodont 58, rue du Pont de Creteil clorhidrato de
VARIANTES EN EL DISEÑO DE LOS ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA. Sandra Flores Moreno. AETSA 21 de Diciembre de 2006
 VARIANTES EN EL DISEÑO DE LOS ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA Sandra Flores Moreno. AETSA 21 de Diciembre de 2006 VARIANTES EN EL DISEÑO DE ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA *INTRODUCCIÓN
VARIANTES EN EL DISEÑO DE LOS ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA Sandra Flores Moreno. AETSA 21 de Diciembre de 2006 VARIANTES EN EL DISEÑO DE ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA *INTRODUCCIÓN
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox
 TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
MEDICAMENTOS GENERICOS
 MEDICAMENTOS GENERICOS ACLARACIONES AL CONCEPTO DE GENERICOS En general, Médicos y Farmacéuticos identifican inmediatamente como genérico a los medicamentos sin marca y se aplican a ellos conceptos en
MEDICAMENTOS GENERICOS ACLARACIONES AL CONCEPTO DE GENERICOS En general, Médicos y Farmacéuticos identifican inmediatamente como genérico a los medicamentos sin marca y se aplican a ellos conceptos en
MODULO 8. INVESTIGACION EN EL ICTUS
 MODULO 8. INVESTIGACION EN EL ICTUS Dr. Jose Mª Ramírez Moreno Unidad de Ictus. Hospital Universitario Infanta Cristina. Badajoz INDICE: 1. Significado y participación en estudios de investigación en el
MODULO 8. INVESTIGACION EN EL ICTUS Dr. Jose Mª Ramírez Moreno Unidad de Ictus. Hospital Universitario Infanta Cristina. Badajoz INDICE: 1. Significado y participación en estudios de investigación en el
Medida de resultado primaria
 Agonistas beta2 de acción n prolongada versus antileucotrienos como tratamiento adicional a los corticosteroides inhalados para el asma crónica Dr José Damian López Sánchez Servicio de Alergología H.U.
Agonistas beta2 de acción n prolongada versus antileucotrienos como tratamiento adicional a los corticosteroides inhalados para el asma crónica Dr José Damian López Sánchez Servicio de Alergología H.U.
ANÁLISIS DE DUPLICIDAD TERAPÉUTICA DEL SUBGRUPO TERAPÉUTICO C04 VASODILATADORES PERIFÉRICOS
 ANÁLISIS DE TERAPÉUTICA DEL SUBGRUPO TERAPÉUTICO C04 VASODILATADORES PERIFÉRICOS CLASIFICACIÓN ATC C04A - VASODILATADORES PERIFÉRICOS C04AD: Derivados purínicos C04AE: Alcaloides del ergot cinarizina piracetam
ANÁLISIS DE TERAPÉUTICA DEL SUBGRUPO TERAPÉUTICO C04 VASODILATADORES PERIFÉRICOS CLASIFICACIÓN ATC C04A - VASODILATADORES PERIFÉRICOS C04AD: Derivados purínicos C04AE: Alcaloides del ergot cinarizina piracetam
LLD Abreviado de Zoloft. Todo medicamento debe conservarse fuera del alcance de los niños.
 LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
Los Ensayos Clínicos (EC) son estudios epidemiológicos caracterizados por ser:
 (678',26(3,'(0,2/Ï*,&26(;3(5,0(17$/(6 Contenido: 1. Ensayos Clínicos Características Diseño de estudio de cohortes y ensayos clínicos Selección de la muestra de estudio Grupos de estudio. Aleatorización.
(678',26(3,'(0,2/Ï*,&26(;3(5,0(17$/(6 Contenido: 1. Ensayos Clínicos Características Diseño de estudio de cohortes y ensayos clínicos Selección de la muestra de estudio Grupos de estudio. Aleatorización.
Notificación Espontánea de Reacciones Adversas a Medicamentos (RAM) María Elena López González Maria Teresa Herdeiro Adolfo Figueiras
 Notificación Espontánea de Reacciones Adversas a Medicamentos (RAM) María Elena López González Adolfo Figueiras Reacción Adversa a Medicamento cualquier respuesta a un medicamento que sea nociva y no intencionada
Notificación Espontánea de Reacciones Adversas a Medicamentos (RAM) María Elena López González Adolfo Figueiras Reacción Adversa a Medicamento cualquier respuesta a un medicamento que sea nociva y no intencionada
Ministerio de Salud Secretaría de Política, Regulación y Relaciones Sanitarias A.N.M.A.T.
 BUENOS AIRES, 07 Sep 2007 VISTO la Resolución del ex Ministerio de Salud y Acción Social N 706/93, la Disposición N 5904/96, el Expediente N 1-0047-0000-014095-07-9 del registro de esta Administración
BUENOS AIRES, 07 Sep 2007 VISTO la Resolución del ex Ministerio de Salud y Acción Social N 706/93, la Disposición N 5904/96, el Expediente N 1-0047-0000-014095-07-9 del registro de esta Administración
1. INTRODUCCION A LAS CIENCIAS FARMACIA OBJETIVO: Que el alumno conozca la historia, conceptos y evolución de la Farmacia.
 1. INTRODUCCION A LAS CIENCIAS FARMACIA OBJETIVO: Que el alumno conozca la historia, conceptos y evolución de la Farmacia. 1.1. Antecedentes históricos 1.2. Ciencia y arte de la Farmacia 1.3. Definiciones
1. INTRODUCCION A LAS CIENCIAS FARMACIA OBJETIVO: Que el alumno conozca la historia, conceptos y evolución de la Farmacia. 1.1. Antecedentes históricos 1.2. Ciencia y arte de la Farmacia 1.3. Definiciones
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
Cámara de inhalación versus nebulizadores para el tratamiento con β agonista en el asma agudo (1)
 Cámara de inhalación versus nebulizadores para el tratamiento con β agonista en el asma agudo (1) Colaboración Cochrane Antecedentes Las exacerbaciones agudas del asma son frecuentes y responsables de
Cámara de inhalación versus nebulizadores para el tratamiento con β agonista en el asma agudo (1) Colaboración Cochrane Antecedentes Las exacerbaciones agudas del asma son frecuentes y responsables de
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
Documento. Preguntas genéricas, PICO y puntos de Buena Práctica Clínica
 Documento Preguntas genéricas, PICO y puntos de Buena Práctica Clínica Guías de Atención Integral en Seguridad y Salud en el Trabajo Asma ocupacional Definición de Pregunta PICO La pregunta PICO es una
Documento Preguntas genéricas, PICO y puntos de Buena Práctica Clínica Guías de Atención Integral en Seguridad y Salud en el Trabajo Asma ocupacional Definición de Pregunta PICO La pregunta PICO es una
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
ARTÍCULO DE REVISIÓN. supplementation in developmental neurological disorders. Antonio Calderón-Moore RESUMEN ABSTRACT. Introducción. Métodos.
 ARTÍCULO DE REVISIÓN supplementation in developmental neurological disorders Antonio Calderón-Moore RESUMEN Introducción. Métodos. Resultados. Conclusiones. Palabras clave: ABSTRACT Background. for the
ARTÍCULO DE REVISIÓN supplementation in developmental neurological disorders Antonio Calderón-Moore RESUMEN Introducción. Métodos. Resultados. Conclusiones. Palabras clave: ABSTRACT Background. for the
Restricciones de uso de los medicamentos que contienen domperidona
 1 de septiembre de 2014 EMA/465179/2014 Restricciones de uso de los medicamentos que contienen domperidona El 23 de abril de 2014, el Grupo de Coordinación de los Procedimientos de Reconocimiento Mutuo
1 de septiembre de 2014 EMA/465179/2014 Restricciones de uso de los medicamentos que contienen domperidona El 23 de abril de 2014, el Grupo de Coordinación de los Procedimientos de Reconocimiento Mutuo
Disfunción Diastólica y Geométrica Ventricular Izquierda en Pacientes con Preeclampsia Eclampsia. Apaza Coronel, Hector Williams.
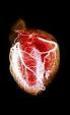 DISCUSION Durante el embarazo normal acontecen un gran número de cambios hemodinámicos, tales como un incremento en el volumen sanguíneo, volumen de stroke y frecuencia cardíaca, asimismo una disminución
DISCUSION Durante el embarazo normal acontecen un gran número de cambios hemodinámicos, tales como un incremento en el volumen sanguíneo, volumen de stroke y frecuencia cardíaca, asimismo una disminución
Equivalentes terapéuticos
 Versión 1 10 Oct 2006 Equivalentes terapéuticos Por qué surge el concepto de equivalentes terapéuticos? El sistema de autorización de medicamentos por parte de las Agencias Reguladoras provoca que en el
Versión 1 10 Oct 2006 Equivalentes terapéuticos Por qué surge el concepto de equivalentes terapéuticos? El sistema de autorización de medicamentos por parte de las Agencias Reguladoras provoca que en el
NOTA DE SEGURIDAD SOBRE PRÓTESIS MAMARIAS POLY IMPLANT (PIP)
 SUBDIRECCIÓN GENERAL DE PRODUCTOS SANITARIOS NOTA DE SEGURIDAD SOBRE PRÓTESIS MAMARIAS POLY IMPLANT (PIP) Ref.: 005/Marzo 2010 31 de marzo de 2010 Posible aumento de casos de rotura e inflamaciones locales
SUBDIRECCIÓN GENERAL DE PRODUCTOS SANITARIOS NOTA DE SEGURIDAD SOBRE PRÓTESIS MAMARIAS POLY IMPLANT (PIP) Ref.: 005/Marzo 2010 31 de marzo de 2010 Posible aumento de casos de rotura e inflamaciones locales
A/42/10 ANEXO IV TASAS DEL PCT Y MECANISMOS RELATIVOS AL TIPO DE CAMBIO
 ANEXO IV TASAS DEL PCT Y MECANISMOS RELATIVOS AL TIPO DE CAMBIO Reseña 1. Las previsiones y los ingresos del PCT en la Oficina Internacional se expresan en francos suizos. Sin embargo, los solicitantes
ANEXO IV TASAS DEL PCT Y MECANISMOS RELATIVOS AL TIPO DE CAMBIO Reseña 1. Las previsiones y los ingresos del PCT en la Oficina Internacional se expresan en francos suizos. Sin embargo, los solicitantes
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
Aprobado por : Elaborado y revisado por : Comité de Seguridad y Salud OFICINA DE PREVENCIÓN DE RIESGOS LABORALES. Fecha: 14 de diciembre de 2011
 Edición 1 Fecha: 12 de noviembre de 2012 Página 1 de 10 (PPRL) Elaborado y revisado por : OFICINA DE PREVENCIÓN DE Fecha: 14 de diciembre de 2011 Aprobado por : Comité de Seguridad y Salud Fecha: 12 de
Edición 1 Fecha: 12 de noviembre de 2012 Página 1 de 10 (PPRL) Elaborado y revisado por : OFICINA DE PREVENCIÓN DE Fecha: 14 de diciembre de 2011 Aprobado por : Comité de Seguridad y Salud Fecha: 12 de
9. Profilaxis de la ITU
 9. Profilaxis de la ITU 9.1. Profilaxis antibiótica en población pediátrica sin alteraciones estructurales y/o funcionales del tracto urinario comprobadas En lactantes y población pediátrica sin alteraciones
9. Profilaxis de la ITU 9.1. Profilaxis antibiótica en población pediátrica sin alteraciones estructurales y/o funcionales del tracto urinario comprobadas En lactantes y población pediátrica sin alteraciones
RUTA CRÍTICA PARA DIAGNÓSTICO Y MANEJO DE RICKETTSIOSIS
 RUTA CRÍTICA PARA DIAGNÓSTICO Y MANEJO DE RICKETTSIOSIS INTRODUCCIÓN En Mexicali, Baja California se encontró la presencia desde 2009 de la Fiebre Manchada de las Montañas Rocosas (FMMR), cuyo agente etiológico
RUTA CRÍTICA PARA DIAGNÓSTICO Y MANEJO DE RICKETTSIOSIS INTRODUCCIÓN En Mexicali, Baja California se encontró la presencia desde 2009 de la Fiebre Manchada de las Montañas Rocosas (FMMR), cuyo agente etiológico
Clase Funcional II OMS en Hipertensión Arterial Pulmonar
 Clase Funcional II OMS en Hipertensión Arterial Pulmonar DEL DIAGNÓSTICO PRECOZ AL TRATAMIENTO EFICAZ COORDINADOR Miguel Ángel Gómez Sánchez Clase Funcional II OMS en Hipertensión Arterial Pulmonar DEL
Clase Funcional II OMS en Hipertensión Arterial Pulmonar DEL DIAGNÓSTICO PRECOZ AL TRATAMIENTO EFICAZ COORDINADOR Miguel Ángel Gómez Sánchez Clase Funcional II OMS en Hipertensión Arterial Pulmonar DEL
ANTICONCEPCIÓN EN MUJERES CON PATOLOGÍA VASCULAR CEREBRAL
 ANTICONCEPCIÓN EN MUJERES CON PATOLOGÍA VASCULAR CEREBRAL Dr. Eduardo López-Arregui Clínica Euskalduna. Bilbao. cambiando actitudes 9º Congreso S.E.C. Sevilla. PATOLOGÍA VASCULAR CEREBRAL * HIPOXIA......ISQUEMIA......INFARTO
ANTICONCEPCIÓN EN MUJERES CON PATOLOGÍA VASCULAR CEREBRAL Dr. Eduardo López-Arregui Clínica Euskalduna. Bilbao. cambiando actitudes 9º Congreso S.E.C. Sevilla. PATOLOGÍA VASCULAR CEREBRAL * HIPOXIA......ISQUEMIA......INFARTO
Alivio de los sofocos que aparecen durante la menopausia como consecuencia de la deprivación estrogénica.
 1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
INSTRUCTIVO PARA LA PRESENTACIÓN DE TRABAJOS ORIGINALES
 INSTRUCTIVO PARA LA PRESENTACIÓN DE TRABAJOS ORIGINALES Los trabajos no deben haber sido publicados y describirán investigaciones originales. No se aceptarán como trabajos casos únicos. Importante: Recuerde
INSTRUCTIVO PARA LA PRESENTACIÓN DE TRABAJOS ORIGINALES Los trabajos no deben haber sido publicados y describirán investigaciones originales. No se aceptarán como trabajos casos únicos. Importante: Recuerde
ACUERDO DE ACREDITACIÓN N 199
 ACUERDO DE ACREDITACIÓN N 199 Carrera de Ingeniería Civil Industrial con diplomas académicos en Ingeniería Ambiental, Ingeniería en Bioprocesos, Ingeniería de Computación, Ingeniería Eléctrica, Ingeniería
ACUERDO DE ACREDITACIÓN N 199 Carrera de Ingeniería Civil Industrial con diplomas académicos en Ingeniería Ambiental, Ingeniería en Bioprocesos, Ingeniería de Computación, Ingeniería Eléctrica, Ingeniería
Las definiciones básicas (ACC/AHA)
 Las definiciones básicas (ACC/AHA) Qué es la? Cuáles son sus modalidades y criterios de diagnóstico? Qué significa IC con fracción de eyección reducida o preservada? El American College of Cardiology y
Las definiciones básicas (ACC/AHA) Qué es la? Cuáles son sus modalidades y criterios de diagnóstico? Qué significa IC con fracción de eyección reducida o preservada? El American College of Cardiology y
Actualización de temas GINA Dra. Patricia Arizmendi Agosto 2014
 Actualización de temas GINA 2014 Dra. Patricia Arizmendi Agosto 2014 Definición Enfermedad caracterizada por la inflamación crónica de la vía aérea. Definida por la presencia de síntomas de la esfera respiratoria
Actualización de temas GINA 2014 Dra. Patricia Arizmendi Agosto 2014 Definición Enfermedad caracterizada por la inflamación crónica de la vía aérea. Definida por la presencia de síntomas de la esfera respiratoria
TECNOLOGÍA EN SALUD DE INTERÉS. Oxcarbazepina, lacosamida, vigabatrina, topiramato o levetiracetam. 1. RESUMEN
 TECNOLOGÍA EN SALUD DE INTERÉS Oxcarbazepina, lacosamida, vigabatrina, topiramato y levetiracetam 1. RESUMEN Título del reporte: Efectividad y seguridad de oxcarbazepina, lacosamida, vigabatrina, topiramato
TECNOLOGÍA EN SALUD DE INTERÉS Oxcarbazepina, lacosamida, vigabatrina, topiramato y levetiracetam 1. RESUMEN Título del reporte: Efectividad y seguridad de oxcarbazepina, lacosamida, vigabatrina, topiramato
ANEXO I FICHA DEL RESUMEN EJECUTIVO
 MINISTERIO DE AGRICULTURA, ALIMENTACIÓN Y MEDIO AMBIENTE SECRETARIA GENERAL DE AGRICULTURA Y ALIMENTACIÓN DIRECCIÓN GENERAL DE PRODUCCIONES Y MERCADOS AGRARIOS ANEXO I FICHA DEL RESUMEN EJECUTIVO Ministerio/Órgano
MINISTERIO DE AGRICULTURA, ALIMENTACIÓN Y MEDIO AMBIENTE SECRETARIA GENERAL DE AGRICULTURA Y ALIMENTACIÓN DIRECCIÓN GENERAL DE PRODUCCIONES Y MERCADOS AGRARIOS ANEXO I FICHA DEL RESUMEN EJECUTIVO Ministerio/Órgano
Plan de Estudios: 509 Licenciado/a en Medicina. Asignatura: Farmacología clínica. Itinerario de la asignatura: Quinto curso
 Licenciatura en Medicina - Facultad de Medicina Plan de Estudios: 509 Licenciado/a en Medicina Asignatura: 29098 Farmacología clínica Itinerario de la asignatura: Quinto curso Curso académico: 2010 2011
Licenciatura en Medicina - Facultad de Medicina Plan de Estudios: 509 Licenciado/a en Medicina Asignatura: 29098 Farmacología clínica Itinerario de la asignatura: Quinto curso Curso académico: 2010 2011
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
Anexo II. Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización
 Anexo II Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización 5 Conclusiones científicas Resumen general de la evaluación científica de medicamentos
Anexo II Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización 5 Conclusiones científicas Resumen general de la evaluación científica de medicamentos
ARIPIPRAZOL En adolescentes contrastorno Bipolar I
 ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
RESUMEN GENERAL DE LA EVALUACIÓN CIENTÍFICA DE LOS MEDICAMENTOS A BASE DE ÁCIDO VALPROICO/VALPROATO (véase el anexo I)
 ANEXO II CONCLUSIONES CIENTÍFICAS Y MOTIVOS PARA LA MODIFICACIÓN DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO PRESENTADOS POR LA AGENCIA EUROPEA DE MEDICAMENTOS 108 CONCLUSIONES CIENTÍFICAS
ANEXO II CONCLUSIONES CIENTÍFICAS Y MOTIVOS PARA LA MODIFICACIÓN DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO PRESENTADOS POR LA AGENCIA EUROPEA DE MEDICAMENTOS 108 CONCLUSIONES CIENTÍFICAS
"Recomendaciones de tratamiento antiviral en infecciones respiratorias bajas 2010"
 "Recomendaciones de tratamiento antiviral en infecciones respiratorias bajas 2010" 14 de junio de 2010 Comités Nacionales de Infectología y Pediatría Ambulatoria Sociedad Argentina de Pediatría Enfermedad
"Recomendaciones de tratamiento antiviral en infecciones respiratorias bajas 2010" 14 de junio de 2010 Comités Nacionales de Infectología y Pediatría Ambulatoria Sociedad Argentina de Pediatría Enfermedad
Complicaciones de la insuficiencia venosa. Dr Luis M. Villalonga Martínez (Medicina General y Flebología)
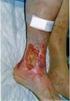 Complicaciones de la insuficiencia venosa Dr Luis M. Villalonga Martínez (Medicina General y Flebología) Venas profundas Están dentro de la masa muscular y van paralelas a la arteria principal y próximas
Complicaciones de la insuficiencia venosa Dr Luis M. Villalonga Martínez (Medicina General y Flebología) Venas profundas Están dentro de la masa muscular y van paralelas a la arteria principal y próximas
Criterio: Relación entre Clasificaciones de Riesgo de Corto y Largo Plazo
 Corto y Largo Plazo El siguiente criterio de clasificación expone la lógica de por qué ICR utiliza escalas diferentes para clasificar obligaciones de corto y largo plazo, además de indicar las similitudes
Corto y Largo Plazo El siguiente criterio de clasificación expone la lógica de por qué ICR utiliza escalas diferentes para clasificar obligaciones de corto y largo plazo, además de indicar las similitudes
OBJETIVO ESPECIFICO. Identificar peligros asociados a cada fase o etapa del trabajo y la posterior evaluación de los riesgos.
 ANALISIS DE RIESGO OBJETIVO ESPECIFICO Identificar peligros asociados a cada fase o etapa del trabajo y la posterior evaluación de los riesgos. ADMINISTRACIÓN DEL RIESGO = PREVENCIÓN CONTROL DE ACCIDENTES/
ANALISIS DE RIESGO OBJETIVO ESPECIFICO Identificar peligros asociados a cada fase o etapa del trabajo y la posterior evaluación de los riesgos. ADMINISTRACIÓN DEL RIESGO = PREVENCIÓN CONTROL DE ACCIDENTES/
No. el alcohol no altera el mecanismo de acción o los efectos del Andanza.
 GUÍA SOBRE 1 1. Qué es Es un fármaco aprobado para su uso como adyuvante, del plan alimentario hipocalórico y la práctica de ejercicio, en el manejo del sobrepeso y la obesidad en adolescentes y adultos.
GUÍA SOBRE 1 1. Qué es Es un fármaco aprobado para su uso como adyuvante, del plan alimentario hipocalórico y la práctica de ejercicio, en el manejo del sobrepeso y la obesidad en adolescentes y adultos.
RIESGO PSICOSOCIAL: ASESINO ENIGMATICO. NOELVIS PAYARES VERGARA Psicóloga Esp. Salud Ocupacional
 RIESGO PSICOSOCIAL: ASESINO ENIGMATICO NOELVIS PAYARES VERGARA Psicóloga Esp. Salud Ocupacional 1 MARCO LEGAL - Ley 9/79, Decreto 614/84 y Resolución 1016/89: Organización y Administración de la SO; subprograma
RIESGO PSICOSOCIAL: ASESINO ENIGMATICO NOELVIS PAYARES VERGARA Psicóloga Esp. Salud Ocupacional 1 MARCO LEGAL - Ley 9/79, Decreto 614/84 y Resolución 1016/89: Organización y Administración de la SO; subprograma
ANEXO Plantillas de trabajo para la formulación de recomendaciones
 ANEXO 12.3. Plantillas de trabajo para la formulación de recomendaciones 1. PREGUNTA CLÍNICA ESTRUCTURADA (FORMATO PICO) En los pacientes adultos Se recomienda el uso de fármacos libres de conservantes
ANEXO 12.3. Plantillas de trabajo para la formulación de recomendaciones 1. PREGUNTA CLÍNICA ESTRUCTURADA (FORMATO PICO) En los pacientes adultos Se recomienda el uso de fármacos libres de conservantes
Informe final de evaluación del seguimiento de la implantación de títulos oficiales GRADO EN EDUCACIÓN PRIMARIA. Facultad de Ciencias Sociales UEM
 Informe final de evaluación del seguimiento de la implantación de títulos oficiales 2014 GRADO EN EDUCACIÓN PRIMARIA Facultad de Ciencias Sociales UEM INFORMACIÓN PUBLICA Valoración Final La adaptación
Informe final de evaluación del seguimiento de la implantación de títulos oficiales 2014 GRADO EN EDUCACIÓN PRIMARIA Facultad de Ciencias Sociales UEM INFORMACIÓN PUBLICA Valoración Final La adaptación
PROGRAMA. Módulo 1: Problemática relacionada con el uso de fármacos en el adulto mayor.
 PROGRAMA PROBLEMÁTICAS FRECUENTES DE FARMACOLOGÍA Y FARMACOTERAPÉUTICA EN LA POBLACIÓN GERONTE: POLIFARMACIA, CONSTIPACION, INSOMNIO, DOLOR, LECTURA CRITICA DE LA BIBLIOGRAFIA Director: Prof. Dr. Rodolfo
PROGRAMA PROBLEMÁTICAS FRECUENTES DE FARMACOLOGÍA Y FARMACOTERAPÉUTICA EN LA POBLACIÓN GERONTE: POLIFARMACIA, CONSTIPACION, INSOMNIO, DOLOR, LECTURA CRITICA DE LA BIBLIOGRAFIA Director: Prof. Dr. Rodolfo
Informe mensual. Medicamentos. Noviembre. sobre. de Uso Humano y Productos Sanitarios. Medicamentos. Información dirigida a profesionales sanitarios
 Informe mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Información dirigida a profesionales sanitarios ÍNDICE Medicamentos 1. Nuevos medicamentos 2. Cambios de especial interés
Informe mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Información dirigida a profesionales sanitarios ÍNDICE Medicamentos 1. Nuevos medicamentos 2. Cambios de especial interés
!"#$%"&"'!% La incidencia, evolución y pronóstico de la infección fúngica invasiva ha variado
 !"#$%"&"'!% ()%&"$ % *+,-,."/"&!"$"+,-0 1 La incidencia, evolución y pronóstico de la infección fúngica invasiva ha variado notablemente en las últimas décadas y actualmente podemos decir que estamos ante
!"#$%"&"'!% ()%&"$ % *+,-,."/"&!"$"+,-0 1 La incidencia, evolución y pronóstico de la infección fúngica invasiva ha variado notablemente en las últimas décadas y actualmente podemos decir que estamos ante
PROCEDIMIENTO GENERAL DE CALIDAD
 REVISION 5 Pág. 1 de 7 INDICE 1. OBJETO. 2. ALCANCE. 3. REFERENCIAS. 4. RESPONSABILIDADES. 5. DESCRIPCION. 6. ARCHIVO DE DOCUMENTACIÓN. Copia: CONTROLADA NO CONTROLADA Código de la Empresa ASIGNADA A:
REVISION 5 Pág. 1 de 7 INDICE 1. OBJETO. 2. ALCANCE. 3. REFERENCIAS. 4. RESPONSABILIDADES. 5. DESCRIPCION. 6. ARCHIVO DE DOCUMENTACIÓN. Copia: CONTROLADA NO CONTROLADA Código de la Empresa ASIGNADA A:
El Sistema Nervioso Autónomo en el Nativo de Altura
 El Sistema Nervioso Autónomo en el Nativo de Altura María Rivera-Ch 1, Marc J. Drinkhill 2, Roger Hainsworth 2 1 UPCH, 2 Universidad de Leeds Esquema de la presentación I. Poblaciones que viven en la altura
El Sistema Nervioso Autónomo en el Nativo de Altura María Rivera-Ch 1, Marc J. Drinkhill 2, Roger Hainsworth 2 1 UPCH, 2 Universidad de Leeds Esquema de la presentación I. Poblaciones que viven en la altura
Anexo II. Modificaciones a las secciones pertinentes de la ficha técnica y el prospecto
 Anexo II Modificaciones a las secciones pertinentes de la ficha técnica y el prospecto 6 Para los medicamentos que contienen los inhibidores de la enzima convertidora de angiotensina (IECA) benazepril,
Anexo II Modificaciones a las secciones pertinentes de la ficha técnica y el prospecto 6 Para los medicamentos que contienen los inhibidores de la enzima convertidora de angiotensina (IECA) benazepril,
Anexo II. Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA
 Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
Documento. Preguntas genéricas, PICO y puntos de Buena Práctica Clínica
 Documento Preguntas genéricas, PICO y puntos de Buena Práctica Clínica Guías de Atención Integral en Seguridad y Salud en el Trabajo Hombro Doloroso Relacionado con el trabajo Definición de Pregunta PICO
Documento Preguntas genéricas, PICO y puntos de Buena Práctica Clínica Guías de Atención Integral en Seguridad y Salud en el Trabajo Hombro Doloroso Relacionado con el trabajo Definición de Pregunta PICO
PROTOCOLO DE EVALUACIÓN PARA LA VERIFICACIÓN Y MODIFICACIÓN DE TÍTULOS OFICIALES DEL SISTEMA UNIVERSITARIO DE CASTILLA Y LEÓN (Ed.
 PROTOCOLO DE EVALUACIÓN PARA LA VERIFICACIÓN Y MODIFICACIÓN DE TÍTULOS OFICIALES DEL SISTEMA UNIVERSITARIO DE CASTILLA Y LEÓN (Ed. 2) ÍNDICE I. Contextualización y objetivos II. Órganos que intervienen
PROTOCOLO DE EVALUACIÓN PARA LA VERIFICACIÓN Y MODIFICACIÓN DE TÍTULOS OFICIALES DEL SISTEMA UNIVERSITARIO DE CASTILLA Y LEÓN (Ed. 2) ÍNDICE I. Contextualización y objetivos II. Órganos que intervienen
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
La valoración de la Enfermedad Mental se realizará de acuerdo con los grandes grupos de Trastornos Mentales incluidos en los sistemas de
 ENFERMEDAD MENTAL La valoración de la Enfermedad Mental se realizará de acuerdo con los grandes grupos de Trastornos Mentales incluidos en los sistemas de clasificación universalmente aceptados CIE 10,
ENFERMEDAD MENTAL La valoración de la Enfermedad Mental se realizará de acuerdo con los grandes grupos de Trastornos Mentales incluidos en los sistemas de clasificación universalmente aceptados CIE 10,
ESTATINAS EN PERSONAS MAYORES
 ESTATINAS EN PERSONAS MAYORES Farmacia Atención Primaria Sevilla Servicios de Farmacia de las Áreas y Distritos Sanitarios Aljarafe Norte, Sevilla, Sur y Osuna Consideraciones previas Principalmente prescritas
ESTATINAS EN PERSONAS MAYORES Farmacia Atención Primaria Sevilla Servicios de Farmacia de las Áreas y Distritos Sanitarios Aljarafe Norte, Sevilla, Sur y Osuna Consideraciones previas Principalmente prescritas
Informe de Actividades INVEMAR Informe del. Revisor Fiscal
 Informe de Actividades INVEMAR 2004 225 Informe del Revisor Fiscal 226 Informe de Actividades INVEMAR 2004 Informe de Actividades INVEMAR 2004 227 DICTAMEN DEL REVISOR FISCAL A los señores asambleístas
Informe de Actividades INVEMAR 2004 225 Informe del Revisor Fiscal 226 Informe de Actividades INVEMAR 2004 Informe de Actividades INVEMAR 2004 227 DICTAMEN DEL REVISOR FISCAL A los señores asambleístas
MANEJO DE LA ENFERMEDAD MENINGOCÓCICA INVASIVA (EMI) PARA FARMACÉUTICOS COMUNITARIOS
 MANEJO DE LA ENFERMEDAD MENINGOCÓCICA INVASIVA (EMI) PARA FARMACÉUTICOS COMUNITARIOS COORDINADOR DEL CURSO Dr. Juan Ruiz-Canela. Médico especialista en Pediatría. Centro de Salud Virgen de África. Sevilla.
MANEJO DE LA ENFERMEDAD MENINGOCÓCICA INVASIVA (EMI) PARA FARMACÉUTICOS COMUNITARIOS COORDINADOR DEL CURSO Dr. Juan Ruiz-Canela. Médico especialista en Pediatría. Centro de Salud Virgen de África. Sevilla.
Diplomado. Dispensación y Manejo de Medicamentos en Farmacia.
 Diplomado. Dispensación y Manejo de Medicamentos en Farmacia. Objetivo Captar al personal que labora en farmacias y droguerías comunitarias privadas y públicas, así como personas que se relacionen con
Diplomado. Dispensación y Manejo de Medicamentos en Farmacia. Objetivo Captar al personal que labora en farmacias y droguerías comunitarias privadas y públicas, así como personas que se relacionen con
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
ANEXO: PROTECCIÓN FRENTE A RADIACIONES IONIZANTES
 PROTECCIÓN FRENTE A RADIACIONES IONIZANTES Las medidas de protección radiológica contra las radiaciones ionizantes están recogidas en su mayor parte en el RD 783/2001 y se basan en el principio de que
PROTECCIÓN FRENTE A RADIACIONES IONIZANTES Las medidas de protección radiológica contra las radiaciones ionizantes están recogidas en su mayor parte en el RD 783/2001 y se basan en el principio de que
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
Encuesta de Morbilidad Hospitalaria
 Encuesta de Morbilidad Hospitalaria Índice Introducción Objetivos Metodología Conceptos y definiciones Tablas estadísticas de Morbilidad Hospitalaria 1.- Residentes en Aragón 1.1.- Resultados generales
Encuesta de Morbilidad Hospitalaria Índice Introducción Objetivos Metodología Conceptos y definiciones Tablas estadísticas de Morbilidad Hospitalaria 1.- Residentes en Aragón 1.1.- Resultados generales
CONCEPTOS BÁSICO DE SEGURIDAD E HIGIENE EN EL 2. FACTORES DE RIESGO Y TÉCNICAS DE PREVENCIÓN 3. ACTUACIÓN DE LA SEGURIDAD DEL TRABAJO
 ASIGNATURA: SEGURIDAD LABORAL CONCEPTOS BÁSICO DE SEGURIDAD E HIGIENE EN EL TRABAJO. TERMINOLOGÍA 1. CONCEPTOS BÁSICOS 2. FACTORES DE RIESGO Y TÉCNICAS DE PREVENCIÓN 3. ACTUACIÓN DE LA SEGURIDAD DEL TRABAJO
ASIGNATURA: SEGURIDAD LABORAL CONCEPTOS BÁSICO DE SEGURIDAD E HIGIENE EN EL TRABAJO. TERMINOLOGÍA 1. CONCEPTOS BÁSICOS 2. FACTORES DE RIESGO Y TÉCNICAS DE PREVENCIÓN 3. ACTUACIÓN DE LA SEGURIDAD DEL TRABAJO
Atención Farmacéutica
 Atención Farmacéutica Los farmacéuticos, como parte del Sistema Nacional de Salud, comparten con los pacientes, los médicos, otros profesionales de la salud, y las Autoridades Sanitarias, la misión de
Atención Farmacéutica Los farmacéuticos, como parte del Sistema Nacional de Salud, comparten con los pacientes, los médicos, otros profesionales de la salud, y las Autoridades Sanitarias, la misión de
PROCEDIMIENTO GENERAL. Gestión de Incidencias y Acciones Correctivas RAZÓN SOCIAL DE LA EMPRESA. Código PG-12 Edición 0. Índice:
 Índice: 1. TABLA RESUMEN... 2 2. OBJETO... 2 3. ALCANCE... 2 4. RESPONSABILIDADES... 3 5. ENTRADAS... 4 6. SALIDAS... 4 7. PROCESOS RELACIONADOS... 4 8. DIAGRAMA DE FLUJO... 5 9. DESARROLLO... 6 9.1. DETECCIÓN
Índice: 1. TABLA RESUMEN... 2 2. OBJETO... 2 3. ALCANCE... 2 4. RESPONSABILIDADES... 3 5. ENTRADAS... 4 6. SALIDAS... 4 7. PROCESOS RELACIONADOS... 4 8. DIAGRAMA DE FLUJO... 5 9. DESARROLLO... 6 9.1. DETECCIÓN
ACUERDO DE ACREDITACIÓN N 152. Carrera de Pedagogía en Educación Física, Deportes y Recreación de la Universidad de La Frontera
 ACUERDO DE ACREDITACIÓN N 152 Carrera de Pedagogía en Educación Física, Deportes y Recreación de la Universidad de La Frontera En la nonagésima quinta sesión de la Comisión Nacional de Acreditación de
ACUERDO DE ACREDITACIÓN N 152 Carrera de Pedagogía en Educación Física, Deportes y Recreación de la Universidad de La Frontera En la nonagésima quinta sesión de la Comisión Nacional de Acreditación de
ISO SERIE MANUALES DE CALIDAD GUIAS DE IMPLEMENTACION. ISO 9001:2008 Como implementar los cambios parte 1 de 6
 ISO 9001 2008 GUIAS DE IMPLEMENTACION ISO 9001:2008 Como implementar los cambios parte 1 de 6 SERIE MANUALES DE CALIDAD 1 NORMA INTERNACIONAL ISO 9000 Dentro de las modificaciones de la nueva versión de
ISO 9001 2008 GUIAS DE IMPLEMENTACION ISO 9001:2008 Como implementar los cambios parte 1 de 6 SERIE MANUALES DE CALIDAD 1 NORMA INTERNACIONAL ISO 9000 Dentro de las modificaciones de la nueva versión de
Resultados relevantes obtenidos con Escozul para Cáncer Maxilar
 Documento elaborado por: Grupo Resultados relevantes obtenidos con Escozul para Cáncer Maxilar Paciente: Maria del Carmen Diagnóstico: CA Maxilar con metástasis Está Está prohibida la la reproducción de
Documento elaborado por: Grupo Resultados relevantes obtenidos con Escozul para Cáncer Maxilar Paciente: Maria del Carmen Diagnóstico: CA Maxilar con metástasis Está Está prohibida la la reproducción de
VÍAS DE ADMINISTRACIÓN Y ABSORCIÓN DE MEDICAMENTOS INTERACCIÓN DROGA RECEPTOR. M.V. Merilio Montero Urdaneta
 VÍAS DE ADMINISTRACIÓN Y ABSORCIÓN DE MEDICAMENTOS INTERACCIÓN DROGA RECEPTOR M.V. Merilio Montero Urdaneta Maracaibo, Marzo del 2011 VIAS DE ADMISTRACIÓN DE MEDICAMENTOS CONCEPTO CLASIFICACIÓN - VIAS
VÍAS DE ADMINISTRACIÓN Y ABSORCIÓN DE MEDICAMENTOS INTERACCIÓN DROGA RECEPTOR M.V. Merilio Montero Urdaneta Maracaibo, Marzo del 2011 VIAS DE ADMISTRACIÓN DE MEDICAMENTOS CONCEPTO CLASIFICACIÓN - VIAS
Anexo IV. Conclusiones científicas
 Anexo IV Conclusiones científicas 54 Conclusiones científicas 1. - Recomendación del PRAC Información general Ivabradina es un medicamento que reduce la frecuencia cardíaca, con acción específica sobre
Anexo IV Conclusiones científicas 54 Conclusiones científicas 1. - Recomendación del PRAC Información general Ivabradina es un medicamento que reduce la frecuencia cardíaca, con acción específica sobre
ESCUELA DE RESIDENTADO MÉDICO Y ESPECIALIZACIÓN
 Universidad Ricardo Palma Facultad de Medicina Humana ESCUELA DE RESIDENTADO MÉDICO Y ESPECIALIZACIÓN Esquema de presentación para la elaboración del proyecto de trabajo de los Residentes del Segundo Año.
Universidad Ricardo Palma Facultad de Medicina Humana ESCUELA DE RESIDENTADO MÉDICO Y ESPECIALIZACIÓN Esquema de presentación para la elaboración del proyecto de trabajo de los Residentes del Segundo Año.
Adjunto se remite a las Delegaciones el documento de la Comisión D027686/02.
 CONSEJO DE LA UNIÓN EUROPEA Bruselas, 23 de julio de 2013 (OR. en) 12706/13 DENLEG 91 SAN 291 NOTA DE TRANSMISIÓN Emisor: Comisión Europea Fecha de recepción: 22 de julio de 2013 Destinatario: Secretaría
CONSEJO DE LA UNIÓN EUROPEA Bruselas, 23 de julio de 2013 (OR. en) 12706/13 DENLEG 91 SAN 291 NOTA DE TRANSMISIÓN Emisor: Comisión Europea Fecha de recepción: 22 de julio de 2013 Destinatario: Secretaría
TRATAMIENTO FARMACOLÓGICO DE LA FPI. Julio Ancochea
 TRATAMIENTO FARMACOLÓGICO DE LA FPI Julio Ancochea GUÍAS 2000 Era de la inmunosupresión y opiniones de expertos 2011 Era de los ensayos clínicos aleatorizados y de la metodología perfeccionada: ningún
TRATAMIENTO FARMACOLÓGICO DE LA FPI Julio Ancochea GUÍAS 2000 Era de la inmunosupresión y opiniones de expertos 2011 Era de los ensayos clínicos aleatorizados y de la metodología perfeccionada: ningún
Ainhoa Quintana Servicio de Farmacia. Hospital Universitario de Álava Txagorritxu. Vitoria Gasteiz
 Ainhoa Quintana Servicio de Farmacia. Hospital Universitario de Álava Txagorritxu. Vitoria Gasteiz Necesidad de establecer equivalentes terapéuticos Los sistemas sanitarios deben buscar la máxima calidad
Ainhoa Quintana Servicio de Farmacia. Hospital Universitario de Álava Txagorritxu. Vitoria Gasteiz Necesidad de establecer equivalentes terapéuticos Los sistemas sanitarios deben buscar la máxima calidad
Copyright 2013 by TEA Ediciones. Información técnica PROPIEDADES TÉCNICAS DEL TEST DE INTERESES PROFESIONAES
 Copyright 2013 by TEA Ediciones Información técnica PROPIEDADES TÉCNICAS DEL TEST DE INTERESES PROFESIONAES Información técnica A continuación se presenta un breve extracto de las propiedades técnicas
Copyright 2013 by TEA Ediciones Información técnica PROPIEDADES TÉCNICAS DEL TEST DE INTERESES PROFESIONAES Información técnica A continuación se presenta un breve extracto de las propiedades técnicas
SITUACIÓN DEL CÁNCER EN LAS AMÉRICAS
 Publicaciones de la OPS/OMS sobre Control y Prevención del Cáncer Las publicaciones están disponibles en la página web de la OPS: www.paho.org/cancer SITUACIÓN DEL CÁNCER EN LAS AMÉRICAS Cáncer en las
Publicaciones de la OPS/OMS sobre Control y Prevención del Cáncer Las publicaciones están disponibles en la página web de la OPS: www.paho.org/cancer SITUACIÓN DEL CÁNCER EN LAS AMÉRICAS Cáncer en las
INTERVENCIÓN SANITARIA EN SITUACIONES DE RIESGO PARA LA SALUD PÚBLICA
 INTERVENCIÓN SANITARIA EN SITUACIONES DE RIESGO PARA LA SALUD PÚBLICA Aprobado por el Consejo Interterritorial del Sistema Nacional de Salud de 18 de Diciembre de 2013 INTRODUCCIÓN El derecho a la protección
INTERVENCIÓN SANITARIA EN SITUACIONES DE RIESGO PARA LA SALUD PÚBLICA Aprobado por el Consejo Interterritorial del Sistema Nacional de Salud de 18 de Diciembre de 2013 INTRODUCCIÓN El derecho a la protección
CONVOCATORIA A PRESENTAR CONTRIBUCIONES PARA LA REVISTA DE ADMINISTRACIÓN TRIBUTARIA CIAT/AEAT/IEF/ N 42
 CONVOCATORIA A PRESENTAR CONTRIBUCIONES PARA LA REVISTA DE ADMINISTRACIÓN TRIBUTARIA CIAT/AEAT/IEF/ N 42 A QUIÉN VA DIRIGIDA ESTA CONVOCATORIA? Esta invitación va dirigida a todos los funcionarios de las
CONVOCATORIA A PRESENTAR CONTRIBUCIONES PARA LA REVISTA DE ADMINISTRACIÓN TRIBUTARIA CIAT/AEAT/IEF/ N 42 A QUIÉN VA DIRIGIDA ESTA CONVOCATORIA? Esta invitación va dirigida a todos los funcionarios de las
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
AZITROMICINA PHARMAGENUS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 AZITROMICINA PHARMAGENUS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Azitromicina Pharmagenus EFG se ha realizado siguiendo las Directrices que la Agencia Europea
AZITROMICINA PHARMAGENUS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Azitromicina Pharmagenus EFG se ha realizado siguiendo las Directrices que la Agencia Europea
ENFERMEDADES TRANSMITIDAS POR ALIMENTOS ETA. Dirección Vigilancia y Análisis del Riesgo Equipo ETA Abril 2014
 ENFERMEDADES TRANSMITIDAS POR ALIMENTOS ETA Dirección Vigilancia y Análisis del Riesgo Equipo ETA Abril 2014 Contenido Protocolo de vigilancia de ETA Lineamientos de vigilancia y control en salud pública
ENFERMEDADES TRANSMITIDAS POR ALIMENTOS ETA Dirección Vigilancia y Análisis del Riesgo Equipo ETA Abril 2014 Contenido Protocolo de vigilancia de ETA Lineamientos de vigilancia y control en salud pública
Unidad Coordinadora Nacional de Farmacovigilancia. Comunicación a profesionales sanitarios sobre AGONISTAS DOPAMINÉRGICOS ERGÓTICOS Alerta No 7
 1 Diciembre 2008 Unidad Coordinadora Nacional de Farmacovigilancia. Comunicación a profesionales sanitarios sobre AGONISTAS DOPAMINÉRGICOS ERGÓTICOS Alerta No 7 Una alternativa a la levodopa es el uso
1 Diciembre 2008 Unidad Coordinadora Nacional de Farmacovigilancia. Comunicación a profesionales sanitarios sobre AGONISTAS DOPAMINÉRGICOS ERGÓTICOS Alerta No 7 Una alternativa a la levodopa es el uso
COMISIÓN DE LAS COMUNIDADES EUROPEAS. Propuesta de REGLAMENTO (UE) Nº /2011 DE LA COMISIÓN
 ES ES ES COMISIÓN DE LAS COMUNIDADES EUROPEAS Propuesta de Bruselas, XXX C REGLAMENTO (UE) Nº /2011 DE LA COMISIÓN de [ ] por el que se modifica el Reglamento (CE) nº 1702/2003 por el que se establecen
ES ES ES COMISIÓN DE LAS COMUNIDADES EUROPEAS Propuesta de Bruselas, XXX C REGLAMENTO (UE) Nº /2011 DE LA COMISIÓN de [ ] por el que se modifica el Reglamento (CE) nº 1702/2003 por el que se establecen
COMITÉS DE FARMACOTERÁPIA. Unidad de Asistencia Técnica y Logística Farmacéutica Ministerio de Salud Pública y Asistencia Social
 COMITÉS DE FARMACOTERÁPIA Unidad de Asistencia Técnica y Logística Farmacéutica Ministerio de Salud Pública y Asistencia Social DEFINICIÓN COMITÉ DE FARMACOTERÁPIA El Comité de Farmacoterápia es un ente
COMITÉS DE FARMACOTERÁPIA Unidad de Asistencia Técnica y Logística Farmacéutica Ministerio de Salud Pública y Asistencia Social DEFINICIÓN COMITÉ DE FARMACOTERÁPIA El Comité de Farmacoterápia es un ente
Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias A.N.M.A.T.
 BUENOS AIRES, 24 Oct 2007 VISTO la Resolución del ex y Acción Social Nº 706/93, la Disposición Nº 5904/96, la Disposición Nº 3855/98, el Expediente Nº 1-0047- 0000-016483-07-1 del registro de esta Administración
BUENOS AIRES, 24 Oct 2007 VISTO la Resolución del ex y Acción Social Nº 706/93, la Disposición Nº 5904/96, la Disposición Nº 3855/98, el Expediente Nº 1-0047- 0000-016483-07-1 del registro de esta Administración
BOMBA VENOSA. Elisabeth Cepas García. Due Traumatología como procedimiento terapéutico.
 BOMBA VENOSA Elisabeth Cepas García. Due Traumatología como procedimiento terapéutico. Enero 2010 RECUERDO ANATOMO- FISIOLÓGICO DEL SISTEMA VENOSO. DE LOS MIEMBROS INFERIORES. 1-INTRODUCCIÓN Es el responsable
BOMBA VENOSA Elisabeth Cepas García. Due Traumatología como procedimiento terapéutico. Enero 2010 RECUERDO ANATOMO- FISIOLÓGICO DEL SISTEMA VENOSO. DE LOS MIEMBROS INFERIORES. 1-INTRODUCCIÓN Es el responsable
