PROSCAR está indicado para tratar y controlar la hiperplasia prostática benigna (HPB) y prevenir trastornos urológicos, para:
|
|
|
- Benito Martínez Núñez
- hace 6 años
- Vistas:
Transcripción
1 I. NOMBRE COMERCIAL II. NOMBRE GENÉRICO Finasterida, MSD III. FORMA FARMACÉUTICA Y FORMULACIÓN Tabletas Cada Tableta contiene: Finasterida... 5 mg Excipiente... 1 Tableta IV. INDICACIONES TERAPÉUTICAS PROSCAR está indicado para tratar y controlar la hiperplasia prostática benigna (HPB) y prevenir trastornos urológicos, para: disminuir el riesgo de retención urinaria aguda disminuir la necesidad de intervenciones quirúrgicas como la resección transuretral de la próstata y la prostatectomía PROSCAR causa la disminución del tamaño de la próstata, y mejora el flujo urinario y los síntomas asociados con la HPB. Los pacientes con próstata agrandada son los candidatos apropiados para el tratamiento con PROSCAR. V. FARMACOCINÉTICA Y FARMACODINAMIA EN HUMANOS La hiperplasia prostática benigna ocurre en la mayoría de los hombres mayores de 50 años, y su frecuencia aumenta con la edad. Los estudios epidemiológicos sugieren que el aumento de volumen de la próstata se asocia con un aumento al triple del riesgo de retención urinaria aguda y de cirugía prostática. Además, la probabilidad de padecer síntomas urinarios moderados a intensos o disminución del flujo urinario es tres veces mayor en los hombres con próstatas agrandadas que en los que tienen próstatas de menor tamaño. Tanto el desarrollo como el crecimiento y la hipertrofia subsecuente de la próstata dependen de la acción del potente andrógeno dihidrotestosterona (DHT). La testosterona, secretada por los testículos y las glándulas suprarrenales, es convertida rápidamente en DHT por la 5 -reductasa de tipo II, principalmente en la próstata, el hígado y la piel, y después se une preferencialmente a los núcleos celulares de esos tejidos. La finasterida es un inhibidor competitivo de la 5 -reductasa de tipo II humana, con la cual va formando un complejo enzimático estable que se desdobla muy lentamente (semivida, unos 30 días). Se ha demostrado tanto in vitro como in vivo que la finasterida es un inhibidor específico de la 5 -reductasa de tipo II y no tiene ninguna afinidad por los receptores de andrógenos. D.R. MERCK & Co., Inc., Reservados todos los derechos. Prohibida su reproducción parcial o total.
2 Una dosis única de 5 mg de finasterida produjo una rápida disminución de la concentración sérica de DHT, con efecto máximo a las ocho horas. Aunque las concentraciones plasmáticas de finasterida variaron en el transcurso de 24 horas, las de DHT permanecieron constantes durante ese periodo, lo cual indica que no hay una correlación directa entre dichas concentraciones. En pacientes con HPB, el tratamiento con 5 mg diarios de finasterida durante cuatro años disminuyó aproximadamente 70% las concentraciones circulantes de DHT y se acompañó de una reducción media del volumen de la próstata de 20% aproximadamente. Además, los valores iniciales de APE disminuyeron alrededor de 50%, lo cual sugiere que disminuyó el crecimiento de las células epiteliales de la próstata. La disminución de las concentraciones de DHT y la regresión de la próstata hiperplásica, acompañadas de la disminución de las concentraciones de APE, se han mantenido en estudios de hasta cuatro años de duración. En esos estudios, las concentraciones circulantes de testosterona aumentaron 10-20% aproximadamente, pero se mantuvieron dentro de los límites fisiológicos. Cuando se administró PROSCAR durante siete a diez días a pacientes que iban a ser sometidos a prostatectomía, sus concentraciones intraprostáticas de DHT disminuyeron 80% aproximadamente, y las de testosterona aumentaron hasta diez veces más que antes del tratamiento. En voluntarios sanos tratados con PROSCAR durante 14 días, al suspender el tratamiento las concentraciones de DHT volvieron a sus valores anteriores en dos semanas aproximadamente. En pacientes tratados durante tres meses, el volumen prostático, que había disminuido 20% aproximadamente, volvió hasta cerca de su valor inicial aproximadamente tres meses después de suspender el tratamiento. En comparación con el placebo, la finasterida no tuvo ningún efecto sobre las concentraciones circulantes de cortisol, estradiol, prolactina, hormona estimulante de la tiroides y tiroxina. Tampoco se observó ningún efecto de importancia clínica sobre el perfil de lípidos plasmáticos (colesterol total, lipoproteínas de baja densidad, lipoproteínas de alta densidad y triglicéridos) ni sobre la densidad mineral ósea. En pacientes tratados durante 12 meses se observó un aumento de aproximadamente 15% en la hormona luteinizante (HL) y de 9% en la hormona foliculoestimulante (HFE), pero las concentraciones de estas hormonas se mantuvieron dentro de los límites fisiológicos. Las concentraciones de HL y HFE estimuladas por la hormona liberadora de gonadotropinas no se modificaron, lo cual indicó que no se alteró el control regulador del eje hipofisario-testicular. El tratamiento con PROSCAR durante 24 semanas para evaluar los parámetros del semen en voluntarios sanos no reveló ningún efecto de importancia clínica sobre el número, la movilidad o la morfología de los espermatozoides ni sobre el ph del semen. Se observó una disminución media de 0.6 ml en el volumen de la eyaculación, con una disminución concomitante del número total de espermatozoides por eyaculación. Estos parámetros se mantuvieron dentro de los límites normales, y sus cambios fueron reversibles al suspender el tratamiento. La finasterida pareció inhibir el metabolismo tanto de los esteroides C 19 como el de los esteroides C 21, lo cual indicaría un efecto inhibidor de la actividad de la 5 -reductasa de tipo II tanto hepática como periférica. También disminuyeron significativamente las concentraciones séricas de los metabolitos de la DHT glucurónido de androstenediol y glucurónido de androsterona. Este patrón metabólico es similar al observado en individuos con deficiencia genética de 5 -reductasa de tipo II, los cuales tienen concentraciones muy disminuidas de DHT y próstatas pequeñas y no padecen HPB. Estos individuos presentan defectos genitourinarios congénitos y anormalidades bioquímicas, pero no sufren ningún otro trastorno clínicamente importante como consecuencia de la deficiencia de 5 -reductasa de tipo II. FARMACOCINÉTICA En el hombre, después de una dosis oral de 14 C-finasterida, 39% de la dosis total fue excretada con la orina en forma de metabolitos (prácticamente no existía medicamento intacto en la orina), y 57% fue excretada con las heces. En ese estudio se identificaron dos metabolitos de la finasterida que poseen sólo una pequeña fracción de su actividad inhibidora de la 5 -reductasa. En comparación con una dosis intravenosa de referencia, la biodisponibilidad de finasterida administrada por vía oral es de 80% aproximadamente, y no es afectada por la presencia de alimentos. La finasterida alcanza
3 concentraciones plasmáticas máximas aproximadamente dos horas después de la administración, y su absorción es completa en seis a ocho horas. Tiene una semivida de eliminación del plasma de seis horas en promedio, y su unión con las proteínas plasmáticas es de 93% aproximadamente. La depuración plasmática de la finasterida es de unos 165 ml/min, y su volumen de distribución es de 76 litros aproximadamente. Un estudio con dosis múltiples demostró una lenta acumulación de pequeñas cantidades de finasterida al paso del tiempo. Después de administrar dosis de 5 mg diarios, las concentraciones plasmáticas mínimas de finasterida en estado de equilibrio se calcularon en 8 a 10 ng/ml y se mantuvieron estables al paso del tiempo. La rapidez de eliminación de la finasterida está un tanto disminuida en los hombres de edad avanzada. A medida que aumenta la edad, su semivida se prolonga de un promedio de seis horas aproximadamente en los hombres de 18 a 60 años a ocho horas en los mayores de 70 años. Esta diferencia no tiene ninguna importancia clínica y, por lo tanto, no es necesario reducir la dosificación en los pacientes de edad avanzada. En pacientes con deterioro renal crónico y depuración de la creatinina de 9 a 55 ml/min, la eliminación de una dosis única de 14 C-finasterida no fue diferente de la de voluntarios sanos, y tampoco varió su unión a las proteínas plasmáticas. En los pacientes con deterioro renal, una porción de los metabolitos que normalmente se excretan por vía renal fue excretada con las heces. Parece ser, por lo tanto, que la excreción de los metabolitos por vía fecal aumenta en proporción con la disminución de su excreción urinaria. No es necesario hacer ningún ajuste de la dosificación en los pacientes con deterioro renal que no están sometidos a diálisis. Se ha hallado finasterida en el líquido cefalorraquídeo (LCR) de pacientes tratados con él durante siete a diez días, pero el medicamento no parece concentrarse preferencialmente en el LCR. También se ha recuperado finasterida del semen de sujetos que estaban recibiendo 5 mg diarios de PROSCAR. La cantidad de finasterida en el semen fue 50 a 100 veces menor que la dosis (5 g) que no tuvo ningún efecto sobre las concentraciones circulantes de DHT en hombres adultos (véase también 12. PRECAUCIONES Y RELACION CON EFECTOS DE CARCINOGENESIS, MUTAGENESIS, TERATOGENESIS Y SOBRE LA FERTILIDAD, ESTUDIOS SOBRE EL DESARROLLO FETAL). ESTUDIOS CLÍNICOS Los datos de los estudios que se describen a continuación, que muestran disminución del riesgo de retención urinaria aguda y de intervención quirúrgica, mejoría de los síntomas relacionados con la HPB, aumento de los flujos urinarios máximos y disminución del volumen de la próstata, sugieren que PROSCAR invierte la progresión de la HPB. El tratamiento con 5 mg diarios de PROSCAR fue evaluado inicialmente en pacientes con síntomas de HPB y aumento de volumen de la próstata detectado por tacto rectal, en dos estudios de fase III de un año de duración, controlados con placebo, con distribución al azar y por el método doble ciego, y en sus extensiones de cinco años por el método abierto. De los 536 pacientes originalmente distribuidos al azar para recibir 5 mg diarios de PROSCAR, 234 completaron los cinco años adicionales de tratamiento y se pudieron incluir en el análisis estadístico. Los parámetros de eficacia fueron la puntuación de los síntomas, el flujo urinario máximo y el volumen de la próstata. También se evaluó PROSCAR en el Estudio de la Eficacia y la Seguridad a Largo Plazo de PROSCAR (PLESS), un estudio multicéntrico doble ciego, con distribución al azar y controlado con placebo de cuatro años de duración, en el cual se determinó el efecto del tratamiento con 5 mg diarios de PROSCAR sobre los síntomas de la HPB y sobre los sucesos urológicos relacionados con ésta (intervenciones quirúrgicas como la resección transuretral de la próstata y la prostatectomía, o la retención urinaria que hiciera necesaria la cateterización). En ese estudio se distribuyó al azar a 3,040 pacientes de 45 a 78 años de edad con síntomas moderados a intensos de HPB y aumento del volumen de la próstata en el tacto rectal (1,524 tratados con finasterida y 1,516 con el placebo), y se pudo evaluar la eficacia del tratamiento en 3,016 de
4 ellos. Completaron el estudio de cuatro años 1,883 pacientes (1,000 en el grupo del finasterida y 883 en el del placebo). También se evaluaron el flujo urinario máximo y el volumen de la próstata. Efecto sobre la retención urinaria aguda y sobre la necesidad de intervención quirúrgica En el estudio PLESS de cuatro años de duración necesitaron la intervención quirúrgica o presentaron retención urinaria aguda 13.2% de los pacientes que recibieron el placebo, en comparación con 6.6% de los que tomaron PROSCAR, lo cual representa una disminución de 51% del riesgo de operación o de retención urinaria aguda en el transcurso de cuatro años. PROSCAR redujo 55% el riesgo de intervención quirúrgica (que fue de 10.1% con el placebo y de 4.6% con PROSCAR), y 57% el riesgo de retención urinaria aguda (6.6% con el placebo y 2.8% con PROSCAR). Esa disminución del riesgo fue evidente en la primera evaluación (a los cuatro meses de tratamiento), y se mantuvo durante los cuatro años del estudio (figuras 1 y 2). La tabla 1 muestra los porcentajes de incidencia y de reducción del riesgo de los sucesos urológicos durante el estudio. Figura 1 Porcentajes de pacientes operados por HPB, incluyendo la resección transuretral de la próstata Figura 2
5 Porcentajes de pacientes que presentaron retención urinaria aguda (espontánea o inducida) Tabla 1 FRECUENCIAS DE LOS SUCESOS UROLOGICOS Y REDUCCION DEL RIESGO CON PROSCAR EN EL TRANSCURSO DE CUATRO AÑOS Porcentaje de pacientes Sucesos urológicos Placebo (n=1,503) Finasterida 5 mg (n=1,513) Reducción del riesgo Operación o retención urinaria aguda 13.2% 6.6% 51%* Operación + Resección transuretral 10.1% 8.3% 4.6% 4.2% 55%* 49%* Retención urinaria aguda 6.6% 2.8% 57%* + Operaciones relacionadas con la HPB *p<0.001 Efecto sobre la puntuación de los síntomas En los dos estudios de fase III de un año de duración, los promedios iniciales de las puntuaciones totales de los síntomas disminuyeron en tan sólo dos semanas, y a los siete y diez meses se observó una mejoría significativa de los síntomas en comparación con el placebo. Aunque en algunos pacientes hubo una mejoría temprana de los síntomas urinarios, generalmente fue necesario ensayar el tratamiento durante seis meses por lo menos para determinar si se había logrado una respuesta beneficiosa. La mejoría de los síntomas de la HPB se mantuvo durante todo el primer año y durante los cinco años adicionales de la extensión de los estudios. Los pacientes del estudio PLESS de cuatro años de duración tenían inicialmente síntomas moderados a intensos (promedio de 15 puntos aproximadamente en una escala de 0 a 34 puntos). En los pacientes que continuaron el tratamiento durante los cuatro años del estudio, PROSCAR mejoró 3.3 puntos la puntuación de los síntomas, en comparación con una mejoría de 1.3 puntos en el grupo del placebo (p<0.001). En los pacientes tratados con PROSCAR la mejoría de la puntuación de los síntomas fue evidente en el primer año, y esa mejoría continuó hasta el cuarto año. En los pacientes tratados con el placebo la puntuación de los síntomas mejoró en el primer año, pero después empeoró. La mejoría de la
6 puntuación de los síntomas tendió a ser mayor en los pacientes con síntomas iniciales moderados a intensos. Efecto sobre el flujo urinario máximo En los dos estudios de fase III de un año de duración, el flujo urinario máximo inicial había aumentado significativamente a la semana 2, y en comparación con el placebo se observó un aumento significativo del flujo urinario máximo a los cuatro y a los siete meses. Este efecto se mantuvo durante el primer año y durante los cinco años adicionales de la extensión de los estudios. En el estudio PLESS de cuatro años, a los cuatro meses hubo una clara diferencia en el flujo urinario máximo entre los dos grupos de tratamiento a favor de PROSCAR, y esa diferencia se mantuvo durante todo el estudio. El promedio inicial de flujo urinario máximo fue de aproximadamente 11 ml/seg. en ambos grupos. En los pacientes que continuaron el tratamiento durante todo el estudio y tuvieron datos evaluables, PROSCAR aumentó 1.9 ml/seg. el flujo urinario máximo, en comparación con 0.2 ml/seg. en el grupo del placebo. Efecto sobre el volumen de la próstata En los dos estudios de fase III de un año de duración, el promedio inicial de volumen de la próstata fue de cc. En ambos estudios PROSCAR disminuyó significativamente el volumen de la próstata en comparación con el valor inicial y con el placebo en la primera evaluación (a los tres meses), y ese efecto se mantuvo durante el primer año y durante los cinco años adicionales de la extensión de los estudios. En el estudio PLESS de cuatro años se determinó anualmente el volumen de la próstata por resonancia magnética en un subgrupo de 284 pacientes. En los pacientes tratados con PROSCAR el volumen prostático disminuyó en comparación con el valor inicial y con el placebo durante los cuatro años del estudio. En los pacientes de ese subgrupo que continuaron el tratamiento durante todo el estudio, PROSCAR disminuyó 17.9% el volumen de la próstata (de 55.9 cc inicial a 45.8 cc a los cuatro años), en comparación con un aumento de 14.1% (de 51.3 cc a 58.5 cc) en el grupo del placebo (p<0.001). El volumen de la próstata como factor de predicción de la respuesta terapéutica Un meta-análisis en el que se combinaron los datos de un año de siete estudios por el método doble ciego controlados con placebo de diseño similar, que incluyeron 4,491 pacientes con HPB sintomática, demostró que en los pacientes tratados con PROSCAR la magnitud de la respuesta de los síntomas y el grado de mejoría del flujo urinario máximo fueron mayores en los pacientes que inicialmente tenían agrandada la próstata (aproximadamente 40 cc o más). Tratamiento médico de los síntomas prostáticos El MTOPS (Tratamiento Médico de los Síntomas Prostáticos) fue un estudio doble ciego, con distribución al azar, controlado con placebo, multicéntrico, de 4 a 6 años de duración (promedio 5 años) en 3,047 hombres con HPB sintomática, que fueron distribuidos al azar a recibir finasterida 5 mg/día (n= 768), doxazosina 4 u 8 mg/día (ajustada de 1 mg a 4 u 8 mg en un periodo de 3 semanas) (n= 756), tratamiento combinado de finasterida 5 mg/día y doxazosina 4 u 8 mg/día (ajustada de 1 mg a 4 u 8 mg en un periodo de 3 semanas) (n= 786) y placebo (n= 737). El objetivo primario fue la progresión clínica de la HPB desde el momento de la distribución al azar; la progresión de la HPB se definió como la primer ocurrencia de cualquiera de estos trastornos: Una puntuación mayor o igual de 4 confirma incremento respecto al inicio en la puntuación de síntomas, retención aguda de orina, insuficiencia renal relacionada con HPB (aumento de la creatinina), infecciones recurrentes del tracto urinario o urosepsia, o incontinencia. Comparado con placebo, el tratamiento con finasterida, doxazosina o el tratamiento combinado resultó en una reducción significativa del riesgo de progresión clínica de la HPB en 34%, 39% y 67%, respectivamente. El tratamiento combinado redujo el riesgo de progresión clínica de la HPB en una forma estadísticamente mayor que la finasterida o la doxazosina solos, los cuales no fueron estadísticamente diferentes entre sí (véase Figura 3). La mayoría de los trastornos (274 de 351) que constituyeron progresión de la HPB fueron confirmados mediante una puntuación de síntomas mayor igual de 4: El riesgo de progresión de la puntuación de síntomas se redujo en
7 30%, 46% y 64% en los grupos de finasterida, doxazosina o tratamiento combinado, respectivamente, comparado con placebo. Se registraron 41 casos de retención aguda de orina en los 351 casos de progresión de la HPB; el riesgo de desarrollar retención aguda de orina se redujo en 67%, 31% y 79% en los grupos de finasterida, doxazosina o tratamiento combinado, respectivamente, comparado con placebo. Sólo los grupos de finasterida y el tratamiento combinado fueron significativamente diferentes a placebo. Pocos casos acumulativos de eventos de insuficiencia renal, infección del tracto urinario y de incontinencia fueron reportados e influyeron muy poco en el objetivo primario de progresión de la HPB. 25 Figura 3 Incidencia acumulada de progresión clínica de la HPB por grupos de tratamiento 20 Placebo Porcentaje Percent con with eventos Event Finasteride Finasterida Doxazosina Combination Combinación Tiempo Study del estudio Time (años) (years) Los objetivos secundarios de medición del estudio MTOPS incluyeron el efecto del tratamiento en el tratamiento invasivo para la HPB, la puntuación de síntomas, el flujo urinario máximo y el volumen prostático. El riesgo de requerir tratamiento invasivo para la HPB se redujo en 64%, 3% y 67% con finasterida, doxazosina o tratamiento combinado, respectivamente, comparado con placebo. Sólo la finasterida y el tratamiento combinado fueron significativamente diferentes a placebo. Los tres grupos de tratamiento mostraron mejoría significativa en la puntuación de los síntomas en comparación con placebo y el tratamiento combinado fue superior a ambas monoterapias. El efecto de la combinación y de la doxazosina en el flujo urinario máximo fue superior al de finasterida y placebo. La finasterida y el tratamiento combinado disminuyeron el volumen prostático, mientras que aumentó en los pacientes tratados con doxazosina o placebo. Los resultados del estudio MTOPS confirman los hallazgos del estudio PLESS de cuatro años controlado con placebo en el que la finasterida redujo el riesgo de retención aguda de orina y la necesidad de cirugía para la HPB. Los resultados del estudio MTOPS demuestran incluso que la combinación de finasterida y doxazosina reduce el riesgo de progresión de la HPB en una proporción significativamente mayor que cualquiera de esos tratamientos administrados solos. ESTUDIOS CLÍNICOS ADICIONALES Los efectos urodinámicos de la finasterida en el tratamiento de la obstrucción de la salida de la vejiga por HPB se evaluaron mediante técnicas invasoras en un estudio de 24 semanas, doble ciego y controlado con
8 placebo, en 36 pacientes con síntomas moderados a intensos de obstrucción urinaria y flujos urinarios máximos de menos de 15 ml/seg. En comparación con el placebo, en los pacientes tratados con 5 mg diarios de PROSCAR se comprobó una reducción de la obstrucción, manifestada por una mejoría significativa de la presión del detrusor y por un aumento del promedio de flujo urinario. En un estudio doble ciego controlado con placebo de un año de duración se evaluó el efecto de la finasterida sobre el volumen de las zonas periférica y periuretral de la próstata en 20 hombres con HPB, por medio de imágenes de resonancia magnética. Los pacientes tratados con PROSCAR, pero no los que recibieron el placebo, experimentaron una disminución significativa (de 11.5 ± 3.2 cc) del volumen total de la próstata, debida en gran parte a una reducción de 6.2 ± 3 cc en el volumen de la zona periuretral. Dado que esta zona es la que obstruye la salida de la vejiga, su disminución puede ser la causa de la respuesta clínica beneficiosa observada en esos pacientes. Información de un reciente estudio controlado con placebo de 7 años de duración que incluyó 18,882 hombres de 55 años de edad o mayores, con resultados normales en el examen de taco rectal y valores de APE 3.0 ng/ml, puede ser relevante para hombres tratados actualmente con PROSCAR. Al final de ese estudio, 9,060 tenían datos disponibles de análisis de biopsia por punción de la próstata. En ese estudio, se detectó cáncer de próstata en 803 (18.4%) de los hombres que recibieron PROSCAR y en 1,147 (24.4%) de los que recibieron placebo (véase OTROS DATOS DE TRATAMIENTO A LARGO PLAZO en 9. REACCIONES SECUNDARIAS Y ADVERSAS). PROSCAR no está indicado para reducir el riesgo de desarrollar cáncer prostático. VI. CONTRAINDICACIONES PROSCAR no está indicado en mujeres ni en niños, y está contraindicado en los siguientes casos: Hipersensibilidad a cualquier componente de este producto. Embarazo - Mujeres embarazadas o que pueden embarazarse. (Véase 8. PRECAUCIONES O RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: EMBARAZO, Y EXPOSICIÓN A LA FINASTERIDA - RIESGO PARA EL FETO DE SEXO MASCULINO). VII. PRECAUCIONES GENERALES Se debe vigilar cuidadosamente a los pacientes con gran volumen residual de orina y/o flujo urinario muy disminuido, por la posibilidad de una uropatía obstructiva. EFECTOS SOBRE EL ANTÍGENO PROSTÁTICO ESPECÍFICO (APE) Y LA DETECCIÓN DEL CÁNCER DE LA PROSTATA Hasta ahora, no se ha demostrado ningún beneficio clínico del tratamiento con PROSCAR en pacientes con cáncer de la próstata. En estudios clínicos controlados se vigiló a pacientes con HPB y APE elevado mediante mediciones del APE y biopsias de próstata en serie. En esos estudios en HPB, PROSCAR no alteró la frecuencia de detección del cáncer de la próstata y la frecuencia total del cáncer de la próstata no fue significativamente diferente en los pacientes tratados con PROSCAR y en los que recibieron un placebo. Se recomienda examinar a los pacientes por tacto rectal y mediante otras pruebas de detección del cáncer prostático antes de iniciar el tratamiento con PROSCAR y periódicamente durante él. Para detectar el cáncer de la próstata también se utiliza la medición del APE sérico. Generalmente, una concentración de APE mayor de 10 ng/ml (Hybritech) requiere una mayor investigación y considerar la conveniencia de realizar una biopsia; las concentraciones de APE de 4 a 10 ng/ml hacen aconsejable una mayor evaluación. Las concentraciones de APE de los hombres con y sin cáncer de la próstata se superponen considerablemente, por lo que en los hombres con HPB, tratados o no con PROSCAR, los valores de APE dentro del rango normal no excluyen la posibilidad de cáncer de la próstata. Una concentración de APE menor de 4 ng/ml tampoco excluye la posibilidad de cáncer de la próstata.
9 PROSCAR disminuye aproximadamente 50% las concentraciones séricas de APE en los pacientes con HPB, aun en presencia de cáncer de la próstata. Esa disminución se debe tener en cuenta al evaluar las concentraciones séricas de APE en los pacientes con HPB tratados con PROSCAR, no excluye la posibilidad de un cáncer prostático concomitante, y es previsible en todo el rango de valores del APE, aunque puede variar de un paciente a otro. En el Estudio de la Eficacia y la Seguridad a Largo Plazo de PROSCAR (PLESS), de cuatro años de duración, doble ciego y controlado con placebo, el análisis de los datos del APE de más de 3,000 pacientes confirmó que en los pacientes típicos tratados con PROSCAR durante seis meses o más los valores de APE se deben duplicar al compararlos con los rangos normales en los hombres no tratados. Ese ajuste mantiene la sensibilidad y la especificidad de la prueba del APE y su capacidad para detectar el cáncer de la próstata. Se debe evaluar cuidadosamente cualquier aumento sostenido de las concentraciones del APE en los pacientes tratados con finasterida, incluyendo la posibilidad de que el paciente no haya seguido fielmente el tratamiento con PROSCAR. El porcentaje de APE libre (libre respecto al porcentaje total de APE) Io disminuye significativamente con PROSCAR. Ese porcentaje de APE permanece constante incluso bajo la influencia de PROSCAR. Cuando se utiliza el porcentaje de APE libre para la detección de cáncer de próstata, no es necesario ajustar ese valor. INTERACCIONES DEL MEDICAMENTO CON PRUEBAS DE LABORATORIO Efecto sobre las mediciones del APE La concentración sérica del APE, la edad del paciente y el volumen de la próstata están correlacionados. Al evaluar las concentraciones de APE se debe tener en cuenta que disminuyen en los pacientes tratados con PROSCAR. En la mayoría de los casos el APE disminuye rápidamente en los primeros meses de tratamiento y después se estabiliza en un nuevo nivel, que es aproximadamente la mitad del que tenía antes del tratamiento. Por consiguiente, en los pacientes típicos tratados con PROSCAR durante seis meses o más los valores de APE se deben duplicar al compararlos con los rangos normales en los hombres no tratados. Para la interpretación clínica, véase arriba EFECTOS SOBRE EL ANTÍGENO PROSTÁTICO ESPECÍFICO (APE) Y LA DETECCIÓN DEL CÁNCER DE LA PRÓSTATA. EMPLEO EN NIÑOS PROSCAR no está indicado en niños. No se han determinado la seguridad y la eficacia de PROSCAR en niños. VIII. PRECAUCIONES O RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA EMBARAZO PROSCAR está contraindicado en mujeres embarazadas o que pueden embarazarse (véase 6. CONTRAINDICACIONES). Debido a la propiedad de los inhibidores de la 5 -reductasa de tipo II de inhibir la conversión de la testosterona en dihidrotestosterona, estos medicamentos, incluyendo a la finasterida, pueden causar anormalidades de los órganos genitales externos de los fetos de sexo masculino si se administran a una mujer embarazada. EXPOSICIÓN A LA FINASTERIDA - RIESGO PARA EL FETO DE SEXO MASCULINO Las mujeres embarazadas o que pueden embarazarse no deben manipular tabletas rotas de PROSCAR, debido a la posibilidad de que absorban finasterida, con el consiguiente riesgo potencial para los fetos de sexo masculino (véase arriba EMBARAZO). Las tabletas de PROSCAR están recubiertas, por lo que, si no están rotas, evitarán el contacto con el ingrediente activo durante su manipulación normal. MADRES LACTANTES PROSCAR no está indicado en mujeres. No se sabe si la finasterida es excretada con la leche humana.
10 IX. REACCIONES SECUNDARIAS Y ADVERSAS PROSCAR es bien tolerado. En el estudio PLESS se evaluó la seguridad de PROSCAR durante un periodo de cuatro años en 1,524 pacientes tratados con 5 mg diarios de PROSCAR y 1,516 pacientes tratados con un placebo. Se suspendió el tratamiento por efectos colaterales asociados con PROSCAR en 4.9% (74 pacientes), en comparación con 3.3% (50 pacientes) de los tratados con el placebo; 3.7% (57 pacientes) de los tratados con PROSCAR y 2.1% (32 pacientes) de los que recibieron el placebo suspendieron el tratamiento a causa de efectos colaterales relacionados con la función sexual, que fueron los reportados con más frecuencia. Las únicas reacciones adversas clínicas consideradas por el investigador como posible, probable o claramente relacionadas con el medicamento que ocurrieron en los cuatro años del estudio en 1.0% o más de los pacientes tratados con PROSCAR y con una frecuencia mayor que con el placebo fueron las relacionadas con la función sexual, trastornos mamarios y erupción cutánea. En el primer año del estudio, reportaron impotencia 8.1% de los pacientes tratados con PROSCAR y 3.7% de los tratados con el placebo, disminución de la libido 6.4% y 3.4%, y trastornos de la eyaculación 0.8% y 0.1%, respectivamente. Del segundo al cuarto años del estudio no hubo ninguna diferencia significativa en las incidencias de esos tres efectos entre los dos grupos de tratamiento. Las incidencias acumulativas en los años dos a cuatro fueron: Impotencia, 5.1% con PROSCAR y 5.1% con el placebo; disminución de la libido, 2.6% y 2.6%, y trastornos de la eyaculación, 0.2% y 0.1%, respectivamente. Durante el primer año reportaron disminución del volumen de la eyaculación 3.7% de los pacientes tratados con PROSCAR y 0.8% de los tratados con el placebo, y del segundo al cuarto años la incidencia acumulativa de ese trastorno fue de 1.5% con PROSCAR y de 0.5% con el placebo. Durante el primer año también se reportaron aumento del volumen mamario (0.5% y 0.1%, respectivamente), hiperestesia mamaria (0.4% y 0.1%) y erupción cutánea (0.5% y 0.2%). Del segundo al cuarto año las respectivas incidencias acumulativas fueron: Aumento del volumen mamario, 1.8% y 1.1%; hiperestesia mamaria, 0.7% y 0.3%, y erupción cutánea, 0.5% y 0.1%. El perfil de reacciones adversas en los estudios de fase III de un año de duración controlados con placebo y en sus extensiones de cinco años, incluyendo 853 pacientes tratados durante cinco a seis años, fue similar al reportado en los años 2 a 4 del estudio PLESS. No hay ningún indicio de que las reacciones adversas aumenten al prolongar el tratamiento con PROSCAR. La incidencia de nuevas reacciones adversas sexuales relacionadas con el medicamento fue disminuyendo a medida que se prolongaba el tratamiento. TRATAMIENTO MÉDICO DE LOS SÍNTOMAS PROSTÁTICOS (Estudio MTOPS) El estudio MTOPS comparó finasterida 5 mg/día (n= 768), doxazosina 4 u 8 mg/día (n= 756), tratamiento combinado de finasterida 5 mg/día y doxazosina 4 u 8 mg/día (n= 786) y placebo (n= 737). En este estudio, el perfil de tolerabilidad y seguridad del tratamiento combinado fue generalmente consistente con los perfiles individuales de los componentes. La incidencia de trastornos de la eyaculación en los pacientes que recibieron el tratamiento combinado fue comparable a la suma de la incidencia de reacciones adversas de las dos monoterapias. OTROS DATOS DE TRATAMIENTO A LARGO PLAZO En un estudio controlado con placebo de 7 años de duración que incluyó 18,882 hombres sanos, de los cuales 9,060 tenían datos disponibles para análisis de biopsia por punción, se detectó cáncer de próstata en 803 (18.4%) de los hombres que recibieron PROSCAR y en 1,147 (24.4%) de los que recibieron placebo. En el grupo de PROSCAR, 280 (6.4%) tenían cáncer de próstata detectado por biopsia por punción con puntuación Gleason de 7-10 en comparación con 237 (5.1%) de los hombres del grupo con placebo. Análisis adicionales sugieren que el incremento en la prevalencia de cáncer de próstata de alto grado observado en el grupo de PROSCAR puede explicarse por sesgos en la detección debido al efecto de PROSCAR en el volumen prostático. Del total de los casos de cáncer diagnosticados en ese estudio, aproximadamente 98%
11 fueron clasificados en el diagnóstico como intracapsulares (fase clínica T1 o T2). Se desconoce el significado clínico de la puntuación Gleason de CÁNCER DE MAMA Durante el estudio MTOPS de 4 a 6 años controlado con placebo y con comparador activo que incluyó a 3,047 hombres, hubo 4 casos de cáncer de mama en los hombres tratados con finasterida pero ninguno en los hombres que no fueron tratados con finasterida. Durante el estudio PLESS de 4 años controlado con placebo que incluyó a 3,040 hombres, hubo 2 casos de cáncer de mama en los hombres tratados con placebo, pero ninguno en los hombres tratados con finasterida. Durante el estudio Prostate Cancer Prevention Trial (PCPT) de 7 años controlado con placebo que incluyó 18,882 hombres, hubo 1 caso de cáncer de mama en los hombres tratados con finasterida, y 1 caso en los hombres tratados con placebo. Después de la comercialización no ha habido reportes de cáncer de mama con el uso de finasterida. Actualmente se desconoce la relación entre el uso a largo plazo de finasterida y neoplasia de cáncer de mama. EXPERIENCIA DESPUÉS DE LA COMERCIALIZACIÓN Después de la salida del producto al mercado se han reportado los siguientes efectos adversos adicionales con PROSCAR y/o finasterida a dosis menores. Como estas reacciones son reportadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar realmente la frecuencia o establecer una relación causal con la exposición al medicamento. Trastornos del sistema inmune: Reacciones de hipersensibilidad, tales como prurito, urticaria y angioderma (incluyendo tumefacción de los labios, lengua, gargante y cara. Trastornos psiquiátricos: Depresión; disminución de la libido que continuó después de la interrupción del tratamiento. Trastornos del sistema reproductor y de las mamas: Disfunción sexual (disfunción eréctil y trastornoes de la eyaculación) que continuó después de la interrupción del tratamiento, dolor testicular; infertilidad masculina y/o pobre calidad seminal. Después de descontinuar la finasterida se ha reportado la normalización o mejoría de la calidad seminal. X. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO No se han identificado interacciones farmacológicas de importancia clínica. PROSCAR no parece afectar significativamente el sistema enzimático de metabolismo de medicamentos relacionado con el citocromo P450. Los compuestos que han sido estudiados en el hombre en administración concomitante con PROSCAR han incluido propranolol, digoxina, gliburida, warfarina, teofilina y antipirina, y no se encontró ninguna interacción de importancia clínica. OTROS TRATAMIENTOS CONCOMITANTES Aunque no se hicieron estudios específicos de interacción, en los estudios clínicos se usó PROSCAR concomitantemente con inhibidores de la ECA, acetaminofén, ácido acetilsalicílico, bloqueadores, bloqueadores, bloqueadores del canal del calcio, nitratos de acción cardiaca, diuréticos, antagonistas H 2, inhibidores de la reductasa de la HMG-CoA, antiinflamatorios no esteroides (AINEs), quinolonas y benzodiacepinas, sin indicios de interacciones adversas de importancia clínica. XI. ALTERACIONES DE PRUEBAS DE LABORATORIO Al evaluar las determinaciones de laboratorio del APE se debe tener en cuenta que PROSCAR disminuye sus concentraciones en el suero (véase 7. PRECAUCIONES GENERALES). No se observó ninguna otra diferencia en los parámetros usuales de laboratorio entre los pacientes tratados con placebo y los tratados con PROSCAR.
12 XII. PRECAUCIONES Y RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD CARCINOGÉNESIS Y MUTAGÉNESIS No se observó ningún indicio de efecto tumorigénico en un estudio de 24 meses en ratas que recibieron hasta 320 mg/kg/día de finasterida (3,200 veces más que la dosis de 5 mg diarios recomendada en seres humanos). En un estudio de carcinogenicidad de 19 meses en ratones se observó un aumento estadísticamente significativo (p 0.05) en la incidencia de adenomas testiculares de las células de Leydig con una dosificación de 250 mg/kg/día (2,500 veces mayor que la de 5 mg diarios recomendada en seres humanos); no se observaron adenomas en los ratones que recibieron 2.5 ó 25 mg/kg/día (25 ó 250 veces más que la dosis de 5 mg diarios recomendada en seres humanos). Se observó un aumento de la incidencia de la hiperplasia de las células de Leydig con una dosificación de 25 mg/kg/día en los ratones y de 40 mg/kg/día o más en las ratas (250 y 400 o más veces mayores, respectivamente, que la de 5 mg diarios recomendada en seres humanos). Se ha demostrado una correlación positiva entre los cambios proliferativos de las células de Leydig y el aumento de las concentraciones séricas de HL (al doble o al triple que las iniciales) en ambas especies de roedores tratadas con dosis altas de finasterida. Esto sugiere que los cambios en las células de Leydig son secundarios al aumento de las concentraciones séricas de HL y no debidos a un efecto directo de la finasterida. No se observaron cambios de las células de Leydig relacionados con el medicamento en ratas o en perros tratados con finasterida durante un año a dosis de 20 mg/kg/día y 45 mg/kg/día (200 y 450 veces mayores, respectivamente, que la de 5 mg diarios recomendada en seres humanos) ni en ratones tratados durante 19 meses con 2.5 mg/kg/día (25 veces más que la dosis de 5 mg diarios recomendada en seres humanos). No se observó ningún indicio de en un ensayo de mutagénesis bacteriana in vitro, en un ensayo de mutagénesis en células de mamífero, ni en un ensayo de elución alcalina in vitro. En un ensayo de aberración cromosómica in vitro, cuando se trataron células de ovario de hámster chino con concentraciones altas ( mol) de finasterida hubo un ligero aumento de las aberraciones cromosómicas. Esas concentraciones son 4,000 a 5,000 veces mayores que las concentraciones plasmáticas máximas obtenidas en el hombre con una dosis total de 5 mg. Además, las concentraciones empleadas en los estudios in vitro ( mol) no se pueden alcanzar en un sistema biológico. En un ensayo de aberración cromosómica in vivo en ratones no se observó ningún aumento de las aberraciones cromosómicas relacionado con el tratamiento administrando la finasterida a la máxima dosificación tolerada (250 mg/kg/día, 2,500 veces mayor que la de 5 mg diarios recomendada en seres humanos). ESTUDIOS SOBRE LA REPRODUCCIÓN En conejos machos sexualmente maduros tratados con 80 mg/kg/día de finasterida (800 veces más que la dosis de 5 mg diarios recomendada en seres humanos) hasta por 12 semanas, no se observó ningún efecto sobre la fertilidad, el número de espermatozoides ni el volumen de la eyaculación. En ratas machos sexualmente maduras tratadas con esa misma dosificación de finasterida, no hubo ningún efecto significativo sobre la fertilidad después de 6 ó 12 semanas de tratamiento; sin embargo, cuando se prolongó éste hasta 24 ó 30 semanas, se notó una disminución de la fertilidad y de la fecundidad, acompañada de una reducción significativa de los pesos de las vesículas seminales y de la próstata. Todos estos efectos fueron reversibles en las seis semanas siguientes a la suspensión del tratamiento. La disminución de la fertilidad en las ratas tratadas con finasterida es secundaria al efecto de éste sobre los órganos sexuales accesorios (próstata y vesículas seminales), que impide que se forme el tapón seminal indispensable para la fertilidad normal de las ratas. Este efecto no tiene importancia en el hombre, en el cual no se forman tapones copulatorios. No se ha observado en las ratas ni en los conejos ningún efecto relacionado con el medicamento sobre los testículos o el apareamiento.
13 ESTUDIOS SOBRE EL DESARROLLO FETAL Se observó hipospadias con una incidencia de 3.6 a 100%, dependiendo de la dosis, en los fetos machos de ratas embarazadas que recibieron finasterida a dosis que variaron entre 100 g/kg/día y 100 mg/kg/día (1 a 1,000 veces más que la dosis de 5 mg diarios recomendada en los seres humanos). Además, las ratas embarazadas produjeron fetos machos con menor peso de la próstata y de las vesículas seminales, retraso de la separación del prepucio y crecimiento pasajero de los pezones cuando se les administró finasterida a dosis de 30 g/kg/día o más ( 30% de la dosis de 5 mg diarios recomendada en seres humanos), y con disminución de la distancia anogenital cuando se les suministraron dosis 3 mg/kg/día ( 3% de la de 5 mg diarios recomendada en seres humanos). Se ha determinado que el periodo crítico para la inducción de estos efectos en las ratas es los días de la gestación. Los cambios arriba descritos son efectos farmacológicos esperados de los inhibidores de la 5 -reductasa de tipo II. Muchos de los cambios observados en ratas machos expuestas in utero a la finasterida, como el hipospadias, son similares a los encontrados en niños varones con deficiencia genética de 5 -reductasa de tipo II. No se observó ningún efecto en las hembras expuestas in utero a la finasterida, con ninguna de las dosificaciones empleadas. La administración de finasterida a ratas (3 mg/kg/día, 30 veces más que la dosis de 5 mg diarios recomendada en seres humanos) durante la última etapa de la gestación y el periodo de lactancia ocasiona una ligera disminución de la fertilidad en los machos de la primera generación. No se ha observado ninguna anormalidad del desarrollo en las crías machos o hembras de la primera generación como resultado del apareamiento de ratas machos tratadas con finasterida (80 mg/kg/día, 800 veces más que la dosis de 5 mg diarios recomendada en seres humanos) con hembras no tratadas. No se ha observado ningún indicio de malformaciones en fetos de conejo expuestos a la finasterida in utero del día 6 al día 18 de la gestación, a dosis de hasta 100 mg/kg/día (1,000 veces más que la dosis de 5 mg diarios recomendada en seres humanos). Los efectos de la exposición a la finasterida in utero durante el periodo embrionario y el desarrollo fetal fueron evaluados en monos rhesus (días 20 a 100 de la gestación), por ser éstos una especie más predictiva del desarrollo fetal humano que los conejos o las ratas. La administración intravenosa de finasterida a monas embarazadas a dosis tan altas como 800 ng/día (por lo menos 60 a 120 veces mayores que la exposición más alta estimada de mujeres embarazadas a la finasterida existente en el semen de hombres que estén tomando 5 mg diarios) no produjo malformaciones en los fetos masculinos. Como confirmación de la importancia del modelo del mono rhesus respecto al desarrollo fetal humano, la administración a monas embarazadas de dosis orales muy altas de finasterida (2 mg/kg/día; 20 veces más que la dosis de 5 mg diarios recomendada en seres humanos, o aproximadamente 1-2 millones de veces más que la exposición más alta estimada de mujeres embarazadas a la finasterida existente en el semen de hombres que estén tomando 5 mg diarios) produjo anormalidades de los órganos genitales externos en los fetos masculinos. No se observó ninguna otra anormalidad en los fetos masculinos ni anormalidades relacionadas con la finasterida en los fetos femeninos con ninguna de las dosis empleadas. XIII. DOSIS Y VÍA DE ADMINISTRACIÓN La dosificación recomendada de PROSCAR es de una tableta de 5 mg al día, con o sin alimentos. PROSCAR puede ser administrado solo o en combinación con el bloqueador alfa doxazosina (véase ESTUDIOS CLÍNICOS en la INFORMACIÓN COMPLEMENTARIA). DOSIFICACIÓN EN LA INSUFICIENCIA RENAL No es necesario hacer ningún ajuste de la dosificación en pacientes con diversos grados de insuficiencia renal (con depuraciones de la creatinina tan bajas como 9 ml/min), pues los estudios farmacocinéticos no indicaron ningún cambio en la eliminación de la finasterida.
14 DOSIFICACIÓN EN LOS PACIENTES DE EDAD AVANZADA No es necesario hacer ningún ajuste de la dosificación, aunque los estudios farmacocinéticos indicaron que la eliminación de la finasterida está un tanto disminuida en los pacientes mayores de 70 años. XIV. SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL (ANTÍDOTOS) Los pacientes han recibido dosis únicas de PROSCAR de hasta 400 mg y dosis múltiples de hasta 80 mg diarios durante tres meses sin efectos adversos. No se recomienda ningún tratamiento específico para la sobredosificación de PROSCAR. XV. PRESENTACION Caja con 30 tabletas de 5 mg. XVI. RECOMENDACIONES PARA EL ALMACENAMIENTO Consérvese a temperatura ambiente a no más de 30 C y en lugar seco. Protéjase de la luz. Las mujeres embarazadas o que pueden embarazarse no deben manipular tabletas rotas de PROSCAR (véase 6. CONTRAINDICACIONES, 8. PRECAUCIONES O RESTRICCIONES DURANTE EL EMBARAZO Y LA LACTANCIA, EMBARAZO Y EXPOSICIÓN A LA FINASTERIDA - RIESGO PARA EL FETO DE SEXO MASCULINO). XVII. LEYENDAS DE PROTECCIÓN Literatura exclusiva para médicos. Su venta requiere receta médica. No se deje al alcance de los niños. S-IPC-PSC-T XVIII. NOMBRE DEL LABORATORIO Y DIRECCIÓN Schering - Plough, S.A. de C.V. Av. 16 de Septiembre No. 301, Col. Xaltocan, C.P , Deleg. Xochimilco, D.F., México. XIX. No. REG. Y DE IPP Reg. No. 205M92 SSA IV No. IPP: ooo
INFORMACION PARA PRESCRIBIR AMPLIA
 INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre Comercial: TEALEP 2. Nombre Genérico: FINASTERIDA 3. Forma Farmacéutica y Formulación: Comprimidos. Cada comprimido contiene: Finasterida... 5 mg Excipiente
INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre Comercial: TEALEP 2. Nombre Genérico: FINASTERIDA 3. Forma Farmacéutica y Formulación: Comprimidos. Cada comprimido contiene: Finasterida... 5 mg Excipiente
Hipersensibilidad a cualquiera de los componentes de este producto.
 PROSCAR 5 mg TABLETAS RECUBIERTAS (Finasteride) PROSCAR (Finasteride) un compuesto sintético 4 azasteroide, es un inhibidor específico de la 5α - reductasa Tipo II, una enzima intracelular que metaboliza
PROSCAR 5 mg TABLETAS RECUBIERTAS (Finasteride) PROSCAR (Finasteride) un compuesto sintético 4 azasteroide, es un inhibidor específico de la 5α - reductasa Tipo II, una enzima intracelular que metaboliza
PROSCAR (finasterida) PROSCAR 5 mg cuya composición es: - Principio activo: Finasterida... 5 mg - Excipientes (ver 6.1), c.s.p...
 FICHA TÉCNICA IPC - 0199 Tracer No. PSC-E-20030237 01/03 PROSCAR (finasterida) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Esta especialidad se presenta como: PROSCAR 5 mg cuya composición es: - Principio
FICHA TÉCNICA IPC - 0199 Tracer No. PSC-E-20030237 01/03 PROSCAR (finasterida) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Esta especialidad se presenta como: PROSCAR 5 mg cuya composición es: - Principio
Finastar. FINASTAR (finasterida) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA. Esta especialidad se presenta como:
 Finastar FINASTAR (finasterida) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Esta especialidad se presenta como: FINASTAR 5 mg cuya composición es: - Principio activo: Finasterida 5 mg - Excipientes (ver
Finastar FINASTAR (finasterida) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Esta especialidad se presenta como: FINASTAR 5 mg cuya composición es: - Principio activo: Finasterida 5 mg - Excipientes (ver
EUCOPROST (finasterida)
 FICHA TÉCNICA para Médicos IPC 0997a Tracer No. PSC-E-14800 07/99 EUCOPROST (finasterida) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Esta especialidad se presenta como: EUCOPROST 5 mg cuya composición es:
FICHA TÉCNICA para Médicos IPC 0997a Tracer No. PSC-E-14800 07/99 EUCOPROST (finasterida) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Esta especialidad se presenta como: EUCOPROST 5 mg cuya composición es:
FICHA TÉCNICA. finasterida cinfa 5 mg comprimidos recubiertos con película EFG
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO finasterida cinfa 5 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 5 mg de finasterida Para
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO finasterida cinfa 5 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 5 mg de finasterida Para
FICHA TÉCNICA. FINASTERIDA BENEL 5 mg comprimidos recubiertos con película EFG
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO FINASTERIDA BENEL 5 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 5 mg de finasterida Para
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO FINASTERIDA BENEL 5 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 5 mg de finasterida Para
La posología recomendada es un comprimido diario de 5 mg, con o sin alimentos.
 1. NOMBRE DEL MEDICAMENTO PROSCAR 5 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 5 mg de finasterida. Excipientes con efecto conocido: 106,40
1. NOMBRE DEL MEDICAMENTO PROSCAR 5 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 5 mg de finasterida. Excipientes con efecto conocido: 106,40
PROYECTO DE PROSPECTO PROSCAR FINASTERIDE 5 mg Comprimidos Recubiertos
 INDUSTRIA NORTEAMERICANA PROYECTO DE PROSPECTO PROSCAR FINASTERIDE 5 mg Comprimidos Recubiertos VENTA BAJO RECETA FÓRMULA: Cada comprimido recubierto contiene: Finasteride... 5,0 mg Lactosa... 106,4 mg
INDUSTRIA NORTEAMERICANA PROYECTO DE PROSPECTO PROSCAR FINASTERIDE 5 mg Comprimidos Recubiertos VENTA BAJO RECETA FÓRMULA: Cada comprimido recubierto contiene: Finasteride... 5,0 mg Lactosa... 106,4 mg
FORMA FARMACÉUTICA Y FORMULACIÓN:
 Profidox * Tabletas (Finasteride/alfuzosina) FORMA FARMACÉUTICA Y FORMULACIÓN: Cada TABLETA contiene: Finasteride 5 mg Clorhidrato de alfuzosina 5 mg Excipiente, c.b.p. 1 tableta. INDICACIONES TERAPÉUTICAS:
Profidox * Tabletas (Finasteride/alfuzosina) FORMA FARMACÉUTICA Y FORMULACIÓN: Cada TABLETA contiene: Finasteride 5 mg Clorhidrato de alfuzosina 5 mg Excipiente, c.b.p. 1 tableta. INDICACIONES TERAPÉUTICAS:
FICHA TÉCNICA. Cada comprimido recubierto con película contiene 5 mg de finasterida.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida TecniGen 5 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 5 mg
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida TecniGen 5 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 5 mg
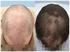
Finasterida está indicada para el tratamiento de las primeras fases de la alopecia androgenética en varones.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida Actavis 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida Actavis 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Finasterida RANBAXY 5mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida RANBAXY 5mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 5 mg de finasterida. Excipientes:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida RANBAXY 5mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 5 mg de finasterida. Excipientes:
PROPECIA FINASTERIDE 1 mg Comprimidos Recubiertos
 PROPECIA FINASTERIDE 1 mg Comprimidos Recubiertos INDUSTRIA NORTEAMERICANA VENTA BAJO RECETA FÓRMULA: Cada comprimido recubierto contiene: Finasteride 1 mg Lactosa Monohidrato 110,4 mg Celulosa Microcristalina
PROPECIA FINASTERIDE 1 mg Comprimidos Recubiertos INDUSTRIA NORTEAMERICANA VENTA BAJO RECETA FÓRMULA: Cada comprimido recubierto contiene: Finasteride 1 mg Lactosa Monohidrato 110,4 mg Celulosa Microcristalina
Repafet. Rupatadina Tabletas. Rupatadina II.- DENOMINACIÓN GENÉRICA: III.- FORMA FARMACÉUTICA Y FORMULACIÓN:
 Repafet Rupatadina Tabletas II.- DENOMINACIÓN GENÉRICA: Rupatadina III.- FORMA FARMACÉUTICA Y FORMULACIÓN: Cada tableta contiene: Fumarato de Rupatadina equivalente a... 10 mg de Rupatadina Excipiente
Repafet Rupatadina Tabletas II.- DENOMINACIÓN GENÉRICA: Rupatadina III.- FORMA FARMACÉUTICA Y FORMULACIÓN: Cada tableta contiene: Fumarato de Rupatadina equivalente a... 10 mg de Rupatadina Excipiente
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA EUSPC-PPC-T-102003/Final for Renewal N01 Tracer No. PPC-E-20033409 10/03 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DE LA ESPECIALIDAD
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA EUSPC-PPC-T-102003/Final for Renewal N01 Tracer No. PPC-E-20033409 10/03 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DE LA ESPECIALIDAD
PROSTENE. FINASTERIDE 5 mg. Comprimidos recubiertos Industria Argentina Venta bajo receta
 PROSTENE FINASTERIDE 5 mg Comprimidos recubiertos Industria Argentina Venta bajo receta FORMULA: Cada comprimido recubierto contiene: Finasteride 5 mg Excipientes: lactosa, dioctilsulfosuccinato de sodio,
PROSTENE FINASTERIDE 5 mg Comprimidos recubiertos Industria Argentina Venta bajo receta FORMULA: Cada comprimido recubierto contiene: Finasteride 5 mg Excipientes: lactosa, dioctilsulfosuccinato de sodio,
FICHA TÉCNICA. Comprimidos recubiertos blancos, redondos y marcados con F y 5 en una de las caras.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida ratiopharm 5 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 5
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida ratiopharm 5 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 5
FICHAS TÉCNICAS. Finasterida NORMON 1 mg comprimidos recubiertos con película EFG Finasterida NORMON 5 mg comprimidos recubiertos con película EFG
 FICHAS TÉCNICAS Finasterida NORMON 1 mg comprimidos recubiertos con película EFG Finasterida NORMON 5 mg comprimidos recubiertos con película EFG RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL
FICHAS TÉCNICAS Finasterida NORMON 1 mg comprimidos recubiertos con película EFG Finasterida NORMON 5 mg comprimidos recubiertos con película EFG RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL
FICHA TECNICA. Comprimido recubierto con película redondo, de color rosa anaranjado, grabado con el logo 'F1' en una de las caras.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO CELGANOL 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg de finasterida.
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO CELGANOL 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg de finasterida.
Datos: Propecia está aprobado para tratar la calvicie masculina.
 Comunicación de seguridad de Medicamentos de la FDA: la 5-alfa reductasa (5-ARI) puede aumentar el riesgo de una forma más grave de cáncer de próstata. Datos: Inhibidores de la 5-alfa-reductasa son un
Comunicación de seguridad de Medicamentos de la FDA: la 5-alfa reductasa (5-ARI) puede aumentar el riesgo de una forma más grave de cáncer de próstata. Datos: Inhibidores de la 5-alfa-reductasa son un
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
LLD Abreviado de Zoloft. Todo medicamento debe conservarse fuera del alcance de los niños.
 LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TÉCNICA. Cada comprimido recubierto con película contiene 1 mg de finasterida como componente activo.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida Actavis 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida Actavis 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
Finasterida NORMON 1 mg comprimidos recubiertos con película EFG. Un comprimido recubierto contiene 1 mg de finasterida.
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Finasterida NORMON 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Finasterida NORMON 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto
Prospecto: información para el usuario
 Prospecto: información para el usuario FINASTERIDA QUALIGEN 5 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el usuario FINASTERIDA QUALIGEN 5 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
No hay evidencia de que un aumento de la dosis resulte en un aumento de la eficacia.
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lambdaxel 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto contiene
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lambdaxel 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto contiene
GO Sildenafil Tabletas
 GO Sildenafil Tabletas FORMA FARMACÉUTICA Y FORMULACIÓN: Cada TABLETA contiene: Citrato de sildenafil equivalente a 25, 50 y 100 mg de sildenafil Excipiente cbp 1 tableta Cada TABLETA (orodispersable)
GO Sildenafil Tabletas FORMA FARMACÉUTICA Y FORMULACIÓN: Cada TABLETA contiene: Citrato de sildenafil equivalente a 25, 50 y 100 mg de sildenafil Excipiente cbp 1 tableta Cada TABLETA (orodispersable)
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 BROMHEXINA 4 mg/5 ml JARABE MUCOLÍTICO, EXPECTORANTE Página 1 BROMHEXINA 4 mg/5 ml Jarabe Principio Activo Bromhexina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 BROMHEXINA 4 mg/5 ml JARABE MUCOLÍTICO, EXPECTORANTE Página 1 BROMHEXINA 4 mg/5 ml Jarabe Principio Activo Bromhexina
Paracetamol DC 90 equivalente a mg de Paracetamol
 INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre comercial: TAFIROL 2. Nombre genérico PARACETAMOL 3. Forma farmacéutica y formulación: Cada tableta contiene: Paracetamol DC 90 equivalente a. 1000 mg de Paracetamol
INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre comercial: TAFIROL 2. Nombre genérico PARACETAMOL 3. Forma farmacéutica y formulación: Cada tableta contiene: Paracetamol DC 90 equivalente a. 1000 mg de Paracetamol
Comprimido recubierto con película convexo, octogonal, color canela, grabado con el logo P en una cara y PROPECIA en la otra.
 1. NOMBRE DEL MEDICAMENTO Propecia 1 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1 mg de finasterida. Excipientes con efecto conocido: Cada
1. NOMBRE DEL MEDICAMENTO Propecia 1 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1 mg de finasterida. Excipientes con efecto conocido: Cada
MEGAPLEX 160mg. Nombre Comercial. Megaplex 160mg. Nombre Genérico. Acetato de Megestrol 160mg. Concentración. 160mg. Denominación Común Internacional
 MEGAPLE 160mg 1. Identificación del Medicamento Nombre Comercial Megaplex 160mg Nombre Genérico Acetato de Megestrol 160mg Concentración 160mg Denominación Común Internacional Acetato de Megestrol N Registro
MEGAPLE 160mg 1. Identificación del Medicamento Nombre Comercial Megaplex 160mg Nombre Genérico Acetato de Megestrol 160mg Concentración 160mg Denominación Común Internacional Acetato de Megestrol N Registro
No. el alcohol no altera el mecanismo de acción o los efectos del Andanza.
 GUÍA SOBRE 1 1. Qué es Es un fármaco aprobado para su uso como adyuvante, del plan alimentario hipocalórico y la práctica de ejercicio, en el manejo del sobrepeso y la obesidad en adolescentes y adultos.
GUÍA SOBRE 1 1. Qué es Es un fármaco aprobado para su uso como adyuvante, del plan alimentario hipocalórico y la práctica de ejercicio, en el manejo del sobrepeso y la obesidad en adolescentes y adultos.
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
Finasterida STADA 1 mg comprimidos recubiertos con película EFG
 1. NOMBRE DEL MEDICAMENTO Finasterida STADA 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: finasterida. Cada comprimido recubierto con película
1. NOMBRE DEL MEDICAMENTO Finasterida STADA 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: finasterida. Cada comprimido recubierto con película
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TÉCNICA. Cada comprimido recubierto con película contiene 1 mg de finasterida.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ALOCARE 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg de finasterida.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ALOCARE 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg de finasterida.
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox
 TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SUPOSITORIO BRONQUIAL LACTANTE SUPOSITORIO ANALGÉSICO, EXPECTORANTE BALSÁMICO Página 1 SUPOSITORIO BRONQUIAL LACTANTE
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SUPOSITORIO BRONQUIAL LACTANTE SUPOSITORIO ANALGÉSICO, EXPECTORANTE BALSÁMICO Página 1 SUPOSITORIO BRONQUIAL LACTANTE
FICHA TÉCNICA. La duración estimada del tratamiento será de dos semanas.
 FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD UVALETTE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Contenido por comprimido recubierto: - 120,00 mg de extracto seco etanólico al 30%, de planta entera de Taraxacum
FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD UVALETTE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Contenido por comprimido recubierto: - 120,00 mg de extracto seco etanólico al 30%, de planta entera de Taraxacum
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
CENAVUL Suspensión inyectable
 Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
Reg. S.A.G.A.R.P.A. Q-0042-368. Indicaciones principales Ypozane para el tratamiento médico de la Hiperplasia Prostática Benigna (HPB).
 Ypozane Reg. S.A.G.A.R.P.A. Q-0042-368 Qué es Ypozane? Acetato de osaterona, primer antiandrógeno veterinario. Indicaciones principales Ypozane para el tratamiento médico de la Hiperplasia Prostática Benigna
Ypozane Reg. S.A.G.A.R.P.A. Q-0042-368 Qué es Ypozane? Acetato de osaterona, primer antiandrógeno veterinario. Indicaciones principales Ypozane para el tratamiento médico de la Hiperplasia Prostática Benigna
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA. Gotas Óticas. Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g.
 DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
tasa de retención urinaria que conduce próstata; acción de la primeros se normales
 Definición La Hiperplasia Prostática Benigna (HPB) es una enfermedad progresiva asociada a síntomas molestos del tracto urinario inferior como aumento de la frecuencia urinaria, urgencia, nocturia, chorro
Definición La Hiperplasia Prostática Benigna (HPB) es una enfermedad progresiva asociada a síntomas molestos del tracto urinario inferior como aumento de la frecuencia urinaria, urgencia, nocturia, chorro
INFORMACION PARA RESCRIBIR AMPLIA
 INFORMACION PARA RESCRIBIR AMPLIA BEZAFISAL MR BEZAFIBRATO Agente antilipidémico Laboratorios Cryopharma, S.A. de C.V INFORMACIÓN PARA PRESCRIBIR AMPLIA 1. NOMBRE COMERICAL Y GENÉRICO 1.1 Nombre comercial:
INFORMACION PARA RESCRIBIR AMPLIA BEZAFISAL MR BEZAFIBRATO Agente antilipidémico Laboratorios Cryopharma, S.A. de C.V INFORMACIÓN PARA PRESCRIBIR AMPLIA 1. NOMBRE COMERICAL Y GENÉRICO 1.1 Nombre comercial:
Usos de fármacos durante el embarazo y la lactancia
 Usos de fármacos durante el embarazo y la lactancia -Son situaciones farmacocinéticas especiales. -En estos estados fisiológicos los fármacos actúan de diferente manera. *Fármacos administrados a la madre
Usos de fármacos durante el embarazo y la lactancia -Son situaciones farmacocinéticas especiales. -En estos estados fisiológicos los fármacos actúan de diferente manera. *Fármacos administrados a la madre
FICHA TÉCNICA. Tratamiento de la incontinencia urinaria asociada a la insuficiencia del esfínter uretral en la perra.
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
,,. - - -j BUENOSAIRES, de la Administración Nacional de Medicamentos, Alimentos y Tecnología
 , ~desaiad Swreú/JÚ4 de 1'0fitiu4, ; ~«tadó.ee 1~ A.1t, m.a. 7, DISPOSICION,,. - - -j No 7740 BUENOSAIRES, 18 ole 2013 VISTO el Expediente NO 1-0047-0000-018483-13-1 del Registro de la Administración Nacional
, ~desaiad Swreú/JÚ4 de 1'0fitiu4, ; ~«tadó.ee 1~ A.1t, m.a. 7, DISPOSICION,,. - - -j No 7740 BUENOSAIRES, 18 ole 2013 VISTO el Expediente NO 1-0047-0000-018483-13-1 del Registro de la Administración Nacional
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Información Para Prescripción Amplia EFUDIX
 Información Para Prescripción Amplia EFUDIX Crema Fluorouracilo FORMA FARMACÉUTICA Y FORMULACIÓN: Cada 100 g contienen: Fluorouracilo 5 g. Excipiente cbp 100 g. INDICACIONES TERAPÉUTICAS: Dermatológicas:
Información Para Prescripción Amplia EFUDIX Crema Fluorouracilo FORMA FARMACÉUTICA Y FORMULACIÓN: Cada 100 g contienen: Fluorouracilo 5 g. Excipiente cbp 100 g. INDICACIONES TERAPÉUTICAS: Dermatológicas:
I.- META DEL TRATAMIENTO= NORMALIZAR NIVELES TSH SIN IMPORTAR CUAL ES LA CAUSA DEL HIPOTIROIDISMO.
 HIPOTIROIDISMO I.- META DEL TRATAMIENTO= NORMALIZAR NIVELES TSH SIN IMPORTAR CUAL ES LA CAUSA DEL HIPOTIROIDISMO. LA VARIABILIDAD DE REQUERIMIENTOS DOSIS DEPENDE DE FACTORES QUE INTERFIEREN EN SU ABSORCION
HIPOTIROIDISMO I.- META DEL TRATAMIENTO= NORMALIZAR NIVELES TSH SIN IMPORTAR CUAL ES LA CAUSA DEL HIPOTIROIDISMO. LA VARIABILIDAD DE REQUERIMIENTOS DOSIS DEPENDE DE FACTORES QUE INTERFIEREN EN SU ABSORCION
Prospecto: Información para el usuario. Finasteridaratiopharm 5 mg comprimidos recubiertos con película EFG
 Prospecto: Información para el usuario Finasteridaratiopharm 5 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información
Prospecto: Información para el usuario Finasteridaratiopharm 5 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información
INTRODUCCIÓN. Otras investigaciones mostraron que el incremento de la glicemia basal en ayunas en hipertiroideos fue más alta que en normales (4,5,6).
 INTRODUCCIÓN La alteración en el metabolismo de la glucosa ha sido descrita en pacientes con hipertiroidismo; muchas investigaciones se han realizado al respecto, siendo sus resultados controversiales.
INTRODUCCIÓN La alteración en el metabolismo de la glucosa ha sido descrita en pacientes con hipertiroidismo; muchas investigaciones se han realizado al respecto, siendo sus resultados controversiales.
FICHA TÉCNICA. Azelastina hidrocloruro al 0,05% (0,5 mg/ml). Cada gota contiene 0,015 mg de azelastina hidrocloruro
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SILDENAFIL PARA HOMBRES 50 mg COMPRIMIDOS RECUBIERTOS PARA LA DISFUNCIÓN ERÉCTIL Página 1 SILDENAFIL PARA HOMBRES
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SILDENAFIL PARA HOMBRES 50 mg COMPRIMIDOS RECUBIERTOS PARA LA DISFUNCIÓN ERÉCTIL Página 1 SILDENAFIL PARA HOMBRES
INTERFERENCIAS POR FÁRMACOS EN ANÁLISIS CLÍNICOS DEPARTAMENTO EDUCATIVO BIOSYSTEMS BOLETÍN NUMERO 3
 INTERFERENCIAS POR FÁRMACOS EN ANÁLISIS CLÍNICOS DEPARTAMENTO EDUCATIVO BIOSYSTEMS BOLETÍN NUMERO 3 En este tercer ejemplar del Boletín de Interferencias por Fármacos en pruebas clínicas, detallaremos
INTERFERENCIAS POR FÁRMACOS EN ANÁLISIS CLÍNICOS DEPARTAMENTO EDUCATIVO BIOSYSTEMS BOLETÍN NUMERO 3 En este tercer ejemplar del Boletín de Interferencias por Fármacos en pruebas clínicas, detallaremos
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
PREVENCIÓN Y DIAGNÓSTICO DE CÁNCER DE PRÓSTATA. Dr. Fernando Quiroa Vera Departamento de Urología INEN 2013
 PREVENCIÓN Y DIAGNÓSTICO DE CÁNCER DE PRÓSTATA Dr. Fernando Quiroa Vera Departamento de Urología INEN 2013 Prevención No se puede explicar con certeza porque unas personas sufren cáncer y otras no Se estudian
PREVENCIÓN Y DIAGNÓSTICO DE CÁNCER DE PRÓSTATA Dr. Fernando Quiroa Vera Departamento de Urología INEN 2013 Prevención No se puede explicar con certeza porque unas personas sufren cáncer y otras no Se estudian
FICHA TÉCNICA. Finasterida SwanPond Investments 1 mg comprimidos recubiertos con película EFG
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida SwanPond Investments 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1 mg de finasterida.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida SwanPond Investments 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1 mg de finasterida.
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ULCERGOLD 370 mg/g PASTA ORAL PARA EQUINO 2. COMPOSICIÓN CUALITATIVA Y
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ULCERGOLD 370 mg/g PASTA ORAL PARA EQUINO 2. COMPOSICIÓN CUALITATIVA Y
Es la segunda causa de muerte en Chile y se ha convertido en una de las enfermedades más temidas entre los hombres mayores de 40 años.
 Es la segunda causa de muerte en Chile y se ha convertido en una de las enfermedades más temidas entre los hombres mayores de 40 años. En este documento ayudamos a entender de qué se trata el cáncer de
Es la segunda causa de muerte en Chile y se ha convertido en una de las enfermedades más temidas entre los hombres mayores de 40 años. En este documento ayudamos a entender de qué se trata el cáncer de
UNIDAD DE UROLOGÍA Dr. ALEJANDRO EGEA
 UNIDAD DE UROLOGÍA Dr. ALEJANDRO EGEA Qué es la próstata? La próstata es un órgano del tamaño de una nuez que rodea la parte inferior de la vejiga masculina frente al recto. La próstata produce los fluidos
UNIDAD DE UROLOGÍA Dr. ALEJANDRO EGEA Qué es la próstata? La próstata es un órgano del tamaño de una nuez que rodea la parte inferior de la vejiga masculina frente al recto. La próstata produce los fluidos
INFORMACION PARA PRESCRIBIR REDUCIDA
 INFORMACION PARA PRESCRIBIR REDUCIDA 1. Nombre Comercial: NABRATIN 2. Nombre Genérico: CLOPIDOGREL 3. Forma Farmacéutica y Formulación: Tabletas. Cada tableta contiene: Bisulfato de Clopidogrel equivalente
INFORMACION PARA PRESCRIBIR REDUCIDA 1. Nombre Comercial: NABRATIN 2. Nombre Genérico: CLOPIDOGREL 3. Forma Farmacéutica y Formulación: Tabletas. Cada tableta contiene: Bisulfato de Clopidogrel equivalente
1. NOMBRE DEL MEDICAMENTO. Doxazosina COMBINO PHARM 2 mg comprimidos EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO Doxazosina COMBINO PHARM 2 mg comprimidos EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 2 mg de doxazosina (mesilato). Para excipientes, ver 6.1. 3. FORMA FARMACEUTICA Comprimidos
1. NOMBRE DEL MEDICAMENTO Doxazosina COMBINO PHARM 2 mg comprimidos EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 2 mg de doxazosina (mesilato). Para excipientes, ver 6.1. 3. FORMA FARMACEUTICA Comprimidos
FICHA TECNICA FAMOTIDINA ESTEVE, E.F.G. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 FICHA TECNICA FAMOTIDINA ESTEVE, E.F.G. 1. NOMBRE DEL MEDICAMENTO FAMOTIDINA ESTEVE 20 mg Comprimidos EFG FAMOTIDINA ESTEVE 40 mg Comprimidos EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TECNICA FAMOTIDINA ESTEVE, E.F.G. 1. NOMBRE DEL MEDICAMENTO FAMOTIDINA ESTEVE 20 mg Comprimidos EFG FAMOTIDINA ESTEVE 40 mg Comprimidos EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido
CONTROVERSIAS HIPERTENSION PULMONAR
 CONTROVERSIAS HIPERTENSION PULMONAR Mª Carmen Torreiro Penas Hospital Xeral-Calde Lugo Eficacia/precio de los fármacos f aprobados? Es necesario evaluar los fármacos f aprobados? TRATAMIENTO Importantes
CONTROVERSIAS HIPERTENSION PULMONAR Mª Carmen Torreiro Penas Hospital Xeral-Calde Lugo Eficacia/precio de los fármacos f aprobados? Es necesario evaluar los fármacos f aprobados? TRATAMIENTO Importantes
FICHA TÉCNICA. Finasterida ratiopharm 1 mg comprimidos recubiertos con película EFG.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida ratiopharm 1 mg comprimidos recubiertos con película EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida ratiopharm 1 mg comprimidos recubiertos con película EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene
Versión Electrónica. Enero 2007 GUÍA DE DIAGNÓSTICO Y TRATAMIENTO DEL CANCER DE PROSTATA
 Versión Electrónica. Enero 2007 GUÍA DE DIAGNÓSTICO Y TRATAMIENTO DEL CANCER DE PROSTATA Colectivo de Autores: Cirugía: Dr. Jorge González Hernández, Dr. Antonio Bouzo López, Dr. Celestino Labori Cardas
Versión Electrónica. Enero 2007 GUÍA DE DIAGNÓSTICO Y TRATAMIENTO DEL CANCER DE PROSTATA Colectivo de Autores: Cirugía: Dr. Jorge González Hernández, Dr. Antonio Bouzo López, Dr. Celestino Labori Cardas
PRINCIPIO Y FIN DE LA VIDA REPRODUCTIVA. Cambios puberales y menopausia.
 PRINCIPIO Y FIN DE LA VIDA REPRODUCTIVA Cambios puberales y menopausia. Definiciones Adrenarquia: Incremento de la secreción de andrógenos por las glándulas adrenales. Ocurre entre los 5 y los 20 años.
PRINCIPIO Y FIN DE LA VIDA REPRODUCTIVA Cambios puberales y menopausia. Definiciones Adrenarquia: Incremento de la secreción de andrógenos por las glándulas adrenales. Ocurre entre los 5 y los 20 años.
ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO
 Toxicología alimentaria Diplomatura de Nutrición humana y dietética Curso 2010-2011 ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO Dr. Jesús Miguel Hernández-Guijo Dpto. Farmacología
Toxicología alimentaria Diplomatura de Nutrición humana y dietética Curso 2010-2011 ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO Dr. Jesús Miguel Hernández-Guijo Dpto. Farmacología
Injuria renal aguda en pacientes pos operados de hipertrofia benigna de próstata R2 LOZANO ESPINOZA NORIS
 Injuria renal aguda en pacientes pos operados de hipertrofia benigna de próstata R2 LOZANO ESPINOZA NORIS INTRODUCCION La Injuria Renal Aguda (IRA) es una patología frecuente en la población hospitalizada
Injuria renal aguda en pacientes pos operados de hipertrofia benigna de próstata R2 LOZANO ESPINOZA NORIS INTRODUCCION La Injuria Renal Aguda (IRA) es una patología frecuente en la población hospitalizada
4.2 Indicaciones de uso, especificando las especies a las que va destinado
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 5 mg/ml solución inyectable para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Principio activo: Meloxicam Excipientes:
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 5 mg/ml solución inyectable para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Principio activo: Meloxicam Excipientes:
PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE
FICHA TÉCNICA. KETOISDIN 400 mg óvulos está indicado en adultos para el tratamiento local de
 1. NOMBRE DEL MEDICAMENTO KETOISDIN 400 mg óvulos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada óvulo contiene: 400 mg de ketoconazol Excipientes con efecto conocido: Butilhidroxianisol
1. NOMBRE DEL MEDICAMENTO KETOISDIN 400 mg óvulos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada óvulo contiene: 400 mg de ketoconazol Excipientes con efecto conocido: Butilhidroxianisol
Control del sangrado. Artículo: Hemorragia por Warfarina (Cortesía de IntraMed.com)
 Control del sangrado En este gran estudio de cohorte de pacientes mayores con fibrilación auricular se halló que las tasas de hemorragia por tratamiento con warfarina son más elevadas durante los primeros
Control del sangrado En este gran estudio de cohorte de pacientes mayores con fibrilación auricular se halló que las tasas de hemorragia por tratamiento con warfarina son más elevadas durante los primeros
Plan de Estudios: 509 Licenciado/a en Medicina. Asignatura: Farmacología clínica. Itinerario de la asignatura: Quinto curso
 Licenciatura en Medicina - Facultad de Medicina Plan de Estudios: 509 Licenciado/a en Medicina Asignatura: 29098 Farmacología clínica Itinerario de la asignatura: Quinto curso Curso académico: 2010 2011
Licenciatura en Medicina - Facultad de Medicina Plan de Estudios: 509 Licenciado/a en Medicina Asignatura: 29098 Farmacología clínica Itinerario de la asignatura: Quinto curso Curso académico: 2010 2011
Eni* Tabletas e Inyectable. Ciprofloxacino
 Tabletas e Inyectable Ciprofloxacino Descripción Es ciprofloxacino, la fluoroquinolona bactericida potente, con amplio espectro antibacteriano que incluye grampositivos y gramnegativos. Tiene alta eficacia
Tabletas e Inyectable Ciprofloxacino Descripción Es ciprofloxacino, la fluoroquinolona bactericida potente, con amplio espectro antibacteriano que incluye grampositivos y gramnegativos. Tiene alta eficacia
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. ACICLOVIR COMBIX 800 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ACICLOVIR COMBIX 800 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de 800 mg contiene: Aciclovir (DCI) 800 mg. 3. FORMA FARMACÉUTICA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ACICLOVIR COMBIX 800 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de 800 mg contiene: Aciclovir (DCI) 800 mg. 3. FORMA FARMACÉUTICA
FICHA TÉCNICA. Cada gramo de crema de Aciclovir Sandoz 50 mg/g crema contiene 50 mg de aciclovir.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Sandoz 50 mg/g crema EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema de Aciclovir Sandoz 50 mg/g crema contiene 50 mg de aciclovir. Excipientes
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Sandoz 50 mg/g crema EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema de Aciclovir Sandoz 50 mg/g crema contiene 50 mg de aciclovir. Excipientes
Efectos de la ingesta diaria de una leche fermentada enriquecida con fitoesteroles sobre:
 E S T U D I O C L Í N I C O Efectos de un producto lácteo enriquecido con fitoesteroles sobre los lípidos, esteroles y 8-isoprostano, en pacientes hipercolesterolémicos: un estudio Italiano multicéntrico.
E S T U D I O C L Í N I C O Efectos de un producto lácteo enriquecido con fitoesteroles sobre los lípidos, esteroles y 8-isoprostano, en pacientes hipercolesterolémicos: un estudio Italiano multicéntrico.
Bonadoxina Meclozina/Piridoxina Tableta 25mg / 50mg
 INFORMACIÓN PARA PRESCRIBIR AMPLIA Bonadoxina Meclozina/Piridoxina Tableta 25mg / 50mg 1. DENOMINACIÓN DISTINTIVA BONADOXINA 2. DENOMINACIÓN GENÉRICA Meclozina/Piridoxina 3. FORMA FARMACÉUTICA Y FORMULACIÓN
INFORMACIÓN PARA PRESCRIBIR AMPLIA Bonadoxina Meclozina/Piridoxina Tableta 25mg / 50mg 1. DENOMINACIÓN DISTINTIVA BONADOXINA 2. DENOMINACIÓN GENÉRICA Meclozina/Piridoxina 3. FORMA FARMACÉUTICA Y FORMULACIÓN
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
Programa RIO Rimonabant en Obesidad Estudios clínicos
 Programa RIO Rimonabant en Obesidad Estudios clínicos Evaluación de eficacia y seguridad de Acomplia en más de 6.600 pacientes Buenos Aires, 25 de Agosto de 2005.- El Programa RIO (Rimonabant in Obesity,
Programa RIO Rimonabant en Obesidad Estudios clínicos Evaluación de eficacia y seguridad de Acomplia en más de 6.600 pacientes Buenos Aires, 25 de Agosto de 2005.- El Programa RIO (Rimonabant in Obesity,
9. Profilaxis de la ITU
 9. Profilaxis de la ITU 9.1. Profilaxis antibiótica en población pediátrica sin alteraciones estructurales y/o funcionales del tracto urinario comprobadas En lactantes y población pediátrica sin alteraciones
9. Profilaxis de la ITU 9.1. Profilaxis antibiótica en población pediátrica sin alteraciones estructurales y/o funcionales del tracto urinario comprobadas En lactantes y población pediátrica sin alteraciones
La infertilidad también está en el hombre
 La infertilidad también está en el hombre Al hablar de fertilidad son varias las preguntas que surgen alrededor del tema, especialmente cuando ese deseo natural de tener hijos y formar una familia se torna
La infertilidad también está en el hombre Al hablar de fertilidad son varias las preguntas que surgen alrededor del tema, especialmente cuando ese deseo natural de tener hijos y formar una familia se torna
DETECCIÓN PRECOZ DEL CÁNCER DE PRÓSTATA
 SUBSECRETARÍA DE SALUD PÚBLICA DIVISIÓN PREVENCIÓN Y CONTROL D ENFERMEDADES DEPTO. ENFERMEDADES NO TRANSMISIBLES UNIDAD DE CANCER DETECCIÓN PRECOZ DEL CÁNCER DE PRÓSTATA El Cáncer de Próstata ha aumentado
SUBSECRETARÍA DE SALUD PÚBLICA DIVISIÓN PREVENCIÓN Y CONTROL D ENFERMEDADES DEPTO. ENFERMEDADES NO TRANSMISIBLES UNIDAD DE CANCER DETECCIÓN PRECOZ DEL CÁNCER DE PRÓSTATA El Cáncer de Próstata ha aumentado
CHECK UP COMPLETO FEMENINO HISTORIA CLÍNICA COMPLETA Y EXPLORACIÓN FÍSICA CHECK UP COMPLETO TOTAL $ 11,500.00
 CHECK UP COMPLETO FEMENINO HISTORIA CLÍNICA OFTALMOLOGIA OTORRINOLARINGOLOGIA GINECOLOGÍA LABORATORIO AUDIOMETRIA Y ESPIROMETRÍA Y PRUEBA DE ESFUERZO PAPANICOLAU, EXPLORACIÓN DE MAMAS, US PÉLVICO Y EXPLORACIÓN
CHECK UP COMPLETO FEMENINO HISTORIA CLÍNICA OFTALMOLOGIA OTORRINOLARINGOLOGIA GINECOLOGÍA LABORATORIO AUDIOMETRIA Y ESPIROMETRÍA Y PRUEBA DE ESFUERZO PAPANICOLAU, EXPLORACIÓN DE MAMAS, US PÉLVICO Y EXPLORACIÓN
PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg
 PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg Lea cuidadosamente este folleto antes de la administración de este medicamento, contiene información importante acerca de su tratamiento. Si
PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg Lea cuidadosamente este folleto antes de la administración de este medicamento, contiene información importante acerca de su tratamiento. Si
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CALCIO-500 D COMPRIMIDOS RECUBIERTOS SUPLEMENTO MINERAL Página 1 CALCIO-500 D Comprimidos Recubiertos Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CALCIO-500 D COMPRIMIDOS RECUBIERTOS SUPLEMENTO MINERAL Página 1 CALCIO-500 D Comprimidos Recubiertos Principio
DIVISIÓN DE RECTORIA Y REGULACIÓN DEPARTAMENTO SALUD DE LAS PERSONAS UNIDAD DE CÁNCER EL CÁNCER DE PRÓSTATA...
 DIVISIÓN DE RECTORIA Y REGULACIÓN DEPARTAMENTO SALUD DE LAS PERSONAS UNIDAD DE CÁNCER GUÍA DE INFORMACIÓN AL PÚBLICO EL CÁNCER DE PRÓSTATA... El Cáncer de Próstata ha aumentado en el mundo en los últimos
DIVISIÓN DE RECTORIA Y REGULACIÓN DEPARTAMENTO SALUD DE LAS PERSONAS UNIDAD DE CÁNCER GUÍA DE INFORMACIÓN AL PÚBLICO EL CÁNCER DE PRÓSTATA... El Cáncer de Próstata ha aumentado en el mundo en los últimos
MINOVAG MR NOVAG. Comprimidos
 MINOVAG MR NOVAG Comprimidos Denominación genérica: Secnidazol.!Forma farmacéutica y formulación: Comprimidos. Cada comprimido contiene: secnidazol 500 mg. Excipiente cbp 1 comprimido.!indicaciones terapéuticas:
MINOVAG MR NOVAG Comprimidos Denominación genérica: Secnidazol.!Forma farmacéutica y formulación: Comprimidos. Cada comprimido contiene: secnidazol 500 mg. Excipiente cbp 1 comprimido.!indicaciones terapéuticas:
