TRABAJO PRÁCTICO DE LABORATORIO N 3 SIEMBRAS Y TRANSPLANTES I
|
|
|
- Fernando Correa de la Fuente
- hace 6 años
- Vistas:
Transcripción
1 TRABAJO PRÁCTICO DE LABORATORIO N 3 SIEMBRAS Y TRANSPLANTES I OBJETIVOS - Reconocer la presencia de los gérmenes en todos los hábitats naturales, en los animales y los seres humanos. - Conocer los distintos instrumentos, materiales y medios de cultivo que se utilizan más frecuentemente en el Laboratorio de Microbiología durante la siembra y transplante de microorganismos - Adquirir conocimiento y destreza en el manejo de la técnica aséptica INTRODUCCIÓN TEÓRICA Siembra: se entiende por siembra al acto de transferir o colocar un microorganismo en un medio de cultivo adecuado. La transferencia se efectúa desde el hábitat natural (nicho ecológico) al medio de cultivo. Por ejemplo, se efectúan siembras desde distintos materiales biológicos (esputo, orina, materia fecal, etc.) cuando existe sospecha de infección y se desea aislar el agente causal. También se pueden efectuar siembras desde los más diversos materiales, por ej. agua, tierra, aire, etc. Con esto se demuestra la universalidad de los gérmenes. Transplante o repique: es la transferencia de gérmenes desde un medio de cultivo a otro. Se efectúan transplantes cuando se desea obtener un cultivo puro a partir de uno mixto, mantener cepas, o efectuar estudios químicos, bioquímicos o culturales. A. Con qué se siembra? Ansa -recta (en punta) -en anillo Pipetas -comunes (de 1, 2, 5, 10 y 25 ml)
2 -Pasteur Micropipetas de diferentes volúmenes: 2, 10, 20, 100, 200 y 1000 µl Espátula de Drigalski y palo de hockey para sembrar en superficies grandes (caja de Petri, botellas de Roux, etc.) Hisopo ídem anterior. B. En qué se siembra? Medios líquidos: sin agregado de agar-agar (0% de agente solidificante) Medios sólidos: contienen 1,5 2 % de agente solidificante, ej. agar nutritivo inclinado o en pico de flauta, agar nutritivo en caja de Petri. Medios semisólidos: con % de solidificante, ej. agar nutritivo blando, agar SIM. C. Cómo se siembra? Medios sólidos - placa de Petri: por extensión en superficie: con espátula de Drigalski por estrías: con ansa en anillo o ansa recta por placa vertida: inóculo más agar fundido y enfriado a C -en superficie inclinada (pico de flauta): por estrías o por contacto Medios semisólidos: por punción (con ansa recta) Medios líquidos: con ansa recta (el inóculo no debe generar turbidez en el momento de sembrar)
3 MATERIALES Y MÉTODOS Por cada grupo de dos alumnos: - Elementos de siembra: un ansa rectas y un ansa en anillo, hisopos estériles, frascos con tips estériles, micropipetas. - Material de vidrio preparado y esterilizado en el TP anterior: 3 placas de Petri, 1 frasco con tips, 2 pipetas estériles, un tubo de hemólisis estéril. - Frascos de descarte con lavandina al 10% - Medios de cultivo: 3 agar nutritivo derecho, 2 agar nutritivo inclinado, 1 agar SIM (semisólido o blando), 1 caldo nutritivo. - Agar sangre: se prepara según se detalla en TP Medios de cultivo. - Botellas con SF: solución fisiólogica estéril (NaCl al 0.9% en agua destilada) - Cámara de bioseguridad tipo II. - Recipiente para realizar microaerofilia - Alcohol yodado y algodón. Repasador. - Elementos de protección personal: guaradapolvo, guantes, barbijo. A. Algunos elementos de siembra utilizados en Microbiología Ansas en anillo y un ansa recta Espátula de Drigalski
4 Micropipeta con tip estéril Pipeta Pasteur B. Técnica aséptica para siembras y transplantes Las operaciones que se describen a continuación están dirigidas a personas diestras. Proceder de modo similar pero con las manos opuestas en caso de personas zurdas. Observar Figura 5.3 para entender la técnica.
5 C. Técnicas de siembra 1. Siembras en agar semisólido o blando por punción o picadura: Esterilizar a la llama (al rojo) el alambre del ansa. Dejarlo enfriar 5 seg. Tomar el tubo del cual se va a extraer el inóculo con la mano izquierda, con el meñique de la mano derecha quitar el tapón del tubo, flamear la boca y mantenerlo oblicuo, casi horizontal, para reducir al mínimo el peligro de contaminación. Retirar con el ansa esterilizado una pequeña cantidad de cultivo (inóculo), flamear nuevamente la boca del tubo, taparlo y dejarlo en la gradilla. Tomar el tubo que se va a sembrar con la mano izquierda, quitarle el tapón con el meñique de la derecha, flamear la boca del tubo y con el ansa cargada de inóculo picar el medio hasta aproximarse al fondo del tubo. Retirar con cuidado el ansa, flamear la boca del tubo, taparlo y esterilizar el ansa antes de dejarla sobre la mesa. El tubo sembrado se marca para identificarlo colocando en el rótulo el nombre del medio de cultivo, lo que se sembró y la fecha. Luego se lleva a incubar a temperatura adecuada durante el tiempo necesario Siembras sobre agar inclinado (en pico de flauta)
6 Esterilizar a la llama el alambre del ansa. Dejarlo enfriar 5 seg. Tomar el tubo del cual se va a extraer el inóculo con la mano izquierda, con el meñique de la mano derecha quitar el tapón del tubo, flamear la boca y mantenerlo oblicuo, introducir el ansa estéril, retirar una pequeña cantidad de cultivo, flamear la boca del tubo, taparlo y dejarlo en la gradilla. Tomar el tubo que se va a sembrar con la mano izquierda, quitarle el tapón con el meñique de la derecha, flamear la boca del tubo, mantenerlo inclinado, introducir el ansa cargada al tubo y extender el inóculo sobre la superficie del medio trazando estrías a intervalos de pocos mm desplazando el ansa en zigzag desde el fondo del pico de flauta hacia adelante. Retirar el ansa, flamear la boca del tubo y taparlo. También esterilizar el ansa antes de dejarla sobre la mesa. Como en la siembra anterior, rotular el tubo y luego llevarlo a incubar. 3. Siembra en placa de Petri Preparación de placa de Petri: Fundir en baño de María hirviente un tubo de agar derecho. Enfriarlo a C en un baño. Secarlo. Destaparlo. Flamear la boca del tubo y volcar el contenido en una caja de Petri estéril, rotar la caja sobre la mesa de manera que se forme una capa uniforme. Dejar solidificar. Secar en estufa a 37 C 5 min y luego sembrar.
7 Siembra por estrías. En estos casos las células son separadas por agotamiento, al realizar estrías sobre la superficie del agar. El inóculo inicial tiende a diluirse progresivamente con cada estría sucesiva. Procedimiento: 1. Tomar una caja de Petri con el medio de cultivo adecuado ya solidificado y dividir la base de la caja (con marcador indeleble del lado externo) en 3-4 sectores 2. Sembrar por orden en cada cuadrante en zigzag. 3. Una vez sembradas, las cajas se incuban invertidas 4. Siembra en medios líquidos en general: (caldo, leche, agua peptonada, medio mineral de fosfato, etc.) Los medios transparentes se deben sembrar con ansa recta, tratando de transportar poco inóculo. Los demás se pueden sembrar con ansa, o bien con pipetas estériles. -Siembra en medios líquidos con ansa: una vez que el ansa esterilizada fue cargada con el inóculo, tomar con la mano izquierda el tubo con medio líquido a sembrar, con el meñique de la mano destaparlo, flamear la boca del tubo y mantenerlo inclinado, introducir el ansa y descargar el inóculo. Retirar el ansa, flamear la boca del tubo, taparlo, esterilizar el ansa antes de dejarla sobre la mesa, rotular el tubo y llevarlo a incubar. -Siembras de medios líquidos con pipetas: tomar la pipeta estéril (puede estar en tambores de aluminio o bien envuelta en papel), pasarla ligeramente por la llama. En la mano izquierda
8 tenemos el tubo del cual vamos a extraer el inóculo, con el meñique de la derecha lo destapamos, flameamos y mantenemos inclinado, introducimos la pipeta, aspiramos el volumen deseado, flameamos el tubo, tapamos y dejamos en la gradilla con la mano izquierda. Tomamos el tubo con el medio de cultivo que vamos a sembrar, con el meñique derecho lo destapamos, flameamos e introduciendo la pipeta sin llegar hasta el líquido sembramos el volumen deseado (gotas, ml, etc.). Flamear la boca del tubo, taparlo y colocar la pipeta en recipientes que contengan mezcla sulfocrómica o solución desinfectante. Una vez hecho esto, el tubo se rotula y se incuba. -Siembras de medios líquidos o sólidos con micropipeta: colocar el volumen deseado en el visor de la micropipeta (siempre dentro del rango de microlitros permitidos en cada una de ellas), y colocar un tip estéril en el extremo de la micropipeta. Ante un roce o toque con elemento extraño, descartar el tip y reemplazarlo por uno estéril. Tomar el tubo con la muestra líquida en la mano izquierda y sostener la micropipeta con la mano derecha. Acercar el tubo a la mano que sostiene la micropipeta y con el dedo meñique quitar y sostener el tapón del tubo y flamear. Con el pulgar de la derecha bajar el pistón de la micropipeta hasta el primer tope e introducir el tip en el líquido donde está la muestra o inóculo. Soltar suavemente el pistón para que el líquido ascienda, retirar la micropipeta, y tapar el tubo acercando al dedo que sostiene el tapón. Llevar la muestra a otro tubo con medio de cultivo, para lo cual, se destapa el tubo con la mano izquierda y se introduce el tip; con el pulgar de la derecha se baja el pistón suavemente hasta el 2do. tope para descargar la muestra. Soltar el pistón suavemente y tapar tubo. ACTIVIDADES A REALIZAR 1. Descontaminar el área de trabajo utilizando algodón embebido en alcohol iodado o alcohol al 70%. 2. Proveerse con un frasco de descarte conteniendo lavandina al 10%. 3. A partir del control de esterilidad realizado en el TP anterior, determinar la eficiencia del proceso de esterilización realizado en autoclave. Descartar tubos con medio de cultivo donde se detecte contaminación. 4. Preparar 3 placas de Petri con 15 ml de agar nutritivo derecho cada una. Proceder de la siguiente manera: - 2 placas se preparan en la mesada de trabajo.
9 - la tercer placa se lleva estéril y sin desenvolver hasta la cámara de bioseguridad clase II para preparar agar sangre. 5. Dejar solidificar sobre la mesada. Llevar a secar en estufa a 37 C por 5-10 min. 6. Sembrar desde las siguientes muestras: -aire del medio ambiente, en: --placa de Petri (siembra espontánea): se deja abierta durante el TP. - tierra de jardín, en: -caldo nutritivo con ansa en anillo, --agar nutritivo inclinado con ansa en anillo, --agar semisólido con ansa recta, --agar en placa de Petri, dividida en cuadrantes en la base, con ansa en anillo. Realizar aislamiento. -fauces, en: --agar sangre, con hisopo en 1er. cuadrante, descartar hisopo en contenedor con lavandina, y continuar con ansa en anillo hasta 4to.cuadrante. Incubar en microaerofilia (baja concentración de O 2 y alta concentración de CO 2, se logra al apagar una vela en un recipiente cerrado). 7. Transplante de Enterobacter de agar nutritivo inclinado a placa de Petri, con preparación previa del inóculo en solución fisiológica: -desde botella con SF estéril, transferir con pipeta estéril ml a un tubo de hemólisis estéril. -desde un repique fresco de Enterobacter, transferir con ansa en anillo un pequeño inóculo al tubo con SF, hasta obtener turbidez muy suave. (Esto es muy importante para lograr un buen aislamiento de colonias!) -Con ansa en anillo, tomar inóculo una sola vez desde tubo con turbidez, y proceder a sembrar en placa de Petri, desde cuadrante 1 a Incubar todos los medios de cultivo en estufa a 37 C durante 24 h. 9. Al concluir el trabajo, repetir descontaminación de mesada y lavado de manos. 10. Clasificar residuos para desechar (recipiente negro: papel, recipiente rojo: algodón contaminado, guantes descartables). BIBLIOGRAFÍA
10 - Madigan, M.T; Martinko, J.M; Dunlap, P.V; Clark, D. P Brock. Biología de los Microorganismos. 12ª ed. Ed Prentice Hall, USA. - (imágenes)
11 TRABAJO PRÁCTICO DE LABORATORIO N 4 A. SIEMBRAS Y TRANSPLANTES II - B. COLORACIONES I OBJETIVOS - Observar y describir el desarrollo macroscópico de los microorganismos en medios de cultivo líquidos y sólidos. - Adquirir entrenamiento en la realización de exámenes en fresco y coloración de Gram para la observación microscópica de los microorganismos. - Reconocer microorganismos Gram positivos y Gram negativos. - Lograr destreza en el uso del microscopio óptico. INTRODUCCION TEÓRICA A. SIEMBRAS Y TRANSPLANTES II Qué debe observarse en los cultivos de microorganismos? 1. En medios de cultivo líquidos: - crecimiento en superficie - turbidez - sedimento -Crecimiento en superficie: Puede ser: floculento: contiene masas de formas diversas que flotan en el medio líquido. en anillo: desarrollo adherido al vidrio en el borde de la superficie del líquido de cultivo. película: desarrollo de una capa delgada uniforme. -Turbidez: -características: ligera, regular, intensa, transitoria, persistente, nula.
12 -Sedimento: -caracterísiticas: compacto, granular, grumoso, escamoso, viscoso. -cantidad de sedimento: abundante, escaso, nulo. 2. En medios de cultivo semisólidos: - desarrollo - movilidad 3. En medios de cultivo sólidos: -en agar nutritivo inclinado: desarrollo abundante, moderado o escaso -en placa de Petri: desarrollo con o sin aislamiento. En este caso se pueden observar colonias. Toda especie bacteriana en medio de cultivo sólido forma un tipo característico de agrupación llamada colonia. Una colonia es la progenie de una sola célula al proliferar en un medio de cultivo sólido. Importante: No se forman colonias en medios de cultivo liquidos! Las colonias se diferencian por su tamaño, forma, altura o elevación, color y grado de adherencia al medio (consistencia). Forma: puntiforme: muy pequeñas, pero visibles a simple vista, diámetro menor de 1 mm. circular: diámetro mayor de 1 mm rizoide: ramificada en forma de raíces en forma de huso Elevación, altura o perfil: plana convexa pulvinada pitting Margen, contorno o borde: entero
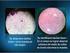
13 ondulado: borde sinuoso lobulado mellado: con muescas irregulares filamentosa: forma de largos hilos festoneado Olor: ausente pronunciado parecido a... Brillo: vivo opaco metálico Características ópticas: opaca traslúcida opalescente iridiscente color Consistencia: (usar ansa recta) butírica viscosa o mucoide membranosa quebradiza -En agar sangre observar: -alfa hemólisis, hay hemólisis parcial y los productos de la hemólisis son de color verde, viéndose alrededor de la colonia un halo de hemólisis de color verde. - beta hemólisis, en este caso hay hemólisis total y alrededor de la colonia se observa un halo transparente. - gamma hemólisis, cuando no se observa hemólisis ni en la superficie ni en la profundidad del medio de cultivo, ejemplo típico: Enterococcus faecalis.
14 Características de las colonias
15 B. COLORACIONES I Forma o morfología de las bacterias Las bacterias tienen tamaños y formas muy variables. La mayoría mide entre 0,2 y 1 μm de diámetro, y entre 2 y 8 μm de largo. Básicamente las 3 formas principales de las bacterias son: - esférica: cocos - cilíndrica (como bastones): bacilos - helicoidal o espiral: espirilos y espiroquetas Cocos: Según la orientación de sus planos de división surgen distintos tipos de agrupaciones: En el caso de cocos: - los grupos de 2 células se denominan diplococos - cuando los cocos se reúnen en cadenas de 5, 10, 100 células, se habla de estreptococos - cuando se dividen según múltiples planos y se agrupan como racimos de uva, se conocen como estafilococos - la división en 2 planos perpendiculares produce agrupaciones de 4 cocos llamadas tétradas - la división en 3 planos produce agrupaciones cúbicas de 8 cocos llamadas sarcinas Bacilos: - pueden ser rectos (bacilo entérico), curvos (bacilo del cólera) - por sus bordes: paralelos convergentes, cóncavos, convexos - por sus extremos: redondeados, afilados o en escuadra - como la división es por fisión binaria transversal (mediante un plano perpendicular al eje mayor del cuerpo bacteriano), los bacilos se presentan aislados, en pares o en cadenas conocidas como filamentos. En algunos géneros, al final de la división no hay una separación total de las células hijas: se deslizan unas sobre otras o giran entre sí por el punto de unión (representado por residuos de la pared) que actúa como bisagra. Entonces se originan agrupaciones de bacilos con forma de L, V, o letras chinas, esto es típico de Corynebacterium diphteriae.
16 Bacterias helicoidales: Pueden presentarse como, - espirales rígidas (Spirillum) - hélices flexibles en forma de sacacorchos o tirabuzón (espiroquetas como Treponema pallidum). Observación de microorganismos La observación de los microorganismos puede realizarse: - sin teñirlos - teñidos con colorantes Es necesario utilizar el microscopio óptico con el aumento apropiado en cada caso. En los exámenes en fresco, los microorganismos no se tiñen y esto permite: - establecer si están vivos - visualizar si son móviles - realizar recuentos Una ansada de la muestra y gotas de colorantes muy diluidos para no matar a las bacterias. Se puede usar cristal violeta diluido 1:5000. Se cubre con un cubreobjetos y se observa al microscopio con
17 objetivo de 10 X, luego 40 X y poca luz (condensador bajo). En el Trabajo Práctico, será reemplazada por examen en fresco, donde la muestra se coloca en una gota de solución fisiológica (SF). En las tinciones, los microorganismos se fijan, con lo cual mueren, y luego son coloreados por distintas técnicas con el propósito de: - proporcionar el contraste suficiente entre la célula y el medio que la rodea, permitiendo observar diferentes tipos morfológicos. - estudiar estructuras propias de la célula. - realizar recuentos. Ej. de tinciones: simple, Gram, Ziehl Neelsen; y otras. -La coloración simple utiliza un solo colorante y permite observar forma y tamaño de las bacterias. -La coloración de Gram utiliza 2 colorantes y una etapa de decoloración entre ambos. Permite diferenciar los microorganismos en dos grandes grupos, Gram positivos (violetas) y Gram negativos (rosados), según la composición química de su pared. Esta coloración está ampliamente difundida en el ámbito de la Microbiología. Pasos de una coloración La coloración se realiza en cultivos jóvenes de h de desarrollo, ya que con el envejecimiento las bacterias pierden afinidad por los colorantes.
18 1. Preparación del frotis: Se realiza sobre portaobjetos nuevos, sin rayaduras, lavados con mezcla sulfocrómica, luego con agua jabonosa, bien enjuagados y conservados en alcohol para desengrasarlos. Antes de usar, secar a la llama, a temperatura ambiente o con un lienzo que no desprenda fibras. El frotis se realiza en el portaobjetos colocando directamente una gota de cultivo desde medio líquido, o si se parte de un cultivo en medio sólido, será necesario colocar previamente una gota de solución fisiológica y luego se emulsiona una ansada de gérmenes. Se distribuye con ansa en una superficie de 1 cm 2 aproximadamente. Se debe llevar poca cantidad de material para que no se formen acúmulos que impiden una óptima visualización. 2. Secado del frotis: se realiza a temperatura ambiente, en estufa de cultivo a 37ºC, o manteniéndolo cerca de la llama del mechero. 3. Fijación del frotis: su objetivo es preservar las estructuras celulares y hacerlas más visibles. Un método de fijación no debe deformar las estructuras ni cambiar la afinidad de la célula hacia el colorante. Existen métodos físicos y químicos de fijación.
19 -En los métodos físicos, la fijación se realiza por calor, pasando el preparado por su revés (con el frotis hacia arriba) 3 veces por la llama del mechero. Esto produce coagulación de proteínas y adhiere el preparado al portaobjetos. Este método deforma levemente las estructuras pero no altera la afinidad por el colorante. -En los químicos, se cubre el preparado con alcohol metílico o etílico, se deja actuar por unos segundos, se escurre el exceso de alcohol y, se arde acercando un hisopo encendido. Existen otras sustancias que se utilizan como acentuadores o reforzadores de la fijación: ácido fénico, KOH, etc. Enfriado del frotis: dejar el portaobjetos sobre la mesada por breves minutos antes de colorear. Este paso no debe soslayarse pues de lo contrario precipitarán los colorantes sobre el frotis. 4. Coloración propiamente dicha, puede ser: -coloración simple: se utiliza un único colorante -coloración diferencial: se utiliza un primer colorante, seguido por un decolorante, y luego un segundo colorante. 5. Lavado: salvo indicación en contrario, se lava con agua común, se seca sobre la llama, en estufa o a temperatura ambiente. Se observa con objetivo de inmersión. Mordientes: Para estructuras muy difíciles de teñir se recurre al uso de mordientes, que son sustancias químicas que unidas a los colorantes forman una laca que se adhiere fuertemente a la estructura difícil de teñir. El mordiente se puede agregar antes o después de la adición del colorante con el que formará la laca. Ej.: en la coloración de Gram se agrega primero cristal violeta y luego el mordiente que es lugol; en la impregnación argéntica primero se agrega el mordiente que es ácido tánico y luego nitrato de plata que es el reactivo precipitante. Fundamento e interpretación de la coloración de Gram Por medio de esta coloración las bacterias se dividen en dos grandes grupos: Gram negativas y Gram positivas. Esto se debe a que la tinción de Gram pone en evidencia diferencias en la composición química de la pared celular de las bacterias.
20 -Diferencias en la pared de bacterias Gram positivas (a) y Gram negativas (b) En las bacterias Gram positivas, el peptidoglicano representa hasta el 90% de la pared, aunque pequeñas cantidades de ácido teicoico suelen formar parte de la misma. Los ácidos teicoicos son polímeros de fosfato de ribitol o fosfato de glicerol. A veces están unidos a los lípidos de membrana de las bacterias Gram positivas y se denominan ácidos lipoteicoicos. En las bacterias Gram negativas, el peptidoglicano constituye sólo el 10% de la pared. El resto de la pared, de adentro hacia afuera, incluye: - periplasma - una capa de lipoproteína que funciona como una especie de anclaje entre las membranas externas y el peptidoglicano, - una capa de lipopolisacárido (LPS), molécula que consta de 3 regiones: -lípido A, con efecto de endotoxina -núcleo del polisacárido, compuesto por cetodesoxioctonato (KDO), heptosas, glucosa, galactosa y N-acetilglucosamina. -polisacárido O: formado por unidades repetitivas de 4-5 azúcares que constituyen el antígeno O, que permite la identificación serológica de la bacteria. El LPS es muy importante desde el punto de vista clínico! Cuando las bacterias Gram negativas ingresan excepcionalmente en la circulación sanguínea (por ej. en un cuadro de peritonitis), se hace evidente el efecto de la endotoxina del LPS por el desarrollo de fiebre, coagulación vascular diseminada, y en algunos casos, se produce la muerte.
21 La pared de todas las bacterias (Gram positivas y Gram negativas) posee una capa rígida llamada peptidoglicano o mureína. Éste es un polisacárido formado por dos aminoazúcares: - N-acetilglucosamina (NAG) - N-acetilmurámico (NAM) que se unen alternadamente por enlaces β1-4: NAG-NAM-NAG-NAM-NAG., y un pequeño grupo de aminoácidos: L-alanina, D-alanina, D-glutámico y, lisina o ácido diaminopimélico (DAP). Esta estructura se repite a lo largo de toda la pared. La estructura básica del peptidoglicano está constituida por largas cadenas adyacentes del polisacárido y estas cadenas se conectan entre sí a través de puentes peptídicos formados por los aminoácidos mencionados. -Pasos a seguir en la coloración de Gram: Se agrega cristal violeta (primer colorante), luego el mordiente lugol (I 2 /I - ), se decolora con alcohol o alcohol-acetona, y finalmente se aplica fucsina fenicada diluida 1:10 (segundo colorante). Se verán: - las bacterias Gram positivas: azul violáceas - las bacterias Gram negativas: rojas Por qué esa diferencia?. La diferencia radica en la composición química y en la estructura física de la pared celular de las bacterias. Las bacterias Gram positivas no tienen lípidos en su pared, las Gram negativas sí lo tienen y en abundancia. Con cristal violeta (CV) se tiñen todas. Al agregar el mordiente, éste forma un complejo con CV que mejora la tinción: CV + lugol CV lugol Luego, al agregar el decolorante alcohol. qué sucede? En las bacterias Gram negativas disuelve los lípidos de la pared, penetra en el protoplasma y quita el complejo cristal violeta iodo. En las bacterias Gram positivas, que no tienen lípidos en su pared, el decolorante produce deshidratación del peptidoglicano compactándolo, no ingresa al protoplasma y no puede remover el complejo CV iodo. Estas bacterias permanecen azules.
22 Por último se agrega fucsina que teñirá solamente las bacterias que fueron decoloradas por el alcohol. Estas células se verán rojas. Nota: las levaduras teñidas al Gram se ven positivas, aunque presentan una pared celular con una estructura química distinta a la pared de las bacterias Gram positivas. MATERIALES Y MÉTODOS A. Siembras y transplantes II -Cultivos obtenidos en el TP anterior -Lupa -Frasco de descarte con desinfectante -Ansas recta y en anillo -Algodón y alcohol iodado B. Coloraciones I -Cepas a utilizar desde cultivos frescos de 18 a 24 h: Sacharomyces cerevisiae, Bacillus subtilis, Yersinia enterocolitica, Staphylococcus aureus, Proteus mirabilis -Portaobjetos y cubreobjetos -Goteros con solución fisiológica. -Microscopios ópticos provistos con objetivos de 4, 10, 40 y 100x. -Aceite de inmersión. -Reactivos de coloración para Gram Técnicas de observación de microorganismos a. Examen en fresco Se observa forma y movilidad. Técnica: 1. Colocar sobre un portaobjetos limpio una gota de solución fisiológica (NaCl 0.85% en agua destilada). Esto no aplica si se trata de un cultivo en medio líquido.
23 2. Con un ansa tomar una pequeña cantidad de cultivo y emulsionarlo perfectamente en la gota. 3. Cubrir suavemente la gota con un cubreobjetos evitando la formación de burbujas de aire. 4. Examinar con el objetivo de 40x y condensador bajo, luego con 100x. Las bacterias se observan refringentes; algunas pueden presentan movimiento por flagelos. Opcional: para diferenciar el movimiento de las bacterias del movimiento browniano propio de partículas inertes, se puede agregar una gotita de formol por capilaridad. -Preparacion del frotis 1. Hacer el frotis colocando una ansada de cultivo líquido en el centro de un portaobjetos limpio; si el examen se debe realizar desde un cultivo sólido, colocar previamente sobre el portaobjetos una gota de solución fisiológica y sobre ella emulsionar perfectamente el inóculo para lograr una película delgada y uniforme. 2. Secar la preparación en el aire caliente sobre la llama del mechero. 3. Fijarla tomando el preparado desde un extremo, y pasar el reverso sobre la llama de un mechero tres veces (método físico). 4. Secar a temperatura ambiente dejando sobre la base del mechero o situando el portaobjetos en el aire caliente sobre la llama del mechero durante 2 ó 3 minutos 5. Una vez frío, seguir con la coloración que corresponda. b. Coloración simple Para la observación de la morfología y agrupación de los microorganismos. Técnica: 1.- Realizar el frotis y una vez frío, cubrir el preparado con una solución diluida de fucsina 1/10 durante 1 minuto. 2.- Lavar con agua corriente, secar. 3.-Examinar con el objetivo de inmersión (100x). Las bacterias aparecen de color rojizo sobre un fondo claro.
24 c. Coloracion de Gram Revela la morfología y formas de agrupación de los microorganismos. Permite clasificarlos en dos grandes grupos, Gram positivos y Gram negativos, según la composición de su pared. Reactivos necesarios (estarán listos para usar en el TP): cristal violeta, lugol, alcohol, fucsina diluida 1/10. Cristal violeta Cristal violeta g Fenol al 50% en alcohol ml Alcohol puro ml Dejar madurar en la estufa a 37 C durante una semana y agregar: Agua destilada ml Filtrar antes de usar. Lugol Iodo... 5 g Ioduro de potasio g Agua destilada ml Fucsina de Ziehl 1/10 Fucsina básica g Fenol al 50% en alcohol ml Alcohol ml Dejar madurar en estufa a 37 C durante una semana y agregar: Agua destilada ml Filtrar antes de usar. Hacer una dilución 1/10 en agua destilada de la fórmula anterior y usar en Gram. Técnica: 1. Hacer el frotis. Secar y fijar a la llama.
25 2. Cubrir la preparación con cristal violeta y dejar actuar 2 min. Lavar. 3. Tratar con lugol durante 1 minuto. Volcar. Lavar. 4. Decolorar con alcohol 96 durante 30 seg. 5. Lavar con agua corriente y efectuar la coloración de fondo con la fucsina 1/10. Dejar actuar 20 segundos a un minuto. 6. Lavar. Secar. Observar por inmersión. Las bacterias Gram positivas se ven violetas y las Gram negativas rojas. ACTIVIDADES A REALIZAR A. SIEMBRAS Y TRANSPLANTES II Observar los cultivos e informar los resultados obtenidos en: - caldo nutritivo: membrana superficial, turbidez, sedimento? - agar SIM: movilidad? - agar nutritivo en pico de flauta: desarrollo abundante o escaso? Examinar el desarrollo en placa de Petri de diferentes muestras. - Informar si se trata de cultivos axénicos o mixtos - Tipos coloniales que se observan: en cada placa determinar número de colonias diferentes y caracterizarlas por sus propiedades macroscópicas. B. COLORACIONES I Cada equipo de alumnos realizará las siguientes actividades: - Preparados en fresco a partir de S. cerevisiae, B. subtilis, Y. enterocolitica o P. mirabilis. Observará y determinará si los microorganismos presentan movilidad. - Preparado de frotis con microorganismos de la misma especie o con mezclas de distintas cepas para ser teñidas por coloración simple y/o Gram. Observará formas, agrupaciones de las células, presencia de esporas y determinará si son Gram positivas o negativas.
26 - Observación de preparados ya teñidos suministrados por su Jefe de Trabajos Prácticos. - Dibujará y anotará resultados de la observación de preparados en el informe de laboratorio. BIBLIOGRAFÍA - Microbiología, Tecnicatura Universitaria en Esterilización, UNSL Atlas de tinciones en Microbiología. En: - Microbiología, Tecnicatura Universitaria en Esterilización, UNSL Explicación Coloraciones I y II. En: - Madigan, M.T; Martinko, J.M; Dunlap, P.V; Clark, D. P Brock. Biología de los Microorganismos. 12ª ed. Ed Prentice Hall, USA. - (imágenes)
PRÁCTICO N 3. Técnicas para la observación, aislamiento y conservación de microorganismos
 PRÁCTICO N 3 Técnicas para la observación, aislamiento y conservación de microorganismos Objetivos Conocer el manejo del microscopio óptico, sus partes y utilidad en el laboratorio de microbiología. Conocer
PRÁCTICO N 3 Técnicas para la observación, aislamiento y conservación de microorganismos Objetivos Conocer el manejo del microscopio óptico, sus partes y utilidad en el laboratorio de microbiología. Conocer
PRACTICA 2 TINCION DE GRAM
 PRACTICA 2 TINCION DE GRAM OBJETIVOS DE APRENDIZAJE: Cuando haya completado este experimento, usted debe comprender: 1. La base teórica y química de los procedimientos de tinción diferencial. 2. La base
PRACTICA 2 TINCION DE GRAM OBJETIVOS DE APRENDIZAJE: Cuando haya completado este experimento, usted debe comprender: 1. La base teórica y química de los procedimientos de tinción diferencial. 2. La base
Trabajo Práctico Nº 2. Medios de cultivo Obtención y preparación de muestras
 TRABAJO PRÁCTICO N 2 PARTE A: MEDIOS DE CULTIVO. OBJETIVOS - Fundamentar la composición de diferentes medios de cultivo conociendo los requerimientos energéticos, nutricionales y ambientales de los principales
TRABAJO PRÁCTICO N 2 PARTE A: MEDIOS DE CULTIVO. OBJETIVOS - Fundamentar la composición de diferentes medios de cultivo conociendo los requerimientos energéticos, nutricionales y ambientales de los principales
UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II
 UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II Maye Bernal Rivera PARTE II. LECTURA E INTERPRETACION DE LOS CULTIVOS
UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II Maye Bernal Rivera PARTE II. LECTURA E INTERPRETACION DE LOS CULTIVOS
AISLAMIENTO DE MICROORGANISMOS
 PRÁCTICA5 AISLAMIENTO DE MICROORGANISMOS Introducción En la naturaleza, la mayoría de los microorganismos no se encuentran aislados, sino integrados en poblaciones mixtas. Para llevar a cabo el estudio
PRÁCTICA5 AISLAMIENTO DE MICROORGANISMOS Introducción En la naturaleza, la mayoría de los microorganismos no se encuentran aislados, sino integrados en poblaciones mixtas. Para llevar a cabo el estudio
GUÍA REALIZACIÓN DE CULTIVOS MICROBIOLÓGICOS
 ESCUELA DE SALUD GUÍA REALIZACIÓN DE CULTIVOS MICROBIOLÓGICOS DIRIGIDO A ALUMNOS DE: Técnico de laboratorio Clínico y Banco de Sangre Técnico de Enfermería Técnico de Radiodiagnóstico y Radioterapia Informática
ESCUELA DE SALUD GUÍA REALIZACIÓN DE CULTIVOS MICROBIOLÓGICOS DIRIGIDO A ALUMNOS DE: Técnico de laboratorio Clínico y Banco de Sangre Técnico de Enfermería Técnico de Radiodiagnóstico y Radioterapia Informática
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR
 UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR Catedrático: Dra. Ana Olivia cañas Urbina. PRACTICA No. 3: TINCIONES Equipo:
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR Catedrático: Dra. Ana Olivia cañas Urbina. PRACTICA No. 3: TINCIONES Equipo:
MICROBIOLOGÍA E INMUNOLOGÍA PARTE A LIC. en BIOLOGÍA MOLECULAR. EXPLICACIÓN DE TRABAJO PRÁCTICO N 2 COLORACIONES I y II
 MICROBIOLOGÍA E INMUNOLOGÍA PARTE A LIC. en BIOLOGÍA MOLECULAR EXPLICACIÓN DE TRABAJO PRÁCTICO N 2 COLORACIONES I y II 1. Forma o morfología de las bacterias Las bacterias tienen tamaños y formas muy variables.
MICROBIOLOGÍA E INMUNOLOGÍA PARTE A LIC. en BIOLOGÍA MOLECULAR EXPLICACIÓN DE TRABAJO PRÁCTICO N 2 COLORACIONES I y II 1. Forma o morfología de las bacterias Las bacterias tienen tamaños y formas muy variables.
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS
 PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
PROCEDIMIENTO DETECCIÓN Y ENUMERACIÓN POR NUMERO MAS PROBABLE (NMP) CON ETAPA DE PRE- ENRIQUECIMIENTO DE ENTEROBACTERIACEAE EN ALIMENTOS
 Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL
 UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL PROTOCOLO PARA OBTENCIÓN DE EMBRIONES DE POLLO EN LABORATORIO
UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL PROTOCOLO PARA OBTENCIÓN DE EMBRIONES DE POLLO EN LABORATORIO
AcuaNatura ÍNDICE TÉCNICAS DE TINCIÓN
 TÉCNICAS DE TINCIÓN ÍNDICE 1. Introducción 3 2. Tipos de tinciones 4 2.1. Tinción de Gram 4 2.2. Tinción ácido alcohol resistencia 5 2.3. Tinción de esporas 5 2.4. Tinción negativa 6 3. Precauciones 7
TÉCNICAS DE TINCIÓN ÍNDICE 1. Introducción 3 2. Tipos de tinciones 4 2.1. Tinción de Gram 4 2.2. Tinción ácido alcohol resistencia 5 2.3. Tinción de esporas 5 2.4. Tinción negativa 6 3. Precauciones 7
RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO
 RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO Fundamento Los alimentos se diferencian entre sí por las sustancias o principios inmediatos que contienen y por la cantidad de cada uno
RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO Fundamento Los alimentos se diferencian entre sí por las sustancias o principios inmediatos que contienen y por la cantidad de cada uno
Técnicas de observación de microorganismos
 Fundamentos y técnicas de análisis microbiológicos Técnicas de observación de microorganismos - 1 Técnicas de observación de microorganismos El examen microscópico es el primer paso para el estudio de
Fundamentos y técnicas de análisis microbiológicos Técnicas de observación de microorganismos - 1 Técnicas de observación de microorganismos El examen microscópico es el primer paso para el estudio de
PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE
 PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE I. OBJETIVO Conocer el procedimiento para preparar extensiones ó frotis y los diferentes métodos de tinción, así como su utilidad
PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE I. OBJETIVO Conocer el procedimiento para preparar extensiones ó frotis y los diferentes métodos de tinción, así como su utilidad
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 1 Bacteriología Veterinaria. TRABAJO PRÁCTICO No. 1 PRIMER PERIODO MICROSCOPÍA Y MORFOLOGÍA DE BACTERIAS OBJETIVOS 1. Manipular correctamente cada una de las partes del microscopio compuesto de campo claro.
1 Bacteriología Veterinaria. TRABAJO PRÁCTICO No. 1 PRIMER PERIODO MICROSCOPÍA Y MORFOLOGÍA DE BACTERIAS OBJETIVOS 1. Manipular correctamente cada una de las partes del microscopio compuesto de campo claro.
Técnicas de monitoreo para la detección de microorganismos en el medio ambiente
 Técnicas de monitoreo para la detección de microorganismos en el medio ambiente Gloria Alicia Figueroa Aguilar Condiciones Ambientales REQUISITO: El laboratorio debe asegurarse que las condiciones ambientales,
Técnicas de monitoreo para la detección de microorganismos en el medio ambiente Gloria Alicia Figueroa Aguilar Condiciones Ambientales REQUISITO: El laboratorio debe asegurarse que las condiciones ambientales,
 TRABAJO PRÁCTICO N 2 CAMBIOS DE ESTADO SÓLIDO LÍQUIDO GASEOSO Manteniendo constante la presión, a baja temperatura los cuerpos se presentan en forma sólida tal que los átomos se encuentran entrelazados
TRABAJO PRÁCTICO N 2 CAMBIOS DE ESTADO SÓLIDO LÍQUIDO GASEOSO Manteniendo constante la presión, a baja temperatura los cuerpos se presentan en forma sólida tal que los átomos se encuentran entrelazados
UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I
 UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I DRAS. MARÍA LUISA ORTIZ Y ANA PEDREGOSA 1 PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA
UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I DRAS. MARÍA LUISA ORTIZ Y ANA PEDREGOSA 1 PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR
 ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
UNIVERSIDAD TECNOLOGICA NACIONAL
 UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE BIOTECNOLOGIA Trabajo práctico n 3 Siembra y recuento de microorganismos. 2009 Jefe de Cátedra:
UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE BIOTECNOLOGIA Trabajo práctico n 3 Siembra y recuento de microorganismos. 2009 Jefe de Cátedra:
FISIOLOGÍA BACTERIANA 2015 TÉCNICAS BÁSICAS DE MICROBIOLOGIA - TÉCNICAS ASÉPTICAS - SIEMBRA Y AISLAMIENTO
 FISIOLOGÍA BACTERIANA 2015 1 TRABAJO PRÁCTICO TÉCNICAS BÁSICAS DE MICROBIOLOGIA - TÉCNICAS ASÉPTICAS - SIEMBRA Y AISLAMIENTO OBJETIVOS: Conocer la importancia de la esterilización y familiarizarse con
FISIOLOGÍA BACTERIANA 2015 1 TRABAJO PRÁCTICO TÉCNICAS BÁSICAS DE MICROBIOLOGIA - TÉCNICAS ASÉPTICAS - SIEMBRA Y AISLAMIENTO OBJETIVOS: Conocer la importancia de la esterilización y familiarizarse con
Microscopio y observación de células
 I.E.S. Rayuela - Departamento de Biología y Geología Práctica nº1 de Anatomía Aplicada Microscopio y observación de células Las células suelen ser de tamaño muy pequeño de modo que permanecen invisibles
I.E.S. Rayuela - Departamento de Biología y Geología Práctica nº1 de Anatomía Aplicada Microscopio y observación de células Las células suelen ser de tamaño muy pequeño de modo que permanecen invisibles
COLEGIO DE BACHILLERES DEL ESTADO DE TLAXCALA DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS BIOLOGÍA I ACTIVIDAD EXPERIMENTAL NUM
 DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS BIOLOGÍA I ACTIVIDAD EXPERIMENTAL NUM. 2 ESTRUCTURA CELULAR (BLOLQUE III) INTRODUCCIÓN La célula es la unidad anatómica y fisiológica de los
DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS BIOLOGÍA I ACTIVIDAD EXPERIMENTAL NUM. 2 ESTRUCTURA CELULAR (BLOLQUE III) INTRODUCCIÓN La célula es la unidad anatómica y fisiológica de los
Objetivos. S Determinar la presencia de bacterias coliformes en una muestra de agua
 Análisis del agua S Objetivos S Determinar la presencia de bacterias coliformes en una muestra de agua Introducción S Las tres pruebas básicas para determinar la presencia de bacterias coliformes (asociada
Análisis del agua S Objetivos S Determinar la presencia de bacterias coliformes en una muestra de agua Introducción S Las tres pruebas básicas para determinar la presencia de bacterias coliformes (asociada
LABORATORIO DE MICROBIOLOGÍA EXPERIMENTAL Grupo 2 (10:00 13:00 hrs) Semestre Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote
 Semana 2 Semana 1 LABORATORIO DE EXPERIMENTAL Grupo 2 (10:00 13:00 hrs) Semestre 2013-2 Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote CALENDARIO DE ACTIVIDADES UNIDAD Lunes 28 ENERO Miércoles
Semana 2 Semana 1 LABORATORIO DE EXPERIMENTAL Grupo 2 (10:00 13:00 hrs) Semestre 2013-2 Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote CALENDARIO DE ACTIVIDADES UNIDAD Lunes 28 ENERO Miércoles
QUÉ CONTIENE UN MEDIO? Aquellos requerimientos nutricionales que los microorganismos necesitan para crecer. Depende del ambiente en donde viven.
 OBJETIVOS u Diferenciar entre ciertos tipos de medios u Conocer actividades bioquímicas de las bacterias u Conocer los procesos bioquímicos de fermentación u Descibir los patrones de fermentación de carbohidratos
OBJETIVOS u Diferenciar entre ciertos tipos de medios u Conocer actividades bioquímicas de las bacterias u Conocer los procesos bioquímicos de fermentación u Descibir los patrones de fermentación de carbohidratos
TRANSFERENCIAS ASÉPTICAS
 Introducción Objetivo Procedimiento Trabajo Práctico Nº 3 TRANSFERENCIAS ASÉPTICAS Resultados Observaciones Bibliografía INTRODUCCIÓN La inoculación de medios de cultivo y la manipulación de cultivos microbianos
Introducción Objetivo Procedimiento Trabajo Práctico Nº 3 TRANSFERENCIAS ASÉPTICAS Resultados Observaciones Bibliografía INTRODUCCIÓN La inoculación de medios de cultivo y la manipulación de cultivos microbianos
o Solución de KOH al 0,01% Disolver el colorante en el alcohol, y añadir la solución de KOH
 OBSERVACIÓN DE LAS BACTERIAS TINCIÓN SENCILLA 1.- Material necesario Cultivo bacteriano de 24 horas, en medio sólido Portaobjetos limpios y desengrasados Frasco lavador con agua de grifo o destilada Asa
OBSERVACIÓN DE LAS BACTERIAS TINCIÓN SENCILLA 1.- Material necesario Cultivo bacteriano de 24 horas, en medio sólido Portaobjetos limpios y desengrasados Frasco lavador con agua de grifo o destilada Asa
UNIVERSIDAD TECNOLOGICA NACIONAL
 UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE BIOTECNOLOGIA Trabajo práctico n 4 Tinción y observación de microorganismos. 2009 Jefe de Cátedra:
UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE BIOTECNOLOGIA Trabajo práctico n 4 Tinción y observación de microorganismos. 2009 Jefe de Cátedra:
PRACTICA #2 ESTUDIO MICROSCOPICO DE LAS BACTERIAS
 PRACTICA #2 ESTUDIO MICROSCOPICO DE LAS BACTERIAS OBJETIVO DE LA PRACTICA Desarrollar las técnicas microscópicas comunes para observar, teñir y medir a las bacterias y sus estructuras. INTRODUCCION El
PRACTICA #2 ESTUDIO MICROSCOPICO DE LAS BACTERIAS OBJETIVO DE LA PRACTICA Desarrollar las técnicas microscópicas comunes para observar, teñir y medir a las bacterias y sus estructuras. INTRODUCCION El
Título de la gráfica: Crecimiento/ No crecimiento
 Resultados de la semana anterior (TSB) Título de la gráfica: # tubo TSB 1-24 Crecimiento/ No crecimiento Descripción del crecimiento Resultados de la semana anterior (TSA slant) Título de la gráfica: tubo
Resultados de la semana anterior (TSB) Título de la gráfica: # tubo TSB 1-24 Crecimiento/ No crecimiento Descripción del crecimiento Resultados de la semana anterior (TSA slant) Título de la gráfica: tubo
Laboratorio de Introducción a la Microbiología. Practico N 1
 Laboratorio de Introducción a la Microbiología Practico N 1 PREPARACIÓN PARA LA OBSERVACIÓN DE MICROORGANISMOS POR MICROSCOPIA Los microorganismos son demasiado pequeños para ser observados a simple vista,
Laboratorio de Introducción a la Microbiología Practico N 1 PREPARACIÓN PARA LA OBSERVACIÓN DE MICROORGANISMOS POR MICROSCOPIA Los microorganismos son demasiado pequeños para ser observados a simple vista,
EXAMEN EN FRESCO DE HECES Y PRESENCIA DE HUEVOS PRACTICA 3
 EXAMEN EN FRESCO DE HECES Y PRESENCIA DE HUEVOS PRACTICA 3 1. Introducción Examen macroscópico Es importante determinar la consistencia de las heces fecales y clasificarlas en líquidas, blandas o duras,
EXAMEN EN FRESCO DE HECES Y PRESENCIA DE HUEVOS PRACTICA 3 1. Introducción Examen macroscópico Es importante determinar la consistencia de las heces fecales y clasificarlas en líquidas, blandas o duras,
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO )
 PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUALITATIVO DE ORINA PRUEBA DE BAUER KIRBY (ANTIBIOGRAMA) PRUEBA DE EPSILON (DETERMINACIÓN DE LA CMI) ANÁLISIS CUALITATIVO
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUALITATIVO DE ORINA PRUEBA DE BAUER KIRBY (ANTIBIOGRAMA) PRUEBA DE EPSILON (DETERMINACIÓN DE LA CMI) ANÁLISIS CUALITATIVO
INSTRUMENTOS BÁSICOS DE UN LABORATORIO
 INSTRUMENTOS BÁSICOS DE UN LABORATORIO Trasfondo y Contenido En un laboratorio se utiliza una amplia variedad de instrumentos o herramientas que, en su conjunto, se denominan material de laboratorio. Pueden
INSTRUMENTOS BÁSICOS DE UN LABORATORIO Trasfondo y Contenido En un laboratorio se utiliza una amplia variedad de instrumentos o herramientas que, en su conjunto, se denominan material de laboratorio. Pueden
Fisiología Bacteriana. Tarea de aula I
 Fisiología Bacteriana Tarea de aula I Técnicas Básicas de Laboratorio de Microbiología Objetivo en Microbiología: Caracterización de un microorganismo Procesos de desinfección y esterilización. Manejo
Fisiología Bacteriana Tarea de aula I Técnicas Básicas de Laboratorio de Microbiología Objetivo en Microbiología: Caracterización de un microorganismo Procesos de desinfección y esterilización. Manejo
Logros. Crecimiento bacteriano. Crecimiento. Finalidad de las bacterias
 Fisiología bacteriana Dr. Juan C. Salazar jcsalazar@med.uchile.cl Programa de Microbiología y Micología ICBM, Facultad de Medicina Finalidad de las bacterias Logros Crecimiento Cómo lo hacen? Herramientas
Fisiología bacteriana Dr. Juan C. Salazar jcsalazar@med.uchile.cl Programa de Microbiología y Micología ICBM, Facultad de Medicina Finalidad de las bacterias Logros Crecimiento Cómo lo hacen? Herramientas
EQUILIBRIO QUÍMICO: DETERMINACIÓN DE LA CONSTANTE DE PRODUCTO DE SOLUBILIDAD DEL Ba(NO 3 ) 2
 Página: 1/5 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 9: EQUILIBRIO QUÍMICO: DETERMINACIÓN DE LA CONSTANTE DE PRODUCTO DE SOLUBILIDAD DEL Ba(NO 3 ) 2 Bibliografía: Química, La Ciencia Central, T.L. Brown,
Página: 1/5 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 9: EQUILIBRIO QUÍMICO: DETERMINACIÓN DE LA CONSTANTE DE PRODUCTO DE SOLUBILIDAD DEL Ba(NO 3 ) 2 Bibliografía: Química, La Ciencia Central, T.L. Brown,
diferentes sustratos Método de Baermann en embudo y modificación en vaso de precipitado. Rina G. de Kaminsky
 Extracción de larvas de diferentes sustratos Método de Baermann en embudo y modificación en vaso de precipitado. p Rina G. de Kaminsky Método de Baermann Existen algunas variaciones, las dos más utilizadas
Extracción de larvas de diferentes sustratos Método de Baermann en embudo y modificación en vaso de precipitado. p Rina G. de Kaminsky Método de Baermann Existen algunas variaciones, las dos más utilizadas
Materiales. Cultivos puros de hongos: Saccharomyces cerevisiae Rhodototula sp Penicillum sp Aspergillus niger Rhizopous sp Alternaria sp Fusarium sp
 Unidad 3. Estudio de cultivos bacterianos puros y Unidad 4. Estudio microscópico y cultivo de hongos algas y protozoarios Práctica 5. Técnicas de siembra y cultivo de bacterias y hongos Objetivos Aplicar
Unidad 3. Estudio de cultivos bacterianos puros y Unidad 4. Estudio microscópico y cultivo de hongos algas y protozoarios Práctica 5. Técnicas de siembra y cultivo de bacterias y hongos Objetivos Aplicar
Trabajo Práctico N 3. Reconocimiento de sustancias ácidas, básicas y neutras. mediante el empleo de indicadores químicos.
 Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
PRÁCTICO 3: SOLUCIONES
 Curso de Laboratorio Página: 1/6 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 3: SOLUCIONES Bibliografía: Química, La Ciencia Central, T.L. Brown, H.E.LeMay, Jr., B.Bursten; Ed. Prentice-Hall Hispanoamericana,
Curso de Laboratorio Página: 1/6 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 3: SOLUCIONES Bibliografía: Química, La Ciencia Central, T.L. Brown, H.E.LeMay, Jr., B.Bursten; Ed. Prentice-Hall Hispanoamericana,
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO
 PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
MORFOLOGÍA DE LAS COLONIAS BACTERIANAS
 MORFOLOGÍA DE LAS COLONIAS BACTERIANAS OBJETIVO: Aprender las diferentes características de la morfología colonial utilizadas en la identificación de bacterias. GENERALIDADES: Una colonia es una agrupación
MORFOLOGÍA DE LAS COLONIAS BACTERIANAS OBJETIVO: Aprender las diferentes características de la morfología colonial utilizadas en la identificación de bacterias. GENERALIDADES: Una colonia es una agrupación
LOS MICROORGANISMOS EN EL AMBIENTE
 Introducción Objetivo Fundamento Trabajo Práctico Nº 2 LOS MICROORGANISMOS EN EL AMBIENTE Procedimiento Resultados Observaciones Conclusiones INTRODUCCIÓN La microbiología es la ciencia que estudia los
Introducción Objetivo Fundamento Trabajo Práctico Nº 2 LOS MICROORGANISMOS EN EL AMBIENTE Procedimiento Resultados Observaciones Conclusiones INTRODUCCIÓN La microbiología es la ciencia que estudia los
MICROBIOLOGÍA INDUSTRIAL. Guía de Trabajos Prácticos Ingeniería en Agroindustria Escuela de Ingeniería UNViMe
 MICROBIOLOGÍA INDUSTRIAL Guía de Trabajos Prácticos Ingeniería en Agroindustria Escuela de Ingeniería UNViMe Integrantes: Prof. Adjunta. Dra. María Cecilia Villa Jefe de Trabajos Prácticos Lic. Rodrigo
MICROBIOLOGÍA INDUSTRIAL Guía de Trabajos Prácticos Ingeniería en Agroindustria Escuela de Ingeniería UNViMe Integrantes: Prof. Adjunta. Dra. María Cecilia Villa Jefe de Trabajos Prácticos Lic. Rodrigo
PREPARACIÓN DE MEDIOS DE CULTIVO
 Introducción Clasificación de los medios de cultivo Almacenamiento de los medios de cultivo Trabajo Práctico Nº 6 PREPARACIÓN DE MEDIOS DE CULTIVO Objetivo Fundamento Procedimiento Resultados Bibliografía
Introducción Clasificación de los medios de cultivo Almacenamiento de los medios de cultivo Trabajo Práctico Nº 6 PREPARACIÓN DE MEDIOS DE CULTIVO Objetivo Fundamento Procedimiento Resultados Bibliografía
ECOLOGÍA MICROBIANA Y COMPORTAMIENTO BACTERIANO COMUNITARIO
 5 TRABAJO PRÁCTICO ECOLOGÍA MICROBIANA Y COMPORTAMIENTO BACTERIANO COMUNITARIO OBJETIVOS: 1 Observar y comprender la diversidad bacteriana que coexiste en un mismo nicho en un dado ecosistema y las interrelaciones
5 TRABAJO PRÁCTICO ECOLOGÍA MICROBIANA Y COMPORTAMIENTO BACTERIANO COMUNITARIO OBJETIVOS: 1 Observar y comprender la diversidad bacteriana que coexiste en un mismo nicho en un dado ecosistema y las interrelaciones
PREPARACION DE MEDIOS DE CULTIVO
 PREPARACION DE MEDIOS DE CULTIVO MEDIOS DE CULTIVO Un medio de cultivo es un conjunto de nutrientes, factores de crecimiento y otros componentes que crean las condiciones necesarias para el desarrollo
PREPARACION DE MEDIOS DE CULTIVO MEDIOS DE CULTIVO Un medio de cultivo es un conjunto de nutrientes, factores de crecimiento y otros componentes que crean las condiciones necesarias para el desarrollo
Dr. Oscar Gutiérrez Coronado Microbiologia Práctica No. 1 Preparación y esterilización de materiales y medios de cultivo
 Dr. Oscar Gutiérrez Coronado Microbiologia Práctica No. 1 Preparación y esterilización de materiales y medios de cultivo Objetivos. Que el alumno conozca los principios generales de las técnicas de esterilización
Dr. Oscar Gutiérrez Coronado Microbiologia Práctica No. 1 Preparación y esterilización de materiales y medios de cultivo Objetivos. Que el alumno conozca los principios generales de las técnicas de esterilización
Por qué en un resultado positivo siempre cambia a amarillo intenso pero solo algunos emiten fluorescencia?
 Biología 3725 L COLILERT Por qué en un resultado positivo siempre cambia a amarillo intenso pero solo algunos emiten fluorescencia? ENTEROLERT Cuál es el propósito de utilizar enterolert, que nos dice
Biología 3725 L COLILERT Por qué en un resultado positivo siempre cambia a amarillo intenso pero solo algunos emiten fluorescencia? ENTEROLERT Cuál es el propósito de utilizar enterolert, que nos dice
Preparación de agua de dilución :
 La determinación de la Demanda Bioquímica de Oxígeno es una prueba en la que se determina los requerimientos relativos de oxígeno en aguas contaminadas tal como aguas residuales domésticas e industriales,,
La determinación de la Demanda Bioquímica de Oxígeno es una prueba en la que se determina los requerimientos relativos de oxígeno en aguas contaminadas tal como aguas residuales domésticas e industriales,,
TRABAJO PRÁCTICO Nº 3. Parte A: Examen macroscópico de los microorganismos.
 TRABAJO PRÁCTICO Nº 3 Parte A: Examen macroscópico de los microorganismos. OBJETIVOS - Caracterizar el desarrollo macroscópico de los microorganismos en medios de cultivo líquidos y sólidos - Adquirir
TRABAJO PRÁCTICO Nº 3 Parte A: Examen macroscópico de los microorganismos. OBJETIVOS - Caracterizar el desarrollo macroscópico de los microorganismos en medios de cultivo líquidos y sólidos - Adquirir
1. LEVINE EMB AGAR FOTO 6. Medios de cultivo Levine EMG Agar.
 1. LEVINE EMB AGAR. El Agar EMB Levine es un medio selectivo y diferencial, adecuado para el crecimiento de Enterobacterias. Es un medio adecuado para la búsqueda y diferenciación de bacilos entéricos,
1. LEVINE EMB AGAR. El Agar EMB Levine es un medio selectivo y diferencial, adecuado para el crecimiento de Enterobacterias. Es un medio adecuado para la búsqueda y diferenciación de bacilos entéricos,
María Cristina Picón. Ernestina Susana Teisaire. Javier Gonzalo Montero.
 Guía de trabajos prácticos de Los microorganismos y sus asociaciones con animales invertebrados 4. Pruebas bioquímicas y morfológicas para la identificación de cepas bacterianas María Cristina Picón. Ernestina
Guía de trabajos prácticos de Los microorganismos y sus asociaciones con animales invertebrados 4. Pruebas bioquímicas y morfológicas para la identificación de cepas bacterianas María Cristina Picón. Ernestina
TRABAJO PRÁCTICO N 2 MEDIOS DE CULTIVO SIEMBRA Y TRANSPLANTE
 TRABAJO PRÁCTICO N 2 MEDIOS DE CULTIVO SIEMBRA Y TRANSPLANTE MEDIOS DE CULTIVO. Definición: es toda preparación artificial, sólida, semisólida o líquida que suministra al microorganismo cada una de las
TRABAJO PRÁCTICO N 2 MEDIOS DE CULTIVO SIEMBRA Y TRANSPLANTE MEDIOS DE CULTIVO. Definición: es toda preparación artificial, sólida, semisólida o líquida que suministra al microorganismo cada una de las
PRÁCTICA Nº 3 PROPIEDADES COLIGATIVAS: DETERMINACIÓN DE LA MASA MOLECULAR DE UN SOLUTO PROBLEMA POR CRIOSCOPIA
 PRÁCTICA Nº 3 PROPIEDADES COLIGATIVAS: DETERINACIÓN DE LA ASA OLECULAR DE UN SOLUTO PROBLEA POR CRIOSCOPIA OBJETIVOS: El objetivo de la práctica es el estudio del efecto que produce la adición de un soluto
PRÁCTICA Nº 3 PROPIEDADES COLIGATIVAS: DETERINACIÓN DE LA ASA OLECULAR DE UN SOLUTO PROBLEA POR CRIOSCOPIA OBJETIVOS: El objetivo de la práctica es el estudio del efecto que produce la adición de un soluto
Trabajo Práctico Nº 4 SACAROSA
 FUNDAMENTOS TEÓRICOS Trabajo Práctico Nº 4 SACAROSA PARTE A: PROPIEDADES COLIGATIVAS Si se disuelve un soluto en un líquido, hay ciertas propiedades de la solución que se irán modificando de acuerdo con
FUNDAMENTOS TEÓRICOS Trabajo Práctico Nº 4 SACAROSA PARTE A: PROPIEDADES COLIGATIVAS Si se disuelve un soluto en un líquido, hay ciertas propiedades de la solución que se irán modificando de acuerdo con
MARCO TEÓRICO. Título: Célula: estructura función. Diversidad celular. Docente: Rolando Hernández Lazo
 Título: Célula: estructura función. Diversidad celular. Docente: Rolando Hernández Lazo OBJETIVOS Al final de esta práctica el estudiante deberá comprobar que: Las células vegetales como las animales poseen
Título: Célula: estructura función. Diversidad celular. Docente: Rolando Hernández Lazo OBJETIVOS Al final de esta práctica el estudiante deberá comprobar que: Las células vegetales como las animales poseen
TRABAJO PRÁCTICO N 3: Identificación microbiana
 TRABAJO PRÁCTICO N 3: Identificación microbiana PARTE A: Identificación Fenotípica 1.-Pruebas Bioquímicas 2- Coloraciones 3. Uso del Manual Bergey Pruebas Bioquímicas Son una serie de pruebas que permiten
TRABAJO PRÁCTICO N 3: Identificación microbiana PARTE A: Identificación Fenotípica 1.-Pruebas Bioquímicas 2- Coloraciones 3. Uso del Manual Bergey Pruebas Bioquímicas Son una serie de pruebas que permiten
PRÁCTICO N 4 CARBOHIDRATOS
 PRÁCTICO N 4 CARBOHIDRATOS I. INTRODUCCIÓN. Los compuestos químicos de la célula se clasifican en dos grandes grupos: moléculas inorgánicas y moléculas orgánicas. Las primeras se caracterizan por la ausencia
PRÁCTICO N 4 CARBOHIDRATOS I. INTRODUCCIÓN. Los compuestos químicos de la célula se clasifican en dos grandes grupos: moléculas inorgánicas y moléculas orgánicas. Las primeras se caracterizan por la ausencia
Protocolos Laboratorio de Microbiología Experimental 2014 PREPARACIONES MICROBIOLÓGICAS
 PREPARACIONES MICROBIOLÓGICAS Objetivos PREPARACIONES HÚMEDAS (EN FRESCO) Al finalizar esta práctica el alumno será capaz de: Realizar diferentes preparaciones microbiológicas a partir de muestras naturales.
PREPARACIONES MICROBIOLÓGICAS Objetivos PREPARACIONES HÚMEDAS (EN FRESCO) Al finalizar esta práctica el alumno será capaz de: Realizar diferentes preparaciones microbiológicas a partir de muestras naturales.
Qué especie actúa generalmente como comburente? Es esta especie el único comburente? Objetivo: Demostrar el papel del oxígeno como comburente.
 RESUMEN: Aquí podrás encontrar algunas actividades experimentales que te podrán resultar útiles para la unidad de proceso de combustión, del programa de 2 EMT opciones: Electromecánica, Electro-electró
RESUMEN: Aquí podrás encontrar algunas actividades experimentales que te podrán resultar útiles para la unidad de proceso de combustión, del programa de 2 EMT opciones: Electromecánica, Electro-electró
PROCEDIMIENTO RECUENTO DE COLIFORMES EN MEDIO SÓLIDO
 PRT-712.03-008 Página 1 de 6 1. OBJETIVO Este método es utilizado para realizar recuento de bacterias del grupo coliformes, como indicador sanitario. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento
PRT-712.03-008 Página 1 de 6 1. OBJETIVO Este método es utilizado para realizar recuento de bacterias del grupo coliformes, como indicador sanitario. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento
LABORATORIO DE QUÍMICA ANALÍTICA I LQ-218. Práctica de Laboratorio No. 3 CALIBRACIÓN DE MATERIAL VOLUMÉTRICO ANALÍTICO
 UNIVERSIDAD NACIONAL AUTÓNOMA DE HONDURAS FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA DEPARTAMENTO DE QUÍMICA LABORATORIO DE QUÍMICA ANALÍTICA I LQ-218 Práctica de Laboratorio No. 3 COMPETENCIAS A LOGRAR:
UNIVERSIDAD NACIONAL AUTÓNOMA DE HONDURAS FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA DEPARTAMENTO DE QUÍMICA LABORATORIO DE QUÍMICA ANALÍTICA I LQ-218 Práctica de Laboratorio No. 3 COMPETENCIAS A LOGRAR:
Práctica # 2: Reconocimiento de Material de Laboratorio Y Técnicas Experimentales
 República Bolivariana de Venezuela Ministerio del poder popular para la Educación Unidad Educativa Colegio Aplicación Palo Gordo-Edo. Táchira Lcda. Katherine Gómez Práctica # 2: Reconocimiento de Material
República Bolivariana de Venezuela Ministerio del poder popular para la Educación Unidad Educativa Colegio Aplicación Palo Gordo-Edo. Táchira Lcda. Katherine Gómez Práctica # 2: Reconocimiento de Material
PROCESAMIENTO DE MUESTRAS VAGINALES
 PROCESAMIENTO DE MUESTRAS VAGINALES Proyecto AECID 2012 Nuevos procedimientos para el diagnóstico de enfermedades olvidadas utilizando tele-microscopía de bajo coste. 1 TABLA DE CONTENIDOS TOMA DE LA MUESTRA
PROCESAMIENTO DE MUESTRAS VAGINALES Proyecto AECID 2012 Nuevos procedimientos para el diagnóstico de enfermedades olvidadas utilizando tele-microscopía de bajo coste. 1 TABLA DE CONTENIDOS TOMA DE LA MUESTRA
Taxonomía bacteriana
 Página 1 Unidad Temática 5 Taxonomía bacteriana (Guía de estudio) Benintende, S; Sánchez, C., Sterren, M. Y Musante, C Objetivo El objetivo de la Taxonomía bacteriana es dar un ordenamiento de las unidades
Página 1 Unidad Temática 5 Taxonomía bacteriana (Guía de estudio) Benintende, S; Sánchez, C., Sterren, M. Y Musante, C Objetivo El objetivo de la Taxonomía bacteriana es dar un ordenamiento de las unidades
CINÉTICA. FACTORES QUE AFECTAN LA VELOCIDAD DE UNA REACCIÓN QUÍMICA
 1. INTRODUCCION El área de la química que estudia la velocidad de las reacciones es llamada Cinética Química. La velocidad de reacción se refiere al cambio de concentración de un reactivo o producto en
1. INTRODUCCION El área de la química que estudia la velocidad de las reacciones es llamada Cinética Química. La velocidad de reacción se refiere al cambio de concentración de un reactivo o producto en
PRACTICA No.9 REACCIONES QUIMICAS I
 PRACTICA No.9 REACCIONES QUIMICAS I INTRODUCCION: Las transformaciones de la materia se conocen como REACCIONES QUIMICAS. En ellas se opera un cambio en la estructura íntima de las sustancias reaccionantes
PRACTICA No.9 REACCIONES QUIMICAS I INTRODUCCION: Las transformaciones de la materia se conocen como REACCIONES QUIMICAS. En ellas se opera un cambio en la estructura íntima de las sustancias reaccionantes
BIORREACTRES. Estudios básicos y aplicados sobre procesos de fermentación
 BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
UNIVERSIDAD INTERAMERICANA DE PUERTO RICO RECINTO DE ARECIBO DEPARTAMENTO DE CIENCIAS Y TECNOLOGÍA BIOL 3405: LABORATORIO DE INMUNOLOGÍA
 UNIVERSIDAD INTERAMERICANA DE PUERTO RICO RECINTO DE ARECIBO DEPARTAMENTO DE CIENCIAS Y TECNOLOGÍA BIOL 3405: LABORATORIO DE INMUNOLOGÍA I. TÍTULO Dilución II. OBJETIVOS Repasar el concepto de dilución
UNIVERSIDAD INTERAMERICANA DE PUERTO RICO RECINTO DE ARECIBO DEPARTAMENTO DE CIENCIAS Y TECNOLOGÍA BIOL 3405: LABORATORIO DE INMUNOLOGÍA I. TÍTULO Dilución II. OBJETIVOS Repasar el concepto de dilución
PRACTICA 3 TECNICAS BASICAS DE CULTIVO
 PRACTICA 3 TECNICAS BASICAS DE CULTIVO OBJETIVOS DE APRENDIZAJE: Cuando haya realizado el experimento, usted deberá ser capaz de: 1. Llevar a cabo la técnica de transferencia aséptica de microorganismos
PRACTICA 3 TECNICAS BASICAS DE CULTIVO OBJETIVOS DE APRENDIZAJE: Cuando haya realizado el experimento, usted deberá ser capaz de: 1. Llevar a cabo la técnica de transferencia aséptica de microorganismos
RECOPILADO POR: EL PROGRAMA UNIVERSITARIO DE ALIMENTOS
 NMX-F-310-1978. DETERMINACIÓN DE CUENTA DE STAPHYLOCOCCUS AUREUS COAGULASA POSITIVA, EN ALIMENTOS. METHOD OF TEST FOR COUNT OF STAPHYLOCOCCUS AUREUS IN FOOD. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS.
NMX-F-310-1978. DETERMINACIÓN DE CUENTA DE STAPHYLOCOCCUS AUREUS COAGULASA POSITIVA, EN ALIMENTOS. METHOD OF TEST FOR COUNT OF STAPHYLOCOCCUS AUREUS IN FOOD. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS.
PRÁCTICA 5. TEJIDOS VEGETALES III. TEJIDO EPIDÉRMICO Y PERIDÉRMICO.
 UNIVERSIDAD DE GUADALAJARA CENTRO UNIVERSITARIO DE LOS LAGOS INGENIERÍA EN BIOQUÍMICA MATERIA: BOTÁNICA SEMESTRE: 2014B PROF. DRA. EN C. SOFÍA LOZA CORNEJO PRÁCTICA 5. TEJIDOS VEGETALES III. TEJIDO EPIDÉRMICO
UNIVERSIDAD DE GUADALAJARA CENTRO UNIVERSITARIO DE LOS LAGOS INGENIERÍA EN BIOQUÍMICA MATERIA: BOTÁNICA SEMESTRE: 2014B PROF. DRA. EN C. SOFÍA LOZA CORNEJO PRÁCTICA 5. TEJIDOS VEGETALES III. TEJIDO EPIDÉRMICO
Práctica 1. Separación de Mezclas Protocolo 2
 Equipo: Preguntas a responder al final de la sesión Práctica 1. Separación de Mezclas Protocolo 2 Qué tipo de mezcla se te proporcionó y cómo lo determinaste? Cuántos y cuáles son los métodos de separación
Equipo: Preguntas a responder al final de la sesión Práctica 1. Separación de Mezclas Protocolo 2 Qué tipo de mezcla se te proporcionó y cómo lo determinaste? Cuántos y cuáles son los métodos de separación
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
Unidad 3. Estudio de cultivos bacterianos puros Práctica 4. Técnicas de siembra y cultivo de bacterias
 Unidad 3. Estudio de cultivos bacterianos puros Práctica 4. Técnicas de siembra y cultivo de bacterias Objetivos Aplicar las diferentes técnicas de siembra que se emplean para el estudio y asilamiento
Unidad 3. Estudio de cultivos bacterianos puros Práctica 4. Técnicas de siembra y cultivo de bacterias Objetivos Aplicar las diferentes técnicas de siembra que se emplean para el estudio y asilamiento
Estructura y Morfología bacteriana 6:41
 Estructura y Morfología bacteriana PROFESOR: JOSÉ AMARO SUAZO Generalidades estructurales Bacteria: bacterium = bastón Características Ribosoma 70S Pared bacteriana Ausencia de esteroles Ausencia de mitocondrias,
Estructura y Morfología bacteriana PROFESOR: JOSÉ AMARO SUAZO Generalidades estructurales Bacteria: bacterium = bastón Características Ribosoma 70S Pared bacteriana Ausencia de esteroles Ausencia de mitocondrias,
Material de uso frecuente en el laboratorio de química. Figura Nombre Uso / Características. Crisol. Espátula de porcelana. Capsula de porcelana
 Material de uso frecuente en el laboratorio de química. En un Laboratorio de Química se utiliza una amplia variedad de instrumentos o herramientas que, en su conjunto, se denominan material de laboratorio.
Material de uso frecuente en el laboratorio de química. En un Laboratorio de Química se utiliza una amplia variedad de instrumentos o herramientas que, en su conjunto, se denominan material de laboratorio.
EXTRACTOS Y TINTURAS. María Eugenia Ávila M. Q. F. Directora Técnica Y Jefe de Producción LABFARVE
 EXTRACTOS Y TINTURAS María Eugenia Ávila M. Q. F. Directora Técnica Y Jefe de Producción LABFARVE EXTRACCIÓN Es el proceso opuesto a la deshidratación o secado de la planta. Generalmente se utilizan líquidos
EXTRACTOS Y TINTURAS María Eugenia Ávila M. Q. F. Directora Técnica Y Jefe de Producción LABFARVE EXTRACCIÓN Es el proceso opuesto a la deshidratación o secado de la planta. Generalmente se utilizan líquidos
LIMPIEZA Y DESINFECCION
 PAGINA: 1 de 7 1. DEFINICION: Es el procedimiento, mediante el cual son eliminados los diferentes desechos generados en los procesos de recolección y procesamiento de muestras; y además se describe el
PAGINA: 1 de 7 1. DEFINICION: Es el procedimiento, mediante el cual son eliminados los diferentes desechos generados en los procesos de recolección y procesamiento de muestras; y además se describe el
Métodos de aislamiento
 Métodos de aislamiento Aislamiento de hongos y bacterias Unidad de Fitopatología Dto. de Protección Vegetal Facultad de Agronomía. Dr. Pedro Mondino Métodos de aislamiento Técnicas de Aislamiento de hongos
Métodos de aislamiento Aislamiento de hongos y bacterias Unidad de Fitopatología Dto. de Protección Vegetal Facultad de Agronomía. Dr. Pedro Mondino Métodos de aislamiento Técnicas de Aislamiento de hongos
MEDIOS DE CULTIVO Y TINCIÓN DE GRAM
 MEDIOS DE CULTIVO Y TINCIÓN DE GRAM AUTORIA AZAHARA CABRERA ORTEGA TEMÁTICA PRÁCTICAS ETAPA EDUCACIÓN SECUNDARIA POSTOBLIGATORIA Resumen Tanto los medios de cultivo como la realización de tinciones de
MEDIOS DE CULTIVO Y TINCIÓN DE GRAM AUTORIA AZAHARA CABRERA ORTEGA TEMÁTICA PRÁCTICAS ETAPA EDUCACIÓN SECUNDARIA POSTOBLIGATORIA Resumen Tanto los medios de cultivo como la realización de tinciones de
BRICOLAJE - CONSTRUCCIÓN - DECORACIÓN - JARDINERÍA. Hacer un trasdosado con placas de cartón-yeso (Pladur)
 BRICOLAJE - CONSTRUCCIÓN - DECORACIÓN - JARDINERÍA Hacer un trasdosado con placas de cartón-yeso (Pladur) www.leroymerlin.es Leroy Merlin, S.A., 00 www.leroymerlin.es Leroy Merlin, S.A., 00 HERRAMIENTAS
BRICOLAJE - CONSTRUCCIÓN - DECORACIÓN - JARDINERÍA Hacer un trasdosado con placas de cartón-yeso (Pladur) www.leroymerlin.es Leroy Merlin, S.A., 00 www.leroymerlin.es Leroy Merlin, S.A., 00 HERRAMIENTAS
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA QUIMICA PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA QUIMICA PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010 CARBOHIDRATOS ELABORADO POR: LICDA. LUCRECIA CASASOLA DE LEIVA
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA QUIMICA PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010 CARBOHIDRATOS ELABORADO POR: LICDA. LUCRECIA CASASOLA DE LEIVA
SEMANA 25 PROPIEDADES QUÍMICAS Y FÍSICAS DE CARBOHIDRATOS Elaborado por: Licda. Vivian Margarita Sánchez Garrido
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS-CUM UNIDAD DIDÁCTICA QUÍMICA- PRIMER AÑO PRÁCTICAS DE LABORATORIO 2016 SEMANA 25 PROPIEDADES QUÍMICAS Y FÍSICAS DE CARBOHIDRATOS Elaborado
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS-CUM UNIDAD DIDÁCTICA QUÍMICA- PRIMER AÑO PRÁCTICAS DE LABORATORIO 2016 SEMANA 25 PROPIEDADES QUÍMICAS Y FÍSICAS DE CARBOHIDRATOS Elaborado
Estados de la materia y cambios de fase
 3 Año de Química: Sistemas Materiales Prof. Javier Ponce Qué es Ciencia? Ciencia (en latíns cientia, de scire, conocer ), término que en su sentido más amplio se emplea para referirse al conocimiento sistematizado
3 Año de Química: Sistemas Materiales Prof. Javier Ponce Qué es Ciencia? Ciencia (en latíns cientia, de scire, conocer ), término que en su sentido más amplio se emplea para referirse al conocimiento sistematizado
MUESTREO Y DETERMINACIÓN DE LARVAS DE MEJILLÓN CEBRA
 MUESTREO Y DETERMINACIÓN DE LARVAS DE MEJILLÓN CEBRA Octubre 2006 ÍNDICE DE CONTENIDO 1. FUNDAMENTO DEL MÉTODO 2. MATERIAL NECESARIO 3. PREPARACIÓN DE LA MUESTRA 4. PROCEDIMIENTO OPERATIVO 5. IDENTIFICACIÓN
MUESTREO Y DETERMINACIÓN DE LARVAS DE MEJILLÓN CEBRA Octubre 2006 ÍNDICE DE CONTENIDO 1. FUNDAMENTO DEL MÉTODO 2. MATERIAL NECESARIO 3. PREPARACIÓN DE LA MUESTRA 4. PROCEDIMIENTO OPERATIVO 5. IDENTIFICACIÓN
TEMA 3 EL DIAGNÓSTICO MICROBIOLÓGICO
 TEMA 3 EL DIAGNÓSTICO MICROBIOLÓGICO FUNDAMENTOS DEL DIAGNÓSTICO DE LAS INFECCIONES DE VIAS URINARIAS METODOLOGÍA UTILIZADA PARA EL DIAGNÓSTICO DE INFECCION URINARIA DIAGNÓSTICO MICROBIOLÓGICO DIAGNOSTICO
TEMA 3 EL DIAGNÓSTICO MICROBIOLÓGICO FUNDAMENTOS DEL DIAGNÓSTICO DE LAS INFECCIONES DE VIAS URINARIAS METODOLOGÍA UTILIZADA PARA EL DIAGNÓSTICO DE INFECCION URINARIA DIAGNÓSTICO MICROBIOLÓGICO DIAGNOSTICO
CARRERA DE MEDICINA GUÍA DE PRÁCTICA DE LABORATORIO
 ASIGNATURA: BIOLOGÍA CELULAR Y GENÉTICA CICLO: PRIMERO SEMESTRE: A 2014 ÁREA: CIENCIAS MORFOFUNCIONALES MALLA: 6 NÚMERO HORAS SEMANALES DE LA PRÁCTICA: 2 NIVEL CURRICULAR: BÁSICO (CIENCIAS BÁSICAS) LABORATORIO:
ASIGNATURA: BIOLOGÍA CELULAR Y GENÉTICA CICLO: PRIMERO SEMESTRE: A 2014 ÁREA: CIENCIAS MORFOFUNCIONALES MALLA: 6 NÚMERO HORAS SEMANALES DE LA PRÁCTICA: 2 NIVEL CURRICULAR: BÁSICO (CIENCIAS BÁSICAS) LABORATORIO:
UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO
 UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE QUÍMICA ORGÁNICA DETERMINACIÓN DE HALÓGENOS TRABAJO PRÁCTICO Nº:... NOMBRE Y APELLIDO:... FECHA:...
UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE QUÍMICA ORGÁNICA DETERMINACIÓN DE HALÓGENOS TRABAJO PRÁCTICO Nº:... NOMBRE Y APELLIDO:... FECHA:...
MANEJO DE SOLUCIONES DESINFECTANTES
 PAGINA: 1 de 8 REVISADO: ELABORADO: COORDINADOR DE CALIDAD 1. DEFINICION ENFERMERO JEFE COORDINADOR CIRUGIA Las soluciones desinfectantes son sustancias que actúan sobre los microorganismos inactivándolos
PAGINA: 1 de 8 REVISADO: ELABORADO: COORDINADOR DE CALIDAD 1. DEFINICION ENFERMERO JEFE COORDINADOR CIRUGIA Las soluciones desinfectantes son sustancias que actúan sobre los microorganismos inactivándolos
MICROBIOLOGIA E INMUNOLOGIA PARTE A
 UNIVERSIDAD NACIONAL DE SAN LUIS LICENCIATURA EN BIOLOGIA MOLECULAR MICROBIOLOGIA E INMUNOLOGIA PARTE A GUIA DE TRABAJOS PRACTICOS Personal docente Personal de asistencia técnica Prof. Responsable: Dra.
UNIVERSIDAD NACIONAL DE SAN LUIS LICENCIATURA EN BIOLOGIA MOLECULAR MICROBIOLOGIA E INMUNOLOGIA PARTE A GUIA DE TRABAJOS PRACTICOS Personal docente Personal de asistencia técnica Prof. Responsable: Dra.
Trabajo práctico Nº 6. Introducción. Ejercicio teórico MORFOLOGÍA Y TINCIÓN DE LOS MICROORGANISMOS. Objetivo. Procedimiento.
 Introducción Ejercicio teórico Objetivo Trabajo práctico Nº 6 MORFOLOGÍA Y TINCIÓN DE LOS MICROORGANISMOS Procedimiento Resultados Actividades adicionales Bibliografía INTRODUCCIÓN Una de las características
Introducción Ejercicio teórico Objetivo Trabajo práctico Nº 6 MORFOLOGÍA Y TINCIÓN DE LOS MICROORGANISMOS Procedimiento Resultados Actividades adicionales Bibliografía INTRODUCCIÓN Una de las características
APÉNDICE G. Identificación bioquímica de enterobacterias por el sistema API 20E
 APÉNDICE G Identificación bioquímica de enterobacterias por el sistema API 20E OBJETIVO: - Establecer la metodología en la identificación de enterobacterias por medio de pruebas bioquímicas estandarizadas
APÉNDICE G Identificación bioquímica de enterobacterias por el sistema API 20E OBJETIVO: - Establecer la metodología en la identificación de enterobacterias por medio de pruebas bioquímicas estandarizadas
Miel de abejas - Método de muestreo
 Vencimiento consulta pública: 2006.12.29 PROYECTO DE NORMA EN CONSULTA PUBLICA NCh617.cR2006 Miel de abejas - Método de muestreo Preámbulo El Instituto Nacional de Normalización, INN, es el organismo que
Vencimiento consulta pública: 2006.12.29 PROYECTO DE NORMA EN CONSULTA PUBLICA NCh617.cR2006 Miel de abejas - Método de muestreo Preámbulo El Instituto Nacional de Normalización, INN, es el organismo que
PROCEDIMIENTO RECUENTO DE LACTOBACILLUS BULGARICUS Y STREPTOCOCCUS THERMOPHILUS EN YOGURT. APHA 17 Edición, modificado. PRT-712.02-047 Página 1 de 8
 PRT-712.02-047 Página 1 de 8 1. OBJETIVO Conocer el número de Lactobacillus bulgaricus y Streptococcus thermophilus (microorganismos característicos del yogurt) presentes en una muestra de yogurt. 2. CAMPO
PRT-712.02-047 Página 1 de 8 1. OBJETIVO Conocer el número de Lactobacillus bulgaricus y Streptococcus thermophilus (microorganismos característicos del yogurt) presentes en una muestra de yogurt. 2. CAMPO
Fisiología Bacteriana. Tarea de aula I Técnicas básicas de Microbiología Control microbiológico Siembra y aislamiento
 Fisiología Bacteriana Tarea de aula I Técnicas básicas de Microbiología Control microbiológico Siembra y aislamiento Objetivo de la Microbiología: Identificación y caracterización de microorganismos Técnicas
Fisiología Bacteriana Tarea de aula I Técnicas básicas de Microbiología Control microbiológico Siembra y aislamiento Objetivo de la Microbiología: Identificación y caracterización de microorganismos Técnicas
