IMPLICACIÓN DE LOS GENES MAPT Y PGRN EN LA DEGENERACIÓN LOBAR FRONTOTEMPORAL: MECANISMOS PATOGÉNICOS Y EXPRESIÓN FENOTÍPICA.
|
|
|
- Purificación Gómez Gil
- hace 6 años
- Vistas:
Transcripción
1 IMPLICACIÓN DE LOS GENES MAPT Y PGRN EN LA DEGENERACIÓN LOBAR FRONTOTEMPORAL: MECANISMOS PATOGÉNICOS Y EXPRESIÓN FENOTÍPICA. TESIS DOCTORAL ALBERT LLADÓ PLARRUMANÍ
2
3 IMPLICACIÓN DE LOS GENES MAPT Y PGRN EN LA DEGENERACIÓN LOBAR FRONTOTEMPORAL: MECANISMOS PATOGÉNICOS Y EXPRESIÓN FENOTÍPICA. Albert Lladó Plarrumaní Tesis Doctoral realizada en la Unitat d Alzheimer i altres trastorns cognitius y laboratorio de neurología experimental del Servei de Neurologia del Hospital Clínic de Barcelona y laboratorio de la Unitat de Genètica del Departament de Ciències Experimentals i de la Salut de la Universitat Pompeu Fabra de Barcelona. Programa de doctorado en Biopatología en Medicina bienio , Departament de Medicina. JOSÉ LUIS MOLINUEVO GUIX, Doctor en Medicina y Cirugía por la Universidad de Barcelona y EDUARDO TOLOSA SARRÓ, Catedrático de la Universidad de Barcelona, CERTIFICAMOS que la memoria titulada IMPLICACIÓN DE LOS GENES MAPT Y PGRN EN LA DEGENERACIÓN LOBAR FRONTOTEMPORAL: MECANISMOS PATOGÉNICOS Y EXPRESIÓN FENOTÍPICA, presentada por ALBERT LLADÓ PLARRUMANÍ, ha estado realizada bajo nuestra dirección y consideramos que reúne las condiciones necesarias para ser defendida ante el Tribunal correspondiente para optar al Grado de Doctor en Medicina y Cirugía. José Luis Molinuevo Guix Eduardo Tolosa Sarró Barcelona, noviembre 2007
4
5 De tantes coses parlàrem, Del que hem viscut i del que viurem, Del mal que ens han vingut fent, Del poc que hem après encara, Del molt que ja hauríem de saber Raimon A la memòria del pare i l àvia Carmeta A la mare, a la Sílvia A l Alba i l Anna.
6
7 AGRAÏMENTS Crec que no hi ha manera mes justa d iniciar aquestes pàgines que agraint la col laboració rebuda de les persones que han estat al meu costat en el dia a dia i que han fet possible aquest treball. En primer lloc, agrair a tots els pacients afectes de degeneració lobar frontotemporal i els seus familiars la seva col laboració desinteressada en aquest projecte i la seva confiança en la recerca. Als directors de la tesis. Al Dr José Luis Molinuevo per la confiança, el suport i l estímul per la recerca. Al Dr Eduardo Tolosa per les seves aportacions i el temps dedicat. A la Dra Raquel Sánchez del Valle per la seva constant col laboració i les nombroses aportacions a aquest treball. Al tots als membres del laboratori de neurologia experimental. Especialment al Dr Mario Ezquerra per transmetrem coneixements de genètica i donar-me suport sempre que he necessitat i al Manel Fernández, per les estones compartides al laboratori i la seva imprescindible ajuda tècnica. A tots els membres del Banc de teixits neurològics de la Universitat de Barcelona-Hospital Clínic per la seva col laboració. En especial al Dr Isidre Ferrer i la Dra M Jesús Rey per les aportacions en el camp de neuropatologia. Als companys del laboratori de la Unitat de Genètica del Departament de Ciències experimentals i de la Salut de la Universitat Pompeu Fabra. Especialment al Dr Luis Alberto Perez-Jurado, Dr Benjamin Rodríguez i Dra Ivon Cuscó, per oferir-me la oportunitat de poder treballar amb ells, ampliar els meus coneixements de genètica i biologia molecular i aprendre noves técniques. Als companys de la Unitat d Alzheimer i altres trastorns cognitius del servei de Neurologia del Hospital Clínic de Barcelona. A la Dra AmparoVillar per la seva ajuda en la selecció de pacients, a l equip de neuropsicòlogues (Dra Lorena Rami, Claudia Caprile, Bea Bosch) per la valoració neuropsicològica dels pacients estudiats i a la Guada Fernández per l extracció de sang dels pacients del nostre centre. Al Dr Francesc Graus per introduir-me en el món de la recerca durant la meva residència. A tots els companys dels anys de la residència i post-residència, pel companyarisme, per la humanitat envers els pacients i per la lluita diària. Especialment al Dr Carles Gaig per facilitarme tots els seus coneixements en estudis d expressió gènica cerebral. A tots els metges que han proporcionat la informació clínica necessària per la realització d aquest treball i han enviat mostres de DNA de pacients amb DLFT, especialment al Dr Ramon Reñé i Dr Jaume Campdelacreu. A l Hospital Clínic per la concessió del premi fi de residència Emili Letang que va permetre l inici d aquest treball i a Pfizer-Eisai per la beca que ha permés la seva continuació. Un agraïment molt especial a la família. A la mare per l educació de tants anys i per la confiança sempre dipositada en mi. A la Sílvia per l estimació que sempre m ha transmès. Al Rubèn, la Isabel i l Eduard per fer-me somriure tot sovint i perquè la vida sense cunyats no seria el mateix. A la Queralt per jugar, distreurem i fer-me gaudir de molts caps de setmana. Al Jaume i l Assumpció per fer-me costat en tot moment. Al pare i a l àvia Carmeta, perquè malgrat ja fa uns anys no estan entre nosaltres, el seu exemple i el seu record han sigut un estímul per intentar fer les coses ben fetes. 7
8 A l Alba, per la il lusió i l alegria que la seva arribada m ha proporcionat, pels somriures, per l estimació i per deixar-me algun ratet per escriure les pàgines que venen a continuació. Finament a l Anna per fer-me costat en tot moment, per l ajuda en la realització d aquesta tesis, pels seus consells de genètica, però molt especialment per l amor que sempre m ha donat, per tots els moments que hem passat junts, pel petits esforços del dia a dia, per ser una dona, una mare i una investigadora meravellosa. 8
9 ÍNDICE INTRODUCCIÓN 1 1. DEGENERACIÓN LOBAR FRONTOTEMPORAL 3 2. GEN MAPT 5 3. GEN PGRN 15 HIPÓTESIS 21 OBJETIVOS 25 MATERIAL Y MÉTODOS 29 RESULTADOS A novel MAPT mutation (P301T) associated with familial frontotemporal dementia Late-onset frontotemporal dementia associated with a novel PGRN mutation MAPT gene duplications are not a cause of frontotemporal lobar degeneration Brain tau expression and correlation with the H1/H1 tau genotype in frontotemporal lobar degeneration patients Clinicopathological and genetic correlates of frontotemporal lobar degeneration and corticobasal degeneration Clinical and pathological heterogeneity of neuronal intermediate filament inclusion disease (NIFID) Resultados no publicados 71 DISCUSIÓN MUTACIONES HALLADAS Y EPIDEMIOLOGÍA MECANISMOS PATOGÉNICOS FENOTIPO CLÍNICO DE LAS MUTACIONES DETERMINANTES EN LOS GENES MAPT Y PGRN FENOTIPO PATOLÓGICO DE LAS MUTACIONES DETERMINANTES EN LOS GENES MAPT Y PGRN CORRELACIÓN GENETICO-CLINICO-PATOLOGICA EN LA DLFT 83 CONCLUSIONES 85 BIBLIOGRAFÍA 89
10
11 INTRODUCCIÓN 1
12 2
13 1. DEGENERACIÓN LOBAR FRONTOTEMPORAL 1.1 Descripción y epidemiología de la degeneración lobar frontotemporal La degeneración lobar frontotemporal (DLFT) es un término que, independiente de la neuropatología subyacente, engloba 3 síndromes clínicos diferentes: la variante frontal de la DLFT (DLFT-vf) o demencia frontotemporal, la afasia progresiva no fluente (APNF) y la demencia semántica (DS), que representan respectivamente un 75%, 15% y 10% de su forma de presentación (Neary et al., 1998; Pickering-Brown et al., 2007). La edad de inicio de la DLFT se sitúa habitualmente entre la quinta y sexta década de la vida, si bien estudios epidemiológicos encuentran que una cuarta parte de los pacientes con DLFT inician la sintomatología en edades superiores a los 65 años (Rosso et al., 2003). Se estima que entre el 10-15% de los casos de demencia degenerativa primaria corresponden a DLFT, siendo la segunda causa de demencia neurodegenerativa en pacientes menores de 65 años. 1.2 Genética de la degeneración lobar frontotemporal Alrededor de un 20-40% de pacientes con DLFT tiene antecedentes familiares de dicha enfermedad (Poorkaj et al., 2001; Rosso et al., 2003). Este elevado porcentaje sugiere que en la etiología de la DLFT existe un componente genético importante (Snowden et al., 2002). Sin embargo, la genética de la DLFT es compleja, identificándose en los últimos años 7 loci cromosómicos relacionados (uno en el cromosoma 3, tres en el cromosoma 9 y tres en el cromosoma 17) (Pickering- Brown et al., 2007). Entre ellos se han identificado 4 genes causantes de DLFT: los genes Microtubule-associated protein tau (MAPT) y Progranulina (PGRN) en el cromosoma 17, el gen Charged multivesicular body protein 2B (CHMP2B) en el cromosoma 3 y el gen valosin-containing protein (VCP) en el cromosoma 9 (Hutton et al., 1998; Watts et al., 2004; Skibinski et al., 2005; Baker et al., 2006; Cruts et al., 2006). Entre ellos las mutaciones en los genes MAPT y PGRN son las más prevalentes y serán comentadas ampliamente en los apartados siguientes. El gen CHMP2B se identificó recientemente en una familia danesa con DLFT-vf ligada al cromosoma 3 (Skibinski et al., 2005). Estudios posteriores han evidenciado que mutaciones en este gen son causa muy infrecuente de DLFT (Cannon et al., 2006). El otro gen causante de DLFT descrito es el gen VCP asociado a un perfil clínico muy específico que incluye miopatía por cuerpos de inclusión, enfermedad ósea de Paget y DLFT-vf (Schröder et al., 2005). 1.3 Aspectos clínicos de la degeneración lobar frontotemporal La DLFT se caracteriza clínicamente por una alteración conductual y/o del lenguaje, y a diferencia de la enfermedad de Alzheimer (EA) existe una relativa preservación de la memoria y las capacidades visuoespaciales en los estadios iniciales de la enfermedad. En la DLFT-vf predomina el 3
14 trastorno conductual y un cambio progresivo en la personalidad que conllevan dificultades en modular el comportamiento, así como respuestas o actividades inapropiadas. Cuando predomina el trastorno del lenguaje, podemos encontrarnos ante la APNF en la que destaca la dificultad para generar un lenguaje gramaticalmente correcto con una fluencia disminuida y preservación inicial de la comprensión, o ante la DS en la que predomina la pérdida del significado de las palabras, de la comprensión de órdenes y anomia con relativa preservación de los aspectos fonológicos y sintácticos. A los síntomas cognitivo-conductuales a menudo se le añaden síntomas parkinsonianos o de enfermedad de motoneurona (DLFT-ELA) (Lomen-Hoerth et al., 2002). Para el diagnóstico clínico de estas entidades se utilizan los criterios consensuados en 1998 (Neary et al., 1998), los cuales presentan una alta especificidad si bien su sensibilidad es baja (Méndez et al., 2007). La duración de la enfermedad oscila entre 3 y 15 años. Estudios de neuroimagen estructural evidencian que los pacientes con DLFT-vf presentan un patrón de atrofia con afectación frontal y temporal anterior (Cárdenas et al., 2007). Las pruebas de neuroimagen funcional como la espectroscopia de emisión de fotón único (SPECT) y la tomografía por emisión de positrones (PET), son capaces de detectar alteraciones en la perfusión y/o metabolismo en áreas frontales y temporales más precozmente que las pruebas de neuroimagen estructural presentando una mayor sensibilidad en el diagnóstico de DLFT-vf (Méndez et al., 2007). Por otro lado, estudios morfométricos han mostrado que la APNF se asocia a una atrofia insular y frontal inferior izquierda y la DS a una atrofia de predominio en el polo anterior temporal con frecuencia asimétrica (Gorno-Tempini et al., 2004). 1.4 Anatomía patológica de la degeneración lobar frontotemporal El diagnóstico definitivo de la DLFT requiere el examen neuropatológico. A nivel neuropatológico el diagnóstico de DLFT incluye diferentes grupos de enfermedades neurodegenerativas con una afectación principal de los lóbulos frontal y temporal. Recientemente se ha llevado a cabo una revisión y actualización de los criterios diagnósticos neuropatológicos utilizados hasta la actualidad (McKhann et al., 2001), con el objetivo de incluir las nuevas entidades descritas, las alteraciones genéticas causantes de enfermedad y los nuevos avances en bioquímica molecular (Cairns et al., 2007) (Tabla 1). A nivel macroscópico la DLFT se caracteriza por una atrofia simétrica focal de los lóbulos frontales y/o temporales. Sin embargo, algunos pacientes presentan una marcada asimetría, especialmente de la región perisilviana (Hodges et al., 2004; Cairns et al., 2007). En algunos casos también existe una atrofia de los ganglios basales y una despigmentación de la sustancia negra. A nivel microscópico las tinciones con hematoxilina-eosina muestran una microvacuolización y pérdida neuronal, que es más evidente en la capa II del córtex afecto. También puede existir pérdida neuronal en los ganglios basales y sustancia negra. En la sustancia blanca se puede apreciar pérdida de mielina y gliosis astrocítica. El diagnóstico específico de la entidad causante de la DLFT requiere estudios inmunohistoquímicos con anticuerpos específicos (anticuerpos anti-tau, anti-ubiquitina, anti- 4
15 -amiloide, anti- -synucleina, anti-tdp-43, anti- -internexina) y estudios genéticos (MAPT, PGRN, VCP, CHMP2B) (Cairns et al., 2007). Los criterios neuropatológicos actuales establecen que las enfermedades neurodegenerativas asociadas a la DLFT clínica incluyen 7 subtipos neurohistológicos (Tabla 1) (Cairns et al., 2007). Este extenso espectro de subtipos de DLFT se puede dividir en dos amplias subdivisiones patológicas: aquellos casos con patología tau-positiva y aquellos con patología tau-negativa. El primer grupo incluiría la DLFT con cuerpos de Pick, la degeneración corticobasal (DCB), la parálisis supranuclear progresiva (PSP), la enfermedad por granos argirófilos, la taupatía multisistémica, la demencia con ovillos neurofibrilares y la DLFT asociada a mutaciones MAPT (McKhann et al., 2001; Forman et al 2006; Cairns et al., 2007). El segundo subgrupo incluiría la DLFT con inclusiones ubiquitin positivas (DLFT-U) (Cairns et al., 2007), la demencia sin hallazgos histológicos distintivos (DLDH), la enfermedad por inclusión neuronal de filamentos intermedios (NIFID) y la miopatía por cuerpos de inclusión con enfermedad ósea de Paget y DLFT-vf (McKhann et al., 2001; Cairns et al., 2003; Watts et al., 2004). Recientemente, la TAR DNA-binding protein 43 (TDP-43) ha sido identificada como el principal componente de las inclusiones ubiquitin-positivas-tau-negativas en casos esporádicos de DLFT con o sin motoneurona, casos esporádicos de ELA, y casos familiares con mutaciones en PGRN o VCP (Neumann et al., 2006; Cairns et al., 2007). Esta proteína, implicada en la regulación de la transcripción, define ahora una nuevo tipo de enfermedades neurodegenerativas, llamadas colectivamente proteinopatías TDP-43. Además no es infrecuente la coexistencia de los hallazgos característicos de DLFT con los de otras entidades, los cuales pueden contribuir al cuadro clínico de forma variable. Dentro de la DLFT, un mismo síndrome clínico (DLFT-vf, APNF o DS) puede ser causado por diferentes procesos patológicos, por lo que es de gran interés el estudio de la correlación clínicopatológica con el objetivo de poder conocer si algunos datos clínicos pueden ayudar a predecir en vida cuales son las alteraciones bioquímicas y moleculares subyacentes a la enfermedad. Los estudios actuales muestran que en general la anatomía patológica de la DLFT es impredecible, si bien, y a pesar de la inconcordancia entre diferentes estudios, existirían algunos datos clínicos que podrían ser útiles. En este sentido la DS y la aparición de signos de motoneurona serían causados principalmente por una DLFT-U, mientras que las inclusiones tau-positivas serían el principal sustrato de la APNF (Hodges et al., 2004; Shi et al., 2005; Josephs et al., 2006b; Knibb et al., 2006). Sin embargo, es necesario el estudio de series amplias de casos para corroborar estas y nuevas asociaciones clínico-patológicas. 2. GEN MAPT El gen MAPT, que codifica la proteína asociada a microtúbulos tau, fue uno de los primeros candidatos en el estudio genético de la DLFT. En 1994, se estableció por primera vez una relación entre una forma de DLFT-vf y el cromosoma 17, que se denominó complejo desinhibición-demencia- 5
16 Tabla 1. Criterios para el diagnóstico neuropatológico de degeneración lobar frontotemporal (DLFT) propuestos por Cairns et al., Taupatía (con pérdida neuronal y gliosis asociada) con predominio de isoformas 3R en la tau insoluble, los diagnósticos más probables son: -DLFT con cuerpos de Pick -DLFT con mutaciones en MAPT 2. Taupatía (con pérdida neuronal y gliosis asociada) con predominio de isoformas 4R en la tau insoluble, los diagnósticos más probables son: -Degeneración corticobasal - Parálisis supranuclear progresiva -Enfermedad por granos argirófilos -Taupatía multisistémica esporádica con demencia - DLFT con mutaciones en MAPT 3. Taupatía (con pérdida neuronal y gliosis asociada) con predominio de isoformas 3R y 4R en la tau insoluble, los diagnósticos más probables son: - Demencia con ovillos neurofibrilares - DLFT con mutaciones en MAPT 4. Pérdida neuronal y gliosis frontotemporal sin inclusiones tau- or ubiquitin/p62-positivas, el diagnóstico más probable es: DLFT (también conocida como demencia sin hallazgos histológicos distintivos) 5. Proteinopatía TDP-43 asociada a pérdida neuronal e inclusions ubiquitin-positivas/p62- positivas tau-negativas con o sin enfermedad de motoneurona pero con inclusiones tipo-ela, iagnósticos más probables son: DLFT-U con enfermedad de motoneurona (DLFT -U tipos 1 3) DLFT -U sin enfermedad de motoneurona (DLFT -U tipos 1 3) DLFT -U con mutaciones en el gen PGRN (DLFT -U tipo 3) DLFT -U con mutaciones en el gen VCP (DLFT -U tipo 4) DLFT -U ligada al cromosoma 9p (DLFT -U tipo 2) Otras proteinopatías TDP-43 todavía no identificadas 6. Pérdida neuronal y gliosis frontotemporal con inclusiones ubiquitin-positivas/p62-positivas, TDP-43- y tau-negativas, los diagnósticos más probables son: DLFT con mutaciones en el gen CHMP2B Enfermedad por cuerpos de inclusión basófilos Otras DLFT U todavía no identificadas, no TDP-43 proteinopatías 7. Pérdida neuronal y gliosis frontotemporal con inclusiones ubiquitin/p62 y -internexinpositivas, el diagnóstico más probable es: Enfermedad por inclusión neuronal de filamentos intermedios (NIFID) parkinsonismo-amiotrofia (Lynch et al., 1994) y posteriormente demencia frontotemporal con parkinsonismo ligada al cromosoma 17 (DFTP-17). En 1998, 3 grupos de investigación identificaron las primeras mutaciones en el gen MAPT en 8 familias con DFTP-17 (Hutton et al., 1998; Poorkaj et al., 1998; Spillantini et al., 1998). Desde entonces se han identificado 41 mutaciones diferentes en más de 100 familias (Tabla 2). (Alzheimer Disease & Frontotemporal Dementia Mutation Database: hhtp:// 6
17 Tabla 2. Número y porcentaje de mutaciones en el gen MAPT descritas hasta la actualidad en cada exón e intrón del gen y número de familias afectas (Alzheimer Disease & Frontotemporal Dementia Mutation Database: hhtp:// Exón/intrón Número mutaciones (porcentaje) Número de familias (porcentaje) EX1 2 (4,88 %) 2 (1,71%) EX9 4 (9,76 %) 6 (5,13 %) IVS9 1 (2,44 %) 1 (0,85 %) EX10 11 (26,83 %) 54 (46,15%) IVS10 7 (17,07 %) 32 (27,35%) EX11 4 (9,76 %) 5 (4,27 %) EX12 7 (17,07 %) 7 (5,98 %) EX13 5 (12,20 %) 10 (8,55 %) Total La proteína tau es una fosfoproteína involucrada en el ensamblaje y estabilización de los microtúbulos jugando un papel importante en el mantenimiento de la integridad neuronal y en el transporte axonal. En el cerebro adulto existen 6 isoformas de tau, con una longitud entre 352 y 441 aminoácidos, todas ellas derivadas del gen MAPT a través del procesamiento alternativo de los exones 2, 3 y 10 (Figura 1) (Goedert et al., 1989). La interacción entre la proteína tau y los microtúbulos es mediada por los dominios repetitivos localizados en posición C-terminal y codificados por los exones 9 12 (Lee et al., 1989). En función de la presencia de 3 ó 4 de estas repeticiones, podemos subdividir las isoformas de tau en 2 subgrupos principales. Así, la inclusión del exón 10 produce isoformas con 4 repeticiones (4R), isoformas que predominan en los depósitos de tau de PSP y DCB, mientras que la exclusión de este exón proporciona isoformas con 3 repeticiones (3R), que predominan en la DLFT con cuerpos de Pick (Buée et al., 2000). En el cerebro adulto, la ratio 4R/3R es aproximadamente 1 (Goedert and Jakes, 1990). Además, el procesamiento alternativo de los exones 2 y 3 proporciona isoformas 3R y 4R con ninguna (0N), una (1N) o dos (2N) inserciones localizadas en la posición N-terminal y de función todavía desconocida. 2.1 Epidemiología La frecuencia de mutaciones en MAPT en pacientes con DLFT varía entre los diferentes estudios (Houlen et al., 1999; Rizzu et al., 1999; Binetti et al., 2003; Stanford et al., 2004; Le Ber et al., 2007). En general dichas mutaciones son relativamente infrecuentes en cohortes de DLFT diagnosticada clínicamente (0-17,8%), siendo más frecuentes si existe una historia familiar de DLFT con patrón de herencia autosómica dominante (7,6%-50%) (Rizzu et al., 1999; Stanford et al., 2004) y confirmación patológica de DLFT tau-positiva (Morris et al., 2001; Poorkaj et al., 2001). 7
18 Figura1. Representación esquemática del gen MAPT y las 6 isoformas de tau expresadas en el sistema nervioso central (SNC) de humanos adultos. De los 16 exones que contiene MAPT, sólo 11 son utilizados en el SNC (recuadros verdes y violetas). El procesamiento alternativo de los exones 2, 3 y 10 (recuadros violetas) genera 6 isoformas en función del número de inserciones N-terminal (N) y repeticiones C-terminal (R). Las barras negras representan las repeticiones que se unen a microtúbulos, codificadas por los exones Adaptada de Ingram and Spillantini, La mayoría de mutaciones se han encontrado en una única familia (van Swieten and Spillantini, 2007). Sin embargo, otras han sido descritas en diferentes zonas geográficas, sin poderse descartar, en algunas de ellas, un efecto fundador. La mutación más frecuente es la P301L, que se ha encontrado en más de 20 familias de diferentes países (Hutton et al., 1998; Rizzu et al., 1999; Poorkaj et al., 2001). 2.2 Mecanismos patogénicos y factores de susceptibilidad Mecanismos patogénicos de las mutaciones determinantes La presencia de diferentes mutaciones en el gen MAPT en pacientes con enfermedades neurodegenerativas junto a estudios funcionales de dichas mutaciones aportan evidencia directa que la disfunción de la proteína tau conduce a la neurodegeneración (Hutton, 2001). La mayoría de mutaciones patogénicas del gen MAPT se sitúan en la región codificante de dicho gen. De ellas las mutaciones situadas en los exones 1, 9, 11, 12, y 13 afectan a todas las isoformas de tau, mientras las localizadas en el exón 10 únicamente afectan a las isoformas 4R (Hong et al., 1998; van Herpen et al., 2003; Grove et al., 2003). Todas ellas causan neurodegeneración a través de la disfunción de la proteína tau, si bien los mecanismos patogénicos subyacentes pueden diferir. En este sentido se han dividido estas mutaciones en función de si su principal mecanismo patogénico es a través de la 8
19 afectación del procesamiento del exón 10 o bien directamente afectando la capacidad de ensamblaje entre tau y los microtúbulos. Esta diferenciación no es absoluta ya que algunas mutaciones ( K280, N296, N296H y E342V) pueden presentar efectos tanto a nivel proteico como de RNA mensajero (RNAm) (van Swieten and Spillantini, 2007) Mutaciones que alteran la interacción tau-microtúbulos y la formación de filamentos. La mayoría de las mutaciones situadas en las regiones de unión a microtúbulos (exones 9 12) o en su proximidad (exón 13) disminuyen la capacidad de tau para promover el ensamblaje de microtúbulos al reducir su afinidad por ellos (Hasegawa et al., 1998; Hong et al., 1998; Dayanandan et al., 1999). Existe alguna excepción a esta norma general, como la mutación Q336R en el exón 12 que incrementa la habilidad de la proteína tau para unirse a microtúbulos (Pickering-Brown et al., 2004). La reducción de la capacidad de unión a microtúbulos también se ha descrito en mutaciones alejadas de los dominios de unión (exón 1) (Hayashi et al., 2002). En este caso, este fenómeno podría ser debido a un cambio conformacional en el dominio amino-terminal, que conduciría a una alteración en el tránsito de tau, afectando las interacciones con los microtúbulos y su dinamismo. Además de afectar las interacciones entre tau y microtúbulos, algunas mutaciones también presentan efectos fibrilogénicos (Goedert et al., 1999). Así, se ha demostrado que algunas de ellas tienen un efecto estimulador directo en el ensamblaje de filamentos de tau inducido por heparina en estudios in vitro (Rizzini et al., 2000). Cambios funcionales adicionales podrían ser causados por la introducción o eliminación de sitios potencialmente fosforilables (Hasegawaet al., 1998; Rizzini et al., 2000; Ros et al., 2005) Mutaciones que alteran el procesamiento del exón 10. Existen dos mecanismos patogénicos a través de los cuales las mutaciones en MAPT alteran el procesamiento del exón 10: la disrupción del bucle del RNAm y la alteración de secuencias reguladoras del procesamiento. El análisis de la estructura secundaria predice un bucle de RNAm muy estable en la frontera entre el exón 10 y el intrón siguiente (Figura 2) (Varani et al., 1999). La mayoría de las mutaciones intrónicas y algunas exónicas (S305N) afectan la estabilidad termodinámica de esta estructura incrementando la inclusión del exón 10 y por consiguiente la expresión de isoformas 4R (Varani et al., 1999; Lee et al., 2001). Sin embargo, algunas de ellas (+19) incrementan la exclusión del exón 10, conduciendo a un incremento de las isoformas 3R (D Souza and Schellenberg, 2002; Stanford et al., 2003). Por el contrario, mutaciones como N279K y L284L producen su efecto patogénico alterando las secuencias reguladoras del procesamiento (D Souza et al., 1999). Así, estas mutaciones fortalecen un elemento favorecedor de la inclusión del exón 10 aumentando los niveles de las isoformas 4R (D Souza and Schellenberg, 2002). En resumen, las mutaciones intrónicas y algunas de regiones codificantes alteran el procesamiento del RNAm de MAPT alterando la ratio 4R/3R de este e indicando la importancia del balance entre la ratio de las diferentes isoformas. 9
20 Figura 2. Localización de las mutaciones en el gen MAPT (a) Se muestran los exones 1 y 9-13 con las diferentes mutaciones descritas y el bucle del RNAm, localizado en la frontera entre el exón 10 y el intrón siguiente. Las mutaciones exónicas se han nombrado en función del codón donde se localizan y la primera letra del código de aminoácidos. Las mutaciones intrónicas se han denominado en función del número de nucleótido, otorgando al primer nucleótido del intrón el número 1. (b) Ampliación del bucle de RNAm y localización de las mutaciones descritas en esta región. Adaptada de van Swieten and Spillantini, Alteración de dosis génica El único gen causante de DLFT tau-positiva conocido hasta la actualidad es el gen MAPT, si bien existen una proporción significativa de pacientes, tanto familiares como esporádicos con DLFT tau-positiva sin mutaciones en dicho gen (Morris et al., 2001). Esto sugiere que otros genes u otros mecanismos mutacionales, como la alteración de la dosis génica (duplicaciones y triplicaciones de genes), podrían estar implicados en la etiología de la DLFT. En este sentido, recientemente se ha implicado la alteración de la dosis génica en diferentes enfermedades neurodegenerativas causadas por el acúmulo de proteínas a nivel cerebral como la enfermedad de Parkinson y la EA (Singleton et al., 2003; Rovelet-Lecrux et al., 2006). Así, se ha descrito que algunos pacientes con enfermedad de 10
21 Parkinson presentan una duplicación o triplicación del gen de la -sinucleína (Singleton et al., 2003). De igual manera, también se han descrito casos de EA causados por la duplicación del gen de proteína precursora del amiloide (Rovelet-Lecrux et al., 2006). La región 17q21, que como hemos visto contiene el gen MAPT, tiene una compleja arquitectura genómica flanqueada por tres bloques altamente homólogos de duplicaciones segmentarias (Cruts et al., 2005) (Figura 3). Las duplicaciones segmentarias son puntos calientes para los reordenamientos cromosómicos como deleciones, duplicaciones o inversiones mediadas por una recombinación homóloga no alélica (Eichler et al., 2001). Estos reordenamientos pueden ser patogénicos o únicamente causar una variación del número de copias (CNV) o polimorfismos estructurales (Redon et al., 2006). Hasta la actualidad se han descrito inversiones y deleciones en la región 17q21. Concretamente una inversión de 900 kb polimórfica en la población (Stefansson et al., 2005) y varias deleciones de novo, que incluyen MAPT, en pacientes con retraso mental, hipotonía y dificultad para el aprendizaje (Coleen et al., 2006; Shaw-Smith et al., 2006; Varela et al., 2006). Estos hallazgos sugieren que un reordenamiento recíproco que cause una duplicación en MAPT podría existir con una frecuencia similar a la deleción, y por lo tanto, podría conducir tanto a DLFT esporádica como familiar, a través de un aumento de función. Figura 3. Arquitectura genómica de la región 17q21. Las duplicaciones segmentarias están representadas con rectángulos y las flechas horizontales superiores indican su orientación relativa. La localización y longitud de los genes están representadas por flechas. La línea simple indica la región común delecionada en los pacientes descritos con retraso mental (Koolen et al., 2006; Shaw-Smith et al., 2006). La línea doble indica las regiones genómicas descritas como variación del número de copias (CNV) en individuos fenotípicamente normales (Redon et al., 2006) Factor de susceptibilidad: haplotipo H1 La región que incluye MAPT se puede dividir en 2 haplotipos mayores, H1 y H2, en función de varios polimorfismos y una inversión de 900 Kb. El genotipo MAPT H1/H1 se ha asociado a un riesgo elevado de padecer PSP y DCB, a pesar que su implicación en DLFT es más inconsistente (Baker et al., 1999; Verpillat et al., 2002; Sobrido et al., 2003; Pastor et al., 2004; Pittman et al., 2005). Por otro lado se ha sugerido que este genotipo podría influenciar en el fenotipo de los portadores de mutaciones en MAPT (Walker et al., 2002; Kobayashi et al., 2002). Así, tras analizar 61 casos de pacientes con mutaciones en MAPT (P301L, P301S, N279K, +16) Baba et al. encontraron que existe una asociación entre genotipo H1/H1 y un fenotipo parkinsoniano y entre genotipo H1/H2 y un fenotipo con predominio de los signos cognitivos. Estas descripciones sugieren que el genotipo 11
22 H1/H1 podría predisponer a una sintomatología específica al inicio de la enfermedad (Baba et al., 2005). Sin embargo esta hipótesis no ha sido replicada en otros casos (Tsuboi et al., 2002) y futuros estudios en series de pacientes más extensas serán necesarios para evaluar la influencia real del genotipo de MAPT en las características clínicas en pacientes con DLFT Expresión génica de MAPT cerebral Los depósitos de proteína tau, como hemos visto, son el hallazgo neuropatológico más característico de diferentes entidades neurodegenerativas como algunos subtipos de DLFT, la DCB o la PSP (McKhann et al., 2001; Cairns et al., 2007). Por ello, el estudio de varios aspectos de dicha proteína ha centrado la investigación en estas enfermedades. Concretamente, estudios de expresión cerebral han descrito un incremento de la ratio 4R/3R del RNAm de MAPT en áreas cerebrales afectas de pacientes con PSP y DCB, sugiriendo que la causa de la neurodegeneración en ellos podría ser una alteración a nivel del procesamiento de MAPT cerebral (Chambers et al., 1999; Takanashi et al., 2002). Sin embargo, los pocos estudios de expresión génica cerebral realizados en pacientes con DLFT sin mutación en MAPT no detectan alteraciones en la ratio 4R/3R de RNAm de MAPT (Connell et al., 2005). Otro aspecto actualmente en investigación es la relación entre el haplotipo H1 y el procesamiento de MAPT (Takanashi et al., 2002; Caffrey et al., 2006; Myers et al., 2007). El mecanismo patogénico por el que el genotipo H1/H1 predispone a algunas taupatías se desconoce, si bien resultados recientes sugieren que cambios en la regulación de la expresión de MAPT o en el procesamiento alternativo podrían ser algunos de los mecanismos subyacentes (Caffrey et al., 2006; Myers et al., 2007). Además, el haplotipo H1 puede ser dividido en varios subhaplotipos, siendo el subhaplotipo H1c, el más específico para PSP y por lo tanto podría ser uno de los más implicados en la modulación de la expresión cerebral de tau (Rademakers et al., 2005). En este contexto pensamos que evaluar la expresión cerebral de las diferentes isoformas de tau y determinar su influencia por los haplotipos de MAPT puede ser de interés para conocer mejor la etiopatogenia de la neurodegeneración en la DLFT. 2.3 Clínica El número reducido de pacientes descritos en la mayoría de mutaciones, junto a la expresión clínica variable incluso en pacientes con la misma mutación hace difícil establecer una correlación genotipo-fenotipo (Bird et al., 1999). Sin embargo, y a pesar de la variabilidad descrita, se pueden detectar similitudes clínicas entre diferentes familias con la misma mutación. Esto sugiere que la mutación es la principal responsable de la enfermedad si bien existen un conjunto de variables ambientales y genéticas que condicionan la expresión fenotípica final en un paciente concreto. La mayoría de mutaciones en MAPT se asocian a un patrón de herencia autosómica dominante con una penetrancia prácticamente del 100% a los 65 años, siendo excepcionales los casos con una edad de inicio posterior (algunos pacientes con las mutaciones R5H y I260V), un 12
23 patrón autosómico recesivo (deln296) o la penetrancia incompleta (L315R) (Pastor et al., 2001; Nicholl et al., 2003; van Herpen et al., 2003). Existe cierta correlación entre el tipo y localización de la mutación en el gen MAPT y la edad de inicio de las manifestaciones neurológicas asociadas a ellas, si bien también existe una considerable variabilidad inter e intrafamiliar (Bird et al., 1999). Así, el inicio de la clínica en los pacientes con la mutación P301L o con la mayoría de mutaciones intrónicas se sitúa entre los 45 y 65 años (van Swieten et al., 1999; Pickering-Brown et al., 2002). Para otras mutaciones (P301S, L315R, G335S y G335V) la edad de presentación es más precoz, situándose entre los años (van Swieten and Spillantini, 2007). También se han descrito algunos casos de inicio después de los 65 años en familias con las mutaciones R5H y I260V (Hayashi et al., 2002; Grover et al., 2003). La duración media de la enfermedad se sitúa entre los 8 y 10 años, si bien existen casos (R406W) con una duración superior a los 25 años (van Swieten et al., 1999) y casos, habitualmente con un inicio más precoz de la enfermedad, con una supervivencia inferior a los 5 años (Bugiani et al., 1999; van Herpen et al., 2003). Las manifestaciones clínicas asociadas a las mutaciones en MAPT se han subdividido en 2 grandes subtipos, en función de si predomina la sintomatología cognitiva o la parkinsoniana (van Swieten and Spillantini, 2007). Los pacientes en los que predomina la clínica cognitiva presentan habitualmente un fenotipo clínico dentro de la esfera de la DLFT, cumpliendo los criterios diagnósticos de DLFT-vf (Bronner et al., 2005). Así, la enfermedad se inicia con cambios de personalidad y alteración conductual (desinhibición, conductas sociales inapropiadas, apatía, perdida de iniciativa y/o hiperoralidad) (van Swieten et al., 1999). También se objetiva dificultad para la planificación, inatención y pérdida de la autocrítica. La memoria episódica reciente suele estar relativamente preservada, a pesar que la grave afectación de la memoria de trabajo puede llevar a una baja puntuación en los test de memoria estándar, lo que en ocasiones conduce erróneamente a un diagnóstico de EA (Rosso et al., 2002). Otra manifestación frecuente es la alteración del lenguaje con dificultad para la nominación y la utilización de palabras y frases estereotipadas (Bugiani et al., 1999; van Swieten et al., 1999). Parafasias semánticas y alteración en la comprensión han sido también observadas si bien en ningún caso se ha descrito una verdadera demencia semántica (Pickering-Brown et al., 2002; van Swieten and Spillantini, 2007). Las alteraciones visuoconstrucutivas y la desorientación espacial suelen estar ausentes o ser poco relevantes en estadios iniciales de la enfermedad. Los signos parkinsonianos (rigidez, bradicinesia, temblor en reposo, inestabilidad postural y alteración de la marcha) son frecuentes en la evolución de la enfermedad, siendo la principal característica clínica de presentación en algunos casos como en la mayoría de mutaciones intrónicas y algunas exónicas (N279K) (Yasuda et al., 1999; Iseki et al., 2001; Miyamoto et al., 2001; Pickering- Brown et al., 2002). Dicha sintomatología no responde, o solo parcial y transitoriamente, a L-dopa. Algunos casos ( N296 y S305N) presentan como primeros síntomas un fenotipo clínico similar a la PSP, con parálisis supranuclear de la mirada vertical y rigidez axial (Stanford et al., 2000; Pastor et al., 2001; Poorkaj et al., 2002). En otros casos el conjunto de síntomas cognitivos y motores sugieren 13
24 un diagnóstico de DCB (Bugiani et al., 1999; Casseron et al., 2005). Así, se puede observar un solapamiento clínico entre DLFT, PSP y DCB en pacientes con mutaciones en el gen MAPT. Las crisis epilépticas parciales o generalizadas son una característica poco común en pacientes con mutaciones en MAPT, y solo se han descrito en algunas mutaciones específicas (Sperfeld et al., 1999). Otra manifestación clínica que puede existir es la afectación de motoneurona, que si bien es frecuente en pacientes con DLFT (Lomen-Hoerth et al., 2002), es infrecuente en los casos con mutaciones en el gen MAPT (Zarranz et al., 2005; Le Ber et al., 2007). Las pruebas de neuroimagen muestran en la mayoría de casos, como hallazgo más característico una atrofia frontal y/o temporal (Bird et al., 1999; van Swieten et al., 1999; Bugiani et al., 1999; Hayashi et al., 2002). En otros casos, especialmente en pacientes con mutaciones intrónicas, la atrofia cerebral es más difusa (Goedert et al., 1999; Miyamoto et al., 2001). Las pruebas funcionales (SPECT y PET) muestran una hipoperfusión e hipometabolismo de la parte anterior del cerebro en estadios iniciales, incluso cuando la neuroimagen estructural no evidencia alteraciones (Nasreddine et al., 1999; Murrell et al., 1999). 2.4 Anatomía patológica Hasta la actualidad todos los cerebros analizados de pacientes con mutaciones en el gen MAPT muestran depósitos de filamentos de proteína tau hiperfosforilada, si bien la morfología, la composición de isoformas y la distribución de los filamentos y depósitos varía en función del tipo de mutación (Morris et al., 2001; van Swieten and Spillantini, 2007). El estudio macroscópico de los cerebros de pacientes con mutaciones en MAPT evidencia, en la mayoría de casos, una atrofia de predominio frontotemporal, si bien en algunos casos puede ser poco marcada (Poorkaj et al., 2002). A nivel temporal la atrofia suele predominar en la parte más anterior de dicho lóbulo (Bird et al., 1999) y afectar en algunos casos el hipocampo y la amígdala (Bird et al., 1999; Hogg et al., 2003). Los ganglios basales varían desde la normalidad hasta la afectación severa, y la sustancia negra aparece despigmentada en algunos casos (Lantos et al., 2002). A nivel microscópico se evidencia pérdida neuronal y gliosis principalmente en la corteza frontal y/o temporal. En muchos casos también se objetiva una pérdida de células piramidales del hipocampo, afectación de la amígdala, ganglios basales, sustancia negra y locus ceruleus, si bien en otros estas estructuras resultan bastante preservadas (van Swieten et al., 1999; Rizzini et al., 2000). En algunos casos también se ha descrito pérdida neuronal en otros núcleos del tronco cerebral, el núcleo dentado del cerebelo y en la médula espinal así como gliosis y/o pérdida de mielina en la sustancia blanca subcortical, con ocasional degeneración del tracto corticospinal (Iseki et al., 2001). A nivel inmunohistoquímico las tinciones con anticuerpos anti-tau muestran diferentes lesiones localizadas principalmente a nivel del córtex frontotemporal y núcleos subcorticales, pero también se pueden observar en tronco cerebral, cerebelo y médula espinal. Entre ellas encontramos la degeneración neurofibrilar en forma de tangles y pre-tangles, hebras neuríticas, neuritas distróficas, 14
25 cuerpos de Pick, cuerpos Pick-like, inclusiones tipo coiled bodies y los astrocitos tipo tufted (Ingram and Spillantini, 2002). La localización de las inclusiones en neuronas y/o glía, así como los diferentes perfiles de tau insoluble en los estudios bioquímicos por inmunoblot, dependerá del tipo y localización de las mutaciones dentro del gen MAPT. La mayoría de las mutaciones localizadas en el exón 10 y las que alteran el procesamiento de este exón, muestran predominantemente isoformas 4R, que normalmente se asocian a patología tanto neuronal como glial (astrocitos y oligodendrocitos) (Bugiani et al., 1999; Lantos et al., 2002; Grover et al., 2003). Por el contrario mutaciones localizadas fuera del exón 10 conducen a una taupatía principalmente neuronal, sin prácticamente afectación glial (Rizzini et al., 2000), con predominio de las isoformas 3R (Ingram and Spillantini, 2002). 3. GEN PGRN En los últimos años se habían descrito varias familias de DLFT con un patrón autosómico dominante ligadas a la misma región que se encuentra MAPT (región 17q21) sin hallarse mutaciones en este gen (Mackenzie et al, 2006b). Existían 2 posibles causas de esta situación: la existencia de una mutación compleja en MAPT no detectada por estudios de secuenciación convencionales o la existencia de otro gen causante de DLFT en la misma región. La ausencia de depósitos de proteína tau en los cerebros de estos casos apoyaba esta segunda hipótesis, que fue confirmada en 2006 al hallarse que mutaciones en el gen PGRN podían causar DLFT (Baker et al, 2006; Cruts et al., 2006). El gen PGRN está localizado a 1.7 Mb centromérico a MAPT y consta de 12 exones codificantes y uno no codificante (Figura 4). Desde entonces se han identificado 44 mutaciones diferentes en más de 80 familias (Tabla 3) (Alzheimer Disease & Frontotemporal Dementia Mutation Database: hhtp:// Figura 4. Representación esquemática del gen PGRN y del RNAm que codifica por la proteína PGRN, mostrando las mutaciones identificadas en este gen. Las letras en los recuadros de la proteína PGRN hacen referencia a las repeticiones de un residuo altamente conservado de 12 cisteínas. Las mutaciones son nombradas en relación al tránscrito más largo de PGRN. Adaptada de Gass et al.,
26 Tabla 3. Número y porcentaje de mutaciones en el gen PGRN descritas hasta la actualidad en cada exón e intrón del gen y número de familias afectas (Alzheimer Disease & Frontotemporal Dementia Mutation Database: hhtp:// Exón/intrón Número mutaciones (porcentaje) Número de familias (porcentaje) IVS1 2 (4,55 %) 9 (11,11 %) EX2 6 (13,64 %) 10 (12,35 %) IVS2 1 (2,27 %) 2 (2,47 %) EX3 3 (6,82 %) 6 (7,41 %) EX5 5 (11,36 %) 6 (7,41 %) IVS5 1 (2,27 %) 1 (1,23 %) EX6 1 (2,27 %) 1 (1,23 %) EX7 1 (2,27 %) 3 (3,70 %) IVS7 3 (6,82 %) 8 (9,88 %) EX8 2 (4,55 %) 3 (3,70 %) IVS8 2 (4,55 %) 2 (2,47 %) EX9 3 (6,82 %) 3 (3,70 %) IVS9 1 (2,27 %) 1 (1,23 %) EX10 5 (11,36 %) 5 (6,17 %) EX11 6 (13,64 %) 7 (8,64 %) EX12 2 (4,55 %) 14 (17,28 %) Total El gen PGRN codifica un factor de crecimiento de 593 aminoácidos expresado en múltiples tejidos denominado progranulina. Esta proteína está compuesta de un péptido señal seguido de 7,5 repeticiones de un residuo altamente conservado de 12 cisteínas (Figura 6). En el sistema nervioso central se expresa en neuronas del córtex cerebral, especialmente en las células granulosas del hipocampo y en las células de Purkinje del cerebelo (Daniel et al., 2000) y también en microglía activada (Baker et al., 2006; Ahmed, et al., 2007). La progranulina tiene funciones en el desarrollo, la progresión del ciclo celular y en la inflamación. A nivel cerebral se desconoce su papel, si bien se ha hipotetizado que actuaría en el mantenimiento de la supervivencia neuronal. 3.1 Epidemiología En el artículo original que demuestra que mutaciones en el gen PGRN son causa de DLFT se describe que 10,6% (11/103) de los pacientes estudiados presentan una mutación en este gen como etiología de la DLFT, porcentaje que alcanza el 25,6% (11/43) en los casos familiares. En esta misma serie belga las mutaciones en MAPT representaban sólo el 2,9% (3/103) del global y el 7% (3/43) de 16
27 los casos familiares, concluyendo los autores que en esta población la frecuencia de mutaciones en PGRN es 3,5 veces superior a MAPT (Cruts et al., 2006). Sin embargo, 8/11 pacientes con mutación en PGRN presentan la misma mutación (IVS0+5G>C), lo que puede ser debido a un efecto fundador en esta población. De confirmarse una procedencia común de estos pacientes, la incidencia de mutaciones entre MAPT y PGRN seria bastante similar. En otro estudio epidemiológico que incluye 378 pacientes con DLFT se describe una frecuencia de mutaciones en PGRN del 10,5% en global y del 22,5% con historia familiar positiva. La muestra de este estudio presenta un sesgo de selección al incluir un elevado porcentaje de pacientes con confirmación patológica de DLFT-U, hallazgos asociados a mutaciones de PGRN. En este mismo estudio, con el objetivo de obtener una estimación más representativa de la población se analizó separadamente un subgrupo de 167 pacientes, en el cual el porcentaje de pacientes con mutaciones en PGRN disminuía hasta el 5%, frecuencia similar a las mutaciones encontradas en MAPT en la misma población (Gass et al., 2006). Recientemente, un estudio europeo en pacientes con DLFT encuentra una prevalencia global de mutaciones en PGRN del 4,8% (10/210), siendo del 3,2% (5/158) en aquellos casos esporádicos y del 9,6% (5/52) en aquellos con historia familiar, definida como al menos 1 familiar de primer grado afecto de DLFT. En esta misma serie la frecuencia global de mutaciones en MAPT es algo inferior (2,9%), concluyendo que las mutaciones en PGRN tienen una prevalencia 1,5 veces superior a MAPT, si bien en los casos familiares las mutaciones en MAPT (11%) serían ligeramente más prevalentes (Le Ber et al., 2007). 3.2 Mecanismos patogénicos La mayoría de mutaciones patogénicas identificadas en el gen PGRN son mutaciones que producen un cambio en la pauta de lectura creando un codón stop prematuro y conduciendo a la degradación del RNA mutado mediante el proceso llamado nonsense-mediated RNAm decay (NMD) (Baker et al, 2006; Cruts et al., 2006; Gass et al, 2006). Además se han descrito mutaciones que destruyen o eliminan el codón Met1 (IVS1+1G>A) imposibilitando el inicio de la traducción, y por tanto bloqueando la producción de proteína por este alelo (Gass et al, 2006). Por otro lado, las mutaciones descritas en el sito donador del exón 0 conducen a la retención del intrón 0 en el tránscrito resultante impidiendo la externalización nuclear de éste y la consiguiente degradación del RNAm a nivel nuclear (Cruts et al., 2006; Van der Zee et al., 2006; Le Ber et al., 2007). Así, todas las mutaciones patogénicas en este gen conllevan la formación de una proteína defectuosa y por tanto que los pacientes portadores heterocigotos tengan únicamente un 50% de progranulina en comparación a sujetos sin mutación, sugiriendo que el principal mecanismo patogénico de las mutaciones de PGRN es la haploinsuficiencia de este gen. Este mecanismo lleva a algunos autores a hablar de hipoprogranulopatías (Boeve et al., 2006). 3.3 Clínica Los pacientes afectos de DLFT portadores de mutaciones en PGRN muestran una edad de inicio de la enfermedad muy variable (45-83 años), con una media de 59 ± 7 años (Gass et al, 2006; 17
28 Huey et al., 2006; Le Ber et al., 2007). La duración media de la enfermedad en estos pacientes es aproximadamente de unos 7 años (Le Ber et al., 2007). Resultados recientes estiman una penetrancia de la enfermedad en portadores de mutaciones en el gen PGRN del 50% a los 60 años y superior al 90% a los 70 años (Gass et al., 2006). Además no todos los pacientes con mutaciones en PGRN presentan historia familiar de DLFT, lo que añade nuevas dificultades al consejo genético de estos pacientes. El perfil clínico asociado a las mutaciones de PGRN es, en la mayoría de los casos, similar a la DLFT-vf. Sin embargo, se debe enfatizar que la alteración del lenguaje puede ser el primer síntoma en un porcentaje considerable, conduciendo al diagnóstico de APNF (Gass et al., 2006; Snowden et al., 2006; Le Ber et al., 2007). También se han descrito casos con el diagnóstico clínico de DCB, EA o enfermedad de Parkinson, si bien el examen neuropatológico de estos confirma que nos hallamos ante una DLFT-U (Gass et al., 2006; Masellis et al., 2006). Algunos pacientes presentan al inicio alucinaciones visuales y una severa alteración psiquiátrica con ideas paranoides y delirios, si bien es más frecuente que aparezcan en el fases no iniciales de la enfermedad (Le Ber et al., 2007). La aparición de signos parkinsonianos es frecuente en el curso de la enfermedad (Le Ber et al., 2007), siendo por el contrario prácticamente inexistente la aparición de signos que sugieran enfermedad de motoneurona (Gass et al., 2006; Le Ber et al., 2007). Las pruebas de neuroimagen estructural suelen evidenciar atrofia frontal o frontotemporal, que en ocasiones se puede extender al lóbulo parietal, a menudo asimétrica (Le Ber et al., 2007). Estudios comparativos de morfometría a través de análisis vóxel a vóxel han mostrado que pacientes con mutaciones en PGRN presentan una atrofia cerebral más severa que los pacientes sin mutaciones en PGRN, especialmente en la parte superior del lóbulo frontal y en el lóbulo parietal (Whitwell et al., 2007). La neuroimagen funcional también objetiva la existencia de hipometabolismo o hipoperfusión en estas localizaciones. (Huey et al., 2006; Sipina et al., 2007). 3.4 Anatomía patológica Diferentes estudios en pacientes con mutaciones en PGRN han demostrado que el sustrato patológico de estos casos es la DLFT-U (Gass et al., 2006; Mackenzie et al., 2006a; Davion et al., 2007). Antes de la descripción del gen PGRN como causante de enfermedad ya se había descrito que las inclusiones neuronales intranucleares (INI) ubiquitin-positivas eran una característica de los pacientes con DLFT familiar ligada al cromosoma 17q21 sin mutaciones en MAPT (Mackenzie et al., 2006b). Estas inclusiones, también conocidas como inclusiones en ojo de gato ( cat s eye ) por su morfología lentiforme, se han propuesto como un marcador para detectar pacientes con mutaciones en PGRN, si bien varios estudios posteriores demuestran que a pesar de estar presentes en todos los pacientes con mutaciones en PGRN, es un hallazgo inespecífico y por lo tanto no serían patognomónicas de esta entidad (Gass et al., 2006; Mackenzie et al., 2006a; Davion et al., 2007). Por otra parte, estudios recientes han evidenciado que la proteína depositada en las lesiones ubiquitinadas de los pacientes con mutaciones en PGRN es la TDP-43, característica también inespecífica ya que esta proteína también está presente en otros casos de DLFT-U y ELA (Neumann 18
29 et al., 2006). Así, y a pesar del importante avance en este campo, el estudio de más casos será necesario para acabar de detallar la expresión patológica de las mutaciones en el gen PGRN. En resumen, la DLFT es una enfermedad neurodegenerativa con una importante carga genética y con un sustrato patológico muy heterogéneo, por lo que un estudio de las bases genéticas y sus correlaciones clínico-patológicas puede ser de utilidad para conocer mejor su fisiopatología, mejorar su diagnóstico y el asesoramiento genético a los afectos y sus familias. 19
30 20
31 HIPÓTESIS 21
32 22
33 HIPÓTESIS: 1. Las mutaciones en los genes MAPT y PGRN causan DLFT a través de mecanismos patogénicos diversos que incluyen alteraciones en la función de la proteína tau y en el procesamiento del gen MAPT y una posible haploinsuficiencia en el gen PGRN. 2. El haplotipo H1 del gen MAPT es un factor de susceptibilidad para padecer DLFT a través de una alteración del procesamiento de MAPT cerebral. 3. Las mutaciones en los genes MAPT y PGRN se asocian a fenotipos clínicos y patológicos de DLFT característicos. 23
34 24
35 OBJETIVOS 25
36 26
37 En relación a las hipótesis descritas, los principales objetivos de este trabajo son: 1. Identificar nuevas mutaciones patogénicas en los genes MAPT y PGRN y analizar sus posibles mecanismos patogénicos. Cuantificar el número de copias del gen MAPT en pacientes con DLFT y valorar su papel en la patogenia de la enfermedad. 2. Determinar si el haplotipo H1 de MAPT actúa como factor de susceptibilidad para desarrollar una DLFT. Estudiar la correlación entre el haplotipo H1 y la expresión génica de las isoformas 3R y 4R de RNAm de MAPT a nivel cerebral. 3. Determinar el fenotipo clínico y patológico de los pacientes con DLFT asociada a mutaciones en los genes MAPT y PGRN. 27
38 28
39 MATERIAL Y MÉTODOS 29
40 30
41 Los materiales y métodos utilizados en la presente tesis están explicados en detalle en el apartado correspondiente de cada trabajo, citando aquí brevemente los criterios de selección de los pacientes estudiados y las principales técnicas utilizadas. 1. PACIENTES Los pacientes seleccionados para este trabajo fueron pacientes visitados en consultas externas del Servei de Neurologia de l Hospital Clínic de Barcelona o procedentes de otros centros españoles, que cumplían los criterios clínicos establecidos de DLFT (Neary et al., 1998,). Todos los pacientes que participaron en el estudio firmaron un consentimiento informado. Se han estudiado también muestras de tejido cerebral de pacientes con el diagnóstico neuropatológico de DLFT procedentes del Banc de Teixits Neurològics de la Universitat de Barcelona-Hospital Clínic (McKhann et al., 2001). Este estudio ha sido aprobado por el Comité ético del Hospital Clínic de Barcelona. 2. MÉTODOS Las principales técnicas utilizadas para el desarrollo de esta tesis son las siguientes: 1. Extracción de DNA de sangre periférica y de tejido cerebral. 2. Extracción de RNA de tejido cerebral. 3. Secuenciación directa: esta técnica se ha utilizado para detectar mutaciones en los exones 0-12 de PGRN y 1 y 9-13 de MAPT según las condiciones descritas previamente (Hutton et al.,. 1998; Baker et al., 2006; Cruts et al., 2006). 3. Polymerase Chain Reaction-Restriction Fragment Lenght Polymorphism (PCR-RFLP): la amplificación y posterior digestión con enzimas de restricción se ha utilizado para genotipar un polimorfismo que define el haplotipo H1/H2 de MAPT (Baker et al., 1999) y para el cribado en controles de las nuevas mutaciones halladas para eliminar la posibilidad de que estas fueran polimorfismos comunes y no patgénicos en la población. 4. Ligación y amplificación de múltiples sondas (MLPA): esta técnica se ha utilizado para el estudio de dosis génica del gen MAPT (Schouten et al., 2002). 5. PCR cuantitativa a tiempo real: esta técnica nos ha permitido la cuantificación relativa de las isoformas 3R y 4R del RNAm de MAPT (Takanashi et al., 2002). 31
42 32
43 RESULTADOS 33
44 34
45 ARTÍCULO 1 A NOVEL MAPT MUTATION (P301T) ASSOCIATED WITH FAMILIAL FRONTOTEMPORAL DEMENTIA. Lladó A, Ezquerra M, Sánchez-Valle R, Rami L, Tolosa E, Molinuevo JL. European Journal of Neurology 2007;14(8):e
46 36
47 European Journal of Neurology 2007, 14: e9 e10 LETTER TO THE EDITOR A novel MAPT mutation (P301T) associated with familial frontotemporal dementia A. Llado a, M. Ezquerra b,r.sa nchez- Valle a, L. Rami a, E. Tolosa b and J. L. Molinuevo a a Alzheimer s Disease and Cognitive Disorders Unit, Service of Neurology, Hospital Clı nic and Institut d Investigacio Biome`dica August Pi i Sunyer (IDIBAPS), Barcelona, Spain; and b Parkinson s Disease and Movement Disorders Unit, Service of Neurology, Hospital Clı nic and Institut d Investigacio Biome`dica August Pi i Sunyer (IDIBAPS), Barcelona, Spain Correspondence: Dr José L Molinuevo, Unitat d Alzheimer i altres trastorns cognitius, Servei de Neurologia-ICN, Hospital Clı nic i Universitari, Villarroel 170, Barcelona, Spain (tel.: ; fax: ; jlmoli@clinic.ub.es). Keywords: MAPT, mutation, frontotemporal dementia, tauopathy, progressive supranuclear palsy Received 12 November 2006 Accepted 24 January 2007 In the last decade, at least 40 mutations have been identified in the gene encoding the protein tau (MAPT) in patients with familial dementia. The clinical profile of these patients is usually frontotemporal dementia (FTD), although there are some reports of individuals developing different phenotypes, such as progressive supranuclear palsy (PSP) or corticobasal degeneration [1]. We describe a patient with familial dementia associated to a new MAPT mutation. The proband was a 57-year-old right-handed man, who was admitted to our hospital with 2 years history of cognitive decline and gait disturbances. His disease started at age 55 with progressive behavioural changes characterized by inhibition and apathy. Few months later, his family noticed speech difficulties with phrase length reduction and high latency when answering. He also presented progressive generalized slowness and difficulty in walking that made him fall frequently. Two years after disease onset, he needed assistance for several activities of daily living (i.e. grooming and dressing). On admission, neurological examination disclosed non-fluent speech with echolalia, mask-like facial expression, axial predominant symmetric rigid-akinetic parkinsonism and impairment of postural reflexes. The gait was slow, with small steps, diminished arm swing and freezing. Paresis of vertical gaze movements and an increased latency in initiating lateral gaze were also noticed. Neuropsychological examination displayed severe attentional deficits, executive dysfunction, motor perseveration and generalized apraxia. Naming and singleword comprehension were within normal limits, although he clearly showed deficits in complex sentences comprehension. Memory evaluation was impossible because of attentional deficits, but remembrance of day-to-day events was preserved. MRI showed mild global atrophy more marked in frontal and temporal lobes. During the next months his balance deteriorated and he became wheel-chair bound. His speech also continued to decline and he became functionally mute, vertical gaze was limited although he still could initiate horizontal gaze movements. Currently, the patient is alive in an advanced stage of the disease. Four familial members had a disorder that resembled the patient s disease, suggesting a pattern of autosomal dominant inheritance (Fig. 1). The proband s father presented at age 56 with personality changes, becoming more irritable, apathetic, inhibited and emotional labile. In few months, he developed memory loss and language disturbances. He died 7 years after disease onset. One paternal uncle died at age 56 after a 3-year history of progressive cognitive impairment. Another paternal uncle died at age 34 affected by progressive cognitive decline AO 56 y AD 63 y AO 55 y AO 53 y AD 56 y 3 doi: /j x with early mutism which started 1 year before. Four paternal uncles died at a young age to unrelated causes and two are in the eighth decade of life and asymptomatic. The paternal grandmother also presented early onset cognitive decline, and died at 56, 4 years after disease onset. No pathological examination has been performed in any of the affected dead relatives. The sequence analysis of exons 1 and 9 13 of MAPT gene of proband identified a heterozygous C fi A transversion in exon 10 [2]. This mutation predicts an aminoacid change from proline (CCG) to threonine (ACG) leading to a P301T mutation. This mutation was not previously described in the literature and was absent in 50 normal individuals and 50 demented patients. Genetic analysis could not be performed in the other affected members that were only defined through clinical reports. This new mutation is located in the same codon where other mutations have been previously described (P301L and P301S), highlighting the importance of this site in tau function [1,3]. We can not discard that this mutation could be a very rare polymorphism. However, its critical location, the absence of this mutation in our controls and in none of the reported MAPT screening studies in the literature, together with the family history support that P301T is a new causal mutation. Functional studies will be necessary to confirm the pathogenic effect of this mutation. Different studies have pointed out the clinical, pathological and genetic overlap between FTD and PSP [4]. Our patient presented clinical features of both FTD AO 52 y AD 56 y AO 33 y AD 34 y Figure 1 Pedigree of the family. Black solid symbols show affected individuals. Slashes indicate dead individuals. The arrow indicates the proband. AO, age at onset; AD, age at death. 4 Ó 2007 EFNS e9
48 e10 Letter to the Editor and PSP phenotypes, reinforcing this idea of overlap between these two diseases. However, the prominent language disturbances and the familial history suggest FTD as the most accurate clinical diagnosis. Acknowledgements The authors thank to Manel Ferna ndez for technical support. This work was supported by the Hospital Clinic-Emili Letang post-residency grant and a Pfizer- Eisai research Grant. References 1. Bugiani O, Murrell JR, Giaccone G, et al. Frontotemporal dementia and corticobasal degeneration in a family with a P301S muatation in Tau. Journal of Neuropathology and Experimental Neurology 1999; 58: Hutton M, Lendon CL, Rizzu P, et al. Association of missense and 5 -splice-site mutations in tau with the inherited dementia FTDP-17. Nature 1998; 393: Bird TD, Nochlin D, Poorkaj P, et al. A clinical pathological comparison of three families with frontotemporal dementia and identical mutations in the tau gene (P301L). Brain 1999; 122: Josephs KA, Petersen RC, Knopman DS, et al. Clinicopathologic analysis of frontotemporal and corticobasal degenerations and PSP. Neurology 2006; 66: Ó 2007 EFNS European Journal of Neurology 14, e9 e10
49 ARTÍCULO 2 LATE-ONSET FRONTOTEMPORAL DEMENTIA ASSOCIATED WITH A NOVEL PGRN MUTATION. Llado A, Sanchez-Valle R, Rene R, Ezquerra M, Rey MJ, Tolosa E, Ferrer I, Molinuevo JL Journal of Neural Transmisión 2007;114(8):
50 38
51 J Neural Transm (2007) 114: DOI /s Printed in The Netherlands Short communication Late-onset frontotemporal dementia associated with a novel PGRN mutation A. Lladó 1,R.Sánchez-Valle 1, R. Reñé 2, M. Ezquerra 3, M. J. Rey 4, E. Tolosa 3, I. Ferrer 4, J. L. Molinuevo 1 1 Alzheimer s Disease and Cognitive Disorders Unit, Neurology Service, Hospital Clínic and Institut d Investigació Biomedica August Pi i Sunyer (IDIBAPS), Barcelona, Spain 2 Unitat de Diagnostic i Tractament de les Demencies, Servei de Neurologia, Hospital Universitari de Bellvitge, Barcelona, Spain 3 Parkinson s Disease and Movement Disorders Unit, Neurology Service, Hospital Clínic and Institut d Investigació Biomedica August Pi i Sunyer (IDIBAPS), Barcelona, Spain 4 Brain Bank, University of Barcelona=Hospital Clínic, Barcelona, Spain Received: December 15, 2006 = Accepted: March 4, 2007 = Published online: April 10, 2007 # Springer-Verlag 2007 Summary We describe a new mutation in the PGRN gene (A303AfsX57) associated with late-onset frontotemporal dementia and with cat s eye shaped intranuclear and cytoplasmatic ubiquitin immunoreactive inclusions in the neuropathological exam. The A303AfsX57 mutation is consistent with a nucleotide deletion in exon 8 (c908delc). This deletion causes a frameshift at codon 303 that introduces a premature termination codon (A303AfsX57). Keywords: Frontotemporal lobar degeneration, PGRN, ubiquitin, neuronal intranuclear inclusions, frameshift mutation Introduction Frontotemporal lobar degeneration (FTLD) is a neurodegenerative disease characterized by focal atrophy of the frontal and=or temporal lobes. The criteria proposed by Neary et al. describe three clinical presentations of FTLD: frontotemporal dementia (FTD), progressive nonfluent aphasia (PNFA) and semantic dementia (Neary et al., 1998). Around 40% of FTD cases have familial history of the disease, and the majority of these cases show an autosomal dominant pattern of inheritance (Rosso et al., 2003). The presence of mutations in several genes has been associated with FTLD. Until recently, MAPT mutations were considered the most frequent cause of genetic FTLD. However, the latest reports have shown that mutations in the progranulin gene (PGRN) are as frequent as MAPT mutations in FTLD (Gass et al., 2006). FTLD is pathologically heterogeneous even among distinct clinical syndromes, although recent studies indicate that FTLD with ubiquitin-positive, tau-negative inclusions (FTLD-U) is probably the most frequent pathological substrate (Shi et al., 2005). Mutations in certain genes are strongly correlated with specific neuropathological features. In this regard, patients with MAPT mutations have been reported to present tau-positive deposits, while in cases with PGRN mutations the presence of ubiquitin-positive neuronal intranuclear inclusions (NII) has been highlighted (Baker et al., 2006; Cruts et al., 2006). There have been reports of two MAPT mutations (IVS10 þ 29 and A239T) associated with FTLD-U, although Pickering- Brown et al. (2006) demonstrate that these cases also harbour a PGRN mutation, thus suggesting that these MAPT variants may be non-pathogenic and that the underlying cause of FTLD in these patients is more likely to be the PGRN mutation. Here we describe a novel PGRN mutation in a patient with late-onset FTD and ubiquitin-positive NII in the neuropathological study. Correspondence: Dr. José L. Molinuevo, Alzheimer s Disease and Cognitive Disorders Unit, Neurology Service, Hospital Clinic i Universitari, Villarroel 170, Barcelona, Spain jlmoli@clinic.ub.es Case report A 69 year-old woman was referred in December 1997 with a two-year history of cognitive decline and behavioural
52 1052 A. Lladó et al. changes. At the age of 67, shortly after her husband s death, her family first noticed that the patient had become forgetful and less talkative. Her behaviour had also changed: she was apathetic, lacked motivation, was less aware of social rules (including grooming), showed blunt emotions, and had also developed certain eating compulsions. She expressed no concern or insight into her altered mental state. There was no relevant previous medical history. She was a housewife and had not completed primary school. Her family had a history of dementia: her mother suffered cognitive decline in her seventies and one of her siblings in his sixties. Their relatives were not formally studied. At her first visit, neurological examination revealed a fatuous affect: she laughed at inappropriate situations and showed echolalia and enhanced primitive reflexes. The remainder of the physical exam was normal. The neuropsychological exam highlighted the presence of a dysexecutive disorder. In addition, her language output was reduced with perseverative responses, although grammatically correct. She had problems naming and following sequenced commands, and generated a deficient word list under both semantic and phonemic cues. Her verbal short-term memory was also impaired. She scored 16 out of 30 on the Mini-Mental State Examination. MRI revealed asymmetric bilateral frontal atrophy (more marked in the left hemisphere). SPECT showed severe asymmetric left-sided predominant frontal hypoperfusion. At this point, the clinical diagnosis was frontotemporal dementia. During the follow-up, her spontaneous speech progressively diminished and she became mute within 12 months after the first visit. By the age of 72 she was fully dependent for basic activities of daily living. She died aged 74, seven years after disease onset. Neuropathology examination: The brain weighed 1050 g. Macroscopic exam disclosed severe atrophy of the frontal cortex and anterior insular cortex, with moderate atrophy of the anterior caudate and putamen and discrete atrophy of the temporal lobes. The parietal and occipital cortex were spared on gross examination. Neuron loss, spongiosis and astrocytic gliosis were seen in the upper cortical layers of the affected regions. Ubiquitin-immunoreactive neurites and intracytoplasmic inclusions were mainly localized in the frontal and insular cortices. Most important, cat s eye shaped intranuclear inclusions were also observed in the same cortical areas (Fig. 1). The study failed to show reactivity against b-amyloid, tau or a-synuclein. Genetic analysis Genomic DNA was isolated from frozen brain tissue using a DNeasy tissue kit (Qiagen). Total RNA isolation from the frozen brain tissues was performed using the RNeasy lipid tissue mini kit, DNase free (Qiagen). cdna was synthesized using MultiScribe Reverse Transcriptase (Applied Biosystems). PGRN exons 0 12 and the flanking intronic were amplified by polymerase chain reaction (PCR) using the primers and conditions previously described (Baker et al., 2006; Cruts et al., 2006). The exonic primers GGGCCTCATTGACTCCAAGTGTA-3 0 and 5 0 -GGTCTT TGTCACTTCCAGGCTC-3 0 were designed for cdna specific amplification of exon 8 using the DNAstar software Primer Express + software v2.0 (Applied Biosystems). The PCR products were purified with the Gel Band Purification Kit (Qiagen), and both sense and antisense strands were subsequently sequenced using the Big Dye Terminator v3.1 Cycle Sequencing Kit (Applied Biosystems) and run on a DNA ABI3200A sequencer (Applied Biosystems). The study was approved by the local Ethics Committee. Results Fig. 1. Intranuclear cat s eye shaped ubiquitin-immunoreactive inclusion in a neuron of the frontal cortex (400) The sequence analysis of the PGRN gene in the proband, in both the sense and the complementary strand, identified a nucleotide deletion mutation in exon 8 (c908delc) in the proband (Fig. 2). This mutation causes a frameshift at codon 303 that introduces a premature termination at amino acid 360 (A303AfsX57), which would lead to a truncated
53 Late-onset frontotemporal dementia associated with a novel PGRN mutation 1053 Fig. 2. DNA forward-sequence fragment of the PGRN gene showing nucleotide deletion mutation in exon 8 (c908delc) (A) and normal sequence (B) protein. To determine the possible degradation of the mutated PGRN mrna, we compared the PGRN genomic DNA and cdna sequences obtained from the brain of the patient. We confirmed the absence of mutant mrna (data not shown). Discussion We describe a novel PGRN mutation (A303AfsX57) associated with late-onset FTD and familial history of senile dementia. Progranulin is a 593-amino acid multifunctional growth factor that is expressed in several tissues, including brain. In previous studies, the most frequent types of pathogenic mutations identified in the PGRN gene were frameshift mutations, some of them leading to the degradation of mutant RNAs by nonsense-mediated decay (Baker et al., 2006; Cruts et al., 2006; Gass et al., 2006). The A303AfsX57 mutation causes premature termination of the coding sequence, leading to the degradation of mutant RNAs, probably by nonsense-mediated decay. Thus, as with other PGRN mutations a loss of progranulin function (haploinsufficiency) is the most probable pathogenic mechanism of this novel PGRN mutation (Gass et al., 2006). The clinical profile described as associated with PGRN mutations is, in the vast majority of cases, similar to sporadic FTD or PNFA (Gass et al., 2006; Snowden et al., 2006). In our case, the proband presented with prominent behavioural symptoms that met Neary s clinical criteria for FTD, thus leading to a clinical diagnosis of FTD. However, language disturbances that evolved to mutism appeared early in the disease evolution. On the neurological examination, no signs of motor neuron disease or parkinsonism were perceived. As described in other carriers of PGRN mutations, neuroimaging in this case demonstrated asymmetric frontal atrophy and hypometabolism (Huey et al., 2006). The neuropathological examination showed ubiquitinimmunoreactive neuronal cytoplasmatic and intranuclear cat s eye shaped inclusions. These inclusions have been previously described in familial FTD and have recently been associated with PGRN mutations (Baker et al., 2006; Cruts et al., 2006; Gass et al., 2006). We confirmed in our case that NII are a consistent feature in the neuropathological examination of PGRN mutation carriers, although more epidemiological studies would be necessary to determine the specificity of this finding. Finally, FTD is mainly considered a presenile dementia, although epidemiological studies have found that nearly one-quarter of patients present after 65 years of age (Rosso et al., 2003). Carriers of PGRN mutations showed a broad range of age at dementia onset (48 83 years), with a mean of 59 7 years (Gass et al., 2006). In recent series, the penetrance distribution of the disease in PGRN mutation carriers estimates that only 50% of these patients are affected by age 60 (Gass et al., 2006). Furthermore, not all the cases carrying PGRN mutations had familial history of disease, thus posing new challenges for genetic counselling in FTLD. These findings contrast with FTD linked to MAPT mutations, which usually presents a family history of similar disease and penetrance near to 100% at 65 years of age. Thus, epidemiological studies of FTD series do not usually recommend MAPT gene screening in patients with sporadic FTD or senile onset in clinical practice. However, our case highlights the presence of a PGRN mutation in a patient with late-onset FTD and familial history of senile dementia. In this regard, patients with FTD and a family history of dementia should be considered for PGRN mutation screening despite an advanced age of onset.
54 1054 A. Lladó et al.: Late-onset frontotemporal dementia associated with a novel PGRN mutation In conclusion, A303AfsX57 is a novel PGRN mutation that causes a premature termination of the coding sequence, leading to the degradation of mutant mrna. This mutation was associated with late-onset FTD and with cat s eye shaped intranuclear and cytoplasmatic ubiquitin immunoreactive inclusions in the neuropathological exam. Acknowledgements This work was supported by the Hospital Clinic-Emili Letang post-residency grant (Dr. Lladó), grants from the Fondo de Investigaciones Sanitarias (U-2004-FS O) and the Generalitat de Catalunya (2001SRG00387), the award Distinció per la promoció de la Recerca Universitaria Generalitat de Catalunya and the Red CIEN IDIBAPS-ISCIII RTIC C03=06 to Dr. Tolosa, as well as by a Pfizer-Eisai research grant (NRA ). The authors thank the patients and their families for their generosity and brain donation and Manel Fernández for technical support. References Baker M, Mackenzie IR, Pickering-Brown SM, Gass J, Rademakers R, Lindholm C, Snowden J, Adamson J, Sadovnick AD, Rollinson S, Cannon A, Dwosh E, Neary D, Melquist S, Richardson A, Dickson D, Berger Z, Eriksen J, Robinson T, Zehr C, Dickey CA, Crook R, McGowan E, Mann D, Boeve B, Feldman H, Hutton M (2006) Mutations in progranulin cause tau-negative frontotemporal dementia linked to chromosome 17. Nature 442: Cruts M, Gijselinck I, van der Zee J, Engelborghs S, Wils H, Pirici D, Rademakers R, Vandenberghe R, Dermaut B, Martin JJ, van Duijn C, Peeters K, Sciot R, Santens P, De Pooter T, Mattheijssens M, Van den Broeck M, Cuijt I, Vennekens K, De Deyn PP, Kumar-Singh S, Van Broeckhoven C (2006) Null mutations in progranulin cause ubiquitinpositive frontotemporal dementia linked to chromosome 17q21. Nature 442: Gass J, Cannon A, Mackenzie IR, Boeve B, Baker M, Adamson J, Crook R, Melquist S, Kuntz K, Petersen R, Josephs K, Pickering-Brown SM, Graff-Radford N, Uitti R, Dickson D, Wszolek Z, Gonzalez J, Beach TG, Bigio E, Johnson N, Weintraub S, Mesulam M, White CL 3rd, Woodruff B, Caselli R, Hsiung GY, Feldman H, Knopman D, Hutton M, Rademakers R (2006) Mutations in progranulin are a major cause of ubiquitin-positive frontotemporal lobar degeneration. Hum Mol Genet 15: Huey ED, Grafman J, Wassermann EM, Pietrini P, Tierney MC, Ghetti B, Spina S, Baker M, Hutton M, Elder JW, Berger SL, Heflin KA, Hardy J, Momeni P (2006) Characteristics of frontotemporal dementia patients with a Progranulin mutation. Ann Neurol 60: Neary D, Snowden JS, Gustafson L, Passant U, Stuss D, Black S, Freedman M, Kertesz A, Robert PH, Albert M, Boone K, Miller BL, Cummings J, Benson DF (1998) Frontotemporal lobar degeneration. A consensus on clinical diagnostic criteria. Neurology 52: Pickering-Brown SM, Baker M, Gass J, Boeve BF, Loy CT, Brooks WS, Mackenzie IR, Martins RN, Kwok JB, Halliday GM, Kril J, Schofield PR, Mann DM, Hutton M (2006) Mutations in progranulin explain atypical phenotypes with variants in MAPT. Brain 129: Rosso SM, Donker Kaat L, Baks T, Joosse M, de Koning I, Pijnenburg Y, de Jong D, Dooijes D, Kamphorst W, Ravid R, Niermeijer MF, Verheij F, Kremer HP, Scheltens P, van Duijn CM, Heutink P, van Swieten JC (2003) Frontotemporal dementia in The Netherlands: patient characteristics and prevalence estimates from a population-based study. Brain 126: Shi J, Shaw CL, Du Plessis D, Bailey KL, Julien C, Stopford C, Thompson J, Varma A, Craufurd D, Tian J, Pickering-Brown S, Neary D, Snowden JS, Mann DM (2005) Histopathological changes underlying frontotemporal lobar degeneration with clinicopathological correlation. Acta Neuropathol 11: Snowden JS, Pickering-Brown SM, Mackenzie IR, Mackenzie IR, Richardson AM, Varma A, Neary D, Mann DM (2006) Progranulin gene mutations associated with frontotemporal dementia and progressive non-fluent aphasia. Brain 129:
55 ARTÍCULO 3 MAPT GENE DUPLICATIONS ARE NOT A CAUSE OF FRONTOTEMPORAL LOBAR DEGENERATION. Lladó A, Rodríguez-Santiago B, Antonell A, Sánchez-Valle R, Molinuevo JL, Reñé R, Pérez-Jurado LA. Neuroscience Letters 2007;424(1):
56 40
57 Neuroscience Letters 424 (2007) MAPT gene duplications are not a cause of frontotemporal lobar degeneration A. Lladó a, B. Rodríguez-Santiago b, A. Antonell b,r.sánchez-valle a, J.L. Molinuevo a,,r.reñé c, L.A. Pérez-Jurado b,d a Alzheimer s disease and other Cognitive Disorders Unit, Neurology Service, Hospital Clínic and the August Pi i Sunyer Institute of Biomedical Research (IDIBAPS), Barcelona, Spain b Genetics Unit, Department of Experimental and Health Sciences, Universitat Pompeu Fabra, and the Center for Biomedical Research on Rare Diseases (CIBERER), ISCIII, Barcelona, Spain c Dementia Diagnosis and Treatment Unit, Neurology Service, Bellvitge University Hospital, Barcelona, Spain d Program in Molecular Medicine and Genetics, Vall d Hebron University Hospital, Barcelona, Spain Received 28 May 2007; received in revised form 12 July 2007; accepted 13 July 2007 Abstract Recurrent deletions of the 17q21.31 region encompassing the microtubule-associated protein tau (MAPT) gene have recently been described in patients with mental retardation. This region is flanked by segmental duplications that make it prone to inversions, deletions and duplications. Since gain-of-function mutations of the MAPT gene cause frontotemporal lobar degeneration (FTLD) characterized by deposition of tau protein, we hypothesize that MAPT duplication affecting gene dosage could also lead to disease. Gene dosage alterations have already been found to be involved in the etiology of neurodegenerative disorders caused by protein or peptide accumulation, such as Alzheimer s and Parkinson s diseases. To determine whether MAPT gene copy number variation is involved in FTLD, 70 patients with clinical diagnosis of FTLD and no MAPT mutation (including 12 patients with pathologically proven tau-positive FTLD) were screened by using multiplex ligation probe amplification (MLPA) with specific oligonucleotide probes. No copy number variation in the MAPT gene was observed in cases. Although our study was limited by the relatively small number of patients, it does not support the theory that chromosomal rearrangements in this region are a cause of FTLD Elsevier Ireland Ltd. All rights reserved. Keywords: Frontotemporal lobar degeneration; MAPT; Segmental duplication; Copy number variation; Tau Following the 1998 consensus criteria for frontotemporal lobar degeneration (FTLD) diagnosis, three distinct clinical syndromes have been defined: frontotemporal dementia (FTD), semantic dementia (SD) and progressive nonfluent aphasia (PNFA) [13]. Definitive diagnosis of FTLD requires pathological examination, which reveals tau-positive inclusions in approximately half of the cases [5,8]. Mutations in different genes have been reported to cause FTLD, although only mutations in the gene of the microtubule-associated protein tau (MAPT) are associated with tau deposits in the neuropathological examination [12]. Over-expression of human tau in glia and neurons of mice recapitulates key features of human FTLD with Corresponding author at: Alzheimer s disease and other Cognitive Disorders Unit, Servei de Neurologia-ICN, Hospital Clinic i Universitari, Villarroel 170, Barcelona, Spain. Tel.: ; fax: address: jlmoli@clinic.ub.es (J.L. Molinuevo). accumulation of abnormal tau aggregates with increasing age. Recently, tau-negative FTLD has been found to be caused by null mutations in the progranulin gene (PGRN) [1,3]. However, a significant proportion of both sporadic and familial cases do not present MAPT or PGRN gene mutations, which suggests that other genes and/or mutational mechanisms, such as MAPT duplication, could be involved in the etiology of FTLD. Consequently, gene dosage alterations have already been implicated in the etiology of neurodegenerative disorders caused by protein or peptide accumulation: (1) -sinuclein gene duplication or triplication has been found in some cases of Parkinson s disease [21]; and (2) amyloid precursor protein (APP) gene duplication has been reported as a cause of Alzheimer s disease [16]. The 17q21.31 region encompassing the MAPT gene has a complex genomic architecture and is flanked by three highly homologous blocks of segmental duplications or low-copy repeats [3] (Fig. 1). Segmental duplications are hotspots for chromosomal rearrangements such as deletions, duplications /$ see front matter 2007 Elsevier Ireland Ltd. All rights reserved. doi: /j.neulet
58 62 A. Lladó et al. / Neuroscience Letters 424 (2007) Fig. 1. Transcriptional map and genomic architecture of the 17q21.31 region. Segmental duplications are depicted as rectangles with different designs indicating shared homology, while the horizontal arrows show their relative orientation. Short vertical lines show the target sequences for the MLPA probes used. Dotted lines illustrate the breakpoints responsible for the inversion polymorphism [3]. The solid line represents the common deleted region detected in mental retardation (MR) phenotypes [7,20]. Double lines depict genomic regions reported as copy number variants (CNVs) in phenotypically normal individuals [14]. or inversions mediated by non-allelic homologous recombination (NAHR) [4]. These rearrangements can lead to disease or genomic variation including large-scale copy-number variants (CNVs) and structural polymorphisms [14]. To date, both inversions and deletions of the 17q21.31 region have been reported in different subjects. A 900 kb inversion is polymorphic in the population, showing different prevalence among different ethnic groups and undergoing positive selection in the Icelandic population [3,22]. De novo deletions of the 17q21.31 region including the MAPT and CRHR1 genes have been identified in several patients with developmental delay, hypotonia and learning disability [7,18,20,23]. The discovery of heterozygous polymorphic inversions in the transmitting parents of patients with deletions suggests that deletions are mediated by NAHR and can be facilitated by the inversion. Finally, genomic CNVs surrounding the flanking segmental duplications that may include the MAPT gene (Fig. 1) have been found in a significant proportion of controls and HapMap individuals by using array CGH technology [9,14,19]. Since the reciprocal rearrangement causing a duplication of the MAPT gene would have a similar frequency to the reported deletion in mentally retarded patients, we hypothesized that duplications could lead to sporadic or familial tau-positive FTLD through an increase in tau protein. To evaluate this hypothesis, we performed multiplex ligation probe amplification (MLPA) [17] analysis in 70 FTLD patients not carrying MAPT or PGRN mutations. Coding exons 1 and 9 13 of the MAPT gene and exons 0 12 of the PGRN gene were screened by direct sequencing as previously described [1,3,15]. Fiftyeight patients fulfilling clinical criteria of FTLD (40 FTD, 10 PNFA and 8 SD) were selected from the Hospital Clínic de Barcelona and Hospital Universitari de Bellvitge. Thirty-five of these patients were men and 23 women. Their mean age at onset of disease was 60 ± 9 years (range 39 75). The remaining 12 patients had pathologically proven tau-positive FTLD and were selected from the University of Barcelona-Hospital Clínic Barcelona Brain Bank [11]. Seven of them were men and five women. Their mean age at onset of disease was 64 ± 6 years (range 52 70). Positive family history of disease was considered in 20 cases with at least one first-degree relative affected by a clinical picture suggestive of dementia. To rule out polymorphic variation at the analysed loci in the normal population, we also screened 310 healthy age-matched control subjects. The study was approved by the local Ethics Committee and all participants gave written informed consent for genetic testing before inclusion. All samples were subjected to MLPA with specific oligonucleotide probes for MAPT gene sequences along with control probes for genes located nearby and on different chromosomes (Table 1). In order to detect possible partial duplications in addition to whole gene duplications two different probes for the MAPT gene were used. PCR amplification of the different amplicons was performed in a single assay using 150 ngr of genomic DNA. The resulting fragments were separated by capillary electrophoresis in a sequencer (ABI Prism 3100, ABI). Samples were analyzed by visual examination of the peak profiles and by exporting the peak heights to an Excel sheet with data calculation as previously described [17]. A decrease of 35 55% in the relative peak height of a probe is indicative of deletion while an increase of 30 55% in relative peak height indicates an increase in copy number from two to three in a diploid genome. No copy number variation (deletion or duplication) was detected by MLPA in the 70 FTLD patients or in the healthy control group (310 subjects). A DNA sample from a subject with known regional trisomy due to iso-17q used as positive control for duplication consistently revealed a 40% increase in MAPT relative peak height (Table 2). Therefore, we did not find MAPT gene dosage alterations in our cohort of patients with FTLD, including a subgroup with tau-positive inclusions as shown by their pathological examinations. Previous studies did not find MAPT rearrangements in cases of tau-negative ubiquitin-positive FTLD linked to chromosome 17 (FTDU-17), although it is now known that most of these cases are caused by PGRN gene mutations [3,2,6,10]. The absence of rearrangements in the 310 healthy controls studied also indicates that the MAPT gene is not part of the common CNV previously described by BAC CGH-arrays [9,14,19]. Thus, MAPT duplication could still be pathogenic or cause susceptibility to disease. Given the instability in the MAPT genomic region and the importance of the tau protein in neurodegeneration, somatic rearrangement might also be involved in sporadic dementias.
59 Table 1 Oligonucleotide sequences used as MLPA probes in the multiplex assay Gene Chromosome Sequence oligo 5 Sequence oligo 3 MAPT i1 17q ,375 K GAACATGACTCTGTAACGAGAGCATTTT GTTTTGTCAAAATGAGAACATATTATTG MAPT-e14 17q ,458 K GGGTTCCCTAAGGGTTGGAGTCAGTACGTAGAGGTCCTGGGACTTTAGGGCTAACCAGTTCTCTTTGTA AGGACTTGTGCCTCTTGGGAGACGTCCACCCGTTTCTCTAGATTGGATCTTGCTGGCAC NSF 17q ,188 K CAACATGTGCTCGCTCTGCATGATTAGTGCAATAAAACTCCCT TCCTTATGCATACTGAGATAGCTTAGTGTCTCGTGG GOSR2 17q ,367 K CTCCCTCCAGAAAGTTCACAACGGCATGGATGACCTCATT TTAGATGGGCACAATATTTTAGATGGACTGAGG BAZ1B 7q ,563 K GGAAAGGTACAGTGAGCGCATTTGGACGTGCAAGAGTACT GGAAAGATACAGTGAACGCATTTGGACGTG TAAGAGTACA WBSCR1 7q ,242 K GGTAGCTCTCGAGAATCTAGAGGTGG ATGGGATTCCCGGGATGACTTC HIRA 22q ,698 K CCCTCAGGATGTCGAGCTGTTCCTGAC ACTCGGTGAAGAGGCGCTGGAATC COPS3 17p ,095 K GGGTTCCCTAAGGGTTGGACTTGCGAAGAACTTATCCCATCTGGACACTGTGCTCGGGGCTCTG GATGTACAAGAACACTCCTTGGGCGTCTCTAGATTGGATCTTGCTGGCAC Table 2 MLPA peak values at each locus following normalization (mean ± standard deviation), obtained from patient and control samples (A) as well as from the sample with the karyotype with the isochromosome 17q (B) Locus/probe WBSCR1 (7q11) HIRA (22q11) BAZ1B (7q11) COPS3 (17p) MAPT-i1 MAPT-e14 NSF GOSR2 (A) Patients and controls ± ± ± ± ± ± ± ± (B) Iso-7q sample ± ± ± ± ± ± ± ± A. Lladó et al. / Neuroscience Letters 424 (2007)
60 64 A. Lladó et al. / Neuroscience Letters 424 (2007) In conclusion, although our study is limited by the small number of patients included, it does not support the theory that chromosomal rearrangements in this region are a cause of FTLD. Future studies with more extensive series of patients with pathologically proven tau-positive FTLD will be necessary to rule out that gene dosage alteration of MAPT could be a disease susceptibility factor or cause FTLD. Acknowledgments The authors wish to thank the patients and their families for their generosity and the collaboration from the University of Barcelona/Hospital Clínic Brain Bank. We also thank Ivon Cuscó for her technical help and Irene Madrigal and Montserrat Milà (Biochemistry and Molecular Genetics Department, Hospital Clínic, Barcelona) for providing MLPA probes. This work was supported by grants from the Spanish Ministry of Health (PI042016), Genome Spain and research grant from Pfizer-Eisai. References [1] M. Baker, I.R. Mackenzie, S.M. Pickering-Brown, J. Gass, R. Rademakers, C. Lindholm, J. Snowden, J. Adamson, A.D. Sadovnick, S. Rollinson, A. Cannon, E. Dwosh, D. Neary, S. Melquist, A. Richardson, D. Dickson, Z. Berger, J. Eriksen, T. Robinson, C. Zehr, C.A. Dickey, R. Crook, E. McGowan, D. Mann, B. Boeve, H. Feldman, M. Hutton, Mutations in progranulin cause tau-negative frontotemporal dementia linked to chromosome17, Nature 442 (2006) [2] M. Cruts, I. Gijselinck, J. van der Zee, S. Engelborghs, H. Wils, D. Pirici, R. Rademakers, R. Vandenberghe, B. Dermaut, J.J. Martin, C. van Duijn, K. Peeters, R. Sciot, P. Santens, T. De Pooter, M. Mattheijssens, M. Van den Broeck, I. Cuijt, K. Vennekens, P.P. De Deyn, S. Kumar-Singh, C. Van Broeckhoven, Null mutations in progranulin cause ubiquitin-positive frontotemporal dementia linked to chromosome 17q21, Nature 442 (2006) [3] M. Cruts, R. Rademakers, I. Gijselinck, J. van der Zee, B. Dermaut, T. de Pooter, P. de Rijk, J. Del-Favero, C. van Broeckhoven, Genomic architecture of human 17q21 linked to frontotemporal dementia uncovers a highly homologous family of low-copy repeats in the tau region, Hum. Mol. Genet. 13 (2005) [4] E.E. Eichler, Recent duplication, domain accretion and the dynamic mutation of the human genome, Trends Genet. 17 (2001) [5] J.R. Hodges, R.R. Davies, J.H. Xuereb, B. Casey, M. Broe, T.H. Bak, J.J. Kril, G.M. Halliday, Clinicopathological correlates in frontotemporal dementia, Ann. Neurol. 5 (2004) [6] J. Johnson, J. Ostojic, L. Lannfelt, A. Glaser, H. Basun, E. Rogaeva, T. Kawarai, A. Bruni, P.H. St George Hyslop, A. Goate, P. Pastor, S. Chakraverty, J. Norton, J.C. Morris, J. Hardy, A. Singleton, No evidence for tau duplications in frontal temporal dementia families showing genetic linkage to the tau locus in which tau mutations have not been found, Neurosci. Lett. 363 (2004) [7] D.A. Koolen, L.E. Vissers, R. Pfundt, N. de Leeuw, S.J. Knight, R. Regan, R.F. Kooy, E. Reyniers, C. Romano, M. Fichera, A. Schinzel, A. Baumer, B.M. Anderlid, J. Schoumans, N.V. Knoers, A.G. van Kessel, E.A. Sistermans, J.A. Veltman, H.G. Brunner, B.B. de Vries, A new chromosome 17q21.31 microdeletion syndrome associated with a common inversion polymorphism, Nat. Genet. 38 (2006) [8] A. Lladó, R. Sánchez-Valle, M.J. Rey, M. Ezquerra, E. Tolosa, I. Ferrer, J.L. Molinuevo, Clinicopathological and genetic correlates of frontotemporal lobar degeneration and corticobasal degeneration, J. Neurol., in press. [9] D.P. Locke, A.J. Sharp, S.A. McCarroll, S.D. McGrath, T.L. Newman, Z. Cheng, S. Schwartz, D.G. Albertson, D. Pinkel, D.M. Altshuler, E.E. Eichler, Linkage disequilibrium and heritability of copy-number polymorphisms within duplicated regions of the human genome, Am. J. Hum. Genet. 79 (2006) [10] I.R. Mackenzie, M. Baker, S. Pickering-Brown, G.Y. Hsiung, C. Lindholm, E. Dwosh, J. Gass, A. Cannon, R. Rademakers, M. Hutton, H.H. Feldman, The neuropathology of frontotemporal lobar degeneration caused by mutations in the progranulin gene, Brain 129 (2006) [11] G.M. McKhann, M.S. Albert, M. Grossman, B. Miller, D. Dickson, J.Q. Trojanowski, Report of the work group on frontotemporal dementia and Pick s disease. Clinical and pathological diagnosis of frontotemporal dementia, Arch. Neurol. 58 (2001) [12] H.R. Morris, M.N. Khan, J.C. Janssen, J.M. Brown, J. Perez-Tur, M. Baker, M. Ozansoy, J. Hardy, M. Hutton, N.W. Wood, A.J. Lees, T. Revesz, P. Lantos, M.N. Rossor, The genetic and pathological classification of familial frontotemporal dementia, Arch. Neurol. 58 (2001) [13] D. Neary, J.S. Snowden, L. Gustafson, U. Passant, D. Stuss, S. Black, M. Freedman, A. Kertesz, P.H. Robert, M. Albert, K. Boone, B.L. Miller, J. Cummings, D.F. Benson, Frontotemporal lobar degeneration. A consensus on clinical diagnostic criteria, Neurology 52 (1998) [14] R. Redon, S. Ishikawa, K.R. Fitch, L. Feuk, G.H. Perry, T.D. Andrews, H. Fiegler, M.H. Shapero, A.R. Carson, W. Chen, E.K. Cho, S. Dallaire, J.L. Freeman, J.R. González, M. Gratacòs, J. Huang, D. Kalaitzopoulos, D. Komura, J.R. MacDonald, C.R. Marshall, R. Mei, L. Montgomery, K. Nishimura, K. Okamura, F. Shen, M.J. Somerville, J. Tchinda, A. Valsesia, C. Woodwark, F. Yang, J. Zhang, T. Zerjal, J. Zhang, L. Armengol, D.F. Conrad, X. Estivill, C. Tyler-Smith, N.P. Carter, H. Aburatani, C. Lee, K.W. Jones, S.W. Scherer, M.E. Hurles, Global variation in copy number in the human genome, Nature 444 (2006) [15] P. Rizzu, J.C. Van Swieten, M. Joosse, M. Hasegawa, M. Stevens, A. Tibben, M.F. Niermeijer, M. Hillebrand, R. Ravid, B.A. Oostra, M. Goedert, C.M. van Duijn, P. Heutink, High prevalence of mutations in the microtubuleassociated protein Tau in a population study of frontotemporal dementia in the Netherlands, Am. J. Hum. Genet. 64 (1999) [16] A. Rovelet-Lecrux, D. Hannequin, G. Raux, N. Le Meur, A. Laquerriere, A. Vital, C. Dumanchin, S. Feuillette, A. Brice, M. Vercelletto, F. Dubas, T. Frebourg, D. Campion, APP locus duplication causes autosomal dominant early-onset Alzheimer disease with cerebral amyloid angiopathy, Nat. Genet. 38 (2006) [17] J.P. Schouten, C.J. McElgunn, R. Waaijer, D. Zwijnenburg, F. Diepvens, G. Pals, Relative quantification of 40 nucleic acid sequences by multiplex ligation-dependent probe amplification, Nucleic Acids Res. 30 (2002) 57. [18] A.J. Sharp, S. Hansen, R.R. Selzer, Z. Cheng, R. Regan, J.A. Hurst, H. Stewart, S.M. Price, E. Blair, R.C. Hennekam, C.A. Fitzpatrick, R. Segraves, T.A. Richmond, C. Guiver, D.G. Albertson, D. Pinkel, P.S. Eis, S. Schwartz, S.J. Knight, E.E. Eichler, Discovery of previously unidentified genomic disorders from the duplication architecture of the human genome, Nat. Genet. 38 (2006) [19] A.J. Sharp, D.P. Locke, S.D. McGrath, Z. Cheng, J.A. Bailey, R.U. Vallente, L.M. Pertz, R.A. Clark, S. Schwartz, R. Segraves, V.V. Oseroff, D.G. Albertson, D. Pinkel, E.E. Eichler, Segmental duplications and copynumber variation in the human genome, Am. J. Hum. Genet. 77 (2005) [20] C. Shaw-Smith, A.M. Pittman, L. Willatt, H. Martin, L. Rickman, S. Gribble, R. Curley, S. Cumming, C. Dunn, D. Kalaitzopoulos, K. Porter, E. Prigmore, A.C. Krepischi-Santos, M.C. Varela, C.P. Koiffmann, A.J. Lees, C. Rosenberg, H.V. Firth, R. de Silva, N.P. Carter, Microdeletion encompassing MAPT at chromosome 17q21.3 is associated with developmental delay and learning disability, Nat. Genet. 38 (2006) [21] A.B. Singleton, M. Farrer, J. Johnson, A. Singleton, S. Hague, J. Kachergus, M. Hulihan, T. Peuralinna, A. Dutra, R. Nussbaum, S. Lincoln, A. Crawley, M. Hanson, D. Maraganore, C. Adler, M.R. Cookson, M. Muenter, M. Baptista, D. Miller, J. Blancato, J. Hardy, K. Gwinn-Hardy, Alpha-synuclein locus triplication causes Parkinson s disease, Science 302 (2003) 841. [22] H. Stefansson, A. Helgason, G. Thorleifsson, V. Steinthorsdottir, G. Masson, J. Barnard, A. Baker, A. Jonasdottir, A. Ingason, V.G. Gudnadottir, N. Desnica, A. Hicks, A. Gylfason, D.F. Gudbjartsson, G.M. Jonsdottir, J.
61 A. Lladó et al. / Neuroscience Letters 424 (2007) Sainz, K. Agnarsson, B. Birgisdottir, S. Ghosh, A. Olafsdottir, J.B. Cazier, K. Kristjansson, M.L. Frigge, T.E. Thorgeirsson, J.R. Gulcher, A. Kong, K. Stefansson, A common inversion under selection in Europeans, Nat. Genet. 37 (2005) [23] M.C. Varela, A.C. Krepischi-Santos, J.A. Paz, J. Knijnenburg, K. Szuhai, C. Rosenberg, C.P. Koiffmann, A 17q21.31 microdeletion encompassing the MAPT gene in a mentally impaired patient, Cytogenet. Genome. Res. 114 (2006)
62 ARTÍCULO 4 BRAIN TAU EXPRESSION AND CORRELATION WITH THE H1/H1 TAU GENOTYPE IN FRONTOTEMPORAL LOBAR DEGENERATION PATIENTS. Llado A *, Ezquerra M *, Gaig C, Sanchez-Valle R, Tolosa E, Molinuevo JL Aceptado en Journal of Neural Transmisión (2007) * Estos dos autores han contribuido de forma igual en el trabajo 41
63 42
64 J Neural Transm (2007) DOI /s Printed in The Netherlands Brain tau expression and correlation with the H1=H1 tau genotype in frontotemporal lobar degeneration patients A. Lladó 1;, M. Ezquerra 2;, C. Gaig 2,R.Sánchez-Valle 1, E. Tolosa 2, J. L. Molinuevo 1 1 Alzheimer s Disease and Other Cognitive Disorders Unit, Service of Neurology, Hospital Clínic and Institut d Investigació Biomedica August Pi i Sunyer (IDIBAPS), Barcelona, Spain 2 Parkinson s Disease and Movement Disorders Unit, Service of Neurology, Hospital Clínic and Institut d Investigació Biomedica August Pi i Sunyer (IDIBAPS), Barcelona, Spain Received 12 February 2007; Accepted 28 June 2007; Published online 30 July 2007 # Springer-Verlag 2007 Summary. Alterations in tau mrna splicing and association with H1=H1 tau genotype have been described in some sporadic tauopathies. We evaluated the 4R=3R tau mrna ratio in 18 patients with frontotemporal lobar degeneration (FTLD), and the effect of the H1=H1 genotype on this ratio. The 4R=3R mrna ratio in frontal cortex was similar in FTLD patients and controls. The H1=H1 genotype carriers showed a significant increase in 4R=3R mrna ratio, suggesting that this genotype could modulate the tau mrna splicing. Keywords: Frontotemporal lobar degeneration; haplotype; tau; expression Introduction Deposition of tau protein is the pathological hallmark of a group of neurodegenerative disorders, including corticobasal degeneration (CBD), progressive supranuclear palsy (PSP) and some types of frontotemporal lobar degeneration (FTLD), such as classic Pick disease (PiD), multiple system tauopathy (MST) and frontotemporal dementia associated to tau mutations (McKhann et al. 2001). However, FTLD is pathologically heterogeneous and embodies taunegative phenotypes as FTLD with ubiquitin-only-immunoreactive neuronal inclusions (FTLD-U), neuronal intermediate filament inclusion disease (NIFID) and dementia lacking distinctive histology (DLDH) (Cairns et al. 2004; Shi et al. 2005). Recently, it has described that TDP- The two authors contributed equally to this work Correspondence: Dr. Jose Luis Molinuevo, Alzheimer s Disease and Other Cognitive Disorders Unit, Service of Neurology, ICN, Hospital Clínic i Universitari, Villarroel 170, Barcelona, Spain jlmoli@clinic.ub.es 43 is the major disease protein in FTLD-U (Neumann et al. 2006). Alternative splicing of exon 10 in tau pre-mrna results in different tau protein isoforms in the adult brain. Inclusion of exon 10 produce tau isoforms with four microtubule-binding repeats (4R) that is the main isoform found in pathological deposits of PSP and CBD, whereas its exclusion results in tau isoforms with three of these repeats (3R), which is the main isoform in PiD (Buee et al. 2000). Functional studies of some tau mutations provided clear evidence that the alteration of normal 4R=3R tau mrna ratio results in neurodegeneration (Hutton 2001). Furthermore, it has been described that the 4R=3R tau mrna ratio is increased in affected brain areas of sporadic PSP and CBD (Chambers et al. 1999; Takanashi et al. 2002). The H1 tau haplotype has been associated with a higher risk of developing PSP and CBD, although its implication in FTLD is controversial (Verpillat et al. 2002; Sobrido et al. 2003). The functional effects of this haplotype in the pathogenesis of these diseases are unknown, but it could act modulating tau splicing (Chambers et al. 1999; Pittman et al. 2005). To evaluate if the tau mrna differential expression may contribute to cause FTLD, and to determine the influence of different tau gene haplotypes on the 4R=3R tau mrna ratio, we measured the 3R and 4R tau mrna expression, using quantitative real time PCR, in frontal cortex of patients with this pathological diagnosis and controls.
65 A. Lladó et al. Material and methods Human brain tissues Frozen frontal cortex tissues of eighteen subjects with neuropathologically diagnosed FTLD and five controls were collected from the brain banks of University of Barcelona=Hospital Clinic and University of Navarra. The cortex frontal was chosen as a representative area for analysis because is one of the more affected areas in FTLD. Tau and progranulin (PGRN) genes were analysed by direct sequencing in all samples. Cases of FTLD with tau or PGRN mutations were excluded of this study. FTLD was defined by neuronal loss and gliosis in frontal and=or temporal lobes and absence of other lesions that could explain the symptoms of the patient. PiD, MST, FTLD-U, NIFID and DLDH cases were classified depending on the immunohistochemical features as described previously (Lladó et al. in press). The patients were stratified in two groups for statistical analysis, according to the presence or absence of tau deposit: tau-positive FTLD (PiD and MST) and tau-negative FTLD (FTLD-U, DLDH and NIFID). The local Ethics Committee approved this study. mrna quantification Total RNA isolation from the frozen brain tissues was performed using the RNeasy lipid tissue mini kit DNase free (Qiagen). RNA integrity was confirmed using formaldehyde-agarose gel electrophoresis and assessing the presence of ribosomal RNA 18S and 28S. cdna was synthesized using MultiScribe Reverse Transcriptase (Applied Biosystems). The analysis of 3R and 4R mrna isoforms was performed by real-time PCR as previously described (Takanashi et al. 2002). Beta-actin (assay Hs _m1) and cyclophilin A (assay Hs _m1) were used as endogenous controls for gene expression (Applied Biosystems, Foster City, CA, USA). The realtime TaqMan-PCR assays for each gene were performed with duplicates of each sample in 96-well optical plates on an ABI Prism 7900 Sequence Detection system (Applied Biosystems). The expression calculation and normalization with the housekeeping genes for relative quantification were made using the qbase version 1.1 software (Center for Medical Genetics, Ghent University Hospital, Belgium; Genotyping H1=H2 tau haplotypes were defined by genotyping the previously described polymorphism in exon 1 (Baker et al. 1999). The promoter polymorphism rs was genotyped amplifying a DNA fragment using the primers F- GACACTAATAAGGGAAAATCTC and R-GACTGTGGAAGGCTCTGA (53 C annealing), digesting the PCR product with the restriction endonuclease ApaLI (Rademakers et al. 2005). Acrylamide electrophoresis and ethidium bromide staining detected the digested PCR fragments. Statistical analysis SPSS 12.0 software was used for the statistical analysis. We used ANCOVA analysis to identify differences between the studied groups. Adjustments were made for postmortem interval, gender and age at death. Results Demographical characteristics and post-mortem time of the subjects are presented in Table 1. Five cases were classified as tau-positive FTLD (3 PiD and 2 MST) and thirteen as tau-negative FTLD (8 FTLD-U, 2 NIFID and 3 DLDH). The 4R=3R tau mrna ratio in the frontal cortex did not present statistical differences among the tau-positive FTLD, tau-negative FTLD and controls (ANCOVA, P ¼ 0.295) (Fig. 1). Table 1. Demographic, neuropathological, and genetic features of 23 patients and controls studied Sample Gender Age at onset Age at death Pathological diagnosis Postmortem time Tau gene genotype 4R=3R ratio 1 M PiD 6.5 H1=H M PiD 9.5 H1=H M PiD 7 H1=H W MST 4 H1=H M MST 7 H1=H M FTLD-U 9.5 H1=H M FTLD-U 5 H1=H M FTLD-U 2.5 H2=H W FTLD-U 5.5 H1=H M FTLD-U 7 H1=H W FTLD-U 13 H1=H W FTLD-U 9.5 H1=H W FTLD-U 7.5 H1=H M DLDH 4 H1=H M DLDH 11.5 H1=H W DLDH 20 H1=H M NIFID NA H1=H W NIFID 8.50 H1=H W NA 79 CONTROL 5 H1=H W NA 78 CONTROL 1 H1=H M NA 77 CONTROL 1 H1=H M NA 71 CONTROL 3.5 H1=H W NA 92 CONTROL 3 H1=H PiD Pick s disease; MST multiple system tauopathy; FTLD-U FTLD with ubiquitin-only-immunoreactive neuronal inclusions; DLDH dementia lacking distinctive histology; NIFID neuronal intermediate filaments inclusions disease.
66 Brain tau expression and H1=H1 tau genotype in FTLD Fig. 1. (A) Log-transformed values of 4R=3R mrna ratios, in each pathological group and controls (P ¼ 0.295; ANCOVA). Mean standard deviation is showed. (B) Log-transformed values of 4R=3R mrna ratio stratifying according to the tau haplotype status (P ¼ 0.04; ANCOVA). Mean standard deviation is showed. FTLD Frontotemporal lobar degeneration When we analyzed all samples together (FTLD and healthy controls), we found a significant increase of 4R= 3R tau mrna ratio in the H1=H1 genotype carriers compared with the non-h1=h1 genotype carriers (ANCOVA, P ¼ 0.04) (Fig. 1). The 4R=3R tau mrna ratio was not affected by the rs promoter genotype state (ANCOVA, P ¼ 0.6). No differences were found in 4R or 3R absolute values between H1=H1 carriers and non-h1=h1 carriers (ANCOVA, 4R; P ¼ 0.17, 3R; P ¼ 0.13), or when comparing patients with different genotypes in the rs promoter polymorphism (ANCOVA, 4R; P ¼ 0.9, 3R; P ¼ 0.18). Discussion In recent years, different studies have reported the presence of an increased 4R=3R tau mrna ratio in affected brain areas of some sporadic tauopathies (PSP and CBD) but not in others (PiD). To our knowledge, there are few studies focusing on the possible involvement of tau mrna expression in FTLD in which tau mutations have been excluded (Connell et al. 2005). Our results do not support the presence of differences in 4R=3R tau mrna ratio in brains from FTLD patients, and thus post-translational events could be the main factors leading to tau isoform deposition in some tauopathies, as suggested previously (Connell et al. 2005). The possible link between the alteration of tau splicing and the tau risk haplotype in specific tauopathies (PSP and CBD), is actually a main line of research (Takanashi et al. 2002; Caffrey et al. 2006; Myers et al. 2007). The pathogenic mechanism by which the H1=H1 genotype causes an increased risk for some tauopathies is unknown; however, subtle changes in the regulation of tau expression or alternative splicing could be one of the underlying mechanisms. Recent reports suggest that the H1 and H2 haplotypes modulate tau gene mrna expression in control and pathological brains (Caffrey et al. 2006; Myers et al. 2007). Therefore, we pooled expression data from all samples, independently of their clinical diagnosis. Then, we found a significant increase of 4R=3R tau mrna ratio in the group of samples carrying the H1=H1 genotype when compared to the other genotypes. In this sense, it has been described that H1 chromosomes express a greater amount of exon 4R tau mrna than H2 chromosomes (Caffrey et al. 2006). However, the specific mechanism and functional exact polymorphisms, that produce a splicing alteration of the tau exon 10, in the context of the H1 haplotype, remain to be determined. So, the H1=H1 genotype could behave a risk factor for some tauopathies, through increasing the 4R=3R tau mrna ratio. In addition, the previously described lack of correlation between the increased 4R=3R tau mrna ratio and tau pathology suggests that not only alternative splicing of tau mrna, but also other factors such as post-transcriptional or translational modifications may play a role in the pathogenesis of tauopathies (Takanashi et al. 2002). In addition, the H1 haplotype can be divided into different sub-haplotypes. One of them, the subhaplotype H1c, which is defined by the promoter polymorphism rs242557, is a more specific risk factor for PSP (Pastor et al. 2004), and it has been proposed to be involved in tau expression modulation (Rademakers et al. 2005). We have not been able to detect any effect of this promoter polymorphism on the tau expression levels. We do not discard that this polymorphism could have a modest but relevant effect in the mrna expression undetectable in our study because the limited number of cases. Haplotypic variability could lead to differences in tau expression in some populations, but in others, the main effect would be an alteration of tau splic-
67 A. Lladó et al.: Brain tau expression and H1=H1 tau genotype in FTLD ing (Myers et al. 2007). Under this hypothesis, we postulate that in our population the splicing mechanism would be the predominant functional event related to tau haplotypes. In conclusion, although our work involves a pathologically heterogeneous group and a limited number of subjects, our results do not support the presence of an alteration of tau splicing in the frontal cortex of FTLD. The 4R=3R tau mrna ratio in the frontal cortex is increased in H1=H1 genotype carriers. Finally, differences in tissue samples could result in variable ratios of neuronal sub-groups and glial cells acting as possible confounding factors. Therefore, future studies using single cell gene expression should be considerate in order to determinate the possible involvement of an increased 4R=3R tau mrna ratio in tauopathies. Acknowledgments This project was supported by grants from the Fondo de Investigaciones Sanitarias (U-2004-FS O), 2001SRG00387 Generalitat de Catalunya, Spain, the award Distinció per la promoció de la Recerca Universitaria Generalitat de Catalunya, Spain and Red CIEN IDIBAPS-ISCIII RTIC C03=06 to Dr. Tolosa and by research grant from Pfizer-Eisai. Dr. Albert Lladó was supported by a grant from the Hospital Clínic of Barcelona and Dr. Carles Gaig was supported by a grant from the Instituto de Salud Carlos III. We acknowledge statistical guidance provided by Carlos Ascaso, and the technical support from Manel Fernandez. We thank the collaboration from the Brain Banks of University of Barcelona=Hospital Clinic and Universidad de Navarra. References Baker M, Litvan I, Houlden H, Adamson J, Dickson D, Perez-Tur J, Hardy J, Lynch T, Bigio E, Hutton M (1999) Association of an extended haplotype in the tau gene with progressive supranuclear palsy. Hum Mol Genet 8: Buee L, Bussiere T, Buee-Scherrer V, Delacourte A, Hof PR (2000) Tau protein isoforms, phosphorilation and role in neurodegenerative disorders. Brain Res Rev 33: Caffrey TM, Joachim C, Paracchini S, Esiri MM, Wade-Martins R (2006) Haplotype-specific expression of exon 10 at the human MAPT locus. Hum Mol Genet 15: Cairns NJ, Zhukareva V, Uryu K, Zhang B, Bigio E, Mackencie IR, Gearing M, Duyckaerts C, Yokoo H, Nakazato Y, Jaros E, Perry RH, Lee VM, Trojanowski JQ (2004) Alpha-internexin is present in the pathological inclusions of neuronal intermediate filament inclusion disease. Am J Pathol 164: Chambers CB, Lee JM, Troncoso JC, Reich S, Muma NA (1999) Overexpression of four-repeat tau mrna isoforms in progressive supranuclear palsy but not in Alzheimer s disease. Ann Neurol 46: Connell JW, Rodriguez-Martin T, Gibb GM, Kahn NM, Grierson AJ, Hanger DP, Revesz T, Lantos PL, Anderton BH, Gallo JM (2005) Quantitative analysis of tau isoform transcripts in sporadic tauopathies. Brain Res Mol Brain Res 137: Hutton M (2001) Missense and splice site mutations in tau associated with FTDP-17: multiple pathogenic mechanisms. Neurology 56: S21 S25 Lladó A, Sánchez-Valle R, Rey MJ, Ezquerra M, Tolosa E, Ferrer I, Molinuevo JL (in press) Clinicopathological and genetic correlates of frontotemporal lobar degeneration and corticobasal degeneration. J Neurol XXX McKhann GM, Albert MS, Grossman M, Miller B, Dickson D, Trojanowski JQ (2001) Report of the work group on frontotemporal dementia and Pick s disease. Clinical and pathological diagnosis of frontotemporal dementia. Arch Neurol 58: Myers AJ, Pittman AM, Zhao AS, Rohrer K, Kaleem M, Marlowe L, Lees A, Leung D, McKeith IG, Perry RH, Morris CM, Trojanowski JQ, Clark C, Karlawish J, Arnold S, Forman MS, Van Deerlin V, de Silva R, Hardy J (2007) The MAPT H1c risk haplotype is associated with increased expression of tau and especially of 4 repeat containing transcripts. Neurobiol Dis 25: Neumann M, Sampathu DM, Kwong LK, Truax AC, Micsenyi MC, Chou TT, Bruce J, Schuck T, Grossman M, Clark CM, McCluskey LF, Miller BL, Masliah E, Mackenzie IR, Feldman H, Feiden W, Kretzschmar HA, Trojanowski JQ, Lee VM (2006) Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science 314: Pastor P, Ezquerra M, Perez JC, Chakraverty S, Norton J, Racette BA, McKeel D, Perlmutter JS, Tolosa E, Goate AM (2004) Novel haplotypes in 17q21 are associated with progressive supranuclear palsy. Ann Neurol 56: Pittman AM, Myers AJ, Abou-Sleiman P, Fung HC, Kaleem M, Marlowe L, Duckworth J, Leung D, Williams D, Kilford L, Thomas N, Morris CM, Dickson D, Wood NW, Hardy J, Lees AJ, de Silva R (2005) Linkage disequilibrium fine mapping and haplotype association analysis of the tau gene in progressive supranuclear palsy and corticobasal degeneration. J Med Genet 42: Rademakers R, Melquist S, Cruts M, Theuns J, Del-Favero J, Poorkaj P, Baker M, Sleegers K, Crook R, De Pooter T, Bel Kacem S, Adamson J, Van den Bossche D, Van den Broeck M, Gass J, Corsmit E, De Rijk P, Thomas N, Engelborghs S, Heckman M, Litvan I, Crook J, De Deyn PP, Dickson D, Schellenberg GD, Van Broeckhoven C, Hutton ML (2005) High-density SNP haplotyping suggests altered regulation of tau gene expression in progressive supranuclear palsy. Hum Mol Genet 14: Shi J, Shaw CL, Du Plessis D, Richardson AM, Bailey KL, Julien C, Stopford C, Thompson J, Varma A, Craufurd D, Tian J, Pickering- Brown S, Neary D, Snowden JS, Mann DM (2005) Histopathological changes underlying frontotemporal lobar degeneration with clinicopathological correlation. Acta Neuropathol 11: Sobrido MJ, Miller BL, Havlioglu N, Zhukareva V, Jiang Z, Nasreddine ZS, Lee VM, Chow TW, Wilhelmsen KC, Cummings JL, Wu JY, Geschwind DH (2003) Novel tau polymorphisms, tau haplotypes, and splicing in familial and sporadic frontotemporal dementia. Arch Neurol 60: Takanashi M, Mori H, Arima K, Mizuno Y, Hattori N (2002) Expression patterns of tau mrna isoforms correlate with susceptible lesions in progressive supranuclear palsy and corticobasal degeneration. Brain Res Mol Brain Res 104: Verpillat P, Camuzat A, Hannequin D, Thomas-Anterion C, Puel M, Belliard S, Dubois B, Didic M, Michel BF, Lacomblez L, Moreaud O, Sellal F, Golfier V, Campion D, Clerget-Darpoux F, Brice A (2002) Association between the extended tau haplotype and frontotemporal dementia. Arch Neurol 59:
68 ARTÍCULO 5 CLINICOPATHOLOGICAL AND GENETIC CORRELATES OF FRONTOTEMPORAL LOBAR DEGENERATION AND CORTICOBASAL DEGENERATION Lladó A, Sánchez-Valle Rl, Rey MJ, Ezquerra M, Tolosa E, Ferrer I, Molinuevo JL for the Catalan collaborative Study Group for FTLD Aceptado en Journal of Neurology (2007) 43
69 44
70 Abstract Objective: To correlate clinical diagnosis and genetic features with different pathological substrates in patients with frontotemporal lobar degeneration (FTLD) and corticobasal degeneration (CBD). Methods: 32 cases with pathological proven FTLD or CBD were selected. Patients were classified clinically as frontotemporal dementia (FTD), progressive nonfluent aphasia (PNFA), semantic dementia (SD), CBD or FLTD with motor neuron disease (FLTD-MND). Coding exons 1 and 9-13 of MAPT and exons 0-12 of PGRN gene were screened by direct sequencing. Regarding the neuropathological findings, cases were classified as tau-positive, ubiquitin-positive tau-negative (FTLD-U), neuronal intermediate filaments inclusions disease (NIFID), dementia lacking distinctive histology (DLDH) or CBD. Results: 17 patients were clinically diagnosed of FTD. Ten showed tau pathology, 3 FTLD-U, 1 NIFID and 3 DLDH. All patients clinically classified as FTLD-MND (6 patients) or SD (3 patients) were FTLD-U. Tau-positive pathology was the substrate of the three patients with PNFA. All three patients classified clinically as CBD presented neuropathologic features of CBD. The three individuals with familial history of early onset FTD and tau- positive pathology carried the P301L mutation in MAPT gene. One out 3 cases with FTLD-U and intranuclear inclusions carried a mutation in PGRN gene. Conclusions: We found that pathology underlying sporadic FTD is heterogeneous and not predictable. MAPT mutations and clinical diagnosis of PNFA and CBD were associated to tau-positive pathology. The presence of signs of lower MND and SD correlated with FTLD-U. Genetic study of MAPT is only recommended when familial history of early onset DFT is present. 45
71 INTRODUCTION Recent studies demostrate that frontotemporal lobar degeneration (FTLD) and corticobasal degeneration (CBD) show clinical and pathological overlap suggesting that these two entities are closely related. However, some clinical features and distinctive pathological lesions continue to define each disease [16]. After the 1998 consensus criteria for FTLD diagnosis, three distinct clinical syndromes have been defined: frontotemporal dementia (FTD), semantic dementia (SD) and progressive nonfluent aphasia (PNFA) [22]. In 10% of the FTLD patients the cognitive and behavioural symptoms are associated with motor neuron disease (MND). The core clinical features of CBD are progressive asymmetric parkinsonism and apraxia. Other typical features of CBD include myoclonus, dystonia, cortical sensory loss and alien limb phenomenon. However, recently, more attention has been given to speech deficits and frontal symptoms as possible early clinical signs of CBD [9,14,18]. Although around 40% of patients with FTD have familial history of disease, only in some cases it is possible to identify a causal mutation, usually in the gene of the microtubule associated protein tau (MAPT) or in the recently described progranulin (PGRN) gene [2,7,26]. CBD is more frequently a sporadic disease, although some familial cases with MAPT mutations present the CBD phenotype [4]. The definitive FTLD and CBD diagnosis requires pathological examination. The hallmark of FTLD is neuronal loss, gliosis and spongiosis of frontotemporal distribution. However, a wide spectrum of subtypes have been described according to immunohistochemical features, such as classic Pick Disease (PiD), FTLD with ubiquitinonly-immunoreactive neuronal inclusions (FTLD-U), neuronal intermediate filament inclusion disease (NIFID), multiple system tauopathy (MST) and dementia lacking distinctive histology (DLDH) [13,25]. Pathologic defining findings of CBD are the presence of cortical achromatic ballooned neurons, tau-positive glia, threads and astrocytic plaques. Prediction of the biochemical abnormality in an early stage of the disease could be now important in terms of diagnosis and prognosis, but will become more important when future treatments will become available. 46
72 In this study we reviewed consecutive cases with pathological proven FTLD and CBD, in an attempt to correlate the clinical diagnosis and genetic features with different pathological substrates. PATIENTS AND METHODS 32 patients with pathological proven FTLD or CBD and sufficient medical information about their disease were selected from the University of Barcelona-Hospital Clínic Barcelona Brain Bank. The study was approved by the local Ethics Committee. Clinical classification: Two neurologists with expertise in neurodegenerative diseases (JLM, RSV), retrospectively reviewed the medical records blinded to the pathological diagnosis. In each case, the presence of behavioural changes, language disturbances (agrammatism, single word comprehension, apraxia of speech, and fluency), other cortical features, signs of upper or lower motor neuron and extrapyramidal features was assessed. We considered that the disease had an early onset if the symptoms appear before 60 years of age. Positive familial history of disease was considered when at least one first-degree relative presented a clinical picture suggestive of dementia. An autosomal dominant pattern of inheritance was defined by the presence of at least three members with dementia in two generations. The patients were clinically classified in five subtypes: (1) FTD, when the main clinical syndrome was characterised by personality and behavioural changes according to consensus criteria [22], (2) PNFA, when the language disturbances were predominant and characterized by difficulty in speech and language production, agrammatism and relatively preserved word comprehension, (3) SD, when the main difficulties in language were characterized by fluent, grammatically correct speech with loss of word and/or object meaning, and (4) CBD, when asymmetric levodopa unresponsiveness extrapyramidal features associated with apraxia, cortical sensory loss or alien limb phenomenon were present [18]. Finally, (5) the patients who presented symptoms of dementia and signs of lower MND, such as muscle atrophy, prominent and diffuse fasciculations, or electromyographic evidences of MND were classified as FTLD-MND. Those patients with upper motor neuron pattern of weakness were not included in this group. 47
73 Neuropathological study Representative sections including neocortex; entorhinal cortex and hippocampus; caudate, putamen and globus pallidus; medial and posterior thalamus; subthalamus; Meynert nucleus; amygdala; midbrain, pons and medulla oblongata; cerebellar cortex and dentate nucleus; and spinal cord were studied. The neuropathological examination was carried out on formalin-fixed paraffin included tissue. De-waxed, 5 m thick, sections were stained with haematoxylin and eosin, and with Klüver Barrera, or processed for immunohistochemistry following the streptavidin LSAB method (Dako, Dakopats, Barcelona). After incubation with methanol and normal serum, the sections were incubated with one of the primary antibodies at 4ºC overnight. Antibodies to phosphorylated neurofilaments of 170 kda or 200 kda (clones BF10 and RT97, Boehringer- Mannheim, Barcelona), glial fibrillary acidic protein (GFAP) (Dako), -amyloid (Boehringer, Mannheim), ubiquitin (Dako), -synuclein (Dako), anti-alpha-internexin (Zymed, San Francisco CA), pan-tau (Sigma, Madrid,Spain), AT8 antibody (Pierce Biotechnology Inc; Rockford) and antiphospho-specific tau rabbit (Thr181, Ser199, Ser202, Ser214, Ser231, Ser262, Ser396 and Ser422) (Calbiochem, Barcelona) were used. Following incubation with the primary antibody, the sections were incubated with LSAB for 1 h at room temperature. The peroxidase reaction was visualized with 0.05% diaminobenzidine and 0.01% hydrogen peroxide. Sections were counterstained with haematoxylin. Neuropathological classification: Two neuropathologists with expertise in neurodegenerative diseases (MJR, IF) performed the pathological examination. FTLD was defined by neuronal loss and gliosis in frontal and/or temporal lobes and absence of other lesions that could explain the symptoms of the patient. Cases were classified depending on the immunohistochemical features. Since there is not an agreement on the neuropathological classification of FTLD, we have used here an instrumental classification mainly based on Lowe and Rossor practical approach. [19] Two broad categories were defined: (1) Tau-positive cases: (a) PiD characterized by hyper-phosphorylated tau-positive inclusions including Pick bodies in then hippocampus, granule cells of the dentate gyrus and isocortex [3]; (b) 48
74 CBD characterized by cortical achromatic ballooned neurons, neuropil threads, neurons with tangles and pre-tangles, astrocytic plaques and coiled bodies [8]; (c) MST when cases of FTLD with deposition of tau protein in neurons, glia and neurites that do not meet criteria for any of the other entities [11]. Cases classified as progressive supranuclear palsy (PSP), based on the regional distribution of tau-immunorecative lesions together with the presence of tufted astrocytes, were excluded from this study [12]. (2) Tau-negative cases: (a) FTLD-U when there were evidence of neuronal loss, gliosis, and spongiosis predominantly in frontal and temporal cortices and ubiquitin-positive, tau- and alphasynuclein-negative inclusions in neurons of frontal or temporal cortex, and granule cell layer of the dentate gyrus [19], (b) NIFID was diagnosed when intraneuronal inclusions were stained with antineurofilament and anti-alpha-internexin antibodies, variably with ubiquitin, but were negative for tau and alpha-synuclein [5]; and (c) cases lacking any of the above distinctive biochemical features with neuronal loss, gliosis, and vacuolation in frontal and/or temporal cortices were called DLDH [19]. The final neuropatholgical diagnosis was determined at the time of writing this review. Statistical assessment for mean age at onset, disease duration and age at death in the different clinical and pathological subgroups was made using the SPSS 10.0 Statistical Package (SSPS Inc. Chicago) and compared using Chi square analysis. Genetics Genomic DNA was isolated from frozen brain tissue using Dneasy tissue kit (Qiagen). Coding exons 1 and 9-13 of MAPT gene and exons 0-12 of PGRN gene were screened by direct sequencing as previously described [2,7,24]. MAPT genotyping was performed in patients and 83 healthy individuals as previously described using PCR amplification over the polymorphism in exon 1 of the MAPT gene included in the H1 haplotype [1]. RESULTS Demographic features and clinical classification: The demographic and clinical features of 32 studied patients are summarized in Table 1. Twenty-one patients were men and 11 women. Mean age at onset was 61 ± 10 years (range years). 49
75 Clinically, 17 patients (53%) were classified as FTD. FTLD-MND was the second most frequent group, with six patients (19%). MND symptoms appeared before the onset of cognitive impairment in two patients, simultaneously in another and after in the remaining three patients (after 1, 4 and 13 years, respectively). Three patients were classified as PNFA (9%), three as SD (9%) and three as CBD (9%). Two patients (1 FTD and 1 CBD) had upper MND signs without evidence of lower MND. Patients with clinical diagnosis of FTD started symptoms at a younger age than patients with other clinical diagnosis (p=0.007) (Table 2). Disease duration in FTD patients was not significantly different from other clinical subgroups (Table 2), although patients with early language alterations tend to have longer survival. When MND symptoms appeared the mean survival was reduced to 2 years. Mean age at death was 68 ± 10 years (range years). Familial history of dementia was positive in 9 patients (28%). However, only 6 patients (19%) had a familial history of dementia and autosomal dominant pattern of inheritance (Table 1). Neuropathological classification Sixteen cases (50%) disclosed tau-positive inclusions. This group included 3 PiD, 5 MST and 8 CBD. Only 2 of 8 CBD have exclusively CBD pathology. In the other CBD cases, typical CBD features coexisted with typical neuropathological findings of other entities (PSP, synucleinopathy, argyrophilic grain disease) (Table 1). Sixteen cases (50%) did not show abnormal tau deposits. Twelve (75%) of the tau-negative cases were classify as FTLD-U. Three cases with FTLD-U showed neuronal intranuclear inclusions (NII).Three patients had DLDH, and only one patient had suffered from NIFID. There were no differences in mean age of onset or disease duration between tau-positive and tau-negative subgroups (Table 3). Genetic features: The study of MAPT gene was performed in 28 patients and disclosed the presence of the P301L mutation in three individuals (11%). Clinically, all of them suffered from early onset familial FTD and autosomal dominant pattern of inheritance. The study of PGRN gene was performed in 50
76 the 3 FTLD-U cases with NII. One out of the three cases carried a mutation in the PGRN gene. Clinically, the patient suffered from familial FTD (submitted elsewhere). The distribution of the frequency of the H1/H1 genotype was similar in the different neuropathological subgroups of FTLD and controls (Table 4). All the 7 cases studied with CBD pathology and all the 3 P301L carriers presented the H1/H1 genotype (Table 4). Clinicopathologic and genetic correlation: Ten patients (59%) classified clinically as FTD disclosed tau pathology (4 MST, 3 PiD and 3 CBD) (Table 5). Seven FTD patients (41%) lacked deposits of protein tau in the pathological examination (3 FTLD-U, 1 NIFID and 3 DLDH). Two of the FTD patients with FTLD-U showed NII. The neuropathological examination in the three cases with MAPT mutations disclosed tau deposition in neurons, astrocytes and oligodendrocytes. However, the most characteristic feature was tau-positive immunoreactivity in the perinuclear region and small cytoplasmic aggregates designed as small Pick-like bodies, mainly in the dentate gyrus [10]. Therefore, in this series the prevalence of MAPT mutations in patients with early onset FTD, autosomal dominant familial history of disease and tau-positive neuropathology was 100%. The three patients classified clinically as CBD presented neuropathologic features of CBD. One of them also presented signs of asymmetric upper MND, initially left hemiparesis that progressed to tetraparesis. However, these three cases clinically classified as CBD correspond only to 37,5% of cases presenting pathological features of CBD. Three patients with pathological diagnosis of CBD presented clinically as FTD and two cases as PNFA. Tau-positive pathology was the pathological substrate of the three cases with clinical diagnosis of PNFA. Two of them met criteria for CBD and one for MST (Table 5) [9]. The 3 cases classified as SD showed FTLD-U. One of them also showed NII. Finally, all patients classified clinically as FTLD-MND presented FTLD-U pathology (Table 5). Furthermore, skein-like ubiquitin inclusions were present in the anterior horn cells in all of them. DISCUSSION We performed a clinicopathological correlation and genetic analysis in 32 consecutive patients with neuropathological diagnosis of FTLD or CBD. According to previous studies, we 51
77 described a broad spectrum of clinical and pathological features in these patients. However, we found certain degree of association of some clinical subtypes to specific pathological substrates. The range of the age at onset (37-82 years) and disease duration (1-16) in our series was wide. Similar to previous studies [13], we did not find differences in demographic features between tau-positive pathology and tau-negative subgroups. However, when we compared different clinical subgroups we observe that patients with FTD had younger age at onset than patients with other clinical syndromes. On the other hand, FTLD-MND had a tendency to have shorter disease duration, and especially bad prognosis when MND symptoms appear. In this sense, other studies also found shorter disease duration in FTLD-MND [25]. The clinical diagnosis of FTD did not correlate with any specific pathological subtype. In the present study, 59% of FTD patients presented tau-positive pathology, although this group was very heterogeneous (PiD, CBD, MST). Although other studies indicate that FTLD-U is the most common pathology, in these studies they also included as FTD some patients with associated MND [14,25]. Some authors had suggested that most cases of DLDH can now be reclassified with ubiquitin immunohistochemistry as FTLD-U [14]. However in the present series, no ubiquitin intraneuronal inclusions were seen in the DLDH cases even after re-staining the sections with new anti-ubiquitin antibodies. Finally, few cases of NIFID have been previously reported associated with different clinical features, although FTD and CBD were the most frequent presentations [6]. In our series, only one patient, presenting with FTD, showed neuronal intermediate filament inclusions (NIFID). All patients classified as FTLD-MND disclosed FTLD-U pathology. Therefore, in agreement with previous studies [13] we found a strong association between clinical FLTD-MND and FTLD-U neuropathology. On the other hand, only two patients presented clinical signs of prominent upper MND. Both of them presented tau-positive pathology, one of them was classified as CBD although also presented pathological features of PSP and the other lacked specific tau-positive inclusions (MST). We consider that these cases are probably very close to those cases recently published by Josephs et al., which were classified as atypical forms of PSP pathology [15]. There are some recent studies that correlate PNFA with tau pathology, while others only found tau pathology in a minor proportion of PNFA patients [13,14,17,25]. The discrepancies in the clinical definition of PNFA could account for these differences. In our series, we found that tau- 52
78 positive pathology was the neuropathological substrate in all the patients clinically classified as PNFA. In addition, the majority of patients with SD in those studies were associated to tau-negative pathology, similar to the few cases reported in our study. All patients with clinical diagnosis of CBD met criteria for pathological diagnosis of CBD. On the contrary, only 37.5% of the patients with pathological diagnosis of CBD presented clinically as CBD. In our series, as well as in those series reported by Josephs, FTD and PNFA were frequent presentations of CBD [14]. Until recently mutations in the MAPT gene have been considered the most frequent cause of genetic FTLD. We identified the P301L mutation in three individuals, which represents a global prevalence of 11% in our series. All of them had a positive autosomal dominant familial history of early onset FTD and tau-positive neuropathology. These results confirm that the presence of tau deposits in familial early onset FTD strongly predicts the presence of a MAPT mutation, whereas other pathological diagnosis nearly excludes the implication of MAPT mutations as a cause of the disease [21]. Furthermore, the absence of MAPT mutations in sporadic FTD, PNFA, SD or CBD in our study, and the lower prevalence disclosed in other studies would not justify routine screening of MAPT mutations in sporadic cases [26]. NII have been previously reported in patients with familial FTLD linked to chromosome 17q21 [20] that lacked MAPT mutations. Recently, mutations in the PGRN gene have been found causative in these families [2,7]. In this study, ubiquitin-positive NII were found in three patients. Only in this case the genetic analysis revealed the presence of a PGRN mutation. However, larger series are needed to assess the specificity of the NII as marker of PGRN mutations. On the other hand, it has recently been suggested that the H1 haplotype could also be a risk factor for FTLD, although more inconsistently than for PSP or CBD [23,27]. Our results showed that there were no differences in the distribution of the H1/H1 genotype and H1 haplotype between FTLD patients and controls (Table 4). These results suggest that H1 haplotype is not risk factor for FTLD. On the contrary, and in concordance with previous studies, all patients studied with CBD pathology presented the H1/H1 genotype, suggesting that the H1 haplotype is a risk factor for CBD [23]. 53
79 In conclusion, we found that the pathology underlying sporadic FTD was heterogeneous and not predictable. Clinical diagnosis of PNFA or CBD and the presence of prominent upper MND were associated with tau-positive pathology. The presence of signs of lower MND and SD correlated with FTLD-U pathology. In clinical practice, genetic study of MAPT is only recommended when familial history of early onset disease is referred and mutations in this gene are associated with tau-positive pathology. Future prospective studies will be necessary to confirm these results and to identify other clinical and genetic features than could predict specific neuropathological subtypes. Acknowledgment: The authors thank the patients and their families for their generosity and brain donation. The authors thank to Manel Fernández for technical support. This work was supported by the Hospital Clinic-Emili Letang post-residency grant and a Pfizer- Eisai research Grant Appendix: Other members of the Catalan collaborative Study Group for FTLD: Dra I. Hernández (Fundació ACE), Dr M. Aguilar, Dra A. Rojo (Hospital Mútua de Terrasa), Dr R. Reñé (Hospital Universitari de Bellvitge), Dra MJ. Martí, Dr E. Muñoz, Dr F. Valldeoriola (Hospital Clínic de Barcelona), Dra P. Sanz (Hospital de Mataró), Dr R. Blesa (Hospital de Sant Pau), Dr J. Peña (Hospital del Mar), Dr J. Alvarez-Sabin (Hospital de la Vall d Hebron), Dr P. Roy (Psicoclínica Nª Sª de la Merced), Dra A. Flor (Centre Hospitalari de Manresa), Dra M. Mira (Sagrat Cor, Martorell) 54
80 REFRENCES 1. Baker M, Litvan I, Houlden H, Adamson J, Dickson D, Perez-Tur J, Hardy J, Lynch T, Bigio E, Hutton M (1999) Association of an extended haplotype in the tau gene with progressive supranuclear palsy. Hum Mol Genet 8: Baker M, Mackenzie IR, Pickering-Brown SM, Gass J, Rademakers R, Lindholm C, Snowden J, Adamson J, Sadovnick AD, Rollinson S, Cannon A, Dwosh E, Neary D, Melquist S, Richardson A, Dickson D, Berger Z, Eriksen J, Robinson T, Zehr C, Dickey CA, Crook R, McGowan E, Mann D, Boeve B, Feldman H, Hutton M (2006). Mutations in progranulin cause tau-negative frontotemporal dementia linked to chromosome17. Nature 442: Bergeron C, Morris HR, Rossor M (2003). Pick s disease. In: Neurodegeneration: The molecular pathology of dementia and movement disorders, Dickson D (ed) ISN Neuropath Press, Basel, pp Bugiani O, Murrell JR, Giaccone G, Hasegawa M, Ghigo G, Tabaton M, Morbin M, Primavera A, Carella F, Solaro C, Grisoli M, Savoiardo M, Spillantini MG, Tagliavini F, Goedert M, Ghetti B (1999). Frontotemporal dementia and corticobasal degeneration in a family with a P301S mutation in Tau. J Neuropathol Exp Neurol 58: Cairns NJ, Zhukareva V, Uryu K, Zhang B, Bigio E, Mackencie IR, Gearing M, Duyckaerts C, Yokoo H, Nakazato Y, Jaros E, Perry RH, Lee VM, Trojanowski JQ (2004). Alpha-internexin is present in the pathological inclusions of neuronal intermediate filament inclusion disease. Am J Pathol 164: Cairns NJ, Grossman M, Arnold SE, Burn DJ, Jaros E, Perry RH, Duyckaerts C, Stankoff B, Pillon B, Skullerud K, Cruz-Sanchez FF, Bigio EH, Mackenzie IR, Gearing M, Juncos JL, Glass JD, Yokoo H, Nakazato Y, Mosaheb S, Thorpe JR, Uryu K, Lee VM, Trojanowski JQ (2004). Clinical and neuropathologic variation in neuronal intermediate filament inclusion disease. Neurology 63: Cruts M, Gijselinck I, van der Zee J, Engelborghs S, Wils H, Pirici D, Rademakers R, Vandenberghe R, Dermaut B, Martin JJ, van Duijn C, Peeters K, Sciot R, Santens P, De Pooter T, Mattheijssens M, Van den Broeck M, Cuijt I, Vennekens K, De Deyn PP, Kumar- 55
81 Singh S, Van Broeckhoven C (2006). Null mutations in progranulin cause ubiquitin-positive frontotemporal dementia linked to chromosome 17q21. Nature 442: Dickson D, Litvan I (2003). Corticobasal degeneration. In: Neurodegeneration: The molecular pathology of dementia and movement disorders, Dickson D (ed) ISN Neuropath Press, Basel, pp Ferrer I, Hernandez I, Boada M, Llorente A, Rey MJ, Cardozo A, Ezquerra M, Puig B (2003). Primary progressive aphasia as the initial manifestationof corticobasal degeneration and unusual tauopathies. Acta Neuropathol 106 : Ferrer I, Hernandez I, Puig B, Rey MJ, Ezquerra M, Tolosa E, Boada M (2003). Ubiquitin-negative mini-pick-like bodies in the dentate gyrus in P301L tauopathy. J Alzheimers Dis 5: Guetti B, Hutton ML, Wszolek ZK (2003). Frontotemporal dementia and parkinsonism linked to chromosome 17 associated with tau gene mutations (FTDP-17T). In: Neurodegeneration: The molecular pathology of dementia and movement disorders, Dickson D (ed) ISN Neuropath Press, Basel, pp Hauw JJ, Agid Y (2003) Progressive supranuclear palsy (PSP) or Steele Ricchardson Olszwewski disease. In Neurodegeneration: The molecular pathology of dementia and movement disorders. Dickson D edit. ISN Neuropath Press, Basel pp Hodges JR, Davies RR, Xuereb JH, Casey B, Broe M, Bak TH, Kril JJ, Halliday GM (2004). Clinicopathological correlates in frontotemporal dementia. Ann Neurol 5: Josephs KA, Petersen RC, Knopman DS, Boeve BF, Whitwell JL, Duffy JR, Parisi JE, Dickson DW (2006). Clinicopathologic analysis of frontotemporal and corticobasal degenerations and PSP. Neurology 66: Josephs KA, Katsuse O, Beccano-Kelly DA, Lin WL, Uitti RJ, Fujino Y, Boeve BF, Hutton ML, Baker MC, Dickson DW (2006). Atypical progressive supranuclear palsy with corticospinal tract degeneration. J Neuropathol Exp Neurol 65: Kertesz A, Martinez-Lage P,Davidson W, Munoz DG (2000). The corticobasal degeneration syndrome overlaps progressive aphasia and frontotemporal dementia. Neurology 55:
82 17. Knibb JA, Xuereb JH, Patterson K, Hodges JR (2006). Clinical and pathological characterization of progressive aphasia. Ann Neurol 59: Litvan I, Agid Y, Goetz C, Jankovic J, Wenning GK, Brandel JP, Lai EC, Verny M, Ray- Chaudhuri K, McKee A, Jellinger K, Pearce RK, Bartko JJ (1997). Accuracy of the clinical diagnosis of corticobasal degeneration: a clinicopathologic study. Neurology 48: Lowe J, Rossor M (2003). Frontotemporal lobar degeneration. In: Neurodegeneration: The molecular pathology of dementia and movement disorders, Dickson D (edit) ISN Neuropath Press, Basel, pp Mackenzie IR, Baker M, West G, Woulfe J, Qadi n, Gass J, Cannon A, Adamson J, Feldman H, Lindholm C, Melquist S, Pettman R, Sadovnick AD, Dwosh E, Whiteheart SW, Hutton M, Pickering-Brown SM (2006). A family with tau-negative frontotemporal dementia and neuronal intranuclear inclusions linked to chromosoma 17. Brain 129: Morris HR, Khan MN, Janssen JC, Brown JM, Perez-Tur J, Baker M, Ozansoy M, Hardy J, Hutton M, Wood NW, Lees AJ, Revesz T, Lantos P, Rossor MN (2001). The genetic and pathological classification of familial frontotemporal dementia. Arch Neurol 58: Neary D, Snowden JS, Gustafson L, Passant U, Stuss D, Black S, Freedman M, Kertesz A, Robert PH, Albert M, Boone K, Miller BL, Cummings J, Benson DF (1998). Frontotemporal lobar degeneration. A consensus on clinical diagnostic criteria. Neurology 52: Pittman AM, Myers AJ, Abou-Sleiman P, Fung HC, Kaleem M, Marlowe L, Duckworth J, Leung D, Williams D, Kilford L, Thomas N, Morris CM, Dickson D, Wood NW, Hardy J, Lees AJ, de Silva R (2005). Linkage disequilibrium fine mapping and haplotype association analysis of the tau gene in progressive supranuclear palsy and corticobasal degeneration. J Med Genet 42: Rizzu P, Van Swieten JC, Joosse M, Hasegawa M, Stevens M, Tibben A, Niermeijer MF, Hillebrand M, Ravid R, Oostra BA, Goedert M, van Duijn CM, Heutink P (1999). High prevalence of mutations in the Microtubule-Associated Protein Tau in a population study of frontotemporal dementia in the Netherlands. Am J Hum Genet 64: Shi J, Shaw CL, Du Plessis D, Richardson AM, Bailey KL, Julien C, Stopford C, Thompson J, Varma A, Craufurd D, Tian J, Pickering-Brown S, Neary D, Snowden JS, Mann 57
83 DM (2005). Histopathological changes underlying frontotemporal lobar degeneration with clinicopathological correlation. Acta Neuropathol 11: Stanford PM, Brooks WS, Teber ET, Hallupp M, McLean C, Halliday GM, Martins RN, Kwok JB, Schofield PR (2004). Frequency of tau mutations in familial and sporadic frontotemporal dementia and other taupathies. J Neurol 251; Verpillat P, Camuzat A, Hannequin D, Thomas-Anterion C, Puel M, Belliard S, Dubois B, Didic M, Michel BF, Lacomblez L, Moreaud O, Sellal F, Golfier V, Campion D, Clerget- Darpoux F, Brice A (2002). Association between the extended tau haplotype and frontotemporal dementia. Arch Neurol 59: Zarranz JJ, Ferrer I, Lezcano E, Forcadas MI, Eizaguirre B, Atares B, Puig B, Gomez- Esteban JC, Fernandez-Maiztegui C, Rouco I, Perez-Concha T, Fernandez M, Rodriguez O, Rodriguez-Martinez AB, de Pancorbo MM, Pastor P, Perez-Tur J (2005). A novel mutation (K317M) in the MAPT gene causes FTDP and motor neuron disease. Neurology 64:
84 Table 1. Demographic features, clinical diagnosis, genetics and pathological diagnosis of all studied patients. Patient Gender Age at Onset Age at Death Clinical diagnosis Familial history of Genotype dementia (MAPT mutation) Pathological diagnosis 1 M FTD Yes* H1/H1(P301L) MST 2 M FTD Yes* H1/H1(P301L) MST 3 M FTD Yes* H1/H1(P301L) MST 4 M FTD No H1/H1 PiD 5 M FTD No H1/H1 PiD 6 M FTD No # H1/H2 PiD 7 M FTD- upper MND Yes* H1/H2 MST-AGD 8 W PNFA No H1/H1 MST 9 M FTD No H1/H1 CBD- AGD 10 M FTD No H1/H1 CBD+PSP 11 W PNFA No H1/H1 CBD+synucleinopathy 12 W PNFA No H1/H1 CBD-PSP-AGDsynucleinopathy 13 W CBD No H1/H1 CBD 14 M CBD-upper MND No H1/H1 CBD+PSP 15 W CBD No H1/H1 CBD +PSP+ AGD 16 M FTD No No DNA CBD 17 W FTD Yes * H1/H2 FTLD-U-NII 18 M FTD No H1/H1 FTLD-U 19 M SD Yes H1/H1 FTLD-U 59
85 20 M FTD No # No DNA FTLD-U-NII 21 M FTLD-MND No H2/H2 FTLD-U 22 W FTLD-MND No H1/H2 FTLD-U 23 M FTLD-MND Yes H1/H1 FTLD-U 24 W FTLD-MND Yes * H1/H2 FTLD-U 25 W FTLD-MND No H1/H1 FTLD-U 26 M FTLD-MND No No DNA FTLD-U 27 W SD No # H1/H1 FTLD-U-NII 28 M SD No No DNA FTLD-U 29 M FTD No + H1/H2 DLDH 30 M FTD Yes H1/H2 DLDH 31 W FTD No H1/H2 DLDH 32 M FTD No H1/H2 NIFID *Patients with autosomal dominant pattern of inheritance; # Father died at a young age; + Unknown father FTD: frontotemporal dementia; MND: motor neuron disease; PNFA: progressive no fluent aphasia; CBD: corticobasal degeneration; FTLD-MND: frontotemporal lobar degeneration with motor neuron disease; SD: semantic dementia; MST: multiple system tauopathy; PiD: Pick s disease; AGD: argyrophilic grain disease; PSP: progressive supranuclear palsy; FTLD-U: FTLD with ubiquitin-only-immunoreactive neuronal inclusions; NII: neuronal intranuclear inclusions; DLDH: dementia lacking distinctive histology; NIFID: neuronal intermediate filaments inclusions disease 60
86 Table 2. Demographic features in different clinical subtypes. FTD FTLD-MND PNFA SD CBD Number M/F 15/2 3/3 0/3 2/1 1/2 Age at onset ±SD, years 56 ± 12* 63 ± 5 67 ± 2 68 ± 5 67 ± 3 Age at death ±SD, years 63 ± ± 4 78 ± 3 76 ± 3 76 ± 6 Disease duration ±SD, years 6 ± 4 5 ± 5 12 ± 3 8 ± 6 10 ± 4 *p=0.007; FTD: frontotemporal dementia; FTLD-MND: frontotemporal lobar degeneration with motor neuron disease; PNFA: progressive no fluent aphasia; SD: semantic dementia; CBD: corticobasal degeneration. Table 3. Demographic features in tau-positive and tau-negative cases. Tau-positive Tau-negative Number M/F 11/5 10/6 Age at onset ± SD, years 61 ± 8 61 ±12 Age at death ± SD, years 68 ± ± 11 Disease duration ± SD, years 7 ± 5 7 ± 4 Table 4. Frequency of H1/H1 genotype and H1 haplotype in patients with frontotemporal lobar degeneration and corticobasal degeneration. Genotypes Alleles H1/H1 (%) H1/H2 (%) H2/H2 (%) H1(%) H2(%) Global (n=28) 18 (64) 9 (32) 1(4) 45(80) 11 (20) FTLD excluding cases with 8 (44) 9 (50) 1(6) 25 (69) 11(31) MAPT mutations (n=18) FTLD tau-positive excluding 3 (60) 2 (40) 0 8 (80) 2 (20) cases with MAPT mutations (n=5) FTLD tau-negative (n=13) 5 (38) 7 (54) 1 (8) 17 (65) 9 (35) CBD (n=7) 7 (100) (100) 0 CONTROLS (n=83) 39 (47) 40 (48) 4 (5) 118 (71) 48 (29) FTLD = frontotemporal lobar degeneration; CBD = corticobasal degeneration 61
87 Table 5. Clinical correlation to pathological classification. FTD PNFA SD FTLD-MND CBD PiD 3 MST 4 1 CBD FTLD-U NIFID 1 DLDH 3 Total FTD: frontotemporal dementia; PNFA: progressive no fluent aphasia; SD: semantic dementia; FTLD-MND: frontotemporal lobar degeneration with motor neuron disease; CBD: corticobasal degeneration; PiD: Pick s disease; MST: multiple system tauopathy; FTLD-U: FTLD with ubiquitin-only-immunoreactive neuronal inclusions; NIFID: neuronal intermediate filaments inclusions disease DLDH: dementia lacking distinctive histology. 62
88 ARTÍCULO 6 CLINICAL AND PATHOLOGICAL HETEROGENEITY OF NEURONAL INTERMEDIATE FILAMENT INCLUSION DISEASE (NIFID) Molina-Porcel L *, Lladó A *, Rey MJ, Molinuevo JL, Martinez-Lage M, Esteve FX, Ferrer I, Tolosa E, Blesa R. Aceptado en Archives of Neurology (2007) * Estos dos autores han contribuido de forma igual en el trabajo 63
89 64
90 ABSTRACT Objective: To report two new cases of neuronal intermediate filament inclusion disease (NIFID), which extend the clinical and pathological phenotype of this disorder. Design: Pathology proven case reports. Patients: Two patients with pathologically proven NIFID were selected from the Universitat de Barcelona- Hospital Clínic Brain Bank. Neuropathological exam in both patients revealed intracellular inclusions that were stained with anti-neurofilament and alpha-internexin antibodies, variably with ubiquitin, but were negative for tau, alpha-synuclein and TDP-43. One patient presented frontotemporal atrophy whereas parietal atrophy was more remarkable in the other one. Interventions Medical records were retrospectively reviewed. Results: The first patient developed progressive behavioral changes characterized by apathy and indifference at 37 years, which lead to the clinical diagnosis of frontotemporal dementia (FTD). The second patient developed progressive tremor and mild speech disturbances at 70 years. Her neurological examination showed mild dysarthria, hypomimia, a mild rigid-akinetic left-predominant parkinsonism and bilateral rest and postural tremor. The clinical impression was atypical parkinsonism. No response was obtained with levodopa, and the disease progressed rapidly with falls and frontal-subcortical cognitive impairment Conclusion: Late onset presentation may be the clinical debut of NIFID. These two cases confirm the clinical and pathological heterogeneity of NIFID, and suggest its inclusion in the differential diagnosis of several neurodegenerative disorders including FTD and atypical parkinsonism. 65
91 INTRODUCTION Neuronal intermediate filament inclusion disease (NIFID) is a distinct neurological disease pathologically characterized by gliosis and neuronal loss, as well as deposition of intermediate neurofilaments containing -internexin 1. Frontotemporal dementia (FTD) is the most frequent clinical presentation, and may also include pyramidal and extrapyramidals signs 2-5. We report two new cases, which confirm the considerable heterogeneity of the clinical and pathological phenotypes of this disease. METHODS AND PATIENTS Patients with pathologically proven NIFID were selected from the Universitat de Barcelona- Hospital Clínic Barcelona Brain Bank. NIFID was diagnosed when clear intraneuronal cytoplasmic inclusions, as seen with haematoxylin and eosin stain, were stained with anti-neurofilament and alpha-internexin antibodies, variably with ubiquitin, but were negative for tau, alpha-synuclein and TDP-43. The medical records of both identified cases were retrospectively reviewed. Case report 1 A right-handed 37 year-old man developed progressive behavioral changes characterized by apathy and indifference. Three years later, his family noticed language and memory disturbances. He also presented inappropriate laughing and presented frequent falls. On admission, four years after disease onset, the neurological examination disclosed generalized hyperreflexia, hypertonia in the right upper limb and elicitation of primitive reflexes. Neuropsychological examination displayed lack of insight, disorientation, severe attentional deficits, altered verbal retention, executive dysfunction, non-fluent aphasia, and visuospatial and dressing apraxia. Past medical and family histories were non-significant. Cerebral perfusion SPECT revealed left frontotemporal hypoperfusion, while cranial CT revealed frontotemporal atrophy. The clinical diagnosis was FTD. During the follow-up, he continued to decline and fell into a state of akinetic mutism. He died at age 44 from aspiration pneumonia and a neuropathological exam was performed. Neuropathological exam: The brain weighed 1200g, and macroscopically showed severe bilateral frontal and temporal atrophy. The microscopic exam revealed severe neuronal loss with gliosis and spongiosis in superficial layers of frontal, temporal and anterior parietal cortices. There was also significant gliosis and moderate neuronal loss in the caudate and putamen. Less severe changes were present in the hippocampus with severe neuronal loss in CA1. Pale, round or ovoid, intracytoplasmic inclusions were observed in the neocortex in sections stained with haematoxylin and eosin (Fig. 1 A). In addition to the frontal, temporal and cingular cortex, similar neuronal cytoplasmic inclusions were seen in the hippocampus, amygdala, striatal nuclei, thalami and brainstem. These inclusions were strongly immunoreactive with best seen with antibodies to -internexin (Fig. 1 B) and phosphorylated neurofilament epitopes, and moderately immunoreactive to ubiquitin. Inclusions were not stained with antibodies to tau, -synuclein and 66
92 TDP-43. -amyloid immunostaning was negative. Some torpedoes in Purkinje cells were also found. Figure 1. Case 1: Pyramidal neurons of the frontal cortex show barely defined inclusions in haematoxylin and eosin-stained sections (A). These inclusions are strongly immunoreactive to -internexin (B). Case 2: Intracytoplasmic neuronal inclusions are stained with antibodies to phosphorylated neurofilaments epitopes (clone RT97) (C and D), and to -internexin (E and F). C: frontal cortex, D: thalamus, E: cingular cortex, F: pons. Bar = 25 microns. Case report 2 A 70-year-old woman with diabetes and hypertension developed progressive tremor, mild speech disturbances and multiple falls. Initial neurological examination showed mild dysarthria, hypomimia, a mild rigid-akinetic left-predominant parkinsonism and bilateral rest and postural tremor. Oculomotor testing was normal. No dysautonomia was present. Her grandmother reportedly suffered similar symptoms but medical records were not available. Cranial CT disclosed mild cortical-subcortical atrophy. The clinical impression was atypical parkinsonism. Levodopa was started but no response was obtained with 450 mg/day. The disease progressed rapidly and the patient developed significant gait disturbances, falls and frontal-subcortical cognitive impairment. She was institutionalized 2 years after disease onset. She died at age 75 and a neuropathological study was performed. Neuropathological study: The brain weight was 1040g with global, moderate atrophy predominantly in the parietal lobes. Substantia nigra was mildly pale. The microscopic study revealed pale neuronal intracytoplasmic inclusions, as revealed with haematoxylin and eosin staining (Fig. 1 C), in the neocortex, striatal nuclei, thalami and several nuclei of the brainstem, including the pons. These inclusions were identical to those observed in the first case. They were 67
Demencias Frontotemporales
 XXV Congreso Nacional de la SEAP y División Española de International Academy of Pathology Zaragoza Mayo 2011 NEUROPATOLOGIA DE LAS ENFERMEDADES NEURODEGENERATIVAS Demencias Frontotemporales Dra. Nuria
XXV Congreso Nacional de la SEAP y División Española de International Academy of Pathology Zaragoza Mayo 2011 NEUROPATOLOGIA DE LAS ENFERMEDADES NEURODEGENERATIVAS Demencias Frontotemporales Dra. Nuria
10/01/2010. El cuadro neuropsicológico asocia signos de disfunción cortical que corresponden a las topografías de las lesiones.
 Demencias degenerativas La degeneración de un órgano se produce por la transformación de su material celular en una sustancia inerte con perdida de toda actividad funcional. Las afecciones degenerativas
Demencias degenerativas La degeneración de un órgano se produce por la transformación de su material celular en una sustancia inerte con perdida de toda actividad funcional. Las afecciones degenerativas
Docente: Dra. M. Gloria Pinto Alumno: Juan Pablo Silva Ramo: Fisiopatología Fecha :
 Docente: Dra. M. Gloria Pinto Alumno: Juan Pablo Silva Ramo: Fisiopatología Fecha : 22-06-2011 Las enfermedades neurodegenerativas, son trastornos del sistema nervioso central marcados por una pérdida
Docente: Dra. M. Gloria Pinto Alumno: Juan Pablo Silva Ramo: Fisiopatología Fecha : 22-06-2011 Las enfermedades neurodegenerativas, son trastornos del sistema nervioso central marcados por una pérdida
C II REUNIÓN DE LAS ASOCIACIONES TERRITORIALES DEL NOROESTE DE LA PENÍNSULA IBÉRICA
 C II REUNIÓN DE LAS ASOCIACIONES TERRITORIALES DEL NOROESTE DE LA PENÍNSULA IBÉRICA Oviedo, 23 y 24 de Abril de 2010 Servicio Anatomía Patológica Hospital San Agustín (Avilés) Historia clínica Varón 67
C II REUNIÓN DE LAS ASOCIACIONES TERRITORIALES DEL NOROESTE DE LA PENÍNSULA IBÉRICA Oviedo, 23 y 24 de Abril de 2010 Servicio Anatomía Patológica Hospital San Agustín (Avilés) Historia clínica Varón 67
02_ EPIDEMIOLOGÍA Y CAUSAS DE LA ENFERMEDAD DE PARKINSON
 02_ EPIDEMIOLOGÍA Y CAUSAS DE LA ENFERMEDAD DE PARKINSON Dr. Jon Infante Ceberio Unidad de Trastornos de ;Movimiento, Servicio de Neurología. Hospital Universitario Marqués de Valdecilla, Santander 1.1
02_ EPIDEMIOLOGÍA Y CAUSAS DE LA ENFERMEDAD DE PARKINSON Dr. Jon Infante Ceberio Unidad de Trastornos de ;Movimiento, Servicio de Neurología. Hospital Universitario Marqués de Valdecilla, Santander 1.1
ESPACIO PÁRKINSON CONOCE LA ENFERMEDAD 1 Qué es el párkinson? Causas, diagnóstico y evolución
 ESPACIO PÁRKINSON CONOCE LA ENFERMEDAD 1 Qué es el párkinson? Causas, diagnóstico y evolución Espacio Párkinson 2017 es un proyecto puesto en marcha por la Federación Española de Párkinson con el objetivo
ESPACIO PÁRKINSON CONOCE LA ENFERMEDAD 1 Qué es el párkinson? Causas, diagnóstico y evolución Espacio Párkinson 2017 es un proyecto puesto en marcha por la Federación Española de Párkinson con el objetivo
Formulario D1: Diagnóstico Clínico
 PaQUETE DE Visita de Seguimiento de Teléfono Formulario D: Diagnóstico Clínico base de datos uniformes del nacc (UDS) Centro: ID del sujeto: Fecha del formulario: / / Visita No.: Iniciales del examinador:
PaQUETE DE Visita de Seguimiento de Teléfono Formulario D: Diagnóstico Clínico base de datos uniformes del nacc (UDS) Centro: ID del sujeto: Fecha del formulario: / / Visita No.: Iniciales del examinador:
ENFERMEDADES DEGENERATIVAS DEL SISTEMA NERVIOSO CENTRAL
 ENFERMEDADES DEGENERATIVAS DEL SISTEMA NERVIOSO CENTRAL Introducción El término degenerativo se aplica a las enfermedades del sistema nervioso que cursan con alteraciones de las células neuronales. Estos
ENFERMEDADES DEGENERATIVAS DEL SISTEMA NERVIOSO CENTRAL Introducción El término degenerativo se aplica a las enfermedades del sistema nervioso que cursan con alteraciones de las células neuronales. Estos
DÍA MUNDIAL DEL ALZHEIMER JORNADA 20º ANIVERSARIO DE AFA BIZKAIA
 OSASUN SAILA Osasun Sailburua DEPARTAMENTO DE SANIDAD Consejero de Sanidad DÍA MUNDIAL DEL ALZHEIMER JORNADA 20º ANIVERSARIO DE AFA BIZKAIA PALABRAS DEL CONSEJERO DE SANIDAD Bilbao, 18 de septiembre de
OSASUN SAILA Osasun Sailburua DEPARTAMENTO DE SANIDAD Consejero de Sanidad DÍA MUNDIAL DEL ALZHEIMER JORNADA 20º ANIVERSARIO DE AFA BIZKAIA PALABRAS DEL CONSEJERO DE SANIDAD Bilbao, 18 de septiembre de
La investigación en la demencia frontotemporal
 La investigación en la demencia frontotemporal Raquel Sánchez-Valle Unidad de Alzheimer y otros trastornos cognitivos Servicio de neurología 9 de junio de 2016 Índice: investigación en demencia frontotemporal
La investigación en la demencia frontotemporal Raquel Sánchez-Valle Unidad de Alzheimer y otros trastornos cognitivos Servicio de neurología 9 de junio de 2016 Índice: investigación en demencia frontotemporal
R-0203 ESTUDIO ESTRUCTURAL Y FUNCIONAL DE LA PATOLOGÍA DEGENERATIVA CEREBRAL
 R-0203 ESTUDIO ESTRUCTURAL Y FUNCIONAL DE LA PATOLOGÍA DEGENERATIVA CEREBRAL Mª TERESA ÁLVAREZ DE EULATE GARCÍA, REBECA SIGÜENZA GONZÁLEZ, MARTA SÁNCHEZ RONCO, AURORA SAINZ ESTEBAN, MARGARITA RODRÍGUEZ
R-0203 ESTUDIO ESTRUCTURAL Y FUNCIONAL DE LA PATOLOGÍA DEGENERATIVA CEREBRAL Mª TERESA ÁLVAREZ DE EULATE GARCÍA, REBECA SIGÜENZA GONZÁLEZ, MARTA SÁNCHEZ RONCO, AURORA SAINZ ESTEBAN, MARGARITA RODRÍGUEZ
Enfermería en el Envejecimiento. Tema 4.1. LAS DEMENCIAS EN EL ANCIANO.
 Este capítulo se publica bajo Licencia Creative Commons BY- NC- SA 3.0 Tema 4.1. LAS DEMENCIAS EN EL ANCIANO. Concepto y Definición de la Demencia Etiología y Genética de la Demencia Clasificación y Manifestaciones
Este capítulo se publica bajo Licencia Creative Commons BY- NC- SA 3.0 Tema 4.1. LAS DEMENCIAS EN EL ANCIANO. Concepto y Definición de la Demencia Etiología y Genética de la Demencia Clasificación y Manifestaciones
Existen dos tipos de genes en el genoma humano: codificantes de proteínas y codificantes de ARN.
 EL GEN Es una porción delimitida de ADN con capacidad de codificar una molécula de ARN denominada transcripto primario mediante un proceso llamado transcripción. El ADN contenido en los cromosomas de los
EL GEN Es una porción delimitida de ADN con capacidad de codificar una molécula de ARN denominada transcripto primario mediante un proceso llamado transcripción. El ADN contenido en los cromosomas de los
ACTUALIZACIÓN DE LAS DEMENCIAS FRONTOTEMPORALES
 ACTUALIZACIÓN DE LAS DEMENCIAS FRONTOTEMPORALES Mª Elena Toribio Díaz 1, Jaume Morera Guitart 2. 1 Unidad de Neurología de la Conducta y Demencias (CDP-Alz). Hospital San Vicente. San Vicente del Raspeig.
ACTUALIZACIÓN DE LAS DEMENCIAS FRONTOTEMPORALES Mª Elena Toribio Díaz 1, Jaume Morera Guitart 2. 1 Unidad de Neurología de la Conducta y Demencias (CDP-Alz). Hospital San Vicente. San Vicente del Raspeig.
En la víspera del Día Mundial del Síndrome de Down
 Nota de prensa En la víspera del Día Mundial del Síndrome de Down La Obra Social la Caixa y el Hospital de la Santa Creu i Sant Pau ponen en marcha el primer estudio para la detección precoz del alzhéimer
Nota de prensa En la víspera del Día Mundial del Síndrome de Down La Obra Social la Caixa y el Hospital de la Santa Creu i Sant Pau ponen en marcha el primer estudio para la detección precoz del alzhéimer
Caso 2: 1ª RM: aumento de señal en la corteza cerebral en difusión y FLAIR, con ganglios de la base normales. 2ª RM: aparece aumento de señal en
 RESULTADOS: En todos los casos encontramos alteraciones características a nivel cortical y/o en los ganglios basales en fases iniciales de la enfermedad. Caso 1: 1ª RM: aumento de señal en T2, FLAIR y
RESULTADOS: En todos los casos encontramos alteraciones características a nivel cortical y/o en los ganglios basales en fases iniciales de la enfermedad. Caso 1: 1ª RM: aumento de señal en T2, FLAIR y
GUÍA DE PRÁCTICA CLÍNICA. Demencia Frontotemporal. Dra. Lucrecia Schweitzer
 Dra. Lucrecia Schweitzer Año 2012 - Revisión: 0 Página 1 de 6 Introducción Esta afección fue descripta por Arnold Pick en 1892 al estudiar un paciente con afasia progresiva y cambios de conducta. En su
Dra. Lucrecia Schweitzer Año 2012 - Revisión: 0 Página 1 de 6 Introducción Esta afección fue descripta por Arnold Pick en 1892 al estudiar un paciente con afasia progresiva y cambios de conducta. En su
DEMENCIA? QUÉ ES LA DEMENCIA?
 PRESENTA QUÉ ES LA? QUÉ ES LA? La demencia es el trastorno de un grupo de procesos mentales entre los cuales podemos mencionar: memoria; razonamiento; planeamiento; aprendizaje; atención; lenguaje; percepción;
PRESENTA QUÉ ES LA? QUÉ ES LA? La demencia es el trastorno de un grupo de procesos mentales entre los cuales podemos mencionar: memoria; razonamiento; planeamiento; aprendizaje; atención; lenguaje; percepción;
Neuropatología 3. Patología II (PA2026) UNIBE III cuatrimestre 2012
 Neuropatología 3 Patología II (PA2026) UNIBE III cuatrimestre 2012 Temas Enfermedades por priones. Enfermedades desmielinizantes, esclerosis múltiple, encefalomielitis diseminada aguda y leucoencefalitis
Neuropatología 3 Patología II (PA2026) UNIBE III cuatrimestre 2012 Temas Enfermedades por priones. Enfermedades desmielinizantes, esclerosis múltiple, encefalomielitis diseminada aguda y leucoencefalitis
Especialista en Neuropsicología. Sanidad, Dietética y Nutrición
 Especialista en Neuropsicología Sanidad, Dietética y Nutrición Ficha Técnica Categoría Sanidad, Dietética y Nutrición Referencia 157334-1602 Precio 39.16 Euros Sinopsis Si quiere conocer los aspectos fundamentales
Especialista en Neuropsicología Sanidad, Dietética y Nutrición Ficha Técnica Categoría Sanidad, Dietética y Nutrición Referencia 157334-1602 Precio 39.16 Euros Sinopsis Si quiere conocer los aspectos fundamentales
Ataxias. Jorge Luis Palacios Espichán MIR 3 Análisis Clínicos. XX JORNADA de FORMACIÓN INTERHOSPITALARIA del LABORATORIO CLÍNICO
 XX JORNADA de FORMACIÓN INTERHOSPITALARIA del LABORATORIO CLÍNICO LABORATORIO CLÍNICO EN EL DIAGNÓSTICO DE LAS ENFERMEDADES NEUROLÓGICAS Ataxias Jorge Luis Palacios Espichán MIR 3 Análisis Clínicos Ataxia
XX JORNADA de FORMACIÓN INTERHOSPITALARIA del LABORATORIO CLÍNICO LABORATORIO CLÍNICO EN EL DIAGNÓSTICO DE LAS ENFERMEDADES NEUROLÓGICAS Ataxias Jorge Luis Palacios Espichán MIR 3 Análisis Clínicos Ataxia
CONCENTRACIONES PLASMÁTICAS Y GENOTIPO APO E EN LA ENFERMEDAD DE ALZHEIMER
 UNIVERSITAT ROVIRA I VIRGILI FACULTAT DE MEDICINA TESIS DOCTORAL CONCENTRACIONES PLASMÁTICAS Y GENOTIPO APO E EN LA ENFERMEDAD DE ALZHEIMER MARÍA PILAR MARTÍNEZ HERAS LICENCIADA EN MEDICINA Y CIRUGIA DICIEMBRE
UNIVERSITAT ROVIRA I VIRGILI FACULTAT DE MEDICINA TESIS DOCTORAL CONCENTRACIONES PLASMÁTICAS Y GENOTIPO APO E EN LA ENFERMEDAD DE ALZHEIMER MARÍA PILAR MARTÍNEZ HERAS LICENCIADA EN MEDICINA Y CIRUGIA DICIEMBRE
Guía del Curso Especialista en Neuropsicología
 Guía del Curso Especialista en Neuropsicología Modalidad de realización del curso: Número de Horas: Titulación: A distancia y Online 120 Horas Diploma acreditativo con las horas del curso OBJETIVOS Si
Guía del Curso Especialista en Neuropsicología Modalidad de realización del curso: Número de Horas: Titulación: A distancia y Online 120 Horas Diploma acreditativo con las horas del curso OBJETIVOS Si
Modificaciones post-traduccionales
 Facultad de Química, UNAM 1630 Genética y Biología Molecular Modificaciones post-traduccionales Modificaciones post-traduccionales No siempre un polipéptido recién sintetizado es una proteína funcional.
Facultad de Química, UNAM 1630 Genética y Biología Molecular Modificaciones post-traduccionales Modificaciones post-traduccionales No siempre un polipéptido recién sintetizado es una proteína funcional.
Amiloide βa4, taupatías, alfa-sinucleinopatías y prionopatías
 ARTÍCULO DE REVISIÓN Amiloide βa4, taupatías, alfa-sinucleinopatías y prionopatías Isidro Ferrer Unidad de Neuropatología. Servicio de Anatomía Patológica. Hospital Príncipes de España. Universidad de
ARTÍCULO DE REVISIÓN Amiloide βa4, taupatías, alfa-sinucleinopatías y prionopatías Isidro Ferrer Unidad de Neuropatología. Servicio de Anatomía Patológica. Hospital Príncipes de España. Universidad de
IES Santa Clara. PAU/EBAU BIOLOGÍA 2º BACHILLER
 GENÉTICA MENDELIANA Jun 01 1. Comenta brevemente la relación existente entre variedad alélica y evolución, de qué forma se originan nuevas variantes alélicas a partir de un alelo original? 2. Describe,
GENÉTICA MENDELIANA Jun 01 1. Comenta brevemente la relación existente entre variedad alélica y evolución, de qué forma se originan nuevas variantes alélicas a partir de un alelo original? 2. Describe,
UD 5. BASE QUÍMICA DE LA HERENCIA. ALMACENAMIENTO Y TRANSMISION DE LA INFORMACIÓN GENÉTICA
 PRUEBAS DE ACCESO A LA UNIVERSIDAD. BACHILLERATO LOGSE. CANTABRIA. BIOLOGÍA (2001-2011). UD 5. BASE QUÍMICA DE LA HERENCIA. ALMACENAMIENTO Y TRANSMISION DE LA INFORMACIÓN GENÉTICA 1. Comenta brevemente
PRUEBAS DE ACCESO A LA UNIVERSIDAD. BACHILLERATO LOGSE. CANTABRIA. BIOLOGÍA (2001-2011). UD 5. BASE QUÍMICA DE LA HERENCIA. ALMACENAMIENTO Y TRANSMISION DE LA INFORMACIÓN GENÉTICA 1. Comenta brevemente
DEMENCIA FRONTOTEMPORAL POR MUTACIONES EN EL GEN DE LA PROGRANULINA. ASPECTOS CLÍNICOS Y MOLECULARES
 DEMENCIA FRONTOTEMPORAL POR MUTACIONES EN EL GEN DE LA PROGRANULINA. ASPECTOS CLÍNICOS Y MOLECULARES TESIS DOCTORAL Fermín Moreno Izco DonostiaSan Sebastián 2016 Memoria presentada para optar al título
DEMENCIA FRONTOTEMPORAL POR MUTACIONES EN EL GEN DE LA PROGRANULINA. ASPECTOS CLÍNICOS Y MOLECULARES TESIS DOCTORAL Fermín Moreno Izco DonostiaSan Sebastián 2016 Memoria presentada para optar al título
ENFERMEDADES HEREDITARIAS EN ANIMALES que son las enfermedades hereditarias?
 ENFERMEDADES HEREDITARIAS EN ANIMALES que son las enfermedades hereditarias? Las enfermedades hereditarias son aquellas que se transmiten mediante el proceso de la herencia, es decir de los progenitores
ENFERMEDADES HEREDITARIAS EN ANIMALES que son las enfermedades hereditarias? Las enfermedades hereditarias son aquellas que se transmiten mediante el proceso de la herencia, es decir de los progenitores
Diagnóstico y evolución de la degeneración lobular frontotemporal en una unidad de demencia: 12 años de experiencia
 original Diagnóstico y evolución de la degeneración lobular frontotemporal en una unidad de demencia: 12 años de experiencia Isabel Hernández Ruiz 1,11, Pablo Martínez-Lage Álvarez 2,11, Sergi Valero Ventura
original Diagnóstico y evolución de la degeneración lobular frontotemporal en una unidad de demencia: 12 años de experiencia Isabel Hernández Ruiz 1,11, Pablo Martínez-Lage Álvarez 2,11, Sergi Valero Ventura
10. Demencia de inicio precoz o presenil
 10. Demencia de inicio precoz o presenil Preguntas para responder: 10.1. Qué se entiende por demencia presenil o de inicio precoz? 10.2. Cuáles son las causas más frecuentes de demencia de inicio precoz
10. Demencia de inicio precoz o presenil Preguntas para responder: 10.1. Qué se entiende por demencia presenil o de inicio precoz? 10.2. Cuáles son las causas más frecuentes de demencia de inicio precoz
Alteraciones estructurales en enfermedades neurodegenerativas
 Alteraciones estructurales en enfermedades neurodegenerativas Galindez, J; Surur, A; Pessini, L; Lopez Galletti, N; Cabral, D. Sanatorio Allende. Córdoba Introducción: Las enfermedades neurodegenerativas
Alteraciones estructurales en enfermedades neurodegenerativas Galindez, J; Surur, A; Pessini, L; Lopez Galletti, N; Cabral, D. Sanatorio Allende. Córdoba Introducción: Las enfermedades neurodegenerativas
ENFERMEDADES DE LA MOTONEURONA Y ESCLEROSIS LATERAL AMIOTROFICA
 ENFERMEDADES DE LA MOTONEURONA Y ESCLEROSIS LATERAL AMIOTROFICA Clase de neurología. Dr. Jaume Coll i Cantí UAB. 2011 ELA (ESCLEROSIS LATERAL AMIOTRÓFICA) es la más común de las enfermedades de la neurona
ENFERMEDADES DE LA MOTONEURONA Y ESCLEROSIS LATERAL AMIOTROFICA Clase de neurología. Dr. Jaume Coll i Cantí UAB. 2011 ELA (ESCLEROSIS LATERAL AMIOTRÓFICA) es la más común de las enfermedades de la neurona
7. Estudio genético en demencias
 7. genético en demencias Preguntas para responder: 7.1. Cuándo está indicado realizar análisis genéticos para identificar mutaciones patogénicas en pacientes con demencia? 7.2. Cuándo está indicado realizar
7. genético en demencias Preguntas para responder: 7.1. Cuándo está indicado realizar análisis genéticos para identificar mutaciones patogénicas en pacientes con demencia? 7.2. Cuándo está indicado realizar
2. La figura representa un segmento de la fibra básica de cromatina.
 Bloque IV: Base molecular de la herencia 1. a. El esquema representa un cromosoma eucariótico en metafase mitótica. Qué denominación reciben los elementos indicados por los números 1 a 4? b. Dibuje un
Bloque IV: Base molecular de la herencia 1. a. El esquema representa un cromosoma eucariótico en metafase mitótica. Qué denominación reciben los elementos indicados por los números 1 a 4? b. Dibuje un
El ADN y sus posibles modificaciones
 El ADN y sus posibles modificaciones Nuestro Genoma está compuesto aproximadamente por 3.000.000.000 de letras llamadas bases de ADN o nucleótidos (Adenina, Guanina, Citosina y Timina), hoy se sabe que
El ADN y sus posibles modificaciones Nuestro Genoma está compuesto aproximadamente por 3.000.000.000 de letras llamadas bases de ADN o nucleótidos (Adenina, Guanina, Citosina y Timina), hoy se sabe que
Taller de Valoración de la Marcha: Trastorno de la marcha nivel intermedio
 Taller de Valoración de la Marcha: Trastorno de la marcha nivel intermedio Grupo de Trabajo de Osteoporosis, Caídas y Fracturas de la S.E.G.G. ESPACIO PARA EL LOGO, FOTO, ECT. DE VUESTRO HOSPITAL Dra Carmen
Taller de Valoración de la Marcha: Trastorno de la marcha nivel intermedio Grupo de Trabajo de Osteoporosis, Caídas y Fracturas de la S.E.G.G. ESPACIO PARA EL LOGO, FOTO, ECT. DE VUESTRO HOSPITAL Dra Carmen
Bases Celulares y Moleculares de la Genética. Dra. Carmen Aída Martínez
 Bases Celulares y Moleculares de la Genética Dra. Carmen Aída Martínez GENOMA Y ADN Al total de información genética de un organismo se le denomina genoma. En los organismos vivos el material genético
Bases Celulares y Moleculares de la Genética Dra. Carmen Aída Martínez GENOMA Y ADN Al total de información genética de un organismo se le denomina genoma. En los organismos vivos el material genético
Síndrome periódico asociado a la criopirina (CAPS)
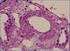 www.printo.it/pediatric-rheumatology/ar/intro Síndrome periódico asociado a la criopirina (CAPS) Versión de 2016 1. QUÉ SON LOS CAPS 1.1 En qué consiste? El síndrome periódico asociado a la criopirina
www.printo.it/pediatric-rheumatology/ar/intro Síndrome periódico asociado a la criopirina (CAPS) Versión de 2016 1. QUÉ SON LOS CAPS 1.1 En qué consiste? El síndrome periódico asociado a la criopirina
Diseño de catalizadores para una obtención limpia de 2-feniletanol
 Universitat Rovira i Virgili Facultat de Química Departament de Química Física i Inorgànica Diseño de catalizadores para una obtención limpia de 2-feniletanol Memòria de Tesi Doctoral Tarragona, Juliol
Universitat Rovira i Virgili Facultat de Química Departament de Química Física i Inorgànica Diseño de catalizadores para una obtención limpia de 2-feniletanol Memòria de Tesi Doctoral Tarragona, Juliol
FISIOLOGÍA HUMANA BLOQUE 9. NEUROFISIOLOGÍA. Tema 42. Organización Funcional del Sistema Nervioso
 Facultad de Medicina Departamento de Fisiología FISIOLOGÍA HUMANA BLOQUE 9. NEUROFISIOLOGÍA Tema 42. Organización Funcional del Sistema Nervioso Dr. Bernardo LÓPEZ CANO Profesor Titular de la Universidad
Facultad de Medicina Departamento de Fisiología FISIOLOGÍA HUMANA BLOQUE 9. NEUROFISIOLOGÍA Tema 42. Organización Funcional del Sistema Nervioso Dr. Bernardo LÓPEZ CANO Profesor Titular de la Universidad
Teoría de la mente en las demencias. María Jesús Cardoso Moreno Alba Pérez Díaz María Ángel Casas Soriano Marta Armengod Ramo
 Teoría de la mente en las demencias María Jesús Cardoso Moreno Alba Pérez Díaz María Ángel Casas Soriano Marta Armengod Ramo CONTENIDOS 1. Introducción: Demencias Corticales Degenerativas Función Ejecutiva
Teoría de la mente en las demencias María Jesús Cardoso Moreno Alba Pérez Díaz María Ángel Casas Soriano Marta Armengod Ramo CONTENIDOS 1. Introducción: Demencias Corticales Degenerativas Función Ejecutiva
Investigando el Genoma en Pacientes con Esquizofrenia
 Investigando el Genoma en Pacientes con Esquizofrenia Facultad de Medicina Universidad Castilla La Mancha Jornada de Investigación Hospital Universitario de la Ribera Alzira,23 de octubre de 2013 Dra.
Investigando el Genoma en Pacientes con Esquizofrenia Facultad de Medicina Universidad Castilla La Mancha Jornada de Investigación Hospital Universitario de la Ribera Alzira,23 de octubre de 2013 Dra.
TALLER (Evaluación 20 de abril). C E R T A A P R I N C I P I O D E S E G R E G A C I O N I
 I. SOPA DE LETRAS TALLER (Evaluación 20 de abril). C E R T A A P R I N C I P I O D E S E G R E G A C I O N I A R D C Z F J Ñ V H I R A J V U B W L G B A C O R P I X P C D G N Z Q E H U L M F A F J A C
I. SOPA DE LETRAS TALLER (Evaluación 20 de abril). C E R T A A P R I N C I P I O D E S E G R E G A C I O N I A R D C Z F J Ñ V H I R A J V U B W L G B A C O R P I X P C D G N Z Q E H U L M F A F J A C
SOLICITUD DE ANÁLISIS GENÉTICO MOLECULAR DE DEMENCIAS DEGENERATIVAS. Marque con una X el estudio solicitado. - Estudio Molecular:...
 CDGM Centro de Diagnóstico Genético Molecular de Enfermedades Hereditarias SOLICITUD DE ANÁLISIS GENÉTICO MOLECULAR DE DEMENCIAS DEGENERATIVAS Marque con una X el estudio solicitado 1. GENES IMPLICADOS
CDGM Centro de Diagnóstico Genético Molecular de Enfermedades Hereditarias SOLICITUD DE ANÁLISIS GENÉTICO MOLECULAR DE DEMENCIAS DEGENERATIVAS Marque con una X el estudio solicitado 1. GENES IMPLICADOS
Guía de Actividad de clases biología IV medio Mutaciones
 Guía de Actividad de clases biología IV medio Mutaciones Nombre: Curso: Fecha: Instrucciones.- Desarrolla la siguiente guía siguiendo la instrucción que se da en cada actividad. En aquellas donde se indique
Guía de Actividad de clases biología IV medio Mutaciones Nombre: Curso: Fecha: Instrucciones.- Desarrolla la siguiente guía siguiendo la instrucción que se da en cada actividad. En aquellas donde se indique
EXPRESIÓN DIFERENCIAL DE ISOFORMAS DE ALFA- SINUCLEÍNA: UN POSIBLE MARCADOR EN SANGRE PERIFÉRICA DE LA ENFERMEDAD DE PARKINSON
 EXPRESIÓN DIFERENCIAL DE ISOFORMAS DE ALFA- SINUCLEÍNA: UN POSIBLE MARCADOR EN SANGRE PERIFÉRICA DE LA ENFERMEDAD DE PARKINSON Investigadora principal: Dra. Katrin Beyer Hospital Universitari Germans Trias
EXPRESIÓN DIFERENCIAL DE ISOFORMAS DE ALFA- SINUCLEÍNA: UN POSIBLE MARCADOR EN SANGRE PERIFÉRICA DE LA ENFERMEDAD DE PARKINSON Investigadora principal: Dra. Katrin Beyer Hospital Universitari Germans Trias
1- DEMENCIA. Cuando existe demencia tenemos las siguientes afectaciones:
 1- DEMENCIA Es la entidad que engloba a todas las enfermedades que tienen en común la pérdida permanente de las facultades superiores y la alteración de conducta del paciente. Cuando existe demencia tenemos
1- DEMENCIA Es la entidad que engloba a todas las enfermedades que tienen en común la pérdida permanente de las facultades superiores y la alteración de conducta del paciente. Cuando existe demencia tenemos
CASO CLINICO AUTOPSIA 07 A 7. Dra. Juliana Escobar Stein. Servicio Anatomía Patológica Hospital Valle del Nalón
 CASO CLINICO AUTOPSIA 07 A 7 Dra. Juliana Escobar Stein Servicio Anatomía Patológica Hospital Valle del Nalón 2003 HISTORIA CLINICA Ingresa servicio de psiquiatría Mujer 20 años Soltera Natural de Ecuador
CASO CLINICO AUTOPSIA 07 A 7 Dra. Juliana Escobar Stein Servicio Anatomía Patológica Hospital Valle del Nalón 2003 HISTORIA CLINICA Ingresa servicio de psiquiatría Mujer 20 años Soltera Natural de Ecuador
Genómica comparada. Brown 2002, págs
 Genómica comparada 1. Teoría neutralista de la evolución molecular 2. Sustituciones nucleotídicas sinónimas y no-sinónimas. Interpretación de la razón Ka/Ks. 3. Duplicaciones y el destino de los genes
Genómica comparada 1. Teoría neutralista de la evolución molecular 2. Sustituciones nucleotídicas sinónimas y no-sinónimas. Interpretación de la razón Ka/Ks. 3. Duplicaciones y el destino de los genes
Recomendaciones del Estudio Genético de BRCA1 y BRCA2 en Cáncer de Ovario
 Recomendaciones del Estudio Genético de BRCA1 y BRCA2 en Cáncer de Ovario Consenso del Grupo Español de Investigación en Cáncer de Ovario (GEICO) y de la Sociedad Española de Oncología Médica (SEOM) Los
Recomendaciones del Estudio Genético de BRCA1 y BRCA2 en Cáncer de Ovario Consenso del Grupo Español de Investigación en Cáncer de Ovario (GEICO) y de la Sociedad Española de Oncología Médica (SEOM) Los
DEMENCIAS SENILES Y ENFERMEDAD DE ALZHEIMER
 DEMENCIAS SENILES Y ENFERMEDAD DE ALZHEIMER Definición: Decaimiento progresivo de la función intelectual que involucra el campo entero de la capacidad de juicio (pérdida de afecto, desintegración de la
DEMENCIAS SENILES Y ENFERMEDAD DE ALZHEIMER Definición: Decaimiento progresivo de la función intelectual que involucra el campo entero de la capacidad de juicio (pérdida de afecto, desintegración de la
ENFERMEDAD DE PARKINSON. Profesora: Raquel García Pérez
 Profesora: Raquel García Pérez 1.INTRODUCCIÓN. 2.DEFINICIÓN. 3.ETIOLOGÍA. 4.FACTORES DE RIESGO. 5.EPIDEMIIOLOGÍA. 6.FISIOPATOLOGÍA. 7.CLÍNICA. 8.EVOLUCIÓN Y PRONÓSTICO. 9.ESCALAS DE VALORACIÓN. 10.DIAGNÓSTICO.
Profesora: Raquel García Pérez 1.INTRODUCCIÓN. 2.DEFINICIÓN. 3.ETIOLOGÍA. 4.FACTORES DE RIESGO. 5.EPIDEMIIOLOGÍA. 6.FISIOPATOLOGÍA. 7.CLÍNICA. 8.EVOLUCIÓN Y PRONÓSTICO. 9.ESCALAS DE VALORACIÓN. 10.DIAGNÓSTICO.
GENOMICA Y PROTEOMICA
 GENOMICA Y PROTEOMICA Dr. José A Gutiérrez Bustamante Area de Genética y Biología Molecular y Celular Depto. de Morfología Humana Fac. de Medicina - UNT Célula ADN gen A gen B gen C ARN Tecnología Bioinformática
GENOMICA Y PROTEOMICA Dr. José A Gutiérrez Bustamante Area de Genética y Biología Molecular y Celular Depto. de Morfología Humana Fac. de Medicina - UNT Célula ADN gen A gen B gen C ARN Tecnología Bioinformática
EJERCICIOS COMPLEMENTARIOS. LIGAMIENTO Y MAPEO GÉNICO 2009
 EJERCICIOS COMPLEMENTARIOS. LIGAMIENTO Y MAPEO GÉNICO 2009 1- Un matrimonio entre dos heterocigotos portadores de Beta talasemia (enfermedad autosómica recesiva causada por un defecto en el gen de la Beta
EJERCICIOS COMPLEMENTARIOS. LIGAMIENTO Y MAPEO GÉNICO 2009 1- Un matrimonio entre dos heterocigotos portadores de Beta talasemia (enfermedad autosómica recesiva causada por un defecto en el gen de la Beta
Neurobiología del autismo. Dr. Josep Artigas
 Neurobiología del autismo Dr. Josep Artigas donde...? que...? cuando...? donde...? Hemisferio derecho o izquierdo? Lobulo prefrontal y lobulo frontal Lobulo parietal Lobulo occipital Talamo Ganglios basales
Neurobiología del autismo Dr. Josep Artigas donde...? que...? cuando...? donde...? Hemisferio derecho o izquierdo? Lobulo prefrontal y lobulo frontal Lobulo parietal Lobulo occipital Talamo Ganglios basales
Estrategias de enfermería en la enfermedad de Parkinson. Posibilidades terapéuticas y herramientas psicoeducativas
 Manuel José Mejías Estévez Estrategias de enfermería en la enfermedad de Parkinson. Posibilidades terapéuticas y herramientas psicoeducativas www.aulascience.es Unidad didáctica 1. Conceptos clínicos 2.
Manuel José Mejías Estévez Estrategias de enfermería en la enfermedad de Parkinson. Posibilidades terapéuticas y herramientas psicoeducativas www.aulascience.es Unidad didáctica 1. Conceptos clínicos 2.
Marcadores Moleculares en Pollos. Gabriela. M. Iglesias, M.V. MSc
 Marcadores Moleculares en Pollos Gabriela. M. Iglesias, M.V. MSc Marcadores moleculares en Pollos Camperos Utilización n en el mejoramiento animal: Evaluar los marcadores moleculares asociados a caracteres
Marcadores Moleculares en Pollos Gabriela. M. Iglesias, M.V. MSc Marcadores moleculares en Pollos Camperos Utilización n en el mejoramiento animal: Evaluar los marcadores moleculares asociados a caracteres
Alteraciones neuropsicológicas, extrapiramidales y neuroimagenológicas en la demencia frontotemporal
 PRESENTACIÓN DE CASOS Alteraciones neuropsicológicas, extrapiramidales y neuroimagenológicas en la demencia frontotemporal Neuropsychological, extrapyramidal and neuroimaging alterations observed in frontotemporal
PRESENTACIÓN DE CASOS Alteraciones neuropsicológicas, extrapiramidales y neuroimagenológicas en la demencia frontotemporal Neuropsychological, extrapyramidal and neuroimaging alterations observed in frontotemporal
Centro Medico Nacional Siglo XXI Hospital de Especialidades. Alergia e Inmunología Clínica
 Centro Medico Nacional Siglo XXI Hospital de Especialidades Complejo Mayor de Histocompatibilidad Dra. Patricia María O Farrill Romanillos R3AIC México, D.F. a 21 de Junio del 2012 Definición Moléculas
Centro Medico Nacional Siglo XXI Hospital de Especialidades Complejo Mayor de Histocompatibilidad Dra. Patricia María O Farrill Romanillos R3AIC México, D.F. a 21 de Junio del 2012 Definición Moléculas
Bases patogénicas de la enfermedad de motoneurona
 Jornada técnica y de divulgación sociosanitaria La Esclerosis Lateral Amiotrófica (ELA) Bases patogénicas de la enfermedad de motoneurona J. Esteban Unidad de ELA. U. 723 ELA Enf. debilitante progresiva
Jornada técnica y de divulgación sociosanitaria La Esclerosis Lateral Amiotrófica (ELA) Bases patogénicas de la enfermedad de motoneurona J. Esteban Unidad de ELA. U. 723 ELA Enf. debilitante progresiva
Descifrando las bases genéticas de la ceguera
 Descifrando las bases genéticas de la ceguera Servicio de interpretación clínica del genoma germinal que analiza mediante secuenciación de nueva generación un panel de más de 300 genes con utilidad clínica,
Descifrando las bases genéticas de la ceguera Servicio de interpretación clínica del genoma germinal que analiza mediante secuenciación de nueva generación un panel de más de 300 genes con utilidad clínica,
Tema 4 Ampliaciones de la Genética Mendeliana I: T ma m a 5 5 Ampliaciones de la Genética Mendeliana II: Ampliaciones de la Genética
 Tema 4: Ampliaciones de la Genética Mendeliana I: Árboles genealógicos. Rasgos autosómicos recesivos. Rasgos autosómicos dominantes. Dominancia incompleta. Alelos codominantes. Alelos múltiples. Tema 5:
Tema 4: Ampliaciones de la Genética Mendeliana I: Árboles genealógicos. Rasgos autosómicos recesivos. Rasgos autosómicos dominantes. Dominancia incompleta. Alelos codominantes. Alelos múltiples. Tema 5:
ESTUDIO DE LOS TRASTORNOS DEL SUEÑO DE LOS PACIENTES CON FIBROMIALGIA
 ESTUDIO DE LOS TRASTORNOS DEL SUEÑO DE LOS PACIENTES CON FIBROMIALGIA Investigadora principal: Dra. Marta Larrosa Padró Corporació Sanitària i Universitària Parc Taulí Duración: 3 años 1 1. Resumen La
ESTUDIO DE LOS TRASTORNOS DEL SUEÑO DE LOS PACIENTES CON FIBROMIALGIA Investigadora principal: Dra. Marta Larrosa Padró Corporació Sanitària i Universitària Parc Taulí Duración: 3 años 1 1. Resumen La
Informe técnico del proyecto. de diagnóstico genético de pacientes con. síndrome de Dravet y espectros asociados
 Informe técnico del proyecto de diagnóstico genético de pacientes con síndrome de Dravet y espectros asociados Introducción El objetivo principal de este proyecto es realizar un diagnóstico genético a
Informe técnico del proyecto de diagnóstico genético de pacientes con síndrome de Dravet y espectros asociados Introducción El objetivo principal de este proyecto es realizar un diagnóstico genético a
Parvovirosis canina: Qué ha cambiado realmente con las nuevas variantes virales?
 Parvovirosis canina: Qué ha cambiado realmente con las nuevas variantes virales? Virus de la Parvovirosis canina (CPV): Familia Parvoviridae, pequeño virus de genoma DNA simple hebra de 5.2 Kb. Su genoma
Parvovirosis canina: Qué ha cambiado realmente con las nuevas variantes virales? Virus de la Parvovirosis canina (CPV): Familia Parvoviridae, pequeño virus de genoma DNA simple hebra de 5.2 Kb. Su genoma
Pregunta 1. A continuación encontrará las estructuras de tres aminoácidos: Clasifíquelos por orden de hidrofobicidad:
 Pregunta 1 A continuación encontrará las estructuras de tres aminoácidos: Clasifíquelos por orden de hidrofobicidad: a) Más hidrofóbico b) Intermedio c) Menos hidrofóbico d) Explique por qué (a) es más
Pregunta 1 A continuación encontrará las estructuras de tres aminoácidos: Clasifíquelos por orden de hidrofobicidad: a) Más hidrofóbico b) Intermedio c) Menos hidrofóbico d) Explique por qué (a) es más
LA UNIVERSITAT DE BARCELONA AUTÒNOMA I LA FACULTAT DE MEDICINA
 LA UNIVERSITAT DE BARCELONA AUTÒNOMA I LA FACULTAT DE MEDICINA Presentació: L any 1933 la Universitat de Barcelona va aconseguir un règim especial d estructura i funcionament que li va permetre una autonomia
LA UNIVERSITAT DE BARCELONA AUTÒNOMA I LA FACULTAT DE MEDICINA Presentació: L any 1933 la Universitat de Barcelona va aconseguir un règim especial d estructura i funcionament que li va permetre una autonomia
24/08/2017. NEUROPSICOLOGIA Cerebro-Mente-Conducta EL PROBLEMA CUERPO MENTE DE DONDE VIENEN LOS PENSAMIENTOS? ELEMENTOS DE NEUROPSICOLOGIA INFANTIL
 ELEMENTOS DE INFANTIL www.enpi.ecaths.com Disciplina científica que estudia la relación entre las estructuras y el funcionamiento del SNC y los procesos cognitivo comportamentales. Ciencia que estudia
ELEMENTOS DE INFANTIL www.enpi.ecaths.com Disciplina científica que estudia la relación entre las estructuras y el funcionamiento del SNC y los procesos cognitivo comportamentales. Ciencia que estudia
QUE ES NEUROPSICOLOGIA?
 ELEMENTOS DE INFANTIL www.enpi.ecaths.com QUE ES? Disciplina científica que estudia la relación entre las estructuras y el funcionamiento del SNC y los procesos cognitivo comportamentales. Ciencia que
ELEMENTOS DE INFANTIL www.enpi.ecaths.com QUE ES? Disciplina científica que estudia la relación entre las estructuras y el funcionamiento del SNC y los procesos cognitivo comportamentales. Ciencia que
Herencia. Br. Angel E. Hernandez C.
 Herencia Br. Angel E. Hernandez C. Genética Ciencia que estudia la herencia y la variabilidad. Estudia: - Los caracteres hereditarios y la forma en que se transmiten de generación a generación. - Las semejanzas
Herencia Br. Angel E. Hernandez C. Genética Ciencia que estudia la herencia y la variabilidad. Estudia: - Los caracteres hereditarios y la forma en que se transmiten de generación a generación. - Las semejanzas
MODELOS 1.- EL MODELO CLÁSICO
 neu.lin. 1 MODELOS 1.- EL MODELO CLÁSICO En 1861 Broca presenta intuición de la importancia de las convoluciones del cerebro. La conclusión central señala que el aparato expresivo del habla se relaciona
neu.lin. 1 MODELOS 1.- EL MODELO CLÁSICO En 1861 Broca presenta intuición de la importancia de las convoluciones del cerebro. La conclusión central señala que el aparato expresivo del habla se relaciona
GENÉTICA: Herencia, Expresión génica, Replicación, biotecnología
 GENÉTICA: Herencia, Expresión génica, Replicación, biotecnología Selectividad: herencia Jun10.Unidad3.En la figura se indica la transmisión de cierto fenotipo (individuos en blanco) en una familia (los
GENÉTICA: Herencia, Expresión génica, Replicación, biotecnología Selectividad: herencia Jun10.Unidad3.En la figura se indica la transmisión de cierto fenotipo (individuos en blanco) en una familia (los
UNIVERSIDAD DE COSTA RICA ESCUELA DE BIOLOGIA SECCIÓN DE GENÉTICA Y BIOTECNOLOGÍA
 UNIVERSIDAD DE COSTA RICA ESCUELA DE BIOLOGIA SECCIÓN DE GENÉTICA Y BIOTECNOLOGÍA B-345 Genética General para Biología I Semestre del 2014 Créditos: 3 Horario: Lunes y martes de 2 a 4 p.m., Aula 180 Requisitos:
UNIVERSIDAD DE COSTA RICA ESCUELA DE BIOLOGIA SECCIÓN DE GENÉTICA Y BIOTECNOLOGÍA B-345 Genética General para Biología I Semestre del 2014 Créditos: 3 Horario: Lunes y martes de 2 a 4 p.m., Aula 180 Requisitos:
4. Definición y clasificación de las demencias
 4. Definición y clasificación de las demencias Preguntas para responder: 4.1. Qué es la demencia? 4.2. Cuál es la incidencia y prevalencia de la demencia? 4.3. Cómo se clasifica la demencia? 4.4. Cuáles
4. Definición y clasificación de las demencias Preguntas para responder: 4.1. Qué es la demencia? 4.2. Cuál es la incidencia y prevalencia de la demencia? 4.3. Cómo se clasifica la demencia? 4.4. Cuáles
Estructura y partes de un gen.
 UNIVERSIDAD AUTÓNOMA DE SINALOA Unidad Académica de Ciencias de la Nutrición y Gastronomía. Estructura y partes de un gen. Dr. Javier Magaña 1. Anna Islas 2. Diego Moreira 2. Eduardo Vargas 2. 1. Responsable
UNIVERSIDAD AUTÓNOMA DE SINALOA Unidad Académica de Ciencias de la Nutrición y Gastronomía. Estructura y partes de un gen. Dr. Javier Magaña 1. Anna Islas 2. Diego Moreira 2. Eduardo Vargas 2. 1. Responsable
2. Definición y clasificación de las demencias
 2. Definición y clasificación de las demencias Preguntas para responder: 2.1. Qué es la demencia? 2.2. Cuál es la incidencia y prevalencia de la demencia? 2.3. Cómo se clasifica la demencia? 2.4. Cuáles
2. Definición y clasificación de las demencias Preguntas para responder: 2.1. Qué es la demencia? 2.2. Cuál es la incidencia y prevalencia de la demencia? 2.3. Cómo se clasifica la demencia? 2.4. Cuáles
CUESTIONES DE SELECTIVIDAD BLOQUE IV GENÉTICA
 CUESTIONES DE SELECTIVIDAD BLOQUE IV GENÉTICA MENDELISMO 1. En relación con las aportaciones de Mendel al estudio de la herencia: a) Explique brevemente el tipo de herencia de una enfermedad hereditaria
CUESTIONES DE SELECTIVIDAD BLOQUE IV GENÉTICA MENDELISMO 1. En relación con las aportaciones de Mendel al estudio de la herencia: a) Explique brevemente el tipo de herencia de una enfermedad hereditaria
DISCAPACIDADES DE ETIOLOGIA GENETICA: PROYECCIONES DE ATENCION INTEGRAL. Prof. Dra. Aracely Lantigua Cruz CUBA 2004
 DISCAPACIDADES DE ETIOLOGIA GENETICA: PROYECCIONES DE ATENCION INTEGRAL Prof. Dra. Aracely Lantigua Cruz CUBA 2004 GENOMA HUMANO 30 000 A 50 000 GENES NUCLEARES Y EL ADN MITOCONDRIAL. MUTACIONES DE ESTOS
DISCAPACIDADES DE ETIOLOGIA GENETICA: PROYECCIONES DE ATENCION INTEGRAL Prof. Dra. Aracely Lantigua Cruz CUBA 2004 GENOMA HUMANO 30 000 A 50 000 GENES NUCLEARES Y EL ADN MITOCONDRIAL. MUTACIONES DE ESTOS
Programa: Beca de Perfeccionamiento en TRASTORNOS DE LA MEMORIA Y LA CONDUCTA
 Programa: Beca de Perfeccionamiento en TRASTORNOS DE LA MEMORIA Y LA CONDUCTA Departamento: Medicina Servicio: Neurología 1) Datos Generales: Nombre del Programa: Beca de Perfeccionamiento en TRASTORNOS
Programa: Beca de Perfeccionamiento en TRASTORNOS DE LA MEMORIA Y LA CONDUCTA Departamento: Medicina Servicio: Neurología 1) Datos Generales: Nombre del Programa: Beca de Perfeccionamiento en TRASTORNOS
3. Fisiopatología y factores de riesgo de las demencias
 3. Fisiopatología y factores de riesgo de las demencias Preguntas para responder: 3.1. Cuáles son los mecanismos fisiopatológicos de las demencias degenerativas? 3.2. Cuáles son los mecanismos fisiopatológicos
3. Fisiopatología y factores de riesgo de las demencias Preguntas para responder: 3.1. Cuáles son los mecanismos fisiopatológicos de las demencias degenerativas? 3.2. Cuáles son los mecanismos fisiopatológicos
Tabla 1. Clasificación de las demencias basadas en la ocurrencia corticales o subcorticales.
 i Lista de Tablas Tabla 1. Clasificación de las demencias basadas en la ocurrencia corticales o subcorticales. de disfunciones 7 Tabla 2. Clasificación de las demencias en tratables, parcialmente tratables
i Lista de Tablas Tabla 1. Clasificación de las demencias basadas en la ocurrencia corticales o subcorticales. de disfunciones 7 Tabla 2. Clasificación de las demencias en tratables, parcialmente tratables
TEMA 2 LA INFORMACIÓN GENÉTICA COLEGIO LEONARDO DA VINCI BIOLOGÍA Y GEOLOGÍA 4º ESO CURSO 2014/15
 TEMA 2 LA INFORMACIÓN GENÉTICA COLEGIO LEONARDO DA VINCI BIOLOGÍA Y GEOLOGÍA 4º ESO CURSO 2014/15 OBJETIVOS DEL TEMA * Ácidos nucleicos. Composición. Estructura. Tipos. Funciones. * Procesos del dogma
TEMA 2 LA INFORMACIÓN GENÉTICA COLEGIO LEONARDO DA VINCI BIOLOGÍA Y GEOLOGÍA 4º ESO CURSO 2014/15 OBJETIVOS DEL TEMA * Ácidos nucleicos. Composición. Estructura. Tipos. Funciones. * Procesos del dogma
(INJURIA CEREBRAL TRAUMATICA )
 (INJURIA CEREBRAL TRAUMATICA ) Predictores Duración del Coma: mejor predictor en lesiones severas. Escala de coma de Glasgow: aplicada en las primeras 48-72 hs, bueno en lesiones severas pudiendo subestimar
(INJURIA CEREBRAL TRAUMATICA ) Predictores Duración del Coma: mejor predictor en lesiones severas. Escala de coma de Glasgow: aplicada en las primeras 48-72 hs, bueno en lesiones severas pudiendo subestimar
Simposio El papel del patólogo en el tratamiento de los tumores cerebrales
 CUESTIONARIO DE AUTOEVALUACIÓN Simposio El papel del patólogo en el tratamiento de los tumores cerebrales Madrid, 4 de febrero de 2010 1. El análisis del 1p y 19q está indicado actualmente para el manejo
CUESTIONARIO DE AUTOEVALUACIÓN Simposio El papel del patólogo en el tratamiento de los tumores cerebrales Madrid, 4 de febrero de 2010 1. El análisis del 1p y 19q está indicado actualmente para el manejo
ESTIMULACIÓN MÚLTIPLE TEMPRANA. Dra. Carmen Montserrat Gómez Juárez R4 Medicina de Rehabilitación
 ESTIMULACIÓN MÚLTIPLE TEMPRANA Dra. Carmen Montserrat Gómez Juárez R4 Medicina de Rehabilitación Con los avances en la atención del recién nacido se ha logrado una tasa creciente de supervivencia entre
ESTIMULACIÓN MÚLTIPLE TEMPRANA Dra. Carmen Montserrat Gómez Juárez R4 Medicina de Rehabilitación Con los avances en la atención del recién nacido se ha logrado una tasa creciente de supervivencia entre
INTEGRACIÓN DEL CARIOTIPO MOLECULAR EN MEDICINA FETAL. INDICACIONES E INTERPRETACIÓN. Complejo Hospitalario Universitario de Badaj
 INTEGRACIÓN DEL CARIOTIPO MOLECULAR EN MEDICINA FETAL. INDICACIONES E INTERPRETACIÓN. Complejo Hospitalario Universitario de Badaj QUE ES? Cariotipo Molecular El micro-array cromosómico de CGH es una técnica
INTEGRACIÓN DEL CARIOTIPO MOLECULAR EN MEDICINA FETAL. INDICACIONES E INTERPRETACIÓN. Complejo Hospitalario Universitario de Badaj QUE ES? Cariotipo Molecular El micro-array cromosómico de CGH es una técnica
complejo polisacárido membrana plasmática palmitato
 Gen RHD Proteina RhD Gen RHCE Proteina RhCcEe RHCED (RH30) y RHAG (RH50) RH30 y RH50 son proteínas integrales de membrana que muestran una topología similar al atravesar 12 veces la membrana. RH30 contiene
Gen RHD Proteina RhD Gen RHCE Proteina RhCcEe RHCED (RH30) y RHAG (RH50) RH30 y RH50 son proteínas integrales de membrana que muestran una topología similar al atravesar 12 veces la membrana. RH30 contiene
DÉFICIT O DETERIORO. Núria Pujol
 DÉFICIT O DETERIORO Núria Pujol Hospital Clínic i Provincial de Barcelona, Bilbao, Junio 2008 SUMARIO Modelos teóricos: -Hipótesis del neurodesarrollo vs. hipótesis de la neurodegeneración Características
DÉFICIT O DETERIORO Núria Pujol Hospital Clínic i Provincial de Barcelona, Bilbao, Junio 2008 SUMARIO Modelos teóricos: -Hipótesis del neurodesarrollo vs. hipótesis de la neurodegeneración Características
ADN: de la doble hélice al cromosoma
 Citogenética ADN: de la doble hélice al cromosoma Teoría cromosómica de la herencia Los genes están situados en los cromosomas La ordenación sobre los mismos es lineal Al proceso de recombinación genética,
Citogenética ADN: de la doble hélice al cromosoma Teoría cromosómica de la herencia Los genes están situados en los cromosomas La ordenación sobre los mismos es lineal Al proceso de recombinación genética,
SISTEMA NERVIOSO. Integración rápida
 SISTEMA NERVIOSO Integración rápida Conceptos fundamentales Irritabilidad Estímulo Respuesta Irritabilidad: capacidad para detectar y responder a los estímulos o cambios del medio externo e interno. Estímulo:
SISTEMA NERVIOSO Integración rápida Conceptos fundamentales Irritabilidad Estímulo Respuesta Irritabilidad: capacidad para detectar y responder a los estímulos o cambios del medio externo e interno. Estímulo:
Madrid, 10 de Marzo de 2009
 Comisión Nacional del Mercado de Valores Att. Sr. D. Rodrigo Buenaventura Paseo de la Castellana nº 19 28046 Madrid Madrid, 10 de Marzo de 2009 Muy Sres. Nuestros: Por la presente nos es grato enviarle,
Comisión Nacional del Mercado de Valores Att. Sr. D. Rodrigo Buenaventura Paseo de la Castellana nº 19 28046 Madrid Madrid, 10 de Marzo de 2009 Muy Sres. Nuestros: Por la presente nos es grato enviarle,
Dra. Graciela Falco Octubre 2011
 Dra. Graciela Falco Octubre 2011 RÁPIDAMENTE PROGRESIVA Y UNIFORMEMENTE FATAL ES UNA ENCEFALOPATÍA ESPONGIFORME DEBIDA A LA ACUMULACIÓN DE UNA PROTEÍNA PRIÓNICAS EN EL CEREBRO ESPORÁDICA es el 84% FAMILIAR
Dra. Graciela Falco Octubre 2011 RÁPIDAMENTE PROGRESIVA Y UNIFORMEMENTE FATAL ES UNA ENCEFALOPATÍA ESPONGIFORME DEBIDA A LA ACUMULACIÓN DE UNA PROTEÍNA PRIÓNICAS EN EL CEREBRO ESPORÁDICA es el 84% FAMILIAR
NEUROPATOLOGIA DE LA (S) ESCLEROSIS MULTIPLE ESCLEROSIS MULTIPLE
 NEUROPATOLOGIA DE LA (S) ESCLEROSIS MULTIPLE ESCLEROSIS MULTIPLE Profesor Juan J Zarranz Catedrático y Jefe del Servicio de Neurología Hospital de Cruces Universidad del País Vasco RELATIVISMO DE LA CIENCIA
NEUROPATOLOGIA DE LA (S) ESCLEROSIS MULTIPLE ESCLEROSIS MULTIPLE Profesor Juan J Zarranz Catedrático y Jefe del Servicio de Neurología Hospital de Cruces Universidad del País Vasco RELATIVISMO DE LA CIENCIA
COMPETENCIAS DEL MÁSTER EN INVESTIGACIÓN BIOMÉDICA POR LA UNIVERSIDAD DE NAVARRA
 COMPETENCIAS DEL MÁSTER EN INVESTIGACIÓN BIOMÉDICA POR LA UNIVERSIDAD DE NAVARRA Competencias generales del Máster en Investigación Biomédica por la Universidad de Navarra CG1: Abordar un reto biomédico
COMPETENCIAS DEL MÁSTER EN INVESTIGACIÓN BIOMÉDICA POR LA UNIVERSIDAD DE NAVARRA Competencias generales del Máster en Investigación Biomédica por la Universidad de Navarra CG1: Abordar un reto biomédico
Proyecto MapEA: Mapa de recursos para enfermos de demencia/alzheimer en Madrid.
 Proyecto MapEA: Mapa de recursos para enfermos de demencia/alzheimer en Madrid. Herramientas de planificación y organización La Comunidad de Madrid ha desarrollado planes específicos de demencias y cuenta
Proyecto MapEA: Mapa de recursos para enfermos de demencia/alzheimer en Madrid. Herramientas de planificación y organización La Comunidad de Madrid ha desarrollado planes específicos de demencias y cuenta
La síntesis de proteínas
 La síntesis de proteínas La Transcripción La información para fabricar todas las proteínas está almacenada en las moléculas de ADN de los cromosomas. La sucesión de bases en las moléculas de ADN es un
La síntesis de proteínas La Transcripción La información para fabricar todas las proteínas está almacenada en las moléculas de ADN de los cromosomas. La sucesión de bases en las moléculas de ADN es un
LIGAMIENTO Y MAPEO GENICO
 LIGAMIENTO Y MAPEO GENICO Ms. MARIA CRUZ BRICEÑO AREA DE GENETICA Y BIOLOGÍA CELULAR DEPARTAMENTO DE MORFOLOGIA HUMANA LIGAMIENTO GENICO En el ligamiento, se cumple el principio de segregación independiente?
LIGAMIENTO Y MAPEO GENICO Ms. MARIA CRUZ BRICEÑO AREA DE GENETICA Y BIOLOGÍA CELULAR DEPARTAMENTO DE MORFOLOGIA HUMANA LIGAMIENTO GENICO En el ligamiento, se cumple el principio de segregación independiente?
Qué es la discalculia?
 Qué es la discalculia? La discalculia o dificultad específica para el aprendizaje de las matemáticas, es un trastorno que condiciona que niños con una inteligencia y escolarización normales tengan dificultades
Qué es la discalculia? La discalculia o dificultad específica para el aprendizaje de las matemáticas, es un trastorno que condiciona que niños con una inteligencia y escolarización normales tengan dificultades
