GUIA PARA LA ELABORACION DEL PETITORIO NACIONAL ÚNICO DE DISPOSITIVOS MÉDICOS ESENCIALES PARA EL SECTOR SALUD
|
|
|
- Raúl Contreras Vargas
- hace 5 años
- Vistas:
Transcripción
1 GUIA PARA LA ELABORACION DEL PETITORIO NACIONAL ÚNICO DE DISPOSITIVOS MÉDICOS ESENCIALES PARA EL SECTOR SALUD INTRODUCCIÓN La Organización Mundial de la Salud (OMS) ha reconocido la importancia de las tecnologías sanitarias, y en particular de los dispositivos médicos, para prevenir, diagnosticar y tratar dolencias, enfermedades y discapacidades y mejorar la salud y la calidad de vida, instando a los Estados Miembros a que formulen estrategias y planes nacionales adecuados para la evaluación y gestión de los dispositivos médicos, conformándose para ello dos grupos de trabajo: La Global Harmonization Task Force (GHTF), actualmente denominada International Medical Device Regulators Fórum (MDRF), y el Asian Harmonization Working Party (AHWP o Equipo de trabajo asiático de armonización) 1. El 2007, la 60ª Asamblea Mundial de la Salud manifestó su preocupación por el despilfarro de recursos que suponen las inversiones inadecuadas en tecnologías sanitarias; en particular, en dispositivos médicos que no responden a las necesidades más prioritarias, aprobando la resolución WHA60.29 que reconoce la necesidad de contener la escalada de costos, definiendo para ello un orden de prioridad en la selección y adquisición de tecnologías sanitarias, en base a su impacto sobre la carga de la enfermedad, así como asegurar un uso eficaz de los recursos mediante procesos adecuados de planificación, evaluación, adquisición y gestión 2. La Ley considera a la accesibilidad como uno de sus principios básicos, determinando que la salud es considerada un derecho fundamental de las personas; asimismo, señala que el acceso al cuidado de la salud incluye el acceso a productos farmacéuticos y dispositivos médicos esenciales; y constituye un requisito para lograr este derecho tener el producto disponible y asequible en el lugar y momento en que sea requerido. Es por ello que a fin de mejorar el acceso de la población a los dispositivos médicos esenciales para la prevención, diagnóstico, tratamiento y el control de las enfermedades prevalentes en el país, la Dirección General de Medicamentos, Insumos y Drogas ha priorizado la elaboración del Petitorio Nacional Único de Dispositivos Médicos Esenciales (PNUDME), en concordancia con lo establecido en la Ley y en el Reglamento de Organización y Funciones del Ministerio de Salud 5. OBJETIVO: Establecer el procedimiento para la elaboración del Petitorio Nacional Único de Dispositivos Médicos Esenciales en los establecimientos de salud del sector público a nivel nacional, según el nivel de uso. CONSIDERACIONES GENERALES La Organización Mundial de la Salud (OMS) en su proyecto sobre Dispositivos Médicos Prioritarios 6 explora el ámbito de los dispositivos médicos analizando dos aspectos fundamentales para la selección de los dispositivos médicos: 1) los dispositivos médicos y 2) la determinación de las necesidades de salud pública y el establecimiento de prioridades, señalando que para comprender los problemas planteados, toman de referencia el programa de medicamentos prioritarios, ya que los conceptos que determinan el acceso a los medicamentos esenciales ya se conocen bien y pueden aplicarse también a la cuestión de los dispositivos médicos idóneos. Por lo que en la selección de dispositivos médicos basados en criterios de salud, propone un método progresivo que considera tres pasos importantes: El primer paso: es la detección de los problemas de salud más importantes. (Estimaciones de la carga de morbilidad o las estimaciones de los factores de riesgo de las enfermedades). El objetivo de este 1 WHO Health Organization Geneva. Medical Device Regulations. Global overview and guiding principles Disponible: int/medical_devices/publications/en/md_regulations.pdf 2 Resolución de la AMS. Tecnologías sanitarias. En: Sexagésima Asamblea Mundial de la Salud, Ginebra, de mayo de Ginebra, Organización Mundial de la Salud, 2007 (WHA60.29 A60/VR/11). 3 Ley Ley de los Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios Ley Ley de los Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios Decreto Supremo N SA. Reglamento de Organización y Funciones del Ministerio de Salud. Art OMS. DISPOSITIVOS MEDICOS: La Gestión de la Discordancia. Resultado Del Proyecto Sobre Dispositivos Médicos Prioritarios. Las Necesidades De Salud Pública. 2012
2 paso inicial es buscar información sobre las enfermedades o discapacidades que tienen máxima prioridad en términos de las necesidades de salud pública; seleccionar directrices clínicas basadas en datos contrastados para el tratamiento de las enfermedades; determinar protocolos y esquemas de actuación sanitaria; y evaluar los recursos disponibles. El segundo paso: consiste en determinar la mejor forma de gestionar los problemas de salud. Las directrices clínicas son una fuente de información obvia para la toma de decisiones clínicas. Sin embargo, las directrices proporcionan escasa información sobre los dispositivos que deberían utilizarse para un determinado procedimiento. Los protocolos y esquemas de actuación sanitaria normalizados pueden servir para determinar qué dispositivos médicos se necesitan para el tratamiento de una enfermedad. El tercer paso es relacionar los resultados de los dos primeros pasos y elaborar una lista de los dispositivos médicos necesarios para el tratamiento de las enfermedades con morbilidad alta identificadas, en un nivel de asistencia sanitaria específico y un contexto determinado. En nuestro país, de acuerdo a la normatividad vigente se define como Dispositivo Médico 7 a cualquier instrumento, aparato, implemento, máquina, dispositivo, reactivo o calibrador in vitro, aplicativo informático, material u otro artículo similar o relacionado, previsto por el fabricante para ser empleado en seres humanos, solo o en combinación, para uno o más de los siguientes propósitos específicos: a) Diagnóstico, prevención, monitoreo y tratamiento o alivio de una enfermedad; b) Diagnóstico, monitoreo, tratamiento, alivio o compensacion de una lesion; c) Investigación, reemplazo, modificación o soporte de la anatomia o de un proceso fisiologico; d) Soporte o mantenimiento de la vida; e) Control de la concepción; y f) Desinfección de dispositivos médicos. Por otro lado, de acuerdo a la función y la finalidad del uso del Dispositivo Médico, la Dirección General de Medicamentos, Insumos y Drogas considera los siguientes tipos de Dispositivos Médicos 8 : Material o Insumo Médico: Sustancia, artículo o material empleado para el diagnóstico, tratamiento o prevención de enfermedades que para su uso no requieren de fuentes de energía. Instrumental Médico: Instrumento destinado al uso quirúrgico, para cortar, horadar, aserrar, raspar, legrar, sujetar, retirar, inmovilizar sin ninguna conexión con otro dispositivo médico activo. Equipo Biomédico: Dispositivo médico operacional y funcional que reúne sistemas y subsistemas eléctricos, electrónicos e hidráulicos y/o híbridos, que para uso requieren una fuente de energía; incluidos los programas informáticos que intervengan en su buen funcionamiento. Dispositivo Médico de Diagnóstico in Vitro: Productos destinados por el fabricante para el examen de muestras derivadas del cuerpo humano, usados solos o en combinación para el examen in vitro de muestras fundamentalmente para: Proveer información sobre un estado fisiológico o patológico o anomalía congénita. Monitorear o determinar la seguridad y compatibilidad con un receptor potencial. Supervisión de las medidas terapéuticas aplicadas. En este sentido, la propuesta de elaboración del PNUDME, tendrá como criterios la necesidad así como el estar considerados en Guías de Práctica Clínica o Protocolos. Para este proceso de elaboración del Petitorio Nacional Único de Dispositivos Médicos Esenciales solo serán considerados los materiales e insumos médicos y los dispositivos médicos de diagnóstico in vitro. Los establecimientos de salud del sector público a nivel nacional podrán formular sus propuestas de inclusión de dispositivos médicos al PNUDME, de acuerdo al Anexo N 01, a través de la Jefatura del Departamento/Servicio de Farmacia/Coordinadores Técnicos de las Estrategias Sanitarias Nacionales/Intervenciones Sanitarias respectivas a nivel nacional, quienes deberán presentar su declaración de conflicto de intereses de acuerdo al Anexo N 02. La Jefatura de los Departamentos/Servicios de Farmacia de los establecimientos de salud del sector público deberán revisar y evaluar las propuestas de solicitudes de inclusión de dispositivos médicos presentadas 7 Ley Ley de los Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios. Capítulo 2. Art 4. Definiciones. Disponible: 8 Dirección General de Medicamentos, Insumos y Drogas. Dirección de Dispositivos Médicos y Productos Sanitarios. Definición de Dispositivos Médicos. Disponible
3 por sus entidades de acuerdo al Anexo N 01; y remitir las solicitudes de inclusión de los dispositivos médicos aprobadas adjuntando el Anexo N 01 a la Dirección General de Medicamentos, Insumos y Drogas (DIGEMID), así como la declaración de conflicto de intereses correspondiente (Anexo N 02). La Jefatura de Departamento/Servicio de Farmacia de los establecimientos de salud a nivel nacional tendrán la responsabilidad de organizarse para revisar, evaluar, procesar y remitir las solicitudes de inclusión de dispositivos médicos aprobadas adjuntado el Anexo N 01 a la Dirección General de Medicamentos, Insumos y Drogas (DIGEMID) para su revisión y evaluación. Las solicitudes de inclusión de dispositivos médicos que no cumplan con la información requerida serán desestimadas y no serán consideradas en el envío a la Dirección General de Medicamentos, Insumos y Drogas (DIGEMID). En el caso de los Coordinadores Técnicos de las Estrategias Sanitarias Nacionales/Intervenciones Sanitarias respectivas a nivel nacional del Ministerio de Salud remitirán sus propuestas a la Dirección General de Medicamentos, Insumos y Drogas (DIGEMID) de acuerdo al Anexo N 01, así como la declaración de conflicto de intereses del Coordinador Técnico (Anexo N 02). Las solicitudes de inclusión de dispositivos médicos que no cumplan con la información requerida serán desestimadas y no serán consideradas para su revisión y evaluación correspondiente. El Centro Nacional de Documentación e Información de Medicamentos (CENADIM) de la Dirección General de Medicamentos, Insumos y Drogas (DIGEMID), podrá facilitar la mejor evidencia disponible requerida para la toma de decisiones durante el proceso de elaboración del PNUDME (correo electrónico: cenadim@digemid.minsa.gob.pe). La Dirección General de Medicamentos, Insumos y Drogas (DIGEMID) recepcionará las propuestas hasta el día 30 de Abril del CONSIDERACIONES ESPECÍFICAS Para la inclusión de dispositivos médicos en el PNUDME se deberá tener en cuenta: Necesidad (de acuerdo a los perfiles de morbi-mortalidad, características poblacionales y de los servicios de salud). Efectividad y seguridad comprobadas. Evaluación comparativa del beneficio en relación al costo de las alternativas disponibles para cada necesidad. No inclusión de dispositivos médicos que incorporen un ingrediente farmacéutico activo. Empleo de la denominación genérica. Disponibilidad en el mercado nacional, conveniencia de uso, entre otras.
4 ANEXO N 01 SOLICITUD PARA LA INCLUSIÓN DE DISPOSITIVOS MÉDICOS EN EL PETITORIO NACIONAL UNICO DE DISPOSITIVOS MÉDICOS ESENCIALES PARA EL SECTOR SALUD I. DEPENDENCIA: DISA/DIRESA/GERESA/Equivalente (..) HOSPITAL/POLICLINICO/CLINICA/Equivalente (..) INSTITUTO ESPECIALIZADO (..) OTROS (..) ESTRATEGIA SANITARIA NACIONAL/INTERVENCION SANITARIA (..) NOMBRE:... DISA/IGSS/DIRESA/GERESA/Equivalente a la que corresponde (cuando se trate de hospitales):... II. TIPO DE DISPOSITIVO MEDICO SOLICITADO: Material ó Insumo Medico Diagnóstico in Vitro Denominación Genérica o Nombre Común del Producto 1 Unidad de Medida 2 Código de identificación 3 Clasificación de acuerdo al riesgo 4 Efectividad dependiente Duración de 5 Costo6 del operador Tratamiento 7 III. INDICACIONES 8 A. B. C. IV. OTRAS: 1. Adherencia al tratamiento, facilidad de uso, etc. (Especificar): 2. Disponibilidad (o mayor disponibilidad) del producto en el mercado nacional... V. RESTRICCIÓN DE USO PARA EL DISPOSITIVO MÉDICO PROPUESTO: No (..) Si (..) Especificar:
5 VI. COMENTARIOS DE LA JEFATURA DEL DEPARTAMENTO/SERVICIO DE FARMACIA/COORDINADOR TÉCNICO Firma Departamento/Servicio de Farmacia/Coordinador Técnico Nombre Nº Registro Colegio Profesional (1) En el caso de una asociación (dispositivo medicamento), consignar el principio activo. (2) Señalar la unidad estándar del dispositivo médico. (ejemplo: caja, mililitros, unidad, kit, etc.). (3) Actualmente se emplean en todo el mundo varios nomenclaturas diferentes, como la Global Medical Device Nomenclature (GMDN, nomenclatura mundial de dispositivos médicos), el Universal Medical Device Nomenclature System (UMDNS, sistema universal de nomenclatura de dispositivos médicos), la norma ISO 9999 (un sistema de clasificación de productos de apoyo empleados por personas con discapacidades) y el sistema armonizado de la Organización Mundial de Aduanas. (4) Ley Ley de los Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios. Capítulo 2. Art 4. Definiciones. Clasifica a los Dispositivos médicos por riesgo: Clase 1 (de Bajo riesgo), Clase 2 (de moderado riesgo), Clase 3 (de alto riesgo), Clase 4 (críticos en materia de riesgo). (5) Efectividad asociada a la habilidad del operador, puede ser: alta, media o baja. (6) Considerar el precio actual de venta al público (7) En los procesos que requieren de un tratamiento de largo plazo colocar el término crónico (8) Detallar la situación clínica específica y/o consideración especial para su uso, de acuerdo con el motivo. De ser pertinente considerar el grado de severidad o estadio clínico. Nota: De ser necesario incluir mayor información, utilizar hoja adicional. A fin que la Dirección General de Medicamentos, Insumos y Drogas (DIGEMID) pueda evaluar la solicitud, ésta debe presentarse con toda la información requerida en el presente formato.
6 ANEXO N 02 DECLARACIÓN DE CONFLICTO DE INTERESES 9 Nombre: Cargo: Institución: Tiene usted o sus familiares por matrimonio, por parentesco hasta el 4 grado de consanguinidad o hasta el 2 grado de afinidad, algún interés financiero o de otro tipo, en cualquier fabricante o proveedor de dispositivos médicos que pueda constituir un conflicto de intereses, ya sean reales, potenciales o aparentes? Señale por favor la respuesta pertinente: ( ) Sí ( ) No Ha trabajado en los últimos cuatro años o ha tenido algún otro tipo de relación profesional con alguna organización que sea fabricante o proveedor de dispositivos médicos o que represente a este tipo de organizaciones? Señale por favor la respuesta pertinente: ( ) Sí ( ) No Existe alguna otra circunstancia que pueda afectar, o que pueda percibirse que afecta a su objetividad o independencia en el desempeño de sus funciones en la Jefatura del Departamento/Servicio de Farmacia/Coordinador Técnico? Declaro por la presente que la información proporcionada es cierta y que no tengo conocimiento de ninguna otra circunstancia que constituya un conflicto de intereses, ya sea efectivo, potencial o aparente. Me comprometo a informar de cualquier cambio a las anteriores circunstancias. Firma: Fecha: 9 Ministerio de Sanidad y Consumo. Elaboración de Guías de Práctica Clínica en el Sistema Nacional de Salud. Manual Metodológico. España En las relaciones de los profesionales con la Industria Farmacéutica o Tecnología Sanitaria, se considera conflicto de interés: recibir apoyo para acudir a reuniones y congresos (inscripciones, becas de viaje, otros); cobrar honorarios como ponente en una reunión organizada por la Industria; recibir financiación de programas educativos o actividades de formación; recibir apoyo y financiación para una investigación; estar empleado como consultor para una compañía farmacéutica; ser accionista o tener intereses económicos en una compañía farmacéutica (adecuado).
SECOND WHO GLOBAL FORUM ON MEDICAL DEVICES
 PERU LATINO AMERICA PERÚ CAMINO A LA ARMONIZACIÓN EN EL TEMA DE DISPOSITIVOS MÉDICOS MOVING TOWARDS HARMONIZATION OF MEDICAL DEVICES IN PERU SECOND WHO GLOBAL FORUM ON MEDICAL DEVICES http://www.digemid.minsa.gob.pe
PERU LATINO AMERICA PERÚ CAMINO A LA ARMONIZACIÓN EN EL TEMA DE DISPOSITIVOS MÉDICOS MOVING TOWARDS HARMONIZATION OF MEDICAL DEVICES IN PERU SECOND WHO GLOBAL FORUM ON MEDICAL DEVICES http://www.digemid.minsa.gob.pe
GUÍA PARA LA ACTUALIZACIÓN DEL PETITORIO NACIONAL ÚNICO DE MEDICAMENTOS ESENCIALES
 GUÍA PARA LA ACTUALIZACIÓN DEL PETITORIO NACIONAL ÚNICO DE MEDICAMENTOS ESENCIALES INTRODUCCIÓN El Petitorio Nacional Único de Medicamentos Esenciales (PNUME) es un valioso instrumento para promover la
GUÍA PARA LA ACTUALIZACIÓN DEL PETITORIO NACIONAL ÚNICO DE MEDICAMENTOS ESENCIALES INTRODUCCIÓN El Petitorio Nacional Único de Medicamentos Esenciales (PNUME) es un valioso instrumento para promover la
GUÍA PARA LA ELABORACIÓN DE LAS LISTAS COMPLEMENTARIAS AL PETITORIO NACIONAL ÚNICO DE MEDICAMENTOS ESENCIALES
 GUÍA PARA LA ELABORACIÓN DE LAS LISTAS COMPLEMENTARIAS AL PETITORIO NACIONAL ÚNICO DE MEDICAMENTOS ESENCIALES INTRODUCCIÓN El Petitorio Nacional Único de Medicamentos Esenciales (PNUME) es un valioso instrumento
GUÍA PARA LA ELABORACIÓN DE LAS LISTAS COMPLEMENTARIAS AL PETITORIO NACIONAL ÚNICO DE MEDICAMENTOS ESENCIALES INTRODUCCIÓN El Petitorio Nacional Único de Medicamentos Esenciales (PNUME) es un valioso instrumento
ORIENTACIÓN GENERAL SOBRE AUTORIZACIÓN EXCEPCIONAL DE DISPOSITIVOSMÉDICOS
 ORIENTACIÓN GENERAL SOBRE AUTORIZACIÓN EXCEPCIONAL DE DISPOSITIVOSMÉDICOS Q.F. VILMA ROSA MAIHUIRE SERRANO Unidad Funcional de Dispositivos Médicos-UFDM DDMP Base legal para solicitar Autorización Excepcional
ORIENTACIÓN GENERAL SOBRE AUTORIZACIÓN EXCEPCIONAL DE DISPOSITIVOSMÉDICOS Q.F. VILMA ROSA MAIHUIRE SERRANO Unidad Funcional de Dispositivos Médicos-UFDM DDMP Base legal para solicitar Autorización Excepcional
ASPECTOS DE INTERÉS SOBRE LOS PRODUCTOS SANITARIOS DE AUTODIAGNÓSTICO
 ASPECTOS DE INTERÉS SOBRE LOS PRODUCTOS SANITARIOS DE AUTODIAGNÓSTICO Introducción El Real Decreto 1662/2000, de 29 de diciembre, que transpone la directiva 98/79/CE, de 27 de octubre de 1998 es la normativa
ASPECTOS DE INTERÉS SOBRE LOS PRODUCTOS SANITARIOS DE AUTODIAGNÓSTICO Introducción El Real Decreto 1662/2000, de 29 de diciembre, que transpone la directiva 98/79/CE, de 27 de octubre de 1998 es la normativa
Q.F. Lida Esther Hildebrandt Pinedo.
 Q.F. Lida Esther Hildebrandt Pinedo lhildebrandtp@digemid.minsa.gob.pe www.digemid.minsa.gob.pe ORGANIGRAMA DE LA DIGEMID DIRECCIÓN GENERAL EQUIPO DE ASESORIA EQUIPO GESTION ADMINISTRATIVA GESTION DE LA
Q.F. Lida Esther Hildebrandt Pinedo lhildebrandtp@digemid.minsa.gob.pe www.digemid.minsa.gob.pe ORGANIGRAMA DE LA DIGEMID DIRECCIÓN GENERAL EQUIPO DE ASESORIA EQUIPO GESTION ADMINISTRATIVA GESTION DE LA
ADQUISICIÓN DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS
 Página 1 de 10 Página 2 de 10 1. OBJETIVO Describir el proceso de Adquisición de insumos medico quirúrgicos, dispositivos médicos y medicamentos, requeridos para la prestación de cada uno de los servicios
Página 1 de 10 Página 2 de 10 1. OBJETIVO Describir el proceso de Adquisición de insumos medico quirúrgicos, dispositivos médicos y medicamentos, requeridos para la prestación de cada uno de los servicios
12. PROCEDIMIENTO PARA ELABORAR GUÍAS TECNOLÓGICAS DE CUIDADOS
 Hoja: 1 de 8 12. PROCEDIMIENTO PARA ELABORAR GUÍAS TECNOLÓGICAS DE CUIDADOS INTENSIVOS Y QUIRÓFANO. Hoja: 2 de 8 1.0 Propósito Describir el procedimiento que se sigue para desarrollar guías tecnológicas
Hoja: 1 de 8 12. PROCEDIMIENTO PARA ELABORAR GUÍAS TECNOLÓGICAS DE CUIDADOS INTENSIVOS Y QUIRÓFANO. Hoja: 2 de 8 1.0 Propósito Describir el procedimiento que se sigue para desarrollar guías tecnológicas
GESTION DE LA TECNOVIGILANCIA EN LOS CENTROS DE REFERENCIA REGIONAL Y EN LOS ESTABLECIEMINTOS DE SALUD ANIVEL NACIONAL QF. ZHENIA SOLIS TARAZONA
 GESTION DE LA TECNOVIGILANCIA EN LOS CENTROS DE REFERENCIA REGIONAL Y EN LOS ESTABLECIEMINTOS DE SALUD ANIVEL NACIONAL QF. ZHENIA SOLIS TARAZONA TECNOVIGILANCIA Conjunto de procedimientos encaminados a
GESTION DE LA TECNOVIGILANCIA EN LOS CENTROS DE REFERENCIA REGIONAL Y EN LOS ESTABLECIEMINTOS DE SALUD ANIVEL NACIONAL QF. ZHENIA SOLIS TARAZONA TECNOVIGILANCIA Conjunto de procedimientos encaminados a
Presentado por: Jhon Ederson Niño Botero
 Presentado por: Jhon Ederson Niño Botero Organizaciones a nivel mundial encargadas de la vigilancia de los dispositivos médicos. Estados Unidos Brasil Francia Normatividad Resolución 1043 del 2006 Decreto
Presentado por: Jhon Ederson Niño Botero Organizaciones a nivel mundial encargadas de la vigilancia de los dispositivos médicos. Estados Unidos Brasil Francia Normatividad Resolución 1043 del 2006 Decreto
Marco normativo para el desarrollo de la Farmacovigilancia en Colombia. Shirley Chapetón Montes Coordinadora Grupo Apoyo Jurídico Institucional
 Marco normativo para el desarrollo de la Farmacovigilancia en Colombia Shirley Chapetón Montes Coordinadora Grupo Apoyo Jurídico Institucional CONTENIDO Conceptos Básicos Normatividad Guía de farmacovigilancia
Marco normativo para el desarrollo de la Farmacovigilancia en Colombia Shirley Chapetón Montes Coordinadora Grupo Apoyo Jurídico Institucional CONTENIDO Conceptos Básicos Normatividad Guía de farmacovigilancia
Dirección de Planeación y Evaluación 1
 Tabla de Contenido 1. OBJETIVO... 2 2. ALCANCE... 2 3. NORMATIVIDAD... 2 3.1. Directrices... 2 3.2. Lineamientos... 2 4. DEFINICIONES... 2 5. DIAGRAMA DE FLUJO Y DESCRIPCIÓN DE ACTIVIDADES... 3 Diagrama
Tabla de Contenido 1. OBJETIVO... 2 2. ALCANCE... 2 3. NORMATIVIDAD... 2 3.1. Directrices... 2 3.2. Lineamientos... 2 4. DEFINICIONES... 2 5. DIAGRAMA DE FLUJO Y DESCRIPCIÓN DE ACTIVIDADES... 3 Diagrama
Regulación de Dispositivos Médicos y proyecciones para reactivos de diagnóstico in vitro
 Regulación de Dispositivos Médicos y proyecciones para reactivos de diagnóstico in vitro BQ. María Graciela Rojas Donoso Jefa del Subdepartamento Dispositivos Médicos Agencia Nacional de Medicamentos mrojas@ispch.cl
Regulación de Dispositivos Médicos y proyecciones para reactivos de diagnóstico in vitro BQ. María Graciela Rojas Donoso Jefa del Subdepartamento Dispositivos Médicos Agencia Nacional de Medicamentos mrojas@ispch.cl
SELECCIÓN DE MEDICAMENTOS EN EL MARCO DEL SUMINISTRO PUBLICO
 Dirección General de Medicamentos, Insumos y Drogas SELECCIÓN DE MEDICAMENTOS EN EL MARCO DEL SUMINISTRO PUBLICO EQUIPO DE SELECCIÓN Y EVALUACION DE MEDICAMENTOS Y OTRAS TECNOLOGIAS SANITARIAS Dirección
Dirección General de Medicamentos, Insumos y Drogas SELECCIÓN DE MEDICAMENTOS EN EL MARCO DEL SUMINISTRO PUBLICO EQUIPO DE SELECCIÓN Y EVALUACION DE MEDICAMENTOS Y OTRAS TECNOLOGIAS SANITARIAS Dirección
II Congreso Nacional de Administración en Salud. Medellín 5, 6 y 7 de octubre de 2016.
 . Medellín ANÁLISIS DE MÉTODOS PARA EVIDENCIAR LA SEGURIDAD Y EL DESEMPEÑO DE DISPOSITIVOS MÉDICOS IMPLANTABLES NO ACTIVOS USADOS EN LA ESPECIALIDAD DE ORTOPEDIA EN COLOMBIA Ponente: Liliana Zuluaga Idárraga
. Medellín ANÁLISIS DE MÉTODOS PARA EVIDENCIAR LA SEGURIDAD Y EL DESEMPEÑO DE DISPOSITIVOS MÉDICOS IMPLANTABLES NO ACTIVOS USADOS EN LA ESPECIALIDAD DE ORTOPEDIA EN COLOMBIA Ponente: Liliana Zuluaga Idárraga
Materiales o Insumos. Instrumentales Insumos. Reactivos de Diagnóstico in vitro. Equipos Biomédicos. 1 P á g i n a
 DIRECCIÓN DE AUTORIZACIONES SANITARIAS EQUIPO DE DISPOSITIVOS MEDICOS - INSTRUCTIVO PARA EL LLENADO DE LOS FORMATOS QUE CONTIENEN EL DETALLE DE CÓDIGOS, MODELOS, ACCESORIOS, COMPONENTES, FORMAS DE PRESENTACIÓN,
DIRECCIÓN DE AUTORIZACIONES SANITARIAS EQUIPO DE DISPOSITIVOS MEDICOS - INSTRUCTIVO PARA EL LLENADO DE LOS FORMATOS QUE CONTIENEN EL DETALLE DE CÓDIGOS, MODELOS, ACCESORIOS, COMPONENTES, FORMAS DE PRESENTACIÓN,
ANEXO 1: GUÍA DE REQUISITOS
 ANEXO 1: GUÍA DE REQUISITOS REQUISITOS PARA LA INSCRIPCIÓN DEL REGISTRO SANITARIO DE Versión [1.0] Diciembre, 2014 CONTENIDO 1. OBJETIVO DEL INSTRUCTIVO... 3 2. INSTRUCCIONES.... 3 2.1. CONSIDERACIONES
ANEXO 1: GUÍA DE REQUISITOS REQUISITOS PARA LA INSCRIPCIÓN DEL REGISTRO SANITARIO DE Versión [1.0] Diciembre, 2014 CONTENIDO 1. OBJETIVO DEL INSTRUCTIVO... 3 2. INSTRUCCIONES.... 3 2.1. CONSIDERACIONES
Dispositivos médicos: regulación
 Dispositivos médicos: regulación Author : Sergio Anguita Lorenzo Categories : General Date : 1 diciembre, 2016 Creo que este será uno de los post más densos en cuanto a conceptos teóricos y legislativos
Dispositivos médicos: regulación Author : Sergio Anguita Lorenzo Categories : General Date : 1 diciembre, 2016 Creo que este será uno de los post más densos en cuanto a conceptos teóricos y legislativos
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE ENFERMEDADES INFECCIOSAS, TROPICALES Y DERMATOLÓGICAS
 MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE ENFERMEDADES INFECCIOSAS, TROPICALES Y DERMATOLÓGICAS MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE ENFERMEDADES INFECCIOSAS Y TROPICALES
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE ENFERMEDADES INFECCIOSAS, TROPICALES Y DERMATOLÓGICAS MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE ENFERMEDADES INFECCIOSAS Y TROPICALES
Adquisiciones de insumos médicos y farmacéuticos en Instituciones Costarricenses.
 Adquisiciones de insumos médicos y farmacéuticos en Instituciones Costarricenses. Diferencias Principios Fines De esta suma aproximadamente un 25% corresponde a la CCSS y al INS (en conjunto) Fuente: Contraloría
Adquisiciones de insumos médicos y farmacéuticos en Instituciones Costarricenses. Diferencias Principios Fines De esta suma aproximadamente un 25% corresponde a la CCSS y al INS (en conjunto) Fuente: Contraloría
REGISTRO SANITARIO DE DISPOSITIVOS MEDICOS
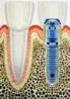 DIRECCIÓN DE AUTORIZACIONES SANITARIAS EQUIPO DE DISPOSITIVOS MEDICOS ----------------- REGISTRO SANITARIO DE DISPOSITIVOS MEDICOS Materiales o Insumos Instrumentales Insumos Equipos Biomédicos iomedicosomedidomat
DIRECCIÓN DE AUTORIZACIONES SANITARIAS EQUIPO DE DISPOSITIVOS MEDICOS ----------------- REGISTRO SANITARIO DE DISPOSITIVOS MEDICOS Materiales o Insumos Instrumentales Insumos Equipos Biomédicos iomedicosomedidomat
EN EL AMBITO DE LAS ACTUACIONES REALIZADAS POR EL ORGANISMO NOTIFICADO 0318
 MODIFICACIÓN DE LA LEY 29/2006, DE 26 DE JULIO, DE GARANTÍAS Y USO RACIONAL DE LOS MEDICAMENTOS Y PRODUCTOS SANITARIOS EN EL AMBITO DE LAS ACTUACIONES REALIZADAS POR EL ORGANISMO NOTIFICADO 0318 Gloria
MODIFICACIÓN DE LA LEY 29/2006, DE 26 DE JULIO, DE GARANTÍAS Y USO RACIONAL DE LOS MEDICAMENTOS Y PRODUCTOS SANITARIOS EN EL AMBITO DE LAS ACTUACIONES REALIZADAS POR EL ORGANISMO NOTIFICADO 0318 Gloria
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE UROLOGÍA APROBADO POR: R.D.Nº SA-HCH/DG
 MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE UROLOGÍA APROBADO POR: R.D.Nº 213-2008-SA-HCH/DG FECHA DE APROBACIÓN: 19-06-2008 1 INDICE CAPITULO I: OBJETIVO
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE UROLOGÍA APROBADO POR: R.D.Nº 213-2008-SA-HCH/DG FECHA DE APROBACIÓN: 19-06-2008 1 INDICE CAPITULO I: OBJETIVO
SELECCIÓN DE MEDICAMENTOS ESENCIALES
 Dirección General de Medicamentos, Insumos y Drogas SELECCIÓN DE MEDICAMENTOS ESENCIALES EQUIPO DE SELECCIÓN Y EVALUACION DE MEDICAMENTOS Y OTRAS TECNOLOGIAS SANITARIAS Dirección General de Medicamentos,
Dirección General de Medicamentos, Insumos y Drogas SELECCIÓN DE MEDICAMENTOS ESENCIALES EQUIPO DE SELECCIÓN Y EVALUACION DE MEDICAMENTOS Y OTRAS TECNOLOGIAS SANITARIAS Dirección General de Medicamentos,
TECNOVIGILANCIA Formato de Reporte de Sospecha Incidente Adverso Modificado QF. ZHENIA SOLIS TARAZONA
 TECNOVIGILANCIA Formato de Reporte de Sospecha Incidente Adverso Modificado QF. ZHENIA SOLIS TARAZONA IDENTIFICACION DEL AFECTADO DATOS DEL DISPOSITIVO MEDICO DATOS DE LA SOSPECHA DEL INCIDENTE ADVERSO
TECNOVIGILANCIA Formato de Reporte de Sospecha Incidente Adverso Modificado QF. ZHENIA SOLIS TARAZONA IDENTIFICACION DEL AFECTADO DATOS DEL DISPOSITIVO MEDICO DATOS DE LA SOSPECHA DEL INCIDENTE ADVERSO
SELECCIÓN DE MEDICAMENTOS Y/O INSUMOS MEDICO- QUIRÚRGICOS
 SELECCIÓN DE MEDICAMENTOS Y/O INSUMOS MEDICO- QUIRÚRGICOS CODIGO: FAR-05-02 VERSION: 0 FECHA: Marzo de 2013 PAGINAS: 5 1. OBJETIVO 1. Asegurar que la Clinica cuente con todos los medicamentos e insumos
SELECCIÓN DE MEDICAMENTOS Y/O INSUMOS MEDICO- QUIRÚRGICOS CODIGO: FAR-05-02 VERSION: 0 FECHA: Marzo de 2013 PAGINAS: 5 1. OBJETIVO 1. Asegurar que la Clinica cuente con todos los medicamentos e insumos
Seguridad de Dispositivos Médicos: Tecnovigilancia
 QFB. LISBETH R. RINCÓN CABRERA Presidente Sección Reactivos y Sistemas de Diagnóstico RSD CANIFARMA IV CONGRESO DE FARMACOVIGILANCIA León Guanajuato, Nov. 26, 2010 OBJETIVO: 1. QUE ES UN DISPOSITIVO MÉDICO
QFB. LISBETH R. RINCÓN CABRERA Presidente Sección Reactivos y Sistemas de Diagnóstico RSD CANIFARMA IV CONGRESO DE FARMACOVIGILANCIA León Guanajuato, Nov. 26, 2010 OBJETIVO: 1. QUE ES UN DISPOSITIVO MÉDICO
INSTRUCTIVO PARA EL LLENADO DEL FORMATO COMPLEMENTARIO PARA EL REGISTRO DE DISPOSITIVOS MÉDICOS - versión N 3. Dispositivos Médicos
 INSTRUCTIVO PARA EL LLENADO DEL FORMATO COMPLEMENTARIO PARA EL REGISTRO DE DISPOSITIVOS MÉDICOS - versión N 3. Dispositivos Médicos Equipos Biomédicos Dispositivos médicos de Diagnóstico in vitro 1 P á
INSTRUCTIVO PARA EL LLENADO DEL FORMATO COMPLEMENTARIO PARA EL REGISTRO DE DISPOSITIVOS MÉDICOS - versión N 3. Dispositivos Médicos Equipos Biomédicos Dispositivos médicos de Diagnóstico in vitro 1 P á
Productos médicos de calidad subestándar, espurios, de etiquetado engañoso, falsificados o de imitación
 65.ª ASAMBLEA MUNDIAL DE LA SALUD WHA65.19 Punto 13.13 del orden del día 26 de mayo de 2012 Productos médicos de calidad subestándar, espurios, de etiquetado engañoso, falsificados o de imitación La 65.ª
65.ª ASAMBLEA MUNDIAL DE LA SALUD WHA65.19 Punto 13.13 del orden del día 26 de mayo de 2012 Productos médicos de calidad subestándar, espurios, de etiquetado engañoso, falsificados o de imitación La 65.ª
SISTEMA INTEGRADO DE SUMINISTRO DE MEDICAMENTOS E INSUMOS MEDICO QUIRÚRGICO - SISMED - Oficina General de Estadística e Informática
 SISTEMA INTEGRADO DE SUMINISTRO DE MEDICAMENTOS E INSUMOS MEDICO QUIRÚRGICO - SISMED - Oficina General de Estadística e Informática 1 Ministerio de Salud 2 Antecedentes El Ministerio de Salud para cumplir
SISTEMA INTEGRADO DE SUMINISTRO DE MEDICAMENTOS E INSUMOS MEDICO QUIRÚRGICO - SISMED - Oficina General de Estadística e Informática 1 Ministerio de Salud 2 Antecedentes El Ministerio de Salud para cumplir
DIRECCIÓN DE DISPOSITIVOS MÉDICOS Y PRODUCTOS SANITARIOS - DDMP
 DIRECCIÓN DE DISPOSITIVOS MÉDICOS Y PRODUCTOS SANITARIOS - DDMP Q.F. Patricia Ingunza Cañoli 19 de Junio del 2017 COMUNICADO FORMATO DE COMUNICACIONES EN EL REGISTRO SANITARIO DE DISPOSITIVOS MÉDICOS La
DIRECCIÓN DE DISPOSITIVOS MÉDICOS Y PRODUCTOS SANITARIOS - DDMP Q.F. Patricia Ingunza Cañoli 19 de Junio del 2017 COMUNICADO FORMATO DE COMUNICACIONES EN EL REGISTRO SANITARIO DE DISPOSITIVOS MÉDICOS La
Documento Final. Título: Evidencia Clínica Definiciones clave y conceptos. Grupo de autores: Grupo de estudio 5
 SG5/N1R8-2007 Documento Final Título: Evidencia Clínica Definiciones clave y conceptos Grupo de autores: Grupo de estudio 5 Aprobado por: Grupo de Trabajo de Armonización Mundial Fecha: Mayo del 2007 Larry
SG5/N1R8-2007 Documento Final Título: Evidencia Clínica Definiciones clave y conceptos Grupo de autores: Grupo de estudio 5 Aprobado por: Grupo de Trabajo de Armonización Mundial Fecha: Mayo del 2007 Larry
Solicitud de Actualización de Cartera de Servicios del Sistema de Salud de Aragón Datos del solicitante
 Fecha de solicitud: Referencia: Solicitud de Actualización de Cartera de Servicios del Sistema de Salud de Aragón Datos del solicitante Entidad /Servicio o Persona que realiza la propuesta: Persona, cargo
Fecha de solicitud: Referencia: Solicitud de Actualización de Cartera de Servicios del Sistema de Salud de Aragón Datos del solicitante Entidad /Servicio o Persona que realiza la propuesta: Persona, cargo
MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE OFTALMOLOGÍA APROBADO POR: R.D.Nº SA-HCH/DG
 MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE OFTALMOLOGÍA APROBADO POR: R.D.Nº 212-2008-SA-HCH/DG FECHA DE APROBACIÓN: 19-06-2008 1 INDICE CAPITULO I:
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE OFTALMOLOGÍA APROBADO POR: R.D.Nº 212-2008-SA-HCH/DG FECHA DE APROBACIÓN: 19-06-2008 1 INDICE CAPITULO I:
Dispensación y Atención Farmacéutica de Productos Sanitarios en Oficinas de Farmacia.
 Fecha: 15/10/2015 Consulta Nº 56: Dispensación y Atención Farmacéutica de Productos Sanitarios en Oficinas de Farmacia. Respuesta: Información en: http://www.elfarmaceutico.es/index.php/oficina-de-farmacia/item/6379-introduccion-a-losproductos-sanitarios#.vrnmc9j6tmo
Fecha: 15/10/2015 Consulta Nº 56: Dispensación y Atención Farmacéutica de Productos Sanitarios en Oficinas de Farmacia. Respuesta: Información en: http://www.elfarmaceutico.es/index.php/oficina-de-farmacia/item/6379-introduccion-a-losproductos-sanitarios#.vrnmc9j6tmo
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE CIRUGÍA DE TÓRAX Y CARDIOVASCULAR
 MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE CIRUGÍA DE TÓRAX Y CARDIOVASCULAR APROBADO POR: R.D.Nº 214-2008-SA-HCH/DG FECHA DE APROBACIÓN: 1 INDICE
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE CIRUGÍA DE TÓRAX Y CARDIOVASCULAR APROBADO POR: R.D.Nº 214-2008-SA-HCH/DG FECHA DE APROBACIÓN: 1 INDICE
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE CIRUGÍA GENERAL
 MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE CIRUGÍA GENERAL APROBADO POR: R.D.Nº 210-2008-SA-HCH/DG FECHA DE APROBACIÓN: 19 JUNIO 2008 1 INDICE CAPITULO
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE CIRUGÍA GENERAL APROBADO POR: R.D.Nº 210-2008-SA-HCH/DG FECHA DE APROBACIÓN: 19 JUNIO 2008 1 INDICE CAPITULO
SELECCIÓN Y MANTENIMIENTO DEL EQUIPO DE LABORATORIO BACT. MARIBEL ESPINOSA PULIDO
 SELECCIÓN Y MANTENIMIENTO DEL EQUIPO DE LABORATORIO BACT. MARIBEL ESPINOSA PULIDO TECNOLOGÍA SANITARIA: La aplicación de conocimientos teóricos y prácticos estructurados en forma de dispositivos, medicamentos,
SELECCIÓN Y MANTENIMIENTO DEL EQUIPO DE LABORATORIO BACT. MARIBEL ESPINOSA PULIDO TECNOLOGÍA SANITARIA: La aplicación de conocimientos teóricos y prácticos estructurados en forma de dispositivos, medicamentos,
REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURIDICA FMP/ARC/AMSCH
 REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURIDICA FMP/ARC/AMSCH REGLAMENTO DEL FORMULARIO NACIONAL DE MEDICAMENTOS DECRETO N 264/03 Publicado en el Diario Oficial de 16 de marzo de 2004 REPUBLICA
REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURIDICA FMP/ARC/AMSCH REGLAMENTO DEL FORMULARIO NACIONAL DE MEDICAMENTOS DECRETO N 264/03 Publicado en el Diario Oficial de 16 de marzo de 2004 REPUBLICA
MINISTERIO DE SALUD DIRECCION GENERAL DE MEDICAMENTOS INSUMOS Y DROGAS
 Código: EA/CAT-PRO-003 CÓDIGO PROCEDIMIENTO DE FECHA ASIGNACIÓN DE VIGENCIA DEL CÓDIGO OPM VERSIÓN PÁGINAS EA/CAT-PRO-003 23-10-2014 01 Página: 1 1/6 de 6 DIRECCION GENERAL DE MEDICAMENTOS INSUMOS Y DROGAS
Código: EA/CAT-PRO-003 CÓDIGO PROCEDIMIENTO DE FECHA ASIGNACIÓN DE VIGENCIA DEL CÓDIGO OPM VERSIÓN PÁGINAS EA/CAT-PRO-003 23-10-2014 01 Página: 1 1/6 de 6 DIRECCION GENERAL DE MEDICAMENTOS INSUMOS Y DROGAS
ANEXO N 3 Instrumento de Evaluación Local en las IPRESS. Evaluación Local de IPRESS
 ANEXO N 3 Instrumento de Evaluación Local en las IPRESS Evaluación Local de IPRESS 1.- mbre de Evaluador: Grupo Ocupacional: _ mbre de Red Asistencial: mbre de IPRESS: Código de Evento: 2.- Datos del Dispositivo
ANEXO N 3 Instrumento de Evaluación Local en las IPRESS Evaluación Local de IPRESS 1.- mbre de Evaluador: Grupo Ocupacional: _ mbre de Red Asistencial: mbre de IPRESS: Código de Evento: 2.- Datos del Dispositivo
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE OFTALMOLOGÍA
 MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE OFTALMOLOGÍA APROBADO POR: R.D.Nº 212-2008-SA-HCH/DG FECHA DE APROBACIÓN: 19 JUNIO 2008 1 INDICE CAPITULO
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE OFTALMOLOGÍA APROBADO POR: R.D.Nº 212-2008-SA-HCH/DG FECHA DE APROBACIÓN: 19 JUNIO 2008 1 INDICE CAPITULO
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE GINECO-OBSTETRICIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE GINECOLOGÍA
 MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE GINECO-OBSTETRICIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE GINECOLOGÍA APROBADO POR: R.D.Nº 255-2008-SA-HCH/DG FECHA DE APROBACIÓN:
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE GINECO-OBSTETRICIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE GINECOLOGÍA APROBADO POR: R.D.Nº 255-2008-SA-HCH/DG FECHA DE APROBACIÓN:
BOLETÍN OFICIAL DEL ESTADO
 Núm. 226 Martes 18 de septiembre de 2018 Sec. III. Pág. 90296 III. OTRAS DISPOSICIONES MINISTERIO DE SANIDAD, CONSUMO Y BIENESTAR SOCIAL 12686 Resolución de 28 de agosto de 2018, de la Dirección General
Núm. 226 Martes 18 de septiembre de 2018 Sec. III. Pág. 90296 III. OTRAS DISPOSICIONES MINISTERIO DE SANIDAD, CONSUMO Y BIENESTAR SOCIAL 12686 Resolución de 28 de agosto de 2018, de la Dirección General
Oficina General de Planeamiento y Presupuesto REGULACION DE LOS DISPOSITIVOS MEDICOS DE DIAGNOSTICO IN VITRO EN EL PERU
 Oficina General de Planeamiento y Presupuesto REGULACION DE LOS DISPOSITIVOS MEDICOS DE DIAGNOSTICO IN VITRO EN EL PERU Q.F. SILVIA A. PEREZ VALDEZ Jefe-Equipo de Dispositivos Medicos y Productos sanitarios
Oficina General de Planeamiento y Presupuesto REGULACION DE LOS DISPOSITIVOS MEDICOS DE DIAGNOSTICO IN VITRO EN EL PERU Q.F. SILVIA A. PEREZ VALDEZ Jefe-Equipo de Dispositivos Medicos y Productos sanitarios
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE PEDIATRIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE NEONATOLOGIA
 MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE PEDIATRIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE NEONATOLOGIA APROBADO POR: R.D.Nº 251-2008-SA-HCH/DG FECHA DE APROBACIÓN: 11-07-2008
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE PEDIATRIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE NEONATOLOGIA APROBADO POR: R.D.Nº 251-2008-SA-HCH/DG FECHA DE APROBACIÓN: 11-07-2008
Investigación con Seres Humanos (HRP Estándares, intenciones y elementos medibles
 Investigación con Seres Humanos (HRP Estándares, intenciones y elementos medibles Estándar HRP.1 POLITICA 104/14 Los lideres del hospital son responsables de la protección de los seres humanos que participan
Investigación con Seres Humanos (HRP Estándares, intenciones y elementos medibles Estándar HRP.1 POLITICA 104/14 Los lideres del hospital son responsables de la protección de los seres humanos que participan
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL DEPARTAMENTO DE PEDIATRIA
 MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL DEPARTAMENTO DE PEDIATRIA APROBADO POR: R.D.Nº 186-2008-SA-HCH/DG FECHA DE APROBACIÓN: 05-06-2008 1 INDICE CAPITULO
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL DEPARTAMENTO DE PEDIATRIA APROBADO POR: R.D.Nº 186-2008-SA-HCH/DG FECHA DE APROBACIÓN: 05-06-2008 1 INDICE CAPITULO
Programa de Cooperación Internacional y Ayuda en Fisioterapia: Objetivo, líneas estratégicas y acciones prioritarias.
 Consejo General de Colegios de Fisioterapeutas de España Unidad de Investigación en Emergencia y Desastre. Universidad de Oviedo Programa de Cooperación Internacional y Ayuda en Fisioterapia: Objetivo,
Consejo General de Colegios de Fisioterapeutas de España Unidad de Investigación en Emergencia y Desastre. Universidad de Oviedo Programa de Cooperación Internacional y Ayuda en Fisioterapia: Objetivo,
MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE ANESTESIA CLÍNICO QUIRÚRGICA APROBADO POR: R.D.Nº SA-HNCH/DG
 MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE ANESTESILOGÍA Y CENTRO QUIRÚRGICO MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE ANESTESIA CLÍNICO QUIRÚRGICA APROBADO POR: R.D.Nº 415-2008-SA-HNCH/DG
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE ANESTESILOGÍA Y CENTRO QUIRÚRGICO MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE ANESTESIA CLÍNICO QUIRÚRGICA APROBADO POR: R.D.Nº 415-2008-SA-HNCH/DG
Plan TEC: Etapas. Habilitación de la. ubicación física del equipamiento. Diseño de. condiciones. básicas para el uso pedagógico
 Plan TEC: Etapas Reunión de Coordinación Nº 1 Reunión de Coordinación Nº 2 Firma y tramitación de convenio Habilitación de la ubicación física del equipamiento Invitación a sostenedores Confirmación de
Plan TEC: Etapas Reunión de Coordinación Nº 1 Reunión de Coordinación Nº 2 Firma y tramitación de convenio Habilitación de la ubicación física del equipamiento Invitación a sostenedores Confirmación de
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE EMERGENCIA Y CUIDADOS CRÍTICOS
 MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE EMERGENCIA Y CUIDADOS CRÍTICOS MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE CUIDADOS INTENSIVOS NEONATAL APROBADO POR: R.D.Nº 467-2008-SA-HNCH/DG
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE EMERGENCIA Y CUIDADOS CRÍTICOS MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE CUIDADOS INTENSIVOS NEONATAL APROBADO POR: R.D.Nº 467-2008-SA-HNCH/DG
CARACTERIZACIÓN DEL PROCESO Laboratorio clínico
 Página: de 8. MACROPROCESO: GESTIÓN DE APOYO DIAGNÓSTICO Y TERAPÉUTICO.. OBJETIVO DEL MACROPROCESO: Contribuir al diagnóstico y terapia de los problemas de salud bajo las mejores condiciones de calidad
Página: de 8. MACROPROCESO: GESTIÓN DE APOYO DIAGNÓSTICO Y TERAPÉUTICO.. OBJETIVO DEL MACROPROCESO: Contribuir al diagnóstico y terapia de los problemas de salud bajo las mejores condiciones de calidad
PROGRAMA REGULAR. Fundamentación:
 PROGRAMA REGULAR Denominación de la Asignatura:Ingeniería Clínica Carreras: Bioingeniería Ciclo lectivo: 2017 Docente/s:Ing. Ignacio Marolla Carga horaria semanal: 4 horas. Fundamentación: La Ingeniería
PROGRAMA REGULAR Denominación de la Asignatura:Ingeniería Clínica Carreras: Bioingeniería Ciclo lectivo: 2017 Docente/s:Ing. Ignacio Marolla Carga horaria semanal: 4 horas. Fundamentación: La Ingeniería
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE GINECO-OBSTETRICIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE OBSTETRICIA
 MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE GINECO-OBSTETRICIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE OBSTETRICIA APROBADO POR: R.D.Nº 256-2008-SA-HCH/DG FECHA DE APROBACIÓN:
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE GINECO-OBSTETRICIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE OBSTETRICIA APROBADO POR: R.D.Nº 256-2008-SA-HCH/DG FECHA DE APROBACIÓN:
GUÍA DE APLICACIÓN ISO 9001: Mejora
 Edición 4 02/11/2016 Copyright iso2015ebook.com. Todos los derechos reservados. ISBN: 978-950-43-0411-1 1 INDICE Objetivo Descripción del documento. Recursos necesarios para la utilización del ebook. Especificaciones
Edición 4 02/11/2016 Copyright iso2015ebook.com. Todos los derechos reservados. ISBN: 978-950-43-0411-1 1 INDICE Objetivo Descripción del documento. Recursos necesarios para la utilización del ebook. Especificaciones
EPOC. Algo nuevo en la EPOC? JC Martín Escudero. Hospital Universitario Río Hortega Valladolid
 EPOC Algo nuevo en la EPOC? JC Martín Escudero Hospital Universitario Río Hortega Valladolid EPOC Estrategia en EPOC del SNS: un consenso novedoso. JC Martín Escudero Hospital Universitario Río Hortega
EPOC Algo nuevo en la EPOC? JC Martín Escudero Hospital Universitario Río Hortega Valladolid EPOC Estrategia en EPOC del SNS: un consenso novedoso. JC Martín Escudero Hospital Universitario Río Hortega
APLICACIÓN DE LOS NUEVOS CRITERIOS PARA LA CLASIFICACIÓN DE DISPOSITIVOS MÉDICOS
 APLICACIÓN DE LOS NUEVOS CRITERIOS PARA LA CLASIFICACIÓN DE DISPOSITIVOS MÉDICOS XIV ENCUENTRO DE REGULACIÓN SANITARIA 24 y 25 DE MAYO DE 2018 HOTEL MARQUIS-REFORMA, CIUDAD DE MÉXICO QFB Juan Carlos Gallegos
APLICACIÓN DE LOS NUEVOS CRITERIOS PARA LA CLASIFICACIÓN DE DISPOSITIVOS MÉDICOS XIV ENCUENTRO DE REGULACIÓN SANITARIA 24 y 25 DE MAYO DE 2018 HOTEL MARQUIS-REFORMA, CIUDAD DE MÉXICO QFB Juan Carlos Gallegos
GUIA DE APRENDIZAJE. Nombre de la Guía: DESPACHO DE PRODUCTOS FARMACÉUTICOS
 PÁGINA 1 DE 5 FECHA DE ACTUALIZACIÒN: Agosto - 201 1. IDENTIFICACIÓN DE LA GUÍA DE Código Guía: 08-01-01 Nombre de la Guía: DESPACHO DE PRODUCTOS FARMACÉUTICOS Programa: Técnico Laboral Auxiliar en Servicios
PÁGINA 1 DE 5 FECHA DE ACTUALIZACIÒN: Agosto - 201 1. IDENTIFICACIÓN DE LA GUÍA DE Código Guía: 08-01-01 Nombre de la Guía: DESPACHO DE PRODUCTOS FARMACÉUTICOS Programa: Técnico Laboral Auxiliar en Servicios
PLANTILLA. Plantilla para un plan de acción nacional de lucha contra la resistencia a los antimicrobianos
 PLANTILLA Plantilla para un plan de acción nacional de lucha contra la resistencia a los antimicrobianos Índice Glosario... 1 Abreviaturas y acrónimos... 1 Prólogo... 2 Resumen... 2 Información general...
PLANTILLA Plantilla para un plan de acción nacional de lucha contra la resistencia a los antimicrobianos Índice Glosario... 1 Abreviaturas y acrónimos... 1 Prólogo... 2 Resumen... 2 Información general...
Gestión Ambiental en la Industria de Procesos.
 Gestión Ambiental en la Industria de Procesos. 1. Definiciones preliminares. Sistema de Gestión Ambiental: Es la Parte del Sistema Global de Gestión de la Empresa, cuyo objetivo es desarrollar, implementar,
Gestión Ambiental en la Industria de Procesos. 1. Definiciones preliminares. Sistema de Gestión Ambiental: Es la Parte del Sistema Global de Gestión de la Empresa, cuyo objetivo es desarrollar, implementar,
COMITÉ DE TECNOVIGILANCIA
 COMITÉ DE TECNOVIGILANCIA Evaluación y análisis de nuevas tecnologías. Características de los dispositivos médicos. Interacción con otros comités. Farm. María Gabriela Fernández Hospital de Pediatría Juan
COMITÉ DE TECNOVIGILANCIA Evaluación y análisis de nuevas tecnologías. Características de los dispositivos médicos. Interacción con otros comités. Farm. María Gabriela Fernández Hospital de Pediatría Juan
11. Los casos que no se encuentren contemplados en estos criterios y acciones, serán evaluados caso a caso por la ANM. CRITERIOS ESPECÍFICOS:
 INFORME DEL GRUPO DE TRABAJO ENCARGADO DE ELABORAR LOS CRITERIOS Y ACCIONES PARA EVALUACION Y CUMPLIMIENTO DE LA EFICACIA Y SEGURIDAD DE LAS ESPECIALIDADES FARMACEUTICAS - RESOLUCION MINISTERIAL N 707-2014/MINSA
INFORME DEL GRUPO DE TRABAJO ENCARGADO DE ELABORAR LOS CRITERIOS Y ACCIONES PARA EVALUACION Y CUMPLIMIENTO DE LA EFICACIA Y SEGURIDAD DE LAS ESPECIALIDADES FARMACEUTICAS - RESOLUCION MINISTERIAL N 707-2014/MINSA
Código: J62.14 Nivel: 4. Programación de informática, consultoría de informática y actividades conexas
 Denominación: Técnicas en redes y telecomunicaciones Código: J62.14 Nivel: 4 Sector: Familia: Programación de informática, consultoría de informática y actividades conexas Tecnología hardware y software
Denominación: Técnicas en redes y telecomunicaciones Código: J62.14 Nivel: 4 Sector: Familia: Programación de informática, consultoría de informática y actividades conexas Tecnología hardware y software
Selección de Medicamentos
 Selección de Medicamentos a) INTRODUCCIÓN Las Direcciones de Área de Salud utilizan los medicamentos que se consideran básicos según el perfil epidemiológico y capacidad resolutiva de los servicios. La
Selección de Medicamentos a) INTRODUCCIÓN Las Direcciones de Área de Salud utilizan los medicamentos que se consideran básicos según el perfil epidemiológico y capacidad resolutiva de los servicios. La
POLÍTICAS OPERATIVAS DE VIH
 POLÍTICAS OPERATIVAS DE VIH Modesta C. Haughton Centeno 16 de agosto de 2013 POLÍTICAS OPERATIVAS Son las normas, las leyes, los códigos, las pautas, los planes, los presupuestos, los procedimientos y
POLÍTICAS OPERATIVAS DE VIH Modesta C. Haughton Centeno 16 de agosto de 2013 POLÍTICAS OPERATIVAS Son las normas, las leyes, los códigos, las pautas, los planes, los presupuestos, los procedimientos y
Auditoría» ISO/IEC 27001» Requerimientos
 Auditoría» ISO/IEC 27001» Requerimientos El análisis de brechas: estado de aplicación de ISO/IEC 27001. 4: Sistema de Gestión de Seguridad de la Información 4.1: Requisitos generales 4.1.1 La organización
Auditoría» ISO/IEC 27001» Requerimientos El análisis de brechas: estado de aplicación de ISO/IEC 27001. 4: Sistema de Gestión de Seguridad de la Información 4.1: Requisitos generales 4.1.1 La organización
Programa regular de asignatura
 Programa regular de asignatura Ciclo lectivo: 2018 Denominación de la Asignatura:Ingeniería Clínica Carreras: Bioingeniería Coordinador: Ing. Fernando Ballina Docente/s:Ing. Ignacio Marolla Carga horaria
Programa regular de asignatura Ciclo lectivo: 2018 Denominación de la Asignatura:Ingeniería Clínica Carreras: Bioingeniería Coordinador: Ing. Fernando Ballina Docente/s:Ing. Ignacio Marolla Carga horaria
Auditorías de Seguridad de la Información
 Auditorías de Seguridad de la Información La revisión del SGSI y de los controles de SI Antecedentes la Seguridad de la Información 2004: Creación del comité UNIT para la seguridad de la información Fuente:
Auditorías de Seguridad de la Información La revisión del SGSI y de los controles de SI Antecedentes la Seguridad de la Información 2004: Creación del comité UNIT para la seguridad de la información Fuente:
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE DIAGNÓSTICO POR IMAGENES
 MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE DIAGNÓSTICO POR IMAGENES MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL DEPARTAMENTO DEL SERVICIO DE ECOGRAFÍA Y TOMOGRAFÍA APROBADO POR: R.D.Nº 420-2008-SA-HNCH/DG
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE DIAGNÓSTICO POR IMAGENES MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL DEPARTAMENTO DEL SERVICIO DE ECOGRAFÍA Y TOMOGRAFÍA APROBADO POR: R.D.Nº 420-2008-SA-HNCH/DG
JUSTIFICACIÓN II. JUSTIFICACIÓN
 JUSTIFICACIÓN II. JUSTIFICACIÓN - 133 - TESIS DOCTORAL - 134 - JUSTIFICACIÓN Actualmente las enfermedades del aparato locomotor tienen una gran repercusión sanitaria, social y económica. Se las considera
JUSTIFICACIÓN II. JUSTIFICACIÓN - 133 - TESIS DOCTORAL - 134 - JUSTIFICACIÓN Actualmente las enfermedades del aparato locomotor tienen una gran repercusión sanitaria, social y económica. Se las considera
COMISIÓN DE LAS COMUNIDADES EUROPEAS. Propuesta de RECOMENDACIÓN DEL CONSEJO. relativa a una acción europea en el ámbito de las enfermedades raras
 ES ES ES COMISIÓN DE LAS COMUNIDADES EUROPEAS Bruselas, 11.11.2008 COM(2008) 726 final Propuesta de RECOMENDACIÓN DEL CONSEJO relativa a una acción europea en el ámbito de las enfermedades raras {SEC(2008)2713}
ES ES ES COMISIÓN DE LAS COMUNIDADES EUROPEAS Bruselas, 11.11.2008 COM(2008) 726 final Propuesta de RECOMENDACIÓN DEL CONSEJO relativa a una acción europea en el ámbito de las enfermedades raras {SEC(2008)2713}
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE EMERGENCIA Y CUIDADOS CRÍTICOS
 MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE EMERGENCIA Y CUIDADOS CRÍTICOS MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE CUIDADOS INTENSIVOS PEDIÁTRICOS APROBADO POR: R.D.Nº 284-2008-SA-HCH/DG
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA DEPARTAMENTO DE EMERGENCIA Y CUIDADOS CRÍTICOS MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE CUIDADOS INTENSIVOS PEDIÁTRICOS APROBADO POR: R.D.Nº 284-2008-SA-HCH/DG
6ªJornada Regional Economía de la Salud
 Toma de decisiones en evaluación de tecnologías sanitarias 23 de OCTUBRE 2014 Lugar de celebración: Salón de Actos Hospital Clínico Universitario Virgen de la Arrixaca www.programaemca.org En colaboración
Toma de decisiones en evaluación de tecnologías sanitarias 23 de OCTUBRE 2014 Lugar de celebración: Salón de Actos Hospital Clínico Universitario Virgen de la Arrixaca www.programaemca.org En colaboración
Morera T, Jaureguizar N. OCW UPV/EHU Farmacología Aplicada en Odontología
 Morera T, Jaureguizar N. OCW UPV/EHU 2016 Farmacología Aplicada en Odontología 1. La Farmacología como pilar fundamental de la terapéutica medicamentosa 2. La prescripción racional de medicamentos 3. Establecimiento
Morera T, Jaureguizar N. OCW UPV/EHU 2016 Farmacología Aplicada en Odontología 1. La Farmacología como pilar fundamental de la terapéutica medicamentosa 2. La prescripción racional de medicamentos 3. Establecimiento
PREGUNTAS FRECUENTES DEL PROCESO DE GESTIÓN DE RIESGOS
 1. Dentro del Establecimiento del contexto, Se toma en cuenta el presupuesto? Las políticas? Las Legislaciones? Respuesta: Sí, se toma en cuenta ya que se tienen que considerar todas las variables, tanto
1. Dentro del Establecimiento del contexto, Se toma en cuenta el presupuesto? Las políticas? Las Legislaciones? Respuesta: Sí, se toma en cuenta ya que se tienen que considerar todas las variables, tanto
INSTRUCTIVO PARA LA GESTION DE ALERTAS EMITIDAS POR EL INVIMA
 GESTION DE ALERTAS EMITIDAS POR EL INVIMA AGOSTO DE 2014 1. OBJETIVO Establecer un mecanismo claro y eficiente para la verificación y emisión de alertas emitidas por el INVIMA que estén relacionadas con
GESTION DE ALERTAS EMITIDAS POR EL INVIMA AGOSTO DE 2014 1. OBJETIVO Establecer un mecanismo claro y eficiente para la verificación y emisión de alertas emitidas por el INVIMA que estén relacionadas con
COMITÉ DE DISPOSITIVOS MÉDICOS PROPUESTAS DE MODIFICACIÓN
 COMITÉ DE DISPOSITIVOS MÉDICOS PROPUESTAS DE MODIFICACIÓN Agentes de diagnóstico: Todos los insumos incluyendo antígenos, anticuerpos, calibradores, verificadores, reactivos, equipos de reactivos, medios
COMITÉ DE DISPOSITIVOS MÉDICOS PROPUESTAS DE MODIFICACIÓN Agentes de diagnóstico: Todos los insumos incluyendo antígenos, anticuerpos, calibradores, verificadores, reactivos, equipos de reactivos, medios
SITUACIÓN DE LA FARMACIA DE LOS ESTABLECIMIENTOS DE SALUD PÚBLICOS, PRIVADOS Y LOS ALMACENES ESPECIALIZADOS A NIVEL NACIONAL
 SITUACIÓN DE LA FARMACIA DE LOS ESTABLECIMIENTOS DE SALUD PÚBLICOS, PRIVADOS Y LOS ALMACENES ESPECIALIZADOS A NIVEL NACIONAL Q. F. DIMAS FLORES PERALTA. RESPONSABLE DEL AREA DE SUPERVISIÓN A REGIONES ALMACENES
SITUACIÓN DE LA FARMACIA DE LOS ESTABLECIMIENTOS DE SALUD PÚBLICOS, PRIVADOS Y LOS ALMACENES ESPECIALIZADOS A NIVEL NACIONAL Q. F. DIMAS FLORES PERALTA. RESPONSABLE DEL AREA DE SUPERVISIÓN A REGIONES ALMACENES
De acuerdo a las distintas prioridades, los más relevantes de ellos son:
 VII. REGULACION El rol regulador del Ministerio de Salud es una función que se ejerce a través de un conjunto de leyes, decretos, reglamentos, circulares, normas y otros instrumentos que permiten el diseño,
VII. REGULACION El rol regulador del Ministerio de Salud es una función que se ejerce a través de un conjunto de leyes, decretos, reglamentos, circulares, normas y otros instrumentos que permiten el diseño,
Madrid, 20 de mayo de 2015 Jornada Informativa
 Madrid, 20 de mayo de 2015 Jornada Informativa Mercedes Suria Luengo Jefe de Servicio de Inspección de Instalaciones Departamento de Productos Sanitarios. AEMPS Legislación Real Decreto 1591/2009, de 16
Madrid, 20 de mayo de 2015 Jornada Informativa Mercedes Suria Luengo Jefe de Servicio de Inspección de Instalaciones Departamento de Productos Sanitarios. AEMPS Legislación Real Decreto 1591/2009, de 16
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE CIRUGIA PEDIATRICA
 MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE CIRUGIA PEDIATRICA APROBADO POR: R.D.Nº 350-2008-SA-HCH/DG FECHA DE APROBACIÓN: 27-08-2008 1 INDICE CAPITULO
MINISTERIO DE SALUD HOSPITAL CAYETANO HEREDIA MANUAL DE ORGANIZACIÓN Y FUNCIONES DEL SERVICIO DE CIRUGIA PEDIATRICA APROBADO POR: R.D.Nº 350-2008-SA-HCH/DG FECHA DE APROBACIÓN: 27-08-2008 1 INDICE CAPITULO
Central de de Esterilización
 Un equipo humano integrado para la Mejora Continua de Servicios de Calidad Médico quirúrgicos Gestión Gestión de de Riesgos Riesgos en en Central de de Esterilización Gestión de Riesgos en Central de
Un equipo humano integrado para la Mejora Continua de Servicios de Calidad Médico quirúrgicos Gestión Gestión de de Riesgos Riesgos en en Central de de Esterilización Gestión de Riesgos en Central de
PROPUESTAS DE MODIFICACIÓN (DEFINICIONES APROBADAS EN LA REUNIÓN DEL 27 DE OCTUBRE) Dice Debe decir Justificación/Comentario
 PROPUESTAS DE MODIFICACIÓN (DEFINICIONES APROBADAS EN LA REUNIÓN DEL 27 DE OCTUBRE) Agentes de diagnóstico: Todos los insumos incluyendo antígenos, anticuerpos, calibradores, verificadores, reactivos,
PROPUESTAS DE MODIFICACIÓN (DEFINICIONES APROBADAS EN LA REUNIÓN DEL 27 DE OCTUBRE) Agentes de diagnóstico: Todos los insumos incluyendo antígenos, anticuerpos, calibradores, verificadores, reactivos,
USO EXCLUSIVO DIGEMID 1. NOMBRE DEL PRODUCTO 2. ORIGEN : 3. N REG.SANITARIO NACIONAL EXTRANJERO
 MINISTERIO DE SALUD DIRECCIÓN GENERAL DE MEDICAMENTOS INSUMOS Y DROGAS DIRECCIÓN DE AUTORIZACIONES SANITARIAS - DAS INSCRIPCIÓN - REINSCRIPCIÓN SOLICITUD DECLARACIÓN JURADA PARA REGISTRO DE PRODUCTOS SANITARIOS
MINISTERIO DE SALUD DIRECCIÓN GENERAL DE MEDICAMENTOS INSUMOS Y DROGAS DIRECCIÓN DE AUTORIZACIONES SANITARIAS - DAS INSCRIPCIÓN - REINSCRIPCIÓN SOLICITUD DECLARACIÓN JURADA PARA REGISTRO DE PRODUCTOS SANITARIOS
PRIMERA CONFERENCIA MINISTERIAL MUNDIAL SOBRE MODOS DE VIDA SANOS Y LUCHA CONTRA LAS ENFERMEDADES NO TRANSMISIBLES (Moscú, 28 y 29 de abril de 2011)
 PRIMERA CONFERENCIA MINISTERIAL MUNDIAL SOBRE MODOS DE VIDA SANOS Y LUCHA CONTRA LAS ENFERMEDADES NO TRANSMISIBLES (Moscú, 28 y 29 de abril de 2011) INFORME DE POLÍTICAS ACCESO A TECNOLOGÍAS Y MEDICAMENTOS
PRIMERA CONFERENCIA MINISTERIAL MUNDIAL SOBRE MODOS DE VIDA SANOS Y LUCHA CONTRA LAS ENFERMEDADES NO TRANSMISIBLES (Moscú, 28 y 29 de abril de 2011) INFORME DE POLÍTICAS ACCESO A TECNOLOGÍAS Y MEDICAMENTOS
Jornadas de Tecnovigilancia
 Jornadas de Tecnovigilancia Foro con Farmacéuticas de Hospital 13 de Diciembre, 2013 Farm. Alejandra Staravijosky Fundamento TECNOVIGILANCIA Que es la Tecnovigilancia Programa de Tecnovigilancia ANMAT
Jornadas de Tecnovigilancia Foro con Farmacéuticas de Hospital 13 de Diciembre, 2013 Farm. Alejandra Staravijosky Fundamento TECNOVIGILANCIA Que es la Tecnovigilancia Programa de Tecnovigilancia ANMAT
GUÍA DE USUARIO PARA LA PRESENTACIÓN DE ESTUDIOS IN VIVO E IN VITRO PARA DEMOSTRAR BIOEQUIVALENCIA
 Página 1 de 8 GUÍA DE USUARIO PARA LA PRESENTACIÓN DE ESTUDIOS IN VIVO E Página 2 de 8 TABLA DE CONTENIDO / INDICE 1. INTRODUCCIÓN... 3 2. OBJETIVOS... 3 3. ALCANCE... 3 4. DEFINICIONES... 3 5. SIGLAS...
Página 1 de 8 GUÍA DE USUARIO PARA LA PRESENTACIÓN DE ESTUDIOS IN VIVO E Página 2 de 8 TABLA DE CONTENIDO / INDICE 1. INTRODUCCIÓN... 3 2. OBJETIVOS... 3 3. ALCANCE... 3 4. DEFINICIONES... 3 5. SIGLAS...
Evaluación del riesgo de la seguridad del paciente en sistemas de atención médica.
 Evaluación del riesgo de la seguridad del paciente en sistemas de atención médica. (Propuesta de la CONAMED para contribuir a mejorar la calidad de atención y la seguridad del paciente en los establecimientos
Evaluación del riesgo de la seguridad del paciente en sistemas de atención médica. (Propuesta de la CONAMED para contribuir a mejorar la calidad de atención y la seguridad del paciente en los establecimientos
SITUACIÓN ACTUAL DE LA TECNOVIGILANCIA EN COLOMBIA
 SITUACIÓN ACTUAL DE LA TECNOVIGILANCIA EN COLOMBIA Dra. Blanca Elvira Cajigas Directora General Dr. Elkin Hernán Otálvaro Cifuentes Director de Dispositivos Médicos y Otras Tecnologías Medellín, Antioquia
SITUACIÓN ACTUAL DE LA TECNOVIGILANCIA EN COLOMBIA Dra. Blanca Elvira Cajigas Directora General Dr. Elkin Hernán Otálvaro Cifuentes Director de Dispositivos Médicos y Otras Tecnologías Medellín, Antioquia
Estandarización y efectividad en el desarrollo de normas para los comités técnicos de ISO. Mayor alineamiento y compatibilidad entre normas.
 PROCESO DE ACTUALIZACIÓN DE LA NORMA ISO 9001 En el año 2012 la International Organization for Standardization ISO decidió que todos los estándares de sistemas de gestión deberían utilizar un marco común
PROCESO DE ACTUALIZACIÓN DE LA NORMA ISO 9001 En el año 2012 la International Organization for Standardization ISO decidió que todos los estándares de sistemas de gestión deberían utilizar un marco común
COMITÉS DE FARMACOTERÁPIA. Unidad de Asistencia Técnica y Logística Farmacéutica Ministerio de Salud Pública y Asistencia Social
 COMITÉS DE FARMACOTERÁPIA Unidad de Asistencia Técnica y Logística Farmacéutica Ministerio de Salud Pública y Asistencia Social DEFINICIÓN COMITÉ DE FARMACOTERÁPIA El Comité de Farmacoterápia es un ente
COMITÉS DE FARMACOTERÁPIA Unidad de Asistencia Técnica y Logística Farmacéutica Ministerio de Salud Pública y Asistencia Social DEFINICIÓN COMITÉ DE FARMACOTERÁPIA El Comité de Farmacoterápia es un ente
Regulación Sanitaria de Dispositivos Médicos
 Regulación Sanitaria de Dispositivos Médicos VII Conferencia de la Red Panamericana para la Armonización de la Reglamentación Farmacéutica (Red PARF) Ottawa, Canadá 7 de septiembre de 2013 La Industria
Regulación Sanitaria de Dispositivos Médicos VII Conferencia de la Red Panamericana para la Armonización de la Reglamentación Farmacéutica (Red PARF) Ottawa, Canadá 7 de septiembre de 2013 La Industria
Profesional Servicio Social Obligatorio (Odontología)
 Profesional Servicio Social Obligatorio (Odontología) I. IDENTIFICACIÓN DEL EMPLEO Nivel Jerárquico Profesional Denominación del empleo ODONTOLOGO SSO Código 217 Grado 01 Número de Cargos Dos (2) Dependencia
Profesional Servicio Social Obligatorio (Odontología) I. IDENTIFICACIÓN DEL EMPLEO Nivel Jerárquico Profesional Denominación del empleo ODONTOLOGO SSO Código 217 Grado 01 Número de Cargos Dos (2) Dependencia
PROGRAMA DE PREVENCIÓN Y CONTROL DE CÁNCER CERVICOUTERINO
 PROYECTO COLABORATIVO CERCA UICC - ISNCC Educación a enfermeras de América Latina sobre cáncer cervical. 2016 PROGRAMA DE PREVENCIÓN Y CONTROL DE CÁNCER CERVICOUTERINO Mg. María Victoria Brunelli. Argentina
PROYECTO COLABORATIVO CERCA UICC - ISNCC Educación a enfermeras de América Latina sobre cáncer cervical. 2016 PROGRAMA DE PREVENCIÓN Y CONTROL DE CÁNCER CERVICOUTERINO Mg. María Victoria Brunelli. Argentina
FECHA SOLO PARA USO EXCLUSIVO DE DIGEMID PARTE I. INFORMACION DEL PRODUCTO 1. NOMBRE DEL PRODUCTO 2. N REG. SANITARIO ANEXA RELACIÓN SI NO
 MINISTERIO DE SALUD SOLICITUD-DECLARACIÓN JURADA PARA CAMBIOS DE PRODUCTOS FARMACEUTICOS DIRECCIÓN GENERAL DE MEDICAMENTOS INSUMOS Y DROGAS Ley 27444 Art. 125 DETERMINA DOS DIAS HABILES PARA COMPLETAR
MINISTERIO DE SALUD SOLICITUD-DECLARACIÓN JURADA PARA CAMBIOS DE PRODUCTOS FARMACEUTICOS DIRECCIÓN GENERAL DE MEDICAMENTOS INSUMOS Y DROGAS Ley 27444 Art. 125 DETERMINA DOS DIAS HABILES PARA COMPLETAR
La nueva ISO 19011:2011 Directrices para auditoría de sistemas de gestión
 NIGEL CROFT EDUARDO LOPEZ GATELL Clase Maestra de Auditorias en Sistemas de Gestión La nueva ISO 19011:2011 Directrices para auditoría de sistemas de gestión Eduardo Gatell Member, ISO/TC176/SC2 Strategic
NIGEL CROFT EDUARDO LOPEZ GATELL Clase Maestra de Auditorias en Sistemas de Gestión La nueva ISO 19011:2011 Directrices para auditoría de sistemas de gestión Eduardo Gatell Member, ISO/TC176/SC2 Strategic
PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN DE LAS COMPETENCIAS PROFESIONALES CUESTIONARIO DE AUTOEVALUACIÓN PARA LAS TRABAJADORAS Y TRABAJADORES
 PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN DE LAS COMPETENCIAS PROFESIONALES CUALIFICACIÓN PROFESIONAL: PRODUCTOS SANITARIOS ORTOPROTÉSICOS Y AYUDAS TÉCNICAS Código: UC1726_2 NIVEL: 2 CUESTIONARIO DE PARA
PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN DE LAS COMPETENCIAS PROFESIONALES CUALIFICACIÓN PROFESIONAL: PRODUCTOS SANITARIOS ORTOPROTÉSICOS Y AYUDAS TÉCNICAS Código: UC1726_2 NIVEL: 2 CUESTIONARIO DE PARA
