4.5 Características comparadas con otros medicamentos con la misma indicación disponibles en el Hospital
|
|
|
- Antonio Macías Parra
- hace 8 años
- Vistas:
Transcripción
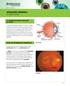
1 RANIBIZUMAB Degeneración macular asociada a la edad (Informe para la Comisión de Farmacia y Terapéutica del Hospital Universitario Central de Asturias) Fecha 01/08/ IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco: Ranibizumab. Indicación clínica solicitada: Tratamiento de la forma exudativa o neovascular de la degeneración macular asociada a la edad (DAME). Autores / Revisores: Lucía Velasco/Miguel Al-Kassam/Mª Paz Sacristán. Declaración Conflicto de Intereses de los autores: Ver declaración en anexo al final del informe. 2.- SOLICITUD Y DATOS DEL PROCESO DE EVALUACIÓN Facultativo que efectuó la solicitud: Ana García. Servicio: Oftalmología II. Justificación de la solicitud: Las alternativas terapéuticas existentes, verteporfina (incluído en la Guía Farmacoterapéutica (GFT) del Hospital) y pegaptanib (no incluido en la GFT) consiguen enlentecer la progresión de la enfermedad pero apenas logran que se recupere la agudeza visual en un porcentaje muy pequeño de los pacientes. Fecha recepción de la solicitud:27/06/2007. Petición a título: Individual. Tiene el visto bueno del Jefe de Servicio. 3.- AREA DESCRIPTIVA DEL MEDICAMENTO Nombre genérico: Ranibizumab. Nombre comercial: Lucentis. Laboratorio: Novartis Farmacéutica. Grupo terapéutico. Denominación: Otros Oftalmológicos Vía de administración: Intravítrea. Tipo de dispensación: Uso Hospitalario. Vía de registro: FDA y EMEA. Código ATC: S01LA04 Presentaciones y precio Forma farmacéutica y dosis Envase Código Coste por unidad PVL con IVA Euros ( ) Viales 3 mg/ 0.3 ml 1 unidad AREA DE ACCIÓN FARMACOLÓGICA 4.1 Mecanismo de acción Ranibizumab es un fragmento de un anticuerpo monoclonal recombinante humanizado dirigido contra el factor de crecimiento endotelial vascular A (VEGF-A) humano. Se une con alta afinidad a las isoformas del VEGF-A impidiendo la unión de este a sus receptores VEGFR-1 y VEGFR-2. Esta unión conduciría a la proliferación de las células endoteliales y a la neovascularización, así como a la exudación vascular, todo lo cual se cree contribuye a la progresión de la forma neovascular de la degeneración macular asociada a la edad. 1
2 4.2 Indicaciones clínicas formalmente aprobadas y fecha de aprobación AEMyPS, EMEA y FDA: Degeneración macular asociada a la edad neovascular (exudativa). 4.3.Posología, forma de preparación y administración (8) La dosis recomendada es 0.5 mg (0.05 ml). El tratamiento se inicia con una dosis de carga, que consiste en una vez al mes durante tres meses consecutivos, seguida de una fase de mantenimiento en la cual se deberá controlar la agudeza visual de los pacientes mensualmente. Si el paciente experimenta una pérdida de agudeza visual superior a 5 letras (ETDRS o equivalente a una línea Snellen), se le deberá administrar ranibizumab. El intervalo entre dos dosis no debe ser inferior a 1 mes. 4.3 Farmacocinética (8) Tras la administración intravítrea mensual de Lucentis a pacientes con degeneración macular asociada a la edad (DMAE) neovascular las concentraciones séricas de ranibizumab fueron en general bajas con niveles máximos (C max ) por debajo de la concentración de ranibizumab necesaria para inhibir la actividad biológica del VEGF en un 50% (11-27 ng/ml, valorado en un ensayo de proliferación in vitro). La C max fue proporcional a la dosis, en el rango de dosis administrada mg/ojo. 4.5 Características comparadas con otros medicamentos con la misma indicación disponibles en el Hospital Características comparadas con otros medicamentos similares NOMBRE RANIBIZUMAB PEGAPTANIB VERTEPORFINA BEVACIZUMAB Presentación Viales 3 mg/ 0.3 ml Jeringa precargada 0.3 Viales de 15 mg Fórmula Magistral intravítreo mg intravítreo intravenosos Posología Mensual durante 3 meses (Reevaluar mensualmente, máximo 12 inyecciones anuales) Cada 6 semanas (9 inyecciones al año) 1 administración y reevaluar cada 3 meses (máximo 4 inyecciones anuales) Mensual durante 3 meses (Reevaluar mensualmente, máximo 12 inyecciones Características diferenciales DMAE neovascular (exudativa) DMAE neovascular (exudativa). DMAE neovascular (exudativa). Neovascularización coroidea (NVC) subfoveal predominantemente clásica o secundaria a miopía patológica. anuales) Hasta Junio de 2007 autorizado por el Ministerio de Sanidad por Uso Compasivo para DMAE Estructura Mecanismo acción Fragmento de anticuerpo monoclonal humanizado bevacizumab Oligonucleótido modificado y pegilado Derivado monoácido de la benzoporfirina Anticuerpo monoclonal humanizado Antiangiogénico Antiangiogénico Terapia fotodinámica Antiangiogénico 2
3 5.- EVALUACIÓN DE LA EFICACIA 5.2.a Resultados de los ensayos clínicos Eficacia clínica de ranibizumab en monoterapia. Tabla 1. Estudio MARINA. 1) -Nº de pacientes: 716 -Diseño: Fase III, randomizado, doble ciego controlado frente a inyección intravítrea de tratamiento simulado (TS) -Tratamiento grupo activo y tratamiento grupo control: inyecciones intravítreas mensuales de ranibizumab 0.3 mg, 0.5 mg o TS durante 24 meses -Criterios de inclusión: pacientes 50 años, agudeza visual de 20/40 a 20/320 con NVC mínimamente clásica u oculta sin componente clásico. Tamaño de lesión máximo de 2.54 mm 2, la neovascularización tenía que ocupar>50%. Enfermedad activa por presencia de sangre visible o pérdida de visión reciente -Criterios de exclusión: Tratamientos previos para la DMAE (la terapia fotodinámica se permitía en si se había realizado en el ojo no tratado >1 semana antes de iniciar el estudio). Tratamiento de cualquier tipo en el ojo de estudio (excepto fotocoagulación extrafoveal por láser). Pacientes con alteraciones que pudieran tener impacto sobre la visión (retinopatía diabética, glaucoma sin controlar, uveítis...) -Pérdidas: <10% en los grupos de tratamiento a los doce meses. -Tipo de análisis: por intención de tratar. Resultados Variable evaluada en el TS Ranibizumab 0.3 mg estudio a los 12 meses N (238) N (238) Variable principal: -Proporción de pacientes que 62.2% (148) 94.5% (225) mantienen la visión (pérdida de menos de 15 letras de agudeza visual (AV). Tabla ETDRS distancia 2 m. p valor vs control Variables secundarias de interés: -Cambio medio de la agudeza (16.6) 6.5 (12.7) visual respecto al valor basal (letras). -Proporción de pacientes que ganaban al menos 15 letras en 4.6% (11) 24.8% (59) la agudeza visual respecto al basal. IC 95% (2.0%, 7.3%) (19.3%, 30.3%) P valor vs control -Proporción de pacientes con 42.9%(102) 12.2%(29%) una agudeza visual Snellen de 20/200 o peor. Ranibizumab 0.5 mg N (240) 94.6% (227) 7.2 (14.4) 33.8% (81) (17.8%, 39.7%) 11.7%(28) Los pacientes incluidos en el estudio debían tener las características para ser tratados con verteporfina. 1 Early Treatment Diabet Retinopathy Study Se permitió terapia fotodinámica con verteporfina si la NVC del ojo estudiado pasaba a ser predominantemente clásica (única indicación por la FDA de la veteporfina). Durante el periodo de tratamiento de 2 años, 38 (16%) pacientes del grupo de inyecciones simuladas, 2 pacientes (0.8%) del grupo tratado con 0.3 mg de ranibizumab y ninguno del grupo de 0.5 mg de ranibizumab recibieron terapia fotodinámica con verteporfina al menos una vez. La mejora de la agudeza visual asociada a ranibizumab era independiente del tamaño de la lesión en la situación basal, del tipo de lesión y de la agudeza visual basal. La ganancia en la agudeza visual se mantuvo al cabo de 24 meses en ambos grupos de ranibizumab, mientras que los pacientes con tratamiento simulado continuaban perdiendo agudeza visual pero de una forma menos pronunciada que durante el primer año. En un análisis por subgrupos del estudio MARINA (3) indica que el tratamiento con ranibizumab produce un incremento medio en la AV en todos los subgrupos evaluados: edad, género, tipo de NVC (mínimamente clásica u oculta sin componente clásico), agudeza visual basal, tamaño de la lesión y duración de la DMAE. Los predictores más importantes de mejora de agudeza visual fueron en orden decreciente de importancia, AV, NVC, tamaño de la lesión y la edad. 3
4 Eficacia clínica de ranibizumab en combinación con terapia fotodinámica (TFD) con verteporfina. Tabla 2. Estudio FOCUS (2) -Nº de pacientes: 162 -Diseño: Fase I/II, simple ciego, multicéntrico. -Tratamiento grupo activo y tratamiento grupo control: ranibizumab 0.5 mg +verteporfina o TS + verteporfina -Criterios de inclusión: Pacientes 50 años, con NVC predominantemente clásica, AV 20/40 a 20/320 Snellen, tamaño de la lesión no superior a 5400 µm. -Criterios de exclusión: Tratamiento con verteporfina en los tres meses previos o del ojo no tratado en los 7 días previos, o más de 3 tratamientos con verteporfina en los 12 meses previos. Pacientes previamente incluidos en otros ensayos con fármacos antiangiogénicos en cualquier ojo. -Tipo de análisis: por intención de tratar. Resultados Variable evaluada en el estudio a los 12 meses TFD N (56) Ranibizumab+TFD N (106) Variable principal: -Proporción de pacientes que mantenían la visión (pérdida de menos de 15 letras de agudeza visual al cabo de 12 meses respecto al inicio). Test ETDRS distancia 2 m. Variables secundarias de interés: -Proporción de pacientes que ganaban al menos 15 letras en la agudeza visual respecto al basal. -Número medio de letras±desviación estándar (SD) ganadas respecto al valor basal. 38% (67.9) 95% (90.5) 3% (5.4) -8± % (23.8) ±14.7 < Proporción de pacientes que hayan perdido 30 letras o más respecto al valor basal -Agudeza visual 20/200 o peor -Área CNV±SD especto al valor basal -repetición de tratamiento con PDT % (8.9) 26% (46.4) +1.3±2 51% (91.1) 11% (19.6) 12% (21.4) 11% (19.6) 17% (30.4) 1% (1) % (29.5) ±1.5 < % (27.6) < % (24.8) 2% (1.9) 0 1% (1) Todos los pacientes recibían verteporfina en el día 0 y en el día +7 se practicaba TS o la administración de ranibizumab. Hasta un total de 24 inyecciones en dos años. La administración mensual de ranibizumab conjuntamente con verteporfina a los doce meses de tratamiento se muestra superior a la administración verteporfina en monoterapia tanto en la variable principal de eficacia como en las secundarias. Los efectos adversos se produjeron en más de un 10% de los ojos estudiados, más frecuentes en el grupo de ranibizumab+verteporfina, probablemente por la técnica de inyección intravítrea. La inflamación intraocular se produjo en más de un tercio de los pacientes que recibieron tratamiento combinado. La administración de ranibizumab reduce la necesidad de repetir la terapia fotodinámica, pasando de un 51% en el grupo control a un 28% en el grupo de ranibizumab. 4
5 Tabla 3. Estudio ANCHOR (4) : -Nº de pacientes: 423 -Diseño: Fase III, randomizado, doble ciego controlado frente a tratamiento activo. -Tratamiento grupo activo y tratamiento grupo control: ranibizumab 0.3 mg, 0.5 mg y TFD simulada vs terapia TFD activa o TS. -Criterios de inclusión: Pacientes 50 años con lesiones de NVC predominantemente clásicas, AV 20/40 a 20/320 Snellen, lesión no superior a 5400 µm en la mayor dirección lineal. -Criterios de exclusión: Tratamientos previos para la DMAE (la terapia fotodinámica se permitía en el ojo no tratado >1 semana antes de iniciar el estudio). Tratamiento de cualquier tipo en el ojo de estudio (excepto fotocoagulación extrafoeveal por láser). -Pérdidas: -Tipo de análisis: por intención de tratar. Resultados Variable evaluada en el Verteporfina TFD Ranibizumab 0.3 mg estudio a los 12 meses N (143) N (140) Resultado principal -Proporción de pacientes que 64.3% (92) 94.3% (132) mantenían la visión (pérdida de menos de 15 letras de agudeza). Test ETDRS distancia 2 m. Valor Variables secundarios de interés -Cambio medio de la agudeza -9.5 (16.4) 8.5 (14.6) visual respecto al valor basal. -Proporción de pacientes que ganaban al menos 15 letras en la agudeza visual respecto al 5.6% (8) 35.7% (50) basal. IC 95% Valor (1.8%, 9.4%) (27.8%, 43.7%) -Proporción de pacientes con una agudeza visual Snellen de 60.1% (86) 31 (22.1%) 20/200 o pero a los 12 meses Ranibizumab 0.5 mg N (140) 96.4% (134) 11.3 (14.36) 40.3% (56) (32.1%, 48.4%) 16.4% (23) El estudio ANCHOR no se ha diseñado para evaluar la superioridad de una dosis sobre otra de ranibizumab pero los resultados de eficacia sugieren un efecto dosis dependiente. Se han desarrollado estudios para reducir la frecuencia de las inyecciones intravítreas de ranibizumab después de la dosis de carga. Estudios PIER y PrONTO. 5
6 (6), (7) Tabla 4. Estudio PIER -Nº de pacientes:184 -Diseño: Fase IIIb, randomizado, doble ciego controlado frente a TS -Tratamiento grupo activo y tratamiento grupo control: ranibizumab 0.3 mg y 0.5 mg vs TS, mensualmente durante tres meses y luego trimestralmente. -Criterios de inclusión: Pacientes con todo tipo de lesiones de NVC. -Tipo de análisis: por intención de tratar. Resultados Variable evaluada en el estudio A los 12 meses TS N (63) ranibizumab 0.3 mg N (60) Variable principal -Cambio medio en la AV respecto a la basal (letras) Valor P vs control < Variables secundarias de interés -Proporción de pacientes que 31 (49.2%) 50 (83.3%) perdían menos de 15 letras en la agudeza visual respecto al basal a los doce meses. Test ETDRS distancia de 4 m. IC 95% (36.9%, 61.6%) (73.9%, 92.8%) Valor P vs control -Proporción de pacientes que 7(11.7%) ganaban al menos 15 letras en la agudeza visual respecto al basal a los doce meses. IC 95% 6 (9.5%) 3.5%,19.8%) Valor P vs control (2.3%, 16.8%) N.S -Proporción de pacientes con una agudeza visual Snellen de 20/200 o peor a los 12 meses 33 (52.4%) 14 (23.3%) IC 95% (40%, 64.7%) (12.6%, 34%) Valor P vs control ranibizumab 0.5 mg N (61) 4.3 < (90.2%) (82.7%, 97.6) 8 (13.1%) (4.6%, 21.6%) N.S 15 (24.6%) (13.8%, 35.4%) N.S. NO significativo Los pacientes tratados con ranibizumab en el ensayo PIER recibieron un promedio de 6 inyecciones desde el día 0 hasta el mes 12. En general tras un incremento inicial de la AV (después de la dosificación mensual), los pacientes con una dosis de ranibizumab cada tres meses perdieron agudeza visual volviendo al valor basal al mes 12. En el ensayo PIER, el 90% de los pacientes tratados con ranibizumab mantuvieron su agudeza basal en el mes 12. 6
7 Tabla 5. Estudio PrONTO (5) -Nº de pacientes: 40 -Diseño: Abierto, prospectivo, no randomizado, unicéntrico -Tratamiento: ranibizumab 0.5 mg tres dosis mensuales consecutivas y posteriormente se retrataba o no en función de los criterios: Pérdida de visión 5 letras asociada a la presencia de fluido detectado por OCT, Incremento del espesor de la membrana retiniana en más de 100 µm, Inicio de nueva hemorragia, Nueva NVC clásica. Persistencia de líquido en la mácula. -Criterios de inclusión: Edad superior a 5 años, activa primaria o recurrente NVC, grosor de la retina central >300 µm por Tomografía de coherencia óptica (OTC), AV 20/40 a 20/400 Snellen en el ojo de estudio. -Criterios de exclusión: tratamientos previos con verteporfina superior a 3, participación previa en un ensayo clínico con fármacos antiangiogénicos, fotocoagulación con láser previa. Resultados Variable evaluada en el estudio Variable principal a los 12 meses: -Cambio en la AV respecto a la basal (letras). p -Medidas de Tomografía de coherencia óptica (OTC). p -Inyecciones requeridas a lo largo de dos años. 9.3 < < ±2.3 Una reducción en el número de inyecciones reduciría el riesgo relacionado con la inyección. La causa más frecuente de reinyección fue la pérdida de visión de más de 5 letras. Dos de los criterios no precisaban Tomografía de coherencia óptica (OTC): inicio de nueva hemorragia y la aparición de una nueva NVC clásica. 20 de las 102 reinyecciones se produjeron por una nueva hemorragia o por NVC clásica sóla o combinación. La media de inyecciones para el primer año fue de 5.6±2.3 inyecciones y la mediana 5. Después de las primeras tres inyecciones 7 pacientes no necesitaron ninguna inyección adicional a lo largo de los doce meses de estudio. 5.2.b Evaluación de la validez y de la utilidad práctica de los resultados En el estudio MARINA la agudeza visual era ligeramente mejor y las dimensiones de CNV ligeramente más pequeñas en los brazos de ranibizumab. En el estudio PIER el brazo de ranibizumab contiene más pacientes con lesiones ocultas que en el brazo control (48-49% vs 32%). Las limitaciones del estudio FOCUS es el relativo número bajo de la muestra, la ausencia de un grupo control de tratamiento con ranibizumab y el enmascaramientio simple ciego. El estudio ANCHOR dilucida mejor estos aspectos. La variable principal del estudio ANCHOR fue probar la no inferioridad de ranibizumab frente a verteporfina, posteriormente si estos se demostraba las diferencias eran evaluadas para probar la superioridad. Todavía no se han publicado los resultados finales del estudio PIER sólo se tiene acceso a resultados preliminares, pero se ha visto que la inyección trimestral no permite mantener la mejoría de la AV. En el estudio PrONTO el número de pacientes incluidos fue muy reducido (40 pacientes) y de características más heterogéneas que los incluidos en los estudios MARINA y ANCHOR. Además los estudios PIVOTALES se basaban en la angiografía el lugar de OTC (tomografía de coherencia óptica) como prueba diagnóstica y no se permitía tratamiento previos en el ojo estudiado. Todo ello limita la extrapolación de los resultados del estudio PIER en cuanto al frecuencia de administración. Será necesario un ensayo de comparación directa para poder concluir de manera inequívoca que una pauta de dosis variables bajo guía OTC es igual de favorable que una pauta de dosis mensuales fijas, pero es improbable que llegue ha realizarse ya que el fármaco ya se ha comercializado y un estudio actualmente en curso (SAILOR, fase 7
8 IIIb), con más de 2000 pacientes, utiliza una pauta de dosis variable en un diseño abierto, similar a la pauta establecida en el estudio PrRONTO. Los resultados del estudio PrONTO sugieren que la OTC puede ser útil como guía para la repetición del tratamiento con ranibizumab intravítreo en la DMAE y que esta guía de OCT debiera reducir la carga de inyecciones sin sacrificar las mejoras en la agudeza visual. 6. EVALUACIÓN DE LA SEGURIDAD 6.1. Descripción de los efectos adversos más significativos (por su frecuencia o gravedad) Los efectos adversos oculares que se produjeron en 10% de los pacientes incluidos en los estudios pivotales MARINA y ANCHOR en los 12 primeros meses están recogidos en la Tabla 6. Efectos oculares Tabla 6 Resultados de seguridad adversos TS n=236 MARINA 0.3 mg ranibizumab n= mg ranibizumab n=239 Verteporfina n=143 ANCHOR 0.3 mg ranibizumab n= mg ranibizumab n=140 Todos los efectos adversos Blefaritis CNV Hemorragia conjuntival Desgarro de pigmento retiniano Irritación ocular Dolor ocular Picor ocular Sensación cuerpo extraño Incremento presión intraocular Incremento de lacrimeo Degeneración macular Alteraciones en la retina Hemorragia retiniana Fribrosis subretiniana Reducción AV Desprendimiento del vítreo Partículas flotantes en el vítreo Inflamación intraocular 229 (97.0%) 14 (5.9%) 27 (11.4%) 139 (58.9%) 30 (12.7%) 43 (18.2%) 57 (4.2) 20 (8.5%) 27 (11.4%) 7(3.0%) 30 (12.7%) 125 (53%) 15 (6.4%) 101 (42.8%) 24 (10.2%) 23 (9.7%) 30 (12.7%) 14 (5.9%) 23 (9.7%) 233 (97.9%) 16 (6.7%) 2 (0.8%) 169 (71.0%) 24 (10.1%) 34 (14.3%) 77 (32.4%) 18 (7.6%) 41 (17.2%) 38 (16%) 32 (13.4%) 88 (37%) 20 (8.4%) 46 (19.3%) 18 (7.6%) 15 (6.3%) 39 (16.4%) 59 (24.8%) 26 (10.9%) 233 (97.5%) 26 (10.9%) 3 (1.3%) 168 (70.3%) 17 (7.1%) 36 (15.1%) 71 (29.7%) 27 (11.3%) 39 (16.3%) 9 (16.3%) 27 (11.3%) 86 (36%) 26 (10.9%) 40 (16.7%) 10 (4.2%) 16 (6.7%) 40 (16.7%) 53 (22.2%) 34 (14.2%) 138 (96.5%) 6 (4.2%) 14 (9.8%) 65 (45.5%) 5 (3.5%) 8 (5.6%) 24 (16.8%) 7 (4.9%) 15 (10.5%) 10 (7.0%) 6 (4.2%) 89 (62.2%) 2 (1.4%) 76 (53.1%) 27 (18.9%) 21 (14.7%) 26 (18.2%) 6 (4.2%) 4 (2.8%) 129 (94.2%) 6 (4.4%) 2 (1.5%) 92 (67.2%) 2 (1.5%) 6 (4.4%) 33 (24.1%) 10 (7.3%) 8 (5.8%) 21 (15.3%) 9 (6.6%) 50 (36.5%) 8 (5.8%) 20(14.6%) 15 (10.9%) 10 (7.3%) 21 (15.3%) 16 (11.7%) 10 (10.2%) 132 (94.3%) 7 (5.0%) 5 (3.6%) 87 (62.1%) 5 (3.6%) 14 (10.0%) 34 (24.3%) 12 (8.6%9 10 (7.1%) 22 (15.7%) 8 (5.7%) 50 (35.7%) 7 (5.0%) 26 (18.6%) 18 (12.9%) 5 (3.6%) 19 (13.6%) 25 (17.9%) 21 (15%) Los efectos adversos graves relacionados con el procedimiento de inyección y que ocurrieron en menos de 0.1%, incluyeron endoftalmitis, desprendimiento de retina regmatógeno, desgarro retiniano y catarata traumática iatrogénica. La disponibilidad sistémica de inhibidores de VEGF (factor del crecimiento vascular endotelial) muy potentes se ha relacionado con acontecimientos tromboembólicos arteriales, según define la Antiplatelet Trialist s Collaboration, que incluye muertes vasculares, infartos de miocardio no mortales y accidentes cerebrovasculares hemorrágicos no mortales. Cuando se combinaron los datos del primer año de los tres ensayos (MARINA, ANCHOR y PIER), la incidencia global de acontecimientos tromboembólicos arteriales fue mayor para los pacientes tratados con ranibizumab 0.5 mg (2.5%) en comparación con el brazo control (1.1%). Sin embargo en el segundo año del ensayo MARINA, el índice de acontecimientos tromboembólicos arteriales fue similar en los pacientes tratado con ranibizumab 0.5 mg (2.6%) comparado con los pacientes incluidos en el brazo control (3.2%). 8
9 El estudio SAILOR de fase IIIb se inició en noviembre de 2005 y se está realizando en más de 100 centros de Estados Unidos. Compara la seguridad del fármaco entre dosis de 0,5 mg y 0,3 mg, en una subcohorte de pacientes Se vio un aumento de incidencia de ictus en pacientes a quienes se les administró una inyección intravítrea de ranibizumab (Lucentis) de 0,5 mg, en un ensayo clínico. Los investigadores hallaron una incidencia de 1,2% de ictus en pacientes que recibieron dosis de 0,5 mg de ranibizumab, en comparación del 0,3% que se dio en el caso de dosis de 0,3 mg. La versión comercial del fármaco es de una dosis de 0,5%. Respecto a los incidentes de infarto de miocardio y muerte vascular no fueron estadísticamente significativos entre ambas dosis. Los pacientes con historial de ictus mostraron un alto riesgo de un nuevo accidente cerebrovascular. Los pacientes recibieron ranibizumab durante una media de 230 días antes de que se realizase el análisis Precauciones de empleo en casos especiales -Precauciones: La administración de ranibizumab puede producir alteraciones visuales transitorias que pueden afectar a la capacidad de conducir o utilizar máquinas. 7. AREA ECONÓMICA 7.1-Coste tratamiento/día y coste del tratamiento completo. Coste incremental. Comparación con la terapia de referencia o alternativa a dosis usuales. Comparación de costes del tratamiento evaluado frente a otra/s alternativa/s medicamento Lucentis (Ranibizumab) Vial 3 mg Visudyne (Verteporfina) Vial 15 mg Macugen (Pegaptanib) Jeringa precargada 0.3 mg Precio unitario (PVL+IVA) Posología (dosis año) Coste tratamiento año Coste incremental (diferencial) respecto a otras terapias disponibles F.M.: Fórmula magistral Avastín (Bevacizumab) F.M mg 7.3. Estimación del número de pacientes/año candidatos al tratamiento en el hospital, coste estimado anual y unidades de eficacia anuales. Medicamento Coste incremental por paciente Impacto economico anual comparador Visudyne Avastin F.M Desde el Servicio de Oftalmología II se ha hecho la estimación de que anualmente serán tratados en nuestro hospital un total de 120 pacientes con ranibizumab ( /año), lo que representaría aproximadamente el 5% del gasto farmacéutico total en el HUCA. Coste anual adicional para el hospital: considerando tratamiento de referencia verteporfina y respecto a bevacizumab. 8.- AREA DE CONCLUSIONES 8.1 Resumen de los aspectos más significativos y propuesta. Ranibizumab es un fragmento del anticuerpo monoclonal recombinante humanizado bevacizumab dirigido contra el factor de crecimiento del endotelio vascular, evitando la neovascularización. 9
10 Presenta beneficios clínica y estadísticamente significativos con respecto a la agudeza visual y a las lesiones angiográficas a los 2 años de administración mensual (MARINA y ANCHOR). La administración trimestral tras la dosis de carga (estudio PIER) detiene la progresión de la lesión pero no mantiene la mejoría de la agudeza visual, los estudios realizados (PrONTO) o que se están realizando (SAILOR) para reducir la frecuencia de administración y así efectos adversos tienen limitaciones en su diseño que dificulta la extrapolación. Ranibizumab viene a sustituir a bevacizumab que era utilizado en nuestro Centro previa solicitud de utilización por uso compasivo. Tras la comercialización de ranibizumab el Ministerio de Sanidad ha denegado estos usos compasivos que había venido autorizando coexistiendo con pegaptanib. Lo que más interesaría sería realizar un estudio comparativo entre bevacizumab y ranibizumab, para aclarar el tratamiento óptimo. Se continuará utilizando bevacizumab en aquellos pacientes que tengan autorizado el uso compasivo. Para todos usos fuera de indicación y que se solicite tratamiento antiangiogénicos se solicitará uso compasivo de bevacizumab (<50 años, oclusión retiniana, secundaria a miopía patológica...). La dispensación se realizará de forma individualizada por paciente en el impreso que se adjunta. En el HUCA sólo se administrará ranibizumab a aquellos pacientes que pertenezcan al área IV de Salud del Principado de Asturias, quedando excluidas otras procedencias. 8.2 Lugar en terapéutica. Condiciones de uso en el hospital. Aplicación de los datos y conclusiones al hospital. Lugar en terapéutica: DAME neovascular exudativa. Mejora la agudeza visual. Condiciones de uso: en las solicitudes el diagnóstico debe estar plenamente confirmado por pruebas diagnósticas (angiografía u OTC). El Servicio de Oftalmología II ha presentado un protocolo de utilización de ranibizumab en el que se presenta como tratamiento en primera línea de la DAME, para el resto de membranas neovasculares, edema macular diabético y otras patologías que requieran tratamiento antiangiogénico y estén fuera de indicación se solicitará uso compasivo de avastin. Método de seguimiento de las condiciones de uso: Impreso especial, dispensación individualizada por paciente. 8.3 Indicaciones y servicios aprobados. Oftalmología II 8.4 Especificar si la inclusión del fármaco va acompañada con la propuesta de retirada de algún otro fármaco. No procede es un tratamiento a añadir no sustitutorio. 9.- BIBLIOGRAFÍA 1) Rosenfeld PJ, Brown DM, Heier JS, et al. N Engl J Med Oct 5;355(14): ) Heier JS, Antoszyk AN, Pavan PR, et al. Arch Opkthalmol Nov;124(11): ) Boyer DS, Antoszyk AN, Awn CC et al. Ophthalmology Feb;114(2): ) Brown DM, Kaiser PK, Michels M, et al. N Engl J Med 2006 Oct 5;355(14): ) Fung AE, et al. Am J Ophthalmol 2007 Apr;143(4): ) Informe EPAR de l a EMEA ranibizumab. en6.pdf 7) Preliminary results from a Phase IIIb study showed patients with wet AND treated with Lucentis quarterly experienced a 16-letter benefit over the control group at one year. [press release]. South San Francisco, California: Genentech; June 2, Available at: Method=detail&id=9747.Acceses Date. August 7, ) Ficha técnica de Lucentis. 10
11 EVALUACIÓN: Conclusiones finales Nota: cumplimentar después de finalizar el informe de evaluación Fecha de evaluación por la CFyT: 26/09/2007 Fecha de notificación: xx/ xx/xx Decisión adoptada por la CFyT : En caso de condiciones de uso o restricciones, indicar: 11
12 ANEXO APARTADO 1 del informe modelo completo DECLARACIÓN DE CONFLICTO DE INTERESES DE LOS AUTORES/REVISORES DE LA EVALUACIÓN Los autores/revisores de este informe, Lucía Velasco, Miguel Al-Kassam y Maria Paz Sacristán declaran: -No tener ningún contrato con las compañías farmacéuticas que tienen registrado el medicamento que se evalúa, ni tampoco con los laboratorios que compiten comercialmente con el mismo. -No beneficiarse de ninguna beca o ayuda por parte de dichas compañías. -No tener ninguna otra relación personal, comercial o profesional que pueda influir en la valoración objetiva y científica del medicamento 12
deterioro de la visión causado por un edema macular provocado por la diabetes;
 EMA/677928/2015 EMA/H/C/002392 Resumen del EPAR para el público general aflibercept El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo el Comité de Medicamentos
EMA/677928/2015 EMA/H/C/002392 Resumen del EPAR para el público general aflibercept El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo el Comité de Medicamentos
INFORME TÉCNICO UTILIZACIÓN DE FÁRMACOS INHIBIDORES DEL FACTOR DE CRECIMIENTO DEL ENDOTELIO VASCULAR POR VÍA INTRAVÍTREA
 INFORME TÉCNICO UTILIZACIÓN DE FÁRMACOS INHIBIDORES DEL FACTOR DE CRECIMIENTO DEL ENDOTELIO VASCULAR POR VÍA INTRAVÍTREA 2012 UTILIZACIÓN DE FÁRMACOS INHIBIDORES DEL FACTOR DE CRECIMIENTO DEL ENDOTELIO
INFORME TÉCNICO UTILIZACIÓN DE FÁRMACOS INHIBIDORES DEL FACTOR DE CRECIMIENTO DEL ENDOTELIO VASCULAR POR VÍA INTRAVÍTREA 2012 UTILIZACIÓN DE FÁRMACOS INHIBIDORES DEL FACTOR DE CRECIMIENTO DEL ENDOTELIO
INFORME TECNICO PARA LA EVALUACION DE LOS MEDICAMENTOS
 INFORME TECNICO PARA LA EVALUACION DE LOS MEDICAMENTOS INTRODUCCIÓN La selección de medicamentos es un proceso por el cual se elige, entre todos los fármacos comercializados, aquellos que, por presentar
INFORME TECNICO PARA LA EVALUACION DE LOS MEDICAMENTOS INTRODUCCIÓN La selección de medicamentos es un proceso por el cual se elige, entre todos los fármacos comercializados, aquellos que, por presentar
Analizan los beneficios vasculares
 Analizan los beneficios vasculares Artículo: La terapia con estatinas reduce el riesgo de presentar eventos vasculares graves, sin importar la concentración basal de proteína C reactiva que presente el
Analizan los beneficios vasculares Artículo: La terapia con estatinas reduce el riesgo de presentar eventos vasculares graves, sin importar la concentración basal de proteína C reactiva que presente el
Importancia de la investigación clínica EN ONCOLOGÍA. ONCOvida. oncovida_20.indd 1 10/10/11 12:53
 Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos
 Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
COMISION DE FARMACIA Y TERAPÉUTICA Hospital Son Dureta Palma de Mallorca. Normas de funcionamiento Texto definitivo Aprobado 1-12-99
 COMISION DE FARMACIA Y TERAPÉUTICA Hospital Son Dureta Palma de Mallorca Normas de funcionamiento Texto definitivo Aprobado 1-12-99 A. Descripción y organización interna 1-FUNCIONES DE LA COMISIÓN DE FARMACIA
COMISION DE FARMACIA Y TERAPÉUTICA Hospital Son Dureta Palma de Mallorca Normas de funcionamiento Texto definitivo Aprobado 1-12-99 A. Descripción y organización interna 1-FUNCIONES DE LA COMISIÓN DE FARMACIA
MONOGRAFÍA DE PRODUCTO
 MONOGRAFÍA DE PRODUCTO UNA NUEVA MIRADA EN OFTALMOLOGÍA CONTENIDOS I. resumen ejecutivo 04 II. fundamentos 08 A) Información general sobre la enfermedad DMAE húmeda 09 A) El peso de la enfermedad (ceguera,
MONOGRAFÍA DE PRODUCTO UNA NUEVA MIRADA EN OFTALMOLOGÍA CONTENIDOS I. resumen ejecutivo 04 II. fundamentos 08 A) Información general sobre la enfermedad DMAE húmeda 09 A) El peso de la enfermedad (ceguera,
MINISTERIO DE SANIDAD, SERVICIOS SOCIALES E IGUALDAD DIRECCIÓN GENERAL DE CARTERA BÁSICA DE SERVICIOS DEL SISTEMA NACIONAL DE SALUD Y FARMACIA
 MINISTERIO DE SANIDAD, SERVICIOS SOCIALES E IGUALDAD DIRECCIÓN GENERAL DE CARTERA BÁSICA DE SERVICIOS DEL SISTEMA NACIONAL DE SALUD Y FARMACIA SUBDIRECCIÓN GENERAL DE CARTERA BÁSICA DE SERVICIOS DEL SISTEMA
MINISTERIO DE SANIDAD, SERVICIOS SOCIALES E IGUALDAD DIRECCIÓN GENERAL DE CARTERA BÁSICA DE SERVICIOS DEL SISTEMA NACIONAL DE SALUD Y FARMACIA SUBDIRECCIÓN GENERAL DE CARTERA BÁSICA DE SERVICIOS DEL SISTEMA
X-Plain Glaucoma Sumario
 X-Plain Glaucoma Sumario El glaucoma es un grupo de enfermedades que afectan al ojo y que pueden llevar a la ceguera si no se recibe tratamiento adecuado. El glaucoma de ángulo abierto, la forma de glaucoma
X-Plain Glaucoma Sumario El glaucoma es un grupo de enfermedades que afectan al ojo y que pueden llevar a la ceguera si no se recibe tratamiento adecuado. El glaucoma de ángulo abierto, la forma de glaucoma
NORMA INTERNACIONAL DE INFORMACIÓN FINANCIERA Nº 5 (NIIF 5) Activos no corrientes mantenidos para la venta y actividades interrumpidas
 NORMA INTERNACIONAL DE INFORMACIÓN FINANCIERA Nº 5 () Activos no corrientes mantenidos para la venta y actividades interrumpidas SUMARIO Párrafos OBJETIVO 1 ALCANCE 2-5 CLASIFICACIÓN DE ACTIVOS NO CORRIENTES
NORMA INTERNACIONAL DE INFORMACIÓN FINANCIERA Nº 5 () Activos no corrientes mantenidos para la venta y actividades interrumpidas SUMARIO Párrafos OBJETIVO 1 ALCANCE 2-5 CLASIFICACIÓN DE ACTIVOS NO CORRIENTES
Anexo II. Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA
 Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
PROCEDIMIENTO OPERATIVO INVESTIGACION DE ACCIDENTES Y ESTADISTICA DE SINIESTRALIDAD DPMPO09
 Página: 1 PROCEDIMIENTO OPERATIVO ESTADISTICA DE SINIESTRALIDAD Página: 2 Edición Motivo cambio Firma Fecha 0 Edición Inicial 6.05.2002 Página: 3 I N D I C E 1. OBJETO 4 2. AMBITO DE APLICACIÓN 4 3. NORMATIVA
Página: 1 PROCEDIMIENTO OPERATIVO ESTADISTICA DE SINIESTRALIDAD Página: 2 Edición Motivo cambio Firma Fecha 0 Edición Inicial 6.05.2002 Página: 3 I N D I C E 1. OBJETO 4 2. AMBITO DE APLICACIÓN 4 3. NORMATIVA
Tras completar el programa completo de ensayo clínico Fase III, BIL ha mostrado resultados superiores en la reducción de HbA1c frente a comparadores
 Eli Lilly and Company Lilly Corporate Center Indianapolis, Indiana 46285 U.S.A. Fecha: 23 de septiembre, 2014 Peglispro, la insulina basal de Lilly, demuestra superioridad en la reducción de los niveles
Eli Lilly and Company Lilly Corporate Center Indianapolis, Indiana 46285 U.S.A. Fecha: 23 de septiembre, 2014 Peglispro, la insulina basal de Lilly, demuestra superioridad en la reducción de los niveles
La degeneración macular asociada a la edad es la causa más común de ceguera legal en personas de más de 50 años en los países occidentales.
 Qué es DMAE? La degeneración macular asociada a la edad es la causa más común de ceguera legal en personas de más de 50 años en los países occidentales. La DMAE es una enfermedad ocular degenerativa que
Qué es DMAE? La degeneración macular asociada a la edad es la causa más común de ceguera legal en personas de más de 50 años en los países occidentales. La DMAE es una enfermedad ocular degenerativa que
DG de Farmacia y Productos Sanitarios PAISE
 Plan de Gestión riesgos para la administración de fármacos antiangiogénicos en la degeneración macular asociada a la edad, edema macular diabético, edema macular secundario a la oclusión de la vena retiniana,
Plan de Gestión riesgos para la administración de fármacos antiangiogénicos en la degeneración macular asociada a la edad, edema macular diabético, edema macular secundario a la oclusión de la vena retiniana,
retinopatía diabética un vistazo a fondo
 2011-2012 retinopatía diabética un vistazo a fondo La diabetes puede afectar la vista Si usted tiene diabetes mellitus, su cuerpo no utiliza ni almacena el azúcar de forma apropiada. El alto nivel de azúcar
2011-2012 retinopatía diabética un vistazo a fondo La diabetes puede afectar la vista Si usted tiene diabetes mellitus, su cuerpo no utiliza ni almacena el azúcar de forma apropiada. El alto nivel de azúcar
5. ACCIONES ANTE LA NOTIFICACIÓN DE CASOS DE LEGIONELOSIS
 5. ACCIONES ANTE LA NOTIFICACIÓN DE CASOS DE LEGIONELOSIS 5.1. Consideraciones generales Para abordar las actuaciones a realizar en un edificio/instalación asociado con casos de legionelosis se deben tener
5. ACCIONES ANTE LA NOTIFICACIÓN DE CASOS DE LEGIONELOSIS 5.1. Consideraciones generales Para abordar las actuaciones a realizar en un edificio/instalación asociado con casos de legionelosis se deben tener
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 0 1. NOMBRE DEL MEDICAMENTO VIRGAN 1,5 mg/g gel oftálmico 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 1g de gel contiene 1,5 mg de ganciclovir
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 0 1. NOMBRE DEL MEDICAMENTO VIRGAN 1,5 mg/g gel oftálmico 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 1g de gel contiene 1,5 mg de ganciclovir
INFORMACION PARA PERSONAS CON DIABETES TIPO2
 INFORMACION PARA PERSONAS CON DIABETES TIPO2 Pag 3 Qué es la retinopatía diabética? Pag 4 Frecuencia Pag 5 Síntomas Pag 6 Diagnóstico Pag 7 Tratamiento Pag 9 Otras enfermedades 2 Qué es la retinopatía
INFORMACION PARA PERSONAS CON DIABETES TIPO2 Pag 3 Qué es la retinopatía diabética? Pag 4 Frecuencia Pag 5 Síntomas Pag 6 Diagnóstico Pag 7 Tratamiento Pag 9 Otras enfermedades 2 Qué es la retinopatía
6. Tratamiento de la dependencia tabáquica en pacientes fumadores con diagnóstico de EPOC
 6. Tratamiento de la dependencia tabáquica en pacientes fumadores con diagnóstico de EPOC La dependencia tabáquica presenta determinadas características, que pueden hacer que se considere una enfermedad
6. Tratamiento de la dependencia tabáquica en pacientes fumadores con diagnóstico de EPOC La dependencia tabáquica presenta determinadas características, que pueden hacer que se considere una enfermedad
Nota de Información al cliente ISO/IEC 22301 Proceso de auditoría
 Nota de Información al cliente ISO/IEC 22301 Proceso de auditoría La presente Nota de Información al Cliente explica las principales fases del proceso de certificación y auditoría de Sistemas de Gestión
Nota de Información al cliente ISO/IEC 22301 Proceso de auditoría La presente Nota de Información al Cliente explica las principales fases del proceso de certificación y auditoría de Sistemas de Gestión
Estrategia restrictiva o liberal?
 Estrategia restrictiva o liberal? Evaluaron si un umbral restrictivo para la transfusión en pacientes con hemorragia digestiva aguda fue más seguro y eficaz que la estrategia transfusional liberal basada
Estrategia restrictiva o liberal? Evaluaron si un umbral restrictivo para la transfusión en pacientes con hemorragia digestiva aguda fue más seguro y eficaz que la estrategia transfusional liberal basada
Comisión Nacional del Mercado de Valores Att. Director del Área de Mercados C/ Edison nº4 28006 Madrid. Madrid, a 2 de octubre de 2015
 Comisión Nacional del Mercado de Valores Att. Director del Área de Mercados C/ Edison nº4 28006 Madrid Madrid, a 2 de octubre de 2015 De conformidad con lo previsto en el artículo 82 de la Ley del Mercado
Comisión Nacional del Mercado de Valores Att. Director del Área de Mercados C/ Edison nº4 28006 Madrid Madrid, a 2 de octubre de 2015 De conformidad con lo previsto en el artículo 82 de la Ley del Mercado
TRATAMIENTO DEL EDEMA MACULAR PROVOCADO POR OCLUSIÓN VENOSA RETINIANA OZURDEX LUCENTIS
 TRTMIENTO DEL EDEM MCULR PROVOCDO POR OCLUSIÓN VENOS RETININ OZURDEX LUCENTIS Informe de evaluación de tecnologías sanitarias elaborado por el Servicio de Evaluación y Planificación a petición de la Dirección
TRTMIENTO DEL EDEM MCULR PROVOCDO POR OCLUSIÓN VENOS RETININ OZURDEX LUCENTIS Informe de evaluación de tecnologías sanitarias elaborado por el Servicio de Evaluación y Planificación a petición de la Dirección
Prevalencia de la ansiedad y cargas asociadas
 1. Introducción El presente documento constituye la GPC completa para el manejo de pacientes con trastornos de ansiedad en Atención Primaria. La GPC está estructurada por capítulos, en los que se da respuesta
1. Introducción El presente documento constituye la GPC completa para el manejo de pacientes con trastornos de ansiedad en Atención Primaria. La GPC está estructurada por capítulos, en los que se da respuesta
http://www.medicosdeelsalvador.com Realizado por:
 Este artículo médico salió de la página web de Médicos de El Salvador. http://www.medicosdeelsalvador.com Realizado por: Clínica de Especialidades Ramírez Amaya http://www.medicosdeelsalvador.com/clinica/ramirezamaya
Este artículo médico salió de la página web de Médicos de El Salvador. http://www.medicosdeelsalvador.com Realizado por: Clínica de Especialidades Ramírez Amaya http://www.medicosdeelsalvador.com/clinica/ramirezamaya
PREGUNTAS FRECUENTES Nuevo Plan de Jubilación a Partir del 1º de Julio del 2014
 PREGUNTAS FRECUENTES Nuevo Plan de Jubilación a Partir del 1º de Julio del 2014 La siguiente lista de preguntas frecuentes pretende responder a muchas de las dudas que pueda tener sobre la decisión de
PREGUNTAS FRECUENTES Nuevo Plan de Jubilación a Partir del 1º de Julio del 2014 La siguiente lista de preguntas frecuentes pretende responder a muchas de las dudas que pueda tener sobre la decisión de
Cirugía de cataratas
 Cirugía de cataratas Introducción Una catarata es el opacamiento del cristalino del ojo. Las cataratas son una afección común que se presenta en muchas personas de más de 65 años. Su médico podría recomendar
Cirugía de cataratas Introducción Una catarata es el opacamiento del cristalino del ojo. Las cataratas son una afección común que se presenta en muchas personas de más de 65 años. Su médico podría recomendar
NORMA TÉCNICA DE AUDITORÍA SOBRE CONSIDERACIONES RELATIVAS A LA AUDITORÍA DE ENTIDADES QUE EXTERIORIZAN PROCESOS DE ADMINISTRACIÓN
 Resolución de 26 de marzo de 2004, del Instituto de Contabilidad y Auditoría de Cuentas, por la que se publica la Norma Técnica de Auditoría sobre consideraciones relativas a la auditoría de entidades
Resolución de 26 de marzo de 2004, del Instituto de Contabilidad y Auditoría de Cuentas, por la que se publica la Norma Técnica de Auditoría sobre consideraciones relativas a la auditoría de entidades
Degeneración Macular (DMRE)
 2014 2015 Degeneración Macular (DMRE) Qué es la degeneración macular relacionada con la edad (DMRE)? La degeneración macular relacionada con la edad (DMRE) es un problema en la retina. Se produce cuando
2014 2015 Degeneración Macular (DMRE) Qué es la degeneración macular relacionada con la edad (DMRE)? La degeneración macular relacionada con la edad (DMRE) es un problema en la retina. Se produce cuando
Huntexil como tratamiento de los síntomas de la enfermedad de Huntington: Y ahora qué?
 Novedades en la investigación de la EH. En lenguaje sencillo. Escrito por científicos. Para toda la comunidad EH. Se ha publicado un nuevo artículo con más información sobre este tema: FDA: es necesario
Novedades en la investigación de la EH. En lenguaje sencillo. Escrito por científicos. Para toda la comunidad EH. Se ha publicado un nuevo artículo con más información sobre este tema: FDA: es necesario
Diagnóstico y Tratamiento del Agujero Macular Idiopático GPC. Guía de Práctica Clínica Catálogo maestro de guías de práctica clínica: IMSS-614-13
 Diagnóstico y Tratamiento del Agujero Macular Idiopático GPC Guía de Práctica Clínica Catálogo maestro de guías de práctica clínica: IMSS-614-13 Guía de Referencia Rápida H35.3 Degeneración de la mácula
Diagnóstico y Tratamiento del Agujero Macular Idiopático GPC Guía de Práctica Clínica Catálogo maestro de guías de práctica clínica: IMSS-614-13 Guía de Referencia Rápida H35.3 Degeneración de la mácula
TECNOLOGÍA EN SALUD DE INTERÉS Metoprolol 1. RESUMEN
 TECNOLOGÍA EN SALUD DE INTERÉS 1. RESUMEN Título del reporte: Efectividad y seguridad de metoprolol para pacientes con síndrome coronario agudo. Información general de la tecnología: el metoprolol es un
TECNOLOGÍA EN SALUD DE INTERÉS 1. RESUMEN Título del reporte: Efectividad y seguridad de metoprolol para pacientes con síndrome coronario agudo. Información general de la tecnología: el metoprolol es un
norma técnica Estándar de Seguridad y Salud: Evaluación del desempeño en seguridad y salud de las empresas colaboradoras Código: NT.00047.GN-SP.
 norma técnica Estándar de Seguridad y Salud: Evaluación del desempeño en seguridad y salud de las empresas colaboradoras Código: NT.00047.GN-SP.ESS Edición: 1 Histórico de Revisiones Edición Fecha Motivo
norma técnica Estándar de Seguridad y Salud: Evaluación del desempeño en seguridad y salud de las empresas colaboradoras Código: NT.00047.GN-SP.ESS Edición: 1 Histórico de Revisiones Edición Fecha Motivo
-Usar el preservativo, que evita el contagio de otras enfermedades de transmisión sexual.
 Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
1.- JUSTIFICACIÓN 2.- OBJETO DEL CONTRATO
 PLIEGO DE PRESCRIPCIONES TÉCNICAS QUE REGIRÁ EL CONCURSO PARA LA GESTION DE LA PRODUCCIÓN TÉCNICA DE EXPOSICIONES QUE SE REALICEN EN LAS SALAS DEL CENTRO CULTURAL DEL MATADERO, ENTRE OTRAS. 1.- JUSTIFICACIÓN
PLIEGO DE PRESCRIPCIONES TÉCNICAS QUE REGIRÁ EL CONCURSO PARA LA GESTION DE LA PRODUCCIÓN TÉCNICA DE EXPOSICIONES QUE SE REALICEN EN LAS SALAS DEL CENTRO CULTURAL DEL MATADERO, ENTRE OTRAS. 1.- JUSTIFICACIÓN
1. DOCUMENTO DE INFORMACIÓN PARA (*) CIRUGÍA DE CATARATA
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
EXTRACTO: TESIS DOCTORAL SERIE: INNOVACIÓN EDUCATIVA
 EXTRACTO: TESIS DOCTORAL SERIE: INNOVACIÓN EDUCATIVA Influencia de las lentes intraoculares amarillas en el daño fototóxico retiniano. Valoración del espesor macular mediante Tomografía de Coherencia Óptica
EXTRACTO: TESIS DOCTORAL SERIE: INNOVACIÓN EDUCATIVA Influencia de las lentes intraoculares amarillas en el daño fototóxico retiniano. Valoración del espesor macular mediante Tomografía de Coherencia Óptica
Plan de Gestión riesgos para la administración de fármacos antiangiogénicos en la degeneración macular asociada a la edad.
 Plan de Gestión riesgos para la administración de fármacos antiangiogénicos en la degeneración macular asociada a la edad. (Adaptado de la plantilla Doc.Ref. EMEA/192632/2006) 1 Objeto Definir el plan
Plan de Gestión riesgos para la administración de fármacos antiangiogénicos en la degeneración macular asociada a la edad. (Adaptado de la plantilla Doc.Ref. EMEA/192632/2006) 1 Objeto Definir el plan
PROTOCOLO DE ACTUACION ANTE LA DETECCION DE UN CASO DE TUBERCULOSIS EN LA COMUNIDAD
 PROTOCOLO DE ACTUACION ANTE LA DETECCION DE UN CASO DE TUBERCULOSIS EN LA COMUNIDAD 1. Detección de la infección tuberculosa. Prueba de la tuberculina. El diagnóstico de la infección se basa en el viraje
PROTOCOLO DE ACTUACION ANTE LA DETECCION DE UN CASO DE TUBERCULOSIS EN LA COMUNIDAD 1. Detección de la infección tuberculosa. Prueba de la tuberculina. El diagnóstico de la infección se basa en el viraje
EXPEDIENTE Nº: 2007.0.013
 PLIEGO DE PRESCRIPCIONES TÉCNICAS PARA LA CONTRATACIÓN DE UN SERVICIO DE TELEOPERADORES PARA EL CENTRO DE LLAMADAS DE CITA PREVIA DEL CENTRO DE ESPECIALIDADES DE MORATALAZ DEPENDIENTE DEL ÁREA I DE ATENCION
PLIEGO DE PRESCRIPCIONES TÉCNICAS PARA LA CONTRATACIÓN DE UN SERVICIO DE TELEOPERADORES PARA EL CENTRO DE LLAMADAS DE CITA PREVIA DEL CENTRO DE ESPECIALIDADES DE MORATALAZ DEPENDIENTE DEL ÁREA I DE ATENCION
Anexo I. La visión. El proceso de la visión. 1. Introducción. 2. La visión
 Anexo I. La visión El proceso de la visión 1. Introducción El ojo humano ha sufrido grandes modificaciones a través de los tiempos como consecuencia de las diferentes formas de vida, desde cuando se usaba
Anexo I. La visión El proceso de la visión 1. Introducción El ojo humano ha sufrido grandes modificaciones a través de los tiempos como consecuencia de las diferentes formas de vida, desde cuando se usaba
Señalaba el ciudadano, literalmente, lo siguiente:
 Expte. DI-72/2015-4 EXCMO. SR. CONSEJERO DE SANIDAD Via Univérsitas, 36 50071 Zaragoza Zaragoza Zaragoza, a 17 de septiembre de 2015 I.- Antecedentes Primero.- Con fecha 16 de enero de 2015 tuvo entrada
Expte. DI-72/2015-4 EXCMO. SR. CONSEJERO DE SANIDAD Via Univérsitas, 36 50071 Zaragoza Zaragoza Zaragoza, a 17 de septiembre de 2015 I.- Antecedentes Primero.- Con fecha 16 de enero de 2015 tuvo entrada
REGLAMENTO DE TRABAJOS FIN DE GRADO EN LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA.
 REGLAMENTO DE TRABAJOS FIN DE GRADO EN LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA. Artículo 1. Definición 1) El Trabajo Fin de Grado (TFG) es un trabajo personal y autónomo del estudiante cuya elaboración
REGLAMENTO DE TRABAJOS FIN DE GRADO EN LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA. Artículo 1. Definición 1) El Trabajo Fin de Grado (TFG) es un trabajo personal y autónomo del estudiante cuya elaboración
proporción de diabetes = 1.500 = 0.06 6 % expresada en porcentaje 25.000.
 UNIDAD TEMATICA 3: Tasas Razones y proporciones Objetivo: Conocer los indicadores que miden los cambios en Salud, su construcción y utilización La información que se maneja en epidemiología frecuentemente
UNIDAD TEMATICA 3: Tasas Razones y proporciones Objetivo: Conocer los indicadores que miden los cambios en Salud, su construcción y utilización La información que se maneja en epidemiología frecuentemente
CRITERIOS GENERALES PARA LA OFERTA DE EMPLEO PÚBLICO DE PERSONAL FUNCIONARIO DOCENTE DE LA ADMINISTRACIÓN DEL PRINCIPADO DE ASTURIAS DEL AÑO 2016
 CRITERIOS GENERALES PARA LA OFERTA DE EMPLEO PÚBLICO DE PERSONAL FUNCIONARIO DOCENTE DE LA ADMINISTRACIÓN DEL PRINCIPADO DE ASTURIAS DEL AÑO 2016 PRIMERO.- La legislación básica contenida en la Ley 48/2015,
CRITERIOS GENERALES PARA LA OFERTA DE EMPLEO PÚBLICO DE PERSONAL FUNCIONARIO DOCENTE DE LA ADMINISTRACIÓN DEL PRINCIPADO DE ASTURIAS DEL AÑO 2016 PRIMERO.- La legislación básica contenida en la Ley 48/2015,
1. ------IND- 2007 0325 FIN ES- ------ 20070622 --- --- PROJET. Decreto del Consejo de Estado sobre equipos láser y su inspección
 1. ------IND- 2007 0325 FIN ES- ------ 20070622 --- --- PROJET PROYECTO Decreto del Consejo de Estado sobre equipos láser y su inspección Según la resolución del Consejo de Estado, adoptada de conformidad
1. ------IND- 2007 0325 FIN ES- ------ 20070622 --- --- PROJET PROYECTO Decreto del Consejo de Estado sobre equipos láser y su inspección Según la resolución del Consejo de Estado, adoptada de conformidad
La importancia social y económica de esta enfermedad queda resumida en algunos datos:
 Domingo, 14 de marzo de 2010 De 11:30 a 13:00 horas Auditorio (N-103+N-104) La degeneración macular asociada a la edad (DMAE) es una enfermedad frecuente y grave, con un elevado coste social, económico
Domingo, 14 de marzo de 2010 De 11:30 a 13:00 horas Auditorio (N-103+N-104) La degeneración macular asociada a la edad (DMAE) es una enfermedad frecuente y grave, con un elevado coste social, económico
DOCUMENTO DE TRABAJO DE LOS SERVICIOS DE LA COMISIÓN RESUMEN DE LA EVALUACIÓN DE IMPACTO. que acompaña al documento
 COMISIÓN EUROPEA Bruselas, 10.9.2014 SWD(2014) 274 final DOCUMENTO DE TRABAJO DE LOS SERVICIOS DE LA COMISIÓN RESUMEN DE LA EVALUACIÓN DE IMPACTO que acompaña al documento Propuesta de Reglamento del Parlamento
COMISIÓN EUROPEA Bruselas, 10.9.2014 SWD(2014) 274 final DOCUMENTO DE TRABAJO DE LOS SERVICIOS DE LA COMISIÓN RESUMEN DE LA EVALUACIÓN DE IMPACTO que acompaña al documento Propuesta de Reglamento del Parlamento
Programa de Becas de Desarrollo Profesional
 Programa de Becas de Desarrollo Profesional Portabilidad Numérica, Motor para la Competencia OAS/DHD-CIR. 171/2009 1) Lugar de Estudio: Plataforma de educación a distancia de la Unión Internacional de
Programa de Becas de Desarrollo Profesional Portabilidad Numérica, Motor para la Competencia OAS/DHD-CIR. 171/2009 1) Lugar de Estudio: Plataforma de educación a distancia de la Unión Internacional de
riesgos con Xolair. Información sobre Xolair (omalizumab)
 La FDA aprueba cambios en la etiqueta del medicamento para el asma Xolair (omalizumab), los que incluyen la descripción de un riesgo ligeramente mayor de acontecimientos adversos cardíacos y cerebrales
La FDA aprueba cambios en la etiqueta del medicamento para el asma Xolair (omalizumab), los que incluyen la descripción de un riesgo ligeramente mayor de acontecimientos adversos cardíacos y cerebrales
Evaluación de la capacidad óptima de medida y alcance de la acreditación de un laboratorio de calibración
 Evaluación de la capacidad óptima de medida y alcance de la acreditación de un laboratorio de calibración Fernández Pareja, Mª Teresa te_fer@topografia.upm.es Departamento de Ingeniería Topográfica y Cartografía
Evaluación de la capacidad óptima de medida y alcance de la acreditación de un laboratorio de calibración Fernández Pareja, Mª Teresa te_fer@topografia.upm.es Departamento de Ingeniería Topográfica y Cartografía
PPRL.14. Procedimiento de Comunicación, Consulta y Participación en la P.R.L.
 P. de, Consulta y Participación en la P.R.L. PPRL.14. Procedimiento de, Consulta y Participación en la P.R.L. Página 1 de 19 P. de, Consulta y Participación en la P.R.L. REGISTRO DE CAMBIOS DEL PROCEDIMIENTO
P. de, Consulta y Participación en la P.R.L. PPRL.14. Procedimiento de, Consulta y Participación en la P.R.L. Página 1 de 19 P. de, Consulta y Participación en la P.R.L. REGISTRO DE CAMBIOS DEL PROCEDIMIENTO
Rincón Médico El glaucoma Dr. Mario Caboara Moreno Cirujano Oftalmólogo Centro Oftalmológico de los Altos - Tepatitlán, Jalisco
 Rincón Médico El glaucoma Dr. Mario Caboara Moreno Cirujano Oftalmólogo Centro Oftalmológico de los Altos - Tepatitlán, Jalisco Si bien todos los sentidos que poseemos los humanos son importantes y nos
Rincón Médico El glaucoma Dr. Mario Caboara Moreno Cirujano Oftalmólogo Centro Oftalmológico de los Altos - Tepatitlán, Jalisco Si bien todos los sentidos que poseemos los humanos son importantes y nos
Fundación Caja de Burgos Obra Social la Caixa
 Programa de Voluntariado Ambiental 2015 Fundación Caja de Burgos Obra Social la Caixa 1. FINALIDAD Esta línea de ayudas busca la promoción y el apoyo de acciones de Voluntariado Medioambiental entre las
Programa de Voluntariado Ambiental 2015 Fundación Caja de Burgos Obra Social la Caixa 1. FINALIDAD Esta línea de ayudas busca la promoción y el apoyo de acciones de Voluntariado Medioambiental entre las
UNIVERSIDAD AUTÓNOMA DE TLAXCALA Facultad de Trabajo Social, Sociología y Psicología Seguimiento de Egresados Licenciatura de Trabajo Social
 UNIVERSIDAD AUTÓNOMA DE TLAXCALA Facultad de Trabajo Social, Sociología y Psicología Seguimiento de Egresados Licenciatura de Trabajo Social ESTUDIO DE SEGUIMIENTO DE EGRESADOS INFORME TÉCNICO Elaboró:
UNIVERSIDAD AUTÓNOMA DE TLAXCALA Facultad de Trabajo Social, Sociología y Psicología Seguimiento de Egresados Licenciatura de Trabajo Social ESTUDIO DE SEGUIMIENTO DE EGRESADOS INFORME TÉCNICO Elaboró:
PROTOCOLO DE USO DE INHIBIDORES DE LA BOMBA DE PROTONES (IBP)
 INDICACIONES Los inhibidores de la bomba de protones (IBP) tienen un efecto terapéutico similar a los anti-h 2 en úlcera gástrica y algo más eficaz en úlcera duodenal (aunque a partir de la cuarta semana
INDICACIONES Los inhibidores de la bomba de protones (IBP) tienen un efecto terapéutico similar a los anti-h 2 en úlcera gástrica y algo más eficaz en úlcera duodenal (aunque a partir de la cuarta semana
Capítulo 8 - Reglas adicionales para ISO9001: 2008
 Capítulo 8 - Reglas adicionales para ISO9001: 2008 TABLA DE CONTENIDOS Artículo 8.1 Tipos de auditorías... 2 Artículo 8.2 Clasificación de no conformidades... 3 Artículo 8.3 Sanciones y condiciones para
Capítulo 8 - Reglas adicionales para ISO9001: 2008 TABLA DE CONTENIDOS Artículo 8.1 Tipos de auditorías... 2 Artículo 8.2 Clasificación de no conformidades... 3 Artículo 8.3 Sanciones y condiciones para
Epidemiológicos. SIDA CASTILLA Y LEÓN Actualización Junio 2015 REGISTRO REGIONAL DE SIDA 1. CASOS DE SIDA EN CASTILLA Y LEÓN 1982-2015 2
 Informes AÑO 2015 Epidemiológicos SIDA CASTILLA Y LEÓN Actualización Junio 2015 REGISTRO REGIONAL DE SIDA 1. CASOS DE SIDA EN CASTILLA Y LEÓN 1982-2015 2 2. EL SIDA EN CASTILLA Y LEON 2 3. CONCLUSIONES
Informes AÑO 2015 Epidemiológicos SIDA CASTILLA Y LEÓN Actualización Junio 2015 REGISTRO REGIONAL DE SIDA 1. CASOS DE SIDA EN CASTILLA Y LEÓN 1982-2015 2 2. EL SIDA EN CASTILLA Y LEON 2 3. CONCLUSIONES
PROPUESTAS COMERCIALES
 PROPUESTAS COMERCIALES 1. Alcance... 2 2. Entidades básicas... 2 3. Circuito... 2 3.1. Mantenimiento de rutas... 2 3.2. Añadir ofertas... 5 3.2.1. Alta desde CRM... 5 3.2.2. Alta desde el módulo de Propuestas
PROPUESTAS COMERCIALES 1. Alcance... 2 2. Entidades básicas... 2 3. Circuito... 2 3.1. Mantenimiento de rutas... 2 3.2. Añadir ofertas... 5 3.2.1. Alta desde CRM... 5 3.2.2. Alta desde el módulo de Propuestas
La vacuna pentavalente oral contra rotavirus puede ser tolerable
 La vacuna pentavalente oral contra rotavirus puede ser tolerable Para los lactantes atendidos en los centros médicos donde se realizó el estudio, la información clínica con respecto a los episodios de
La vacuna pentavalente oral contra rotavirus puede ser tolerable Para los lactantes atendidos en los centros médicos donde se realizó el estudio, la información clínica con respecto a los episodios de
VIGILANCIA EPIDEMIOLÓGICA DEL SIDA REGIÓN DE MURCIA. RESUMEN DE SITUACIÓN A 30 DE JUNIO DE 2010
 VIGILANCIA EPIDEMIOLÓGICA DEL SIDA REGIÓN DE MURCIA. RESUMEN DE SITUACIÓN A 0 DE JUNIO DE A nivel mundial la epidemia de sida está comenzando a cambiar su curso, pues el número de nuevas infecciones por
VIGILANCIA EPIDEMIOLÓGICA DEL SIDA REGIÓN DE MURCIA. RESUMEN DE SITUACIÓN A 0 DE JUNIO DE A nivel mundial la epidemia de sida está comenzando a cambiar su curso, pues el número de nuevas infecciones por
6. Conservación y almacenaje de medicamentos
 6. Conservación y almacenaje de medicamentos 6.1. Normas generales de almacenamiento y conservación Los medicamentos deben conservarse en las condiciones idóneas para impedir su alteración. Los laboratorios
6. Conservación y almacenaje de medicamentos 6.1. Normas generales de almacenamiento y conservación Los medicamentos deben conservarse en las condiciones idóneas para impedir su alteración. Los laboratorios
DICTAMEN Nº. 281/2008, de 30 de diciembre. *
 DICTAMEN Nº. 281/2008, de 30 de diciembre. * Expediente relativo a reclamación de responsabilidad patrimonial de la Administración Sanitaria a instancia de Dª. X, por los daños y perjuicios que anuda a
DICTAMEN Nº. 281/2008, de 30 de diciembre. * Expediente relativo a reclamación de responsabilidad patrimonial de la Administración Sanitaria a instancia de Dª. X, por los daños y perjuicios que anuda a
GERENCIA DE INTEGRACIÓN
 GERENCIA DE INTEGRACIÓN CONTENIDO Desarrollo del plan Ejecución del plan Control de cambios INTRODUCCIÓN La gerencia de integración del proyecto incluye los procesos requeridos para asegurar que los diversos
GERENCIA DE INTEGRACIÓN CONTENIDO Desarrollo del plan Ejecución del plan Control de cambios INTRODUCCIÓN La gerencia de integración del proyecto incluye los procesos requeridos para asegurar que los diversos
Los costes de la accidentalidad en la Red de Carreteras del Estado
 Los costes de la accidentalidad en la Red de Carreteras del Estado Un criterio objetivo para la política de mantenimiento de carreteras 17 de abril de 2013 índice Objetivos Introducción a la inversión
Los costes de la accidentalidad en la Red de Carreteras del Estado Un criterio objetivo para la política de mantenimiento de carreteras 17 de abril de 2013 índice Objetivos Introducción a la inversión
LAS CAUSAS DE LAS CATARATAS
 LAS CAUSAS DE LAS CATARATAS La mayoría de las cataratas se deben a cambios relacionados con la edad en el cristalino del ojo. La mayoría de las cataratas se deben a cambios relacionados con la edad en
LAS CAUSAS DE LAS CATARATAS La mayoría de las cataratas se deben a cambios relacionados con la edad en el cristalino del ojo. La mayoría de las cataratas se deben a cambios relacionados con la edad en
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
CONCEPTOS Y CRITERIOS DE LOS INDICADORES DE CALIDAD
 CONCEPTOS Y CRITERIOS DE LOS INDICADORES DE CALIDAD Las tablas con los indicadores de calidad recogen los siguientes campos: 1. Denominación de la actividad. Nombre que aparece en el Programa Estadístico
CONCEPTOS Y CRITERIOS DE LOS INDICADORES DE CALIDAD Las tablas con los indicadores de calidad recogen los siguientes campos: 1. Denominación de la actividad. Nombre que aparece en el Programa Estadístico
 Comentarios de introducción al Procedimiento de Compras Como apuntábamos en los capítulos iniciales, uno de los pilares en los que se apoya nuestro sistema de la calidad es el producto entregado a nuestros
Comentarios de introducción al Procedimiento de Compras Como apuntábamos en los capítulos iniciales, uno de los pilares en los que se apoya nuestro sistema de la calidad es el producto entregado a nuestros
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
1. DOCUMENTO DE INFORMACIÓN PARA (*) CIRUGÍA DE LA INCURVACION DE PENE
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
Preguntas y respuestas
 GUÍA DEL PACIENTE Filtro opcional de vena cava Preguntas y respuestas Embolia pulmonar y filtros de vena cava Esta guía tiene por objeto brindarle más información sobre la embolia pulmonar, sus causas,
GUÍA DEL PACIENTE Filtro opcional de vena cava Preguntas y respuestas Embolia pulmonar y filtros de vena cava Esta guía tiene por objeto brindarle más información sobre la embolia pulmonar, sus causas,
Y ahora Qué hago? Aspectos a tener en cuenta ante un siniestro. Derechos y Obligaciones de los Asegurados
 Y ahora Qué hago? Aspectos a tener en cuenta ante un siniestro Derechos y Obligaciones de los Asegurados MINISTERIO DE AGRICULTURA, PESCA Y ALIMENTACIÓN ENTIDAD ESTATAL DE SEGUROS AGRARIOS (ENESA) Muy
Y ahora Qué hago? Aspectos a tener en cuenta ante un siniestro Derechos y Obligaciones de los Asegurados MINISTERIO DE AGRICULTURA, PESCA Y ALIMENTACIÓN ENTIDAD ESTATAL DE SEGUROS AGRARIOS (ENESA) Muy
Curso Auditor Interno Calidad
 Curso Auditor Interno Calidad 4. Fases de una auditoria OBJETIVOS Fases de una auditoria 1 / 10 OBJETIVOS Al finalizar esta unidad didáctica será capaz: Conocer las fases de una auditoria interna. Conocer
Curso Auditor Interno Calidad 4. Fases de una auditoria OBJETIVOS Fases de una auditoria 1 / 10 OBJETIVOS Al finalizar esta unidad didáctica será capaz: Conocer las fases de una auditoria interna. Conocer
Las traslocaciones suponen una serie de impactos, quizá menos conocidos, en las poblaciones locales de conejos
 Las poblaciones de conejo de monte en la Península Ibérica han sufrido un serio declive en las últimas décadas, debido a la incidencia de enfermedades víricas y a la pérdida de hábitat. Esta disminución
Las poblaciones de conejo de monte en la Península Ibérica han sufrido un serio declive en las últimas décadas, debido a la incidencia de enfermedades víricas y a la pérdida de hábitat. Esta disminución
CONVENCIÓN INTERNACIONAL CONTRA EL DOPAJE EN EL DEPORTE. Anexo II - Normas para la concesión de autorizaciones para uso con fines terapéuticos
 Resolución 2CP/10 CONVENCIÓN INTERNACIONAL CONTRA EL DOPAJE EN EL DEPORTE Anexo II - Normas para la concesión de autorizaciones para uso con fines terapéuticos París, 1º de enero de 2011 - 2 - Extracto
Resolución 2CP/10 CONVENCIÓN INTERNACIONAL CONTRA EL DOPAJE EN EL DEPORTE Anexo II - Normas para la concesión de autorizaciones para uso con fines terapéuticos París, 1º de enero de 2011 - 2 - Extracto
PRINCIPADO DE ASTURIAS CONSEJO DE GOBIERNO
 1 PRINCIPADO DE ASTURIAS CONSEJO DE GOBIERNO Consejería de Hacienda y Sector Público Dirección General de la Función Pública Propuesta: ACUERDO POR EL QUE SE REGULA LA JORNADA ORDINARIA EN EL ÁMBITO DE
1 PRINCIPADO DE ASTURIAS CONSEJO DE GOBIERNO Consejería de Hacienda y Sector Público Dirección General de la Función Pública Propuesta: ACUERDO POR EL QUE SE REGULA LA JORNADA ORDINARIA EN EL ÁMBITO DE
BECAS FUNDACIÓN BBVA-FUNDACIÓN CAROLINA MASTER EN ESPACIOS NATURALES PROTEGIDOS Año 2008 FICHA TÉCNICA
 BECAS FUNDACIÓN BBVA-FUNDACIÓN CAROLINA MASTER EN ESPACIOS NATURALES PROTEGIDOS Año 2008 FICHA TÉCNICA Duración del Programa 10 meses y medio (Febrero a mediados de Diciembre 2008) Nº de becas 12 Requisitos
BECAS FUNDACIÓN BBVA-FUNDACIÓN CAROLINA MASTER EN ESPACIOS NATURALES PROTEGIDOS Año 2008 FICHA TÉCNICA Duración del Programa 10 meses y medio (Febrero a mediados de Diciembre 2008) Nº de becas 12 Requisitos
INFORME DE LOS RESULTADOS PARCIALES DE LOS PROGRAMAS DE GESTIÓN DE LA DEMANDA DE 2004 RESPECTO A DISTRIBUCIÓN DE UNA GUÍA DE USO EFICIENTE DE LA
 INFORME DE LOS RESULTADOS PARCIALES DE LOS PROGRAMAS DE GESTIÓN DE LA DEMANDA DE 2004 RESPECTO A DISTRIBUCIÓN DE UNA GUÍA DE USO EFICIENTE DE LA ENERGÍA EN EL ENTORNO DOMÉSTICO 5 de julio de 2007 INFORME
INFORME DE LOS RESULTADOS PARCIALES DE LOS PROGRAMAS DE GESTIÓN DE LA DEMANDA DE 2004 RESPECTO A DISTRIBUCIÓN DE UNA GUÍA DE USO EFICIENTE DE LA ENERGÍA EN EL ENTORNO DOMÉSTICO 5 de julio de 2007 INFORME
Bienestar, desigualdad y pobreza
 97 Rafael Guerreiro Osório Desigualdad y Pobreza Bienestar, desigualdad y pobreza en 12 países de América Latina Argentina, Bolivia, Brasil, Chile, Colombia, Ecuador, El Salvador, México, Paraguay, Perú,
97 Rafael Guerreiro Osório Desigualdad y Pobreza Bienestar, desigualdad y pobreza en 12 países de América Latina Argentina, Bolivia, Brasil, Chile, Colombia, Ecuador, El Salvador, México, Paraguay, Perú,
11 knúmero de publicación: 2 150 566. 51 kint. Cl. 7 : A61K 38/26. k 72 Inventor/es: Dupre, John. k 74 Agente: Manresa Val, Manuel
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 150 566 51 kint. Cl. 7 : A61K 38/26 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 95917874.0
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 150 566 51 kint. Cl. 7 : A61K 38/26 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 95917874.0
5.1.2. Eficacia de las intervenciones para la pérdida de peso
 5. Dieta y ejercicio Preguntas para responder Cuál es la dieta más adecuada en el paciente con diabetes? Cuáles son los efectos del ejercicio físico en pacientes con DM 2? Qué tipo de ejercicio se recomienda?
5. Dieta y ejercicio Preguntas para responder Cuál es la dieta más adecuada en el paciente con diabetes? Cuáles son los efectos del ejercicio físico en pacientes con DM 2? Qué tipo de ejercicio se recomienda?
Anexo II. Conclusiones científicas y motivos para la denegación presentados por la Agencia Europea de Medicamentos
 Anexo II Conclusiones científicas y motivos para la denegación presentados por la Agencia Europea de Medicamentos 5 Conclusiones científicas Resumen general de la evaluación científica de Etinilestradiol-Drospirenona
Anexo II Conclusiones científicas y motivos para la denegación presentados por la Agencia Europea de Medicamentos 5 Conclusiones científicas Resumen general de la evaluación científica de Etinilestradiol-Drospirenona
Cómo investigar y no morir en el intento
 Cómo investigar y no morir en el intento INTRODUCCIÓN Desde el comienzo de los tiempos, el ser humano se ha planteado preguntas a cerca de sus experiencias y de la naturaleza de las actividades entorno
Cómo investigar y no morir en el intento INTRODUCCIÓN Desde el comienzo de los tiempos, el ser humano se ha planteado preguntas a cerca de sus experiencias y de la naturaleza de las actividades entorno
Guía del paciente. Braquiterapia: El mejor modo de tratar el cáncer. Porque la vida es para vivirla
 Guía del paciente Braquiterapia: El mejor modo de tratar el cáncer Porque la vida es para vivirla El objetivo de este folleto es ayudar a aquellas personas que han recibido un diagnóstico de cáncer, así
Guía del paciente Braquiterapia: El mejor modo de tratar el cáncer Porque la vida es para vivirla El objetivo de este folleto es ayudar a aquellas personas que han recibido un diagnóstico de cáncer, así
NORMA INTERNACIONAL DE AUDITORÍA 706 PÁRRAFOS DE ÉNFASIS Y PÁRRAFOS SOBRE OTRAS CUESTIONES EN EL INFORME EMITIDO POR UN AUDITOR INDEPENDIENTE
 NORMA INTERNACIONAL DE AUDITORÍA 706 PÁRRAFOS DE ÉNFASIS Y PÁRRAFOS SOBRE OTRAS CUESTIONES EN EL INFORME EMITIDO POR UN AUDITOR INDEPENDIENTE (NIA-ES 706) (adaptada para su aplicación en España mediante
NORMA INTERNACIONAL DE AUDITORÍA 706 PÁRRAFOS DE ÉNFASIS Y PÁRRAFOS SOBRE OTRAS CUESTIONES EN EL INFORME EMITIDO POR UN AUDITOR INDEPENDIENTE (NIA-ES 706) (adaptada para su aplicación en España mediante
Ensayos Clínicos en Oncología
 Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
nom web Manual: Cierre de Ejercicio
 Manual: Cierre de Ejercicio Sumario Prólogo... 2 Esquema del proceso a seguir... 3 1. Entrada de Incidencias del mes de diciembre... 4 1.1.- Entrada de variables en la Paga Mensual y Paga Extra...4 1.2.-
Manual: Cierre de Ejercicio Sumario Prólogo... 2 Esquema del proceso a seguir... 3 1. Entrada de Incidencias del mes de diciembre... 4 1.1.- Entrada de variables en la Paga Mensual y Paga Extra...4 1.2.-
Comunicado de prensa. Basilea, 27 de febrero de 2015
 Comunicado de prensa Basilea, 27 de febrero de 2015 La combinación de Avastin de Roche y quimioterapia obtiene el dictamen positivo del CHMP para su autorización en la UE contra el cáncer cervicouterino
Comunicado de prensa Basilea, 27 de febrero de 2015 La combinación de Avastin de Roche y quimioterapia obtiene el dictamen positivo del CHMP para su autorización en la UE contra el cáncer cervicouterino
NORMA INTERNACIONAL DE INFORMACIÓN FINANCIERA 5 (NIIF 5) Activos no corrientes mantenidos para la venta y actividades interrumpidas
 NORMA INTERNACIONAL DE INFORMACIÓN FINANCIERA 5 (NIIF 5) Activos no corrientes mantenidos para la venta y actividades interrumpidas SUMARIO Párrafos Objetivo 1 Alcance 2-5 Clasificación de activos no corrientes
NORMA INTERNACIONAL DE INFORMACIÓN FINANCIERA 5 (NIIF 5) Activos no corrientes mantenidos para la venta y actividades interrumpidas SUMARIO Párrafos Objetivo 1 Alcance 2-5 Clasificación de activos no corrientes
Lista de la Verificación de la Gestión de la Seguridad y Salud Ocupacional 1
 Lista de la Verificación de la Gestión de la Seguridad y Salud Ocupacional 1 Sección Punto de Control Cumplimiento 4. Requisitos del Sistema de gestión de la seguridad y salud ocupacional 4.1 Requisitos
Lista de la Verificación de la Gestión de la Seguridad y Salud Ocupacional 1 Sección Punto de Control Cumplimiento 4. Requisitos del Sistema de gestión de la seguridad y salud ocupacional 4.1 Requisitos
EL FONDO DE OJO Y LOS PROBLEMAS DE LA RETINA
 EL FONDO DE OJO Y LOS PROBLEMAS DE LA RETINA SE CURAN LOS DESPRENDIMIENTOS DE RETINA? TIENE TRATAMIENTO LA DEGENERACIÓN DE LA MÁCULA? QUÉ ES UNA OCT? La Tomografía de Coherencia Óptica es un sistema que
EL FONDO DE OJO Y LOS PROBLEMAS DE LA RETINA SE CURAN LOS DESPRENDIMIENTOS DE RETINA? TIENE TRATAMIENTO LA DEGENERACIÓN DE LA MÁCULA? QUÉ ES UNA OCT? La Tomografía de Coherencia Óptica es un sistema que
GPC. Guía de Referencia Rápida. Diagnóstico y Tratamiento de la Degeneración Macular Relacionada con la Edad. Guía de Práctica Clínica
 Guía de Referencia Rápida Diagnóstico y Tratamiento de la Degeneración Macular Relacionada con la Edad GPC Guía de Práctica Clínica Catálogo maestro de guías de práctica clínica: IMSS-401-10 Guía de Referencia
Guía de Referencia Rápida Diagnóstico y Tratamiento de la Degeneración Macular Relacionada con la Edad GPC Guía de Práctica Clínica Catálogo maestro de guías de práctica clínica: IMSS-401-10 Guía de Referencia
La base de datos Panel de Innovación Tecnológica (PITEC) Mayo 2011
 La base de datos Panel de Innovación Tecnológica (PITEC) Mayo 2011 Indice 1. PITEC 2. Datos, actualización y accesibilidad Nota: Acceso a los datos no anonimizados 3. Muestras Nota: Utilización de la muestra
La base de datos Panel de Innovación Tecnológica (PITEC) Mayo 2011 Indice 1. PITEC 2. Datos, actualización y accesibilidad Nota: Acceso a los datos no anonimizados 3. Muestras Nota: Utilización de la muestra
Estudio de Corredurías de Seguros 2008 INDICE
 INDICE 1. Resumen ejecutivo 2 2. Metodología 4 3. Análisis de balance 7 3.1. Activo 10 3.1.1. Inmovilizado 11 3.1.2. Circulante 15 3.2. Pasivo 18 3.2.1. Recursos propios 21 3.2.2. Recursos ajenos 24 3.3.
INDICE 1. Resumen ejecutivo 2 2. Metodología 4 3. Análisis de balance 7 3.1. Activo 10 3.1.1. Inmovilizado 11 3.1.2. Circulante 15 3.2. Pasivo 18 3.2.1. Recursos propios 21 3.2.2. Recursos ajenos 24 3.3.
Cefalea en racimos INTRODUCCIÓN
 Cefalea en racimos IV INTRODUCCIÓN Incluida y paradigma clínico de las cefalalgias trigémino-autonómicas, la cefalea en racimos (CR) predomina en el varón (relación hombre/mujer de 5/1); sin embargo, en
Cefalea en racimos IV INTRODUCCIÓN Incluida y paradigma clínico de las cefalalgias trigémino-autonómicas, la cefalea en racimos (CR) predomina en el varón (relación hombre/mujer de 5/1); sin embargo, en
Unidad VI: Supervisión y Revisión del proyecto
 Unidad VI: Supervisión y Revisión del proyecto 61. Administración de recursos La administración de recursos es el intento por determinar cuánto, dinero, esfuerzo, recursos y tiempo que tomará construir
Unidad VI: Supervisión y Revisión del proyecto 61. Administración de recursos La administración de recursos es el intento por determinar cuánto, dinero, esfuerzo, recursos y tiempo que tomará construir
(S-0433/15) PROYECTO DE LEY. Artículo 1 : Modificase la Ley 24.449, en su artículo 48, inciso a, el que quedará redactado de la siguiente manera:
 (S-0433/15) Senado de la Nación Secretaria Parlamentaria Dirección General de Publicaciones Buenos Aires, 10 de Marzo de 2015 Señor Presidente del H. Senado de la Nación Licenciado Amado Boudou S / D De
(S-0433/15) Senado de la Nación Secretaria Parlamentaria Dirección General de Publicaciones Buenos Aires, 10 de Marzo de 2015 Señor Presidente del H. Senado de la Nación Licenciado Amado Boudou S / D De
