SOLUCIONARIO Guía Estándar Anual
|
|
|
- Rodrigo Valdéz Segura
- hace 7 años
- Vistas:
Transcripción
1 SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1
2 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento 7 A Comprensión 8 B Comprensión 9 A Comprensión 10 A Comprensión 11 A ASE 12 E Comprensión 13 D ASE 14 E ASE 15 B ASE 16 C Comprensión 17 B ASE 18 C Comprensión 19 C Comprensión 20 C ASE 21 D ASE 22 B ASE 23 C ASE 24 A Comprensión 25 A ASE
3 EJERCICIOS PSU Ítem Alternativa Defensa 1 A Si un átomo del elemento X está ubicado a la izquierda y abajo en una tabla periódica, lo más probable es que forme cationes. Por otra parte, si un átomo del elemento Y tiene una electroafinidad muy alta, significa que formará aniones. Por lo tanto, lo más probable es que X e Y se enlacen a través de un enlace iónico, unión que se establece por atracción electrostática entre un catión y un anión para formar compuestos. Por lo tanto, las moléculas de este compuesto establecen entre sí interacciones de tipo ion-ion. 2 E Para determinar la polaridad de una molécula, es necesario conocer: 1. la electronegatividad de los elementos que componen la molécula, ya que así se puede determinar si habrá diferencia en la densidad electrónica de la molécula. 2. la estructura de Lewis de la molécula para determinar si existen pares de electrones libres en el átomo central, determinar la geometría de la molécula y evaluar si existe polaridad. 3. el tipo de enlace de la molécula, ya que en el enlace covalente se producen momentos dipolares, debido a la diferencia electronegatividades. 3 D La estructura de Lewis de la molécula de CO 2 es: En ella se puede apreciar que la molécula no tiene pares de electrones libres alrededor del átomo central (alternativa E incorrecta) y que contiene dos enlaces dobles entre carbono y oxígeno. Como este último es más electronegativo que el carbono, cada uno de los enlaces es polar (alternativa A incorrecta). Sin embargo, dado que los momentos dipolares de cada uno de los enlaces son iguales en
4 magnitud y de sentido opuesto (alternativa D correcta), estos se anulan, haciendo que la molécula sea apolar. Por lo tanto, las moléculas de CO 2 no pueden establecer enlaces dipolo-dipolo entre sí, ya que este tipo de interacción se forma entre moléculas polares (alternativa B incorrecta). El enlace puente de hidrógeno es un tipo especial de interacción dipolo-dipolo, que se forma entre un átomo electronegativo, como F, N y O, y un átomo de hidrógeno unido covalentemente a otro átomo electronegativo de un compuesto polar. Por lo tanto, es incorrecto que se forme este tipo de interacción entre las moléculas de CO 2 y las de H 2 O, ya que las primeras no son polares (alternativa C incorrecta). 4 B Para determinar la polaridad de las moléculas es necesario conocer su geometría, además determinar si los elementos en la molécula generan algún momento dipolar µ 0. Para el tolueno, se sabe que el benceno es una molécula apolar, sin embargo, al estar uno de sus hidrógenos sustituido con el grupo metilo, este genera un momento dipolar (µ 0) que la transforma en una molécula polar. Para el trans-1,2-dibromoeteno, sabiendo que el bromo es un átomo más electronegativo que el carbono, se puede deducir que en el enlace C Br, se genera un momento dipolar, que desplaza la nube electrónica hacia el bromo. En el caso del enlace C H, el carbono es levemente más electronegativo que el hidrógeno, por lo que se genera un pequeño momento dipolar en dirección al carbono. A pesar de la presencia de estos enlaces polares, la molécula es apolar, ya que debido a la simetría de su estructura, los momentos dipolares se anulan. Para el cis-1,2-dibromoeteno, siendo el átomo de bromo el más electronegativo, se genera una densidad de carga negativa sobre él y una densidad de carga positiva sobre los hidrógenos, formando una molécula polar.
5 Para el amoniaco, como el átomo de nitrógeno es más electronegativo y además posee un par de electrones libres, se genera una densidad de carga negativa sobre él y una densidad de carga positiva sobre los hidrógenos, formando una molécula polar. Para el agua, siendo el átomo de oxígeno el más electronegativo y poseer pares de electrones libres, se genera una densidad de carga negativa y una densidad de carga positiva sobre los hidrógenos, formando una molécula polar. 5 C Respecto a la molécula de BF 3 podemos afirmar que no cumple con la regla del octeto, ya que al enlazarse el boro queda rodeado de 6 electrones, en vez de 8 (A incorrecta). No existen pares de electrones libres alrededor del átomo central (D correcta), por lo tanto, su geometría es plana trigonal (B incorrecta), con ángulos de enlace de 120. Pese a que contiene tres enlaces covlentes polares (E incorrecta), es una molecular apolar (C correcta) debido a que todos los momentos dipolares se anulan (µ = 0). 6 D Dentro de una molécula, los átomos están unidos entre sí a través de fuerzas intramoleculares, las que incluyen al enlace covalente, iónico y metálico (alternativas A y E incorrectas). Estas fuerzas son las que deben vencerse para que ocurra un cambio químico (alternativa B incorrecta). Las fuerzas intermoleculares, son aquellas que se establecen entre moléculas de un compuesto. De ellas dependen las propiedades físicas de las sustancias, como el estado de agregación, punto de fusión, punto de ebullición, etc. (alternativa D correcta). Individualmente, estos enlaces son más débiles que un enlace intramolecular, como el enlace covalente (alternativa C incorrecta). 7 A La molécula del tetracloruro de carbono (CCl 4 ) es un tipo de molécula AB 4, cuyo ángulo de enlace es de 109,5. No presenta pares de electrones libres en el átomo central, por lo que se forman 4
6 momentos dipolares de igual magnitud, que se anulan debido a la geometría de la molécula, lo que hace que sea apolar. 8 B La molécula gaseosa de N 2 no presenta momento dipolar por lo que es apolar, pero al interactuar con el agua, que sí presenta un momento dipolar, se produce una distorsión de su nube electrónica, convirtiéndose de modo transitorio en un dipolo. Este tipo de interacción se denomina dipolo inducido (N 2 ) dipolo permanente (agua). 9 A El hielo puede flotar en el agua líquida debido a que presenta menor densidad (opción II correcta; III incorrecta), esto se debe a que en el hielo, los puentes de hidrógeno entre las moléculas se establecen de tal forma que estas adoptan las formas hexagonales características de los cristales de hielo (opción IV incorrecta). En estas estructuras se producen espacios no ocupados por moléculas sueltas, a diferencia de lo que ocurre en el agua líquida. Por ello, un volumen de hielo tiene menor masa que el mismo volumen de agua (opción I correcta). 10 A El punto de ebullición está directamente relacionado con la mayor o menor interacción entre las moléculas, ya que mientras mayor sea está interacción más va a costar que se separen las moléculas y mayor será el punto de ebullición de las mismas. Los ácidos orgánicos presentan mayores puntos de ebullición que los ésteres y éteres, ya que las moléculas de los ácidos interactúan por puentes de hidrógeno, que es una interacción más fuerte que la que presentan los dos últimos (dipolo- dipolo). 11 A Las moléculas polares pueden establecer interacciones de tipo dipolodipolo entre sí. A mayor polaridad, estas fuerzas intermoleculares serán mayores, por lo que se requerirá más energía para romper la unión entre las moléculas, determinando un mayor punto de ebullición. De acuerdo a los datos entregados, las moléculas que tienen mayores
7 puntos de ebullición son los ácidos y los alcoholes, ya que ellos interactúan por puentes de hidrógeno, un tipo particular de interacción dipolo dipolo, de mayor fuerza (opción I correcta). Los ésteres presentan polaridad, pero esta es menor que la de alcoholes y ácidos carboxílicos (opción II incorrecta); los éteres son poco polares y los alcanos son apolares, por lo tanto, presentan interacciones más débiles, facilitando la ruptura de enlaces y generando puntos de ebullición más bajos (opción III incorrecta). 12 E La solvatación de NaCl en el agua se debe a que la atracción que existe entre los iones Na + y Cl - y los correspondientes polos con carga opuesta de la molécula de agua, es capaz de vencer las fuerzas que mantienen juntos a Na y Cl en estado sólido. Esta interacción entre los iones Na + y Cl - y la molécula dipolar de agua es de tipo ion - dipolo. 13 D El H 2 es una molécula apolar por lo tanto, las interacciones que se forman entre moléculas de H 2 serán fuerzas de dispersión de London. Entre moléculas de HBr (moléculas polares), las fuerzas de interacción serán de tipo dipolo - dipolo y por último entre moléculas de NH 3 (moléculas polares) la interacción será por puentes de hidrógeno, ya que estos se forman entre H y F, N u O. 14 E Para determinar las características de la molécula de Cl 2 es necesario conocer que sus átomos se enlazan mediante un enlace covalente apolar, ya que se están uniendo dos átomos iguales. Como tienen electronegatividades iguales no habrá polaridad en la molécula. Por último, la interacción de moléculas de Cl 2 entre sí, ocurre por la formación de dipolos instantáneos y dipolos inducidos, lo que se denomina fuerzas de dispersión de London.
8 15 B Para determinar las características de la molécula de CH 4 tenemos que conocer que los enlaces C-H son de tipo covalente y por poseer electronegatividades distintas se determina que es además polar. Al conocer la geometría de la molécula, que es tetraédrica, podemos ver que todos los momentos dipolares de la molécula se anulan, por ende la molécula no presentará polaridad. 16 C En el caso de la 2-pentanona (CH 3 -CO-CH 2 -CH 2 -CH 3 ), se trata de fuerzas de Van der Waals dipolo-dipolo, ya que el grupo carbonilo, cetónico posee un enlace polar. Son fuerzas de cohesión débiles. En el n-hexano (CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH 3 ), se establecen fuerzas de Van der Waals de tipo dipolo instantáneo - dipolo inducido, ya que la molécula no muestra enlaces polares. Estas interacciones se denominan también fuerzas de London. Esto quiere decir que sus fuerzas de cohesión son aún menores que en el caso anterior. Para el ácido acético (CH 3 -COOH), las fuerzas de cohesión son puentes de hidrógeno porque el grupo carboxilo posee un enlace OH muy polarizado, que permite este tipo de interacción. Son fuerzas de cohesión mayores. 17 B Habilidad de pensamiento científico: Procesamiento e
9 interpretación de datos y formulación de explicaciones, apoyándose en los conceptos y modelos teóricos. Las líneas discontinuas muestran una unión entre moléculas, por lo que corresponden a uniones intermoleculares (opción I incorrecta). Este tipo de interacción entre moléculas de agua se denominan puentes de hidrógeno y son un tipo especial de interacción dipolodipolo. Las uniones dipolo dipolo se forman cuando las moléculas presentan polos dentro de su estructura, estableciéndose una interacción entre zonas con carga parcial positiva y zonas con carga parcial negativa (opción II correcta). Al aumentar la temperatura, aumenta la energía cinética de las moléculas, por lo que las uniones entre ellas se rompen (opción III incorrecta). 18 C Los enlaces intramoleculares corresponden a los enlaces que se dan entre los átomos de una misma molécula (enlaces iónicos y enlaces covalentes). En el caso de una molécula de agua se forman enlaces covalentes polares entre el átomo de oxígeno e hidrógeno. Los enlaces intermoleculares son los que se dan entre las moléculas (puentes de hidrógeno y enlaces por fuerzas de Van der Waals). Las moléculas de agua interactúan entre sí a través de puentes de hidrógeno. 19 C El puente de Hidrógeno, se forma por la fuerza dipolo dipolo entre un átomo muy electronegativo (N, O o F) y un átomo de H unido covalentemente a otro átomo electronegativo (N, O o F ). El benceno (C 6 H 6 ) es una molécula aromática que no presenta grandes diferencias de electronegatividad en su estructura interna, por lo que no existirán atracciones electrostáticas entre moléculas de C 6 H 6, siendo imposible que forme puentes de hidrógeno, tal como el agua y los demás compuestos mencionados que sí las poseen.
10 20 C El punto de ebullición depende de las fuerzas intermoleculares que se establecen en una sustancia. Mientras más fuertes sean estas, mayor será la energía que se tendrá que aplicar para separar las moléculas y con ello el punto de ebullición será mayor. Los tres compuestos que se presentan son polares, pero solo dos de ellos pueden formar puentes de hidrógeno (CH 3 OH y CH 3 NH 2 ). Por lo tanto, el menor punto de ebullición corresponde a CH 3 Br (2). Como el O tiene mayor electronegatividad que el N, la polaridad del enlace O-H es mayor que la del enlace N-H, por lo que se puede inferir que las interacciones por puente de hidrógeno entre moléculas de CH 3 OH serán más fuertes que entre moléculas de CH 3 NH 2. Así, el orden creciente de los puntos de ebullición de los compuestos es: 2, 1, D El hidrógeno (H2) está formado por dos átomos iguales, por lo que los electrones son atraídos con la misma fuerza por ambos núcleos y el momento dipolar es igual a cero. H H En el metano, los enlaces C-H son débilmente polares dado que el átomo de carbono y el de hidrógeno presentan similar electronegatividad. Sin embargo, debido a la geometría tetraédrica de la molécula, los momentos dipolares de enlace se cancelan entre sí, haciendo que sea apolar. El caso del amoniaco es similar al de la molécula de agua: el nitrógeno es más electronegativo que el hidrógeno y, por tanto, los tres enlaces N-H son polares. Además, existe un par de electrones libres en el átomo de N, de modo que la densidad de carga se encuentra desplazada hacia este átomo.
11 22 B Estas sustancias presentan una masa molar similar, por lo tanto tenemos que observar la polaridad o la capacidad de formar puentes de hidrógeno. Puesto que el butanol es el único que puede formar enlaces puente de hidrógeno, presentará el punto de ebullición más elevado, debido a la presencia del grupo OH (hidroxilo). Este tipo de enlace intermolecular es más fuerte que los enlaces de Van der Waals (dipolo dipolo y dipolo instantáneo dipolo inducido), que se dan en el resto de las moléculas, por lo que se necesita más energía para romper estas fuerzas intermoleculares y, en consecuencia, el punto de ebullición es mayor. 23 C Para que una sustancia orgánica sencilla sea soluble en agua ha de presentar un grupo polar en su molécula o bien un grupo capaz de formar puentes de hidrógeno con las moléculas de agua, y a su vez tener la cadena hidrocarbonada pequeña. La posibilidad de formación de enlace de puente de hidrógeno con el agua favorece mucho la solubilidad. Con estas premisas la sustancia más soluble en agua será el propanol, ya que puede formar puentes de hidrógeno, considerándose una molécula medianamente polar. Las otras sustancias serán poco o nada solubles. 24 A El enlace covalente entre dos átomos es el más fuerte, el que mantiene unidos o ligados a éstos más firmemente, y tiene un carácter direccional. El enlace por puente de hidrógeno tiene un cierto carácter covalente, con una cierta direccionalidad, que hace que su magnitud sea mayor que las fuerzas de Van der Waals. El enlace por puente de hidrógeno se forma entre un átomo de H perteneciente a una molécula, con un átomo de O, F o N perteneciente a otra molécula. En último lugar están las fuerzas de Van der Waals; para los átomos de los gases nobles estas fuerzas dependen de la polarizabilidad, pero para moléculas también dependen de la polaridad de éstas. 25 A Tanto el p-dihidroxibenceno como el o-dihidroxibenceno pueden formar enlace de puente de hidrógeno, puesto que tienen dos grupos OH; pero el isómero orto (o-) presenta los grupos OH lo suficientemente próximos para permitir la formación de enlace de puente de hidrógeno intramolecular, tal como se representa en el diagrama. La formación de este enlace disminuye la posibilidad de la formación del enlace intermolecular y por tanto disminuye la fuerza de
12 las interacciones intermoleculares; en consecuencia, el isómero para (p-) presentará un punto de ebullición superior.
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
Fuerzas Intermoleculares. Materia Condensada.
 Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
ENLACE QUÍMICO 2º BACH EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. H-CHO H C = O : CH 3 OH H C O H H H H C O C H H H CH 3 OCH 3
 EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
Profesor: Carlos Gutiérrez Arancibia. Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares
 Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
11. FUERZAS INTERMOLECULARES
 Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
Interacciones químicas de no enlace. Fuerzas de van der Waals
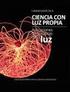 Interacciones químicas de no enlace IES La Magdalena. Avilés. Asturias En el mundo material, además de los enlaces entre átomos existen otras interacciones, más débiles, pero lo suficientemente intensas
Interacciones químicas de no enlace IES La Magdalena. Avilés. Asturias En el mundo material, además de los enlaces entre átomos existen otras interacciones, más débiles, pero lo suficientemente intensas
Longitud y energía de enlace
 Longitud y energía de enlace ENLACES QUIMICOS Los enlaces interatómicos se clasifican en: Enlaces iónicos Enlaces covalentes Enlaces metálicos ENLACE IÓNICO: Transferencia de electrones Li F El litio le
Longitud y energía de enlace ENLACES QUIMICOS Los enlaces interatómicos se clasifican en: Enlaces iónicos Enlaces covalentes Enlaces metálicos ENLACE IÓNICO: Transferencia de electrones Li F El litio le
EL ENLACE QUÍMICO 1. El enlace químico. 2. Enlace intramolecular. 3. Enlace intermolecular. 4. Propiedades del enlace.
 EL ENLACE QUÍMICO 1. El enlace químico. 2. Enlace intramolecular. 3. Enlace intermolecular. 4. Propiedades del enlace. Química 1º bachillerato El enlace químico 1 1. EL ENLACE QUÍMICO El enlace químico
EL ENLACE QUÍMICO 1. El enlace químico. 2. Enlace intramolecular. 3. Enlace intermolecular. 4. Propiedades del enlace. Química 1º bachillerato El enlace químico 1 1. EL ENLACE QUÍMICO El enlace químico
ESTRUCTURA DE LA MATERIA QCA 05 ANDALUCÍA
 1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
SOLUCIONES EJERCICIOS DE ENLACE QUÍMICO. 1º BCT
 SOLUCIOES EJERCICIOS DE ELACE QUÍMICO. 1º CT 1. La teoría de la repulsión de los pares electrónicos de la capa de valencia (TRPECV) dice que los pares electrónicos que rodean al átomo central se disponen
SOLUCIOES EJERCICIOS DE ELACE QUÍMICO. 1º CT 1. La teoría de la repulsión de los pares electrónicos de la capa de valencia (TRPECV) dice que los pares electrónicos que rodean al átomo central se disponen
ESTRUCTURA DE LA MATERIA QCA 01 ANDALUCÍA. 1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad.
 1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad. 2.- Razone si son verdaderas o falsas las siguientes afirmaciones: a) El punto de ebullición del butano es menor que
1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad. 2.- Razone si son verdaderas o falsas las siguientes afirmaciones: a) El punto de ebullición del butano es menor que
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
MOMENTO DIPOLAR DE ENLACE. La polaridad de un enlace se mide con el momento dipolar de enlace, µ.
 didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
Tema 4. Fuerzas intermoleculares
 Tema 4: Fuerzas intermoleculares Química para biólogos Slide 1 of 35 Contenidos 4-1 Electronegatividad 4-2 Polaridad de enlace y molécula: momento dipolar 4-3 Fuerzas intermoleclares 4-4 Puentes de hidrógeno
Tema 4: Fuerzas intermoleculares Química para biólogos Slide 1 of 35 Contenidos 4-1 Electronegatividad 4-2 Polaridad de enlace y molécula: momento dipolar 4-3 Fuerzas intermoleclares 4-4 Puentes de hidrógeno
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto.
 OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López.
 Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
Capitulo 8 Fuerzas intermoleculares.
 Fuerzas intermoleculares 97 Capitulo 8 Fuerzas intermoleculares. En este tema se estudian las propiedades físicas de las sustancias moleculares en base a la magnitud de las fuerzas intermoleculares: fuerzas
Fuerzas intermoleculares 97 Capitulo 8 Fuerzas intermoleculares. En este tema se estudian las propiedades físicas de las sustancias moleculares en base a la magnitud de las fuerzas intermoleculares: fuerzas
Actividad introductoria: Aplicación en la industria de las fuerzas intermoleculares.
 Grado 10 Ciencias - Unidad 3 Cómo se relacionan los componentes del mundo? Tema Cómo afectan las fuerzas intermoleculares las propiedades de los compuestos? Curso: Nombre: Actividad introductoria: Aplicación
Grado 10 Ciencias - Unidad 3 Cómo se relacionan los componentes del mundo? Tema Cómo afectan las fuerzas intermoleculares las propiedades de los compuestos? Curso: Nombre: Actividad introductoria: Aplicación
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs.
 Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
Técnico Profesional QUÍMICA
 Programa Técnico Profesional QUÍMICA Geometría molecular Nº Ejercicios PSU 1. La siguiente figura muestra la estructura del gas metano. C Al respecto, qué valor adopta el ángulo de enlace en este compuesto?
Programa Técnico Profesional QUÍMICA Geometría molecular Nº Ejercicios PSU 1. La siguiente figura muestra la estructura del gas metano. C Al respecto, qué valor adopta el ángulo de enlace en este compuesto?
ENLACE QUÍMICO II. 5.- De los compuestos iónicos KBr y NaBr, cuál será el más duro y cuál el de mayor temperatura de fusión?. Por qué?.
 ENLACE QUÍMICO II 1.- Representa las estructuras de Lewis indicando geometría molecular y momento dipolar de las siguientes moléculas: CO 2, H 2 S y O 2. 2.- De las siguientes moléculas: F 2, CS 2, C 2
ENLACE QUÍMICO II 1.- Representa las estructuras de Lewis indicando geometría molecular y momento dipolar de las siguientes moléculas: CO 2, H 2 S y O 2. 2.- De las siguientes moléculas: F 2, CS 2, C 2
ENLACES QUÍMICOS. Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos.
 1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
Las que tienen relación con el de tamaño: LAS PROPIEDADES PERIÓDICAS. Se pueden separar en dos grupos: PERIODICIDAD
 LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
Enlace químico. 5. Dadas las siguientes sustancias: CS 2 (lineal), HCN (lineal), NH 3 (piramidal) y H 2 O (angular):
 Enlace químico Cuestiones y problemas 1. Explique: a) Si las estructuras de Lewis justifican la forma geométrica de las moléculas o si ésta se debe determinar experimentalmente para poder proponer la representación
Enlace químico Cuestiones y problemas 1. Explique: a) Si las estructuras de Lewis justifican la forma geométrica de las moléculas o si ésta se debe determinar experimentalmente para poder proponer la representación
Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato
 Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato Planteamiento del problema 1. La mina de un lápiz se compone de grafito y arcilla. El grafito es una sustancia simple
Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato Planteamiento del problema 1. La mina de un lápiz se compone de grafito y arcilla. El grafito es una sustancia simple
ENLACE QUÍMICO. TEMA 3 Pág. 271 libro (Unidad 13)
 ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Propiedades de sustancias puras se deben a: Elementos de las que están constituidas Tipo de enlace
ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Propiedades de sustancias puras se deben a: Elementos de las que están constituidas Tipo de enlace
Lección 9: HALUROS DE ALQUILO I
 Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
ENLACE QUÍMICO. TEMA 3 Pág. 271 libro (Unidad 13)
 ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Las propiedades de las sustancias puras se deben a: Elementos de las que están constituidas Tipo de
ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Las propiedades de las sustancias puras se deben a: Elementos de las que están constituidas Tipo de
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
Niveles de Organización Conceptos, átomos y enlaces
 Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Colegio San Lorenzo - Copiapó - Región de Atacama Per Laborem ad Lucem
 TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2006 PRIMERA PARTE
 1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
Composición química de los seres vivos
 Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
ÁTOMO Y ENLACE QUÍMICO
 ÁTM Y ENLACE QUÍMIC EJERCICIS DE ENTRENAMIENT PARA LA XIV LIMPÍADA NACINAL DE QUÍMICA Bibliografía recomendada Química, La Ciencia Central, T. L. Brown, H. E. LeMay, Jr., B. Burnsten. Editorial PrenticeHall
ÁTM Y ENLACE QUÍMIC EJERCICIS DE ENTRENAMIENT PARA LA XIV LIMPÍADA NACINAL DE QUÍMICA Bibliografía recomendada Química, La Ciencia Central, T. L. Brown, H. E. LeMay, Jr., B. Burnsten. Editorial PrenticeHall
GUÍA DE EJERCICIOS ENLACE
 GUÍA DE EJERCICIOS ENLACE Área Química Resultados de aprendizaje Aplicar y analizar características de moléculas, para predecir solubilidad, tipo de enlace que la forman y estructura más estable, potenciando
GUÍA DE EJERCICIOS ENLACE Área Química Resultados de aprendizaje Aplicar y analizar características de moléculas, para predecir solubilidad, tipo de enlace que la forman y estructura más estable, potenciando
GUÍA N 1: Enlace Químico y Grupos Funcionales
 UIVERSIDAD MAYR PRIMERA PARTE: Ejercicios de desarrollo. GUÍA : Enlace Químico y Grupos Funcionales.- Defina enlace químico y señale los tipos de enlaces químicos que se pueden presentar en una molécula
UIVERSIDAD MAYR PRIMERA PARTE: Ejercicios de desarrollo. GUÍA : Enlace Químico y Grupos Funcionales.- Defina enlace químico y señale los tipos de enlaces químicos que se pueden presentar en una molécula
Química Orgánica General
 Química Orgánica General Dra. Maribel Plascencia Jatomea Departamento de Investigación y Posgrado en Alimentos, DIPA Laboratorio de Microbiología y Micotoxinas 3 er piso, Edificio 5P Dr. Manuel Sánchez
Química Orgánica General Dra. Maribel Plascencia Jatomea Departamento de Investigación y Posgrado en Alimentos, DIPA Laboratorio de Microbiología y Micotoxinas 3 er piso, Edificio 5P Dr. Manuel Sánchez
EJERCICIOS DE ENLACE. a) Amoniaco. b) Tricloruro de boro. c) Metano.
 EJERCICIOS DE ENLACE 1. Deduzca, según la teoría de Repulsión de Pares de Electrones de la Capa de Valencia, la geometría de las siguientes moléculas e indique la polaridad de las mismas: a) Amoniaco.
EJERCICIOS DE ENLACE 1. Deduzca, según la teoría de Repulsión de Pares de Electrones de la Capa de Valencia, la geometría de las siguientes moléculas e indique la polaridad de las mismas: a) Amoniaco.
SUSTANCIA QUÍMICA mercurio oxígeno
 ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
PRUEBA ESPECÍFICA PRUEBA 201
 PRUEBA DE ACCESO A LA UNIVERSIDAD MAYORES PRUEBA ESPECÍFICA PRUEBA 201 PRUEBA SOLUCIONARIO Aclaraciones previas Tiempo de duración de la prueba: 1 hora Contesta 4 de los 5 ejercicios propuestos (Cada ejercicio
PRUEBA DE ACCESO A LA UNIVERSIDAD MAYORES PRUEBA ESPECÍFICA PRUEBA 201 PRUEBA SOLUCIONARIO Aclaraciones previas Tiempo de duración de la prueba: 1 hora Contesta 4 de los 5 ejercicios propuestos (Cada ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO
 QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
Preguntas Propuestas
 Preguntas Propuestas 2 ... Propiedades periódicas de los elementos 1. En qué orden varía el tamaño (volumen atómico) de los elementos alcalinos? A) K > Cs > Rb > Na > Li B) Na > Rb > K > Cs > Li C) Li
Preguntas Propuestas 2 ... Propiedades periódicas de los elementos 1. En qué orden varía el tamaño (volumen atómico) de los elementos alcalinos? A) K > Cs > Rb > Na > Li B) Na > Rb > K > Cs > Li C) Li
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
TEMA 8 SISTEMA PERIÓDICO Y ENLACES
 TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
TEMA 3- ENLACE QUÍMICO Y PROPIEDADES DE LA SUSTANCIAS
 TEMA 3- ENLACE QUÍMICO Y PROPIEDADES DE LA SUSTANCIAS E2A.S2010 Para la molécula CH 3 Cl: a) Establezca su geometría mediante la teoría de Repulsión de Pares de Electrones de la Capa de Valencia. b) Razone
TEMA 3- ENLACE QUÍMICO Y PROPIEDADES DE LA SUSTANCIAS E2A.S2010 Para la molécula CH 3 Cl: a) Establezca su geometría mediante la teoría de Repulsión de Pares de Electrones de la Capa de Valencia. b) Razone
TEMA 5. FUERZAS INTERMOLECULARES
 TEMA 5. FUERZAS ITERMLECULARES Interacciones de Van der Waals. Enlace de hidrógeno. Fuerzas intermoleculares y propiedades físicas. Aplicaciones a sistemas biológicos. De acuerdo con los modelos de enlace
TEMA 5. FUERZAS ITERMLECULARES Interacciones de Van der Waals. Enlace de hidrógeno. Fuerzas intermoleculares y propiedades físicas. Aplicaciones a sistemas biológicos. De acuerdo con los modelos de enlace
Ejercicios variados resueltos
 Ejercicios variados resueltos Programa de Acceso Inclusivo, Equidad y Permanencia 1. Cuál de los siguientes compuestos es isómero del CH 3 CH 2 COOH? a) CH 3 CO CH 2 OH b) CH 3 CH 2 CHO c) CH 2 =CH COOH
Ejercicios variados resueltos Programa de Acceso Inclusivo, Equidad y Permanencia 1. Cuál de los siguientes compuestos es isómero del CH 3 CH 2 COOH? a) CH 3 CO CH 2 OH b) CH 3 CH 2 CHO c) CH 2 =CH COOH
Enlace Químico. Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León
 Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
2. Cuál(es) de las siguientes propiedades periódicas aumenta(n) al incrementarse el número atómico en un grupo?
 Programa Estándar Anual Nº Guía práctica Teoría atómica III: tabla periódica y propiedades periódicas Ejercicios PSU 1. En un sistema periódico muy simplificado, como el que se muestra en la figura, los
Programa Estándar Anual Nº Guía práctica Teoría atómica III: tabla periódica y propiedades periódicas Ejercicios PSU 1. En un sistema periódico muy simplificado, como el que se muestra en la figura, los
CLASE Nº 4 ENLACE QUÍMICO
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 4 ENLACE QUÍMICO 2012 1 Moléculas y compuestos
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 4 ENLACE QUÍMICO 2012 1 Moléculas y compuestos
Parámetros de enlace. Jesús Gracia Mora
 Parámetros de enlace Jesús Gracia Mora La presentación, material adicional, ejercicios y bibliografía se encuentran a su disposición en: http://depa.pquim.unam.mx/qi/ Que es un enlace químico? Diferentes
Parámetros de enlace Jesús Gracia Mora La presentación, material adicional, ejercicios y bibliografía se encuentran a su disposición en: http://depa.pquim.unam.mx/qi/ Que es un enlace químico? Diferentes
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
M +n X -n EL ENLACE QUIMICO. Clase 05
 EL ENLACE QUIMICO Clase 05 Cuando dos átomos se aproximan entre sí, se ejercen varias fuerzas entre ellos. Algunas de estas fuerzas tienden a unir los átomos, otras tienden a separarlos. En la mayoría
EL ENLACE QUIMICO Clase 05 Cuando dos átomos se aproximan entre sí, se ejercen varias fuerzas entre ellos. Algunas de estas fuerzas tienden a unir los átomos, otras tienden a separarlos. En la mayoría
Los enlaces C F son polares pero la geometría tetraédrica
 1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
FUERZAS INTERMOLECULARES
 DEPARTAMENTO DE CIENCIAS QUÍMICA - IB FUERZAS INTERMOLECULARES Existen fuerzas de atracción entre las moléculas (fuerzas intermoleculares). Ellas son las responsables de que los gases condensen (pasar
DEPARTAMENTO DE CIENCIAS QUÍMICA - IB FUERZAS INTERMOLECULARES Existen fuerzas de atracción entre las moléculas (fuerzas intermoleculares). Ellas son las responsables de que los gases condensen (pasar
BIOQUÍMICA Y BIOLOGÍA MOLECULAR I CURSO 2003/04 ENLACE QUÍMICO
 BIQUÍMIA Y BILGÍA MLEULAR I URS 2003/04 Problemas 1º de Medicina UIVERSIDAD DE AVARRA DEPARTAMET DE BIQUÍMIA ELAE QUÍMI 1. rdenar por su estabilidad relativa (menor energía de ionización) los siguientes
BIQUÍMIA Y BILGÍA MLEULAR I URS 2003/04 Problemas 1º de Medicina UIVERSIDAD DE AVARRA DEPARTAMET DE BIQUÍMIA ELAE QUÍMI 1. rdenar por su estabilidad relativa (menor energía de ionización) los siguientes
Capítulo 2: Enlace químico
 Capítulo 2: Enlace químico ACTIVIDADES DE RECAPITULACIÓN 1. Cuál será la electrovalencia de los siguientes elementos: Al, K, Br, Ne? Teniendo en cuenta la configuración electrónica del nivel de valencia,
Capítulo 2: Enlace químico ACTIVIDADES DE RECAPITULACIÓN 1. Cuál será la electrovalencia de los siguientes elementos: Al, K, Br, Ne? Teniendo en cuenta la configuración electrónica del nivel de valencia,
3. DESARROLLO 3.1 ENLACE IONICO
 3. DESARROLLO Los átomos se unen entre sí para formar moléculas mediante fuerzas de enlace. Los tipos fundamentales de enlace son el iónico, el covalente y el metálico. 3.1 ENLACE IONICO El enlace iónico
3. DESARROLLO Los átomos se unen entre sí para formar moléculas mediante fuerzas de enlace. Los tipos fundamentales de enlace son el iónico, el covalente y el metálico. 3.1 ENLACE IONICO El enlace iónico
VARIACIONES PERIÓDICAS. Z = 53 Z = 53 Z = 53 Electrones = 54 Electrones = 53 Electrones = 52
 RESOLUCIÓN PRÁCTICO 13 VARIACIONES PERIÓDICAS 1 a) Las variaciones en el tamaño atómico e iónico son el resultado de la influencia del nivel n y de la carga nuclear efectiva (Z ef ). I > I > I Z = 53 Z
RESOLUCIÓN PRÁCTICO 13 VARIACIONES PERIÓDICAS 1 a) Las variaciones en el tamaño atómico e iónico son el resultado de la influencia del nivel n y de la carga nuclear efectiva (Z ef ). I > I > I Z = 53 Z
EJERCICIOS DE ENLACE QUIMICO 2º DE BACHILLERATO
 1- Coloca las siguientes moléculas por orden creciente de su polaridad: HBr, HF, HI y HCl Justifica brevemente la respuesta 2- Al comparar dos moléculas muy similares como el CO 2 y el SO 2 se observa
1- Coloca las siguientes moléculas por orden creciente de su polaridad: HBr, HF, HI y HCl Justifica brevemente la respuesta 2- Al comparar dos moléculas muy similares como el CO 2 y el SO 2 se observa
El H solo necesita 2 electrones en su capa de valencia como el He.
 Tema II. Enlace químico Concepto de enlace químico y modelos de enlace Un enlace químico se caracteriza por una situación de mínima energía, respecto a los átomos de partida que lo forman, de ahí que la
Tema II. Enlace químico Concepto de enlace químico y modelos de enlace Un enlace químico se caracteriza por una situación de mínima energía, respecto a los átomos de partida que lo forman, de ahí que la
Enlaces Químicos y Estados de la Materia
 Enlaces Químicos y Estados de la Materia 1.- Concepto de enlace químico Mientras que sólo hay alrededor de 118 elementos catalogados en la tabla periódica, obviamente hay más substancias en la naturaleza
Enlaces Químicos y Estados de la Materia 1.- Concepto de enlace químico Mientras que sólo hay alrededor de 118 elementos catalogados en la tabla periódica, obviamente hay más substancias en la naturaleza
MÓDULO A: ácido-base y espectroscópicas de los compuestos orgánicos
 MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos orgánicos MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos
MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos orgánicos MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos
energía de enlace distancia de enlace
 Enlace covalente 1 Enlace covalente Se da entre dos átomos no-metálicos por compartición de e de valencia. Dos átomos unidos mediante enlace covalente tienen menos energía que los dos átomos aislados.
Enlace covalente 1 Enlace covalente Se da entre dos átomos no-metálicos por compartición de e de valencia. Dos átomos unidos mediante enlace covalente tienen menos energía que los dos átomos aislados.
Química 2º de Bachillerato
 Química 2º de Bachillerato Tema 3 Enlace químico Contenidos Tipos de sustancias y de enlace Enlace iónico Enlace metálico Enlace covalente Estructuras de Lewis Geometría molecular: RPECV Enlace de valencia:
Química 2º de Bachillerato Tema 3 Enlace químico Contenidos Tipos de sustancias y de enlace Enlace iónico Enlace metálico Enlace covalente Estructuras de Lewis Geometría molecular: RPECV Enlace de valencia:
3. El sistema periódico de los elementos. 3. El sistema periódico de los elementos. 3. El sistema periódico de los elementos
 3. El sistema periódico de los elementos Clasificación de los elementos químicos en el siglo XIX: los químicos de la época tenían una idea vaga de los átomos; no conocían p + ni e -. Clasificaban los elementos
3. El sistema periódico de los elementos Clasificación de los elementos químicos en el siglo XIX: los químicos de la época tenían una idea vaga de los átomos; no conocían p + ni e -. Clasificaban los elementos
Los elementos químicos
 Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
RESPUESTA Guía de ejercicios #5 Enlace químico
 Liceo Bicentenario Teresa Prats Subsector: Química Nivel: 1 Medio J.C.B. / M.Q.de la F RESPUESTA Guía de ejercicios #5 Enlace químico Estimadas alumnas: Les envío las respuestas de algunas (aquellas con
Liceo Bicentenario Teresa Prats Subsector: Química Nivel: 1 Medio J.C.B. / M.Q.de la F RESPUESTA Guía de ejercicios #5 Enlace químico Estimadas alumnas: Les envío las respuestas de algunas (aquellas con
SGUICEL009QM11-A16V1. Ácido base I: conceptos y teorías
 SGUICEL009QM11-A16V1 Ácido base I: conceptos y teorías Ítem Alternativa Habilidad 1 B Reconocimiento 2 A Comprensión 3 E Reconocimiento 4 E Comprensión 5 E ASE 6 E Comprensión 7 D Comprensión 8 E Comprensión
SGUICEL009QM11-A16V1 Ácido base I: conceptos y teorías Ítem Alternativa Habilidad 1 B Reconocimiento 2 A Comprensión 3 E Reconocimiento 4 E Comprensión 5 E ASE 6 E Comprensión 7 D Comprensión 8 E Comprensión
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre Fase específica OPCIÓN A
 1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
Solamente los gases nobles y los metales en estado vapor existen en la naturaleza como átomo aislados (átomos libres).
 Dato experimental: Solamente los gases nobles y los metales en estado vapor existen en la naturaleza como átomo aislados (átomos libres). En condiciones estándar sólo los gases nobles. Por qué se unen
Dato experimental: Solamente los gases nobles y los metales en estado vapor existen en la naturaleza como átomo aislados (átomos libres). En condiciones estándar sólo los gases nobles. Por qué se unen
CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13
 CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13 T4 REACCIONES QUÍMICAS: Cálculos, Energías y Velocidades...19 T5 ESTUDIO DEL MOVIMIENTO...25
CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13 T4 REACCIONES QUÍMICAS: Cálculos, Energías y Velocidades...19 T5 ESTUDIO DEL MOVIMIENTO...25
ENLACE QUIMICO. Química General 2009
 ENLACE QUIMICO 1.- Prediga la estructura de Lewis de los siguientes compuestos: a.- BF 3 b.- CH 4 Para poder predecir la estructura de Lewis utilizamos la siguiente fórmula: E = I - R Donde: E representa
ENLACE QUIMICO 1.- Prediga la estructura de Lewis de los siguientes compuestos: a.- BF 3 b.- CH 4 Para poder predecir la estructura de Lewis utilizamos la siguiente fórmula: E = I - R Donde: E representa
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Septiembre,
Fuerzas Intermoleculares
 Fuerzas Intermoleculares 1. Defina los siguientes términos: Fase Fuerzas intermoleculares Fuerzas intramoleculares Densidad Compresibilidad Vibración molecular Propiedad Macroscópica Dipolo Polaridad Momento
Fuerzas Intermoleculares 1. Defina los siguientes términos: Fase Fuerzas intermoleculares Fuerzas intramoleculares Densidad Compresibilidad Vibración molecular Propiedad Macroscópica Dipolo Polaridad Momento
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID
 UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOGSE) Modelo Curso 2009-2010 MATERIA: QUÍMICA INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOGSE) Modelo Curso 2009-2010 MATERIA: QUÍMICA INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos
Tema 4. Estados de Agregación y FUERZAS INTERMOLECULARES
 Tema 4. Estados de Agregación y FUERZAS INTERMOLECULARES Todo gas, si se enfría y comprime suficientemente, se transforma en un líquido. La causa son las fuerzas intermoleculares, fuerzas de atracción
Tema 4. Estados de Agregación y FUERZAS INTERMOLECULARES Todo gas, si se enfría y comprime suficientemente, se transforma en un líquido. La causa son las fuerzas intermoleculares, fuerzas de atracción
EJERCICIO DE EXAMEN DE QUÍMICA INORGÁNICA
 EJERCICIO DE EXAMEN DE QUÍMICA INORGÁNICA Las 6 preguntas siguientes se refieren a la tabla periódica que se presenta. Los símbolos han sido asignados arbitrariamente. D H B A E M G J L R X Y N P Q Z T
EJERCICIO DE EXAMEN DE QUÍMICA INORGÁNICA Las 6 preguntas siguientes se refieren a la tabla periódica que se presenta. Los símbolos han sido asignados arbitrariamente. D H B A E M G J L R X Y N P Q Z T
QUÍMICA GENERAL PROBLEMAS RESUELTOS. Dr. D. Pedro A. Cordero Guerrero EL ENLACE QUÍMICO
 QUÍMICA GENERAL PROBLEMAS RESUELTOS Dr. D. Pedro A. Cordero Guerrero EL ENLACE QUÍMICO EL ENLACE QUÍMICO. CONCEPTOS TEÓRICOS BÁSICOS El enlace químico es el resultado de la interacción entre dos cuerpos
QUÍMICA GENERAL PROBLEMAS RESUELTOS Dr. D. Pedro A. Cordero Guerrero EL ENLACE QUÍMICO EL ENLACE QUÍMICO. CONCEPTOS TEÓRICOS BÁSICOS El enlace químico es el resultado de la interacción entre dos cuerpos
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2
 FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
EJERCICIOS RESUELTOS DE ENLACE QUIMICO
 EJERCICIOS RESUELTOS DE ENLACE QUIMICO 1. a) Qué tipo de enlace presenta el compuesto formado por F y Ca? b) Formule dicho compuesto a) Considerando los números atómicos del F (Z=9) y el Ca (Z=20) se desarrollan
EJERCICIOS RESUELTOS DE ENLACE QUIMICO 1. a) Qué tipo de enlace presenta el compuesto formado por F y Ca? b) Formule dicho compuesto a) Considerando los números atómicos del F (Z=9) y el Ca (Z=20) se desarrollan
H 2 SO 4 + Cu CuSO 4 + SO 2 + H 2 O. SO H e - SO H 2 O. Cu Cu e - Cu Cu e - +
 1 Universidad de Castilla la Mancha Selectividad Junio 2.01 Opción A 1.- El ácido sulfúrico (tetraoxosulfato (VI) de hidrógeno) reacciona con el cobre para dar sulfato de cobre (II) (tetraoxosulfato (VI)
1 Universidad de Castilla la Mancha Selectividad Junio 2.01 Opción A 1.- El ácido sulfúrico (tetraoxosulfato (VI) de hidrógeno) reacciona con el cobre para dar sulfato de cobre (II) (tetraoxosulfato (VI)
ACADEMIA DE QUÍMICA TURNO VESPERTINO
 INSTITUTO POLITÉCNICO NACIONAL CENTRO DE ESTUDIOS CIENTÍFICOS Y TECNOLÓGICOS No. 3 ESTANISLAO RAMÍREZ RUIZ ACADEMIA DE QUÍMICA TURNO VESPERTINO GUIA PARA EL SEGUNDO EXAMEN DEPARTAMENTALDE QUÍMICA I UNIDAD
INSTITUTO POLITÉCNICO NACIONAL CENTRO DE ESTUDIOS CIENTÍFICOS Y TECNOLÓGICOS No. 3 ESTANISLAO RAMÍREZ RUIZ ACADEMIA DE QUÍMICA TURNO VESPERTINO GUIA PARA EL SEGUNDO EXAMEN DEPARTAMENTALDE QUÍMICA I UNIDAD
ANDALUCÍA / JUNIO 2000 LOGSE / QUÍMICA / OPCIÓN A /EXAMEN COMPLETO OPCIÓN A
 OPCIÓN A 1. ormule o nombre los siguientes compuestos: a) Óxido de cromo (III) b) osfato de calcio c) Ácido benzoico d) BaSO 4 e) KNO 3 f) CH 3 CH 2 OH 2. Razone qué cantidad de las siguientes sustancias
OPCIÓN A 1. ormule o nombre los siguientes compuestos: a) Óxido de cromo (III) b) osfato de calcio c) Ácido benzoico d) BaSO 4 e) KNO 3 f) CH 3 CH 2 OH 2. Razone qué cantidad de las siguientes sustancias
JUNIO FASE GENERAL QUÍMICA. OPCIÓN A
 JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
OLIMPIADA DEPARTAMENTAL DE QUÍMICA NIVEL 2. iii. H 2 SO 3 iv. HF
 Nombre: Cédula de Identidad: Liceo: OLIMPIADA DEPARTAMENTAL DE QUÍMICA NIVEL 2 NOMENCLATURA Y FORMULACIÓN (1) Nombre los siguientes compuestos (en una hoja aparte): i. NaBr ii. NaClO iii. H 2 SO 3 iv.
Nombre: Cédula de Identidad: Liceo: OLIMPIADA DEPARTAMENTAL DE QUÍMICA NIVEL 2 NOMENCLATURA Y FORMULACIÓN (1) Nombre los siguientes compuestos (en una hoja aparte): i. NaBr ii. NaClO iii. H 2 SO 3 iv.
A. VIVENCIA Elabora la siguiente sopa de letras y define los conceptos:
 INSTITUCIÓN EDUCATIVA COLEGIO ARTISTICO RAFAEL CONTRERAS NAVARRO AREA: CIENCIAS NATURALES PROFESOR; JESÚS ALONSO PABA LEÓN ENLACES QUIMICOS Cómo se forman las sustancias químicas? COMPETENCIA: Construye
INSTITUCIÓN EDUCATIVA COLEGIO ARTISTICO RAFAEL CONTRERAS NAVARRO AREA: CIENCIAS NATURALES PROFESOR; JESÚS ALONSO PABA LEÓN ENLACES QUIMICOS Cómo se forman las sustancias químicas? COMPETENCIA: Construye
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS - (2015)
 PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS - (2015) Serie A - RADIOS ATOMICOS, VOLUMENES ATÓMICOS, PROPIEDADES GENERALES Serie B - ENERGÍA DE IONIZACIÓN, AFINIDAD ELECTRÓNICA y ELECTRONEGATIVIDAD: Serie A:
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS - (2015) Serie A - RADIOS ATOMICOS, VOLUMENES ATÓMICOS, PROPIEDADES GENERALES Serie B - ENERGÍA DE IONIZACIÓN, AFINIDAD ELECTRÓNICA y ELECTRONEGATIVIDAD: Serie A:
DERIVADOS HALOGENADOS. Estructura
 TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
Práctica 6. Propiedades físicas y enlace químico
 Práctica 6. Propiedades físicas y enlace químico Revisaron: M. en C. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA Qué tipo de enlace predomina
Práctica 6. Propiedades físicas y enlace químico Revisaron: M. en C. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA Qué tipo de enlace predomina
GUÍA PARA EXAMEN DE REGULARIZACIÓN DE QUÍMICA 1
 GUÍA PARA EXAMEN DE REGULARIZACIÓN DE QUÍMICA 1 1.- Ciencia que estudia la composición, estructura de la materia y sus transformaciones. R= Química 2.-Es todo lo que tiene masa y posee inercia R= Materia
GUÍA PARA EXAMEN DE REGULARIZACIÓN DE QUÍMICA 1 1.- Ciencia que estudia la composición, estructura de la materia y sus transformaciones. R= Química 2.-Es todo lo que tiene masa y posee inercia R= Materia
Introducción: La importancia del enlace. químicos. Nos interesa conocer las propiedades físico-químicas de las diferentes sustancias que existen
 Introducción: La importancia del enlace químicos Nos interesa conocer las propiedades físico-químicas de las diferentes sustancias que existen De qué dependen esas propiedades? La clave está en el interior
Introducción: La importancia del enlace químicos Nos interesa conocer las propiedades físico-químicas de las diferentes sustancias que existen De qué dependen esas propiedades? La clave está en el interior
Profundizando sobre enlace químico
 Capítulo 11 Profundizando sobre enlace químico Para que una sustancia se disuelva en otra, ambas deben tener características comunes. De esa manera las partículas de las sustancias se mezclan formando
Capítulo 11 Profundizando sobre enlace químico Para que una sustancia se disuelva en otra, ambas deben tener características comunes. De esa manera las partículas de las sustancias se mezclan formando
EJERCICIOS PROPUESTOS
 Solucionario 14 El enlace químico EJERCICIOS PROPUESTOS 14.1 Diferencia los cuatro tipos de estructuras sólidas: multimolecular, gigante covalente, gigante metálica y gigante iónica. Especifica cuáles
Solucionario 14 El enlace químico EJERCICIOS PROPUESTOS 14.1 Diferencia los cuatro tipos de estructuras sólidas: multimolecular, gigante covalente, gigante metálica y gigante iónica. Especifica cuáles
GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS
 A FUERZAS INTERMOLECULARES GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS 1. Menciona y describe las propiedades macroscópicas de los estados de agregación más comunes en que se presenta la materia. 2. Para cada
A FUERZAS INTERMOLECULARES GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS 1. Menciona y describe las propiedades macroscópicas de los estados de agregación más comunes en que se presenta la materia. 2. Para cada
