BALANCE DE MATERIA PARA INGENIEROS QUÍMICOS
|
|
|
- José Ignacio Acosta Figueroa
- hace 7 años
- Vistas:
Transcripción
1 BALANCE DE MATERIA PARA INGENIEROS QUÍMICOS NÉSTOR GOODING GARAVITO
2 BALANCE DE MATERIA CONTIENE : FUNDAMENTOS TEORICOS 215 PROBLEMAS RESUELTOS 299 PROBLEMAS PROPUESTOS NESTOR GOODING GARAVITO INGENIERO QUIMICO UNIVERSIDAD NACIONAL DE COLOMBIA SEPTIMA EDICION 2009
3 PROLOGO Este texto presenta de una manera resumida los principios físicos y químicos utilizados en la solución de problemas de Balance de Materia y su aplicación directa en Operaciones Unitarias y Procesos Químicos. En consecuencia, será de gran utilidad para estudiantes de pre-grado en Ingeniería Química. Uno de los problemas que con frecuencia enfrenta el Ingeniero es la selección de un Sistema de Unidades apropiado. Aunque la tendencia actual es el uso del Sistema de Unidades Internacional (SI), no se puede desconocer que la mayor parte de los Ingenieros deben utilizar datos, catálogos y equipos de medición en otras unidades, especialmente del Sistema Inglés. Se consideró en consecuencia que la solución de los problemas se efectuara utilizando los diferentes tipos de sistemas para proporcionar al futuro profesional las herramientas necesarias que la práctica le exige. Teniendo en cuenta las diversas situaciones que están representadas en la solución de un problema de Balance de Materia, se trata mediante una gran cantidad de problemas resueltos y propuestos mostrar al estudiante como puede lograr la metodología adecuada para resolver problemas con enfoque ingenieril, sin tener que estar sujeto a modelos matemáticos generalizados que limiten su capacidad de análisis. Los temas tratados pueden ser distribuídos y evaluados equitativamente a través de un semestre académico en tres grupos a saber: Fundamentación Física y Química (Capítulos 1 a 4), Balance de Materia en Operaciones Unitarias (Capítulo 5), Balance de Materia en Procesos Químicos (Capítulo 6). Los capitulos 7, 8,y 9 pueden ser vistos como complemento de procesos especiales y cuyos balances utilizan algunos recursos interesantes para el curso. Néstor Gooding Garavito
4 CONTENIDO CAPITULO 1 - UNIDADES 1 Fuerza y Masa - Sistemas de Unidades - Factores de Conversión de Unidades - Consistencia Dimensional - Cantidades Adimensionales - Problemas Resueltos - Problemas Propuestos. CAPITULO 2 - VARIABLES DE PROCESO 13 Generalidades - Volumen Específico - Gravedad Específica - Escalas de Gravedad Específica - Presión - Temperatura - Flujo de Masa y Flujo Volumétrico - Variables de Composición - Composición de Mezclas - Composición en Masa y Molar - Masa Molecular Media - Base de Cálculo - Base seca, húmeda y libre de un componente - Problemas Resueltos - Problemas Propuestos. CAPITULO 3 - GASES IDEALES 49 Leyes de los Gases Ideales - Condiciones Normales - Ecuación de Estado - Densidad de un Gas Ideal - Mezclas de Gases Ideales - Límite de Aplicación de las leyes de los Gases - Problemas Resueltos - Problemas Propuestos. CAPITULO 4 - MEZCLAS GAS-VAPOR 71 Vaporización - Presión de Vapor - Relación entre la Presión de Vapor y la Temperatura - Saturación - Saturación Relativa - Porcentaje de Saturación - Humedad - Humedad Absoluta - Humedad Relativa - Porcentaje de Humedad - Temperatura de Bulbo Seco - Temperatura de Bulbo Húmedo - Punto de Rocío - Saturación Adiabática - Diagrama de Humedad - Problemas Resueltos - Problemas Propuestos. CAPITULO 5 - BALANCE SIN REACCION QUIMICA 89 Clasificación de los Procesos - Diagramas de Flujo - Balances de Masa - Recomendaciones Generales para la Solución de Problemas - Operaciones Unitarias - Problemas Resueltos Operaciones de Mezclado - Problemas Resueltos Operaciones de Evaporación - Problemas Resueltos Operaciones de Secado - Problemas Resueltos Operaciones de Destilación - Problemas Resueltos Operaciones de Condensación - Problemas Resueltos de Balance en Unidades Múltiples - Problemas Resueltos en Operaciones de Recirculación y Derivación de Flujo - Problemas Propuestos.
5 CAPITULO 6 - BALANCE CON REACCION QUIMICA 197 Estequiometria - Generalidades - Reactivo Limitante y Reactivo en Exceso - Porcentaje en Exceso - Grado de Finalización - Empleo de las Unidades Molares en los Cálculos - Problemas Resueltos - Procesos Químicos y Problemas Resueltos CAPITULO 7 - BALANCE DE MATERIA EN 273 PROCESOS DE COMBUSTIÓN Combustión - Combustibles Gaseosos, Líquidos y Sólidos - Combustión Completa. Oxígeno Teórico y en Exceso - Combustión Incompleta - Análisis Orsat - Problemas Resueltos de Combustión y problemas propuestos. CAPITULO 8 - BALANCE DE MATERIA EN 309 PROCESOS DE OXIDACIÓN DE AZUFRE Y PIRITAS Oxidación de Azufre y Piritas - Problemas Resueltos de Oxidación de Azufre y Piritas y problemas propuestos. CAPITULO 9 - BALANCE DE MATERIA EN 333 PROCESOS DE METALURGIA Y ALTO HORNO Metalurgia y Alto Horno - Problemas Resueltos de Metalurgia y Alto Horno. Problemas propuestos Tabla 1 - Factores de Conversión de Unidades Tabla 2 - Elementos Químicos - Símbolos y Masas Atómicas. Tabla 3 - Presión de Vapor del Agua Tabla 4 Ecuación de Antoine Diagrama 1 - Diagrama de Cox Diagrama 2 - Diagrama de Humedad (en función de Y P ) Diagrama 3 Diagrama de humedad ( en función de Y R ) Bibliografía
6 CAPITULO 1 UNIDADES Los sistemas físicos se describen mediante ciertas medidas. Se utilizan cantidades primarias tales como la longitud, la masa y el tiempo como base de estas medidas. Las cantidades secundarias tales como la densidad, aceleración, velocidad, presión, etc.,se definen en términos de las cantidades primarias. FUERZA Y MASA. Mediante la segunda ley del movimiento de Newton la fuerza es proporcional a la masa por la aceleración. Para definir el peso se toma entonces el valor de la aceleración local de la gravedad así: F m a La conversión de esta proporcionalidad en ecuación se logra con la inclusión de una constante denominada g c. g F = m g c Tanto los sistemas absolutos como el sistema internacional se definen tomando el valor unitario para g c lo cual da como resultado la aparición de unidades de fuerza derivadas tales como la dina, el poundal, y el newton. En los sistemas de unidades de ingeniería el valor de g c viene definido por la unidad de masa y la unidad de fuerza utilizando como valor de la aceleración de la gravedad su valor normal (9,8 m/s 2, 32,17 pie/s 2 ). El uso de estos últimos sistemas elimina las unidades derivadas facilitando de esta manera los cálculos y la simplificación de unidades. En el sistema de unidades de Ingeniería, las ecuaciones correspondientes incluyen la constante g c. Su utilización está muy difundida en textos de Termodinámica, Transferencia de Fluídos, Transferencia de Calor y Transferencia de Masa.
7 BALANCE DE MATERIA : NESTOR GOODING GARAVITO 2 SISTEMAS DE UNIDADES Métrico Absoluto: Masa, g Longitud, cm Tiempo, s Temperatura, o K cm Fuerza, dina ( g x ) s 2 Inglés absoluto: Internacional: (SI) Masa, lb Longitud, pie Tiempo, s Temperatura, o R pie Fuerza, poundal ( lb x ) s 2 Masa, kg Longitud, m Tiempo, s Temperatura, o K m Fuerza, Newton (N)( kg x ) s 2 Ingeniería Métrico: Fuerza, g f, kg f Masa, g, kg Longitud, cm, m Tiempo, s Temperatura, o K Ingeniería Inglés: Fuerza, lb f Masa, lb Longitud, pie Tiempo, s Temperatura, o R
8 CAPITULO 1 : UNIDADES 3 FACTORES DE CONVERSION. Una cantidad en un sistema de unidades tiene su equivalencia en otro sistema. La relación unitaria entre estos dos valores es lo que se denomina factor de conversión. La multiplicación sucesiva de una misma cantidad por una serie de factores de conversión unitarios es el mecanismo utilizado para la conversión de unidades. CONSISTENCIA DIMENSIONAL Y CANTIDADES ADIMENSIONALES Una cantidad puede sumarse o restarse con otra sólo si sus unidades son iguales. Para que una ecuación sea válida debe ser dimensionalmente consistente, es decir que todos sus términos aditivos en ambos miembros deben tener las mismas unidades. Una cantidad adimensional es aquella cuya combinación de variables da un número sin unidades. En muchos casos deben realizarse las conversiones de unidades adecuadas para demostrar la adimensionalidad. PROBLEMAS RESUELTOS Determine cuántos litros hay en 5,27 pies 3 28,316 litros 5,27 pies 3 x = 149,2 litros pie Convertir una aceleración de 15 pies/s 2 a millas/hr 2. pie 1 milla (3600 s) 2 millas 15 x x = ,1 s pies hr 2 hr Convertir 1.3 onzas/cm 3 a kg/pie 3. onzas 1 lb kg (30,48 cm) 3 1,3 x x x cm 3 16 onzas 2,204 lb pie ,8 kg = pie 3
9 BALANCE DE MATERIA : NESTOR GOODING GARAVITO Convertir 38 dinas/cm 2 a lb f /pulg 2. dinas g f lb f (2,54 cm) 2 38 x x x cm dinas 453,59 gf pulg 2 lb f = 5,51 x 10-4 pulg Determine el número de pies 3 en un barril y en una caneca. 42 galones 1 pie 3 1 barril x x = 5,61 pies 3 barril 7,48 gal 55 gal 1 pie 3 1 caneca x x = 7,35 pies 3 caneca 7,48 gal Si el valor de g en el ecuador, al nivel del mar, es de 32,088 pies/s 2, y éste valor disminuye mas o menos en 0,001 pies/s 2 por cada 1000 pies de altitud. Cuánto pesa una persona de 200 lb a una altitud de 5000 pies sobre el nivel del mar? Disminución en el valor de g: 0,001 pies/s 2 pies x 5000 pies = 0, pies s 2 g = 32,088-0,005 = 32,083 pies/s 2 mg 200 lb x 32,083 pie/s 2 F (peso) = = g c (lb/lb f ) (32,17 pie/s 2 ) = 199,46 lb f
10 CAPITULO 1 : UNIDADES Un pie 3 de agua a 70 o F y presión atmosférica, pesa alrededor de 62,4 lb f en un punto donde g vale 32,17 pies/s 2. Cuánto pesará éste mismo volumen de agua en un lugar donde g = 32 pies/s 2? Como g = g c la masa del cuerpo será 62,4 lb. mg 62,4 lb x 32 pie/s 2 F (peso) = = = 62,07 lb f g c (lb/lb f )(32,17 pie/s 2 ) Un hombre de 175 lb experimenta una desaceleración (por ejemplo, en un accidente automovilístico) de 20 (g), donde g vale 32,17 pie/s 2. Cuánto vale la fuerza que actúa sobre el hombre en lb f? m a 175 lb x 20 x 32,17 pie/s 2 F = = = 3500 lb f g c (lb/lb f )(32,17 pie/s 2 ) Una masa de 1 kg se acelera con una fuerza de 4,5 kg f. Calcular la aceleración en m/s 2 F 4.5 kg f kg x 9.8 m/s 2 m a = x g c = x = 44.1 m 1 kg kg f s Cuál es el peso en Newton de un objeto cuya masa es 10 kg? F (peso) = mg = 10 kg x 9,8 m/s 2 = 98 N En flujo de fluídos la ecuación que expresa la caída de presión por fricción en una tubería es: 2 f L ρ v 2 Δ P = g c D donde: Δ P = caída de presión, lb f /pie 2 v = velocidad, pies/s ρ = densidad del fluído, lb/pie 3 L = longitud de la tubería, pies g c = constante, (lb/lb f )(pie/s 2 )
11 BALANCE DE MATERIA : NESTOR GOODING GARAVITO 6 D = diámetro de la tubería, pies Cuáles son las unidades del factor de fricción f? ( Δ P) (g c ) (D) f = (L) (ρ) (v 2 ) (lb f /pie 2 ) (lb/lb f ) (pie/s 2 ) (pie) f = = adimensional (pie) (lb/pie 3 ) (pie 2 /s 2 ) La potencia de emisión de un cuerpo negro depende de la cuarta potencia de la temperatura y está dada por la siguiente expresión: W = A T 4 en donde: W = potencia de emisión, BTU/hr-pie 2 A = constante de Stefan-Boltzman [0.171 x 10-8 BTU / (cm 2 ) (s) ( o K) 4 ] Cuál es el valor de A en ergio/(cm 2 ) (s) ( o K) 4? BTU ergio A = x 10-8 x (cm 2 ) (s) ( o K) x BTU A = ergio/(cm 2 ) (s) ( o K ) La ecuación para determinar la velocidad de transporte por difusión es K = 2πDρr. Esta velocidad es utilizada para separar el U 235 de U 238 en centrífugas con gas en contracorriente. Si K = velocidad de transporte del componente ligero hacia el centro de la centrífuga, gmol/cm.s D = coeficiente de difusión. ρ = densidad molar, gmol/cm 3 r = radio medio logarítmico, (r 2 - r 1 ) / ln(r 2 /r 1 ) donde "r" está en cm. Cuáles son las unidades de D?
12 CAPITULO 1 : UNIDADES 7 K gmol/(s) (cm) D = = = cm/s 2 πρ r (gmol/cm 3 ) (cm) La siguiente ecuación es dimensionalmente inconsistente en las unidades especificadas. Inserte un factor de conversión dimensionalmente apropiado para eliminar la inconsistencia. m= C A 2 2ρ( ΔP) 1 (D 2 /D 4 1) donde: m = flujo, lb/s A 2 = área de flujo, pie2 ρ = densidad, lb/pie 3 Δ P = caída de presión, psi D = diámetro, pies C = constante adimensional Para que las unidades de la ecuación resulten consistentes se introduce dentro del radical la constante g c, así: m= C A 2ρ( ΔP) 2 x 4 C 1 (D g 2 /D1) m = pie (lb / pie )(lb / pie )(lb /lb )(pie / s ) f f 2 = lb / s La siguiente es una ecuación para calcular el caudal de un vertedero en función de la altura alcanzada por el líquido dentro de éste: V = 0,01651 ( Δ Z) 2.45 donde: V está en litros/s Δ Z está en cm
13 BALANCE DE MATERIA : NESTOR GOODING GARAVITO 8 Desarrollar una ecuación similar donde V * esté dado en gal/mi y Δ Z * esté dado en pulgadas. gal 3,785 lt mi V * ( ) ( ) ( ) = 0,063 V * = V mi gal 60 s 2,54 cm Δ Z * (pulg) ( ) = 2,54 ( Δ Z * ) = Δ Z pulg Reemplazando estos valores en la ecuación original: 0,063 V * = 0,01651 [2,54( Δ Z * )] 2.45 V * = 2,571 ( Δ Z * ) 2.45 Esta última ecuación puede ser probada reemplazando un valor de Δ Z *, obteniendo un valor de V *, y comparando dicho valor con la ecuación original luego de hacer las conversiones de unidades respectivas. PROBLEMAS PROPUESTOS Utilizando el precio actual de la gasolina corriente en pesos/galón, determine el valor de 35 litros de gasolina Cuántos litros hay en una caneca y cuántas pulgadas cúbicas hay en un barril? Convertir: a) 10 millas/hr a km/mi b) 100 millas/hr a pies/s c) 5 g/cm 3 a lb/pie 3 d) 547 J/mi a HP
14 CAPITULO 1 : UNIDADES Calcular el número de: a) segundos en tres años b) centímetros cuadrados en una yarda cuadrada c) dinas/cm 2 en 1 lb f /pulg 2 d) onzas/ cm 3 en 1 kg/pie Convertir una milla cúbica por año a millones de galones por día Utilizando sólo los factores 1 pie=12 pulg, 1 pulg = 2,54 cm y 1 litro = 1000 cm 3. Encuentre el número de litros en 1 pie El pentano tiene una viscosidad de 0,23 centipoises a 25 o C. Si un poise equivale a 1 g/cm.s y 10 2 centipoises equivalen a 1 poise, calcule la viscosidad en lb/hr.pie Con qué fuerza en kg f se atrae una masa de 14 kg en un punto de la Tierra donde la aceleración de la gravedad es 30,2 pie/s Un cuerpo pesa a una altura de 8000 metros (g=32,07 pie/s 2 ) 10 libras. Si se utilizó una balanza de resorte calibrada a nivel del mar, cuál es la masa del cuerpo en kg? Un sistema tiene una masa de 20 lb. Cuál es la fuerza necesaria en kg para acelerarlo 15 pie/s 2 si su movimiento se realiza en un plano horizontal sin fricción? Cual es el peso en lb f de un objeto cuya masa es 10 lb? Cuál es el peso en poundal de un objeto cuya masa es g? Un cuerpo pesó 30 k f en un sitio donde la aceleración de la gravedad es 9.71 m/s 2. Cuál será la fuerza desarrollada en lb f y en N para que éste cuerpo se mueva sobre un plano horizontal con aceleración de 80 pie/s 2? Un instrumento para medir la aceleración de la gravedad en el mar se construye con un resorte del cual se suspende una masa de 0.24 kg. En un sitio de la Tierra, donde la aceleración local de la gravedad es 9.8 m/s 2,el resorte se extiende 0.61 cm. Cuando el paquete del instrumento se deposita
15 BALANCE DE MATERIA : NESTOR GOODING GARAVITO 10 sobre la superficie de Marte, emite a la Tierra la información que el resorte se ha extendido 0.20 cm. Cuál es la aceleración de la gravedad en Marte? El número de Reynolds es una cantidad adimensional que aparece con frecuencia en el análisis del flujo de fluídos. Para el flujo en tuberías se define como (Dvρ/µ), donde D es el diámetro de la tubería, v es la velocidad del fluído, ρ es la densidad del fluído, y µ es la viscosidad del fluído. Para un sistema en particular, D = 4 cm, v = 10 pies/s, ρ = 0.7 g/cm 3 µ = 0.18 centipoises. Calcular el número de Reynolds La densidad algunas veces se expresa como una función de la temperatura: ρ = ρ o + A t donde: ρ = densidad en lb/pie 3 a temperatura t ρ o = densidad en lb/pie 3 a temperatura t o t = temperatura en o F Cuáles son las unidades de A? En transferencia de calor se utiliza el número de Prandtal. N Pr = C p µ / k Demuestre que es adimensional e investigue y sugiera las unidades En transferencia de calor el número de Grashof está dado por: (L 3 ) (ρ 2 ) (g) (ß) (Δ t) N Gr = µ 2 Si : L = 12 cm g = aceleración normal de la gravedad. ρ = lb/pie 3 ß = 2.03 x 10-3 ( o R) -1 Δ t =80 o R µ = centipoises. Calcule el valor de N Gr.
16 CAPITULO 1 : UNIDADES La potencia al freno (W F ) de un motor utilizado para mover una bomba centrífuga está dado por la siguiente expresión: (F) (RPM) W F = 1500 donde: F = fuerza en kg f RPM = revoluciones por minuto del motor W F = potencia al freno en HP Desarrollar una fórmula donde F esté en newton (N) y la potencia al freno esté en kilovatios La ecuación de Colburn en transferencia de calor es: (h/cg) (Cµ/k) 0.66 = (0.023) / (DG/µ) 0.2 donde: C = capacidad calorífica, BTU/lb o F µ = viscosidad, lb/(hr) (pie) k = conductividad térmica, BTU / (hr) (pie 2 ) ( o F) / pie D = diámetro, pies G = velocidad másica, lb / (hr) (pie 2 ) Cuáles son las unidades del coeficiente de transferencia de calor "h"? La ecuación: µ = 3,24 t (1,02/t) se utiliza para hallar el valor de la viscosidad µ, en lb/pie.s en función del tiempo t dado en segundos. Hallar una ecuación equivalente que permita calcular la viscosidad en centipoises como una función del tiempo dado en minutos Una investigación experimental de la velocidad de transferencia de masa del SO 2 desde una corriente de aire hasta dentro del agua indicó que el coeficiente de transferencia de masa se podría correlacionar mediante una ecuación de la forma:
17 BALANCE DE MATERIA : NESTOR GOODING GARAVITO 12 k x = K v en la que k x, es el coeficiente de transferencia de masa en mol / (cm 2 x s) y v es la velocidad en cm/s. Tiene dimensiones la constante K? Cuáles son? Si se expresa la velocidad en pies/s, y queremos conservar la misma forma de la relación, cuáles serían las unidades de K' si k x se encuentra aún en mol/(cm 2 x s), donde K' es el nuevo coeficiente de la fórmula? La velocidad de transferencia de masa entre un gas y un líquido en flujo a contracorriente se expresa por la ecuación: donde: (dm/dt) = k x A Δ c k x = coeficiente de transferencia de masa, cm/s A = área disponible de transferencia. Δ c = diferencia de concentración entre el material en la fase gaseosa y la concentración en la fase líquida, en g-mol/cm 3. t = tiempo, s Cuáles son las unidades de m? Si la ecuación anterior se reemplaza por: (dm/dt) = k' x A Δ p donde Δ p = diferencia de presión parcial y tiene las unidades de kpa cuáles son las unidades de k' x?
18 CAPITULO 2 VARIABLES DE PROCESO Dentro de una planta química se desarrollan en general OPERACIONES UNITARIAS y PROCESOS QUIMICOS según ocurran sólo cambios físicos o cambios químicos respectivamente. La unificación de todos ellos constituye la llamada unidad de proceso. En general, el balance de materia de una unidad de proceso implica balances individuales en los diferentes aparatos que la forman. Cualquiera que sea la situación, existirán siempre materiales que entran y materiales que salen. En el diseño de éstas unidades individuales, así como en el control de operación de las mismas deben conocerse una serie de datos tales como: masas, volúmenes, presiones, temperaturas, composiciones, etc.,llamadas también variables de proceso. UNIDAD Entradas DE Salidas PROCESO VOLUMEN ESPECIFICO Se denomina por la letra (v) y puede definirse como el volumen por unidad de masa. Se expresa generalmente en m 3 /kg, lt/kg, pie 3 /lb, etc. El inverso del volumen específico corresponde a la densidad (ρ). El volumen específico de sólidos y líquidos resulta relativamente independiente de la presión y la temperatura y su valor puede consultarse en tablas.
19 BALANCE DE MATERIA : NESTOR GOODING GARAVITO 14 El volumen específico de gases y vapores es una función de la presión y la temperatura y su cálculo implica el conocimiento de las relaciones de estado correspondientes. La densidad relativa o gravedad específica (G) es el cociente entre la densidad de la sustancia y la densidad de una sustancia de referencia bajo condiciones específicas. La referencia utilizada en el caso de sólidos y líquidos es el agua a 4 O C, la cual posee una densidad de 1 g/cm 3 o 62,43 lb/pie 3. La siguiente notación se utiliza: G (20/4) o c = 0,7 Indica la gravedad específica de la sustancia a 20 o C respecto al agua a 4 o C. Escalas de Gravedad Específica. Existen varias escalas en las cuales la gravedad específica se expresa en "grados" y que constituyen relaciones matemáticas arbitrarias. Escala Baumé. Se utiliza para líquidos más ligeros y más pesados que el agua. Está definida por las siguientes expresiones: Para más ligeros que el agua: 140 ( o Bé) Grados Baumé = G Para más pesados que el agua: 145 ( o Bé) Grados Baumé = G Escala API. Es la escala adoptada por el Instituto Americano del Petróleo para expresar la densidad de productos derivados del petróleo. Teniendo en cuenta que la mayoría de éstos productos son más ligeros que el agua existe sólo la siguiente expresión: ( o API) Grados API = G
20 CAPITULO 2 : VARIABLES DE PROCESO 15 Escala Twaddell. Se utiliza solamente para líquidos más pesados que el agua y se define por: ( o Tw) = Grados Twaddell = 200 (G - 1) Escala Brix. Es una escala arbitraria y expresa el porcentaje en peso de azúcar en una solución. Un grado Brix corresponde a 1% en peso de azúcar. 400 ( o Bx) Grados Brix = G PRESION La presión en un punto de un fluído es la misma en todas direcciones y puede definirse como la componente normal de fuerza por unidad de área. Se expresa generalmente en atmósferas, kg f /cm 2, pascales (N/m 2 ) y lb f /pulg 2 (psi). Los instrumentos utilizados para medir la presión se llaman manómetros y el más sencillo de todos ellos es un tubo doblado en forma de U, el cual está conectado por un extremo a la atmósfera y por el otro al sistema cuya presión se desea medir. Si el sistema se encuentra a una presión mayor que la presión atmosférica el valor medido corresponde a la presión manométrica, pero si el sistema se encuentra a una presión por debajo de la presión atmosférica la presión se denomina presión de vacío. Midiendo la altura Z y conociendo la densidad (ρ) del líquido manométrico, cuando el fluído de sello (fluído que corresponde al sistema) tiene una densidad despreciable con respecto a la del líquido del manómetro, la presión manométrica o de vacío ( ver figura ) se calcula mediante la siguiente fórmula: P = ρ g Z ( sistemas absolutos o Internacional) P = ρ g Z / g c ( sistemas de Ingeniería) Se denomina presión absoluta al valor de la presión en un punto respecto al vacío absoluto o presión cero. Los diagramas siguientes indican el cálculo según el caso. No pueden existir presiones negativas. Para calcular el valor de la presión atmosférica o barométrica es necesario disponer de un barómetro, el cual es un dispositivo que contiene mercurio y mide la presión atmosférica del lugar respecto al vacío.
21 BALANCE DE MATERIA : NESTOR GOODING GARAVITO 16 A (P A ) abs = P atm + P m B (P B ) abs = P atm - P v C P C = P atm DIAGRAMA COMPARATIVO DE PRESIONES P A P m P C Presión Atmosférica P atm P v P B Vacío Absoluto P = 0
22 CAPITULO 2 : VARIABLES DE PROCESO 17 TEMPERATURA La temperatura puede definirse como la fuerza motriz que produce una transferencia de calor. Dos cuerpos están a la misma temperatura si no hay transferencia de calor cuando se ponen en contacto. La temperatura se mide mediante los termómetros y las escalas más usuales son la Celcius o Centígrada y la Fahrenheit. Se seleccionan dos puntos fijos para normalizar un termómetro, generalmente el punto de congelación y el punto de ebullición del agua a presión de 1 atm. En la escala Centígrada ( o C) el punto de congelación del agua es definido como 0 o C y el punto de ebullición del agua como 100 o C. La distancia entre estos dos puntos es dividida en 100 partes iguales y cada división corresponde a 1 o C. En la escala Fahrenheit ( o F) se define el punto de congelación del agua como 32 o F y el punto de ebullición como 212 o F. La distancia entre estos dos puntos es dividida en 180 partes iguales y cada división es 1 o F. Las dos escalas se relacionan mediante la fórmula: t ( o F) = 1,8 t ( o C) + 32 La relación de magnitud entre las dos escalas es: ( o C / o F) = 1,8 Se demuestra experimentalmente que la presión de un gas se incrementa en 1/273 por cada grado centígrado de aumento de temperatura, y en la misma forma decrece 1/273 por cada grado centígrado de disminución de temperatura. Se concluye entonces que la presión ejercida por un gas cesaría cuando su temperatura llegase a 273 o C bajo cero. Esta temperatura equivalente a -273 o C es llamada cero absoluto de temperatura y es el punto de partida de la escala Kelvin absoluta. En la escala Fahrenheit el cero absoluto corresponde a -460 o F y la escala que toma este punto de partida se denomina escala Rankine absoluta. La relación entre estas dos escalas es: T ( o R) = 1,8 (T o K) La relación de magnitud entre las dos es: ( o K / o R) = 1,8 Las siguientes fórmulas y relaciones son también de gran utilidad:
23 BALANCE DE MATERIA : NESTOR GOODING GARAVITO 18 T ( o K) = t ( o C) T ( o R) = t ( o F) ( o K / o C) = 1 ; ( o R / o F) = 1 Para convertir una diferencia de temperaturas puede utilizarse: (ΔT o R) = ( ΔT o K) x 1,8 ( Δ t o F) = ( Δ t o C) x 1,8 ( Δ T o R) = ( Δ t o F) ( Δ T o K) = ( Δ t o C) ESCALAS DE TEMPERATURA t o C t o F T o K T o R
24 CAPITULO 2 : VARIABLES DE PROCESO 19 FLUJO DE MASA Y FLUJO VOLUMETRICO El movimiento de material o masa de un punto a otro recibe el nombre de flujo. Se o denomina flujo másico ( m ) a la masa transportada en la unidad de tiempo (masa/tiempo) y se denomina caudal o flujo volumétrico ( V ) al volumen transportado en la unidad de tiempo (volumen / tiempo). El flujo másico en condiciones estables es el mismo en todos los puntos de un ducto o tubería y puede calcularse a partir de la ecuación: o o m = v A ρ = V ρ o donde: v = velocidad lineal de flujo A = área de la sección de flujo ρ = densidad del fluído VARIABLES DE COMPOSICION Elementos y Compuestos Químicos. La masa atómica de un elemento es la masa de un átomo tomada en una escala donde el isótopo del carbono ( 12 C) cuyo núcleo está formado por seis neutrones y seis protones, tiene una masa atómica exacta de 12. Para las expresiones matemáticas que se verán más adelante puede representarse por la letra A y su forma dimensional es (at -1 ). Los valores de las masas atómicas pueden tomarse de una tabla periódica o de la tabla 2 del libro. Según sean las unidades tomadas para la masa de un elemento, la relación entre ésta y su masa atómica constituye la unidad atómica correspondiente. m (g) = número de g-at A (at -1 ) m (kg) = número de kg-at A (at -1 )
25 BALANCE DE MATERIA : NESTOR GOODING GARAVITO 20 m (Tn) = número de Tn-at A (at -1 ) m (lb) = número de lb-at A (at -1 ) La masa molecular de un compuesto se determina sumando las masas atómicas de los átomos que constituyen la molécula del compuesto. Para las respectivas expresiones matemáticas se representa por M y su forma dimensional es (mol -1 ). Según sean las unidades tomadas para la masa de un compuesto, la relación entre ésta y su masa molecular constituye una unidad molar. m (g) = número de g-mol M (mol -1 ) m (kg) = número de kg-mol M (mol -1 ) m (Tn) = número de Tn-mol M (mol -1) m (lb) = número de lb-mol M (mol -1 ) COMPOSICION DE MEZCLAS Considerando un sistema formado por "n" componentes. Designando por la letra "i" a un componente específico en la mezcla y además: m = peso o masa (g, kg, lb, Tn) V = volumen (lt, m 3, pies 3, gal)
26 CAPITULO 2 : VARIABLES DE PROCESO 21 M = masa molecular de una sustancia (mol -1 ) A = masa atómica de un elemento (at -1 ) a) Porcentaje en peso. El porcentaje en peso de cada componente se obtiene dividiendo su peso respectivo por el peso total del sistema y multiplicando por 100. m i % en peso de i = x 100 m i Se utiliza generalmente para expresar la composición de mezclas de sólidos y líquidos. En general no se emplea para mezclas de gases. b) Porcentaje en Volumen. El tanto por ciento en volumen de cada componente se obtiene dividiendo su volumen individual por el volumen total de sistema y multiplicando por 100. V i % en volumen de i = x 100 V i Se utiliza para expresar la composición de mezclas de gases. c) Fracción Atómica. Si el compuesto es una mezcla de átomos, el número total de átomos de "i" dividido por el número total de átomos presentes, se denomina fracción atómica de "i". (m i /A i ) Fracción atómica de i = = N i (m i /A i ) d) Fracción en masa. El porcentaje en peso o masa dividido por 100 corresponde a la fracción en masa y se representa por la letra w m i Fracción en masa de i = w i = Σ m i
27 BALANCE DE MATERIA : NESTOR GOODING GARAVITO 22 e) Fracción molar. Si el sistema es una mezcla de varias clases de moles, el número total de moles de "i" dividido por el número total de moles de mezcla es la fracción molar de "i". (m i /M i ) Fracción molar de i = = x i (m i /M i ) x i = 1 f) Porcentaje atómico. El tanto por ciento atómico de un componente se encuentra multiplicando su fracción atómica por 100. % atómico de i = N i x 100 g) Porcentaje en peso o masa. El tanto por ciento en peso o masa de un componente se encuentra multiplicando su fracción en peso o masa por 100. % en peso de i = w i x 100 h) Porcentaje molar. El tanto por ciento molar de un componente se encuentra multiplicando su fracción molar por 100. % molar de i = x i x 100 i) Concentración. Se utiliza generalmente en soluciones y está relacionada casi siempre con el volumen de la solución. masa del componente i Concentración másica = volumen de la solución moles del componente i Concentración molar = volumen de la solución
28 CAPITULO 2 : VARIABLES DE PROCESO 23 Las formas más conocidas de expresar la concentración de soluciones son las siguientes: Molaridad (M) = g-mol de soluto/lt de solución Molalidad (m) = g-mol de soluto/kg de solvente Normalidad (N) = equivalente-g de soluto/lt solución En éstas últimas se supone que la mezcla o solución está formada únicamente por dos sustancias. La sustancia disuelta se llama soluto y el líquido en el cual se disuelve se llama solvente. MASA MOLECULAR MEDIA Conocer la masa molecular media es de gran ayuda cuando se tiene una mezcla gaseosa. Para su determinación es necesario conocer su composición molar. La siguiente fórmula puede utilizarse: M = (M i x i ) M i = masa molecular del componente i x i = fracción molar del componente i BASE DE CALCULO ( B.C. ) Normalmente, todos los cálculos relacionados con un problema dado se establecen con respecto a una cantidad específica de una de las corrientes de materiales que entran o salen del proceso. Esta cantidad de materia se designa como base de cálculo y se deberá establecer específicamente como primera etapa en la solución del problema. Con frecuencia el planteamiento del problema lleva consigo la base de cálculo. Cuando se conoce la composición en peso de una mezcla se recomienda tomar una base de 100 unidades de masa o peso, ejemplo: 100 g, 100 kg, 100 lb. Si por el contrario se conoce la composición molar de la mezcla, la recomendación es tomar 100 unidades molares de la mezcla, ejemplo: 100 g-mol, 100 kg-mol, 100 lbmol.
29 BALANCE DE MATERIA : NESTOR GOODING GARAVITO 24 BASE SECA, BASE HUMEDA Y BASE LIBRE DE UN COMPONENTE Se dice que un material es húmedo cuando el agua es uno de sus componentes. La composición que incluye el agua se dice que es en base húmeda. Cuando en la composición se excluye el agua (aún estando presente), se dice que está en base seca. En el caso de algunas mezclas gaseosas, la composición está dada sin tener en cuenta uno de los componentes. En éste caso, dicho componente no aparece en los porcentajes, aunque sí está presente en la mezcla y se dice que la composición es libre de un componente. En algunas operaciones, especialmente en el secado de sólidos, se acostumbra a expresar el contenido de humedad por unidad de peso de sólido seco o por unidad de peso de sólido húmedo. A ésta modalidad multiplicada por 100 se le denomina porcentaje de humedad en base seca y en base húmeda respectivamente. PROBLEMAS RESUELTOS El ácido sulfúrico puro a 20 o C tiene una densidad de lb/pie Cuál es su densidad en grados Baumé ( o Bé)? (ρ) H 2 SO 4 (20 o C) lb/pie 3 G = = = (ρ ) H2 O (4 o C) lb/pie 3 Por ser un líquido más pesado que el agua se utiliza la relación: 145 o Bé = G 145 o Bé = = Se llena un recipiente cuyo volumen es 3.5 galones con gasolina corriente y se pesa. El peso de la gasolina fué 9.77 kg. Cuál es la densidad expresada en grados API? m 9.77 kg 1 gal kg ρ = = x = V 3.5 gal lt lt
30 CAPITULO 2 : VARIABLES DE PROCESO 25 ρ = g/cm 3 ρ gasolina g/cm 3 G = = = ρ agua 1 g/cm 3 La densidad en grados API será: = o API En el condensador de una turbina de vapor se mantiene la presión absoluta de 3,92 kpa. Qué marcarán los vacuómetros graduados en mm Hg, si en un caso indica el barómetro 735 mm Hg y en otro caso 764 mm Hg? 760 mm Hg P abs = 3,92 kpa x = 29,41 mm Hg 101,3 kpa P v = P atm - P abs = ,41 = 705,59 mm Hg P v = ,41 = 734,59 mm Hg Un pistón tiene un área de 450 cm 2. Calcular la masa del pistón en kg si éste ejerce una presión de 20 kpa por encima de la presión atmosférica sobre un gas encerrado en el cilindro. P = 20 kpa = N/m N 1 m F = P.A = x 450 cm 2 x ( ) 2 m cm F = 900 N
31 BALANCE DE MATERIA : NESTOR GOODING GARAVITO N F = m g > m = = 91,83 kg 9,8 m/s Un sistema de alimentación por gravedad se emplea para alimentar agua a un aparato. Se requiere una presión mínima de 30 psig a la entrada del aparato. Cuál debe ser la elevación del nivel del agua por encima del aparato? P = ρ g Z Se utiliza la presión manométrica en el cálculo. 101,3 kpa P = 30 psi x = 206,734 kpa 14,7 psi P Z = x = 21,09 m ρ g (1000 kg/m 3 )(9,8 m/s 2 ) Un fluído manométrico especial tiene una gravedad específica de 2,95 y se utiliza para medir una presión de 17,5 psia en un lugar donde la presión barométrica es 28,9 pulg de Hg. Cuál será la altura alcanzada por el fluído manométrico? ρ L G = = 2,95 ρ agua ρ L = 2,95 x 1000 kg/m 3 = 2950 kg/m 3 101,3 kpa P abs = 17,5 psi x = 120,59 kpa 14,7 psi
32 CAPITULO 2 : VARIABLES DE PROCESO ,3 kpa P atm = 28,9 pulg Hg x = 97,84 kpa 29,92 pulg Hg P abs = P atm + P m P m = 120,59-97,84 = 22,75 kpa P Pa Z = = = 0,787 m = 78,7 cm ρ g (2950 kg/m 3 )(9,8 m/s 2 ) Cuál es la temperatura en o R de un fluído cuya temperatura es 67 o C? La conversión puede hacerse por dos caminos: T o K = t o C = = o K T o R = 1.8 (T o K) = 1.8 (340.16) = o R t o F = 1.8 (t o C) + 32 = 1.8 (67) + 32 = o F T o R = t o F = = o R Para fines prácticos y tal como se indica en la teoría, el cero absoluto puede tomarse en forma aproximada como -273 o C y o F. El cálculo efectuado con estos dos últimos valores no resulta exactamente igual en los dos casos El incremento de temperatura del agua al pasar por un calentador es 80 o F. Cuál es éste en o C, o R, y o K? Δ t o C = = 100 o C = Δ T o K Δ t o F = = 180 o F =Δ T o R Δ t o F Δ T o R = = 1.8 Δ t o C Δ T o K
33 BALANCE DE MATERIA : NESTOR GOODING GARAVITO 28 Para el presente problema se tendrá: Δ t o C = (80/1.8) = 44.4 o C = Δ T o K Δ t o F = Δ T o R = 80 o R Convertir en grados centígrados las siguientes temperaturas medidas con un termómetro Fahrenheit: -275, 24, 162, t o C = (t o F - 32) /1,8 t o C = ( ) /1,8 = - 170,5 o C t o C = (24-32) /1,8 = - 4,44 o C t o C = (162-32) /1,8 = 72,2 o C t o C = ( ) /1,8 = 796,1 o C Convertir en grados Fahrenheit las siguientes temperaturas medidas en grados centígrados: - 186, -12, 127, 893. t o F = 1,8 t o C + 32 t o F = 1,8 (-186) + 32 = - 302,8 o F t o F = 1,8 ( -12) + 32 = 10,4 o F t o F = 1,8(127) + 32 = 260,6 o F t o F = 1,8(893) + 32 = 1639,4 o F Dos termómetros, uno Fahrenheit y otro Centígrado están sumergidos en un fluído e indican la misma lectura. Cuál es esa lectura en o R y o K? t o C = t o F = t t = 1,8 t + 32 > t = (- 32/0,8) = - 40
34 CAPITULO 2 : VARIABLES DE PROCESO 29 t = - 40 o C = - 40 o F El tetracloroetano tiene una densidad relativa de Calcular la masa en libras de tetracloroetano dentro de un recipiente de 120 galones y el flujo volumétrico en lt/mi para llenar este recipiente en 1 hora. ρ= G x ρ agua = x = lb/pie 3 lb pie 3 m = V x ρ = 120 gal x x pie gal m = lb V 120 gal lt hr lt o V = = x x = 7.57 θ 1 hr gal 60 mi mi Por una tubería se descargan 95 galones por minuto (GPM) de un líquido sobre un tanque. Si la capacidad del tanque es de galones, en cuánto tiempo se llenará el tanque? o V = V/ θ ----> θ = (V/V) V 5000 gal θ = = = 52,63 mi o V 95 gal/mi Una bomba descarga 75 GPM de un líquido cuya gravedad específica es 0,96. Encuentre: a) El flujo en lb/mi. b) El tiempo necesario para llenar un tanque vertical de 20 pies de diámetro y 15 pies de altura. G =ρ L /ρ agua > ρ L = 0,96 x 62,43 lb/pie 3 ρ L = 59,93 lb/pie 3
35 BALANCE DE MATERIA : NESTOR GOODING GARAVITO 30 o o V gal lb pie 3 a) m = x ρ = 75 x 59,93 x mi pie 3 7,48 gal m = 600,9 lb/mi π D 2 π (20) 2 b) V = Z = x 15 = 4 712,3 pies o V V V 4 712,3 7,48 gal = > θ = x x o θ V 75 gal/mi pie 3 θ = 470 mi Se bombea agua hacia un tanque cuyo diámetro es 10 pies a velocidad estable. El nivel del tanque se incrementa en 16 pulgadas por hora. a) Cuántos galones por minuto son bombeados? b) Si se utiliza una tubería de 6 pulg de diámetro para llenar el tanque, Cuál es la velocidad del agua en la tubería en pies/mi? a) Area del tanque = (πd 2 /4) = (100 π /4) = pies 2 La velocidad lineal respecto al tanque es: 16 pulg pie hr pies v = x x = hr 12 pulg 60 mi mi El flujo volumétrico en gal/mi será: pies o V = v x A = x pies 2 mi
36 CAPITULO 2 : VARIABLES DE PROCESO 31 = pies 3 /mi pies gal gal o V = x = mi pie 3 mi b) área de la tubería = (πd 2 /4) = (36 π /4) = pulg pulg 2 x (pie 2 /144 pulg 2 ) = pies 2 Teniendo en cuenta que el flujo volumétrico es el mismo, la velocidad del agua en la tubería será: o V pies 3 /mi v = = = 8.8 pies/mi A pies Cuántos g-at de hidrógeno hay en 1 libra de H 2 SO 4? g H 2 SO 4 g-mol H 2 SO 4 2 g-at H 1 lb H 2 SO 4 x x x lb H 2 SO 4 98 g H 2 SO 4 g-mol H 2 SO 4 = 9.25 g-at H Cuántos g-mol de CaCO 3 hay en 2 kg? kg-mol CaCO g-mol CaCO 3 2 kg CaCO 3 x x = 20 g-mol CaCO kg CaCO 3 kg-mol CaCO Cuántos gramos de cloro hay en 2.4 g-mol de HCl? 1 g-at Cl g Cl 2.4 g-mol HCl x x = 85.1 g Cl g-mol HCl g-at Cl
37 BALANCE DE MATERIA : NESTOR GOODING GARAVITO En 1.4 toneladas de Fe 2 O 3, cuántas lb-mol hay? kg Fe 2 O lb Fe 2 O 3 lb-mol Fe 2 O Tn Fe 2 O 3 x x x Tn Fe 2 O 3 kg Fe 2 O lb Fe 2 O 3 = lb-mol Fe 2 O Cuántos g-mol de oxígeno hay en 430 g de SO 3? g-mol SO 3 3 g-at O g-mol O g SO 3 x x x 80 g SO 3 g-mol SO 3 2 g-at O = 8.06 g-mol O Se mezclan 20 kg de CaCO 3 puro con 45 kg de caliza cuya composición en peso es: CaCO 3 81%, MgCO 3 10% y H 2 O 9%. Cuál es la composición en peso de la mezcla? CaCO 3 en caliza = 45 kg x 0.81 = kg CaCO 3 total = = kg MgCO 3 = 45 kg x 0.1 = 4.5 kg H 2 O = 45 kg x 0.09 = 4.05 kg Masa total de mezcla = = 65 kg Composición en peso: CaCO 3 : (56.45/65) x 100 = % MgCO 3 : (4.5/65) x 100 = 6.92 % H 2 O : (4.05/65) x 100 = 6.23 %
38 CAPITULO 2 : VARIABLES DE PROCESO Un mineral de hierro contiene: Fe 2 O 3 80% en peso, MnO 1%, SiO 2 12%, Al 2 O 3 3%, H 2 O 4%. Por cada tonelada de mineral calcular: a) Los kilogramos de Fe y su porcentaje. b) Los kg-at de Si. c) Los kg-mol de H 2. d) Los kg-mol de O 2. Base de Cálculo (B.C.): 1 tonelada de mineral a) Fe 2 O 3 en el mineral = kg x 0.8 = 800 kg kg-mol Fe 2 O 3 2 kg-at Fe kg Fe 800 kg Fe 2 O 3 x x x kg Fe 2 O 3 kg-mol Fe 2 O 3 kg-at Fe = 559 kg Fe % de Fe = (559/1 000) x 100 = 55.9 % b) SiO 2 en el mineral = kg x 0.12 = 120 kg kg-mol SiO 2 1 kg-at Si 120 kg SiO 2 x x = 1.99 kg-at Si 60.1 kg SiO 2 1 kg-mol SiO 2 c) H 2 O en el mineral = kg x 0.04 = 40 kg kg-mol H 2 O 1 kg-mol H 2 40 kg H 2 O x x 18 kg H 2 O 1 kg-mol H 2 O = 2.22 kg-mol H 2 d) El oxígeno está contenido en todos los componentes, luego hay que determinarlo por separado y sumar. kg-mol Fe 2 O 3 3 kg-at O 800 kg Fe 2 O 3 x x kg Fe 2 O 3 kg-mol Fe 2 O 3
39 BALANCE DE MATERIA : NESTOR GOODING GARAVITO 34 = kg-at O kg-mol MnO 1 kg-at O 10 kg MnO x x = kg-at O kg MnO kg-mol MnO kg-mol SiO 2 2 kg-at O 120 kg SiO 2 x x 60.1 kg SiO 2 kg-mol SiO 2 = kg-at O kg-mol Al 2 O 3 3 kg-at O 30 kg Al 2 O 3 x x 102 kg Al 2 O 3 kg-mol Al 2 O 3 = kg-at O kg-mol H 2 O 1 kg-at O 40 kg H 2 O x x = 2.22 kg-at O 18 kg H 2 O kg-mol H 2 O Oxígeno total = kg-mol O 2 Oxígeno total = kg-at x 2 kg-at O = kg-mol O Se mezclan 12 galones de un líquido A cuya densidad relativa es 0.77 con 25 galones de otro líquido B cuya densidad relativa es Calcular el porcentaje en peso de la mezcla y la densidad relativa de la mezcla si los volúmenes son aditivos. ρ A = G A x ρ agua = 0.77 x = lb/pie 3 ρ B = G B x ρ agua = 0.86 x = lb/pie 3 lb pie 3 m A = V A x ρ A = 12 gal x x pie gal m A = lb
40 CAPITULO 2 : VARIABLES DE PROCESO 35 lb pie 3 m B = V B x ρ B = 25 gal x x pie gal m B = lb m T = = lb % peso de A = (77.11/256.52) x 100 = % % peso de B = (179.41/256.52) x 100 = % pie 3 V T = V A + V B = = 37 gal x 7.48 gal V T = 4.94 pies 3 ρ mezcla = (m T /V T ) =(256.52/4.94) = lb/pie 3 ρ lb/pie 3 G = = = ρ agua lb/pie Una mezcla de alcohol etílico y agua contiene 80% en volumen de alcohol a 15.5 o C y su densidad relativa es Cuál será el porcentaje en peso de alcohol etílico? B.C.: 100 litros de mezcla. H 2 O en la mezcla = 100 lt x 0.20 = 20 litros m agua = 20 lt x (1 kg/lt) = 20 kg ρ solución = x 1 kg/lt = kg/lt m solución = V x ρ = 100 lt x kg/lt m solución = kg
41 BALANCE DE MATERIA : NESTOR GOODING GARAVITO 36 % peso de agua = (20/86.38) x 100 = % % peso de alcohol = = % Se mezclan 100 g de agua con 100 g de H 2 SO 4. Cuántos g-mol de H 2 SO 4 hay por cada g-mol de agua? g-mol H 2 O 100 g H 2 O x = 5.55 g-mol H 2 O 18 g H 2 O g-mol H 2 SO g H 2 SO 4 x = 1.02 g-mol H 2 SO 4 98 g H 2 SO g-mol H 2 SO 4 g-mol H 2 SO 4 = g-mol H 2 O g-mol H 2 O Se disuelve un gramo de KOH en 670 cm 3 de agua, cuál es la molalidad de la solución formada? g-mol KOH 1 g KOH x = g-mol KOH 56.1 g KOH g-mol KOH cm 3 g-mol KOH x = cm 3 H 2 O lt H 2 O lt H 2 O Una solución de sulfato férrico, Fe 2 (SO 4 ) 3, contiene 16% en peso de sulfato y su densidad relativa es Determinar la concentración molar en lbmol/pie 3 de solución y la molaridad (g-mol/lt de solución). B.C.: 100 lb de solución. lb-mol Fe 2 (SO 4 ) 3 16 lb Fe 2 (SO 4 ) 3 x = 0.04 lb-mol Fe 2 (SO 4 ) lb Fe 2 (SO 4 ) 3
42 CAPITULO 2 : VARIABLES DE PROCESO 37 lb lb ρ = G x ρ agua = x = pie 3 pie 3 m 100 lb V = = = pie 3 ρ lb/pie 3 Concentración molar = 0.04 lb-mol/ pies 3 = lb-mol/pie 3 Molaridad = x (453.59/28.32) = Una aleación de cobre y níquel contiene 40% de níquel, cuál es la fracción atómica de cobre? B.C.: 100 g de aleación. Ni : 100 g x 0.4 = 40 g Cu : 100 g x 0.6 = 60 g g-at Ni 40 g Ni x = g-at Ni g Ni g-at Cu 60 g Cu x = g-at Cu g Cu g-at de aleación = = N Ni = (0.6813/1.6255) = N Cu = (0.9442/1.6255) = N Ni + N Cu = = Un gas combustible tiene la siguiente composición molar: O 2 5%, N 2 80% y CO 15%. Calcular:
43 BALANCE DE MATERIA : NESTOR GOODING GARAVITO 38 a) La masa molecular media. b) La composición en peso. a) M = (M i x i ) M = (32 x x x 0.15) = 28.2 mol -1 b) B.C.: 100 g-mol de gas combustible. O 2 5 g-mol x 32 mol -1 = 160 g N 2 80 g-mol x 28 mol -1 = g CO 15 g-mol x 28 mol -1 = 420 g Total g Composición en peso: O 2 (160/2 820) x 100 = 5.67 % N 2 (2 240/2 820) x 100 = % CO (420/2 820) x 100 = % Para cálculos de combustión el aire se toma con la siguiente composición molar: O 2 21% y N 2 79%. Cuál es su composición en peso? B.C.: 100 g-mol de aire Composición en peso: O 2 N 2 21 g-mol x 32 mol -1 = 672 g 79 g-mol x 28 mol -1 = g Total g O 2 (672/2 884) x 100 = 23.3 % N 2 (2 212/2 884) x 100 = 76.7 %
44 CAPITULO 2 : VARIABLES DE PROCESO Una mezcla de oxígeno y nitrógeno tiene un 43% en peso de oxígeno, cuál es la fracción molar de N 2? B.C.: 100 g de mezcla. O 2 N 2 43 g x (g-mol/32 g) = g-mol 57 g x (g-mol/28 g) = g-mol Total g-mol x nitrógeno = (2.035/3.378) = El arrabio producido en un alto horno sale libre de humedad, pero al analizarlo se encontró que contenía: Fe 84.72% en peso, C 3.15%, Si 1.35%, Mn 0.72%, H 2 O 10.06%. Cuál era el porcentaje en peso de hierro al salir del horno? B.C.: 100 kg de arrabio húmedo. arrabio seco = = kg % en peso de Fe = (84.72/89.94) x 100 = % peso Los gases que salen de un quemador de azufre tienen la siguiente composición en base libre de SO 3 : SO %, O % y N %. Se sabe también que hay 6.08 g de SO 3 por cada 100 g de gas libre de SO 3. Cuál es el porcentaje molar de SO 3 en la mezcla? B.C.: 100 g-mol de gas libre de SO 3. M = (64 x x x ) El SO 3 en el gas será: M = mol -1 Masa de gas libre de SO 3 = 100 g-mol x mol -1 = g
45 BALANCE DE MATERIA : NESTOR GOODING GARAVITO g SO 3 x g gas libre SO g gas libre SO 3 = g SO 3 g-mol SO g SO 3 x = g-mol SO 3 80 g SO 3 Moles totales de gas = g-mol % molar SO 3 = (2.418/ ) x 100 = 2.36 % a) Convertir 60% de agua (b.s.) a base húmeda. b) Convertir 60% de agua (b.h.) a base seca. a) B.C.: 100 g de material seco. 60 g de agua 100 g de material seco Material húmedo = 160 g % de agua (b.h.) = (60/160) x 100 = 37.5 % b) B.C.: 100 g de material húmedo. 60 g de agua 40 g de material seco % de agua (b.s.) = (60/40) x 100 = 150 % Se mezclan 150 lb de un sólido húmedo que contiene 75% de agua (b.s.) con 18 lb de agua. Cuál es el porcentaje de agua de la mezcla resultante en base seca y en base húmeda? B.C.: 150 lb de sólido húmedo (s.h.)
46 CAPITULO 2 : VARIABLES DE PROCESO lb agua x 150 lb s.h. = lb agua 175 lb s.h. Sólido seco = = lb Agua total = = lb Sólido húmedo final = = 168 lb % Agua (b.h.) = (82.28/168) x 100 = % % Agua (b.s.) = (82.28/85.72) x 100 = % PROBLEMAS PROPUESTOS La densidad de una cierta solución es de 7.3 lb/galón a 80 o F. Cuántos pies 3 de esta solución ocuparán 6 toneladas a 80 o F? En un colector de vapor hay 300 kg de vapor de agua. Determine el volumen V del colector, en galones, si el volumen específico del vapor es 20.2 cm 3 /g La gravedad específica del tetracloruro de carbono a 20 o C con respecto al agua a 4 o C es Calcular la densidad del tetracloruro de carbono en lb/pie 3 a 20 o C El peso específico de la dietanolamina (DEA) a 15 o C/4 o C es de En un día cuando la temperatura es de 15 o C se introducen en un tanque galones de DEA medidos exactamente. A cuántas libras de DEA corresponde este volumen? Un aceite tiene una gravedad API de A cuántos galones equivale 1 tonelada de aceite? Una solución tiene una gravedad de 100 o Tw. Calcule su gravedad en o Bé Efectuar las siguientes conversiones de unidades de presión:
47 BALANCE DE MATERIA : NESTOR GOODING GARAVITO 42 a) mm Hg a psi. b) 25 pies de agua a Pa. c) 3 atm a N/cm 2. d) 100 cm Hg a dinas/pulg 2. e) 30 cm Hg de vacío a atm abs. f) 10 psig a mm Hg manométricos. g) 10 psig a bar absolutos. h) 650 mm Hg abs a mm Hg manométricos. i) 10 pulg de Hg de vacío a pulg de Hg abs. j) 20 psi a cm de tetracloruro de carbono Un manómetro, montado en la cabina abierta de un aeroplano que se encuentra en tierra, y que mide la presión del aceite, indica una lectura de 6 kg f /cm 2, cuando el barómetro marca 752 mm Hg. a) Cuál es la presión absoluta del aceite, expresada en N/m 2, bar y kg f /cm 2? b) Qué marcará el manómetro, expresado en estas mismas unidades, cuando el aeroplano se eleva a cierta altura en la cual la presión atmosférica es 0,59 bar, si la presión absoluta permanece constante? En la sala de máquinas de una central eléctrica funciona una turbina cuyo condensador se mantiene a la presión absoluta de 0,711 psia. Determinar el valor del vacío como un porcentaje de la presión barométrica cuyo valor es 753 mm Hg Calcular la presión manométrica en el fondo de un tanque de 12 pies de profundidad, si este está lleno de una solución de ácido acético a 25 o C (G = ). Respuesta en kpa y psig Se coloca un manómetro de mercurio en el fondo de un tanque que contiene benceno (G = 0.879). Si la diferencia de altura en el líquido del manómetro es 97 mm, cuál será la altura del fluído en metros dentro del tanque? Un cilindro de diámetro 200 mm está herméticamente cerrado por un émbolo que pende de un resorte. Este émbolo convencionalmente ingrávido se desliza sin rozamiento. En el cilindro de ha practicado un vacío equivalente al 80% de la presión barométrica que es de 600 mm Hg. Determine la fuerza F de tensión del resorte, en kg f, si el émbolo no se mueve Efectuar las siguientes conversiones de temperatura:
BALANCES DE MASA Y ENERGÍA CAPITULO 1: BALANCES DE MATERIALES
 BALANCES DE MASA Y ENERGÍA CAPITULO 1: BALANCES DE MATERIALES 1.1 INTRODUCCION Proceso: Cualquier operación o serie de operaciones que produce un cambio físico o químico en una sustancia o en una mezcla
BALANCES DE MASA Y ENERGÍA CAPITULO 1: BALANCES DE MATERIALES 1.1 INTRODUCCION Proceso: Cualquier operación o serie de operaciones que produce un cambio físico o químico en una sustancia o en una mezcla
1.- La materia y clasificación. La materia es cualquier cosa que ocupa un espacio y tiene masas Estados: sólido, líquido, gaseoso
 La Química La Química se encarga del estudio de las propiedades de la materia y de los cambios que en ella se producen. La Química es una ciencia cuantitativa y requiere el uso de mediciones. Las cantidades
La Química La Química se encarga del estudio de las propiedades de la materia y de los cambios que en ella se producen. La Química es una ciencia cuantitativa y requiere el uso de mediciones. Las cantidades
HIDRAULICA DE POTENCIA. Unidad 1. Bases físicas de la hidráulica
 HIDRAULICA DE POTENCIA Unidad 1. Bases físicas de la hidráulica Presión Este término se refiere a los efectos de una fuerza que actúa distribuida sobre una superficie. La fuerza causante de la presión
HIDRAULICA DE POTENCIA Unidad 1. Bases físicas de la hidráulica Presión Este término se refiere a los efectos de una fuerza que actúa distribuida sobre una superficie. La fuerza causante de la presión
INGENIERO. JOSMERY SÁNCHEZ
 UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA REALIZADO POR: INGENIERO.
UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA REALIZADO POR: INGENIERO.
Masas atómicas (g/mol): O = 16; S = 32; Zn = 65,4. Sol: a) 847 L; b) 710,9 g; c) 1,01 atm.
 1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
de aire. Determinar la composicion de la mezcla resultante. Cuál es el porcentaje en exceso de aire, suponiendo conversion completa?
 C A P Í T U L O 2 Dada la importancia que tienen los procesos de combustión en la generación de contaminantes, en este capítulo se han incluido algunos ejercicios relacionados con la combustión estequiométrica.
C A P Í T U L O 2 Dada la importancia que tienen los procesos de combustión en la generación de contaminantes, en este capítulo se han incluido algunos ejercicios relacionados con la combustión estequiométrica.
C: GASES Y PRESIÓN DE VAPOR DEL AGUA
 hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
Sustancias puras, procesos de cambios de fase, diagramas de fase. Estado 3 Estado 4 Estado 5. P =1 atm T= 100 o C. Estado 3 Estado 4.
 TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
Respuesta: a) La fracción molar de NaCl es 0,072 b) La concentración másica volumétrica de NaCl es 0,231 g/cc
 Ejercicio 1: La densidad a 4 ºC de una solución acuosa de NaCl al 20% en peso es 1,155 g/cc a) Calcule la fracción molar de NaCl b) Calcule la concentración másica volumétrica de NaCl La masa molecular
Ejercicio 1: La densidad a 4 ºC de una solución acuosa de NaCl al 20% en peso es 1,155 g/cc a) Calcule la fracción molar de NaCl b) Calcule la concentración másica volumétrica de NaCl La masa molecular
TEMA 5. MAGNITUDES FISICAS Y UNIDADES DE MEDIDA. 4ª. PARTE
 1 TEMA 5. MAGNITUDES FISICAS Y UNIDADES DE MEDIDA. 4ª. PARTE Mario Melo Araya Ex Profesor Universidad de Chile melomarioqca@gmail.com 11. EQUIVALENCIAS Y CONVERSION DE UNIDADES DE MEDIDA. Para toda magnitud
1 TEMA 5. MAGNITUDES FISICAS Y UNIDADES DE MEDIDA. 4ª. PARTE Mario Melo Araya Ex Profesor Universidad de Chile melomarioqca@gmail.com 11. EQUIVALENCIAS Y CONVERSION DE UNIDADES DE MEDIDA. Para toda magnitud
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
FÍSICA CICLO 5 CAPACITACIÓN La Termodinámica es el estudio de las propiedades de la energia térmica y de sus propiedades.
 UNIDAD 5 TERMODINÁMICA - HIDRAULICA TERMODINÁMICA La Termodinámica es el estudio de las propiedades de la energia térmica y de sus propiedades. ENERGIA TERMICA: Todos los cuerpos se componen de pequeñas
UNIDAD 5 TERMODINÁMICA - HIDRAULICA TERMODINÁMICA La Termodinámica es el estudio de las propiedades de la energia térmica y de sus propiedades. ENERGIA TERMICA: Todos los cuerpos se componen de pequeñas
QUÍMICA. La MATERIA REPRESENTACIÓN. Observación Datos Ley Hipótesis Teoría DEFINICIONES BÁSICAS. Propiedades
 QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
TEMA 2: PROPIEDADES FÍSICAS DE LOS FLUIDOS
 Manual para el diseño de una red hidráulica de climatización 3 A ntes de comenzar a estudiar cualquier problema de flujo, es necesario conocer algunas características y propiedades físicas de los fluidos,
Manual para el diseño de una red hidráulica de climatización 3 A ntes de comenzar a estudiar cualquier problema de flujo, es necesario conocer algunas características y propiedades físicas de los fluidos,
Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES. Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile
 Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile Guía 4: Mecánica de fluidos Martes 25 de Septiembre, 2007
Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile Guía 4: Mecánica de fluidos Martes 25 de Septiembre, 2007
Ing. Sol de María Jiménez González
 Ing. Sol de María Jiménez González 1 02 de junio I Tutoría Presencial 16 de junio II Tutoría Presencial Entrega de Tarea 30 de junio: I Examen Ordinario 14 de julio III Tutoría Presencial Entrega de proyecto
Ing. Sol de María Jiménez González 1 02 de junio I Tutoría Presencial 16 de junio II Tutoría Presencial Entrega de Tarea 30 de junio: I Examen Ordinario 14 de julio III Tutoría Presencial Entrega de proyecto
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
QUÉ ES LA TEMPERATURA?
 1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
LA MATERIA: ESTADOS DE AGREGACIÓN
 LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
MECÁNICA DE FLUIDOS. Docente: Ing. Alba Díaz Corrales
 MECÁNICA DE FLUIDOS Docente: Ing. Alba Díaz Corrales Fecha: 1 de septiembre 2010 Mecánica de Fluidos Tipo de asignatura: Básica Específica Total de horas semanales: 6 Total de horas semestrales: 84 Asignatura
MECÁNICA DE FLUIDOS Docente: Ing. Alba Díaz Corrales Fecha: 1 de septiembre 2010 Mecánica de Fluidos Tipo de asignatura: Básica Específica Total de horas semanales: 6 Total de horas semestrales: 84 Asignatura
Unidad 16: Temperatura y gases ideales
 Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
Capítulo 17. Temperatura. t(h) = 100 h h 0
 Capítulo 17 Temperatura t(h) = 100 h h 0 h 1 00 h 0 rincipio cero de la termodinámica. Temperatura empírica. La temperatura empírica de un sistema en equilibrio termodinámico se puede asignar mediante
Capítulo 17 Temperatura t(h) = 100 h h 0 h 1 00 h 0 rincipio cero de la termodinámica. Temperatura empírica. La temperatura empírica de un sistema en equilibrio termodinámico se puede asignar mediante
PROBLEMARIO No. 2. Veinte problemas con respuesta sobre los Temas 3 y 4 [Trabajo y Calor. Primera Ley de la Termodinámica]
![PROBLEMARIO No. 2. Veinte problemas con respuesta sobre los Temas 3 y 4 [Trabajo y Calor. Primera Ley de la Termodinámica] PROBLEMARIO No. 2. Veinte problemas con respuesta sobre los Temas 3 y 4 [Trabajo y Calor. Primera Ley de la Termodinámica]](/thumbs/50/26203302.jpg) Universidad Simón olívar Departamento de Termodinámica y Fenómenos de Transferencia -Junio-007 TF - Termodinámica I Prof. Carlos Castillo PROLEMARIO No. Veinte problemas con respuesta sobre los Temas y
Universidad Simón olívar Departamento de Termodinámica y Fenómenos de Transferencia -Junio-007 TF - Termodinámica I Prof. Carlos Castillo PROLEMARIO No. Veinte problemas con respuesta sobre los Temas y
TEMA 2 CONCEPTOS BÁSICOS Cálculos estequiométricos
 TEMA 2 CONCEPTOS BÁSICOS Cálculos estequiométricos ÍNDICE 1. Ecuaciones (reacciones) químicas 2. Cálculos estequiométricos. Reactivo limitante y reacciones consecutivas 3. Pureza de un reactivo 4. Rendimiento
TEMA 2 CONCEPTOS BÁSICOS Cálculos estequiométricos ÍNDICE 1. Ecuaciones (reacciones) químicas 2. Cálculos estequiométricos. Reactivo limitante y reacciones consecutivas 3. Pureza de un reactivo 4. Rendimiento
Prof. Jorge Rojo Carrascosa
 Asignatura: FÍSICA Y QUÍMICA EJERCICIOS DE AMPLIACIÓN - SOLUCIONES Fecha finalización: Martes, 8 de marzo de 2011 Nombre y Apellidos JRC 1 Un submarino se encuentra a una profundidad de 400 metros. Cuál
Asignatura: FÍSICA Y QUÍMICA EJERCICIOS DE AMPLIACIÓN - SOLUCIONES Fecha finalización: Martes, 8 de marzo de 2011 Nombre y Apellidos JRC 1 Un submarino se encuentra a una profundidad de 400 metros. Cuál
MAGNITUDES Y MEDIDAS
 MAGNITUDES Y MEDIDAS 1. EL MÉTODO CIENTÍFICO: Concepto de ciencia: La ciencia trata de explicar los fenómenos que ocurren en el Universo, y trata de encontrar las leyes que los rigen. La Física y la Química
MAGNITUDES Y MEDIDAS 1. EL MÉTODO CIENTÍFICO: Concepto de ciencia: La ciencia trata de explicar los fenómenos que ocurren en el Universo, y trata de encontrar las leyes que los rigen. La Física y la Química
Unidad 0 CÁLCULOS QUÍMICOS. Unidad 0. Cálculos químicos
 Unidad 0 CÁLCULOS QUÍMICOS Unidad 0. Cálculos químicos 1 0. Leyes ponderales Leyes que rigen las combinaciones químicas. Se basan en la experimentación y miden cuantitativamente la cantidad de materia
Unidad 0 CÁLCULOS QUÍMICOS Unidad 0. Cálculos químicos 1 0. Leyes ponderales Leyes que rigen las combinaciones químicas. Se basan en la experimentación y miden cuantitativamente la cantidad de materia
Capítulo 10. Efectos de superficie. Sistema respiratorio
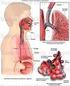 Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
PRÁCTICA 10. TORRE DE REFRIGERACIÓN POR AGUA
 PRÁCTICA 10. TORRE DE REFRIGERACIÓN POR AGUA OBJETIVO GENERAL: Familiarizar al alumno con los sistemas de torres de refrigeración para evacuar el calor excedente del agua. OBJETIVOS ESPECÍFICOS: Investigar
PRÁCTICA 10. TORRE DE REFRIGERACIÓN POR AGUA OBJETIVO GENERAL: Familiarizar al alumno con los sistemas de torres de refrigeración para evacuar el calor excedente del agua. OBJETIVOS ESPECÍFICOS: Investigar
2 La densidad de una sustancia es ρ, el volumen es V, y la masa es m. Si el volumen se triplica y la densidad no cambia Cuál es la masa?
 Slide 1 / 20 1 Dos sustancias, A tiene una densidad de 2000 kg/m 3 y la B tiene una densidad de 3000 kg/m 3 son seleccionadas para realizar un experimento. Si el experimento necesita de igual masa de cada
Slide 1 / 20 1 Dos sustancias, A tiene una densidad de 2000 kg/m 3 y la B tiene una densidad de 3000 kg/m 3 son seleccionadas para realizar un experimento. Si el experimento necesita de igual masa de cada
GUÍA DE EJERCICIOS CONCEPTOS FUNDAMENTALES
 GUÍA DE EJERCICIOS CONCEPTOS FUNDAMENTALES Área Resultados de aprendizaje Identifica, conecta y analiza conceptos básicos de química para la resolución de ejercicios, desarrollando pensamiento lógico y
GUÍA DE EJERCICIOS CONCEPTOS FUNDAMENTALES Área Resultados de aprendizaje Identifica, conecta y analiza conceptos básicos de química para la resolución de ejercicios, desarrollando pensamiento lógico y
La uma, por ser una unidad de masa, tiene su equivalencia en gramos:
 UNIDAD 2 Magnitudes atómico-moleculares Introducción Teórica La masa de un átomo depende del átomo en cuestión, es decir del número de protones y neutrones que contenga su núcleo. Dicha magnitud es muy
UNIDAD 2 Magnitudes atómico-moleculares Introducción Teórica La masa de un átomo depende del átomo en cuestión, es decir del número de protones y neutrones que contenga su núcleo. Dicha magnitud es muy
TERMODINÁMICA AVANZADA
 ERMODINÁMICA AANZADA Cantidades fundamentales Cantidades básicas y unidaded Unidad I: ropiedades y Leyes de la ermodinámica Cantidades fundamentales ropiedades de estado Función de estado y ecuación de
ERMODINÁMICA AANZADA Cantidades fundamentales Cantidades básicas y unidaded Unidad I: ropiedades y Leyes de la ermodinámica Cantidades fundamentales ropiedades de estado Función de estado y ecuación de
Electricidad y calor
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor. Webpage: Departamento de Física Universidad de Sonora
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Problemas de Estática y Dinámica DINÁMICA DE FLUIDOS
 Problemas de Estática y Dinámica DINÁMICA DE FLUIDOS (1 er Q.:prob pares, 2 ndo Q.:prob impares) 1. En el esquema adjunto las secciones de la tubería son 40 y 12 cm 2, y la velocidad del agua en la primera
Problemas de Estática y Dinámica DINÁMICA DE FLUIDOS (1 er Q.:prob pares, 2 ndo Q.:prob impares) 1. En el esquema adjunto las secciones de la tubería son 40 y 12 cm 2, y la velocidad del agua en la primera
ESTO NO ES UN EXAMEN, ES UNA HOJA DEL CUADERNILLO DE EJERCICIOS. Heroica Escuela Naval
 CUADERNILLO DE FÍSICA. TERCER GRADO. I.- SUBRAYE LA RESPUESTA CORRECTA EN LOS SIGUIENTES ENUNCIADOS. 1.- CUANDO DOS CUERPOS CON DIFERENTE TEMPERATURA SE PONEN EN CONTACTO, HAY TRANSMISIÓN DE: A) FUERZA.
CUADERNILLO DE FÍSICA. TERCER GRADO. I.- SUBRAYE LA RESPUESTA CORRECTA EN LOS SIGUIENTES ENUNCIADOS. 1.- CUANDO DOS CUERPOS CON DIFERENTE TEMPERATURA SE PONEN EN CONTACTO, HAY TRANSMISIÓN DE: A) FUERZA.
NOCIONES BASICAS ES LA MATERIA QUE INTEGRA UN CUERPO SÓLIDO, UN LIQUIDO O UN GAS.
 SUSTANCIA: ES LA MATERIA QUE INTEGRA UN CUERPO SÓLIDO, UN LIQUIDO O UN GAS. SUSTANCIA DE TRABAJO: ES LA PORCIÓN DE MATERIA QUE ACTUANDO EN UN SISTEMA ES CAPAZ DE ABSORBER O CEDER ENERGÍA. EN ESE PROCESO
SUSTANCIA: ES LA MATERIA QUE INTEGRA UN CUERPO SÓLIDO, UN LIQUIDO O UN GAS. SUSTANCIA DE TRABAJO: ES LA PORCIÓN DE MATERIA QUE ACTUANDO EN UN SISTEMA ES CAPAZ DE ABSORBER O CEDER ENERGÍA. EN ESE PROCESO
DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4
 Universidad Tecnológica Nacional Facultad Regional La Plata DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4 Descenso crioscópico Objeto de la experiencia:
Universidad Tecnológica Nacional Facultad Regional La Plata DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4 Descenso crioscópico Objeto de la experiencia:
CONCEPTOS BASICOS UNIDADES Y DIMENSIONES
 CONCEPTOS BASICOS UNIDADES Y DIMENSIONES Las dimensiones son nuestros conceptos básicos de medición, como longitud, tiempo, masa, temperatura, etc.; las unidades son la forma de expresar las dimensiones,
CONCEPTOS BASICOS UNIDADES Y DIMENSIONES Las dimensiones son nuestros conceptos básicos de medición, como longitud, tiempo, masa, temperatura, etc.; las unidades son la forma de expresar las dimensiones,
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
Operaciones Básicas de Transferencia de Materia Problemas Tema 6
 1º.- En una torre de relleno, se va a absorber acetona de una corriente de aire. La sección de la torre es de 0.186 m 2, la temperatura de trabajo es 293 K y la presión total es de 101.32 kpa. La corriente
1º.- En una torre de relleno, se va a absorber acetona de una corriente de aire. La sección de la torre es de 0.186 m 2, la temperatura de trabajo es 293 K y la presión total es de 101.32 kpa. La corriente
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2014 La fórmula empírica de un compuesto orgánico es C 4 H 8 S. Si su masa molecular es 88, determine:
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2014 La fórmula empírica de un compuesto orgánico es C 4 H 8 S. Si su masa molecular es 88, determine:
LAS HERRAMIENTAS DE LA FÍSICA. Ing. Caribay Godoy Rangel
 LAS HERRAMIENTAS DE LA FÍSICA SISTEMA INTERNACIONAL DE UNIDADES (SI) UNIVERSABILIDAD MEDICIÓN ACCESIBILIDAD INVARIANCIA SISTEMA INTERNACIONAL DE Metro (m) UNIDADES (SI) 1889: Diezmillonésima parte de la
LAS HERRAMIENTAS DE LA FÍSICA SISTEMA INTERNACIONAL DE UNIDADES (SI) UNIVERSABILIDAD MEDICIÓN ACCESIBILIDAD INVARIANCIA SISTEMA INTERNACIONAL DE Metro (m) UNIDADES (SI) 1889: Diezmillonésima parte de la
EJERCICIOS RESUELTOS DISOLUCIONES
 EJERIIOS RESUELTOS DISOLUIONES 1.- Se disuelven 20 g de NaOH en 560 g de agua. alcula a) la concentración de la en % en masa y b) su molalidad. Ar(Na) 2. Ar(O)16. Ar(H)1. NaOH 20 a) % NaOH.100 % NaOH.100
EJERIIOS RESUELTOS DISOLUIONES 1.- Se disuelven 20 g de NaOH en 560 g de agua. alcula a) la concentración de la en % en masa y b) su molalidad. Ar(Na) 2. Ar(O)16. Ar(H)1. NaOH 20 a) % NaOH.100 % NaOH.100
UNIDAD 1 La materia y sus cambios
 UNIDAD 1 La materia y sus cambios Tema 1.3 Propiedades características de las sustancias: físicas, organolépticas, químicas; intensivas y extensivas. NMLV 1 Propiedades de las sustancias Organolépticas
UNIDAD 1 La materia y sus cambios Tema 1.3 Propiedades características de las sustancias: físicas, organolépticas, químicas; intensivas y extensivas. NMLV 1 Propiedades de las sustancias Organolépticas
Soluciones. DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I)
 Soluciones DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I) 1. Demuestre que 1 mol de cualquier gas a presión atmosférica de 101 kpa y temperatura de 0ºC ocupa un volumen de 22,4 L. n =
Soluciones DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I) 1. Demuestre que 1 mol de cualquier gas a presión atmosférica de 101 kpa y temperatura de 0ºC ocupa un volumen de 22,4 L. n =
 TALLER: TEMAS IMPORTANTES DE QUIMICA http://cap7-teoriacuantica.blogspot.com/p/s-isoelectronicos.html Refuerzo, ver video: http://www.quimitube.com/videos/comparacion-radio-ionicoiones-isoelectronico/
TALLER: TEMAS IMPORTANTES DE QUIMICA http://cap7-teoriacuantica.blogspot.com/p/s-isoelectronicos.html Refuerzo, ver video: http://www.quimitube.com/videos/comparacion-radio-ionicoiones-isoelectronico/
MATERIA: FÍSICA 1. PARA CONVERTIR CENTÍMETROS A PULGADAS SE DEBE MULTIPLICAR POR: 2. PARA CONVERTIR KILOGRAMOS EN LIBRAS SE DEBE MULTIPLICAR POR:
 MATERIA: FÍSICA 1. PARA CONVERTIR CENTÍMETROS A PULGADAS SE DEBE MULTIPLICAR POR: a. 0.3937 b. 0.5423 c. 0.2345 d. 0.1726 2. PARA CONVERTIR KILOGRAMOS EN LIBRAS SE DEBE MULTIPLICAR POR: a. 2.208 b. 2.235
MATERIA: FÍSICA 1. PARA CONVERTIR CENTÍMETROS A PULGADAS SE DEBE MULTIPLICAR POR: a. 0.3937 b. 0.5423 c. 0.2345 d. 0.1726 2. PARA CONVERTIR KILOGRAMOS EN LIBRAS SE DEBE MULTIPLICAR POR: a. 2.208 b. 2.235
- Leyes ponderales: Las leyes ponderales relacionan las masas de las sustancias que intervienen en una reacción química.
 FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2012 Se disponen de tres recipientes que contienen en estado gaseoso 1 L de metano, 2 L de nitrógeno
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2012 Se disponen de tres recipientes que contienen en estado gaseoso 1 L de metano, 2 L de nitrógeno
HOJA DE PROBLEMAS 1: ENUNCIADOS
 Tema: DISOLUCIONES HOJA DE PROBLEMAS 1: ENUNCIADOS 1. ( ) Una disolución acuosa de AgNO 3 con una composición del 12 % en peso tiene una densidad de 1.1080 g/cm 3 a 20 C y 1 atm. Calcule la fracción molar,
Tema: DISOLUCIONES HOJA DE PROBLEMAS 1: ENUNCIADOS 1. ( ) Una disolución acuosa de AgNO 3 con una composición del 12 % en peso tiene una densidad de 1.1080 g/cm 3 a 20 C y 1 atm. Calcule la fracción molar,
TEMPERATURA DILATACIÓN. 9. En la escala Celsius una temperatura varía en 45 C. Cuánto variará en la escala Kelvin y
 TEMPERATURA 1. A cuántos grados kelvin equivalen 50 grados centígrados? a) 303 b) 353 c) 453 d) 253 2. Si un cuerpo presenta una temperatura de 20 C Cuál será la lectura de esta en la escala Fahrenheit?
TEMPERATURA 1. A cuántos grados kelvin equivalen 50 grados centígrados? a) 303 b) 353 c) 453 d) 253 2. Si un cuerpo presenta una temperatura de 20 C Cuál será la lectura de esta en la escala Fahrenheit?
Contenidos mínimos Física y Química 3º ESO
 Contenidos mínimos Física y Química 3º ESO EL TRABAJO CIENTÍFICO Etapas del método científico. Magnitudes y unidades. Cambio de unidades. Sistema Internacional de Unidades (SI). Representación de gráficas
Contenidos mínimos Física y Química 3º ESO EL TRABAJO CIENTÍFICO Etapas del método científico. Magnitudes y unidades. Cambio de unidades. Sistema Internacional de Unidades (SI). Representación de gráficas
Relaciones de masa en las reacciones químicas
 Relaciones de masa en las reacciones químicas Capítulo 3 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Micro-mundo Átomos y moléculas Macro-mundo gramos La
Relaciones de masa en las reacciones químicas Capítulo 3 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Micro-mundo Átomos y moléculas Macro-mundo gramos La
Solución: Según Avogadro, 1 mol de cualquier gas, medido en condiciones normales ocupa 22,4 L. Así pues, manteniendo la relación: =1,34 mol CH 4
 Ejercicios Física y Química Primer Trimestre 1. Calcula los moles de gas metano CH 4 que habrá en 30 litros del mismo, medidos en condiciones normales. Según Avogadro, 1 mol de cualquier gas, medido en
Ejercicios Física y Química Primer Trimestre 1. Calcula los moles de gas metano CH 4 que habrá en 30 litros del mismo, medidos en condiciones normales. Según Avogadro, 1 mol de cualquier gas, medido en
Física de fluidos. Densidad. kg/m. kg/m = S. kg/m. Principio de Arquímedes
 Física de fluidos Densidad ρ V dv 3 σ S ds L dl λ Principio de Arquímedes Principio de Arquímedes: todo cuerpo sumergido en un fluido eperimenta un empuje vertical y hacia arriba igual al peso de fluido
Física de fluidos Densidad ρ V dv 3 σ S ds L dl λ Principio de Arquímedes Principio de Arquímedes: todo cuerpo sumergido en un fluido eperimenta un empuje vertical y hacia arriba igual al peso de fluido
Conceptos básicos en estequiometría
 Conceptos básicos en estequiometría Tomado de: http://www.eis.uva.es/~qgintro/esteq/tutorial-01.html El Mol Un mol se define como la cantidad de materia que tiene tantos objetos como el número de átomos
Conceptos básicos en estequiometría Tomado de: http://www.eis.uva.es/~qgintro/esteq/tutorial-01.html El Mol Un mol se define como la cantidad de materia que tiene tantos objetos como el número de átomos
INDICE 1.- CÁLCULO DE CHIMENEA DE EVACUACIÓN DE HUMOS SEGÚN LA NORMA EN DATOS DE PARTIDA... 2
 INDICE 1.- CÁLCULO DE CHIMENEA DE EVACUACIÓN DE HUMOS SEGÚN LA NORMA EN 13384-1.... 2 1.1.- DATOS DE PARTIDA.... 2 1.2.- CAUDAL DE LOS PRODUCTOS DE COMBUSTIÓN.... 2 1.3.- DENSIDAD MEDIA DE LOS HUMOS...
INDICE 1.- CÁLCULO DE CHIMENEA DE EVACUACIÓN DE HUMOS SEGÚN LA NORMA EN 13384-1.... 2 1.1.- DATOS DE PARTIDA.... 2 1.2.- CAUDAL DE LOS PRODUCTOS DE COMBUSTIÓN.... 2 1.3.- DENSIDAD MEDIA DE LOS HUMOS...
Ecuación de estado del gas ideal
 Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
SUSTANCIA QUÍMICA mercurio oxígeno
 ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
CENTRIFUGACIÓN. Fundamentos. Teoría de la centrifugación
 CENTRIFUGACIÓN Fundamentos. Teoría de la centrifugación Fuerzas intervinientes Tipos de centrífugas Tubular De discos Filtración centrífuga 1 SEDIMENTACIÓN Se basa en la diferencia de densidades entre
CENTRIFUGACIÓN Fundamentos. Teoría de la centrifugación Fuerzas intervinientes Tipos de centrífugas Tubular De discos Filtración centrífuga 1 SEDIMENTACIÓN Se basa en la diferencia de densidades entre
PROPIEDADES GENERALES DE LA MATERIA. ESQUEMA 1
 PROPIEDADES GENERALES DE LA MATERIA. ESQUEMA 1 La materia es todo aquello que tiene se describe por sus Volumen Masa Propiedades que se pueden clasificar de dos formas Generales Específicas Extensivas
PROPIEDADES GENERALES DE LA MATERIA. ESQUEMA 1 La materia es todo aquello que tiene se describe por sus Volumen Masa Propiedades que se pueden clasificar de dos formas Generales Específicas Extensivas
Física y Química. 2º ESO. LA MATERIA Y SUS PROPIEDADES La materia. La materia es todo aquello que tiene masa y ocupa un espacio.
 La materia es todo aquello que tiene masa y ocupa un espacio. Es materia por tanto el plástico, el carbón, la madera, el aire, el agua, el hierro, etc. y no lo es la alegría, la tristeza, la velocidad,
La materia es todo aquello que tiene masa y ocupa un espacio. Es materia por tanto el plástico, el carbón, la madera, el aire, el agua, el hierro, etc. y no lo es la alegría, la tristeza, la velocidad,
EJERCICIOS DE TERMOQUÍMICA
 EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
MAGNITUDES FÍSICAS y UNIDADES de MEDICIÓN
 MAGNITUDES FÍSICAS y UNIDADES de MEDICIÓN 1.- Definición de magnitud física Desde el punto de vista físico, una magnitud es toda aquella propiedad o entidad abstracta que puede ser medida en una escala
MAGNITUDES FÍSICAS y UNIDADES de MEDICIÓN 1.- Definición de magnitud física Desde el punto de vista físico, una magnitud es toda aquella propiedad o entidad abstracta que puede ser medida en una escala
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
F A. 2. Medición de Presión. Generalización:
 . Medición de Presión. Generalización: La presión y la presión diferencial están entre los mas importantes parámetros medidos y controlados en la industria de procesos en la actualidad. Su significado,
. Medición de Presión. Generalización: La presión y la presión diferencial están entre los mas importantes parámetros medidos y controlados en la industria de procesos en la actualidad. Su significado,
PENDIENTE MEDIDA DE LA INCLINACIÓN
 Capítulo 2 PENDIENTE MEDIDA DE LA INCLINACIÓN 2.1.2 2.1.4 Los alumnos utilizaron la ecuación = m + b para graficar rectas describir patrones en los cursos anteriores. La Lección 2.1.1 es un repaso. Cuando
Capítulo 2 PENDIENTE MEDIDA DE LA INCLINACIÓN 2.1.2 2.1.4 Los alumnos utilizaron la ecuación = m + b para graficar rectas describir patrones en los cursos anteriores. La Lección 2.1.1 es un repaso. Cuando
ECUACIONES DIMENSIONALES
 ECUACIONES DIMENSIONALES 1. En la expresión x = k v n / a, x = distancia, v = velocidad, a = aceleración y k es una constante adimensional. Cuánto vale n para que la expresión sea dimensionalmente homogénea?
ECUACIONES DIMENSIONALES 1. En la expresión x = k v n / a, x = distancia, v = velocidad, a = aceleración y k es una constante adimensional. Cuánto vale n para que la expresión sea dimensionalmente homogénea?
Estequiometría y Leyes Ponderales
 Estequiometría y Leyes Ponderales Equipo de Educación en Química Verde Centro Interdisciplinario de Líquidos Iónicos Programa de Educación Continua para el Magisterio Introducción Leyes fundamentales de
Estequiometría y Leyes Ponderales Equipo de Educación en Química Verde Centro Interdisciplinario de Líquidos Iónicos Programa de Educación Continua para el Magisterio Introducción Leyes fundamentales de
CLASE Nº 2 ESTEQUIOMETRÍA
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 2 ESTEQUIOMETRÍA 1 Estequiometría Leyes que rigen
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 2 ESTEQUIOMETRÍA 1 Estequiometría Leyes que rigen
Acuerdo 286. Química. Disoluciones. Recopiló: M.C. Macaria Hernández Chávez
 Acuerdo 286 Química Disoluciones Recopiló: M.C. Macaria Hernández Chávez Disolución: Es una mezcla homogénea de dos o más sustancias. La sustancia que se encuentra en mayor proporción se llama disolvente
Acuerdo 286 Química Disoluciones Recopiló: M.C. Macaria Hernández Chávez Disolución: Es una mezcla homogénea de dos o más sustancias. La sustancia que se encuentra en mayor proporción se llama disolvente
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA.
 PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
6. Cuál es el número total de átomos en 0,100 mol de [ Pt (NH 3 ) 2 Cl 2 ]? A. 11 B. 6,02 x 10 22 C. 3,01 x 10 23 D. 6,62 x 10 23
![6. Cuál es el número total de átomos en 0,100 mol de [ Pt (NH 3 ) 2 Cl 2 ]? A. 11 B. 6,02 x 10 22 C. 3,01 x 10 23 D. 6,62 x 10 23 6. Cuál es el número total de átomos en 0,100 mol de [ Pt (NH 3 ) 2 Cl 2 ]? A. 11 B. 6,02 x 10 22 C. 3,01 x 10 23 D. 6,62 x 10 23](/thumbs/20/396963.jpg) 1. Cuál contiene mayor número de iones? A. 1 mol de Al 2 (SO 4 ) 3 B. 1 mol de Mg 3 (PO 4 ) 2 C. 2 moles de K 3 PO 4 D. 3 moles de NaNO 3 2. Cuántos átomos hay en 0,10 mol de PtCl 2 (NH 3 ) 2? A. 6,0 x
1. Cuál contiene mayor número de iones? A. 1 mol de Al 2 (SO 4 ) 3 B. 1 mol de Mg 3 (PO 4 ) 2 C. 2 moles de K 3 PO 4 D. 3 moles de NaNO 3 2. Cuántos átomos hay en 0,10 mol de PtCl 2 (NH 3 ) 2? A. 6,0 x
todoesquimica.bligoo.cl
 todoesquimica.bligoo.cl Ley de conservación de la masa (Lavoisier) Ley de proporciones definidas (Proust) Ley de proporciones múltiples (Dalton). Ley de proporciones recíprocas (Ritcher) Ley de volúmenes
todoesquimica.bligoo.cl Ley de conservación de la masa (Lavoisier) Ley de proporciones definidas (Proust) Ley de proporciones múltiples (Dalton). Ley de proporciones recíprocas (Ritcher) Ley de volúmenes
NPSH: INFLUENCIA DE LA ALTURA Y TEMPERATURA DEL AGUA EN LA ASPIRACION DE LAS BOMBAS
 NPSH: INFLUENCIA DE LA ALTURA Y TEMPERATURA DEL AGUA EN LA ASPIRACION DE LAS BOMBAS Se denomina NPSH (Net Positive Suction Head) o ANPA (Altura Neta Positiva de Aspiración) a la diferencia entre la presión
NPSH: INFLUENCIA DE LA ALTURA Y TEMPERATURA DEL AGUA EN LA ASPIRACION DE LAS BOMBAS Se denomina NPSH (Net Positive Suction Head) o ANPA (Altura Neta Positiva de Aspiración) a la diferencia entre la presión
Guía Temática de Química
 Guía Temática de Química Introducción a la Química Definición de química y de ciencias afines a ella Diferenciación de las ciencias afines a la química 1 Conceptos básicos de química y el método científico
Guía Temática de Química Introducción a la Química Definición de química y de ciencias afines a ella Diferenciación de las ciencias afines a la química 1 Conceptos básicos de química y el método científico
LEYES FUNDAMENTALES DE LA QUÍMICA
 LEYES FUNDAMENTALES DE LA QUÍMICA SUSTANCIAS PURAS Cambios físicos Cambios Químicos TRANSFORMACIÓN No implican cambio de composición Ejemplo: Cambio de fase COMPUESTOS COMBINACIONES QUIMICAS DE ELEMENTOS
LEYES FUNDAMENTALES DE LA QUÍMICA SUSTANCIAS PURAS Cambios físicos Cambios Químicos TRANSFORMACIÓN No implican cambio de composición Ejemplo: Cambio de fase COMPUESTOS COMBINACIONES QUIMICAS DE ELEMENTOS
DENSIDAD Y PESO ESPECÍFICO
 DENSIDAD Y PESO ESPECÍFICO Adaptación del Experimento Nº 2 de la Guía de Ensayos y Teoría del Error del profesor Ricardo Nitsche, página 43-47. Autorizado por el Autor. Materiales: Cilindros graduados
DENSIDAD Y PESO ESPECÍFICO Adaptación del Experimento Nº 2 de la Guía de Ensayos y Teoría del Error del profesor Ricardo Nitsche, página 43-47. Autorizado por el Autor. Materiales: Cilindros graduados
Tema 5 Tratamientos térmicos EUETI Escola Universitaria de Enxeñería Técnica Industrial
 Tratamiento de Residuos Tema 5 Tratamientos térmicos EUETI Escola Universitaria de Enxeñería Técnica Industrial INCINERACIÓN DE RESIDUOS Definición: Es el procesamiento térmico de los residuos sólidos
Tratamiento de Residuos Tema 5 Tratamientos térmicos EUETI Escola Universitaria de Enxeñería Técnica Industrial INCINERACIÓN DE RESIDUOS Definición: Es el procesamiento térmico de los residuos sólidos
CURSO DE NIVELACIÓN EN QUÍMICA INTRODUCCIÓN A LA QUÍMICA
 U.N.P.S.J.B. FACULTAD DE CIENCIAS NATURALES SEDE TRELEW CURSO DE NIVELACIÓN EN QUÍMICA INTRODUCCIÓN A LA QUÍMICA AÑO 2016 Lic. Maite L. Domínguez Ing. Sebastián Polacco Ing. Ruth Salomón MEDICIONES Magnitud,
U.N.P.S.J.B. FACULTAD DE CIENCIAS NATURALES SEDE TRELEW CURSO DE NIVELACIÓN EN QUÍMICA INTRODUCCIÓN A LA QUÍMICA AÑO 2016 Lic. Maite L. Domínguez Ing. Sebastián Polacco Ing. Ruth Salomón MEDICIONES Magnitud,
INSTITUTO POLITÉCNICO NACIONAL
 INSTITUTO POLITÉCNICO NACIONAL Centro De Estudios Científicos Y Tecnológicos Wilfrido Massieu LABORATORIO DE FÍSICA II ALUMNO GRUPO EQUIPO PROFESOR FECHA CALIF. PRACTICA No. 7 I. NOMBRE: PRESION ATMOSFERICA.
INSTITUTO POLITÉCNICO NACIONAL Centro De Estudios Científicos Y Tecnológicos Wilfrido Massieu LABORATORIO DE FÍSICA II ALUMNO GRUPO EQUIPO PROFESOR FECHA CALIF. PRACTICA No. 7 I. NOMBRE: PRESION ATMOSFERICA.
MEDICIÓN DEL VOLUMEN
 MEDICIÓN DEL VOLUMEN CONCEPTOS BÁSICOS Volumen: porción de espacio que ocupa un cuerpo ya sea sólido, líquido o gaseoso. Capacidad: es el volumen de un fluido que puede contener o suministrar un instrumento
MEDICIÓN DEL VOLUMEN CONCEPTOS BÁSICOS Volumen: porción de espacio que ocupa un cuerpo ya sea sólido, líquido o gaseoso. Capacidad: es el volumen de un fluido que puede contener o suministrar un instrumento
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas.
 LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
Shell Térmico Oil B. Aceite para transferencia térmica
 Shell Térmico B es un aceite mineral puro de baja viscosidad, baja tensión de vapor y alta resistencia a la oxidación desarrollado para transferencia de calor ya sea en sistemas de calefacción cerrados
Shell Térmico B es un aceite mineral puro de baja viscosidad, baja tensión de vapor y alta resistencia a la oxidación desarrollado para transferencia de calor ya sea en sistemas de calefacción cerrados
TUTORIAL BÁSICO DE MECÁNICA FLUIDOS
 TUTORIAL BÁSICO DE MECÁNICA FLUIDOS El tutorial es básico pues como habréis visto en muchos de ellos es haceros entender no sólo la aplicación práctica de cada teoría sino su propia existencia y justificación.
TUTORIAL BÁSICO DE MECÁNICA FLUIDOS El tutorial es básico pues como habréis visto en muchos de ellos es haceros entender no sólo la aplicación práctica de cada teoría sino su propia existencia y justificación.
4.4. MOLES Y MOLÉCULAS.
 4.4. MOLES Y MOLÉCULAS. 4.4.1. MASA ATÓMICA Y MASA MOLECULAR Las moléculas están formadas por la unión de átomos que se unen mediante enlace químico. Esto significa que los átomos son difíciles de separar
4.4. MOLES Y MOLÉCULAS. 4.4.1. MASA ATÓMICA Y MASA MOLECULAR Las moléculas están formadas por la unión de átomos que se unen mediante enlace químico. Esto significa que los átomos son difíciles de separar
DEPARTAMENTO DE INGENIERÍA QUÍMICA. Laboratorio de Ingeniería Química BALANCE DE ENERGÍA EN ESTADO NO ESTACIONARIO
 DEPARAMENO DE INGENIERÍA QUÍMICA Laboratorio de Ingeniería Química BALANCE DE ENERGÍA EN ESADO NO ESACIONARIO 1. INRODUCCIÓN El sistema al que se va a plantear el balance de energía calorífica consiste
DEPARAMENO DE INGENIERÍA QUÍMICA Laboratorio de Ingeniería Química BALANCE DE ENERGÍA EN ESADO NO ESACIONARIO 1. INRODUCCIÓN El sistema al que se va a plantear el balance de energía calorífica consiste
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
Química Propedéutico para Bachillerato OBJETIVO
 Actividad 14. CÁLCULO DEL PESO MOLECULAR OBJETIVO Calcular los pesos moleculares de los compuestos químicos D.R. Universidad TecMilenio 1 INTRODUCCIÓN Las reacciones químicas son representadas mediante
Actividad 14. CÁLCULO DEL PESO MOLECULAR OBJETIVO Calcular los pesos moleculares de los compuestos químicos D.R. Universidad TecMilenio 1 INTRODUCCIÓN Las reacciones químicas son representadas mediante
El resultado se expresa mediante una cantidad seguida de la unidad elegida. La cantidad representa el número de veces que se repite la unidad.
 LA MEDIDA Magnitudes físicas Todas las propiedades que podemos medir se denominan magnitudes. Para medir una magnitud hay que determinar previamente una cantidad de esta, llamada unidad. Al medir, se comparan
LA MEDIDA Magnitudes físicas Todas las propiedades que podemos medir se denominan magnitudes. Para medir una magnitud hay que determinar previamente una cantidad de esta, llamada unidad. Al medir, se comparan
LABORATORIO DE FENÓMENOS COLECTIVOS
 LABORATORIO DE FENÓMENOS COLECTIVOS LA VISCOSIDAD DE LOS LÍQUIDOS CRUZ DE SAN PEDRO JULIO CÉSAR RESUMEN La finalidad de esta práctica es la determinación de la viscosidad de diferentes sustancias (agua,
LABORATORIO DE FENÓMENOS COLECTIVOS LA VISCOSIDAD DE LOS LÍQUIDOS CRUZ DE SAN PEDRO JULIO CÉSAR RESUMEN La finalidad de esta práctica es la determinación de la viscosidad de diferentes sustancias (agua,
Cómo leer la curva característica de una bomba?
 Cómo leer la curva característica de una bomba? Este boletín trata sobre la lectura y la comprensión de las curvas de funcionamiento de una bomba centrífuga. Se consideran tres tipos de curvas: bomba autocebante
Cómo leer la curva característica de una bomba? Este boletín trata sobre la lectura y la comprensión de las curvas de funcionamiento de una bomba centrífuga. Se consideran tres tipos de curvas: bomba autocebante
TERMODINAMICA 1 Conceptos Basicos
 TERMODINAMICA 1 Conceptos Basicos Prof. Carlos G. Villamar Linares Ingeniero Mecánico MSc. Matemáticas Aplicada a la Ingeniería 1 CONTENIDO DEFINICIONES BASICAS Definición de Termodinámica, sistema termodinámico,
TERMODINAMICA 1 Conceptos Basicos Prof. Carlos G. Villamar Linares Ingeniero Mecánico MSc. Matemáticas Aplicada a la Ingeniería 1 CONTENIDO DEFINICIONES BASICAS Definición de Termodinámica, sistema termodinámico,
Tema 5. PRINCIPIOS GENERALES DE MÁQUINAS 1. CONCEPTO DE MÁQUINA...2 2. SISTEMA INTERNACIONAL DE UNIDADES. MAGNITUDES Y MEDIDAS...2
 1. CONCEPTO DE MÁQUINA...2 2. SISTEMA INTERNACIONAL DE UNIDADES. MAGNITUDES Y MEDIDAS...2 2. TRABAJO. UNIDADES Y EQUIVALENCIAS...2 3. FORMAS DE ENERGÍA...3 A) Energía. Unidades y equivalencias...3 B) Formas
1. CONCEPTO DE MÁQUINA...2 2. SISTEMA INTERNACIONAL DE UNIDADES. MAGNITUDES Y MEDIDAS...2 2. TRABAJO. UNIDADES Y EQUIVALENCIAS...2 3. FORMAS DE ENERGÍA...3 A) Energía. Unidades y equivalencias...3 B) Formas
