Manual Toma de Muestras
|
|
|
- María Nieves Camacho Bustamante
- hace 6 años
- Vistas:
Transcripción
1 Biotechnology company 2013 Manual Toma de Muestras
2 Sistema Nervioso Central Muestras Sistema Nervioso Central Contenido 1. Introducción... 1 a) Líquido cefalorraquídeo (LCR)... 1 b) Sangre obtenida a través de punción periférica Bibliografía Introducción La mayoría de las infecciones del sistema nervioso afectan al sistema nervioso central (cerebro, medula espinal o meninges). Debido a sus especiales características anatómicas y fisiológicas es muy vulnerable a los efectos de una inflamación o edema, pudiendo provocar daños irreversibles. La más común es la meningitis, inflamación de las meninges que rodean al cerebro, causada principalmente por bacterias como Streptococcus pneumoniae y Neisseria meningitidis, entre otros. Por su lado la encefalitis, inflamación del tejido cerebral, es provocada generalmente por virus como los enterovirus o arbovirus. a) Líquido cefalorraquídeo (LCR) Enviar con resumen de historia clínica. Procedimiento realizado por personal médico. Preparación aséptica de la piel: el paciente debe estar recostado sobre un costado con el torso doblado hacia delante. Bajo anestesia local se introduce una aguja larga en el conducto espinal; no necesita ser aspirado, fluye por presión en individuos sanos. Obtener mínimo 3 ml de LCR en tubo estéril tapa rosca. Equipo de asepsia: mascarilla, guantes y campo estériles. Equipo de punción lumbar. temperatura ambiente durante 8 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por una semana. b) Sangre obtenida a través de punción periférica Realizar lavado de manos quirúrgico. Mantener técnica aséptica durante todo el procedimiento. Utilizar campo estéril para evitar tener contacto con áreas circundantes que ofrezca el riesgo de contaminación. Colocar mascarilla al paciente. Realizar antisepsia de la zona a puncionar; no palpe la vena sin guantes estériles una vez preparada la piel. Utilizar otros guantes estériles para cada
3 Sistema Nervioso Central Muestras Sistema Nervioso Central punción. POR ÉSTE MÉTODO NO PUEDEN SER PROCESADAS MUESTRAS CON HEPARINA. En pacientes heparinizados, la toma de muestra debe realizarse en el momento más alejado de la administración del medicamento. La toma deberá hacerse en un lugar perfectamente iluminado y con el paciente cómodamente sentado. Localizar una vena adecuada en la cara anterior del codo y colocar el torniquete en la parte media del brazo. Desinfectar el área con un algodón humedecido con alcohol al 70% e introducir la aguja con el bisel hacia arriba. Si la sangre no fluye espontáneamente y se está utilizando una jeringa, jalar el émbolo y aspirar con suavidad; si se está empleando equipo al vacío presionar el tubo de ensaye hacia arriba. Al empezar a fluir la sangre retirar el torniquete. Una vez que se haya obtenido entre 5-8 ml de sangre, retirar la aguja y colocar una tórula con alcohol sobre el sitio de punción ejerciendo presión para detener la hemorragia. En recién nacidos y lactantes, donde no es fácil obtener tanta cantidad de muestra, debe enviarse como mínimo 1 ml de sangre completa. Si la toma se hizo con jeringa, retirar la aguja y verter la sangre a un tubo estéril, dejándola resbalar lentamente por la pared para evitar hemólisis. Tapar el tubo cuidadosamente. Si la muestra necesaria es sangre total utilizar un tubo de hematología con EDTA (venoject ó vacutainer TAPA MORADA). Bata y campos estériles. Gorro y mascarilla con protección ocular. Guantes estériles. Equipo de asepsia (antiséptico, gasas y guantes estériles). Tubo de hematología con EDTA. Jeringas estériles. La muestra debe ser analizada dentro de las 24 hrs. siguientes, en caso contrario puede mantenerse refrigerada a 4ºC hasta una semana. Se recomienda no congelar. 2. Bibliografía Carlberg, D. Cleanroom microbiology for the non microbiologist. Interpharm Press. INC. Buffalo Grove, Illinois CercenadoE, Cantón R. Procedimientos en microbiología clínica. SEIMC. España, Collins CH, Lyne PM, Grange JM. Microbiological methods. 7ma edition. Oxford 1995.
4 Sistema Nervioso Central Muestras Sistema Nervioso Central Forman MS, Valsamakis A, Specimen collection, transport, and processing: Virology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Guerrero Gómez C; Sánchez Carrillo C. Procedimientos en microbiología clínica. Recogida, transporte y procesamientos general de las muestras en el laboratorio de microbiología, Miller JM, Holmes HT. General principles in specimen collection, transport and storage. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Organización Mundial de la Salud. Guía para transporte seguro de sustancias infecciosas y especímenes. Ginebra (Suiza): WHO/EMC/97.3; Thomson BR (JR.), and Miller M. Specimen collection, transport, and processing: Bacteriology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; 2003.
5 Ocular Muestras Ocular Deberá utilizarse una tórula para cada ojo. Contenido 1. Introducción... 1 a) Secreción conjuntival... 1 b) Raspado corneal... 1 c) Aspirado de fluido vítreo Bibliografía Introducción La infección ocular es una de las principales causas de ceguera en los países en vías de desarrollo esencialmente debido al tracoma. Asimismo, es una infección relevante en los países occidentales debido a la infección herpética y, más recientemente, al aumento de las intervenciones quirúrgicas y las complicaciones asociadas al uso de lentes de contacto. Para el manejo de estas infecciones es fundamental establecer el diagnóstico microbiológico puesto que las manifestaciones clínicas a menudo son inespecíficas. Por otro lado, el diagnóstico debe obtenerse lo más pronto posible porque los tejidos oculares son muy vulnerables a la respuesta inflamatoria y su lesión conduce a la pérdida irreversible de agudeza visual. a) Secreción conjuntival No usar gotas oftálmicas 18 a 24 horas antes de la muestra. Ausencia de cualquier cosmético. No tomar antibióticos 24 a 48 horas antes. No usar anestésicos que posean actividad antimicrobiana. Tome una muestra por cada ojo con tórula previamente humedecidas con suero fisiológico. Obtener la secreción con tórula estéril frotando la conjuntiva tarsal inferior y el fórnix de afuera hacia adentro. Rotar la tórula suavemente para que toda la superficie del algodón se empape de la secreción purulenta. Guantes estériles Tórula estéril, jeringa y aguja estériles. temperatura ambiente durante 48 horas. Posteriormente debe b) Raspado corneal Esta muestra es recolectada por el especialista. Procedimiento médico bajo técnica aséptica. Instile uno o dos gotas de anestésico. Use espátula estéril y raspe las lesiones o
6 Ocular Muestras Ocular úlceras e inocule la muestra en tubo estéril seco con tapa rosca o tapón de caucho. Espátula de platino flexible o ansa bacteriológica nueva o descartable. Anestésico local. Guantes estériles Jeringa y aguja estériles temperatura ambiente durante 48 horas. Posteriormente debe temperatura ambiente durante 48 horas. Posteriormente debe c) Aspirado de fluido vítreo Procedimiento médico bajo técnica aséptica. Puede obtenerse una muestra de humor vítreo, por aspiración con jeringa en el quirófano o preferentemente por vitrectomía y lavado para evitar tracciones vítreas. Utilice técnica aséptica para realizar punción por aspiración. 2. Bibliografía Carlberg, D. Cleanroom microbiology for the non microbiologist. Interpharm Press. INC. Buffalo Grove, Illinois Cercenado E, Canton R. Procedimientos en microbiología clínica, SEIMC. España, Collins CH, Lyne PM, Grange JM. Microbiological methods. 7ma edition. Oxford Etxebarría J, López-Cerero L, Mensa J., E. Diagnóstico microbiológico de las infecciones oculares. Procedimientos en Microbiología Clínica. Recomendaciones de la Sociedad Española de Enfermedades Infecciosas Forman MS, Valsamakis A, Specimen collection, transport, and processing: Virology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH,
7 Ocular Muestras Ocular editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Guerrero Gómez C; Sánchez Carrillo C. Procedimientos en microbiología clínica. Recogida, transporte y procesamientos general de las muestras en el laboratorio de microbiología, Miller JM, Holmes HT. General principles in specimen collection, transport and storage. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Organización Mundial de la Salud. Guía para transporte seguro de sustancias infecciosas y especímenes. Ginebra (Suiza): WHO/EMC/97.3; Thomson BR (JR.), and Miller M. Specimen collection, transport, and processing: Bacteriology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; 2003.
8 Ótica Muestras Ótica Contenido 1. Introducción... 1 a) Exudado del auditivo externo... 1 b) Tímpanocentesis Bibliografía Introducción En el oído existen dos compartimentos, el oído externo y el oído interno que pueden ser afectados por distintos microorganismos. El oído externo se encuentra abierto al ambiente y los patógenos que lo infectan son los que afectan normalmente a la piel y tejidos blandos. Por su parte, el oído interno alberga los componentes anatómicos del sistema auditivo y está comunicado con la nasofaringe, por lo que los organismos que la infectan son los patógenos respiratorios. a) Exudado del auditivo externo Se utiliza para conocer la etiología en caso de otitis externa. No usar gotas óticas de 18 a 24 horas antes de la toma de la muestra. No tomar o aplicar antibióticos de 24 a 48 horas antes. Antes de tomar la muestra hacer un aseo cuidadoso en la piel del área. Limpiar el oído con suero fisiológico y el antiséptico. Tomar el exudado de las zonas profundas mediante frotis con tórula o, en caso de abscesos, por aspiración del fluido. Tórula de algodón. Suero fisiológico Antiséptico suave temperatura ambiente durante 48 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por 4 b) Tímpanocentesis La muestra debe ser obtenida por un especialista en otorrinolaringología. Si el tímpano está roto, tras limpiar el canal externo, se tomará la muestra con tórula a través del otoscopio Se limpia el canal auditivo externo con una tórula impregnado en yodo povidona. El tímpano se punciona a través de un otoscopio estéril. La muestra se enviará en un tubo estéril. temperatura
9 Ótica Muestras Ótica ambiente durante 48 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por 4 2. Bibliografía Carlberg, D. Cleanroom microbiology for the non microbiologist. Interpharm Press. INC. Buffalo Grove, Illinois Collins CH, Lyne PM, Grange JM. Microbiological methods. 7ma edition. Oxford infecciosas y especímenes. Ginebra (Suiza): WHO/EMC/97.3; Procedimientos en microbiología clínica. Emilia Cercenado y Rafael Cantón SEIMC. España. Thomson BR (JR.), and Miller M. Specimen collection, transport, and processing: Bacteriology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Forman MS, Valsamakis A, Specimen collection, transport, and processing: Virology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Guerrero Gómez C; Sánchez Carrillo C. Procedimientos en microbiología clínica. Recogida, transporte y procesamientos general de las muestras en el laboratorio de microbiología, Miller JM, Holmes HT. General principles in specimen collection, transport and storage. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Organización Mundial de la Salud. Guía para transporte seguro de sustancias
10 Periodontal Muestras Periodontal Contenido 1. Introducción... 1 a) Gingival, periodontal, periapical, estomatitis de Vicent... 1 b) Saliva... 1 c) Ulceras y heridas superficiales Bibliografía Introducción Las infecciones periodontales inflaman y destruyen las estructuras que rodean y sostienen los dientes, principalmente las encías, el hueso y la capa externa de la raíz del diente. Están producidas por ciertas microorganismos provenientes de la placa subgingiva, siendo las bacterias anaerobias gramnegativas más importantes y prevalentes en el área subgingival el Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis y Prevotella intermedia. a) Gingival, periodontal, periapical, estomatitis de Vicent Limpie cuidadosamente el margen gingival y la superficie dental supragingival, para remover la saliva, los detritos y la placa. Usando una espátula periodontal remueva cuidadosamente material de la lesión subgingival y transfiéralo al microtubo estéril. Guantes no estériles. Mascarilla, protección ocular. Espátula periodontal. Microtubo estéril. temperatura ambiente durante 48 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por 4 b) Saliva Se recomienda mantener ayuno de una hora por lo menos. Colectar entre ml de saliva en un tubo estéril. Tubo estéril. temperatura ambiente durante 48 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por una
11 Periodontal Muestras Periodontal c) Ulceras y heridas superficiales Limpiar la herida del borde hacia afuera con gasa impregnada con solución salina normal y alcohol isopropílico al 70%, con el fin de evitar la contaminación de la muestra con flora colonizante que no está realmente implicada en el proceso infeccioso. Lavar la parte interna de la herida con solución salina abundante, sin presión. No usar antisépticos. Aspire si es posible o pase una tórula dentro de la herida. Tome la muestra con dos tórulas. Coloque las tórulas en un tubo estéril con tapa. Guantes estériles. Solución salina normal o alcohol al 70%. Gasa estéril. Frasco estéril con tapa rosca o tapón de caucho. Tórulas estériles. temperatura ambiente durante 48 horas. Posteriormente debe 2. Bibliografía Carlberg, D. Cleanroom microbiology for the non microbiologist. Interpharm Press. INC. Buffalo Grove, Illinois CercenadoE, Cantón R. Procedimientos en microbiología clínica. SEIMC. España, Collins CH, Lyne PM, Grange JM. Microbiological methods. 7ma edition. Oxford Forman MS, Valsamakis A, Specimen collection, transport, and processing: Virology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Guerrero Gómez C; Sánchez Carrillo C. Procedimientos en microbiología clínica. Recogida, transporte y procesamientos general de las muestras en el laboratorio de microbiología, Miller JM, Holmes HT. General principles in specimen collection, transport and storage. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Organización Mundial de la Salud. Guía para transporte seguro de sustancias
12 Periodontal Muestras Periodontal infecciosas y especímenes. Ginebra (Suiza): WHO/EMC/97.3; Thomson BR (JR.), and Miller M. Specimen collection, transport, and processing: Bacteriology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; 2003.
13 Cardiovascular Muestras Cardiovascular Contenido 1. Introducción... 1 a) Sangre obtenida a través de punción periférica Bibliografía Introducción Cuando un microorganismo llega a la sangre viaja por todo el cuerpo y algunos de ellos pueden acceder al espacio intravascular, infectando la superficie endotelial de distintas zonas del sistema cardiovascular. Ahí causan distintos cuadros clínicos como flebitis, endarteritis o endocarditis. Las infecciones intravasculares son causadas principalmente por bacterias, y en menor proporción por hongos. a) Sangre obtenida a través de punción periférica Realizar lavado de manos quirúrgico. Mantener técnica aséptica durante todo el procedimiento. Utilizar campo estéril para evitar tener contacto con áreas circundantes que ofrezca el riesgo de contaminación. Colocar mascarilla al paciente. Realizar antisepsia de la zona a puncionar; no palpe la vena sin guantes estériles una vez preparada la piel. Utilizar otros guantes estériles para cada punción. POR ÉSTE MÉTODO NO PUEDEN SER PROCESADAS MUESTRAS CON HEPARINA. En pacientes heparinizados, la toma de muestra debe realizarse en el momento más alejado de la administración del medicamento. La toma deberá hacerse en un lugar perfectamente iluminado y con el paciente cómodamente sentado. Localizar una vena adecuada en la cara anterior del codo y colocar el torniquete en la parte media del brazo. Desinfectar el área con un algodón humedecido con alcohol al 70% e introducir la aguja con el bisel hacia arriba. Si la sangre no fluye espontáneamente y se está utilizando una jeringa, jalar el émbolo y aspirar con suavidad; si se está empleando equipo al vacío presionar el tubo de ensaye hacia arriba. Al empezar a fluir la sangre retirar el torniquete. Una vez que se haya obtenido entre 5-8 ml de sangre, retirar la aguja y colocar una tórula con alcohol sobre el sitio de punción ejerciendo presión para detener la hemorragia. En recién nacidos y lactantes, donde no es
14 Cardiovascular Muestras Cardiovascular fácil obtener tanta cantidad de muestra, debe enviarse como mínimo ml de sangre completa. Si la toma se hizo con jeringa, retirar la aguja y verter la sangre a un tubo estéril, dejándola resbalar lentamente por la pared para evitar hemólisis. Tapar el tubo cuidadosamente. Si la muestra necesaria es sangre total utilizar un tubo de hematología con EDTA (venoject ó vacutainer TAPA MORADA). Bata y campos estériles. Gorro y mascarilla con protección ocular. Guantes estériles. Equipo de asepsia (antiséptico, gasas y guantes estériles). Tubo de hematología con EDTA. Jeringas estériles. La muestra debe ser analizada dentro de las 24 hrs. siguientes, en caso contrario puede mantenerse refrigerada a 4ºC hasta una semana. Se recomienda no congelar. 2. Bibliografía Carlberg, D. Cleanroom microbiology for the non microbiologist. Interpharm Press. INC. Buffalo Grove, Illinois Collins CH, Lyne PM, Grange JM. Microbiological methods. 7ma edition. Oxford Forman MS, Valsamakis A, Specimen collection, transport, and processing: Virology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Guerrero Gómez C; Sánchez Carrillo C. Procedimientos en microbiología clínica. Recogida, transporte y procesamientos general de las muestras en el laboratorio de microbiología, Miller JM, Holmes HT. General principles in specimen collection, transport and storage. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Organización Mundial de la Salud. Guía para transporte seguro de sustancias infecciosas y especímenes. Ginebra (Suiza): WHO/EMC/97.3; Procedimientos en microbiología clínica. Emilia Cercenado y Rafael Cantón SEIMC. España.
15 Cardiovascular Muestras Cardiovascular Thomson BR (JR.), and Miller M. Specimen collection, transport, and processing: Bacteriology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; 2003.
16 Respiratorias Muestras Respiratorias Tabla de contenido 1. Introducción Infecciones del tracto respiratorio superior... 1 a. Secreción de la zona nasal... 1 b. Secreción de área nasofaríngea... 2 c. Aspirado nasofaringe... 2 d. Secreción de la faringe... 3 e. Senos paranasales Infecciones del tracto respiratorio inferior... 4 a. Esputo por expectoración espontánea... 4 b. Esputo inducido... 5 c. Secreción traqueal... 5 d. Lavado o cepillado broncoalveolar... 6 e. Muestras obtenidas por abordaje percutáneo... 6 i. Punción pulmonar aspirativa transtorácica:... 7 ii. Punción biópsica pulmonar... 7 iii. Biopsia pulmonar por toracotomía Bibliografía Introducción Las infecciones respiratorias agudas comprenden numerosos cuadros clínicos, los que pueden dividirse de acuerdo a su localización en dos grupos, infecciones del tracto respiratorio agudo superior e infecciones del tracto respiratorio agudo inferior. Pueden ser causadas por distintos patógenos, los cuales varían de un cuadro a otro. Las principales bacterias involucradas son Streptococcus pyogenes, Streptococcus pneumoniae y Haemophilus influenzae, en las cuales se ha visto el desarrollo de resistencia a los antibióticos de uso habitual. 2. Infecciones del tracto respiratorio superior a. Secreción de la zona nasal Evitar las gotas y los baños nasales antes de tomar la muestra. El frotis y cultivo nasal no es el cultivo para diagnóstico de sinusitis, otitis media o infecciones del tracto respiratorio inferior. Sólo se recomienda tomar cultivo de fosas nasales anteriores para la detección de portadores de Staphylococcus aureus o en lesiones nasales. Para búsqueda de hongos se recomienda la misma técnica.
17 Respiratorias Muestras Respiratorias Colocar al paciente bajo una buena fuente de luz. Levantar la cabeza del paciente y con la otra mano introducir la tórula 1 cm en el interior de las fosas nasales, rotarla y luego retirarla e identificar de qué fosa nasal se tomó la muestra. Guantes no estériles. Tórulas estériles. Lámina de vidrio y tubo con medio de transporte. temperatura ambiente durante 48 horas. Posteriormente debe Colocar al paciente bajo una buena fuente de luz. Introducir la tórula flexible hasta la nasofaringe posterior evitando trauma. Rotar la tórula por 10 a 15 segundos para permitir la impregnación del hisopo y retirar lentamente Barreras de protección (mascarilla y protección ocular). Guantes no estériles. Tórulas estériles flexibles. Tubo estéril. temperatura ambiente durante 48 horas. Posteriormente debe b. Secreción de área nasofaríngea La persona que obtiene la muestra debe usar barreras de protección (mascarilla, protección ocular). No hacer gárgaras ni limpieza con ninguna solución bucofaríngea. Tomar la muestra preferiblemente en ayunas. c. Aspirado nasofaringe La persona que obtiene la muestra debe usar barreras de protección (mascarilla, protección ocular). No hacer gárgaras ni limpieza con ninguna solución bucofaríngea Tomar la muestra preferiblemente en ayunas.
18 Respiratorias Muestras Respiratorias Es colectado mediante el paso de una sonda nelaton de un calibre apropiado dentro de la nasofaringe. Aspirar luego el material con una jeringa estéril u otro mecanismo de succión y colocarlo en tubo estéril seco. En caso de no poder recolectar la muestra en la jeringa, envíe el extremo distal de la sonda con el material aspirado en el tubo estéril seco. Barreras de protección (mascarilla y protección ocular). Guantes no estériles. Tubo estéril seco o medio de transporte para virus. Sonda nelaton. Jeringa estéril. temperatura ambiente durante 48 horas. Posteriormente debe d. Secreción de la faringe No contaminar la tórula con secreción de cavidad oral o dientes. El hisopado de garganta está contraindicado en pacientes con diagnóstico de epiglotitis. No hacer gárgaras ni limpieza con ninguna solución bucofaríngea. Colocar al paciente bajo una buena fuente de luz. Con un bajalenguas, presionar la lengua hacia abajo para visualizar los pilares de la faringe y del área tonsilar para localizar el área de inflamación y exudado. Rotar la tórula estéril sobre el área. Guantes. Tórulas estériles. temperatura ambiente durante 48 horas. Posteriormente debe e. Senos paranasales Se realiza la punción-aspiración de los mismos, lo que requiere un especialista en otorrinolaringología. Este tipo de muestra no se realiza de rutina en caso de sinusitis aguda, sino que en general se reserva para casos de
19 Respiratorias Muestras Respiratorias sinusitis crónica, para aquellos casos que no responden al tratamiento instaurado y en aquellos casos que el especialista considere necesario. Desinfectar el lugar de la punción con yodo povidona. Introducir una aguja en el antrum maxilar por debajo del cornete inferior, o en el seno frontal por debajo del marco supraorbital del ojo. Aspirar el líquido del seno. Cuando no se obtenga líquido, instilar 1 ml de suero salino estéril y aspirarlo nuevamente. Inyectar la muestra en un medio de transporte para anaerobios o en su defecto tubo estéril. Yodo povidona al 10%. Contenedor de boca ancha estéril, con tapa de rosca. Material quirúrgico de otorrinolaringología. temperatura ambiente durante 48 horas. Posteriormente debe 3. Infecciones del tracto respiratorio inferior a. Esputo por expectoración espontánea El esputo no es la muestra ideal para el diagnóstico de neumonía; se recomienda preferiblemente el lavado broncoalveolar. Recolectar la muestra en la mañana, en ayunas preferiblemente. Instruir al paciente para realizar cepillado de dientes y lavado de la lengua sólo con agua para remover el exceso de flora oral y retirar prótesis dental en pacientes de edad. Para pacientes pediátricos incapaces de producir un esputo, la terapeuta respiratoria debe obtener la muestra a través de succión. En pacientes ambulatorios sintomáticos respiratorios con sospecha de tuberculosis, la primera muestra se toma el día de la consulta médica y las otras dos al día siguiente, cumpliendo las recomendaciones descritas para paciente hospitalizado. Instruir al paciente para que tosa con fuerza y profundamente, con el fin de obtener una muestra que provenga del tracto respiratorio inferior, libre de saliva contenida en la cavidad oral, la cual debe expectorar directamente en un recipiente estéril de boca ancha de tapa rosca.
20 Respiratorias Muestras Respiratorias Frasco estéril de boca ancha, de 5 cm de diámetro, de tapa rosca, con capacidad de 30 a 50 ml, de material fácil de rotular. temperatura ambiente durante 48 horas. Posteriormente debe b. Esputo inducido Instruir al paciente para realizar cepillado de dientes y lavado de lengua solo con agua. Realizar nebulización con solución salina normal. Para pacientes pediátricos incapaces de producir un esputo, la terapeuta respiratoria debe obtener la muestra a través de succión. Instruir al paciente para que tosa con fuerza y profundamente, con el fin de obtener una muestra que provenga del tracto respiratorio inferior, libre de saliva contenida en la cavidad oral, la cual debe expectorar directamente en un recipiente estéril de boca ancha de tapa rosca. Frasco estéril de boca ancha de tapa rosca de 5 cm de diámetro, con una capacidad de 30 a 50 ml y material fácil de rotular. Nebulizador. Solución salina normal. temperatura ambiente durante 48 horas. Posteriormente debe c. Secreción traqueal Realice el procedimiento con técnica aséptica. De acuerdo con las características de las secreciones, irrigar con solución salina normal previo a realizar el procedimiento. Introducir la sonda sin hacer succión a través del tubo endotraqueal o cánula de traquestomía, hasta ubicarla en el espacio traqueal. Ocluya el orificio distal de la sonda y comience a succionar, retire la sonda lentamente mientras la va limpiando externamente con una gasa estéril. Tenga precaución de suspender la succión, retirando la oclusión de la sonda para que se conserve la muestra obtenida
21 Respiratorias Muestras Respiratorias en el trayecto de la misma. Coloque la muestra obtenida en frasco estéril cortando el segmento distal de la sonda, si no es posible el depósito de la muestra sola, para lo cual retira la presión en el orificio de la sonda lo que permitirá la expulsión de la muestra en el recipiente. Guantes estériles. Mascarilla con protección ocular. Sonda de nelaton. Hoja de bisturí. Solución salina normal. Gasas estériles. Frasco de boca ancha estéril o trampa recolectora. temperatura ambiente durante 48 horas. Posteriormente debe d. Lavado o cepillado broncoalveolar El paciente debe estar en ayunas para realizar el procedimiento, ya que se requiere de sedación. A través de técnica de fibrobroncoscopia. Conecte una trampa de Lukens al fibrobroncoscopio. Irrigar con 10 ml de solución salina a través del canal abierto. Succione para obtener la muestra en dos frascos estériles de boca ancha. Equipos de fibrobroncoscopia. Sistema de succión. Recipiente de boca ancha estéril de tapa rosca. temperatura ambiente durante 48 horas. Posteriormente debe e. Muestras obtenidas por abordaje percutáneo Son todos procedimientos médicos. Dentro de las técnicas invasivas son las que permiten la obtención de muestras más representativas del parénquima pulmonar, no obstante, sólo deben emplearse cuando fracasen otros métodos menos invasivos o cuando la situación del enfermo haga imprescindible conocer el diagnóstico etiológico. Técnica a realizar por personal entrenado. Pueden emplearse las siguientes:
22 Respiratorias Muestras Respiratorias i. Punción pulmonar aspirativa transtorácica: Obtención del exudado de las lesiones pulmonares a través de una punción transtorácica con aguja ultrafina con control radioscópico o ecográfico. Debe aplicarse ante infiltraciones densas (no intersticiales) y sobre todo si son periféricas. Contraindicado en pacientes con bullas, trastornos de coagulación y sospecha de hidatidosis. Posibles complicaciones, como neumotórax y hemoptisis. Es una muestra ideal para estudio en infección anaerobia grave en niños, especialmente en edades tempranas. ii. Punción biópsica pulmonar Biopsia transtorácica con trocar. Sólo en casos excepcionales y en caso de lesiones muy periféricas debido al alto riesgo de neumotórax. iii. Biopsia pulmonar por toracotomía Permite la selección visual del área neumónica a cielo abierto. temperatura ambiente durante 48 horas. Posteriormente debe 4. Bibliografía Carlberg, D. Cleanroom microbiology for the non microbiologist. Interpharm Press. INC. Buffalo Grove, Illinois CercenadoE, Cantón R. Procedimientos en microbiología clínica. SEIMC. España, Collins CH, Lyne PM, Grange JM. Microbiological methods. 7ma edition. Oxford Forman MS, Valsamakis A, Specimen collection, transport, and processing: Virology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Guerrero Gómez C; Sánchez Carrillo C. Procedimientos en microbiología clínica. Recogida, transporte y procesamientos general de las muestras en el laboratorio de microbiología, Miller JM, Holmes HT. General principles in specimen collection, transport and storage. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Organización Mundial de la Salud. Guía para transporte seguro de sustancias
23 Respiratorias Muestras Respiratorias infecciosas y especímenes. Ginebra (Suiza): WHO/EMC/97.3; Thomson BR (JR.), and Miller M. Specimen collection, transport, and processing: Bacteriology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; 2003.
24 Gastrointestinal Muestras Gastrointestinal Contenido 1. Introducción Materia fecal... 1 a) Heces... 1 b) Tórula rectal Muestras digestivas altas... 2 a) Aspirado gástrico... 2 b) Biopsia gástrica/antral obtenida por endoscopia Muestras digestivas bajas... 3 a) Biopsia rectal y sigmoidoscopia Bibliografía Introducción Las infecciones gastrointestinales agudas presentan una incidencia muy variable y pueden ser provocadas por una gran cantidad de patógenos como bacterias, virus o protozoos. Clínicamente se presentan como trastornos funcionales leves, poco molestos y autolimitados, o pueden convertirse en un proceso grave, con importantes cuadros de deshidratación y desnutrición y severos desequilibrios hidroelectrolíticos que pueden poner en peligro la vida del enfermo. En los países subdesarrollados, la gastroenteritis aguda asociada a diarrea es una causa importante de morbilidad en todas las edades y de mortalidad en lactantes y niños pequeños. 2. Materia fecal a) Heces En el caso de pacientes pediátricos, si no es posible recoger muestra de materia fecal se puede tomar la muestra a través de frotis rectal. Recolectar en lo posible más de 2 cc o gramos de materia fecal. Guantes. Frasco plástico limpio, de boca ancha. temperatura ambiente durante 48 horas. Posteriormente debe b) Tórula rectal Recomendado en pacientes pediátricos y adultos incapaces de recolectar muestra de materia fecal.
25 Gastrointestinal Muestras Gastrointestinal Cuidadosamente introducir la tórula 2 cm en el esfínter anal. Rotar suavemente la tórula para obtener la muestra. Guantes no estériles. Tórulas. Tubo estéril con tapa rosca o tapón de caucho. temperatura ambiente durante 48 horas. Posteriormente debe 3. Muestras digestivas altas a) Aspirado gástrico La sonda se debe fijar y marcar al nivel que se introdujo, con el fin de evaluar si se movilizó durante la noche. Dejar cerrada durante la noche. Recolectar la muestra de la mañana, luego de 6 horas de ayuno. Tomar la muestra con el paciente en reposo. Pasar una sonda nasogástrica la noche anterior y explicar la finalidad de la misma. En la mañana y con el paciente en reposo, aspirar de 5 a 10 ml de contenido gástrico con una jeringa estéril. Depositar la muestra en recipiente estéril. Posteriormente instilar de 25 a 50 ml de agua destilada y aspirar 20 ml de contenido gástrico. Agregar al recipiente estéril con la muestra inicial y tapar herméticamente. Jeringa de 10 ml. Guantes no estériles. Recipiente de boca ancha estéril de tapa rosca con capacidad para 50 ml. Sonda nasogástrica. Agua destilada. temperatura ambiente durante 48 horas. Posteriormente debe b) Biopsia gástrica/antral obtenida por endoscopia Se usa para la detección de Helicobacter
26 Gastrointestinal Muestras Gastrointestinal pylori, agente causal en casos de úlceras duodenales o gástricas. Es fundamental obtener varias muestras tanto de la base como de los cuatro cuadrantes del margen de la úlcera, sin olvidar la biopsia de la mucosa antral. Este procedimiento debe ser realizado por el médico. Seccionar la muestra en fresco para enviar al laboratorio clínico. Fibrogastroscopio y material complementario. Tubos con suero fisiológico (1 ml) para pequeñas muestras. temperatura ambiente durante 48 horas. Posteriormente debe 4. Muestras digestivas bajas a) Biopsia rectal y sigmoidoscopia La biopsia rectal es normalmente empleada para la detección de Entamoeba histolytica, el HSV y Balantidium coli. Las muestras tomadas por sigmoidoscopia se usan en la detección de E.histolytica, micobacterias y colitis seudomembranosa por C. difficile y S. aureus. Biopsia rectal: emplear pinzas para tomar muestras de las lesiones o de la mucosa rectal posterior a unos 7-10 cm del esfínter anal. Sigmoidoscopia: toma con pinzas o con pipeta. Sigmoidoscopio, rectoscopio y material complementario. Pipetas. Tubos de tapa rosca estériles con o sin solución salina. temperatura ambiente durante 48 horas. Posteriormente debe
27 Gastrointestinal Muestras Gastrointestinal 5. Bibliografía Carlberg, D. Cleanroom microbiology for the non microbiologist. Interpharm Press. INC. Buffalo Grove, Illinois CercenadoE, Cantón R. Procedimientos en microbiología clínica. SEIMC. España, Collins CH, Lyne PM, Grange JM. Microbiological methods. 7ma edition. Oxford infecciosas y especímenes. Ginebra (Suiza): WHO/EMC/97.3; Thomson BR (JR.), and Miller M. Specimen collection, transport, and processing: Bacteriology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Forman MS, Valsamakis A, Specimen collection, transport, and processing: Virology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Guerrero Gómez C; Sánchez Carrillo C. Procedimientos en microbiología clínica. Recogida, transporte y procesamientos general de las muestras en el laboratorio de microbiología, Miller JM, Holmes HT. General principles in specimen collection, transport and storage. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Organización Mundial de la Salud. Guía para transporte seguro de sustancias
28 Ósea y Articular Muestras Ósea y Articular etilendiaminotetracético). Contenido 1. Introducción... 1 a) Líquido sinovial o articular Bibliografía Introducción Las infecciones de los huesos y articulaciones (ostomielitis y artritis) pueden originarse como consecuencia de una fractura abierta contaminada o de forma secundaria a una intervención quirúrgica sobre un hueso o articulación. También pueden producirse por extensión local de un proceso supurativo de las partes blandas adyacentes. Los estafilococos y los estreptococos son los microorganismos que causan con mayor frecuencia infecciones en las articulaciones y los huesos. Antes de la vacunación contra Haemophilus influenzae tipo b, este microorganismo era una causa frecuente de artritis y ostomielitis en niños menores de 5 años de edad. a) Líquido sinovial o articular La recolección de muestras de este origen está reservada estrictamente al médico especialista. No se recomienda usar tórulas, la muestra debe ser obtenida por aspirado o drenaje quirúrgico. Los líquidos susceptibles de formar coágulo deben ser colectados en tubos con anticoagulante EDTA (ácido Realice preparación de la piel con técnica aséptica. Puncionar con jeringa y aguja estéril, y recoger entre 0,5 y 3 ml de líquido. Recolectar en frasco seco. Equipo de preparación de piel y anestesia local. Jeringa y aguja estéril. Tubo estéril seco. temperatura ambiente durante 4 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por una semana. 2. Bibliografía Carlberg, D. Cleanroom microbiology for the non microbiologist. Interpharm Press. INC. Buffalo Grove, Illinois CercenadoE, Cantón R. Procedimientos en microbiología clínica. SEIMC. España, Collins CH, Lyne PM, Grange JM. Microbiological methods. 7ma edition. Oxford 1995.
29 Ósea y Articular Muestras Ósea y Articular Forman MS, Valsamakis A, Specimen collection, transport, and processing: Virology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Guerrero Gómez C; Sánchez Carrillo C. Procedimientos en microbiología clínica. Recogida, transporte y procesamientos general de las muestras en el laboratorio de microbiología, Miller JM, Holmes HT. General principles in specimen collection, transport and storage. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Organización Mundial de la Salud. Guía para transporte seguro de sustancias infecciosas y especímenes. Ginebra (Suiza): WHO/EMC/97.3; Thomson BR (JR.), and Miller M. Specimen collection, transport, and processing: Bacteriology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; 2003.
30 Laboratorio Clínico Especializado en Análisis Genéticos Envío de Muestras Muestras de piel y tejidos blandos. a) Biopsia de tejido Medio de Transporte Tubo estéril tapa rosca Cantidad Mínima 1 muestra (0.5 gramo) Temperatura Transporte Almacenamiento y Transporte Requerimiento Especial Temperatura ambiente Máximo 48 horas a partir de la recolección (temperatura ambiente). Hasta dos semanas manteniendo la muestra refrigerada a 4 ºC. Hasta tres meses manteniendo la muestra congelada a -20 ºC. Ninguno b) Herida o abscesos. Medio de Transporte Tubo estéril tapa rosca Cantidad Mínima 1 muestra (0.5 gramo) Temperatura Transporte Almacenamiento y Transporte Requerimiento Especial Temperatura ambiente Máximo 48 horas a partir de la recolección (temperatura ambiente). Hasta dos semanas manteniendo la muestra refrigerada a 4 ºC. Hasta tres meses manteniendo la muestra congelada a -20 ºC. Ninguno.
31 Laboratorio Clínico Especializado en Análisis Genéticos Envío de Muestras Muestras de piel y tejidos blandos. c)sangre total Medio de Transporte Tubo con EDTA como anticoagulante (tapa morada). Cantidad Mínima 1ml Temperatura Transporte Almacenamiento y Transporte Requerimiento Especial Temperatura ambiente Máximo 24 horas a partir de la recolección (temperatura ambiente). Hasta una semana manteniendo la muestra refrigerada a 4 ºC. No se debe utilizar heparina como anticoagulante (no usar tubo tapa verde). Se recomienda no congelar.
32 Genitourinarias Muestras Genitourinarias Contenido Contenido Introducción Genitales femeninos... 2 a) Secreciones cervicales... 2 b) Secreciones vaginales... 2 c) Secreciones uretrales Genitales masculinos... 3 a) Secreciones uretrales... 3 b) Secreción prostática... 4 c) Lesiones genitales... 4 d) Semen Orina... 5 a) Orina de micción espontánea... 5 b) Orina obtenida a través de cateterismo transuretral... 5 c) Orina obtenida a través de sonda vesical permanente... 6 d) Orina obtenida en pacientes pediátricos 6 e) Orina obtenida a través de sonda de urostomía y nefrostomía... 7 f) Orina obtenida por punción suprapúbica 7 5. Bibliografía... 8
33 Genitourinarias Muestras Genitourinarias 1. Introducción La gravedad de una enfermedad urinaria depende de la zona del aparato urinario que se infecte. Las infecciones en la zona baja, como vejiga y uretra, son comunes y no dejan secuelas, aunque pueden ser muy molestas. Las infecciones que afectan al tracto superior, como los riñones y uréteres, presentan síntomas más graves como fiebre y vómitos. Las bacterias presentes en los riñones pueden diseminarse por la sangre, causando una infección potencialmente mental. 2. Genitales femeninos a) Secreciones cervicales La paciente debe haber suspendido el tratamiento antibiótico, aplicación de óvulos o duchas vaginales 3 días antes de la toma de la muestra. Evitar tener relaciones sexuales 3 días antes de la toma de la muestra y no realizar la toma durante el sangrado menstrual. Este procedimiento está contraindicado en pacientes embarazadas. Utilizar espéculo estéril o desechable. No usar lubricantes durante el procedimiento. Con la paciente en posición ginecológica introducir un espéculo. Con un primera torula estéril remover moco y secreciones del orificio de entrada del cuello cervical, y desecharlo. Con una nueva torula estéril tome cuidadosamente la muestra del canal endocervical y colóquelo en tubo estéril con tapa rosca o tapón de caucho. Guantes no estériles. Tórula estéril. Tubo estéril con tapa rosca o tapón de caucho. temperatura ambiente durante 48 horas. Posteriormente debe b) Secreciones vaginales La paciente no debe aplicar óvulos o duchas vaginales 24 horas antes de la toma de la muestra. Verificar que se haya realizado una limpieza adecuada de los genitales externos previamente, para eliminar secreciones contaminantes. Con la paciente en posición ginecológica introducir un espéculo, recoger la muestra, bajo visión directa, con una tórula seca. Tomar la muestra en la zona de mayor exudado o del fondo del saco vaginal, realizar suaves movimientos de rotación. Colóquelo en tubo estéril con tapa rosca o tapón de caucho.
34 Genitourinarias Muestras Genitourinarias Tórulas estériles. Tubo estéril. Solución salina. temperatura ambiente durante 48 horas. Posteriormente debe c) Secreciones uretrales Verificar que se haya realizado una limpieza adecuada de los genitales externos previamente, para eliminar secreciones contaminantes. La muestra se debe tomar al menos una hora después de que el paciente haya orinado. Inserte una tórula estéril pequeña 1 a 2 cm dentro de la uretra, rótela y déjela introducida al menos por 2 segundos para facilitar la absorción. Equipo para higiene externa (jabón antiséptico, gasas, jarra con agua). Tórulas uretrales finas estériles. Tubo estéril. temperatura ambiente durante 48 horas. Posteriormente debe 3. Genitales masculinos a) Secreciones uretrales Verificar que se haya realizado una limpieza adecuada de los genitales externos previamente, para eliminar secreciones contaminantes. La muestra se debe tomar al menos una hora después de que el paciente haya orinado. Realice masaje prostático para tomar la muestra; si se observa la salida de material por la uretra, recoléctelo en un tubo seco estéril. En caso de no obtener drenaje con el masaje uretral, realice lavado en el área periuretral con antiséptico y enjuague con agua. Inserte una tórula estéril pequeña 2 a 4 cm dentro de la uretra, rótela y déjela introducido al menos por 2 segundos para facilitar la absorción. Equipo para higiene externa (jabón antiséptico, gasas, jarra con agua). Tórulas estériles.
35 Genitourinarias Muestras Genitourinarias Tubo estéril. temperatura ambiente durante 48 horas. Posteriormente debe b) Secreción prostática Verificar que el paciente haya evacuado la vejiga. Realice la limpieza del meato uretral con agua y jabón. Realice masaje prostático a través del recto y recolecte el fluido expulsado a través de la uretra en un tubo estéril o recolecte más de un mililitro. Guantes no estériles. Tubo estéril. temperatura ambiente durante 48 horas. Posteriormente debe c) Lesiones genitales Realice limpieza de las lesiones con solución salina estéril antes de tomar la muestra. Los virus aislados con mayor frecuencia de lesiones genitales son HSV-1 y HSV-2, CMV y virus de papiloma humano. Con una hoja de bisturí remueva la superficie de la lesión. Mientras presiona firmemente la base de la lesión, permita que el trasudado se acumule y con la tórula estéril recolecte la muestra y colóquela en tubo estéril. Guantes no estériles. Torula estéril. Tubo estéril. temperatura ambiente durante 48 horas. Posteriormente debe d) Semen Lavarse cuidadosamente las manos con agua y jabón. Limpiar la zona genital. Recoger la muestra obtenida por masturbación en recipiente estéril.
36 Genitourinarias Muestras Genitourinarias Frasco estéril. temperatura ambiente durante 48 horas. Posteriormente debe 4. Orina a) Orina de micción espontánea Realizar higiene de genitales: en mujeres, es necesario lavar el vestíbulo vaginal y la entrada de la uretra con agua jabonosa, enjuagar con abundante agua. Secar y separar los labios e iniciar la micción. En el hombre se debe hacer retracción del prepucio y lavar el meato urinario con agua jabonosa, enjuagar con abundante agua y secar. Con el prepucio retraído iniciar la recolección de la orina. En pacientes ambulatorios es ideal recoger la muestra de la primera micción del día. Instruir al paciente para que inicie la micción, desechar la primera parte de la orina. Recoger la parte media de la orina en el frasco colector sin detener el flujo urinario (5-10 ml) Terminar de eliminar en el sanitario o pato. Tapar el frasco sin contaminar la muestra. Frasco recolector estéril de boca ancha de tapa rosca. Equipo de higiene: jabón, gasas. temperatura ambiente durante 24 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por una semana. b) Orina obtenida a través de cateterismo transuretral Realizar higiene de genitales con guantes no estériles. Retirar y desechar los guantes; realizar lavado de manos clínico, usar guantes estériles e insertar el catéter urinario asépticamente. La confiabilidad diagnóstica es cercana a una sensibilidad de 95% y especificidad del 99%, constituyendo una buena alternativa en niños sin control de esfínteres. El riesgo de introducir la infección durante el cateterismo o de otras complicaciones es bajo si el personal entrenado emplea la técnica correcta. Eliminar la primera porción de orina obtenida, colectar la siguiente porción de orina (5-10 ml) en el frasco estéril, retirar la sonda de nélaton y tapar el frasco.
37 Genitourinarias Muestras Genitourinarias Frasco recolector estéril de boca ancha de tapa rosca. Equipo de higiene: jabón, gasas. Sonda de Nelaton (No adultos, No. 6-8 en niños). Guantes estériles y no estériles. temperatura ambiente durante 24 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por una semana. c) Orina obtenida a través de sonda vesical permanente Pinzar la sonda durante 30 a 60 minutos antes de obtener la muestra. Realizar desinfección del puerto en Y de la sonda de foley con alcohol al 70%. Verificar el retiro de la pinza de la sonda después de obtener la muestra. No utilizar orina que ha estado depositada por varias horas en bolsas o frascos colectores. Los pacientes con catéter vesical por largo tiempo, siempre tienen microorganismos en la vejiga. No se recomienda recolectar orina de estos pacientes, a menos que se sospeche que el foco infeccioso es urinario. Puncionar la sonda con jeringa estéril con aguja de calibre pequeño, aspirar 5 a 10 ml de orina, retirar jeringa. Envasar en el frasco estéril, manteniendo la técnica aséptica. Frasco recolector estéril de boca ancha de tapa rosca. Guantes no estériles, gasas estériles, alcohol al 70%. Jeringa estéril. Guantes estériles. temperatura ambiente durante 24 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por una semana. d) Orina obtenida en pacientes pediátricos Pacientes con control de esfínter: realizar higiene de genitales con guantes no estériles. Secar adecuadamente el área genital. El paciente elimina en un recipiente limpio, de este recipiente se reenvasa en un frasco limpio de tapa rosca. Pacientes sin control de esfínter: realizar higiene de genitales con guantes no estériles. Secar adecuadamente el área genital. Si el niño no tiene control de esfínteres y no se puede realizar punción suprapúbica debe tomarse la muestra por sonda vesical. Otra método es colocar bolsa recolectora, si la micción no se da en 20 minutos se deberá repetir el aseo y colocar nueva bolsa. La bolsa recolectora es el método menos traumático de obtener la muestra de orina, ofrece más alto riesgo de contaminación
Manual Toma de Muestras Human PCR Kit
 Manual Toma de Muestras Human PCR Kit Tabla de contenido 1. Introducción... 1 2. Infecciones del tracto respiratorio superior... 1 a. Secreción de la zona nasal... 1 b. Secreción de área nasofaríngea...
Manual Toma de Muestras Human PCR Kit Tabla de contenido 1. Introducción... 1 2. Infecciones del tracto respiratorio superior... 1 a. Secreción de la zona nasal... 1 b. Secreción de área nasofaríngea...
Manual Toma de Muestras Human PCR Kit
 Manual Toma de Muestras Human PCR Kit Contenido Contenido... 1 1. Introducción... 2 2. Genitales femeninos... 2 a) Secreciones cervicales... 2 b) Secreciones vaginales... 2 c) Secreciones uretrales...
Manual Toma de Muestras Human PCR Kit Contenido Contenido... 1 1. Introducción... 2 2. Genitales femeninos... 2 a) Secreciones cervicales... 2 b) Secreciones vaginales... 2 c) Secreciones uretrales...
Manual Toma de Muestras Human PCR Kit
 Manual Toma de Muestras Human PCR Kit Contenido 1. Introducción... 2 2. Herpesvirus humano 1 y herpesvirus humano 2... 2 a) Sangre obtenida a través de punción periférica... 2 b) Líquido pleural, pericárdico,
Manual Toma de Muestras Human PCR Kit Contenido 1. Introducción... 2 2. Herpesvirus humano 1 y herpesvirus humano 2... 2 a) Sangre obtenida a través de punción periférica... 2 b) Líquido pleural, pericárdico,
Manual Toma de Muestras Human PCR Kit
 Manual Toma de Muestras Human PCR Kit 1. Materia fecal... 9 Contenido MUESTRAS GENITOURINARIAS... 2 1. Genitales femeninos... 2 A. Secreciones cervicales... 2 B. Secreciones vaginales... 3 C. Secreciones
Manual Toma de Muestras Human PCR Kit 1. Materia fecal... 9 Contenido MUESTRAS GENITOURINARIAS... 2 1. Genitales femeninos... 2 A. Secreciones cervicales... 2 B. Secreciones vaginales... 3 C. Secreciones
Toma de Muestras Microbiológicas
 Toma de Muestras Microbiológicas MICROBIOLOGÍA CLÍNICA DIAGNÓSTICO DE ENFERMEDADES INFECCIOSAS MUESTRA AISLAMIENTO IDENTIFICACIÓN SENSIBILIDAD A ANTIMICROBIANOS Detección de anticuerpos, antígenos y ácidos
Toma de Muestras Microbiológicas MICROBIOLOGÍA CLÍNICA DIAGNÓSTICO DE ENFERMEDADES INFECCIOSAS MUESTRA AISLAMIENTO IDENTIFICACIÓN SENSIBILIDAD A ANTIMICROBIANOS Detección de anticuerpos, antígenos y ácidos
GUÍA PARA RECOGIDA Y TRANSPORTE DE MUESTRAS
 GUÍA PARA RECOGIDA Y TRANSPORTE DE MUESTRAS SECCIÓN DE MICROBIOLOGÍA H. G. U. A REVISIÓN 2012 Supervisora de Microbiología Mª Ángeles Lillo Hernández NORMAS GENERALES PARA RECOGIDA DE MUESTRAS RECOGER
GUÍA PARA RECOGIDA Y TRANSPORTE DE MUESTRAS SECCIÓN DE MICROBIOLOGÍA H. G. U. A REVISIÓN 2012 Supervisora de Microbiología Mª Ángeles Lillo Hernández NORMAS GENERALES PARA RECOGIDA DE MUESTRAS RECOGER
TOMA DE MUESTRAS MICROBIOLOGICAS. Dra. Dona Benadof Microbiología Hospital Roberto del Río Comité Vigilancia Infecciones Intrahospitalarias
 TOMA DE MUESTRAS MICROBIOLOGICAS Dra. Dona Benadof Microbiología Hospital Roberto del Río Comité Vigilancia Infecciones Intrahospitalarias INTRODUCCIÓN La confiabilidad de los resultados del estudio microbiológico
TOMA DE MUESTRAS MICROBIOLOGICAS Dra. Dona Benadof Microbiología Hospital Roberto del Río Comité Vigilancia Infecciones Intrahospitalarias INTRODUCCIÓN La confiabilidad de los resultados del estudio microbiológico
CATETERISMO VESICAL ELABORADO: CATETERISMO VESICAL
 PAGINA: 1 de 6 REVISADO: COORDINADOR DE CALIDAD ELABORADO: ENFERMERO JEFE COORDINADOR URGENCIAS CATETERISMO VESICAL 1. DEFINICION: Es la introducción de una sonda o catéter a la vejiga por el orificio
PAGINA: 1 de 6 REVISADO: COORDINADOR DE CALIDAD ELABORADO: ENFERMERO JEFE COORDINADOR URGENCIAS CATETERISMO VESICAL 1. DEFINICION: Es la introducción de una sonda o catéter a la vejiga por el orificio
Estudios microbiológicos.procedimientos. 1. Urocultivos
 Estudios microbiológicos.procedimientos 1. Urocultivos Se realizará el cultivo de orina a todas las muestras llegadas al laboratorio, que cumplan con los requisitos para la toma, conservación y transporte
Estudios microbiológicos.procedimientos 1. Urocultivos Se realizará el cultivo de orina a todas las muestras llegadas al laboratorio, que cumplan con los requisitos para la toma, conservación y transporte
Trabajo Práctico Nº4: OBTENCIÓN Y PROCESAMIENTO DE MUESTRAS CLÍNICAS DESTINADAS AL ANÁLISIS MICROBIOLÓGICO. (Lic en Enfermería y Lic en Obstetricia)
 Trabajo Práctico Nº4: OBTENCIÓN Y PROCESAMIENTO DE MUESTRAS CLÍNICAS DESTINADAS AL ANÁLISIS MICROBIOLÓGICO. (Lic en Enfermería y Lic en Obstetricia) INTRODUCCIÓN La actividad que desarrolla el laboratorio
Trabajo Práctico Nº4: OBTENCIÓN Y PROCESAMIENTO DE MUESTRAS CLÍNICAS DESTINADAS AL ANÁLISIS MICROBIOLÓGICO. (Lic en Enfermería y Lic en Obstetricia) INTRODUCCIÓN La actividad que desarrolla el laboratorio
Prevención, Diagnóstico y Tratamiento de la Infección de Vías Urinarias No Complicada en Menores de 18 años en el Primero y Segundo Nivel de Atención
 Guía de Referencia Rápida Prevención, Diagnóstico y Tratamiento de la Infección de Vías Urinarias No Complicada en Menores de 18 años en el Primero y Segundo Nivel de Atención Guía de Referencia Rápida
Guía de Referencia Rápida Prevención, Diagnóstico y Tratamiento de la Infección de Vías Urinarias No Complicada en Menores de 18 años en el Primero y Segundo Nivel de Atención Guía de Referencia Rápida
Universidad de Buenos Aires, Facultad de Medicina. Departamento de Microbiología, Parasitología e Inmunología. Cátedra 1 Microbiología II
 Universidad de Buenos Aires, Facultad de Medicina Departamento de Microbiología, Parasitología e Inmunología Cátedra 1 Microbiología II Teórico 1 Diagnóstico Bacteriológico Cristina Cerquetti ccerquetti@yahoo.com.ar
Universidad de Buenos Aires, Facultad de Medicina Departamento de Microbiología, Parasitología e Inmunología Cátedra 1 Microbiología II Teórico 1 Diagnóstico Bacteriológico Cristina Cerquetti ccerquetti@yahoo.com.ar
La muestra idónea es la primera orina de la mañana, ya que permite la multiplicación de bacterias durante la noche.
 INSTRUCCCIONES PARA LA TOMA DE MUESTRA DE ORINAS Y HECES ORINA 1. ORINA PARCIAL Y UROCULTIVO La muestra idónea es la primera orina de la mañana, ya que permite la multiplicación de bacterias durante la
INSTRUCCCIONES PARA LA TOMA DE MUESTRA DE ORINAS Y HECES ORINA 1. ORINA PARCIAL Y UROCULTIVO La muestra idónea es la primera orina de la mañana, ya que permite la multiplicación de bacterias durante la
TRATAMIENTO Y RECOGIDA DE MUESTRAS EN EL LABORATORIO
 TRATAMIENTO Y RECOGIDA DE MUESTRAS EN EL LABORATORIO GEMA GÓMEZ LAJARA TEL TEL SERVICIO SERVICIO DE DE LABORATORIO LABORATORIO HOSPITAL SANTA BARBARA. PUERTOLLANO. HOSPITAL SANTA BARBARA. PUERTOLLANO.
TRATAMIENTO Y RECOGIDA DE MUESTRAS EN EL LABORATORIO GEMA GÓMEZ LAJARA TEL TEL SERVICIO SERVICIO DE DE LABORATORIO LABORATORIO HOSPITAL SANTA BARBARA. PUERTOLLANO. HOSPITAL SANTA BARBARA. PUERTOLLANO.
TOMA DE MUESTRAS MICROBIOLOGICAS. Dra. Dona Benadof Microbiología Hospital Roberto del Río
 TOMA DE MUESTRAS MICROBIOLOGICAS Dra. Dona Benadof Microbiología Hospital Roberto del Río Temario Definiciones Requisitos Procedimientos de toma de muestras Ejemplos INTRODUCCIÓN La confiabilidad de los
TOMA DE MUESTRAS MICROBIOLOGICAS Dra. Dona Benadof Microbiología Hospital Roberto del Río Temario Definiciones Requisitos Procedimientos de toma de muestras Ejemplos INTRODUCCIÓN La confiabilidad de los
La excelencia no es una acción, es un hábito Aristóteles
 RECOMENDACIONES PARA LA TOMA DE MUESTRAS EN BACTERIOLOGÍA CLÍNICA. La excelencia no es una acción, es un hábito Aristóteles ÍNDICE 1. HERIDAS SUPERFICIALES Y ABSCESOS ABIERTOS. 2. ABSCESOS CERRADOS. 3.
RECOMENDACIONES PARA LA TOMA DE MUESTRAS EN BACTERIOLOGÍA CLÍNICA. La excelencia no es una acción, es un hábito Aristóteles ÍNDICE 1. HERIDAS SUPERFICIALES Y ABSCESOS ABIERTOS. 2. ABSCESOS CERRADOS. 3.
LIMPIEZA Y DESINFECCION
 PAGINA: 1 de 7 1. DEFINICION: Es el procedimiento, mediante el cual son eliminados los diferentes desechos generados en los procesos de recolección y procesamiento de muestras; y además se describe el
PAGINA: 1 de 7 1. DEFINICION: Es el procedimiento, mediante el cual son eliminados los diferentes desechos generados en los procesos de recolección y procesamiento de muestras; y además se describe el
INDICACIONES PARA LA HIGIENE DE MANOS
 Medicina Preventiva y Salud Pública H.C.U.V. Actualizado 2010 INDICACIONES PARA LA HIGIENE DE MANOS Debe realizarse higiene de las manos por parte del personal sanitario en las siguientes situaciones A.
Medicina Preventiva y Salud Pública H.C.U.V. Actualizado 2010 INDICACIONES PARA LA HIGIENE DE MANOS Debe realizarse higiene de las manos por parte del personal sanitario en las siguientes situaciones A.
TEMA 11 METODOLOGÍA PARA LA TOMA Y TRANSPORTE DE MUESTRAS DE ANAEROBIOS
 TEMA 11 METODOLOGÍA PARA LA TOMA Y TRANSPORTE DE MUESTRAS DE ANAEROBIOS TOMA DE MUESTRA DE ANAEROBIOS Y TRANSPORTE AL LABORATORIO GENERALIDADES IMPORTANCIA DE LA MICROBIOTA ANEROBIA RECOLECCIÓN DE MUESTRAS
TEMA 11 METODOLOGÍA PARA LA TOMA Y TRANSPORTE DE MUESTRAS DE ANAEROBIOS TOMA DE MUESTRA DE ANAEROBIOS Y TRANSPORTE AL LABORATORIO GENERALIDADES IMPORTANCIA DE LA MICROBIOTA ANEROBIA RECOLECCIÓN DE MUESTRAS
GenPE: estudio Internacional de Genética en Preeclampsia
 GenPE: estudio Internacional de Genética en Preeclampsia INSTRUCTIVO Toma de muestra proyecto GenPE PAQUETE PARA CAPTACIÓN DE PACIENTE Y TOMA DE MUESTRA. Cuando llegue a su institución la caja del proyecto
GenPE: estudio Internacional de Genética en Preeclampsia INSTRUCTIVO Toma de muestra proyecto GenPE PAQUETE PARA CAPTACIÓN DE PACIENTE Y TOMA DE MUESTRA. Cuando llegue a su institución la caja del proyecto
NOMBRE TOMA DE HEMOCULTIVOS Página 1 de 12 ESTADO DOCUMENTAL EL PORTADOR DE ESTA INFORMACION NO ESTA AUTORIZADO A SACAR COPIAS
 NOMBRE TOMA DE HEMOCULTIVOS Página 1 de 12 ESTADO 1. VALIDACION JERARQUIA NOMBRE CARGO FECHA FIRMA ELABORO PATRICIA SABOGAL ENFERMERA VALIDO ALBERTO VALDERRAMA ENFEMERO VIGILANCIA E APROBO DIANA SOTO COORDINACION
NOMBRE TOMA DE HEMOCULTIVOS Página 1 de 12 ESTADO 1. VALIDACION JERARQUIA NOMBRE CARGO FECHA FIRMA ELABORO PATRICIA SABOGAL ENFERMERA VALIDO ALBERTO VALDERRAMA ENFEMERO VIGILANCIA E APROBO DIANA SOTO COORDINACION
TOMA DE MUESTRA 22/02/2016. Objetivos. Factores Que Intervienen En La Toma De Muestra. Importancia Toma de Muestra
 TOMA DE MUESTRA Objetivos Establecer el agente causal de la infección para su adecuado tratamiento. Mejorar la calidad en la toma de muestra. Disminuir el riesgo de contaminación durante el Lda. María
TOMA DE MUESTRA Objetivos Establecer el agente causal de la infección para su adecuado tratamiento. Mejorar la calidad en la toma de muestra. Disminuir el riesgo de contaminación durante el Lda. María
Normas para la Toma de Muestras. Mediante una torunda estéril se procederá de la siguiente forma:
 Anexo 1: Normas para la Toma de Muestras a) Toma de Frotis Faríngeo: - Se realizará un escobillado (frotado) con hisopo preferiblemente de materia sintético (Ej: tipo Dacron), de la faringe, pilares y
Anexo 1: Normas para la Toma de Muestras a) Toma de Frotis Faríngeo: - Se realizará un escobillado (frotado) con hisopo preferiblemente de materia sintético (Ej: tipo Dacron), de la faringe, pilares y
3.- Higiene de manos y Antisepsia cutánea
 Higiene de manos La medida más sencilla y eficaz para reducir la infección asociada a la asistencia sanitaria Transmisión cruzada de microorganismos a través de las manos: Las manos de los profesionales
Higiene de manos La medida más sencilla y eficaz para reducir la infección asociada a la asistencia sanitaria Transmisión cruzada de microorganismos a través de las manos: Las manos de los profesionales
PROCEDIMIENTO HIGIENE BUCAL
 Pág. 1 de 6 REALIZADO por REVISADO por APROBADO por Nombre: Rocío González Nombre: Silvia de León Nombre: Miriam Gorrasi Asistencial Directora Dpto. Educación Nombre: Silvia Esquibel Nombre: Ana Díaz Nombre:
Pág. 1 de 6 REALIZADO por REVISADO por APROBADO por Nombre: Rocío González Nombre: Silvia de León Nombre: Miriam Gorrasi Asistencial Directora Dpto. Educación Nombre: Silvia Esquibel Nombre: Ana Díaz Nombre:
Instructivo. Manejo de los Residuos Infecciosos
 Página 1 de 5 1. Objetivo Describir las actividades necesarias (clasificación, almacenamiento, tratamiento y eliminación), para realizar el manejo de los residuos infeciosos. 2. Alcance Se aplica a todas
Página 1 de 5 1. Objetivo Describir las actividades necesarias (clasificación, almacenamiento, tratamiento y eliminación), para realizar el manejo de los residuos infeciosos. 2. Alcance Se aplica a todas
FUNDACION PANZENU TOMA DE MUESTRAS EN EL LABORATORIO CLINICO. Claudia Isabel Bedoya C. Bacterióloga
 FUNDACION PANZENU TOMA DE MUESTRAS EN EL LABORATORIO CLINICO Claudia Isabel Bedoya C. Bacterióloga FASE PREANALÍTICA EN EL PROCESAMIENTO DE LAS MUESTRAS Procedimiento especializado que consiste en la obtención
FUNDACION PANZENU TOMA DE MUESTRAS EN EL LABORATORIO CLINICO Claudia Isabel Bedoya C. Bacterióloga FASE PREANALÍTICA EN EL PROCESAMIENTO DE LAS MUESTRAS Procedimiento especializado que consiste en la obtención
PROCEDIMIENTO DE TOMA DE MUESTRAS PARA UROCULTIVO PROLAB S.A.S LABORATORIO CLÍNICO PARA INSTITUCIONES HOSPITALARIAS
 PROCEDIMIENTO DE TOMA DE MUESTRAS PARA UROCULTIVO PROLAB S.A.S LABORATORIO CLÍNICO PARA INSTITUCIONES HOSPITALARIAS Es importante anotar los datos personales y de la historia clínica del paciente, pues
PROCEDIMIENTO DE TOMA DE MUESTRAS PARA UROCULTIVO PROLAB S.A.S LABORATORIO CLÍNICO PARA INSTITUCIONES HOSPITALARIAS Es importante anotar los datos personales y de la historia clínica del paciente, pues
Extracción de Sangre Venosa Periférica
 Extracción de Sangre Venosa Periférica Introducción La extracción venosa de sangre es un proceso muy acequiado en el análisis biológico dado que es posible detectar diversas enfermedades o condiciones
Extracción de Sangre Venosa Periférica Introducción La extracción venosa de sangre es un proceso muy acequiado en el análisis biológico dado que es posible detectar diversas enfermedades o condiciones
TEMA 11. Cultivo de microorganismos anaerobios
 TEMA 11 Cultivo de microorganismos anaerobios Tema 11. Cultivo de microorganismos anaerobios 1. Microorganismos anaerobios 1.1. Anaerobios estrictos y anaerobios aerotolerantes 1.2. Importancia de la microbiota
TEMA 11 Cultivo de microorganismos anaerobios Tema 11. Cultivo de microorganismos anaerobios 1. Microorganismos anaerobios 1.1. Anaerobios estrictos y anaerobios aerotolerantes 1.2. Importancia de la microbiota
PREVENCION DE INFECCIONES ASOCIADAS A CATETER URINARIO PERMANENTE HOSPITAL DR. ERNESTO TORRES GALDAMES IQUIQUE
 PREVENCION DE INFECCIONES ASOCIADAS A CATETER URINARIO HOSPITAL DR. ERNESTO TORRES GALDAMES IQUIQUE 2013 Página: 2 de 12 INDICE INTRODUCCION 3 PROPOSITO 4 OBJETIVO GENERAL 4 ALCANCE 4 RESPONSABLES 4 DESARROLLO
PREVENCION DE INFECCIONES ASOCIADAS A CATETER URINARIO HOSPITAL DR. ERNESTO TORRES GALDAMES IQUIQUE 2013 Página: 2 de 12 INDICE INTRODUCCION 3 PROPOSITO 4 OBJETIVO GENERAL 4 ALCANCE 4 RESPONSABLES 4 DESARROLLO
INSTRUCTIVO PARA TOMA DE MUESTRAS BACTERIOLÓGICAS
 INSTRUCTIVO PARA TOMA DE MUESTRAS BACTERIOLÓGICAS Toda la información diagnóstica que el laboratorio de microbiología puede proporcionar, depende de la calidad de la muestra recibida. Por ello, una toma
INSTRUCTIVO PARA TOMA DE MUESTRAS BACTERIOLÓGICAS Toda la información diagnóstica que el laboratorio de microbiología puede proporcionar, depende de la calidad de la muestra recibida. Por ello, una toma
INSTRUCCIONES DE USO
 1/4 INSTRUCCIONES DE USO (IMPROMINI TUBOS PARA LA RECOLECCION DE SANGRE CAPILAR PARA UN UNICO USO) Fabricante Guangzhou Improve Medical Instruments Co., Ltd Nombre del Producto Capillary Blood Collection
1/4 INSTRUCCIONES DE USO (IMPROMINI TUBOS PARA LA RECOLECCION DE SANGRE CAPILAR PARA UN UNICO USO) Fabricante Guangzhou Improve Medical Instruments Co., Ltd Nombre del Producto Capillary Blood Collection
TOMA DE MUESTRAS MICROBIOLÓGICAS
 TOMA DE MUESTRAS MICROBIOLÓGICAS Fecha de actualización: Abril de 2008 En vigencia desde: Junio de 2008 DIRIGIDO A: Médicos Enfermeras Matronas Tecnólogos Médicos Técnicos Paramédicos OBJETIVOS: Identificar
TOMA DE MUESTRAS MICROBIOLÓGICAS Fecha de actualización: Abril de 2008 En vigencia desde: Junio de 2008 DIRIGIDO A: Médicos Enfermeras Matronas Tecnólogos Médicos Técnicos Paramédicos OBJETIVOS: Identificar
LISTA DE DISPOSITIVOS MÉDICOS ESENCIALE PARA EVENTOS SÍSMICOS
 MINISTERIO DE SALUD PÚBLICA SUBSECRETARIA NACIONAL DE GOBERNANZA DE LA SALUD PÚBLICA DIRECCIÓN NACIONAL DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS LISTA DE DISPOSITIVOS MÉDICOS ESENCIALE PARA EVENTOS SÍSMICOS
MINISTERIO DE SALUD PÚBLICA SUBSECRETARIA NACIONAL DE GOBERNANZA DE LA SALUD PÚBLICA DIRECCIÓN NACIONAL DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS LISTA DE DISPOSITIVOS MÉDICOS ESENCIALE PARA EVENTOS SÍSMICOS
UNIDAD DIDÁCTICA III: INFECCIONES ASOCIADAS A LA ATENCIÓN SANITARIA
 UNIDAD DIDÁCTICA III: INFECCIONES ASOCIADAS A LA ATENCIÓN SANITARIA Apartados de información del Unidad Didáctica III De qué estamos hablando cuando decimos infecciones asociadas a la atención sanitaria?
UNIDAD DIDÁCTICA III: INFECCIONES ASOCIADAS A LA ATENCIÓN SANITARIA Apartados de información del Unidad Didáctica III De qué estamos hablando cuando decimos infecciones asociadas a la atención sanitaria?
Toma de muestra, conservación y transporte para estudios microbiológicos Departamento de Microbiología
 , conservación y transporte para estudios microbiológicos Departamento de Microbiología Indice I- INTRODUCCION I 01 II- ORINA A- Urocultivo Instructivo para laboratorio derivante: II 01 Pacientes que controlan
, conservación y transporte para estudios microbiológicos Departamento de Microbiología Indice I- INTRODUCCION I 01 II- ORINA A- Urocultivo Instructivo para laboratorio derivante: II 01 Pacientes que controlan
LABORATORIO DE ANALISIS CLINICOS,BACTERIOLOGICOS Y ENDOCRINOLOGICOS DR. CARLOS GUZZETTI
 LABORATORIO DE ANALISIS CLINICOS,BACTERIOLOGICOS Y ENDOCRINOLOGICOS DR. CARLOS GUZZETTI Horario de toma de muestra (extraccion de sangre) Lunes a Viernes de 8.15:00 a 10.30 hs Retiro de informes: 10.30
LABORATORIO DE ANALISIS CLINICOS,BACTERIOLOGICOS Y ENDOCRINOLOGICOS DR. CARLOS GUZZETTI Horario de toma de muestra (extraccion de sangre) Lunes a Viernes de 8.15:00 a 10.30 hs Retiro de informes: 10.30
ESTUDIO PARASITOLOGICO DE HECES.
 ESTUDIO PARASITOLOGICO DE HECES. DE MUESTRAS. A:PREPARACIÓN 3 DÍAS ANTES DE LA RECOGIDA DE LAS HECES DEBE SUPRIMIRSE: 1. MEDICAMENTOS QUE CONTENGAN CARBÓN VEGETAL, SALES DE BISMUTO, DE MAGNESIO, CAOLÍN,
ESTUDIO PARASITOLOGICO DE HECES. DE MUESTRAS. A:PREPARACIÓN 3 DÍAS ANTES DE LA RECOGIDA DE LAS HECES DEBE SUPRIMIRSE: 1. MEDICAMENTOS QUE CONTENGAN CARBÓN VEGETAL, SALES DE BISMUTO, DE MAGNESIO, CAOLÍN,
50 kits de recolección de muestras con torunda multitest Aptima (N.º de catálogo PRD-03546) Cada kit contiene:
 Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
5.- Inserción y retirada del catéter
 Objetivos Obtener un acceso venoso periférico seguro con fines diagnósticos y/o terapéuticos. Mantener el buen funcionamiento del catéter para prevenir complicaciones. Retirar el catéter correctamente.
Objetivos Obtener un acceso venoso periférico seguro con fines diagnósticos y/o terapéuticos. Mantener el buen funcionamiento del catéter para prevenir complicaciones. Retirar el catéter correctamente.
2. Precauciones de Rutina para el Control de Infecciones de Enfermedades Respiratorias
 2. PRECAUCIONES DE RUTINA PARA EL CONTROL DE INFECCIONES DE ENFERMEDADES RESPIRATORIAS 2. Precauciones de Rutina para el Control de Infecciones de Enfermedades Respiratorias Precauciones estándar Las precauciones
2. PRECAUCIONES DE RUTINA PARA EL CONTROL DE INFECCIONES DE ENFERMEDADES RESPIRATORIAS 2. Precauciones de Rutina para el Control de Infecciones de Enfermedades Respiratorias Precauciones estándar Las precauciones
GUIA Nº2: POSTURA DE GUANTES DE PROCEDIMIENTO Y ESTERILES
 FACULTAD DE ENFERMERÍA ASIGNATURA: CUIDADOS DE ENFERMERÍA EN EL CICLO VITAL I (ENFE-6013) CREADO EQUIPO DOCENTE PAE 1 (2010) ACTUALIZADO EQUIPO DOCENTE CICLO VITAL I (2012-1) TALLER Nº 1 GUIA Nº2: POSTURA
FACULTAD DE ENFERMERÍA ASIGNATURA: CUIDADOS DE ENFERMERÍA EN EL CICLO VITAL I (ENFE-6013) CREADO EQUIPO DOCENTE PAE 1 (2010) ACTUALIZADO EQUIPO DOCENTE CICLO VITAL I (2012-1) TALLER Nº 1 GUIA Nº2: POSTURA
APÉNDICE B. INSTRUCTIVO DE RECOLECCIÓN Y ENVÍO DE MUESTRAS PARA LOS LABORATO- RIOS DE APOYO A VIGILANCIA EPIDEMIOLÓGICA.
 APÉNDICE B. INSTRUCTIVO DE RECOLECCIÓN Y ENVÍO DE MUESTRAS PARA LOS LABORATO- RIOS DE APOYO A VIGILANCIA EPIDEMIOLÓGICA. La selección, la recolección y el transporte apropiados de especimenes al laboratorio
APÉNDICE B. INSTRUCTIVO DE RECOLECCIÓN Y ENVÍO DE MUESTRAS PARA LOS LABORATO- RIOS DE APOYO A VIGILANCIA EPIDEMIOLÓGICA. La selección, la recolección y el transporte apropiados de especimenes al laboratorio
Instalación de Catéter Urinario Permanente en HRR
 en HRR Elaborado por : Revisado por : Aprobado por : Verónica Torres Mónica Rubio Gabriela García Roxana González Enfermeras Dr. Sonia Correa Comité IAAS Carmen Gloria Díaz Calidad y Seguridad del Paciente
en HRR Elaborado por : Revisado por : Aprobado por : Verónica Torres Mónica Rubio Gabriela García Roxana González Enfermeras Dr. Sonia Correa Comité IAAS Carmen Gloria Díaz Calidad y Seguridad del Paciente
MICROBIOLOGÍA CLÍNICA Y SANITARIA TEMA 29. INFECCIÓN NOSOCOMIAL II INFECCIÓN NOSOCOMIAL: CONSECUENCIAS
 INFECCIÓN NOSOCOMIAL: CONSECUENCIAS Aumenta la mortalidad y morbilidad Prolonga la estancia hospitalaria Requiere el uso de antimicrobianos Aumenta el costo sanitario INFECCIÓN NOSOCOMIAL: CONTROL Eliminar
INFECCIÓN NOSOCOMIAL: CONSECUENCIAS Aumenta la mortalidad y morbilidad Prolonga la estancia hospitalaria Requiere el uso de antimicrobianos Aumenta el costo sanitario INFECCIÓN NOSOCOMIAL: CONTROL Eliminar
Medicinas y consejos. Consejos
 El botiquín casero Consejos Medicinas y consejos Los medicamentos se guardarán siempre en su envase original y con su prospecto, así se podrán consultar en cualquier momento las dudas sobre su utilización.
El botiquín casero Consejos Medicinas y consejos Los medicamentos se guardarán siempre en su envase original y con su prospecto, así se podrán consultar en cualquier momento las dudas sobre su utilización.
114. Señala a continuación, sistemas de eliminación de líquidos: a) Pulmones. b) Vómitos. c) Intestino. d) Todos son sistemas de eliminación.
 1 111. En condiciones normales el cuerpo elimina un volumen de líquido que oscila entre: a) 2400 y 2500 ml. b) 2300 y 2500 ml. c) 2300 y 2600 ml. d) 2400 y 2700 ml. 112. Qué es el balance?: a) Es el resultado
1 111. En condiciones normales el cuerpo elimina un volumen de líquido que oscila entre: a) 2400 y 2500 ml. b) 2300 y 2500 ml. c) 2300 y 2600 ml. d) 2400 y 2700 ml. 112. Qué es el balance?: a) Es el resultado
CONDICIONES GENERALES PARA TOMA DE MUESTRAS LABORATORIO CLINICO
 EXAMEN CONDICIONES HEMATOLOGIA PRUEBAS DE COAGULACION (PT, PTT, FIBRINOGENO, DIMERO D) No tomar el anticoagulante hasta después de la toma de Informar que anticoagulante está usando. HEMOGRAMA No es necesario
EXAMEN CONDICIONES HEMATOLOGIA PRUEBAS DE COAGULACION (PT, PTT, FIBRINOGENO, DIMERO D) No tomar el anticoagulante hasta después de la toma de Informar que anticoagulante está usando. HEMOGRAMA No es necesario
MINISTERIO DE SALUD PÚBLICA Y BIENESTAR SOCIAL INSTITUTO DE MEDICINA TROPICAL
 MANUAL DE RECOLECCIÓN, TRANSPORTE Y CONSERVACIÓN DE MUESTRAS PARA EXÁMENES BACTERIOLÓGICOS MAYO 2.009 2 DOCUMENTO ELABORADO POR: Dr. Juan D. Irala Ledezma REVISADO POR: Dra. Edelira Ayala de Paredes APROBADO
MANUAL DE RECOLECCIÓN, TRANSPORTE Y CONSERVACIÓN DE MUESTRAS PARA EXÁMENES BACTERIOLÓGICOS MAYO 2.009 2 DOCUMENTO ELABORADO POR: Dr. Juan D. Irala Ledezma REVISADO POR: Dra. Edelira Ayala de Paredes APROBADO
MANEJO DE SOLUCIONES DESINFECTANTES
 PAGINA: 1 de 8 REVISADO: ELABORADO: COORDINADOR DE CALIDAD 1. DEFINICION ENFERMERO JEFE COORDINADOR CIRUGIA Las soluciones desinfectantes son sustancias que actúan sobre los microorganismos inactivándolos
PAGINA: 1 de 8 REVISADO: ELABORADO: COORDINADOR DE CALIDAD 1. DEFINICION ENFERMERO JEFE COORDINADOR CIRUGIA Las soluciones desinfectantes son sustancias que actúan sobre los microorganismos inactivándolos
Ejemplos de recolección, conservación, envase y transporte de muestras de alimentos MANEJO EN EL MUESTRAS CONSERVACIÓN
 VI. Ejemplos de recolección, conservación, envase y transporte de muestras de alimentos RECOLECCIÓN Y Y DESECHO sólidos o mezcla de dos alimentos Realice cortes o tomar porciones de los alimentos utilizando
VI. Ejemplos de recolección, conservación, envase y transporte de muestras de alimentos RECOLECCIÓN Y Y DESECHO sólidos o mezcla de dos alimentos Realice cortes o tomar porciones de los alimentos utilizando
SONDAS Y CATÉTERES FIJACIÓN DE SONDAS Y CATÉTERES EN NEONATOLOGÍA
 SONDAS Y CATÉTERES FIJACIÓN DE SONDAS Y CATÉTERES EN NEONATOLOGÍA SONDAS Y CATÉTERES CONSIDERACIONES ESPECÍFICAS Permitir la visualización de las sondas Evitar que se obstruya la salida de las sondas y
SONDAS Y CATÉTERES FIJACIÓN DE SONDAS Y CATÉTERES EN NEONATOLOGÍA SONDAS Y CATÉTERES CONSIDERACIONES ESPECÍFICAS Permitir la visualización de las sondas Evitar que se obstruya la salida de las sondas y
MANUAL DE OPERACIONES DE REUTILIZACIÓN Y DESECHO DE MATERIAL CLÍNICO Y QUIRÚRGICO
 Rev. 01 Hoja: 1 de 5 MANUAL DE OPERACIONES DE REUTILIZACIÓN Y DESECHO DE MATERIAL CLÍNICO Y QUIRÚRGICO Elaboró: Médico Infectologo Autorizó: Director Quirúrgico Hoja: 2 de 5 1. Propósito El presente manual
Rev. 01 Hoja: 1 de 5 MANUAL DE OPERACIONES DE REUTILIZACIÓN Y DESECHO DE MATERIAL CLÍNICO Y QUIRÚRGICO Elaboró: Médico Infectologo Autorizó: Director Quirúrgico Hoja: 2 de 5 1. Propósito El presente manual
CUIDADOS DE HERIDAS QUIRÚRGICAS
 DIRECCION DE CUIDADOS DE HERIDAS QUIRÚRGICAS AUTORES Ultima actualización Alba Mª Álvarez González Enero 2011 REVISORES Comisión Cuidados Enfermería Mayo 2012 AUTORIZADO Dirección de Enfermería Mayo 2012
DIRECCION DE CUIDADOS DE HERIDAS QUIRÚRGICAS AUTORES Ultima actualización Alba Mª Álvarez González Enero 2011 REVISORES Comisión Cuidados Enfermería Mayo 2012 AUTORIZADO Dirección de Enfermería Mayo 2012
HIGIENE EN EL MEDIO HOSPITALARIO
 HIGIENE EN EL MEDIO HOSPITALARIO Código Nombre Categoría SN_0079 HIGIENE EN EL MEDIO HOSPITALARIO SANIDAD Duración 30 HORAS Modalidad ONLINE Audio SI Vídeo SI Objetivos OFRECER AL PERSONAL DEL CENTRO SANITARIO
HIGIENE EN EL MEDIO HOSPITALARIO Código Nombre Categoría SN_0079 HIGIENE EN EL MEDIO HOSPITALARIO SANIDAD Duración 30 HORAS Modalidad ONLINE Audio SI Vídeo SI Objetivos OFRECER AL PERSONAL DEL CENTRO SANITARIO
Coordinador de Enfermería
 Alejandra Abril Tirado Enfermera CS Torreblanca Julián Rosselló Llerena Coordinador de Enfermería CS Illes Columbretes 1 Definición de retención aguda de orina Acumulación de orina en la vejiga urinaria
Alejandra Abril Tirado Enfermera CS Torreblanca Julián Rosselló Llerena Coordinador de Enfermería CS Illes Columbretes 1 Definición de retención aguda de orina Acumulación de orina en la vejiga urinaria
MANUAL DE GUÍAS CLÍNICAS DE ABORDAJE DE LA FIEBRE EN EL PACIENTE HOSPITALIZADO
 Fecha: JUN 15 Hoja: 1 de 5 MANUAL DE GUÍAS CLÍNICAS DE ABORDAJE DE LA FIEBRE EN EL PACIENTE HOSPITALIZADO Elaboró: Revisó: Autorizó: Puesto Médico Infectólogo Director Quirúrgico Director Quirúrgico Firma
Fecha: JUN 15 Hoja: 1 de 5 MANUAL DE GUÍAS CLÍNICAS DE ABORDAJE DE LA FIEBRE EN EL PACIENTE HOSPITALIZADO Elaboró: Revisó: Autorizó: Puesto Médico Infectólogo Director Quirúrgico Director Quirúrgico Firma
MANEJO DE INMUNOTERAPIA EN ATENCIÓN PRIMARIA
 JORNADA DE ALERGIA INFANTIL PARA PEDIATRAS DE ATENCIÓN PRIMARIA MANEJO DE INMUNOTERAPIA EN ATENCIÓN PRIMARIA Da. Pilar Alcantud Fuertes. Enfermera Unidad de Alergia Infantil. Hospital G. U. de Elche. Dra.
JORNADA DE ALERGIA INFANTIL PARA PEDIATRAS DE ATENCIÓN PRIMARIA MANEJO DE INMUNOTERAPIA EN ATENCIÓN PRIMARIA Da. Pilar Alcantud Fuertes. Enfermera Unidad de Alergia Infantil. Hospital G. U. de Elche. Dra.
GASTROSTOMIA EN PACIENTES CON E.L.A.
 GASTROSTOMIA EN PACIENTES CON E.L.A. Rosario Jiménez Bautista Enfermera/gestora de casos Unidad de ELA y Patología Neuromuscular Servicio de Neurología qué es una gastrostomía? La gastrostomía consiste
GASTROSTOMIA EN PACIENTES CON E.L.A. Rosario Jiménez Bautista Enfermera/gestora de casos Unidad de ELA y Patología Neuromuscular Servicio de Neurología qué es una gastrostomía? La gastrostomía consiste
Código: PM-IS PT-1 Versión:1 Fecha Vigencia:
 1 de 7 1. PROCESO/SUBPROCESO RELACIONADO: Gestión de la Interacción Social/Servicios de Salud a la Comunidad 2. RESPONSABLE(S):. 3. OBJETIVO: Evacuar la orina retenida en la vejiga, utilizando la técnica
1 de 7 1. PROCESO/SUBPROCESO RELACIONADO: Gestión de la Interacción Social/Servicios de Salud a la Comunidad 2. RESPONSABLE(S):. 3. OBJETIVO: Evacuar la orina retenida en la vejiga, utilizando la técnica
MICROBIOTA HUMANA NORMAL (Flora normal)
 FLORA HUMANA NORMAL MICROBIOTA HUMANA NORMAL (Flora normal) Microorganismos que se encuentran en la superficie de la piel y de las mucosas respiratoria, digestiva y urogenital del hombre estableciendo
FLORA HUMANA NORMAL MICROBIOTA HUMANA NORMAL (Flora normal) Microorganismos que se encuentran en la superficie de la piel y de las mucosas respiratoria, digestiva y urogenital del hombre estableciendo
INFECCIÓN DEL TRACTO URINARIO e IAAS. Prevención y diagnostico Dra. Dona Benadof F
 INFECCIÓN DEL TRACTO URINARIO e IAAS Prevención y diagnostico Dra. Dona Benadof F Objetivos Al término de esta presentación podrá: Entender la importancia clínica de la infección urinaria Identificar los
INFECCIÓN DEL TRACTO URINARIO e IAAS Prevención y diagnostico Dra. Dona Benadof F Objetivos Al término de esta presentación podrá: Entender la importancia clínica de la infección urinaria Identificar los
Infecciones Asociadas a Catéter Venoso Central. Dra. Mirta Acuña Ávila Unidad de Infectología Hospital Roberto Del Río
 Infecciones Asociadas a Catéter Venoso Central Dra. Mirta Acuña Ávila Unidad de Infectología Hospital Roberto Del Río Objetivos de la presentación Conocer la definición de infección asociada a catéter
Infecciones Asociadas a Catéter Venoso Central Dra. Mirta Acuña Ávila Unidad de Infectología Hospital Roberto Del Río Objetivos de la presentación Conocer la definición de infección asociada a catéter
Recogida de Muestras en Pediatría
 Recogida de Muestras en Pediatría Sr. Juan Jareño Talero Supervisor de Urgencias Pediátricas del Hospital Son Dureta Palma de Mallorca Muestras de sangre venosa Hemocultivo Sist. BACTEC Bioquímica Hematología
Recogida de Muestras en Pediatría Sr. Juan Jareño Talero Supervisor de Urgencias Pediátricas del Hospital Son Dureta Palma de Mallorca Muestras de sangre venosa Hemocultivo Sist. BACTEC Bioquímica Hematología
Experto en Análisis de Muestras en el Laboratorio de Microbiología
 Experto en Análisis de Muestras en el Laboratorio de Microbiología Sanidad, Dietética y Nutrición Ficha Técnica Categoría Laboratorios, Microbiología y Farmacia Contenido del Pack - 1 Manual Teórico -
Experto en Análisis de Muestras en el Laboratorio de Microbiología Sanidad, Dietética y Nutrición Ficha Técnica Categoría Laboratorios, Microbiología y Farmacia Contenido del Pack - 1 Manual Teórico -
Infección de vías urinarias asociada a sonda vesical
 Infección de vías urinarias asociada a sonda vesical Objetivo: Prevenir el desarrollo de infecciones de vías urinarias relacionadas con la presencia de sonda vesical a permanencia en pacientes hospitalizados,
Infección de vías urinarias asociada a sonda vesical Objetivo: Prevenir el desarrollo de infecciones de vías urinarias relacionadas con la presencia de sonda vesical a permanencia en pacientes hospitalizados,
Silletas y Espaciadores de México S.A de C.V
 PRIMEROS AUXILIOS DE ACUERDO CON EL TIPO DE RIESGO QUE SE ESTÁ EXPUESTO EN EL MANEJO DE MATERIALES Silletas y Espaciadores de México S.A de C.V Los tipos de riesgo que se está expuesto en el área de almacén
PRIMEROS AUXILIOS DE ACUERDO CON EL TIPO DE RIESGO QUE SE ESTÁ EXPUESTO EN EL MANEJO DE MATERIALES Silletas y Espaciadores de México S.A de C.V Los tipos de riesgo que se está expuesto en el área de almacén
Secretaría Distrital de Salud de Bogotá, D. C. Dirección de Salud Pública. Manual para la toma de muestras para análisis microbiológico
 Secretaría Distrital de Salud de Bogotá, D. C. Dirección de Salud Pública Manual para la toma de muestras para análisis microbiológico Samuel Moreno Rojas Alcalde Mayor de Bogotá, D. C. Héctor Zambrano
Secretaría Distrital de Salud de Bogotá, D. C. Dirección de Salud Pública Manual para la toma de muestras para análisis microbiológico Samuel Moreno Rojas Alcalde Mayor de Bogotá, D. C. Héctor Zambrano
DRENAJES DE HERIDAS. Proporcionar los cuidados necesarios para el funcionamiento óptimo del drenaje y evitar complicaciones.
 Página 1 de 7 DRENAJES DE HERIDAS 1.-OBJETIVO Proporcionar los cuidados necesarios para el funcionamiento óptimo del drenaje y evitar complicaciones. 2.-DEFINICIÓN Drenaje: sistema mecánico de eliminación
Página 1 de 7 DRENAJES DE HERIDAS 1.-OBJETIVO Proporcionar los cuidados necesarios para el funcionamiento óptimo del drenaje y evitar complicaciones. 2.-DEFINICIÓN Drenaje: sistema mecánico de eliminación
50 kits de recolección de muestras con torunda multitest Aptima (N.º de catálogo PRD-03546) Cada kit contiene:
 Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
Sistema Renal. Técnica de colocación de Sonda vesical. Prof. Lic. Vanesa Arzamendia. Escuela Superior de Enfermería Cecilia Grierson
 Escuela Superior de Enfermería Cecilia Grierson Adulto y Anciano I Turno Tarde Sistema Renal Técnica de colocación de Sonda vesical Prof. Lic. Vanesa Arzamendia Anatomía y fisiología renal Anatomía y fisiología
Escuela Superior de Enfermería Cecilia Grierson Adulto y Anciano I Turno Tarde Sistema Renal Técnica de colocación de Sonda vesical Prof. Lic. Vanesa Arzamendia Anatomía y fisiología renal Anatomía y fisiología
RECOMENDACIONES PARA PADRES CON NIÑOS CON TRAQUEOTOMÍA
 RECOMENDACIONES PARA PADRES CON NIÑOS CON TRAQUEOTOMÍA Hospital de Niños R. Gutiérrez Centro Respiratorio Gallo 1330, Ciudad Autónoma de Buenos Aires. TEL. 4963-3224 www.centrorespiratorio.org Qué es una
RECOMENDACIONES PARA PADRES CON NIÑOS CON TRAQUEOTOMÍA Hospital de Niños R. Gutiérrez Centro Respiratorio Gallo 1330, Ciudad Autónoma de Buenos Aires. TEL. 4963-3224 www.centrorespiratorio.org Qué es una
TEMA 8. Selección, recolección y transporte de muestras para examen microbiológico
 TEMA 8 Selección, recolección y transporte de muestras para examen microbiológico Tema 8. Selección, recolección y transporte de muestras para examen microbiológico. 1. Consideraciones generales para la
TEMA 8 Selección, recolección y transporte de muestras para examen microbiológico Tema 8. Selección, recolección y transporte de muestras para examen microbiológico. 1. Consideraciones generales para la
URGENCIAS. Servicio de Microbiología
 URGENCIAS Servicio de Microbiología Peticiones urgentes al Servicio de Microbiología 1 I. Consideraciones generales La guardia para las urgencias microbiológicas tiene varios objetivos: 1) Asistencial
URGENCIAS Servicio de Microbiología Peticiones urgentes al Servicio de Microbiología 1 I. Consideraciones generales La guardia para las urgencias microbiológicas tiene varios objetivos: 1) Asistencial
Dirección de Redes en Salud Pública
 Dirección de Redes en Salud Pública Recolección de muestras para el estudio de Microcefalias y otras mal formaciones del SNC posiblemente asociadas a infección por virus Zika 22 de Febrero de 2016 Confirmación
Dirección de Redes en Salud Pública Recolección de muestras para el estudio de Microcefalias y otras mal formaciones del SNC posiblemente asociadas a infección por virus Zika 22 de Febrero de 2016 Confirmación
NUTRICIÓN ENTERAL EN FORMA DE BOLUS CON JERINGA
 NUTRICIÓN ENTERAL EN FORMA DE BOLUS CON JERINGA AUTORES Ultima actualización: Begoña Alvarez Coto DUE Sº Nutrición y dietética Fecha Mayo 2011 REVISORES Comisión Cuidados Enfermería Enfermeria de Nutrición
NUTRICIÓN ENTERAL EN FORMA DE BOLUS CON JERINGA AUTORES Ultima actualización: Begoña Alvarez Coto DUE Sº Nutrición y dietética Fecha Mayo 2011 REVISORES Comisión Cuidados Enfermería Enfermeria de Nutrición
El microorganismo responsable de la difteria faríngea es: Seleccione una: a. Corynebacterium diphtheriae.
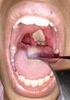 Pregunta 1 El microorganismo responsable de la difteria faríngea es: a. Corynebacterium diphtheriae. b. Mycobacterium tuberculosis. c. Haemophilus influenzae. d. Bacillus anthracis. La respuesta correcta
Pregunta 1 El microorganismo responsable de la difteria faríngea es: a. Corynebacterium diphtheriae. b. Mycobacterium tuberculosis. c. Haemophilus influenzae. d. Bacillus anthracis. La respuesta correcta
EL LAVADO GASTRICO EN EL NEONATO
 PROCEDIMIENTOS DE ENFERMERIA EL LAVADO GASTRICO EN EL NEONATO DEFINICION Es un procedimiento que consiste en la introducción de una sonda hueca, multiperforada en su extremo distal, que se llevará hasta
PROCEDIMIENTOS DE ENFERMERIA EL LAVADO GASTRICO EN EL NEONATO DEFINICION Es un procedimiento que consiste en la introducción de una sonda hueca, multiperforada en su extremo distal, que se llevará hasta
Sdme febril del lactante Dra. R.Garrido Adjunta Servicio de Urgencias Hospital Sant Joan de Deu Mayo 2016
 Sdme febril del lactante Dra. R.Garrido Adjunta Servicio de Urgencias Hospital Sant Joan de Deu Mayo 2016 EDAD 1-3 meses Etiologia de la febre: - Infección viral - IBPG - Deshidratación - Ambiental -
Sdme febril del lactante Dra. R.Garrido Adjunta Servicio de Urgencias Hospital Sant Joan de Deu Mayo 2016 EDAD 1-3 meses Etiologia de la febre: - Infección viral - IBPG - Deshidratación - Ambiental -
Obtención de la muestra
 DIAGNÓSTICO MICROBIOLÓGICO DE LA INFECCIÓN RESPIRATORÍA. Obtención de la muestra Montserrat Brugués ETIOPATOGENIA DE LA NEUMONIA NO ASOCIADA A VENTILACIÓN MECANICA MICROASPIRACIÓN Colonización orofarigea
DIAGNÓSTICO MICROBIOLÓGICO DE LA INFECCIÓN RESPIRATORÍA. Obtención de la muestra Montserrat Brugués ETIOPATOGENIA DE LA NEUMONIA NO ASOCIADA A VENTILACIÓN MECANICA MICROASPIRACIÓN Colonización orofarigea
PROCEDIMIENTO ADMINISTRACIÓN DE MEDICACIÓN INTRAMUSCULAR
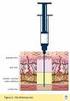 Pág. 1 de 6 REALIZADO por REVISADO por APROBADO por Nombre: Silvia de León Nombre: Beatriz Bagnasco Nombre: Miriam Gorrasi Cargo: Lic.Enf. Esp. Directora Dpto. Educación Nombre: Ana Díaz Nombre: Nancy
Pág. 1 de 6 REALIZADO por REVISADO por APROBADO por Nombre: Silvia de León Nombre: Beatriz Bagnasco Nombre: Miriam Gorrasi Cargo: Lic.Enf. Esp. Directora Dpto. Educación Nombre: Ana Díaz Nombre: Nancy
EL KIT CONTIENE: EL KIT CONTIENE: Jeringa de diluyente precargada. Adaptador del vial en su envase. Vial con el fármaco en polvo. Vástago del émbolo
 ALPROLIX Factor IX de coagulación (recombinante), proteína de fusión a Fc INSTRUCCIONES DE USO Lea las Instrucciones de uso antes de comenzar a usar el ALPROLIX y cada vez que obtenga un suministro nuevo
ALPROLIX Factor IX de coagulación (recombinante), proteína de fusión a Fc INSTRUCCIONES DE USO Lea las Instrucciones de uso antes de comenzar a usar el ALPROLIX y cada vez que obtenga un suministro nuevo
MANEJO DE LAS INFECCIONES RESPIRATORIAS AGUDAS ALTAS
 MANEJO DE LAS INFECCIONES RESPIRATORIAS AGUDAS ALTAS Dra. Concepción Sánchez Infante 2da parte TRATAMIENTO DE FARINGOAMIGDALITIS ESTREPTOCÓCCICA SITUACIÓN Portador asintomático TRATAMIENTO DE ELECCIÓN
MANEJO DE LAS INFECCIONES RESPIRATORIAS AGUDAS ALTAS Dra. Concepción Sánchez Infante 2da parte TRATAMIENTO DE FARINGOAMIGDALITIS ESTREPTOCÓCCICA SITUACIÓN Portador asintomático TRATAMIENTO DE ELECCIÓN
Catéteres venosos centrales de corta duración
 Catéteres venosos centrales de corta duración Mª Luisa Villaseñor Herrera. Supervisora de Área de Servicios Especiales. Complejo Hospitalario de Badajoz Jornada Extremeña de Actualización en terapia IV.
Catéteres venosos centrales de corta duración Mª Luisa Villaseñor Herrera. Supervisora de Área de Servicios Especiales. Complejo Hospitalario de Badajoz Jornada Extremeña de Actualización en terapia IV.
AISLAMIENTO UNIVERSAL
 AISLAMIENTO UNIVERSAL OBJETIVO: Llevar a cabo las medidas de protección que deben observarse de forma sistemática y generalizada en el ámbito hospitalario. 1 EQUIPAMIENTO NECESARIO: Jabón antiséptico y
AISLAMIENTO UNIVERSAL OBJETIVO: Llevar a cabo las medidas de protección que deben observarse de forma sistemática y generalizada en el ámbito hospitalario. 1 EQUIPAMIENTO NECESARIO: Jabón antiséptico y
Instrucciones para la autocateterización intermitente estéril de mujeres que usan Cure Catheter Sistema Cerrado
 Cure Medical dona 10% de sus ingresos netos para proyectos de investigación médica dedicados a encontrar una cura para lesiones de la médula espinal y trastornos del sistema nervioso central. Para encontrar
Cure Medical dona 10% de sus ingresos netos para proyectos de investigación médica dedicados a encontrar una cura para lesiones de la médula espinal y trastornos del sistema nervioso central. Para encontrar
Materiales para el docente:
 CURSO: CLÍNICA BÁSICA GUÍA Nº 1 CÓDIGO: 501051 NOMBRE DEL PROCEDIMIENTO: PROCEDIMIENTOS DE TÉCNICA ASÉPTICA OBJETIVOS DE LA PRÁCTICA DE LABORATORIO: Adquirir habilidad previa en los procedimientos relacionados
CURSO: CLÍNICA BÁSICA GUÍA Nº 1 CÓDIGO: 501051 NOMBRE DEL PROCEDIMIENTO: PROCEDIMIENTOS DE TÉCNICA ASÉPTICA OBJETIVOS DE LA PRÁCTICA DE LABORATORIO: Adquirir habilidad previa en los procedimientos relacionados
INTRODUCCION EQUIPO NECESARIO INDICACIONES
 INTRODUCCION Son múltiples los cuadros que producen parálisis intestinal postoperatoria y se ven casos muy rebeldes de íleo paralítico en grandes traumatismos abdominales y en procedimientos quirúrgicos
INTRODUCCION Son múltiples los cuadros que producen parálisis intestinal postoperatoria y se ven casos muy rebeldes de íleo paralítico en grandes traumatismos abdominales y en procedimientos quirúrgicos
CATETERISMO VESICAL EN CASA
 CATETERISMO VESICAL EN CASA PARA MUJERES Es un procedimiento sencillo, indoloro y consiste en el paso de una sonda a través de la uretra hasta la vejiga para evacuar la orina contenida en ella. DEFINICIÓN
CATETERISMO VESICAL EN CASA PARA MUJERES Es un procedimiento sencillo, indoloro y consiste en el paso de una sonda a través de la uretra hasta la vejiga para evacuar la orina contenida en ella. DEFINICIÓN
Instrucciones para la autocateterización intermitente estéril de hombres que usan Cure Catheter Sistema Cerrado
 Cure Medical dona 10% de sus ingresos netos para proyectos de investigación médica dedicados a encontrar una cura para lesiones de la médula espinal y trastornos del sistema nervioso central. Para encontrar
Cure Medical dona 10% de sus ingresos netos para proyectos de investigación médica dedicados a encontrar una cura para lesiones de la médula espinal y trastornos del sistema nervioso central. Para encontrar
Guía de uso. Advance Plus Sistema de sonda intermitente Sin Tocar
 Advance Plus Sistema de sonda intermitente Sin Tocar Guía de uso La sonda intermitente Hollister Advance Plus presenta la técnica Sin Tocar que permite a los usuarios sondarse con confianza; prácticamente
Advance Plus Sistema de sonda intermitente Sin Tocar Guía de uso La sonda intermitente Hollister Advance Plus presenta la técnica Sin Tocar que permite a los usuarios sondarse con confianza; prácticamente
INTRODUCCION INDICACIONES CONTRAINDICACIONES EQUIPO NECESARIO. Anestesia local.
 Toracocentesis INTRODUCCION El volumen y la complicación de las grandes operaciones toracoabdominales hacen cada vez más frecuente la existencia de derrames pleurales, que interfieren con el buen curso
Toracocentesis INTRODUCCION El volumen y la complicación de las grandes operaciones toracoabdominales hacen cada vez más frecuente la existencia de derrames pleurales, que interfieren con el buen curso
Toma de Muestras Microbiológicas aseguramiento de calidad
 Toma de Muestras Microbiológicas aseguramiento de calidad T.M. Carlos Ivovic O Profesor de Microbiología Clínica Facultad de Ciencias Médicas Universidad Pedro de Valdivia Objetivos de la toma de muestras
Toma de Muestras Microbiológicas aseguramiento de calidad T.M. Carlos Ivovic O Profesor de Microbiología Clínica Facultad de Ciencias Médicas Universidad Pedro de Valdivia Objetivos de la toma de muestras
NORMAS DE SEGURIDAD EN EL LABORATORIO DE MICROBIOLOGÍA
 Introducción Principios de Bioseguridad NORMAS DE SEGURIDAD EN EL LABORATORIO DE MICROBIOLOGÍA Normas de seguridad en el Laboratorio de Microbiología Medidas en caso de emergencia Bibliografía INTRODUCCIÓN
Introducción Principios de Bioseguridad NORMAS DE SEGURIDAD EN EL LABORATORIO DE MICROBIOLOGÍA Normas de seguridad en el Laboratorio de Microbiología Medidas en caso de emergencia Bibliografía INTRODUCCIÓN
Curso Prácticas
 IMQ 180 Al finalizar la unidad, el alumno será capaz de describir y aplicar correctamente la técnica del sondaje gastrointestinal, conocer sus diversos fines y efectuar la prevención y cuidado de las complicaciones.
IMQ 180 Al finalizar la unidad, el alumno será capaz de describir y aplicar correctamente la técnica del sondaje gastrointestinal, conocer sus diversos fines y efectuar la prevención y cuidado de las complicaciones.
PREPARACIÓN DE EXÁMENES. Condiciones Generales para la toma de muestras de sangre:
 PREPARACIÓN DE EXÁMENES Condiciones Generales para la toma de muestras de sangre: 1. Presentarse al Laboratorio en ayunas en el horario establecido. 2. El ayuno ideal es de 8 a 10 horas. 3. No tomar bebidas
PREPARACIÓN DE EXÁMENES Condiciones Generales para la toma de muestras de sangre: 1. Presentarse al Laboratorio en ayunas en el horario establecido. 2. El ayuno ideal es de 8 a 10 horas. 3. No tomar bebidas
c. Ingestión de agua y alimentos contaminados con heces u orina de enfermos portadores. Correcta
 Cuál es el modo de transmisión de la fiebre tifoidea? a. Animales salvajes. b. Contacto directo con sangre y fluidos corporales. c. Ingestión de agua y alimentos contaminados con heces u orina de enfermos
Cuál es el modo de transmisión de la fiebre tifoidea? a. Animales salvajes. b. Contacto directo con sangre y fluidos corporales. c. Ingestión de agua y alimentos contaminados con heces u orina de enfermos
TOMA DE MUESTRAS DE HECES PARA COPROCULTIVO. Se debe efectuar la toma antes de comenzar tratamiento antibiótico.
 NORMAS GENERALES PARA LA RECOLECCIÓN DE MUESTRAS CLÍNICAS Las muestras deben ser tomadas: 1.- Antes de la administración de antibióticos, siempre que sea posible. 2.- Del lugar de la infección, evitando
NORMAS GENERALES PARA LA RECOLECCIÓN DE MUESTRAS CLÍNICAS Las muestras deben ser tomadas: 1.- Antes de la administración de antibióticos, siempre que sea posible. 2.- Del lugar de la infección, evitando
