FICHA TÉCNICA. Naratriptán está indicado para el tratamiento agudo de los ataques de migraña con o sin aura.
|
|
|
- Esteban Cáceres Romero
- hace 6 años
- Vistas:
Transcripción
1 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Naratriptán Kern Pharma 2,5 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 2,5 mg de naratriptán (en forma de naratriptán, hidrocloruro). Excipiente(s): Contiene 81 mg de lactosa anhidra Para consultar la lista completa de excipientes ver sección FORMA FARMACÉUTICA Comprimido recubierto con película. Comprimido de color verde, de forma alargada y recubierto con película. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas Naratriptán está indicado para el tratamiento agudo de los ataques de migraña con o sin aura. 4.2 Posología y forma de administración Posología Naratriptán se recomienda como monoterapia para el tratamiento agudo de un ataque de migraña. Naratriptán no debe usarse de forma profiláctica. Naratriptán debe tragarse entero con agua. Adultos (18 a 65 años) La dosis recomendada de Naratriptán es un comprimido único de 2,5 mg. La dosis total no superará dos comprimidos de 2,5 mg en un período de 24 horas. Si los síntomas de migraña reapareciesen, tras una respuesta inicial, podrá tomarse una segunda dosis siempre que haya un intervalo mínimo de cuatro horas entre las dos dosis. Si un paciente no responde a una primera dosis de Naratriptán, no se tomará una segunda dosis para el mismo ataque, ya que es poco probable que produzca algún beneficio. Sin embargo, Naratriptán podrá usarse para ataques de migraña posteriores. Adolescentes (12-17 años de edad) En un estudio controlado con placebo en adolescentes (12 a 17 años) no se ha demostrado que la eficacia de Naratriptán a dosis únicas de 0,25, 1,0 y 2,5 mg sea mayor que la de placebo. Por tanto, no se recomienda el uso de Naratriptán en pacientes menores de 18 años. Niños (menores de 12 años) No se dispone de datos sobre el uso de naratriptán en niños menores de 12 años y, por tanto, no se recomienda su uso en este grupo de edad. Pacientes en edad avanzada (mayores de 65 años) 1 de 8
2 No se ha determinado todavía la seguridad y eficacia de naratriptán en personas mayores de 65 años y, por tanto, no puede recomendarse su uso en este grupo de edad. Hay una reducción moderada del aclaramiento con la edad (véase el apartado de farmacocinética 5.2). Insuficiencia renal Naratriptán se usará con precaución en pacientes con insuficiencia renal. La dosis máxima en cualquier período de tratamiento de 24 horas es un comprimido único de 2,5 mg. El uso de Naratriptán está contraindicado en pacientes con insuficiencia renal grave (aclaramiento de creatinina < 15 ml/min) (Véase las secciones de Contraindicaciones y Farmacocinética 4.3 y 5.2). Insuficiencia hepática Naratriptán se usará con precaución en pacientes con insuficiencia hepática. La dosis máxima en cualquier período de tratamiento de 24 horas es un comprimido único de 2,5 mg. El uso de Naratriptán está contraindicado en pacientes con insuficiencia hepática grave (Grado C de Child-Pugh) (Véase las secciones de Contraindicaciones y Farmacocinética 4.3 y 5.2). 4.3 Contraindicaciones Hipersensibilidad a cualquier componente del preparado. Igual que otros agonistas de los receptores de 5-hidroxitriptamina 1 (5-HT 1 ) no se usará naratriptán en pacientes que hayan sufrido un infarto de miocardio o sufran una cardiopatía isquémica o angina de Prinzmetal/vasoespasmo coronario, enfermedad vascular periférica o pacientes con síntomas o signos compatibles con cardiopatía isquémica. Naratriptán no se administrará a pacientes con antecedentes de accidente cerebrovascular (ACV) o accidente isquémico transitorio (AIT). El uso de naratriptán en pacientes con hipertensión moderada o grave e hipertensión leve no controlada está contraindicado. La administración concomitante de ergotamina, derivados de la ergotamina (incluida la metisergida) y cualquier agonista de los receptores de triptán/ 5-hidroxitriptamina 1 (5-HT 1 ) con naratriptán está contraindicada (véase la sección 4.5). Naratriptán está contraindicado en pacientes con insuficiencia renal (aclaramiento de creatinina < 15 ml/min) o hepática graves (grado C de Child-Pugh). 4.4 Advertencias y precauciones especiales de empleo Naratriptán sólo se usará cuando haya un diagnóstico claro de migraña. Naratriptán no está indicado para uso en el tratamiento de la migraña hemipléjica, basilar u oftalmopléjica. Igual que con otros tratamientos para la migraña, antes de tratar la cefalea en pacientes no diagnosticados previamente como migrañosos, y en migrañosos que presenten síntomas atípicos, se tendrá precaución de descartar otras enfermedades neurológicas potencialmente graves. Hay que señalar que los pacientes con migraña pueden estar en riesgo de ciertos episodios cerebrovasculares (p.ej., ictus o AIT). Todavía no se ha determinado la seguridad y eficacia de naratriptán administrado durante la fase de aura antes del comienzo de la cefalea migrañosa. Igual que con otros agonistas de los receptores 5-HT 1, naratriptán no se administrará a pacientes con factores de riesgo de cardiopatía isquémica, como pacientes que sean muy fumadores o consumidores de terapia de sustitución de nicotina antes de una evaluación cardiovascular previa (véase la sección 4.3). Se prestará especial atención a las mujeres posmenopáusicas y hombres mayores de 40 años con estos factores de riesgo. Sin embargo, estas 2 de 8
3 evaluaciones pueden no detectar a cada paciente que sufra una cardiopatía y, en muy raros casos, se han producido episodios cardíacos graves en pacientes sin una enfermedad cardiovascular de base cuando se administraron agonistas de 5-HT 1. Tras su administración, naratriptán puede estar relacionado con síntomas transitorios como dolor torácico y opresión que pueden ser intensos y afectar a la garganta (véase el apartado 4.8). Cuando se piense que estos síntomas indican una cardiopatía isquémica, no se tomarán más dosis de naratriptán y se realizarán los exámenes pertinentes (véase la sección 4.8). Se ha notificado un síndrome de serotonina (incluido un estado de alteración mental, inestabilidad autonómica y alteraciones neuromusculares) tras el tratamiento concomitante con triptanes e inhibidores selectivos de la recaptación de la serotonina (ISRS) o inhibidores de la recaptación de la serotonina-noradrenalina (IRSN). Si está justificado clínicamente el tratamiento concomitante con naratriptán y un ISRS/IRSN, se aconseja vigilar debidamente al paciente (véase el apartado 4.5). Naratriptán contiene un componente de sulfonamida y, por tanto, existe un riesgo teórico de reacciones de hipersensibilidad en pacientes con hipersensibilidad comprobada a las sulfonamidas. No debe superarse la dosis recomendada de naratriptán. El uso prolongado de cualquier tipo de analgésico para la cefalea puede hacerla empeorar. Si se sufre o se sospecha esta situación, se buscará consejo médico y se interrumpirá el tratamiento. Se sospechará el diagnóstico de MOH en los pacientes con cefaleas frecuentes o diarias pese (o debido a) al uso periódico de medicaciones contra la cefalea. Los efectos no deseados pueden ser más frecuentes durante el uso concomitante de triptanes y plantas medicinales que contengan hierba de San Juan (Hypericum perforatum). Naratriptán contiene lactosa, los pacientes con intolerancia hereditaria a la galactosa, deficiencia de lactasa de Lapp (insuficiencia observada en ciertas poblaciones de Laponia) (insuficiencia observada en ciertas poblaciones de Laponia) o malaabsorción de glucosa o galactosa no deben tomar este medicamento. 4.5 Interacción con otros medicamentos y otras formas de interacción Se ha notificado un síndrome de serotonina (incluido un estado de alteración mental, inestabilidad autonómica y alteraciones neuromusculares) tras el tratamiento concomitante con triptanes e ISRS/IRSN (véase el apartado 4.4). No hay pruebas de una interacción farmacocinética con β-bloqueantes, antidepresivos tricíclicos e inhibidores selectivos de la recaptación de serotonina, alcohol o comida. La administración concomitante de naratriptán con ergotamina, dihidroergotamina o sumatriptán no produjo efectos clínicamente significativos en la tensión arterial, la frecuencia cardíaca o el ECG ni afectó a la exposición a naratriptán. Sin embargo, el aumento del riesgo de vasoespasmo coronario es una posibilidad teórica y está contraindicada la administración concomitante con preparados que contengan ergotamina u otro triptán/agonista de los receptores de 5-HT 1 (Véase Contraindicaciones, sección 4.3). Deben transcurrir al menos 24 horas después de la administración de naratriptán antes de administrar un preparado que contenga ergotamina o cualquier triptán/agonista del receptor de 5-HT 1. Por el contrario, deben transcurrir al menos 24 horas después de la administración de un preparado que contenga ergotamina antes de administrar naratriptán. Naratriptán no inhibe las enzimas monoaminoxidasas; por tanto, no se esperan interacciones con los inhibidores de la monoaminoxidasa. Además, el metabolismo limitado del naratriptán y la amplia gama de isoenzimas del citocromo P450 que intervienen indica que es poco probable que se produzcan interacciones farmacológicas significativas con el naratriptán (ver sección 5.2. Farmacocinética). Los anticonceptivos orales reducen el aclaramiento total de naratriptán en un 30 % y el tabaquismo aumenta el aclaramiento total en un 30 %. No obstante, no se requiere ningún ajuste de dosis. Puesto que el 60 % del naratriptán se excreta por vía renal, representando la secreción renal activa aproximadamente un 30 % del aclaramiento renal, podría haber interacciones con otros fármacos que también se segregan por vía renal. No obstante, debido al perfil de seguridad de naratriptán, la inhibición de la secreción de naratriptán tiene probablemente una importancia menor, aunque se considerará la posibilidad de que naratriptán inhiba otros fármacos de secreción activa. 3 de 8
4 4.6 Fertilidad, embarazo y lactancia No se ha establecido el uso seguro de naratriptán en las mujeres embarazadas. La evaluación de los estudios en animales experimentales no indica ningún efecto teratógeno directo ni efectos perjudiciales en el desarrollo peri- o post-natal. Sin embargo, se han observado en conejos retrasos en la osificación fetal y posibles efectos en la viabilidad de los embriones. Debido a que los estudios en reproducción animal no siempre reproducen la respuesta humana, la administración de naratriptán sólo se considerará si el beneficio esperado para la madre es mayor que cualquier posible riesgo para el feto. Naratriptán o los metabolitos relacionados con el fármaco se segregan en la lecha de las ratas en período de lactancia. Se observaron efectos transitorios en el desarrollo pre y post-natal de ratas neonatas sólo a exposiciones maternas suficientemente mayores que la exposición máxima en el hombre. No se han llevado a cabo estudios para determinar el nivel de transferencia del naratriptán en la leche materna de las mujeres en período de lactancia. Se recomienda reducir al mínimo la exposición del lactante evitando la lactancia en las 24 horas siguientes al tratamiento. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas La migraña o el tratamiento con Naratriptán pueden producir somnolencia. Se debe recomendar a los pacientes que valoren su capacidad para realizar tareas complejas, tales como conducir, durante las crisis de migraña y tras la administración de Naratriptán. 4.8 Reacciones adversas A dosis terapéuticas de naratriptán, la incidencia de efectos secundarios comunicados en ensayos clínicos fue similar a la de placebo. Algunos de los síntomas pueden ser parte del ataque de migraña. Las reacciones adversas se clasificaron por frecuencia utilizando la siguiente convención: Muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/ a <1/1.000); y muy raras (<1/10.000). Trastornos del sistema inmunológico Raras: Reacciones de hipersensibilidad que oscilan desde hipersensibilidad cutánea a casos raros de anafilaxia. Trastornos del sistema nervioso Frecuentes: Hormigueo. Normalmente es de poca duración, puede ser intenso y puede afectar a cualquier parte del cuerpo, incluido el tórax o la garganta. Mareos y somnolencia. Trastornos oculares Poco frecuentes: Trastornos visuales Trastornos cardíacos Poco frecuentes: Bradicardia, taquicardia, palpitaciones Muy raras: Se han notificado muy rara vez vasoespasmo de la arteria coronaria, cambios isquémicos transitorios en el ECG, angina e infarto de miocardio (véase las secciones 4.3 y 4.4 Contraindicaciones y Advertencias y Precauciones). Trastornos vasculares Muy raras: Isquemia vascular periférica Trastornos gastrointestinales Frecuentes: Náuseas y vómitos. Raras: Colitis isquémica. Trastornos de la piel y del tejido subcutáneo 4 de 8
5 Raras: Eczema, urticaria, prurito, edema facial Trastornos generales y alteraciones en el lugar de administración: Los síntomas siguientes normalmente son de poca duración, pueden ser intensos y pueden afectar a cualquier parte del cuerpo, incluido el tórax o la garganta: Frecuentes: Sensación de calor. Malestar/fatiga. Poco frecuentes: Dolor, sensación de pesadez, presión o tirantez. Exploraciones complementarias Poco frecuentes: Aumento de la presión arterial de aproximadamente 5 mmhg (sistólica) y 3 mmhg (diastólica) en un período de hasta 12 horas después de la administración. 4.9 Sobredosis La administración de una dosis elevada de 25 mg de naratriptán a un varón sano aumentó la presión arterial hasta 71 mmhg y produjo acontecimientos adversos, como mareo, tensión en el cuello, cansancio y pérdida de coordinación. La presión arterial volvió a los valores iniciales en 8 horas después de la administración sin otra intervención farmacológica. No se sabe qué efecto tiene la hemodiálisis o la diálisis peritoneal en las concentraciones plasmáticas del naratriptán. Tratamiento Si se produce una sobredosis con naratriptán, se vigilará al paciente durante al menos 24 horas y se aplicará un tratamiento complementario estándar, según sea necesario. 5. PROPIEDADES FARMACOLÓGICAS Grupo farmacoterapéutico: Agonistas selectivos de los receptores de 5-HT 1. Código ATC: N02CC Propiedades farmacodinámicas Grupo farmacoterapéutico: Se ha demostrado que el naratriptán es un agonista selectivo de los receptores de 5 hidroxitriptamina 1 (5-HT 1 ) que median la contracción vascular. Este receptor se encuentra predominantemente en los vasos sanguíneos intracraneales (cerebrales y durales). El naratriptán presenta una alta afinidad por los receptores de 5-HT 1B y 5-HT 1D clonados humanos, se piensa que el receptor de 5-HT 1B humano corresponde al receptor vascular 5-HT 1 que media en la contracción de los vasos sanguíneos intracraneales. Naratriptán tiene poco o ningún efecto en otros subtipos de receptores de 5-HT (5-HT 2, 5-HT 3, 5-HT 4 y 5-HT 7 ). En animales, el naratriptán dificulta la circulación de la arteria carótida. Esta circulación suministra sangre a los tejidos extracraneales e intracraneales, como las meninges y se piensa que la dilatación o la formación de edema en estos vasos es el mecanismo que subyace en la migraña en el hombre. Además, pruebas experimentales indican que el naratriptán inhibe la actividad del nervio trigémino. Ambas acciones pueden contribuir a la acción anti-migrañosa del naratriptán en el hombre. En el hombre, un meta-análisis de los registros de la PA de 15 estudios mostró que los aumentos máximos medios de la población en la presión arterial sistólica y diastólica tras una dosis de 2,5 mg de naratriptán en comprimidos sería menos de 5 mmhg y 3 mmhg, respectivamente. La respuesta de la presión arterial no se vio afectada por la edad, el peso o la insuficiencia hepática o renal. 5.2 Propiedades farmacocinéticas Absorción 5 de 8
6 Tras la administración oral, el naratriptán se absorbe rápidamente, con concentraciones plasmáticas máximas observadas a las 2-3 horas. Tras la administración de un comprimido de 2,5 mg de naratriptán, la C máx es de aproximadamente 8 ng/ml (IC del 95%: 6,5 a 10,5 ng/ml) en mujeres y 5,4 ng/ml (IC 95 %: 4,7 a 6,1 ng/ml) en el hombre. La biodisponibilidad oral es del 74% en mujeres y del 63% en hombres, sin diferencias de eficacia y tolerabilidad con el uso clínico. Por tanto, no se requiere un ajuste de la dosis relacionado con el género. Distribución El naratriptán se distribuye en un volumen de 170 l. La unión a proteínas plasmáticas es baja (29 %). La semivida de eliminación media (t 1/2 ) es de 6 horas. Metabolismo y eliminación El aclaramiento medio tras la administración intravenosa fue de 470 ml/min en hombres y 380 ml/min en mujeres. El aclaramiento renal es similar en hombres y mujeres a 220 ml/min y es mayor que la velocidad de sedimentación glomerular, lo que indica que el naratriptán se secreta de forma activa en los túbulos renales. El naratriptán se excreta predominantemente en la orina y un 50% de la dosis se recupera como naratriptán no modificado y el 30% se recupera como metabolitos inactivos. El naratriptán in vitro se metaboliza por una amplia variedad de isoenzimas del citocromo P450. En consecuencia, no se prevén interacciones farmacológicas metabólicas significativas con el naratriptán (véase el apartado 4.5). Poblaciones especiales de pacientes Pacientes de edad avanzada En pacientes de edad avanzada sanos (n=12), el aclaramiento disminuyó en un 26% en comparación con personas jóvenes sanas (n=12) en el mismo estudio (véase Posología y forma de administración en la sección 4.2). Género El AUC y la C máx fueron aproximadamente un 35 % menores en hombres que en mujeres; sin embargo, no hay diferencias en la eficacia y tolerabilidad en el uso clínico. Por tanto, no se requiere un ajuste de la dosis relacionado con el género (véase la sección 4.2. Posología y forma de administración). Insuficiencia renal La excreción renal es la principal vía de eliminación del naratriptán. En consecuencia, la exposición al naratriptán puede aumentar en pacientes con enfermedad renal. En un estudio en hombres y mujeres con insuficiencia renal (aclaramiento de creatinina 18 a 115 ml/min; n = 15) ajustada por sexo, edad y peso, con personas sanas (n = 8), los pacientes con insuficiencia renal tenían un aumento de aproximadamente un 80% en la t 1/2 y aproximadamente una reducción del 50% en el aclaramiento (véase la sección 4.2 Posología y forma de administración). Insuficiencia hepática El hígado desempeña un papel menor en el aclaramiento del naratriptán administrado por vía oral. En un estudio en hombres y mujeres con insuficiencia hepática (grado A o B de Child-Pugh n=8) ajustado por sexo, edad y peso, con personas sanas que recibieron naratriptán oral, los pacientes con insuficiencia hepática tenían un aumento de aproximadamente un 40% en la t 1/2 y aproximadamente una reducción del 30% en el aclaramiento (véase la sección 4.2 Posología y forma de administración). 5.3 Datos preclínicos sobre seguridad No se observaron datos clínicamente significativos en los estudios preclínicos. 6 de 8
7 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes Núcleo del comprimido Celulosa microcristalina Lactosa anhidra Croscarmelosa sódica Estearato de magnesio Recubrimiento: Laca de aluminio FD&C azul 2/índigo carmín (E132) Óxido de hierro amarillo (E172) Polietilenglicol / macrogol Dióxido de titanio (E171) Alcohol polivinilo Talco 6.2 Incompatibilidades No procede. 6.3 Periodo de validez 30 meses. 6.4 Precauciones especiales de conservación Este medicamento no requiere condiciones especiales de conservación. 6.5 Naturaleza y contenido del envase Laminado de opa/alu/pvc con blísters de hoja de tapa de aluminio Copolímero opaco blanco de PVC/PE/PCTE: Blísters de lámina de tapa de Al. Tamaños de envase: 2, 3, 4, 6, 12 ó 18 comprimidos. Puede que solamente están comercializados algunos tamaños de envases. 6.6 Precauciones especiales de eliminación y otras manipulaciones La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN KERN PHARMA, S.L. Venus, 72 - Pol. Ind. Colón II Terrassa (Barcelona) 8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN Septiembre de de 8
8 10. FECHA DE LA REVISIÓN DEL TEXTO 11/ de 8
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
IMIGRAN Sumatriptán (D.O.E.) (succinato)
 agencia española de medicamentos y productos sanitarios IMIGRAN Sumatriptán (D.O.E.) (succinato) 1. NOMBRE DEL MEDICAMENTO IMIGRAN 6 mg, Inyectable IMIGRAN 50 mg, Comprimidos 2. COMPOSICIÓN CUALITATIVA
agencia española de medicamentos y productos sanitarios IMIGRAN Sumatriptán (D.O.E.) (succinato) 1. NOMBRE DEL MEDICAMENTO IMIGRAN 6 mg, Inyectable IMIGRAN 50 mg, Comprimidos 2. COMPOSICIÓN CUALITATIVA
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
PROPUESTA DE FICHA TÉCNICA
 PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
FICHA TÉCNICA. Cada jeringa precargada contiene: 6mg de sumatriptán (como sumatriptán succinato)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Sumatriptán SUN 6mg/0,5ml solución inyectable EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada jeringa precargada contiene: 6mg de sumatriptán (como sumatriptán
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Sumatriptán SUN 6mg/0,5ml solución inyectable EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada jeringa precargada contiene: 6mg de sumatriptán (como sumatriptán
FICHA TÉCNICA. Cada jeringa precargada contiene 6,0 mg de sumatriptán (como sumatriptán succinato).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO IMIGRAN 6 mg inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA IMIGRAN 6mg inyectable Cada jeringa precargada contiene 6,0 mg de sumatriptán (como sumatriptán
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO IMIGRAN 6 mg inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA IMIGRAN 6mg inyectable Cada jeringa precargada contiene 6,0 mg de sumatriptán (como sumatriptán
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SILDENAFIL PARA HOMBRES 50 mg COMPRIMIDOS RECUBIERTOS PARA LA DISFUNCIÓN ERÉCTIL Página 1 SILDENAFIL PARA HOMBRES
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SILDENAFIL PARA HOMBRES 50 mg COMPRIMIDOS RECUBIERTOS PARA LA DISFUNCIÓN ERÉCTIL Página 1 SILDENAFIL PARA HOMBRES
FICHA TÉCNICA. Tratamiento de la incontinencia urinaria asociada a la insuficiencia del esfínter uretral en la perra.
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
Alivio de los sofocos que aparecen durante la menopausia como consecuencia de la deprivación estrogénica.
 1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
FICHA TÉCNICA. La duración estimada del tratamiento será de dos semanas.
 FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD UVALETTE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Contenido por comprimido recubierto: - 120,00 mg de extracto seco etanólico al 30%, de planta entera de Taraxacum
FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD UVALETTE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Contenido por comprimido recubierto: - 120,00 mg de extracto seco etanólico al 30%, de planta entera de Taraxacum
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Ropinirol KERN PHARMA 0,25 mg comprimidos recubiertos con película EFG. Ropinirol KERN PHARMA 0,5 mg comprimidos recubiertos con película EFG. Ropinirol KERN PHARMA 1 mg comprimidos
1. NOMBRE DEL MEDICAMENTO Ropinirol KERN PHARMA 0,25 mg comprimidos recubiertos con película EFG. Ropinirol KERN PHARMA 0,5 mg comprimidos recubiertos con película EFG. Ropinirol KERN PHARMA 1 mg comprimidos
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Glucosamina KERN PHARMA 1.500 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Glucosamina KERN PHARMA 1.500 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TÉCNICA. Zolmitriptán Flas STADA 2,5 mg comprimidos bucodispersables EFG Zolmitriptán Flas STADA 5 mg comprimidos bucodispersables EFG
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Zolmitriptán Flas STADA 2,5 mg comprimidos bucodispersables EFG Zolmitriptán Flas STADA 5 mg comprimidos bucodispersables EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Zolmitriptán Flas STADA 2,5 mg comprimidos bucodispersables EFG Zolmitriptán Flas STADA 5 mg comprimidos bucodispersables EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA. El comprimido es redondo, blanco y marcado con el código NL 1.5 en una cara.
 1. NOMBRE DEL MEDICAMENTO NorLevo 1500 microgramos comprimido. FICHA TÉCNICA 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 1500 microgramos de levonorgestrel. Excipientes: Lactosa
1. NOMBRE DEL MEDICAMENTO NorLevo 1500 microgramos comprimido. FICHA TÉCNICA 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 1500 microgramos de levonorgestrel. Excipientes: Lactosa
LABORATORIOS NORMON, S.A.
 1. NOMBRE DEL MEDICAMENTO normoval 250 mg comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto de normoval contiene: 250 mg de extracto hidroalcohólico seco de raíz
1. NOMBRE DEL MEDICAMENTO normoval 250 mg comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto de normoval contiene: 250 mg de extracto hidroalcohólico seco de raíz
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TÉCNICA. KETOISDIN 400 mg óvulos está indicado en adultos para el tratamiento local de
 1. NOMBRE DEL MEDICAMENTO KETOISDIN 400 mg óvulos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada óvulo contiene: 400 mg de ketoconazol Excipientes con efecto conocido: Butilhidroxianisol
1. NOMBRE DEL MEDICAMENTO KETOISDIN 400 mg óvulos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada óvulo contiene: 400 mg de ketoconazol Excipientes con efecto conocido: Butilhidroxianisol
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Principio activo: 18,42 mg de benazepril (equivalente a 20 mg de benazepril hidrocloruro)
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BENAKOR 20 mg COMPRIMIDOS PARA PERROS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BENAKOR 20 mg COMPRIMIDOS PARA PERROS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio
Zomig Flas 2,5 mg comprimidos bucodispersables Zolmitriptán
 Zomig Flas 2,5 mg comprimidos bucodispersables Zolmitriptán Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si
Zomig Flas 2,5 mg comprimidos bucodispersables Zolmitriptán Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si
Prospecto: información para el usuario. Naramig 2,5 mg comprimidos recubiertos con película Naratriptán
 Prospecto: información para el usuario 2,5 mg comprimidos recubiertos con película Naratriptán Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario 2,5 mg comprimidos recubiertos con película Naratriptán Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CALCIO-500 D COMPRIMIDOS RECUBIERTOS SUPLEMENTO MINERAL Página 1 CALCIO-500 D Comprimidos Recubiertos Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CALCIO-500 D COMPRIMIDOS RECUBIERTOS SUPLEMENTO MINERAL Página 1 CALCIO-500 D Comprimidos Recubiertos Principio
1. NOMBRE DEL MEDICAMENTO. VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio activo: Extracto seco
1. NOMBRE DEL MEDICAMENTO VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio activo: Extracto seco
Prospecto: información para el usuario. Rizatriptán Flas Kern Pharma 10 mg comprimidos bucodispersables EFG
 Prospecto: información para el usuario Rizatriptán Flas Kern Pharma 10 mg comprimidos bucodispersables EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el usuario Rizatriptán Flas Kern Pharma 10 mg comprimidos bucodispersables EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
PROSPECTO: INFORMACIÓN PARA EL USUARIO Sumatriptán Bluefish 50 mg comprimidos Sumatriptán
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Sumatriptán Bluefish 50 mg comprimidos Sumatriptán Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto ya que puede
PROSPECTO: INFORMACIÓN PARA EL USUARIO Sumatriptán Bluefish 50 mg comprimidos Sumatriptán Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto ya que puede
FICHA TÉCNICA. Azelastina hidrocloruro al 0,05% (0,5 mg/ml). Cada gota contiene 0,015 mg de azelastina hidrocloruro
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
FICHA TÉCNICA. Comprimidos recubiertos con película. Comprimidos recubiertos alargados de color amarillo.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Actithiol Mucolítico 500 mg Comprimidos recubiertos con película Actithiol Mucolítico adultos 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Actithiol Mucolítico 500 mg Comprimidos recubiertos con película Actithiol Mucolítico adultos 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
FICHA TÉCNICA. Imigran solución para pulverización nasal está indicado para el tratamiento agudo de ataques de migraña con o sin aura.
 1. NOMBRE DEL MEDICAMENTO Imigran 10 mg solución para pulverización nasal. Imigran 20 mg solución para pulverización nasal. FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Imigran 10 mg solución
1. NOMBRE DEL MEDICAMENTO Imigran 10 mg solución para pulverización nasal. Imigran 20 mg solución para pulverización nasal. FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Imigran 10 mg solución
Anexo II Tratamiento farmacológico de las cefaleas primarias y algias faciales (Grupo de Estudio de Cefaleas, S.E.N.)
 Anexo II Tratamiento farmacológico de las cefaleas primarias y algias faciales (Grupo de Estudio de Cefaleas, S.E.N.) Las dosis recomendadas son para pacientes adultos. Estas recomendaciones no deberían
Anexo II Tratamiento farmacológico de las cefaleas primarias y algias faciales (Grupo de Estudio de Cefaleas, S.E.N.) Las dosis recomendadas son para pacientes adultos. Estas recomendaciones no deberían
Agonistas y antagonistas de receptores de Serotonina (5-HT)
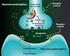 UNIVERSIDAD NACIONAL DE PIURA FACULTAD DE MEDICINA HUMANA Agonistas y antagonistas de receptores de Serotonina (5-HT) USO PARA EL TRATAMIENTO DE LA MIGRAÑA. DOCENTE : Dr. Littner Franco Palacios. CURSO
UNIVERSIDAD NACIONAL DE PIURA FACULTAD DE MEDICINA HUMANA Agonistas y antagonistas de receptores de Serotonina (5-HT) USO PARA EL TRATAMIENTO DE LA MIGRAÑA. DOCENTE : Dr. Littner Franco Palacios. CURSO
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MAGNESIUM PYRE 64 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MAGNESIUM PYRE 64 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 64 mg de magnesio (en forma de 550 mg de cloruro de magnesio,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MAGNESIUM PYRE 64 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 64 mg de magnesio (en forma de 550 mg de cloruro de magnesio,
FICHA TÉCNICA. Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTOS FICHA TÉCNICA Loratadina NORMON 10 mg Comprimidos EFG. Loratadina NORMON 1 mg/ml Jarabe EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina.
1. NOMBRE DEL MEDICAMENTOS FICHA TÉCNICA Loratadina NORMON 10 mg Comprimidos EFG. Loratadina NORMON 1 mg/ml Jarabe EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina.
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
FICHA TECNICA. ANASTROZOL NORMON 1 mg comprimidos recubiertos con película EFG
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO ANASTROZOL NORMON 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1 mg de anastrozol. Excipientes:
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO ANASTROZOL NORMON 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1 mg de anastrozol. Excipientes:
FICHA TÉCNICA. Por sobre: Acetato de calcio, 2,5 g (equivale a 635 mg de calcio), almidón de maíz, manitol (E421)
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
PROSPECTO: INFORMACIÓN PARA EL USUARIO. IRBESARTÁN KERN PHARMA 150 mg COMPRIMIDOS RECUBIERTOS EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO IRBESARTÁN KERN PHARMA 150 mg COMPRIMIDOS RECUBIERTOS EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya
PROSPECTO: INFORMACIÓN PARA EL USUARIO IRBESARTÁN KERN PHARMA 150 mg COMPRIMIDOS RECUBIERTOS EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya
FICHA TÉCNICA. Vispring 500 microgramos/ml colirio en solución en envases unidosis
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vispring 500 microgramos/ml colirio en solución en envases unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de colirio en solución contiene: Tetrizolina
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vispring 500 microgramos/ml colirio en solución en envases unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de colirio en solución contiene: Tetrizolina
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
4.2 Indicaciones de uso, especificando las especies a las que va destinado
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 1 mg comprimidos masticables para perros Metacam 2,5 mg comprimidos masticables para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 1 mg comprimidos masticables para perros Metacam 2,5 mg comprimidos masticables para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA. Ebastina Kern Pharma 10 mg comprimidos recubiertos con película EFG Ebastina Kern Pharma 20 mg comprimidos recubiertos con película EFG
 1. DENOMINACIÓN DEL MEDICAMENTO FICHA TÉCNICA Ebastina Kern Pharma 10 mg comprimidos recubiertos con película EFG Ebastina Kern Pharma 20 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA
1. DENOMINACIÓN DEL MEDICAMENTO FICHA TÉCNICA Ebastina Kern Pharma 10 mg comprimidos recubiertos con película EFG Ebastina Kern Pharma 20 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA
FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO. URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Benzbromarona (D.C.I.)...100 mg
FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Benzbromarona (D.C.I.)...100 mg
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. ACICLOVIR COMBIX 800 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ACICLOVIR COMBIX 800 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de 800 mg contiene: Aciclovir (DCI) 800 mg. 3. FORMA FARMACÉUTICA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ACICLOVIR COMBIX 800 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de 800 mg contiene: Aciclovir (DCI) 800 mg. 3. FORMA FARMACÉUTICA
PRUCAL PRUCALOPRIDE Comprimidos recubiertos Vía oral FÓRMULAS
 INDUSTRIA ARGENTINA VENTA BAJO RECETA PRUCAL PRUCALOPRIDE Comprimidos recubiertos Vía oral PRUCAL 1 FÓRMULAS Cada comprimido recubierto contiene: Prucalopride (como Prucalopride Succinato) 1,00 mg. Excipientes:
INDUSTRIA ARGENTINA VENTA BAJO RECETA PRUCAL PRUCALOPRIDE Comprimidos recubiertos Vía oral PRUCAL 1 FÓRMULAS Cada comprimido recubierto contiene: Prucalopride (como Prucalopride Succinato) 1,00 mg. Excipientes:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO: CLARITYNE FLAS 10 mg Liofilizado Oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada liofilizado oral de CLARYTINE FLAS contiene:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO: CLARITYNE FLAS 10 mg Liofilizado Oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada liofilizado oral de CLARYTINE FLAS contiene:
Cada ml contiene levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina.
 1. NOMBRE DEL MEDICAMENTO Bilina 0,5 mg/ml colirio en suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina. Excipiente
1. NOMBRE DEL MEDICAMENTO Bilina 0,5 mg/ml colirio en suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina. Excipiente
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA 3. FORMA FARMACÉUTICA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO. Pexion 100 mg comprimidos para perros Pexion 400 mg comprimidos para perros
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Pexion 100 mg comprimidos para perros Pexion 400 mg comprimidos para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido contiene: Sustancia activa:
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Pexion 100 mg comprimidos para perros Pexion 400 mg comprimidos para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido contiene: Sustancia activa:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RIMADYL SOLUCIÓN INYECTABLE PARA BOVIN0 50 mg/ml 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RIMADYL SOLUCIÓN INYECTABLE PARA BOVIN0 50 mg/ml 2. COMPOSICIÓN CUALITATIVA
Finasterida está indicada para el tratamiento de las primeras fases de la alopecia androgenética en varones.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida Actavis 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Finasterida Actavis 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 1 mg
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FORDIURAN 1 mg Comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Bumetanida 1 mg. Excipientes: 100 mg de almidón de maíz y 52,3
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FORDIURAN 1 mg Comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Bumetanida 1 mg. Excipientes: 100 mg de almidón de maíz y 52,3
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Emeprid 1 mg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Emeprid 1 mg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
REACTINE Cetirizina 10 mg comprimidos recubiertos con película
 PROSPECTO: INFORMACIÓN PARA EL USUARIO REACTINE Cetirizina 10 mg comprimidos recubiertos con película Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento Este medicamento puede
PROSPECTO: INFORMACIÓN PARA EL USUARIO REACTINE Cetirizina 10 mg comprimidos recubiertos con película Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento Este medicamento puede
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DRONTAL PLUS SABOR 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Sustancias activas: Febantel...
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DRONTAL PLUS SABOR 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Sustancias activas: Febantel...
FICHA TÉCNICA. ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. IDEOS UNIDIA 1000 mg/880 UI granulado efervescente 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO IDEOS UNIDIA 1000 mg/880 UI granulado efervescente 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 8 g contiene : Calcio elemento... 1000 mg ó25 mmol equivalente
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO IDEOS UNIDIA 1000 mg/880 UI granulado efervescente 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 8 g contiene : Calcio elemento... 1000 mg ó25 mmol equivalente
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Flerudin 5 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Flerudin contiene hidrocloruro
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Flerudin 5 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Flerudin contiene hidrocloruro
1. NOMBRE DEL MEDICAMENTO. Doxazosina COMBINO PHARM 2 mg comprimidos EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO Doxazosina COMBINO PHARM 2 mg comprimidos EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 2 mg de doxazosina (mesilato). Para excipientes, ver 6.1. 3. FORMA FARMACEUTICA Comprimidos
1. NOMBRE DEL MEDICAMENTO Doxazosina COMBINO PHARM 2 mg comprimidos EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 2 mg de doxazosina (mesilato). Para excipientes, ver 6.1. 3. FORMA FARMACEUTICA Comprimidos
FICHA TÉCNICA. Glucosamina Teva 1.500 mg polvo para solución oral EFG
 1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Naratriptán Kern Pharma 2,5 mg comprimidos recubiertos con película EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Naratriptán Kern Pharma 2,5 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este
PROSPECTO: INFORMACIÓN PARA EL USUARIO Naratriptán Kern Pharma 2,5 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este
Prospecto: Información para el paciente. Aciclovir Kern Pharma 200 mg comprimidos dispersables EFG
 Prospecto: Información para el paciente Aciclovir Kern Pharma 200 mg comprimidos dispersables EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: Información para el paciente Aciclovir Kern Pharma 200 mg comprimidos dispersables EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
LLD Abreviado de Zoloft. Todo medicamento debe conservarse fuera del alcance de los niños.
 LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
FICHA TÉCNICA. 3. FORMA FARMACÉUTICA Comprimidos recubiertos. Biconvexos, ovales, de color blanco o blanquecino grisáceo jaspeado.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FUCIDINE 250 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 250 mg de fusidato de sodio. Excipiente: 72 mg de lactosa por comprimido.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FUCIDINE 250 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 250 mg de fusidato de sodio. Excipiente: 72 mg de lactosa por comprimido.
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 POSTINOR 750 microgramos comprimidos. 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Excipientes en el apartado 6.1. Comprimidos.
POSTINOR 750 microgramos comprimidos. 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Excipientes en el apartado 6.1. Comprimidos.
Prospecto: información para el paciente Ebastel Forte 20 mg Comprimidos recubiertos con película. Ebastina
 Prospecto: información para el paciente Ebastel Forte 20 mg Comprimidos recubiertos con película Ebastina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el paciente Ebastel Forte 20 mg Comprimidos recubiertos con película Ebastina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
MAXALT MAX 5 y 10 mg
 MAXALT MAX 5 y 10 mg 470 FICHA TÉCNICA SPC-MXT-RPD-0698 Tracer MXT-T/E-11935 10/98 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DE LA ESPECIALIDAD MAXALT MAX 5 mg MAXALT MAX 10 mg 2. COMPOSICIÓN
MAXALT MAX 5 y 10 mg 470 FICHA TÉCNICA SPC-MXT-RPD-0698 Tracer MXT-T/E-11935 10/98 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DE LA ESPECIALIDAD MAXALT MAX 5 mg MAXALT MAX 10 mg 2. COMPOSICIÓN
PROSPECTO: INFORMACIÓN PARA EL USUARIO VIRLIX 10 mg comprimidos recubiertos con película Cetirizina dihidrocloruro
 PROSPECTO: INFORMACIÓN PARA EL USUARIO VIRLIX 10 mg comprimidos recubiertos con película Cetirizina dihidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Este medicamento
PROSPECTO: INFORMACIÓN PARA EL USUARIO VIRLIX 10 mg comprimidos recubiertos con película Cetirizina dihidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Este medicamento
Prospecto: información para el usuario. Memantina Cinfa 10 mg comprimidos recubiertos con película EFG Memantina hidrocloruro
 Prospecto: información para el usuario Memantina Cinfa 10 mg comprimidos recubiertos con película EFG Memantina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento,
Prospecto: información para el usuario Memantina Cinfa 10 mg comprimidos recubiertos con película EFG Memantina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento,
FICHA TÉCNICA. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada comprimido contiene: Acido ursodeoxicólico, 150 mg Excipientes: Ver 6.1.
 FICHA TÉCNICA URSOCHOL 1. NOMBRE DEL MEDICAMENTO URSOCHOL comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada comprimido contiene: Acido ursodeoxicólico, 150 mg Excipientes: Ver 6.1. 3. FORMA FARMACÉUTICA:
FICHA TÉCNICA URSOCHOL 1. NOMBRE DEL MEDICAMENTO URSOCHOL comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada comprimido contiene: Acido ursodeoxicólico, 150 mg Excipientes: Ver 6.1. 3. FORMA FARMACÉUTICA:
FICHA TÉCNICA. Cada gramo de crema de Aciclovir Sandoz 50 mg/g crema contiene 50 mg de aciclovir.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Sandoz 50 mg/g crema EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema de Aciclovir Sandoz 50 mg/g crema contiene 50 mg de aciclovir. Excipientes
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Sandoz 50 mg/g crema EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema de Aciclovir Sandoz 50 mg/g crema contiene 50 mg de aciclovir. Excipientes
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CARPROGESIC 50 mg COMPRIMIDOS PARA PERROS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Sustancia
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CARPROGESIC 50 mg COMPRIMIDOS PARA PERROS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Sustancia
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Lacovin 20 mg/ml solución cutánea. Lacovin 50 mg/ml solución cutánea.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lacovin 20 mg/ml solución cutánea. Lacovin 50 mg/ml solución cutánea. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de Lacovin 20 mg/ml solución cutánea contiene
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lacovin 20 mg/ml solución cutánea. Lacovin 50 mg/ml solución cutánea. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de Lacovin 20 mg/ml solución cutánea contiene
TUSQUIM Paracetamol - Dextrometorfano bromhidrato - Fenilefrina clorhidrato Bromhexina clorhidrato Tabletas Recubiertas
 TUSQUIM Paracetamol - Dextrometorfano bromhidrato - Fenilefrina clorhidrato Bromhexina clorhidrato Tabletas Recubiertas TUSQUIM Comprimidos recubiertos Antitusivo Analgésico Antipirético Mucolítico COMPOSICION:
TUSQUIM Paracetamol - Dextrometorfano bromhidrato - Fenilefrina clorhidrato Bromhexina clorhidrato Tabletas Recubiertas TUSQUIM Comprimidos recubiertos Antitusivo Analgésico Antipirético Mucolítico COMPOSICION:
1. DENOMINACIÓN DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 3. FORMA FARMACÉUTICA
 POSTINOR 750 microgramos comprimidos. 1. DENOMINACIÓN DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Para los excipientes, véase en
POSTINOR 750 microgramos comprimidos. 1. DENOMINACIÓN DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Para los excipientes, véase en
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SUPOSITORIO BRONQUIAL LACTANTE SUPOSITORIO ANALGÉSICO, EXPECTORANTE BALSÁMICO Página 1 SUPOSITORIO BRONQUIAL LACTANTE
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SUPOSITORIO BRONQUIAL LACTANTE SUPOSITORIO ANALGÉSICO, EXPECTORANTE BALSÁMICO Página 1 SUPOSITORIO BRONQUIAL LACTANTE
1. Tratamiento del estreñimiento 2. Tratamiento de la encefalopatia hepática (encefalopatía porto-sistémica); coma hepático
 1. NOMBRE DEL MEDICAMENTO Lactulosa Resolution 3,3 g/5 ml, solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 5 mililitros de solución oral contienen 3,3 g de lactulosa Para la lista completa
1. NOMBRE DEL MEDICAMENTO Lactulosa Resolution 3,3 g/5 ml, solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 5 mililitros de solución oral contienen 3,3 g de lactulosa Para la lista completa
Repafet. Rupatadina Tabletas. Rupatadina II.- DENOMINACIÓN GENÉRICA: III.- FORMA FARMACÉUTICA Y FORMULACIÓN:
 Repafet Rupatadina Tabletas II.- DENOMINACIÓN GENÉRICA: Rupatadina III.- FORMA FARMACÉUTICA Y FORMULACIÓN: Cada tableta contiene: Fumarato de Rupatadina equivalente a... 10 mg de Rupatadina Excipiente
Repafet Rupatadina Tabletas II.- DENOMINACIÓN GENÉRICA: Rupatadina III.- FORMA FARMACÉUTICA Y FORMULACIÓN: Cada tableta contiene: Fumarato de Rupatadina equivalente a... 10 mg de Rupatadina Excipiente
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO LAMBDALINA 40 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 g de crema contiene 40 mg de lidocaína Excipientes:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO LAMBDALINA 40 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 g de crema contiene 40 mg de lidocaína Excipientes:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Clarityne 10 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina.
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Clarityne 10 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina.
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DICLOVET 50 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DICLOVET 50 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina
 FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Valsartán KERN PHARMA 160 mg comprimidos recubiertos con película EFG Valsartán
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Valsartán KERN PHARMA 160 mg comprimidos recubiertos con película EFG Valsartán Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve
PROSPECTO: INFORMACIÓN PARA EL USUARIO Valsartán KERN PHARMA 160 mg comprimidos recubiertos con película EFG Valsartán Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve
PROSPECTO: INFORMACIÓN PARA EL USUARIO Alercina 10 mg comprimidos cetirizina dihidrocloruro
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Alercina 10 mg comprimidos cetirizina dihidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
PROSPECTO: INFORMACIÓN PARA EL USUARIO Alercina 10 mg comprimidos cetirizina dihidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
Prospecto: información para el usuario. Ratioalerg 10 mg comprimidos cetirizina dihidrocloruro
 Prospecto: información para el usuario Ratioalerg 10 mg comprimidos cetirizina dihidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario Ratioalerg 10 mg comprimidos cetirizina dihidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
FICHA TECNICA. Adultos en prediálisis o en diálisis: 1 dosis (40 µg) de 1 ml en cada inyección.
 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Lactofilus polvo oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lactofilus polvo oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición por gramo: Principio activo: Lactobacilos acidófilos 120 millones de unidades formadoras
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lactofilus polvo oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición por gramo: Principio activo: Lactobacilos acidófilos 120 millones de unidades formadoras
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Vivotif cápsulas duras gastrorresistentes (Vacuna viva antitífica oral) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA.
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Vivotif cápsulas duras gastrorresistentes (Vacuna viva antitífica oral) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA.
Psicofàrmacos. Escuela de parteras 2013
 Psicofàrmacos Escuela de parteras 2013 Psicofàrmacos Fàrmacos que actùan sobre las funciones cerebrales como sedantes o estimulantes, lo que produce cambios en la percepciòn, estado de ànimo, conciencia
Psicofàrmacos Escuela de parteras 2013 Psicofàrmacos Fàrmacos que actùan sobre las funciones cerebrales como sedantes o estimulantes, lo que produce cambios en la percepciòn, estado de ànimo, conciencia
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO. GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Cada cápsula dura contiene:
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene: Diacereína,
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene: Diacereína,
