INFORMACIÓN PARA PRESCRIBIR AMPLIA
|
|
|
- Roberto Cortés Márquez
- hace 5 años
- Vistas:
Transcripción
1 INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. DENOMINACIÓN DISTINTIVA FANHDI 2. DENOMINACIÓN GENÉRICA Factor VIII de la coagulación sanguínea humana 3. FORMA FARMACÉUTICA Y FORMULACIÓN Solución Inyectable Fórmula: El frasco ámpula con liofilizado contiene: Factor VIII de la coagulación sanguínea humana 250 UI 500 UI 1000 UI Proteínas totales 90 mg 90 mg 90 mg Excipientes: Histidina Albúmina humana Arginina La jeringa prellenada con diluyente contiene: Agua estéril para uso inyectable 10 ml 10 ml 10 ml FANHDI es un concentrado liofilizado de FVIII altamente puro y estable, obtenido a partir de plasma humano mediante un proceso de purificación continuo consistente en una precipitación con polietilenglicol (PEG) seguido de una cromatografía de afinidad y de precipitaciones con cloruro sódico y glicina. El producto en frasco ámpula final tiene una actividad específica como mínimo de 2,5 a 10 UI/mg de proteína dependiendo de sus presentaciones (250, 500 ó 1000 UI). La actividad específica excluyendo el estabilizante natural FvW y la albúmina es superior a 1000 UI/mg de proteína. 4. INDICACIONES TERAPÉUTICAS Tratamiento y profilaxis de hemorragias en pacientes con hemofilia A (déficit congénito de factor VIII). 1
2 5. FARMACOCINÉTICA Y FARMACODINAMIA 5.1 Propiedades farmacocinéticas La actividad plasmática de F VIII disminuye según una degradación exponencial bifásica. La vida media obtenida en el ensayo clínico realizado con FANHDI es de ± 2.55 horas, con una recuperación in vivo de ± 18.5% equivalente aproximadamente a ± UI/mL por UI/kg administrada (determinaciones realizadas por el método cromogénico). 5.2 Propiedades farmacodinámicas El F VIII:c es responsable de la actividad de coagulación. Actúa como cofactor del factor IX acelerando la conversión del factor X en factor X activado. El factor X activado transforma la protrombina en trombina, la cual a su vez convierte el fibrinógeno en fibrina de manera que puede formarse un coágulo. La actividad del F VIII:c se encuentra muy reducida en pacientes con hemofilia A y por ello, se hace necesaria una terapia de reposición. 6. CONTRAINDICACIONES Utilizar con precaución en pacientes con reacciones alérgicas conocidas a los componentes de la preparación. 7. PRECAUCIONES GENERALES En caso de aparecer reacciones alérgicas o anafilácticas deberá suspenderse inmediatamente la infusión (deben seguirse las pautas de tratamiento del shock). Después de la administración repetida de concentrados de factor VIII humano, debe determinarse el nivel de inhibidores en el plasma. La transmisión de agentes infecciosos no es totalmente descartada cuando son administrados productos preparados a partir de la sangre o plasma humano. Esto también se refiere a la posible transmisión de patógenos de naturaleza desconocida. Sin embargo, el riesgo de transmisión de agentes infecciosos se reduce por: - La selección de los donantes mediante un reconocimiento médico. 2
3 - En las donaciones individuales y en las mezclas de plasma se descarta la presencia de marcadores de los virus de la inmunodeficiencia humana (VIH), de la hepatitis C (VHC) y de la hepatitis B (VHB). - En las mezclas de plasma se descarta la presencia del material genético que utiliza el VHC para reproducirse. - Los procedimientos validados de inactivación/eliminación incluidos en el proceso de producción. Estos procedimientos se consideran efectivos para el VIH, VHC, virus de la hepatitis A (VHA) y VHB. Los procedimientos de inactivación/eliminación pueden tener un valor limitado para virus no envueltos tales como parvovirus B19 y otros agentes infecciosos transmisibles. En todos los pacientes que reciban FANHDI deben considerarse las pautas de vacunación indicadas para los sujetos que reciben medicamentos derivados de la sangre o plasma humanos. 8. RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA No se ha demostrado la inocuidad de este producto para su uso durante el embarazo con ensayos clínicos controlados. Los estudios con animales de experimentación son insuficientes para asegurar la seguridad con respecto a la reproducción, desarrollo del embrión o feto, curso del embarazo y desarrollo peri y postnatal. Por lo tanto, durante el embarazo y la lactancia pueden utilizarse los concentrados de factor VIII únicamente si son claramente necesarios. 9. REACCIONES SECUNDARIAS Y ADVERSAS - En raras ocasiones se han observado reacciones alérgicas o anafilácticas. - Aumento de la temperatura, en raras ocasiones. - Desarrollo de anticuerpos contra el F VIII. - A pesar del bajo contenido en isoaglutininas, existe algún riesgo de hemólisis intravascular. - No puede excluirse totalmente la transmisión de agentes infecciosos (ver apartado Precauciones generales). 3
4 10. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO No se han descrito. Incompatibilidades FANHDI no debe mezclarse con otros medicamentos. 11. ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO No se han descrito. 12. PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGENESIS MUTAGENESIS, TERATOGENESIS Y SOBRE LA FERTILIDAD El factor VIII humano es un constituyente normal del plasma humano y actúa de la misma forma que el factor VIII endógeno. Dado que la experiencia clínica no indica efectos carcinogénicos ni mutagénicos tras la administración de factor VIII, no se considera necesario realizar estudios experimentales, particularmente en especies heterólogas. 13. DOSIS Y VÍA DE ADMINISTRACIÓN DOSIS La dosis y duración del tratamiento con FANHDI debe ajustarse según las necesidades individuales del paciente. La dosis necesaria puede calcularse utilizando la siguiente fórmula como guía: Número de Unidades de Factor VIII = Peso corporal x Incremento deseado x 0.5 requeridas (UI) (kg) de F VIII (%) Este cálculo está basado en el hecho que 1 UI de F VIII por kg de peso corporal incrementa la actividad plasmática de F VIII aproximadamente un 2% (Es decir: se necesitan 0.5 UI/kg peso para incrementar en un 1% el nivel de F VIII en el plasma). Los niveles de F VIII plasmáticos del paciente deben ser determinados y monitorizados durante el tratamiento con FANHDI. Esto es particularmente importante en el caso de intervenciones quirúrgicas. 4
5 Tipo de hemorragia - Hemorragias menores: Hemorragias en articulaciones - Hemorragias mayores: Hemorragias en músculos. Extracciones dentales. Traumatismo craneal leve. Intervenciones quirúrgicas menores. Hemorragias en la cavidad bucal - Hemorragias que ponen en peligro la vida: Intervenciones quirúrgicas mayores. Hemorragias gastrointestinales. Hemorragias intracraneales, intraabdominales o intratorácicas. Fracturas. Nivel plasmático de actividad de F VIII terapéuticamente necesario Período durante el cual es necesario mantener dicho nivel plasmático de actividad de F VIII 30% Al menos 1 día, dependiendo de la gravedad de la hemorragia 40 50% 3-4 días o hasta alcanzar una adecuada recuperación % Tratamiento durante 7 días. A partir de aquí, terapia durante al menos otros 7 días. Pacientes con inhibidores: Si el factor VIII plasmático no alcanza los niveles esperados en el paciente, o si la hemorragia no se puede controlar tras una dosis adecuada, debe sospecharse la presencia de un inhibidor. Los hemofílicos con anticuerpos contra el factor VIII (inhibidores) requieren una terapia específica. Puede obtenerse inmunotolerancia mediante el tratamiento con concentrado de factor VIII de coagulación de plasma humano. Profilaxis: Para profilaxis a largo plazo de hemorragias en pacientes con hemofilia A severa, debe administrarse FANHDI a dosis de UI/kg a intervalos de 2-3 días. En algunos casos, especialmente en pacientes jóvenes, pueden ser necesarios intervalos más cortos o dosis mayores. - VIA DE ADMINISTRACIÓN FANHDI está indicado para ser administrado únicamente por vía intravenosa. 5
6 14. MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL No se conocen sus consecuencias, ya que no se han descrito casos de sobredosificación. 15. PRESENTACIONES - FANHDI 250 UI: - Frasco ámpula liofilizado: 250 UI de FVIII - Jeringa prellenada con diluyente: 10 ml de agua estéril para uso inyectable - FANHDI 500 UI: - Frasco ámpula liofilizado: 500 UI de FVIII - Jeringa prellenada con diluyente: 10 ml de agua estéril para uso inyectable - FANHDI 1000 UI: - Frasco ámpula liofilizado: 1000 UI de FVIII - Jeringa prellenada con diluyente: 10 ml de agua estéril para uso inyectable 16. RECOMENDACIONES PARA EL ALMACENAMIENTO Consérvese a no más de 30 ºC. No se congele. Protéjase de la luz. 17. LEYENDAS DE PROTECCIÓN No se deje al alcance de los niños. Reporte las sospechas de reacción adversa al correo: farmacovigilancia@cofepris.gob.mx 18. NOMBRE DEL LABORATORIO Y DOMICILIO Hecho en España por: Representante legal: Instituto Grifols, S.A. Grifols México, S.A. de C.V. Polígon Industrial Llevant. Eugenio Cuzín No. 909, Can Guasch, 2, Parets del Vallès, Parque Ind. Belenes Nte., Barcelona, España. C.P , Zapopan, Jalisco, México. Importado y distribuido por: Grifols México, S.A. de C.V. Eugenio Cuzín No. 909, Parque Ind. Belenes Nte., C.P , Zapopan, Jalisco, México. 6
7 19. NÚMERO DE REGISTRO DEL MEDICAMENTO, ANTE LA SECRETARIA DE SALUD. Reg. No. 232M95 SSA IV 7
Factor VIII 250 U.I. 500 U.I U.I (Proteínas totales 90 mg 90 mg 90 mg)
 1. NOMBRE DEL MEDICAMENTO - FANHDI 250 U.I. inyectable - FANHDI 500 U.I. inyectable - FANHDI 1000 U.I. inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Vial liofilizado. Principio activo: Factor
1. NOMBRE DEL MEDICAMENTO - FANHDI 250 U.I. inyectable - FANHDI 500 U.I. inyectable - FANHDI 1000 U.I. inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Vial liofilizado. Principio activo: Factor
- Frasco ámpula liofilizado 250 U.I. 500 U.I. 1000 U.I.
 INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. DENOMINACIÓN DISTINTIVA FANHDI 2. DENOMINACIÓN GENÉRICA Factor Antihemofílico Humano 3. FORMA FARMACÉUTICA Y FORMULACIÓN Solución Inyectable Formulación: - Frasco
INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. DENOMINACIÓN DISTINTIVA FANHDI 2. DENOMINACIÓN GENÉRICA Factor Antihemofílico Humano 3. FORMA FARMACÉUTICA Y FORMULACIÓN Solución Inyectable Formulación: - Frasco
La composición del medicamento, expresada por ml de producto reconstituido en agua inyectable, es la siguiente:
 INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. DENOMINACIÓN DISTINTIVA TRYPSONE 0,5 g TRYPSONE 1 g 2. DENOMINACIÓN GENÉRICA Alfa-1-antitripsina 3. FORMA FARMACÉUTICA Y FORMULACIÓN Solución inyectable. La
INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. DENOMINACIÓN DISTINTIVA TRYPSONE 0,5 g TRYPSONE 1 g 2. DENOMINACIÓN GENÉRICA Alfa-1-antitripsina 3. FORMA FARMACÉUTICA Y FORMULACIÓN Solución inyectable. La
600 U.I. 480 mg 95% Ig. 67,5 mg 9,0 mg 3 ml. Solución inyectable con inmunoglobulinas, principalmente inmunoglobulina G (IgG).
 1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-HEPATITIS B GRIFOLS 600 U.I. GAMMA ANTI-HEPATITIS B GRIFOLS 1000 U.I. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 600 U.I. 1000 U.I. Inmunoglobulina
1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-HEPATITIS B GRIFOLS 600 U.I. GAMMA ANTI-HEPATITIS B GRIFOLS 1000 U.I. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 600 U.I. 1000 U.I. Inmunoglobulina
FICHA TÉCNICA. 1. NOMBRE COMERCIAL DEL MEDICAMENTO Hepuman Berna P 600 UI y Hepuman Berna P 1000 UI Pasteurizado.
 FICHA TÉCNICA 1. NOMBRE COMERCIAL DEL MEDICAMENTO Hepuman Berna P 600 UI y Hepuman Berna P 1000 UI Pasteurizado. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Composición cualitativa: Inmunoglobulina humana
FICHA TÉCNICA 1. NOMBRE COMERCIAL DEL MEDICAMENTO Hepuman Berna P 600 UI y Hepuman Berna P 1000 UI Pasteurizado. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Composición cualitativa: Inmunoglobulina humana
FICHA TÉCNICA. PROTHROMPLEX IMMUNO TIM UI Complejo de protrombina humana tratado con vapor
 FICHA TÉCNICA 1. DENOMINACIÓN 2. COMPOSICIÓN PROTHROMPLEX IMMUNO TIM 4 600 UI Complejo de protrombina humana tratado con vapor Proteína Potencia: Complejo de protrombina: Factor II humano 1) Factor VII
FICHA TÉCNICA 1. DENOMINACIÓN 2. COMPOSICIÓN PROTHROMPLEX IMMUNO TIM 4 600 UI Complejo de protrombina humana tratado con vapor Proteína Potencia: Complejo de protrombina: Factor II humano 1) Factor VII
1. NOMBRE COMERCIAL DEL MEDICAMENTO Globuman Berna P 320 mg y Globuman Berna P 800 mg. Pasteurizado
 1. NOMBRE COMERCIAL DEL MEDICAMENTO Globuman Berna P 320 mg y Globuman Berna P 800 mg. Pasteurizado 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. 2.1. Composición cualitativa: Inmunoglobulina humana normal.
1. NOMBRE COMERCIAL DEL MEDICAMENTO Globuman Berna P 320 mg y Globuman Berna P 800 mg. Pasteurizado 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. 2.1. Composición cualitativa: Inmunoglobulina humana normal.
FICHA TÉCNICA. KYBERNIN P 500 U.I U.I. Liofilizado mg mg Antitrombina III 500 UI 1000 UI Proteína total mg mg
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO KYBERNIN P 500 UI KYBERNIN P 1000 UI 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Composición cualitativa Principio activo: Antitrombina III humana 2.2 Composición
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO KYBERNIN P 500 UI KYBERNIN P 1000 UI 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Composición cualitativa Principio activo: Antitrombina III humana 2.2 Composición
Vial liofilizado 250 U.I. 500 U.I. - Agua para inyección 2 ml 2 ml
 1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-TÉTANOS GRIFOLS 250 U.I. GAMMA ANTI-TÉTANOS GRIFOLS 500 U.I. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Vial liofilizado 250 U.I. 500 U.I. - Principio activo: Inmunoglobulina
1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-TÉTANOS GRIFOLS 250 U.I. GAMMA ANTI-TÉTANOS GRIFOLS 500 U.I. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Vial liofilizado 250 U.I. 500 U.I. - Principio activo: Inmunoglobulina
FICHA TÉCNICA TOXOIDES TETÁNICO Y DIFTÉRICO (TD)
 1. DENOMINACIÓN DISTINTIVA. 2. DENOMINACIÓN GENÉRICA. Toxoides tetánico y diftérico 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Toxoide diftérico Toxoide tetánico Vehículo cbp 3 5 Lf 10 20 Lf 0.5 ml 4.
1. DENOMINACIÓN DISTINTIVA. 2. DENOMINACIÓN GENÉRICA. Toxoides tetánico y diftérico 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Toxoide diftérico Toxoide tetánico Vehículo cbp 3 5 Lf 10 20 Lf 0.5 ml 4.
INFORMACIÓN PARA PRESCRIBIR AMPLIA. Seroalbúmina Humana 12.5 g 25 g Vehículo c.b.p. 50 ml 100 ml
 INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. DENOMINACIÓN DISTINTIVA ALBUMINA HUMANA GRIFOLS 2. DENOMINACIÓN GENÉRICA Seroalbúmina Humana 25% 3. FORMA FARMACÉUTICA Y FORMULACIÓN El frasco ámpula contiene:
INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. DENOMINACIÓN DISTINTIVA ALBUMINA HUMANA GRIFOLS 2. DENOMINACIÓN GENÉRICA Seroalbúmina Humana 25% 3. FORMA FARMACÉUTICA Y FORMULACIÓN El frasco ámpula contiene:
100 UI 80 mg 95% IgG
 1. NOMBRE DEL MEDICAMENTO IGANTIBE 200 UI/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 100 UI/0,5 ml 600 UI/3 ml 1000 UI/5 ml Inmunoglobulina humana antihepatitis
1. NOMBRE DEL MEDICAMENTO IGANTIBE 200 UI/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 100 UI/0,5 ml 600 UI/3 ml 1000 UI/5 ml Inmunoglobulina humana antihepatitis
1500 U.I. (300 µg) 320 mg) 95% Ig) - Prevención de la inmunización Rh(D) en mujeres Rh(D) negativas.
 1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-D GRIFOLS 1500 U.I. SOLUCIÓN INYECTABLE EN JERINGA PRECARGADA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: Inmunoglobulina humana anti-d (Rh) (Proteínas
1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-D GRIFOLS 1500 U.I. SOLUCIÓN INYECTABLE EN JERINGA PRECARGADA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: Inmunoglobulina humana anti-d (Rh) (Proteínas
- Principio activo: D-sorbitol 0,5 g 2,5 g 5 g 10 g Agua para inyección c.s.p. 10 ml 50 ml 100 ml 200 ml
 1. NOMBRE DE LA ESPECIALIDAD 5% 0,5 g 5% 2,5 g 5% 5 g 5% 10 g 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 0,5 g 2,5 g 5 g 10 g Inmunoglobulina humana normal 0,5 g 2,5 g 5 g 10 g - Excipientes:
1. NOMBRE DE LA ESPECIALIDAD 5% 0,5 g 5% 2,5 g 5% 5 g 5% 10 g 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 0,5 g 2,5 g 5 g 10 g Inmunoglobulina humana normal 0,5 g 2,5 g 5 g 10 g - Excipientes:
4.1. Indicaciones terapéuticas
 1. NOMBRE DEL MEDICAMENTO Albúmina Humana Grifols al 20%, solución para perfusión intravenosa. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: - Principio activo: Albúmina humana 0,200 g Solución
1. NOMBRE DEL MEDICAMENTO Albúmina Humana Grifols al 20%, solución para perfusión intravenosa. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: - Principio activo: Albúmina humana 0,200 g Solución
320 mg mg. Terapia de reposición en adultos y niños en síndromes de inmunodeficiencia primaria tales como:
 1. NOMBRE DEL MEDICAMENTO GAMMAGLOBULINA HUMANA PASTEURIZADA GRIFOLS 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 320 mg/2 ml 800 mg/5 ml Inmunoglobulina
1. NOMBRE DEL MEDICAMENTO GAMMAGLOBULINA HUMANA PASTEURIZADA GRIFOLS 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 320 mg/2 ml 800 mg/5 ml Inmunoglobulina
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO. Prothromplex Immuno Tim UI Complejo de protrombina humana tratado con vapor
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO. Prothromplex Immuno Tim 4 600 UI Complejo de protrombina humana tratado con vapor 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Proteína Potencia: Complejo de
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO. Prothromplex Immuno Tim 4 600 UI Complejo de protrombina humana tratado con vapor 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Proteína Potencia: Complejo de
FICHA TÉCNICA. Terapia de reposición en adultos y niños en síndromes de inmunodeficiencia primaria tales como:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO IGAMPLIA 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 320 mg/2 ml 800 mg/5 ml - Principio activo: Inmunoglobulina humana normal (Proteínas
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO IGAMPLIA 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 320 mg/2 ml 800 mg/5 ml - Principio activo: Inmunoglobulina humana normal (Proteínas
INFORMACION PARA PRESCRIBIR AMPLIA KITNOS. Comprimidos. Amebicida. Tratamiento de la amibiasis intestinal sintomática, aguda y crónica, ameboma.
 Marzo de, 2007 INFORMACION PARA PRESCRIBIR AMPLIA KITNOS 1. NOMBRE COMERCIAL KITNOS 2. NOMBRE GENERICO: Etofamida 3. FORMA FARMACEUTICA Y FORMULACION: Fórmula: Cada comprimido contiene: Etofamida..500
Marzo de, 2007 INFORMACION PARA PRESCRIBIR AMPLIA KITNOS 1. NOMBRE COMERCIAL KITNOS 2. NOMBRE GENERICO: Etofamida 3. FORMA FARMACEUTICA Y FORMULACION: Fórmula: Cada comprimido contiene: Etofamida..500
INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A DIODOQUIN
 INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. NOMBRE COMERCIAL: 2. NOMBRE GENÉRICO: 3. FORMA FARMACÉUTICA Y FORMULACIÓN: Tabletas Cada tableta contiene: Excipiente cbp 650 mg 1 tableta 4. INDICACIONES TERAPÉUTICAS:
INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. NOMBRE COMERCIAL: 2. NOMBRE GENÉRICO: 3. FORMA FARMACÉUTICA Y FORMULACIÓN: Tabletas Cada tableta contiene: Excipiente cbp 650 mg 1 tableta 4. INDICACIONES TERAPÉUTICAS:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-TÉTANOS GRIFOLS 250 UI SOLUCIÓN INYECTABLE EN JERINGA PRECARGADA GAMMA ANTI-TÉTANOS GRIFOLS 500 UI SOLUCIÓN INYECTABLE EN JERINGA PRECARGADA 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-TÉTANOS GRIFOLS 250 UI SOLUCIÓN INYECTABLE EN JERINGA PRECARGADA GAMMA ANTI-TÉTANOS GRIFOLS 500 UI SOLUCIÓN INYECTABLE EN JERINGA PRECARGADA 2. COMPOSICIÓN
ATENATIV 500 UI, polvo y disolvente para solución para perfusión. Antitrombina III derivada de plasma humano
 ATENATIV 500 UI, polvo y disolvente para solución para perfusión. Antitrombina III derivada de plasma humano Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene
ATENATIV 500 UI, polvo y disolvente para solución para perfusión. Antitrombina III derivada de plasma humano Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene
FICHA TÉCNICA. 1. NOMBRE COMERCIAL DEL MEDICAMENTO Tetuman Berna P 500 U.I., solución inyectable.
 FICHA TÉCNICA 1. NOMBRE COMERCIAL DEL MEDICAMENTO Tetuman Berna P 500 U.I., solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Composición cualitativa: Inmunoglobulina humana antitetánica.
FICHA TÉCNICA 1. NOMBRE COMERCIAL DEL MEDICAMENTO Tetuman Berna P 500 U.I., solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Composición cualitativa: Inmunoglobulina humana antitetánica.
Reconstituir el producto como se describe en 6.6. El producto debe administrarse por vía intravenosa a una velocidad aproximada de 0,08 ml/kg/min.
 1. NOMBRE DEL MEDICAMENTO Trypsone 0,5 g polvo y disolvente para solución para perfusión Trypsone 1 g polvo y disolvente para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Trypsone
1. NOMBRE DEL MEDICAMENTO Trypsone 0,5 g polvo y disolvente para solución para perfusión Trypsone 1 g polvo y disolvente para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Trypsone
4.2.1 Posología FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ATENATIV 500 U.I., polvo y disolvente para solución para perfusión ATENATIV 1000 U.I., polvo y disolvente para solución para perfusión 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ATENATIV 500 U.I., polvo y disolvente para solución para perfusión ATENATIV 1000 U.I., polvo y disolvente para solución para perfusión 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA VACUNA ANTIPOLIOMIELÍTICA BIVALENTE ORAL
 1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Vacuna Antipoliomielítica Bivalente Oral 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0.1 ml contiene Virus de Poliomielitis Tipo 1 1,000,000
1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Vacuna Antipoliomielítica Bivalente Oral 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0.1 ml contiene Virus de Poliomielitis Tipo 1 1,000,000
Inmunoglobulina humana antihepatitis B 600 UI 1000 UI (Proteínas humanas 480 mg 800 mg) (Proporción inmunoglobulina humana 95% Ig 95% Ig)
 PROSPECTO Igantibe 600 UI y 1000 UI Solución inyectable Inmunoglobulina humana antihepatitis B Industria Española Venta bajo receta FÓRMULA CUALI Y CUANTITATIVA - Principio activo: 600 UI 1000 UI Inmunoglobulina
PROSPECTO Igantibe 600 UI y 1000 UI Solución inyectable Inmunoglobulina humana antihepatitis B Industria Española Venta bajo receta FÓRMULA CUALI Y CUANTITATIVA - Principio activo: 600 UI 1000 UI Inmunoglobulina
PROSPECTO: INFORMACIÓN PARA EL USUARIO
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Gamma Anti-Tétanos Grifols 500 UI solución inyectable en jeringa precargada Inmunoglobulina humana antitetánica Lea todo el prospecto detenidamente antes de empezar
PROSPECTO: INFORMACIÓN PARA EL USUARIO Gamma Anti-Tétanos Grifols 500 UI solución inyectable en jeringa precargada Inmunoglobulina humana antitetánica Lea todo el prospecto detenidamente antes de empezar
La actividad específica de Trypsan es 0,5 mg de alfa-1-antitripsina activa/mg de proteína. Para información sobre excipientes, ver 6.1.
 FOLLETO DE INFORMACIÓN AL PROFESIONAL 1. NOMBRE DEL MEDICAMENTO Trypsan 0,5 g Polvo liofilizado para solución inyectable con solvente Trypsan 1 g Polvo liofilizado para solución inyectable con solvente
FOLLETO DE INFORMACIÓN AL PROFESIONAL 1. NOMBRE DEL MEDICAMENTO Trypsan 0,5 g Polvo liofilizado para solución inyectable con solvente Trypsan 1 g Polvo liofilizado para solución inyectable con solvente
FICHA TÉCNICA HIBERIX
 1. Denominación distintiva 2. Denominación genérica Vacuna conjugada de Haemophilus influenzae tipo b 3. Composición cualitativa y cuantitativa El frasco ámpula con liofilizado para 1 dosis de 0.5 ml contiene:
1. Denominación distintiva 2. Denominación genérica Vacuna conjugada de Haemophilus influenzae tipo b 3. Composición cualitativa y cuantitativa El frasco ámpula con liofilizado para 1 dosis de 0.5 ml contiene:
Ficha Técnica. La solución contiene un 20% de proteína, de la que al menos el 95% es albúmina humana.
 Ficha Técnica 1 Denominación del medicamento ALBÚMINA HUMANA 20% Baxter, Solución para perfusión intravenosa 2 Composición cualitativa y cuantitativa Albúmina humana. La solución contiene un 20% de proteína,
Ficha Técnica 1 Denominación del medicamento ALBÚMINA HUMANA 20% Baxter, Solución para perfusión intravenosa 2 Composición cualitativa y cuantitativa Albúmina humana. La solución contiene un 20% de proteína,
FICHA TÉCNICA. Complejo de factor VIII de coagulación y factor von Willebrand humanos.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fanhdi 25 UI FVIII/30 UI FVW por ml, polvo y disolvente para solución inyectable Fanhdi 50 UI FVIII/60 UI FVW por ml, polvo y disolvente para solución inyectable
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fanhdi 25 UI FVIII/30 UI FVW por ml, polvo y disolvente para solución inyectable Fanhdi 50 UI FVIII/60 UI FVW por ml, polvo y disolvente para solución inyectable
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: Presentación: Nanotiv 500 UI Polvo para solución inyectable. 500 UI de factor IX de la coagulación de plasma
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: Presentación: Nanotiv 500 UI Polvo para solución inyectable. 500 UI de factor IX de la coagulación de plasma
FICHA TÉCNICA. MENCEVAX AC es una preparación liofilizada de polisacáridos purificados de Neisseria meningitidis (meningococo) de los grupos A y C.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MENCEVAX AC Vacuna de polisacáridos meningocócicos, grupos A y C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. MENCEVAX AC es una preparación liofilizada de polisacáridos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MENCEVAX AC Vacuna de polisacáridos meningocócicos, grupos A y C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. MENCEVAX AC es una preparación liofilizada de polisacáridos
FICHA TÉCNICA, ETIQUETADO Y PROSPECTO FICHA TÉCNICA
 1.3.1. FICHA TÉCNICA, ETIQUETADO Y PROSPECTO FICHA TÉCNICA MÓDULO 1. AGUA INYECCION GRIFOLS 1 1. NOMBRE DEL MEDICAMENTO Agua para Inyección Grifols 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones
1.3.1. FICHA TÉCNICA, ETIQUETADO Y PROSPECTO FICHA TÉCNICA MÓDULO 1. AGUA INYECCION GRIFOLS 1 1. NOMBRE DEL MEDICAMENTO Agua para Inyección Grifols 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones
2.1 Composición cualitativa Inmunoglobulina humana normal para administración intramuscular
 O Aventis Behring FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO BERIGLOBINA P 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Composición cualitativa Inmunoglobulina humana normal para administración intramuscular
O Aventis Behring FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO BERIGLOBINA P 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Composición cualitativa Inmunoglobulina humana normal para administración intramuscular
FICHA TÉCNICA. Albutein 5% es una solución que contiene 50 g/l de proteína total, de las cuales al menos un 95% es albúmina humana.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Albutein 5% solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Albúmina humana. Albutein 5% es una solución que contiene 50 g/l de proteína total,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Albutein 5% solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Albúmina humana. Albutein 5% es una solución que contiene 50 g/l de proteína total,
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Igamplia 160 mg/ml solución inyectable Inmunoglobulina humana normal
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Igamplia 160 mg/ml solución inyectable Inmunoglobulina humana normal Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto,
PROSPECTO: INFORMACIÓN PARA EL USUARIO Igamplia 160 mg/ml solución inyectable Inmunoglobulina humana normal Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Plasbumin 20 % solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Plasbumin 20 % solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Albúmina humana. Plasbumin 20% es una solución que contiene 200 g/l de proteína
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Plasbumin 20 % solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Albúmina humana. Plasbumin 20% es una solución que contiene 200 g/l de proteína
AT III KEDRION 500 UI / ANTITROMBINA DE PLASMA HUMANO AT III KEDRION 1000 UI / ANTITROMBINA DE PLASMA HUMANO
 ATIIIKEDRION500UI/ANTITROMBINADEPLASMAHUMANO ATIIIKEDRION1000UI/ANTITROMBINADEPLASMAHUMANO POLVOYSOLUCIÓNDILUYENTEPARAINFUSIÓN USOPROFESIONALEXCLUSIVO INDUSTRIAITALIANA VENTABAJORECETA Fórmula: Antitrombinadeplasmahumano
ATIIIKEDRION500UI/ANTITROMBINADEPLASMAHUMANO ATIIIKEDRION1000UI/ANTITROMBINADEPLASMAHUMANO POLVOYSOLUCIÓNDILUYENTEPARAINFUSIÓN USOPROFESIONALEXCLUSIVO INDUSTRIAITALIANA VENTABAJORECETA Fórmula: Antitrombinadeplasmahumano
OCTAPLEX 500 UI, Polvo y disolvente para solución inyectable,
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 NOMBRE DEL MEDICAMENTO OCTAPLEX 500 UI, Polvo y disolvente para solución inyectable, 2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA OCTAPLEX se presenta como polvo
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 NOMBRE DEL MEDICAMENTO OCTAPLEX 500 UI, Polvo y disolvente para solución inyectable, 2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA OCTAPLEX se presenta como polvo
FICHA TÉCNICA. Tratamiento y profilaxis de hemorragias en pacientes con hemofilia A (déficit congénito de factor VIII)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Haemoctin 250 Haemoctin 500 Haemoctin 1000 Polvo y disolvente para solución inyectable Factor VIII de coagulación derivado de plasma humano 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Haemoctin 250 Haemoctin 500 Haemoctin 1000 Polvo y disolvente para solución inyectable Factor VIII de coagulación derivado de plasma humano 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA. El tratamiento debe ser iniciado bajo la supervisión de un médico con experiencia en el tratamiento de la hemofilia.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Octanate LV 100 UI/ml Polvo y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Octanate LV 100 UI/ml contiene nominalmente 500 UI de
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Octanate LV 100 UI/ml Polvo y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Octanate LV 100 UI/ml contiene nominalmente 500 UI de
FICHA TÉCNICA. Albutein 20% es una solución que contiene 200 g/l de proteína total, de las cuales al menos un 95% es albúmina humana.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Albutein 20% solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Albúmina humana. Albutein 20% es una solución que contiene 200 g/l de proteína total,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Albutein 20% solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Albúmina humana. Albutein 20% es una solución que contiene 200 g/l de proteína total,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO Helixate NexGen 250 UI Polvo y disolvente para solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Factor
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO Helixate NexGen 250 UI Polvo y disolvente para solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Factor
El producto NO es adecuado para el tratamiento de la enfermedad de Von Willebrand.
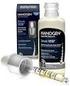 1 NOMBRE DEL MEDICAMENTO Recombinate 250 UI, Recombinate 500 UI, Recombinate 1000 UI, 2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial de Recombinate,, contiene nominalmente 250, 500 ó 1000 UI. Cada
1 NOMBRE DEL MEDICAMENTO Recombinate 250 UI, Recombinate 500 UI, Recombinate 1000 UI, 2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial de Recombinate,, contiene nominalmente 250, 500 ó 1000 UI. Cada
FICHA TÉCNICA. Octanate 50 UI/ml contiene nominalmente 250 UI o 500 UI de factor VIII de la coagulación humano por vial.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Octanate 50 UI/ml Polvo y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Octanate 50 UI/ml contiene nominalmente 250 UI o 500 UI de
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Octanate 50 UI/ml Polvo y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Octanate 50 UI/ml contiene nominalmente 250 UI o 500 UI de
FICHA TÉCNICA. (fitomenadiona, DCI) en 0,2 ml (volumen de llenado: 0,3 ml). Solución contenida en ampollas para administración oral o parenteral.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Konakion 2 mg pediátrico 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ampolla contiene 2 mg de vitamina K 1 (fitomenadiona, DCI) en 0,2 ml (volumen de llenado:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Konakion 2 mg pediátrico 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ampolla contiene 2 mg de vitamina K 1 (fitomenadiona, DCI) en 0,2 ml (volumen de llenado:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/7 1. DENOMINACIÓN DEL MEDICAMENTO ReFacto 250 UI, polvo y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ReFacto se prepara
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/7 1. DENOMINACIÓN DEL MEDICAMENTO ReFacto 250 UI, polvo y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ReFacto se prepara
Resumen de las características del producto. 1 ml. Para consultar la lista completa de excipientes, ver sección 6.1.
 Resumen de las características del producto 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables B.Braun Disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio Activo
Resumen de las características del producto 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables B.Braun Disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio Activo
FICHA TÉCNICA. Vial conteniendo polvo blanco o amarillo pálido y vial/jeringa con agua para inyectables (disolvente).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Factor IX Grifols 50 UI/ml polvo y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Factor IX de coagulación humano. Factor IX Grifols
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Factor IX Grifols 50 UI/ml polvo y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Factor IX de coagulación humano. Factor IX Grifols
Parte I B: Resumen de las características del producto
 Parte I B: Resumen de las características del producto 1 Denominación del medicamento HEMOFIL M 250 UI/500 UI/1000 UI (Factor Antihemofílico Humano, Método M, Purificación Monoclonal) Baxter, Hyland y
Parte I B: Resumen de las características del producto 1 Denominación del medicamento HEMOFIL M 250 UI/500 UI/1000 UI (Factor Antihemofílico Humano, Método M, Purificación Monoclonal) Baxter, Hyland y
FICHA TÉCNICA. La cantidad de principios activos presentes en 1 ml de ADDAMEL es de:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ADDAMEL concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de ADDAMEL contiene: Principio activo Cantidad Cloruro de cromo,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ADDAMEL concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de ADDAMEL contiene: Principio activo Cantidad Cloruro de cromo,
FICHA TÉCNICA. El producto contiene aproximadamente 60 UI/ml de Factor de von Willebrand (VWF:RCo).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Octanate 100 UI/ml Polvo y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Octanate 100 UI/ml contiene nominalmente 1000 UI de factor
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Octanate 100 UI/ml Polvo y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Octanate 100 UI/ml contiene nominalmente 1000 UI de factor
FICHA TÉCNICA. Prothromplex 600 UI/20 ml, polvo y disolvente para solución inyectable
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Prothromplex 600 UI/20 ml, polvo y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: complejo de protrombina humano.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Prothromplex 600 UI/20 ml, polvo y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: complejo de protrombina humano.
Trypsone se presenta como polvo y disolvente para solución para perfusión, con un contenido nominal de 0,5 g o 1 g de alfa-1-antitripsina por vial.
 1. NOMBRE DEL MEDICAMENTO Trypsone 20 mg/ml polvo y disolvente para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Alfa-1-antitripsina Trypsone se presenta como polvo y disolvente para
1. NOMBRE DEL MEDICAMENTO Trypsone 20 mg/ml polvo y disolvente para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Alfa-1-antitripsina Trypsone se presenta como polvo y disolvente para
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
FICHA TÉCNICA. Cantidad por vial (UI)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO OCTAPLEX, 1000 UI, Polvo y disolvente para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA OCTAPLEX se presenta como polvo y disolvente para solución
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO OCTAPLEX, 1000 UI, Polvo y disolvente para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA OCTAPLEX se presenta como polvo y disolvente para solución
OCTAPLEX, 500 UI, Polvo y disolvente para solución para perfusión,
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 NOMBRE DEL MEDICAMENTO OCTAPLEX, 500 UI, Polvo y disolvente para solución para perfusión, 2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA OCTAPLEX se presenta como
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 NOMBRE DEL MEDICAMENTO OCTAPLEX, 500 UI, Polvo y disolvente para solución para perfusión, 2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA OCTAPLEX se presenta como
Laboratorios Silanes, S.A. de C.V. Información para prescribir Versión de IPP:
 11M80 SSA-IV; INFORMACION PARA PRESCRIBIR AMPLIA () FORMA FARMACÉUTICA Y FORMULACIÓN Tabletas y polvo para solución inyectable IM e IV H E M E S T A L* (Hemezol) 1 / 5 Contiene cada: Tableta Fco. ámpula
11M80 SSA-IV; INFORMACION PARA PRESCRIBIR AMPLIA () FORMA FARMACÉUTICA Y FORMULACIÓN Tabletas y polvo para solución inyectable IM e IV H E M E S T A L* (Hemezol) 1 / 5 Contiene cada: Tableta Fco. ámpula
ambroxol cinfa 15 mg / 5 ml jarabe EFG
 FICHA TÉCNICA ambroxol cinfa 15 mg / 5 ml jarabe EFG 1. NOMBRE DEL MEDICAMENTO ambroxol cinfa 15 mg/5 ml jarabe EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 5 ml de jarabe contienen 15 mg de clorhidrato
FICHA TÉCNICA ambroxol cinfa 15 mg / 5 ml jarabe EFG 1. NOMBRE DEL MEDICAMENTO ambroxol cinfa 15 mg/5 ml jarabe EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 5 ml de jarabe contienen 15 mg de clorhidrato
El porcentaje de subclases de IgG, determinado por inmunonefelometría, es aproximadamente 74,3% IgG 1, 22,1% IgG 2, 1,99% IgG 3 y 1,61% IgG 4.
 1. NOMBRE DEL MEDICAMENTO Niuliva 250 U.I./ml solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina humana antihepatitis B El porcentaje de subclases de IgG, determinado por
1. NOMBRE DEL MEDICAMENTO Niuliva 250 U.I./ml solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina humana antihepatitis B El porcentaje de subclases de IgG, determinado por
El porcentaje de subclases de IgG, determinado por inmunonefelometría, es aproximadamente 74,3% IgG 1, 22,1% IgG 2, 1,99% IgG 3 y 1,61% IgG 4.
 1. NOMBRE DEL MEDICAMENTO Niuliva 250 U.I./ml solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina humana antihepatitis B El porcentaje de subclases de IgG, determinado por
1. NOMBRE DEL MEDICAMENTO Niuliva 250 U.I./ml solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina humana antihepatitis B El porcentaje de subclases de IgG, determinado por
FICHA TÉCNICA STAMARIL
 1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Vacuna antiamarílica atenuada 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Suspensión inyectable Fórmula: El frasco ámpula con liofilizado para una dosis
1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Vacuna antiamarílica atenuada 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Suspensión inyectable Fórmula: El frasco ámpula con liofilizado para una dosis
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO SYNCROSTIM 500 UI LIOFILIZADO Y DISOLVENTE PARA SOLUCIÓN INYECTABLE PARA BOVINO Y OVINO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SYNCROSTIM 500 UI LIOFILIZADO Y DISOLVENTE PARA SOLUCIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SYNCROSTIM 500 UI LIOFILIZADO Y DISOLVENTE PARA SOLUCIÓN
AlphaNine, Polvo Liofilizado para Solución Inyectable 500 UI, 1000 UI, 1500 UI, con solvente.
 1. NOMBRE DEL MEDICAMENTO AlphaNine, Polvo Liofilizado para Solución Inyectable 500 UI, 1000 UI, 1500 UI, con solvente. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Frasco-ampolla liofilizado: - Principio
1. NOMBRE DEL MEDICAMENTO AlphaNine, Polvo Liofilizado para Solución Inyectable 500 UI, 1000 UI, 1500 UI, con solvente. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Frasco-ampolla liofilizado: - Principio
CABATINA Inyectable. Ficha Técnica
 CABATINA Inyectable ANTIHEMORRÁGICO. CABATINA INYECTABLE está indicada para el tratamiento inicial de emergencia de intoxicaciones agudas y sobreagudas generadas por rodenticidas anticoagulantes. Ficha
CABATINA Inyectable ANTIHEMORRÁGICO. CABATINA INYECTABLE está indicada para el tratamiento inicial de emergencia de intoxicaciones agudas y sobreagudas generadas por rodenticidas anticoagulantes. Ficha
FICHA TÉCNICA. Tratamiento y profilaxis de hemorragias en pacientes con hemofilia A (deficiencia congénita de factor VIII).
 FICHA TÉCNICA 1. Nombre del medicamento Beriate 250 U. I. polvo y disolvente para solución inyectable o perfusión Beriate 500 U. I. polvo y disolvente para solución inyectable o perfusión Beriate 1.000
FICHA TÉCNICA 1. Nombre del medicamento Beriate 250 U. I. polvo y disolvente para solución inyectable o perfusión Beriate 500 U. I. polvo y disolvente para solución inyectable o perfusión Beriate 1.000
FICHA TÉCNICA. Anbinex 50 UI/ml Polvo y disolvente para solución para perfusión.
 FICHA TÉCNICA 1 NOMBRE DEL MEDICAMENTO Anbinex 50 UI/ml Polvo y disolvente para solución para perfusión 2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Antitrombina humana Anbinex se presenta como polvo liofilizado
FICHA TÉCNICA 1 NOMBRE DEL MEDICAMENTO Anbinex 50 UI/ml Polvo y disolvente para solución para perfusión 2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Antitrombina humana Anbinex se presenta como polvo liofilizado
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. (Factor VIII de coagulación humano).
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: Presentación: Titular del Registro Sanitario, país: Fabricante, país: octanate 1000 UI (Factor VIII de coagulación
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: Presentación: Titular del Registro Sanitario, país: Fabricante, país: octanate 1000 UI (Factor VIII de coagulación
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Trypsone 20 mg/ml Polvo y disolvente para solución para perfusión. Alfa-1-Antitripsina
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Trypsone 20 mg/ml Polvo y disolvente para solución para perfusión Alfa-1-Antitripsina Lea todo el prospecto detenidamente antes de empezar a usar el medicamento.
PROSPECTO: INFORMACIÓN PARA EL USUARIO Trypsone 20 mg/ml Polvo y disolvente para solución para perfusión Alfa-1-Antitripsina Lea todo el prospecto detenidamente antes de empezar a usar el medicamento.
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO IMOGAM RABIA 150 UI/ml, solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina antirrábica
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO IMOGAM RABIA 150 UI/ml, solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina antirrábica
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Grifols Disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Grifols Disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. IMOGAM RABIA 150 UI/ml, solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO IMOGAM RABIA 150 UI/ml, solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina antirrábica humana > 150 UI/1ml (en una cantidad de proteínas
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO IMOGAM RABIA 150 UI/ml, solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina antirrábica humana > 150 UI/1ml (en una cantidad de proteínas
Para información sobre excipientes, ver 6.1 ALBÚMINA HUMANA BERNA al 20% tiene un efecto hiperoncótico respecto al plasma normal.
 FICHA TÉCNICA Comentario: FECHA... [1] 1. NOMBRE DEL MEDICAMENTO Albúmina humana Berna al 20%, solución para perfusión intravenosa. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Composición cualitativa: Albúmina
FICHA TÉCNICA Comentario: FECHA... [1] 1. NOMBRE DEL MEDICAMENTO Albúmina humana Berna al 20%, solución para perfusión intravenosa. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Composición cualitativa: Albúmina
Prospecto: información para el usuario Imogam Rabia 150 UI/ml Solución inyectable Inmunoglobulina antirrábica humana
 Prospecto: información para el usuario Imogam Rabia 150 UI/ml Solución inyectable Inmunoglobulina antirrábica humana Lea todo el prospecto detenidamente antes de que usted o su hijo sea inmunizado porque
Prospecto: información para el usuario Imogam Rabia 150 UI/ml Solución inyectable Inmunoglobulina antirrábica humana Lea todo el prospecto detenidamente antes de que usted o su hijo sea inmunizado porque
- Como disolvente de medicamentos en polvo o liofilizados, previamente a su administración. - Como diluyente de soluciones y/o medicamentos.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables SERRACLINICS. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen agua para preparaciones inyectables. ph: 5,0-7,0
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables SERRACLINICS. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen agua para preparaciones inyectables. ph: 5,0-7,0
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Igamad 750 UI/ml solución inyectable en jeringa precargada Inmunoglobulina humana anti-d
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Igamad 750 UI/ml solución inyectable en jeringa precargada Inmunoglobulina humana anti-d Lea todo el prospecto detenidamente antes de empezar a usar el medicamento.
PROSPECTO: INFORMACIÓN PARA EL USUARIO Igamad 750 UI/ml solución inyectable en jeringa precargada Inmunoglobulina humana anti-d Lea todo el prospecto detenidamente antes de empezar a usar el medicamento.
Alfa-1-Antitripsina Humana Liofilizado 2% Para Solución Inyectable I.V. Con Solvente
 Alfa-1-Antitripsina Humana Liofilizado 2% Para Solución Inyectable I.V. Con Solvente Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que
Alfa-1-Antitripsina Humana Liofilizado 2% Para Solución Inyectable I.V. Con Solvente Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Albutein 20% solución para perfusión. Albúmina Humana
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Albutein 20% solución para perfusión Albúmina Humana Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto, ya que
PROSPECTO: INFORMACIÓN PARA EL USUARIO Albutein 20% solución para perfusión Albúmina Humana Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto, ya que
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Anatoxal Tedi, suspensión inyectable, jeringa precargada Vacuna contra la difteria y el tétanos (adsorbida, contenido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Anatoxal Tedi, suspensión inyectable, jeringa precargada Vacuna contra la difteria y el tétanos (adsorbida, contenido
Clorhidrato de Tamsulosina mg Excipiente cbp... 1 cápsula
 Autorizada por Secretaría de Salud el 12 de Julio de 2010 INFORMACION PARA PRESCRIBIR REDUCIDA 1. Nombre Comercial: ASOFLON 2. Nombre Genérico: TAMSULOSINA 3. Forma Farmacéutica y Formulación: Cápsulas.
Autorizada por Secretaría de Salud el 12 de Julio de 2010 INFORMACION PARA PRESCRIBIR REDUCIDA 1. Nombre Comercial: ASOFLON 2. Nombre Genérico: TAMSULOSINA 3. Forma Farmacéutica y Formulación: Cápsulas.
FICHA TÉCNICA. * La vacuna cumple con la recomendación de la OMS (hemisferio Norte) y con la decisión de la Unión Europea para la campaña 2000/2001.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL PASTEUR Vacuna antigripal inactivada (virus fraccionados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe cultivados en huevos, fraccionados
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL PASTEUR Vacuna antigripal inactivada (virus fraccionados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe cultivados en huevos, fraccionados
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DE LA ESPECIALIDAD IMOGAM RABIA 300 UI, pasteurizada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Composición cualitativa: Inmunoglobulina humana
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DE LA ESPECIALIDAD IMOGAM RABIA 300 UI, pasteurizada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Composición cualitativa: Inmunoglobulina humana
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Factor IX Grifols 50 UI/ml, Polvo y disolvente para solución inyectable. Factor IX de coagulación humano
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Factor IX Grifols 50 UI/ml, Polvo y disolvente para solución inyectable Factor IX de coagulación humano Lea todo el prospecto detenidamente antes de empezar a usar
PROSPECTO: INFORMACIÓN PARA EL USUARIO Factor IX Grifols 50 UI/ml, Polvo y disolvente para solución inyectable Factor IX de coagulación humano Lea todo el prospecto detenidamente antes de empezar a usar
