Aislamiento, cultivo e identificación de microorganismos ambientales a partir de muestras naturales
|
|
|
- Vicente Reyes Ávila
- hace 5 años
- Vistas:
Transcripción
1 Aislamiento, cultivo e identificación de microorganismos ambientales a partir de muestras naturales Julio Ricardo Moreno. Virginia Helena Albarracín Facultad de Ciencias Naturales e IML. Universidad Nacional de Tucumán. Miguel Lillo San Miguel de Tucumán. Argentina. Laboratorio de Investigaciones Microbiológicas de Lagunas Andinas LIMLA. Planta Piloto de Procesos Industriales Microbiológicos PROIMI-CONICET. Av. Belgrano y Pje. Caseros San Miguel de Tucumán. Argentina. julio_m@live.com.ar virginia@proimi.org.ar Resumen: se emplearán muestras naturales (agua, suelo, sedimentos de ríos o lagos, heces, etc.) a partir de las cuales se aislaran microrganismos cultivables, principalmente bacterias, mediante el empleo de medios selectivos. Posteriormente se procederá a la identificación por características morfológicas y patrones fisiológicos particulares. Palabras clave: Microorganismos ambientales. Bacterias. Hongos. Algas. Aislamiento. Cultivo. Resiembra. Cepario. Caracterización morfológica. Tinciones. Colorantes. Identificación bioquímica. OBJETIVOS Obtención de cultivos puros de microrganismos ambientales mediante aislamiento selectivo y sus sucesivas resiembras por estriado en medio agarizado. Confección de un cepario bacteriano para mantener un stock de los microrganismos aislados en un agente conservante (glicerina anhidra 20% v/v a - 80 C) para su posterior utilización. Observación y caracterización preliminar a partir de preparaciones microscópicas en fresco y tinciones simples que permitan la diferenciación de la morfología y tamaño celular, así como algunas estructuras particulares (envoltura capsular, endosporas, exosporas y corpúsculos metacromáticos). Caracterización específica mediante tinciones negativas (tinción capsular), diferenciales (tinción de Gram y de Ziehl-Neelsen) y selectivas (tinción de esporas). 79
2 Identificación bioquímica mediante técnicas simples que permitan la identificación de actividades enzimáticas presentes en los microorganismos, las cuales, por otro lado, contribuyen a la identificación taxonómica de los mismos. MATERIAL DE TRABAJO Agitador vortex. Agua destilada. Asa de siembra. Barbijos. Colorantes (Safranina, Violeta cristal, Fucsina fénica, Azul de metileno y nigrosina). Cubreobjetos. Delantal. Espátula de Drigalsky. Guantes. Etanol. Gafas. Gradillas para microtubos. Gradillas para tubos plásticos. Tubos plásticos estériles. Mecheros. Microscopio óptico. Microtubos estériles de 1,5 ml. Placas de Petri con medio agarizado con antibióticos. Peróxido de hidrógeno. Pipetas automáticas. Portaobjetos. Soluciones decolorantes (Alcohol-acetona y solución alcohólica acidificada). Solución fisiológica de sembrado (agua destilada 9% NaCl). Tips estériles. Varilla de vidrio. Vasos de precipitación. MATERIAL BIOLÓGICO Cepas identificadas de microrganismos (controles positivos). Cultivos puros en medio líquido y medio agarizado. Resiembras de microorganismos aislados. Suspensión de una mezcla de microrganismos ambientales (agua, sedimentos, heces, etc.). Aislamiento ACTIVIDADES El trabajo con microorganismos no se realiza con células aisladas, sino con poblaciones extensas y homogéneas del microorganismo a estudiar. Por lo tanto, el microbiólogo utiliza técnicas que permiten obtener un cultivo puro, y luego cultivar a mayor escala dicho microorganismo. Para obtener cultivos puros se han de utilizar instrumentos estériles, es decir, libres de otros microorganismos no deseados (contaminantes). La esterilidad se consigue por diferentes métodos previamente estudiados: calor seco, calor húmedo, filtración, esterilización química, radiación. Para poder estudiar los microorganismos en el laboratorio, el microbiólogo también debe utilizar medios de cultivo que posean los nutrientes necesarios para el crecimiento de los mismos. Si los nutrientes están en forma de solución acuosa hablamos de medios de cultivo líquidos, mientras que si a esta solución se añaden solidificantes, como la gelatina o el agar (2-3%), obtenemos medios de cultivo sólidos. A veces se utilizan medios de cultivo semisólidos, si la concentración de agar es 0,6-1,5%. Los medios de cultivo se esterilizan generalmente mediante calor húmedo (Autoclave). En este trabajo utilizaremos los medios ISP2, TSB y 5339 específicos 80
3 para Actinobacterias, cuya formulación se explica detalladamente en el trabajo de Albarracín, V.H. (2007), que estará a disposición durante el trabajo práctico. Para aislar un microorganismo de una mezcla de varios y obtener un cultivo puro del mismo, la técnica más utilizada es la de siembra por estría en medio sólido, en medio sólido, que permite obtener colonias separadas de individuos que proceden por división de una única célula. Estas colonias nos sirven para iniciar un cultivo a gran escala. Otra técnica consiste en obtener una suspensión de la mezcla de microorganismos y hacer diluciones seriadas que se vierten en una placa Petri hasta conseguir colonias aisladas. Una vez que se ha obtenido un cultivo puro, se puede mantener haciendo resiembras sucesivas o conservando las células en refrigeración empleando un agente conservante, más comúnmente glicerol (10-30%) a -80 C, en nitrógeno líquido a -173 C, o mediante liofilización. Procedimiento Seleccionar la muestra a partir de la cual se realizaran los aislamientos (suelo. heces, sedimentos, agua, etc.), pesar un gramo de la misma y colocarla en un tubo Falcón estéril al cual se le adicionaran 9 ml de solución fisiológica de sembrado (agua destilada 0.9% NaCl), colocar la tapa y agitar hasta homogeneizar el contenido con un agitador vórtex. Una vez obtenida una muestra homogeneizada, realizar diluciones seriadas según indica el esquema (Fig. 1). Con una micropipeta se toman 1000 µl de la muestra total, y se colocan en un tubo falcón estéril con 9 ml de solución fisiológica de sembrado y homogeneizar con un agitador vortex, obteniendo una dilución de 10-2 ; repetir dos veces para llegar a una dilución de Figura 1. Representación del sistema de diluciones seriadas. 81
4 El siguiente esquema (Fig. 2) explica el proceso de inoculación en placa con medio sólido. Los medios seleccionados fueron ISP2, TSB y 5339 con adición de antibióticos (Cicloheximida para inhibir el crecimiento de hongos y Ácido Nalidíxico para inhibir bacterias Gram negativas). Con una pipeta micropipeta extraer 100 µl del inóculo (Fig. 2 A) y volcarlo en una placa con el medio seleccionado (Fig. 2 B). Con la ayuda de una espátula de Drigalsky previamente esterilizada, esparcir el inóculo de manera homogénea en todas direcciones hasta que la superficie del agar quede completamente seca (Fig. 2 C). Por último incubar las placas en posición invertida durante 24 horas en una estufa a 28 C (Fig. 2 D). La posición invertida evitará que agua de condensación se deposite sobre el medio de cultivo, dificultando la obtención de colonias aisladas. Figura 2. Proceso de inoculación de la muestra en placa con medio de cultivo agarizado. Una vez transcurridas las 24 horas (en algunos casos hasta mas tiempo), se observaran colonias separadas en las placas (Fig. 3 A), las cuales deben ser resembradas en una nueva placa de Petri. La resiembra se realiza transfiriendo las colonias de interés con ayuda del asa de siembra, y en la nueva placa distribuir las células con la técnica de estriado en agar (Fig. 3 B). Por último incubar las placas en posición invertida durante 24 horas en una estufa a 28 C (Fig. 3 C). Figura 3. Resiembra de las colonias aisladas. 82
5 El paso final del aislamiento consiste en lograr un stock permanente del microrganismo aislado, lo cual se consigue mediante la confección de un cepario. Una alternativa comúnmente utilizada es mantener las células a temperaturas de entre -20 C y -80 C en un agente conservante como el glicerol al 20%, para lo cual debe cultivar el microrganismos en medio líquido hasta su fase exponencial de crecimiento, luego por centrifugación obtenemos un pellet de células y eliminamos el sobrenadante constituido por el medio de cultivo, para luego resuspender las células en glicerol y posteriormente refrigerarlas. También se puede optar por deshidratar las células mediante liofilización. Algunos microrganismos como algas y hongos son vulnerables a estas técnicas por lo cual se requieren resiembras periódicas para mantener la disponibilidad de los microrganismos. Observación microscópica Para observar una muestra al microscopio óptico podemos realizar preparados frescos simplemente colocando una gota de la suspensión de microorganismos entre un porta y un cubreobjetos y observar directamente. También podemos fijar la muestra antes de observar para lo cual se coloca una suspensión homogénea de microorganismos sobre el portaobjetos y se fija (mediante calor o agentes químicos). En ambos casos suele ser necesario utilizar coloraciones de contraste para diferenciar las células, para lo cual se usan diferentes técnicas. Estas preparaciones se observan habitualmente con objetivos de inmersión. Tinciones Son técnicas que permiten observar microorganismos en función de la capacidad de los mismos para retener o no determinadas sustancias colorantes, lo que depende de la carga de la célula y del colorante. Los colorantes pueden ser de distintos tipos, como por ejemplo los colorantes catiónicos. Éstos son sustancias que tienen carga positiva. Penetran en el interior de las células y las tiñen. Ejemplos: azul de metileno, cristal violeta, safranina. Otros tipos de colorantes son los aniónicos, los cuales poseen carga negativa. No penetran en el interior celular, de modo que no tiñen las células, sino el entorno. En este caso se habla de tinción negativa. Ejemplos: eosina, nigrosina. Existen colorantes con afinidad por ciertas sustancias, en nuestro caso utilizaremos colorantes liposolubles. Se caracterizan por su capacidad de integrarse con los lípidos celulares coloreándolos. Ejemplo: negro Sudán. A su vez, las tinciones pueden ser: Simples, diferenciales o selectivas. Las tinciones simples utilizan un solo colorante. Se basan en el hecho de que las células tienen una composición química diferente a la de su entorno, de modo que ambos se comportan de forma diferente frente a un colorante. Las tinciones diferenciales se basan en el hecho de que distintos tipos de células tienen distinta composición química, y por lo tanto reaccionan de forma diferente frente a una tinción, lo que permite clasificar los microorganismos en diferentes grupos, según su capacidad de tinción. En este apartado 83
6 están dos tinciones de importancia taxonómica y clínica (Tinción de Gram y Ziehl- Neelsen). La tinción de Gram (Fig. 4) permite diferenciar dos grandes grupos de bacterias: Gram positivas y Gram negativas. La técnica se basa en propiedades estructurales de la pared celular de ambos tipos de microorganismos, no siendo una reacción específica. Las bacterias Gram positivas poseen como componente estructural un 90% de peptidoglucano, mientras que las bacterias Gram negativas solo poseen un 10% de estos compuestos. Por lo tanto, si bien ambas pueden ser teñidas por el colorante cristal violeta (Fig. 4 A), la diferencia entre ambas radica en su resistencia a la decoloración (Fig. 4 B). Las bacterias Gram positivas gracias a su gruesa pared impiden la entrada del decolorante y por lo tanto la salida del complejo yodo-colorante. Por el contrario en las bacterias Gram negativas, los lípidos de la pared (más abundantes que en las células Gram positivas) se disuelven por este tratamiento, lo que permite el escape del complejo del yodo-colorante. Después de la decoloración las células Gram positivas son todavía púrpuras, pero las Gram negativas son incoloras. Para poner de manifiesto las células Gram negativas se utiliza una coloración de contraste. Habitualmente es un colorante de color rojo, como la safranina o la fucsina básica. Después de la coloración de contraste las células Gram negativas son rosadas, mientras que las Gram positivas permanecen púrpuras (Fig. 4 C). Figura 4. Representación comparativa de la tinción de Gram en bacterias Gram+ (izquierda) y Gram- (derecha), mostrando el estado de la coloración en cada proceso. 84
7 La tinción de Ziehl-Neelsen (Fig. 5), se basa en que ciertos microorganismos no son desteñidos con alcohol ácido si han sido previamente teñidos con fucsina fenicada (Fig. 5 A y 5 B). A estos microorganismos se los denominan ácido-alcohol resistentes. Una vez realizada la decoloración con esta mezcla se utiliza un colorante de contraste (azul de metileno) para poder observar las células sensibles a la decoloración con alcohol ácido (Fig. 5 C). Son microorganismos ácido-alcohol resistentes las micobacterias, debido a la composición de su pared celular (con ácidos micólicos). Esta tinción tiene interés desde el punto de vista del diagnóstico clínico puesto que algunos microorganismos patógenos son ácido-alcohol resistentes, tales como Mycobacterium tuberculosis, M. leprae, Nocardia sp. y Criptosporidios. Figura 5. Representación comparativa de la tinción de Ziehl-Neelsen en bacterias ácido alcohol resistentes (izquierda) y ácido alcohol no resistentes (derecha), mostrando el estado de la coloración en cada proceso. Al igual que las tinciones diferenciales, las tinciones selectivas se basan en el hecho de que distintas estructuras celulares tienen distinta composición química, de modo que se tiñen selectivamente con ciertos colorantes. Son ejemplos de tinciones selectivas: Tinción de esporas (Fig. 6), de flagelos, y de corpúsculos metacromáticos. Dependiendo 85
8 del caso pueden utilizarse uno o más colorantes. En la presenta actividad prestaremos atención únicamente a la tinción de esporas. Esta técnica de fundamenta en que ciertos grupos de bacterias producen esporas de resistencia cuya pared celular es característica. La tinción de esporas permite detectar este tipo de estructuras, lo cual es de gran utilidad a la hora de la identificación del microorganismo en estudio. Figura 6. Etapas de la tinción de esporas. A y B. Coloración inicial. C. Coloración de contraste. Procedimiento Tinción de Cápsulas por Método de Burri (ejemplo de tinción negativa). Procedimiento (Fig. 7): en el extremo de un portaobjetos colocar una gota de nigrosina o tinta china especial para bacteriología y una gota de igual volumen de un cultivo líquido, y mezclar con el ansa (Fig. 7 A). Extender con el borde de un portaobjeto, dejando que el líquido se extienda para formar una película delgada (Fig. 7 B). Dejar secar (Fig. 7 C). Observar por inmersión, bajando el condensador del microscopio para reducir la luz. Las cápsulas (Fig. 8) se observan como un halo claro sobre un fondo oscuro. Este método se fundamenta en que la cápsula desplaza las partículas de carbono coloidal de la tinta china y aparece como un halo claro alrededor de los microrganismos que presentan capsulas. Figura 7. Pasos del Método de Burri para tinción capsular. A. Mezclado. B. Extensión. C. Secado. 86
9 Figura 8. Diferenciación de Cápsulas al Microscopio óptico. A. Microfotografía. B. Esquema. Tinción de Gram (ejemplo de tinción diferencial): requiere cuatro soluciones, primer colorante, solución mordiente, agente decolorante y un segundo colorante. Procedimiento (Fig. 9). Figura 9. Procedimiento de la coloración de Gram. A-c. Coloración inicial. D y e. Decoloración. F y g. Coloración de contraste. Cubrir la muestra con el primer colorante (cristal violeta) durante un minuto (Fig. 9 A); lavar suavemente con abundante agua destilada para eliminar el exceso de colorante (Fig. 9 B). Colocar lugol durante un minuto (Fig. 9 C), este actúa como solución 87
10 mordiente por su afinidad con el colorante cristal violeta. La decoloración se realiza agregando suavemente gotas de alcohol-acetona de forma continua por alrededor de treinta segundos (Fig. 9 D), transcurridos los cuales se procese a lavar enseguida con abundante agua (Fig. 9 E). Finalmente cubrimos la preparación con un segundo colorante durante un minuto (Fig. 9 F). Lavar con abundante agua (Fig. 9 G), dejar secar y observar a inmersión en el Microscopio. Tinción de Ziehl-Neelsen (Fig. 10): requiere tres soluciones (primer colorante, agente decolorante y un segundo colorante). Procedimiento: a partir de un cultivo puro de M. luteus, realizar un frotis y fijar por calor la muestra. Cubrir la muestra con un trozo de papel de filtro y sujetarlo con una pinza. Colorar el primer colorante (fucsina fenicada) empapando el papel (Fig. 10 A). Tomando las debidas precauciones exponer la preparación a la llama del mechero hasta notar emisión de vapores, repetir si es necesario cinco minutos (Fig. 10 B); quitar el papel y lavar suavemente con abundante agua destilada (Fig. 10 C). Añadir gotas de alcohol ácido y esperar treinta segundos (Fig. 10 D). Lavar con abundante agua (Fig. 10 E). Teñir con azul de metileno y dejar actuar dos minutos (Fig. 10 F); lavar la muestra con abundante agua (Fig. 10 G), dejar secar y observar a inmersión en el Microscopio. Figura 10. Procedimiento de Ziehl-Neelsen. A-C. Coloración inicial. D y E. Decoloración. F y G. Coloración de contraste. 88
11 Tinción de esporas (ejemplo de tinción selectiva): requiere dos soluciones (primer colorante y segundo colorante). Procedimiento (Fig. 11): a partir de un cultivo puro de Bacillus megateium, realizar un frotis y fijar por calor la muestra. Cubrir la muestra con un trozo de papel de filtro y sujetarlo con una pinza. Colorar el primer colorante (verde de malaquita) empapando el papel (Fig. 11 A). Tomando las debidas precauciones exponer la preparación a la llama del mechero hasta notar emisión de vapores; cuando dejen de salir vapores volver a flamear, repetir agregando mas colorante si es necesario (Fig. 11 B) y dejar enfriar cinco minutos; quitar el papel y lavar suavemente con abundante agua destilada (Fig. 11 C). Teñir con safranina y dejar actuar un minuto (Fig. 11 D) y lavar la muestra con abundante agua (Fig. 11 E). Dejar secar y observar a inmersión en el Microscopio. Figura 11. Procedimiento de Tinción de esporas. A-C. Coloración inicial. D y E. Coloración de contraste. IDENTIFICACIÓN BIOQUÍMICA Las pruebas bioquímicas son muy importantes para la identificación taxonómica de microorganismos, y se basan en diferentes reacciones químicas que permiten poner de manifiesto las actividades enzimáticas presentes en los microorganismos analizados. A pesar de su tamaño microscópico los microorganismos poseen innumerables enzimas que aseguran sus funciones metabólicas. El tipo y la cantidad de actividad de cada una de las enzimas presentes en un momento dado en el microorganismo, están determinados por un sistema genético de control. La mayoría de las enzimas se ubican intracelularmente. Algunos microrganismos (principalmente bacterias y hongos) excretan dichas sustancias al exterior. 89
12 Reacciones en el Agar Hierro Triple Azúcar: TSI (Triple Sugar Iron) Esta prueba se recomienda para la identificación de patógenos entéricos Gram negativos. Se emplea para detectar la fermentación de lactosa, sacarosa y glucosa, con formación de ácido y gas, y también para detectar producción de ácido sulfhídrico. Se emplea el medio TSI, cuya formulación esta detallada a continuación (Tabla 1). Extracto de carne 3 g Extracto de levadura 3 g Peptona 15 g Proteasa-peptona 5 g Lactosa 10 g Sacarosa 10 g Glucosa 1 g Sulfato ferroso 0,2 g Cloruro de sodio 5 g Tiosulfato de sodio 0,3 g Rojo fenol 0,024 g Agar 12 g Agua destilada 1000 ml Tabla 1. Composición del medio de Cultivo Agar-Hierro triple azúcar. Los pasos a seguir son los siguientes: colocar el medio en tubos de vidrio esterilizado e inclinar. Una vez que el medio solidificó realizar una punción en el taco y una estría en bisel. Incubar a 37 C durante 24 horas. Para la interpretación tener en cuenta los siguientes fenómenos (Fig. 12). La falta de cambio en el medio de cultivo, indica que el microorganismo no es fermentador de azúcar, o sea que es incapaz de producir ácido por fermentación de glucosa, sacarosa o lactosa (Fig. 12 A). La presencia de fermentación inicial del fondo y del pico del medio con posterior retorno del pico al color original (ya que se forman aminas alcalinas por descarboxilación oxidativa de proteínas cerca de la superficie), indica la presencia de bacterias que fermentan la glucosa (Fig. 12 B). Una acidificación completa permanente del fondo y del pico revela la presencia de bacterias fermentadoras de lactosa y glucosa (Fig. 12 C). El ácido sulfhídrico se detecta por la formación de sulfuro de hierro que se deposita en el fondo del tubo oscureciendo el medio (Fig. 12 D). 90
13 Figura 12. Pruebas de fermentación de azúcares y producción de ácido en medio TSI. Respuesta enzimática (prueba de la catalasa) La catalasa es una enzima que descompone el peróxido de hidrógeno (H 2 O 2 ) en oxígeno y agua. Químicamente es una hemoproteína de estructura similar a la hemoglobina. La mayoría de las bacterias aerobias y anaerobias facultativas poseen actividad de catalasa. La prueba se fundamenta en que el peróxido de hidrógeno se forma como uno de los productos finales del metabolismo oxidativo aeróbico de los hidratos de carbono. Si se deja acumular, el peróxido de hidrógeno es letal para las células. La catalasa descompone el peróxido de hidrógeno en agua y oxígeno, previniendo la intoxicación celular. El procedimiento de la prueba se detalla a continuación: Transferir células del centro de una colonia bien aislada a la superficie de un portaobjetos, o si se trata de un cultivo líquido (caldo de cultivo). Añadir 1 o 2 gotas de peróxido de hidrógeno al 3% y observar si hay burbujeo. Se recomienda no añadir el microorganismo al reactivo, especialmente si se utilizan agujas o ansas que contienen hierro, ya que se pueden producir resultados falsos positivos. Para la interpretación tener en cuenta los siguientes fenómenos (Fig. 13): la rápida aparición sostenida de burbujas de gas o efervescencia, indica una reacción positiva. Dado que algunas bacterias pueden poseer enzimas distintas de la catalasa, capaces también de descomponer el peróxido de hidrógeno, unas pocas burbujas diminutas formadas a los 20 o 30 segundos no se consideran una prueba positiva. 91
14 Figura 13. Prueba de actividad de la catalasa. Izquierda resultado negativo. Derecha resultado positivo. Elaboración de Informe Realice un informe indicando los tipos de microorganismos aislados en base a las técnicas de tinción empleados y a su respuesta a las pruebas bioquímicas, por ejemplo: Aislamiento de Suelo 1: Bacilos, Gram positivos, Ácido Alcohol no resistente, catalasa negativo, (se puede acompañar con fotografías de los preparados obtenidos). BIBLIOGRAFÍA Albarracín, V.H Estudios de los aspectos fisiológicos, bioquímicos y moleculares de la resistencia a cobre en cepas de Actinomycetes. Tesis Doctoral. Facultad de Bioquímica, Química y Farmacia. Universidad Nacional de Tucumán. BIBLIOGRAFÍA DE CONSULTA Albarracín, V.H., Amoroso, M.J. & Abate, C.M Isolation and Characterization of indigenous copper resistant actinomycete strains. Chemie der Erde/ Geochemistry 65(1): Gerhardt, P.; Murray, R.G.E.; Costilow, R.N.; Nester, E.W.; Wood, W.A.; Krieg, N.R. y Phillips, G.R Manual of Methods for General Bacteriology. American Society for Microbiology, Washington, DC. Madigan, M.T., Martinko, J.M. y Parker J Brock: Biología de los Microorganismos. 8 Edición. Ed. Prentice Hall Iberia. Madrid. 1064p Madigan, M.T., Martinko, J.M. y Parker J Brock: Biología de los Microorganismos. 10 Edición. Ed. Pearson Educación., Madrid. 1011p 92
15 Madigan, M.T., Martinko, J.M., Dunlap, P.V. y Clark, D.P Brock: Biología de los Microorganismos. 12 Edición. Ed. Pearson Educación., Madrid. 1296p Ordoñez, O.F., Flores, M.R., Dib, J.R., Paz, A. & Farías, M.E Extremophile culture collection from andean lakes: Extreme pristine environments that host a wide diversity of microorganisms with tolerance to UV radiation. Microbial Ecology. 58(3): Prescott, L., Harley, J., Klein, D Microbiology. 5 th Edn. McGraw-Hill. London. 950pp Tortora, G.J., Funke, B.R., Case, C.L Introducción a la Microbiología. 9 Edición. Ed. Médica Panamericana. Buenos Aires. 988p Recibido: 15 julio Aceptado: 4 octubre
PREPARACIONES Y TINCIONES
 PREPARACIONES Y TINCIONES PREPARACIONES En fresco Temporales: Microcultivos de hongos, preparaciones de tejidos Fijas: Gram, Ziehl Nielsen, Sheaffer y fulton, SEM, TEM, naranja de acridina. CONTRASTE DE
PREPARACIONES Y TINCIONES PREPARACIONES En fresco Temporales: Microcultivos de hongos, preparaciones de tejidos Fijas: Gram, Ziehl Nielsen, Sheaffer y fulton, SEM, TEM, naranja de acridina. CONTRASTE DE
PRÁCTICO N 3. Técnicas para la observación, aislamiento y conservación de microorganismos
 PRÁCTICO N 3 Técnicas para la observación, aislamiento y conservación de microorganismos Objetivos Conocer el manejo del microscopio óptico, sus partes y utilidad en el laboratorio de microbiología. Conocer
PRÁCTICO N 3 Técnicas para la observación, aislamiento y conservación de microorganismos Objetivos Conocer el manejo del microscopio óptico, sus partes y utilidad en el laboratorio de microbiología. Conocer
AcuaNatura ÍNDICE TÉCNICAS DE TINCIÓN
 TÉCNICAS DE TINCIÓN ÍNDICE 1. Introducción 3 2. Tipos de tinciones 4 2.1. Tinción de Gram 4 2.2. Tinción ácido alcohol resistencia 5 2.3. Tinción de esporas 5 2.4. Tinción negativa 6 3. Precauciones 7
TÉCNICAS DE TINCIÓN ÍNDICE 1. Introducción 3 2. Tipos de tinciones 4 2.1. Tinción de Gram 4 2.2. Tinción ácido alcohol resistencia 5 2.3. Tinción de esporas 5 2.4. Tinción negativa 6 3. Precauciones 7
Preparaciones Microbiológicas. Preparaciones en fresco (microorganismos vivos) Preparaciones fijas y teñidas (microorganismos muertos)
 Preparaciones Microbiológicas Preparaciones en fresco (microorganismos vivos) Preparaciones fijas y teñidas (microorganismos muertos) Frotis Una capa delgada de muestra extendida sobre un portaobjetos
Preparaciones Microbiológicas Preparaciones en fresco (microorganismos vivos) Preparaciones fijas y teñidas (microorganismos muertos) Frotis Una capa delgada de muestra extendida sobre un portaobjetos
OBJETIVOS CRECIMIENTO MICROBIANO EN MEDIO SÓLIDO
 UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA PROGRAMA: CIENCIAS AMBIENTALES ÁREA: AGRO Y MAR CÁTEDRA: Microbiología e Inmunología Veterinaria PROF: JOSÉ ARAUJO Actividad Prática 3 OBJETIVOS 1
UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA PROGRAMA: CIENCIAS AMBIENTALES ÁREA: AGRO Y MAR CÁTEDRA: Microbiología e Inmunología Veterinaria PROF: JOSÉ ARAUJO Actividad Prática 3 OBJETIVOS 1
MANUAL DE OPERACIONES. DIRECCIÓN DE INVESTIGACIÓN Fecha: JUN 15 SUBDIRECCIÓN DE INVESTIGACIÓN BIOMÉDICA MANUAL DE TINCIONES
 A Hoja: de 0 MANUAL DE TINCIONES Elaboró: Autorizó: Puesto QUÍMICO JEFE DE LABORATORIO Firma Hoja: 2 de 0. Propósito Establecer las técnicas y condiciones para la realización de tinciones utilizadas en
A Hoja: de 0 MANUAL DE TINCIONES Elaboró: Autorizó: Puesto QUÍMICO JEFE DE LABORATORIO Firma Hoja: 2 de 0. Propósito Establecer las técnicas y condiciones para la realización de tinciones utilizadas en
GUÍA OBSERVACIÓN DE MICROORGANISMOS Y USO DE TINCIONES
 ESCUELA DE SALUD GUÍA OBSERVACIÓN DE MICROORGANISMOS Y USO DE TINCIONES DIRIGIDO A ALUMNOS DE: Técnico de laboratorio Clínico y Banco de Sangre Técnico de Enfermería Técnico de Radiodiagnóstico y Radioterapia
ESCUELA DE SALUD GUÍA OBSERVACIÓN DE MICROORGANISMOS Y USO DE TINCIONES DIRIGIDO A ALUMNOS DE: Técnico de laboratorio Clínico y Banco de Sangre Técnico de Enfermería Técnico de Radiodiagnóstico y Radioterapia
Tema I Introducción al estudio de los agentes biológicos de importancia médica.
 Tema I Introducción al estudio de los agentes biológicos de importancia médica. - Características de las células procarióticas y eucarióticas. - Microscopía y coloraciones. 2da Parte Esporas Se forma bajo
Tema I Introducción al estudio de los agentes biológicos de importancia médica. - Características de las células procarióticas y eucarióticas. - Microscopía y coloraciones. 2da Parte Esporas Se forma bajo
EXPLICACIÓN DE TRABAJOS PRÁCTICOS COLORACIONES
 EXPLICACIÓN DE TRABAJOS PRÁCTICOS COLORACIONES Microbiología General Carrera: Tecnicatura Universitaria en Esterilización Analista Biológico 2015 DIFERENCIA ENTRE CÉLULA PROCARIOTA Y CÉLULA EUCARIOTA Morfología
EXPLICACIÓN DE TRABAJOS PRÁCTICOS COLORACIONES Microbiología General Carrera: Tecnicatura Universitaria en Esterilización Analista Biológico 2015 DIFERENCIA ENTRE CÉLULA PROCARIOTA Y CÉLULA EUCARIOTA Morfología
Técnicas de observación de microorganismos
 Fundamentos y técnicas de análisis microbiológicos Técnicas de observación de microorganismos - 1 Técnicas de observación de microorganismos El examen microscópico es el primer paso para el estudio de
Fundamentos y técnicas de análisis microbiológicos Técnicas de observación de microorganismos - 1 Técnicas de observación de microorganismos El examen microscópico es el primer paso para el estudio de
1ª PRÁCTICA DE MICROBIOLOGÍA:
 1ª PRÁCTICA DE MICROBIOLOGÍA: INTRODUCCIÓN A LAS TÉCNICAS DE CULTIVO EN MICROBIOLOGÍA (O COMO HACER VISIBLES ORGANISMOS INVISIBLES) INTRODUCCIÓN El objetivo de esta práctica es aislar y observar algunos
1ª PRÁCTICA DE MICROBIOLOGÍA: INTRODUCCIÓN A LAS TÉCNICAS DE CULTIVO EN MICROBIOLOGÍA (O COMO HACER VISIBLES ORGANISMOS INVISIBLES) INTRODUCCIÓN El objetivo de esta práctica es aislar y observar algunos
GUÍA DE LABORATORIO Nº 1 MEDIOS DE CULTIVO. OBJETIVO Comprender la utilidad de los medios de cultivo en el trabajo microbiológico.
 GUÍA DE LABORATORIO Nº 1 MEDIOS DE CULTIVO OBJETIVO Comprender la utilidad de los medios de cultivo en el trabajo microbiológico. MATERIALES Placas de agar sangre y agar McConkey. Tubos con agar TSI, agar
GUÍA DE LABORATORIO Nº 1 MEDIOS DE CULTIVO OBJETIVO Comprender la utilidad de los medios de cultivo en el trabajo microbiológico. MATERIALES Placas de agar sangre y agar McConkey. Tubos con agar TSI, agar
Importancia. Una de las técnicas más utilizadas en los laboratorios para clasificar microorganismos.
 Tinciones OBJETIVOS Estudiar las bases teóricas y químicas de una tinción biológica Realizar la preparación de un frotis Hacer una tinción simple Efectuar una tinción diferencial (Tinción Gram) Estudia
Tinciones OBJETIVOS Estudiar las bases teóricas y químicas de una tinción biológica Realizar la preparación de un frotis Hacer una tinción simple Efectuar una tinción diferencial (Tinción Gram) Estudia
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO )
 PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUANTITATIVO DE ORINA ANÁLISIS CUALITATIVO DE ORINA M-1 M-2 M-3 M-4 Lectura de la placa de Agar CLED Identificación presuntiva
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUANTITATIVO DE ORINA ANÁLISIS CUALITATIVO DE ORINA M-1 M-2 M-3 M-4 Lectura de la placa de Agar CLED Identificación presuntiva
EXAMEN PRACTICO NIVEL II Tema: Microbiología General
 EXAMEN PRACTICO NIVEL II Tema: Microbiología General Puntaje Total: 50 puntos Introducción Una de las principales áreas de la Microbiología es la Microbiología diagnóstica, en la cual un microbiólogo aísla
EXAMEN PRACTICO NIVEL II Tema: Microbiología General Puntaje Total: 50 puntos Introducción Una de las principales áreas de la Microbiología es la Microbiología diagnóstica, en la cual un microbiólogo aísla
2.8 Estudio microscópico de los microorganismos.
 2.8 Estudio microscópico de los microorganismos. http://es.dreamstime.com/imagenes-de-archivo-microscopio-y-bacterias-image29404744 Preparaciones Microbiológicas Preparaciones en fresco (microorganismos
2.8 Estudio microscópico de los microorganismos. http://es.dreamstime.com/imagenes-de-archivo-microscopio-y-bacterias-image29404744 Preparaciones Microbiológicas Preparaciones en fresco (microorganismos
LABORATORIO DE MICROBIOLOGÍA EXPERIMENTAL Grupo 02 (10:00 13:00 hrs) Semestre Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote
 Sema na 3 Semana 2 Semana 1 LABORATORIO DE EXPERIMENTAL Grupo 02 (10:00 13:00 hrs) Semestre 2014-1 Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote CALENDARIO DE ACTIVIDADES PROTOCOLO / UNIDAD
Sema na 3 Semana 2 Semana 1 LABORATORIO DE EXPERIMENTAL Grupo 02 (10:00 13:00 hrs) Semestre 2014-1 Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote CALENDARIO DE ACTIVIDADES PROTOCOLO / UNIDAD
Asignaturas antecedentes y subsecuentes
 PROGRAMA DE ESTUDIOS Microbiología General Área a la que pertenece: AREA SUSTANTIVA PROFESIONAL Horas teóricas: 3 Horas practicas: 3 Créditos: 9 Clave: F0219 Ninguna. Asignaturas antecedentes y subsecuentes
PROGRAMA DE ESTUDIOS Microbiología General Área a la que pertenece: AREA SUSTANTIVA PROFESIONAL Horas teóricas: 3 Horas practicas: 3 Créditos: 9 Clave: F0219 Ninguna. Asignaturas antecedentes y subsecuentes
QUÉ CONTIENE UN MEDIO? Aquellos requerimientos nutricionales que los microorganismos necesitan para crecer. Depende del ambiente en donde viven.
 OBJETIVOS u Diferenciar entre ciertos tipos de medios u Conocer actividades bioquímicas de las bacterias u Conocer los procesos bioquímicos de fermentación u Descibir los patrones de fermentación de carbohidratos
OBJETIVOS u Diferenciar entre ciertos tipos de medios u Conocer actividades bioquímicas de las bacterias u Conocer los procesos bioquímicos de fermentación u Descibir los patrones de fermentación de carbohidratos
CULTIVO DE MICROORGANISMOS MEDIOS DE CULTIVO
 CULTIVO DE MICROORGANISMOS MEDIOS DE CULTIVO CULTIVO DE MICROORGANISMOS fuente de energía exógena nutrientes esenciales: agua, carbón, nitrógeno, minerales condiciones ambientales apropiadas: ph, temperatura,
CULTIVO DE MICROORGANISMOS MEDIOS DE CULTIVO CULTIVO DE MICROORGANISMOS fuente de energía exógena nutrientes esenciales: agua, carbón, nitrógeno, minerales condiciones ambientales apropiadas: ph, temperatura,
Unidad 2. Técnicas básicas de microbiología Práctica 5. Preparaciones Microbiológicas
 Unidad 2. Técnicas básicas de microbiología Práctica 5. Preparaciones Microbiológicas Objetivos Realizar diferentes preparaciones microbiológicas a partir de muestras naturales y cultivos puros. Describir
Unidad 2. Técnicas básicas de microbiología Práctica 5. Preparaciones Microbiológicas Objetivos Realizar diferentes preparaciones microbiológicas a partir de muestras naturales y cultivos puros. Describir
Laboratorio Nacional de Salud Pública
 1. Tinción de Gram 2. Objeto y campo de aplicación La técnica de tinción de Gram se utiliza para la tinción de bacterias, levaduras y actinomicetos aerobios. Este procedimiento operativo estándar es aplicable
1. Tinción de Gram 2. Objeto y campo de aplicación La técnica de tinción de Gram se utiliza para la tinción de bacterias, levaduras y actinomicetos aerobios. Este procedimiento operativo estándar es aplicable
Tema 2.- Tinciones Bacteriológicas
 Tema 2.- Tinciones Bacteriológicas El contraste en una observación microscópica da cuenta de la diferencia de intensidad entre el objeto y el medio. Sin embargo, la mayoría de los microorganismos son prácticamente
Tema 2.- Tinciones Bacteriológicas El contraste en una observación microscópica da cuenta de la diferencia de intensidad entre el objeto y el medio. Sin embargo, la mayoría de los microorganismos son prácticamente
TECNICAS DE VISUALIZACIÓN MICROSCOPICA DE MICROORGANISMOS
 ISSN 1988-6047 DEP. LEGAL: GR 2922/2007 Nº 11 OCTUBRE DE 2008 TECNICAS DE VISUALIZACIÓN MICROSCOPICA DE MICROORGANISMOS AUTORIA ROSARIO ALORS CORREDERAS TEMÁTICA MICROBIOLOGÍA ETAPA FORMACIÓN PROFESIONAL
ISSN 1988-6047 DEP. LEGAL: GR 2922/2007 Nº 11 OCTUBRE DE 2008 TECNICAS DE VISUALIZACIÓN MICROSCOPICA DE MICROORGANISMOS AUTORIA ROSARIO ALORS CORREDERAS TEMÁTICA MICROBIOLOGÍA ETAPA FORMACIÓN PROFESIONAL
PROCEDIMIENTO DETECCIÓN Y ENUMERACIÓN POR NUMERO MAS PROBABLE (NMP) CON ETAPA DE PRE- ENRIQUECIMIENTO DE ENTEROBACTERIACEAE EN ALIMENTOS
 Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
Sistema Integrado de Gestión GUÍA PRÁCTICA N 11
 Sistema Integrado de Gestión GUÍA PRÁCTICA N 11 PREPARACIÓN DE EXTENDIDOS Y TÉCNICAS DE TINCIÓN PROGRAMA DE Versión 3 Código: IV.4.1.19.03.16 Proceso: Investigación IV Febrero de 2016 Página 2 de 9 1.
Sistema Integrado de Gestión GUÍA PRÁCTICA N 11 PREPARACIÓN DE EXTENDIDOS Y TÉCNICAS DE TINCIÓN PROGRAMA DE Versión 3 Código: IV.4.1.19.03.16 Proceso: Investigación IV Febrero de 2016 Página 2 de 9 1.
PRACTICA Núm. 6 TINCION DE FLAGELOS BACTERIANOS POR EL METODO DE LEIFSON
 PRACTICA Núm. 6 TINCION DE FLAGELOS BACTERIANOS POR EL METODO DE LEIFSON I. OBJETIVO Demostrar la presencia de flagelos mediante tinción y observar la movilidad que presentan algunas bacterias diferenciándola
PRACTICA Núm. 6 TINCION DE FLAGELOS BACTERIANOS POR EL METODO DE LEIFSON I. OBJETIVO Demostrar la presencia de flagelos mediante tinción y observar la movilidad que presentan algunas bacterias diferenciándola
PRACTICA 2 TINCION DE GRAM
 PRACTICA 2 TINCION DE GRAM OBJETIVOS DE APRENDIZAJE: Cuando haya completado este experimento, usted debe comprender: 1. La base teórica y química de los procedimientos de tinción diferencial. 2. La base
PRACTICA 2 TINCION DE GRAM OBJETIVOS DE APRENDIZAJE: Cuando haya completado este experimento, usted debe comprender: 1. La base teórica y química de los procedimientos de tinción diferencial. 2. La base
AISLAMIENTO DE MICROORGANISMOS
 PRÁCTICA5 AISLAMIENTO DE MICROORGANISMOS Introducción En la naturaleza, la mayoría de los microorganismos no se encuentran aislados, sino integrados en poblaciones mixtas. Para llevar a cabo el estudio
PRÁCTICA5 AISLAMIENTO DE MICROORGANISMOS Introducción En la naturaleza, la mayoría de los microorganismos no se encuentran aislados, sino integrados en poblaciones mixtas. Para llevar a cabo el estudio
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR
 UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR Catedrático: Dra. Ana Olivia cañas Urbina. PRACTICA No. 3: TINCIONES Equipo:
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR Catedrático: Dra. Ana Olivia cañas Urbina. PRACTICA No. 3: TINCIONES Equipo:
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA
 PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
Unidad 5. Técnicas de aislamiento de microorganismos Práctica 6. Técnicas de aislamiento de microorganismos.
 Unidad 5. Técnicas de aislamiento de microorganismos Práctica 6. Técnicas de aislamiento de microorganismos. Objetivos Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación
Unidad 5. Técnicas de aislamiento de microorganismos Práctica 6. Técnicas de aislamiento de microorganismos. Objetivos Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación
PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA: BACTERIOLOGÍA Y MICOLOGÍA
 PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA: BACTERIOLOGÍA Y MICOLOGÍA Mª PAZ MERINO JIMÉNEZ MIREIA LLINARES MARCELO PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA: BACTERIOLOGÍA Y MICOLOGÍA A mi padre. M.
PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA: BACTERIOLOGÍA Y MICOLOGÍA Mª PAZ MERINO JIMÉNEZ MIREIA LLINARES MARCELO PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA: BACTERIOLOGÍA Y MICOLOGÍA A mi padre. M.
Unidad 2. Técnicas básicas de microbiología Práctica 3. Preparaciones Microbiológicas
 Unidad 2. Técnicas básicas de microbiología Práctica 3. Preparaciones Microbiológicas Objetivos Realizar diferentes preparaciones microbiológicas a partir de muestras naturales y cultivos puros. Describir
Unidad 2. Técnicas básicas de microbiología Práctica 3. Preparaciones Microbiológicas Objetivos Realizar diferentes preparaciones microbiológicas a partir de muestras naturales y cultivos puros. Describir
Bacterias, Arqueas y una introducción a las tinciones bacterianas. Dr. Héctor L. Ayala del Río UPRH-BIOL3707. Organizando la Diversidad 5 Reinos
 Bacterias, Arqueas y una introducción a las tinciones bacterianas Dr. Héctor L. Ayala del Río UPRH-BIOL3707 Organizando la Diversidad 5 Reinos 1 Célula Eucariota Célula Procariota 2 Microbiología Acelulares
Bacterias, Arqueas y una introducción a las tinciones bacterianas Dr. Héctor L. Ayala del Río UPRH-BIOL3707 Organizando la Diversidad 5 Reinos 1 Célula Eucariota Célula Procariota 2 Microbiología Acelulares
PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE
 PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE I. OBJETIVO Conocer el procedimiento para preparar extensiones ó frotis y los diferentes métodos de tinción, así como su utilidad
PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE I. OBJETIVO Conocer el procedimiento para preparar extensiones ó frotis y los diferentes métodos de tinción, así como su utilidad
PROCEDIMIENTO TECNICA NMP STAPHYLOCOCCUS AUREUS EN ALIMENTOS. BAM ONLINE 2001
 PRT-712.02-025 Página 1 de 9 1. OBJETIVO Estimar la densidad de bacterias S. aureus en matrices de alimento o agua como indicador sanitario 2. CAMPO DE APLICACIÓN Y ALCANCE El método de NMP es recomendado
PRT-712.02-025 Página 1 de 9 1. OBJETIVO Estimar la densidad de bacterias S. aureus en matrices de alimento o agua como indicador sanitario 2. CAMPO DE APLICACIÓN Y ALCANCE El método de NMP es recomendado
PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA GENERAL Trimestre 14-I
 PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA GENERAL Trimestre 14-I P # 1 P # 2 P # 3 P # 4 P # 5 P # 6 Uso y cuidados en el manejo del Microscopio Esterilización de materiales y medios Técnicas de Tinción
PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA GENERAL Trimestre 14-I P # 1 P # 2 P # 3 P # 4 P # 5 P # 6 Uso y cuidados en el manejo del Microscopio Esterilización de materiales y medios Técnicas de Tinción
PRÁCTICA 5. Aislamiento de Microorganismos (1ª Sesión)
 PRÁCTICA 5. Aislamiento de Microorganismos (1ª Sesión) Objetivos Al finalizar esta práctica el alumno será capaz de: Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación para
PRÁCTICA 5. Aislamiento de Microorganismos (1ª Sesión) Objetivos Al finalizar esta práctica el alumno será capaz de: Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación para
Cultivo Puro. Técnicas de aislamiento Mantenimiento y preservación de cultivos puros Morfología macroscópica Morfología microscópica
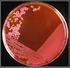 Cultivo Puro Técnicas de aislamiento Mantenimiento y preservación de cultivos puros Morfología macroscópica Morfología microscópica Definición El cultivo puro representa las condiciones artificiales para
Cultivo Puro Técnicas de aislamiento Mantenimiento y preservación de cultivos puros Morfología macroscópica Morfología microscópica Definición El cultivo puro representa las condiciones artificiales para
RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO
 RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO Fundamento Los alimentos se diferencian entre sí por las sustancias o principios inmediatos que contienen y por la cantidad de cada uno
RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO Fundamento Los alimentos se diferencian entre sí por las sustancias o principios inmediatos que contienen y por la cantidad de cada uno
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 1 TRABAJO PRÁCTICO No. 8 ENTEROBACTERIAS OBJETIVOS 1. Identificar las características morfológicas y tintoreales a partir frotis teñidos con el método de Gram. 2. Desarrollar los criterios necesarios para
1 TRABAJO PRÁCTICO No. 8 ENTEROBACTERIAS OBJETIVOS 1. Identificar las características morfológicas y tintoreales a partir frotis teñidos con el método de Gram. 2. Desarrollar los criterios necesarios para
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 1 Bacteriología Veterinaria. TRABAJO PRÁCTICO No. 1 PRIMER PERIODO MICROSCOPÍA Y MORFOLOGÍA DE BACTERIAS OBJETIVOS 1. Manipular correctamente cada una de las partes del microscopio compuesto de campo claro.
1 Bacteriología Veterinaria. TRABAJO PRÁCTICO No. 1 PRIMER PERIODO MICROSCOPÍA Y MORFOLOGÍA DE BACTERIAS OBJETIVOS 1. Manipular correctamente cada una de las partes del microscopio compuesto de campo claro.
Taxonomía bacteriana
 Página 1 Unidad Temática 5 Taxonomía bacteriana (Guía de estudio) Benintende, S; Sánchez, C., Sterren, M. Y Musante, C Objetivo El objetivo de la Taxonomía bacteriana es dar un ordenamiento de las unidades
Página 1 Unidad Temática 5 Taxonomía bacteriana (Guía de estudio) Benintende, S; Sánchez, C., Sterren, M. Y Musante, C Objetivo El objetivo de la Taxonomía bacteriana es dar un ordenamiento de las unidades
LABORATORIO DE MICROBIOLOGÍA EXPERIMENTAL Grupo 2 (10:00 13:00 hrs) Semestre Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote
 Semana 2 Semana 1 LABORATORIO DE EXPERIMENTAL Grupo 2 (10:00 13:00 hrs) Semestre 2013-2 Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote CALENDARIO DE ACTIVIDADES UNIDAD Lunes 28 ENERO Miércoles
Semana 2 Semana 1 LABORATORIO DE EXPERIMENTAL Grupo 2 (10:00 13:00 hrs) Semestre 2013-2 Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote CALENDARIO DE ACTIVIDADES UNIDAD Lunes 28 ENERO Miércoles
Tema I Introducción al estudio de los agentes biológicos de importancia médica. Metabolismo, nutrición, cultivo y crecimiento microbiano
 Tema I Introducción al estudio de los agentes biológicos de importancia médica. Metabolismo, nutrición, cultivo y crecimiento microbiano Objetivos Explicar los principios generales del metabolismo microbiano.
Tema I Introducción al estudio de los agentes biológicos de importancia médica. Metabolismo, nutrición, cultivo y crecimiento microbiano Objetivos Explicar los principios generales del metabolismo microbiano.
Objetivos. S Determinar la presencia de bacterias coliformes en una muestra de agua
 Análisis del agua S Objetivos S Determinar la presencia de bacterias coliformes en una muestra de agua Introducción S Las tres pruebas básicas para determinar la presencia de bacterias coliformes (asociada
Análisis del agua S Objetivos S Determinar la presencia de bacterias coliformes en una muestra de agua Introducción S Las tres pruebas básicas para determinar la presencia de bacterias coliformes (asociada
o Solución de KOH al 0,01% Disolver el colorante en el alcohol, y añadir la solución de KOH
 OBSERVACIÓN DE LAS BACTERIAS TINCIÓN SENCILLA 1.- Material necesario Cultivo bacteriano de 24 horas, en medio sólido Portaobjetos limpios y desengrasados Frasco lavador con agua de grifo o destilada Asa
OBSERVACIÓN DE LAS BACTERIAS TINCIÓN SENCILLA 1.- Material necesario Cultivo bacteriano de 24 horas, en medio sólido Portaobjetos limpios y desengrasados Frasco lavador con agua de grifo o destilada Asa
Título de la gráfica: Crecimiento/ No crecimiento
 Resultados de la semana anterior (TSB) Título de la gráfica: # tubo TSB 1-24 Crecimiento/ No crecimiento Descripción del crecimiento Resultados de la semana anterior (TSA slant) Título de la gráfica: tubo
Resultados de la semana anterior (TSB) Título de la gráfica: # tubo TSB 1-24 Crecimiento/ No crecimiento Descripción del crecimiento Resultados de la semana anterior (TSA slant) Título de la gráfica: tubo
PRACTICA N 02: PROCESOS FERMENTATIVOS: PRODUCCION DE PROTEÍNA UNICELULAR O BIOMASA
 PRACTICA N 02: PROCESOS FERMENTATIVOS: PRODUCCION DE PROTEÍNA UNICELULAR O BIOMASA Capacidades a lograr: 1. Conoce y aplica técnicas de siembra, cultivo y cuantificación del proceso fermentativo para producción
PRACTICA N 02: PROCESOS FERMENTATIVOS: PRODUCCION DE PROTEÍNA UNICELULAR O BIOMASA Capacidades a lograr: 1. Conoce y aplica técnicas de siembra, cultivo y cuantificación del proceso fermentativo para producción
Ejercicio 5 Actividades Bioquímicas En Bacterias
 Objetivos Ejercicio 5 Actividades Bioquímicas En Bacterias Entender los procesos bioquímicos de distintas reacciones enzimáticas como son las fermentaciones e hidrólisis. Describir el patrón de las reacciones
Objetivos Ejercicio 5 Actividades Bioquímicas En Bacterias Entender los procesos bioquímicos de distintas reacciones enzimáticas como son las fermentaciones e hidrólisis. Describir el patrón de las reacciones
PREPARACION DE MEDIOS DE CULTIVO
 PREPARACION DE MEDIOS DE CULTIVO MEDIOS DE CULTIVO Un medio de cultivo es un conjunto de nutrientes, factores de crecimiento y otros componentes que crean las condiciones necesarias para el desarrollo
PREPARACION DE MEDIOS DE CULTIVO MEDIOS DE CULTIVO Un medio de cultivo es un conjunto de nutrientes, factores de crecimiento y otros componentes que crean las condiciones necesarias para el desarrollo
Laboratorio de Microbiología General
 PRÁCTICA No. 3 Preparaciones microscópicas y tinciones OBJETIVOS Introducir a los estudiantes en los fundamentos, utilidades y procedimientos aplicados a las tinciones bacterianas, para la observación
PRÁCTICA No. 3 Preparaciones microscópicas y tinciones OBJETIVOS Introducir a los estudiantes en los fundamentos, utilidades y procedimientos aplicados a las tinciones bacterianas, para la observación
En la naturaleza los microorganismos se encuentran en poblaciones mixtas de varios tipos. Para todos los estudios llevados a cabo en el laboratorio
 En la naturaleza los microorganismos se encuentran en poblaciones mixtas de varios tipos. Para todos los estudios llevados a cabo en el laboratorio de microbiología se requiere un cultivo axénico, es decir,
En la naturaleza los microorganismos se encuentran en poblaciones mixtas de varios tipos. Para todos los estudios llevados a cabo en el laboratorio de microbiología se requiere un cultivo axénico, es decir,
Microbiología. Carrera: PEN 0625
 1.- DATOS DE LA ASIGNATURA Nombre de la asignatura: Carrera: Clave de la asignatura: Horas teoría-horas práctica-créditos Microbiología Ingeniería en Pesquerías PEN 0625 3 3 9 2.- HISTORIA DEL PROGRAMA
1.- DATOS DE LA ASIGNATURA Nombre de la asignatura: Carrera: Clave de la asignatura: Horas teoría-horas práctica-créditos Microbiología Ingeniería en Pesquerías PEN 0625 3 3 9 2.- HISTORIA DEL PROGRAMA
Explique el significado de los términos magnificación, resolución y apertura numérica. Cuál es su importancia en microscopía?
 Fecha: dd / mm / aa Datos alumno Nombre: Informe de laboratorio Prácticas 2, 3, 4 y 5 PDF para impresión 1. Preguntas Explique el significado de los términos magnificación, resolución y apertura numérica.
Fecha: dd / mm / aa Datos alumno Nombre: Informe de laboratorio Prácticas 2, 3, 4 y 5 PDF para impresión 1. Preguntas Explique el significado de los términos magnificación, resolución y apertura numérica.
Laboratorio: Deteccio n de biomole culas orga nicas (Carbohidratos, Proteí nas, Grasas)
 Laboratorio: Deteccio n de biomole culas orga nicas (Carbohidratos, Proteí nas, Grasas) Introducción Las biomoléculas son las moléculas constituyentes de los seres vivos. Los seis elementos o bioelementos
Laboratorio: Deteccio n de biomole culas orga nicas (Carbohidratos, Proteí nas, Grasas) Introducción Las biomoléculas son las moléculas constituyentes de los seres vivos. Los seis elementos o bioelementos
Carrera: Químico Farmacobiólogo. Asignatura: Microbiología General. Área del Conocimiento: Microbiología General. Licenciatura Químico Farmacobiólogo
 Carrera: Químico Farmacobiólogo Asignatura: Microbiología General Área del Conocimiento: Generales de la Asignatura: Nombre de la Asignatura: Clave Asignatura: Nivel: Carrera: Frecuencia (h/semana) Teoría:
Carrera: Químico Farmacobiólogo Asignatura: Microbiología General Área del Conocimiento: Generales de la Asignatura: Nombre de la Asignatura: Clave Asignatura: Nivel: Carrera: Frecuencia (h/semana) Teoría:
BIORREACTRES. Estudios básicos y aplicados sobre procesos de fermentación
 BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
LICENCIATURA DE QUÍMICO EN ALIMENTOS. Microbiología General I. Tipo de Asignatura: Teórico-Práctico Área de Conocimiento: Básica de Carrera
 LICENCIATURA DE QUÍMICO EN ALIMENTOS Microbiología General I Tipo de Asignatura: Teórico-Práctico Área de Conocimiento: Básica de Carrera 111 1. DATOS GENERALES DE IDENTIFICACIÓN Nombre de la asignatura
LICENCIATURA DE QUÍMICO EN ALIMENTOS Microbiología General I Tipo de Asignatura: Teórico-Práctico Área de Conocimiento: Básica de Carrera 111 1. DATOS GENERALES DE IDENTIFICACIÓN Nombre de la asignatura
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO )
 PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUALITATIVO DE ORINA PRUEBA DE BAUER KIRBY (ANTIBIOGRAMA) PRUEBA DE EPSILON (DETERMINACIÓN DE LA CMI) ANÁLISIS CUALITATIVO
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUALITATIVO DE ORINA PRUEBA DE BAUER KIRBY (ANTIBIOGRAMA) PRUEBA DE EPSILON (DETERMINACIÓN DE LA CMI) ANÁLISIS CUALITATIVO
LABORATORIO 8. REINO MÓNERA OBSERVACIÓN DE BACTERIAS COLORACIÓN DE GRAM
 LABORATORIO 8. REINO MÓNERA OBSERVACIÓN DE BACTERIAS COLORACIÓN DE GRAM Profesor: Luis Francisco Moreno B. Biólogo, M. Sc. Biología. El reino mónera es el grupo de microorganismos más pequeño que se puede
LABORATORIO 8. REINO MÓNERA OBSERVACIÓN DE BACTERIAS COLORACIÓN DE GRAM Profesor: Luis Francisco Moreno B. Biólogo, M. Sc. Biología. El reino mónera es el grupo de microorganismos más pequeño que se puede
MEDIOS DE CULTIVO Y TINCIÓN DE GRAM
 MEDIOS DE CULTIVO Y TINCIÓN DE GRAM AUTORIA AZAHARA CABRERA ORTEGA TEMÁTICA PRÁCTICAS ETAPA EDUCACIÓN SECUNDARIA POSTOBLIGATORIA Resumen Tanto los medios de cultivo como la realización de tinciones de
MEDIOS DE CULTIVO Y TINCIÓN DE GRAM AUTORIA AZAHARA CABRERA ORTEGA TEMÁTICA PRÁCTICAS ETAPA EDUCACIÓN SECUNDARIA POSTOBLIGATORIA Resumen Tanto los medios de cultivo como la realización de tinciones de
FICHAS DE PRÁCTICAS DE BIOLOGÍA 4º ESO BIOLOGÍA
 FICHAS DE PRÁCTICAS DE BIOLOGÍA 4º ESO BIOLOGÍA UNIDAD DIDÁCTICA : CÉLULAS Y TEJIDOS 01.- Células animales y vegetales Duración Estimada: 1h 40 min Capacidad Terminal Observación de células animales y
FICHAS DE PRÁCTICAS DE BIOLOGÍA 4º ESO BIOLOGÍA UNIDAD DIDÁCTICA : CÉLULAS Y TEJIDOS 01.- Células animales y vegetales Duración Estimada: 1h 40 min Capacidad Terminal Observación de células animales y
Microbiología. Trabajo Práctico 3. Cultivo e identificación de bacterias. GRACIELA NATALIA PUCCI
 Microbiología Trabajo Práctico 3. Cultivo e identificación de bacterias. GRACIELA NATALIA PUCCI Objetivos: Reconocer los distintos medios de cultivo utilizados para la recuperación de bacterias, y comprender
Microbiología Trabajo Práctico 3. Cultivo e identificación de bacterias. GRACIELA NATALIA PUCCI Objetivos: Reconocer los distintos medios de cultivo utilizados para la recuperación de bacterias, y comprender
Morfología Agua peptonada. 37 C/ h. investigar: Agar Salmonella. Bacilos gran Shigella. negativos, con Agar Xilosa Lactosa selectivos
 Práctica No. 7 Nombre la práctica: Método para la terminación Salmonella en alimentos Objetivo: Intificación Salmonella en una muestra carne NOM: NOM-114-SSA1-1994 Muestra utilizada: Carne picada Características
Práctica No. 7 Nombre la práctica: Método para la terminación Salmonella en alimentos Objetivo: Intificación Salmonella en una muestra carne NOM: NOM-114-SSA1-1994 Muestra utilizada: Carne picada Características
Objetivo Describir el efecto de los factores ambientales, su concentración, así como de agentes químicos en el crecimiento de los microorganismos.
 Unidad 8. Condiciones ambientales para el desarrollo, inhibición y destrucción de microorganismos. Práctica 8. Crecimiento Microbiano. Efecto de los factores ambientales y químicos Objetivo Describir el
Unidad 8. Condiciones ambientales para el desarrollo, inhibición y destrucción de microorganismos. Práctica 8. Crecimiento Microbiano. Efecto de los factores ambientales y químicos Objetivo Describir el
PRÁCTICA 2.2 Preparaciones Microbiológicas
 PRÁCTICA 2.2 Preparaciones Microbiológicas 2.2.1 Preparaciones húmedas 2.2.2 Gota pendiente 2.2.3 Preparaciones fijas 2.2.4 Tinción simple Objetivos Al finalizar esta práctica el alumno será capaz de:
PRÁCTICA 2.2 Preparaciones Microbiológicas 2.2.1 Preparaciones húmedas 2.2.2 Gota pendiente 2.2.3 Preparaciones fijas 2.2.4 Tinción simple Objetivos Al finalizar esta práctica el alumno será capaz de:
1. LEVINE EMB AGAR FOTO 6. Medios de cultivo Levine EMG Agar.
 1. LEVINE EMB AGAR. El Agar EMB Levine es un medio selectivo y diferencial, adecuado para el crecimiento de Enterobacterias. Es un medio adecuado para la búsqueda y diferenciación de bacilos entéricos,
1. LEVINE EMB AGAR. El Agar EMB Levine es un medio selectivo y diferencial, adecuado para el crecimiento de Enterobacterias. Es un medio adecuado para la búsqueda y diferenciación de bacilos entéricos,
Fabricante ROSCO Diagnostica A/S, Taastrupgaardsvej 30, DK-2630 Taastrup, Denmark,
 Diatabs - Instrucciones de uso Revisión: DBV0008B Fecha de publicación: 12.04.2013 Idioma: Español Diatabs Para la identificación bacteriana Fabricante ROSCO Diagnostica A/S, Taastrupgaardsvej 30, DK-2630
Diatabs - Instrucciones de uso Revisión: DBV0008B Fecha de publicación: 12.04.2013 Idioma: Español Diatabs Para la identificación bacteriana Fabricante ROSCO Diagnostica A/S, Taastrupgaardsvej 30, DK-2630
AISLAMIENTO Y CARACTERIZACIÓN MORFOLÓGICA DE LA BACTERIA Leuconostoc mesenteroides DEL JUGO DE LA CAÑA DE AZÚCAR EN EL SUR DE TAMAULIPAS.
 AISLAMIENTO Y CARACTERIZACIÓN MORFOLÓGICA DE LA BACTERIA Leuconostoc mesenteroides DEL JUGO DE LA CAÑA DE AZÚCAR EN EL SUR DE TAMAULIPAS. ISOLATION AND MORPHOLOGICAL CHARACTERIZATION OF THE BACTERIA Leuconostoc
AISLAMIENTO Y CARACTERIZACIÓN MORFOLÓGICA DE LA BACTERIA Leuconostoc mesenteroides DEL JUGO DE LA CAÑA DE AZÚCAR EN EL SUR DE TAMAULIPAS. ISOLATION AND MORPHOLOGICAL CHARACTERIZATION OF THE BACTERIA Leuconostoc
Unidad 6. Nutrición microbiana y caracterización de bacterias. Práctica 9 Metabolismo de bacterias.
 Unidad 6. Nutrición microbiana y caracterización de bacterias. Práctica 9 Metabolismo de bacterias. Objetivos Relacionar la actividad metabólica de los microorganismos con los cambios producidos en diferentes
Unidad 6. Nutrición microbiana y caracterización de bacterias. Práctica 9 Metabolismo de bacterias. Objetivos Relacionar la actividad metabólica de los microorganismos con los cambios producidos en diferentes
Materiales. Cultivos puros de bacterias: Streptomyces griseus Streptomyces erythraeus
 Unidad 3. Estudio de cultivos bacterianos puros y Unidad 4. Estudio microscópico y cultivo de hongos, algas y protozoarios Práctica 6. Técnicas de siembra y cultivo de actinomicetos y hongos Objetivos
Unidad 3. Estudio de cultivos bacterianos puros y Unidad 4. Estudio microscópico y cultivo de hongos, algas y protozoarios Práctica 6. Técnicas de siembra y cultivo de actinomicetos y hongos Objetivos
Laboratorio de Agroindustria II. Calidad de Leche
 Laboratorio de Agroindustria II. Calidad de Leche Medio de cultivo: Caldo lactosado biliado verde brillante (Brilliant Green Bile Lactose: BGBL) Composición - Peptona 10 g. - Lactosa 10 g. - Bilis de buey
Laboratorio de Agroindustria II. Calidad de Leche Medio de cultivo: Caldo lactosado biliado verde brillante (Brilliant Green Bile Lactose: BGBL) Composición - Peptona 10 g. - Lactosa 10 g. - Bilis de buey
PRÁCTICA No. 5 BASE QUIMICA DE LA VIDA
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA ESCUELA DE FORMACION DE PROFESORES DE ENSEÑANZA MEDIA-EFPEM- CURSO: BIOLOGÍA I I. INTRODUCCIÓN PRÁCTICA No. 5 BASE QUIMICA DE LA VIDA Los organismos vivos estamos
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA ESCUELA DE FORMACION DE PROFESORES DE ENSEÑANZA MEDIA-EFPEM- CURSO: BIOLOGÍA I I. INTRODUCCIÓN PRÁCTICA No. 5 BASE QUIMICA DE LA VIDA Los organismos vivos estamos
Estudio microscópico de microorganismos
 Estudio microscópico de microorganismos Facultad de Ciencias U.A.E.M. Licenciatura en Biotecnología Microbiología General Segundo semestre M. C. Laura Alejandra Sánchez Paz Ciclo 2017A Objetivo general
Estudio microscópico de microorganismos Facultad de Ciencias U.A.E.M. Licenciatura en Biotecnología Microbiología General Segundo semestre M. C. Laura Alejandra Sánchez Paz Ciclo 2017A Objetivo general
Instructivo de Laboratorio. Cocos Piógenos
 Universidad de San Carlos de Guatemala Facultad de Ciencias Médicas Curso de Inmunología y Microbiología Tercer año, Fase II Instructivo de Laboratorio Cocos Piógenos Dra. Débora Esmeralda Aldana Introducción:
Universidad de San Carlos de Guatemala Facultad de Ciencias Médicas Curso de Inmunología y Microbiología Tercer año, Fase II Instructivo de Laboratorio Cocos Piógenos Dra. Débora Esmeralda Aldana Introducción:
Instructivo de Laboratorio. Cocos Piógenos
 Universidad de San Carlos de Guatemala Facultad de Ciencias Médicas Curso de Inmunología y Microbiología Tercer año, Fase II Instructivo de Laboratorio Cocos Piógenos Dra. Débora Esmeralda Aldana Introducción:
Universidad de San Carlos de Guatemala Facultad de Ciencias Médicas Curso de Inmunología y Microbiología Tercer año, Fase II Instructivo de Laboratorio Cocos Piógenos Dra. Débora Esmeralda Aldana Introducción:
UNIVERSIDAD AUTÓNOMA CHAPINGO DEPARTAMENTO DE INGENIERÍA AGROINDUSTRIAL FICHA CURRICULAR
 UNIVERSIDAD AUTÓNOMA CHAPINGO DEPARTAMENTO DE INGENIERÍA AGROINDUSTRIAL FICHA CURRICULAR 1. Datos Generales: Departamento Nombre del Programa Licenciatura Línea curricular Tecnológica Asignatura Biología
UNIVERSIDAD AUTÓNOMA CHAPINGO DEPARTAMENTO DE INGENIERÍA AGROINDUSTRIAL FICHA CURRICULAR 1. Datos Generales: Departamento Nombre del Programa Licenciatura Línea curricular Tecnológica Asignatura Biología
Varios tipos de microorganismos crecen en la piel, especialmente en los pliegues y partes húmedas asociadas a las glándulas sudoríparas.
 ACCIÓN GERMICIDA POR QUÉ NECESITAMOS DESODORANTES? Varios tipos de microorganismos crecen en la piel, especialmente en los pliegues y partes húmedas asociadas a las glándulas sudoríparas. Su actividad
ACCIÓN GERMICIDA POR QUÉ NECESITAMOS DESODORANTES? Varios tipos de microorganismos crecen en la piel, especialmente en los pliegues y partes húmedas asociadas a las glándulas sudoríparas. Su actividad
MANUAL DE PREPARACIÓN DE REACTIVOS
 MOP-SIB-3 DIRECCIÓN DE INVESTIGACIÓN Fecha: JUN 5 Hoja: de MANUAL DE PREPARACIÓN DE REACTIVOS Elaboró: Autorizó: Puesto QUÍMICO JEFE DE LABORATORIO Firma F0-SGC-0 Rev.2 MOP-SIB-3 DIRECCIÓN DE INVESTIGACIÓN
MOP-SIB-3 DIRECCIÓN DE INVESTIGACIÓN Fecha: JUN 5 Hoja: de MANUAL DE PREPARACIÓN DE REACTIVOS Elaboró: Autorizó: Puesto QUÍMICO JEFE DE LABORATORIO Firma F0-SGC-0 Rev.2 MOP-SIB-3 DIRECCIÓN DE INVESTIGACIÓN
GRUPOS MICROBIANOS BACTERIAS PROTOZOOS ALGAS
 MEDIOS DE CULTIVO GRUPOS MICROBIANOS BACTERIAS LEVADURAS MOHOS PROTOZOOS ALGAS NUTRIMENTOS Material celular Generar energía Metabolismo adecuado Elementos importantes en los sistemas biológicos APPLIED
MEDIOS DE CULTIVO GRUPOS MICROBIANOS BACTERIAS LEVADURAS MOHOS PROTOZOOS ALGAS NUTRIMENTOS Material celular Generar energía Metabolismo adecuado Elementos importantes en los sistemas biológicos APPLIED
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS LABORATORIO DE BIOLOGIA CELULAR. PRACTICA No. 3 TINCIONES
 UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS LABORATORIO DE BIOLOGIA CELULAR PRACTICA No. 3 TINCIONES Alumnos(as): Karla Ayde Sánchez Guillen Erika Vanessa Molina Murillo Yatzeny Gpe.
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS LABORATORIO DE BIOLOGIA CELULAR PRACTICA No. 3 TINCIONES Alumnos(as): Karla Ayde Sánchez Guillen Erika Vanessa Molina Murillo Yatzeny Gpe.
ENUMERACIÓN DE ENTEROBACTERIACEAE EN ALIMENTOS SIN RESUSCITACIÓN. TÉCNICA RECUENTO EN PLACA
 PRT-712.03-040 Página 1 de 6 1. OBJETIVO Determinar el número de Enterobactereaceae presentes en un alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos
PRT-712.03-040 Página 1 de 6 1. OBJETIVO Determinar el número de Enterobactereaceae presentes en un alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS
 PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
NMP PARA LA DETERMINACION DE COLIFORMESY COLIFORMES FECALES EN AGUAS
 PRT-712.03-005 Página 1 de 6 1. OBJETIVO Este método es utilizado para estimar la densidad de bacterias del grupo coliformes y conocer la calidad sanitaria en aguas crudas 2. CAMPO DE APLICACIÓN Y ALCANCE
PRT-712.03-005 Página 1 de 6 1. OBJETIVO Este método es utilizado para estimar la densidad de bacterias del grupo coliformes y conocer la calidad sanitaria en aguas crudas 2. CAMPO DE APLICACIÓN Y ALCANCE
TRABAJO PRÁCTICO N 2 MEDIOS DE CULTIVO SIEMBRA Y TRANSPLANTE. Lic.Soria Josè
 TRABAJO PRÁCTICO N 2 MEDIOS DE CULTIVO SIEMBRA Y TRANSPLANTE Lic.Soria Josè MEDIOS DE CULTIVO. Definición: es toda preparación artificial, sólida, semisólida o líquida que suministra al microorganismo
TRABAJO PRÁCTICO N 2 MEDIOS DE CULTIVO SIEMBRA Y TRANSPLANTE Lic.Soria Josè MEDIOS DE CULTIVO. Definición: es toda preparación artificial, sólida, semisólida o líquida que suministra al microorganismo
UNIVERSIDAD JUAREZ AUTONOMA DE TABASCO DIVISIÓN ACADEMICA DE CIENCIAS BIOLOGICAS LICENCIATURA EN ECOLOGIA
 UNIVERSIDAD JUAREZ AUTONOMA TABASCO DIVISIÓN ACAMICA CIENCIAS BIOLOGICAS LICENCIATURA EN ECOLOGIA ASIGNATURA: MICROBIOLOGÍA AREA : SUSTANTIVA PROFESIONAL HORAS TEÓRICAS: 2 HORAS PRÁCTICAS: 4 CRÉDITOS:
UNIVERSIDAD JUAREZ AUTONOMA TABASCO DIVISIÓN ACAMICA CIENCIAS BIOLOGICAS LICENCIATURA EN ECOLOGIA ASIGNATURA: MICROBIOLOGÍA AREA : SUSTANTIVA PROFESIONAL HORAS TEÓRICAS: 2 HORAS PRÁCTICAS: 4 CRÉDITOS:
Facultad de Ciencias
 Facultad de Ciencias Grado en Química GUÍA DOCENTE DE LA ASIGNATURA: Análisis Microbiológico Curso Académico 2016-2017 Fecha de la última modificación: 11-09-2017 Fecha: 27-07-2016 1. Datos Descriptivos
Facultad de Ciencias Grado en Química GUÍA DOCENTE DE LA ASIGNATURA: Análisis Microbiológico Curso Académico 2016-2017 Fecha de la última modificación: 11-09-2017 Fecha: 27-07-2016 1. Datos Descriptivos
UNIVERSIDAD AUTONOMA DE TAMAULIPAS
 R-RS-01-25-03 UNIVERSIDAD AUTONOMA DE TAMAULIPAS UNIDAD ACADÉMICA MULTIDISCIPLINARIA REYNOSA-AZTLÁN NOMBRE DE LA CARRERA LICENCIADO EN NUTRICION Y CIENCIA DE LOS ALIMENTOS NOMBRE DE LA ASIGNATURA LABORATORIO
R-RS-01-25-03 UNIVERSIDAD AUTONOMA DE TAMAULIPAS UNIDAD ACADÉMICA MULTIDISCIPLINARIA REYNOSA-AZTLÁN NOMBRE DE LA CARRERA LICENCIADO EN NUTRICION Y CIENCIA DE LOS ALIMENTOS NOMBRE DE LA ASIGNATURA LABORATORIO
Programa BIO 252 Biología de Microorganismos
 Programa BIO 252 Biología de Microorganismos 1. Identificación 1.- Profesor : Dr. Victoriano Campos 2.- Sigla : BIO 252 3.- Créditos : 4 4.- Pre-requisitos : BIO 240 5.- Horas Teóricas : 4 6.- Horas Prácticas
Programa BIO 252 Biología de Microorganismos 1. Identificación 1.- Profesor : Dr. Victoriano Campos 2.- Sigla : BIO 252 3.- Créditos : 4 4.- Pre-requisitos : BIO 240 5.- Horas Teóricas : 4 6.- Horas Prácticas
MEDIOS DE CULTIVO. Microbiología Lic. en Biología Molecular FQBF-UNSL Marzo 2017
 MEDIOS DE CULTIVO Microbiología Lic. en Biología Molecular FQBF-UNSL Marzo 2017 PROCARIOTAS Bacterias Hongos y levaduras www.profesorenlinea.cl Cianobacterias EUCARIOTAS Protistas urbinavinos.blogspot.com
MEDIOS DE CULTIVO Microbiología Lic. en Biología Molecular FQBF-UNSL Marzo 2017 PROCARIOTAS Bacterias Hongos y levaduras www.profesorenlinea.cl Cianobacterias EUCARIOTAS Protistas urbinavinos.blogspot.com
UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I
 UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I DRAS. MARÍA LUISA ORTIZ Y ANA PEDREGOSA 1 PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA
UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I DRAS. MARÍA LUISA ORTIZ Y ANA PEDREGOSA 1 PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA
Protocolos Laboratorio de Microbiología Experimental 2014 PREPARACIONES MICROBIOLÓGICAS
 PREPARACIONES MICROBIOLÓGICAS Objetivos PREPARACIONES HÚMEDAS (EN FRESCO) Al finalizar esta práctica el alumno será capaz de: Realizar diferentes preparaciones microbiológicas a partir de muestras naturales.
PREPARACIONES MICROBIOLÓGICAS Objetivos PREPARACIONES HÚMEDAS (EN FRESCO) Al finalizar esta práctica el alumno será capaz de: Realizar diferentes preparaciones microbiológicas a partir de muestras naturales.
UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II
 UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II Maye Bernal Rivera PARTE II. LECTURA E INTERPRETACION DE LOS CULTIVOS
UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II Maye Bernal Rivera PARTE II. LECTURA E INTERPRETACION DE LOS CULTIVOS
Créditos: 6 (2 h de teoría y 2 de taller) Modalidad: Semipresencial Horas Semana: 4 Horas curso: 64. Ingeniería Química y Metalurgia
 UNIVERSIDAD DE SONORA Unidad Regional Centro División de Ingeniería Departamento Ingeniería Química y Metalurgia LICENCIATURA EN INGENIERÍA QUÍMICA Asignatura: Biotecnología de Procesos Clave: 6967 Antecedente:
UNIVERSIDAD DE SONORA Unidad Regional Centro División de Ingeniería Departamento Ingeniería Química y Metalurgia LICENCIATURA EN INGENIERÍA QUÍMICA Asignatura: Biotecnología de Procesos Clave: 6967 Antecedente:
Universidad Nacional de Ingeniería UNI Norte. Métodos de detección de contaminación microbiana
 Universidad Nacional de Ingeniería UNI Norte Curso: Un enfoque práctico para la inocuidad de los alimentos Métodos de detección de contaminación microbiana iciar el explorador Internet Explorer.lnk Facilitadoras
Universidad Nacional de Ingeniería UNI Norte Curso: Un enfoque práctico para la inocuidad de los alimentos Métodos de detección de contaminación microbiana iciar el explorador Internet Explorer.lnk Facilitadoras
