Gina Marcela Bulla Quintero Angie Mayroth Hernández Zorro. Aprobado
|
|
|
- Vicente Alcaraz Nieto
- hace 5 años
- Vistas:
Transcripción
1 Ensayo preliminar de una modificación de la técnica de microdilución propuesta por la CLSI documento M38-A, mediante el uso de 2,3,5- trifenil - tetrazolium como método alterno para la medición de viabilidad de propágulos fúngicos. Gina Marcela Bulla Quintero Angie Mayroth Hernández Zorro Aprobado Maria Ximena Rodríguez Bocanegra Directora Melva Yomary Linares Linares Codirectora PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS PROGRAMA DE MICROBIOLOGÍA INDUSTRIAL BOGOTÁ
2 Ensayo preliminar de una modificación de la técnica de microdilución propuesta por la CLSI documento M38-A, mediante el uso de 2,3,5- trifenil - tetrazolium como método alterno para la medición de viabilidad de propágulos fúngicos. Gina Marcela Bulla Quintero Angie Mayroth Hernández Zorro Maria Ximena Rodríguez Bocanegra Directora Melva Yomary Linares Linares Codirectora Nidia Alexandra Torres Jurado PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS PROGRAMA DE MICROBIOLOGÍA INDUSTRIAL BOGOTÁ
3 TABLA DE CONTENIDO PAG RESUMEN 5 1. INTRODUCCIÓN 6 2. JUSTIFICACIÓN PLANTEAMIENTO DEL PROBLEMA 7 3. MARCO TEÓRICO 8 4. OBJETIVOS METODOLOGIA Obtención de cepas microbianas Ensayos preliminares con E.coli para determinar 10 viabilidad por asimilación de 2,3,5- trifenil tetrazolium 5.3 Ensayos preliminares con hongos para determinar viabilidad 11 por asimilación de 2,3,5- trifenil tetrazolium. 5.4 Determinación de la concentración mínima requerida de 12 propágulos viables para detección de viraje de color, por asimilación de 2,3,5-trifenil-tetrazolium y resazurina. 5.5 Determinación de la longitud de onda para cuantificación de viabilidad 12 Por espectrofotometría 5.6 Evaluación de la modificación de la técnica empleando 13 terbinafina como antifúngico 6. RESULTADOS Y DISCUSIÓN Ensayos preliminares con E.coli para determinar 14 viabilidad por asimilación de 2,3,5- trifenil tetrazolium 6.2 Ensayos preliminares con hongos para determinar viabilidad 15 por asimilación de 2,3,5- trifenil tetrazolium. 6.3 Determinación de la concentración mínima requerida de propágulos viables para detección de viraje de color, por asimilación 18 de 2,3,5-trifenil-tetrazolium y resazurina. 6.4 Determinación de la longitud de onda para cuantificación de viabilidad 22 Por espectrofotometría 6.5 Evaluación de la modificación de la técnica empleando terbinafina 24 como antifúngico 3
4 7 CONCLUSIONES 31 8 RECOMENDACIONES 32 9 BIBLIOGRAFÍA 32 ANEXOS 37 4
5 RESUMEN. Objetivo. Evaluar de forma preliminar una modificación de la técnica de microdilución propuesta por la CLSI documento M38-A, mediante el uso de 2,3,5- trifenil - tetrazolium como método alterno para la medición de viabilidad de propágulos fúngicos. Metodología. Se empleó una cepa bacteriana de E.coli ATCC 25922, junto con tres cepas de Aspergillus # 1, 2 y 10, cuatro cepas de Fusarium # 8, 108, 121 y 203 y una cepa de Microsporum gypseum. Como cepas de referencia se evaluaron C. krusei ATCC 6258 y A. niger ATCC y como cepas de comparación A. flavus y A. fumigatus. Se llevaron a cabo ensayos de asimilación de 2,3,5-trifenil-tetrazolium y resazurina, en donde se evaluaron parámetros como el uso de diferentes medios de cultivo, diferentes concentraciones de inóculo, y diferentes concentraciones de terbinafina. Las condiciones de tiempo y temperatura de incubación que se manejaron en todos los ensayos fueron de 96 horas a 28 C. Resultados. En todos los ensayos se observó la asimilación de la sal de tetrazolium, la cual se evidenció por un cambio de color a rojo intenso del medio de cultivo. En cuanto a la asimilación de resazurina, esta se evidenció por un cambio de color azul hasta un color rosa intenso y en ciertos casos hasta incoloro, pasando por diferentes matices de colores. Se determinó que el medio de cultivo más adecuado en la ejecución de los ensayos fue el caldo Mueller-Hinton ya que fue en el que mejor se evidenció la asimilación tanto de la sal de tetrazolio como de la resazurina. En la evaluación de diferentes concentraciones de inóculo, no existió diferencia alguna entre la concentración de inóculo y la producción de sales de formazán, debido a que la intensidad del color se mantuvo en todas las concentraciones; caso contrario a los resultados obtenidos con resazurina ya que se evidenciaron diferentes intensidades de color. Para la cuantificación de sales de formazán se determinó una longitud de onda de 580nm y para la producción de resorufina se determinó una longitud de onda de 560nm. Finalmente, los resultados obtenidos en la evaluación de la modificación de la técnica empleando terbinafina a diferentes concentraciones, demostraron la efectividad de las sales de tetrazolium y de la resazurina al evidenciar su asimilación por medio de un cambio de color del medio. Conclusión. De acuerdo a los resultados obtenidos en los diferentes ensayos preliminares, se puede concluir que el uso de 2,3,5-trifenil-tetrazolium como método alterno de la técnica de microdilución, para la medición de viabilidad de propágulos fúngicos, es un procedimiento factible con la cepa bacteriana E. coli ATCC 25922, las cepas de hongos filamentosos de los géneros Aspergillus, Fusarium y Microsporum gypseum evaluadas en el proyecto, junto con la cepa de comparación Aspergillus fumigatus, teniendo en cuenta aspectos como el tiempo y temperatura de incubación para cada cepa, medio de cultivo, concentración de inóculo y antifúngico. 5
6 1. INTRODUCCIÓN La creciente incidencia y diversidad de las infecciones fúngicas oportunistas en pacientes inmunosuprimidos, ha favorecido el mejor conocimiento de las micosis invasivas y el desarrollo de nuevos antifúngicos que ofrezcan nuevas alternativas al tratamiento de estas infecciones (1). Dentro del grupo de hongos implicados con mayor frecuencia en estas infecciones micóticas, se encuentran los géneros Candida, Aspergillus, Fusarium y el grupo de los dermatofitos. Estos son hongos patógenos oportunistas que han sido participes de varios estudios, debido a su capacidad de producir micosis superficiales y sistémicas (2). Obtener un diagnóstico rápido y preciso que permita determinar un tratamiento adecuado no deja de ser una tarea difícil, debido a que muchos de estos hongos patógenos originan cada vez más problemas de resistencia intrínseca a los antifúngicos, que actualmente se emplean a nivel clínico para el tratamiento de las micosis, situación que actualmente conlleva a la evaluación de dichas sustancias mediante el uso de distintas técnicas que tienen como objetivo determinar cuál es la concentración mínima inhibitoria (CMI) de antifúngico necesaria para logar inhibir el crecimiento del hongo (1). En la última década se han desarrollado varios métodos para llevar a cabo pruebas de sensibilidad in vitro a los antifúngicos. Estas técnicas han mostrado una buena reproducibilidad inter-laboratorio y cierta capacidad para detectar la resistencia in vitro a estos fármacos, por lo que la mayoría de los expertos creen que las pruebas de sensibilidad a los antifúngicos tienen utilidad clínica (3). Existen varios métodos comerciales basados en las pruebas de difusión y dilución en agar, a través de los cuales se puede estudiar la sensibilidad de los antifúngicos, que se encuentran ya sea a una concentración fija o a diferentes concentraciones, determinando cualitativamente si el hongo es sensible o resistente, o también se puede conocer cuantitativamente empleando una serie de diluciones seriadas que nos permiten determinar la CMI (1). Dentro de estos métodos comerciales se encuentran la difusión en placa y el E-test, entre otros. Estas técnicas son ampliamente utilizadas debido a que son simples, reproducibles y fáciles de leer e interpretar (4,5). De igual manera, existen métodos de referencia para evaluación de susceptibilidad antifúngica, de los cuales la técnica de microdilución en caldo propuesta por el CLSI (Clinical and Laboratory Standards Institute, antiguo NCCLS) documento M27-A2 para levaduras y M38-A para hongos filamentosos, es una de las más difundidas (3,4). Desde su aparición, los protocolos establecidos por el CLSI, han sido aceptados universalmente como el método de referencia para el ensayo de la actividad in vitro de los compuestos antifúngicos. Sin embargo, algunos ensayos han puesto de manifiesto su falta de 6
7 reproducibilidad. El documento M38-A para hongos filamentosos, presenta limitaciones importantes y una de ellas es la interpretación de los resultados ya que es muy subjetiva y solo personal ampliamente experimentado podría ofrecer datos confiables (6). Para intentar resolver estos inconvenientes, se han desarrollado modificaciones a la técnica de microdilución, que consiste en emplear indicadores de oxido-reducción como la resazurina, el cual ha sido recientemente identificado como el principal componente del Azul de Alamar. Esta sustancia azul es reducida por células del microorganismo metabólicamente activas hasta un color rosa intenso (7). La lectura de las microplacas se realiza teniendo en cuenta el viraje del indicador, así se considera la CMI como la menor dilución de antifúngico, en la que no se observa cambio de color (6). También existen otros métodos colorimétricos como las sales de tetrazol MTT y XTT, que al igual que la resazurina se han utilizado como indicadores de viabilidad en estudios con bacterias, hongos levaduriformes y filamentosos (8). El objetivo de este proyecto de investigación es llevar a cabo un ensayo preliminar, realizando una modificación de la técnica de microdilución (M38-A) utilizando como reactivo el 2,3,5- trifenil tetrazolium, el cual será empleado para la medición de viabilidad de propágulos fúngicos. 2. JUSTIFICACIÓN PLANTEAMIENTO DEL PROBLEMA Las infecciones micóticas por hongos oportunistas son cada día más frecuentes. Se ha considerado que hongos como Fusarium spp. (Hongo emergente), Aspergillus spp. y el grupo de los dermatofitos, dentro del grupo de hongos patógenos oportunistas capaces de causar una serie de infecciones micóticas superficiales y sistémicas. Se ha visto que los microorganismos causantes de estas patologías frente a diferentes antifúngicos muestran cada vez mayor resistencia, problema que hoy en día implica la evaluación de estas sustancias mediante el uso técnicas que permitan determinar cuál es la Concentración Mínima Inhibitoria (CMI) que se requiere del antifúngico para lograr inhibir el crecimiento (viabilidad) del hongo patógeno. Actualmente, a nivel clínico se emplean técnicas que se fundamentan en la evaluación de susceptibilidad antifúngica, dentro de las cuales se encuentran el E-test, la difusión en placa y la técnica de microdilución en caldo, propuesta por la CLSI documento M38-A, la cual ha sido empleada para evaluar hongos filamentosos. Tanto el E-test como la técnica de microdilución en caldo, son técnicas que evalúan diferentes concentraciones del antifúngico, lo cual permite determinar y establecer con exactitud la concentración mínima inhibitoria necesaria para inhibir el crecimiento del hongo; sin embargo, se ha despertado un gran interés en la técnica de microdilución en caldo, debido a que resulta ser una técnica difícil de interpretar, mostrando 7
8 resultados subjetivos, ya que dependen de la experiencia de la persona que está haciendo la evaluación; esto hace que se convierta en una técnica dispendiosa y solo personas con experiencia en la interpretación de los resultados podrían ofrecer datos confiables. Es por ello que el objetivo principal de este estudio es llevar a cabo un ensayo preliminar, realizando una modificación de la técnica de microdilución (M38-A) utilizando como reactivo el 2,3,5- trifenil tetrazolium, el cual será empleado para la medición de viabilidad de propágulos fúngicos (prueba bioquímica), permitiendo evidenciar de forma más clara el resultado de la técnica a través de un cambio de color, el cual se puede cuantificar por medio de espectrofotometría. Según reportes bibliográficos, la adición de esta sal como revelador de viabilidad se ha llevado a cabo en estudios con bacterias y levaduras pero no con hongos filamentosos, razón por la cual se evaluarán aislamientos de Fusarium spp, Aspergillus spp y el dermatofito Microsporum gypseum, que presentan comportamientos metabólicos diferentes, con el fin de poder establecer la efectividad de las sales de tetrazolium en estudios con hongos filamentosos. 3. MARCO TEÓRICO En las últimas décadas, se ha aumentado el número de casos por infecciones micóticas, mostrando una mayor incidencia en hongos de los géneros Fusarium spp., Aspergillus spp. y el grupo de los dermatofitos (9, 10). Estos son hongos patógenos miceliales que han sido participes de varios estudios con el fin de llegar a su control, debido a que son capaces de producir micosis superficiales e invasivas, al ser hongos oportunistas (11, 2). Así mismo, al ser hongos patógenos de mayor incidencia son importantes en el área clínica y por esta razón es conveniente tener en cuenta cuales son los antifúngicos capaces de controlar a estos organismos y las dosis requeridas para llevar a cabo esta acción (12). Todo esto ha generado la necesidad de desarrollar técnicas para el estudio de la susceptibilidad in vitro a los antifúngicos, de las cuales la técnica E-test, la difusión en placa y microdilución en caldo, son las técnicas más utilizadas a nivel clínico (13). El E-test es considerado uno de los métodos convencionales más empleados en estudios de susceptibilidad antifúngica, debido a que no sólo permite catalogar a una cepa como sensible o resistente, sino que también suministra el valor de la concentración inhibitoria mínima (CIM), virtud que ha sido promovida por muchos autores. A ello se suma la fácil y rápida manipulación e interpretación de resultados, características que la han hecho una de las técnicas más difundidas para el estudio de la sensibilidad a los antifúngicos (13). Por otro lado, la técnica de difusión en placa al igual que el E-test, es un método sencillo de llevar a cabo en condiciones in 8
9 vitro, permitiendo una fácil reproducibilidad del método y condiciones óptimas de crecimiento para los microorganismos a evaluar; además es una técnica fácil de interpretar en cuanto a resultados se refiere (14). Finalmente la técnica de microdilución en caldo propuesta por la CLSI documento M38-A, es una técnica empleada para la evaluación de susceptibilidad de hongos filamentosos, que surgió de la necesidad de controlar hongos causantes de infecciones invasivas, dentro de los que se encuentran especies de Fusarium, Aspergillus y Rhizopus, entre otros. La técnica de microdilución en caldo está basada en la determinación de la concentración mínima inhibitoria (CMI) (11,14), la cual permite establecer la mínima concentración de antifúngico que se necesita para la inhibición de crecimiento. Esta técnica es controversial, puesto que para algunos es fácil de realizar, mientras que para otros la técnica puede convertirse en un procedimiento dispendioso. La limitante de esta técnica es la subjetividad en la evaluación de crecimiento fúngico y solo personas que trabajan constantemente con la técnica han adquirido gran experiencia y son capaces de interpretar con facilidad los resultados (15, 16). A pesar de ello, ya se han realizado modificaciones de la técnica con el fin de obtener un resultado de mayor confiabilidad, empleando métodos colorimétricos. En varios estudios de susceptibilidad se ha utilizado resazurina como indicador de viabilidad. La resazurina, al ser un indicador redox, es reducida por parte de las células vivas dando como resultado final un viraje de color, de azul (indicando no crecimiento) a morado (indicando inhibición parcial) o a rojo rosa intenso (indicando crecimiento) (8). La viabilidad de microoganismos también ha sido determinada colorimétricamente mediante el uso de sales de tetrazolium, las cuales se conocen desde 1894 por su efecto de teñir bacterias (17). La reducción de una sal de tetrazolium causa la formación de un precipitado insoluble de coloración intensa, conocido con el nombre de formazán. Hoy día su utilización se extiende a pruebas de viabilidad de semillas, presencia y enumeración de bacterias, pruebas de motilidad bacteriana en agar semisólido y detección de sistemas enzimáticos de deshidrogenasas (18). La concentración de formazán producida por el organismo metabólicamente activo puede ser determinada por espectrofotometría. El uso de estas sales permite estimar la actividad respiratoria ligada a cadenas de transporte de electrones que operan bajo condiciones aeróbicas (respiración aeróbica) y anaeróbicas (respiración anaeróbica). Finalmente, es importante señalar que la reducción de sales tetrazolium es afectada por el ph. A ph bajos (ph < 5) se inhibe la reducción del cloruro 2,3,5 trifenil-tetrazolium a la correspondiente sal formazán. Por consiguiente, es importante considerar el ph de las muestras, cuando se utiliza la reducción de sales tetrazolium como un indicador de la actividad respiratoria de una comunidad de un cultivo microbiano (19). 9
10 4. OBJETIVOS 4.1 Objetivo general. Evaluar de forma preliminar una modificación de la técnica de microdilución propuesta por la CLSI documento M38-A, mediante el uso de 2,3,5- trifenil - tetrazolium como método alterno para la medición de viabilidad de propágulos fúngicos. 4.2 Objetivos específicos. Evaluar la producción de sales de formazán a partir de 2,3,5- trifenil tetrazolium para hongos filamentosos patógenos oportunistas (Fusarium spp., Aspergillus spp. y el dermatofito Microsporum gypseum). Determinar la concentración mínima de propágulos viables para detección de viraje de color (producción de sales de formazán). Determinar un índice de relación entre producción de sales de formazán y número de propágulos fúngicos viables. Evaluar la modificación de la técnica empleando terbinafina como antifúngico. 5. MATERIALES Y MÉTODOS: 5.1 Obtención de cepas microbianas La cepa de Escherichia coli ATCC se obtuvo de la colección de bacterias de la Pontificia Universidad Javeriana. Se trabajó con cepas de Aspergillus (1, 2, 10), Fusarium (8, 108, 121, 203) y Microsporum gypseum, provenientes de muestras de animales y humanos obtenidas de la colección de hongos de Pontificia Universidad Javeriana (Anexo 1 y 2). Las cepas de referencia con las cuales se trabajó fueron: Candida krusei ATCC 6258, Aspergillus niger ATCC y las cepas de comparación fueron Aspergillus fumigatus y Aspergillus flavus (Anexo 2). 5.2 Ensayos preliminares con E.coli para determinar viabilidad por asimilación de 2,3,5- trifenil tetrazolium Se realizó una suspensión a partir de la cepa bacteriana E. coli ATCC en solución salina al 0,85%, se ajustó la concentración del inóculo a 10 8 UFC/ml (0,15-0,2 UA) por 10
11 espectrofotometría a 540nm. Las pruebas fueron realizadas en agar nutritivo suplementado con 0,5mL/50mL de glicerol y 50mg/50mL de 2,3,5-trifenil tetrazolium y en caldo nutritivo suplementado de igual forma (Anexo 3). La suspensión fue sembrada por agotamiento en el agar nutritivo suplementado e inoculando 500µL de la suspensión bacteriana en tubos que contenían 4,5mL de caldo. Se incubó a 37 C durante 24 a 48 horas. Para realizar esta prueba se realizaron dos ensayos, uno adicionando la sal antes de autoclavar el medio y otro adicionando la sal después de autoclavar el medio de cultivo. Se utilizaron controles de crecimiento, sembrando el microorganismo en agar nutritivo y caldo nutritivo sin suplemento de sales, y como controles de esterilidad los medios sin inóculo. Estas pruebas fueron realizadas por triplicado. 5.3 Ensayos preliminares con hongos filamentosos para determinar viabilidad por asimilación de 2,3,5- trifenil tetrazolium. Se probaron tres medios de cultivo, los cuales fueron: Caldo Mueller Hinton, caldo extracto de malta y caldo Sabouraud (Anexo 3); estos medios de cultivo fueron preparados de acuerdo a la formulación descrita en el anexo 1. Posteriormente, se designaron dos tratamientos para cada medio de cultivo: i) Medio de cultivo + inoculo de microorganismo; ii) Medio de cultivo + 2,3,5- trifenil - tetrazolium (en una concentración de 1mg/mL de medio de cultivo) + inóculo de microorganismo; cabe resaltar que la adición del 2,3,5- trifenil tetrazolium se llevó a cabo una vez esterilizado el medio de cultivo. Las suspensiones de inóculo de las cepas de Fusarium spp. y Aspergillus spp. empleadas en el ensayo se obtuvieron a partir de cultivos monospóricos crecidos en agar avena (Anexo 2 y 3), los cuales habían cumplido un periodo de incubación de 5 días a 28 C. Las suspensiones de propágulos se prepararon en solución salina al 0.85% y posteriormente se llevó a cabo el recuento de conidios en cámara de Neubauer. La concentración que se manejo en el ensayo fue la establecida por la norma CLSI documento M38-A, la cual hace referencia a 1x10 4 conidios/ml. Seguidamente se inoculó 200µL de la suspensión de conidios en tubos que contenían 1,8mL de cada medio de cultivo antes mencionado, al igual que los tratamientos establecidos en un principio del ensayo. Finalmente, se llevó a incubación a 28 C por 96 horas y durante este periodo de tiempo se llevó a cabo un monitoreo cada 24 horas. Para el ensayo, se empleó como control de crecimiento el medio de cultivo + inóculo y sin adición de sal de tetrazolium y como control de esterilidad de medio: i) Medio de cultivo + 11
12 solución salina, ii) Medio de cultivo + sal de tetrazolium + solución salina. Cada tratamiento se llevó a cabo por triplicado para cada una de las cepas empleadas. Después de obtenidos los resultados, se procedió a trabajar el resto de ensayos únicamente con el medio de cultivo caldo Mueller Hinton. 5.4 Determinación de la concentración mínima requerida de propágulos viables para detección de viraje de color, por asimilación de 2,3,5-trifenil-tetrazolium y resazurina. Se llevaron a cabo tres tratamientos: i) Medio de cultivo + inoculo de microorganismo; ii) Medio de cultivo + 2,3,5- trifenil - tetrazolium (manteniendo siempre la misma concentración, que en el numeral 5.3) + inóculo de microorganismo y iii) Medio de cultivo + resazurina (en una concentración de 0,002%) + inóculo de microorganismo. Para cada uno de los tratamientos se evaluaron diferentes concentraciones celulares, las cuales iban de 1x10 1 conidios/ml hasta 1x10 5 conidios/ml. Las suspensiones para Fusarium spp., Aspergillus spp. y M. gypseum fueron obtenidas de la misma forma como se describió en el numeral 5.3, y en el caso de M. gypseum el periodo de incubación para obtención de propágulos fue de 14 días a 28 C. Una vez obtenida la concentración de propágulos de partida (1x10 5 conidios/ml), se realizaron diluciones seriadas con el fin de obtener cada una de las concentraciones antes mencionadas (1x10 5 conidios/ml hasta 1x10 1 conidios/ml), para cada microorganismo empleado en el ensayo. Una vez obtenidas las suspensiones celulares, se procedió adicionar 200µL de éstas suspensiones en tubos que contenían 1,8mL de medio de cultivo, de acuerdo a cada tratamiento. A continuación, se llevó a incubar a 28 C por 96 horas, durante este periodo de tiempo se llevó a cabo un monitoreo cada 24 horas. Para este ensayo se empleó como control de crecimiento: i) Medio de cultivo Mueller Hinton + microorganismo evaluado, y como control de esterilidad de medio: i) Medio de cultivo + solución salina, ii) Medio de cultivo + sal 2,3,5- trifenil tetrazolium + solución salina y iii) Medio de cultivo + sal de resazurina + solución salina. Cada tratamiento se llevó a cabo por triplicado para cada una de las cepas empleadas. 5.5 Determinación de la longitud de onda para cuantificación de viabilidad por espectrofotometría. A partir de los caldos de cultivo donde se observó crecimiento, evaluados en el numeral 5.4, de las cepas Aspergillus 1, Fusarium 108 y Microsporum gypseum, se tomó una alícuota de 1mL y 12
13 se diluyó en caldo Mueller-Hinton, posteriormente, se determinó un espectro de absorción en rango de luz visible ( nm), con el fin de determinar el pico de absorción para la cuantificación de las sales de formazán. Para resazurina se llevó a cabo el mismo procedimiento con las cepas A. fumigatus y Fusarium Evaluación de la modificación de la técnica empleando terbinafina como antifúngico. Se llevaron a cabo tres tratamientos: i) Medio de cultivo + inoculo de microorganismo + concentraciones de terbinafina (320µg/mL; 32µg/mL; 3,2µg/mL; 0.32µg/mL); ii) Medio de cultivo + sal de 2,3,5- trifenil - tetrazolium + inóculo de microorganismo + concentraciones de terbinafina (mencionadas anteriormente); y iii) Medio de cultivo + sal de resazurina + inóculo de microorganismo + concentraciones de terbinafina (mencionadas anteriormente). La preparación de cada concentración de antifúngico se hizo a partir de una tableta que contiene como principio activo 250mg de terbinafina perteneciente a la casa comercial MK del lote 8M3039. Se tomó una tableta y se maceró en mortero estéril, a continuación se pesó 128mg y disolvió a 5mL con dimetilsulfóxido (DMSO), seguidamente se agitó hasta obtener una mezcla homogénea, con el fin de obtener una concentración final de 16mg/mL de terbinafina. Una vez alcanzada esta concentración, se realizaron diluciones seriadas en solución salina al 0,85% para obtener las concentraciones mencionadas a evaluar anteriormente. Para cada uno de los tratamientos se evaluó una concentración celular de 1x10 5 conidios/ml; las suspensiones para Fusarium spp., Aspergillus spp. y Microsporum gypseum fueron obtenidas de la misma forma como se describió en el numeral 5.4. Posteriormente de la obtención de las suspensiones celulares, se procedió a agregar 100µL de éstas suspensiones en tubos, los cuales contenían 0.9mL de medio de cultivo, de acuerdo al tratamiento ensayado + 100µL de la respectiva concentración de terbinafina a evaluar. Inmediatamente, se llevó a incubar a 28 C por 96 horas, durante este periodo de tiempo se llevo a cabo un monitoreo cada 24 horas. Para este ensayo se empleó como control de crecimiento: i) Medio de cultivo Mueller Hinton + microorganismo y como control de esterilidad del medio: i) Medio de cultivo + solución salina, ii) Medio de cultivo + concentraciones de terbinafina (320µg/mL; 32µg/mL; 3,2µg/mL; 0.32µg/mL) + solución salina, iii) Medio de cultivo + sal 2,3,5- trifenil tetrazolium + solución salina, iv) Medio de cultivo + sal 2,3,5- trifenil tetrazolium + concentraciones de terbinafina + solución salina al 0,85%, v) Medio de cultivo + sal de resazurina + solución salina al 0,85%, vi) Medio de cultivo + sal de resazurina + concentraciones de terbinafina + solución salina al 0,85%. 13
14 Cada tratamiento se llevó a cabo por cuadriplicado para cada una de las cepas empleadas. 6. RESULTADOS Y DISCUSIÓN 6.1 Ensayos preliminares con E. coli para determinar viabilidad por asimilación de 2,3,5- trifenil tetrazolium. No solo la creciente incidencia de las infecciones causadas por hongos, sino que también el reciente incremento en las infecciones causadas por microorganismos patógenos tanto Gram positivos como Gran negativos, ha generado la necesidad de llevar a cabo estudios de susceptibilidad in vitro frente a diferentes antifúngicos, mediante el uso de métodos tanto comerciales como de referencia (20). Adicional a esto, el uso de marcadores colorimétricos como indicadores de viabilidad en las pruebas de susceptibilidad ha ganado cada vez mayor importancia con el pasar de los años debido a que han permitido suplir los limitantes que presentan algunas de las técnicas de susceptibilidad en lo referente a la interpretación de los resultados (21-25). Con respecto a lo anterior, el propósito de llevar a cabo un ensayo preliminar con una cepa bacteriana que ha sido reportada en estudios de susceptibilidad, era evidenciar viabilidad celular al emplear 2,3,5-trifenil-tetrazolium como un indicador de oxidoreducción y a partir de los resultados obtenidos poder llevar a cabo ensayos posteriores empleando cepas de hongos. De esta manera los resultados de la tabla 1 y 2, demuestran que efectivamente la sal de tetrazolium sirve como indicador de viabilidad debido a que se observó un cambio de color a rojo tanto de las colonias de E.coli ATCC crecidas en el agar nutritivo suplementado con la sal de tetrazolium y gricerol, como del caldo nutritivo igualmente suplementado. 14
15 Tabla 1: Control de crecimiento de la cepa E. coli ATCC en Agar Nutritivo y Caldo Nutritivo, empleando una concentración de inóculo de 10 8 UFC/ml. Agar nutritivo + microorganismo Caldo nutritivo + microorganismo Cepa Concentración de inóculo 10 8 UFC/ml Control negativo (agar nutritivo) Cepa Concentración de inóculo 10 8 UFC/ml Control negativo (Caldo nutritivo) Crecimiento de colonias No crecimiento Crecimiento positivo (turbidez) No crecimiento E. coli E. coli ATCC ATCC Tabla 2: Asimilación de 2,3,5- trifenil tetrazolium por viraje de color a rojo en Agar nutritivo suplementado y del caldo nutritivo suplementado, por parte de la cepa E. coli ATCC Agar nutritivo suplementado + microorganismo Cepa Concentración de inóculo 10 8 UFC/ml Colonias rojas Control de esterilidad (agar nutritivo suplementado) No crecimiento Caldo nutritivo suplementado + microorganismo Cepa Concentración de inóculo 10 8 UFC/ml Medio de cultivo rojo Control de esterilidad (Caldo nutritivo suplementado) No hay cambio E. coli ATCC E. coli ATCC Ensayos preliminares con hongos para determinar viabilidad por asimilación de 2,3,5- trifenil tetrazolium En las pruebas de susceptibilidad el uso de medios de cultivo adecuados para llevar a cabo los ensayos juega un papel importante a la hora de obtener resultados precisos y reproducibles. Según lo reportado (20), existen ciertos medios de cultivo que en comparación con otros, 15
16 permiten un mejor desarrollo de los microorganismos, razón por la cual son ampliamente utilizados. Con base en esto, los medios de cultivo que se emplearon en el ensayo de asimilación de la sal de terazolium por parte de las cepas de hongos corresponden a los caldos Sabouraud, caldo extracto de malta y caldo Mueller Hinton (tabla 3), los cuales por ser medios enriquecidos le proporcionan a los hongos los macro y micronutrientes necesarios para su óptimo desarrollo y crecimiento. Los hongos son organismos quimioheterótrofos, que en su hábitat natural se encuentran asociados a la materia orgánica en descomposición y su nutrición es llevada a cabo por absorción (26, 31). Por otra parte, en pruebas in vitro, crecen en medios de cultivo en donde se les proporciona fuente de carbono orgánico y fuente de nitrógeno orgánica o inorgánica, de forma que el hongo las asimile para su crecimiento y producción de propágulos (26) como se puede observar en la figura 1. Estos medios de cultivo tienen dentro de su composición los nutrientes necesarios para que el microorganismo pueda crecer, tal como se puede observar en la figura 1, donde el hongo mostró un crecimiento tanto micelial (figura 1- b y 1-e) como por turbidez (figura 1-h), lo cual es un comportamiento normal de los géneros evaluados Fusarium spp. y Aspergillus spp.(26), indicando ser medios de cultivo viables de crecimiento para llevar a cabo el ensayo. Sin embargo, para el objetivo del estudio, el caldo Mueller Hinton demostró presentar un mejor comportamiento (Figura 1-a, 1-b y 1-c) debido a la modificación que se realizó en la formulación del medio de cultivo. El caldo Muller Hinton contiene peptona, extracto de carne y almidón (27), y la modificación realizada fue adicionarle glucosa al 2% (Anexo 3), el cual es un factor nutricional que le brinda una mayor concentración de fuente de carbono induciendo un mayor crecimiento frente a los demás medios de cultivo. Esto ha sido verificado en ensayos experimentales de estudios de susceptibilidad, no solo para hongos filamentosos, sino también ha sido empleado para estudios en microorganismos levaduriformes y en microorganismos procariotas como bacterias (3, 4, 20). Las condiciones de incubación juegan un papel importante en los resultados obtenidos, debido a que las cepas evaluadas de Fusarium spp. y Aspergillus spp., a pesar de no tener conocimiento de las especies de cada género, tienen tiempos y temperaturas de incubación similares, razón por la cual las condiciones de incubación dadas fueron 28 C durante un periodo de tiempo de 96 horas y condiciones de oscuridad. Otra de las razones por las cuales se escogió el caldo Muelle-Hinton, se debe a que en el ensayo de asimilación de la sal de 2,3,5- trifenil tetrazolium éste presentó homogeneidad y consistencia en el color (figura 1-c) dado por la asimilación de la sal por parte de los microorganismos evaluados (Anexo 4), mientras que en los caldos extracto de malta y Sabouraud no se observó el mismo comportamiento, debido a que el desarrollo de la coloración por reducción de sales de tetrazolium se dió solamente a nivel 16
17 del micelio y no del caldo de cultivo (figura 1- f y 1-i). Para la modificación de la técnica de microdilución con la adición de sales de tetrazolium para detección de viabilidad, se espera que el cambio de color se presente de forma homogénea en el medio de cultivo (Anexo 4), lo que es más evidente y por lo tanto facilita la determinación de viabilidad (17, 19, 21). Tabla 3: Crecimiento en Caldo Mueller-Hinton, Caldo Extracto de Malta y Caldo Sabouraud; y asimilación de 2,3,5- trifenil tetrazolium, por parte de las cepas de Aspergillus spp. y Fusarium spp. Medio de Cultivo Caldo Mueller Hinton Caldo Extracto de Malta Caldo Sabouraud Tratamiento Mueller Hinton + microorganismo Mueller Hinton + 2,3,5- trifenil tetrazolium + microorganismo Extracto de Malta + microorganismo Extracto de Malta + 2,3,5- trifenil tetrazolium + microorganismo Sabouraud + microorganismo Sabouraud + 2,3,5- trifenil tetrazolium + microorganismo Microorganismo Aspergillus spp. Fusarium spp. Aspergillus spp. Fusarium spp. Aspergillus spp. Fusarium spp. Aspergillus spp. Fusarium spp. Aspergillus spp. Fusarium spp. Aspergillus spp. Fusarium spp. CN: Control de esterilidad (caldo Mueller Hinton + solución salina) Cto: Hubo crecimiento. V: Viabilidad. Concentración inóculo 1x10 4 conidios/ml Control de esterilidad CN A1 Cto A2 Cto A10 Cto F108 Cto F121 Cto F203 Cto A1 V A2 V A10 V F108 V F121 V F203 V A1 Cto A2 Cto A10 Cto F108 Cto F121 Cto F203 Cto A1 V A2 V A10 V F108 V F121 V F203 V A1 Cto A2 Cto A10 Cto F108 Cto F121 Cto F203 Cto A1 V A2 V A10 V F108 V F121 V F203 V
18 a b c d e f g h i CN Cto V CN Cto V CN Cto V Figura 1: Detección de crecimiento y reducción de sales de tetrazolium en tres medios de cultivo a) Control de esterilidad.b) Crecimiento en caldo Mueller-Hinton. c) Asimilación de 2,3,5- trifenil tetrazolium. d) Control de esterilidad de caldo Extracto de Malta + solución salina al 0,85%. e) Crecimiento en caldo Extracto de Malta. f) Asimilación de 2,3,5- trifenil tetrazolium. g) Control de esterilidad de caldo Sabouraud + solución salina al 0,85%. h) Crecimiento en caldo Sabouraud. i) Asimilación de 2,3,5- trifenil tetrazolium. 6.3 Determinación de la concentración mínima requerida de propágulos viables para detección de viraje de color. Uno de los procedimientos que facilitan la interpretación de los resultados de la técnica de microdilución, principal objetivo de este trabajo de investigación, es el uso de métodos colorimétricos o indicadores de oxido-reducción (20). En el presente ensayo (numeral 6.3) es importante tener en cuenta tres aspectos relevantes a la hora de discutir los resultados los cuales se refieren a: 1) la asimilación tanto de la sal de tetrazolium como de la resazurina (Tablas 5 y 6), 2) la relación de las diferentes concentraciones de inóculo que se evaluaron frente a la intensidad de color al asimilar la sal de tetrazolium y la resazurina (tablas 5 y 6) y 3) los tiempos de incubación que se manejaron en el ensayo. En primer lugar, la asimilación de 2,3,5-trifenil-tetrazolium por parte de las cepas de hongos evaluadas, arrojó resultados satisfactorios tal como se muestra en la tabla 5 y en la figura 3, debido a que tanto las cepas de Aspergillus spp., como de Fusarium spp. y M. gypseum asimilaron la sal de tetrazolium, la cual es incolora y soluble, produciendo un precipitado insoluble de pigmentación rojiza intensa, conocido con el nombre de formazán (17); en base a esto, se puede inferir que hasta la mínima concentración de inóculo empleada es capaz de reducir la sal de tetrazolium y de igual manera, mantener constante la pigmentación rojiza intensa (Anexo 4). 18
19 El uso de sales de tetrazolium provee de métodos alternos indirectos para medir actividad respiratoria asociada a una cadena de transporte de electrones. Dichas sales son conocidas desde hace tiempo por la capacidad que tienen al teñir las bacterias; hoy en día su uso se ha extendido a pruebas de viabilidad de semilla, pruebas de motilidad bacteriana en agar semisólido, presencia y enumeración de bacterias y detección de sistemas enzimáticos de deshidrogenasas (17,19). Actualmente, no existen estudios con hongos donde se demuestre el uso de 2,3,5-trifenil-tetrazolium como indicador de viabilidad de propágulos fúngicos; sin embargo, en algunos estudios de susceptibilidad antifúngica con levaduras (Candida spp., Candida neoformans) y hongos (Aspergillus o Fusarium spp.) se ha observado que el uso de MTT (bromuro de [3-(4,5-dimetiltiazol-2-il)-2,5-difenil-tetrazolio]) y XTT (2,3-bis-(2-methoxi-4- nitro-5- sulfofenil)-5-(fenilamin-carbonil-2h-tetrazol hidróxido)) como indicador colorimétrico de oxido-reducción, ha sido efectivo (7, 21). En la prueba con resazurina, los resultados obtenidos (tabla 6), muestran de igual manera que todas las cepas evaluadas la asimilaron, debido a que se observó un cambio de color de azul hasta rosa intenso y en ciertos casos alcanza a volverse incoloro (figura 4). El fundamento de la reacción se basa en que la resazurina (azul) (figura 4-a) en su primer estado de reducción es reducida a resorufina (rojo intenso) (figura 4-f) por oxido-reductasas que se encuentran principalmente en la mitocondria de células vivas; posteriormente se reduce a hidroresorufina que es incolora (figura 4-g). El método de reducción de la resazurina se ha descrito como un indicador de oxido-reducción que tiene propiedades de fluorescencia y responde a la actividad metabólica tanto de células humanas como de bacterias (22). En la actualidad es utilizado como un método de detección de células viables en pruebas de susceptibilidad antifúngica tanto en levaduras como en hongos filamentosos, dentro de los que se incluye al grupo de los dermatofitos (7, 23, 24); además de ser un método sensible y altamente reproducible. En cuanto a la relación que existe entre las diferentes concentraciones evaluadas frente a la intensidad de color dada por la asimilación tanto de la sal de tetrazolium como de resazurina (tabla 5 y 6), se evidenció que en caso de la sal de tetrazolium la coloración roja intensa se mantuvo constante en todas las concentraciones y con todas las cepas (Anexo 4), mientras que con resazurina se observaron diferentes intensidades de color a medida que aumentaba la concentración de conidios y no en todas las cepas se evidenciaron todas las intensidades de color (Anexo 5). Según el estudio realizado por Pujol I et, al, 2002, este hecho podría deberse a que la resazurina al virar del color azul-violáceo al rosa intenso, pasa por varios matices dentro de los que se encuentra el lila, malva, rojo malva y malva-rojo (Figura 4 y Anexo 4); además la 19
20 estabilidad de la resazurina puede verse alterada por factores como la luz directa o la luz artificial fuerte, ya que es fotosensible (25). Finalmente, en lo referente al tiempo incubación se manejó un tiempo de 96 horas. La razón de esta evaluación se debe al hecho de que se trabajó con diferentes géneros de hongos y por ejemplo, en el caso de Microsporum gypseum, se necesita de un periodo de incubación de 72 a 96 horas para que se dé la asimilación de la sal de tetrazolium y de la resazurina, debido a que es un microorganismo de crecimiento lento (24). En el caso de Aspergillus spp. y Fusarium spp. se necesita un periodo de incubación de aproximadamente 48 horas, sin embargo las expresión de los resultados de asimilación para ambos géneros se evidenció de forma más clara una vez cumplidas las 72 horas de incubación (27). Para el presente ensayo, se utilizó como control positivo de crecimiento el medio de cultivo Mueller Hinton + las diferentes concentraciones de inóculo de cada una de las cepas evaluadas (tabla 4), donde se evidenció un óptimo crecimiento (figura 2), confirmando una vez más que el caldo Mueller Hinton es el medio de cultivo más viable para llevar a cabo los ensayos. Tabla 4: Crecimiento en caldo Mueller-Hinton por parte de las cepas de Aspergillus spp., Fusarium spp. y Microsporum gypseum frente a diferentes concentraciones de inóculo (conidios/ml). Microorganismo Aspergillus spp. Caldo Mueller-Hinton + microorganismo Concentración de inóculo (conidios/ml) 1x10 5 1x10 4 1x10 3 1x10 2 1x10 1 Control de esterilidad CN A1 Cto 72h Cto 72h Cto 72h Cto 96h Cto 96h A2 Cto 72h Cto 72h Cto 72h Cto 96h Cto 96h A10 Cto 72h Cto 72h Cto 96h Cto 96h Cto 96h F8 Cto 48h Cto 48h Cto 48h Cto 48h Cto 72h Fusarium F108 Cto 72h Cto 72h Cto 72h Cto 96h Cto 96h spp. F121 Cto 72h Cto 72h Cto 72h Cto 96h Cto 96h F203 Cto 72h Cto 72h Cto 72h Cto 96h Cto 96h M. gypseum Mg Cto 96h Cto 96h Cto 96h Ncto Ncto CN: Control de esterilidad (caldo Mueller Hinton + solución salina) Ncto: No hubo crecimiento Cto: Hubo Crecimiento. 20
21 a b CN Figura 2: Caldo Mueller-Hinton: a) Control de esterilidad de b) Crecimiento en caldo Mueller Hinton. Ct Tabla 5: Asimilación de 2,3,5-trifenil-tetrazolium por viraje de color del caldo Mueller-Hinton, por parte de la cepas de Aspergillus spp., Fusarium spp. y Microsporum gypseum frente a diferentes concentraciones de inóculo (conidios/ml). Caldo Mueller-Hinton + 2,3,5-trifenil-tetrazolium + microorganismo Concentración de inóculo (conidios/ml) Control de Microorganismo esterilidad 1x10 5 1x10 4 1x10 3 1x10 2 1x10 1 CN A1 V 72h V 72h V 72h V 72h V 72h Aspergillus A2 V 72h V 72h V 72h V 72h V 72h spp. A10 V 72h V 72h V 72h V 72h V 72h F8 V 72h V 72h V 72h V 72h V 72h Fusarium F108 V 72h V 72h V 72h V 72h V 72h spp. F121 V 72h V 72h V 72h V 72h V 72h F203 V 72h V 72h V 72h V 72h V 72h M. gypseum Mg V 72h V 72h V 72h V 72h V 72h CN: Control de esterilidad (Caldo Mueller Hinton + 2,3,5- trifenil tetrazolium + solución salina) V: Hubo viabilidad. Nv: No hubo viabilidad. a b CN V Figura 3: Caldo Mueller-Hinton + 2,3,5-trifenil tetrazolium: a) Control de esterilidad b) Asimilación de 2,3,5-trifenil-terazolium. 21
22 Tabla 6: Asimilación de la resazurina por viraje de color del caldo Mueller-Hinton, por parte de la cepas de Aspergillus spp., Fusarium spp. y Microsporum gypseum frente a diferentes concentraciones de inóculo (conidios/ml). Microorganismo Aspergillus spp. Caldo Mueller-Hinton + Resazurina + microorganismo Concentración de inóculo (conidios/ml) 1x10 5 1x10 4 1x10 3 1x10 2 1x10 1 Control de esterilidad CN A1 V-R5 72h V-R4 72h V-R4 72h V-R4 72h V-R4 72h A2 V-R6 72h V-R1 72h V-R3 72h V-R4 72h V-R4 72h A10 V-R6 72h V-R2 72h V-R2 72h V-R2 72h V-R4 72h F8 V-R4 72h V-R4 72h V-R4 72h V-R6 72h V-R6 72h Fusarium F108 V-R5 72h Ncto V-R3 72h V-R4 72h V-R4 72h spp. F121 V-R2 72h V-R2 72h V-R2 72h V-R3 72h V-R3 72h F203 V-R3 72h V-R6 72h V-R2 72h V-R2 72h V-R2 72h M. gypseum Mg V-R33 96h V-R3 96h V-R2 96h V-R3 96h V-R4 96h CN: Control de esterilidad (caldo Mueller Hinton + resazurina + solución salina). V: Hubo viabilidad. Ncto: No hubo crecimiento. a b c d e f g CN V-R1 V-R2 V-R3 V-R4 V-R5 V-R6 Figura 4: Caldo Mueller-Hinton + resazurina: a) Control esterilidad. b g) Asimilación de resazurina mostrando diferentes intensidades de color. 6.4 Determinación de la longitud de onda para cuantificación de viabilidad por espectrofotometría Un gran número de métodos de cuantificación de compuestos y organismos se fundamentan en determinar la absorción de luz, a determinada longitud de onda, por parte de la muestra a estudiar. La cuantificación de densidad poblacional por turbidez en microorganismos como bacterias y levaduras, se hace rutinariamente por espectrofotometría, debido a su carácter unicelular, pero con hongos filamentosos este tipo de mediciones no son precisas puesto que las hifas no se distribuyen homogéneamente en la suspensión, interfiriendo parcialmente con en el paso de la luz, dificultando de esta manera la lectura. Por otro lado, los métodos colorimétricos de detección de viabilidad no solo buscan obtener una medida cualitativa del 22
23 comportamiento de los microorganismo mediante virajes de color, sino también una medida cuantitativa, lo cual implica la utilización de métodos espectrofotométricos, específicamente aplicado a la evaluación de antifúngicos para determinar concentraciones mínimas inhibitorias. A partir de los ensayos que se llevaron a cabo previamente, donde se observó cambio de color del indicador de viabilidad, se corrió un espectro de absorción, en un rango de luz visible entre nm, para determinar el pico de absorción de la reacción. La determinación del pico de absorción de la reacción permite definir la longitud de onda para cuantificar la producción de sales de formazán (en el caso de 2,3,5- trifenil tetrazolium) y la producción de resorufina (en el caso de resazurina). Según los resultados arrojados, para la cuantificación de sales de formazán se determinó una longitud de onda de 580nm (figura 5), puesto que fue donde se presentó el pico de mayor absorción. En cuanto a la cuantificación de resorufina, se determinó una la longitud de onda de 560nm (figura 5). En los resultados de la prueba de producción de sales de formazán partiendo de diferentes concentraciones de inóculo no se observó diferencia en la intensidad de color (Anexo 4 y 5). Este resultado no justificaría la cuantificación espectrofotométrica, pues se asume que la intensidad de color es directamente proporcional al número de propágulos viables. Por otro lado, en la prueba con resazurina si se observaron diferentes intensidades de color en relación a la inoculación de diferentes concentraciones de propágulos viables (figura 4), pero la escala de intensidad de color no corresponde exactamente a la escala del azul-violeta a rosa intenso, pues se observan coloraciones amarillo-naranja, lo cual no permite la correcta cuantificación de la intensidad del color en una misma longitud de onda. Otro punto a tener en cuenta en relación a la determinación de propágulos viables por intensidad de color para resazurina, es la no concordancia de aumento de intensidad de color en función del aumento de la concentración del inóculo, pues no se observó en todos las cepas y réplicas evaluadas una relación directamente proporcional, entre intensidad de color y número de propágulos (Anexo 4). Adicionalmente, se debe tener en cuenta que la reacción de reducción de la resazurina se da en dos etapas (27), en la primera etapa se da el cambio de azul o rosa intenso y en la segunda el cambio se da de rosa intenso a incoloro. Este cambio en la coloración hace que la lectura de la prueba solo se pueda hacer antes del inicio de la segunda etapa de reducción, lo cual restringe el tiempo de evaluación de la técnica; caso contrario a la evaluación con sales de tetrazolium donde la reacción se da en un solo paso, determinando así uno solo cambio de color. La reacción de reducción de resazurina, como todas la reacciones redox, se asocia a la tasa metabólica del organismo en evaluación, por lo que en hongos filamentosos no es posible 23
24 generalizar un tiempo determinado de lectura de viabilidad, teniendo en cuenta diferencias de velocidad de germinación de propágulos y desarrollo de micelio entre diferentes especies. Por ejemplo, los dermatofitos son más lentos en su desarrollo comparado con Fusarium y Aspergillus, por lo que para este estudio se tendrían que establecer tiempos diferentes de lectura para cada género, lo que hace más dispendioso el manejo de los ensayos. E.coli ATCC Aspergillus 1 Sales de formazán 580 nm Fusarium 108 M. gypseum Sales de formazán 580 nm A. fumigatus Fusarium 108 Resorufina 560 nm Figura 5: Longitudes de onda para producción de sales de formazán y resorufina. 6.5 Evaluación de la modificación de la técnica empleando terbinafina como antifúngico. Durante muchos años se han llevado a cabo estudios de susceptibilidad, con el fin de encontrar la concentración mínima inhibitoria de los antifúngicos capaces de llevar a cabo la eliminación parcial y/o total de aquellos microorganismos oportunistas filamentosos, causantes de enfermedades a nivel clínico, los cuales han llevado hasta la muerte a los pacientes que las padecen. Este hecho, ha llevado al desarrollo de antifúngicos de base tanto biológica como sintética. Sin embargo, se ha observando que los hongos, han ido desarrollado resistencia contra la mayoría de los principios activos que contienen los fungicidas y/o fungistáticos, lo cual ha hecho más difícil la tarea de encontrar el blanco de acción que permita la inhibición total del 24
25 hongo. De acuerdo a esto, estudios previos (1, 10, 11, 30, 33) han demostrado que la terbinafina es un micótico ampliamente usado para tratamientos de onicomicosis y dermatofitosis, debido a la sensibilidad que han mostrado tener cepas tales como Trichophyton rubrum, Trichophyton mentagrophytes, Microsporum canis, Microsporum gypseum, Scopulariopsis brevicaulis y Epidermophyton floccosum, entre otros. La terbinafina es una alilamina de amplio espectro, que por su mecanismo de acción actúa como fungicida. El blanco de acción de la terbinafina es el ergosterol que se encuentra en la membrana del hongo, el cual se encarga de la integridad y el desarrollo de ésta. El mecanismo de acción está dado en la inhibición de la biosíntesis del ergosterol, que en sí consiste en inhibir la conversión del escualeno a epóxido de escualeno, el cual se une selectivamente a la epoxidasa de escualeno de las células del hongo, está enzima que no es perteneciente al citocromo P-450, permite una acumulación del precursor (escualeno) el cual se vuelve tóxico para las células y conlleva a su lisis (muerte celular) (32). Además de ello, la terbinafina por su fácil asequibilidad y su amplio espectro, también ha sido estudiada en la eliminación de hongos filamentosos como Aspergillus spp. y Fusarium spp., los cuales han demostrado sensibilidad y resistencia, respectivamente. Posiblemente esto pudo haber pasado en los tubos que se muestran en las figuras 9 y 11, donde no se evidenció viabilidad ni por turbidez ni por viraje de color, lo cual se asume que la terbinafina haya inhibido en las cuatro concentraciones evaluadas las tres cepas de Aspergillus spp. y la cepa de Microsporum gypseum, resultados que no se pueden sustentar con veracidad debido a que actualmente no existen estudios con hongos filamentosos donde se hayan estandarizado los puntos de corte que permitan determinar a una cepa como sensible o resistente. No obstante, es importante resaltar que los alcances de los objetivos no abarcan la verificación de la sensibilidad de las cepas evaluadas a antifúngicos comerciales, sino que se centran en determinar si realmente es posible llevar a cabo la modificación de la técnica de microdilución para detección colorimétrica de viabilidad. Con base en esto y en los resultados obtenidos en el presente ensayo (tablas 8 y 9, figuras 8 y 10), donde se evaluó la asimilación de la sal de tetrazolium y de la resazurina frente a diferentes concentraciones de terbinafina, se puede decir que el empleo de indicadores de oxido-reducción, es un procedimiento factible para pruebas de susceptibilidad antifúngica, empleando en este caso terbinafina como antifúngico, debido a que la evidencia de viabilidad de las células no se ve afectado en el momento de enfrentar ya sea la sal de tetrazolium o la resazurina, con diferentes concentraciones de antifúngico (Anexo 9 y 10). Para finalizar, es importante mencionar que paralelo a los ensayos y cepas propuestas en el proyecto, también se llevaron a cabo los mismos ensayos con una cepa de A. fumigatus y 25
26 Aspergillus flavus como cepas de comparación, junto con una cepa de Candida krusei ATCC 6258 y Aspergillus niger ATCC 16404, como cepas de referencia reportadas en test de susceptibilidad para levaduras y hongos filamentosos, motivo por el cual fue relevante evaluar el comportamiento de estas cepas frente a la asimilación de la sal 2,3,5- trifenil tetrazolium y de la resazurina, esto con el fin de obtener resultados comparables y significativos para dar validez y reproducibilidad a la modificación planteada en el presente estudio. Los resultados obtenidos se pueden observar en el anexo x, el cual permitió evidenciar asimilación de las sales evaluadas por parte de estos microorganismos (Anexo 6 y 7), infiriendo de esta manera, que el objetivo del estudio se cumplió pues los microorganismos de referencia también reducen estos compuestos mostrando el cambio de color en el medio de cultivo, indicando viabilidad. Para el presente ensayo, se utilizó como control positivo de crecimiento el medio de cultivo Mueller Hinton + inóculo de cada una de las cepas evaluadas (tabla 7), donde se evidenció un óptimo crecimiento (figura 6; Anexo 8). Tabla 7: Crecimiento en caldo Mueller-Hinton por parte de las cepas de Aspergillus spp., Fusarium spp. y Microsporum gypseum frente a diferentes concentraciones de terbinafina (µg/ml). Microorganismo 1x10 4 conidios/ml Aspergillus spp. Fusarium spp Caldo Mueller Hinton + microorganismo Concentración Control de Terbinafina (µg/ml) esterilidad ,2 0,32 CN 1 Control de esterilidad CN 2 A1 Ncto Ncto Ncto Ncto A2 Ncto Ncto Ncto Ncto A10 Ncto Ncto Ncto Ncto F8 Cto Cto Cto Cto F108 Ncto Ncto Ncto Ncto F121 Cto Cto Cto Cto F203 Cto Cto Cto Cto M. Mg Ncto Ncto Ncto Ncto gypseum CN 1: Control de esterilidad (Caldo Mueller Hinton + Solución salina) CN 2: Control de esterilidad (Caldo Mueller Hinton + Terbinafina + Solución salina) Cto: Hubo crecimiento Ncto: No hubo crecimiento. 320µg/ml 32µg/ml MH MH+Tb MH+Tb+ MH MH+Tb MH+Tb+ Fusarium spp. Fusarium spp. 26
27 3,2 µg/ml 32 µg/ml MH MH + Tb MH + Tb+ MH MH + Tb MH + Tb Fusarium spp. Fusarium spp. Figura 6: Crecimiento en Caldo Mueller-Hinton + diferentes concentraciones de terbinafina. 320µg/ml 32µg/ml MH MH + Tb MH + Tb + MH MH + Tb MH + Tb + Aspergillus spp. Aspergillus spp. 3,2µg/ml 0,32µg/ml MH MH + Tb MH + Tb + MH MH + Tb MH + Tb+ Aspergillus spp. Aspergillus spp. Figura 7: Ausencia de crecimiento en Caldo Mueller-Hinton + diferentes concentraciones de terbinafina en todas las concentraciones evaluadas (caldo Mueller Hinton + terbinafina). 27
28 Tabla 8: Viabilidad o no viabilidad en Caldo Mueller-Hinton + 2,3,5-trifenil-tetrazolium, por parte de la cepas de Aspergillus spp., Fusarium spp. y Microsporum gypseum frente a diferentes concentraciones de terbinafina (µg/ml). Caldo Mueller Hinton + 2,3,5- trifenil tetrazolium + microorganismo Concentración Terbinafina Control de Control de Microorganismo 1X10 4 (µg/ml) esterilidad esterilidad conidios/ml ,2 0,32 CN 1 CN 2 Aspergillus spp. A1 Nv Nv Nv Nv A2 Nv Nv Nv Nv A10 Nv Nv Nv Nv F8 V V V V Fusarium F108 Nv Nv Nv Nv spp F121 V V V V F203 V V V V M. gypseum Mg Nv Nv Nv Nv CN 1: Control de esterilidad (Caldo Mueller Hinton + 2,3,5- trifenil tetrzaolium + solución salina) CN 2: Control de esterilidad (Caldo Mueller Hinton + 2,3,5- trifenil tetrzaolium + terbinafina + solución salina). V: Viabilidad. Nv: No hubo viabilidad. 320µg/ml 32µg/ml MH + T MH+T+Tb MH+T+Tb+ MH + T MH+T+Tb MH+T+Tb+ Fusarium spp. Fusarium spp. 3,2µg/ml 0,32µg/ml MH + T MH+T+Tb MH+T+Tb+ MH + T MH+T+Tb MH+T+Tb+ Fusarium spp. Fusarium spp. Figura 8: Viabilidad en Caldo Mueller-Hinton + 2,3,5- trifenil tetrazolium + diferentes concentraciones de terbinafina. 28
29 320µg/ml 32µg/ml MH + T MH+T+Tb MH+T+Tb+ MH + T MH+T+Tb MH+T+Tb+ Aspergillus spp. Aspergillus spp. 3,2µg/ml 0,32µg/ml MH + T MH+T+Tb MH+T+Tb+ MH + T MH+T+Tb MH+T+Tb+ Aspergillus spp. Aspergillus spp. Figura 9: No viabilidad en Caldo Mueller Hinton + 2,3,5- trfineil tetrazolium + diferentes concentraciones de terbinafina. Tabla 9: Viabilidad o no viabilidad en Caldo Mueller-Hinton + Resazurina, por parte de la cepas de Aspergillus spp., Fusarium spp. y Microsporum gypseum frente a diferentes concentraciones de terbinafina (µg/ml). Caldo Mueller Hinton + resazurina + microorganismo Microorganismo Concentración Terbinafina (µg/ml) Control de esterilidad Control de esterilidad 1x10 4 conidios/ml ,2 0,32 CN 1 CN 2 A1 Nv Nv Nv Nv Aspergillus A2 Nv Nv Nv Nv spp. A10 Nv Nv Nv Nv F8 V V V V Fusarium F108 Nv Nv Nv Nv spp F121 V V V V F203 V V V V M. gypseum Mg Nv Nv Nv Nv
30 CN 1: Control de esterilidad (Caldo Mueller Hinton + resazurina + solución salina) CN 2: Control de esterilidad (Caldo Mueller Hinton + resazurina + terbinafina + solución salina) V: Viabilidad. Nv: No hubo viabilidad. 320µg/ml 32µg/ml MH + R MH+R+Tb MH+R+Tb MH + R MH+R+Tb MH+R+Tb+ Fusarium spp. Fusarium spp. 3,2µg/ml 0,32µg/ml MH + R MH+R+Tb MH+R+Tb+ MH + R MH+R+Tb MH+R+Tb+ Fusarium spp. Fusarium spp. Figura 10: Viabilidad en Caldo Mueller Hinton + resazurina + diferentes concentraciones de terbinafina. 30
31 320µg/ml 32µg/ml MH + R MH+R+Tb MH+R+Tb+ MH + R MH+R+Tb MH+R+Tb+ Aspergillus spp. Aspergillus spp. 3,2µg/ml 0,32µg/ml MH + R MH+R+Tb MH+R+Tb+ MH + R MH+R+Tb MH+R+Tb+ Aspergillus spp. Aspergillus spp. Figura 11: No viabilidad en Caldo Mueller Hinton + resazurina + diferentes concentraciones de terbinafina) 7. CONCLUSIONES El 2,3,5- trifenil tetrazolium si puede ser utilizado como indicador de viabilidad en hongos filamentosos como Fusarium spp., Aspergillus spp. y Microsporum gypseum y no filamentosos como Candida krusei ATCC 6258, debido a la reducción de la sal de tetrazolium a formazán, evidenciada por la producción de color rojo en el micelio, en el caso de hongos filamentosos, y el medio de cultivo. La utilización de sales de óxido reducción como método colorimétrico para detectar viabilidad se podría cuantificar por espectrofotometría, leyendo a 580nm para reducción a formazán y 560nm para reducción a resorufina. 31
32 La modificación de la técnica de microdilución para pruebas de susceptibilidad a antifúngicos en hongos filamentosos es factible, puesto que la reducción de 2,3,5- trifenil tetrazolium no se afecta en presencia de antifúngicos como terbinafina. La reducción de 2,3,5- trifenil tetrazolium por parte de las cepas de Aspergillus spp., Fusarium spp, Mycrosporum gypseum y Candida krusei ATCC 6258 evaluadas y la estabilidad del color de la reacción de reducción, sugieren que el uso de sales de tetrazolium como indicador de viabilidad de propágulos fúngicos es una alternativa factible para la modificación de la técnica de microdilución propuesta por la CLSI documento M38-A. 8. RECOMENDACIONES Para evitar falsos positivos y errores al momento de llevar a cabo el montaje de la modificación de la técnica de microdilución, se recomienda en estudios futuros conocer la vida útil de las sales evaluadas: 2,3,5- trifenil tetrazolium y resazurina. Para estudios futuros, se recomienda llevar a cabo la modificación de la técnica de microdilución, enfrentando las cepas evaluadas en el presente estudio contra nuevos antifúngicos de interés clínico. Antes de llevar a cabo la preparación de las diferentes concentraciones, se recomienda filtrar la solución stock del antifúngico, en este caso un comprimido de terbinafina, con el fin de disminuir la turbidez que se presenta en el momento de disolver la terbinafina en Dimetilsulfóxido (DMSO). En el momento de llevar a cabo los ensayos con cada una de las cepas a evaluar, se recomienda hacer primero el montaje con las cepas de Fusarium y Microsporum gypseum y de últimas hacer el montaje con las cepas de Aspergillus 9. BIBLIOGRAFIA 1. Cermeño-Vivas JR, Torres-Rodriguez JM. Sensibilidad de hongos miceliares dematiáceos a diez antifúngicos empleando un método de difusión en agar. Revista Iberoamericana de 2. Micología 2001; 18: Petrikkos G, Skiada A. Recent advances in antifungal chemotherapy. International Journal of Antimicrobial Agents 2007; 30 (2):
33 4. Cuenca-Estrella M, Gadea-Gironés I, Martín-Mazuelos E, Pemán-Garcia J, Pontón J, Rodríguez-Tudela JL. Diagnóstico microbiológico de las micosis y estudios de sensibilidad a los antifúngicos. Procedimientos en microbiología clínica Matar MJ, Ostrosky-Zeichner L, Paetznick VL, Rodriguez JR, Chen E, Rex JH. Correlation between E-Test, Disk Diffusion and Microdilution methods for Antifungal Susceptibility of Fluconazole and Voriconazole. Antimivrobial agents and chemotherapy (5): Magaldi S, Mata S, Hartung de Carriles C, Perez C, Colella MT, Olaizola C, Ontiveros Y. Well diffusion for antifungal susceptibility testing. International Journal of Infectious Diseases 2004; 8: Capilla-Luque J. Estudios in vitro e in vivo sobre la actividad de nuevos antifúngicos frente a hongos filamentosos oportunistas. Tesis doctoral. Facultad de Medicina i Ciències de la Salut. Universitat Rovira i Virgili, Reus, 2003, 185 p. 8. Jahn B, Stüben A, Bhakdi S. Colorimetric Susceptibility Testing for Aspergillus fumigatus: Comparison of Menadione-Augmented 3-(4,5-Dimethyl-2- Thiazolyl)-2,5-Diphenyl-2H- Tetrazolium Bromide and Alamar Blue Tests. Journal of Clinical Microbiology 1996; 34 (8): Ruzicka F, Holá V, Votava M, Tejkalova R. Importance of Biofilm in Candida parapsilosis and Evaluation of its Susceptibility to Antifungal Agents by Colorimetric Method. Folia Microbiology 2007; 52 (3): Castro C, Serrano MC, Flores B, Espinel A, Martín E. Comparison of the Sensititre YeastOne Colorimetric Antifungal Panel with a Modified NCCLS M38-A Method To Determine the Activity of Voriconazole against Clinical Isolates of Aspergillus spp. Journal of clinical microbiology 2004; 42 (9): Martinez NM, Peres NT, Rossi A. Antifungal Resistance Mechanisms in Dermatophytes. Mycopathologia 2008; 166: Carrillo AJ, Giusiano G, Cárdenes D, Hernández JM, Eraso E, Quindós G, Guardia C, del Valle O, Tur C, Guarro J. Terbinafine susceptibility patterns for onychomycosis-causative dermatophytes and Scopulariopsis brevicaulis. International Journal of Antimicrobial Agents 2008; 31:
34 12. Groll AH, Kolve H. Antifungal Agents: In Vitro Susceptibility Testing, Pharmacodynamics, and Prospects for Combination Therapy. Eur J Clin Microbiol Infect Dis 2004; 23: Ballesté R, Arteta Z, Barloco A, Mier C, Fernández N, Mousqués N, Xavier B, Cabrera MJ, Combol A, Gezuele E. Evaluación del desempeño diagnóstico de difusión en agar Etest para el estudio de sensibilidad a los antifúngicos. Revista médica del Uruguay 2006; 22: Magaldi S, Mata S, Hartung de Carriles C, Perez C, Colella MT, Olaizola C, Ontiveros Y. Well diffusion for antifungal susceptibility testing. International Journal of Infectious Diseases 2004; 8: Pfaller MA, Chaturvedi V, Espinel A, Ghannoum MA, Gosey LL, Odds FC, Rex JH, Rinaldi MG, Sheehan DJ, Walsh TJ, Warnock DW. Reference method for broth dilution antifungal susceptibility testing of filamentous fungi; Approved Standard. NCCLS M38-A 2002; 22 (16): Cabañas M, Abarca M, Bragulat M, Cabañes F. In vitro activity of imazalil against Penicillium expansum: Comparison of the CLSI M38-A broth microdilution method with traditional techniques. International Journal of Food Microbiology 2009; 129: Hatzinger P, Palmer P, Smith L, Peñarrieta C, Yoshinari T. Applicability of tetrazolium salts for the measurement of respiratory activity and viability of groundwater bacteria. Journal of Microbiological Methods 2003; 52: Verleysen H, Samyn G, Van Bockstaele E, Debergh P. Evaluation of analytical techniques to predict viability after cryopreservation. Plant Cell, Tissue and Organ Culture 2004; 77: Tsukatani T, Suenaga H, Higuchi T.; Akao, T, Ishiyama M, Ezoe K, Matsumoto K. Colorimetric cell proliferation assay for microorganisms in microtiter plate using watersoluble tetrazolium salts. Journal of Microbiological Methods 2008; 75: Malli E, Spiliopoulou I, Kolonitsiou F, Klapsa D, Giannitsioti E, Pantelidi K, Pratti A, Panopoulou M, Grapsa S, Alepopoulou E, Neonakis I, Frantzidou F, Alexiou-Daniel S, Bakola D, Koutsia-Carouzou C, Malamou-Lada H, Zerva L, Vlahaki E, Kartali-Ktenidou S, Anastassiou ED, Petinaki E. In vitro activity of daptomycin against Gram-positive cocci: the first multicentre study in Greece. International Journal of Antimicrobial Agents 2008; 32:
35 21. Carrillo-Muñoz AJ, Abarca L, Quindós G. Métodos colorimétricos para la determinación de la sensibilidad in vitro a los antifúngicos. Revista Iberoamericana de Micología 2001; 18: Rex JH, Pfaller MA, Walsh TJ, Chaturdevi V, Espinel-Ingroff A, Ghannoum MA, Gosey LL, Odss FC, Rinaldi MG, Sheehan DJ, Warnock DW. Antifungal Susceptibility Testing: Practical Aspects and Current Challenges. Clinical Microbiology reviews 2001;14 (4): Escobar LM, Alfonso PA, Aristizábal FA. Valoración de dos métodos de tinción en ensayos de citotoxicidad sobre líneas celulares tumorales. Revista Colombiana de Biotecnología 2009; 11(2): Liu M, Seidel V, Katerere DR, Gray AI. Colorimetric broth microdilution method for the antifungal screening of plant extracts against yeasts. Methods 2007; 42: Pujol I, Capilla J, Fernández-Torres B, Ortoneda M, Guarro J. Use of the Sensititre Colorimetric Microdilution Panel for Antifungal Susceptibility Testing of Dermatophytes. Journal of Clinical Microbiology 2002; 40 (7): Carrillo-Inungaray M L, Ramírez-Zapata M R, Martínez-Castilleja J C. Efectos de solutos sobre el crecimiento de hongos deteriorativos de alimentos. Ciencia y Tecnología alimentaria Microbiology Manual Merck. 28. Rossi-Lema L, Echenique L, Sosa de caruso N. Resazurina, azul de metileno y contaje en placas en el control del contenido bacteriano de la leche higiénica. Instituto de industria Animal 1999; p Espinel-Ingroff A. Comparison of the E-Test with the NCCLS M38-P Method for Antifungal Susceptibility Testing of Common and Emerging Pathogenic Filamentous Fungi. Journal of Clinical Microbiology 2001; 39 (4): Moore C B, Walls C M, Denning D W. In Vitro Activities of Terbinafine against Aspergillus species in comparison with Those of Itraconazole and Amphotericin B. Antimicrobial Agents and Chemotherapy 2001; p Consultado el 29 de Mayo de Vanden B H. Mechanisms of antifungal resistance. Rev Iberoam Micol 1997; 14: Review. 35
36 33. Maniscalchi MT, Lemus D, Ledezma E et al. Estudio de la susceptibilidad in vitro de aislados de Microsporum canis al ajoene, terbinafina y griseofulvina, utilizando el método de microdilución. Rev. Soc. Ven. Microbiol., ene. 2004, vol.24, no.1-2, p ISSN
37 ANEXO 1 HOJAS DE VIDA DE LAS CEPAS EVALUADAS COLECCIÓN DE MICROORGANISMOS DEPARTAMENTO DE MICROBIOLOGÍA PONTIFICIA UNIVERSIDAD JAVERIANA Responsable: Melba Linares Linares Número CMDM-PUJ 11 ( 1) Microorganismo Aspergillus sp Fuente Donado Dra Mery Santaella Origen HUMANO Aislado de muestra de esputo Almacenamiento Agua destilada en discos de agar Nivel de seguridad 2 Conservación Agua destilada Condiciones de crecimiento Aerobio estricto. Temperatura 25 C durante 4 días. Pruebas biológicas Características morfológicas Características Macroscópicas: crecimiento rápido (3-4 días), Anverso: colonias con pigmento difusible de amarillo a verde Reverso: colonias color verde Textura: pulverulenta Aspecto: radiado Características Microscópicas: se caracteriza por presentar la cabeza aspergilar constituida por el conidióforo, vesícula, fiálides. Hifas hialinas Reacciones atípicas Identificación de peligros Forma de transmisión No presenta Inhalación de esporas Persona-Persona Período de incubación Enfermedade s que produce 3-4 días Enfermedad pulmonar alérgica o invasora, aspergiloma, lesiones en piel, invasión cerebral, micetoma. Medidas de protección/manipulación Conservación del microorganismo EL personal debe usar equipo de protección normal (Uso apropiado de bata, guantes, tapabocas, gorro) Eliminación y tratamiento apropiado de desechos Higiene personal: Lavado de manos Intervención solo por personal capacitado Conservación en agua Objetivos a conseguir en todo proceso de conservación de microorganismos son el mantenimiento de: Viabilidad: Debe de ser posible recuperar el microorganismo conservado cuando sea necesario. Estabilidad: Los microorganismos recuperados deben presentar las mismas características genotípicas y fenotípicas de aquellos de los que provienen. Pureza: Los cultivos en conservación no deben presentar ningún tipo de contaminación. 37
38 COLECCIÓN DE MICROORGANISMOS DEPARTAMENTO DE MICROBIOLOGÍA PONTIFICIA UNIVERSIDAD JAVERIANA Responsable: Melba Linares Linares Número CMDM-PUJ 12 (2) Microorganismo Aspergillus sp Fuente Donado Dra Mery Santaella Origen HUMANO Aislado de muestra de esputo Almacenamiento Agua destilada en discos de agar Nivel de seguridad 2 Conservación Agua destilada Condiciones de crecimiento Aerobio estricto. Temperatura 25 C durante 4 días. Pruebas biológicas Características morfológicas Características Macroscópicas: crecimiento rápido (3-4 días), Anverso: colonias con pigmento difusible de amarillo a verde Reverso: colonias color verde Textura: pulverulenta Aspecto: radiado Características Microscópicas: se caracteriza por presentar la cabeza aspergilar constituida por el conidióforo, vesícula, fiálides. Hifas hialinas Reacciones atípicas Identificación de peligros Forma de transmisión No presenta Inhalación de esporas Persona-Persona Período de incubación Enfermedade s que produce 3-4 días Enfermedad pulmonar alérgica o invasora, aspergiloma, lesiones en piel, invasión cerebral, micetoma. Medidas de protección/manipulación Conservación del microorganismo EL personal debe usar equipo de protección normal (Uso apropiado de bata, guantes, tapabocas, gorro) Eliminación y tratamiento apropiado de desechos Higiene personal: Lavado de manos Intervención solo por personal capacitado Conservación en agua Objetivos a conseguir en todo proceso de conservación de microorganismos son el mantenimiento de: Viabilidad: Debe de ser posible recuperar el microorganismo conservado cuando sea necesario. Estabilidad: Los microorganismos recuperados deben presentar las mismas características genotípicas y fenotípicas de aquellos de los que provienen. Pureza: Los cultivos en conservación no deben presentar ningún tipo de contaminación. 38
39 COLECCIÓN DE MICROORGANISMOS DEPARTAMENTO DE MICROBIOLOGÍA PONTIFICIA UNIVERSIDAD JAVERIANA Responsable: Melba Linares Linares Número CMDM-PUJ 7 Microorganismo Microsporum gypseum Fuente Donado Dra Mery Santaella Origen Humano Aislado de Uña de pie Almacenamiento Agua destilada en discos de agar Nivel de seguridad 2 Conservación Agua destilada Condiciones de crecimiento Aerobio estricto. Temperatura 25 C durante 7-10 días. Pruebas biológicas Características morfológicas Características Macroscópicas: crecimiento moderado (6-10 dias) Anverso: color amarillo a blanco Reverso: color amarillo a crema Textura: pulverulenta, aspecto plano Aspecto: radial Características Microscópicas: hifas con macroconidias en huso, paredes delgadas y con menos de 6 lóbulos lo que la diferencia de M canis (mas de 6 lóbulos); microconidias ocasionales. Reacciones atípicas Identificación de peligros Forma de transmisión Período de incubación Enfermedade s que produce No presenta Animales domésticos (gatos, perros)- Humanos Persona-Persona Fómites/ Geofísico 7-10 días Tinea capitis, Onicomicosis Medidas de protección/manipulación Conservación del microorganismo EL personal debe usar equipo de protección normal (Uso apropiado de bata, guantes, tapabocas, gorro) Eliminación y tratamiento apropiado de desechos Higiene personal: Lavado de manos Intervención solo por personal capacitado Conservación en agua Objetivos a conseguir en todo proceso de conservación de microorganismos son el mantenimiento de: Viabilidad: Debe de ser posible recuperar el microorganismo conservado cuando sea necesario. Estabilidad: Los microorganismos recuperados deben presentar las mismas características genotípicas y fenotípicas de aquellos de los que provienen. Pureza: Los cultivos en conservación no deben presentar ningún tipo de contaminación. 39
40 COLECCIÓN DE MICROORGANISMOS DEPARTAMENTO DE MICROBIOLOGÍA PONTIFICIA UNIVERSIDAD JAVERIANA Responsable: Melba Linares Linares Número CMDM-PUJ 24 (8) Microorganismo Fusarium sp Fuente Origen Humano Aislado de Uña de pie Almacenamiento Agua destilada en discos de agar Nivel de seguridad 2 Conservación Agua destilada Condiciones de crecimiento Aerobio estricto. Temperatura 25 C durante 3-5 días. Pruebas biológicas Características morfológicas Características Macroscópicas: crecimiento rápido (3-5 dias) Anverso: color morado Reverso: color morado y blanco Textura: algodonosa, micelio aéreo Aspecto: radial Características Microscópicas: las células conidiógenas están aisladas o agrupadas en esporodoquios. Macroconidios curvados, pluriseptados. Microconidios unicelulares, elipsoidales, fusiformes. hialino Reacciones atípicas Identificación de peligros Forma de transmisión Período de incubación Enfermedade s que produce No presenta Persona-Persona Lesiones, traumatismos 3-5 días Onicomicosis, Queratitis, lesión cutánea localizada, Micetoma, Endocarditis. Medidas de protección/manipulación Conservación del microorganismo EL personal debe usar equipo de protección normal (Uso apropiado de bata, guantes, tapabocas, gorro) Eliminación y tratamiento apropiado de desechos Higiene personal: Lavado de manos Intervención solo por personal capacitado Conservación en agua Objetivos a conseguir en todo proceso de conservación de microorganismos son el mantenimiento de: Viabilidad: Debe de ser posible recuperar el microorganismo conservado cuando sea necesario. Estabilidad: Los microorganismos recuperados deben presentar las mismas características genotípicas y fenotípicas de aquellos de los que provienen. Pureza: Los cultivos en conservación no deben presentar ningún tipo de contaminación. 40
41 COLECCIÓN DE MICROORGANISMOS DEPARTAMENTO DE MICROBIOLOGÍA PONTIFICIA UNIVERSIDAD JAVERIANA Responsable: Melba Linares Linares Número CMDM-PUJ 22 (121) Microorganismo Fusarium sp Fuente Origen Animal animal Almacenamiento Agua destilada en discos de agar Nivel de seguridad 2 Conservación Agua destilada Condiciones de crecimiento Aerobio estricto. Temperatura 25 C durante 3-5 días. Pruebas biológicas Características morfológicas Características Macroscópicas: crecimiento rápido (3-5 dias) Anverso: color rojo oscuro Reverso: color amarillo verdoso a rojo claro Textura: algodonosa Aspecto: radial Características Microscópicas: las células conidiógenas están aisladas o agrupadas en esporodoquios. Macroconidios curvados, pluriseptados. Microconidios unicelulares, elipsoidales, fusiformes. hialino Reacciones atípicas Identificación de peligros Forma de transmisión Período de incubación Enfermedade s que produce No presenta Persona-Persona Lesiones, traumatismos 3-5 días Onicomicosis, Queratitis, lesión cutánea localizada, Micetoma, Endocarditis. Medidas de protección/manipulación Conservación del microorganismo EL personal debe usar equipo de protección normal (Uso apropiado de bata, guantes, tapabocas, gorro) Eliminación y tratamiento apropiado de desechos Higiene personal: Lavado de manos Intervención solo por personal capacitado Conservación en agua Objetivos a conseguir en todo proceso de conservación de microorganismos son el mantenimiento de: Viabilidad: Debe de ser posible recuperar el microorganismo conservado cuando sea necesario. Estabilidad: Los microorganismos recuperados deben presentar las mismas características genotípicas y fenotípicas de aquellos de los que provienen. Pureza: Los cultivos en conservación no deben presentar ningún tipo de contaminación. 41
42 COLECCIÓN DE MICROORGANISMOS DEPARTAMENTO DE MICROBIOLOGÍA PONTIFICIA UNIVERSIDAD JAVERIANA Responsable: Melba Linares Linares Número CMDM-PUJ 23 (203) Microorganismo Fusarium sp Fuente Origen Humano Almacenamiento Agua destilada en discos de agar Aislado de lesión queratitis Nivel de seguridad 2 Conservación Agua destilada Condiciones de crecimiento Aerobio estricto. Temperatura 25 C durante 3-5 días. Pruebas biológicas Características morfológicas Características Macroscópicas: crecimiento rápido (3-5 dias) Anverso: color morado claro a amarillo crema Reverso: color morado y blanco Textura: algodonosa, micelio aéreo Aspecto: radial Características Microscópicas: las células conidiógenas están aisladas o agrupadas en esporodoquios. Macroconidios curvados, pluriseptados. Microconidios unicelulares, elipsoidales, fusiformes. hialino Reacciones atípicas Identificación de peligros Forma de transmisión Período de incubación Enfermedade s que produce No presenta Persona-Persona Lesiones, traumatismos 3-5 días Onicomicosis, Queratitis, lesión cutánea localizada, Micetoma, Endocarditis. Medidas de protección/manipulación Conservación del microorganismo EL personal debe usar equipo de protección normal (Uso apropiado de bata, guantes, tapabocas, gorro) Eliminación y tratamiento apropiado de desechos Higiene personal: Lavado de manos Intervención solo por personal capacitado Conservación en agua Objetivos a conseguir en todo proceso de conservación de microorganismos son el mantenimiento de: Viabilidad: Debe de ser posible recuperar el microorganismo conservado cuando sea necesario. Estabilidad: Los microorganismos recuperados deben presentar las mismas características genotípicas y fenotípicas de aquellos de los que provienen. Pureza: Los cultivos en conservación no deben presentar ningún tipo de contaminación. 42
43 COLECCIÓN DE MICROORGANISMOS DEPARTAMENTO DE MICROBIOLOGÍA PONTIFICIA UNIVERSIDAD JAVERIANA Responsable: Melba Linares Linares Número CMDM-PUJ 21 (108) Microorganismo Fusarium sp Fuente Origen Animal Almacenamiento Agua destilada en discos de agar Aislado de lesión de ojo de vaca Nivel de seguridad 2 Conservación Agua destilada Condiciones de crecimiento Aerobio estricto. Temperatura 25 C durante 3-5 días. Pruebas biológicas Características morfológicas Características Macroscópicas: crecimiento rápido (3-5 dias) Anverso: color café a amarillo Reverso: color blanco Textura: algodonosa, micelio aéreo Aspecto: radial Características Microscópicas: las células conidiógenas están aisladas o agrupadas en esporodoquios. Macroconidios curvados, pluriseptados. Microconidios unicelulares, elipsoidales, fusiformes. hialino Reacciones atípicas Identificación de peligros Forma de transmisión Período de incubación Enfermedade s que produce No presenta Persona-Persona Lesiones, traumatismos 3-5 días Onicomicosis, Queratitis, lesión cutánea localizada, Micetoma, Endocarditis. Medidas de protección/manipulación Conservación del microorganismo EL personal debe usar equipo de protección normal (Uso apropiado de bata, guantes, tapabocas, gorro) Eliminación y tratamiento apropiado de desechos Higiene personal: Lavado de manos Intervención solo por personal capacitado Conservación en agua Objetivos a conseguir en todo proceso de conservación de microorganismos son el mantenimiento de: Viabilidad: Debe de ser posible recuperar el microorganismo conservado cuando sea necesario. Estabilidad: Los microorganismos recuperados deben presentar las mismas características genotípicas y fenotípicas de aquellos de los que provienen. Pureza: Los cultivos en conservación no deben presentar ningún tipo de contaminación. 43
44 ANEXO 2 CARACTERÍSTICAS MACROSCÓPICAS DE LAS CEPAS EVALUADAS M. gypseum Aspergillus 1 Aspergillus 2 Aspergillus 10 Fusarium 8 Fusarium 108 Fusarium 203 Fusarium 121 A. niger ATCC Aspergillus fumigatus Aspergillus flavus Candida krusei ATCC
45 ANEXO 3 MEDIOS DE CULTIVO, COMPONENTES Y PREPARACIÓN CALDO MUELLER-HINTON MODIFICADO COMPONENTES CANTIDAD O VOLUMEN/LITRO DE MEDIO Peptona de caseína 17,5 g Almidón 1,5 g Extracto de carne 4 g Glucosa 2% p/v PREPARACIÓN Disolver todos los componentes en agua destilada y llevar a autoclavar a 121 C por 15 minutos. CALDO EXTRACTO DE MALTA COMPONENTES Glucosa Extracto de malta Peptona CANTIDAD O VOLUMEN/LITRO DE MEDIO 20 g 5 g 5 g PREPARACIÓN Disolver todos los componentes en agua destilada y llevar a autoclavar a 121 C por 15 minutos. 45
46 CALDO SABOURAUD COMPONENTES Glucosa Peptona CANTIDAD O VOLUMEN/LITRO DE MEDIO 40 g 10 g PREPARACIÓN Disolver todos los componentes en agua destilada y llevar a autoclavar a 121 C por 15 minutos. AGAR AVENA COMPONENTES Harina de avena Agar-Agar CANTIDAD O VOLUMEN/LITRO DE MEDIO 20 g 10 g PREPARACIÓN Disolver todos los componentes en agua destilada, calentar hasta ebullición y llevar a autoclavar a 121 C por 15 minutos. 46
47 ANEXO 4 Intensidad de color por asimilación deresazurina en diferentes concentraciones deinóculo 47
48 ANEXO 5 CEPAS DE REFERENCIA Y COMPARACIÓN CRECIMIENTO EN CALDO MUELLER-HINTON Aspergillus flavus Aspergillus niger ATCC CN CN 48
49 ANEXO 6 CEPAS DE REFERENCIA Y COMPARACIÓN ASIMILACIÓN DE LA SAL DE TETRAZOLIUM EN CLADO MUELLER-HINTON Aspergillus fumigatus Aspergillus flavus CN CN Aspergillus niger ATCC Candida krusei ATCC 6258 CN CN 49
50 ANEXO 7 CEPAS DE REFERENCIA Y COMPARACIÓN ASIMILACIÓN DE RESAZURINA EN CALDO MUELLER HINTON Candida krusei ATCC 6258 Aspergillus fumigatus CN CN Aspergillus flavus CN 50
51 ANEXO 8 CEPAS DE REFERENCIA Y COMPARACIÓN CRECIMIENTO EN CALDO MUELLER-HINTON EN DIFERENTES CONCENTRACIONES DE TERBINAFINAA 320 µg/ml 32 µg/ml CN Ck A. fu A. fla An CN Ck A. fu A.fl An 51
52 A ANEXO 9 CEPAS S DE REFER RENCIA Y COMPARAC C IÓN ASIMILA ACIÓN DE LA SAL DE TETRAZOL LIUM EN DIFERENTES S CONCENT TRACIONES S DE TER RBINAFINA A 52
53 ANEXO 10 ASIMILACIÓN DE RESAZURINA EN CALDO MUELLER-HINTON EN DIFERENTES CONCENTRACIONES DE TERBINAFINA 53
Javier Pemán Unidad de Micología Servicio de Microbiología Hospital Universitario La Fe Valencia
 Técnicas de sensibilidad in vitro a los antifúngicos Javier Pemán Unidad de Micología Servicio de Microbiología Hospital Universitario La Fe Valencia Palma de Mallorca, 11 febrero 2010 Detección de resistencias
Técnicas de sensibilidad in vitro a los antifúngicos Javier Pemán Unidad de Micología Servicio de Microbiología Hospital Universitario La Fe Valencia Palma de Mallorca, 11 febrero 2010 Detección de resistencias
Crecimiento del microorganismo en diferentes sustratos
 AVANCE DEL PROYECTO SIP 20070396 RESULTADOS Preparación del inóculo La cepa Aspergillus níger (ATCC 1015) se adquirió en tubos de ensaye en agar de dextrosa y papa (PDA), por tal motivo fue resembrada
AVANCE DEL PROYECTO SIP 20070396 RESULTADOS Preparación del inóculo La cepa Aspergillus níger (ATCC 1015) se adquirió en tubos de ensaye en agar de dextrosa y papa (PDA), por tal motivo fue resembrada
9 MATERIALES Y MÉTODOS.
 9 MATERIALES Y MÉTODOS. Se evaluó la inactivación de Escherichia coli ATCC 25922 en agua destilada utilizando Dióxido de Titanio dopado con Nitrógeno, a diferentes condiciones de ph y de radiación solar
9 MATERIALES Y MÉTODOS. Se evaluó la inactivación de Escherichia coli ATCC 25922 en agua destilada utilizando Dióxido de Titanio dopado con Nitrógeno, a diferentes condiciones de ph y de radiación solar
PRUEBAS DE SENSIBILIDAD A AGENTES ANTIMICROBIANOS
 PRACTICA Nº2 DE MALALTIES INFECCIOSES I PRUEBAS DE SENSIBILIDAD A AGENTES ANTIMICROBIANOS Introducción La determinación de la sensibilidad a los agentes antimicrobianos es una de las principales funciones
PRACTICA Nº2 DE MALALTIES INFECCIOSES I PRUEBAS DE SENSIBILIDAD A AGENTES ANTIMICROBIANOS Introducción La determinación de la sensibilidad a los agentes antimicrobianos es una de las principales funciones
BIORREACTRES. Estudios básicos y aplicados sobre procesos de fermentación
 BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
MÉTODOS DE DIFUSIÓN Y MÉTODOS DE DILUCIÓN CÁLCULO DE CIM Y CBM
 2017 TRABAJO PRACTICO N 4: ANTIMICROBIANOS MÉTODOS DE DIFUSIÓN Y MÉTODOS DE DILUCIÓN CÁLCULO DE CIM Y CBM Objetivos - Que el estudiante conozca las distintas técnicas de difusión y dilución que permiten
2017 TRABAJO PRACTICO N 4: ANTIMICROBIANOS MÉTODOS DE DIFUSIÓN Y MÉTODOS DE DILUCIÓN CÁLCULO DE CIM Y CBM Objetivos - Que el estudiante conozca las distintas técnicas de difusión y dilución que permiten
Técnicas de sensibilidad in vitro a los antifúngicos
 Técnicas de sensibilidad in vitro a los antifúngicos Javier Pemán Unidad de Micología Servicio de Microbiología Hospital Universitario La Fe Valencia Palma de Mallorca, 11 febrero 2010 Detección de resistencias
Técnicas de sensibilidad in vitro a los antifúngicos Javier Pemán Unidad de Micología Servicio de Microbiología Hospital Universitario La Fe Valencia Palma de Mallorca, 11 febrero 2010 Detección de resistencias
Infecciones Micóticas y el Estado Actual de las Pruebas de Sensibilidad a los Antifúngicos. Antifúngicos
 Infecciones Micóticas y el Estado Actual de las Pruebas de ensibilidad a los Antifúngicos Antifúngicos Departamento de Parasitología y Micología Departamento de Parasitología y Micología Instituto de Higiene
Infecciones Micóticas y el Estado Actual de las Pruebas de ensibilidad a los Antifúngicos Antifúngicos Departamento de Parasitología y Micología Departamento de Parasitología y Micología Instituto de Higiene
CAPÍTULO III. 3.1 ANÁLISIS CROMATOGRÁFICOS DE LOS ALCALOIDES DE Lupinus mutabilis Sweet.
 - 37 - CAPÍTULO III 3. RESULTADOS Y DISCUSIÓN 3.1 ANÁLISIS CROMATOGRÁFICOS DE LOS ALCALOIDES DE Lupinus mutabilis Sweet. El análisis cromatográfico se desarrollo en: a) aguas del proceso de desamargado;
- 37 - CAPÍTULO III 3. RESULTADOS Y DISCUSIÓN 3.1 ANÁLISIS CROMATOGRÁFICOS DE LOS ALCALOIDES DE Lupinus mutabilis Sweet. El análisis cromatográfico se desarrollo en: a) aguas del proceso de desamargado;
Biplaca que se utiliza para evaluar la contaminación microbiológica de las superficies (Paredes, Techos, Equipos, Pisos, etc.) o Líquidos.
 BIPLACA HYCHECK Biplaca que se utiliza para evaluar la contaminación microbiológica de las superficies (Paredes, Techos, Equipos, Pisos, etc.) o Líquidos. Son estadísticamente comparables a una Torunda
BIPLACA HYCHECK Biplaca que se utiliza para evaluar la contaminación microbiológica de las superficies (Paredes, Techos, Equipos, Pisos, etc.) o Líquidos. Son estadísticamente comparables a una Torunda
ÍNDICE DE CONTENIDOS. ÍNDICE DE TABLAS. vi. ÍNDICE DE FIGURAS... vii. ÍNDICE DE APÉNDICES... xi. RESUMEN.. xii. ABREVIACIONES Y NOMENCLATURAS xiv
 ÍNDICE DE CONTENIDOS ÍNDICE DE TABLAS. vi ÍNDICE DE FIGURAS... vii ÍNDICE DE APÉNDICES... xi RESUMEN.. xii ABREVIACIONES Y NOMENCLATURAS xiv CAPÍTULO 1. INTRODUCCIÓN 1 1.1 Situación del Agua en el Mundo.
ÍNDICE DE CONTENIDOS ÍNDICE DE TABLAS. vi ÍNDICE DE FIGURAS... vii ÍNDICE DE APÉNDICES... xi RESUMEN.. xii ABREVIACIONES Y NOMENCLATURAS xiv CAPÍTULO 1. INTRODUCCIÓN 1 1.1 Situación del Agua en el Mundo.
Efecto de agentes químicos sobre los microorganismos
 Efecto de agentes químicos sobre los microorganismos Definiciones Desinfección: se refiere al uso de agentes físicos o químicos para eliminar las células vegetativas pero no necesariamente las esporas.
Efecto de agentes químicos sobre los microorganismos Definiciones Desinfección: se refiere al uso de agentes físicos o químicos para eliminar las células vegetativas pero no necesariamente las esporas.
CULTIVO DE MICROORGANISMOS MEDIOS DE CULTIVO
 CULTIVO DE MICROORGANISMOS MEDIOS DE CULTIVO CULTIVO DE MICROORGANISMOS fuente de energía exógena nutrientes esenciales: agua, carbón, nitrógeno, minerales condiciones ambientales apropiadas: ph, temperatura,
CULTIVO DE MICROORGANISMOS MEDIOS DE CULTIVO CULTIVO DE MICROORGANISMOS fuente de energía exógena nutrientes esenciales: agua, carbón, nitrógeno, minerales condiciones ambientales apropiadas: ph, temperatura,
DESCRIPCION DE BIOCOUNTER
 DESCRIPCION DE BIOCOUNTER BIOCOUNTER es un Laminocultivo para Control Microbiológico Industrial utilizado ampliamente en el campo alimentario y áreas relacionadas. El análisis microbiológico realizado
DESCRIPCION DE BIOCOUNTER BIOCOUNTER es un Laminocultivo para Control Microbiológico Industrial utilizado ampliamente en el campo alimentario y áreas relacionadas. El análisis microbiológico realizado
COMO ABORDAR Y RESOLVER ASPECTOS PRÁCTICOS DE MICROBIOLOGÍA
 COMO ABORDAR Y RESOLVER ASPECTOS PRÁCTICOS DE MICROBIOLOGÍA PROPUESTA DE EJERCICIOS Inés Arana, Maite Orruño e Isabel Barcina Departamento Inmunología, Microbiología y Parasitología Universidad del País
COMO ABORDAR Y RESOLVER ASPECTOS PRÁCTICOS DE MICROBIOLOGÍA PROPUESTA DE EJERCICIOS Inés Arana, Maite Orruño e Isabel Barcina Departamento Inmunología, Microbiología y Parasitología Universidad del País
MISIÓN DE UN SERVICIO DE MICROBIOLOGÍA Información necesaria para tomar una decisión clínica o industrial, y adopción de medidas preventivas. Normas d
 DIAGNÓSTICO MICROBIOLÓGICO 1 MISIÓN DE UN SERVICIO DE MICROBIOLOGÍA Información necesaria para tomar una decisión clínica o industrial, y adopción de medidas preventivas. Normas de obtención de muestras
DIAGNÓSTICO MICROBIOLÓGICO 1 MISIÓN DE UN SERVICIO DE MICROBIOLOGÍA Información necesaria para tomar una decisión clínica o industrial, y adopción de medidas preventivas. Normas de obtención de muestras
Taller Pruebas de Susceptibilidad a los antifúngicos
 Taller Pruebas de Susceptibilidad a los antifúngicos ngicos Susana CórdobaC Departamento Micología Instituto Nacional de Enfermedades Infecciosas ANLIS. Dr. Carlos G. Malbrán Buenos Aires. Argentina 2009
Taller Pruebas de Susceptibilidad a los antifúngicos ngicos Susana CórdobaC Departamento Micología Instituto Nacional de Enfermedades Infecciosas ANLIS. Dr. Carlos G. Malbrán Buenos Aires. Argentina 2009
TEMA 12. Pruebas de sensibilidad a los antimicrobianos
 TEMA 12 Pruebas de sensibilidad a los antimicrobianos Tema 12. Pruebas de sensibilidad a los antimicrobianos 1. Nacimiento de la era de los antibióticos 2. Pruebas de sensibilidad a los antimicrobianos
TEMA 12 Pruebas de sensibilidad a los antimicrobianos Tema 12. Pruebas de sensibilidad a los antimicrobianos 1. Nacimiento de la era de los antibióticos 2. Pruebas de sensibilidad a los antimicrobianos
Tarea de aula IV Crecimiento bacteriano y efecto de los antibióticos
 Fisiología Bacteriana Tarea de aula IV Crecimiento bacteriano y efecto de los antibióticos Trabajos Prácticos TP 1: Esterilización y técnicas asépticas. TP2: Aisalmiento de microorganismos y medios de
Fisiología Bacteriana Tarea de aula IV Crecimiento bacteriano y efecto de los antibióticos Trabajos Prácticos TP 1: Esterilización y técnicas asépticas. TP2: Aisalmiento de microorganismos y medios de
Universidad de Los Andes Facultad de Farmacia y Bioanálisis Escuela de Bioanálisis Mérida Edo. Mérida
 Universidad de Los Andes Facultad de Farmacia y Bioanálisis Escuela de Bioanálisis Mérida Edo. Mérida Determinación de actividad biológica de extractos crudos obtenidos de esponjas marinas autóctonas de
Universidad de Los Andes Facultad de Farmacia y Bioanálisis Escuela de Bioanálisis Mérida Edo. Mérida Determinación de actividad biológica de extractos crudos obtenidos de esponjas marinas autóctonas de
MANUAL DE NORMAS Y PROCEDIMIENTOS PROCEDIMIENTO: CONTROL DE CALIDAD INTERNO
 UNIDAD DE LABORATORIO 1 DE 8 I. INTRODUCCIÓN La Garantía de calidad es un conjunto de procedimientos utilizados para asegurar la calidad de los resultados finales, cubriendo con ello todas las fases del
UNIDAD DE LABORATORIO 1 DE 8 I. INTRODUCCIÓN La Garantía de calidad es un conjunto de procedimientos utilizados para asegurar la calidad de los resultados finales, cubriendo con ello todas las fases del
INFORME DE EVALUACIÓN DE DESINFECTANTES
 Página1., EL LÍDER MUNDIAL EN CERTIFICACIÓN, INSPECCIÓN Y CONTROL DE CALIDAD INFORME DE EVALUACIÓN DE DESINFECTANTES WellHome Ltda OL:268806 RUT : 77.760.020-6 ATENCIÓN A : Andrea Prenzlau DIRECCIÓN :
Página1., EL LÍDER MUNDIAL EN CERTIFICACIÓN, INSPECCIÓN Y CONTROL DE CALIDAD INFORME DE EVALUACIÓN DE DESINFECTANTES WellHome Ltda OL:268806 RUT : 77.760.020-6 ATENCIÓN A : Andrea Prenzlau DIRECCIÓN :
USO: MEDIO ENRIQUECIDO QUE PERMITE EL CRECIMIENTO DE MICROORGANISMOS EXIGENTES COMO HAEMOPHILUS, NEISSERIA Y LISTERIA.
 AGAR CHOCOLATE SUPLEMENTADO USO: MEDIO ENRIQUECIDO QUE PERMITE EL CRECIMIENTO DE MICROORGANISMOS EXIGENTES COMO HAEMOPHILUS, NEISSERIA Y LISTERIA. AGAR 10.0 g FOSFATO DIPOTASICO ALMIDON DE 1.0 g FOSFATO
AGAR CHOCOLATE SUPLEMENTADO USO: MEDIO ENRIQUECIDO QUE PERMITE EL CRECIMIENTO DE MICROORGANISMOS EXIGENTES COMO HAEMOPHILUS, NEISSERIA Y LISTERIA. AGAR 10.0 g FOSFATO DIPOTASICO ALMIDON DE 1.0 g FOSFATO
RESULTADOS. Estandarización del Ensayo de Actividad Antiproliferativa de Propóleos Sobre Trofozoítos de G. lamblia
 RESULTADOS Para cumplir con los objetivos del proyecto fue necesaria la recolección de muestras de propóleos de diferentes regiones del estado de Sonora: Caborca (PC), Pueblo de Álamos (PPA) y Ures (PU),
RESULTADOS Para cumplir con los objetivos del proyecto fue necesaria la recolección de muestras de propóleos de diferentes regiones del estado de Sonora: Caborca (PC), Pueblo de Álamos (PPA) y Ures (PU),
ACTIVIDAD METABOLICA CUARTA PARTE
 UATA PATE ATIVIDAD METABOLIA UO DE LOS OBJETIVOS FUDAMETALES de la Ecología Microbiana es el estudio de la actividad metabólica de los microorganismos en su ambiente natural o bajo condiciones de laboratorio
UATA PATE ATIVIDAD METABOLIA UO DE LOS OBJETIVOS FUDAMETALES de la Ecología Microbiana es el estudio de la actividad metabólica de los microorganismos en su ambiente natural o bajo condiciones de laboratorio
Pruebas de sensibilidad a antifúngicos
 Pruebas de sensibilidad a antifúngicos Las pruebas de sensibilidad tienen como objetivo conocer si los microorganismos ensayados son sensibles o resistentes a los antimicrobianos y sirven para elegir de
Pruebas de sensibilidad a antifúngicos Las pruebas de sensibilidad tienen como objetivo conocer si los microorganismos ensayados son sensibles o resistentes a los antimicrobianos y sirven para elegir de
3M Petrifilm Simplemente rápidas, precisas y productivas
 3M Petrifilm Simplemente rápidas, precisas y productivas Simplemente revolucionario El pequeño punto rojo que cambió la microbiología Las Placas 3M Petrifilm comenzaron con la curiosidad de un microbiólogo
3M Petrifilm Simplemente rápidas, precisas y productivas Simplemente revolucionario El pequeño punto rojo que cambió la microbiología Las Placas 3M Petrifilm comenzaron con la curiosidad de un microbiólogo
Crecimiento microbiano
 CONCEPTOS PRELIMINARES: 1) Crecimiento celular Vs crecimiento poblacional: En microbiología el término «crecimiento» se refiere a una población microbiana. Como ejemplo, valga una de las tareas que hacemos
CONCEPTOS PRELIMINARES: 1) Crecimiento celular Vs crecimiento poblacional: En microbiología el término «crecimiento» se refiere a una población microbiana. Como ejemplo, valga una de las tareas que hacemos
2. Examen microbiológico de productos no estériles: pruebas de microorganismos específicos
 PROGRAMA CURSO VALIDACIONES MICROBIOLÓGICAS: FARMACOPÉICAS Y NO FARMACOPÉICAS CÓD. SENCE: 1237975004 OBJETIVOS DEL CURSO: Entregar conceptos que permitirán definir los parámetros para la validación de
PROGRAMA CURSO VALIDACIONES MICROBIOLÓGICAS: FARMACOPÉICAS Y NO FARMACOPÉICAS CÓD. SENCE: 1237975004 OBJETIVOS DEL CURSO: Entregar conceptos que permitirán definir los parámetros para la validación de
OBTENCIÓN DE AMILASAS FÚNGICAS A PARTIR DE Aspergillus sp. AISLADO DE SEMILLAS DE LENTEJAS C. Castro 1, C. Navas 2, O. Caro 3, Y. Piñeros 4* 1, 2, 3
 1 OBTENCIÓN DE AMILASAS FÚNGICAS A PARTIR DE Aspergillus sp. AISLADO DE SEMILLAS DE LENTEJAS C. Castro 1, C. Navas 2, O. Caro 3, Y. Piñeros 4* 1, 2, 3 Estudiantes Ingeniería de Alimentos, Universidad de
1 OBTENCIÓN DE AMILASAS FÚNGICAS A PARTIR DE Aspergillus sp. AISLADO DE SEMILLAS DE LENTEJAS C. Castro 1, C. Navas 2, O. Caro 3, Y. Piñeros 4* 1, 2, 3 Estudiantes Ingeniería de Alimentos, Universidad de
Conservación y actividad probiótica de biomasa cultivada en sustratos naturales
 Conservación y actividad probiótica de biomasa cultivada en sustratos naturales Resumen M. en C. Román Jiménez Vera M. en C. Nicolás González Cortés M. A. E. S. Arturo Magaña Contreras Est. IA. Cristina
Conservación y actividad probiótica de biomasa cultivada en sustratos naturales Resumen M. en C. Román Jiménez Vera M. en C. Nicolás González Cortés M. A. E. S. Arturo Magaña Contreras Est. IA. Cristina
Puntos de corte para definir sensibilidad a los antimicrobianos
 Puntos de corte para definir sensibilidad a los antimicrobianos JEHA Dra. Liliana Fernández Canigia Microbiología- Hospital Alemán 2012 Consideraciones generales I Los microorganismos que con mayor frecuencia
Puntos de corte para definir sensibilidad a los antimicrobianos JEHA Dra. Liliana Fernández Canigia Microbiología- Hospital Alemán 2012 Consideraciones generales I Los microorganismos que con mayor frecuencia
LEVADURAS DE INTERÉS MÉDICO PRUEBAS DE IDENTIFICACIÓN
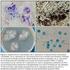 LEVADURAS DE INTERÉS MÉDICO PRUEBAS DE IDENTIFICACIÓN Levaduras de Importancia Médica Levaduras del género Candida Levaduras del género Cryptococcus Levaduras del género Malassezia Levaduras del género
LEVADURAS DE INTERÉS MÉDICO PRUEBAS DE IDENTIFICACIÓN Levaduras de Importancia Médica Levaduras del género Candida Levaduras del género Cryptococcus Levaduras del género Malassezia Levaduras del género
PRACTICAS ADECUADAS EN EL LABORATORIO DE MICROBIOLOGIA CAPITULO 1117, 1051 (USP 40) Farmacopea Nacional de los Estados Unidos Mexicanos (FEUM)
 PRACTICAS ADECUADAS EN EL LABORATORIO DE MICROBIOLOGIA CAPITULO 1117, 1051 (USP 40) Farmacopea Nacional de los Estados Unidos Mexicanos (FEUM) Norma Oficial Mexicana NOM-059-SSA1-2015 INSTALACIONES Áreas
PRACTICAS ADECUADAS EN EL LABORATORIO DE MICROBIOLOGIA CAPITULO 1117, 1051 (USP 40) Farmacopea Nacional de los Estados Unidos Mexicanos (FEUM) Norma Oficial Mexicana NOM-059-SSA1-2015 INSTALACIONES Áreas
UNIVERSIDAD NACIONAL MAYOR DE SAN MARCOS FACULTAD DE MEDICINA VETERINARIA LABORATORIO DE PATOLOGIA CLINICA
 INFORME DE EVALUACIÓN ANTIBIOTICA N DE REGISTRO DEL ANÁLISIS: 318-08 SOLICITANTE: REFERENTE: AGROVET MARKET S.A. Umberto Calderón Ojeda IDENTIFICACION DE PRODUCTO Nombre Comercial: Principio Activo: CEFA-MILK
INFORME DE EVALUACIÓN ANTIBIOTICA N DE REGISTRO DEL ANÁLISIS: 318-08 SOLICITANTE: REFERENTE: AGROVET MARKET S.A. Umberto Calderón Ojeda IDENTIFICACION DE PRODUCTO Nombre Comercial: Principio Activo: CEFA-MILK
UNIVERSIDAD NACIONAL MAYOR DE SAN MARCOS
 INFORME DE EVALUACIÓN ANTIBIOTICA N DE REGISTRO DEL ANÁLISIS: 690-05 SOLICITANTE: REFERENTE: AGROVET MARKET S.A. Umberto Calderón Ojeda IDENTIFICACION DE PRODUCTO Nombre Comercial: Principio Activo: Tilosina
INFORME DE EVALUACIÓN ANTIBIOTICA N DE REGISTRO DEL ANÁLISIS: 690-05 SOLICITANTE: REFERENTE: AGROVET MARKET S.A. Umberto Calderón Ojeda IDENTIFICACION DE PRODUCTO Nombre Comercial: Principio Activo: Tilosina
INSTRUCCIONES DE USO. USO PREVISTO Agar Cromogenico Salmonella está recomendado para el aislamiento de salmonella a partir de muestras clínicas.
 INSTRUCCIONES DE USO Revisión 2 Feb.2017 AGAR CROMOGENICO SALMONELLA Agar Cromogenico Salmonella presentación 575 gramos, 5, 25, 50 kilos. Catálogo 1122 Agar Cromogenico Salmonella presentación placas
INSTRUCCIONES DE USO Revisión 2 Feb.2017 AGAR CROMOGENICO SALMONELLA Agar Cromogenico Salmonella presentación 575 gramos, 5, 25, 50 kilos. Catálogo 1122 Agar Cromogenico Salmonella presentación placas
En la naturaleza los microorganismos se encuentran en poblaciones mixtas de varios tipos. Para todos los estudios llevados a cabo en el laboratorio
 En la naturaleza los microorganismos se encuentran en poblaciones mixtas de varios tipos. Para todos los estudios llevados a cabo en el laboratorio de microbiología se requiere un cultivo axénico, es decir,
En la naturaleza los microorganismos se encuentran en poblaciones mixtas de varios tipos. Para todos los estudios llevados a cabo en el laboratorio de microbiología se requiere un cultivo axénico, es decir,
PRODUCCIÓN DE AGENTES DE CONTROL BIOLÓGICO. M. Pía Cerdeiras CATEDRA DE MICROBIOLOGÍA FACULTAD DE QUIMICA
 PRODUCCIÓN DE AGENTES DE CONTROL BIOLÓGICO M. Pía Cerdeiras CATEDRA DE MICROBIOLOGÍA FACULTAD DE QUIMICA Requisitos para el desarrollo de un ACB Selección de un agente superior. Producción abundante y
PRODUCCIÓN DE AGENTES DE CONTROL BIOLÓGICO M. Pía Cerdeiras CATEDRA DE MICROBIOLOGÍA FACULTAD DE QUIMICA Requisitos para el desarrollo de un ACB Selección de un agente superior. Producción abundante y
Estructura y actividad de los antifúngicos. Dr. Maximiliano Sortino
 Estructura y actividad de los antifúngicos Dr. Maximiliano Sortino DEFINICIÓN Agente antifúngico o antimicótico: cualquier sustancia capaz de producir una alteración tal de las estructuras de una célula
Estructura y actividad de los antifúngicos Dr. Maximiliano Sortino DEFINICIÓN Agente antifúngico o antimicótico: cualquier sustancia capaz de producir una alteración tal de las estructuras de una célula
Tema I Introducción al estudio de los agentes biológicos de importancia médica. Metabolismo, nutrición, cultivo y crecimiento microbiano
 Tema I Introducción al estudio de los agentes biológicos de importancia médica. Metabolismo, nutrición, cultivo y crecimiento microbiano Objetivos Explicar los principios generales del metabolismo microbiano.
Tema I Introducción al estudio de los agentes biológicos de importancia médica. Metabolismo, nutrición, cultivo y crecimiento microbiano Objetivos Explicar los principios generales del metabolismo microbiano.
Microbiología. Trabajo Práctico 3. Cultivo e identificación de bacterias. GRACIELA NATALIA PUCCI
 Microbiología Trabajo Práctico 3. Cultivo e identificación de bacterias. GRACIELA NATALIA PUCCI Objetivos: Reconocer los distintos medios de cultivo utilizados para la recuperación de bacterias, y comprender
Microbiología Trabajo Práctico 3. Cultivo e identificación de bacterias. GRACIELA NATALIA PUCCI Objetivos: Reconocer los distintos medios de cultivo utilizados para la recuperación de bacterias, y comprender
UNIVERSIDAD NACIONAL MAYOR DE SAN MARCOS FACULTAD DE MEDICINA VETERINARIA LABORATORIO DE PATOLOGIA CLINICA
 INFORME DE EVALUACIÓN ANTIBIOTICA N DE REGISTRO DEL ANÁLISIS: 317-08 SOLICITANTE: REFERENTE: AGROVET MARKET S.A. Umberto Calderón Ojeda IDENTIFICACION DE PRODUCTO Nombre Comercial: Principio Activo: Cefalexina
INFORME DE EVALUACIÓN ANTIBIOTICA N DE REGISTRO DEL ANÁLISIS: 317-08 SOLICITANTE: REFERENTE: AGROVET MARKET S.A. Umberto Calderón Ojeda IDENTIFICACION DE PRODUCTO Nombre Comercial: Principio Activo: Cefalexina
MEDIOS DE CULTIVO. Microbiología Lic. en Biología Molecular FQBF-UNSL Marzo 2017
 MEDIOS DE CULTIVO Microbiología Lic. en Biología Molecular FQBF-UNSL Marzo 2017 PROCARIOTAS Bacterias Hongos y levaduras www.profesorenlinea.cl Cianobacterias EUCARIOTAS Protistas urbinavinos.blogspot.com
MEDIOS DE CULTIVO Microbiología Lic. en Biología Molecular FQBF-UNSL Marzo 2017 PROCARIOTAS Bacterias Hongos y levaduras www.profesorenlinea.cl Cianobacterias EUCARIOTAS Protistas urbinavinos.blogspot.com
USP FEUM ÍFICO CIENT Límites microbianos ENCUENTRO MEMORIAS
 Límites microbianos Origen de técnicas de cultivo en medios sólidos En 1881 dentro del Congreso Médico Internacional en Londres, Robert Koch describió un método de cultivo de microorganismos empleando
Límites microbianos Origen de técnicas de cultivo en medios sólidos En 1881 dentro del Congreso Médico Internacional en Londres, Robert Koch describió un método de cultivo de microorganismos empleando
PROGRAMA DE MEJORA DE LA CALIDAD PLAN ESTRATEGICO GENERAL Planes de formación e innovación MEMORIA DE RESULTADOS. Título del Proyecto
 PROGRAMA DE MEJORA DE LA CALIDAD PLAN ESTRATEGICO GENERAL 2013-2018 Planes de formación e innovación MEMORIA DE RESULTADOS Título del Proyecto Implementación de una nueva práctica de aislamiento e identificación
PROGRAMA DE MEJORA DE LA CALIDAD PLAN ESTRATEGICO GENERAL 2013-2018 Planes de formación e innovación MEMORIA DE RESULTADOS Título del Proyecto Implementación de una nueva práctica de aislamiento e identificación
PROCEDIMIENTO TECNICA NMP STAPHYLOCOCCUS AUREUS EN ALIMENTOS. BAM ONLINE 2001
 PRT-712.02-025 Página 1 de 9 1. OBJETIVO Estimar la densidad de bacterias S. aureus en matrices de alimento o agua como indicador sanitario 2. CAMPO DE APLICACIÓN Y ALCANCE El método de NMP es recomendado
PRT-712.02-025 Página 1 de 9 1. OBJETIVO Estimar la densidad de bacterias S. aureus en matrices de alimento o agua como indicador sanitario 2. CAMPO DE APLICACIÓN Y ALCANCE El método de NMP es recomendado
Logros. Crecimiento bacteriano. Crecimiento. Finalidad de las bacterias
 Fisiología bacteriana Dr. Juan C. Salazar jcsalazar@med.uchile.cl Programa de Microbiología y Micología ICBM, Facultad de Medicina Finalidad de las bacterias Logros Crecimiento Cómo lo hacen? Herramientas
Fisiología bacteriana Dr. Juan C. Salazar jcsalazar@med.uchile.cl Programa de Microbiología y Micología ICBM, Facultad de Medicina Finalidad de las bacterias Logros Crecimiento Cómo lo hacen? Herramientas
5.2 Preparación del inóculo
 Américas, Puebla, las cuales se mantuvieron en agar papa dextrosa (Merck, Merck México) y se resembraron periódicamente cada 20 días (López-Malo, 1995). 5.2 Preparación del inóculo Se preparó el inóculo,
Américas, Puebla, las cuales se mantuvieron en agar papa dextrosa (Merck, Merck México) y se resembraron periódicamente cada 20 días (López-Malo, 1995). 5.2 Preparación del inóculo Se preparó el inóculo,
Trabajo Práctico Nº4: Análisis Bacteriológico del Agua. Lic Soria José
 Trabajo Práctico Nº4: Análisis Bacteriológico del Agua Lic Soria José Las fuentes del Agua Se considera agua potable de suministro público y agua potable de uso domiciliario la que es apta para la alimentación
Trabajo Práctico Nº4: Análisis Bacteriológico del Agua Lic Soria José Las fuentes del Agua Se considera agua potable de suministro público y agua potable de uso domiciliario la que es apta para la alimentación
LABORATORIO INFECCIONES INTRAHOSPITALARIAS- IIH CONTROL DE CALIDAD EXTERNO
 TALLER ANALISIS RESULTADOS PEEC BACTERIOLOGIA PROGRAMA: IDENTIFICACIÓN BACTERIANA Y SUSCEPTIBILIDAD ANTIMICROBIANA LABORATORIO INFECCIONES INTRAHOSPITALARIAS- IIH ACTIVIDADES ABRIL 2011 TM M. Soledad Prat.
TALLER ANALISIS RESULTADOS PEEC BACTERIOLOGIA PROGRAMA: IDENTIFICACIÓN BACTERIANA Y SUSCEPTIBILIDAD ANTIMICROBIANA LABORATORIO INFECCIONES INTRAHOSPITALARIAS- IIH ACTIVIDADES ABRIL 2011 TM M. Soledad Prat.
LABORATORIO INFECCIONES INTRAHOSPITALARIAS- IIH
 TALLER ANALISIS RESULTADOS PEEC BACTERIOLOGIA PROGRAMA: IDENTIFICACIÓN BACTERIANA Y SUSCEPTIBILIDAD ANTIMICROBIANA LABORATORIO INFECCIONES INTRAHOSPITALARIAS- IIH ACTIVIDADES ABRIL 2011 TM M. Soledad Prat.
TALLER ANALISIS RESULTADOS PEEC BACTERIOLOGIA PROGRAMA: IDENTIFICACIÓN BACTERIANA Y SUSCEPTIBILIDAD ANTIMICROBIANA LABORATORIO INFECCIONES INTRAHOSPITALARIAS- IIH ACTIVIDADES ABRIL 2011 TM M. Soledad Prat.
III. MATERIALES Y MÉTODOS
 III. MATERIALES Y MÉTODOS 1. EVALUACIÓN PRELIMINAR DE LA CAPACIDAD CELULOLÍTICA. 1.1. Material Biológico: Se trabajó con cepas celulolíticas aisladas en el año 1990 a partir de muestras de tierra con hojarascas
III. MATERIALES Y MÉTODOS 1. EVALUACIÓN PRELIMINAR DE LA CAPACIDAD CELULOLÍTICA. 1.1. Material Biológico: Se trabajó con cepas celulolíticas aisladas en el año 1990 a partir de muestras de tierra con hojarascas
QUÉ CONTIENE UN MEDIO? Aquellos requerimientos nutricionales que los microorganismos necesitan para crecer. Depende del ambiente en donde viven.
 OBJETIVOS u Diferenciar entre ciertos tipos de medios u Conocer actividades bioquímicas de las bacterias u Conocer los procesos bioquímicos de fermentación u Descibir los patrones de fermentación de carbohidratos
OBJETIVOS u Diferenciar entre ciertos tipos de medios u Conocer actividades bioquímicas de las bacterias u Conocer los procesos bioquímicos de fermentación u Descibir los patrones de fermentación de carbohidratos
MICROBIOLOGÍA AGROINDUSTRIAL I- UNIDAD REPASO DE CLASES PRÁCTICAS. Dra. Flor Teresa García Huamán
 MICROBIOLOGÍA AGROINDUSTRIAL I- UNIDAD REPASO DE CLASES PRÁCTICAS 1 1. AISLAMIENTO DE BACTERIAS PRODUCTORAS DE AMILASAS. 2. TÉCNICAS DE SEMBRADO. 3. DETERMINACIÓN DE BACTERIAS DE UNA MUESTRA: RECUENTO
MICROBIOLOGÍA AGROINDUSTRIAL I- UNIDAD REPASO DE CLASES PRÁCTICAS 1 1. AISLAMIENTO DE BACTERIAS PRODUCTORAS DE AMILASAS. 2. TÉCNICAS DE SEMBRADO. 3. DETERMINACIÓN DE BACTERIAS DE UNA MUESTRA: RECUENTO
FICHA TÉCNICA: Rev. : Septiembre/2009. Producto: SABOURAUD AGAR WITH CHLORAMPHENICOL Y CYCLOHEXIMIDE
 FICHA TÉCNICA: 770343 Rev. : Septiembre/2009 Producto: SABOURAUD AGAR WITH CHLORAMPHENICOL Y CYCLOHEXIMIDE PLACAS DE 90 mm USO El Agar Sabouraud Dextrosa con Cloranfenicol y Cicloheximida, es un medio
FICHA TÉCNICA: 770343 Rev. : Septiembre/2009 Producto: SABOURAUD AGAR WITH CHLORAMPHENICOL Y CYCLOHEXIMIDE PLACAS DE 90 mm USO El Agar Sabouraud Dextrosa con Cloranfenicol y Cicloheximida, es un medio
MICROBIOLOGÍA AGRÍCOLA
 MICROBIOLOGÍA AGRÍCOLA CONTROL DE LA CALIDAD DE ALIMENTOS Año 2015 TRABAJO PRÁCTICO N 9 PRÁCTICO N 9 CONTROL DE LA CALIDAD DE ALIMENTOS Objetivos: Conocer posibles contaminantes en alimentos. Conocer la
MICROBIOLOGÍA AGRÍCOLA CONTROL DE LA CALIDAD DE ALIMENTOS Año 2015 TRABAJO PRÁCTICO N 9 PRÁCTICO N 9 CONTROL DE LA CALIDAD DE ALIMENTOS Objetivos: Conocer posibles contaminantes en alimentos. Conocer la
TEMA 10. DIAGNÓSTICO DE LABORATORIO DE LAS ENFERMEDADES INFECCIOSAS BUCODENTALES
 TEMA 10. DIAGNÓSTICO DE LABORATORIO DE LAS ENFERMEDADES INFECCIOSAS BUCODENTALES 1. Objetivo del diagnóstico microbiológico 2. Toma de muestra 3. Diagnóstico directo - bacterias - hongos - protozoos -
TEMA 10. DIAGNÓSTICO DE LABORATORIO DE LAS ENFERMEDADES INFECCIOSAS BUCODENTALES 1. Objetivo del diagnóstico microbiológico 2. Toma de muestra 3. Diagnóstico directo - bacterias - hongos - protozoos -
Laboratorio de Agroindustria II. Calidad de Leche
 Laboratorio de Agroindustria II. Calidad de Leche Medio de cultivo: Caldo lactosado biliado verde brillante (Brilliant Green Bile Lactose: BGBL) Composición - Peptona 10 g. - Lactosa 10 g. - Bilis de buey
Laboratorio de Agroindustria II. Calidad de Leche Medio de cultivo: Caldo lactosado biliado verde brillante (Brilliant Green Bile Lactose: BGBL) Composición - Peptona 10 g. - Lactosa 10 g. - Bilis de buey
Panorama Nacional de Resistencia Antimicotica
 VIII Curso de Actualización en Infecciones Nosocomiales y II Seminario de Bacteriemias Relacionadas a Líneas Intravasculares Panorama Nacional de Resistencia Antimicotica Dr. Rodolfo Jiménez Juárez Jefe
VIII Curso de Actualización en Infecciones Nosocomiales y II Seminario de Bacteriemias Relacionadas a Líneas Intravasculares Panorama Nacional de Resistencia Antimicotica Dr. Rodolfo Jiménez Juárez Jefe
CAPÍTULO 7 DISCUSIÓN. 7.1 Caracterización fisicoquímica del suelo. La caracterización del suelo mostró un suelo pobre en nutrientes (fósforo y
 CAPÍTULO 7 DISCUSIÓN 7.1 Caracterización fisicoquímica del suelo La caracterización del suelo mostró un suelo pobre en nutrientes (fósforo y nitrógeno) con textura franco arenosa, un ph ligeramente ácido
CAPÍTULO 7 DISCUSIÓN 7.1 Caracterización fisicoquímica del suelo La caracterización del suelo mostró un suelo pobre en nutrientes (fósforo y nitrógeno) con textura franco arenosa, un ph ligeramente ácido
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA
 PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
Universidad de San Carlos de Guatemala Facultad de Ciencias Médicas Fase II - Unidad Didáctica de Inmunología - Microbiología Médicas
 Universidad de San Carlos de Guatemala Facultad de Ciencias Médicas Fase II - Unidad Didáctica de Inmunología - Microbiología Médicas Dr. Alejandro Samayoa Introducción: Este instructivo proporciona al
Universidad de San Carlos de Guatemala Facultad de Ciencias Médicas Fase II - Unidad Didáctica de Inmunología - Microbiología Médicas Dr. Alejandro Samayoa Introducción: Este instructivo proporciona al
Gelatina Ácido ascórbico Carbón
 Instrucciones de uso n Epower USO PREVISTO Los microorganismos Epower son preparaciones cuantitativas liofilizadas de microorganismos destinadas al uso en laboratorios industriales para fines de control
Instrucciones de uso n Epower USO PREVISTO Los microorganismos Epower son preparaciones cuantitativas liofilizadas de microorganismos destinadas al uso en laboratorios industriales para fines de control
revolucionario Simplemente Une los puntos La fascinante historia detrás del pequeño punto rojo Une los puntos. Soluciones Punto-a-punto
 revolucionario La fascinante historia detrás del pequeño punto rojo Las placas 3M Petrifilm comenzaron con la curiosidad de un microbiólogo y la colaboración con otros científicos, condujo a nuevos descubrimientos
revolucionario La fascinante historia detrás del pequeño punto rojo Las placas 3M Petrifilm comenzaron con la curiosidad de un microbiólogo y la colaboración con otros científicos, condujo a nuevos descubrimientos
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO )
 PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUANTITATIVO DE ORINA ANÁLISIS CUALITATIVO DE ORINA M-1 M-2 M-3 M-4 Lectura de la placa de Agar CLED Identificación presuntiva
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUANTITATIVO DE ORINA ANÁLISIS CUALITATIVO DE ORINA M-1 M-2 M-3 M-4 Lectura de la placa de Agar CLED Identificación presuntiva
1. OBJETIVO Detectar enterotoxina A de C. perfringens por método de aglutinación pasiva en látex en cepas aisladas de alimentos
 PRT-712.04-080 Página 1 de 9 1. OBJETIVO Detectar enterotoxina A de C. perfringens por método de aglutinación pasiva en látex en cepas aisladas de alimentos 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este
PRT-712.04-080 Página 1 de 9 1. OBJETIVO Detectar enterotoxina A de C. perfringens por método de aglutinación pasiva en látex en cepas aisladas de alimentos 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este
LISOZIMA PRODUCTION BY ASPERGILLUS NIGER IN SUBMERGED AND SOLID- STATE FERMENTATION.
 LISOZIMA PRODUCTION BY ASPERGILLUS NIGER IN SUBMERGED AND SOLID- STATE FERMENTATION. Arroyo Ruiz A.; Romero Gómez S.J.; Facultad de Ciencias Químicas Universidad Autónoma De Querétaro RESUMEN En la presente
LISOZIMA PRODUCTION BY ASPERGILLUS NIGER IN SUBMERGED AND SOLID- STATE FERMENTATION. Arroyo Ruiz A.; Romero Gómez S.J.; Facultad de Ciencias Químicas Universidad Autónoma De Querétaro RESUMEN En la presente
Ejercicio 5 Actividades Bioquímicas En Bacterias
 Objetivos Ejercicio 5 Actividades Bioquímicas En Bacterias Entender los procesos bioquímicos de distintas reacciones enzimáticas como son las fermentaciones e hidrólisis. Describir el patrón de las reacciones
Objetivos Ejercicio 5 Actividades Bioquímicas En Bacterias Entender los procesos bioquímicos de distintas reacciones enzimáticas como son las fermentaciones e hidrólisis. Describir el patrón de las reacciones
DESCRIPCIÓN DE UN MÉTODO CUANTITATIVO DE PCR PARA LA ESTIMACIÓN DEL CONTENIDO DE VIRUS EN VACUNAS MULTIVALENTES DE ROTAVIRUS
 DESCRIPCIÓN DE UN MÉTODO CUANTITATIVO DE PCR PARA LA ESTIMACIÓN DEL CONTENIDO DE VIRUS EN VACUNAS MULTIVALENTES DE ROTAVIRUS María L. Pombo Departmento de Control de Vacunas Instituto Nacional de Higiene
DESCRIPCIÓN DE UN MÉTODO CUANTITATIVO DE PCR PARA LA ESTIMACIÓN DEL CONTENIDO DE VIRUS EN VACUNAS MULTIVALENTES DE ROTAVIRUS María L. Pombo Departmento de Control de Vacunas Instituto Nacional de Higiene
Demostración de la naturaleza proteica de la enzima catalasa en vegetales. I.- Introducción:
 Demostración de la naturaleza proteica de la enzima catalasa en vegetales I.- Introducción: Las enzimas están en el centro de cada proceso bioquímico. Actuando en secuencias organizadas catalizan cientos
Demostración de la naturaleza proteica de la enzima catalasa en vegetales I.- Introducción: Las enzimas están en el centro de cada proceso bioquímico. Actuando en secuencias organizadas catalizan cientos
DERMATOFITOSIS POR EPIDERMOPHYTON FLOCCOSUM. CASO 516
 DERMATOFITOSIS POR EPIDERMOPHYTON FLOCCOSUM. CASO 516 Varón de 40 años, sin antecedentes clínicos de interés, sano y que practica deporte con regularidad, que acude a consultas externas de Dermatología
DERMATOFITOSIS POR EPIDERMOPHYTON FLOCCOSUM. CASO 516 Varón de 40 años, sin antecedentes clínicos de interés, sano y que practica deporte con regularidad, que acude a consultas externas de Dermatología
10. APÉNDICE 10.1 Obtención de Extractos Metanólicos de Propóleos (EMP)
 10. APÉNDICE 10.1 Obtención de Extractos Metanólicos de Propóleos (EMP) Las muestras previamente molidas se colocan cada una sobre un matraz erlenmeyer. Adicionar 300mL de MeOH. Agitar por 24 horas con
10. APÉNDICE 10.1 Obtención de Extractos Metanólicos de Propóleos (EMP) Las muestras previamente molidas se colocan cada una sobre un matraz erlenmeyer. Adicionar 300mL de MeOH. Agitar por 24 horas con
IV. MATERIALES Y MÉTODOS. IV.1.
 IV. MATERIALES Y MÉTODOS. IV.1. Material Biológico IV.1.1. Organismos Para la obtención de las cepas bacterianas se utilizaron organismos adultos de Litopenaeus vannamei obtenidos de la empresa Acuacultores
IV. MATERIALES Y MÉTODOS. IV.1. Material Biológico IV.1.1. Organismos Para la obtención de las cepas bacterianas se utilizaron organismos adultos de Litopenaeus vannamei obtenidos de la empresa Acuacultores
Instructivo de Laboratorio. Cocos Piógenos
 Universidad de San Carlos de Guatemala Facultad de Ciencias Médicas Curso de Inmunología y Microbiología Tercer año, Fase II Instructivo de Laboratorio Cocos Piógenos Dra. Débora Esmeralda Aldana Introducción:
Universidad de San Carlos de Guatemala Facultad de Ciencias Médicas Curso de Inmunología y Microbiología Tercer año, Fase II Instructivo de Laboratorio Cocos Piógenos Dra. Débora Esmeralda Aldana Introducción:
Instructivo de Laboratorio. Cocos Piógenos
 Universidad de San Carlos de Guatemala Facultad de Ciencias Médicas Curso de Inmunología y Microbiología Tercer año, Fase II Instructivo de Laboratorio Cocos Piógenos Dra. Débora Esmeralda Aldana Introducción:
Universidad de San Carlos de Guatemala Facultad de Ciencias Médicas Curso de Inmunología y Microbiología Tercer año, Fase II Instructivo de Laboratorio Cocos Piógenos Dra. Débora Esmeralda Aldana Introducción:
APLICACION DEL SISTEMA BACTRAC IMPEDANCIA ELECTRICA EN ALIMENTACION
 APLICACION DEL SISTEMA BACTRAC IMPEDANCIA ELECTRICA EN ALIMENTACION Calidad microbiológica en la industria de alimentación CONTAMINACION DE LOS ALIMENTOS Multiplicación Alimentos alterados Alimentos peligrosos
APLICACION DEL SISTEMA BACTRAC IMPEDANCIA ELECTRICA EN ALIMENTACION Calidad microbiológica en la industria de alimentación CONTAMINACION DE LOS ALIMENTOS Multiplicación Alimentos alterados Alimentos peligrosos
Programa BIO 252 Biología de Microorganismos
 Programa BIO 252 Biología de Microorganismos 1. Identificación 1.- Profesor : Dr. Victoriano Campos 2.- Sigla : BIO 252 3.- Créditos : 4 4.- Pre-requisitos : BIO 240 5.- Horas Teóricas : 4 6.- Horas Prácticas
Programa BIO 252 Biología de Microorganismos 1. Identificación 1.- Profesor : Dr. Victoriano Campos 2.- Sigla : BIO 252 3.- Créditos : 4 4.- Pre-requisitos : BIO 240 5.- Horas Teóricas : 4 6.- Horas Prácticas
5 MATERIALES Y MÉTODOS
 5 MATERIALES Y MÉTODOS 5.1 Preparación del inoculo Se obtuvo del Laboratorio de Microbiología de Alimentos de la Universidad de las Américas, una cepa de Escherichia coli (ATCC 35218). Esta cepa se hizo
5 MATERIALES Y MÉTODOS 5.1 Preparación del inoculo Se obtuvo del Laboratorio de Microbiología de Alimentos de la Universidad de las Américas, una cepa de Escherichia coli (ATCC 35218). Esta cepa se hizo
Objetivo 1 Comprender las propiedades fisiológicas de las bacterias que explican su capacidad de producir daño en el hospedero
 Facultad de Medicina Universidad de Chile Fisiología Bases del diagnóstico Dra. M.Angélica Martínez Tagle Programa de Microbiología, ICBM Objetivo 1 Comprender las propiedades fisiológicas de las bacterias
Facultad de Medicina Universidad de Chile Fisiología Bases del diagnóstico Dra. M.Angélica Martínez Tagle Programa de Microbiología, ICBM Objetivo 1 Comprender las propiedades fisiológicas de las bacterias
SÍNTESIS DE LA PROGRAMACIÓN
 www.iesanctipetri.com Modelo MD7501PR05 Rev.: 1 Página 1 de 6 CURSO ACADÉMICO GRUPO MÓDULO PROFESOR/A 2017/2018 2ºLCB- A y B Microbiología clínica D. Manuel Prado Fernández D. José Nacente Aleu RESULTADOS
www.iesanctipetri.com Modelo MD7501PR05 Rev.: 1 Página 1 de 6 CURSO ACADÉMICO GRUPO MÓDULO PROFESOR/A 2017/2018 2ºLCB- A y B Microbiología clínica D. Manuel Prado Fernández D. José Nacente Aleu RESULTADOS
Ensayos microbiológicos
 Análisis rápidos para diagnóstico microbiológico y de higiene Para los siguientes tests en cubetas NANOCOLOR basados en reacciones bioquímicas consultar el capítulo NANOCOLOR el sistema para el análisis
Análisis rápidos para diagnóstico microbiológico y de higiene Para los siguientes tests en cubetas NANOCOLOR basados en reacciones bioquímicas consultar el capítulo NANOCOLOR el sistema para el análisis
LABORATORIO CONTROL MICROBIOLÓGICO SL.
 VALORACIÓN DE LA VIABILIDAD Y FUNGICA EN PLACA DE ESCAYOLA PARA FALSOS TECHOS REGISTRABLES INFORME DE ENSAYO Nº 200915 (Hoja 1 de 7) a) Laboratorio de ensayo... Control Microbiológico S.L. b) Cliente...
VALORACIÓN DE LA VIABILIDAD Y FUNGICA EN PLACA DE ESCAYOLA PARA FALSOS TECHOS REGISTRABLES INFORME DE ENSAYO Nº 200915 (Hoja 1 de 7) a) Laboratorio de ensayo... Control Microbiológico S.L. b) Cliente...
Estimación de Biomasa
 Estimación de Biomasa Dra. Alejandra Cardillo Proceso de producción Monitoreo de información ph Temperatura Biomasa po Concentración 2 de producto Sustrato consumido Estrategias de control Toma de decisiones
Estimación de Biomasa Dra. Alejandra Cardillo Proceso de producción Monitoreo de información ph Temperatura Biomasa po Concentración 2 de producto Sustrato consumido Estrategias de control Toma de decisiones
PROCEDIMIENTO DETECCIÓN Y ENUMERACIÓN POR NUMERO MAS PROBABLE (NMP) CON ETAPA DE PRE- ENRIQUECIMIENTO DE ENTEROBACTERIACEAE EN ALIMENTOS
 Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol.
 1. NOMBRE DEL MEDICAMENTO TROSID 280 mg/ml barniz de uñas medicamentoso 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol. Para consultar la
1. NOMBRE DEL MEDICAMENTO TROSID 280 mg/ml barniz de uñas medicamentoso 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol. Para consultar la
PRACTICA N 02: PROCESOS FERMENTATIVOS: PRODUCCION DE PROTEÍNA UNICELULAR O BIOMASA
 PRACTICA N 02: PROCESOS FERMENTATIVOS: PRODUCCION DE PROTEÍNA UNICELULAR O BIOMASA Capacidades a lograr: 1. Conoce y aplica técnicas de siembra, cultivo y cuantificación del proceso fermentativo para producción
PRACTICA N 02: PROCESOS FERMENTATIVOS: PRODUCCION DE PROTEÍNA UNICELULAR O BIOMASA Capacidades a lograr: 1. Conoce y aplica técnicas de siembra, cultivo y cuantificación del proceso fermentativo para producción
22.- Introducción a la Micología
 22.- Introducción a la Micología Introducción a la Micología Los hongos son organismos eucarióticos, no fotosintéticos (quimioorganotropos). Son abundantes en la naturaleza, en los suelos, cuerpos de agua,
22.- Introducción a la Micología Introducción a la Micología Los hongos son organismos eucarióticos, no fotosintéticos (quimioorganotropos). Son abundantes en la naturaleza, en los suelos, cuerpos de agua,
Revista Cubana de Plantas Medicinales. 2013;47(2):
 ARTÍCULO ORIGINAL Validación e implementación de una metodología para el análisis microbiológico de un producto líquido preservado, elaborado en una industria farmacéutica Validation and implementation
ARTÍCULO ORIGINAL Validación e implementación de una metodología para el análisis microbiológico de un producto líquido preservado, elaborado en una industria farmacéutica Validation and implementation
CONTENIDO DE HIERRO EN LAS LECHES DE FORMULA EMPLEADAS EN LA ALIMENTACIÓN INFANTIL: DISTRIBUCION EN EL SUERO LACTEO Y EN LA GRASA
 CONTENIDO DE HIERRO EN LAS LECHES DE FORMULA EMPLEADAS EN LA ALIMENTACIÓN INFANTIL: DISTRIBUCION EN EL SUERO LACTEO Y EN LA GRASA R. Domínguez 3,1, J.M. Fraga 1,2, J.A. Cocho 1,2, P. Bermejo 3, A. Bermejo
CONTENIDO DE HIERRO EN LAS LECHES DE FORMULA EMPLEADAS EN LA ALIMENTACIÓN INFANTIL: DISTRIBUCION EN EL SUERO LACTEO Y EN LA GRASA R. Domínguez 3,1, J.M. Fraga 1,2, J.A. Cocho 1,2, P. Bermejo 3, A. Bermejo
Medición del crecimiento Microbiano
 Medición del crecimiento Microbiano Determinación del número de microorganismos en una muestra. Determinación de la actividad metabólica, biomasa y proteínas. Métodos para el conteo de microorganismos
Medición del crecimiento Microbiano Determinación del número de microorganismos en una muestra. Determinación de la actividad metabólica, biomasa y proteínas. Métodos para el conteo de microorganismos
BIODETERIORO DEL PATRIMONIO FOTOGRÁFICO URUGUAYO PRODUCIDO POR HONGOS
 BIODETERIORO DEL PATRIMONIO FOTOGRÁFICO URUGUAYO PRODUCIDO POR HONGOS Silvina Soria; Belén Corallo, Dinorah Pan, Raquel Alonso y Lina Bettucci Laboratorio de Micología Facultad de Ciencias Espacio Interdisciplinario-UDELAR
BIODETERIORO DEL PATRIMONIO FOTOGRÁFICO URUGUAYO PRODUCIDO POR HONGOS Silvina Soria; Belén Corallo, Dinorah Pan, Raquel Alonso y Lina Bettucci Laboratorio de Micología Facultad de Ciencias Espacio Interdisciplinario-UDELAR
Fabricante ROSCO Diagnostica A/S, Taastrupgaardsvej 30, DK-2630 Taastrup, Denmark,
 Diatabs - Instrucciones de uso Revisión: DBV0008B Fecha de publicación: 12.04.2013 Idioma: Español Diatabs Para la identificación bacteriana Fabricante ROSCO Diagnostica A/S, Taastrupgaardsvej 30, DK-2630
Diatabs - Instrucciones de uso Revisión: DBV0008B Fecha de publicación: 12.04.2013 Idioma: Español Diatabs Para la identificación bacteriana Fabricante ROSCO Diagnostica A/S, Taastrupgaardsvej 30, DK-2630
OZOSYSTEMS-MODELO ESTERILIZADOR DE INSTRUMENTAL CONSIDERACIONES TÉCNICAS
 OZOSYSTEMS-MODELO ESTERILIZADOR DE INSTRUMENTAL CONSIDERACIONES TÉCNICAS El generador de ozono modelo OZOSYSTEMS Esterilizador de Instrumental es un armario destinado a la esterilización de instrumental
OZOSYSTEMS-MODELO ESTERILIZADOR DE INSTRUMENTAL CONSIDERACIONES TÉCNICAS El generador de ozono modelo OZOSYSTEMS Esterilizador de Instrumental es un armario destinado a la esterilización de instrumental
ESTANDARIZACIÓN DE UN MÉTODO A MICRO-ESCALA DE QUÍMICA SANGUÍNEA POR ESPECTROFOTOMETRÍA
 ESTANDARIZACIÓN DE UN MÉTODO A MICRO-ESCALA DE QUÍMICA SANGUÍNEA POR ESPECTROFOTOMETRÍA Maria José Falcón Iracheta y Dr. Jorge Alejandro Alegría Torres Laboratorio de Investigación Molecular en Nutrición
ESTANDARIZACIÓN DE UN MÉTODO A MICRO-ESCALA DE QUÍMICA SANGUÍNEA POR ESPECTROFOTOMETRÍA Maria José Falcón Iracheta y Dr. Jorge Alejandro Alegría Torres Laboratorio de Investigación Molecular en Nutrición
Fisiología bacteriana. José Miguel Amaro S. Profesor Asistente
 Fisiología bacteriana José Miguel Amaro S. Profesor Asistente Metabolismo bacteriano 3 funciones específicas Obtener energía química del entorno, almacenarla, para utilizar luego en diferentes funciones
Fisiología bacteriana José Miguel Amaro S. Profesor Asistente Metabolismo bacteriano 3 funciones específicas Obtener energía química del entorno, almacenarla, para utilizar luego en diferentes funciones
La mayor parte de las meningitis estan causadas por cepas no capsuladas y afectan a adultos con una mortalidad del 10%
 La introduccion de la vacuna conjugada frente a H. influenzae produjo una desaparicion casi absoluta de portadores faringeos asintomáticos y de la incidencia de meningitis y otras enfermedades invasivas
La introduccion de la vacuna conjugada frente a H. influenzae produjo una desaparicion casi absoluta de portadores faringeos asintomáticos y de la incidencia de meningitis y otras enfermedades invasivas
Detección de virus. Cuantificación de virus. Producción de virus
 Facultad de Ciencias Exactas y Naturales Universidad de Buenos Aires LOS CULTIVOS CELULARES EN VIROLOGIA Elsa B. Damonte 2018 LOS CULTIVOS CELULARES EN VIROLOGIA Detección de virus Cuantificación de virus
Facultad de Ciencias Exactas y Naturales Universidad de Buenos Aires LOS CULTIVOS CELULARES EN VIROLOGIA Elsa B. Damonte 2018 LOS CULTIVOS CELULARES EN VIROLOGIA Detección de virus Cuantificación de virus
