FICHA TECNICA. - Prevención de la coagulación en el circuito de circulación extracorpórea en la hemodiálisis.
|
|
|
- Miguel Ángel Redondo Nieto
- hace 7 años
- Vistas:
Transcripción
1 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Clexane 20 mg (2000 UI) ampollas Clexane 40 mg (4000 UI) ampollas 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Clexane 20 mg (2000 UI) ampollas Cada ampolla contiene: - Enoxaparina (D.C.I.) sódica: 20 mg (equivalente a 2000 UI)* - Agua para preparaciones inyectables c.s.p. 0,2 ml Clexane 40 mg (4000 UI) ampollas Cada ampolla contiene: - Enoxaparina (D.C.I.) sódica: 40 mg (equivalente a 4000 UI)* - Agua para preparaciones inyectables c.s.p. 0,4 ml * Valorada frente al primer estándar internacional OMS, para heparina de bajo peso molecular (HBPM), utilizando el método anti-xa amidolítico ATIII (CBS 31-39). 3. FORMA FARMACEUTICA Solución inyectable contenida en ampollas 4. DATOS CLINICOS 4.1. Indicaciones terapéuticas - Profilaxis de la trombosis venosa en pacientes quirúrgicos sometidos a cirugía ortopédica o cirugía general y en pacientes no quirúrgicos inmovilizados, cuya situación pueda definirse como de riesgo moderado o elevado - Prevención de la coagulación en el circuito de circulación extracorpórea en la hemodiálisis. - Tratamiento de la trombosis venosa profunda establecida (con o sin embolia pulmonar) - Tratamiento de angina inestable e infarto de miocardio sin onda Q, administrada conjuntamente con aspirina. 1
2 4.2. Posología y forma de administración Advertencia Las diferentes heparinas de bajo peso molecular no son necesariamente equivalentes. En consecuencia, se debe respetar la dosificación y el modo de empleo específico de cada una de estas especialidades farmacéuticas. Un miligramo de enoxaparina tiene una actividad anti-xa de 100 UI, aproximadamente. Profilaxis de la enfermedad tromboembólica venosa. 1. En pacientes quirúrgicos: En pacientes con riesgo moderado de tromboembolismo, por ejemplo en cirugía abdominal, la posología recomendada de enoxaparina es de 20mg (2000 UI) una vez al día, en inyección subcutánea. La primera inyección se efectuará alrededor de 2 horas antes de la intervención. Como norma general, se considera necesario mantener el tratamiento al menos 7 a 10 días después de la intervención En los pacientes de alto riesgo tromboembólico, por ejemplo en cirugía ortopédica, la posología recomendada de enoxaparina administrada por inyección subcutánea será de 40mg (4000 UI) una vez al día, administrando la primera inyección 12 horas antes de la intervención. La duración de la profilaxis coincidirá con la duración del riesgo tromboembólico venoso, según la estimación del médico.los datos clínicos apoyan su utilización durante un periodo máximo de cuatro semanas. Para recomendaciones especiales en lo referente a los intervalos de dosis para anestesia espinal/epidural y procedimientos de revascularización coronaria percutánea, ver: apartado 4.4 Advertencias. 2. En pacientes no quirúrgicos: En pacientes de riesgo moderado la posología será de 20 mg (2000 UI) una vez al día, en inyección subcutánea, y en pacientes de riesgo elevado de 40 mg (4000 UI) una vez al día en inyección subcutánea. La duración del tratamiento coincidirá con la duración del riesgo tromboembólico venoso, según la estimación del médico. Como norma general, se considera necesario mantener el tratamiento de 7 a 10 días, en base a los datos de los estudios clínicos realizados, que incluyeron únicamente pacientes inmovilizados por enfermedad aguda. - En condiciones normales, una dosis profiláctica de 20 mg (2000 UI) o 40 mg (4000 UI) no modifica las pruebas de coagulación, por lo que se hace innecesaria la monitorización rutinaria de dichas pruebas. - El paciente deberá estar en decúbito supino y la administración de enoxaparina debe ser realizada mediante inyección subcutánea profunda, normalmente en la pared abdominal antero-lateral o posterolateral, alternativamente del lado derecho y del lado izquierdo. La aguja deberá introducirse verticalmente en toda su longitud, en el espesor de un pliegue cutáneo tomado entre el pulgar y el índice del operador. Este pliegue cutáneo se debe mantener mientras se administra la inyección. Prevención de la coagulación en el circuito de circulación extracorpórea en la hemodiálisis: 2
3 - En los pacientes sometidos a sesiones de hemodiálisis repetidas, la prevención de la coagulación en el circuito de circulación extracorpórea se obtiene inyectando una dosis de 0,6 a 1 mg/kg ( UI/kg) en la línea arterial del circuito de diálisis, al comienzo de la sesión [0,8 a 1 mg ( UI/kg) para los casos de flujos bajos, unipunción, o diálisis superior a 4 horas]. En general, para un paciente tipo de unos 60 kg de peso, una dosis de 40 mg (4000 UI) es eficaz y bien tolerada. En caso de aparición de anillos de fibrina, se practicará una nueva inyección de 0,5 a 1 mg/kg ( UI/kg), en función del tiempo que reste hasta el final de la diálisis. - En pacientes de alto riesgo hemorrágico (en particular diálisis pre o post-operatorias), o que presenten un síndrome hemorrágico en evolución, las sesiones de diálisis se podrán efectuar utilizando una dosis de 0,4-0,5 mg/kg (40-50 UI/kg) (bipunción) o de 0,5-0,75 mg/kg (50-75 UI/kg) (unipunción). Tratamiento de la trombosis venosa profunda establecida: La administración de Clexane debe realizarse por vía subcutánea, inyectando o bien una vez al día 1,5 mg/kg de peso o bien 1 mg/kg de peso (100 UI/kg) dos veces al día. En pacientes con trastornos tromboembólicos complicados se recomienda la dosis de 1 mg/kg de peso dos veces al día La duración del tratamiento es, generalmente, de 10 días. Salvo contraindicación expresa, debe iniciarse tratamiento anticoagulante por vía oral lo antes posible y continuar el tratamiento con enoxaparina hasta que se haya alcanzado el efecto anticoagulante terapéutico (2 a 3 de INR). Tratamiento de angina inestable e infarto de miocardio sin onda Q: - La dosis recomendada de Clexane es 1 mg/kg de peso (100 UI/kg) cada 12 horas por vía subcutánea y administrada conjuntamente con aspirina por vía oral (de mg una vez al día). - En estos pacientes debe prescribirse el tratamiento con enoxaparina sódica durante un mínimo de dos días y continuar hasta la estabilización clínica. La duración máxima del tratamiento es 8 días. Observaciones generales: Ancianos: en los ancianos no se necesita ninguna reducción de la dosis, a menos que la función renal esté alterada (ver 4.4 Precauciones: Hemorragia en ancianos y 4.2 Posología y Forma de Administración: Insuficiencia renal Niños: la seguridad y la eficacia de la enoxaparina en niños no han sido establecidas. Insuficiencia hepática: en estos pacientes no se necesita ningún ajuste posológico a las dosis usadas en la profilaxis (ver 5.2. Propiedades farmacocinéticas). Insuficiencia renal: (ver 4.4 Precauciones: Insuficiencia renal y 5.3 Propiedades Farmacocinéticas: Insuficiencia renal). Insuficiencia renal grave: En pacientes con insuficiencia renal grave (aclaramiento de creatinina <30ml/min) se requiere un ajuste posológico, según se indica a continuación, ya que la exposición a la enoxaparina se incrementa significativamente en estos pacientes. Se recomiendan los siguientes ajustes posológicos en el tratamiento de la trombosis venosa profunda establecida y en el tratamiento de la angina inestable e infarto de miocardio sin onda Q 3
4 Posología estándar Insuficiencia renal grave 1 mg/kg dos veces al día 1 mg/kg una vez al día 1,5 mg/kg una vez al día 1 mg/kg una vez al día Se recomiendan los siguientes ajustes posológicos en la profilaxis de la enfermedad tromboembólica venosa Posología estándar Insuficiencia renal grave 40 mg una vez al día 20 mg una vez al día 20 mg una vez al día 20 mg una vez al día Estos ajustes posológicos recomendados, no afectan a la indicación de hemodiálisis. Insuficiencia renal leve o moderada Aunque no se necesita ningún ajuste posológico en pacientes con insuficiencia renal moderada (aclaramiento de creatinina ml/min) o leve (aclaramiento de creatinina ml/min), se recomienda una monitorización clínica cuidadosa Contraindicaciones - Hipersensibilidad a la enoxaparina. - Hipersensibilidad a la heparina o sustancias de origen porcino. - Hemorragias activas. - Historia de trombocitopenia o trombosis secundaria a la enoxaparina. - Endocarditis séptica. - Lesiones orgánicas que puedan determinar hemorragia, como la úlcera péptica activa y el ictus hemorrágico no debido a embolismo sistémico. - Trastornos hemorrágicos importantes ligados a alteraciones de la hemostasia, salvo la coagulación intravascular diseminada no relacionada con la heparina. - En pacientes que reciban heparina con fines de tratamiento y no de profilaxis, está contraindicada la utilización de anestesia regional en las intervenciones quirúrgicas programadas Advertencias y precauciones especiales de empleo - No administrar por vía intramuscular. - Al igual que otros anticoagulantes, la inyección de enoxaparina debe usarse con extrema precaución en las situaciones con aumento de riesgo de hemorragia, tales como alteraciones de la coagulación, insuficiencia hepática, historia de úlcera péptica, hipertensión arterial grave no controlada, retinopatía hipertensiva o diabética, anestesia espinal o epidural, permanencia de catéteres intratecales o postoperatorio inmediato oftalmológico o neurológico. - Anestesia espinal/epidural: En pacientes sometidos a anestesia epidural o espinal o a punción lumbar, la administración de heparina con fines profilácticos se ha asociado muy raramente a la 4
5 aparición de hematomas epidurales o espinales, con el resultado final de parálisis prolongada o permanente. Este riesgo se incrementa por el uso de catéteres epidurales o espinales para anestesia, la administración concomitante de medicamentos con efecto sobre la coagulación como antiinflamatorios no esteroídicos (AINES), antiagregantes plaquetarios o anticoagulantes, y por las punciones traumáticas o repetidas. - A la hora de decidir el intervalo de tiempo que debe transcurrir entre la administración de heparina a dosis profilácticas y la inserción o retirada de un cateter espinal o epidural, deben tenerse en cuenta las características del paciente y del producto, debiendo de transcurrir al menos doce horas para las heparinas de bajo peso molecular. Una vez insertado o retirado el catéter, deberán transcurrir al menos cuatro horas hasta la administración de una nueva dosis de heparina. La nueva dosis deberá retrasarse hasta que la intervención quirúrgica haya finalizado. - Si bajo criterio médico se decide administrar tratamiento anticoagulante durante un procedimiento anestésico espinal o peridural debe extremarse la la vigilancia del paciente para detectar precozmente cualquier signo o síntoma de déficit neurológico, como dolor lumbar, déficit sensorial y motor (entumecimiento y debilidad de extremidades inferiores ) y trastornos funcionales del intestino o vejiga. El personal de enfermería debe ser entrenado para detectar tales signos y síntomas. Asimismo, se advertirá a los pacientes que informen inmediatamente al médico o personal de enfermería si experimentan cualquiera de los síntomas antes descritos. - Si se sospecha la aparición de algún signo o síntoma sugestivo de hematoma espinal o epidural deben realizarse las pruebas diagnósticas con carácter de urgencia e instaurar el tratamiento adecuado, incluyendo la descompresión medular. - Hemorragia en ancianos En ancianos, no se observó aumento de la tendencia a la hemorragia, a las dosis usadas en la profilaxis,. En pacientes ancianos (especialmente los pacientes de más de 80 años) puede aumentar el riesgo de complicaciones hemorrágicas a la dosis terapéutica. Se recomienda una cuidadosa monitorización clínica (ver: Posología y forma de administración: Ancianos - Insuficiencia renal En pacientes con insuficiencia renal, existe un aumento del riesgo de hemorragia. En pacientes con insuficiencia renal grave (aclaramiento de creatinina <30 ml/min) se recomienda ajustar la posología tanto profiláctica como terapéutica, ya que, la exposición a enoxaparina sódica está significativamente aumentada en estos pacientes. Aunque no se requiere ningún ajuste posológico en pacientes con insuficiencia renal moderada (aclaramiento de creatinina ml/min) y leve (aclaramiento de creatinina ml/min), se recomienda una cuidadosa monitorización clínica (ver: Posología y forma de administración: Insuficiencia renal y Farmacocinética: Insuficiencia Renal - Pacientes de bajo peso En mujeres de bajo peso corporal (menos de 45 Kg) y en hombres de bajo peso corporal (menos de 57 Kg) se ha observado un aumento de la exposición a enoxaparina sódica a las dosis usadas en la profilaxis (no ajustadas según el peso), lo cual puede aumentar el riesgo de hemorragia. Por lo tanto se recomienda una cuidadosa monitorización clínica en estos pacientes (ver: Farmacocinética: peso ) - Procedimientos de revascularización coronaria percutánea 5
6 Para minimizar el riesgo de hemorragia después de la instrumentación vascular durante el tratamiento de la angina inestable, la guía de acceso vascular debe mantenerse en su lugar durante 6 a 8 horas después de la dosis de enoxaparina sódica. La siguiente dosis programada no debe administrarse antes de 6 a 8 horas después de la retirada de la guía. La zona donde se ha realizado el proceso debe observarse para detectar signos de hemorragia o formación de hematomas. - Válvulas protésicas cardíacas: Enoxaparina no ha demostrado eficacia y seguridad en indicaciones terapéuticas diferentes a las establecidas en la sección 4.1. Se han notificado casos de trombosis en prótesis valvulares cardíacas en pacientes en los que se administró enoxaparina como agente profiláctico. Algunos de estos casos tuvieron un desenlace mortal - Pruebas de laboratorio: En las dosis empleadas para la profilaxis del tromboembolismo venoso, la enoxaparina sódica no modifica de forma significativa las pruebas de tiempo de sangrado y coagulación sanguínea global, ni afecta a la agregación plaquetaria o la unión de fibrinógeno a plaquetas. A dosis más elevadas, pueden aparecer incrementos en el tiempo de tromboplastina parcial activada (PTT) y en el tiempo de coagulación activado (ACT). Los aumentos de PTT y ACT no se correlacionan de forma lineal con el incremento de actividad antitrombótica de enoxaparina sódica y por tanto no son adecuados ni fiables para la monitorización de la actividad de enoxaparina sódica. - Monitorización del recuento de plaquetas: con las heparinas de bajo peso molecular también existe el riesgo de trombocitopenia inducida por la heparina y mediada por anticuerpos, a veces de pronóstico grave. Debe considerarse esta posibilidad ante cualquier caso de trombocitopenia o aparición de una coagulación intravascular diseminada o trombosis, durante el tratamiento. Estas trombopenias aparecen habitualmente entre el día 5 y 21 después del comienzo del tratamiento con enoxaparina. Además, el riesgo de trombocitopenia inducida por la heparina puede persistir varios años tras la exposición previa a compuestos de heparina. a) En pacientes sin historia de trombocitopenia: Debe efectuarse un recuento de plaquetas antes del comienzo de la terapia y luego dos veces por semanas durante 21 días, a lo largo del tratamiento con enoxaparina. Si, pasado este tiempo, es necesario prolongar el tratamiento, el recuento de plaquetas tiene que realizarse una vez a la semana, hasta el final del tratamiento. En la práctica, cualquier descenso significativo (30 a 50 % del valor inicial) del recuento de plaquetas debe ser un motivo de alerta. En tal caso, hay que realizar inmediatamente una monitorización inmediata y diaria del recuento de plaquetas, y el tratamiento debe interrumpirse lo antes posible. Si tiene que continuar el tratamiento anticoagulante, hay que instaurar una terapia de sustitución con anticoagulantes orales o, al menos, un tratamiento con inhibidores de la agregación plaquetaria. b) En pacientes con historia de trombocitopenia: En pacientes con historia de trombocitopenia tras un tratamiento con una heparina no fraccionada, o con otra heparina de bajo peso molecular, el cambio a enoxaparina puede ser posible siempre y cuando un test de agregación plaquetaria en presencia de enoxaparina haya sido negativo. Dado que, aún en pacientes con un resultado negativo, se han observado reacciones cruzadas, la monitorización del estado clínico deberá 6
7 ser especialmente cuidadosa y se requiere realizar recuentos diarios de plaquetas. El tratamiento debe ser interrumpido si persiste la trombocitopenia inicial. Si tiene que continuar el tratamiento anticoagulante, hay que instaurar una terapia de sustitución con anticoagulantes orales o, al menos, un tratamiento con inhibidores de la agregación plaquetaria Interacción con otros medicamentos y otras formas de interacción Se recomienda antes del tratamiento con enoxaparina sódica interrumpir la utilización de aquellos fármacos que afecten la hemostasia a menos que estén estrictamente indicados. Sustancias que interfieren los mecanismos de la coagulación: - Acido acetilsalicílico, otros salicilatos y antiinflamatorios no esteroides (vía sistémica). incluido ketorolaco - Anticoagulantes y trombolíticos - Glucocorticoides (vía sistémica): la administración de enoxaparina aumenta el riesgo hemorrágico propio de la corticoterapia a altas dosis o en tratamientos prolongados. Inhibidores de la agregación plaquetaria: - Ticlopidina, dipiridamol, sulfinpirazona. - Dextrano 40 (vía parenteral). - Otros agentes antiplaquetarios como son los antagonistas IIa/IIIa Si la asociación de estos medicamentos y enoxaparina sódica es necesaria se recomienda proceder a una estrecha monitorización clínica y de laboratorio, dado el aumento de riesgo de hemorragia Embarazo y lactancia Categoría B. Embarazo Los estudios realizados en el animal no han mostrado evidencia de acción teratógena o fetotóxica. En la rata preñada, el paso de 35 S-enoxaparina a través de la placenta hasta el feto es muy limitado. En la mujer embarazada no hay ninguna evidencia de que la enoxaparina atraviese la barrera placentaria durante el segundo y el tercer trimestre de la gestación. Por prudencia y por falta de experiencia, se desaconseja la utilización de la enoxaparina durante el primer trimestre del embarazo. Si se realiza una anestesia epidural, el tratamiento con enoxaparina debe ser interrumpido. En un ensayo clínico en el que se administró enoxaparina sódica a 8 mujeres embarazadas con prótesis valvulares cardíacas, dos de ellas desarrollaron coágulos que bloquearon la válvula, lo que les ocasionó la muerte. Por tanto, no debe administrarse enoxaparina para otras indicaciones diferentes a las establecidas en la sección 4.1. Lactancia 7
8 En la rata, durante el periodo de lactancia, la concentración de 35 S-enoxaparina en la leche es muy baja. No se sabe si la enoxaparina se excreta en la leche humana, en las madres durante el periodo de lactancia. Por tanto, en este periodo, las madres no deben proceder a la lactancia materna, si están bajo tratamiento con enoxaparina Efectos sobre la capacidad para conducir vehículos y utilizar maquinaria La enoxaparina no tiene efecto sobre la capacidad de conducción y uso de maquinaria Reacciones adversas Hemorragia Como con otros anticoagulantes, la hemorragia puede ocurrir, virtualmente en cualquier localización, principalmente en presencia de factores de riesgo asociados: lesiones orgánicas susceptibles de sangrar, procedimientos invasivos o algunas asociaciones medicamentosas que afectan la hemostasia (ver: 4.6. Interacción con otros medicamentos y otras formas de interacción). Debe investigarse el origen de la hemorragia e instaurarse el tratamiento adecuado. Se han comunicado casos de hemorragias mayores, incluso retroperitoneales e intracraneales. Algunos de estos casos han sido letales. Trombocitopenia Se han comunicado algunos casos de trombocitopenia moderada y ocasionalmente grave asociada con trombosis venosa o arterial (ver 4.4. Advertencias y precauciones especiales de empleo). En algunos casos la trombosis se complicó con infarto del órgano o isquemia de la extremidad. Irritación local Tras la inyección subcutánea de enoxaparina puede aparecer irritación local moderada, dolor y hematoma. En algunos casos, pueden observarse nódulos duros en el lugar de la inyección. Estos nódulos no contienen enoxaparina y son más bien el resultado de una reacción inflamatoria. Se resuelven tras varios días y no son causa de interrupción del tratamiento. Con las HBPM, al igual que con la heparina no fraccionada, se han señalado algunas observaciones raras de necrosis cutánea sobrevenida en el punto de la inyección. Estos fenómenos son precedidos habitualmente por la aparición de púrpura o de placas eritematosas infiltradas y dolorosas, con o sin signos generales. En este caso, es necesario suspender inmediatamente el tratamiento. Otras - Raras manifestaciones alérgicas, cutáneas o generales. En algunos casos, su existencia debe conducir a la detención del tratamiento. - Se han comunicado aumentos asintomáticos y reversibles de niveles de enzimas hepáticas. - Entre los efectos secundarios asociados a tratamiento con heparina no fraccionada, la caída de cabello y la cefalea se han comunicado excepcionalmente con enoxaparina. Igualmente, el riesgo de osteoporosis no se puede excluir, en caso de tratamiento prolongado. - Muy raramente, se han comunicado casos de hematomas espinales y epidurales asociados al uso profiláctico de heparina en el contexto de un procedimiento anestésico epidural o espinal- y de una 8
9 punción lumbar. Estos hematomas han tenido como resultado final diferentes grados de déficit neurológico, incluyendo parálisis prolongada o permanente (ver Sección 4.4 : Advertencias y Precauciones especiales de empleo) Sobredosificación La sobredosificación accidental, tras la administración intravenosa o subcutánea, puede conducir a complicaciones hemorrágicas. Los efectos pueden ser ampliamente neutralizados por la inyección intravenosa lenta de protamina (sulfato o clorhidrato). La dosis de protamina será idéntica a la dosis de enoxaparina inyectada: 1 mg o 100 unidades anti-heparina de protamina para neutralizar la actividad anti- IIa generada por 1 mg (100 UI) de enoxaparina. En estas condiciones, e incluso con dosis elevadas de protamina, la actividad anti-xa nunca es totalmente neutralizada (máximo 60 %) lo que permite la persistencia de una actividad antitrombótica. 5. PROPIEDADES FARMACOLOGICAS La enoxaparina es una heparina de bajo peso molecular. Se caracteriza por un peso molecular medio de 4500 daltons ( ). La distribución del peso molecular es la siguiente: fracciones < 2000: < 20 %, fracciones de 2000 a 8000: > 68 % y fracciones > 8000: < 15 %. Posee una actividad anti-xa elevada (alrededor de 100 UI/mg) y una débil actividad anti-iia o antitrombínica (aproximadamente 28 UI/mg). La relación entre estas dos actividades es de 3,6, aproximadamente Propiedades farmacodinámicas A las posologías utilizadas para la profilaxis del tromboembolismo, la enoxaparina no influye negativamente de forma significativa sobre los tests globales de coagulación. No modifica la agregación plaquetaria ni la fijación del fibrinógeno sobre las plaquetas Datos clínicos en el tratamiento de angina inestable e infarto de miocardio sin onda Q En un estudio multicéntrico, pacientes en fase aguda de angina inestable o infarto de miocardio sin onda Q fueron randomizados para recibir, asociada con aspirina(100 a 350 mg una vez al día), 1mg/kg de peso de enoxaparina sódica administrada por vía subcutánea cada 12 horas ó heparina no fraccionada ajustada en base al tiempo de tromboplastina parcial activada (TTPA). Los pacientes tuvieron que ser tratados en el hospital durante un mínimo de dos días y un máximo de ocho, hasta la estabilización clínica, cirugía de revascularización o alta hospitalaria. Se hizo un seguimiento de los pacientes de hasta 30 días. Los resultados fueron los siguientes: el tratamiento con enoxaparina sódica, en comparación con heparina, redujo significativamente la incidencia de angina recurrente, infarto de miocardio y muerte, con una reducción del riesgo relativo del 16,2 % el día 14 y que se mantuvo durante todo el periodo de 30 días. Además, pocos pacientes del grupo de enoxaparina sódica necesitaron revascularización con angioplastia coronaria transluminal percutánea (ACTP) o bypass arterial coronario (reducción del riesgo relativo de un 15,8 % el día 30) Propiedades farmacocinéticas Los parámetros farmacocinéticos de la enoxaparina han sido estudiados principalmente a partir de la evolución de las actividades plasmáticas anti-xa y anti-iia, a los intervalos de dosis recomendados tras la administración subcutánea única y repetida y tras la administración intravenosa única. 9
10 La determinación de la actividad farmacocinética de anti Xa y anti IIa se efectúa por método amidolítico validado, con substratos específicos y un estándar de enoxaparina calibrado frente al patrón internacional LMWH1 (NIBSC). Biodisponibilidad y Absorción La biodisponibilidad, de enoxaparina sódica tras la inyección por vía subcutánea, basada en la actividad anti-xa, está próxima al 100 %. La actividad anti-xa plasmática máxima se observa 3 a 4 horas después de la inyección subcutánea y alcanza 0,18, 0,43 y 1,01 anti-xa/ml, tras la administración subcutánea única de dosis de 20 mg (2000 UI), 40 mg (4000 UI), 1 mg/kg (100 UI/kg) y 1,5 mg/kg (150 UI), respectivamente. La farmacocinética de enoxaparina, parece ser lineal en los intervalos de dosis recomendados. La variabilidad intra-paciente e inter-paciente es baja. Tras repetidas administraciones subcutáneas de 40 mg una vez al día y pautas posológicas de 1,5 mg/kg una vez al día en voluntarios sanos, la situación de equilibrio se alcanzó antes de 4 días y a los 2 ó 3 días respectivamente, con un promedio de niveles de exposición un 10 % más elevados que los alcanzados tras la dosis única. Después de administraciones subcutáneas repetidas con la pauta posológica de 1 mg/kg dos veces al día, el equilibrio se alcanza el día 3 con una exposición media más elevada que la de la dosis única. La actividad plasmática anti-xa tras la administración subcutánea es aproximadamente 10 veces menor que la actividad anti-xa. El máximo de la actividad anti-iia se observa aproximadamente 4 horas después de la administración subcutánea. Eliminación La semivida de eliminación de la actividad anti-xa es aproximadamente de 4 horas. La actividad anti-xa está presente en el plasma durante horas después de la administración subcutánea de 40 mg (4000 UI) de enoxaparina. Con dosis de 1 mg/kg (100 UI/kg) BID, el estado estacionario de C max de actividad anti-xa se alcanza entre el 2º y el 6º día del tratamiento. Biotransformación El hígado es probablemente el lugar principal de biotransformación. La enoxaparina se metaboliza por desulfatación y/o despolimerización hasta tipos con peso molecular más bajo, consecuentemente con potencia biológica muy reducida. Excreción En voluntarios varones sanos, con dosis única de enoxaparina de 20 mg (2000 UI) o 40 mg (2000 UI), por vía subcutánea, la excreción urinaria basada en actividad anti-xa es del 7,4 % y 9,3 %, respectivamente, de la dosis administrada. La eliminación de la enoxaparina y sus metabolitos sucede por las vías renal y biliar. Poblaciones de riesgo Insuficiencia renal: En estado de equilibrio, se ha observado una relación lineal entre el aclaramiento del plasma con anti- Xa y el aclaramiento de creatinina, lo que indica una disminución en el aclaramiento de enoxaparina sódica en pacientes con la función renal disminuída. En estado de equilibrio, la exposición a anti-xa representada por AUC está aumentada de modo marginal en pacientes con insuficiencia renal leve (aclaramiento de creatinina ml/min) y 10
11 moderada (aclaramiento de creatinina ml/min) tras administraciones subcutáneas repetidas de la dosis de 40 mg una vez al día. En pacientes con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min), la AUC en estado de equilibrio está significativamente aumentada en una media de un 64 % mayor en el día 4 (IC90%, %,p<0,001) tras administraciones subcutáneas repetidas de la dosis de 40 mg una vez al día Con las dosis de 1,5 mg/kg y con 1 mg/kg en pacientes con insuficiencia renal grave el AUC aumentó aproximadamente en una 96 %(ver: Precauciones: Insuficiencia renal y Posología y forma de administración: Insuficiencia renal ) Peso Tras repetidas administraciones subcutáneas de 1,5 mg/kg una vez al día, la AUC media de la actividad anti-xa es marginalmente más elevado en el estado de equilibrio en voluntarios sanos obesos (BMI Kg/ m 2 ) comparado con sujetos control no obesos, mientras que Amax no estaba aumentada. Hay un menor aclaramiento ajustado al peso en personas obesas con administración subcutánea. Cuando se administró una dosis no ajustada al peso, se encontró que, la exposición anti-xa es un 50% superior en las mujeres con bajo peso (<45 Kg) y un 27% superior en hombres con bajo peso (<57 kg) tras una dosis única de 40 mg, cuando se comparó con sujetos control con peso normal (ver: Precauciones: Bajo peso ) 5.4. Datos preclínicos sobre la seguridad Tras inyección única i.v., en ratón y rata, la DL 50 de la enoxaparina es de 2000 mg/kg, aproximadamente. En el ratón, tras inyección única por vía s.c., la DL 50 es de 7000 mg/kg, aproximadamente. En estas especies el producto genera una mortalidad tardía e irregular debida a hemorragias gastrointestinales. En el perro, la enoxaparina es no tóxica y bien tolerada hasta 1000 mg/kg i.v. En administración repetida, la enoxaparina por vía s.c. en rata (13 semanas), perro (13 semanas) y primate (4 semanas), resulta no tóxica hasta dosis de 15 mg/kg. Tras administración i.v. en rata y en mono Cynomolgus, durante 6 meses, la dosis máxima tolerada es de 10 mg/kg/día en rata y de 5 mg/kg/día en el mono. Tras administración s.c. en rata y en mono Cynomolgus, durante 6 meses, la dosis máxima tolerada es de 3 mg/kg/día en rata y de 10 mg/kg/día en el mono. La enoxaparina carece de efectos embriotóxicos o teratógenos en ratas y conejas hasta dosis de 30 mg/kg/día s.c. o 160 mg/kg/día i.v. La tolerancia peri y post-natal fue excelente en ratas hasta dosis de 10 mg/kg/día s.c. Hasta dosis de 3 a 20 mg/kg/día s.c., en ratas, la enoxaparina no tuvo efectos sobre la gametogénesis, gestación, parto y lactancia de recién nacidos. La enoxaparina fue inactiva en una batería de 4 tests realizados in vitro e in vivo, diseñados para detectar una actividad mutagénica de tipo génico o cromosómico. 6. DATOS FARMACEUTICOS 6.1. Lista de excipientes Agua estéril para preparaciones inyectables. 11
12 6.2. Incompatibilidades No se han descrito Período de validez 18 meses Precauciones especiales de conservación Almacenar a 25º C Naturaleza y contenido del recipiente Clexane 20 mg (2000 UI) ampollas Caja con 2 ampollas de 0,2 ml, conteniendo cada una 20 mg (2000 UI) de enoxaparina sódica. Caja con 10 ampollas de 0,2 ml, conteniendo cada una 20 mg (2000 UI) de enoxaparina sódica. Clexane 40 mg (4000 UI) ampollas Caja con 2 ampollas de 0,4 ml, conteniendo cada una 40 mg (4000 UI) de enoxaparina sódica. Caja con 10 ampollas de 0,4 ml, conteniendo cada una 40 mg (4000 UI) de enoxaparina sódica Instrucciones de uso/manipulación Ninguna en especial. 7. Nombre y domicilio social del titular Titular: Laboratoires Aventis 42-50, Quai de la Rapée Paris (Francia) Comercializador: AVENTIS PHARMA, S.A. Avenida de Leganés, Alcorcón (Madrid) 12
13 Julio
FICHA TÉCNICA. Clexane 120 mg (12.000 UI) solución inyectable en jeringa precargada
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Clexane 120 mg (12.000 UI) solución inyectable en jeringa precargada Clexane 150 mg (15.000 UI) solución inyectable en jeringa precargada 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Clexane 120 mg (12.000 UI) solución inyectable en jeringa precargada Clexane 150 mg (15.000 UI) solución inyectable en jeringa precargada 2. COMPOSICIÓN CUALITATIVA
PROFILAXIS DE LA ENFERMEDAD TROMBOEMBÓLICA VENOSA ASOCIADA CON CIRUGÍA GENERAL Y CIRUGÍA ORTOPÉDICA
 INDICACIONES Las heparinas de bajo peso molecular (HBPM) administradas por vía subcutánea, han demostrado ser un tratamiento tan seguro y eficaz como la heparina no fraccionada intravenosa en el tratamiento
INDICACIONES Las heparinas de bajo peso molecular (HBPM) administradas por vía subcutánea, han demostrado ser un tratamiento tan seguro y eficaz como la heparina no fraccionada intravenosa en el tratamiento
- Enoxaparina (D.C.I.) sódica: 90 mg (equivalente a UI)* - Agua para preparaciones inyectables c.s.p. 0,6 ml
 1. NOMBRE DEL MEDICAMENTO Clexane Forte 90 mg (9.000 UI)/0,6 ml jeringas Clexane Forte 120 mg (12.000 UI)/0,8 ml jeringas Clexane Forte150 mg (15.000 UI)/1ml jeringas 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
1. NOMBRE DEL MEDICAMENTO Clexane Forte 90 mg (9.000 UI)/0,6 ml jeringas Clexane Forte 120 mg (12.000 UI)/0,8 ml jeringas Clexane Forte150 mg (15.000 UI)/1ml jeringas 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO CLEXANE (Enoxaparina sódica) 100 mg/ml
 Nombre del producto: RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO CLEXANE (Enoxaparina sódica) Forma farmacéutica: Fortaleza: Solución para inyección SC, intravascular (hemodiálisis). 100 mg/ml Presentación:
Nombre del producto: RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO CLEXANE (Enoxaparina sódica) Forma farmacéutica: Fortaleza: Solución para inyección SC, intravascular (hemodiálisis). 100 mg/ml Presentación:
Nuevos anticoagulantes orales. A. Andrés Servicio de Medicina Interna Hospital Dr. Moliner
 Nuevos anticoagulantes orales A. Andrés Servicio de Medicina Interna Hospital Dr. Moliner Cascada de la coagulación Es una secuencia compleja de reacciones proteolíticas que terminan con la formación de
Nuevos anticoagulantes orales A. Andrés Servicio de Medicina Interna Hospital Dr. Moliner Cascada de la coagulación Es una secuencia compleja de reacciones proteolíticas que terminan con la formación de
Clexane 40 mg (4.000 UI) solución inyectable en jeringa precargada Enoxaparina sódica
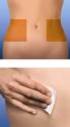 PROSPECTO: INFORMACION PARA EL USUARIO Clexane 40 mg (4.000 UI) solución inyectable en jeringa precargada Enoxaparina sódica Lea todo el prospecto detenidamente antes de empezar a usar el medicamento -
PROSPECTO: INFORMACION PARA EL USUARIO Clexane 40 mg (4.000 UI) solución inyectable en jeringa precargada Enoxaparina sódica Lea todo el prospecto detenidamente antes de empezar a usar el medicamento -
Fármacos utilizados en el Tratamiento de las Enfermedades Hematológicas. Tratamiento de las Alteraciones de la Coagulación.
 FARMACOLOGÍA CINICA Fármacos utilizados en el Tratamiento de las Enfermedades Hematológicas. Tratamiento de las Alteraciones de la Coagulación. 2005-2006 Fármacos para el tratamiento de las Alteraciones
FARMACOLOGÍA CINICA Fármacos utilizados en el Tratamiento de las Enfermedades Hematológicas. Tratamiento de las Alteraciones de la Coagulación. 2005-2006 Fármacos para el tratamiento de las Alteraciones
Prospecto: información para el usuario. Clexane 150 mg (15.000 UI) solución inyectable en jeringa precargada. Enoxaparina sódica
 Prospecto: información para el usuario Clexane 150 mg (15.000 UI) solución inyectable en jeringa precargada Enoxaparina sódica Lea todo el prospecto detenidamente antes de empezar a usar este medicamento,
Prospecto: información para el usuario Clexane 150 mg (15.000 UI) solución inyectable en jeringa precargada Enoxaparina sódica Lea todo el prospecto detenidamente antes de empezar a usar este medicamento,
Tratamiento de la trombosis venosa profunda establecida, con o sin embolismo pulmonar.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO: HIBOR 5.000 UI. HIBOR 7.500 UI. HIBOR 10.000 UI. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Presentación HIBOR 5.000 UI / 0,2 ml jeringas precargadas Principio
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO: HIBOR 5.000 UI. HIBOR 7.500 UI. HIBOR 10.000 UI. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Presentación HIBOR 5.000 UI / 0,2 ml jeringas precargadas Principio
Guía de Referencia Rápida. Prevención Secundaria en el Tratamiento con Anticoagulante Oral: Warfarina en Adultos en el Primer Nivel de Atención Médica
 Guía de Referencia Rápida Prevención Secundaria en el Tratamiento con Anticoagulante Oral: Warfarina en Adultos en el Primer Nivel de Atención Médica Guía de Práctica Clínica GPC Catalogo Maestro de Guías
Guía de Referencia Rápida Prevención Secundaria en el Tratamiento con Anticoagulante Oral: Warfarina en Adultos en el Primer Nivel de Atención Médica Guía de Práctica Clínica GPC Catalogo Maestro de Guías
FICHA TÉCNICA. La dosis a utilizar dependerá de la evolución de los síntomas y deberá utilizarse siempre la menor dosis efectiva.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Saccharomyces boulardii 250 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Saccharomyces boulardii 250 mg Excipientes con efecto conocido:
Heparinas de bajo peso molecular
 Página 1 de 10 Heparinas de bajo peso molecular Juan Erviti - Servicio de Prestaciones Farmacéuticas Mª José Paloma - Servicio de Hematología - Hospital Virgen del Camino Introducción Eficacia clínica
Página 1 de 10 Heparinas de bajo peso molecular Juan Erviti - Servicio de Prestaciones Farmacéuticas Mª José Paloma - Servicio de Hematología - Hospital Virgen del Camino Introducción Eficacia clínica
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Solución para inyección SC URUGUAY.
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: Presentación: Titular del Registro Sanitario, país: Fabricante, país: ENOXAPARINA SÓDICA 60 mg Solución para
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: Presentación: Titular del Registro Sanitario, país: Fabricante, país: ENOXAPARINA SÓDICA 60 mg Solución para
Tratamiento Anticoagulante Oral. Tratamiento Anticoagulante
 Tratamiento Anticoagulante Oral Eduardo Guarda S. Profesor Adjunto Departamento de Enfermedades Cardiovasculares Pontificia Universidad Católica de Chile Tratamiento Anticoagulante Trombosis en enfermedades
Tratamiento Anticoagulante Oral Eduardo Guarda S. Profesor Adjunto Departamento de Enfermedades Cardiovasculares Pontificia Universidad Católica de Chile Tratamiento Anticoagulante Trombosis en enfermedades
GAMMAGLOBULINA HUMANA PASTEURIZADA GRIFOLS 320 mg (2 ml) GAMMAGLOBULINA HUMANA PASTEURIZADA GRIFOLS 800 mg (5 ml) - Principio activo: 2 ml 5 ml
 1. NOMBRE DEL MEDICAMENTO GAMMAGLOBULINA HUMANA PASTEURIZADA GRIFOLS 320 mg (2 ml) GAMMAGLOBULINA HUMANA PASTEURIZADA GRIFOLS 800 mg (5 ml) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo:
1. NOMBRE DEL MEDICAMENTO GAMMAGLOBULINA HUMANA PASTEURIZADA GRIFOLS 320 mg (2 ml) GAMMAGLOBULINA HUMANA PASTEURIZADA GRIFOLS 800 mg (5 ml) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo:
ENOXAPARINA SÓDICA 40 mg. Solución para inyección SC. 40 mg
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: ENOXAPARINA SÓDICA 40 mg Forma farmacéutica: Fortaleza: Solución para inyección SC 40 mg Presentación: Titular del Registro Sanitario, país:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: ENOXAPARINA SÓDICA 40 mg Forma farmacéutica: Fortaleza: Solución para inyección SC 40 mg Presentación: Titular del Registro Sanitario, país:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO ENOXAPARINA SÓDICA
 Nombre del producto: RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO ENOXAPARINA SÓDICA Forma farmacéutica: Fortaleza: Presentación: Solución para inyección SC, Intravascular 10,0 mg/0,1 ml Estuche por 2 jeringuillas
Nombre del producto: RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO ENOXAPARINA SÓDICA Forma farmacéutica: Fortaleza: Presentación: Solución para inyección SC, Intravascular 10,0 mg/0,1 ml Estuche por 2 jeringuillas
FICHA TÉCNICA. Los ingredientes activos en 1 ml de VITALIPID ADULTOS corresponden a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VITALIPID ADULTOS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de VITALIPID ADULTOS contiene: Principios activos: Retinolpalmitato (equivalente a Retinol 99 μg)
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VITALIPID ADULTOS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de VITALIPID ADULTOS contiene: Principios activos: Retinolpalmitato (equivalente a Retinol 99 μg)
Excipientes: Ácido Clorhidrico o Hidróxido de sodio para ajustar ph, Agua para inyección Basado en una potencia de 100 UI/mg
 Nurox Solución Inyectable Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier duda o no está seguro
Nurox Solución Inyectable Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier duda o no está seguro
Para la lista completa de excipientes, véase la sección 6.1.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 1 mg comprimidos masticables para perros Metacam 2,5 mg comprimidos masticables para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido masticable
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 1 mg comprimidos masticables para perros Metacam 2,5 mg comprimidos masticables para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido masticable
1. NOMBRE DEL MEDICAMENTO DICLOFENACO RETARD JUVENTUS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Composición por cápsula:
 1. NOMBRE DEL MEDICAMENTO DICLOFENACO RETARD JUVENTUS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición por cápsula: Principio activo Diclofenaco (DCI) sódico Excipientes Sucrosa Almidón de maíz Ácido
1. NOMBRE DEL MEDICAMENTO DICLOFENACO RETARD JUVENTUS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición por cápsula: Principio activo Diclofenaco (DCI) sódico Excipientes Sucrosa Almidón de maíz Ácido
FICHA TÉCNICA. Solución inyectable, en viales de 5 ml. Solución incolora, transparente, exenta de partículas visibles
 FICHA TÉCNICA 1 NOMBRE DEL MEDICAMENTO PROTAMINA HOSPIRA 50 mg. solución inyectable 2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial de 5 ml contiene: Sulfato de protamina 50 mg Cada ml de solución contiene
FICHA TÉCNICA 1 NOMBRE DEL MEDICAMENTO PROTAMINA HOSPIRA 50 mg. solución inyectable 2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial de 5 ml contiene: Sulfato de protamina 50 mg Cada ml de solución contiene
INFORMACION PARA PRESCRIBIR AMPLIA IPP-A K-ASMAL*
 INFORMACION PARA PRESCRIBIR AMPLIA IPP-A K-ASMAL* FORMA FARMACEUTICA Y FORMULACION Jarabe Cada 100 mi contienen: Fumarato ácido de Ketotifeno equivalente a... 20 mg de Ketotifeno vehículo, c.b.p... 100
INFORMACION PARA PRESCRIBIR AMPLIA IPP-A K-ASMAL* FORMA FARMACEUTICA Y FORMULACION Jarabe Cada 100 mi contienen: Fumarato ácido de Ketotifeno equivalente a... 20 mg de Ketotifeno vehículo, c.b.p... 100
FICHA TECNICA. - Prevención de la coagulación en el circuito de circulación extracorpórea en la hemodiálisis.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Clexane 20 mg (2.000 UI) ampollas Clexane 40 mg (4.000 UI) ampollas 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Clexane 20 mg (2.000 UI) ampollas Cada ampolla contiene:
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Clexane 20 mg (2.000 UI) ampollas Clexane 40 mg (4.000 UI) ampollas 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Clexane 20 mg (2.000 UI) ampollas Cada ampolla contiene:
FICHA TÉCNICA -BOXOL-
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA -BOXOL- BOXOL 2.500 UI/0,2 ml, solución inyectable en jeringas desechables. BOXOL 5.000 UI/0,2 ml, solución inyectable en jeringas desechables. 2. COMPOSICIÓN CUALITITATIVA
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA -BOXOL- BOXOL 2.500 UI/0,2 ml, solución inyectable en jeringas desechables. BOXOL 5.000 UI/0,2 ml, solución inyectable en jeringas desechables. 2. COMPOSICIÓN CUALITITATIVA
ELABORACIÓN DE SOLUCION DE PROPANOLOL 1 mg/ml Fórmula Propanolol. 100 mg Agua conservans.20 ml Ácido cítrico 25 % 0,4 ml Jarabe simple c.s.
 ELABORACIÓN DE SOLUCION DE PROPANOLOL 1 mg/ml Fórmula Propanolol. 100 mg Agua conservans.20 ml Ácido cítrico 25 % 0,4 ml Jarabe simple c.s.p 100 ml Método específico 1.- Pesar (PN/L/OF/001/00) la cantidad
ELABORACIÓN DE SOLUCION DE PROPANOLOL 1 mg/ml Fórmula Propanolol. 100 mg Agua conservans.20 ml Ácido cítrico 25 % 0,4 ml Jarabe simple c.s.p 100 ml Método específico 1.- Pesar (PN/L/OF/001/00) la cantidad
Anticoagulación y Gestación. Luis Malpartida del Carpio Médico Asistente Anestesiología a y Terapia Intensiva INCOR - ESSALUD
 Anticoagulación y Gestación Luis Malpartida del Carpio Médico Asistente Anestesiología a y Terapia Intensiva INCOR - ESSALUD Vasoconstricción HEMOSTASIA PRIMARIA COAGULACION HEMOSTASIA SECUNDARIA FIBRINOLISIS
Anticoagulación y Gestación Luis Malpartida del Carpio Médico Asistente Anestesiología a y Terapia Intensiva INCOR - ESSALUD Vasoconstricción HEMOSTASIA PRIMARIA COAGULACION HEMOSTASIA SECUNDARIA FIBRINOLISIS
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Clexane 120 mg (12.000 UI) solución inyectable en jeringa precargada Clexane 150 mg (15.000 UI) solución inyectable
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Clexane 120 mg (12.000 UI) solución inyectable en jeringa precargada Clexane 150 mg (15.000 UI) solución inyectable
PROSPECTO: INFORMACIÓN PARA EL USUARIO. VARIDASA Comprimidos Estreptoquinasa y Estreptodornasa
 PROSPECTO: INFORMACIÓN PARA EL USUARIO VARIDASA Comprimidos Estreptoquinasa y Estreptodornasa Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto, ya
PROSPECTO: INFORMACIÓN PARA EL USUARIO VARIDASA Comprimidos Estreptoquinasa y Estreptodornasa Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto, ya
Las jeringas graduadas facilitan la administración de dosis ajustadas cuando se requiere una adaptación al peso del paciente.
 1. DENOMINACIÓN DEL MEDICAMENTO FRAXIPARINA FORTE 0,6 ml, jeringa precargada. FRAXIPARINA FORTE 0,8 ml, jeringa precargada. FRAXIPARINA FORTE 1 ml, jeringa precargada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1. DENOMINACIÓN DEL MEDICAMENTO FRAXIPARINA FORTE 0,6 ml, jeringa precargada. FRAXIPARINA FORTE 0,8 ml, jeringa precargada. FRAXIPARINA FORTE 1 ml, jeringa precargada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
- Frasco ámpula liofilizado 250 U.I. 500 U.I. 1000 U.I.
 INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. DENOMINACIÓN DISTINTIVA FANHDI 2. DENOMINACIÓN GENÉRICA Factor Antihemofílico Humano 3. FORMA FARMACÉUTICA Y FORMULACIÓN Solución Inyectable Formulación: - Frasco
INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. DENOMINACIÓN DISTINTIVA FANHDI 2. DENOMINACIÓN GENÉRICA Factor Antihemofílico Humano 3. FORMA FARMACÉUTICA Y FORMULACIÓN Solución Inyectable Formulación: - Frasco
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Clexane 20 mg (2.000 UI) solución inyectable en jeringa precargada Clexane 40 mg (4.000 UI) solución inyectable en
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Clexane 20 mg (2.000 UI) solución inyectable en jeringa precargada Clexane 40 mg (4.000 UI) solución inyectable en
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
FICHA TECNICA F R A X I P A R I N A. Nadroparina cálcica (D.C.I.)
 FICHA TECNICA F R A X I P A R I N A Nadroparina cálcica 1. Nombre del medicamento FRAXIPARINA 0,3 ml FRAXIPARINA 0,4 ml FRAXIPARINA 0,6 ml FRAXIPARINA 0,8 ml 2. Composición cualitativa y cuantitativa 1
FICHA TECNICA F R A X I P A R I N A Nadroparina cálcica 1. Nombre del medicamento FRAXIPARINA 0,3 ml FRAXIPARINA 0,4 ml FRAXIPARINA 0,6 ml FRAXIPARINA 0,8 ml 2. Composición cualitativa y cuantitativa 1
PERFIL DE LOS NUEVOS ANTICOAGULANTES Control biológico de los nuevos anticoagulantes DABIGATRAN RIVAROXABAN
 PERFIL DE LOS NUEVOS ANTICOAGULANTES Control biológico de los nuevos anticoagulantes Prof. V. Vicente Servicio de Hematología y Oncología Médica Hospital Universitario Morales Meseguer DABIGATRAN Murcia
PERFIL DE LOS NUEVOS ANTICOAGULANTES Control biológico de los nuevos anticoagulantes Prof. V. Vicente Servicio de Hematología y Oncología Médica Hospital Universitario Morales Meseguer DABIGATRAN Murcia
FICHA TÉCNICA. - Fraxiparina 0,8 ml solución inyectable, cada jeringa precargada contiene UI anti Xa de nadroparina cálcica.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fraxiparina 0,3 ml solución inyectable Fraxiparina 0,4 ml solución inyectable Fraxiparina 0,6 ml solución inyectable Fraxiparina 0,8 ml solución inyectable 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fraxiparina 0,3 ml solución inyectable Fraxiparina 0,4 ml solución inyectable Fraxiparina 0,6 ml solución inyectable Fraxiparina 0,8 ml solución inyectable 2. COMPOSICIÓN
Modo de administración Por vía oral. Administrar preferiblemente mañana, mediodía y noche.
 1. NOMBRE DEL MEDICAMENTO Cloperastina NORMON 3,54 mg/ml suspensión oral EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cloperastina NORMON 3,54 mg/ml suspensión oral: cada ml de suspensión oral contiene
1. NOMBRE DEL MEDICAMENTO Cloperastina NORMON 3,54 mg/ml suspensión oral EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cloperastina NORMON 3,54 mg/ml suspensión oral: cada ml de suspensión oral contiene
FICHA TÉCNICA. (fitomenadiona, DCI) en 0,2 ml (volumen de llenado: 0,3 ml). Solución contenida en ampollas para administración oral o parenteral.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Konakion 2 mg pediátrico 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ampolla contiene 2 mg de vitamina K 1 (fitomenadiona, DCI) en 0,2 ml (volumen de llenado:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Konakion 2 mg pediátrico 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ampolla contiene 2 mg de vitamina K 1 (fitomenadiona, DCI) en 0,2 ml (volumen de llenado:
Solución inyectable en jeringas precargadas. (solución incolora, transparente, exenta de partículas visibles).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO: HIBOR 3.500 UI anti Xa/0,2 ml de solución inyectable en jeringas precargadas. HIBOR 2.500 UI anti Xa/0,2 ml de solución inyectable en jeringas precargadas. 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO: HIBOR 3.500 UI anti Xa/0,2 ml de solución inyectable en jeringas precargadas. HIBOR 2.500 UI anti Xa/0,2 ml de solución inyectable en jeringas precargadas. 2. COMPOSICIÓN
MINOXIDIL AL 2%, SOLUCIÓN DE. Excipientes: Propilenglicol Agua purificada Etanol 96 %
 FN/2006/PO/039 1. NOMBRE: Solución de minoxidil 2. SINÓNIMOS Minoxidil en solución hidroalcohólica MINOXIDIL AL 2%, SOLUCIÓN DE 3. COMPOSICIÓN 3.1. FÓRMULA PATRÓN ( 2 % ) Minoxidil Excipientes: Propilenglicol
FN/2006/PO/039 1. NOMBRE: Solución de minoxidil 2. SINÓNIMOS Minoxidil en solución hidroalcohólica MINOXIDIL AL 2%, SOLUCIÓN DE 3. COMPOSICIÓN 3.1. FÓRMULA PATRÓN ( 2 % ) Minoxidil Excipientes: Propilenglicol
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
FICHA TÉCNICA. Bemiparina sódica: UI (anti Factor Xa*) por vial de 3,5 ml. Bemiparina sódica: UI (anti Factor Xa*) por vial de 2,5 ml
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Hepadren 1.000 UI anti Xa/ml de solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Bemiparina sódica: 3.500 UI (anti Factor Xa*) por vial de 3,5 ml Bemiparina
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Hepadren 1.000 UI anti Xa/ml de solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Bemiparina sódica: 3.500 UI (anti Factor Xa*) por vial de 3,5 ml Bemiparina
FICHA TÉCNICA. - Fraxiparina 0,8 ml solución inyectable, cada jeringa precargada contiene UI anti Xa de nadroparina cálcica.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fraxiparina 0,3 ml solución inyectable Fraxiparina 0,4 ml solución inyectable Fraxiparina 0,6 ml solución inyectable Fraxiparina 0,8 ml solución inyectable 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fraxiparina 0,3 ml solución inyectable Fraxiparina 0,4 ml solución inyectable Fraxiparina 0,6 ml solución inyectable Fraxiparina 0,8 ml solución inyectable 2. COMPOSICIÓN
FICHA TÉCNICA. - Fraxiparina 0,8 ml solución inyectable, cada jeringa precargada contiene UI anti Xa de nadroparina cálcica.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fraxiparina 0,3 ml solución inyectable Fraxiparina 0,4 ml solución inyectable Fraxiparina 0,6 ml solución inyectable Fraxiparina 0,8 ml solución inyectable 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fraxiparina 0,3 ml solución inyectable Fraxiparina 0,4 ml solución inyectable Fraxiparina 0,6 ml solución inyectable Fraxiparina 0,8 ml solución inyectable 2. COMPOSICIÓN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
100 mg/ml. Xa de UI. 24 meses
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: ENOXAPARINA SÓDICA 60 Forma farmacéutica: Solución para inyección SC, intravascular Fortaleza: Presentación: Titular del Registro Sanitario,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: ENOXAPARINA SÓDICA 60 Forma farmacéutica: Solución para inyección SC, intravascular Fortaleza: Presentación: Titular del Registro Sanitario,
Niños entre 2 y 7 años: La posología media recomendada es de 300 mg de acetilcisteína al día por vía oral. En 3 tomas de 100 mg cada 8 horas.
 1. NOMBRE DEL MEDICAMENTO acetilcisteína cinfa 100 mg polvo para solución oral EFG acetilcisteína cinfa 200 mg polvo para solución oral EFG acetilcisteína cinfa 600 mg polvo para solución oral EFG 2. COMPOSICIÓN
1. NOMBRE DEL MEDICAMENTO acetilcisteína cinfa 100 mg polvo para solución oral EFG acetilcisteína cinfa 200 mg polvo para solución oral EFG acetilcisteína cinfa 600 mg polvo para solución oral EFG 2. COMPOSICIÓN
FICHA TÉCNICA. Acetilcisteína NORMON 100 mg granulado para solución oral EFG. Acetilcisteína NORMON 200 mg granulado para solución oral EFG.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Acetilcisteína NORMON 100 mg granulado para solución oral EFG. Acetilcisteína NORMON 200 mg granulado para solución oral EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Acetilcisteína NORMON 100 mg granulado para solución oral EFG. Acetilcisteína NORMON 200 mg granulado para solución oral EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA. FRAXIPARINA FORTE 0,6 ml solución inyectable, cada jeringa precargada contiene UI anti Xa.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FRAXIPARINA FORTE 0,6 ml solución inyectable. FRAXIPARINA FORTE 0,8 ml solución inyectable. FRAXIPARINA FORTE 1 ml solución inyectable. 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FRAXIPARINA FORTE 0,6 ml solución inyectable. FRAXIPARINA FORTE 0,8 ml solución inyectable. FRAXIPARINA FORTE 1 ml solución inyectable. 2. COMPOSICIÓN CUALITATIVA
PROSPECTO HEPARINA HOSPIRA 1%
 PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento Conserve este prospecto. Puede tener que volver a leerlo. Si tiene alguna duda, consulte a su médico o farmacéutico.
PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento Conserve este prospecto. Puede tener que volver a leerlo. Si tiene alguna duda, consulte a su médico o farmacéutico.
Trombolisis en el Ictus Isquémico
 Trombolisis en el Ictus Isquémico Protocolo de tratamiento trombolítico EV en ictus isquémico. I: Debe cumplir los 4 Criterios de Inclusión: 1: ictus agudo de menos de 3 horas de evolución 2: edad menor
Trombolisis en el Ictus Isquémico Protocolo de tratamiento trombolítico EV en ictus isquémico. I: Debe cumplir los 4 Criterios de Inclusión: 1: ictus agudo de menos de 3 horas de evolución 2: edad menor
FICHA TÉCNICA. Cada pastilla para chupar contiene 20 mg de ambroxol hidrocloruro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Bucoxon 20 mg pastillas para chupar sabor menta 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada pastilla para chupar contiene 20 mg de ambroxol hidrocloruro. Excipiente
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Bucoxon 20 mg pastillas para chupar sabor menta 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada pastilla para chupar contiene 20 mg de ambroxol hidrocloruro. Excipiente
NADROPARINA CÁLCICA Inyección SC, intravascular 9500 UI
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: NADROPARINA CÁLCICA Inyección SC, intravascular 9500 UI/mL Presentación: Estuche por 2 blísteres de PVC conteniendo
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: NADROPARINA CÁLCICA Inyección SC, intravascular 9500 UI/mL Presentación: Estuche por 2 blísteres de PVC conteniendo
Profilaxis de enfermedad tromboembólica venosa en pacientes quirúrgicos
 Profilaxis de enfermedad tromboembólica venosa en pacientes quirúrgicos La importancia de la profilaxis tromboembólica tras diferentes cirugías radica en: La alta prevalencia de la enfermedad tromboembólica
Profilaxis de enfermedad tromboembólica venosa en pacientes quirúrgicos La importancia de la profilaxis tromboembólica tras diferentes cirugías radica en: La alta prevalencia de la enfermedad tromboembólica
Prospecto: Información para el usuario. FRAGMIN UI/ml solución inyectable en ampollas Dalteparina sódica
 Prospecto: Información para el usuario FRAGMIN 10.000 UI/ml solución inyectable en ampollas Dalteparina sódica Lea todo el prospecto detenidamente antes de empezar a utilizar el medicamento porque contiene
Prospecto: Información para el usuario FRAGMIN 10.000 UI/ml solución inyectable en ampollas Dalteparina sódica Lea todo el prospecto detenidamente antes de empezar a utilizar el medicamento porque contiene
LA HEMOSTASIA EN LAS COMPLICACIONES OBSTÉTRICAS
 LA HEMOSTASIA EN LAS COMPLICACIONES OBSTÉTRICAS PROF. DELFINA ALMAGRO VÁZQUEZ Conferencia en el Taller Nacional de Mortalidad Materna. CENAPET. Sept 2005. Cambios en la hemostasia Embarazo normal Cambios
LA HEMOSTASIA EN LAS COMPLICACIONES OBSTÉTRICAS PROF. DELFINA ALMAGRO VÁZQUEZ Conferencia en el Taller Nacional de Mortalidad Materna. CENAPET. Sept 2005. Cambios en la hemostasia Embarazo normal Cambios
1. NOMBRE DE LOS MEDICAMENTOS. ATENOLOL NORMON 50 mg Comprimidos recubiertos EFG. ATENOLOL NORMON 100 mg Comprimidos recubiertos EFG.
 1. NOMBRE DE LOS MEDICAMENTOS ATENOLOL NORMON 50 mg Comprimidos recubiertos EFG. ATENOLOL NORMON 100 mg Comprimidos recubiertos EFG. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto
1. NOMBRE DE LOS MEDICAMENTOS ATENOLOL NORMON 50 mg Comprimidos recubiertos EFG. ATENOLOL NORMON 100 mg Comprimidos recubiertos EFG. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto
FICHA TÉCNICA. solución Bemiparina sódica (DCI) UI (anti-xa) Bemiparina sódica (DCI) UI (anti-xa)
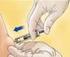 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HIBOR 5.000 UI anti Xa/0,2 ml solución inyectable en jeringas precargadas HIBOR 7.500 UI anti Xa/0,3 ml solución inyectable en jeringas precargadas HIBOR 10.000
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HIBOR 5.000 UI anti Xa/0,2 ml solución inyectable en jeringas precargadas HIBOR 7.500 UI anti Xa/0,3 ml solución inyectable en jeringas precargadas HIBOR 10.000
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO CORREO ELECTRÓNICO Sugerencias_ft@aemps.es Se atenderán exclusivamente incidencias informáticas sobre la aplicación CIMA (http://www.aemps.gob.es/cima)
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO CORREO ELECTRÓNICO Sugerencias_ft@aemps.es Se atenderán exclusivamente incidencias informáticas sobre la aplicación CIMA (http://www.aemps.gob.es/cima)
FICHA TÉCNICA. solución Bemiparina sódica (DCI) UI (anti-xa) Bemiparina sódica (DCI) UI (anti-xa)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HIBOR 5.000 UI anti Xa/0,2 ml solución inyectable en jeringas precargadas HIBOR 7.500 UI anti Xa/0,3 ml solución inyectable en jeringas precargadas HIBOR 10.000
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HIBOR 5.000 UI anti Xa/0,2 ml solución inyectable en jeringas precargadas HIBOR 7.500 UI anti Xa/0,3 ml solución inyectable en jeringas precargadas HIBOR 10.000
Atención enfermera en hemodiálisis
 Atención enfermera en hemodiálisis Curso de 80 h de duración, acreditado con 11,2 Créditos CFC Programa 1. PRINCIPIOS FISICOQUÍMICOS DE LA HEMODIÁLISIS Y TOXINAS URÉMICAS 2) Difusión 3) Convección 4) El
Atención enfermera en hemodiálisis Curso de 80 h de duración, acreditado con 11,2 Créditos CFC Programa 1. PRINCIPIOS FISICOQUÍMICOS DE LA HEMODIÁLISIS Y TOXINAS URÉMICAS 2) Difusión 3) Convección 4) El
CABATINA Inyectable. Ficha Técnica
 CABATINA Inyectable ANTIHEMORRÁGICO. CABATINA INYECTABLE está indicada para el tratamiento inicial de emergencia de intoxicaciones agudas y sobreagudas generadas por rodenticidas anticoagulantes. Ficha
CABATINA Inyectable ANTIHEMORRÁGICO. CABATINA INYECTABLE está indicada para el tratamiento inicial de emergencia de intoxicaciones agudas y sobreagudas generadas por rodenticidas anticoagulantes. Ficha
Tabla de equivalencia aproximada entre opioides
 Tabla de equivalencia aproximada entre opioides Documentos www.1aria.com DOSIS EQUIPOTENTES BUPRENORFINA PARCHE TRANSDÉRMICO 8,75 (0,2 17,5 (0,4 35 (0,8 52,5 (1,2 70 (1,6 105 (2,4 122,5 (2,8 140 (3,2 -
Tabla de equivalencia aproximada entre opioides Documentos www.1aria.com DOSIS EQUIPOTENTES BUPRENORFINA PARCHE TRANSDÉRMICO 8,75 (0,2 17,5 (0,4 35 (0,8 52,5 (1,2 70 (1,6 105 (2,4 122,5 (2,8 140 (3,2 -
Losartán Potásico...50 mg. Excipientes...c.s.
 LOSARTÁN POTÁSICO 50 mg Comprimidos Recubiertos Vía de Administración: Oral FÓRMULA Cada comprimido recubierto de ACCORD contiene: Losartán Potásico...50 mg Excipientes...c.s. Justificación Accord comprimidos
LOSARTÁN POTÁSICO 50 mg Comprimidos Recubiertos Vía de Administración: Oral FÓRMULA Cada comprimido recubierto de ACCORD contiene: Losartán Potásico...50 mg Excipientes...c.s. Justificación Accord comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Sustancia activa: Cabergolina... 50 µg. Excipiente, c.s.p... 1 ml
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LACTOFIN, 50 mcg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Sustancia activa:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LACTOFIN, 50 mcg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Sustancia activa:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. DENUBIL 250 mg/180 mg solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DENUBIL 250 mg/180 mg solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición por ampolla (de 5 ml de solución oral): Pidolato de deanol 250 mg Heptaminol,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DENUBIL 250 mg/180 mg solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición por ampolla (de 5 ml de solución oral): Pidolato de deanol 250 mg Heptaminol,
Prospecto: información para el usuario
 Prospecto: información para el usuario Konakion 10 mg/ml solución oral/solución inyectable Fitomenadiona Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Prospecto: información para el usuario Konakion 10 mg/ml solución oral/solución inyectable Fitomenadiona Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
La monitorización de niveles plasmáticos de fármacos: utilidad y limitaciones, indicaciones, relación coste-beneficio
 FARMACOLOGÍA CLINICA 6º CURSO 2005-2006 La monitorización de niveles plasmáticos de fármacos: utilidad y limitaciones, indicaciones, relación coste-beneficio Dr. Francisco Abad Santos FARMACOCINÉTICA CLÍNICA
FARMACOLOGÍA CLINICA 6º CURSO 2005-2006 La monitorización de niveles plasmáticos de fármacos: utilidad y limitaciones, indicaciones, relación coste-beneficio Dr. Francisco Abad Santos FARMACOCINÉTICA CLÍNICA
Introducción. Para una información más detallada, consulte la ficha técnica del medicamento que se adjunta a este material.
 Introducción El objetivo de esta guía consiste en proporcionar información sobre el riesgo de hemorragias graves en pacientes tratados con este medicamento. Además, contiene información sobre los siguientes
Introducción El objetivo de esta guía consiste en proporcionar información sobre el riesgo de hemorragias graves en pacientes tratados con este medicamento. Además, contiene información sobre los siguientes
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BYKAHEPAR M 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Sustancia activa:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BYKAHEPAR M 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Sustancia activa:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. NUFLOR 300 mg/ml SOLUCIÓN INYECTABLE PARA BOVINO Y OVINO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS Área de Gestión de Procedimientos RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NUFLOR 300 mg/ml SOLUCIÓN INYECTABLE
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS Área de Gestión de Procedimientos RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NUFLOR 300 mg/ml SOLUCIÓN INYECTABLE
Profilaxis de la Enfermedad Tromboembólica en el Embarazo. Marta Pastor Extremiana Hospital Universitario Cruces Bilbao, 16 de Enero de 2015
 Profilaxis de la Enfermedad Tromboembólica en el Embarazo Marta Pastor Extremiana Hospital Universitario Cruces Bilbao, 16 de Enero de 2015 Enfermedad Tromboembólica Venosa (ETEV) Incluye la Trombosis
Profilaxis de la Enfermedad Tromboembólica en el Embarazo Marta Pastor Extremiana Hospital Universitario Cruces Bilbao, 16 de Enero de 2015 Enfermedad Tromboembólica Venosa (ETEV) Incluye la Trombosis
FICHA TÉCNICA. de solución Bemiparina sódica (DCI) UI (anti-xa) Bemiparina sódica (DCI) UI (anti-xa)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HIBOR 2.500 UI anti-xa/0,2 ml solución inyectable en jeringas precargadas HIBOR 3.500 UI anti-xa/0,2 ml solución inyectable en jeringas precargadas 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HIBOR 2.500 UI anti-xa/0,2 ml solución inyectable en jeringas precargadas HIBOR 3.500 UI anti-xa/0,2 ml solución inyectable en jeringas precargadas 2. COMPOSICIÓN
PROTAMYN 1000 SOLUCION INYECTABLE
 PROTAMYN 1000 SOLUCION INYECTABLE FICHA TECNICA PRODUCTO TERMINADO 1. NOMBRE Y MARCA DEL MEDICAMENTO PROTAMYN 1000 UI/ml solución inyectable y para uso en perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
PROTAMYN 1000 SOLUCION INYECTABLE FICHA TECNICA PRODUCTO TERMINADO 1. NOMBRE Y MARCA DEL MEDICAMENTO PROTAMYN 1000 UI/ml solución inyectable y para uso en perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TÉCNICA. Fraxiparina Forte 0,6 ml solución inyectable, cada jeringa precargada contiene UI anti Xa de nadroparina cálcica.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fraxiparina Forte 0,6 ml solución inyectable Fraxiparina Forte 0,8 ml solución inyectable Fraxiparina Forte 1 ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Fraxiparina Forte 0,6 ml solución inyectable Fraxiparina Forte 0,8 ml solución inyectable Fraxiparina Forte 1 ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y
FICHA TÉCNICA. 1. NOMBRE DEL MEDICAMENTO HEPARINA SÓDICA CHIESI UI/ml HEPARINA SÓDICA CHIESI UI/ml
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HEPARINA SÓDICA CHIESI 1.000 UI/ml HEPARINA SÓDICA CHIESI 5.000 UI/ml 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Heparina sódica Chiesi 1.000 UI/ml: vial conteniendo
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HEPARINA SÓDICA CHIESI 1.000 UI/ml HEPARINA SÓDICA CHIESI 5.000 UI/ml 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Heparina sódica Chiesi 1.000 UI/ml: vial conteniendo
ambroxol cinfa 15 mg / 5 ml jarabe EFG
 FICHA TÉCNICA ambroxol cinfa 15 mg / 5 ml jarabe EFG 1. NOMBRE DEL MEDICAMENTO ambroxol cinfa 15 mg/5 ml jarabe EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 5 ml de jarabe contienen 15 mg de clorhidrato
FICHA TÉCNICA ambroxol cinfa 15 mg / 5 ml jarabe EFG 1. NOMBRE DEL MEDICAMENTO ambroxol cinfa 15 mg/5 ml jarabe EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 5 ml de jarabe contienen 15 mg de clorhidrato
1. NOMBRE DEL MEDICAMENTO INNOHEP 20.000 UI anti-xa/ml, solución inyectable en jeringas
 1. NOMBRE DEL MEDICAMENTO INNOHEP 20.000 UI anti-xa/ml, solución inyectable en jeringas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una jeringa contiene 20.000 UI anti-xa/ml de tinzaparina sódica. Para excipientes,
1. NOMBRE DEL MEDICAMENTO INNOHEP 20.000 UI anti-xa/ml, solución inyectable en jeringas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una jeringa contiene 20.000 UI anti-xa/ml de tinzaparina sódica. Para excipientes,
Cada jeringa pre-llenada con 2 ml de solución inyectable contiene:
 1. NOMBRE DEL MEDICAMENTO IGAMAD SOLUCIÓN INYECTABLE 300 mcg/2 ml 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada jeringa pre-llenada con 2 ml de solución inyectable contiene: - Principio activo: Inmunoglobulina
1. NOMBRE DEL MEDICAMENTO IGAMAD SOLUCIÓN INYECTABLE 300 mcg/2 ml 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada jeringa pre-llenada con 2 ml de solución inyectable contiene: - Principio activo: Inmunoglobulina
INFORMACIÓN AL PACIENTE NUEVOS ANTICOAGULANTES ORALES (DABIGATRAN, RIVAROXABAN, APIXABAN)
 INFORMACIÓN AL PACIENTE NUEVOS ANTICOAGULANTES ORALES (DABIGATRAN, RIVAROXABAN, APIXABAN) C O N S E L L E R I A D E S A N I D A D 1. INTRODUCCIÓN Los anticoagulantes orales son medicamentos que modifican
INFORMACIÓN AL PACIENTE NUEVOS ANTICOAGULANTES ORALES (DABIGATRAN, RIVAROXABAN, APIXABAN) C O N S E L L E R I A D E S A N I D A D 1. INTRODUCCIÓN Los anticoagulantes orales son medicamentos que modifican
Numerosos estudios han documentado la seguridad
 Artículo Especial Anestesia Neuroaxial y Anticoagulantes Conferencia de Consenso de Opinión American Society of Regional Anesthesia and Pain Medicine Agradecemos a la American Society of Regional Anestesia
Artículo Especial Anestesia Neuroaxial y Anticoagulantes Conferencia de Consenso de Opinión American Society of Regional Anesthesia and Pain Medicine Agradecemos a la American Society of Regional Anestesia
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
Olmesartán Medoxomilo... 20 mg y 40 mg Excipiente cbp... 1 tableta
 INFORMACION PARA PRESCRIBIR REDUCIDA 1. Nombre Comercial: ILTUX 2. Nombre Genérico: OLMESARTAN MEDOXOMILO 3. Forma Farmacéutica y Formulación: Tabletas. Cada tableta contiene: Olmesartán Medoxomilo...
INFORMACION PARA PRESCRIBIR REDUCIDA 1. Nombre Comercial: ILTUX 2. Nombre Genérico: OLMESARTAN MEDOXOMILO 3. Forma Farmacéutica y Formulación: Tabletas. Cada tableta contiene: Olmesartán Medoxomilo...
INIBSACAIN HIPERBARICA 0,5 %,, SOLUCIÓN INYECTABLE Bupivacaína
 Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo - Si tiene alguna duda, consulte a su médico o farmacéutico - Este
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo - Si tiene alguna duda, consulte a su médico o farmacéutico - Este
FICHA TÉCNICA. Debe evitarse la administración por vía intramuscular debido al riesgo de formación de hematomas en el lugar de inyección.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HEPARINA LEO PHARMA 1.000 UI/ml, solución inyectable HEPARINA LEO PHARMA 5.000 UI/ml, solución inyectable
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HEPARINA LEO PHARMA 1.000 UI/ml, solución inyectable HEPARINA LEO PHARMA 5.000 UI/ml, solución inyectable
Esther Ruiz Sánchez MIR 2 de Ginecología y Obstetricia
 Esther Ruiz Sánchez MIR 2 de Ginecología y Obstetricia ETV (TVP y EP) Complicaciones obstétricas HBPM de elección (grado Ib) HNF Dosis profilácticas subcutánea Dosis terapéuticas intravenosa en perfusión
Esther Ruiz Sánchez MIR 2 de Ginecología y Obstetricia ETV (TVP y EP) Complicaciones obstétricas HBPM de elección (grado Ib) HNF Dosis profilácticas subcutánea Dosis terapéuticas intravenosa en perfusión
Boletín de Actualización Farmacoterapéutica
 Cátedra de Farmacia Clínica y Asistencial Departamento de Ciencias Biológicas Facultad de Ciencias Exactas - Universidad Nacional de La Plata Calle 47 esq 115 - (1900) La Plata (54 221) 423-0121 Int.53
Cátedra de Farmacia Clínica y Asistencial Departamento de Ciencias Biológicas Facultad de Ciencias Exactas - Universidad Nacional de La Plata Calle 47 esq 115 - (1900) La Plata (54 221) 423-0121 Int.53
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. PRILBEN VET 20 mg COMPRIMIDO RECUBIERTO CON PELÍCULA PARA PERROS
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PRILBEN VET 20 mg COMPRIMIDO RECUBIERTO CON PELÍCULA PARA PERROS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PRILBEN VET 20 mg COMPRIMIDO RECUBIERTO CON PELÍCULA PARA PERROS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
